Algoritme(s) voor de behandeling van depressie
Uitgangsvraag
Wat is de volgorde van stappen (psychotherapie, farmacotherapie, neuromodulatie en de combinatie daarvan) bij de behandeling van depressie?
Aanbeveling
Conform de voorgaande Multidisciplinaire richtlijn voor Diagnostiek en Behandeling van Depressie (Spijker et al., 2013) en de algemene uitgangspunten voor goede zorg, beveelt de Werkgroep aan om elke depressie te behandelen volgens een vast algoritme volgens het adagium: behandel goed en consequent.
|
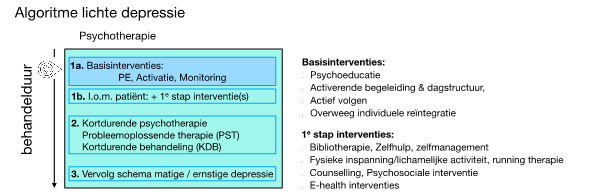
Figuur 8.1 Algoritme bij lichte depressie1 |
|
Basisinterventies worden altijd ingezet. T.a.v. ‘individuele re-integratie’: besteed aandacht aan arbeidsmatig functioneren en adviseer arbozorg/arbeidsgerichte interventies bij (dreigende) participatieproblemen (zie de module Arbeidsgerichte zorg bij depressie). |
1. Dit algoritme is van toepassing op kinderen en adolescenten, volwassenen en ouderen.
|
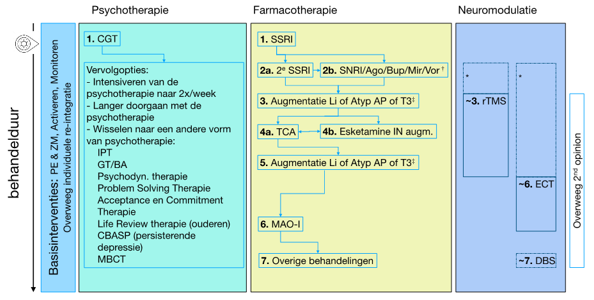
Figuur 8.2 Algoritme bij matig ernstige en ernstige depressie1 |
|
Dit behandelalgoritme is in principe van toepassing op alle leeftijdsgroepen. Bij ouderen zijn als 1e keus antidepressivum naast een SSRI ook duloxetine en mirtazapine mogelijk (zie de module Farmacotherapie van eerste keuze bij ouderen (≥60 jaar)). Bij kinderen en jeugdigen zijn fluoxetine of citalopram 1e keus middelen (zie de module Farmacotherapie van eerste keuze bij kinderen en adolescenten). Behandeling met psychotherapie wordt bij voorkeur tegelijkertijd gestart met farmacotherapie, evt. gecombineerde behandeling met neuromodulatie wordt later ingezet. T.a.v. de basisinterventie ‘individuele re-integratie’: besteed aandacht aan arbeidsmatig functioneren en adviseer arbozorg/arbeidsgerichte interventies bij (dreigende) participatieproblemen (zie ook module Arbeidsgerichte zorg bij depressie). Bij kinderen en jeugdigen betreft dit het betrekken van school/opleiding bij de behandeling.
† Er is een beperkte meerwaarde van een ‘between-class’ ten opzichte van een ‘within-class’ wissel van het antidepressivum; Bij hinderlijke bijwerkingen op een 1e SSRI is een andere SSRI een goede optie. • Bij ernstige bijwerkingen op farmacologische interventies kunnen rTMS en ECT ook eerder ingezet worden. ‡ Overweeg augmentatie zeker bij bij partiele respons of respons zonder remissie. Lithiumaugmentatie moet tenminste eenmaal (hetzij als stap 3 of stap 5) worden ingezet.
Afkortingen: Ago= agomelatine; Atyp AP=atypische antipsychotica; BA= behavioral activation; Bup= buproprion; CBASP= cogitive behavioral analysis system of psychotherapy; CGT=cognitieve gedragstherapie; DBS= deep brain stimulation; ECT= electroconvulsie therapie; GT= gedragstherapie; IN= intranasaal; IPT= interpersoonlijke therapie; Li= lithium; MAO-I= Monoamine Oxidase inhibitor; MBCT= Mindfulness-based cognitieve therapie; Mir= mirtazapine; rTMS= repetitieve Transcraniele magnetische stimulatie; SNRI= serotonine noradrenaline reuptake inhibitor; SSRI= selectieve serotonine reuptake inhibitor; T3= schildklierhormoon; TCA= tricyclisch antidepressivum; Vor= vortioxetine |
1. Dit algoritme is van toepassing op kinderen en adolescenten, volwassenen en ouderen.
|
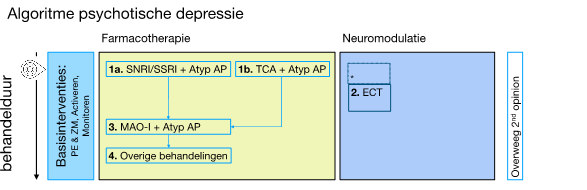
Figuur 8.3 Algoritme bij psychotische depressie1 |
|
* Bij levensbedreigende situaties kan ECT ook als 1e stap ingezet worden. T.a.v. ‘individuele re-integratie’: deze basisinterventie is niet opgenomen omdat psychotisch depressieve patiënten veelal niet in staat zullen zijn bij het begin van de behandeling naar arbeidsreintegratie te kijken. Besteed daarom in het vervolgtraject na verbetering van de acute symptomatologie aandacht aan arbeidsmatig functioneren en adviseer arbozorg/arbeidsgerichte interventies bij (dreigende) participatieproblemen (zie ook Module Arbeidsgerichte zorg bij depressie). |
1. Dit algoritme is van toepassing op volwassenen en ouderen.
Overwegingen
Alhoewel er geen sterke wetenschappelijke onderbouwing is voor één specifiek exact en volledig uitgewerkt algoritme, zijn voor sommige voor mogelijke onderdelen van behandelstappen netwerk-meta-analyses uitgevoerd (Yan et al., 2022; Strawbridge et al., 2019, Nuñez et al., 2022). Een complicerende factor is dat - in navolging van de STAR*D studie- het niveau van therapieresistentie waarschijnlijk van invloed is op de effectiviteit van opeenvolgende behandelstappen (Rush, 2006, Ruhe, 2006). Heterogeniteit ten aanzien van therapieresistentie wordt tot op heden zelden verdisconteerd in netwerk meta-analyses (Muit et al., 2022).
Onderbouwing
Achtergrond
Voor een uitgebreide systematische literatuur review en nadere beoordeling van genoemde (netwerk-)meta-analyses was bij de huidige herziening geen mogelijkheid. Deze module geeft daarom -zoveel mogelijk onderbouwd met wetenschappelijke literatuur- op expert opinion gebaseerde algoritmes aan voor 1) ‘lichte depressie’, 2) ‘matig ernstige en ernstige depressie’ en 3) psychotische depressie’. Het onderscheid lichte depressie (1) versus matig ernstige, ernstige en psychotische depressie (2 & 3) correspondeert met het onderscheid in de NHG-standaard: ‘depressie zonder ernstig sociaal disfunctioneren, grote lijdensdruk of ernstige comorbiditeit’ versus ‘depressie met ernstig sociaal disfunctioneren, grote lijdensdruk, en/of veel comorbiditeit’. In de algoritmes wordt niet aangegeven wanneer doorverwijzing naar de SGGZ of tertiaire/TOP-GGZ of klinische opname aangewezen is. Uitgangspunt is dat een algoritme onafhankelijk van setting en echelon kan worden gevolgd.
Bij alle algoritmes wordt tenminste gebruik gemaakt van (een combinatie van) de basisinterventies: Psychoeducatie en Zelfmanagement, Activeren (en dagstructurering) en Monitoren (en evalueren). Voor de matig ernstige en ernstige depressie wordt op basis van de Module Combinatiebehandeling een algoritme gepresenteerd waarin qua behandeling gelijktijdig met farmacotherapie en/of psychotherapie wordt behandeld. De Werkgroep is van mening bij het doorlopen van het algoritme ook een combinatiebehandeling met neuromodulatie zou kunnen worden overwogen.
Uitgangspunt bij het volgen van deze algoritmes is dat regelmatig (‘kritische beslismomenten’) op basis van gedeelde besluitvorming tussen hulpverlener, patiënt en naasten wordt gekozen voor vervolgstappen (farmacotherapie, psychotherapie of neuromodulatie). Hierbij wordt het optreden van ongewenste bijwerkingen en het niveau van klachten gemonitord, wat een aanleiding kan zijn om tot snellere opvolging van stappen of tussenliggende aanpassingen te besluiten.
Op elk kritisch beslismoment zal bij onvoldoende verbetering nagegaan moeten worden of:
- de diagnostiek volledig/adequaat is
- de behandeling optimaal is uitgevoerd (bv adequate dosering, bloedspiegelcontroles (bij TCA), juiste frequentie/intensiteit van de psychotherapiesessies of neuromodulatie
- de therapietrouw voldoende is
- er in standhoudende factoren bestaan zoals comorbiditeit, en/of ongunstige sociale omstandigheden (waaronder disbalans inspanning/ontspanning of slaap) bestaan, die aandacht behoeven
Algemene aanwijzingen:
- Bij elk algoritme geldt: volg het (indien mogelijk) consequent, en ga bij geen/onvoldoende effect door naar de volgende stap
- Bespreek het algoritme vooraf met de patiënt en pas aan waar nodig o.b.v. gedeelde besluitvorming
- Overweeg farmacogenetisch onderzoek vooral bij herhaalde ineffectiviteit en/of opvallend veel bijwerkingen (Leidraad farmacogenetica voor de dagelijkse psychiatrische praktijk)
- Wijk niet zonder goede onderbouwing (bijv. CYP P450 poor-metabolism) af door lager dan de minimaal effectieve dosering te gebruiken.
- Bij twijfel over de diagnostiek of het te voeren behandelbeleid kan een second opinion van een in stemmingsstoornissen gespecialiseerde collega of instelling behulpzaam zijn.
Algoritme ‘Lichte depressie’
- Bij een lichte depressie wordt altijd gestart met de basisinterventies.
- In overleg met de patiënt worden 1 of 2 Eerste-stapinterventies toegevoegd.
- Mocht dit na 2 maanden onvoldoende verbetering geven, dan wordt een kortdurende psychotherapie (begeleide eHealth met CGT, dan wel PST of KDB) gestart.
- Mocht dit na 6 weken onvoldoende resultaat opleveren dan is een behandeling met psychotherapie aangewezen (zie de modules Eerste keuze psychotherapie voor de verschillende leeftijdsgroepen).
|
Figuur 8.1 Algoritme bij lichte depressie1 |
|
Basisinterventies worden altijd ingezet. T.a.v. ‘individuele re-integratie’: besteed aandacht aan arbeidsmatig functioneren en adviseer arbozorg/arbeidsgerichte interventies bij (dreigende) participatieproblemen (zie de module Arbeidsgerichte zorg bij depressie). |
1. Dit algoritme is van toepassing op kinderen en adolescenten, volwassenen en ouderen.
Algoritme ‘Matig ernstige en ernstige depressie’
- Naast de basisinterventies wordt in principe gestart met een gecombineerde behandeling van psychotherapie en farmacotherapie (zie module Combinatiebehandeling van psychotherapie en farmacotherapie).
- Psychotherapeutisch wordt gestart met individuele CGT.
- Wat betreft farmacotherapie wordt als 1e stap gestart met een van de voorkeur SSRI’s (citalopram, escitalopram, fluoxetine of sertraline) (zie Figuur 8.2).
- Voor adviezen ten aanzien van frequentie van contacten, beleid bij bijwerkingen farmacotherapie zie module Algemene principes voor de behandeling van depressie.
- Breng het beloop in kaart met een klachtenvragenlijst (bv PHQ-9, IDS-SR, HDRS, MADRS, CDI (voor kinderen)) vooraf en daarna elke 4 weken.
|
Figuur 8.2 Algoritme bij matig ernstige en ernstige depressie1 |
|
Dit behandelalgoritme is in principe van toepassing op alle leeftijdsgroepen. Bij ouderen zijn als 1e keus antidepressivum naast een SSRI ook duloxetine en mirtazapine mogelijk (zie de module Farmacotherapie van eerste keuze bij ouderen (≥60 jaar)). Bij kinderen en jeugdigen zijn fluoxetine of citalopram 1e keus middelen (zie de module Farmacotherapie van eerste keuze bij kinderen en adolescenten). Behandeling met psychotherapie wordt bij voorkeur tegelijkertijd gestart met farmacotherapie, evt. gecombineerde behandeling met neuromodulatie wordt later ingezet. T.a.v. de basisinterventie ‘individuele re-integratie’: besteed aandacht aan arbeidsmatig functioneren en adviseer arbozorg/arbeidsgerichte interventies bij (dreigende) participatieproblemen (zie ook module Arbeidsgerichte zorg bij depressie). Bij kinderen en jeugdigen betreft dit het betrekken van school/opleiding bij de behandeling.
† Er is een beperkte meerwaarde van een ‘between-class’ ten opzichte van een ‘within-class’ wissel van het antidepressivum; Bij hinderlijke bijwerkingen op een 1e SSRI is een andere SSRI een goede optie. • Bij ernstige bijwerkingen op farmacologische interventies kunnen rTMS en ECT ook eerder ingezet worden. ‡ Overweeg augmentatie zeker bij bij partiele respons of respons zonder remissie. Lithiumaugmentatie moet tenminste eenmaal (hetzij als stap 3 of stap 5) worden ingezet.
Afkortingen: Ago= agomelatine; Atyp AP=atypische antipsychotica; BA= behavioral activation; Bup= buproprion; CBASP= cogitive behavioral analysis system of psychotherapy; CGT=cognitieve gedragstherapie; DBS= deep brain stimulation; ECT= electroconvulsie therapie; GT= gedragstherapie; IN= intranasaal; IPT= interpersoonlijke therapie; Li= lithium; MAO-I= Monoamine Oxidase inhibitor; MBCT= Mindfulness-based cognitieve therapie; Mir= mirtazapine; rTMS= repetitieve Transcraniele magnetische stimulatie; SNRI= serotonine noradrenaline reuptake inhibitor; SSRI= selectieve serotonine reuptake inhibitor; T3= schildklierhormoon; TCA= tricyclisch antidepressivum; Vor= vortioxetine |
1. Dit algoritme is – met de aanpassing zoals beschreven in de voetnoten - van toepassing op kinderen en adolescenten, volwassenen en ouderen.
Vervolgstappen Psychotherapie
Psychotherapie na onvoldoende respons op een eerdere psychotherapeutische behandeling lijkt zinvol bij matig ernstige/ernstige, ook al is er soms beperkt meta-analytisch bewijs (Van Bronswijk et al., 2019). De topicgroep Psychotherapie vindt de evidentie onvoldoende om aanbevelingen te doen voor een algoritme waarin een volgorde wat betreft type psychotherapie wordt bepaald. De volgorde van psychotherapie na CGT zal daarom afhangen van het oordeel van de behandelaar, het beschikbare aanbod van een instelling en gedeelde besluitvorming.
Mogelijke aanpassingen van de psychotherapie zijn (zie module Psychotherapie):
- Intensiveren van de psychotherapie naar 2x/week
- Langer doorgaan met dezelfde vorm van psychotherapie
- Wisselen naar een andere vorm van psychotherapie (zie module Psychotherapie)
Wanneer patiënten met een depressie na respons op een acute behandeling met antidepressiva nog restsymptomen hebben, dient cognitieve gedragstherapie overwogen te worden.
Vervolgstappen Farmacotherapie
- De eerste evaluatie van de effecten van de farmacotherapie vindt plaats na 4 weken behandeling.
- Als er >25% verbetering is opgetreden kan de behandeling nog 2-4 weken worden gecontinueerd alvorens een definitief besluit wordt genomen of de depressie voldoende respondeert op de ingezette behandeling.
- Indien er bij 4 weken ≤25% verbetering op een gebruikte meetschaal is, wordt meteen overgegaan naar de 2e/volgende stap.
- Verdere evaluaties van farmacotherapie vinden steeds 4-6 weken na de start van een behandelstap plaats, waarbij steeds getracht wordt tenminste 4 weken op een adequate dosering te hebben behandeld voordat een evaluatie plaatsvindt.
Als tweede stap wordt gewisseld naar een van de andere moderne antidepressiva (stap 2a. andere SSRI: citalopram, escitalopram, fluoxetine, sertraline of stap 2b. SNRI/ander modern antidepressivum: agomelatine, bupropion, duloxetine, mirtazapine, venlafaxine, vortioxetine). Overigens is de evidentie voor switchen beperkt (Bschor et al., 2018), er is een beperkte meerwaarde van een ‘between-class’ ten opzichte van een ‘within-class’ wissel van het antidepressivum (Ruhe et al., 2006; Papakostas et al., 2008). Bij hinderlijke bijwerkingen op een 1e SSRI is een andere SSRI vaak een goede optie.
Voor stap 3 is op grond van diverse (netwerk-)meta-analyses besloten dat augmentatie strategieën effectief zijn als patiënten onvoldoende respons vertonen op twee eerdere farmacotherapeutische stappen, ook als dit SSRIs en SNRIs zijn geweest (Zhou et al., 2015a,b; Strawbridge et al., 2019, Nuñez et al.,2022, Vazquez et al., 2021, Yan et al., 2022). Hoewel de augmentatie-strategie in sommige originele studies in de genoemde (netwerk) meta-analyses toegepast werd bij het eerste antidepressivum, adviseert de werkgroep augmentatie als derde stap. Overweeg augmentatie zeker bij partiele respons of respons zonder remissie. In een recente studie bij ouderen die niet reageerden op tenminste twee antidepressieve behandelingen was augmentatie met aripiprazol of buproprion eveneens significant effectiever dan switch naar bupropion (Lenze et al. 2023), zodat de werkgroep bij ouderen hetzelfde algoritme aangewezen acht.
In de grootste netwerk meta-analyses wordt een beperkte meerwaarde van de augmentatie met atypische antipsychotica (maar ook T3) ten opzichte van lithium-augmentatie gezien (Zhou et al., 2015; Nuñez et al., 2022). T3 augmentatie (niet te verwarren met T4 suppletie) wordt relatief weinig toegepast in Nederland. Dit blijkt in eerdere meta-analyses effectief bij TCA’s, maar mogelijk niet bij SSRI’s (Cooper-Kazaz & Lerer, 2008).
Hierbij zijn van de atypische antipsychotica aripiprazol en quetiapine het meest onderzocht en meest effectief, en is risperidon minder goed onderzocht maar wel effectief (Zhou et al., 2015, Nunez et al., 2022, Yan et al., 2022). Voor augmentatie met atypische antipsychotica is het aan te bevelen deze atypische antipsychotica qua dosering geleidelijk op te hogen tot de maximaal onderzochte doseringen voor augemntatie, omdat lage doseringen minder effectief zijn (versus hogere doseringen) (Zhou et al., 2015). In tabel 8.1 staan de doserings-ranges zoals gebruikt in de onderliggende studies in de meta-analyses. De maximale dosering komt overeen met de gebruikelijke standaarddoseringen voor psychose. Echter, de dosis-respons relatie van bijvoorbeeld aripiprazol als augmentatiestrategie is niet lineair waarbij in een specifiekere analyse boven 5mg onzekerheid is over de toename van de effectiviteit (Furukawa et al., 2022). Het is onduidelijk hoe dit voor andere atypische antipsychotica is. In de praktijk zal men de dosering van atypische antipsychotica i.v.m. evt. bijwerkingen laag starten en bij voldoende effect op geleide van verdraagbaarheid verder ophogen tot doseringen zoals gebruikt als standaarddosering bij psychotische stoornissen.
Tabel 8.1 Doserings-ranges zoals gebruikt in atypische antipsychotica augmentatie studies voor depressie1
|
Antipsychoticum |
Onderzochte doserings-range |
|
Aripiprazol |
2-20 mg |
|
Brexipiprazol |
1-3 mg |
|
Caripiprazine |
1-4.5 mg |
|
Olanzapine |
5-20 mg |
|
Risperidon |
0.5-3 mg |
|
Quetiapine |
150-600 mg |
|
Ziprasidone |
40-160 mg |
1. Bron: Scholte, Muit, Ruhé (manuscript in voorbereiding).
De augmentatie met lithium is in de praktijk veel toegepast, is effectief ten opzichte van placebo (Nuñez et al., 2022; Zhou et al., 2015; Vazquez et al., 2021) en kan bij alle antidepressiva worden toegepast. Bij lithium-augmentatie dient een bloedspiegel van ≥0.5 mmol/l nagestreefd te worden.
De Werkgroep heeft gezien de ervaring met lithium besloten om als 3e stap daarom een augmentatie met hetzij een atypisch antipsychoticum, lithium of T3 te adviseren.
Voor stap 4 wordt het wisselen naar een TCA (meestal nortriptyline) aangegeven als stap 4a, omdat deze stap al jarenlang in Nederland worden gebruikt (Spijker & Nolen, 2010). Deze stap wordt door de Werkgroep op grond van expert opinion aanbevolen, er is zeer beperkte literatuur die wisselen naar TCA’s onderzoekt (Ruhe et al., 2006). Bloedspiegels van TCA’s zijn essentieel (Vis et al., 2013).
Naast een switch naar een TCA is de Werkgroep van mening dat een augmentatie met esketamine neusspray (An et al., 2021; Papakostas et al., 2020) een alternatief kan zijn (stap 4b). Dit is passend bij de thans geldende criteria voor gepast gebruik (onvoldoende verbetering op tenminste 3 behandelstappen waaronder tenminste 1 augmentatiestrategie) (ZIN, 2020), waarbij expliciet opgemerkt moet worden dat er meer kennis over de effectiviteit van esketamine neusspray moet worden verkregen om de positionering van dit middel te heroverwegen. Tot op heden ontbreekt een goede netwerk meta-analyse waarin de augmentatie met esketamine neusspray wordt vergeleken met andere behandelstappen (Vazquez et al., 2021; Strawbridge et al., 2019). Als voor augmentatie met esketamine neusspray (stap 4b) wordt gekozen voordat een TCA is geprobeerd is beveelt de Werkgroep aan om bij onvoldoende effectiviteit alsnog naar een TCA te wisselen (stap 4a).
Voor stap 5 beveelt de Werkgroep opnieuw een augmentatiestrategie aan. Belangrijkste reden hiervoor is dat ook bij TCA’s een augmentatiestrategie effectief kan zijn. De Werkgroep is van mening dat lithium-augmentatie tenminste ergens in het behandelalgoritme toegepast zou moeten worden; hetzij als stap 3 of als stap 5.
Als stap 6 wordt het wisselen naar een irreversibele MAO-remmer aanbevolen, wederom omdat deze stap al jarenlang in Nederland worden gebruikt (Spijker & Nolen, 2010). Deze stap wordt door de Werkgroep op grond van expert opinion aanbevolen. Er is zeer beperkte literatuur over de effectiviteit van MAO-remmers bij moeilijk behandelbare of therapieresistente depressie (Van den Eynde et al., 2022). Voor therapieresistente depressie wordt veelal tranylcypromine gebruikt, bij atypische kenmerken is er enige voorkeur voor fenelzine. Bij onverdraaglijke bijwerkingen is een wissel tussen beide MAO-remmers te overwegen.
Als stap 7 is het mogelijk om antidepressiva of evt. combinaties die nog niet zijn geprobeerd toe te passen.
De Werkgroep beveelt aan om bij stap 7 maar ook hiervoor en überhaupt terughoudend te zijn met combinatiebehandelingen (combinatie van verschillende antidepressiva). De reden hiervoor is dat er ondanks aanvankelijk veelbelovende eerste resultaten (Blier et al., 2010) in latere onderzoeken een beperkte meerwaarde van combinatiebehandelingen werd gevonden t.o.v. ongewijzigd doorbehandelen of monotherapie (Henssler et al., 2016, 2022). Bij een nadere analyse van de effectiviteit van een combinatiebehandeling bij non-responders/moeilijk behandelbare/ therapieresistente depressies daalde de gevonden effect inschatting aanzienlijk (Henssler et al., 2016, 2022). Mocht voor een combinatiebehandeling worden gekozen dat is de combinatie met een antagonist van de presynaptische α2-autoreceptoren (mirtazapine/mianserine) het meest effectief (Henssler et al., 2016, 2022). Een grote netwerk meta-analyse die farmacologische combinatiebehandeling vergelijkt met andere stappen in het voorgestelde algoritme ontbreekt.
Vervolgstappen Neuromodulatie
De Werkgroep beveelt aan dat rTMS kan worden ingezet parallel aan, of als alternatief voor de 3e stap farmacotherapie (toegevoegd aan de 2e stap), of daarna. Bij ernstige bijwerkingen op psychofarmaca is rTMS eerder in het algoritme te overwegen.
Electroconvulsietherapie (ECT) wordt door de Werkgroep aanbevolen als alternatief voor de farmacotherapeutische stap 6 (wisselen naar een irreversibele MAO-remmer). ECT is een van de meest effectieve behandelingen voor depressie (Mutz et al., 2019). Daarom geldt ook voor ECT dat deze stap eerder kan worden ingezet (zie ook de Richtlijn electroconvulsietherapie).
- Overweeg ECT onverwijld bij levensbedreigende situaties (ernstige suicidaliteit, katatone verschijnselen bij depressie);
- Overweeg ECT eerder dan alleen behandelen met farmacotherapie en afwachten bij dehydratie en uithongering bij depressie;
- Overweeg ECT eerder dan een volgende medicatie stap bij positief voorspellende factoren van ECT-effectiviteit bij depressie, zoals psychotische depressie, geremde depressie, hogere leeftijd, een eerdere effectieve ECT-kuur;
- Overweeg ECT bij therapieresistente depressie. ECT wordt door de Werkgroep aanbevolen als alternatief voor de farmacotherapeutische stap 6 (wisselen naar een irreversibele MAO-remmer).
- ECT kan eerder worden ingezet bijvoorbeeld bij ernstige bijwerkingen op psychofarmaca
De Werkgroep is van mening dat voor elke patiënt met een moeilijk behandelbare/therapieresistente depressie ECT zou moeten worden overwogen, wat in Nederland nog onvoldoende plaatsvindt (Scheepens et al., 2019).
Diepe Hersenstimulatie voor moeilijk behandelbare depressie wordt in Nederland uitgevoerd in onderzoekssituaties bij patiënten die niet reageerden op eerdere behandelingen (stap 7) (Dandekar et al., 2018; Drobisz & Damborská, 2019; Figee et al., 2022; Kisely et al., 2018; Kruizinga et al., 2021).
Algoritme ‘Psychotische depressie’
- Bij een psychotische depressie wordt altijd behandeld met een combinatie van een antidepressivum en een atypisch antipsychoticum (zie de module Farmacotherapeutische behandeling van psychotische depressie).
- Er is op basis van de literatuur geen absolute uitspraak te doen of het antidepressivum een SSRI, SNRI (stap 1a) of TCA (stap 1b) moet zijn. Ook voor de keuze van het atypische antipsychoticum is geen expliciete voorkeur te geven. In de praktijk wordt vaak venlafaxine (tot 375mg) met quetiapine (tot 600mg), en nortrilen (bloedspiegel) met olanzapine (10mg) toegepast.
- Bij onvoldoende effect beveelt de Werkgroep aan om als 2e stap Electroconvulsie therapie (ECT) te overwegen, aangezien ECT zeer effectief is bij een psychotische depressie (Van Diermen et al., 2018, Richtlijn electroconvulsietherapie). Bij levensbedreigende situaties kan ECT ook als 1e stap ingezet worden.
- Als 3e stap beveelt de Werkgroep -op basis van expert-opinion- een MAO-remmer (in combinatie met een antipsychoticum) aan.
- Hierna zijn als 4e en latere stappen geen specifieke aanbevelingen bij de behandeling van psychotische depressie te geven.
|
Figuur 8.3 Algoritme bij psychotische depressie1 |
|
* Bij levensbedreigende situaties kan ECT ook als 1e stap ingezet worden. T.a.v. ‘individuele re-integratie’: deze basisinterventie is niet opgenomen omdat psychotisch depressieve patiënten veelal niet in staat zullen zijn bij het begin van de behandeling naar arbeidsreintegratie te kijken. Besteed daarom in het vervolgtraject na verbetering van de acute symptomatologie aandacht aan arbeidsmatig functioneren en adviseer arbozorg/arbeidsgerichte interventies bij (dreigende) participatieproblemen (zie ook Module Arbeidsgerichte zorg bij depressie). |
1. Dit algoritme is van toepassing op volwassenen en ouderen.
Referenties
- An D, Wei C, Wang J, Wu A. (2021). Intranasal Ketamine for Depression in Adults: A Systematic Review and Meta-Analysis of Randomized, Double-Blind, Placebo-Controlled Trials. Front Psychol.;12:648691.
- Blier P, Ward HE, Tremblay P, Laberge L, Hébert C, Bergeron R. (2010). Combination of antidepressant medications from treatment initiation for major depressive disorder: a double-blind randomized study. Am J Psychiatry. Mar;167(3):281-8.
- Bronswijk, van, S., Moopen, N., Beijers, L., Ruhe, H. G., & Peeters, F. (2019). Effectiveness of psychotherapy for treatment-resistant depression: a meta-analysis and meta-regression. Psychological medicine, 49(3), 366-379.
- Bschor T, Kern H, Henssler J, et al. (2018). Switching the antidepressant after nonresponse in adults with major depression: A Systematic literature search and meta-analysis. J Clin Psychiatry;79(1):16r10749.
- Cooper-Kazaz, R., & Lerer, B. (2008). Efficacy and safety of triiodothyronine supplementation in patients with major depressive disorder treated with specific serotonin reuptake inhibitors. The international journal of neuropsychopharmacology, 11(5), 685-699. https://doi.org/10.1017/S1461145707008206
- Dandekar MP, Fenoy AJ, Carvalho AF, Soares JC, Quevedo J. (2018). Deepbrainstimulation for treatment-resistant depression: an integrative review of preclinical and clinical findings and translational implications. Mol Psychiatry. May;23(5):1094-1112.
- Drobisz D, Damborská A. (2019). Deepbrainstimulation targets for treating depression. Behav Brain Res. Feb 1;359:266-273.
- Figee M, Riva-Posse P, Choi KS, Bederson L, Mayberg HS, Kopell BH. (2022). DeepBrainStimulation forDepression. Neurotherapeutics. Jul;19(4):1229-1245.
- Furukawa, Y., Hamza, T., Cipriani, A., Furukawa, T. A., Salanti, G., & Ostinelli, E. G. (2022). Optimal dose of aripiprazole for augmentation therapy of antidepressant-refractory depression: preliminary findings based on a systematic review and dose-effect meta-analysis. The British journal of psychiatry : the journal of mental science, 221(2), 440-447. https://doi.org/10.1192/bjp.2021.165
- Henssler J, Bschor T, Baethge C. (2016). Combining Antidepressants in Acute Treatment of Depression: A Meta-Analysis of 38 Studies Including 4511 Patients. Can J Psychiatry. Jan;61(1):29-43.
- Henssler J, Alexander D, Schwarzer G, Bschor T, Baethge C. (2022). CombiningAntidepressants vs Antidepressant Monotherapy for Treatment of Patients With Acute Depression: A Systematic Review and Meta-analysis. JAMA Psychiatry. Apr 1;79(4):300-312.
- Kisely S, Li A, Warren N, Siskind D. (2018). A systematic review and meta-analysis of deepbrainstimulation for depression. Depress Anxiety. May;35(5):468-480.
- Kruizinga J, Liemburg E, Burger H, Cipriani A, Geddes J, Robertson L, Vogelaar B, Nolen WA. (2021). Pharmacological treatment for psychotic depression. Cochrane Database Syst Rev. Dec 7;12(12):CD004044.
- Lenze, E. J., Mulsant, B. H., Roose, S. P., Lavretsky, H., Reynolds, C. F., 3rd, Blumberger, D. M., Brown, P. J., Cristancho, P., Flint, A. J., Gebara, M. A., Gettinger, T. R., Lenard, E., Miller, J. P., Nicol, G. E., Oughli, H. A., Pham, V. T., Rollman, B. L., Yang, L., & Karp, J. F. (2023). Antidepressant Augmentation versus Switch in Treatment-Resistant Geriatric Depression. The New England journal of medicine, 388(12), 1067-1079. https://doi.org/10.1056/NEJMoa2204462
- Muit JJ, van Eijndhoven PFP, Cipriani A, Dalhuisen I, van Bronswijk S, Furukawa TA, Ruhe HG. (2022). Efficacy and acceptability of next step treatment strategies in adults with treatment-resistant major depressive disorder: protocol for systematic review and network meta-analysis. BMJ Open.;12:e056777.
- Mutz J, Vipulananthan V, Carter B, Hurlemann R, Fu CHY, Young AH. (2019). Comparative efficacy and acceptability of non-surgical brain stimulation for the acute treatment of major depressive episodes in adults: systematic review and network meta-analysis. BMJ. Mar 27;364:l1079.
- Nuñez NA, Joseph B, Pahwa M, Kumar R, Resendez MG, Prokop LJ, Veldic M, Seshadri A, Biernacka JM, Frye MA, Wang Z, Singh B. (2022). Augmentation strategies for treatmentresistant major depression: A systematic review and network meta-analysis. J Affect Disord. Apr 1;302:385-400.
- Papakostas GI, Fava M, Thase ME. (2008). Treatment of ssri-resistant depression: A meta-analysis comparing withinversus across-class switches. Biol Psychiatry;63(7):699-704.
- Papakostas GI, Salloum NC, Hock RS, Jha MK, Murrough JW, Mathew SJ, Iosifescu DV, Fava M. (2020). Efficacy of Esketamine Augmentation in Major Depressive Disorder: A Meta-Analysis. J Clin Psychiatry. May 26;81(4):19r12889.
- Ruhe HG, Huyser J, Swinkels JA, et al. (2006). Switching antidepressants after a first selective serotonin reuptake inhibitor in major depressive disorder: a systematic review. J Clin Psychiatry;67(12):1836-55.
- Rush, A. J., Trivedi, M. H., Wisniewski, S. R., Nierenberg, A. A., Stewart, J. W., Warden, D., Niederehe, G., Thase, M. E., Lavori, P. W., Lebowitz, B. D., McGrath, P. J., Rosenbaum, J. F., Sackeim, H. A., Kupfer, D. J., Luther, J., & Fava, M. (2006). Acute and longer-term outcomes in depressed outpatients requiring one or several treatment steps: a STAR*D report. The American journal of psychiatry, 163(11), 1905-1917. https://doi.org/10.1176/ajp.2006.163.11.1905
- Scheepens DS, van Waarde JA, Lok A, Zantvoord JB, de Pont BJHB, Ruhé HG, Denys DAJP, van Wingen GA. (2019). Electroconvulsion therapy for persistent depression in the Netherlands; very low application rate. Tijdschr Psychiatr.;61(1):16-21.
- Spijker, J., Bockting, C.L.H., Meeuwissen, J.A.C., Vliet, I.M. van, Emmelkamp, P.M.G., Hermens, M.L.M. & van Balkom A.L.J.M., namens de Werkgroep Multidisciplinaire richtlijnontwikkeling Angststoornissen/Depressie (2013). Multidisciplinaire richtlijn Depressie (Derde revisie). Richtlijn voor de diagnostiek, behandeling en begeleiding van volwassen patiënten met een depressieve stoornis. Utrecht: Trimbos-instituut.
- Spijker J, Nolen WA. (2010). An algorithm for the pharmacological treatment of depression. Acta Psychiatr Scand. Mar;121(3):180-9.
- Strawbridge R, Carter B, Marwood L, Bandelow B, Tsapekos D, Nikolova VL, Taylor R, Mantingh T, de Angel V, Patrick F, Cleare AJ, Young AH. (2019). Augmentation therapies for treatment-resistant depression: systematic review and meta-analysis. Br J Psychiatry. Jan;214(1):42-51.
- Van den Eynde V, Abdelmoemin WR, Abraham MM, Amsterdam JD, Anderson IM, Andrade C, Baker GB, Beekman ATF, Berk M, Birkenhäger TK, Blackwell BB, Blier P, Blom MBJ, Bodkin AJ, Cattaneo CI, Dantz B, Davidson J, Dunlop BW, Estévez RF, Feinberg SS, Finberg JPM, Fochtmann LJ, Gotlib D, Holt A, Insel TR, Larsen JK, Mago R, Menkes DB, Meyer JM, Nutt DJ, Parker G, Rego MD, Richelson E, Ruhé HG, Sáiz-Ruiz J, Stahl SM, Steele T, Thase ME, Ulrich S, van Balkom AJLM, Vieta E, Whyte I, Young AH, Gillman PK. (2022). The prescriber's guide to classic MAO inhibitors (phenelzine, tranylcypromine, isocarboxazid) for treatment-resistant depression. CNS Spectr. Jul 15:1-14.
- Van Diermen L, van den Ameele S, Kamperman AM, Sabbe BCG, Vermeulen T, Schrijvers D, Birkenhäger TK. (2018). Prediction of electroconvulsive therapy response and remission in major depression: meta-analysis. Br J Psychiatry. Feb;212(2):71-80.
- Vazquez, G.H., Bahji, A., Undurraga, J., et al. (2021). Efficacy and tolerability of combination treatments for major depression: antidepressants plus second-generation antipsychotics vs. esketamine vs. lithium. J. Psychopharmacol. 35 (8), 890-900.
- Vis R, Hassink JJM, Vinkers CH. (2013). Tricyclische antidepressiva en plasmaspiegels bij depressie: een praktische leidraad. Tijdschr Psychiatr;9:695-705.
- Yan Y, Yang X, Wang M, Chen, B, Yin L, Ma X (2022). Efficacy and acceptability of second-generation antipsychotics with antidepressants in unipolar depression augmentation: a systematic review and network meta-analysis. Psychological Medicine 52, 2224-2231.
- Zhou X, Ravindran AV, Qin B, Del Giovane C, Li Q, Bauer M, Liu Y, Fang Y, da Silva T, Zhang Y, Fang L, Wang X, Xie P. (2015). Comparative efficacy, acceptability, and tolerability of augmentation agents in treatment-resistant depression: systematic review and network meta-analysis. J Clin Psychiatry. Apr;76(4):e487-98.
- Zhou X, Keitner GI, Qin B, Ravindran AV, Bauer M, Del Giovane C, Zhao J, Liu Y, Fang Y, Zhang Y, Xie P. (2015). Atypical Antipsychotic Augmentation for Treatment-Resistant Depression: A Systematic Review and Network Meta-Analysis. Int J Neuropsychopharmacol. May 25;18(11):pyv060.
- Zorginstituut Nederland. (2020). Pakketadvies esketamine neusspray (Spravato®) bij de behandeling van depressie. https://www.zorginstituutnederland.nl/publicaties/adviezen/2020/09/30/pakketadvies-esketamine-neusspray-spravato#:~:text=Esketamine%20neusspray%20is%20bedoeld%20voor,van%20depressie%20kunnen%20ingrijpend%20zijn
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 23-05-2024
Beoordeeld op geldigheid : 01-03-2024
Algemene gegevens
Voor de Multidisciplinaire richtlijn Depressie (2013) zijn in het kader van de onderhavige richtlijnherziening nieuwe modules ontwikkeld. In deze modules wordt ingegaan op de beantwoording van uitgangsvragen bij actuele knelpunten in de praktijk van de zorg voor depressie. Uitzondering hierop vormen de modules Diagnostiek, Basisinterventies en eerste-stap interventies en Ondersteunende interventies, voor deze module heeft alleen een tekstrevisie plaatsgevonden.
Samenstelling werkgroep
De Multidisciplinaire richtlijn Depressie is ontwikkeld door de Werkgroep Depressie, in opdracht van de Nederlandse Vereniging voor Psychiatrie (NVvP) en Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De Werkgroep bestond uit: psychiaters, psychologen, verpleegkundig specialisten, een huisarts en ervaringsdeskundigen, welke door de respectievelijke beroepsverenigingen en patiëntenverenigingen werden afgevaardigd. Voorafgaande aan het ontwikkeltraject werden kennismakingsgesprekken gevoerd met verscheidene kandidaat-leden voor werkgroep deelname. Naast de Werkgroep waren enkele adviseurs betrokken, welke delen hebben meegeschreven en die werden gevraagd voorafgaand aan de commentaarfase schriftelijk te reageren op onderdelen van de concepttekst. Deze adviseurs konden tevens worden gevraagd om tijdens een werkgroep bijeenkomst mee te denken over een specifieke uitgangsvraag. De Werkgroep werd methodologisch, inhoudelijk en organisatorisch ondersteund door het technisch team van het Trimbos-instituut. Dit technisch team bestond uit een projectleider, redacteur/richtlijnontwikkelaar, informatiespecialist, literatuur reviewers, een notulist en projectassistenten. Onderstaande schema's geven een overzicht van de samenstelling van de Werkgroep, de adviseurs en het ondersteunend technisch team.
Leden Werkgroep
|
|
Naam |
Organisatie |
Beroepsvereniging |
|
1. |
Jan Spijker (voorzitter) |
Pro Persona |
Psychiater, NVvP |
|
2. |
Eric Ruhé (vicevoorzitter) |
Radboud UMC |
Psychiater, NVvP |
|
3. |
Claudi Bockting |
Amsterdam UMC |
Psycholoog, NIP |
|
3. |
Philip van Eijndhoven |
Radboud UMC |
Psychiater, NVvP |
|
4. |
Bart Groeneweg |
Depressievereniging |
Ervaringsdeskundige, MIND |
|
5. |
Rob Kok |
Parnassia |
Psychiater, NVvP |
|
6. |
Miranda Kurver |
NHG |
Huisarts, NHG |
|
7. |
Josephine van der Lande |
GGZ InGeest |
Verpleegkundig specialist, V&VN |
|
8. |
Nicoline Lous |
Depressievereniging |
Ervaringsdeskundige, MIND |
|
9. |
Catrien Reichart |
Curium-LUMC |
Psychiater, NVvP |
|
10. |
Marie-Louise Seelen |
PsyQ |
Verpleegkundig specialist, V&VN |
|
11. |
Marc Verbraak |
Pro Persona |
Psycholoog, NIP |
|
12. |
Christiaan Vinkers |
Amsterdam UMC en GGZ InGeest |
Psychiater, NVvP |
|
13. |
Yvonne Suijkerbuijk |
Amsterdam UMC/NVVG/UWV |
Verzekeringsarts, NVVG |
Adviseurs
|
Hoofdstuk |
Naam |
Organisatie |
Beroep |
|
Psychotherapie / stadiëring en profilering |
Ellen Driessen |
Pro Persona/ Radboud Universiteit |
GZ-psycholoog |
|
Psychotherapie / Jeugd |
Yvonne Stikkelbroek |
GGZ Oost-Brabant / Universiteit Utrecht |
Klinisch psycholoog |
|
Psychotherapie / Ouderen |
Arjan Videler |
GGZ Breburg |
Psychotherapeut, GZ-psycholoog |
|
Neuromodulatie
|
Ysbrand van der Werf |
A’dam UMC |
Neurowetenschapper |
|
Jeugd
|
Daan Creemers |
GGZ Oost-Brabant |
Klinisch psycholoog |
|
Jeugd
|
Fleur Velders |
UMC Utrecht |
Psychiater |
|
Ouderen
|
Gert-Jan Hendriks |
Pro Persona |
Psychiater |
|
Ouderen
|
Mardien Oudega |
GGZ InGeest |
Psychiater |
|
Ouderen
|
Angela Carlier |
Pro Persona |
Psychiater |
|
Ouderen |
Hans Jeuring |
UMCG |
Psychiater
|
|
Vaktherapie
|
Sonja Aalbers |
NHL Stenden |
Muziektherapeut |
|
Vaktherapie
|
Cees Boerhout |
Windesheim / Lentis |
Psychomotorisch therapeut |
|
Arbeidsgerichte zorg
|
Jeroen Roggekamp |
Zelfstandige |
Maatschappelijk werker / systeemtherapeut |
|
Arbeidsgerichte zorg |
Marjolein Bastiaansen |
Radboud UMC |
Bedrijfsarts |
|
Organisatie van de zorg voor depressie |
Bea Tiemens |
ProPersona |
|
Methodologische, inhoudelijke en organisatorische ondersteuning
|
Naam |
Ondersteuning |
|
Nicole van Erp / Piet Post |
Projectleider, Trimbos-instituut |
|
Jolanda Meeuwissen |
Redacteur en richtlijnontwikkelaar, Trimbos-instituut |
|
Egbert Hartstra |
Reviewer, Trimbos-instituut |
|
Matthijs Oud |
Reviewer, Trimbos-instituut |
|
Elena Vos |
Reviewer, Trimbos-instituut |
|
Erika Papazoglou |
Reviewer, Trimbos-instituut |
|
Bram Zwanenburg |
Reviewer, Trimbos-instituut |
|
Lex Hulsbosch |
Reviewer, Trimbos-instituut |
|
Beatrix Vogelaar |
Reviewer, Trimbos-instituut |
|
Rikie Deurenberg |
Informatiespecialist, namens Trimbos-instituut |
|
Chris van der Grinten / Jannita Paters |
Notulist, namens Trimbos-instituut |
|
Joyce Huls / Nelleke van Zon / Isa Reijgersberg |
Projectassistent, Trimbos-instituut |
In totaal kwam de Werkgroep Depressie voorafgaand aan de commentaarfase 10 keer bijeen in de periode november 2020 - april 2023. In deze periode werden de stappen van de methodiek voor evidence-based richtlijnontwikkeling (EBRO) doorlopen. De informatiespecialist verrichtte in overleg met de werkgroepleden op systematische wijze literatuuronderzoek en de reviewers maakten per uitgangsvraag een selectie in de gevonden onderzoeken (zie voor informatie over de zoekstrategie en de selectiecriteria: het reviewprotocol). De reviewers beoordeelden de kwaliteit en inhoud van de aldus verkregen literatuur en verwerkten deze per uitgangsvraag in evidence-tabellen, GRADE-profielen, beschrijvingen van de wetenschappelijke onderbouwing en wetenschappelijke (gewogen) conclusies (per module beschreven onder “Onderbouwing”). Leden van de Werkgroep gingen op basis van de gevonden literatuur met elkaar in discussie over praktijkoverwegingen (per module beschreven onder “Overwegingen”) en aanbevelingen (per module beschreven onder “Aanbevelingen”). De werkgroepleden schreven samen met het technisch team van het Trimbos-instituut de concepttekst, welke ter becommentariëring openbaar is gemaakt. De ontvangen commentaren worden verwerkt in een commentaartabel, die tijdens een werkgroep bijeenkomst wordt besproken. Na het doorvoeren van op deze bijeenkomst voorgestelde wijzigingen wordt de definitieve richtlijn aan de opdrachtgever aangeboden.
Methode ontwikkeling
Evidence based
Werkwijze
EBRO-methode voor wetenschappelijke onderbouwing
Deze multidisciplinaire richtlijn is ontwikkeld volgens de methodiek van evidence-based richtlijnontwikkeling (EBRO). Hierbij werd de GRADE-methodiek toegepast. Er zijn ook hoofdstukken overgenomen vanuit de vorige versie van de MDR Depressie (2013). Hierin zijn conclusies gebaseerd op de ‘levels of evidence’.
Levels of evidence
Bij ‘levels of evidence’ krijgt een individuele publicatie een mate van bewijskracht toegekend. Vervolgens wordt er naar alle bewijskracht over een onderwerp gekeken en kort samengevat in een conclusie, met daarbij een niveau van bewijs. Zie hieronder voor de indeling van bewijskracht en de verschillende conclusieniveaus.
Indeling van de literatuur naar de mate van bewijskracht
|
Voor artikelen betreffende preventie of therapie |
|
|
A1 |
systematische reviews die tenminste enkele onderzoeken van A2-niveau betreffen, waarbij de resultaten van afzonderlijke onderzoeken consistent zijn |
|
A2 |
gerandomiseerd vergelijkend klinisch onderzoek van goede kwaliteit (gerandomiseerde, dubbelblind gecontroleerde trials) van voldoende omvang en consistentie |
|
B |
gerandomiseerde klinische trials van matige kwaliteit of onvoldoende omvang of ander vergelijkend onderzoek (niet-gerandomiseerd, vergelijkend cohortonderzoek, patiënt-controle-onderzoek) |
|
C |
niet-vergelijkend onderzoek |
|
D |
mening van deskundigen, bijvoorbeeld de werkgroepleden |
|
Voor artikelen betreffende diagnostiek |
|
|
A1 |
onderzoek naar de effecten van diagnostiek op klinische uitkomsten bij een prospectief gevolgde goed gedefinieerde patiëntengroep met een tevoren gedefinieerd beleid op grond van de te onderzoeken testuitslagen, of besliskundig onderzoek naar de effecten van diagnostiek op klinische uitkomsten, waarbij resultaten van onderzoek van A2-niveau als basis worden gebruikt en voldoende rekening wordt gehouden met onderlinge afhankelijkheid van diagnostische tests |
|
A2 |
onderzoek ten opzichte van een referentietest, waarbij van tevoren criteria zijn gedefinieerd voor de te onderzoeken test en voor een referentietest, met een goede beschrijving van de test en de onderzochte klinische populatie; het moet een voldoende grote serie van opeenvolgende patiënten betreffen, er moet gebruikgemaakt zijn van tevoren gedefinieerde afkapwaarden en de resultaten van de test en de 'gouden standaard' moeten onafhankelijk zijn beoordeeld. Bij situaties waarbij multipele, diagnostische tests een rol spelen, is er in principe een onderlinge afhankelijkheid en dient de analyse hierop te zijn aangepast, bijvoorbeeld met logistische regressie |
|
B |
vergelijking met een referentietest, beschrijving van de onderzochte test en populatie, maar niet de kenmerken die verder onder niveau A staan genoemd |
|
C |
niet-vergelijkend onderzoek |
|
D |
mening van deskundigen, bijvoorbeeld de werkgroepleden |
|
Niveau van de conclusies |
|
|
1 |
gebaseerd op minimaal 1 systematische review (A1) of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A1 of A2 |
|
2 |
gebaseerd op tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
gebaseerd op 1 onderzoek van niveau A2 of B of onderzoek(en) van niveau C |
|
4 |
gepubliceerde mening van deskundigen of mening van de werkgroepleden |
GRADE-methodiek
Sinds de introductie van de GRADE-methodiek in 2004 werd dit wereldwijd al snel de methode van voorkeur om wetenschappelijk bewijs te graderen ten behoeve van richtlijnontwikkeling (Guyatt et al., 2008), inclusief deze richtlijn. De GRADE-methodiek gaat er van uit dat de zekerheid van het wetenschappelijk bewijs uit randomized controlled trials (RCT’s) in beginsel hoog is vanwege de, mits goed uitgevoerd, kleine kans op vertekening (bias). In geval van observationele (niet gerandomiseerde) studies is de uitgangspositie van de zekerheid van bewijs laag. De zekerheid van het bewijs per uitkomstmaat wordt, behalve door de methodologische kwaliteit van de individuele onderzoeken, ook bepaald door andere factoren, zoals de mate van consistentie van de gevonden resultaten uit de verschillende onderzoeken en de precisie van de gevonden uitkomst (zie tabel 1.1). Bij observationeel onderzoek kan het bewijs in bepaalde gevallen omhoog worden gegradeerd.
Tabel 1.1 GRADE: Factoren voor downgraden en upgraden 1
|
|
We downgraden de zekerheid van bewijs van studies met een hoge uitgangspositie (RCT’s), bij: |
|
We upgraden de zekerheid van bewijs van observationele studies bij: |
|
|
||
|
|
||
|
|
||
|
|
||
|
|
||
1. De zekerheid van het bewijs (zeer laag, laag, matig en hoog) verwijst naar de mate van vertrouwen dat men heeft in de schatting van het effect van een behandeling.
Bij de beoordeling van het wetenschappelijke bewijs ten aanzien van bovenstaande factoren werd uitgegaan van ‘Grade guidelines’, zoals ook te raadplegen in het ‘Grade handbook’ (Guyatt et al., 2013; Handbook for grading the quality of evidence and the strength of recommendations using the GRADE approach).
Legenda GRADE
Na vaststelling van het niveau van bewijs wordt dit in de bijbehorende conclusies als volgt verwoord:
|
Zekerheid |
Symbolen |
|
Signaalwoorden |
|
Hoog |
⊕⊕⊕⊕ |
“Het is aangetoond dat…” |
geeft, heeft (een effect), resulteert in |
|
Redelijk |
⊕⊕⊕◯ |
“Het is aannemelijk...” |
waarschijnlijk |
|
Laag |
⊕⊕◯◯ |
“Er zijn aanwijzingen…” |
zou kunnen, lijkt, suggereert |
|
Zeer laag |
⊕◯◯◯ |
“Het is onzeker, maar er zijn aanwijzingen dat…” |
onzeker |
Van bewijs naar aanbevelingen: Overwegingen
Naast het wetenschappelijk bewijs bepalen enkele andere factoren mede of een instrument of behandeling wordt aanbevolen. In de teksten van de vorige richtlijn-versies werd dit onder “Overige Overwegingen” beschreven.
Mee te wegen factoren om te bepalen of een instrument of behandeling wordt aanbevolen:
|
1. Kwaliteit van bewijs Hoe hoger de algehele kwaliteit van het bewijs, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. |
|
2. Balans tussen gewenste en ongewenste effecten Hoe groter het verschil is tussen de gewenste en ongewenste effecten, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Hoe kleiner dit verschil of hoe meer onzekerheid over de grootte van het verschil, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling. Toelichting:
|
|
3. Patiëntenperspectief Hoe groter de uniformiteit in waarden en voorkeuren van patiënten bij het afwegen van de voor- en nadelen van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. |
|
4. Professioneel perspectief Hoe groter de uniformiteit in waarden en voorkeuren van professionals ten aanzien van de toepasbaarheid van een interventie, des te waarschijnlijker wordt het formuleren van een sterke (positieve of negatieve) aanbeveling. Toelichting:
|
|
5. Middelenbeslag Hoe minder middelen er worden gebruikt (m.a.w. hoe lager de kosten van een interventie zijn vergeleken met de beschouwde alternatieven en andere kosten gerelateerd aan de interventie), des te waarschijnlijker wordt het formuleren van een sterke aanbeveling. Hoe meer onzekerheid over het middelenbeslag, des te waarschijnlijker wordt een conditionele aanbeveling. |
|
6. Organisatie van zorg Hoe meer onzekerheid of de geëvalueerde interventie daadwerkelijk op landelijke schaal toepasbaar is, des te waarschijnlijker wordt het formuleren van een conditionele aanbeveling. Toelichting:
|
Formulering van aanbevelingen
Afhankelijk van deze factoren kun je een instrument of behandeling wel of niet aanbevelen. We maken daarbij onderscheid tussen zwakke en sterke aanbevelingen. In het geval van een sterke aanbeveling zou je behandeling X voor alle patiënten met Y willen aanbevelen. Bij een zwakke aanbeveling is dit bijvoorbeeld afhankelijk van de voorkeuren van de patiënt in kwestie. Het is belangrijk in deze sectie expliciet te vermelden op grond waarvan een behandeling wel of niet wordt aanbevolen en ook waarom die aanbeveling zwak of sterk zou moeten zijn.
Voor de formulering van ‘sterke’ (onvoorwaardelijke) en ‘zwakke’ (voorwaardelijke) aanbevelingen is de volgende indeling aangehouden (zie tabel 1.2):
Tabel 1.2 GRADE Voorkeursformulering sterke / zwakke aanbevelingen
|
Gradering aanbeveling |
Betekenis |
Voorkeursformulering* |
|
STERK VOOR |
De voordelen zijn groter dan de nadelen voor bijna alle patiënten. Alle of nagenoeg alle geïnformeerde patiënten zullen waarschijnlijk deze optie kiezen. |
We bevelen [interventie] aan. |
|
ZWAK VOOR |
De voordelen zijn groter dan de nadelen voor een meerderheid van de patiënten, maar niet voor iedereen. De meerderheid van geïnformeerde patiënten zal waarschijnlijk deze optie kiezen. |
Overweeg [interventie], bespreek de voor- en nadelen). |
|
ZWAK TEGEN |
De nadelen zijn groter dan de voordelen voor een meerderheid van de patiënten, maar niet voor iedereen. De meerderheid van geïnformeerde patiënten zal waarschijnlijk deze optie kiezen. |
Wees terughoudend met [interventie], bespreek de voor- en nadelen). |
|
STERK TEGEN |
De nadelen zijn groter dan de voordelen voor bijna alle patiënten. Alle of nagenoeg alle geïnformeerde patiënten zullen waarschijnlijk deze optie kiezen. |
We bevelen [interventie] niet aan. |
* Het gaat hier om voorkeursaanbevelingen, deze kunnen in een enkele geval afwijken. Voor bepaalde hoofdstukken is GRADE niet toegepast (bijv. Organisatie van zorg) daar zijn uit praktisch oogpunt ook de aanbevelingen niet volgens GRADE.
Leeswijzer
Klachten of symptomen die horen bij een depressieve stoornis (depressie) noemen we ‘depressieklachten’ of ‘depressiesymptomen’. Met ‘depressieve klachten’ bedoelen we stemmingsklachten waar iemand hinder van ondervindt, waarbij niet wordt voldaan aan de DSM-criteria voor een depressieve stoornis (depressie).
Als we spreken van een depressieve stoornis of depressie wordt een unipolaire depressieve stoornis bedoeld, al dan niet chronisch, en inclusief de persisterende depressieve stoornis. Behalve van ‘(psychische/depressieve) stoornis’ spreken we in deze richtlijn, rechtdoende aan het patiëntenperspectief, bij voorkeur van ‘aandoening’.
Met kinderen en adolescenten bedoelen we kinderen van 8 tot 12 jaar en adolescenten van 12 tot 18 jaar. Met jongvolwassenen bedoelen we volwassenen van 18 tot 25 jaar. Met volwassenen bedoelen we mensen van 25 tot 60 jaar. Met ouderen bedoelen we oudere volwassenen van 60 jaar en ouder.
Metapsy
Tijdens de ontwikkeling van deze richtlijn is gebruik gemaakt van metapsy.org. Metapsy is een onderzoeksinitiatief van de Vrije Universiteit Amsterdam, onder leiding van professor Pim Cuijpers. Het hoofddoel van Metapsy is het verschaffen van toegang tot een meta-analytische database van klinische studies die de effecten van psychologische interventies, zoals psychotherapie, preventieve interventies en psychoeducatie, op diverse psychische aandoeningen en geestelijke gezondheidsproblemen onderzoeken.
Metapsy bevat twee R-pakketten waarmee met behulp van klinische variabelen van interesse (PICO) een meta-analyse kan worden uitgevoerd en waarbij alle relevante informatie om tot een GRADE conclusie te komen over de effecten van psychotherapie op depressieve symptomen wordt gepresenteerd in een (pdf) rapport of online zijn te bekijken.