Organisatie van Zorg
Uitgangsvraag
Op welke wijze dient de zorg voor patiënten met MASLD/MASH georganiseerd te worden?
Aanbeveling
Verwijzing naar de Maag-Darm-Leverziekten en/of Interne Geneeskunde
Patiënten met een VCTE-LSM (FibroScan®) <8 kPa/FIB-4 score <1,3/ELF <7,7:
- Adviseer leefstijlaanpassingen en pas obesitas, diabetes- en CVRM-management toe. Patiënten hoeven hiervoor niet verwezen te worden naar de Maag-Darm- Leverziekten;
- Beoordeel de leverfibrose na 3-5 jaar nogmaals.
Zie module ‘Leefstijlinterventies’, module ‘Cardiovasculair risicomanagement’ en module ‘Monitoren progressie van leverfibrose’
Patiënten met een VCTE-LSM FibroScan® >8,0 kPa), met progressie ondanks leefstijlinterventies en patiënten met een indicatie voor bariatrische chirurgie:
- Verwijs door naar de Maag-Darm-Leverziekten voor verdere diagnostiek en eventuele behandeling. Vooralsnog is behandeling niet voorbehouden aan de Maag-Darm-Leverziekten.
- Bepaal mede op basis van de complexiteit en co morbiditeit, zoals diabetes mellitus type 2 en dislipidemie, welke specialist(en) er nodig zijn.
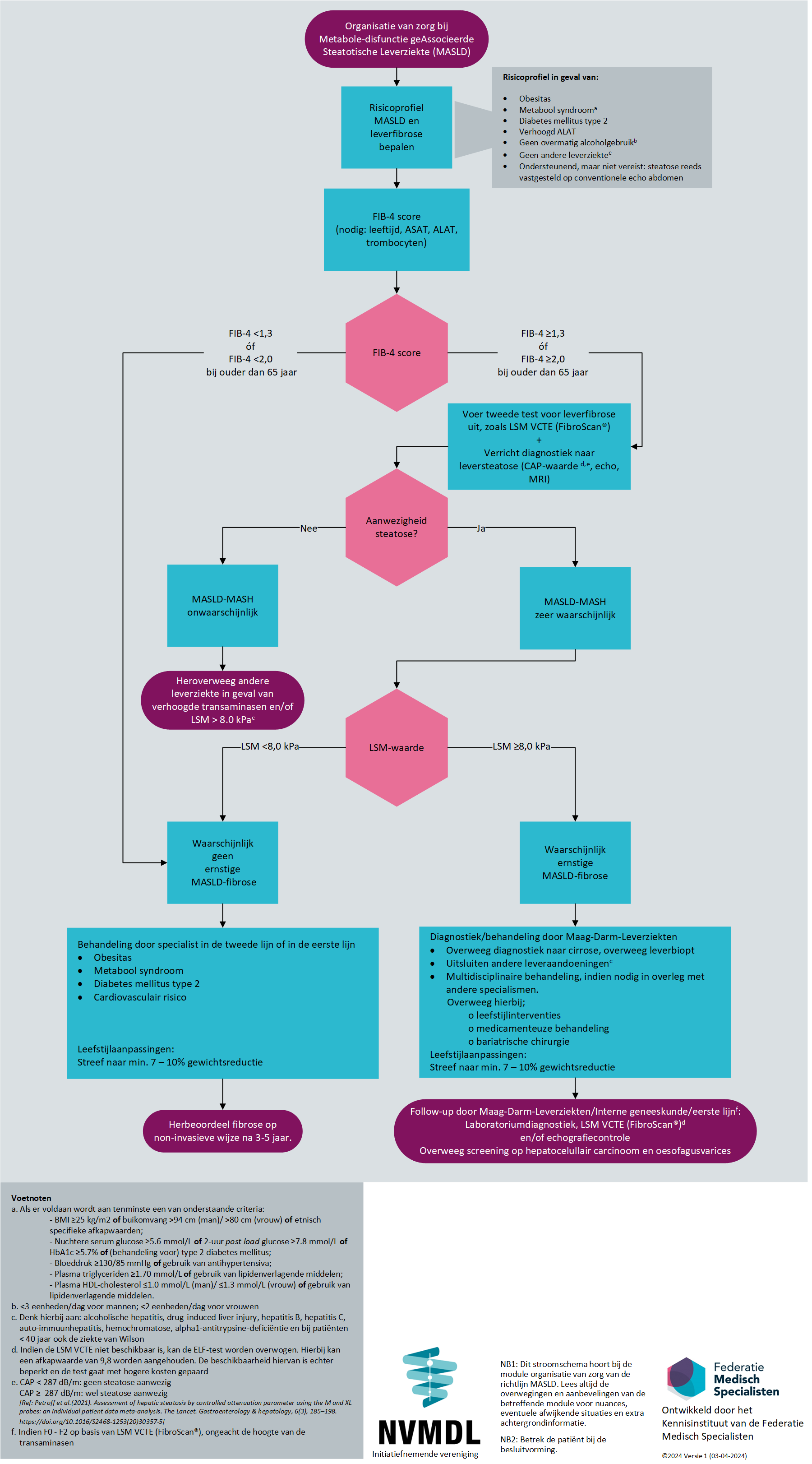
Maak gebruik van het stroomschema (Figuur 1) van het zorgproces voor patiënten met MASLD (zorgpad met diagnostisch algoritme voor leverfibrose).
Multidisciplinaire zorg
- Vorm binnen of vanuit ziekenhuizen een multidisciplinair team dat gespecialiseerd is in MASLD/MASH en maak afspraken over taken/ verantwoordelijkheden in een zorgpad. Maak hierbij gebruik van het stroomschema (Figuur 1) van het zorgproces voor patiënten met MASLD (zorgpad met diagnostisch algoritme voor leverfibrose).
- Zorg voor goede communicatie en afstemming met huisartsen, GLI-organisaties en diëtisten in de regio. Leg afspraken vast.
- Overweeg de inzet van een verpleegkundig specialist/ physician assistant als regiebehandelaar.
- Geef de patiënt informatie omtrent:
- Behandelmogelijkheden en leefstijlinterventies (beweging, voeding, GLI-programma’s) en bespreek hierbij de voor- en nadelen van de beschikbare opties;
- De Nederlandse Leverpatiënten Vereniging;
- Het (mogelijke) beloop van het ziektebeeld, risico’s en in hoeverre de ziekte nog reversibel is;
- Wie de hoofdbehandelaar is voor welk deel van de zorg;
- Verwijsmogelijkheid naar een leefstijlloket waar specifiek gekeken wordt welke leefstijlverandering voor de individuele patiënt haalbaar is en hoe deze ingezet kan worden, en met welke ondersteuning;
- eHealth tools/ apps, die ondersteuning geven in het inzicht verkrijgen in het voedingspatroon en beweging;
Behandeling en follow-up
- Bespreek met de patiënt het belang van leefstijlinterventie en gewichtsreductie. Dit is de eerste behandeling die geadviseerd wordt, naast diabetes- en CVRM-management. Zie module ‘Leefstijlinterventies’, module ‘Cardiovasculair risicomanagement’
- Overweeg en bespreek zo nodig andere behandelmogelijkheden zoals bariatrische chirurgie, vitamine E, pioglitazon of medicatie in studieverband met de patiënt. Zie module ‘Medicamenteuze behandeling’ en module ‘Bariatrische chirurgie’
- Verwijs de patiënt terug naar de huisarts als er sprake is van een MASLD-fibrose F0, F1 of F2 en de patiënt geen andere indicatie voor follow up heeft in de 2e lijn. Geef daarbij advies voor diabetes- en CVRM-management en na 3-5 jaar monitoring op fibrose progressie. Zie module ‘Cardiovasculair Risicomanagement’ en module ‘Monitoren progressie van leverfibrose’
- Overweeg bij patiënten met een verhoogd risico op fibroseprogressie zoals patiënten met bewezen MASH, patiënten met diabetes mellitus type 2 en bij patiënten met een ernstig fibrosestadium (F3) een korter interval. Zie module ‘Monitoren progressie van leverfibrose’.
- Overweeg HCC surveillance bij patiënten met een levercirrose op basis van MASLD. Zie module ‘HCC-surveillance’.
Mensen en middelen
- Betrokken professionals volgen minimaal 1x per 2 jaar een congres/ bijscholing omtrent MASLD/MASH.
- Zorg dat er een mogelijkheid is tot het verrichten van een VCTE-LSM (Fibroscan®). Mocht deze niet beschikbaar zijn, maak hierover dan afspraken met een ziekenhuis in de regio.
Overwegingen
In Figuur 1 is het stroomschema weergegeven voor de organisatie van zorg voor patiënten met MASLD/MASH. Hieronder worden de weergegeven stappen verder toegelicht en onderbouwd. Zoals ook op de startpagina bij deze richtlijn aangegeven, is deze module bedoeld voor zorgverleners in de tweede en derde lijn.
Stap 1: identificatie patiënt met risicoprofiel voor MASLD/MASH en mogelijk een ernstig stadium leverfibrose
Risicoprofiel MASLD/MASH
- Obesitas of metabool syndroom of DM2 (cave ‘lean’ MASH met BMI <25 kg/m2, met name bij Aziatische of Zuid-Amerikaanse achtergrond);
- Verhoogd ALAT en/of gamma GT. Voor beide geldt: ondersteunend maar niet vereist; de waarden kunnen zelfs bij ernstige stadia van MASLD in het referentiegebied vallen;
- Afwezigheid overmatig alcoholgebruik;
- Geen andere leverziekten; zie stap 2.
- Steatose reeds vastgesteld op beeldvorming zoals conventionele echo abdomen.
Toepassen van een diagnostisch algoritme voor patiënten met MASLD/MASH
Door toepassing van een diagnostische algoritme voor leverfibrose gekoppeld aan een klinisch zorgpad – een ontwikkeling die ook in andere Europese landen ingang vindt en met name in het Verenigd Koninkrijk recent effectief en doelmatig is gebleken, kan betere ‘case finding’ van ernstige gevallen van MASLD bereikt worden en tegelijkertijd reductie van onnodige verwijzingen van milde stadia naar de MDL-arts (Srivastava, 2019).
Zie ook module ‘Identificatie MASLD-fibrose’
Stap 2: Diagnostiek en stellen van de diagnose MASLD
Diagnostiek en stellen van de diagnose MASLD
Om MASLD bij de risicogroepen te diagnosticeren en de ernst ervan te bepalen, is het van belang dat huisartsen, internisten, cardiologen en reumatologen screenend onderzoek inzetten: leverlaboratorium, beeldvorming zoals bijvoorbeeld echo lever, uitsluiten andere leverziekten, en zo mogelijk een non-invasieve leverfibrosetest zoals de FIB-4 score, ELF en/of VCTE-LSM (FibroScan®).
Ondanks dat MASLD de meest voorkomende oorzaak is van leververvetting, is het van oorsprong/per definitie een diagnose per exclusionem en daarom is het van belang dat andere leverziekten worden uitgesloten. Het is kosteneffectief om dit in één keer te doen (Srivastava, 2019). Denk hierbij aan alcoholische hepatitis, drug-induced liver injury, hepatitis B en C, auto-immuunhepatitis, hemochromatose, alfa-1-antitrypsine-deficientie en bij patiënten < 40 jaar ook de ziekte van Wilson.
Stap 3: Beleid
Voor MASLD zijn er de volgende behandelmodaliteiten:
- leefstijlinterventie, de hoeksteen van de behandeling voor alle patiënten met MASLD
- voor patiënten met gevorderde stadia kan behandeling in trials met medicatie worden overwogen
- bij patiënten met ernstige/progressieve fibrotische MASLD en obesitas kan bariatrische chirurgie worden overwogen
Daarnaast is bij aanwijzingen voor MASLD-fibrose monitoring op progressie van de fibrose aangewezen. Zie module ‘Leefstijlinterventies’, module ‘Bariatrische chirurgie’ en module ‘Monitoren progressie van leverfibrose’.
Geen ernstige MASLD-fibrose – in de eerste of tweede lijn
Patiënten zonder ernstige MASLD-fibrose (FIB-4 score <1.3, ELF < 7,7 en/of VCTE-LSM (FibroScan®) < 8.0 kPa) worden gestratificeerd als laag tot mild risico op ernstige MASLD-fibrose en hebben geen indicatie voor verwijzing naar de Maag-Darm-Leverziekten. Patiënten < 50 jaar hebben gedurende hun leven nog een aanzienlijke kans om ernstiger stadia van NALFD-fibrose te ontwikkelen. MASLD is in het algemeen een langzaam progressief proces. Deze progressiekans is verhoogd wanneer er tevens sprake is van (ernstig) overgewicht en/of DM2. Hun MASLD, overgewicht, DM2 en cardiovasculair risico kan door de huisarts of internist worden gemanaged, in samenwerking met een diëtist en/of leefstijlcoach. Herbeoordeling op (het ontstaan van) gevorderde danwel ernstige leverfibrose wordt geadviseerd. Zie module ‘Leefstijlinterventies’, module ‘Cardiovasculair risicomanagement’ en module ‘Monitoren progressie van leverfibrose’.
Ernstige MASLD-fibrose – bij het specialisme Maag-Darm-Leverziekten
Aanwijzingen voor gevorderde danwel ernstige MASLD-fibrose (FIB-4 > 2,67; ELF> 7,7; VCTE-LSM (Fibroscan®) >8.0 kPa), progressie van MASLD-fibrose ondanks leefstijlinterventies en eventuele kandidaten voor bariatrische chirurgie met als co-indicatie fibrotische MASLD zijn indicaties voor verwijzing naar de Maag-Darm-Leverziekten voor nader aanvullend onderzoek en behandeling en monitoring. Bij de behandeling van patiënten met MASLD is een multidisciplinaire aanpak gewenst, mede gezien de frequente aanwezigheid van comorbiditeit, zoals DM2 en dislipidemie.
Behandeling
Leefstijlinterventie
Leefstijlinterventie is aanbevolen bij alle patiënten met MASLD, ongeacht het stadium, en dient gericht te zijn op minstens 7-10% gewichtsreductie, vermindering van steatose en insuline-resistentie. Leefstijlinterventie kan eventueel in samenwerking met de diëtist/ leefstijlcoaching opgezet worden. Hierbij staat een pragmatische, op het individu afgestemde handelswijze centraal waarbij aanpassingen van het eetpatroon en progressieve inspanningsbelasting worden gecombineerd. Hierbij moeten ook cardiometabole comorbiditeiten in acht worden genomen. Zie voor gedetailleerde overwegingen en verdere aanbevelingen de module ‘Leefstijlinterventies’
Medicamenteuze behandeling
Overweeg medicamenteuze behandeling in patiënten met MASH en leverfibrose waarbij leefstijlinterventies niet succesvol zijn gebleken. Leefstijlinterventies zijn de eerste keus behandeling, mede gezien de lage bewijsvoering voor de effectiviteit van medicamenteuze behandeling, onduidelijkheid over lange termijn resultaten en bijwerkingen en de beperkte opties van geschikte medicatie op dit moment.
Indien er gekozen wordt voor een medicamenteuze behandeling, overweeg dan het gebruik van pioglitazon of vitamine E.
Behandeling in klinische trials, met name bij falen leefstijlinterventie en progressief beeld, kan worden overwogen bij patiënten met MASLD-fibrosestadium F2-F3 (d.w.z. gevorderde respectievelijk ernstige fibrose).
Zie voor gedetailleerde overwegingen en verdere aanbevelingen de module ‘Medicamenteuze behandeling’
Bariatrische chirurgie
Overweeg bij obesitas en ernstige/ progressieve fibrotische MASLD bariatrische chirurgie; tot 60% van de patiënten heeft resolutie van MASH na gastric bypass (RYGB), inclusief resolutie fibrose. De richtlijn ‘chirurgische behandeling van obesitas’ geeft sinds 2021 aan dat bij een BMI ≥ 35 kg/m2 bariatrische chirurgie mogelijk is in het geval van belangrijke comorbiditeit, en dat ernstige/ progressieve fibrotische MASLD als zo’n comorbiditeit kan gelden. Er kan bij een BMI ≥ 35 kg/m2 en een MASLD-fibrose (VCTE-LSM (Fibroscan®) > 8,0 kPa) worden verwezen worden naar een chirurg met expertise bariatrie. Zie voor overwegingen en verdere aanbevelingen de module ‘Bariatrische chirurgie’
Stap 4. Follow-up
Een deel van de patiënten met de diagnose MASLD/MASH zal onder controle blijven bij het specialisme Maag-Darm-Leverziekten. Bijvoorbeeld omdat er een verhoogd risico is op het ontwikkelen van levercirrose of het hepatocellulair carcinoom.
Bij een verhoogd risico wordt follow-up geadviseerd met onder andere laboratoriumonderzoek- en VCTE-LSM (FibroScan®). De inzet van een verpleegkundig specialist of een physician assistant kan een toegevoegde waarde hebben in de kwaliteit van de zorg qua behandeling en begeleiding. Afhankelijk van de gemaakte afspraken in het zorgpad kunnen deze collega’s regiebehandelaar zijn.
Monitoring progressie MASLD
Monitor patiënten met MASLD en fibrosegraad 0-3 elke 3-5 jaar op progressie van leverfibrose op non-invasieve wijze. Overweeg bij patiënten met een verhoogd risico op fibroseprogressie zoals patiënten met bewezen MASH, patiënten met DM2 en bij patiënten met een ernstig fibrosestadium (F3) een korter interval.
Zie voor overwegingen en verdere aanbevelingen de module ‘Monitoren progressie van leverfibrose’
Surveillance hepatocellulair carcinoom
Overweeg surveillance voor hepatocellulair carcinoom door middel van beeldvorming met of zonder alfafoetoproteïne elke zes maanden bij patiënten met een bewezen levercirrose (op basis van radiologische beeldvorming, elastografie of leverbiopt) ten gevolge van MASLD.
Zie voor overwegingen en verdere aanbevelingen de module ‘HCC-surveillance’
Criteria terugverwijzing naar huisarts
Patiënten met een laag risico die door de huisarts vervolgd kunnen worden, zijn:
- VCTE LSM (FibroScan®) < 8,0 kPa, suggestief voor F0, F1, F2 (ongeacht de hoogte van de transaminasen)
Adviseer in de ontslagbrief naar de huisarts:
- Management van obesitas, DM2 (als aanwezig) en cardiovasculair risico (CVRM). Zie module ‘Cardiovasculair risicomanagement’
- Monitoring op MASLD-fibroseprogressie. Zie module ‘Identificatie MASLD-fibrose’ en module ‘Monitoren progressie van leverfibrose’
- De verwachting is dat vanaf medio 2026 meer medicatie beschikbaar is voor patiënten met MASLD-fibrose. Het advies is om te overwegen patiënten bij indicatie (vanaf F2-fibrose) dan opnieuw te verwijzen naar de 2e lijn voor FibroScan.
Het advies is om dit eerst met de patiënt te bespreken voordat patiënt terugverwezen wordt naar de huisarts.
Figuur 1: Stroomschema organisatie van zorg voor patiënten met MASLD/MASH.
Coördinatie van multidisciplinaire zorg
Taakverdeling en verantwoordelijkheden, coördinatie van de zorg
Nadat een patiënt verwezen is naar de MDL-arts, kunnen er meerdere specialismen betrokken zijn bij de behandeling en begeleiding van de patiënt met MASLD/MASH (van Dijk, 2021). De voorkeur heeft een multidisciplinaire aanpak per ziekenhuis met behulp van lokaal vastgestelde zorgpaden/ protocollen met duidelijkheid wie waarvoor verantwoordelijk is.
Hierbij is het volgende van belang:
- Zorg dat er een zorgpad beschikbaar is in uw organisatie ter afstemming tussen Maag-Darm-Leverziekten en andere betrokken specialismen zoals interne geneeskunde, endocrinologie, vasculaire geneeskunde en cardiologie;
- Advies is om in de eerste lijn een coördinerende rol voor de praktijkondersteuner te overwegen, in aanvulling op het management van obesitas, DM2, dislipidemie en hypertensie;
- Verpleegkundig specialisten of physician assistants kunnen ingezet worden als regiebehandelaar in de zorg voor deze multimorbide patiënten;
- Maak afspraken met regionale diëtisten en GLI-coördinatoren ten aanzien van leefstijlinterventies gericht op MASLD. Een overzicht van GLI-centra in de regio is hier beschikbaar.
Informatievoorziening en besluitvorming
De eerste stap in het behandel- en begeleidingsproces is een optimale informatievoorziening aan de patiënt. Het is van belang dat de stappen die ondernomen worden, gericht zijn op een langdurige aanpassing van de leefstijl en aansluiten bij de voorkeuren en wensen van de individuele patiënt.
Overwegingen/ adviezen:
- Wijs de patiënt op de informatie van de Nederlandse Leverpatiënten Vereniging die beschikbaar is via de website https://www.leverpatientenvereniging.nl/ en op de informatie die beschikbaar is op Thuisarts.nl. www.thuisarts.nl
- Geef duidelijke voorlichting over het (mogelijke) beloop van het ziektebeeld, risico’s en in hoeverre de ziekte nog reversibel is;
- Geef duidelijkheid over wie hoofdbehandelaar is voor welk deel van de zorg;
- Samen beslissen: bespreek voor- en nadelen van de interventies en mogelijkheden;
- Verwijs patiënt eventueel naar een leefstijlloket waar specifiek gekeken wordt welke leefstijlverandering voor de individuele patiënt haalbaar is en hoe deze ingezet kan worden, en met welke ondersteuning. Ook zijn er in gemeenten verschillende beweegprogramma’s beschikbaar, welke inzichtelijk zijn gemaakt per gemeente op de website van de gemeente;
- Wijs de patiënt op eHealth tools/ apps, die ondersteuning geven in het inzicht verkrijgen in het voedingspatroon en beweging;
Mensen en middelen
Mensen
Om het gehele zorgproces voor de patiënt met MASLD/MASH goed in te richten en op elkaar aan te laten sluiten, is optimale samenwerking van belang. Zorgverleners die hierbij betrokken zijn, zijn o.a. de huisarts, medisch specialisten (MDL-arts/internist), verpleegkundig specialisten/ physician assistants, diëtisten en leefstijlcoaches.
Van de betrokken professionals wordt verwacht dat ze naast hun basaal beroepsvaardigheden, kennis en ervaring hebben op het gebied van MASLD/MASH, leefstijlinterventies, behandeling en follow-up.
Middelen
Het medisch behandelteam beschikt over de mogelijkheid om de volgende onderzoeken te verrichten of om patiënt hiervoor in de regio te kunnen verwijzen:
- Echografie;
- VCTE-LSM (FibroScan®) met CAP-meting;
- Laboratoriumonderzoek.
Patiënten worden behandeld op de plaats waar dit het beste gedaan kan worden (1e lijn/ 2e lijns zorg). Door de risico-inschatting wordt alleen bij patiënten met een hoog risico zorg in de 2e lijn (‘dure zorg’) geleverd. Daarnaast draagt een multidisciplinaire aanpak bij aan een verlaging van de risico’s die patiënten met MASLD/MASH hebben. Patiënten met een BMI >25 en een co-morbiditeit zoals MASLD/MASH en patiënten met een BMI van 30 of hoger, krijgen een volledige vergoeding van de GLI vanuit het basispakket van de zorgverzekering.
Onderbouwing
Achtergrond
MASLD heeft een hoge prevalentie in Nederland: 22-25% van de algemene volwassen bevolking (van Dijk, 2022). Bij risicogroepen loopt deze prevalentie op tot 50-60%, te weten patiënten met overgewicht/obesitas, metabool syndroom en diabetes mellitus type 2 (DM2, van den Berg, 2017). MASH, het actieve en potentieel progressieve stadium van MASLD, komt naar schatting op grond van de (inter)nationale vakliteratuur bij 3% van de Nederlanders voor. MASH kan progressie vertonen naar MASH-fibrose en daarna cirrose en zelfs hepatocellulair carcinoom. Het is van belang patiënten met ernstige MASLD-gerelateerde fibrose tijdig te diagnosticeren, aangezien de opeenvolgende MASLD-fibrosestadia een sterke graduele samenhang vertonen met zowel lever-gerelateerde mortaliteit als met ‘all-cause mortality’ (Taylor, 2020; Dulai, 2017). De laatste jaren komen deze ernstige MASLD-stadia steeds meer voor (Estes, 2018).
Daarnaast treden bij patiënten met MASLD twee keer meer atherosclerotische cardiovasculaire events op (Stols-Goncalves, 2019). Patiënten met MASLD hebben dus vaak cardiometabole comorbiditeiten en lopen daarom bij verschillende medische disciplines. Patiënten en artsen merken progressie van MASLD echter onvoldoende op, omdat MASLD-progressie vaak asymptomatisch verloopt en omdat het bewustzijn van en de kennis over MASLD in de zorg en de implementatie van zorgpaden om voortschrijdende MASLD-stadia tijdig te detecteren, beperkt zijn (Lazarus, 2021). De huidige diagnostische benadering van MASLD varieert sterk, wat leidt tot zowel over- als onderdiagnostiek bij deze groep patiënten en te late detectie van vergevorderde stadia bij patiënten, dat wil zeggen als er al sprake is van ernstige MASLD-fibrose of zelfs MASLD-cirrose of MASLD-gerelateerd hepatocellulair carcinoom. Goede onderlinge samenwerking tussen de betrokken medische disciplines bij de diagnose, stadiëring en behandeling van MASLD is daarom aangewezen, conform de adviezen van (inter)nationale richtlijnen (Cusi, 2022; Marjot, 2020).
Gezien de toenemende prevalentie en ernst van MASLD/MASH is het van belang de zorg goed te organiseren middels een multidisciplinaire aanpak.
Referenties
- van den Berg, E. H., Amini, M., Schreuder, T. C. et al (2017). Prevalence and determinants of non-alcoholic fatty liver disease in lifelines: A large Dutch population cohort. PLoS One, 12(2), e0171502.
- Cusi, K., Isaacs, S., Barb, D. et al (2022). American Association of Clinical Endocrinology clinical practice guideline for the diagnosis and management of nonalcoholic fatty liver disease in primary care and endocrinology clinical settings: co-sponsored by the American Association for the Study of Liver Diseases (AASLD). Endocrine Practice, 28(5), 528-562.
- van Dijk, A. M., Schattenberg, J. M., Holleboom, A. G., & Tushuizen, M. E. (2021). Referral care paths for non?alcoholic fatty liver diseaseGearing up for an ever more prevalent and severe liver disease. United European Gastroenterology Journal, 9(8), 903-909.
- van Dijk, A. M., Vali, Y., Mak, A. L., Galenkamp, H., Nieuwdorp, M., van den Born, B. J., & Holleboom, A. G. (2022). Noninvasive tests for nonalcoholic fatty liver disease in a multi?ethnic population: The HELIUS study. Hepatology communications.
- Dulai, P. S., Singh, S., Patel, J. et al (2017). Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease: systematic review and meta?analysis. Hepatology, 65(5), 1557-1565.
- Estes, C., Razavi, H., Loomba, R., Younossi, Z., & Sanyal, A. J. (2018). Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease. Hepatology, 67(1), 123-133.
- Lazarus, J. V., Anstee, Q. M., Hagström, H. et al (2021). Defining comprehensive models of care for NAFLD. Nature reviews Gastroenterology & hepatology, 18(10), 717-729.
- Marjot, T., Moolla, A., Cobbold, J. F., Hodson, L., & Tomlinson, J. W. (2020). Nonalcoholic fatty liver disease in adults: current concepts in etiology, outcomes, and management. Endocrine reviews, 41(1), 66-117.
- Stols-Gonçalves, D., Hovingh, G. K., Nieuwdorp, M., & Holleboom, A. G. (2019). NAFLD and atherosclerosis: two sides of the same dysmetabolic coin?. Trends in Endocrinology & Metabolism, 30(12), 891-902.
- Taylor, R. S., Taylor, R. J., Bayliss, S. et al (2020). Association between fibrosis stage and outcomes of patients with nonalcoholic fatty liver disease: a systematic review and meta-analysis. Gastroenterology, 158(6), 1611-1625.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 19-03-2024
Laatst geautoriseerd : 19-03-2024
Geplande herbeoordeling : 01-12-2025
De NVMDL is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied. De werkgroep heeft per module een inschatting gemaakt van de periode waarbinnen de modules beoordeeld zouden moeten worden voor eventuele herziening.
|
Module |
Uiterlijk jaar voor beoordeling |
|
Identificatie MASLD-fibrose |
2027 |
|
Leefstijlinterventies |
2027 |
|
Medicamenteuze behandeling |
2025 |
|
Bariatrische chirurgie |
2027 |
|
Cardiovasculair risicomanagement |
2027 |
|
Monitoring progressie van leverfibrose |
2027 |
|
HCC-surveillance |
2025 |
|
Organisatie van zorg |
2025 |
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met MASLD/MASH.
Werkgroep
- Dr. M.E. Tushuizen (voorzitter), MDL-arts, Leids Universitair Medisch Centrum, NVMDL
- Dr. A.G. Holleboom, internist-endocrinoloog en vasculaire geneeskunde, Amsterdam UMC, NIV
- Dr. J.G.P. Reijnders (vice-voorzitter), MDL-arts, HagaZiekenhuis, NVMDL
- Dr. M.M.J. Guichelaar, MDL-arts, Medisch Spectrum Twente, NVMDL
- Dr. J. Blokzijl, MDL-arts, Universitair Medisch Centrum Groningen, NVMDL
- Dr. G. H. Koek, MDL-arts en leefstijlcoach, Maastricht UMC+, NVMDL
- Dr. S. Simsek, internist-endocrinoloog en vasculaire geneeskunde, Noordwest Ziekenhuisgroep, NIV
- Prof. dr. M.E. Numans, hoogleraar huisartsengeneeskunde/huisarts, NHG
- T.A. Korpershoek, Verpleegkundig specialist MDL, Albert Schweitzer ziekenhuis, V&VN MDL
- Drs. L.C. te Nijenhuis-Noort, Diëtist, NVD
- Drs. J.A. Willemse, Directeur/patiëntvertegenwoordiger, NLV
Klankbordgroep
- Prof. dr. J. Verheij, patholoog, Amsterdam UMC, NVVP
Met ondersteuning van
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. M.E. Tushuizen (voorzitter) |
MDL-arts, Leids Universitair Medisch Centrum |
Geen |
Ontwikkeling screening NAFLD bij DM2, projectleider, financier: Novo Nordisk; Ontwikkeling zorgpad NAFLD/NASH, geen projectleider, financier: Gilead; Ontwikkeling zorgpad NAFLD/NASH, projectleider, financier MLDS; Internationaal onderwijsprogramma, projectleider, financier: Pfizer. |
Vicevoorzitter aangesteld, voor module over medicamenteuze behandeling en module over CVRM. Daarmee restricties ten aanzien van besluitvorming bij de betreffende modules. |
|
Dr. J.G.P. Reijnders (vice-voorzitter) |
MDL-arts, HagaZiekenhuis, Erasmus MC (vanaf sept 2023) |
Lid Raad Kwaliteit NVMDL (onbetaald); Lid clinical board DGEA/DRCE/PRISMA netwerk |
Geen |
Geen restricties |
|
Dr. M.M.J. Guichelaar |
MDL-arts, Medisch Spectrum Twente |
Lid Kwaliteitsvisitatie commissie-audits; Lid Auto-immuun hepatitis werkgroep (onbetaald); Secretaris NAFLD/ NASH werkgroep (onbetaald) |
Ontwikkeling Serious game voor NAFLD, financier: MLDS |
Geen restricties |
|
Dr. J. Blokzijl |
MDL-arts, Universitair Medisch Centrum Groningen |
Geen |
Extracellular vesicles: towards personalized monitoring NAFLD, geen projectleider, financier MLDS |
Geen restricties |
|
Dr. G. Koek |
MDL-arts, Maastricht UMC+, onderzoeker NUTRIM Universiteit Maastricht |
Lid adviesraad NLV |
Nieuwe medicatie bij NASH, projectleider, financier: Boehringer Ingelheim; Genfit Resolve-it trial, projectleider, financier Convance/Genfit; Onderzoek semaglutide, projectleider, financier: Novo Nordisk; ontwikkeling Happi Lever App, rol als projectleider, financier MLDS |
Restricties ten aanzien van besluitvorming bij de module over medicamenteuze behandeling. |
|
Dr. A.G. Holleboom |
Internist-endocrinoloog en vasculaire geneeskunde en assistant professor Amsterdam UMC; staflid vasculaire geneeskunde |
Betaald adviseurschap Novo Nordisk (neergelegd) |
Studie naar autophagic turnover of lipid droplets in NASH, projectleider, financier: Gilead; Ontwikkeling zorgpad NAFLD/NASH, geen projectleider, financier: Gilead; onderzoek naar non-invasieve proxies en Fibroscan in NAFLD in Helius study population, financier: Novo Nordisk. |
Restricties ten aanzien van besluitvorming bij de module over medicamenteuze behandeling. |
|
Dr. S. Simsek |
Internist-endocrinoloog Noordwest Ziekenhuisgroep en Amsterdam UMC |
Voorzitter wetenschapscommissie NWZ; Begeleider promovendi |
Onderzoek naar semaglutide, participatie, financier: Novo Nordisk |
Restricties ten aanzien van besluitvorming bij de module over medicamenteuze behandeling. |
|
Prof. dr. M.E. Numans |
hoogleraar huisartsengeneeskunde LUMC |
Huisarts in Utrecht (betaald); voorzitter Autorisatiecommissie Standaarden NHG (vacatiegelden); Bestuurslid stichting SALTRO2 Diagnostic Living Lab (vacatiegelden); Adviesraad Leefstijl Norgine (onbetaald) |
Geen |
Geen restricties |
|
T.A. Korpershoek |
Verpleegkundig specialist MDL, Albert Schweitzer ziekenhuis; flex-docent HAN-MDL opleiding |
Bestuurslid V&VN MDL; Voorzitter netwerk VS MDL V&VN MDL (vacatiegelden) |
Geen |
Geen restricties |
|
Drs. L.C. te Nijenhuis-Noort |
Diëtist/Klinisch epidemioloog |
Lid Netwerk MDL diëtisten (onbetaald); Lid Commissie Voeding NVMDL (onbetaald) |
Geen |
Geen restricties |
|
Drs. J.A. Willemse |
Directeur NLV |
Board member Liver Patients International (onbetaald); Member management board ERN RARE LIVER (patient advocate, (onbetaald); lid diverse internationale expert groups NAFLD/NASH (onbetaald) |
|
Geen restricties |
|
Klankbordgroep lid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. J. Verheij |
Patholoog, Amsterdam UMC |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van de Nederlandse Leverpatiënten Vereniging in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kopje waarden en voorkeuren van patiënten). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Nederlandse Leverpatiënten Vereniging en de aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Organisatie van zorg |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met MASLD/MASH. Tevens zijn er (aanvullende) knelpunten aangedragen door de Nederlandse Vereniging van Maag-Darm-Leverartsen, Nederlandse Internisten Vereniging, Nederlandse Vereniging voor Klinische Geriatrie en de Nederlandse Vereniging van Ziekenhuizen via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.