Bloeddrukmedicatie bestaande nefropathie
Uitgangsvraag
Welke (combinaties van) bloeddrukverlagende medicamenten zijn optimaal in het remmen van progressie van nierschade bij patiënten met type 1 of 2 diabetes en nefropathie?
Aanbeveling
Gebruik in principe voor het vaststellen van de indicatie voor bloeddrukverlagende medicatie, de behandeldoelen en het vervolgen van de behandeling, bij alle patiënten met diabetische nefropathie een vergelijkbare benadering zoals vastgesteld in de richtlijn Cardiovasculair Risicomanagement (NHG/NIV/NVvC, 2019).
Hanteer na het vaststellen van een te hoge bloeddruk onderstaande uitgangspunten:
- Bepaal het behandeldoel in samenspraak met de patiënt:
- Overweeg de streefwaarde voor de bloeddruk te individualiseren, met name op basis van leeftijd, mate van kwetsbaarheid en levensverwachting, absolute cardiovasculaire ziektereductie en (potentiële) schade.
- Overweeg voor patiënten met een beperkte levensverwachting een minder strikt beleid, en voor jongere patiënten met ernstig verhoogde albuminurie juist een strikter beleid.
- Hanteer bij het vaststellen van de individuele streefwaarde het volgende algemene uitgangspunt:
- Behandel patiënten met diabetische nefropathie (eGFR < 60 ml/min/1,73 m2 en/of verhoogde albuminurie) bij een systolische bloeddruk ≥ 130 mmHg. De streefwaarde is daarbij < 130 mmHg.
- Overweeg het starten van een ACE-remmer of ARB bij patiënten met diabetes met verhoogde albuminurie ondanks een systolische bloeddruk < 130 mmHg.
Behandel patiënten met diabetische nefropathie op basis van de individuele bloeddrukstreefwaarde, bepaal het behandelplan in samenspraak met de patiënt, en volg hierbij onderstaand stappenplan:
- Verstrek leefstijladviezen (zie richtlijn Chronische Nierschade; NIV/NHG, 2018).
- Start bij een niet bereikt bloeddrukbehandeldoel met een ACE-remmer of ARB. Overweeg in het geval van bijwerkingen bij de ene klasse RAAS-remmers (ACE-remmer of ARB) te wisselen naar de andere klasse.
- Controleer in de tweede week na het starten van een ACE-remmer of ARB bij patiënten met eGFR < 60 ml/min/1,73 m2, het serum natrium, kalium en creatinine, en dus de eGFR. Een stijging van creatinine met maximaal 25% (eGFR daling met maximaal 25%) wordt geaccepteerd. Bij grotere veranderingen dient overlegd te worden met of verwezen te worden naar een ter zake kundige internist of nefroloog.
- Kies bij een niet behaald bloeddrukbehandeldoel of bij persisterende verhoogde albuminurie, ondanks geoptimaliseerde behandeling met ACE-remmer of ARB, voor het toevoegen van een diureticum* of calcium antagonist. Start bij voorkeur met een diureticum* bij patiënten met een te hoge zoutinname ondanks dieetadviezen.
- Kies bij niet behalen van het bloeddrukbehandeldoel of bij persisterende verhoogde albuminurie ondanks twee adequaat gedoseerde middelen (ACE-remmer of ARB samen met diureticum* of calciumantagonist), voor behandeling met een combinatie van een ACE-remmer of ARB met een calciumantagonist en diureticum*.
- Kies bij intolerantie voor zowel ACE-remmer als ARB voor (combinatie)behandeling met alternatieve bloeddrukverlagers: diureticum* en/of calciumantagonist, renineremmer of aldosteronantagonist. Pas aantal en dosering van deze middelen aan op geleide van verdraagzaamheid en de bloeddrukstreefwaarde.
Stop met het verder intensiveren van bloeddrukverlagende behandeling en overweeg het verlagen van de dosering bij kwetsbare ouderen met een diastolische bloeddruk < 70 mmHg, ongeacht de hoogte van de systolische bloeddruk.
Gebruik geen RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB). Bij een combinatie met andere RAAS-remmers (renineremmers, aldosteronantagonisten) kan eveneens een negatief effect niet worden uitgesloten.
Overweeg bij twijfel aan de waarschijnlijkheidsdiagnose diabetische nefropathie om patiënten te verwijzen naar een nefroloog.
Wees alert op therapieontrouw bij therapieresistente hypertensie (niet bereiken van het bloeddruk behandeldoel ondanks drie verschillende klasses adequaat gedoseerde bloeddrukverlagende middelen waaronder een diureticum*, of bereikt bloeddruk behandeldoel met vier verschillende klasses bloeddrukverlagende middelen).
Overweeg bij therapieresistente hypertensie verwijzing naar een ter zake deskundige internist of expertisecentrum.
Wees alert op houdingsafhankelijke duizeligheid, met name na wijzigingen in de therapie of bij onbegrepen klachten. Pas zo nodig het beleid aan. Meet in ieder geval wanneer er onbegrepen klachten zijn, naast liggende/zittende bloeddruk ook steeds de staande bloeddruk. Beschouw klachten passend bij orthostase ook als een belangrijk signaal (zeker bij oudere mensen), ook al is de orthostase niet objectiveerbaar.
Overweeg de behandeling (met name combinatie van RAAS-blokkade en diureticum) aan te passen bij (kwetsbare) ouderen/ patiënten ouder dan 70 jaar als er sprake is van een (dreigende) dehydratie. Als praktisch handvat voor beslissingen kan daarbij worden aangehouden:
- vijf dagen met een omgevingstemperatuur boven de 27 °C en/of;
- meer dan driemaal daags waterdunne diarree en/of;
- meer dan driemaal daags overgeven en/of;
- meer dan twee dagen koorts boven 38,5 °C.
*thiazidediureticum of lisdiureticum (bij renale overvulling) in een dosering aangepast aan de nierfunctie
Overwegingen
De onderstaande overwegingen gelden in principe voor het overgrote deel van de patiëntenpopulatie waarop de uitgangsvraag betrekking heeft. Als definitie voor diabetische nefropathie is gebruik gemaakt van de definitie chronische nierschade uit de richtlijnen Chronische Nierschade (NIV/NHG, 2018; NfN, 2018): aanwezigheid van een afwijkende nierfunctie en/of één van de markers van nierschade gedurende drie maanden of langer, onafhankelijk van de oorzaak. Hierbij wordt voorbijgegaan aan de mogelijkheid dat de nierschade bij een patiënt met diabetes het gevolg kan zijn van een andere oorzaak dan diabetes. De huidige richtlijn doet geen uitspraken over bloeddrukdoelen en verwijst hiervoor naar de vigerende richtlijnen (zie ‘Bloeddrukbehandeldoelen’ later in de tekst). Voor de subgroep (kwetsbare) ouderen/patiënten ouder dan 70 jaar zijn aanvullende overwegingen van belang met betrekking tot de voor- en nadelen van de interventie, en de waarden en voorkeuren van patiënten (zie module Kwetsbare ouderen met hypertensie bij CVRM in de richtlijn Cardiovasculair Risicomanagement, NHG/NIV/NVvC, 2019). Meer algemeen geldt dat behandeldoelen moeten worden geïndividualiseerd in samenspraak met de patiënt op basis van kwetsbaarheid, leeftijd, comorbiditeit en daarmee te verwachten absolute winst versus schade.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Uit de systematische literatuuranalyse (zie Samenvatting literatuur en Conclusies op tabblad Onderbouwing) kan voor personen met diabetes type 2 en nefropathie worden geconcludeerd:
Voor RAAS-monotherapie
- Monotherapie met ACE-remmers of ARB's verlaagt waarschijnlijk het risico op verdubbeling van serum creatinine (GRADE bewijskracht: redelijk), verlaagt waarschijnlijk albumine-excretie in de urine (bewijskracht: redelijk), bevordert regressie van matig verhoogde albuminurie (microalbuminurie) (bewijskracht: hoog), remt waarschijnlijk progressie van microalbuminurie (bewijskracht: redelijk), verlaagt het risico op eindstadium nierfalen (waarschijnlijk voor ARB's, mogelijk voor ACE-remmers; bewijskracht respectievelijk redelijk en laag), heeft mogelijk geen effect op totale mortaliteit en cardiovasculaire mortaliteit (bewijskracht: laag), verlaagt het risico op een myocardinfarct (waarschijnlijk voor ARB's, mogelijk voor ACE-remmers; bewijskracht respectievelijk redelijk en laag), heeft mogelijk geen effect op beroerte (bewijskracht: laag), leidt mogelijk tot enige verhoging van het risico op acuut nierfalen (bewijskracht: laag), verhoogt mogelijk het risico op hyperkaliëmie (maar bewijskracht is zeer laag), ACE-remmers verhogen het risico op droge hoest (bewijskracht: hoog) en ARB’s mogelijk niet (bewijskracht: laag).
- Veel minder is bekend over monotherapie met renine-remmers en er zijn geen aanwijzingen voor een meerwaarde van renine-remmers ten opzichte van ACE-remmers of ARB's: monotherapie met een renine-remmer verhoogt mogelijk het risico op verdubbeling van serum creatinine (bewijskracht: laag), verhoogt mogelijk het risico op acuut nierfalen (bewijskracht: laag) en op presyncope (bewijskracht: hoog), en er is meer bewijs voor een verhoogd risico op hyperkalïemie (bewijskracht laag in vergelijking met zeer laag voor ACE-remmer en ARB).
- Monotherapie met ACE-remmer en monotherapie met ARB lijken een vergelijkbaar effect te hebben op de meeste uitkomstmaten, ARB’s zijn mogelijk enigszins effectiever in het bevorderen van regressie van matig verhoogde albuminurie (microalbuminurie) (bewijskracht: laag) en het remmen van progressie naar ernstig verhoogde albuminurie (macroalbuminurie) (bewijskracht: redelijk), en er is meer bewijs voor een verlaagd risico op myocardinfarct bij ARB monotherapie (bewijskracht redelijk in vergelijking met laag voor ACE-remmers).
Voor RAAS-dubbeltherapie
- Er zijn geen duidelijke aanwijzingen voor een meerwaarde van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) in vergelijking met RAAS-monotherapie (ACE-remmer of ARB): RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) is mogelijk wel effectiever dan RAAS-monotherapie in het bevorderen van regressie van microalbuminurie (bewijskracht: laag), maar RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) leidt mogelijk tot een (verder) verhoogd risico op acuut en eindstadium nierfalen (bewijskracht: laag), en er is meer bewijs voor een verhoogd risico op hyperkaliëmie (bewijskracht laag in vergelijking met zeer laag voor monotherapie met ACE-remmer of ARB).
Voor RAAS-combinatietherapie met ander antihypertensivum
- Er is minder bekend over combinatietherapie van RAAS-remmers met andere antihypertensiva, maar er zijn wel enkele aanwijzingen voor een mogelijke meerwaarde van sommige combinatietherapieën ten opzichte van monotherapie met een ACE-remmer of ARB: combinatietherapie (ACE-remmer en diureticum, of ARB met calciumantagonist) is mogelijk effectiever in het bevorderen van regressie van microalbuminurie dan RAAS-monotherapie (bewijskracht: laag), en combinatietherapie met ACE-remmer en calciumantagonist verlaagt mogelijk de totale mortaliteit (bewijskracht: laag).
Voor de cruciale uitkomstmaten geldt dat de bewijskracht voor uitkomstmaten met betrekking tot mortaliteit en ernstige morbiditeit laag is (totale mortaliteit, cardiovasculaire mortaliteit, optreden van acute nierschade) of laag-tot-redelijk (eindstadium nierfalen, hart- en vaatziekten morbiditeit). Voor de cruciale uitkomstmaat proteïnurie is de bewijskracht daarentegen redelijk tot hoog. Een van de cruciale uitkomstmaten voor nierfunctie, eGFR daling, wordt niet geanalyseerd maar er wordt voldoende informatie verkregen uit andere overlappende uitkomstmaten (verdubbeling van serum creatinine, eindstadium nierfalen). De overall bewijskracht over alle cruciale uitkomstmaten bij personen met diabetes type 2 en nefropathie is daarmee laag, met name door een gebrek aan onderzoeksgegevens over de effecten van bloeddrukmedicatie op totale mortaliteit en ernstige morbiditeit.
Uit de systematische literatuuranalyse kan voor personen met diabetes type 1 en nefropathie worden geconcludeerd:
Voor RAAS-monotherapie
- Monotherapie met ACE-remmers verlaagt waarschijnlijk de albumine-excretie in de urine (bewijskracht: redelijk), bevordert mogelijk regressie van microalbuminurie (bewijskracht: laag), remt mogelijk progressie van microalbuminurie (bewijskracht: laag), verlaagt mogelijk het risico op eindstadium nierfalen (bewijskracht: laag), en heeft mogelijk geen effect op totale mortaliteit (bewijskracht: laag).
- Door onvoldoende onderzoeksgegevens is geen uitspraak mogelijk over de effecten van monotherapie met ARB's of andere RAAS-remmers.
RAAS-dubbeltherapie, of RAAS-combinatietherapie met een ander antihypertensivum
- Door onvoldoende onderzoeksgegevens is geen uitspraak mogelijk over de effecten van RAAS-dubbeltherapie of van RAAS-combinatietherapie met een ander antihypertensivum.
Voor de cruciale uitkomstmaten bij analyse van de effecten van monotherapie met ACE-remmers geldt dat de bewijskracht met betrekking tot mortaliteit en ernstige morbiditeit laag is (totale mortaliteit, eindstadium nierfalen), en de bewijskracht voor proteïnurie laag-tot-redelijk. Er is geen uitspraak mogelijk voor verdubbeling van serum creatinine, cardiovasculaire mortaliteit en morbiditeit (myocardinfarct, beroerte) en acuut nierfalen (cruciale uitkomstmaten). Door onvoldoende onderzoeksgegevens is geen uitspraak mogelijk over de effecten van monotherapie met ARB's of andere RAAS-remmers (renine-remmers, aldosteron-antagonisten), RAAS-dubbeltherapie, of RAAS-combinatietherapie met een ander antihypertensivum. De overall bewijskracht over alle cruciale uitkomstmaten bij personen met diabetes type 1 en nefropathie is zeer laag-tot-laag voor monotherapie met ACE-remmers, en zeer laag voor andere vormen van RAAS-monotherapie, RAAS-dubbeltherapie en voor combinatietherapie met een ander hypertensivum.
Er is veel minder onderzoek gedaan naar bloeddrukmedicatie bij personen met diabetes type 1 dan bij personen met diabetes type 2, waardoor de bewijskracht op cruciale uitkomstmaten laag is of bewijs soms zelfs geheel ontbreekt. De werkgroep is echter van mening dat het aannemelijk is dat de klinische effecten van RAAS-remmers op renale eindpunten en cardiovasculaire mortaliteit zoals vastgesteld bij personen met diabetes type 2 geëxtrapoleerd mogen worden naar personen met diabetes type 1. Dit is gebaseerd op de overeenkomsten tussen DM1 en DM2 en de rol die hypertensie speelt bij het ontstaan van nierschade en cardiovasculaire morbiditeit en mortaliteit.
RAAS-dubbeltherapie met aldosteronantagonist
De systematische literatuuranalyse biedt weinig houvast bij het beoordelen van de waarde van behandeling met aldosteronantagonisten. Er zijn echter wel enige aanwijzingen dat RAAS-dubbeltherapie waarin een ACE-remmer of ARB wordt gecombineerd met een aldosteronantagonist een gunstig effect kan hebben op proteïnurie en bloeddruk (Mavrakanas, 2014). Vanwege het ontbreken van gegevens over de langetermijn effectiviteit en veiligheid is de werkgroep van mening dat deze combinatietherapie alleen moet worden overwogen als behandeling met ACE-remmer of ARB, al dan niet in combinatie met een diureticum en/of calcium antagonist onvoldoende effectief is, en dan alleen moet worden voorgeschreven door medisch specialisten met ervaring met deze gecombineerde behandeling.
Bijwerkingen
De systematische literatuuranalyse suggereert dat ARB's het risico op droge hoest niet verhogen bij patiënten met diabetische nefropathie, in tegenstelling tot ACE-remmers, maar de bewijskracht is laag vanwege ernstige imprecisie (breed betrouwbaarheidsinterval). De suggestie wordt echter ondersteund in onderzoek bij patiënten met cardiovasculaire ziekte of diabetes met een hoog risico op cardiovasculaire ziekten (ONTARGET, 2008): patiënten in de ARB-groep (telmisartan) hadden een aanzienlijk lagere kans dan patiënten in de ACE-remmer groep (ramipril) op het ontwikkelen van hoest (1.1% versus 4.2%; p-waarde < 0.001) en een lagere kans op angio-oedeem (0.1% versus 0.3%; p-waarde = 0.01). Voor de gelijktijdige behandeling met een ACE-remmer en een ARB vermeldt het Farmacotherapeutisch Kompas dat deze combinatietherapie de kans op hypotensie, syncope, hyperkaliëmie en achteruitgang van de nierfunctie vergroot, en niet moet worden toegepast bij patiënten met diabetische nefropathie. Bij patiënten met diabetes of een verminderde nierfunctie (GFR < 60 ml/min/1,73 m²) is het gebruik van lisinopril in combinatie met aliskiren gecontra–indiceerd (FK, 2019). Voor bijwerkingen en contra-indicaties zoals deze die worden beschreven in de officiële productinformatie (Summary of Product Characteristics, SmPC) van geneesmiddelen, kunt u desgewenst de website van het College ter Beoordeling van Geneesmiddelen (CBG-MEB) raadplegen via https://www.cbg-meb.nl/. Met betrekking tot de voor- en nadelen van de interventie geldt voor de belangrijke subgroep (kwetsbare) ouderen/patiënten ouder dan 70 jaar dat deze personen extra gevoelig zijn voor uitdroging, vooral als er sprake is van een verminderde nierfunctie (eGFR< 60ml/min/min/1,73m2). Met name het de combinatie van RAAS-blokker en diureticum kan het risico op uitdroging verder vergroten en daarom moet overwogen worden om de behandeling aan te passen als er sprake is van (dreigende) dehydratie. Als praktisch handvat voor beslissingen kan daarbij worden aangehouden: vijf dagen met een omgevingstemperatuur boven de 27 °C en/of; meer dan driemaal daags waterdunne diarree en/of; meer dan driemaal daags overgeven en/of; meer dan twee dagen koorts boven 38,5 °C.
Bloeddrukbehandeldoelen en subgroepen
Met betrekking tot het vaststellen van de indicatie voor leefstijlinterventies en bloeddrukverlagende medicatie, de keuze van bloeddrukbehandeldoelen en het volgen van de behandeling sluit de werkgroep zich aan bij de richtlijn Cardiovasculair Risicomanagement (NHG/NIV/NVvC, 2019). Patiënten met diabetes worden beschouwd als hoog risico patiënten voor zowel cardiovasculaire ziekten en het ontwikkelen van eindstadium nierfalen (richtlijn CVRM; NHG/NIV/NVvC, 2019). Conform bovenstaande richtlijn is in het algemeen de behandelgrens voor bloeddruk bij patiënten met diabetes en chronische nierschade, een in de spreekkamer gemeten systolische bloeddruk van ≥130 mmHg en is het behandeldoel een systolische bloeddruk lager dan 130 mmHg. Bij het weergeven van dit afkappunt dient te worden aangetekend, dat in de NfN richtlijn ‘Behandeling van patiënten met diabetes mellitus en chronische nierschade stadium 3b of hoger’ (NfN 2018) het behandeldoel een systolische bloeddruk lager dan140 mmHg is. Aangezien echter de richtlijn Cardiovasculair risicomanagement (NHG/NIV/NVvC, 2019) van recenter datum is dan de NfN richtlijn én is goedgekeurd door de NIV, gaat de richtlijnwerkgroep ervan uit, dat het laatst geformuleerde standpunt (behandeldoel < 130 mmHg) de voorkeur kent. Uiteraard moet bij het proberen te behalen van een streefdoel altijd rekening worden gehouden met de kenmerken van de individuele patiënt.
Het behandeldoel wordt bepaald in samenspraak met de patiënt op basis van te verwachten absolute winst versus schade. Bij oudere patiënten met chronische nierschade wordt de bloeddruk geïndividualiseerd, rekening houdend met leeftijd, comorbiditeit, nadelig effecten zoals electrolytstoornissen, acute verslechtering van de nierfunctie, (orthostatische) hypotensie en valrisico, en verhoogd risico op bijwerkingen ten gevolge van bijvoorbeeld polyfarmacie. Zo kan bij kwetsbare ouderen met een beperkte levensverwachting gekozen worden voor een hogere behandelgrens en -doel (bijvoorbeeld systolische bloeddruk van 140 mmHg of 150 mmHg). In deze verwijst de werkgroep naar de module Kwetsbare ouderen met hypertensie in de richtlijn Cardiovasculair Risicomanagement (NHG/NIV/NVvC, 2019). Daarnaast kan bij jongere patiënten (met een verwacht lange levensverwachting), en zeker bij jongere patiënten met bekende verhoogde albuminurie, besproken worden om te kiezen voor lagere behandeldoelen. Hiermee zegt de werkgroep expliciet dat het in overleg met de patiënt nastreven van een systolische bloeddruk van bijvoorbeeld lager dan 120 mmHg een optie is, welke ook geboden wordt in de richtlijn Chronische Nierschade (NIV/NHG, 2018). De werkgroep is zich voorts bewust van een subgroep van patiënten met diabetes met albuminurie in aanwezigheid van systolische bloeddrukken lager dan 130 mmHg zonder medicamenteuze behandeling. Hoewel een diabetische nefropathie niet noodzakelijk het onderliggend lijden hoeft te zijn bij deze patiënten, vindt de werkgroep het voorschrijven van een lage dosis RAAS-remmer in overleg met de patiënt te verdedigen. Binnen de huidige onderzoeksvraag is het niet mogelijk om een uitspraak te doen over de waarde van individuele RAAS-remmers als functie van specifieke bloeddrukbehandeldoelen.
Uit diverse studies blijkt dat een lage diastolische bloeddruk bij kwetsbare ouderen geassocieerd is met een verhoogd mortaliteitsrisico en verminderd fysiek en cognitief functioneren (zie richtlijn Chronische nierschade; NIV/NHG, 2018). De werkgroep sluit zich aan bij het advies in genoemde richtlijn om bij kwetsbare ouderen de bloeddrukverlagende behandeling niet verder te intensiveren als de diastolische bloeddruk onder de 70mmHg komt. Bij de adviezen met betrekking tot ernstig verhoogde albuminurie stelt de werkgroep voor om aan te sluiten bij het advies zoals geformuleerd in de richtlijn Chronische Nierschade (NIV/NHG, 2018; submodule ‘Ernstig verhoofde albuminurie’): tijdens behandeling moet getracht worden albuminuriewaarden <30 mg/mmol (ofwel <300 mg/24 uur, dan wel proteïnuriewaarden <0,5 g/24 uur) te bereiken, onafhankelijk van de bloeddruk. Dit kan bereikt worden door dosering van de ACE-remmer of ARB op te hogen, en/of één van deze middelen te combineren met zoutbeperkt dieet (<2400 mg natrium ofwel <6 gram zout per dag) en/of een (thiazide) diureticum. Ook daarbij moet haalbaarheid individueel bepaald worden.
Aangezien een niet onbelangrijk deel van de patiënten met diabetes mellitus type 2 en albuminurie (vooral als er geen diabetische retinopathie vast te stellen is) geen klassieke diabetische nefropathie zal hebben (richtlijn Chronische nierschade; NIV/NNG, 2018), maar een andere onderliggende, mogelijk op een andere manier te behandelen nierziekte (al dan niet in combinatie met diabetische nierschade), dient overwogen te worden om patiënten bij wie twijfel bestaat aangaande de waarschijnlijkheidsdiagnose diabetische nefropathie te verwijzen naar een nefroloog.
Waarden en voorkeuren van patiënten
Remming van progressie van nefropathie is een belangrijk doel voor iedere patiënt, aangezien afname van de nierfunctie grote gevolgen heeft voor de kwaliteit van leven en algehele gezondheid van de patiënt. Enige uitleg over de ernst van een afnemende nierfunctie en het belang van (bloeddruk)medicatie ter preventie hiervan is dan ook op zijn plaats. Ter illustratie kan wellicht in de toekomst een speciale tool gebruikt worden die de toename van de kans op nierfalen laat zien naarmate bijvoorbeeld albuminurie toeneemt. Ernst van de bijwerkingen van een bloeddrukverlagend middel (welke dan ook) en de effecten daarvan op het welzijn/kwaliteit van leven van de patiënt moet altijd in ogenschouw genomen worden. De voorkeur moet uitgaan naar medicatie met zo weinig mogelijk bijwerkingen en een bloeddruk die dusdanig laag is dat de progressie van nefropathie wordt afgeremd en die tevens draaglijk is. De effecten van een lage bloeddruk kunnen erg vervelend (bijv. niet kunnen functioneren) en ook gevaarlijk zijn (bijv. omvallen). De bloeddruk mag zeker niet lager zijn dan voor een patiënt draaglijk is. Uiteraard zal dit per persoon sterk verschillen. Dit moet dan ook een leidraad zijn. Met andere woorden: de bloeddrukstreefwaarde moet individueel zijn, waarbij de klachten van eventuele hypotensie de leidraad vormen. Maak dit vooral bespreekbaar. Patiënten zullen dit niet altijd zelf aangeven, maar ‘braaf’ doen wat de dokter zegt. Met alle gevolgen van dien. Stel het medicatiebeleid gezamenlijk met de patiënt op. Ook leefstijl is een belangrijke factor voor het al dan niet verergeren van nefropathie. Leefstijladviezen zijn dan ook van groot belang (zie richtlijn Chronische Nierschade; NIV/NHG, 2018). Patiënten zullen dikwijls niet op de hoogte zijn van dergelijke leefstijladviezen en hier zelf ook geen informatie over inwinnen. Misschien is het raadzaam hiervoor te verwijzen naar een diëtist (zie richtlijn Chronische Nierschade; NIV/NHG, 2018), medisch maatschappelijk werker of leefstijlcoach. Een patiëntenvereniging kan ook een belangrijke rol spelen bij het verstrekken van informatie en adviezen. Daarbij dient ook rekening gehouden te worden met bijvoorbeeld leeftijd, kwetsbaarheid en levensverwachting.De eerder genoemde streefwaarden voor de bloeddruk hebben op de lange termijn een gunstig effect op de nierfunctie. Op de korte termijn kunnen patiënten echter last hebben van bijwerkingen zoals droge hoest en hypotensie. Patiënten met diabetes en matig tot ernstige nierschade (stadium 3b) en hoger kunnen last hebben van autonome dysfunctie en zijn daardoor gevoeliger voor complicaties zoals hypotensie. Ook oudere kwetsbare patiënten kunnen meer last hebben van bijwerkingen.
Kosten (middelenbeslag)
ACE-remmers en ARB’s zijn relatief goedkope (generieke) geneesmiddelen (gemiddelde kosten per dag tussen 2 eurocent en €1,02 voor ACE-remmers, en tussen 3 eurocent en €1,40 voor ARB’s; FK, 2019). De meest voorkomende bijwerkingen (hoest, lage bloeddruk en tijdelijke bloeddrukdaling) zijn relatief eenvoudig en tegen geringe meerkosten te corrigeren. De complicaties welke voorkomen worden (met name eindstadium nierfalen) gaan gepaard met zeer hoge kosten en frequente ziekenhuisbezoeken. Kosteneffectiviteit wordt bevestigd in de systematische review en economische evaluatie van Farmer (Farmer, 2014). Farmer (2014) onderzocht de kosteneffectiviteit van vroegtijdige behandeling van nefropathie bij personen met diabetes (zie Samenvatting literatuur). De kosteneffectiviteitsanalyse uitgevoerd in de UK (kostenniveau 2011) gaat uit van behandeling met ACE-remmer of ARB zodra er sprake is van progressie van normo- naar microalbuminurie. De resultaten geven aan dat vroegtijdige behandeling met ACE-remmer of ARB kosteneffectief is voor zowel personen met DM1 als personen met DM2.
Aanvaardbaarheid voor de overige relevante stakeholders
Behandeling met ACE-remmers of ARB’s is standaardzorg bij personen met DM1 en DM2. Er zijn naar inschatting van de werkgroep dan ook geen noemenswaardige bezwaren tegen de aanbeveling te verwachten vanuit het veld.
Haalbaarheid en implementatie
Behandeling met ACE-remmers of ARB’s is standaardzorg en er zijn derhalve geen problemen te verwachten met betrekking tot haalbaarheid of implementatie van de aanbeveling.
Rationale - balans tussen de argumenten voor en tegen de interventie
De werkgroep is van mening dat het aannemelijk is dat de klinische effecten van RAAS-remmers op renale eindpunten en cardiovasculaire mortaliteit zoals vastgesteld bij personen met diabetes type 2 geëxtrapoleerd mogen worden naar personen met diabetes type 1. Het is daarom niet nodig om afzonderlijke aanbevelingen op te stellen, en een gelijkluidend advies voor patiënten met diabetes type 1 en type 2 vereenvoudigt toepassing in de praktijk. Monotherapie met ACE-remmer en monotherapie met ARB lijken een vergelijkbaar effect te hebben op de meeste uitkomstmaten. Het starten van een ACE-remmer of een ARB naast leefstijlaanpassingen (leefstijl en dieetmaatregelen; zie richtlijn Chronische nierschade, NIV/NHG, 2018) bij patiënten met een diabetische nefropathie is een behandeling met een relatief lage kans op complicaties terwijl er een bewezen sterke reductie is van het eindpunt (eindstadium) nierfalen. In het geval van bijwerkingen bij de ene klasse RAAS-remmers (ACE-remmer of ARB), kan switchen naar de andere klasse een oplossing bieden (zoals bij droge hoest). De belangrijkste overweging om te kiezen voor een ARB in monotherapie is de lagere kans op bijwerkingen (droge hoest en angio-oedeem). De werkgroep is van mening dat de afwezigheid van data bij patiënten met type 1 diabetes geen reden hoeft te zijn om niet te kiezen voor een ARB. Er zijn ook geen grote conceptuele bezwaren voor de keuze voor een ARB dan wel een ACE-remmer vanuit de pathogenese van diabetische nefropathie bij patiënten met type 1 dan wel type 2 diabetes met nefropathie. Op basis van de mogelijk hogere kans op verdubbeling van serum creatinine, risico op acuut nierfalen, presyncope en de verhoogd risico op hyperkalïemie in combinatie met de hogere kosten kiest de werkgroep niet voor initiële monotherapie met een renine-remmer. RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) bij patiënten met diabetische nefropathie wordt enerzijds ontraden op basis van de beperkte hoeveelheid bewijs. Anderzijds laat het beschikbare bewijs alleen regressie van beperkte (matig verhoogde) albuminurie zien zonder bewijs op voor patiënten meer relevante eindpunten als verdubbeling van creatinine of ontwikkelen van eindstadium nierfalen. Gezien de hogere kans op acuut nierfalen en het ontwikkelen van hyperkaliëmie in de aanwezigheid van een veiliger alternatief (RAAS-monotherapie met ACE-remmer of ARB, eventueel in combinatie met een bloeddrukverlagend middel uit een andere klasse) is de werkgroep van mening dat RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) moet worden ontraden bij patiënten met diabetische nefropathie. Indien ondanks geoptimaliseerde RAAS-monotherapie (ACE-remmer of ARB in combinatie met leefstijlinterventie zoals zoutbeperkt dieet, conform de richtlijn Chronische nierschade; NIV/NHG, 2018; NfN, 2018), het bloeddruk behandeldoel niet gehaald wordt kan een bloeddrukverlagend middel toegevoegd worden uit een andere klasse. Op basis van de beperkte data is de voorkeur om bij patiënten met een diabetische nefropathie een diureticum (thiazide- of lisdiureticum) of een calciumantagonist toe te voegen. De keuze voor een van beiden kan geleid worden door overwegingen zoals eerdere bijwerkingen bij de patiënt en het bekende bijwerkingenprofiel van het geneesmiddel, de aanwezigheid van overvulling (keuze voor lisdiuretica) en/of de beschikbaarheid en vergoeding van combinatietabletten. De mate van klachten van de overvulling moet worden afgewogen tegen de soms hinderlijke piek in de diurese geïnduceerd door gebruik van lisdiuretica. Bij kwetsbare ouderen is het van belang om het verder intensiveren van bloeddrukverlagende behandeling te stoppen en verlagen van de dosering te overwegen bij een diastolische bloeddruk < 70 mmHg, ongeacht de hoogte van de systolische bloeddruk. Overweeg verwijzing naar een ter zake kundige internist of expertisecentrum bij therapieresistente hypertensie (niet bereiken van het bloeddruk behandeldoel ondanks drie verschillende klasses adequaat gedoseerde bloeddrukverlagende middelen waaronder een diureticum, of bereikt bloeddruk behandeldoel met vier verschillende klasses bloeddrukverlagende middelen), maar wees alert op therapieontrouw. Aangezien een substantieel deel van de patiënten met diabetes mellitus type 2 en albuminurie geen klassieke diabetische nefropathie heeft, maar een andere nierziekte (al dan niet in combinatie met diabetische nierschade), dient een verwijzing naar de nefroloog overwogen te worden bij twijfel aan de waarschijnlijkheidsdiagnose diabetische nefropathie. Het verdient tenslotte aanbeveling om bij (kwetsbare) ouderen/ patiënten ouder dan 70 jaar met een verminderde nierfunctie behandeling (met name bij het combineren van RAAS-remmer met een diureticum) aan te passen als er sprake is van dehydratie of omstandigheden die het risico op dehydratie sterk vergroten.
Onderbouwing
Achtergrond
Behandeling met een bloeddrukverlagend middel, en in het bijzonder het gebruik van een remmer van het RAAS-systeem, vormt samen met een goede glykemische regulatie de basis voor zowel het voorkomen van nierschade als het remmen van de progressie van nierschade bij patiënten met type 1 en 2 diabetes. Huidige richtlijnen wijzen op de belangrijke plaats van remmers van het RAAS-systeem, maar zijn minder uitgesproken als het gaat om welke combinaties van middelen bij voorkeur gebruikt moeten worden. Aangezien de meeste patiënten met diabetes meerdere medicamenten nodig hebben om de strenger wordende streefbloeddrukken te behalen is het nodig om niet alleen te onderzoeken welke remmers van het RAAS-systeem, maar ook welke andere bloeddrukverlagende medicamenten gunstige effecten hebben.
Conclusies / Summary of Findings
De conclusies worden hieronder gepresenteerd per type diabetes (DM2 of DM1), per uitkomstmaat en per vergelijking.
Bloeddrukmedicatie bij patiënten met type 2 diabetes en nefropathie
RAAS-monotherapie
|
Redelijk1
Laag2
GRADE |
Monotherapie met ACE-remmers of ARB’s verlaagt waarschijnlijk het risico op verdubbeling van serum creatinine bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De effectiviteit van ACE-remmers en ARB’s (monotherapie) is waarschijnlijk vergelijkbaar.
Renine-remmers verhogen mogelijk het risico op verdubbeling van serum creatinine bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Bronnen: (Palmer, 2015; Farmer, 2014) |
RAAS-monotherapie versus RAAS-dubbeltherapie
|
Laag3 GRADE |
RAAS-monotherapie (ACE-remmer of ARB) is mogelijk effectiever in de preventie van verdubbeling van serum creatinine bij patiënten met DM2 en nefropathie dan RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB).
Bronnen: (Palmer, 2015) |
RAAS therapie (mono of dubbel) versus RAAS therapie gecombineerd met een ander antihypertensivum
|
- GRADE |
Geen onderzoeksgegevens beschikbaar voor verdubbeling van serum creatinine.
Bronnen: (Palmer, 2015; Farmer, 2014; Uzu, 2016) |
RAAS-monotherapie
|
Redelijk4 GRADE |
RAAS-monotherapie (ACE-remmer of ARB) verlaagt waarschijnlijk de albumine-excretie in de urine bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De effectiviteit van ARB’s is waarschijnlijk enigszins hoger dan die van ACE-remmers.
Bronnen: (Farmer, 2014) |
RAAS dubbeltherapie en combinatietherapie (alle vergelijkingen)
|
Geen GRADE |
Albumine-excretie in de urine bij patiënten met DM2 en nefropathie (cruciale uitkomstmaat) wordt niet gerapporteerd.
Bronnen: (Palmer, 2015; Farmer, 2014) |
RAAS-monotherapie
|
Hoog5
Laag6 GRADE |
ACE-remmers en ARB (monotherapie) bevorderen regressie van matig verhoogde albuminurie (microalbuminurie) bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
De effectiviteit van ARB’s (monotherapie) in het bevorderen van regressie van microalbuminurie is mogelijk enigszins hoger dan die van ACE-remmers.
Bronnen: (Palmer, 2015; Farmer, 2014) |
RAAS-monotherapie versus RAAS-dubbeltherapie
|
Laag7 GRADE |
RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) is mogelijk effectiever dan RAAS-monotherapie (ACE-remmer of ARB) in het bevorderen van regressie van microalbuminurie bij patiënten met DM2 en nefropathie.
Bronnen: (Palmer, 2015) |
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum
|
Laag8 GRADE |
Combinatietherapie met ACE-remmer en diureticum, of ARB met calciumantagonist, is mogelijk effectiever dan RAAS monotherapie (ACE-remmer of ARB) in het bevorderen van regressie van microalbuminurie bij patiënten met DM2 en nefropathie.
Bronnen: (Palmer, 2015) |
RAAS-monotherapie
|
Redelijk9 GRADE |
RAAS-monotherapie (ACE-remmer of ARB) remt waarschijnlijk de progressie naar ernstig verhoogde albuminurie (macroalbuminurie) bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De effectiviteit van ARB’s (monotherapie) is mogelijk enigszins hoger dan die van ACE-remmers.
Bronnen: (Farmer, 2014) |
RAAS-dubbeltherapie en combinatietherapie
|
- GRADE |
Progressie naar macroalbuminurie bij patiënten met DM2 en nefropathie (cruciale uitkomstmaat) wordt niet gerapporteerd.
Bronnen: (Palmer, 2015; Farmer, 2014) |
RAAS-monotherapie
|
Redelijk10
Laag11
GRADE |
Monotherapie met ARB’s verlaagt waarschijnlijk het risico op eindstadium nierfalen bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Monotherapie met ACE-remmers verlaagt mogelijk het risico op eindstadium nierfalen bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
De effectiviteit van ACE-remmers en ARB’s (monotherapie) in het verlagen van het risico op eindstadium nierfalen lijkt vergelijkbaar.
Bovenstaande conclusies voor de effecten van ACE-remmers en ARB’s op eindstadium nierfalen hebben betrekking op patiënten met ernstig verhoogde albuminurie (macroalbuminurie).
Bronnen: (Palmer, 2015) |
RAAS-monotherapie versus RAAS-dubbeltherapie
|
Laag12
GRADE |
RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) verlaagt mogelijk het risico op eindstadium nierfalen bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
De effectiviteit van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) in het verlagen van het risico op eindstadium nierfalen lijkt vergelijkbaar met die van RAAS-monotherapie (ACE-remmer of ARB).
Bronnen: Palmer, 2015 |
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum
|
- GRADE |
Geen onderzoeksgegevens beschikbaar voor eindstadium nierfalen.
Bronnen: (Palmer, 2015; Farmer, 2014; Uzu, 2016) |
RAAS-monotherapie
|
Laag13 GRADE |
RAAS-monotherapie (ACE-remmer, ARB, of renine-remmer) heeft mogelijk geen effect op de totale mortaliteit bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Bronnen: (Palmer, 2015; Farmer, 2014) |
RAAS-monotherapie versus RAAS-dubbeltherapie
|
Laag14
GRADE |
RAAS-dubbeltherapie (combinatie van ACE-remmer met ARB) heeft mogelijk geen effect op de totale mortaliteit bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
De effectiviteit van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) op totale mortaliteit lijkt vergelijkbaar met die van RAAS-monotherapie (ACE-remmer of ARB).
Bronnen: (Palmer, 2015) |
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum
|
Laag15 GRADE |
Combinatietherapie met ACE-remmer en calciumantagonist verlaagt mogelijk de totale mortaliteit bij patiënten met DM2 en nefropathie, in vergelijking met RAAS-monotherapie (ACE-remmer).
Bronnen: (Palmer, 2015) |
RAAS-monotherapie
|
Laag16
Redelijk17
Laag18
Laag19
GRADE |
RAAS-monotherapie (ACE-remmer, ARB, of renine-remmer) heeft mogelijk geen effect op de cardiovasculaire mortaliteit bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Monotherapie met ARB’s verlaagt waarschijnlijk het risico op Myocardinfarct bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Monotherapie met ACE-remmers verlaagt mogelijk het risico op Myocardinfarct bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De effectiviteit van ACE-remmers en ARB’s (monotherapie) lijkt vergelijkbaar.
RAAS-monotherapie (ACE-remmer, ARB) heeft mogelijk geen effect op het risico op een beroerte bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De effectiviteit van ACE-remmers en ARB’s (monotherapie) lijkt vergelijkbaar.
Bronnen: (Palmer, 2015) |
RAAS-monotherapie versus RAAS-dubbeltherapie
|
Laag20
Laag21
Laag22
GRADE |
RAAS-dubbeltherapie (combinatie van ACE-remmer met ARB) heeft mogelijk geen effect op de cardiovasculaire mortaliteit bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De effectiviteit van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) lijkt vergelijkbaar met die van RAAS-monotherapie (ACE-remmer of ARB).
RAAS-dubbeltherapie (combinatie van ACE-remmer met ARB) verlaagt mogelijk het risico op myocardinfarct bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De effectiviteit van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) lijkt vergelijkbaar met die van RAAS-monotherapie (ACE-remmer of ARB).
RAAS-dubbeltherapie (combinatie van ACE-remmer met ARB) heeft mogelijk geen effect op het risico op een beroerte bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De effectiviteit van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) lijkt vergelijkbaar met die van RAAS-monotherapie (ACE-remmer of ARB).
Bronnen: (Palmer, 2015) |
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum
|
Zeer laag23 GRADE |
Het effect van RAAS-therapie gecombineerd met een ander antihypertensivum op hart- en vaatziekten (cardiovasculaire mortaliteit, myocardinfarct, beroerte) bij patiënten met DM2 en nefropathie is onbekend.
Bronnen: (Palmer, 2015) |
RAAS-monotherapie
|
Laag24 GRADE |
RAAS-monotherapie (ACE-remmer, ARB, renine-remmer of aldosteronantagonist) leidt mogelijk tot enige verhoging van het risico op acuut nierfalen bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De effecten van ACE-remmers, ARB’s, renine-remmer en aldosteronantagonist lijken vergelijkbaar.
Bronnen: (Palmer, 2015) |
RAAS-monotherapie versus RAAS-dubbeltherapie
|
Laag25 GRADE |
RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) leidt mogelijk tot een (verder) verhoogd risico op acuut nierfalen bij patiënten met DM2 en nefropathie, in vergelijking met placebo en in vergelijking met ARB-monotherapie.
Bronnen: (Palmer, 2015) |
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum
|
Zeer laag26 GRADE |
Het effect van RAAS-therapie gecombineerd met een ander antihypertensivum op het risico op acuut nierfalen bij patiënten met DM2 en nefropathie is onbekend.
Bronnen: (Palmer, 2015) |
RAAS-monotherapie
|
Laag27 GRADE |
RAAS-monotherapie met een renine-remmer leidt mogelijk tot verhoging van het risico op hyperkaliëmie bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
De effecten van RAAS-remmers (ACE-remmer, ARB, renine-remmer of aldosteronantagonist) op het risico op hyperkaliëmie lijken vergelijkbaar.
Bronnen: (Palmer, 2015) |
RAAS-monotherapie versus RAAS-dubbeltherapie
|
Laag28 GRADE |
RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) leidt mogelijk tot verhoging van het risico op hyperkaliëmie bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
De effecten van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) op het risico op hyperkaliëmie lijken vergelijkbaar met die van RAAS-monotherapie (ACE-remmer, ARB, renine-remmer of aldosteronantagonist).
Bronnen: (Palmer, 2015) |
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum
|
Zeer laag29 GRADE |
Het effect van RAAS-therapie gecombineerd met een ander antihypertensivum op het risico op hyperkaliëmie bij patiënten met DM2 en nefropathie is onbekend.
Bronnen: (Palmer, 2015) |
RAAS monotherapie, dubbeltherapie en combinatietherapie (alle vergelijkingen)
|
Hoog30
Hoog31
Laag32
GRADE |
Monotherapie met renine-remmers verhoogt het risico op presyncope bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
ACE-remmers (monotherapie en in combinatie met diureticum of calciumantagonist) en ARB in combinatie met calciumantagonist verhogen het risico op droge hoest bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
ARB monotherapie verhoogd mogelijk niet het risico op droge hoest bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Bronnen: (Palmer, 2015) |
Bloeddrukmedicatie bij patiënten met type 1 diabetes en nefropathie
RAAS-monotherapie
|
Laag33
GRADE |
Monotherapie met ACE-remmers verlaagt mogelijk het risico op eindstadium nierfalen bij patiënten met DM1 en nefropathie, in vergelijking met placebo.
Door het ontbreken van onderzoeksgegevens is er geen uitspraak mogelijk over de effecten van ARB monotherapie op eindstadium nierfalen.
Bronnen: (Palmer, 2015 (sensitiviteitsanalyse)) |
RAAS-monotherapie
|
Redelijk34 GRADE |
Monotherapie met ACE-remmers verlaagt waarschijnlijk de albumine-excretie in de urine bij patiënten met DM1 en nefropathie, in vergelijking met placebo.
Door het ontbreken van onderzoeksgegevens is er geen uitspraak mogelijk over de effecten van ARB monotherapie op albumine-excretie in de urine.
Bronnen: (Farmer, 2014) |
RAAS-monotherapie
|
Laag35 GRADE |
Monotherapie met ACE-remmers bevordert mogelijk de regressie van matig verhoogde albuminurie (microalbuminurie) bij patiënten met DM1 en nefropathie, in vergelijking met placebo.
Door het ontbreken van onderzoeksgegevens is er geen uitspraak mogelijk over de effecten van ARB-monotherapie op de regressie van microalbuminurie.
Bronnen: (Farmer, 2014) |
RAAS-monotherapie
|
Laag36 GRADE |
Monotherapie met ACE-remmers remt mogelijk de progressie naar ernstig verhoogde albuminurie (macroalbuminurie) bij patiënten met DM1 en nefropathie, in vergelijking met placebo.
Door het ontbreken van onderzoeksgegevens is er geen uitspraak mogelijk over de effecten van ARB monotherapie op progressie naar macroalbuminurie.
Bronnen: (Farmer, 2014) |
RAAS-monotherapie
|
Laag37 GRADE |
RAAS-monotherapie (ACE-remmer) heeft mogelijk geen effect op de totale mortaliteit bij patiënten met DM1 en nefropathie, in vergelijking met placebo.
Bronnen: (Palmer, 2015; Farmer, 2014) |
RAAS-monotherapie, dubbeltherapie en combinatietherapie (alle vergelijkingen)
|
- GRADE |
Verdubbeling van serum creatinine, eindstadium nierfalen, cardiovasculaire mortaliteit en morbiditeit (myocardinfarct, beroerte) en acuut nierfalen (cruciale uitkomstmaten) worden niet gerapporteerd voor personen met DM1 en nefropathie.
Adverse events (hyperkaliëmie, presyncope, droge hoest; belangrijke uitkomstmaten) worden niet gerapporteerd.
Bronnen: (Farmer, 2014) |
Aanvullende literatuurconclusies (geldend voor DM1 en DM2, met nefropathie)
RAAS-monotherapie, dubbeltherapie en combinatietherapie (alle vergelijkingen)
|
- GRADE |
Overige diabetes-gerelateerd complicaties (cruciale uitkomstmaat) worden niet gerapporteerd.
Bronnen: (Palmer, 2015; Farmer, 2014) |
RAAS-monotherapie, dubbeltherapie en combinatietherapie (alle vergelijkingen)
|
- GRADE |
Ziekenhuisopname, kwaliteit van leven (HRQoL), en patiënttevredenheid (belangrijke uitkomstmaten) worden niet gerapporteerd.
Bronnen: (Palmer, 2015; Farmer, 2014) |
RAAS monotherapie
|
Laag38 GRADE |
Een jaarlijkse screening op basis van de albumine-creatinine ratio in de urine (ACR test) en behandeling met ACE-remmer of ARB zodra er sprake is van progressie van normo- naar microalbuminurie lijkt kosteneffectief voor zowel personen met DM1 als personen met DM2.
Bronnen: (Farmer, 2014) |
Samenvatting literatuur
De literatuuranalyse is gebaseerd op twee systematische reviews (Palmer, 2015; Farmer, 2014) aangevuld met een recente RCT (Uzu, 2016).
Palmer (2015). De SR van Palmer (2015) is van zeer goede kwaliteit (zie evidencetabellen onder het tabblad Onderbouwing). Deze SR analyseert de effecten van orale bloeddrukverlagers (alleen of in combinaties) in vergelijking met elkaar, placebo of geen behandeling, bij personen met diabetes en nefropathie. Nefropathie werd gedefinieerd als micro- of macroalbuminurie (matig tot ernstig verhoogde albuminurie; albumine-excretie in de urine >30 mg/dag) met of zonder afname van de glomerulaire filtratiesnelheid. Palmer (2015) dekt de literatuur tot januari 2014 en includeert alleen RCT’s met een parallel design en een follow-up van tenminste acht weken. Studies met een onbetrouwbare randomisatie ('quasi-gerandomiseerde studies') worden uitgesloten, evenals studies bij patiënten met een niertransplantaat of nierfunctievervangende therapie (dialyse).
Palmer (2015) includeert 188 studies met in totaal 45.338 deelnemers, waarvan 157 studies (43.256 deelnemers) geschikt waren voor opname in een netwerk meta-analyse. Voor de studiekarakteristieken en resultaten van de SR en beoordeling van de individuele studieopzet (risk of bias) van de geïncludeerde studies wordt verwezen naar de publicatie van Palmer (2015), een beknopt overzicht is opgenomen in de evidencetabel. Zeven categorieën bloeddrukverlagers, alleen of in combinatie, werden vergeleken met placebo of standaard zorg: ACE-remmers, ARB’s, aldosteronantagonisten, β-blokkers, calciumantagonisten, endothelin-remmers, en renine-remmers. De gemiddelde leeftijd van de deelnemers bedroeg ruim 52 jaar. Van de geïncludeerde studies hebben 53 studies betrekking op personen met ernstig verhoogde albuminurie (macroalbuminurie; meestal gedefinieerd als een albumine-excretie in de urine van meer 300 mg per dag; 9,455 personen) en 102 studies op personen met matig verhoogde albuminurie (microalbuminurie; meestal gedefinieerd als een albumine-excretie in de urine van 30 mg tot maximaal 300 mg per dag; 15,576 personen). Palmer (2015) analyseert totale mortaliteit en eindstadium nierfalen als primaire uitkomstmaten. De studiekwaliteit werd beoordeeld met de Cochrane risk of bias tool en was over het algemeen hoog (laag risico op bias): 65% van de informatie in de netwerk meta-analyse voor totale mortaliteit, en 89% van de informatie in de netwerk meta-analyse voor eindstadium nierfalen werd beoordeeld als informatie met een laag risico op bias.
Vanwege het grote aantal relevante behandelopties en het gebrek aan directe (head-to-head) vergelijking tussen deze behandelopties, werd een netwerk meta-analyse uitgevoerd. Een netwerk meta-analyse maakt ook gebruik van informatie afkomstig uit indirecte vergelijkingen tussen interventies, en geeft een completer beeld van de relatieve effectiviteit van de behandelopties. Hierbij moet wel rekening worden gehouden met een eventueel verminderde betrouwbaarheid van effectschattingen die geheel of gedeeltelijk zijn gebaseerd op indirecte data. Palmer (2015) hanteert een frequentie-model voor de netwerk meta-analyse. Naast de effectschattingen op basis van de netwerk meta-analyse werden ook klassieke (‘pairwise’) meta-analyses uitgevoerd.
Palmer (2015) presenteert alleen voor de primaire uitkomstmaten totale mortaliteit en eindstadium nierfalen een (sensitiviteits)analyse waarbij onderscheid wordt gemaakt tussen diabetes type 1 en 2. Daarom wordt op dit punt (zie later in de tekst onder ‘DM1 versus DM2’) de literatuuranalyse aangevuld met analyses uit de systematische review van Farmer (2014).
Farmer (2014). In Farmer (2014) worden de resultaten afzonderlijk gepresenteerd voor DM type 1 en DM type 2 voor de uitkomstmaten proteïnurie, progressie van matig verhoogde naar ernstig verhoogde albuminurie (microalbuminurie naar macroalbuminurie), regressie van ernstig verhoogde naar matig verhoogde albuminurie (macroalbuminurie naar microalbuminurie), en totale mortaliteit. De SR van Farmer is van redelijke kwaliteit (zie evidencetabellen onder het tabblad Onderbouwing), dekt de literatuur tot augustus 2010 en includeert 49 RCT’s naar de effecten van ACE-remmers en ARB’s (monotherapie) in vergelijking met placebo, geen behandeling of een alternatief antihypertensivum.
Uzu (2016). De SR van Palmer (2015) is aangevuld met de recente RCT van Uzu (2016). Uzu (2016) vergeleek de directe renine-remmer aliskiren met ARB in een open-label RCT (geen blindering van patiënt, behandelaar of effectbeoordelaar). De studie includeert patiënten met ‘hoog-normale’ en matig verhoogde albuminurie (10 tot 300 mg/g ACR). De RCT kent een lage studiekwaliteit (hoog risico op bias) met name door het ontbreken van blindering en het presenteren van een posthoc subgroepanalyse (niet opgenomen in trial register) van patiënten met ‘hoog-normale’ albuminurie (10 tot 30 mg/g ACR) en matig verhoogde albuminurie (microalbuminurie; 30 tot 300 mg/g ACR). Onder de patiënten met matig verhoogde albuminurie zijn er opvallende verschillen tussen interventie- en controlegroep op baseline (zie evidencetabellen voor meer details). Uzu (2016) rapporteert alleen resultaten voor de uitkomstmaat proteïnurie (albumine-creatinine ratio in de urine).
Glomerulaire filtratie snelheid (eGFR; cruciale uitkomstmaat)
Palmer (2015) rapporteert de uitkomstmaat eGFR niet, maar analyseert wel verdubbeling van serum creatinine als (indirecte) uitkomstmaat voor verslechtering van de nierfunctie, gedefinieerd als een verdubbeling van de baseline serum creatinine concentratie.
Figuur 1 Doubling serum creatinine
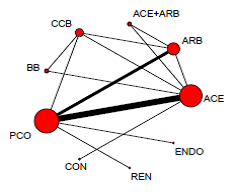
Overzicht netwerk meta-analyse voor de uitkomstmaat verdubbeling serum creatinine (Palmer, 2015). Het netwerk bevat 9 interventies (cirkels in de figuur) en 14 RCT’s (20.637 deelnemers). Het aantal RCT’s beschikbaar per interventie varieert sterk. ACE = angiotensine-converterend enzym inhibitor; ARB = angiotensine II receptor blokker; ENDO = endothilin inhibitor; REN = renine inhibitor; CON = controle; PCO = placebo; BB = β blocker; CCB = Calcium-channel blocker.
Tabel 1
|
(a) Compared to placebo |
RCTs / participants (events) |
OR (95% CI) |
|
|
Pairwise meta-analysis |
Network meta-analysis |
||
|
RAAS monotherapy |
|||
|
ACE inhibitor |
6/6655 (241) |
0.62 (0.37 to 1.04) |
0.71 (0.55 to 0.93) |
|
ARB |
3/3227 (819) |
0.75 (0.64 to 0.88) |
0.75 (0.64 to 0.88) |
|
Renin inhibitor |
1/8579 (201) |
2.40 (1.77 to 3.26) |
2.40 (1.77 to 3.26) |
|
RAAS dual therapy |
|||
|
ACE inhibitor + ARB |
0/0 |
.. |
0.76 (0.33 to 1.74) |
|
RAAS combined with other blood pressure-lowering agents |
|||
|
.. |
.. |
.. |
.. |
|
Other (combinations of) blood-pressure lowering agents |
|||
|
Calcium-channel blocker |
1/1136 (279) |
1.09 (0.84 to 1.43) |
1.16 (0.91 to 1.49) |
|
Endothelin inhibitor |
1/1392 (15) |
0.32 (0.11 to 0.92) |
0.32 (0.11 to 0.91) |
|
β blocker |
0/0 |
.. |
4.64 (0.94 to 23.0) |
|
(b) Direct Comparisons (head-to-head) |
RCTs / participants (events) |
OR (95% CI) |
|
|
Intervention |
comparison |
Pairwise meta-analysis |
|
|
RAAS monotherapy |
|||
|
ACE inhibitor |
ARB |
1/63 (14) |
1.09 (0.33 to 3.60) |
|
RAAS dual therapy |
|||
|
ACE inhibitor |
ACE + ARB |
1/78 (24) |
0.13 (0.04 to 0.43) |
|
ARB |
ACE + ARB |
1/51 (22) |
0.12 (0.03 to 0.42) |
|
RAAS combined with other blood pressure-lowering agents |
|||
|
.. |
|
|
|
(a) Meta-analyse van resultaten ten opzichte van placebo op basis van directe vergelijking (pairwise meta-analyse) en op basis van directe plus indirecte vergelijkingen (netwerk meta-analyse; Palmer, 2015).
(b) Meta-analyse van directe (head-to-head) vergelijking tussen de actieve interventies. Statistisch significante verschillen zijn vetgedrukt; een waarde lager dan 1 is in het voordeel van de interventie. OR = Odds ratio; 95% CI = 95% betrouwbaarheidsinterval
Tabel 1a geeft een overzicht van de resultaten van zowel pairwise als netwerk meta-analyse van vergelijking van de actieve interventies met placebo. Tabel 1b geeft een overzicht van de resultaten van pairwise meta-analyse van directe (head-to-head) vergelijkingen tussen de actieve interventies. In de tekst hieronder wordt per vergelijking de evidence samengevat afkomstig uit de vergelijking van actieve interventies met placebo en uit directe vergelijking tussen de actieve interventies.
RAAS monotherapie. De vergelijking met placebo (Tabel 1a) laat een voordeel zien voor ACE-remmers en ARB in de preventie van verdubbeling van serum creatinine: het risico op verdubbeling van serum creatinine is statistisch significant en klinisch relevant lager dan bij placebobehandeling (odds ratio, OR respectievelijk 0,71 (0,55; 0,93) en 0,75 (0,64; 0,88)). Behandeling met een renine-remmer geeft een statistisch significant en klinisch relevant hoger risico op verdubbeling van serum creatinine ten opzichte van placebo (OR= 2,40 (1,77; 3,26)), maar dit resultaat is gebaseerd op slechts een RCT. Bij deze uitkomstmaat zijn geen data beschikbaar voor aldosteronantagonisten (Figuur 1). Er is een RCT beschikbaar die een ACE-remmer rechtstreeks vergelijkt met ARB (Tabel 1b). In deze RCT wordt geen statistisch significant verschil gevonden tussen ACE-remmer en ARB (OR= 1,09 (0,33; 3,60)), maar de RCT is van geringe omvang (63 deelnemers, 14 events) en heeft daarom onvoldoende statistische power voor de uitkomstmaat. Het brede betrouwbaarheidsinterval laat geen betrouwbare uitspraak toe. Er zijn geen data beschikbaar voor directe vergelijkingen met renine-remmers of aldosteronantagonisten.
RAAS monotherapie versus RAAS dubbeltherapie. Uit de vergelijking van RAAS dubbeltherapie (ACE-remmer gecombineerd met ARB) met placebo (Tabel 1a) komt geen statistisch significant verschil naar voren (OR= 0,76 (0,33; 1,74)), de effectschatting is volledig gebaseerd op indirecte vergelijkingen en heeft een breed betrouwbaarheidsinterval. Er zijn twee RCT’s beschikbaar die RAAS-monotherapie (ACE-remmer of ARB) vergelijken met RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB). Beide RCT’s vinden een statistisch significant en klinisch relevant lager risico op verdubbeling van serum creatinine bij monotherapie met een ACE-remmer of ARB: in vergelijking met dubbeltherapie, respectievelijk OR= 0,13 ((0,04; 0,43)) en 0,12 ((0,03; 0,42)). Beide RCT’s zijn echter van geringe omvang (51 tot 78 deelnemers, 22 tot 24 events) en hebben daarom onvoldoende statistische power voor de uitkomstmaat.
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum. Er zijn geen data beschikbaar voor de uitkomstmaat verdubbeling van serum creatinine.
Samenvattend: monotherapie met ACE-remmers en monotherapie met ARB lijken het risico op verdubbeling van serum creatinine te verlagen. De effectiviteit van ACE-remmers en ARB (monotherapie) lijken vergelijkbaar. Renine-remmers verhogen mogelijk het risico op verdubbeling van serum creatinine. RAAS-monotherapie (ACE-remmer of ARB) is mogelijk effectiever in de preventie van verdubbeling van serum creatinine dan RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB).
Proteïnurie (albuminurie; cruciale uitkomstmaat)
Palmer (2015) analyseert regressie van matig verhoogde albuminurie (regressie van microalbuminurie) als uitkomstmaat. Regressie van microalbuminurie wordt in de geïncludeerde studies over het algemeen gedefinieerd als regressie van microalbuminurie (20 tot 200 µg/min; 30 tot 300 mg/dag) naar normoalbuminurie (< 20 µg/min; < 30 mg/dag).
Figuur 2 Regression of microalbuminuria
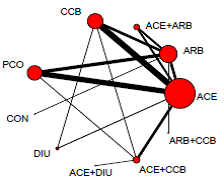
Overzicht netwerk meta-analyse voor de uitkomstmaat regressie van microalbuminurie (Palmer, 2015). Het netwerk bevat 10 interventies (cirkels in de figuur) en 36 RCT’s (11.299 deelnemers). Het aantal RCT’s beschikbaar per interventie varieert sterk. ACE = angiotensine-converterend enzym inhibitor; ARB = angiotensine II receptor blokker; ENDO = endothelin inhibitor; REN = renine inhibitor; CON = controle; PCO = placebo; BB = β blocker; CCB = Calcium-channel blocker; DIU = diuretic.
Tabel 2
|
(a) Compared to placebo |
RCTs / participants (events) |
OR (95% CI) |
|
|
Pairwise meta-analysis |
Network meta-analysis |
||
|
RAAS monotherapy |
|||
|
ACE inhibitor |
8/6585 (1482) |
1.78 (1.20 to 2.64) |
2·25 (1·28 to 3·94) |
|
ARB |
5/1185 (215) |
5.49 (1.43 to 21.0) |
3·37 (1·77 to 6·40) |
|
RAAS dual therapy |
|||
|
ACE inhibitor + ARB |
0/0 |
.. |
|
|
RAAS combined with other blood pressure-lowering agents |
|||
|
ACE inhibitor + calcium-channel blocker |
0/0 |
.. |
|
|
ARB + calcium-channel blocker |
0/0 |
.. |
|
|
ACE inhibitor + diuretic |
0/0 |
.. |
|
|
Other (combinations of) blood-pressure lowering agents |
|||
|
Calcium-channel blocker |
0/0 |
.. |
1·40 (0·71 to 2·78) |
|
Diuretic |
0/0 |
.. |
0·93 (0·34 to 2·57) |
|
(b) Direct Comparisons (head-to-head) |
RCTs / participants (events) |
OR (95% CI) |
|
|
Intervention |
Comparison |
Pairwise meta-analysis |
|
|
RAAS monotherapy |
|||
|
ACE versus. |
ARB |
4/158 (53) |
|
|
RAAS mono versus dual therapy |
|||
|
ACE + ARB |
3/136 (39) |
0.76 (0.07 to 7.73) |
|
|
ARB versus. |
ACE + ARB |
2/136 (36) |
0.48 (0.09 to 2.57) |
|
RAAS versus RAAS + Other |
|||
|
ACE versus. |
ACE + CCB |
4/776 (267) |
|
|
ARB versus. |
ARB + CCB |
1/58 (16) |
|
|
ACE + DIU versus. |
ACE + CCB |
1/248 (147) |
2.45 (1.46 to 4.11) |
(a) Meta-analyse van resultaten ten opzichte van placebo op basis van directe vergelijking (pairwise meta-analyse) en op basis van directe plus indirecte vergelijkingen (netwerk meta-analyse; Palmer, 2015).
(b) Meta-analyse van directe (head-to-head) vergelijking tussen de actieve interventies. Statistisch significante verschillen zijn vetgedrukt; een waarde hoger dan 1 is in het voordeel van de interventie. OR = Odds ratio; 95% CI = 95% betrouwbaarheidsinterval.
RAAS monotherapie. De vergelijking met placebo (Tabel 2a) laat een voordeel zien voor ACE-remmers en ARB in de regressie van microalbuminurie: de kans op regressie van microalbuminurie is statistisch significant en klinisch relevant hoger dan bij placebobehandeling (odds ratio, OR respectievelijk 2,25 (1,28; 3,94) en 3,37 (1,77; 6,40)). Er zijn geen data beschikbaar voor deze uitkomstmaat voor renine-remmers of aldosteronantagonisten (Figuur 2). Er zijn vier RCT’s beschikbaar die een ACE-remmer rechtstreeks vergelijken met ARB (Tabel 2b). Meta-analyse geeft geen statistisch significant verschil te zien tussen ACE-remmer en ARB (OR= 0,88 (0.37; 2.06)), maar de gepoolde studieomvang is gering (158 deelnemers, 53 events) en het betrouwbaarheidsinterval is breed.
RAAS-monotherapie versus RAAS-dubbeltherapie. Uit de vergelijking van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) met placebo (Tabel 2a) komt een statistisch significant en klinisch relevant voordeel voor RAAS dubbeltherapie naar voren (OR= 5,16 (1,32; 20,2)), de effectschatting is volledig gebaseerd op indirecte vergelijkingen en wordt gekenmerkt door een breed betrouwbaarheidsinterval. Er zijn vijf RCT’s beschikbaar die RAAS-monotherapie (ACE-remmer of ARB) vergelijken met RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB). Na meta-analyse wordt geen statistisch significant verschil gevonden tussen monotherapie en dubbeltherapie (OR= 0,76 (0,07; 7,73)) en 0,48 (0,09; 2,57)), maar de gepoolde studieomvang is gering (136 deelnemers, minder dan 40 events) en de betrouwbaarheidsintervallen zijn breed.
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum. De vergelijking met placebo laat een statistisch significant en klinisch relevant voordeel zien voor de combinaties van ACE-remmer met calciumantagonist (OR= 2,80 (1,19; 6,60)), ARB met calciumantagonist (OR= 9,87 (1,59; 61,3)) en ACE-remmer met diureticum (OR= 6,85 (1,44; 32,6)), de effectschattingen zijn volledige gebaseerd op indirecte vergelijkingen en de betrouwbaarheidsintervallen zijn breed. Er zijn vier RCT’s beschikbaar die monotherapie met een ACE-remmer vergelijken met behandeling met een combinatie van ACE-remmer en calciumantagonist, er wordt geen statistisch significant verschil gevonden, maar het betrouwbaarheidsinterval is breed (OR= 0,77 (0,37; 1,63)). In de RCT waarin ARB-monotherapie wordt vergeleken met een combinatie van ARB en calciumantagonist, wordt eveneens geen statistisch significant verschil gevonden (OR= 0,34 (0,10; 1,16)), maar de studieomvang is gering (58 deelnemers, 16 events) en het betrouwbaarheidsinterval breed.
Samenvattend: ACE-remmers en ARB (monotherapie) zijn effectief in het induceren van regressie van microalbuminurie. De effectiviteit van ARB (monotherapie) is mogelijk enigszins hoger dan die van ACE-remmers. RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) is mogelijk effectiever dan RAAS-monotherapie (ACE-remmer of ARB). Combinatietherapie met ACE-remmer en diureticum, of ARB met calciumantagonist, zijn mogelijk effectiever dan RAAS-monotherapie.
Aanvullende studie (Uzu, 2016). Deze RCT vergeleek de directe renine-remmer aliskiren met ARB bij een studieduur van zes maanden en voert een posthoc subgroepanalyse van de verandering in albumine-creatinine ratio uit bij patiënten met microalbuminurie (30 tot 300 mg/g ACR). Het percentage verandering ten opzichte van baseline bedroeg gemiddeld -11,2% (interkwartiel afstand, IQR= (-29,1; 23,8)) in vergelijking met -20,5% (IQR= (-53,6; 2,6)). Het verschil tussen de interventiegroepen, 9,3% in het voordeel van ARB, wordt gerapporteerd als zijnde statistisch niet significant (zonder verdere details). De studiekwaliteit is echter laag (hoog risico op bias) en de studieomvang (statistische power) is onvoldoende om een eventueel klinisch relevant verschil tussen de twee interventies uit te kunnen sluiten.
Eindstadium nierfalen (end-stage renal/kidney disease, ESRD/ESKD; cruciale uitkomstmaat)
Eindstadium nierfalen is een primaire uitkomstmaat in Palmer (2015). In het merendeel van de geïncludeerde studies gedefinieerd als eGFR lager dan 15 ml/min per 1,73 m2 met noodzaak voor lange termijn behandeling, dialyse of transplantatie.
Figuur 3
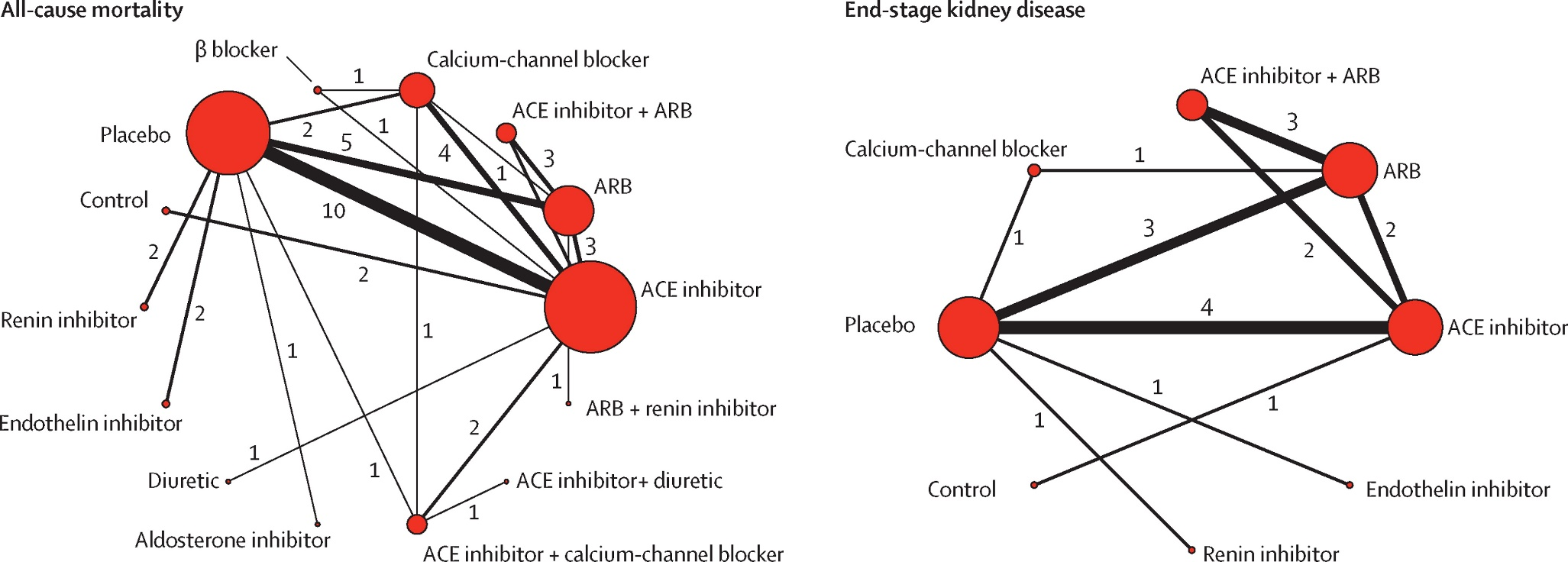
Overzicht netwerk meta-analyse voor de uitkomstmaat eindstadium nierfalen (Palmer, 2015). Het netwerk bevat 8 interventies (cirkels in de figuur) en 13 RCT’s (24.477 deelnemers). Het aantal RCT’s beschikbaar per interventie varieert sterk. ACE = angiotensine-converterend enzym; ARB = angiotensine II receptor blokker
Tabel 3
|
(a) Compared to placebo |
RCTs / participants (events) |
OR (95% CI) |
|
|
Pairwise meta-analysis |
Network meta-analysis |
||
|
RAAS monotherapy |
|||
|
ACE inhibitor |
4/6580 (86) |
0·73 (0·47 to 1·14) |
|
|
ARB |
3/3227 (606) |
0·81 (0·69 to 0·96) |
|
|
Renin inhibitor |
1/8579 (132) |
1·21 (0·86 to 1·71) |
|
|
RAAS dual therapy |
|||
|
ACE inhibitor + ARB |
0/0 |
·· |
|
|
RAAS combined with other blood pressure-lowering agents |
|||
|
.. |
.. |
.. |
.. |
|
Other (combinations of) blood-pressure lowering agents |
|||
|
Endothelin inhibitor |
1/1392 (74) |
0·72 (0·44 to 1·16) |
0·71 (0·44 to 1·14) |
|
Calcium-channel blocker |
1/1136 (205) |
0·87 (0·56 to 1·35) |
1·04 (0·79 to 1·38) |
|
(b) Direct Comparisons (head-to-head) |
RCTs / participants (events) |
OR (95% CI) |
|
|
Intervention |
Comparison |
Pairwise meta-analysis |
|
|
RAAS monotherapy |
|||
|
ACE versus. |
ARB |
||
|
RAAS mono versus dual therapy |
|||
|
ACE versus. |
ACE + ARB |
||
|
ARB versus. |
ACE + ARB |
3/3453 (128) |
|
|
RAAS versus RAAS + Other |
|||
(a) Meta-analyse van resultaten ten opzichte van placebo op basis van directe vergelijking (pairwise meta-analyse) en op basis van directe plus indirecte vergelijkingen (netwerk meta-analyse; Palmer, 2015).
(b) Meta-analyse van directe (head-to-head) vergelijking tussen de actieve interventies. Statistisch significante verschillen zijn vetgedrukt; een waarde lager dan 1 is in het voordeel van de interventie. OR = Odds ratio; 95% CI = 95% betrouwbaarheidsinterval
RAAS-monotherapie. De vergelijking met placebo (Tabel 3a) laat een voordeel zien voor ACE-remmers en ARB in het voorkomen van eindstadium nierfalen. De kans op nierfalen is bij monotherapie met ARB statistisch significant en mogelijk klinisch relevant lager dan bij placebobehandeling (OR= 0,77 (0,65; 0,92)). Er is net geen sprake van 25% risicoreductie, de GRADE default grens voor klinische relevantie, maar het betrouwbaarheidsinterval overlapt wel met deze grens. Monotherapie met ACE-remmers resulteert in een vergelijkbare daling van het risico op nierfalen, maar het verschil ten opzichte van placebo bereikt net geen statistische significantie (OR= 0,71 (0,51; 1,01)), mogelijk vanwege een gebrek aan statistische power (6.580 deelnemers maar slechts 86 events). Renine-remmers lijken geen voordeel te bieden ten opzichte van placebo (OR= 1,21 (0,85; 1,70)). Er zijn geen data beschikbaar voor aldosteronantagonisten (Figuur 3). Er zijn twee RCT’s beschikbaar die een ACE-remmer rechtstreeks vergelijken met ARB (Tabel 2b). Meta-analyse geeft geen statistisch significant verschil te zien tussen ACE-remmer en ARB (OR= 1,08 (0,84; 1,40)), maar de statistische power is betrekkelijk gering (1985 deelnemers maar slechts 51 events).
RAAS-monotherapie versus RAAS-dubbeltherapie. Uit de vergelijking van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) met placebo (Tabel 3a) komt een statistisch significant en klinisch relevant voordeel voor RAAS-dubbeltherapie naar voren (OR= 0,62 (0,43; 0,90)), de effectschatting is volledig gebaseerd op indirecte vergelijkingen. Er zijn drie RCT’s beschikbaar die ARB monotherapie vergelijken met RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB). Na meta-analyse wordt geen statistisch significant verschil gevonden tussen monotherapie en dubbeltherapie (OR= 0,83 (0,53; 1,29)) maar het betrouwbaarheidsinterval is betrekkelijk breed. In de RCT waarin monotherapie met een ACE-remmer wordt vergeleken met RAAS-dubbeltherapie wordt eveneens geen statistisch significant verschil waargenomen (OR= 1,24 (0,94; 1,62)), maar de statistische power is gering (1692 deelnemers, 59 events) en het betrouwbaarheidsinterval breed.
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum. Er zijn geen data beschikbaar voor de uitkomstmaat eindstadium nierfalen.
Samenvattend: ACE-remmers en ARB (monotherapie) lijken vergelijkbaar effectief in het voorkomen van eindstadium nierfalen. RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) is mogelijk eveneens effectief als monotherapie in het voorkomen van eindstadium nierfalen. De effectiviteit van combinatietherapie (combinatie van RAAS-remmer en ander antihypertensivum) in het voorkomen van eindstadium nierfalen is onbekend.
Mortaliteit (totaal; all cause mortality; cruciale uitkomstmaat)
Totale mortaliteit is een primaire uitkomstmaat in Palmer (2015).
Figuur 4
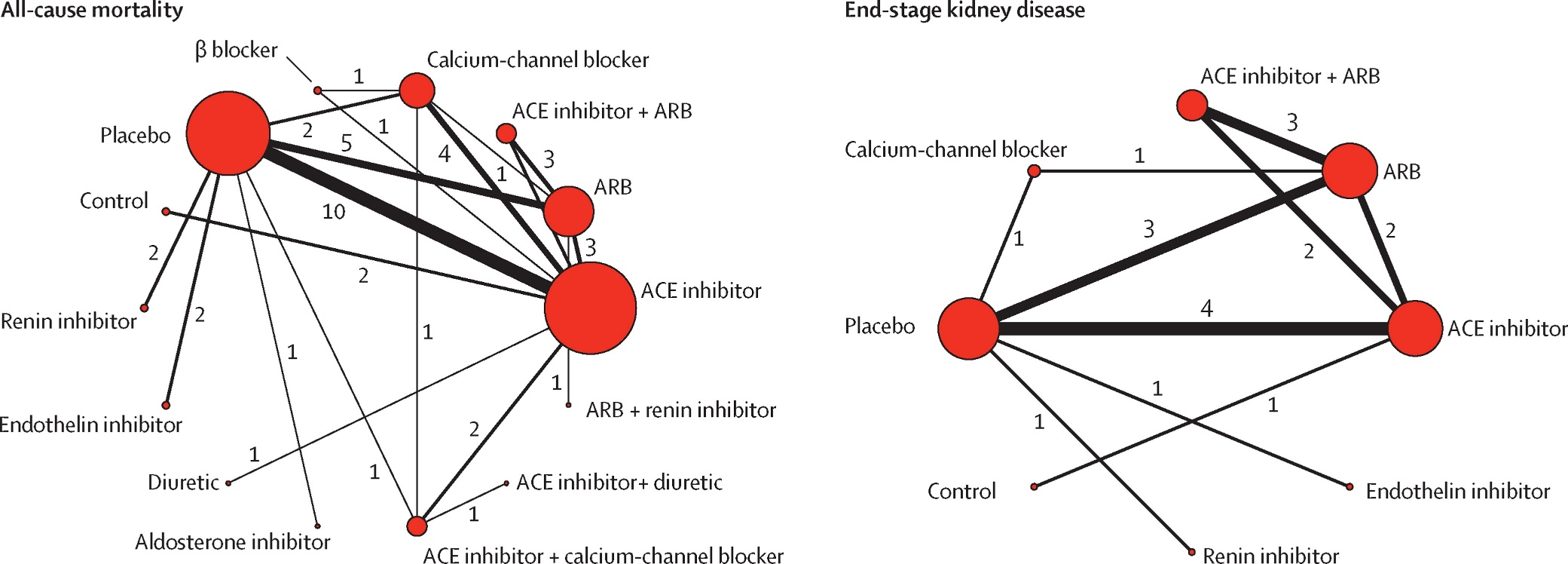
Overzicht netwerk meta-analyse voor de uitkomstmaat totale mortaliteit (Palmer, 2015). Het netwerk bevat 14 interventies (cirkels in de figuur) en 33 RCT’s (29.782 deelnemers). Het aantal RCT’s beschikbaar per interventie varieert sterk. De grootte van de cirkels is representatief voor de gepoolde groepsgrootte, en de lijndikte voor het aantal RCT’s beschikbaar per (directe) vergelijking. ACE = angiotensine-converterend enzym; ARB = angiotensine II receptor blokker
Tabel 4
|
(a) Compared to placebo |
RCTs / participants (events) |
OR (95% CI) |
|
|
Pairwise meta-analysis |
Network meta-analysis |
||
|
RAAS monotherapy |
|||
|
Aldosterone antagonist |
1/55 (2) |
0·22 (0·01 to 4·91) |
0·28 (0·01 to 6·46) |
|
ARB |
5/4443 (534) |
0·91 (0·71 to 1·16) |
0·87 (0·71 to 1·07) |
|
ACE inhibitor |
10/7938 (903) |
0·85 (0·61 to 1·19) |
0·94 (0·76 to 1·15) |
|
Renin inhibitor |
2/9896 (734) |
0·93 (0·39 to 2·24) |
1·05 (0·81 to 1·36) |
|
RAAS dual therapy |
|||
|
0/0 |
·· |
0·84 (0·63 to 1·11) |
|
|
ARB + renin inhibitor |
0/0 |
·· |
0·86 (0·05 to 14·0) |
|
RAAS combined with other blood pressure-lowering agents |
|||
|
ACE inhibitor + calcium-channel blocker |
0/0 |
.. |
0·36 (0·12 to 1·05) |
|
ACE inhibitor + diuretic |
0/0 |
·· |
0·72 (0·05 to 10·2) |
|
Other (combinations of) blood-pressure lowering agents |
|||
|
Calcium-channel blocker |
2/1333 (177) |
0·89 (0·65 to 1·22) |
0·88 (0·63 to 1·23) |
|
Diuretic |
0/0 |
·· |
1·89 (0·17 to 21·3) |
|
Endothelin inhibitor |
2/1699 (55) |
1·55 (0·82 to 2·89) |
1·53 (0·79 to 2·97) |
|
β blocker |
0/0 |
·· |
5·13 (0·81 to 32·4) |
|
(b) Direct Comparisons (head-to-head) |
RCTs / participants (events) |
OR (95% CI) |
|
|
Intervention |
comparison |
Pairwise meta-analysis |
|
|
RAAS monotherapy |
|||
|
ACE versus. |
ARB |
3/2048 (433) |
|
|
RAAS mono versus dual therapy |
|||
|
ACE+ARB |
3/3245 (530) |
0.88 (0.73 to 1.06) |
|
|
ARB versus. |
ACE + ARB |
2/1877 (404) |
0.95 (0.76 to 1.88) |
|
ARB versus. |
ARB + REN |
1/1145 (2) |
1.01 (0.06 to 16.2) |
|
RAAS versus RAAS + Other |
|||
|
ACE versus. |
ACE+CCB |
2/501 (14) |
2.45 (0.74 to 8.10) |
|
ACE + CCB versus. |
ACE +DIU |
1/335 (3) |
0.50 (0.05 to 5.53) |
(a) Meta-analyse van resultaten ten opzichte van placebo op basis van directe vergelijking (pairwise meta-analyse) en op basis van directe plus indirecte vergelijkingen (netwerk meta-analyse; Palmer, 2015).
(b) Meta-analyse van directe (head-to-head) vergelijking tussen de actieve interventies. Een waarde lager dan 1 is in het voordeel van de interventie; bij geen van de interventies is sprake van een statistisch significant verschil ten opzichte van placebo. OR = Odds ratio; 95% CI = 95% betrouwbaarheidsinterval
RAAS-monotherapie. De vergelijking met placebo (Tabel 4a) laat geen statistisch significante verschillen zien in mortaliteit bij behandeling met een RAAS blokker: voor ARB, ACE-remmer en renine-remmer respectievelijk: OR= 0,87 (0,71; 1,07), OR= 0,94 (0,76; 1,15) en OR= 1,05 (0,81; 1,36). Voor aldosteronantagonisten zijn nauwelijks studies beschikbaar en is de effectschatting onbetrouwbaar. Er zijn drie RCT’s beschikbaar die een ACE-remmer rechtstreeks vergelijken met ARB (Tabel 4b). Meta-analyse geeft geen statistisch significant verschil te zien tussen ACE-remmer en ARB (OR= 0.87 (0,70; 1,08)).
RAAS-monotherapie versus RAAS-dubbeltherapie. Uit de vergelijking van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) met placebo (Tabel 4a) komt eveneens geen statistisch significant verschil naar voren: OR= 0,84 ((0,63; 1,11)), de effectschatting is uitsluitend gebaseerd op indirecte vergelijkingen. De effectschatting voor RAAS-dubbeltherapie met een combinatie van ARB en renine-remmer heeft een zeer breed betrouwbaarheidsinterval en laat geen eenduidige conclusie toe. Uit de RCT’s die RAAS-monotherapie (ACE-remmer of ARB) vergelijken met RAAS-dubbeltherapie (combinatie van ACE-remmer en ARB) komen ook geen statistisch significante verschillen naar voren: respectievelijk OR= 0,88 ((0,73; 1,06)) en 0,95 ((0,76; 1,88)). Een RCT vergelijkt ARB monotherapie met een combinatie van ARB en renine-remmer, maar de effectschatting is onbetrouwbaar vanwege onvoldoende statistische power (1.145 deelnemers maar slechts 2 events).
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum. Vergelijking met placebo laat geen statistisch significant verschil zien voor de combinatie van ACE-remmer met calciumantagonist (OR= 0,36 (0,12; 1,05)), of ACE-remmer met diureticum (OR= 0,72 (0,05; 10,2)), de effectschattingen zijn volledige gebaseerd op indirecte vergelijkingen. Er zijn twee RCT’s beschikbaar die een ACE-remmer vergelijken met een combinatie van ACE-remmer en calciumantagonist maar de effectschatting is onbetrouwbaar door onvoldoende statistische power (501 deelnemers met slechts 14 events).
Samenvattend: er zijn geen duidelijke aanwijzingen voor een effect op mortaliteit bij RAAS-monotherapie (ACE-remmer, ARB, renine-remmer) of RAAS-dubbeltherapie (combinatie van ACE-remmer met ARB). Mogelijk heeft de combinatie van ACE-remmer met calciumantagonist een gunstig effect op de mortaliteit, maar de effectschatting bereikt geen statistische significantie en is uitsluitend gebaseerd op indirecte vergelijkingen. Meer algemeen geldt voor alle behandelopties dat de statistische power onvoldoende is, en de betrouwbaarheidsintervallen te breed, om een klinisch relevante verhoging of verlaging van de mortaliteit uit te kunnen sluiten.
Hart- en vaatziekten (morbiditeit, mortaliteit; cruciale uitkomstmaat)
De studies geïncludeerd in Palmer (2015) hanteren verschillende definities voor cardiovasculaire uitkomstmaten. In de definitie van cardiovasculaire mortaliteit neemt een aantal studies ook plotselinge dood (sudden death) en congestief hartfalen mee. In de definitie voor beroerte (stroke) wordt in een aantal studies ook een TIA inbegrepen.
Figuur 5
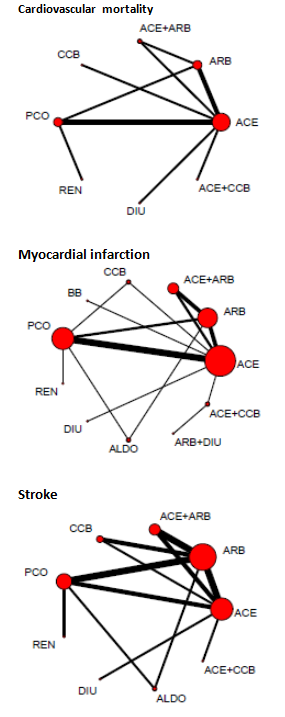
Overzicht netwerk meta-analyse voor de uitkomstmaten cardiovasculaire mortaliteit, myocardinfarct en beroerte (stroke; TIA/CVA) (Palmer, 2015). Het netwerk bevat respectievelijk 8/11/9 interventies (cirkels in de figuren) en 9/18/15 RCT’s (17.806/ 21.417/ 19.878 deelnemers). Het aantal RCT’s beschikbaar per interventie varieert sterk. De grootte van de cirkels is representatief voor de gepoolde groepsgrootte, en de lijndikte voor het aantal RCT’s beschikbaar per (directe) vergelijking. ACE = angiotensine-converterend enzym inhibitor; ARB = angiotensine II receptor blokker; ENDO = endothilin inhibitor; REN = renine inhibitor; PCO = placebo; CCB = Calcium-channel blocker; ALDO = aldosteron antagonist; DIU = diuretic; BB = β blocker
Tabel 5
|
(a) Compared to placebo |
RCTs / participants (events) |
OR (95% CI) |
|
|
Pairwise meta-analysis |
Network meta-analysis |
||
|
CARDIOVASCULAR MORTALITY |
|||
|
RAAS monotherapy |
|||
|
ARB |
1/566 (13) |
3.44 (0.94 to 12.6) |
NR |
|
ACE inhibitor |
2/5300 (355) |
1.04 (0.84 to 1.29) |
NR |
|
Renin inhibitor |
1/8561 (461) |
1.16 (0.96 to 1.40) |
NR |
|
RAAS dual therapy |
|||
|
ACE inhibitor + ARB |
0/0 |
.. |
NR |
|
RAAS combined with other blood pressure-lowering agents |
|||
|
ACE inhibitor + Calcium-channel blocker |
0/0 |
.. |
NR |
|
Other (combinations of) blood-pressure lowering agents |
|||
|
Calcium-channel blocker |
0/0 |
.. |
NR |
|
Diuretic |
0/0 |
.. |
NR |
|
MYOCARDIAL INFARCTION |
|||
|
RAAS monotherapy |
|||
|
Aldosterone antagonist |
1/55 (1) |
3.00 (0.12 to 76.9) |
|
|
ARB |
2/2207 (128) |
0.72 (0.50 to 1.03) |
|
|
ACE inhibitor |
5/5420 (147) |
0.81 (0.58 to 1.12) |
|
|
Renin inhibitor |
1/8850 (289) |
1.04 (0.82 to 1.31) |
|
|
RAAS dual therapy |
|
|
|
|
ACE inhibitor + ARB |
0/0 |
.. |
0·83 (0·59 to 1·19) |
|
RAAS combined with other blood pressure-lowering agents |
|||
|
ACE inhibitor + calcium-channel blocker |
0/0 |
.. |
1·74 (0·10 to 29·1) |
|
ARB + diuretic |
0/0 |
.. |
1·60 (0·04 to 64·9) |
|
Other (combinations of) blood-pressure lowering agents |
|||
|
Calcium-channel blocker |
1/61 (1) |
0.43 (0.02 to 11.1) |
0·52 (0·05 to 5·63) |
|
Diuretic |
0/0 |
.. |
3·11 (0·14 to 70·3) |
|
β blocker |
0/0 |
.. |
0·86 (0·05 to 15·5) |
|
STROKE |
|||
|
RAAS monotherapy |
|||
|
Aldosterone antagonist |
1/54 (3) |
2.08 (0.18 to 24.4) |
|
|
ARB |
3/706 (21) |
0.76 (0.32 to 1.79) |
1·01 (0·68 to 1·48) |
|
ACE inhibitor |
2/5180 (235) |
1.02 (0.79 to 1.33) |
1·00 (0·77 to 1·28) |
|
Renin inhibitor |
1/8561 (269) |
1.22 (0.95 to 1.55) |
1·21 (0·95 to 1·55) |
|
RAAS dual therapy |
|||
|
ACE inhibitor + ARB |
0/0 |
.. |
1·07 (0·70 to 1·62) |
|
RAAS combined with other blood pressure-lowering agents |
|||
|
ACE inhibitor + calcium-channel blocker |
0/0 |
.. |
1·03 (0·25 to 4·31) |
|
Other (combinations of) blood-pressure lowering agents |
|||
|
Calcium-channel blocker |
0/0 |
.. |
1·26 (0·17 to 9·29) |
|
Diuretic |
0/0 |
.. |
8·09 (0·42 to 155·1) |
|
(b) Direct Comparisons (head-to-head) |
RCTs / participants (events) |
OR (95% CI) |
|
|
Intervention |
comparison |
Pairwise meta-analysis |
|
|
CARDIOVASCULAR MORTALITY |
|||
|
RAAS monotherapy |
|||
|
ACE versus. |
ARB |
2/1985 (270) |
|
|
RAAS mono versus dual therapy |
|||
|
ACE versus. |
ACE + ARB |
2/1720 (246) |
1.25 (0.95 to 1.63) |
|
ARB versus. |
ACE + ARB |
1/1779 (249) |
1.13 (0.86 to 1.48) |
|
RAAS versus RAAS + Other |
|||
|
ACE versus. |
ACE + CCB |
1/281 (5) |
3.94 (0.44 to 35.7) |
|
|
|||
|
MYOCARDIAL INFARCTION |
|||
|
RAAS monotherapy |
|||
|
ACE versus. |
ARB |
3/2048 (145) |
|
|
ARB versus. |
ALDO |
1/53 (1) |
0.33 (0.01 to 8.56) |
|
RAAS mono versus dual therapy |
|||
|
ACE versus. |
ACE + ARB |
2/1797 (136) |
|
|
ARB versus. |
ACE + ARB |
3/3325 (224) |
0.82 (0.63 to 1.08) |
|
RAAS versus RAAS + Other |
|||
|
ACE versus. |
ACE + CCB |
1/281 (3) |
0.48 (0.04 to 5.34) |
|
ARB + DIU versus. |
ACE + CCB |
1/110 (2) |
0.96 (0.06 to 15.8) |
|
|
|||
|
STROKE |
|||
|
RAAS monotherapy |
|||
|
ACE versus. |
ARB |
3/2048 (131) |
|
|
ARB versus. |
ALDO |
1/53 (2) |
0.19 (0.01 to 4.21) |
|
RAAS mono versus dual therapy |
|||
|
ACE versus. |
ACE + ARB |
2/1797 (119) |
1.17 (0.31 to 4.45) |
|
ARB versus. |
ACE + ARB |
3/3325 (164) |
0.97 (0.71 to 1.33) |
|
RAAS versus RAAS + Other |
|||
|
ACE versus. |
ACE + CCB |
1/281 (8) |
0.96 (0.24 to 3.93) |
(a) Meta-analyse van resultaten ten opzichte van placebo op basis van directe vergelijking (pairwise meta-analyse) en op basis van directe plus indirecte vergelijkingen (netwerk meta-analyse; Palmer, 2015).
(b) Meta-analyse van directe (head-to-head) vergelijking tussen de actieve interventies. Statistisch significante verschillen zijn vetgedrukt; een waarde lager dan 1 is in het voordeel van de interventie. OR = Odds ratio; 95% CI = 95% betrouwbaarheidsinterval. NR = not reported
RAAS-monotherapie
Cardiovasculaire mortaliteit. Palmer (2015) rapporteert alleen de resultaten van klassieke (pairwise) meta-analyse. De vergelijking met placebo (Tabel 5a) laat geen statistisch significante verschillen zien in cardiovasculaire mortaliteit bij behandeling met een RAAS-blokker: voor ACE-remmer en renine-remmer respectievelijk OR= 1,04 ((0,84; 1,29)) en OR= 1,16 ((0,96; 1,40)). Voor ARB-monotherapie wordt een verhoogd risico gerapporteerd (OR= 3,44 (0,94; 12,6)), maar de effectschatting is gebaseerd op een enkele RCT met onvoldoende statistische power (566 deelnemers en slechts 13 events) en is statistisch niet significant. Voor aldosteronantagonisten zijn geen data beschikbaar. Er zijn twee RCT’s beschikbaar die een ACE-remmer rechtstreeks vergelijken met ARB (Tabel 5b). Meta-analyse geeft geen statistisch significant verschil te zien tussen ACE-remmer en ARB (OR= 1,08 (0,84; 1,40)).
Myocardinfarct. De vergelijking met placebo (Tabel 5a) laat een mogelijk voordeel zien voor ACE-remmers en ARB in het voorkomen van een myocardinfarct. De kans op myocardinfarct is bij monotherapie met ARB statistisch significant en klinisch relevant lager dan bij placebobehandeling (OR= 0,70 (0,53; 0,94)). Monotherapie met ACE-remmers resulteert in een vergelijkbare daling van het risico op een myocardinfarct, maar het verschil ten opzichte van placebo bereikt geen statistische significantie (OR= 0,80 (0,61; 1,06)). De effectschatting voor aldosteronantagonisten is zeer imprecies (OR= 1,78 (0,11; 29,8)), door het brede betrouwbaarheidsinterval is geen eenduidige uitspraak mogelijk. Voor renine-remmers wordt geen statistisch significant effect gevonden op het aantal myocardinfarcten (OR= 1,04 (0,82; 1,31)). Er zijn drie RCT’s beschikbaar die een ACE-remmer rechtstreeks vergelijken met ARB (Tabel 5b). Meta-analyse geeft geen statistisch significant verschil te zien tussen ACE-remmer en ARB (OR= 1,10 (0,79; 1,55)). Voor de vergelijking tussen ARB en aldosteronantagonisten is een RCT beschikbaar maar van onvoldoende omvang (53 deelnemers met 1 event).
Beroerte (TIA/CVA). De vergelijking met placebo (Tabel 5a) laat geen statistisch significante verschillen zien in het risico op een beroerte bij behandeling met een RAAS-blokker: voor ARB, ACE-remmer en renine-remmer: respectievelijk OR= 1,01 ((0,68; 1,48)), OR= 1,00 ((0,77; 1,28)) en OR= 1,21 ((0,95; 1,55)). De effectschatting voor aldosteronantagonisten is zeer imprecies (OR= 2,65 (0,30; 23,4)), door het brede betrouwbaarheidsinterval is geen uitspraak mogelijk. Er zijn drie RCT’s beschikbaar die een ACE-remmer rechtstreeks vergelijken met ARB (Tabel 5b). Meta-analyse geeft geen statistisch significant verschil te zien tussen ACE-remmer en ARB (OR= 0,94 (0,66; 1,34)). Voor de vergelijking tussen ARB en aldosteronantagonisten is een RCT beschikbaar maar van onvoldoende omvang (53 deelnemers met 2 events).
RAAS-monotherapie versus RAAS-dubbeltherapie
Cardiovasculaire mortaliteit. Palmer (2015) rapporteert alleen de resultaten van klassieke (pairwise) meta-analyse. Er zijn geen studies beschikbaar voor de vergelijking met placebo (Tabel 5a). Uit de RCT’s die RAAS-monotherapie (ACE-remmer of ARB) vergelijken met RAAS-dubbeltherapie (combinatie van ACE-remmer en ARB) komen geen statistisch significante verschillen naar voren: respectievelijk OR= 1,25 ((0,95; 1,63)) en OR= 1,13 ((0,86; 1,48)).
Myocardinfarct. Uit de vergelijking van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) met placebo (Tabel 5a) komt geen statistisch significant verschil naar voren: OR= 0,83 ((0,59; 1,19)), de effectschatting is uitsluitend gebaseerd op indirecte vergelijkingen. Uit de RCT’s die RAAS-monotherapie (ACE-remmer of ARB) vergelijken met RAAS-dubbeltherapie (combinatie van ACE-remmer en ARB) komen ook geen statistisch significante verschillen naar voren: respectievelijk OR= 1,04 ((0,73; 1,47)) en OR= 0,82 ((0,63; 1,08)).
Beroerte (TIA/CVA). Uit de vergelijking van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) met placebo (Tabel 5a) komt geen statistisch significant verschil naar voren: OR= 1,07 ((0,70; 1,62)), de effectschatting is uitsluitend gebaseerd op indirecte vergelijkingen. Uit de RCT’s die RAAS-monotherapie (ACE-remmer of ARB) vergelijken met RAAS-dubbeltherapie (combinatie van ACE-remmer en ARB) komen ook geen statistisch significante verschillen naar voren: respectievelijk OR= 1,17 ((0,31; 4,45)) en OR= 0,97 ((0,71; 1,33)).
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum
Cardiovasculaire mortaliteit. Palmer (2015) rapporteert alleen de resultaten van klassieke (pairwise) meta-analyse. Er is een RCT beschikbaar die een ACE-remmer vergelijkt met een combinatie van ACE-remmer en calciumantagonist maar de effectschatting is onbetrouwbaar door onvoldoende statistische power (281 deelnemers met slechts 5 events).
Myocardinfarct. Vergelijking met placebo laat geen statistisch significant verschil zien voor de combinatie van ACE-remmer met calciumantagonist, of ARB met diureticum, maar de effectschattingen zijn imprecies, de brede betrouwbaarheidsintervallen laten geen uitspraak toe. Er is een RCT beschikbaar die een ACE-remmer vergelijkt met een combinatie van ACE-remmer en calciumantagonist maar de effectschatting is onbetrouwbaar door onvoldoende statistische power (281 deelnemers met slechts 3 events).
Beroerte (TIA/CVA). Vergelijking met placebo laat geen statistisch significant verschil zien voor de combinatie van ACE-remmer met calciumantagonist, maar de effectschatting is imprecies, het brede betrouwbaarheidsinterval laat geen eenduidige uitspraak toe. Er is een RCT beschikbaar die een ACE-remmer vergelijkt met een combinatie van ACE-remmer en calciumantagonist maar de effectschatting is onbetrouwbaar door onvoldoende statistische power (281 deelnemers met slechts 8 events).
Samenvattend: er zijn geen duidelijke aanwijzingen voor een effect op cardiovasculaire mortaliteit van RAAS-monotherapie (ACE-remmer, ARB, renine-remmer) of RAAS-dubbeltherapie (combinatie van ACE-remmer met ARB of ARB met renine-remmer), maar de effectschattingen zijn overwegend imprecies en een klinisch relevant effect op mortaliteit (verhoging of verlaging) kan niet worden uitgesloten. Er zijn geen aanwijzingen voor een verschil in effect tussen RAAS-monotherapie en dubbeltherapie op cardiovasculaire mortaliteit. ACE-remmers en ARB (monotherapie) leiden mogelijk tot een (vergelijkbare) daling in het risico op een myocardinfarct. Er zijn geen aanwijzingen voor een verschil in effect tussen RAAS-monotherapie (ACE-remmer of ARB) en dubbeltherapie (combinatie van ACE-remmer en ARB) op het risico op een myocardinfarct. Er zijn geen aanwijzingen voor een effect van RAAS-monotherapie (ACE-remmer, ARB, renine-remmer) op het beroerte risico, nog voor een verschil in effect tussen RAAS-monotherapie (ACE-remmer of ARB) en dubbeltherapie (combinatie van ACE-remmer en ARB). Vanwege een gebrek aan onderzoeksgegevens is er geen uitspraak mogelijk over de mogelijke effecten van het combineren van RAAS-remmers met andere antihypertensiva op de uitkomstmaten cardiovasculaire mortaliteit, myocardinfarct en beroerte. Meer algemeen geldt voor alle behandelopties dat de statistische power veelal onvoldoende is, en de betrouwbaarheidsintervallen te breed, om een klinisch relevante verhoging of verlaging van mortaliteit of morbiditeit uit te kunnen sluiten bij een statistisch niet significant effect.
Acuut nierfalen (acute kidney injury, AKI; cruciale uitkomstmaat)
In Palmer (2015) is acuut nierfalen toegevoegd als extra (post hoc) uitkomstmaat voor veiligheid tijdens de data extractie fase voorafgaand aan de statistische analyse. De geïncludeerde studies hanteren verschillende definities variërend van ‘acuut nierfalen’ (zonder verdere uitleg) tot ‘verslechterde nierfunctie’, ‘transiënte toename in serum creatinine met tenminste 50%’ of ‘acuut nierfalen met noodzaak ziekenhuisopname’.
Figuur 6
Acute kidney injury
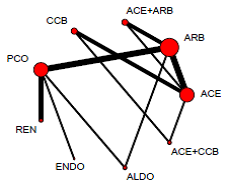
Overzicht netwerk meta-analyse voor de uitkomstmaat acuut nierfalen (Palmer, 2015). Het netwerk bevat 9 interventies (cirkels in de figuur) en 11 RCT’s (26.960 deelnemers). Het aantal RCT’s beschikbaar per interventie varieert sterk. ACE = angiotensine-converterend enzym inhibitor; ARB = angiotensine II receptor blokker; ENDO = endothilin inhibitor; REN = renine inhibitor; PCO = placebo; CCB = Calcium-channel blocker; ALDO = aldosteron antagonist
Tabel 6
|
(a) Compared to placebo |
RCTs / participants (events) |
OR (95% CI) |
|
|
Pairwise meta-analysis |
Network meta-analysis |
||
|
RAAS monotherapy |
|||
|
ACE inhibitor |
0/0 |
.. |
1·19 (0·33 to 4·27) |
|
ARB |
2/748 (26) |
1.58 (0.60 to 4.19) |
1·54 (0·58 to 4·06) |
|
Renin inhibitor |
2/9156 (189) |
1.28 (0.96 to 1.71) |
|
|
Aldosteron antagonist |
1/54 (23) |
1.58 (0.53 to 4.68) |
1·50 (0·52 to 4·30) |
|
RAAS dual therapy |
|||
|
ACE inhibitor + ARB |
0/0 |
.. |
|
|
RAAS combined with other blood pressure-lowering agents |
|||
|
ACE inhibitor + calcium-channel blocker |
0/0 |
.. |
0·50 (0·04 to 7·19) |
|
Other (combinations of) blood-pressure lowering agents |
|||
|
Endothelin inhibitor |
1/89 (2) |
1.82 (0.08 to 39.4) |
1·47 (0·06 to 33·8) |
|
Calcium-channel blocker |
.. |
.. |
0·89 (0·12 to 6·58) |
|
(b) Direct Comparisons (head-to-head) |
RCTs / participants (events) |
OR (95% CI) |
|
|
Intervention |
comparison |
Pairwise meta-analysis |
|
|
RAAS monotherapy |
|||
|
ACE versus. |
ARB |
3/2075 (18) |
0.73 (0.29 to 1.86) |
|
RAAS mono versus dual therapy |
|||
|
ACE versus. |
ACE + ARB |
1/1692 (17) |
0.44 (0.15 to 1.24) |
|
ARB versus. |
ACE + ARB |
2/3227 (230) |
0.57 (0.43 to 0.76) |
|
ARB versus. |
ALDO |
1/53 (26) |
1.08 (0.37 to 3.16) |
|
RAAS versus RAAS + Other |
|||
|
ACE versus. |
ACE + CCB |
1/206 (3) |
2.06 (0.18 to 23.1) |
(a) Meta-analyse van resultaten ten opzichte van placebo op basis van directe vergelijking (pairwise meta-analyse) en op basis van directe plus indirecte vergelijkingen (netwerk meta-analyse; Palmer, 2015).
(b) Meta-analyse van directe (head-to-head) vergelijking tussen de actieve interventies. Statistisch significante verschillen zijn vetgedrukt; een waarde lager dan 1 is in het voordeel van de interventie. OR = Odds ratio; 95% CI = 95% betrouwbaarheidsinterval
RAAS-monotherapie. De vergelijking met placebo (Tabel 6a) laat geen statistisch significante verschillen zien in het risico op acuut nierfalen bij behandeling met een RAAS-blokker: puntschatters (OR) voor ACE-remmers, ARB, renine-remmer en aldosteronantagonist variëren van 1,19 tot 1,54 maar door de brede betrouwbaarheidsintervallen zijn nauwelijks betrouwbare uitspraken mogelijk. Alleen voor renine-remmers zijn er data van voldoende omvang beschikbaar uit directe vergelijking (9.156 deelnemers, 189 events) en kan voorzichtig geconcludeerd worden dat er mogelijk sprake is van een verhoogd risico op acuut nierfalen (OR= 1,28 (0,95; 1,71); statistisch niet significant). Er zijn drie RCT’s beschikbaar die een ACE-remmer rechtstreeks vergelijken met ARB (Tabel 6b). Meta-analyse geeft geen statistisch significant verschil te zien tussen ACE-remmer en ARB (OR= 0,73 (0,29; 1,86)), maar de statistische power is gering (2.075 deelnemers maar slechts 18 events) en het betrouwbaarheidsinterval breed.
RAAS-monotherapie versus RAAS-dubbeltherapie. Uit de vergelijking van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) met placebo (Tabel 6a) komt een mogelijk verhoogd risico op acuut nierfalen naar voren die net geen statistische significantie bereikt: OR= 2,69 ((0·98; 7,38)), de effectschatting is volledig gebaseerd op indirecte vergelijkingen. Er zijn twee RCT’s beschikbaar die ARB-monotherapie vergelijken met RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB): na meta-analyse wordt een statistisch significant en klinisch relevant lager risico gevonden voor ARB-monotherapie (OR= 0,57 (0,43; 0,76)). In de RCT waarin monotherapie met een ACE-remmer wordt vergeleken met RAAS-dubbeltherapie wordt geen statistisch significant verschil waargenomen (OR= 0,44 (0,15; 1,24)), maar de statistische power is gering (1692 deelnemers maar slechts 17 events) en het betrouwbaarheidsinterval breed.
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum. De vergelijking met placebo laat geen statistisch significant voordeel zien voor de combinatie van ACE-remmer met calciumantagonist (OR= 0,50 (0,04; 7,19)), de effectschatting is volledige gebaseerd op indirecte vergelijkingen en het betrouwbaarheidsinterval breed. Er is een RCT beschikbaar die een ACE-remmer vergelijkt met een combinatie van ACE-remmer en calciumantagonist: er wordt geen statistisch significant verschil waargenomen (OR= 2,06 (0,18; 23,1)), maar de statistische power is zeer gering (206 deelnemers met slechts 3 events) en het betrouwbaarheidsinterval breed.
Samenvattend: monotherapie met ACE-remmer, ARB, renine-remmer of aldosteronantagonist leidt mogelijk tot enige verhoging van het risico op acuut nierfalen maar conclusies zijn onzeker omdat de studies verschillende definities hanteren voor acuut nierfalen en de effectschattingen imprecies zijn. RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) leidt mogelijk tot een (verder) verhoogd risico op acuut nierfalen in vergelijking met placebo en in vergelijking met ARB monotherapie. Over de effecten van combinatietherapie (combinatie van RAAS remmer en ander antihypertensivum) op acuut nierfalen is geen uitspraak mogelijk.
Overige diabetes-gerelateerde complicaties (cruciale uitkomstmaat)
Niet gerapporteerd in Palmer (2015).
Adverse events (bijwerkingen, complicaties, ‘veiligheid’ van de interventie; belangrijke uitkomstmaat)
Palmer (2015) analyseert hyperkaliëmie, presyncope, droge hoest en oedeem. Hyperkaliëmie wordt in de geïncludeerde studies gedefinieerd als een kaliumconcentratie groter dan 5.0 tot 6.0 mmol/l.
Figuur 7
Hyperkalaemia
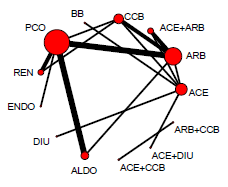
Overzicht netwerk meta-analyse voor de uitkomstmaat Hyperkaliëmie (Palmer, 2015). Het netwerk bevat 13 interventies (cirkels in de figuur) en 18 RCT’s (16.450 deelnemers). Het aantal RCT’s beschikbaar per interventie varieert sterk. De grootte van de cirkels is representatief voor de gepoolde groepsgrootte, en de lijndikte voor het aantal RCT’s beschikbaar per (directe) vergelijking. ACE = angiotensine-converterend enzym inhibitor; ARB = angiotensine II receptor blokker; ENDO = endothilin inhibitor; REN = renine inhibitor; PCO = placebo; CCB = Calcium-channel blocker; ALDO = aldosteron antagonist; DIU = diuretic; BB = β blocker
Tabel 7
|
(a) Compared to placebo |
RCTs / participants (events) |
OR (95% CI) |
|
|
Pairwise meta-analysis |
Network meta-analysis |
||
|
RAAS monotherapy |
|||
|
Aldosterone antagonist |
3/365 (20) |
2.23 (0.81 to 6.13) |
2·53 (0·82 to 7·84) |
|
ARB |
2/1714 (54) |
2.54 (0.94 to 6.86) |
1·88 (0·86 to 4·12) |
|
ACE inhibitor |
3/480 (24) |
1.63 (0.33 to 7.95) |
1·92 (0·74 to 4·97) |
|
Renin inhibitor |
2/9156 (2933) |
1·83 (0·88 to 3·78) |
|
|
RAAS dual therapy |
|||
|
ACE inhibitor + ARB |
0/0 |
.. |
|
|
RAAS combined with other blood pressure-lowering agents |
|||
|
ACE inhibitor + diuretic |
0/0 |
.. |
1·11 (0·23 to 5·41) |
|
Other (combinations of) blood-pressure lowering agents |
|||
|
Calcium-channel blocker |
1/1136 (5) |
1.51 (0.25 to 9.06) |
0·71 (0·22 to 2·33) |
|
Diuretic |
0/0 |
.. |
1·34 (0·26 to 6·84) |
|
Endothelin inhibitor |
1/1392 (49) |
1.24 (0.66 to 2.33) |
1·23 (0·42 to 3·69) |
|
β blocker |
0/0 |
.. |
0·53 (0·02 to 14·5) |
|
(b) Direct Comparisons (head-to-head) |
RCTs / participants (events) |
OR (95% CI) |
|
|
Intervention |
comparison |
Pairwise meta-analysis |
|
|
RAAS monotherapy |
|||
|
ACE versus. |
ARB |
1/63 (24) |
0.91 (0.33 to 2.54) |
|
ARB versus. |
ALDO |
1/53 (2) |
0.19 (0.01 to 4.02) |
|
RAAS mono versus dual therapy |
|||
|
ACE versus |
ACE + ARB |
1/105 (46) |
1.21 (0.52 to 2.82) |
|
ARB versus. |
ACE + ARB |
2/1546 (138) |
0.69 (0.23 to 2.13) |
|
RAAS versus RAAS + Other |
|||
|
ACE versus |
ACE + DIU |
1/457 (21) |
1.73 (0.70 to 4.26) |
|
ACE + CCB versus. |
ARB + CCB |
1/304 (2) |
5.06 (0.24 to 106.4) |
(a) Meta-analyse van resultaten ten opzichte van placebo op basis van directe vergelijking (pairwise meta-analyse) en op basis van directe plus indirecte vergelijkingen (netwerk meta-analyse; Palmer, 2015).
(b) Meta-analyse van directe (head-to-head) vergelijking tussen de actieve interventies. Statistisch significante verschillen zijn vetgedrukt; een waarde lager dan 1 is in het voordeel van de interventie. OR = Odds ratio; 95% CI = 95% betrouwbaarheidsinterval
RAAS-monotherapie. Vergelijking met placebo (Tabel 7a, netwerk meta-analyse) laat geen statistisch significante verschillen zien in het risico op hyperkaliëmie bij behandeling met een RAAS-blokker (aldosteronantagonist, ARB, ACE-remmer of renine-remmer), maar de effectschattingen zijn imprecies. Voor renine-remmers wordt na klassieke (pairwise) meta-analyse wel een statistisch significant en klinisch relevant verhoogd risico op hyperkaliëmie waargenomen in vergelijking met placebo: OR= 1,68 ((1,15; 2,45); 2 RCT’s, 9.156 deelnemers en 2.933 events). Er zijn twee RCT’s beschikbaar die RAAS-remmers onderling vergelijken (Tabel 7b) maar de statistische power is onvoldoende.
RAAS-monotherapie versus RAAS-dubbeltherapie. Uit de vergelijking van RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) met placebo (Tabel 7a) komt een verhoogd risico op hyperkaliëmie naar voren dat net niet statistisch significant is: OR= 2,69 (0,97; 7,47), de effectschatting is uitsluitend gebaseerd op indirecte vergelijkingen. Er zijn drie RCT’s beschikbaar die RAAS-monotherapie (ACE-remmer of ARB) vergelijken met RAAS-dubbeltherapie (combinatie van ACE-remmer en ARB), meta-analyse geeft geen statistisch significant verschillen te zien (respectievelijk OR= 1,21 (0,52; 2,82) en OR= 0,69 (0,23; 2,13)).
RAAS-therapie (mono of dubbel) versus RAAS-therapie gecombineerd met een ander antihypertensivum. Vergelijking met placebo laat geen statistisch significant verschil zien voor de combinatie van ACE-remmer met diureticum (OR= 1,11 (0,23; 5,41)), de effectschatting is volledige gebaseerd op indirecte vergelijkingen en imprecies. Er is een RCT beschikbaar die een ACE-remmer vergelijkt met een combinatie van ACE-remmer en diureticum maar de effectschatting is onbetrouwbaar door onvoldoende statistische power (457 deelnemers met slechts 21 events).
Samenvattend: monotherapie met een renine-remmer leidt mogelijk tot een verhoging van het risico op hyperkaliëmie in vergelijking met placebo. Monotherapie met een ACE-remmer of ARB leidt mogelijk ook tot verhoging van het risico op hyperkaliëmie maar conclusies zijn onzeker omdat de effectschattingen imprecies zijn. RAAS-dubbeltherapie met ACE-remmer en ARB leidt eveneens mogelijk tot een verhoogd risico op hyperkaliëmie in vergelijking met placebo. Vanwege een gebrek aan onderzoeksgegevens is er geen uitspraak mogelijk over de effecten van het combineren van RAAS-remmers met andere antihypertensiva op het risico op hyperkaliëmie.
Naast hyperkaliëmie rapporteert Palmer (2015) ook presyncope, droge hoest en oedeem als uitkomstmaat (zie Palmer, 2015 voor details). Renine-remmers (monotherapie) verhoogden de kans op presyncope (OR= 1,52 (1,32; 1,75)). ACE-remmers (monotherapie en in combinatie met diureticum of calciumantagonist) en ARB in combinatie met calciumantagonist verhoogden de kans op droge hoest (gemiddelde odds ratio tussen 2,95 en 5,27; statistisch significant), terwijl er vanwege ernstige imprecisie (breed betrouwbaarheidsinterval) geen eenduidige conclusie getrokken kan worden over de kans op droge hoest bij monotherapie met ARB (odds ratio, OR= 1,40 (0,48;4,13)). Met uitzondering van monotherapie met een calciumantagonist, een interventie die buiten de huidige uitgangsvraag valt, was bij geen van de behandelopties sprake van een statistisch significant effect op het risico op (perifeer) oedeem.
Overige uitkomstmaten (ziekenhuisopname, kwaliteit van leven (HRQoL), patiënttevredenheid en kosten; belangrijke uitkomstmaten)
Ziekenhuisopname, kwaliteit van leven (HRQoL) en patiënttevredenheid worden niet gerapporteerd in Palmer (2015) of Farmer (2014). Farmer (2014) bevat naast een systematische review naar de effectiviteit van ACE-remmers en ARB's bij personen met DM1 en DM2 (zie later in de tekst), maar presenteert ook modellen voor de progressie van nierziekte en integreert de resultaten in een economische evaluatie (HTA) naar de waarde en kosteneffectiviteit van screening (verschillende screeningsfrequenties) en vroegtijdige behandeling van nefropathie. De kosteneffectiviteitsanalyse is uitgevoerd in de UK (kostenniveau 2011) en gaat uit van behandeling met ACE-remmer of ARB zodra er sprake is van progressie van normo- naar microalbuminurie. De resultaten geven aan dat een jaarlijkse screening op basis van de albumine-creatinine ratio in de urine (ACR test) kosteneffectief is voor zowel personen met DM1 als personen met DM2. Bij interpretatie van deze resultaten moet rekening worden gehouden met indirectheid: de analyses hebben betrekking op het zorgstelsel in de UK en zijn gedateerd (kostenniveau 2011). Voor aanvullende overwegingen met betrekking tot kosten en kosteneffectiviteit wordt de lezer verwezen naar het tabblad Overwegingen.
Lange termijn effecten en relevante subgroepen
Palmer (2015) voert voor de primaire uitkomstmaten totale mortaliteit en eindstadium nierfalen een aantal sensitiviteitsanalyses uit. De resultaten van de meest relevante analyses zijn samengevat in tabel 8. Met betrekking tot de overige uitkomstmaten waarvoor Palmer (2015) geen subgroepanalyses presenteert is van belang dat in de netwerk meta-analyse (overall) 68% van de studies in de netwerken alleen personen met DM2 includeerden en 19% alleen personen met DM1, bij 13% was dit niet gespecificeerd of betrof het een gemengde populatie van DM1 en DM2. Een meerderheid van de studies (55%) includeerde alleen personen met matig verhoogde albuminurie (microalbuminurie), 28% alleen personen met ernstig verhoogde albuminurie (macroalbuminurie), en bij 17% van de studies was dit niet gespecificeerd of betrof het een gemengde populatie. Tenslotte, includeerde 49% van de studies alleen personen met hypertensie, 20% alleen personen met normotensie, en bij 32% van de studies was dit niet gespecificeerd of een gemengde populatie.
Lange termijn effecten
Uit de hoofdanalyse (33 RCT’s) kwamen geen duidelijke aanwijzingen naar voren voor een effect op de totale mortaliteit bij RAAS monotherapie of RAAS dubbeltherapie, terwijl de combinatie van ACE-remmer met calciumantagonist mogelijk een gunstig effect op mortaliteit had (zie eerder in de tekst onder ‘Mortaliteit’). Eenzelfde beeld ontstaat als de analyse wordt beperkt tot studies met meer dan 24 maanden follow-up (23 van de 33 RCT’s): de gemiddelde effectschattingen (puntschatters) verschuiven nauwelijks. Wel zijn de betrouwbaarheidsintervallen smaller: voor monotherapie met ARB, dubbeltherapie met ACE-remmer en ARB, en combinatietherapie met ACE-remmer en calciumantagonist wordt nu een statistisch significant lagere mortaliteit waargenomen in vergelijking met placebobehandeling. Deze resultaten suggereren dat laatstgenoemde behandelopties mogelijk resulteren in een lagere mortaliteit. Net als voor de hoofdanalyse (zie eerder in de tekst onder ‘Mortaliteit’) geldt echter ook voor deze sensitiviteitsanalyses dat voor alle behandelopties de statistische power onvoldoende is, en de effectschatting voor de combinatie van ACE-remmer met calciumantagonist (OR= 0,32 (0,11; 0,93)) uitsluitend is gebaseerd op indirecte vergelijkingen.
Uit de hoofdanalyse (13 RCT’s) kwam naar voren dat ACE-remmers en ARB (monotherapie) waarschijnlijk vergelijkbaar effectief zijn in het voorkomen van eindstadium nierfalen, en dat RAAS-dubbeltherapie (ACE-remmer gecombineerd met ARB) mogelijk eveneens effectief is in het voorkomen van eindstadium nierfalen (gebaseerd op indirecte vergelijkingen; zie eerder in de tekst onder ‘Eindstadium nierfalen’). De effectschattingen worden niet beïnvloed als de analyse wordt beperkt tot studies met meer dan 24 maanden follow-up (10 van de 13 RCT’s). De conclusies uit de hoofdanalyse met betrekking tot eindstadium nierfalen lijken daarmee (ook) geldig voor een behandelduur langer dan twee jaar.
Tabel 8
|
(a) All-cause mortality Network meta-analysis: OR (95% CI) |
|||||||
|
Compared to placebo |
All 33 RCTs |
Fup >24 m 23 RCTs |
Microalbum 13 RCTs |
Macroalbum 12 RCTs |
Hypertension 14 RCTs |
DM1 5 RCTs |
DM2 21 RCTs |
|
RAAS monotherapy |
|||||||
|
Aldosterone antagonist |
0·28 (0·01 to 6·46) |
0.28 (0.01 to 6.44) |
.. |
0.28 (0.01 to 6.42) |
0.28 (0.07 to 1.16) |
.. |
0.28 (0.02 to 6.40) |
|
ARB |
0·87 (0·71 to 1·07) |
0.74 (0.57 to 0.96) |
0.77 (0.22 to 2.70) |
0.94 (0.69 to 1.28) |
0.89 (0.55 to 1.42) |
.. |
0.95 (0.79 to 1.14) |
|
ACE inhibitor |
0·94 (0·76 to 1·15) |
0.80 (0.61 to 1.03) |
1.04 (0.88 to 1.22) |
0.63 (0.30 to 1.32) |
0.67 (0.23 to 1.99) |
0.59 (0.26 to 1.34) |
1.03 (0.88 to 1.21) |
|
Renin inhibitor |
1·05 (0·81 to 1·36) |
1.06 (0.84 to 1.34) |
.. |
.. |
.. |
.. |
1.05 (0.91 to 1.23) |
|
RAAS dual therapy |
|||||||
|
ACE inhibitor + ARB |
0·84 (0·63 to 1·11) |
0.69 (0.49 to 0.96) |
.. |
1.01 (0.64 to 1.59) |
1.35 (0.26 to 6.96) |
.. |
1.04 (0.70 to 1.55) |
|
ARB + renin inhibitor |
0·86 (0·05 to 14·0) |
.. |
.. |
.. |
.. |
.. |
0.93 (0.06 to 15.1) |
|
RAAS combined with other blood pressure-lowering agents |
|||||||
|
ACE inhibitor + CCB |
0·36 (0·12 to 1·05) |
0.32 (0.11 to 0.93) |
0.41 (0.14 to 1.25) |
.. |
0.29 (0.07 to 1.16) |
.. |
0.39 (0.13 to 1.12) |
|
ACE inhibitor + diuretic |
0·72 (0·05 to 10·2) |
0.64 (0.05 to 8.95) |
.. |
.. |
0.57 (0.03 to 9.44) |
.. |
0.78 (0.06 to 10.8) |
|
(b) End-stage kidney disease Network meta-analysis: OR (95% CI) |
|||||||
|
Compared to placebo |
All 13 RCTs |
Fup >24 m 10 RCTs |
Microalbum 1 RCT |
Macroalbum 9 RCTs |
Hypertension 2 RCTs |
DM1 1 RCT |
DM2 9 RCTs |
|
RAAS monotherapy |
|||||||
|
ACE inhibitor |
0·71 (0·51 to 1·01) |
0.70 (0.50 to 1.00) |
0.93 (0.41 to 2.10)* |
0.62 (0.37 to 1.04) |
0.73 (0.19 to 2.79) |
0.59 (0.32 to 1.07)* |
0.84 (0.44 to 1.59) |
|
ARB |
0·77 (0·65 to 0·92) |
0.77 (0.65 to 0.91) |
.. |
0.77 (0.65 to 0.78) |
0.76 (0.56 to 1.05) |
.. |
0.78 (0.65 to 0.92) |
|
Renin inhibitor |
1·21 (0·85 to 1·70) |
1.21 (0.85 to 1.70) |
.. |
.. |
.. |
.. |
1.21 (0.85 to 1.70) |
|
RAAS dual therapy |
|||||||
|
ACE inhibitor + ARB |
0·62 (0·43 to 0·90) |
0.62 (0.43 to 0.90) |
.. |
0.49 (0.30 to 0.78) |
0.59 (0.17 to 1.98) |
.. |
0.51 (0.32 to 0.81) |
|
RAAS combined with other blood pressure-lowering agents |
|||||||
|
.. |
|
|
|
|
|
|
|
Sensitiviteitsanalyse voor de uitkomstmaten mortaliteit (a) en eindstadium nierfalen (b): resultaten van netwerk meta-analyse op basis van alle RCT's (hoofdanalyse) in vergelijking met een analyse beperkt tot studies met tenminste 24 maanden follow-up, en analyses beperkt tot studies bij patiënten met microalbuminurie, macroalbuminurie, hypertensie op baseline, diabetes type 1 of diabetes type 2 (Palmer, 2015). Het aantal RCT’s beschikbaar per subgroep varieert sterk. Statistisch significante verschillen zijn vetgedrukt; een waarde lager dan 1 is in het voordeel van de interventie. OR = Odds ratio; 95% CI = 95% betrouwbaarheidsinterval; ACE = angiotensine-converterend enzym inhibitor; ARB = angiotensine II receptor blokker; CCB = Calcium-channel blocker. *Op basis van directe vergelijking (slechts een RCT beschikbaar)
DM1 versus DM2.
Het beperken van de netwerk meta-analyse voor de primaire uitkomstmaten totale mortaliteit en eindstadium nierfalen (Palmer, 2015) tot personen met diabetes mellitus type 2 (21 van de 33 RCT’s voor totale mortaliteit, en 9 van de 13 RCT’s voor eindstadium nierfalen) heeft nauwelijks invloed op de effectschattingen en geen invloed op de conclusies. De sensitiviteitsanalyse beperkt tot diabetes mellitus type 1 wordt bemoeilijkt door het geringe aantal beschikbare RCT’s (5 van de 33 voor mortaliteit, 1 van de 13 voor eindstadium nierfalen), alleen voor ACE-remmers is een effectschatting mogelijk. De betrouwbaarheidsintervallen zijn echter breed. Hieruit kan worden geconcludeerd dat de conclusies uit de hoofdanalyse met betrekking tot mortaliteit en eindstadium nierfalen van toepassing zijn op personen met diabetes mellitus type 2, maar dat dit onzeker is voor personen met diabetes type 1. Palmer (2015) presenteert geen aparte analyse voor personen met diabetes mellitus type 1.
In de SR van Farmer (2014) naar monotherapie met ACE-remmers of ARB’s worden de resultaten afzonderlijk gepresenteerd voor diabetes mellitus type 1 en 2 voor de uitkomstmaten proteïnurie, regressie van microalbuminurie naar normoalbuminurie, progressie van microalbuminurie naar macroalbuminurie, en totale mortaliteit.
Proteïnurie. Farmer (2014) analyseert albumine-excretie in de urine (figuur 8). Hierbij werd de ratio van gemiddelde albumine-excretie gebruikt als effectmaat zodat RCT's waarin albumine-excretie snelheid (mg/24 uur) werd bepaald, gecombineerd konden worden met RCT's waarin de albumine-creatinine-ratio werd bepaald (mg/mol of mg/g).
Figuur 8
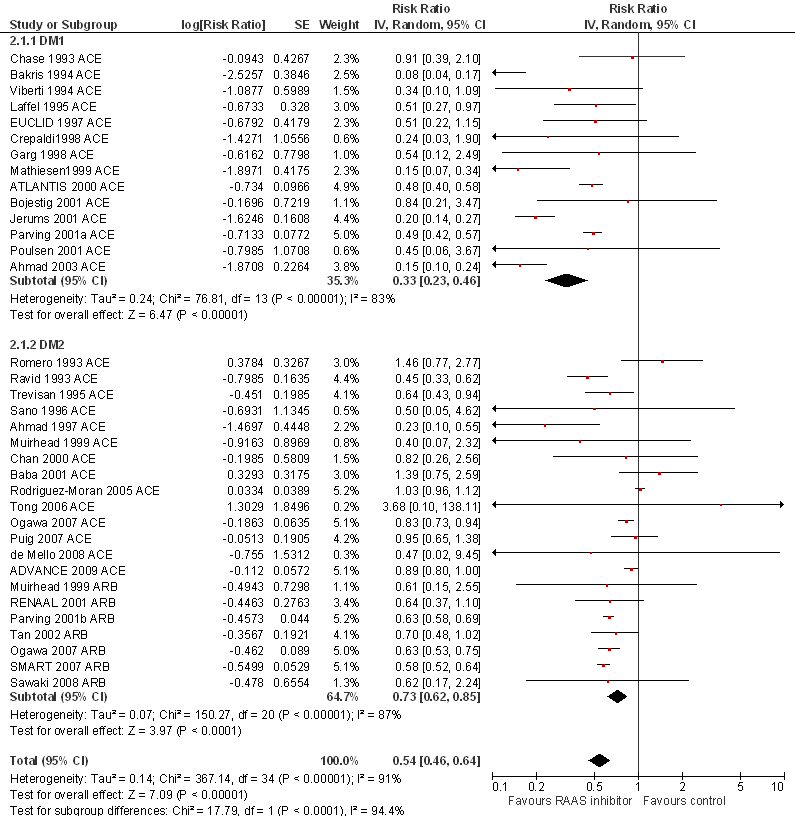
Forest plot van het effect van ACE-remmers en ARB’s op albumine-excretie in de urine in vergelijking met placebo (ratio van gemiddelde albumine-excretie). Subgroepen: diabetes mellitus type 1 en type 2. Klassieke (pairwise) meta-analyse (random effects model)
RAAS-monotherapie bij personen met DM1. Alle RCT’s betreffen ACE-remmers. De vergelijking met placebo (10 uit 14 studies), geen behandeling (2 studies) of calciumantagonist (2 studies), laat een statistisch significant en klinisch relevant voordeel zien voor ACE-remmers: relatief risico, RR= 0,33 ((0,23; 0,46); n= 705 deelnemers). Er is sprake van een zeer hoge statistische heterogeniteit (I2= 83%) maar alle puntschatters zijn in het voordeel van de ACE-remmers. De effectschatting is gebaseerd op overwegend zeer kleine studies (8 met minder dan 50 deelnemers, slechts 1 met meer dan 100 deelnemers, geen met meer dan 200 deelnemers). Uit sensitiviteitsanalyses blijkt dat de overall RR nauwelijks wordt beïnvloed als alleen RCT’s met dubbele blindering worden meegenomen (RR= 0,43 (0,28; 0,65); 10 RCT’s).
RAAS-monotherapie bij personen met DM2. De vergelijking met placebo (11 uit 21 studies), geen behandeling (2 studies), dieet (1 studie), pentoxifylline (1 studie) of alternatief antihypertensivum (calciumantagonist of diureticum; respectievelijk 5 en 1 studies), laat een statistisch significant en klinisch relevant voordeel zien voor RAAS-remmers: overall RR= 0,73 ((0,62; 0,85); n= 4.793 deelnemers). De statistische heterogeniteit is hoog (I2= 87%) maar een grote meerderheid (17 uit 21) van de puntschatters is in het voordeel van de RAAS-remmers. Als de meta-analyse wordt beperkt tot ARB’s of ACE-remmers bedraagt het relatief risico respectievelijk: RR=0,61 ((0,58; 0,65); I2= 0%), en RR= 0,81 ((0,68; 0,96); I2= 74%). De effectschatting is gebaseerd op zowel zeer kleine studies (9 met minder dan 50 deelnemers) als grotere studies (8 met meer dan 100 deelnemers waarvan 2 met meer dan 500 deelnemers). Uit sensitiviteitsanalyses blijkt dat het overall RR nauwelijks wordt beïnvloed als alleen RCT’s met dubbele blindering worden meegenomen (RR= 0,69 (0,57; 0,83); 11 RCT’s), of alleen grotere RCT’s (n ≥ 200) worden geïncludeerd (RR= 0,73 (0,54; 0,98); 3 RCT’s).
Samenvattend: bij zowel personen met DM1 als DM2 zijn ACE-remmers (monotherapie) effectief in het verminderen van albumine-excretie in de urine. Bij personen met DM2 is de effectiviteit van ARB (monotherapie) mogelijk enigszins hoger dan die van ACE-remmers. Door het ontbreken van onderzoeksgegevens is er geen uitspraak mogelijk over de effecten van ARB monotherapie op albumine-excretie bij personen met DM1. Farmer (2014) analyseert alleen RAAS-monotherapie en op basis van Farmer (2014) is dus geen uitspraak mogelijk over de effecten van RAAS dubbeltherapie of combinaties van RAAS therapie met een ander antihypertensivum.
Regressie van microalbuminurie naar normoalbuminurie. Farmer (2014) analyseert ook regressie van matig verhoogde albuminurie (microalbuminurie) naar normale albuminurie (normoalbuminurie; figuur 9).
Figuur 9
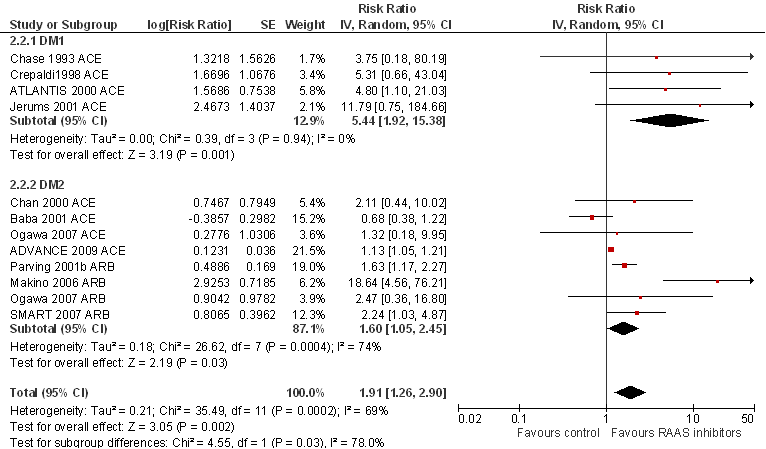
Forest plot van het effect van ACE-remmers en ARB’s op regressie van micro- naar normoalbuminurie in vergelijking met placebo. Subgroepen: diabetes mellitus type 1 en type 2. Klassieke (pairwise) meta-analyse (random effects model)
RAAS-monotherapie bij personen met DM1. Alle vier de RCT’s betreffen ACE-remmers. De vergelijking met placebo laat een statistisch significant en klinisch relevant voordeel zien voor ACE-remmers: RR= 5,44 ((1,92; 15,38); random effects model; n= 169 deelnemers). Er is geen sprake van statistische heterogeniteit (I2= 0%), alle puntschatters zijn in het voordeel van de RAAS-remmer maar slechts een van de effectschattingen is statistisch significant. De effectschatting is gebaseerd op overwegend zeer kleine studies (2 met minder dan 50 deelnemers, geen met meer dan 100 deelnemers) en de studieomvang is gering, ook na pooling (totaal n= 169 deelnemers).
RAAS-monotherapie bij personen met DM2. De vergelijking met placebo laat een statistisch significant en klinisch relevant voordeel zien voor RAAS-remmers: overall RR= 1,60 ((1,05; 2,45); 3.637 deelnemers). De statistische heterogeniteit is hoog (I2= 74%) maar vrijwel alle (7 uit 8) puntschatters zijn in het voordeel van de RAAS-remmers. Als de meta-analyse wordt beperkt tot ARB’s (vier RCT's) of ACE-remmers (vier RCT's) bedraagt het relatief risico respectievelijk: RR= 3,05 ((1,26; 7,37); I2= 73%) en RR= 1,07 ((0,83; 1,37); I2= 15%). De effectschatting is gebaseerd op zowel zeer kleine studies (3 met minder dan 50 deelnemers) als grotere studies (4 met meer dan 100 deelnemers waarvan 1 met meer dan 500 deelnemers).
Samenvattend: bij personen met DM1 lijken ACE-remmers (monotherapie) effectief in het induceren van regressie van microalbuminurie. Bij personen met DM2 is de effectiviteit van ARB (monotherapie) hoger dan die van ACE-remmers en zijn ACE-remmers mogelijk niet effectief. Door het ontbreken van onderzoeksgegevens is er geen uitspraak mogelijk over de effecten van ARB monotherapie op regressie van microalbuminurie bij personen met DM1. Farmer (2014) analyseert alleen RAAS-monotherapie en op basis van Farmer (2014) is dus geen uitspraak mogelijk over de effecten van RAAS-dubbeltherapie of combinaties van RAAS-therapie met een ander antihypertensivum.
Progressie van microalbuminurie naar macroalbuminurie
RAAS-monotherapie bij personen met DM1. Alle RCT’s betreffen ACE-remmers. De vergelijking met placebo laat een statistisch significant en klinisch relevant voordeel zien voor ACE-remmers: RR= 0,39 ((0,23; 0,67); random effects model; n= 378 deelnemers). Er is geen sprake van statistische heterogeniteit (I2= 0%). De effectschatting is gebaseerd op overwegend zeer kleine studies (3 met minder dan 50 deelnemers, geen met meer dan 100 deelnemers), en de studieomvang is gering, ook na pooling (totaal n= 378 deelnemers).
RAAS-monotherapie bij personen met DM2. Vijf RCT’s betreffen ACE-remmers en drie RCT’s betreffen ARB’s. De vergelijking met placebo laat een statistisch significant en klinisch relevant voordeel zien voor RAAS-remmers: overall RR= 0,49 ((0,34; 0,70); random effects model; 3.509 deelnemers). De statistische heterogeniteit is matig (I2= 48%) maar alle puntschatters zijn in het voordeel van de RAAS-remmers. Als de meta-analyse wordt beperkt tot ARB’s of ACE-remmers bedraagt het relatief risico respectievelijk: RR= 0,34 ((0,25; 0,47); I2= 0%) en RR= 0,67 ((0,53; 0,86)); I2= 0%). De effectschatting is gebaseerd op zowel zeer kleine studies (3 met minder dan 50 deelnemers) als grotere studies (4 met meer dan 100 deelnemers waarvan 1 met meer dan 500 deelnemers).
Samenvattend: bij zowel personen met DM1 als DM2 zijn ACE-remmers (monotherapie) effectief in het remmen van progressie van micro- naar macroalbuminurie. Bij personen met DM2 is de effectiviteit van ARB (monotherapie) hoger dan die van ACE-remmers. Door het ontbreken van onderzoeksgegevens is er geen uitspraak mogelijk over de effecten van ARB-monotherapie op progressie naar macroalbuminurie bij personen met DM1. Farmer (2014) analyseert alleen RAAS-monotherapie en op basis van Farmer (2014) is dus geen uitspraak mogelijk over de effecten van RAAS-dubbeltherapie of combinaties van RAAS-therapie met een ander antihypertensivum.
Totale mortaliteit
RAAS monotherapie bij personen met DM1. Farmer (2014) includeert vier RCT’s, die alle betrekking hebben op ACE-remmers. Er is nauwelijks statistische heterogeniteit (I2= 13%) en de meeste (3 uit 4) puntschatters zijn in het voordeel van controle, maar geen van de effectschatters is statistisch significant en de betrouwbaarheidsintervallen zijn zeer breed: relatief risico na pooling, RR= 0,91 ((0,45; 1,84); fixed effects model; n= 643 deelnemers). De effectschatting is gebaseerd op overwegend kleine studies (1 met minder dan 50 deelnemers, 2 met meer dan 100 deelnemers) en de studieomvang is gering ook na pooling (totaal 643 deelnemers), zeker voor een zeldzame uitkomst als mortaliteit.
RAAS-monotherapie bij personen met DM2. Farmer (2014) includeert drie RCT’s, een RCT betreft een ACE-remmer en twee RCT's betreffen ARB's. Vergelijking met placebo laat geen statistisch significant verschil zien: overall RR= 1,04 ((0,93; 1,16); fixed effects model; 6.635 deelnemers). Er is geen statistische heterogeniteit (I2= 0%), alle drie de puntschatters zijn in het voordeel van de controle, maar geen van de effectschatters is statistisch significant. De effectschatting is gebaseerd op maar drie RCT’s maar deze RCT's zijn alle van aanzienlijke omvang (meer dan 500 deelnemers).
Samenvattend: bij zowel personen met DM1 als DM2 zijn er geen duidelijke aanwijzingen voor een effect van RAAS-remmers op de totale mortaliteit. De statistische power is onvoldoende, en de betrouwbaarheidsintervallen te breed, om een klinisch relevante verhoging of verlaging van de mortaliteit uit te kunnen sluiten. Op basis van de resultaten bij personen met DM2 kan in die patiëntengroep wel worden geconcludeerd dat er waarschijnlijk geen groot effect is van RAAS-remming (ACE-remmers of ARB's) op de totale mortaliteit. Door het ontbreken van onderzoeksgegevens is er geen uitspraak mogelijk over de effecten van ARB-monotherapie op mortaliteit bij personen met DM1. Farmer (2014) analyseert alleen RAAS-monotherapie en op basis van Farmer (2014) is dus geen uitspraak mogelijk over de effecten van RAAS-dubbeltherapie of van combinaties van RAAS-therapie met een ander antihypertensivum.
Microalbuminurie versus macroalbuminurie
Als de analyse in Palmer (2015) voor totale mortaliteit wordt beperkt tot personen met matig verhoogde albuminurie (microalbuminurie; 13 van de 33 RCT’s) of ernstig verhoogde albuminurie (macroalbuminurie; 12 van de 33 RCT’s) kan slechts voor enkele van de behandelopties een effectschatting worden bepaald (zie tabel 8). De effectschattingen zijn vergelijkbaar met die in de hoofdanalyse, maar de brede betrouwbaarheidsintervallen laten geen conclusies toe specifiek voor personen met microalbuminurie of macroalbuminurie. Voor een analyse van eindstadium nierfalen bij personen met microalbuminurie is maar een RCT. Voor een analyse bij personen met macroalbuminurie zijn voor eindstadium nierfalen negen RCT’s beschikbaar en de resultaten zijn vergelijkbaar met die in de hoofdanalyse. De conclusies uit de hoofdanalyse met betrekking tot eindstadium nierfalen zijn van toepassing op personen met macroalbuminurie, maar dit is onzeker is voor personen met microalbuminurie.
In de SR van Farmer (2014) worden de resultaten afzonderlijk gepresenteerd voor diabetes mellitus type 1 en 2, en worden de uitkomstmaten regressie van microalbuminurie naar normoalbuminurie, en progressie van microalbuminurie naar macroalbuminurie gerapporteerd (zie voor details de eerdere tekst onder ‘DM1 versus DM2’). De kans op regressie van micro- naar normoalbuminurie was respectievelijk RR= 5,44 ((1,92; 15,38); n= 169 deelnemers) bij personen met DM1, en RR= 1,60 ((1,05; 2,45); n= 3.637 deelnemers) bij personen met DM2, in beide patiëntgroepen in het voordeel van behandeling met RAAS-remmers. Het relatief risico op progressie van micro- naar macroalbuminurie was respectievelijk RR= 0,39 ((0,23; 0,67); n= 378 deelnemers), en RR= 0,49 ((0,34; 0,70); n= 3.590 deelnemers) in het voordeel van de RAAS-remmers.
Normotensieve versus hypertensieve patiënten.
Het beperken van de netwerk meta-analyse voor totale mortaliteit (Palmer, 2015) tot personen met hypertensie (14 van de 33 RCT’s) heeft nauwelijks invloed op de effectschattingen en geen invloed op de conclusies. Voor een analyse van eindstadium nierfalen bij personen met hypertensie zijn maar twee RCT’s beschikbaar, de effectschattingen zijn vergelijkbaar met die in de hoofdanalyse maar de betrouwbaarheidsintervallen zijn breed. De conclusies uit de hoofdanalyse met betrekking tot mortaliteit zijn daarmee waarschijnlijk van toepassing op personen met hypertensie, dit is minder zeker voor conclusies met betrekking tot eindstadium nierfalen bij personen met hypertensie. Een aparte analyse bij personen met normotensie ontbreekt in Palmer (2015) en het is daarom onzeker in hoeverre de conclusies gelden voor normotensieve personen. Ook in de SR van Farmer (2014) ontbreekt een analyse specifiek voor personen met hypertensie of normotensie op baseline.
Bewijskracht van de literatuur
De bewijskracht (GRADE-methodiek) is bepaald per vergelijking en uitkomstmaat, en is in alle gevallen gebaseerd op resultaten uit gerandomiseerd onderzoek en start derhalve hoog. Vervolgens is de bewijskracht verlaagd als er sprake was van relevante tekortkomingen op een of meerdere GRADE-domeinen: risk of bias, inconsistentie, indirectheid, imprecisie, publicatiebias (zie Werkwijze op het tabblad Verantwoording).
De nummering verwijst naar de opeenvolgende literatuurconclusies:
- De bewijskracht is verlaagd met 1 niveau vanwege imprecisie (overlap met grens klinische relevantie); bewijskracht is REDELIJK.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (een enkele RCT); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (zeer breed BI voor netwerk effectschatting, een enkele RCT voor head-to-head vergelijking); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau vanwege imprecisie (overlap met grens voor klinische relevantie); bewijskracht is REDELIJK.
- De bewijskracht is niet verlaagd; bewijskracht is HOOG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap BI’s netwerk effectschattingen, zeer breed BI voor head-to-head vergelijking); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap BI’s netwerk effectschattingen, zeer breed BI voor head-to-head vergelijking); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap BI’s netwerk effectschattingen, zeer breed BI voor head-to-head vergelijking); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau vanwege RoB (overwegend zeer kleine studies); bewijskracht is REDELIJK
- De bewijskracht is verlaagd met 1 niveau vanwege imprecisie (overlap met grens klinische relevantie); bewijskracht is REDELIJK.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met nul-effect); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau vanwege indirectheid en 1 niveau vanwege imprecisie (alleen indirecte vergelijkingen, overlap met grens klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met grenzen voor klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau vanwege indirectheid en 1 niveau vanwege imprecisie (alleen indirecte vergelijkingen, overlap met grens klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau vanwege indirectheid en 1 niveau voor imprecisie (alleen indirecte vergelijkingen, overlap met grens klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met grenzen voor klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau vanwege imprecisie (overlap met grens klinische relevantie); bewijskracht is REDELIJK.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met nul-effect); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met grenzen voor klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met grenzen voor klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met nul-effect); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met grenzen voor klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (onvoldoende data beschikbaar); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met grenzen voor klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met grenzen voor klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (onvoldoende data beschikbaar); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met grenzen voor klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau vanwege indirectheid en 1 niveau voor imprecisie (alleen indirecte vergelijkingen, overlap met grens voor klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (onvoldoende data beschikbaar); bewijskracht is LAAG.
- De bewijskracht is niet verlaagd; bewijskracht is HOOG.
- De bewijskracht is niet verlaagd; bewijskracht is HOOG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met beide grenzen voor een klinisch relevant effect); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (overlap met nul-effect); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau vanwege RoB (overwegend zeer kleine studies); bewijskracht is REDELIJK.
- De bewijskracht is verlaagd met 1 niveau voor RoB en 1 niveau voor imprecisie (overwegend zeer kleine studies, geringe studieomvang na pooling); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau voor RoB en 1 niveau voor imprecisie (overwegend zeer kleine studies, geringe studieomvang na pooling); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus voor imprecisie (overlap met grenzen voor klinische relevantie); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus voor indirectheid (gedateerde niet-Nederlandse kosteneffectiviteitsstudie); bewijskracht is LAAG.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (PICO):
P: volwassen patiënten met diabetes mellitus type 1 of type 2 en nefropathie;
I: RAAS-remmer(s) al dan niet gecombineerd met andere medicamenteuze bloeddrukverlager(s);
C: alternatieve interventies (zie I);
O: gunstige en ongunstige effecten van de interventies (zie ‘Relevante uitkomstmaten’).
De zoekvraag richt zich op de volgende vergelijkingen:
- Welke RAAS-remmer heeft primair de voorkeur? Vergelijking van een klasse RAAS-remmer (ACE-remmer, ARB, renineremmer, aldosteronantagonist) met een alternatieve klasse RAAS-remmer.
- Is er plaats voor dubbele RAAS-blokkade (twee klassen RAAS-remmer)? Vergelijking van enkelvoudige RAAS-blokkade met dubbele RAAS-blokkade.
- Welke combinatie van antihypertensiva naast RAAS-blokkade heeft de voorkeur? Vergelijking van RAAS-blokkade (enkelvoudig of dubbel) met RAAS-blokkade (enkelvoudig of dubbel) in combinatie met een ander antihypertensivum.
Relevante uitkomstmaten
De werkgroep achtte nierziekteprogressie (daling eGFR; stijging (verdubbeling van) serum creatinine; optreden eindstadium nierfalen, ESRD), toename proteïnurie (albuminurie), mortaliteit (totaal), hart- en vaatziekten (morbiditeit, mortaliteit), optreden acute nierschade (AKI) en overige diabetes-gerelateerde complicaties, cruciale uitkomstmaten voor de besluitvorming. Ziekenhuisopname, kwaliteit van leven (HRQoL) en patiënttevredenheid, adverse events (bijwerkingen, complicaties, ‘veiligheid’ van de interventie) en kosten (kosteneffectiviteit werden benoemd als belangrijke uitkomstmaten voor de besluitvorming. De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De huidige richtlijn focust op diabetische nefropathie en daarom is de literatuuranalyse met name gericht op renale eindpunten. Overige uitkomstmaten zoals cardiovasculaire eindpunten zijn eveneens van (groot) belang maar daarvoor wordt ook verwezen (zie Overwegingen) naar vigerende richtlijnen zoals de multidisciplinaire CVRM richtlijn (NHG/NIV/NVvC, 2019).
Als grenzen voor klinische relevantie werden de door de internationale GRADE working group voorgestelde default grenzen gehanteerd: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is, in een gecombineerde zoekactie voor beide submodules, op 22 februari 2018 met relevante zoektermen gezocht naar (systematische reviews van) RCT's die de effecten van bloeddrukmedicatie op het voorkomen en remmen van progressie van nierschade onderzochten bij personen met diabetes type 1 of type 2. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 587 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerd vergelijkend onderzoek bij volwassenen met diabetes mellitus type 1 of 2 en nefropathie (submodule Bloeddrukmedicatie bestaande nefropathie) of geen nefropathie (submodule Bloeddrukmedicatie preventie nefropathie; vergelijking van bloeddrukmedicatie met controle of alternatieve bloeddrukmedicatie; tenminste 1 jaar follow-up en tenminste 50 patiënten per groep; en rapportage van een relevante uitkomstmaat met betrekking tot nierschade. Studies naar interventies die niet primair waren gericht op bloeddrukverlaging (zoals pentoxifylline en statines) en klinisch onderzoek met niet-geregistreerde bloeddrukverlagers werden geëxcludeerd, evenals RCT’s met een cross-over design. Systematische reviews met afwijkende inclusiecriteria werden niet a priori uitgesloten als relevante sensitiviteits- of subgroepanalyses mogelijk waren. Op basis van titel en abstract werden in eerste instantie 138 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 134 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 4 studies definitief geselecteerd. Bij aanvang van de richtlijnontwikkeling is een oriënterende zoekactie uitgevoerd naar systematische reviews en richtlijnen met betrekking tot behandeling van diabetische nefropathie (zie werkwijze onder het tabblad verantwoording). Deze oriënterende zoekactie leverde een Cochrane review op naar de waarde van bloeddrukmedicatie bij preventie van nierschade bij personen met diabetes zonder nefropathie (Lv, 2012) die aan de literatuurselectie werd toegevoegd. In totaal zijn vijf onderzoeken opgenomen in de literatuuranalyse.
De literatuuranalyse voor submodule Bloeddrukmedicatie bestaande nefropathie is gebaseerd op twee systematische reviews (Palmer, 2015; Farmer, 2014) aangevuld met een recente RCT (Uzu, 2016). De literatuuranalyse voor submodule Bloeddrukmedicatie preventie nefropathie is gebaseerd op de Cochrane review uit de oriënterende zoekactie (Lv, 2012) aangevuld met relevante recentere RCT’s op basis van de systematisch review van Catalá-López (2016; deze SR maakt geen onderscheid tussen personen met nefropathie en personen zonder nefropathie) en de zoekactie, dit leverde een aanvullende RCT op (Uzu, 2016). De beoordeling van de individuele studieopzet (risk of bias) van de geselecteerde SR's en aanvullende RCT is opgenomen in de risk of bias tabellen. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. Voor de beoordeling van de individuele studieopzet (risk of bias) van de studies geïncludeerd in de systematische reviews en gedetailleerde studiekarakteristieken en resultaten wordt verwezen naar de respectievelijke systematische reviews.
Referenties
- Catalá-López F, Macías Saint-Gerons D, González-Bermejo D, et al. Cardiovascular and Renal Outcomes of Renin-Angiotensin System Blockade in Adult Patients with Diabetes Mellitus: A Systematic Review with Network Meta-Analyses. PLoS Med. 2016 Mar 8;13(3):e1001971. doi: 10.1371/journal.pmed.1001971. eCollection 2016 Mar. Review. Erratum in: PLoS Med. 2016 Jun;13(6):e1002064. PubMed PMID: 26954482; PubMed Central PMCID: PMC4783064.
- Farmer AJ, Stevens R, Hirst J, et al. Optimal strategies for identifying kidney disease in diabetes: properties of screening tests, progression of renal dysfunction and impact of treatment - systematic review and modelling of progression and cost-effectiveness. Health Technol Assess. 2014 Feb;18(14):1-128. doi: 10.3310/hta18140. Review. PubMed PMID: 24576414; PubMed Central PMCID: PMC4781444.
- FK (2019). Farmacotherapeutisch Kompas. Link: https://www.farmacotherapeutischkompas.nl/ (geraadpleegd 18 januari 2019).
- NfN (2018). Richtlijn Behandeling van patiënten met diabetes mellitus en chronische nierschade stadium 3b of hoger (eGFR < 45 ml/min/1,73 m2). Link: https://www.nefro.nl/sites/www.nefro.nl/files/richlijnen/DM%20bij%20CNS%203b%20of%20hoger%2C%202018.pdf (geraadpleegd 15 februari 2019).
- NHG/NIV/NVvC (2019). Cardiovasculair risicomanagement (CVRM). Richtlijnendatabase. Link: https://richtlijnendatabase.nl/richtlijn/cardiovasculair_risicomanagement_cvrm/samenvatting_richtlijn_cvrm.html (geraadpleegd 8 april 2019).
- NIV/NHG (2018). Richtlijn diagnostiek en beleid bij volwassenen met chronische nierschade (CNS). Richtlijnendatabase. Link: https://richtlijnendatabase.nl/richtlijn/chronische_nierschade_cns/startpagina_-_chronische_nierschade_cns.html (geraadpleegd 15 februari 2019).
- ONTARGET Investigators, Yusuf S, Teo KK, Pogue J, et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med. 2008 Apr 10;358(15):1547-59. doi: 10.1056/NEJMoa0801317. Epub 2008 Mar 31. PubMed PMID: 18378520.
- Palmer SC, Mavridis D, Navarese E, et al. Comparative efficacy and safety of blood pressure-lowering agents in adults with diabetes and kidney disease: a network meta-analysis. Lancet. 2015 May 23;385(9982):2047-56. doi: 10.1016/S0140-6736(14)62459-4. Review. PubMed PMID: 26009228.
- Uzu T, Araki SI, Kashiwagi A, et al; Shiga Committee for Preventing Diabetic Nephropathy. Comparative Effects of Direct Renin Inhibitor and Angiotensin Receptor Blocker on Albuminuria in Hypertensive Patients with Type 2 Diabetes. A Randomized Controlled Trial. PloS One. 2016 Dec 29;11(12):e0164936. doi: 10.1371/journal.pone.0164936. eCollection 2016. PubMed PMID: 28033332; PubMed Central PMCID: PMC5198982.
- Williams B, Mancia G, Spiering W, et al; ESC Scientific Document Group. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018 Sep 1;39(33):3021-3104. doi: 10.1093/eurheartj/ehy339. PubMed PMID: 30165516.
- Williams B, Mancia G, Spiering W, et al. 2018 Practice Guidelines for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. Blood Press. 2018 Dec;27(6):314-340. doi: 10.1080/08037051.2018.1527177. Review. Erratum in: Blood Press. 2019 Feb;28(1):74. PubMed PMID: 30380928.
Evidence tabellen
Risk of bias table for intervention studies (randomized controlled trials)
Research question: What is the optimal blood pressure medication to prevent progression of kidney damage in diabetic patients with nephropathy?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Uzu, 2016 |
computer-generated list of random numbers |
Unlikely |
Unlikely*1 |
Likely*1 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
*1 Open-label RCT (no blinding); absence of blinding may result in a difference in intensity of treatment to reach target 130/80 mmHg; biochemical outcome (UACR) not influenced by patient unblinding; note: insufficient power, posthoc subgroup analysis, mixed population (>50% also uses a calcium channel blocker); overall high risk of bias
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher,2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: What is the optimal blood pressure medication to prevent kidney damage in diabetic patients without nephropathy, and to prevent progression of kidney damage in diabetic patients with nephropathy?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Palmer, 2015 |
Yes |
Yes |
Yes*1 |
Yes |
Not applicable |
Yes*1 |
Yes*1 |
Yes |
Unclear*1 |
|
Farmer, 2014 |
Yes |
Yes |
Yes*2 |
Yes |
Not applicable |
Unclear*2 |
Yes*2 |
Unclear*2 |
Unclear*2 |
*1 reasons for exclusion mentioned but not described per individual study; RoB assessed but only reported across all included studies (sensitivity analyses are provided for all-cause mortality and ESRD, limiting inclusion to studies with adequate allocation concealment, or excluding trials with premature trial termination); data DM1 and DM2, micro- and macroalbuminuria, with and without hypertension on baseline, pooled (but sensitivity analyses provided for all-cause mortality and ESRD); COI mentioned for review authors but not for trials included in the systematic review.
*2 reasons for exclusion mentioned but not described per individual study; RoB assessed but only reported in general terms and without reference to individual studies (but sensitivity analyses provided for urinary albumin excretion, limiting inclusion to trials with double blinding, or to trials with at least 200 participants); separate analyses for DM1 and DM2 and patients without or with nephropathy (normo- versus micro-albuminuria); stated that ‘ there was little or no evidence of publication bias’ but without presenting further details; COI mentioned for review authors but not for trials included in the systematic review.
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Evidence table
Research question: What is the optimal blood pressure medication to prevent progression of kidney damage in diabetic patients with nephropathy?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Systematic reviews with data obtained in diabetic patients with nephropathy (micro- or macroalbuminuria) |
|||||||
|
Palmer, 2015 |
SR and meta-analysis of RCTs (network meta-analysis)
Literature search up to January 2014
157 studies in network meta-analysis
Study design: RCT (parallel)
Setting and Country: see Suppl appendix Palmer, 2015
Source of funding and conflicts of interest: SR non-commercial/ no serious COI; not reported for included RCTs |
Inclusion criteria SR: parallel-group RCTs comparing any orally administered BP-lowering agent, alone or in combination, with a second blood pressure agent or combination, placebo, or control; follow-up at least 8 weeks; fixed-dose or flexible-dose; adults with diabetes and chronic kidney disease (KDIGO criteria)
Exclusion criteria SR: participants with kidney transplantation or dialysis
188 studies in SR, 157 studies (43,256 participants) in network meta-analysis
Important patient characteristics at baseline:
53 studies on macroalbuminuria (9,445 patients), and 102 studies on microalbuminuria (15,576 patients), 9 studies (17,258 participants) terminated early
N, mean age Overall 52.5 yrs
For more details see Suppl appendix Palmer, 2015 |
ACE inhibitor, ARB, calcium-channel blocker, β blocker, α blocker, diuretic, renin inhibitor, aldosterone antagonist, or endothelin inhibitor, alone or in combination
See Palmer, 2015 (Suppl. appendix) for details on individual studies
|
Second blood pressure agent or combination, placebo, or control |
End-point of follow-up: Varies from 3 to 71 months
See Palmer, 2015 (Suppl. Appendix p16) for details on individual studies
Methods (statistiscs): Standard pairwise meta-analysis (random-effects model) and network meta-analysis using a frequentist model;
See Suppl appendix Palmer:
Consistency in networks assessed within every closed triangular or quadratic loop as difference between direct and indirect estimates for a specific treatment comparison (inconsistency factor): inconsistent loops are those yielding a 95% CI excluding zero.
Generalisability assessed in sensitivity analysis by restricting analyses to type 1 or type 2 diabetes; microalbuminuria; macroalbuminuria; hypertensive participants; adequately concealed allocation; follow-up longer than 24 months; and not terminated prematurely.
Ranking of treatments for an outcome determined using surface under the cumulative ranking (SUCRA) probabilities |
Prim outcomes all-cause mortality and end-stage kidney disease (need for dialysis or kidney transplantation); sec outcomes MI, stroke, CV mortality, blood pressure, doubling of serum creatinine, regression of albuminuria, acute kidney injury, adverse events (hyperkalaemia (serum potassium >5·5 mmol/L), presyncope, cough, and peripheral oedema), acute kidney injury
Treatments were ranked using surface under the cumulative ranking (SUCRA)
See Palmer, 2015 (Suppl appendix) for a description of outcomes in included studies
See guideline text for a summary of results from standard pairwise meta-analysis and network meta-analysis (frequentist model; random-effects)
Note: Authors present clinical implications based on comparison with placebo and estimation of absolute effects (note: not clear what baseline risks were used, and imprecision of the effect estimates not taken into account); estimation is based on following network estimates (OR): outcome ESKD: ARB+ACEi 0·62 (0·43–0·90) ARB alone 0·77 (0·65–0·92) regression albuminuria: ARB+ACEi 5·16 (1·32-20·2) ARB alone 3·37 (1·77-6·40) outcome hyperkalaemia: ARB+ACEi 2·69 (0·97–7·47) ARB alone 1·88 (0·86-4·12) outcome AKI: ARB+ACEi 2·69 (0·98–7·38) ARB alone 1·54 (0·58-4·06) Absolute implications: - ACEi+ARB instead of placebo in 1000 patients for 1 year might prevent 14 patients ESKD and induce regression of albuminuria in 208 people, at the cost of 55 patients having AKI and 135 individuals developing hyperkalaemia. - Treatment with ARB alone might prevent 11 cases of ESKD, induce regression of albuminuria in 118 people, but lead to AKI in 17 patients and hyperkalaemia in 70 individuals. |
Authors conclude that no blood pressure-lowering strategy prolonged survival in adults with diabetes and kidney disease; ACE inhibitors and ARBs, alone or in combination, were the most effective strategies against ESKD; any benefits of combined ACE inhibitor and ARB treatment need to be balanced against potential harms of hyperkalaemia and acute kidney injury
Note:: high SUCRA ranking of combined ACE inhibitor and calcium-channel blocker treatment suggests that future trials of this drug combination are needed and would strongly inform clinical practice; surveillance for treatment-related acute kidney injury and hyperkalaemia is important
Note: most studies and the great majority of patients included in the network meta-analysis have DM2, e.g. only 5 out 33 RCTs for mortality present data for DM1, and only 1 out of 13 for ESKD); conclusions for DM1 are uncertain (see guideline text for details)
RoB: Cochrane tool, only summary graph across all studies provided; ‘Overall 65% of information for all-cause mortality and 89% for ESKD judged low risk; sens analysis showed no major tendency for smaller studies to over- or underestimate active treatment effects’
Sensitivity analyses (for primary outcomes: mortality and ESKD): microalbuminuria only, macroalbuminuria only, hypertension only, follow-up >24 months, excluding premature trial termination, DM1 only, DM2 only (see Suppl appendix Palmer, 2015)
|
|
Farmer, 2014 |
SR and meta-analysis of RCTs (pairwise meta-analysis)
Literature search up to Aug 2010
49 studies in meta-analysis
Study design: RCT (parallel)
Setting and Country: see Table-6 in Farmer, 2014
Source of funding and conflicts of interest: SR non-commercial/ no serious COI; not reported for included RCTs |
Inclusion criteria SR: RCTs comparing ACEi or ARB (monotherapy) with placebo, no treatment or other anti-hypertensive (not ACEi or ARB); outcomes reported separately for DM1 and DM2; at least one outcome separately reported for normoalbuminuria or micro-/ macro-albuminuria; urinary albumin levels reported; follow-up at least 6 months
49 studies (34,082 patients) in SR
Important patient characteristics at baseline: DM1: 20 RCTs, 6 with normo-albuminuria (3 used ARBs), 15 with micro- or macroalbuminuria (none with ARBs) DM2: 28 RCTs, 10 with normo-albuminuria (3 used ARBs), 22 with micro- or macroalbuminuria (9 used ARBs)
For more details see Table 6 in Farmer, 2014 |
ACE inhibitor or ARB
See Farmer, 2014 (p19) for details on individual studies
|
Placebo, no treatment or other antihypertensive medication (not ACEi or ARB) |
End-point of follow-up: Varies from 6 months to 9 yrs see Table 6 in Farmer, 2014
Methods (statistiscs): Standard pairwise meta-analysis (both fixed and random effects estimates provided)
Sensitivity analysis: for UAE at end of trial (ratio of means), by restricting analyses to trials with double blinding, or to trails of at least 200 participants (separate analysis for DM1 and DM2, and normo-albuminuria versus micro/ macroalbuminuria
|
UAE at end trial; progression to microalbuminuria (30–300 mg/24 hours); progression to macroalbuminuria (> 300 mg/24 hours); regression from micro- to normoalbuminuria (< 30 mg/24 hours); all-cause mortality
See guideline text for a summary of results (random-effects)
|
Authors conclude that In DM1, results support strategy of initiating RAASI when kidney disease is detected. In DM2, RAASI has similar albumin-lowering effects in those with and without kidney disease, and RAASI treatment of DM2 patients with normo-albuminuria may be beneficial in terms of progression to microalbuminuria
RoB: authors state RoB was assessed but provide no data; sensitivity analyses were performed limiting analysis to double blinded studies, or to larger studies (at least 200 participants); authors state that there was ‘little or no evindence of publication bias’ (no details provided)
|
|
Supplementary RCTs (published after the search date in the systematic reviews) |
|||||||
|
Uzu, 2016
SMART-2
NCT01461499
|
RCT; parallel group; open-label
Dec 2011 – Nov 2013
University medical centre, ‘multi-centre’; Japan
Funding and conflicts of interest: non-commercial; no obvious COIs |
Inclusion criteria: hypertensive (taking anti-hypertensive treatment or SBP/DBP > 130/80 mmHg) adult patients with DM2; high-normal albuminuria (urinary albumin-to-creatinine ratio (UACR) >10 and <30 mg/g) or microalbuminuria (UACR >30 and <300 mg/g).
Exclusion criteria: severe hypertension (> 180/110 mmHg),malignant hypertension, known secondary hypertension; hyperkalemia at baseline; history GI tract surgery
N total at baseline: 237 randomized Intervention: 119 Control:118 Resp 8 and 4 withdrew during screening period
Analytic sample: 111/114
Important prognostic factors2: I/C age: 62.9/ 63.0 female: 31/29% SBP: 137.1/ 140.0 DBP: 77.0/ 76.4 eGFR: 79.6/ 76.3 UACR: I: 30.6 (26.1; 35.8) C: 33.0 (27.9; 39.0)
Groups comparable at baseline? Unclear (ARB group with slightly higher SBP and worse eGFR)
Note: posthoc subgroup analysis, ‘high-normal’ versus ‘microalbuminuria’; the ARB group with micro-albuminuria has higher SBP (DRI 134.5/ ARB 142.4), worse eGFR (79.2/ 73.9) and worse UACR (66.6/ 76.1) |
Aliskiren (DRI, direct renin inhibitor)
N=111
Protocol: 8-week screening period; RAAS blockers stopped (>50% used DRI or ARB before trial) but other antihypertensive medication continued (>50% uses CCB); treatment with target SBP/DBP of 130/80 mmHg |
ARB (‘any ARB’)
N= 114
ARB not further specified
Protocol: see intervention |
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: 8 (7%) Control: 4 (3,4%)
during screening (no reasons provided)
|
UACR (% change to baseline; CI or IQR), urinary angiotensinogen excretion (see Uzu, 2016); AE’s
UACR (% change) 95%CI I: -5.5% (-13.5 to 2.5) C: -6.7% (-20.3 to 0.6) Diff: 1,2% (-9,5; 11,9) statistically not significant (NS)
Subgroup analysis
‘high-normal’ albiminuria Defined as 10-30 mg/g UACR IQR (95%CI not provided) I: -4.3% (IQR=(-8.6; 0.2)) C: -4.8% (IQR=(-9.6; -0.9) Diff: 0,5% in favour of control NS
Microalbuminuria Defined as 30-300 mg/g UACR IQR (95%CI not provided) I: -11,2% (IQR=(-29,1; 23,8)) C: -20,5% (IQR=(-53,6; 2,6) Diff: 9.3% in favour of control NS
Adverse events (AEs) I: 5 events C: 6 events Not serious (mainly infectious disease, elevated liver enzymes, gastrointestinal Symptoms); hyperkalemia not reported; no deaths
|
Authors conclude DRI and ARB reduced albuminuria in hypertensive DM2 patients; ARB, but not DRI, reduced albuminuria even in patients with normal albuminuria. DRI is not superior to ARB
but note insufficient statistical power to exclude a clinically relevant difference; also note that the differences in effect sizes between DRI and ARB are statistically not significant, i.e. author conclusions are questionable
Note: open-label i.e. no blnding; >50% patients used RAAS blocker (DRI or ARB) before trial i.e. were not naïve to the interventions; >50% uses a calcium channel blockker (CCB) which is not discontinued during the trial
Note: subgroup analysis was added posthoc (i.e. is not registered in the trial registry); there are considerable differences between DRI and ARB groups at baseline in the microalbiminuria subgroup
Note: power calculation (based on mean 20% difference in UACR outcome between intervention and control) indicates power is (just) insufficient for overall analysis; power for subgroup analysis is clearly too low |
Tabel Exclusie na het lezen van het volledige artikel (submodules Bloeddrukmedicatie bestaande nefropathie en Bloeddrukmedicatie preventie nefropathie)
|
Auteur en jaartal |
Redenen van exclusie |
|
Mogelijke SR’s |
|
|
Nistor, 2018 |
Verkeerde PICO (submodule Bloeddrukmedicatie bestaande nefropathie, verkeerde vergelijking) |
|
Levy, 2018 |
Geen SR (narrative review) |
|
Zheng, 2017 |
Verkeerde PICO (patiënten met en zonder nefropathie); beperkte SR overlapt met Palmer, 2014 |
|
Thomopoulos, 2017 |
Verkeerde PICO (vergelijking personen met en zonder DM) |
|
Sun, 2017 |
SR zonder meerwaarde ten opzichte van Palmer, 2014 |
|
Strauss, 2017 |
Geen SR of RCT |
|
Huang, 2017 |
SR van mindere kwaliteit, zonder meerwaarde ten opzichte van Palmer, 2014 |
|
Brunstrom, 2017 |
SR van SR’s |
|
Prescrire, 2017 |
Geen SR of RCT |
|
Xie, 2016 |
Verkeerde PICO (verkeerde uitkomstmaat) |
|
Takahashi, 2016 |
SR zonder meerwaarde ten opzichte van Palmer, 2014 |
|
Staff, 2016 |
Geen SR (erratum) |
|
Shih, 2016 |
Geen SR of RCT; verkeerde PICO |
|
Shen, 2016 |
SR van SR’s |
|
Persson, 2016 |
Beperkte SR zonder meerwaarde ten opzichte van Lv, 2012 en Farmer, 2014 |
|
Isaacs, 2016 |
Geen SR (narrative review) |
|
Feng, 2016 |
Geen SR (narrative review) |
|
Bangalore, 2016 |
Verkeerde PICO (verkeerde vergelijking) |
|
Wombwell, 2015 |
Geen SR (narrative review) |
|
Tian, 2015 |
Verkeerde PICO (verkeerde interventie) |
|
Simó, 2015 |
Geen SR (narrative review) |
|
Sato, 2015 |
Geen SR (narrative review) |
|
Ren, 2015 |
Beperkte SR zonder meerwaarde ten opzichte van Palmer, 2014 |
|
Jeffers, 2015 |
Verkeerde PICO (verkeerde vergelijking) |
|
Bolignano, 2015 |
Geen SR (narrative review) |
|
Persson, 2014 |
Geen SR (narrative review) |
|
Mavrakanas, 2014 |
Beperkte SR van mindere kwaliteit, zonder meerwaarde ten opzichte van Palmer, 2014 |
|
Harel, 2014 |
Geen SR (commentaar) |
|
Hao, 2014 |
Verkeerde PICO (geen renale uitkomstmaten) |
|
Cheng, 2014 |
Verkeerde PICO (geen renale uitkomstmaten) |
|
Mogelijke RCT’s |
|
|
Wanner, 2018 |
Verkeerde PICO (brede patiëntengroep niet beperkt tot DM) |
|
Lindhardt, 2018 |
Verkeerde PICO (verkeerde uitkomstmaat; proteomics) |
|
Kristensen, 2018 |
Verkeerde PICO (geen renale uitkomstmaten) |
|
Heerspink, 2018 |
Geen RCT (protocol) |
|
Seher, 2017 |
RCT van lage kwaliteit (Pakistaans, geen volledige tekst beschikbaar) |
|
Sarafidis, 2017 |
Geen SR (narrative review) |
|
Marcovecchio, 2017 |
Verkeerde PICO (adolescenten) |
|
Kim, 2017 |
Verkeerde PICO (verkeerde uitkomstmaat; oxidatieve stress) |
|
Hwang, 2017 |
Verkeerde PICO (verkeerde vergelijking); <50 deelnemers per groep |
|
Hou, 2017 |
Verkeerde PICO (verkeerde uitkomstmaat); <50 deelnemers per groep |
|
Hanon, 2017 |
Verkeerde PICO (verkeerde vergelijking) |
|
Furat, 2017 |
<50 deelnemers per groep |
|
Drawz, 2017 |
Geen RCT of SR |
|
De Boer, 2017 |
Geen RCT of SR |
|
Aggarwal, 2017 |
Geen RCT of SR |
|
Zhu, 2016 |
Verkeerde PICO (verkeerde vergelijking) |
|
Tanamas, 2016 |
Geen RCT (follow-up analyse van RCT; RCT is opgenomen in Palmer, 2015) |
|
Sternlicht, 2016 |
Geen RCT of SR |
|
Shah, 2016 |
Verkeerde PICO (verkeerde interventie; minocyline) |
|
Schmieder, 2016 |
Geen RCT of SR; verkeerde PICO |
|
Schievink, 2016 |
Geen RCT of SR (model voor progressie nefropathie) |
|
Ruilope, 2016 |
Verkeerde PICO (verkeerde vergelijking) |
|
Karashima, 2016 |
Verkeerde PICO (verkeerde vergelijking); <50 deelnemers per groep |
|
Heerspink, 2016a |
Secundaire analyse van RCT die is opgenomen in Palmer, 2015 |
|
Heerspink, 2016b |
Posthoc analyse van RCT die is opgenomen in Palmer, 2015 |
|
Chan, 2016 |
Geen RCT of SR (narrative review) |
|
Barzilay, 2016 |
Geen RCT of SR |
|
Zhang, 2015 |
Verkeerde PICO (verkeerde vergelijking) |
|
Yacoub, 2015 |
Geen RCT of SR (narrative review) |
|
Wong, 2015 |
Geen RCT of SR (cohortstudie) |
|
van Hateren, 2015 |
Geen RCT of SR (cohortstudie) |
|
Usuelli, 2015 |
Geen RCT of SR |
|
Toth-Manikowski, 2015 |
Geen RCT of SR (narrative review) |
|
Tawaramoto, 2015 |
Verkeerde PICO (verkeerde vergelijking); <50 deelnemers per groep |
|
Takihata, 2015 |
Verkeerde PICO (verkeerde vergelijking) |
|
Suzuki, 2015 |
Geen RCT of SR (narrative review) |
|
Singh, 2015 |
<50 deelnemers per groep |
|
Quiroga, 2015 |
Geen RCT of SR (narrative review) |
|
Puri, 2015 |
Verkeerde PICO (geen renale uitkomstmaten); posthoc analyse |
|
Momeni, 2015 |
<50 deelnemers per groep |
|
Molitch, 2015 |
Geen RCT of SR (narrative review) |
|
Lv, 2015 |
Geen RCT of SR (narrative review) |
|
Liu, 2015 |
Geen RCT of SR (narrative review) |
|
Leehey, 2015 |
Geen RCT of SR; verkeerde PICO (verkeerde uitkomstmaat) |
|
Laffin, 2015 |
Geen RCT of SR (narrative review) |
|
Kumar, 2015 |
<50 deelnemers per groep |
|
Kumar, 2015b |
Verkeerde PICO (verkeerde uitkomstmaat); zeer lage kwaliteit |
|
Kröpelin, 2015 |
Verkeerde PICO (verkeerde vergelijking en uitkomstmaat) |
|
Kato, 2015 |
<50 deelnemers per groep |
|
Jerums, 2015 |
Geen RCT of SR; verkeerde PICO (verkeerde uitkomstmaat) |
|
Imbalzano, 2015 |
Verkeerde PICO (verkeerde vergelijking) |
|
Hobeika, 2015 |
Geen RCT of SR; verkeerde PICO (verkeerde vergelijking) |
|
Hanon, 2015 |
Verkeerde PICO (verkeerde vergelijking) |
|
Færch, 2015 |
Geen RCT of SR; verkeerde PICO (verkeerde interventie en uitkomstmaat) |
|
Dushay, 2015 |
Verkeerde PICO (verkeerde uitkomstmaat) |
|
Dunkler, 2015 |
Geen RCT of SR (predictiemodel) |
|
Derosa, 2015 |
Verkeerde PICO (verkeerde vergelijking) |
|
Chen, 2015 |
Verkeerde PICO (verkeerde interventie en uitkomstmaat) |
|
Bakris, 2015 |
Niet-geregistreerd geneesmiddel (finerenone); nog in stadium van klinisch onderzoek |
|
Yamamoto, 2014 |
Geen RCT of SR (cohortstudie) |
|
Tuttle, 2014 |
Geen RCT of SR (narrative review) |
|
Tonolo, 2014 |
Geen RCT of SR (narrative review) |
|
Tanaka, 2014 |
Geen RCT of SR (cohortstudie) |
|
Spinar, 2014 |
Verkeerde PICO (verkeerde interventie en patiëntengroep) |
|
Smink, 2014 |
Geen RCT of SR (predictiemodel) |
|
Simonyi, 2014 |
Geen RCT of SR (observationeel) |
|
Shiffman, 2014 |
Geen RCT of SR; verkeerde PICO (verkeerde interventie) |
|
Satirapoj, 2014 |
Geen RCT of SR (narrative review) |
|
Ruilope, 2014 |
Geen RCT of SR (design van RCT) |
|
Rossen, 2014 |
Verkeerde PICO (verkeerde interventie) |
|
Roscioni, 2014 |
Geen RCT of SR (narrative review) |
|
Renke, 2014 |
Verkeerde PICO (verkeerde uitkomstmaat); <50 deelnemers per groep |
|
Raff, 2014 |
Verkeerde PICO (verkeerde uitkomstmaat) |
|
Netchessova, 2014 |
Geen RCT of SR (observationeel) |
|
Menne, 2014 |
Geen RCT of SR (observationeel; follow-up studie van RCT) |
|
McMullan, 2014 |
Geen RCT of SR (observationeel; posthoc analyse) |
|
McCoy, 2014 |
Geen RCT of SR (commentaar) |
|
Marcovecchio, 2014 |
Geen RCT of SR (screening voor RCT) |
|
Makhlough, 2014 |
Verkeerde PICO (verkeerde vergelijking); <50 deelnemers per groep |
|
Luft, 2014 |
Geen RCT of SR (narrative review) |
|
Lovshin, 2014 |
Geen RCT of SR (narrative review) |
|
Ljungberg, 2014 |
Geen RCT of SR (observationeel) |
|
Lambers Heerspink, 2014 |
Geen RCT of SR (observationeel) |
|
Kwakernaak, 2016 |
Verkeerde PICO (verkeerde interventie; zoutrestrictie); <50 deelnemers per groep |
|
Kitada, 2014 |
Geen RCT of SR (narrative review) |
|
Ivanov, 2014 |
Geen RCT of SR (cohortstudie) |
|
Horwitz, 2014 |
Geen RCT of SR (‘recent trial results’) |
|
Hirakawa, 2014 |
Geen RCT of SR (observationeel) |
|
Hamed, 2014 |
<50 deelnemers per groep |
|
Graham, 2014 |
Geen RCT of SR (Medicare cohort) |
|
Gosmanov, 2014 |
Geen RCT of SR (narrative review) |
|
Fried, 2014 |
Geen RCT of SR (commentaar) |
|
Fogari, 2014 |
Verkeerde PICO (verkeerde vergelijking) |
|
Fernandez-Fernandez, 2014 |
Geen RCT of SR (narrative review) |
|
Dhakarwal, 2014 |
Geen RCT of SR (narrative review) |
|
De Boer, 2014 |
Geen RCT of SR (observationeel) |
|
Daikuhara, 2014 |
Geen RCT of SR (2 parallelle cohorts) |
|
Chalmers, 2014 |
Verkeerde PICO (verkeerde vergelijking) |
|
Camelo Castillo, 2014 |
Geen RCT of SR |
|
Bjornstad, 2014 |
Geen RCT of SR (narrative review) |
|
Ando, 2014 |
Verkeerde PICO (niet-diabeten) |
|
Agabiti-Rosei, 2014 |
Verkeerde PICO (verkeerde vergelijking) |
|
Advani, 2014 |
Geen RCT of SR (narrative review) |
|
Ghazi, 2014 |
Geen RCT of SR (narrative review) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-05-2020
Beoordeeld op geldigheid : 07-08-2020
Uiterlijk in 2022 bepaalt het bestuur van de Nederlandse Internisten Vereniging (NIV) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de module komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Bloeddrukmedicatie bestaande nefropathie |
NIV |
2020 |
2022 |
Eens in de twee jaar |
NIV |
Lopend onderzoek, beschikbaarheid nieuwe middelen |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Doel van de richtlijn is om een duidelijk en zoveel mogelijk evidence-based overzicht te bieden van kansen op nierschade bij diabetes, en de mogelijkheden om het proces richting (progressieve) nierschade te beïnvloeden, met aandacht voor de overeenkomsten en verschillen tussen volwassenen met diabetes mellitus type 1 (DM1) en volwassenen met diabetes mellitus type 2 (DM2). Doel is daarbij om de kansen op nierschade (met name als dit ook bijdraagt aan een verhoogde ziektelast) zo klein mogelijk te maken. In de laatste 20 jaar is er al veel bereikt, maar er zijn nog steeds mogelijkheden voor verbetering in preventie en behandeling, juist ook door consequente implementatie van reeds aanwezige kennis. De NIV richtlijn Diabetische nefropathie uit 2006 is verouderd. Dit project heeft ten doel de richtlijn diabetische nefropathie te herzien, zodat er een actuele en modulaire richtlijn diabetische nefropathie beschikbaar is. Daarnaast zal patiënteninformatie worden ontwikkeld die aansluit bij de informatie die al beschikbaar is op de website voor publieks- en patiënteninformatie Thuisarts.nl.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg en patiëntvoorlichting voor mensen (in het bijzonder volwassenen) met diabetes.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor personen met diabetische nefropathie (zie hiervoor de samenstelling van de werkgroep). De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. H.J.G. (Henk) Bilo, internist niet-praktiserend, Universitair Medisch Centrum, Groningen (voorzitter); Nederlandse Internisten Vereniging
- Dr. J. (Jan) Westerink, internist-vasculair geneeskundige, Universitair Medisch Centrum Utrecht, Utrecht; Nederlandse Internisten Vereniging
- Prof. dr. S.J.L. (Stephan) Bakker, internist-nefroloog, Universitair Medisch Centrum Groningen, Groningen; Nederlandse Internisten Vereniging en Nederlandse Federatie voor Nefrologie
- Dr. E.K. (Ellen) Hoogeveen, internist-nefroloog, Jeroen Bosch Ziekenhuis, Den Bosch, en UMC Leiden (nefrologie en epidemiologie); Nederlandse Internisten Vereniging en Nederlandse Federatie voor Nefrologie
- Dr. H. (Henk) Boom, internist-nefroloog, Reinier de Graaf Ziekenhuis, Delft; Nederlandse Internisten Vereniging en Nederlandse Federatie voor Nefrologie
- P.M. (Pauline) Heijstee, huisarts en kaderarts diabetes, Huisartsenpraktijk Lambermon&Heijstee, Rosmalen; Nederlands Huisartsen Genootschap
- J.M. (Anne-Margreeth) Krijger-Dijkema, apotheker, Apotheek Stevenshof, Leiden; Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie en Nederlandse Vereniging van Ziekenhuisapothekers
- P. (Petra) Philipse, diabetesverpleegkundige, Tergooi Ziekenhuis, Hilversum; Verpleegkundigen & Verzorgenden Nederland
- E. (Eglantine) Barents, senior beleidsmedewerker Diabetesvereniging Nederland, Leusden; Diabetesvereniging Nederland
- C. (Cora) van Dorp, patiëntvertegenwoordiger Diabetesvereniging Nederland, Leusden; Diabetesvereniging Nederland
Klankbordgroep
- Prof dr. S.P. (Stefan) Berger, internist-nefroloog, Hoofd Nier en Pancreastransplantatieprogramma, Universitair Medisch Centrum Groningen, Groningen; Nederlandse Internisten Vereniging en Nederlandse Federatie voor Nefrologie
- Dr. A.P.M. (Angèle) Kerckhoffs, Internist-ouderengeneeskunde, internist-nefroloog, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch; Nederlandse Internisten Vereniging
- N. (Nienke) Snitjer, specialist ouderengeneeskunde GERION/afdeling huisartsengeneeskunde en ouderengeneeskunde, VUmc en Amstelring Amsterdam; Verenso
Met ondersteuning van
- Dr. K.N.J. (Koert) Burger, epidemioloog, senior adviseur Kennisinstituut Federatie van Medisch Specialisten
- L. (Linda) Niesink (MSc), medisch informatiespecialist Kennisinstituut, Federatie van Medisch Specialisten
- N.F. (Natalia) Bullock, secretaresse, Kennisinstituut Federatie van Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd (KNAW/KNMG/GR/NHG/FMS, 2016). Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bilo (voorzitter) |
Hoogleraar inwendige geneeskunde UMC Groningen (nulaanstelling), directeur Kenniscentrum voor Ketenzorg Zwolle (deels betaald) |
Lid Stichting Langerhans (deels betaald), aandeelhouder IPADIC (organisatie opgezet om een nieuw model implanteerbare insulinepomp te ontwikkelen), directeur onderzoekstichting chronische ziekten in Zwolle (waarbij op basis van eigen vragen, maar ook op basis van vragen van derden , dus ook de farmaceutische industrie) data worden geanalyseerd afkomstig uit het databestand van het Kenniscentrum en de met andere partijen gekoppelde gegevens (bv Vektis, ziekenhuis, IKNL) |
Het overgrote deel van het onderzoek wordt voorgelegd aan de METC. Als het gaat om de contracten op farmaceutisch gebied, dan wordt er op projectbasis gewerkt aan projecten voor Novo Nordisk, Sanofi Aventis en MSD. Deze samenwerkingsverbanden worden omschreven in een onderzoeksopzet, vastgelegd in contracten die aan alle wettelijke eisen voldoen, en waar opportuun voorgelegd aan de METC. Er zijn geen door de farmaceutische industrie ondersteunde onderzoeken, die betrekking hebben op de onderwerpen zoals aan de orde komend in de NIV-richtlijn diabetische nefropathie. Wel betrokkenheid met een door de Nierstichting gesubsidieerd promotie traject gericht op het uit VEKTIS data opbouwen van een nieratlas voor Nederland. Echter, ook hierbij geen belangen die elkaar raken. |
Geen actie nodig (insulinepompen zijn geen onderwerp in de huidige richtlijn) |
|
Bakker |
Internist-Nefroloog werkgever: Universitair Medisch Centrum Groningen |
Lid van de vaste commissie Voeding van de Gezondheidsraad (onbetaald) |
Geen. In toekomst mogelijk betrokken bij trial over SGLT-2-remmers. |
Geen voortrekker op module SGLT-2-remmers |
|
Westerink |
Internist-vasculair geneeskundige, Universitair Medisch Centrum Utrecht |
Lid van de redactie van www.diabetesgeneeskunde.nl (onkostenvergoeding). De website geeft informatie over ontwikkelingen in de behandeling van diabetes met als focus POH/HA en internist. Voor ontwikkelen en onderhouden van deze website is sponsoring ontvangen van meerdere sponsoren. Op de website is meer informatie te vinden over de onafhankelijkheid van de website en de redactie. |
Momenteel en in het verleden ben ik lokale PI in meerdere door de farmacie gedreven studies geweest waarbij SGLT2 inhibitoren en een GLP1 analoog onderzocht werden/worden. In mijn hoedanigheid coördineerde ik de studie lokaal. Gelden voortkomend uit deze studies komen ten goede aan de afdeling vasculaire geneeskunde in het UMCU en niet aan mijn persoon. |
Geen voortrekker op module SGLT-2-remmers of GLP-1 analogen |
|
Krijger-Dijkema |
Openbaar apotheker (apotheek Stevenhof Leiden) en Senior onderzoeker Sir institute for Pharmacy Practice and Policy Leiden |
Lid Special Interest Group (SIG) diabetes KNMP en afgevaardigde (namens KNMP) in bestuur Nederlands diabetes federatie (NDF) (beide vacatiegelden). Lid Wetenschappelijke Advies Raad van het Diabetes Fonds (alleen reiskosten vergoeding). |
Geen |
Geen |
|
Phillipse-Visscher |
Gespecialiseerd verpleegkundige diabetes, ziekenhuis Tergooi, Hilversum |
Geen |
Geen |
Geen |
|
Heijstee |
Huisarts, huisartsenpraktijk Lambermon en Heijstee te Rosmalen |
Kaderarts diabetes zorggroep BeRoEmD (2 uur per week, betaald). Adviseur diabetes, Saltro eerstelijns diagnostisch centrum (1 dag/week, betaald). Kaderarts diabetes Beter in Bommelerwaard (1uur/maand, betaald). |
Geen |
Geen |
|
Hoogeveen |
Internist-nefroloog Jeroen Bosch Ziekenhuis, nefroloog-epidemioloog afdeling nefrologie en klinische epidemiologie LUMC |
Geen |
Geen |
Geen |
|
Dorp, van |
Ervaringsdeskundige namens Diabetesvereniging Nederland (DVN), Regiosecretaris bij DVN |
Ervaringsdeskundige: feedback vanuit patiëntenperspectief (onbetaald). Regiosecretaris DVN (onbetaald) |
Geen |
Geen |
|
Barents |
Senior beleidsadviseur Diabetesvereniging Nederland |
Bestuurslid Stichting BIDON (onbetaald). Werkgroep lid NHG standaard DM 2 (2017) en NIV richtlijn DM 2 in de 2de lijn (2017) |
Geen |
Geen |
|
Boom |
Internist-nefroloog, Reinier de Graaf Gasthuis, Delft |
Geen |
bijdrage (vergoeding gastvrijheid) van Farma/MD Roche Nederland B.V. voor lezing tijdens de nephroweek 2016 (San Diego); niet specifiek voor diabetes |
Geen |
|
Klankbordgroep leden (meelezers bij specifieke modules) |
||||
|
Kerckhoffs |
Internist nefroloog Jeroen Bosch ziekenhuis en Dialysecentrum Ravenstein; internist ouderen geneeskunde Jeroen Bosch Ziekenhuis |
Kerngroep interne ouderengeneeskunde NIV, sectie kwaliteit en richtlijnen (onbetaald) |
Geen |
Geen |
|
Berger |
Internist-nefroloog, hoofd onderafdeling nefrologie UMCG |
Bestuurslid Nefrovisie (onbetaald). Bestuurslid Groningen Transplantatie Centrum. Voorzitter Landelijk Overleg Niertransplantatie (onbetaald). |
Lid adviesraad Transplantatie Novartis |
Geen. Alleen meelezer op modules met betrekking tot nierfunctievervangende therapie en nier-pancreas-transplantatie. |
|
Snitjer |
Specialist ouderengeneeskunde (16 uur/week), Onderwijsontwikkelaar VUmc/geriatrie (20 uur/week) |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afvaardiging van Diabetesvereniging Nederland in de werkgroep. Nierpatiënten Vereniging Nederland en de Nierstichting (als stichting waarbinnen patiënten ook vaak hun stem laten horen) zijn eveneens gevraagd om knelpunten aan te leveren, en de conceptrichtlijn is voor commentaar voorgelegd aan genoemde organisaties.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten van de afzonderlijk (sub)modules. Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld (zie Indicatorontwikkeling onder Werkwijze).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een Invitational conference en een schriftelijke knelpuntanalyse op basis van het conceptraamwerk en de conceptnotulen van de invitational conference door: Nederlandse Internisten Vereniging, Nederlandse Federatie voor Nefrologie, Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, Nederlandse Vereniging van Ziekenhuisapothekers, Nederlandse Vereniging voor Klinische Geriatrie, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlands Huisartsen Genootschap, Verpleegkundigen & Verzorgenden Nederland, Diabetesvereniging Nederland, Nierpatiënten Vereniging Nederland, Nederlandse Diabetes Federatie, Bijwerkingencentrum Lareb, Inspectie Gezondheidszorg en Jeugd, Nederlandse Vereniging van Diëtisten, Diëtisten Nierziekten Nederland, en Vereniging Maatschappelijk Werk Nefrologie. Een verslag van de invitational conference en schriftelijke knelpuntanalyse met toelichting van de richtlijnwerkgroep is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (zie hiervoor Zoeken en selecteren onder Onderbouwing). In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van patiënten (patient values and preferences), kosten, aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’. Hierbij is gebruik gemaakt van het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016).
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit (Agoritsas, 2017; Neumann, 2016), en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Indicatorontwikkeling
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. Daarnaast werden de volgende verenigingen en organisaties benaderd voor commentaar: Nederlandse Vereniging voor Klinische Geriatrie, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nierpatiënten Vereniging Nederland, Nierstichting, Nederlandse Diabetes Federatie, Bijwerkingencentrum Lareb, Inspectie Gezondheidszorg en Jeugd, Nederlandse Vereniging van Diëtisten, Diëtisten Nierziekten Nederland, Vereniging Maatschappelijk Werk Nefrologie, Nefemed, Nederlandse Federatie van Universitair Medische Centra, Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse Vereniging voor Urologie, Nederlandse Vereniging voor Cardiologie, Nederlandse Vereniging van Ziekenhuizen, Zelfstandige Klinieken Nederland, Samenwerkende Topklinische opleidingsZiekenhuizen, Nederlandse Zorgautoriteit, Patiëntenfederatie Nederland, Vereniging Innovatieve Geneesmiddelen (voorheen Nefarma), Diagnostica Associatie Nederland (Diagned), Zorginstituut Nederland en Zorgverzekeraars Nederland. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas, T., Merglen, A., Heen, A. F., Kristiansen, A., Neumann, I., Brito, J. P., ... & Guyatt, G. H. (2017). UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ open, 7(11), e018593.
Alonso-Coello P, Oxman AD, Moberg J, et al.; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, et al.; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
KNAW/KNMG/GR/NHG/FMS (2016). Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling. Link: https://www.knaw.nl/shared/resources/actueel/publicaties/pdf/gedragscode-belangenverstrengeling
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. Link: https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Neumann I., Santesso N., Ak, EA, et al. (2016). A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. Journal of clinical epidemiology, 72, 45-55.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al, editors. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
Voor de gecombineerde zoekactie voor de submodule Bloeddrukmedicatie bestaande nefropathie (de huidige submodule), en de submodule Bloeddrukmedicatie preventie nefropathie
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2014 – februari 2018
Zoekdatum: 22-02-2018 |
1 exp *DIABETES MELLITUS/ or diabet*.ti. or t1dm.ti. or t2dm.ti. or dmt1.ti. or dmt2.ti. (351507) 2 Angiotensin-Converting Enzyme Inhibitors/ or exp Renin-Angiotensin System/ or (renin adj3 (angiotensin or at) adj3 (receptor antagonist* or receptor blocker* or system)).ab,ti. or aliskiren.ab,ti. or exp CAPTOPRIL/ or captopril.ab,ti. or exp ENALAPRIL/ or enalapril.ab,ti. or exp FOSINOPRIL/ or fosinopril.ab,ti. or exp LISINOPRIL/ or lisinopril.ab,ti. or PERINDOPRIL/ or perindopril.ab,ti. or quinapril.ab,ti. or exp RAMIPRIL/ or ramipril.ab,ti. or zofenopril.ab,ti. or candesartan.ab,ti. or eprosartan.ab,ti. or irbesartan.ab,ti. or exp LOSARTAN/ or losartan.ab,ti. or Olmesartan Medoxomil/ or olmesartan.ab,ti. or telmisartan.ab,ti. or exp VALSARTAN/ or valsartan.ab,ti. (79164) 3 1 and 2 (6212) 4 limit 3 to (english language and yr="2014 -Current") (917) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (344205) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1727799) 7 4 and 5 (51) 8 4 and 6 (292) 9 7 or 8 (315) = 315 |
587 |
|
Embase (Elsevier) |
((('diabetes mellitus'/exp/mj OR diabet*:ti OR t1dm:ti OR t2dm:ti OR dmt1:ti OR dmt2:ti)
AND ('angiotensin antagonist'/exp/mj OR 'renin angiotensin aldosterone system'/exp OR 'renin inhibitor'/exp OR 'renin angiotensin aldosterone system':ab,ti OR ((renin NEAR/3 (angiotensin OR at) NEAR/3 ('receptor antagonist*' OR 'receptor blocker*' OR system)):ab,ti) OR 'aliskiren'/exp OR aliskiren*:ab,ti OR 'captopril'/exp OR captopril*:ab,ti OR 'benazepril'/exp OR benazepril*:ab,ti OR 'enalapril'/exp OR enalapril*:ab,ti OR 'fosinopril'/exp OR fosinopril*:ab,ti OR 'lisinopril'/exp OR lisinopril*:ab,ti OR 'perindopril'/exp OR perindopril*:ab,ti OR 'quinapril'/exp OR quinapril*:ab,ti OR 'ramipril'/exp OR ramipril*:ab,ti OR 'zofenopril'/exp OR zofenopril*:ab,ti OR 'candesartan'/exp OR candesartan:ab,ti OR 'eprosartan'/exp OR eprosartan:ab,ti OR 'irbesartan'/exp OR irbesartan:ab,ti OR 'losartan'/exp OR losartan:ab,ti OR 'olmesartan'/exp OR olmesartan:ab,ti OR 'telmisartan'/exp OR telmisartan:ab,ti OR 'valsartan'/exp OR valsartan:ab,ti)
AND (english)/lim AND (2014-2018)/py NOT 'conference abstract':it)
AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)))
AND (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it))
= 492 (483 uniek) |
