Generieke module: Zorgpad chirurgie bij kwetsbare ouderen
Uitgangsvraag
Wat zijn kernelementen in het zorgpad chirurgie bij kwetsbare ouderen?
Aanbeveling
Aanbeveling-1
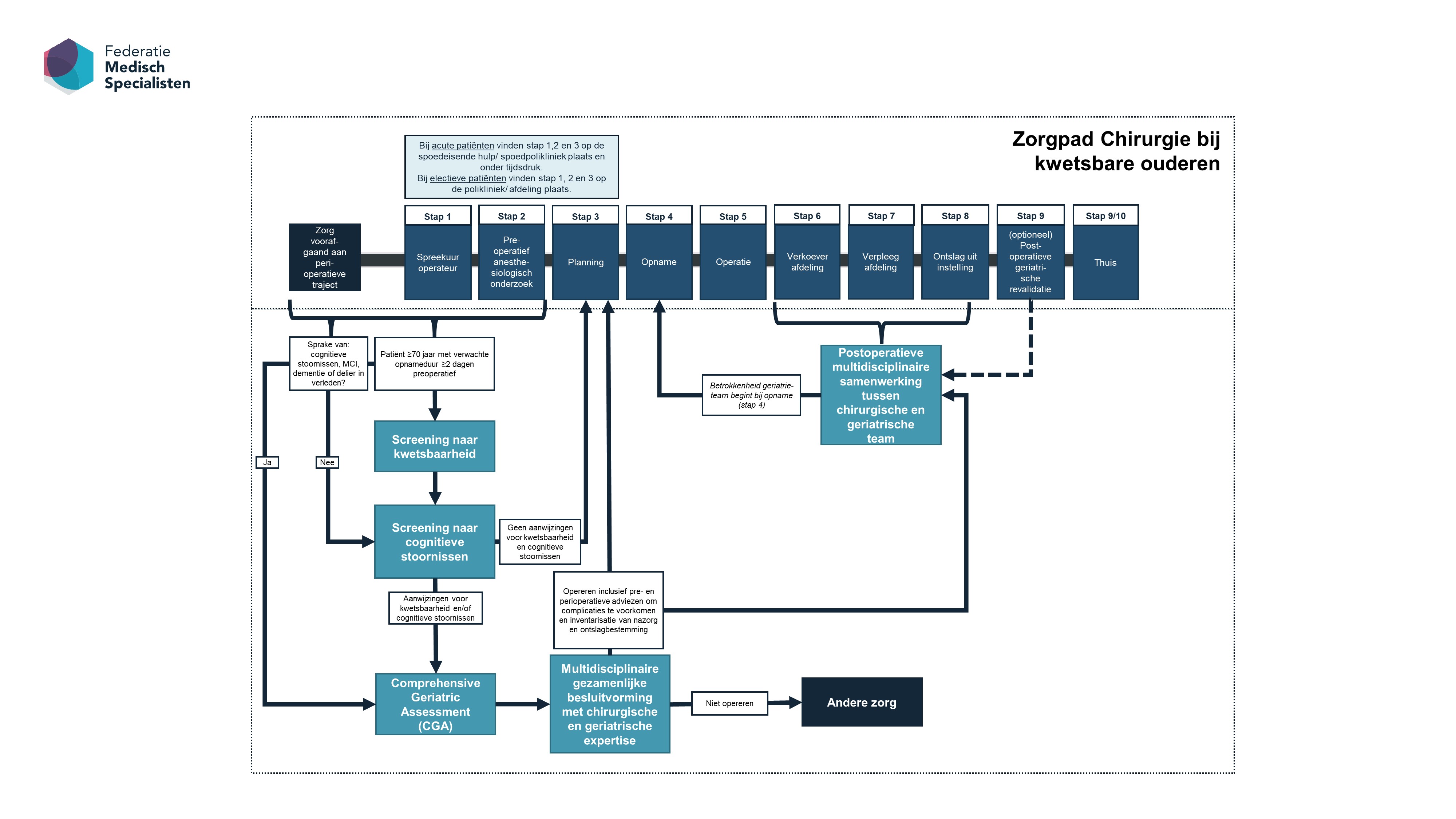
Stel in ieder ziekenhuis een zorgpad op voor (kwetsbare) ouderen die (mogelijk) een operatie moeten ondergaan met een verwachte opnameduur van ≥ 2 dagen. Onderdelen van dit zorgpad zijn (zie ook Figuur 1):
- Preoperatieve herkenning van kwetsbaarheid en cognitieve stoornissen bij ouderen met gebruik van screeningsinstrumenten (module 2).
- Multidisciplinaire besluitvorming voor kwetsbare ouderen door zorgverleners met expertise t.a.v. chirurgie, anesthesiologie en klinische geriatrie/interne geneeskunde-ouderengeneeskunde. Optioneel kan hierbij de eerste lijn worden betrokken. Patiënt en mantelzorger/naaste(n) of diens wettelijk vertegenwoordiger kunnen hierbij aanwezig zijn of na dit overleg door de hoofdbehandelaar worden gesproken (module 3).
- Multidisciplinaire postoperatieve samenwerking voor kwetsbare ouderen met:
- Monitoring en behandeling door zorgverleners met chirurgische en geriatrische competenties;
- Snelle en actieve bevordering van postoperatief herstel in een multidisciplinair team;
- Monitoren en behandelen van postoperatieve complicaties;
- Vroegtijdige planning van revalidatie en follow-up (beoordeling begint in de preoperatieve fase) (module 4).
Plan geen electieve chirurgische ingrepen in voor kwetsbare ouderen voordat de stappen van het zorgpad doorlopen zijn.
Gebruik deze generieke module als blauwdruk bij richtlijnen waarbij chirurgie een van de behandelopties is voor ouderen.
Aanbeveling-2
Maak transmurale afspraken over het borgen van een goede overdracht. Bij verwijzingen voor acute chirurgische problematiek (SEH) en electieve chirurgie (polikliniek) moeten ten minste onderstaande gegevens vermeld zijn voor patiënten van 70 jaar of ouder:
- Volledige medische voorgeschiedenis;
- Huidige medicatie;
- Laatste laboratorium onderzoek;
- Aan- of afwezigheid van gegevens over kwetsbaarheid (mobiliteitsproblemen, vallen, ADL afhankelijkheid, ondervoeding);
- Bekende dementie, cognitieve stoornissen of een doorgemaakt delier;
- Psychosociale problematiek of behandeling via de GGZ;
- Behandelwensen, -beperkingen en proactieve zorgplanning indien bekend.
Volg hierbij ook de afspraken en aanbevelingen uit de richtlijn HASP en Zorgpad kwetsbare oudere over de keten en in het ziekenhuis
Figuur 1. Het zorgpad Chirurgie bij kwetsbare ouderen, gebaseerd op de aanbevelingen in deze richtlijn. Stap 9 Postoperatieve geriatrische revalidatie is optioneel. Belangrijk is dat kwetsbaarheid zowel lichamelijk, psychologisch (waaronder ook cognitief), en sociaal kan zijn. MCI: Mild Cognitieve Impairment.
Overwegingen
1. Voor- en nadelen van de interventies en kwaliteit van het bewijs
Om de grote toestroom van oudere patiënten te kunnen blijven bedienen, is gestructureerde, doelgerichte benadering van kwetsbaarheid vereist, waarbij het individu te allen tijde centraal staat. Vroegtijdig aandacht voor (uitingen van) kwetsbaarheid in de eerste lijn kan maken dat patiënten realistisch na kunnen denken over hun verwachtingen en wensen ten aanzien van toekomstige zorg. Door de kenmerken en uitkomsten van kwetsbare ouderen in een landelijk kwaliteitsregister op te nemen, kan een behandelplan gebaseerd worden op specialistische ervaring én robuuste uitkomstdata. Het doel is om (hoogbejaarde) patiënt-behandeling-uitkomst-patronen te gaan herkennen. Ook op het gebied van preoperatieve besluitvorming is samenwerking wenselijk: leren van elkaars ervaringen is essentieel om de zorg voor complexe patiënten te verbeteren (van Dongen et al., 2019).
De Raad voor Volksgezondheid en Samenleving heeft in juni 2017 een advies uitgebracht waarbij aandacht werd gevraagd voor de context van de patiënt in diens medische behandeling en vooral in wetenschappelijk onderzoek (Raad Volksgezondheid & Samenleving, 2017). Bij oudere patiënten is dit een belangrijk punt. Hiernaast is de context van het ziekenhuis van belang. Is de geriatrische zorg op orde en zijn er structurele afspraken? Bij zelfstandige behandelcentra ontbreekt deze geriatrische zorg.
In de praktijk gebeurt het nog steeds dat patiënten vanuit het ene ziekenhuis naar het andere ziekenhuis worden overgeplaatst of verwezen voor een acute of electieve ingreep waarbij de basisgegevens niet op orde zijn (NVKG, 2018; NHG, 2017). Bij voorkeur wordt geriatrische expertise direct in het eerste ziekenhuis ingezet en moeten uitingen van kwetsbaarheid bij de start van de behandelrelatie worden meegenomen.
Specifieke kennis en vaardigheden over kwetsbare ouderen en het meewegen van kwetsbaarheid in behandelvoorstellen vormt geen standaard onderdeel van de meeste medisch specialistische opleidingen. In het beleid vanuit een ziekenhuis of de zorgverzekeraar wordt de klinisch geriater of internist-ouderengeneeskunde vaak niet meegenomen terwijl dit wel vereist is voor de acuut medische zorg. Bovenstaande is een beperkende factor voor succesvolle implementatie en kan leiden tot onnodige zorgkosten waarbij de patiënt niet direct een adequate beoordeling krijgt, of besluiten worden genomen zonder dat risicovolle patiënt kenmerken worden meegewogen of zonder erkenning dat de patiënt in de laatste levensfase zit met bijbehorende slechte prognose. De norm uit het Kwaliteitskader Spoedzorg ondersteunt om dit wel goed te implementeren en stelt dat 24/7 een klinisch geriater of internist ouderengeneeskunde beschikbaar is voor telefonische consultatie en 24/7 beschikbaar om patiënt te zien voor het nemen van belangrijke beslissingen in diagnostiek of behandeling. (Zorginstituut Nederland, 2020).
2. Patiëntvoorkeuren
Het is bij het inrichten van een zorgpad chirurgie bij kwetsbare ouderen zinvol om patiënten/ patiënt vertegenwoordigers te betrekken. Via spiegelgesprekken kunnen patiënten ook terugkoppelen hoe zij het ziekenhuis traject hebben ervaren en hierin aangeven wat positieve punten en verbeterpunten zijn.
Een opname in het ziekenhuis heeft grote impact op het welbevinden van kwetsbare ouderen en hun mantelzorger(s). Vaak wordt veel angst ervaren. Tijd voor een gesprek in rustige omstandigheden is een wens. Verder ook dat er voldoende informatie wordt gegeven, aandacht is voor medicatie, bezorgdheden en eventueel eerdere ziekenhuis ervaringen.
Er is gebleken uit een systematische review dat het proces van gedeelde besluitvorming leidt tot meer tevreden patiënten, betere therapietrouw, minder symptomen en betere kwaliteit van leven en psychisch functioneren (Shay et al., 2014). Negatieve effecten werden vrijwel niet gezien. Afhankelijk van het domein van de besluitvorming zou het tot lagere kosten kunnen leiden. De aanwijzingen voor lagere kosten komen echter uit studies naar keuzehulpen bij electieve chirurgie, waar patiënten die een keuzehulp kregen vaker conservatieve opties kozen dan patiënten in de ‘usual care’ groep (Stiggelbout et al., 2015; Wennberg et al., 1984; Stacey et al., 2017)
3. Kosten (middelenbeslag)
Het is bekend dat kwetsbaarheid zal toenemen met het stijgen van de leeftijd. Kwetsbaarheid geeft een hoger risico op negatieve uitkomsten, vallen, ziekenhuisopnames en mortaliteit. Studies hebben aangetoond dat toegenomen gezondheidskosten gekoppeld zijn aan kwetsbaarheid (Hoogendijk et al., 2019). Kostenbesparing wordt gezien binnen ERAS (enhanced recovery after surgery) (Ljungqvist et al., 2021).
Onderdeel van ERAS is kwetsbaarheid adresseren en de impact hiervan onderkennen, namelijk dat dit een groot risico geeft op complicaties en een verminderde postoperatieve levensverwachting. Een multidisciplinair team gericht op zorg voor de oudere patiënt is van belang voor optimale zorg en verlaagt heropnames (Engelhardt et al., 2018; Mohanty et al., 2016).
Optimaliseren van de gezondheid van een patiënt voor een operatie kan zorgen voor minder complicaties. Optimalisatie kan worden bereikt door het:
- Herkennen van kwetsbaarheid en dit meenemen in besluitvorming en behandeling.
- Optimaliseren van voedingstoestand. Belangrijke factor bij herstel van grote operaties.
- Preoperatief corrigeren van anemie en oorzaak hiervan eerst nagaan en behandelen.
- Mogelijk door middel van prehabilitatie door middel van verbeteren conditie, voedingstoestand (stop roken en alcoholgebruik), en psychologische ondersteuning. Aanwijzingen voor een positief effect is gezien bij grote abdominale chirurgie en cardiothoracale chirurgie (Kamarajah et al., 2020; Molenaar et al., 2023). Echter is de mate waarin studiedeelnemers kwetsbaar waren in deze onderzoekspopulaties niet bekend. Dit is een kennishiaat.
4. Aanvaardbaarheid, haalbaarheid en implementatie
- Goede samenwerking met de eerste lijn is nodig om kwetsbare patiënten te herkennen en proactieve zorgplanning mee te nemen in het ziekenhuis. Verwachtingsmanagement start reeds bij verwijzing.
- Implementatie zal pas succesvol zijn als alle partijen het belang van het herkennen van kwetsbaarheid bij ouderen en de impact hiervan onderkennen. Een zorgpad maken voor ouderen in een chirurgisch traject is hierbij vereist, zodat logistiek ook goed op elkaar wordt afgestemd. Dit start al bij verwijzing en is van belang in hele proces naar operatie tot ontslag. Scholing van betrokken zorgverleners over (het herkennen van) kwetsbaarheid kan hierin helpen en het uitvoeren van onderzoek bij specifieke chirurgie bij ouderen kan duidelijkheid geven over welke factoren bijdragen aan een (on)succesvol beloop. Verder kunnen niet-kwetsbare ouderen, kwetsbaar worden na een acute operatie of na een grote electieve operatie. Hier zou ook een proactief beleid op moeten worden gevoerd.
- Implementatie is praktisch beter haalbaar bij selectie van hoog risico ingrepen en intermediair risico. Om die reden kiest de werkgroep om zich in de aanbeveling te richten op electieve ingrepen met een verwachte opname duur van 2 of meer dagen.
- Reden voor implementatie dat patiënten optimaal geïnformeerd dienen te worden over risico’s en winstverwachting op geïndividualiseerde wijze. Kwetsbaarheid screening geeft belangrijke basisinformatie om het proces van samen beslissen te kunnen starten
- Implementatie vereist scholing m.b.t. gespreksvoering/ communicatie. Belangrijk is om de patiënt, samen met de mantelzorger/naaste, te bekrachtigen om actief de verwachtingen en doelen ten aanzien van de operatie en revalidatie te bespreken.
- Voor oudere patiënten is de setting extra belangrijk. Het geeft vertrouwen als de zorgverlener tijd neemt om te luisteren en respect toont met als resultaat dat angst en spanning vermindert. Geduld en vriendelijkheid zijn basisvoorwaarden.
- Verder moet er goede informatie worden gegeven en moet worden gecheckt of dit overkomt, waarbij de patiënt actief moet worden uitgenodigd om mee te beslissen. Hierin kan training in gespreksvoering helpen. Ook spiegelgesprekken met patiënten en alle betrokkenen binnen de keten kunnen hierin bijdragen. Dit geeft vaak waardevolle informatie die kan helpen ter verbetering. Vanuit patiënt perspectief zijn vaak andere zaken van belang dan we als zorgverleners denken.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Herkenning van kwetsbaarheid in het ziekenhuis
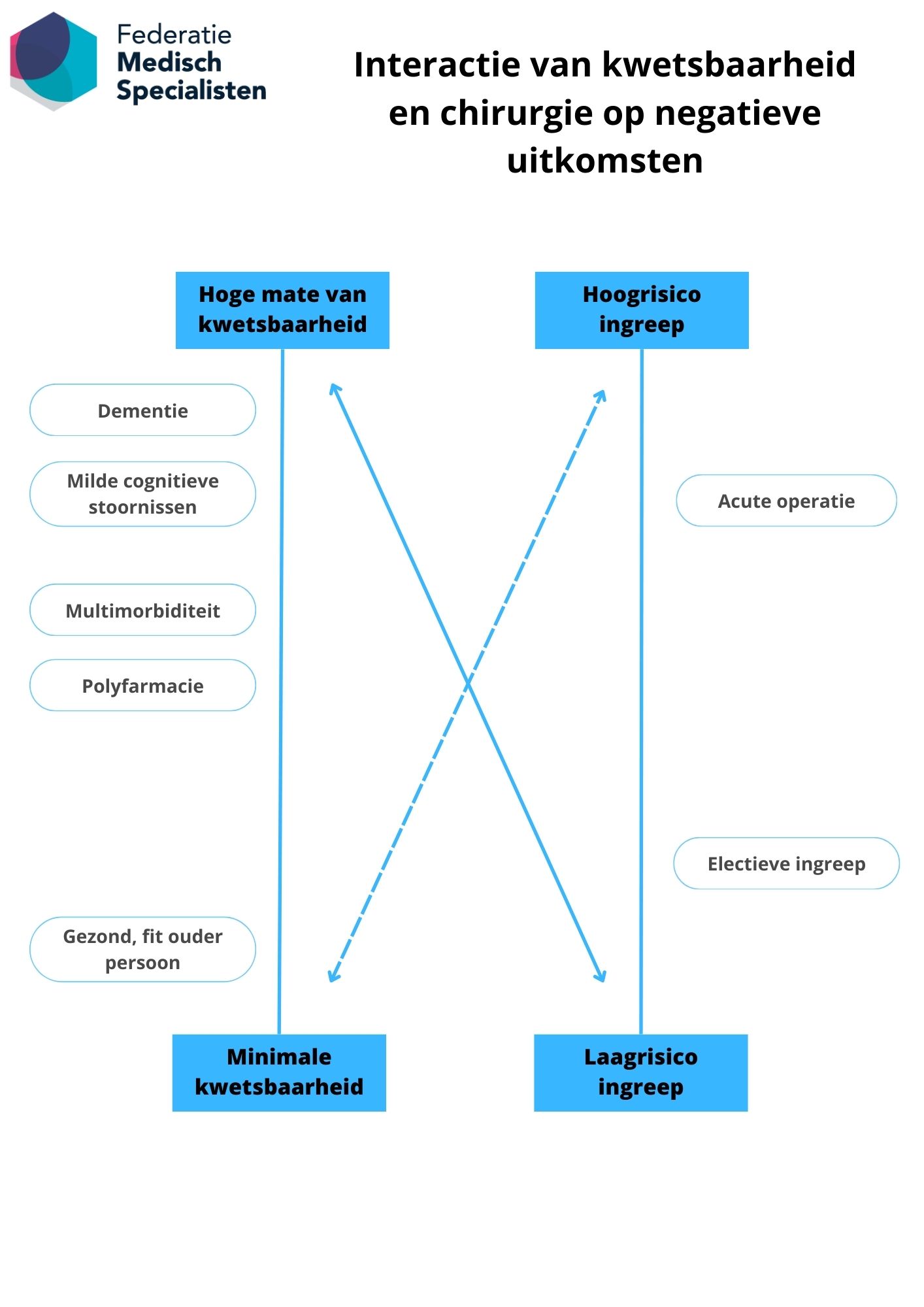
Kwetsbaarheid kan op verschillende manieren worden gedefinieerd. Het is een proces waarin achteruitgang wordt ervaren in één of meer domeinen van functioneren (fysiek, psychisch of sociaal), wat de kans op negatieve gezondheidsuitkomsten vergroot. Patiënten hebben minder reserves, waardoor deze steeds verder inleveren en niet optimaal kunnen herstellen (Gobbens et al., 2010). Zie ook Figuur 2 voor de interactie van kwetsbaarheid en chirurgie op negatieve uitkomsten.
Figuur 2. Interactie van kwetsbaarheid en chirurgie op negatieve uitkomsten
Figuur is gebaseerd op Inouye (Predisposing and precipitating factors for delirium in hospitalized older patients. Dement Geriatr Cogn Disord. 1999 Sep-Oct;10(5):393-400. doi: 10.1159/000017177. PMID: 10473946.).
Kwetsbaarheid is de belangrijkste risicofactor voor slechtere uitkomsten, zoals risico op postoperatieve complicaties, functieverlies en mortaliteit (VMS veiligheidsprogramma, 2009; Lin et al., 2016). Om deze reden worden in vrijwel alle ziekenhuizen patiënten van de 70 jaar en ouder gescreend op kwetsbaarheid wanneer zij worden opgenomen in het ziekenhuis als onderdeel van het VMS Veiligheidsprogramma (2009). In de spoedeisende hulp setting kunnen patiënten van 70 jaar of ouder gescreend worden met de APOP (APOP, n.d.). Bij 30% worden afwijkende uitkomsten gevonden: in deze groep zit 20% van de ouderen met hoogste risico op mortaliteit of functionele achteruitgang binnen 3 maanden. Op groepsniveau is er een risico van 60% op ongewenste gezondheidsuitkomsten voor de patiënten met een hoog risico op kwetsbaarheid volgens de APOP (APOP, n.d.).
Preoperatieve herkenning van kwetsbaarheid is van groot belang om te komen tot een passende behandeling, waarin winstverwachting en risico’s in balans met elkaar zijn. Belangrijk is dat dit ook aansluit bij het doel van de patiënt. Het doel van preoperatieve herkenning van kwetsbaarheid is het voorkomen van schade door te verwachten complicaties bij kwetsbaarheid, zoals functionele achteruitgang en niet meer terugkeren op het oude niveau. Het doel van preoperatief herkennen van mogelijke cognitieve stoornissen of dementie is om de kans op een delier te (h)erkennen, de onderliggende somatische reden hiervan (h)erkennen en adequate preoperatieve maatregelen te nemen. Dit vraagt bij kwetsbare ouderen vaak expertise van gespecialiseerde professionals. Daarnaast is bij dementie het doel om het risico op verdere achteruitgang van dementie door operatie en delierrisico te verminderen. Het is van belang dat dit zo vroeg mogelijk in het traject wordt onderkend, bij voorkeur al bij verwijzing vanuit de eerste lijn en bij het eerste consult met de chirurg. Dit om te komen tot goed verwachtingsmanagement, juiste informatie voor de patiënt en goede gespreksvoering. Daarnaast kan de bekendheid van dementie er ook voor zorgen dat er bij besluitvorming ook andere hulp ingezet kan worden om dit te optimaliseren, zoals een wettelijk vertegenwoordiger, partner en/of kinderen en/of zijn er andere informed consent procedures nodig in geval van wilsonbekwaamheid.
De werkgroep heeft ervoor gekozen om preoperatieve screening op kwetsbaarheid en cognitieve stoornissen te beperken tot ouderen die een operatie krijgen met verwachte opnameduur van meer dan 2 dagen. Hiervoor heeft de werkgroep twee redenen. Allereerst moet kwetsbaarheid in relatie gezien worden tot de grootte van de ingreep (zie Figuur 2). De grootte van de ingreep is indirect af te leiden uit de verwachtte opnameduur. De inschatting van de werkgroep is dat preoperatieve screening meer baat heeft naarmate de ingreep groter is. Als tweede zal de focus op de grotere ingrepen leiden tot een betere praktische haalbaarheid en dus implementatie, zeker gezien de toename van het aantal ouderen in onze populatie. Uiteraard kan een ernstig kwetsbare patiënt zelfs ontregelen door een kleine (poliklinische) ingreep. Deze afweging kan de snijdend specialist individueel maken, en bij een kleine ingreep is altijd overleg mogelijk met de geriatrie/ interne geneeskunde-ouderengeneeskunde.
Voor verdere rationale ten aanzien van preoperatieve screening op kwetsbaarheid en mogelijke cognitieve stoornissen: zie module Preoperatieve herkenning van kwetsbaarheid .
Risicofactoren voor ongunstige postoperatieve uitkomsten
Bij kwetsbare ouderen die in aanmerking komen voor een chirurgische ingreep inventariseren we preoperatief risicofactoren die van invloed zijn op de uitkomst. Daarbij wordt niet alleen gekeken naar bekende uitkomsten zoals postoperatieve complicaties, re-operatie en mortaliteit, maar ook naar typisch geriatrische uitkomstmaten uit het functionele domein, zoals mobiliteit, ADL-zelfredzaamheid en ontslag naar verpleeghuis/ revalidatie plek. Bij iedere zorgvraag of aandoening zijn bepaalde risicofactoren relevant. Denk hierbij aan:
- Hogere leeftijd;
- Hogere ASA-classificatie;
- Relevante multimorbiditeit (huidige status en ernst) en polyfarmacie;
- Preoperatieve afhankelijkheid in ADL functie of moeite hiermee;
- Cognitieve stoornissen;
- Stoornissen in mobiliteit;
- (Risico op) ondervoeding;
- Sociale situatie;
- Woonsituatie en mantelzorg systeem.
Deze risicofactoren dienen naast de aandoening-specifieke risicofactoren in ieder geval preoperatief in kaart gebracht te worden. Van belang is ook risicofactoren in kaart te brengen die zelfs in een (sub)acute situatie als een proximale femurfractuur nog gecorrigeerd kunnen worden, zoals een anemie, stollingsafwijkingen, ondervulling en elektrolytstoornissen, ontregelde diabetes en acute cardiale of pulmonale problematiek.
Daarnaast is het van belang om aandacht te hebben voor risicomedicatie, psychiatrische problematiek, chronische of acute nierinsufficiëntie, leverpathologie en aandacht voor motivatie tot revalidatie, juiste natraject en prehabilitatie.
Preoperatief afwegen van prognose, risico’s, verwachte gezondheidswinst en doelen van de patiënt
Behalve het screenen op kwetsbaarheid is het van belang dat beoordeeld wordt hoe de prognose en verwachte gezondheidswinst zich verhouden tot de zwaarte en risico’s van de ingreep, en tot de wensen/doelen van de patiënt. Uitgangspunt is het doel en de verwachting van patiënt, waarbij getoetst moet worden of deze aansluiten bij de verwachte uitkomst van een operatie en de risico’s die hieraan gekoppeld zijn. Oudere mensen hebben vaker dan jongere mensen als behandeldoel om kwaliteit van leven te behouden of ADL-zelfstandigheid te houden, naast levensverlenging (Festen et al., 2021). Hoe de kwetsbare oudere zijn of haar gezondheid en kwaliteit van leven beoordeelt is ook een belangrijke pijler. Dit kan worden beoordeeld met TOPICS-SF en ook na operatie worden vervolgd.
Met name de prognose, verwachte gezondheidswinst en risico’s zijn aandoening gebonden en zouden daarom per aandoening in kaart gebracht moeten worden voor kwetsbare ouderen. De aanwezigheid van dementie heeft ook invloed op de prognose. Hiervoor kunnen risicomodellen worden gebruikt uit de studie van Haaksma et al. (2020). Daarnaast stijgt het mortaliteitsrisico bij toenemende leeftijd en aanwezigheid van multimorbiditeit en cognitieve stoornissen (Lin et al., 2016; Hoogendijk et al., 2019).
Preoperatieve geriatrische beoordeling (comprehensive geriatric assessment)
Een oudere bij wie screening wijst op kwetsbaarheid en/of cognitieve stoornissen, kan verwezen worden naar de geriater, internist-ouderengeneeskunde of specialist ouderengeneeskunde voor een Comprehensive Geriatric Assessment (CGA). Een preoperatief CGA heeft als doel om de patiënt volledig in kaart te brengen zoals hierboven beschreven en de doelen van de patiënt duidelijk te krijgen. Indien de mogelijke scenario’s reeds bekend zijn (operatie, alternatieve behandeling, conservatief beleid of palliatief beleid) kunnen deze met de patiënt en diens wettelijk vertegenwoordiger, naaste of mantelzorger of worden besproken. Dit om te inventariseren hoe patiënt hierin staat en of patiënt zich ook bewust is van de impact op de voor hem/haar belangrijke domeinen.
- Volgend op geriatrische beoordeling kan een multidisciplinair overleg plaatsvinden.
- Preoperatieve adviezen zullen met de patiënt worden besproken en gecommuniceerd aan hoofdbehandelaar en huisarts. Dit kunnen adviezen zijn ten aanzien van:
- Afwegen/bespreken van voor- en nadelen van de voorgenomen operatie en alternatieve behandelopties.
- Optimaliseren voedingstoestand.
- Uitleg over delierrisico en belang van rooming in (mogelijkheid hiertoe) en goed slapen.
- Optimaliseren zintuigen (bril, hoorapparaat).
- Uitleg over valrisico. Valsensor, saneren valrisico bevorderende medicatie en/of preventieve maatregelen tegen delier bij bijvoorbeeld patiënten met hoog valrisico, cognitieve stoornissen of (kans op) delier. Gebruik rollator postoperatief bij al verminderde mobiliteit vooraf.
- Herstelperiode na de operatie: kan de patiënt thuis revalideren of is Geriatrische Revalidatie Zorg (GRZ) in een verpleeghuisinstelling nodig? Moet de patiënt thuis traplopen? Is er mantelzorg aanwezig? Geeft patiënt zelf mantelzorg aan partner met dementie, moet hiervoor zorg geregeld worden?
- Risico’s door medicatie.
- Risico’s door somatische problemen.
- Specifieke wensen of behoeften van de patiënt, bijvoorbeeld het niet zelf om hulp vragen. Indien al wordt aangegeven dat patiënt dit niet doet of de inschatting dat dit zo is, dan een proactief beleid hierop voeren op de verpleegafdeling.
- Optimaliseren conditie voor operatie: het afbouwen en stoppen van alcohol gebruik en het stoppen van roken, met uitleg over de risico’s rondom een operatie hiervan.
- Huisarts is vaak als eerste op de hoogte van veranderingen in toestand van kwetsbare oudere patiënt. Dit kan ook impact hebben op geplande operatie. Het kan nodig zijn patiënt opnieuw te beoordelen.
Multidisciplinair overleg/ complexe besluitvorming (module Besluitvorming rondom chirurgie bij kwetsbare ouderen)
Een aanbeveling is om bij kwetsbare oudere patiënten (70 jaar of ouder) met een indicatie voor chirurgie de klinisch geriater of internist- ouderengeneeskunde te betrekken bij een multidisciplinair overleg. Daarvoor is het noodzakelijk dat er voorafgaand aan het MDO al screening en geriatrische beoordeling middel (comprehensive) geriatric assessment heeft plaatsgevonden (zie module 2). Screening op kwetsbaarheid wordt geadviseerd bij operaties waar de oudere patiënt 2 dagen of meer wordt opgenomen. Echter bij grote kwetsbaarheid kan er reden zijn om dit ook bij kleinere operaties in kaart te brengen.
Een multidisciplinair overleg waar geriater of internist-ouderengeneeskunde aansluit, is wenselijk in situatie van:
- Complexe besluitvorming;
- Afwegen operatie of alternatieve behandeling;
- Grote operatie/ hoog risico operatie;
- Kwetsbare patiënt/ relevante multimorbiditeit/ gebruik van risico medicatie.
Bij de besluitvorming moet systematisch en zo precies mogelijk geformuleerd worden wat de behandeling toevoegt aan de levensverwachting, wat de behandeling bijdraagt aan vermindering van de klachten, wat de verwachte invloed is op kwaliteit van leven, wat de nadelen (lasten) van de behandeling zijn en welke andere mogelijkheden er voor behandeling zijn. Sluit dit aan bij doelen van patiënt? Uiteraard is dit bij een electieve behandeling gemakkelijker te realiseren dan in een acute situatie, echter dient ook daar het proces met de beschikbare informatie zo volledig mogelijk te worden doorlopen. Als voorbeeld de FRAIL HIP studie waarin bij zeer kwetsbare patiënten na shared decison making regelmatig wordt afgezien van chirurgie en dit nauwelijks negatieve invloed heeft op kwaliteit van leven en kwaliteit van sterven (Loggers et al., 2022).
Verder moet aandacht worden besteed aan het optimaliseren van perioperatieve situatie van de patiënt. Hierbij moet het volgende worden afgewogen: soort anesthesie, soort pijnstilling, operatie bij voorkeur begin van de dag, bij voorkeur niet voor een weekend, welke operateur, optimalisatie preoperatief nog mogelijk, aandachtspunten postoperatief. Verder kan overwogen worden om bij grote kwetsbaarheid te kiezen voor een opname op de afdeling geriatrie/ ouderengeneeskunde met geriater/ internist ouderengeneeskunde als hoofdbehandelaar, of op een gedeelde afdeling zoals een geriatrische trauma unit. Kennis op deze afdelingen op gebied van wondzorg en postoperatieve complicaties moet wel adequaat zijn.
De stappen om te komen tot complexe besluitvorming staan beschreven in module Besluitvorming rondom chirurgie bij kwetsbare ouderen.
Samen beslissen
Samen beslissen met de patiënt is een belangrijk onderdeel bij besluitvorming rondom chirurgie bij kwetsbare ouderen, omdat hierdoor operatie ook kan aansluiten bij doel dat patiënt heeft en patiënt ook goed geïnformeerd is over verwachte winst en risico’s. Hiervoor is een campagne ontwikkeld, die zich focust op de drie goede vragen:
- Wat zijn mijn mogelijkheden?
- Wat zijn de voor- en nadelen van die mogelijkheden?
- Wat betekent dit in mijn situatie?
Hierin is belangrijk dat patiënt de juiste informatie ontvangt over de ingreep, risico’s, verwachte herstelperiode en de invloed van kwetsbaarheid en andere aandoeningen die spelen op prognose en kwaliteit van leven.
Daarna dient met de patiënt en diens wettelijk vertegenwoordiger, naaste of mantelzorger volgens het model van de gezamenlijke besluitvorming het advies te worden besproken. Dit model van gezamenlijke besluitvorming bij kwetsbare ouderen wordt vormgeven volgens de vier fasen (Elwyn et al., 2017):
- Voorbereiding: hierin wordt in kaart gebracht welke behandelbeslissingen in het verleden zijn genomen, of alle problemen voldoende in kaart zijn gebracht, wie de gesprekspartner is en wat de levensvisie en beleving van de patiënt is, en worden de behandeldoelen geïdentificeerd;
- Choice talk: het uitwisselen van informatie en de uitleg dat er keuzes mogelijk zijn;
- Option talk: beschrijven en overwegen van alle opties met voor- en nadelen;
- Decision talk: het komen tot een gezamenlijk besluit eventueel met behulp van keuzehulpen.
Het is daarbij van groot belang om goed te beoordelen of de patiënt wilsbekwaam ter zake is. Een wettelijk vertegenwoordiger kan betrokken worden bij de besluitvorming.
Passende zorg
Door samen te beslissen met patiënt en diens naaste(n) verwacht je dat passende zorg ontstaat. Passende zorg stelt de kwaliteit van leven en het functioneren van patiënten voorop. Deze richtlijn sluit hierbij aan door zich te richten op het doel van de oudere patiënt ten aanzien van een operatie, en door hierbij mee te wegen hoe kwetsbaar de patiënt is en of er ziekten zijn die invloed hebben op het ontwikkelen van complicaties. Door dit proactief te adresseren, kan samen met de patiënt de juiste afweging worden gemaakt.
Multidisciplinaire postoperatieve samenwerking (module Postoperatieve samenwerking bij chirurgie bij kwetsbare ouderen)
Voortvloeiend uit preoperatieve screening (module Preoperatieve herkenning van kwetsbaarheid) en multidisciplinaire besluitvorming (module Besluitvorming rondom chirurgie bij kwetsbare ouderen) is de multidisciplinaire postoperatieve samenwerking (module Postoperatieve samenwerking bij chirurgie bij kwetsbare ouderen). Bij voorkeur wordt preoperatief hiervoor al een plan gemaakt. Hierbij moet worden bepaald welke paramedici moeten worden betrokken en of het geriatrisch expertise team wordt betrokken in medebehandeling. Als laatste moet worden bepaald hoe het natraject kan worden vormgegeven.
Initieel is de hoofdbehandelaar (op advies van KNMG zou er een regiebehandelaar moeten komen (KNMG, 2022)) over het algemeen de snijdend specialist. Dit dient ook genoteerd te worden in het dossier en moet worden gecommuniceerd met de patiënt. De hoofdbehandelaar kan anderen in medebehandeling vragen, zoals het geriatrisch expertise team. Het geriatrisch expertise team bestaat uit geriater en/of internist ouderengeneeskunde, hiernaast verpleegkundigen, verpleegkundig specialisten en PA’s. Deze kunnen allen ook in opleiding zijn. Verder geriatrisch fysiotherapeut en eventueel nog andere paramedici. Dit zal afhangen van lokale situatie.
Op oudere leeftijd is de incidentie van de typisch chirurgische complicaties hoger. Daarnaast ontstaan ook veel vaker geriatrische complicaties. Een cohortstudie toonde aan dat 40% van de patienten ouder dan 80 jaar een complicatie krijgen bij een spoedoperatie, en 5% bij een electieve operatie (Polanczyk et al., 2001). Belangrijke complicaties die voorkomen bij kwetsbare patiënten zijn cardiopulmonale complicaties, waaronder postoperatieve pneumonie en hartfalen door overvulling (Turrentine et al., 2006). Verder dient er rekening gehouden te worden met geriatrische presentatie van complicaties zoals symptoomarmoede en geriatrische syndromen, zoals vallen en delier. Het ontwikkelen van een delier is vaak juist gekoppeld aan ontregelde somatiek, naast kwetsbaarheid. Naast dat de verschillende risico factoren voor postoperatieve morbiditeit en mortaliteit stijgen met de leeftijd, blijft de hogere leeftijd zelf ook een belangrijke risico factor voor postoperatieve morbiditeit en mortaliteit (Turrentine et al., 2006).
Postoperatieve zorg voor kwetsbare ouderen
In de postoperatieve fase is het van belang om snel te starten met revalidatie en de risico’s, zoals die preoperatief zijn ingeschat, te monitoren en te behandelen. De revalidatie moet in ieder geval bestaan uit het zo snel en veel mogelijk mobiliseren van de patiënt en het snel starten en uitbreiden van orale voeding. Het ERAS-protocol zoals gebruikt in de gastro-intestinale chirurgie geeft daarvoor concrete aanbevelingen. Hierbij is een belangrijke rol weggelegd voor paramedische beroepsgroepen, bij voorkeur met geriatrische competenties. Vrijwilligers worden ook vaak ingezet en hebben een belangrijke rol (Ljungqvist et al., 2021).
Een veel voorkomende complicatie is het delier. In de richtlijn Delier volwassenen (NVKG, 2020) wordt aanbevolen om te werken met een meervoudig interventie programma (zie bijlage bij de richtlijn Delier bij volwassenen). Belangrijk is om aandacht te hebben voor het voorkómen of behandelen van cognitieve stoornissen en/of desoriëntatie, uitdroging en/of obstipatie, hypoxie, infectie, immobiliteit, pijn, ondervoeding, sensore deprivatie en slaapstoornissen. Bij tekenen van een delier dienen verpleegkundigen te monitoren op dehydratie, urineretentie, vallen, infecties of neurologische aandoeningen. Somatische uitlokkende factoren moeten worden behandeld. Het is van belang om niet medicamenteuze interventies in te zetten om delier te behandelen, en de belangrijkste hiervan is rooming-in. Bij voorkeur wordt preoperatief al met de familie besproken of dit mogelijk is. Verder van belang om te anticiperen op aanpassingsvermogen van patiënt. Een indruk hiervan kan worden verkregen door ervaring met eerdere opnames na te gaan.
Om postoperatieve complicaties te voorkomen, zijn proactieve monitoring en snelle interventie van groot belang. Deze monitoring wordt bij kwetsbare ouderen bemoeilijkt door typisch geriatrische aspecten zoals een andere symptomatologie, multimorbiditeit en polyfarmacie en de aanwezigheid of het ontstaan van cognitieve stoornissen. Daarnaast zijn functionele beperkingen prevalent, zoals beperkingen in waarneming, mobiliteit, ADL-functie en bij slikken en voeding. Dit vereist regelmatige beoordeling van de algemene toestand van de patiënt en van vitale parameters en resultaten van aanvullend onderzoek. Controle op anemie, nierfunctie- en elektrolietstoornissen en infectieparameters dient laagdrempelig te worden gedaan. Daarnaast moet de medicatie stelselmatig worden beoordeeld, om deze waar nodig aan te passen aan de dan actuele situatie. Het geriatrisch expertise team kan van toegevoegde waarde zijn in het voorkomen van complicaties en monitoren van bovenstaande aspecten.
Voor verdere onderbouwing ten aanzien van postoperatieve samenwerking met het geriatrisch expertise team: zie module 4.
Hierboven werd al de meerwaarde van geriatrische medebehandeling beschreven. Het Comprehensive Geriatric Assessment heeft in verschillende settingen (kliniek, medebehandeling, poli, SEH, eerste lijn) mogelijk positieve effecten op het aantal ouderen dat bij ontslag en tijdens de follow-up zelfstandig thuis woont, het verminderen van het aantal ouderen dat na ontslag en tijdens follow-up institutionaliseert, duur ziekenhuisopname en duur en ernst van een doorgemaakt delier (zie Richtlijn CGA (NVKG, 2021)).
Acute chirurgie
De werkgroep adviseert om bij de ontwikkeling van zorgpaden voor acute chirurgie uit te gaan van kenmerken van de patiëntengroep. Het percentage patiënten met verhoogde kwetsbaarheid in de patiëntengroep is daarbij een belangrijke factor om mee te wegen. Dit zorgpad wordt in geval van acute chirurgie dan toegepast bij alle patiënten. Als voorbeeld de patiënten met een acute heupfractuur van 70 jaar en ouder bij wie in sommige centra geriater/ internist-ouderengeneeskunde hoofdbehandelaar is, of actieve
medebehandeling plaatsvindt, of patiënt wordt opgenomen op geriatrische trauma unit.
Belangrijk om te beseffen is dat laag risico procedures bij acute chirurgie evenveel risico geven op postoperatieve complicaties, failure-to-rescue en heropnames als hoog risico procedures, zoals aangetoond in een retrospectieve studie (Collins et al., 2023). Bij oudere patiënten die een acute operatie ondergaan, verhoogt de ernst van het ziek zijn het risico op delier, naast eerder besproken risicofactoren (NVKG, 2020).
Electieve chirurgie
De werkgroep is van mening dat bij de ontwikkeling van zorgpaden voor electieve chirurgie uitgegaan dient te worden van kenmerken van individuele patiënten die baat kunnen hebben bij structurele medebehandeling door een klinisch geriater of internist-
ouderengeneeskunde. Dit kan bijvoorbeeld door geriatrische expertise te betrekken bij het multidisciplinair overleg of door preoperatief te screenen op kwetsbaarheid.
Transmurale samenwerking
Bij transmurale samenwerking is het van belang dat de volgende verwijsgegevens beschikbaar zijn vanuit de eerste en/of tweede lijn, bij alle patiënten van 70 jaar en ouder (NVKG, 2018; NHG, 2017):
- Aan of afwezigheid van kwetsbaarheid (mobiliteitsproblemen, vallen, ADL afhankelijkheid);
- Bekende dementie/ cognitieve stoornis/ eerder delier;
- Relevante multimorbiditeit/ medische voorgeschiedenis;
- Medicatie (polyfarmacie/ risico medicatie);
- Psychiatrische voorgeschiedenis of huidige psychiatrische problematiek/ behandeling via GGZ.
- Laatste lab gegevens
- Behandelbeperkingen/ proactieve zorgplanning
- Aanvullende informatie: reeds ingezette professionele zorg / mantelzorg. ZZP-indicatie
Indien verwijsgegevens ontbreken of niet compleet zijn, vraag dan het huisartsjournaal op of neem telefonisch contact op met de huisarts. Bij voorkeur al bij eerste bezoek aan chirurg. Dit kan ook het geval zijn als patiënt voor second opinion is verwezen van heelkunde uit 1e ziekenhuis naar andere ziekenhuis.
In de praktijk ontbreken regelmatig gegevens en worden deze pas opgevraagd als screening op mogelijke kwetsbaarheid wijst en bij geriater of internist ouderengeneeskunde op de poli komt.
Proactieve zorg planning en afstemming over doelen van patiënt in eerste of tweede lijn bij kwetsbaarheid/ multimorbiditeit kan helpen bij besluitvorming ten aanzien van wel of geen (acute/ electieve) operatie. Hierbij kan huisarts besluiten nog voor verwijzing naar chirurg een specialist ouderengeneeskunde te betrekken of te verwijzen naar geriater/ internist-ouderengeneeskunde of om af te wegen of een chirurgisch traject passend is en kwetsbaarheid en doelen van patiënt verder in kaart te brengen.
Ketenafspraken helpen om patiënt de juiste zorg op de juiste plek te geven. Van belang dat dit regionaal goed ingericht is.
In het traject is het van belang dat tijdige berichtgeving naar de eerste lijn (huisarts/ geriatrische revalidatie zorg/) ook adequaat is en bij actieve adviezen (zoals Hb vervolgen of oxycodon afbouwen.) en dit bij voorkeur ook telefonisch te communiceren. Warme verpleegkundige overdracht is ook van belang naar wijkverpleegkundige of naar nazorgplek. Met name bij concrete adviezen ten aanzien van wondzorg, benaderingsplan, dagelijks wegen bij risico op hartfalen (ook in medische overdracht).
Onderbouwing
Achtergrond
Bij patiënten met een proximale femurfractuur is aangetoond dat standaard geriatrische medebehandeling met zorgpaden, zoals de geriatrische trauma unit of een andere vorm, kan leiden tot betere uitkomsten. Dit is ook de algemene ervaring binnen de chirurgische oncologie. Binnen dit generieke hoofdstuk wordt een algemeen zorgpad voorgesteld voor kwetsbare ouderen die een indicatie hebben voor een operatieve interventie. Deze module wordt sterk aanbevolen voor:
- Ziekenhuizen om de zorg te optimaliseren voor kwetsbare ouderen die een operatie-indicatie hebben.
- Richtlijnwerkgroepen om deze generieke module op te nemen in een chirurgische richtlijn en een verwijslink te maken naar de modules 2 t/m 4, zodat kwetsbare ouderen de juiste work-up krijgen in voorbereiding op een chirurgische behandeling met aandacht voor besluitvorming.
Referenties
- Acuut Presenterende Oudere Patiënt (APOP). De APOP screener. n.d. https://apop.eu/apop-programma/de-screener/
- Collins CE, Renshaw S, Adib M, Gupta A, Rosenthal R. Frailty in emergency general surgery: Low-risk procedures pose similar risk as high-risk procedures for frail patients. Surgery. 2023 Feb;173(2):485-491. doi: 10.1016/j.surg.2022.10.002. Epub 2022 Nov 23. PMID: 36435653.
- Engelhardt KE, Reuter Q, Liu J, Bean JF, Barnum J, Shapiro MB, Ambre A, Dunbar A, Markzon M, Reddy TN, Schilling C, Posluszny JA Jr. Frailty screening and a frailty pathway decrease length of stay, loss of independence, and 30-day readmission rates in frail geriatric trauma and emergency general surgery patients. J Trauma Acute Care Surg. 2018 Jul;85(1):167-173. doi: 10.1097/TA.0000000000001931. PMID: 29659475.
- Elwyn G, Durand MA, Song J, Aarts J, Barr PJ, Berger Z, Cochran N, Frosch D, Galasi?ski D, Gulbrandsen P, Han PKJ, Härter M, Kinnersley P, Lloyd A, Mishra M, Perestelo-Perez L, Scholl I, Tomori K, Trevena L, Witteman HO, Van der Weijden T. A three-talk model for shared decision making: multistage consultation process. BMJ. 2017 Nov 6;359:j4891. doi: 10.1136/bmj.j4891. PMID: 29109079; PMCID: PMC5683042.
- Elwyn G, Frosch D, Thomson R, Joseph-Williams N, Lloyd A, Kinnersley P, Cording E, Tomson D, Dodd C, Rollnick S, Edwards A, Barry M. Shared decision making: a model for clinical practice. J Gen Intern Med. 2012 Oct;27(10):1361-7. doi: 10.1007/s11606-012-2077-6. Epub 2012 May 23. PMID: 22618581; PMCID: PMC3445676.
- Elwyn G, Vermunt NPCA. Goal-Based Shared Decision-Making: Developing an Integrated Model. J Patient Exp. 2020 Oct;7(5):688-696. doi: 10.1177/2374373519878604. Epub 2019 Oct 17. PMID: 33294602; PMCID: PMC7705836.
- Festen S, van Twisk YZ, van Munster BC, de Graeff P. 'What matters to you?' Health outcome prioritisation in treatment decision-making for older patients. Age Ageing. 2021 Nov 10;50(6):2264-2269. doi: 10.1093/ageing/afab160. PMID: 34343234; PMCID: PMC8581373.
- Gobbens RJ, Luijkx KG, Wijnen-Sponselee MT, Schols JM. In search of an integral conceptual definition of frailty: opinions of experts. J Am Med Dir Assoc. 2010 Jun;11(5):338-43. doi: 10.1016/j.jamda.2009.09.015. Epub 20ss10 Mar 24. PMID: 20511101.
- Haaksma ML, Eriksdotter M, Rizzuto D, Leoutsakos JS, Olde Rikkert MGM, Melis RJF, Garcia-Ptacek S. Survival time tool to guide care planning in people with dementia. Neurology. 2020 Feb 4;94(5):e538-e548. doi: 10.1212/WNL.0000000000008745. Epub 2019 Dec 16. PMID: 31843808; PMCID: PMC7080282.
- Hoogendijk EO, Afilalo J, Ensrud KE, Kowal P, Onder G, Fried LP. Frailty: implications for clinical practice and public health. Lancet. 2019 Oct 12;394(10206):1365-1375. doi: 10.1016/S0140-6736(19)31786-6. PMID: 31609228.
- Kamarajah SK, Bundred J, Weblin J, Tan BHL. Critical appraisal on the impact of preoperative rehabilitation and outcomes after major abdominal and cardiothoracic surgery: A systematic review and meta-analysis. Surgery. 2020 Mar;167(3):540-549. doi: 10.1016/j.surg.2019.07.032. Epub 2019 Sep 20. PMID: 31548095.
- KNMG. Handreiking Verantwoordelijkheidsverdeling bij samenwerking in de zorg. 2022. https://www.knmg.nl/advies-richtlijnen/dossiers/verantwoordelijkheidsverdeling
- Lin HS, Watts JN, Peel NM, Hubbard RE. Frailty and post-operative outcomes in older surgical patients: a systematic review. BMC Geriatr. 2016 Aug 31;16(1):157. doi: 10.1186/s12877-016-0329-8. PMID: 27580947; PMCID: PMC5007853.
- Ljungqvist O, de Boer HD, Balfour A, Fawcett WJ, Lobo DN, Nelson G, Scott MJ, Wainwright TW, Demartines N. Opportunities and Challenges for the Next Phase of Enhanced Recovery After Surgery: A Review. JAMA Surg. 2021 Aug 1;156(8):775-784. doi: 10.1001/jamasurg.2021.0586. Erratum in: JAMA Surg. 2021 Aug 1;156(8):800. PMID: 33881466.
- Loggers SAI, Willems HC, Van Balen R, Gosens T, Polinder S, Ponsen KJ, Van de Ree CLP, Steens J, Verhofstad MHJ, Zuurmond RG, Van Lieshout EMM, Joosse P; FRAIL-HIP Study Group. Evaluation of Quality of Life After Nonoperative or Operative Management of Proximal Femoral Fractures in Frail Institutionalized Patients: The FRAIL-HIP Study. JAMA Surg. 2022 May 1;157(5):424-434. doi: 10.1001/jamasurg.2022.0089. PMID: 35234817; PMCID: PMC8892372.
- Mohanty S, Rosenthal RA, Russell MM, Neuman MD, Ko CY, Esnaola NF. Optimal Perioperative Management of the Geriatric Patient: A Best Practices Guideline from the American College of Surgeons NSQIP and the American Geriatrics Society. J Am Coll Surg. 2016 May;222(5):930-47. doi: 10.1016/j.jamcollsurg.2015.12.026. Epub 2016 Jan 4. PMID: 27049783.
- Molenaar CJL, Minnella EM, Coca-Martinez M, Ten Cate DWG, Regis M, Awasthi R, Martínez-Palli G, López-Baamonde M, Sebio-Garcia R, Feo CV, van Rooijen SJ, Schreinemakers JMJ, Bojesen RD, Gögenur I, van den Heuvel ER, Carli F, Slooter GD; PREHAB Study Group. Effect of Multimodal Prehabilitation on Reducing Postoperative Complications and Enhancing Functional Capacity Following Colorectal Cancer Surgery: The PREHAB Randomized Clinical Trial. JAMA Surg. 2023 Jun 1;158(6):572-581. doi: 10.1001/jamasurg.2023.0198. Erratum in: JAMA Surg. 2023 May 3;: PMID: 36988937; PMCID: PMC10061316.
- NHG. Richtlijn Informatie-uitwisseling tussen Huisarts en Specialist (HASP). 2017. https://richtlijnendatabase.nl/richtlijn/informatie-uitwisseling_tussen_huisarts_en_specialist_hasp/richtlijn_informatieuitwisseling_tussen_huisarts_en_specialist.html
- NVKG. Richtlijn Comprehensive geriatric assessment (CGA). 2021. https://richtlijnendatabase.nl/richtlijn/comprehensive_geriatric_assessment_cga/startpagina_-_comprehensive_geriatric_assessment_cga.html
- NVKG. Richtlijn Delier bij volwassenen en ouderen. 2020. https://richtlijnendatabase.nl/richtlijn/delier_bij_volwassenen_en_ouderen/startpagina_-_delier_bij_volwassenen_en_ouderen.html
- NVKG. Zorgpad kwetsbare ouderen over de keten en in het ziekenhuis. 2018. https://www.nvkg.nl/sites/nvkg.nl/files/NVKG%20Leidraad%20Zorgpad%20Kwetsbare%20Ouderen.pdf
- Polanczyk CA, Marcantonio E, Goldman L, Rohde LE, Orav J, Mangione CM, Lee TH. Impact of age on perioperative complications and length of stay in patients undergoing noncardiac surgery. Ann Intern Med. 2001 Apr 17;134(8):637-43. doi: 10.7326/0003-4819-134-8-200104170-00008. PMID: 11304103.
- Raad Volksgezondheid & Samenleving. Zonder context geen bewijs. 2017. https://www.raadrvs.nl/documenten/publicaties/2017/06/19/zonder-context-geen-bewijs
- Shay LA, Lafata JE. Where is the evidence? A systematic review of shared decision making and patient outcomes. Med Decis Making. 2015 Jan;35(1):114-31. doi: 10.1177/0272989X14551638. Epub 2014 Oct 28. PMID: 25351843; PMCID: PMC4270851.
- Stacey D, Légaré F, Col NF, Bennett CL, Barry MJ, Eden KB, Holmes-Rovner M, Llewellyn-Thomas H, Lyddiatt A, Thomson R, Trevena L, Wu JH. Decision aids for people facing health treatment or screening decisions. Cochrane Database Syst Rev. 2014 Jan 28;(1):CD001431. doi: 10.1002/14651858.CD001431.pub4. Update in: Cochrane Database Syst Rev. 2017 Apr 12;4:CD001431. PMID: 24470076.
- Stiggelbout AM, Gärtner FR, Pieterse AH. Gedeelde besluitvorming met ouderen. Tijdschrift voor Ouderengeneeskunde. 2015
- Turrentine FE, Wang H, Simpson VB, Jones RS. Surgical risk factors, morbidity, and mortality in elderly patients. J Am Coll Surg. 2006 Dec;203(6):865-77. doi: 10.1016/j.jamcollsurg.2006.08.026. PMID: 17116555.
- Van Dongen E, Noordzij P. Screening cruciaal bij opereren kwetsbare oudere: belangrijke rol voor anesthesioloog bij proces naar patient gerichte zorg. Medisch Contact. 2019.
- VMS veiligheidsprogramma. Kwetsbare ouderen. 2009. https://www.vmszorg.nl/wp-content/uploads/2017/11/web_2009.0104_praktijkgids_kwetsbare_ouderen.pdf
- Wennberg JE. Dealing with medical practice variations: a proposal for action. Health Aff (Millwood). 1984 Summer;3(2):6-32. doi: 10.1377/hlthaff.3.2.6. PMID: 6432667.
- Zorginstituut. Kwaliteitskader spoedzorgketen. 2020. https://www.zorginstituutnederland.nl/werkagenda/spoedzorg/kwaliteitskader-spoedzorgketen
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 12-04-2024
Beoordeeld op geldigheid : 09-04-2024
Algemene gegevens
In samenwerking met : bovenstaande partijen, Verenso, Verpleegkundigen en Verzorgenden Nederland – Verpleegkundig Specialisten en Genero
Verenso heeft een verklaring geen bezwaar afgegeven.
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij chirurgie bij kwetsbare ouderen.
Werkgroep
Dr. D.E. (Didy) Jacobsen (voorzitter), Nederlandse Vereniging voor Klinische Geriatrie
Dr. H.A. (Harmke) Polinder-Bos, Nederlandse Vereniging voor Klinische Geriatrie
Dr. S. (Suzanne) Festen, Nederlandse Internisten Vereniging
N.S. (Niamh) Landa-Hoogerbrugge, MSc Verpleegkundigen en Verzorgenden Nederland en Verpleegkundigen en Verzorgenden Nederland – Verpleegkundig Specialisten
Dr. H.P.A. (Eric) van Dongen, Nederlandse Vereniging voor Anesthesiologie
Dr. J. (Juul) Tegels, Nederlandse Vereniging voor Heelkunde
Drs. P.E. (Petra) Flikweert, Nederlandse Orthopaedische Vereniging
Drs. H.P.P.R. (Heike) de Wever, Verenso
Patiëntvertegenwoordiger
M.R. (Marike) Abel- van Nieuwamerongen, Genero
Met ondersteuning van
Drs. E.A. (Emma) Gans, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Drs. L.A.M. (Liza) van Mun, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten
Dr. T. (Tim) Christen, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Dr. J.F. (Janke) de Groot, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
Y. (Yvonne) van Kempen, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Naam |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke Financiële Belangen |
Persoonlijke Relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Datum |
Actie |
|
Didy Jacobsen (voorzitter) |
Internist-ouderengeneeskunde, academisch medisch specialist, Radboudumc afdeling geriatrie |
Geen |
Geen |
Geen |
- |
Niet aanwezig. |
Nieuwe onderzoeksvoorstel op het gebied van zorgpadoptimalisatie/zorgpadontwikkeling voor ouderen met hoogrisico plaveiselcelcarcinoom. Vanuit dermatologie (Radboudumc) wordt dit opgezet. Ik denk mee voor geriatrisch perspectief. |
30-09-2021 |
Geen restricties |
|
Heike de Wever |
Specialist ouderengeneeskunde, kaderarts geriatrische revalidatie bij de stichting TanteLouise |
Lid van kerngroep kaderartsen geriatrische revalidatie van Verenso (onbetaald) |
Geen |
Neen |
Neen |
Neen |
Neen |
1-12-2021 |
Geen restricties |
|
Suzanne Festen |
Internist ouderengeneeskunde |
Nvt |
Geen belangenverstrengeling |
Geen belangenverstrengeling |
Betrokken bij ZIN subsidie en KWF subsidie |
Behoudens dat de inhoud raakt aan mijn expertise in klinisch werk en onderzoek geen belangen. |
Nvt |
11-11-2021 |
Geen restricties |
|
Eric van Dongen |
Anesthesioloog maatschap anesthesiologie, ic en pijnbestrijding |
Bestuur E infuse, vacatiegelden |
Geen |
Geen |
Geen |
Co-founder AGE MDO, ketenzorg perioperatief proces kwetsbare oudere |
Geen |
11-10-2021 |
Geen restricties |
|
Harmke Polinder- Bos |
Klinisch Geriater, Erasmus MC, Rotterdam |
Niet van toepassing |
Niet van toepassing |
Niet van toepassing |
2021: COOP-studie |
Behoudens dat de inhoud raakt aan mijn expertise in klinisch werk en onderzoek geen belangen. |
Geen |
4-10-2021 |
Geen restricties |
|
Niamh Landa - Hoogerbruggen |
Verpleegkundig specialist GE-chirurgie/klinische geriatrie Maasstad ziekenhuis |
Bestuurslid V&VN geriatrie en gerontologie |
Nee |
Nee |
Nee |
Neveneffect kan zijn meer expertise ontwikkelen op dit gebied en zodoende integreren in huidig zorgpad dieontwikkeld is |
Nee |
29-09-2021 |
Geen restricties |
|
Juul Tegels |
Lid richtlijnwerkgroep |
Traumachirurg, fellow |
Geen |
Geen |
Geen |
|
Geen |
18-3-2022 |
Geen restricties |
|
Petra Flikweert |
Orthopedisch chirurg, Reinier haga orthopedisch centrum, zoetermeer. Vanuit de NOV gemandateerde voor de werkgroep. |
Commissie kwaliteit - Haga ziekenhuis - onbetaald Commissie kwaliteit - NOV - onbetaald Onderwijscommissie NOV - onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
3-9-2023 |
Geen restricties |
|
Marike Abel- van Nieuwamerongen |
Lid ouderen- en mantelzorgforum; Genero (onbezoldigd> onkostenvergoeding) |
Lid RvT landelijke medezeggenschapsorganisatie cliënten Lid Cliëntenraad ziekenhuis in Tilburg Lid Cliëntenraad 1e lijnsorganisatie in Etten-Leur (onbetaalde functies, wel onkostenvergoeding) |
Geen |
Geen |
Geen |
Geen |
Geen |
6-9-2023 |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland en KBO-PCOB voor de schriftelijke knelpuntenanalyse. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Genero, KBO-PCOB en Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er [waarschijnlijk geen/ mogelijk] substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module Generieke module: Zorgpad chirurgie bij kwetsbare ouderen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de chirurgische zorg voor kwetsbare ouderen. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijnmodule (NVKG, 2016) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door betrokken partijen via een schriftelijke knelpuntenanalyse.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zou de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Referenties
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
NVKG. Richtlijn Behandeling kwetsbare ouderen bij chirurgie. 2016. https://richtlijnendatabase.nl/richtlijn/behandeling_kwetsbare_ouderen_bij_chirurgie/generieke_zorgpad.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J [corrected to Schünemann, Holger J]. PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.