Indicatie aanvullend onderzoek obstructief slaapapneu (OSA) bij obesitas
Uitgangsvraag
Welke patiënten met obesitas (BMI≥30) komen in aanmerking voor (aanvullend) obstructief slaapapneu (OSA) onderzoek indien zij een chirurgische ingreep onder algehele anesthesie moeten ondergaan?
Aanbeveling
Aanbeveling-1
Screen elke patiënt met obesitas op Obstructief Slaapapneu (OSA) door middel van het invullen van een vragenlijst gericht op een afwijkend slaappatroon. Maak daarbij gebruik van een standaard scoreformulier (zoals STOP-BANG).
Aanbeveling-2
Verricht preoperatief een poly(somno)grafie onderzoek bij elke patiënt met obesitas met symptomatische Obstructief Slaap Apneu klachten en mogelijke verdenking op het Obesitas Hypoventilatie Syndroom.
Overweeg een patiënt met obesitas en een positieve STOP-BANG-score (≥5) te verwijzen naar een slaapapneu-centrum voor verder onderzoek en therapie ter verbetering van de gezondheidstoestand op de langere termijn.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De werkgroep heeft een literatuuronderzoek verricht naar de impact van het gebruik van een klinische beslisregel in patiënten met obesitas die een operatieve ingreep onder algehele anesthesie moeten ondergaan. Het doel van dit onderzoek is om te bepalen of er aanvullend onderzoek naar Obstructief Slaap Apneu (OSA) nodig is ter voorkoming van postoperatieve complicaties. Er werd geen literatuur gevonden waarin het effect van de toepassing van een klinische beslisregel werd onderzocht, tenminste niet specifiek gericht op patiënten met obesitas.
Daarom is aanvullend gezocht op gevalideerde modellen die voorafgaand aan de operatie postoperatieve complicaties/adverse events door OSA kunnen voorspellen. Er werden geen gevalideerde modellen gevonden voor de groep met patiënten met obesitas waarvan de predicatieve waarde bepaald was. Daarom kunnen er geen conclusies getrokken worden over de impact van klinische beslisregels op het voorkomen van postoperatieve complicaties en adverse events door OSA. Ook kunnen er geen conclusies getrokken worden over de voorspellende waarde van factoren die postoperatieve complicaties door OSA voorspellen, specifiek voor patiënten met obesitas die een operatie onder algehele anesthesie moeten ondergaan. Er bestaat hier een kennislacune.
Prevalentie OSA
Aangaande OSA en overgewicht komt de meeste literatuur uit de bariatrie (Ahmad, 2008; Cheng, 2023; de Raaff, 2018; Van Veldhuisen, 2022). Al deze studies laten zien dat hoe hoger het BMI is, des te groter de kans op OSA. In twee studies naar de prevalentie van OSA in een bariatrische patiëntenpopulatie (Lopez, 2018; Ravesloot, 2012) kwam naar voor dat bijna 70% van de geïncludeerd patiënten voldeed aan de criteria van OSA (gemiddeld BMI 44,2 kg/m2 ± SD 6,4 kg/m2). Meer dan 40% van deze patiënten voldeden aan de criteria van ernstig OSA (Apneu Hypopneu Index >30 per uur). Bij een BMI ≥60 is OSA aanwezig in bijna 100% van de patiënten. Het is suggestief om deze resultaten uit de bariatrie te extrapoleren naar een populatie met obesitas die voor andere dan een bariatrische ingreep komen.
Veel studies naar OSA zijn gericht de prevalentie van OSA in de gehele chirurgische populatie (Bamgbade, 2021; Kaw, 2012; Opperer, 2015). De prevalentie van OSA in deze ‘normale’ chirurgische populatie varieert tussen de 3% en 7% (ASMBS Clinical Issues Committee, 2012). OSA komt dus zeker tien keer meer voor bij de patiënt met overgewicht.
Scoringsystemen OSA
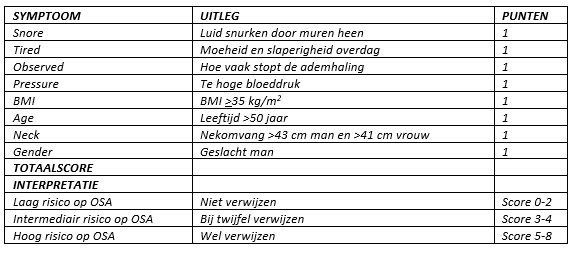
De STOP-BANG-score (tabel 1) is in de Nederlandse ziekenhuizen het meest gebruikte anesthesiologische instrument om aan te tonen of een patiënt wel of geen OSA heeft (Chung, 2016). Naast de STOP-BANG-score bestaan er nog andere scoringsystemen voor een afwijkend slaappatroon zoals bijvoorbeeld de Epworth Sleepiness Scale, de Berlin Questionnaire, Classification of Sleep Disorders, etc. Al deze scoringssystemen zijn gebaseerd op de door de patiënt zelf aangegeven slaapklachten. Voor de populatie met obesitas is er geen goed model beschikbaar die de kans op postoperatieve complicaties door een preoperatieve bekende OSA voorspelt (Nagappa, 2015). De STOP-BANG is de meest gangbare scorelijst op zoek naar een afwijkend slaappatroon, maar is minder specifiek bij mannen met obesitas en bij patiënten ouder dan 50 jaar. Toch is de STOP-BANG-vragenlijst, zowel nationaal als internationaal, de meest toegepaste screeningstool om te onderzoeken of een patiënt OSA heeft (Chung, 2016; Nagappa, 2017).
Tabel 1. De STOP-BANG Slaap-Apneu Vragenlijst (Chung, 2016)
Scoringssystemen ernst OSA
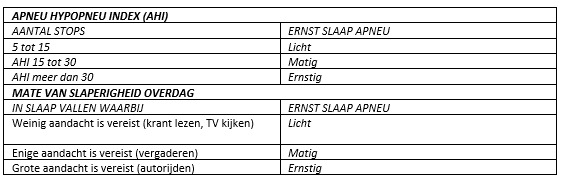
De ernst van de OSA wordt naast de STOP-BANG-score vaak weergegeven in de Apneu Hypopneu Index (AHI) en de mate van slaperigheid overdag (tabel 2).
De AHI is het gemiddelde aantal abnormale ademhalingen per uur slaap. Deze abnormale ademhalingen bestaan uit apneus en hypopneus.
Tabel 2. Apneu hypopneu index en de mate van slaperigheid overdag
Obesitas Hypoventilatie Syndroom (OHS)
Hoewel OHS niet valt onder de uitgangsvraag, is de werkgroep van mening dit syndroom hier wel te benoemen, gezien de het feit dat OHS preoperatief vaak niet herkend wordt, terwijl de kans op per- en postoperatieve complicaties meer aanwezig zijn in vergelijking met OSA (ASMBS Clinical Issues Committee, 2012; Cheng, 2022; Kaw, 2017; Kaw, 2021; Raveendran, 2017). OHS komt vooral voor in patiënten met een hogere BMI (≥40) en leidt tot abnormale longfysiologie met als gevolg pulmonale hypertensie, rechter- en linkerventrikel falen en afwijking in de gasuitwisseling. Bloedgasanalyse laat een hypercapnie zien met een verhoogd bicarbonaat. Vaak hebben deze patiënten slaapproblemen en een zeer geringe inspanningstolerantie. Postoperatief hebben zij ten opzichte van de ‘normale’ populatie meer kans op respiratoir falen (OR = 10,9), hartfalen (OR = 5,4), verlengde intubatie tijd (OR = 3,1), verblijf op de IC (OR = 10,9) en hogere kans op overlijden binnen 30 dagen (ASMBS Clinical Issues Committee, 2012; Kaw, 2017). Het is dus van belang om patiënten met verdenking op OHS vroegtijdig, dus vooraf aan de ingreep, te diagnosticeren.
Bestaande OSA-richtlijnen
Bij gebrek aan literatuur over de validatie van beslisregels bij patiënten met obesitas heeft de werkgroep gekeken naar verschillende nationale en internationale richtlijnen.
- Ten eerste de Nederlandse richtlijn ‘Obstructief slaapapneu (OSA) bij volwassenen’. Dit geldt voor de hele bevolkingsgroep en is dus niet specifiek voor de mensen met obesitas. Deze richtlijn adviseert het volgende:
- Alle volwassen chirurgische patiënten moeten gescreend worden op het risico voor OSA.
- Screeningsvragenlijsten zoals STOP-BANG, P-SAP, Berlin en de ASA-checklist kunnen gebruikt worden om patiënten met een verhoogd risico op OSA te identificeren.
- Ten tweede zijn er verscheidene internationale richtlijnen gepubliceerd zoals van de American Society for Metabolic and Bariatric Surgery (ASMBS, 2012), van de American Society of Anesthesiologists (ASA Task Force, 2014) en van de Society of Anesthesia and Sleep Medicine (Chung, 2016). Helaas worden er in deze richtlijnen verschillende afkappunten gehanteerd voor de ernst van de OSA; bijvoorbeeld voor de ernst van het overgewicht (BMI vanaf 35 of vanaf 40), de voorspelling van de mate slaapklachten (een STOP-BANG-score vanaf 3 of vanaf 5), of de ernst van de ademstops (AHI >30 of >40). Onder deze drie internationale richtlijnen is er wel consensus om standaard te screenen op OSA bij patiënten met obesitas (BMI ≥35 of ≥40).
- De ASMBS adviseert onder andere (ASMBS, 2012):
- Om bij patiënten met een BMI ≥35 standaard een poly(somno)grafie onderzoek te verrichten voorafgaand aan bariatrische chirurgie.
- Bij een STOP-BANG-score ≥5 wordt een poly(somno)grafie uitgevoerd.
- Er wordt altijd een CPAP-behandeling gestart indien de AHI >15/h, de basis SaO2 <90% en >10 min of de laagste SaO2 ≤80%.
- De ASA Task Force on Perioperative Management of Patients with Obstructive Sleep Apnea (2014) adviseert om samen met de chirurgen afspraken te maken hoe te handelen bij patiënten die verdacht zijn voor OSA en een operatie moeten ondergaan onder algehele anesthesie. Zij adviseren, ter voorkoming van complicaties, verdere maatregelen te laten afhangen (i) van de ernst van de OSA, (ii) de bijbehorende klachten en (iii) de complexiteit van de ingreep. De ASA Task Force on Perioperative Management of Patients with Obstructive Sleep Apnea (2014) ziet het als hun voornaamste doel de ‘awareness voor OSA’ onder het operatieteam te vergroten en daarmee mogelijke risico’s op perioperatieve complicaties te voorkomen.
De meest recente onderzoeken naar OSA en postoperatieve complicaties tonen aan dat patiënten die bekend zijn met OSA niet meer postoperatieve complicaties hebben dan patiënten zonder OSA (Azizad, 2023; Nijland, 2023, Van Veldhuisen, 2020). Bijvoorbeeld in de studie van Van Veldhuisen (2020) waar in een retrospectieve studie de bariatrische populatie helemaal niet werd gescreend op OSA: 5089 bariatrische patiënten zonder bekend te zijn met OSA werden vergeleken met 593 patiënten wel bekend met OSA. De groep met OSA kreeg de eigen behandeling en de niet-gescreende groep werd minimaal 24-uur postoperatief bewaakt met saturatiemetingen en kregen eventueel extra zuurstof toegediend. Na 30 dagen was er geen significant verschil in cardiopulmonale complicaties (0.8% versus 0.6%). De auteurs suggereren op basis van deze resultaten dat postoperatieve 24-uurs controle met saturatiebewaking een veilig alternatief is voor het routinematig screenen op OSA bij patiënten die bariatrische chirurgie ondergaan.
De vraag die gesteld moet worden is of het verschil in cardiopulmonale complicaties 30 dagen na een operatie het juiste ijkpunt is gezien het feit dat de meeste pulmonale en cardiale ‘adverse events’ plaatsvinden in de eerste paar dagen na de ingreep.
Zoals eerder gemeld is voor een juiste risico-inschatting op postoperatieve complicaties niet alleen de ernst van de OSA-klachten van belang, maar ook de complexiteit van ingreep (laag, middel of hoog risico), de ernst van de co-morbiditeit en de verwachte behoefte aan postoperatieve opiaten (ASA, 2014; ASMBS, 2012; Azizad, 2023; Chung, 2016).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Patiënten met obesitas willen en verwachten veilig door een operatie te worden geloodst. Voor alle chirurgische patiënten, wel of geen obesitas, is het invullen van een preoperatieve vragenlijst een normale procedure. Het toevoegen van een vragenlijst aangaande het slaappatroon levert geen extra belasting op, zeker als daarmee de veiligheid kan worden gediend. Dit kan digitaal, indien dit voor de patiënt mogelijk is, met laagdrempelig de mogelijkheid tot een telefonisch of fysiek consult. Bij een STOP-BANG score ≥3 met of zonder andere co-morbiditeit kan de patiënt gevraagd toch naar het ziekenhuis te komen voor verder onderzoek (hartfilmpje, luisteren naar hart en longen, inspectie mondopening, inspectie benen), en eventueel een aanvullend slaaponderzoek (poly(somno)grafie). Uitleg aan de patiënt over het hoe en waarom van dit aanvullend onderzoek is een vereiste (zie module Preoperatief Consult en module Indicatie Cardiovasculair Onderzoek). Een eventueel onderzoek naar OSA kan belastend zijn maar kan ook een verbetering van de klachten geven indien een therapie zoals bijvoorbeeld Continuous Positive Airway Pressure wordt gestart (CPAP). Dit moet met elke patiënt apart worden besproken, zodat een ‘tailor made’ beleid kan worden gemaakt op basis van patiëntkenmerken en de complexiteit van de ingreep. Zoals vermeld kunnen CPAP of andere manieren van niet-invasieve beademing belastend zijn voor patiënten en vergt het gewenning (Van Veldhuisen, 2022). Het succes van de CPAP-therapie is mede afhankelijk van de leeftijd en ernst van de klachten en symptomen (Jacobsen, 2017; Van Veldhuisen, 2023). De therapietrouw varieert tussen de 23% en 80%. Deze belasting van een slaaponderzoek moet worden afgezet tegen over het doel van het poly(somno)grafie onderzoek en het starten van CPAP. Voor de patiënt zelf is een bewezen OSA en een succesvolle CPAP-therapie een enorme verbetering van de kwaliteit van leven. Niet alleen voelt de patiënt zich fitter maar heeft het ook een positief effect op de langere termijn ten aanzien van het stressniveau o.a. leidend tot een daling van de bloeddruk (Berezin, 2023; Nagappa, 2017). Voor patiënten met de verdenking op OHS is de werkgroep van mening dat deze patiënten preoperatief altijd verder onderzoek behoeven gericht op de ernst van de klachten en de mogelijkheid tot verbetering van de gezondheidstoestand.
Kosten (middelenbeslag)
De kosten voor het uitvoeren van een vragenlijst vallen onder het preoperatief consult. De kosten van een polikliniekbezoek en uitgebreid slaaponderzoek (polysomnografie) zijn rond de 1700 euro (DBC-zorgproductiecode 60607007, 2024). Polysomnografie is meer belastend dan een polygrafie onderzoek maar beide onderzoeken kunnen tegenwoordig thuis worden uitgevoerd. In een retrospectieve studie van Van Veldhuisen (2020) worden de kosten van polysomnografie vergeleken met saturatie-bewaking. Patiënten werden helemaal niet gescreend op OSA maar werden postoperatief gemonitord met pulse-oxymetrie. De kosten lagen lager dan een poly(somno)grafie onderzoek en varieerde tussen de 500 en 600 euro per patiënt. Daartegenover staat dat een patiënt, adequaat ingesteld op CPAP, relatief veilig in dagbehandeling geopereerd kunnen worden.
Haalbaarheid, aanvaardbaarheid in implementatie
Het screenen op OSA door middel van een (digitale) vragenlijst is relatief eenvoudig uit te voeren (zie module Preoperatief Consult). Echter bij een positieve uitslag (STOP-BANG≥5) is een poly(somno)grafie onderzoek tot nu nog geïndiceerd en wordt dit beschouwd als de ‘gouden standaard’ (ASA, 2014; ASMBS, 2012; Cheng, 2022; Cozowic, 2021; Nijland 2023; Opperer, 2016; O’Reilly, 2009). Indien elke patiënt met een positieve STOP-BANG ≥5 doorgestuurd zou worden voor een poly(somno)grafie onderzoek is dat qua tijd, geld en menskracht een belasting voor het ziekenhuis, specifiek voor het slaapcentrum (afgezet tegen aantal te voorkomen complicaties).
Rationale van de aanbeveling-1: weging van argumenten voor en tegen de interventies
De werkgroep komt op basis van bovenstaande richtlijnen, de huidige literatuur en ‘expert opinion’ tot de volgende overwegingen en aanbevelingen.
Het (digitaal) screenen op OSA in de patiëntenpopulatie met obesitas met behulp van een vragenlijst gericht op het ontdekken van OSA is relatief eenvoudig uit te voeren en weinig belastend voor de patiënt, wetende dat bijna 70% van de patiënten met een BMI ≥35 OSA heeft. Op basis van deze vragenlijst is de ernst van OSA in te schatten zonder aanvullend onderzoek te hoeven verrichten. Kennis hebben over de ernst van de OSA vergroot de alertheid onder het anesthesieteam en verlaagt mogelijk de kans op complicaties (ASA, 2014). De kans op complicaties wordt naast de ernst van de OSA ook bepaald door de complexiteit van de ingreep, de ernst van co-morbiditeit en de verwachte behoefte aan postoperatieve zorg en opiaten. Literatuur toont aan dat aanvullend onderzoek alleen nodig is indien de patiënt symptomatische OSA-klachten heeft (ASA, 2014; ASMBS, 2012; Azizad, 2023; Chung, 2016).
De reden om af te zien van verder onderzoek bij aangetoond OSA (STOP-BANG ≥5) is (i) het mogelijk grote aantal obese patiënten met een positieve OSA-anamnese die op basis van de STOP-BANG-score doorgestuurd moeten worden voor verder aanvullende onderzoek en therapie, (ii) de belasting die dit oplevert voor zowel patiënt als onderzoekers, (iii) daarbij in ogenschouw nemend de geringe therapietrouw van een eventuele CPAP -therapie en (iv) het ontbreken van een klinisch relevant effect op de ernst en het aantal postoperatieve complicaties, mits postoperatief bewaakt met pulse-oxymetrie en het geven van extra zuurstof. Hierbij moet in de overweging worden meegenomen de complexiteit van de ingreep en de te verwachte postoperatieve opiaatbehoefte. Zie hiervoor ook de aanbevelingen in module ‘Postoperatieve Bewaking’. Echter, de werkgroep is van mening dat bovenstaande niet geldt voor de patiënten met de verdenking op OHS. Hier is verder preoperatief onderzoek geïndiceerd om postoperatieve complicaties te voorkomen en gezondheidswinst te realiseren.
Rationale van de aanbeveling-2: weging van argumenten voor en tegen de interventies
Op basis van expert opinion is de werkgroep van mening dat bij patiënten met obesitas, symptomatisch OSA en mogelijke verdenking op OHS (luid snurken, stoppen van de ademhaling voor langere tijd met opeens wakker schrikken, overdag eenvoudig in slaap vallen, bloedgasanalyse met hypercapnie en verhoogd bicarbonaat) wel preoperatief aanvullend poly(somno)grafie noodzakelijk is om postoperatieve complicaties te voorkomen. Mogelijke CPAP-therapie of alternatieven zijn hier geïndiceerd conform de richtlijn Obstructief Slaap Apneu (OSA) bij volwassenen.
Daarnaast is het verstandig om patiënten met positieve STOP-BANG (score ≥5) door te verwijzen voor verder onderzoek en therapie om de nadelige effecten van OSA op langere termijn te verminderen.
Onderbouwing
Achtergrond
Obesitas is een multifactoriële, complexe aandoening die geassocieerd wordt met meerdere co-morbiditeiten (American Society for Metabolic and Bariatric Surgery (ASMBS) Clinical Issues Committee, 2012; Seyni-Boureima, 2022), waarvan het obstructief slaap apneu (OSA) misschien wel de belangrijkste is voor de anesthesiologische praktijkvoering (Cozowicz, 2021; de Raaff, 2018; Raveendran, 2017). Patiënten met OSA zijn gevoeliger voor medicamenten die de tonus van de bovenste luchtweg kunnen beïnvloeden (sedativa, opiaten). Dit kan leiden tot een bovenste luchtwegobstructie met als gevolg een (tijdelijke) ademstilstand (apneu). Postoperatief kunnen deze apneus leiden tot desaturaties, hypoxemie, ritmestoornissen en ischemie (Kaw, 2012; Opperer, 2016). Het is daarom van belang om tijdens de preoperatieve screening te vragen naar afwijkend slaapgedrag (’s nachts vaak wakker, snurken, stoppen met de ademhaling) met behulp van een standaard vragenlijst (bijvoorbeeld STOP-BANG).
De vraag van de werkgroep is nu: “welke patiënten met obesitas die een chirurgische ingreep onder algehele anesthesie moeten ondergaan komen in aanmerking voor aanvullend OSA-onderzoek”, ter voorkoming van per- en postoperatieve complicaties?
Bij de uitwerking van deze module wordt de volgende terminologie gebruikt:
- OSA bestaat uit intermitterende bovenste luchtwegobstructies die vergezeld gaan met apneus, hypoventilatie, hypoxemie, hypercapnie met als gevolg een overactiviteit van het sympathische zenuwstelsel.
- OSA-klachten kunnen o.a. bestaan uit: luid snurken, stoppen met ademen, tijdens de slaap wakker schrikken, moeheid overdag, overdag gemakkelijk in slaap vallen.
- Klinische relevant OSA bestaat uit symptomatisch OSA en/of co-morbiditeit met hypersomnolentie (extreme moeheid overdag) met gemakkelijk in slaap vallen bij activiteiten waarbij aandacht is vereist (krantlezen, een gesprek of autorijden).
- Type 3 test, zoals Polygrafie, is een draagbaar slaaponderzoek waarbij meerdere lichaamsfuncties worden gemeten, met minimaal 4 kanalen, met ventilatie of luchtstroommeting. De Polysomnografie is een type 1 (klinisch) of 2 (thuis) test waarbij naast type 3 slaaponderzoek ook de hersenfuncties met elektro-encefalografie worden gemeten.
- Apneu-Hypopneu-Index (AHI is de verhouding tussen apneus en hypopneus per uur, gemeten met poly(somno)grafie. Apneu is een volledige ademstop langer durend dan 10 seconden. Hypopneu is een gedeeltelijke ademstop voor langer dan 10 seconden.
- Oxygen-Desaturation-Index (DSI) is het aantal keer per uur slaap dat de zuurstofwaarde in het bloed daalt met >4% ten opzichte van de baseline, gemeten met poly(somno)grafie (richtlijn Obstructief slaapapneu (OSA) bij volwassenen).
Conclusies / Summary of Findings
PICO 1: impact of using a clinical decision model
|
- GRADE |
No evidence was found regarding the effect of the use of clinical decision rules (to determine whether additional obstructive sleep apnea examination must be performed) on postoperative complications/adverse events when compared with other clinical decision rules or expert opinion in obese patients undergoing surgery under general anesthesia.
Source: - |
PICO 2: predictive value of a clinical decision model
|
- GRADE |
No evidence was found regarding the predictive value of a model predicting postoperative complications/adverse events due to (postoperative) sleep apnea in obese patients undergoing surgery under general anesthesia.
Source: - |
Samenvatting literatuur
PICO 1: impact of using a clinical decision model.
Description of studies
No studies reporting the impact of using a clinical decision rule to determine whether additional OSA examination must be performed were found.
Results
Postoperative complications/adverse events.
No results could be reported as no studies reporting the impact of using a clinical decision rule to determine whether additional OSA examination must be performed were found.
Level of evidence of the literature
The level of evidence regarding the outcome measure postoperative complication/adverse events could not be graded as no studies reporting the impact of using a clinical decision rule to determine whether additional OSA examination must be performed were found.
PICO 2: predictive value of a clinical decision model.
Description of studies
No studies reporting a validated model predicting postoperative complications/adverse events due to postoperative sleep apnea were found.
Results
Model performance
No results could be reported as no studies reporting a validated model predicting postoperative complications/adverse events due to (postoperative) sleep apnea were found.
Level of evidence of the literature
The level of evidence regarding the outcome measure model performance could not be graded as no studies reporting a validated model predicting postoperative complications/adverse events due to (postoperative) sleep apnea were found.
Zoeken en selecteren
The literature was searched for a systematic review, measuring the impact of a clinical decision model to decide whether additional preoperative clinical examination for obstructive sleep apnea (OSA) must be performed, in obese patients undergoing surgery under general anesthesia, compared to standard decision-making, on the number of postoperative complications and adverse events.
PICO 1: impact of using a clinical decision model
| P: |
Obese patients undergoing surgery under general anesthesia |
| I: |
Clinical decision-making for additional preoperative OSA examination based on clinical decision rules (questionnaires such as STOP-BANG method, EPWORTH, etc.) |
| C: |
Clinical decision-making for additional preoperative OSA examination based on standard decision-making (like other clinical decision rules, expert opinion) |
| O: |
Postoperative complications/adverse events after surgery (apnea with desaturation, resuscitation, mortality, cardiac events (atrial fibrillation, onset ischemia)) |
| T: |
Outcome one month after surgery |
| S: |
Clinical decision-making during pre-anesthesia medical evaluation |
As such research is very rare, the working group defined a second research question: What is the predictive value of models predicting postoperative complications and adverse events caused by sleep apnea (questionnaires such as STOP-BANG, EPWORTH, etc.) compared to each other or other models predicting postoperative complications caused by sleep apnea in obese patients undergoing surgery under general anesthesia?
PICO 2: predictive value of a clinical decision model
| P: |
Obese patients undergoing surgery under general anesthesia |
| I: |
Model predicting postoperative complications and adverse events due to (postoperative) sleep apnea |
| C: | Other model predicting postoperative complications and adverse events due to (postoperative) sleep apnea/no model |
| O: |
Predictive value/model performance |
| T: |
Prediction one month after surgery |
| S: |
Clinical decision-making during pre-anesthesia medical evaluation |
Relevant outcome measures
PICO 1: impact of using a clinical decision model.
The guideline development group considered apnea with desaturation, resuscitation, mortality, and cardiac events (atrial fibrillation, onset ischemia) as critical outcome measures for decision-making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the following values as a minimal clinically (patient) important difference:
Apnea with desaturation: 0.91³relative risk (RR)≥1.10
Resuscitation: 0.91≥RR≥1.10
Mortality: 0.95≥RR≥1.05
Cardiac events: 0.95≥RR≥1.05
PICO 2: predictive value of a clinical decision model
The guideline development group considered model performance as a critical outcome measure for decision-making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the performance of the included models as follows:
0.7 ≤ area under the curve (AUC) <0.8: acceptable,
0.8 ≤ AUC <0.9: excellent,
AUC ≥ 0.9: outstanding.
Prognostic research: Study design and hierarchy
When reviewing literature, there is a hierarchy in quality of individual studies. Preferably, the effectiveness of a clinical decision model is evaluated in a clinical trial. Unfortunately, these studies are very rare. If not available, studies in which prediction models are developed and validated in other samples of the target population (external validation) are preferred as there is more confidence in the results of these studies compared to studies that are not externally validated. Most samples do not completely reflect the characteristics of the total population, resulting in deviated associations, possibly having consequences for conclusions. Studies validating prediction models internally (e.g., bootstrapping or cross validation) can be used to answer the first research question as well. But downgrading the level of evidence is obvious due to risk of bias and/or indirectness as it is not clear whether models perform sufficiently in target populations. The confidence in the results of unvalidated prediction models is very low. Therefore, such models will not be graded. Not grading is also applicable for prognostic factor research. The risk factors identified from such models can be used to inform patients about the elevated risk on complications after surgery. However, they are less suitable to be used in clinical decision-making as the predictive value of these factors is unclear.
Search and select (Methods)
The databases [Medline (via OVID) and Embase (via Embase.com)] were searched with relevant search terms until September 2023. The search strategy was combined for PICO 1 and PICO 2 and was based on the elements; obesity, general anesthesia, and adverse events/effects. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 641 hits. Studies were selected based on the following criteria:
PICO 1: impact of using a clinical decision model.
- Systematic review, RCTs or observational studies
- Comparing the use of clinical decision rules with the use of other clinical decision rules or expert opinion to determine whether additional pre-operative OSA examination must be performed in obese patients undergoing surgery under general anesthesia.
- Clinical decision-making was performed during pre-anesthesia medical evaluation.
- The outcome measures apnea with desaturation, resuscitation, mortality, cardiac events were measured until one month after surgery.
PICO 2: predictive value of a clinical decision model
- Systematic reviews or cohort studies reporting a model predicting postoperative complications and adverse events after one month due to postoperative sleep apnea in obese patients undergoing surgery under general anesthesia.
- Predictors were measured before surgery (and can be measured during pre- anesthesia consultation).
- Models need to be internally and/or externally validated.
- At least one model performance measure was reported.
Four studies were initially selected based on title and abstract screening. After reading the full text, all studies were excluded (see the table with reasons for exclusion under the tab Methods), and no studies were included.
Results
No studies were included in the analysis of the literature.
Referenties
- Ahmad S, Nagle A, McCarthy RJ, Fitzgerald PC, Sullivan JT, Prystowsky J. Postoperative Hypoxemia in Morbidly Obese Patients with and without Obstructive Sleep Apnea Undergoing Laparoscopic Bariatric Surgery. Anesth Analg. 2008 Jul;107(1):138-43.
- American Society for Metabolic and Bariatric Surgery Clinical Issues Committee. Peri-Operative Management of Obstructive Sleep Apnea. Surg Obes Relat Dis. 2012 May-Jun;8(3):27-32.
- American Society of Anesthesiologists Task Force on Perioperative Management of patients with obstructive sleep apnea. Practice guidelines for the perioperative management of patients with obstructive sleep apnea: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Management of patients with obstructive sleep apnea. Anesthesiology. 2014 Feb;120(2):268-86. doi: 10.1097/ALN.0000000000000053. PMID: 24346178.
- Azizad O, Joshi GP. Day-Surgery Adult Patients with Obesity and Obstructive Sleep Apnea: Current Controversies and Concerns. Best Pract Res Clin Anaesthesiology 2023 Sep;37(3):317-330.
- Bamgbade OA, Oluwole O, Khalaf WM, Namata C, Metekia LM. Perioperative Care of Obstructive Sleep Apnea Patients: A Survey of European Anesthesiologists. Saudi J Anaesth. 2021 Apr-Jun;15(2):101-108.
- Berezin L, Nagappa M, Poorzargar K, Saripella A, Ariaratnam J, Butris N, Englesakis M, Chung F. The Effectiveness of Positive Airway Pressure Therapy in Reducing Postoperative Adverse Outcomes in Surgical Patients with Obstructive Sleep Apnea: A Systematic Review and Meta-Analysis. J Clin Anesth. 2023 Feb;84.
- Chan MTV, Wang CY, Seet E, Tam S, Lai HY, Chew EFF, Wu WKK, Cheng BCP, Lam CKM, Short TG, Hui DSC, Chung F. Postoperative Vascular Complications in Unrecognized Obstructive Sleep Apnea (POSA) Study Investigators: Association of Unrecognized Obstructive Sleep Apnea with Postoperative Cardiovascular Events in Patients Undergoing Major Noncardiac Surgery. JAMA. 2019 May 14;321(18):1788-1798.
- Cheng MCF, Murphy PB, Lee K, McGowan B, Hart N, Piper A, Steier J. Screening and Treatment of Pre-Bariatric Surgical Patients with Obesity Related Sleep Disordered Breathing. J Thorac Dis. 2023 Jul 31;15(7):4066-4073.
- Cheng MCF, Steier J. Pre-Operative Screening for Sleep Disordered Breathing: Obstructive Sleep Apnoea and Beyond. Breathe (Sheff). 2022 Sep;18(3).
- Chung F, Memtsoudis SG, Ramachandran SK, Nagappa M, Opperer M, Cozowicz C, Patrawala S, Lam D, Kumar A, Joshi GP, Fleetham J, Ayas N, Collop N, Doufas AG, Eikermann M, Englesakis M, Gali B, Gay P, Hernandez AV, Kaw R, Kezirian EJ, Malhotra A, Mokhlesi B, Parthasarathy S, Stierer T, Wappler F, Hillman DR, Auckley D. Society of Anesthesia and Sleep Medicine Guidelines on Preoperative Screening and Assessment of Adult Patients With Obstructive Sleep Apnea. Anesth Analg. 2016 Aug;123(2):452-73.
- Cozowicz C, Memtsoudis SG. Perioperative Management of the Patient with Obstructive Sleep Apnea: A Narrative Review. Anesth Analg. 2021 May 1;132(5):1231-1243.
- Jacobsen AR, Eriksen F, Hansen RW, Erlandsen M, Thorup L, Damgård MB, Kirkegaard MG, Hansen KW. Determinants for adherence to continuous positive airway pressure therapy in obstructive sleep apnea. PLoS One. 2017 Dec 18;12(12.
- Kaw R, Chung F, Pasupuleti V, Mehta J, Gay PC, Hernandez AV. Meta-Analysis of the Association between Obstructive Sleep Apnoea and Postoperative Outcome. Br J Anaesth. 2012 Dec;109(6):897-906.
- Kaw RK. Spectrum of Postoperative Complications in Pulmonary Hypertension and Obesity Hypoventilation Syndrome. Curr Opin Anaesthesiol. 2017 Feb;30(1):140-145.
- Kaw R, Wong J, Mokhlesi B. Obesity and Obesity Hypoventilation, Sleep Hypoventilation, and Postoperative Respiratory Failure. Anesth Analg. 2021 May 1;132(5):1265-1273.
- Lopez PP, Stefan B, Schulman CI, Byers PM. Prevalence of Sleep Apnea in Morbidly Obese Patients who Presented for Weight Loss Surgery Evaluation: More Evidence for Routine Screening for Obstructive Sleep Apnea before Weight Loss Surgery. Am Surg. 2008 Sep;74(9):834-8.
- Nagappa M, Mokhlesi B, Wong J, Wong DT, Kaw R, Chung F. The Effects of Continuous Positive Airway Pressure on Postoperative Outcomes in Obstructive Sleep Apnea Patients Undergoing Surgery: A Systematic Review and Meta-analysis. Anesth Analg. 2015 May;120(5):1013-1023.
- Nagappa M, Wong J, Singh M, Chung F. An Update on the Various Practical Applications of the Stop-Bang Questionnaire in Anesthesia, Surgery and Perioperative Medicine. Current Opinion in Anaesthesiology. 2017; 30(1):118-125.
- Nijland LMG, van Veldhuisen SL, van Veen RN, Hazebroek EJ, Bonjer HJ, de Castro SMM. Complications and Predictors Associated with Moderate to Severe Obstructive Sleep Apnoea in Bariatric Surgery: Evaluation of Routine Obstructive Sleep Apnoea Screening. Surgeon. 2023 Aug 14:S1479-666X.
- O Reilly J. Sleep Apnoea and Sleep Breathing Disorders. Br J Hosp Med (Lond). 2009 Jun;70(6):320-6.
- De Raaff CAL, Gorter-Stam MAW, de Vries N, Sinha AC, Jaap Bonjer H, Chung F, Coblijn UK, Dahan A, van den Helder RS, Hilgevoord AAJ, Hillman DR, Margarson MP, Mattar SG, Mulier JP, Ravesloot MJL, Reiber BMM, van Rijswijk AS, Singh PM, Steenhuis R, Tenhagen M, Vanderveken OM, Verbraecken J, White DP, van der Wielen N, van Wagensveld BA. Perioperative Management of Obstructive Sleep Apnea in Bariatric Surgery: A Consensus Guideline. Surg Obes Relat Dis. 2017 Jul;13(7):1095-1109.
- De Raaff CAL, de Vries N, van Wagensveld BA. Obstructive Sleep Apnea and Bariatric Surgical Guidelines: Summary and Update. Curr Opin Anaesthesiol. 2018 Feb;31(1):104-109.
- Raveendran R, Wong J, Singh M, Wong DT, Chung F. Obesity Hypoventilation Syndrome, Sleep Apnea, Overlap Syndrome: Perioperative Management to Prevent Complications. Curr Opin Anaesthesiol. 2017 Feb;30(1):146-155.
- Ravesloot MJ, van Maanen JP, Hilgevoord AA, van Wagensveld BA, de Vries N. Obstructive Sleep Apnea is Underrecognized and Underdiagnosed in Patients undergoing Bariatric Surgery. Eur Arch Otorhinolaryngol. 2012 Jul;269(7):1865-71.
- Seyni-Boureima R, Zhang Z, Antoine MMLK, Antoine-Frank CD. A review on the Anesthetic Management of Obese Patients Undergoing Surgery. BMC Anesthesiol. 2022 Apr 5;22(1):98.
- Van Veldhuisen SL, Kuppens K, de Raaff CAL, Wiezer MJ, de Castro SMM, van Veen RN, Swank DJ, Demirkiran A, Boerma EG, Greve JM, van Dielen FMH, Frederix GWJ, Hazebroek EJ. Protocol of a Multicentre, Prospective Cohort Study that Evaluates Cost-Effectiveness of two Perioperative Care Strategies for Potential Obstructive Sleep Apnoea in Morbidly Obese Patients Undergoing Bariatric Surgery. BMJ Open. 2020 Oct 7;10(10).
- Van Veldhuisen SL, Nijland LMG, Ravesloot MJL, de Vries N, van Veen RN, Hazebroek EJ, de Castro SMM. Preoperative Assessment of Obstructive Sleep Apnea in Bariatric Patients Using Polysomnography or Polygraphy. Obes Surg. 2022 Jun;32(6):1814-1821.
- Van Veldhuisen SL, van Boxel MF, Wiezer MJ, van Veen RN, de Castro SMM, Swank DJ, Demirkiran A, Boerma EG, Greve JWM, van Dielen FMH, Kuppens K, Hazebroek EJ. Evaluation of CPAP Adherence in Bariatric Patients Diagnosed with Obstructive Sleep Apnea: Outcomes of a Multicenter Cohort Study. Sleep Breath. 2023 May;27(2):535-544.
Evidence tabellen
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Flier S, Knape JT. How to inform a morbidly obese patient on the specific risk to develop postoperative pulmonary complications using evidence-based methodology. Eur J Anaesthesiol. 2006 Feb;23(2):154-9. doi: 10.1017/S0265021505002073. PMID: 16438750. |
no relevant studies included in review |
|
Joshi GP, Ahmad S, Riad W, Eckert S, Chung F. Selection of obese patients undergoing ambulatory surgery: a systematic review of the literature. Anesth Analg. 2013 Nov;117(5):1082-91. doi: 10.1213/ANE.0b013e3182a823f4. PMID: 24108263. |
no decision criteria/predictive model reported |
|
Piccioni F, Droghetti A, Bertani A, Coccia C, Corcione A, Corsico AG, Crisci R, Curcio C, Del Naja C, Feltracco P, Fontana D, Gonfiotti A, Lopez C, Massullo D, Nosotti M, Ragazzi R, Rispoli M, Romagnoli S, Scala R, Scudeller L, Taurchini M, Tognella S, Umari M, Valenza F, Petrini F; AIPO, Associazione Italiana Pneumologi Ospedalieri; SIAARTI, Società Italiana di Anestesia Analgesia Rianimazione e Terapia Intensiva; SIC, Società Italiana di Chirurgia; SICT, Società Italiana di Chirurgia Toracica; SIET, Società Italiana di Endoscopia Toracica; SIP, Società Italiana di Pneumologia. Recommendations from the Italian intersociety consensus on Perioperative Anesthesia Care in Thoracic surgery (PACTS) part 1: preadmission and preoperative care. Perioper Med (Lond). 2020 Dec 1;9(1):37. doi: 10.1186/s13741-020-00168-y. PMID: 33292657; PMCID: PMC7704118. |
systematic literature review not reported, based on consensus document |
|
KLARIĆ, V., ŠRIBAR, A., MILIĆ, M., MERC, V., ZAJC, I., PERŠEC, J. IDENTIFICATION OF RESPIRATORY RISK PARAMETERS IN OBESE ORAL SURGICAL PATIENTS. Acta medica Croatica: Časopis Akademije medicinskih znanosti Hrvatske, 2017, 71.4: 249-254. |
no predictive values reported |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-04-2025
Beoordeeld op geldigheid : 09-04-2025
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de anesthesiologische zorg voor patiënten met obesitas.
Werkgroep
Dr. T.A. Brouwer, anesthesioloog, NVA
Drs. M.A.M. Siepel, anesthesioloog, NVA
Drs. A.D. Pot, anesthesioloog, NVA
Drs. S.D.X. Oei, AIOS anesthesiologie, NVA (vanaf september 2022)
Dr. B. Torensma, PhD, anesthesiemedewerker, NVAM
Drs. J.A. Apers, chirurg, NVvH
Dr. L. Freeman, gynaecoloog, NVOG (tot oktober 2022)
Dr. D.D.C.A. Henriquez, gynaecoloog, NVOG (vanaf oktober 2022)
Prof. dr. C. A. J. Knibbe, ziekenhuisapotheker, NVZA
Drs. M.A. Damhof, ziekenhuisapotheker, NVZA (vanaf december 2023)
Dr. H.J. Reesink, longarts, NVALT
Drs. H.L. Lutgers, internist-endocrinoloog, NIV (vanaf april 2023)
N.G. Cnossen, patiëntvertegenwoordiger, Nederlandse Stichting Over Gewicht
Klankbordgroep
Dr. M. Klemt-Kropp, MDL-arts, NVMDL
Drs. Ö. Engin, oogarts, NOG
Dr. H. Buter, internist-intensivist, NVIC
N.J.C. Raeijmaekers, BSc, diëtist, NVD/NDBC
Met ondersteuning van
Drs. I. van Dusseldorp, literatuurspecialist, Kennisinstituut van de Federatie van Medisch Specialisten
Dr. J.C. Maas, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Drs. I. van Dijk, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Tammo Brouwer (voorzitter) |
Anesthesioloog, vrij ondernemer. |
Geen |
Geen |
Geen restricties |
|
Alice Dorien Pot |
Anesthesioloog in Meander Medisch Centrum Amersfoort |
Co-auteur boek 'klinische kinderanesthesiologie in de praktijk', initiatief vanuit NVA, uitgeverij Prelum (onbetaald). |
Geen |
Geen restricties |
|
Bart Torensma |
Klinisch epidemioloog en data scientist via eigen bedrijf Torensma Research Consultancy BV. |
"Dagelijks bestuurslid (penningmeester) Stichting COREON Algemeen bestuurslid Vereniging voor epidemiologen. Lesgeven aan de research verpleegkundige Breederode hogeschool Rotterdam
Masterclass gemaakt samen met Medtronic AUE over ERABS en team samenwerkingen." |
Voor PhD (<3 jaar geleden) onderzoek gedaan naar deep block verslapping bij patiënten met obesitas. Deze studie is destijds door MSD gesponsord in de vorm van gratis ampullen sugammadex.
|
Geen restricties |
|
Catherijne A.J. Knibbe |
Ziekenhuisapotheker-klinisch farmacoloog, St. Antonius ziekenhuis Nieuwegein en Utrecht, afdeling Klinische farmacie |
Lid CCMO, Lid Board ACCP |
Diverse studies gefinancierd door ZonMw of Antonius Onderzoeksfonds. De onderzoeken zijn niet gerelateerd aan de richtlijn. |
Geen restricties |
|
Dacia Henriquez |
Gynaecoloog, Amphia Ziekenhuis |
Geen |
Geen |
Geen restricties |
|
Helen Lutgers |
Internist in Ommelander Ziekenhuis Groningen |
Geen |
Geen |
Geen restricties |
|
Herre Reesink |
Longarts, OLVG Amsterdam |
Geen |
Geen |
Geen restricties |
|
Jan Apers |
Chirurg Franciscus Gasthuis & Vlietland |
NVGIC bestuur Dutch Obesity Academy |
Geen |
Geen restricties |
|
Liv Freeman |
Gynaecoloog Ikazia Ziekenhuis Rotterdam |
Voorzitter samenwerking obstetrie anesthesie (onbetaald)
|
Geen |
Geen restricties |
|
Michiel Damhof
|
Ziekenhuisapotheker Medisch Centrum Leeuwarden |
Geen |
Geen |
Geen restricties |
|
Muriel Arianne Michelle Siepel |
Anesthesioloog OLVG Amsterdam |
Geen |
Geen |
Geen restricties |
|
Nienke Cnossen |
Patiëntvertegenwoordiger |
Geen |
Geen |
Geen restricties |
|
Sander Oei |
Aios anesthesiologie. ErasmusMC |
SITdiensten Park Medisch Centrum, betaald. 1-2x/mnd ANWdiensten verpleeghuizen, betaald. 1x/mnd |
Geen |
Geen restricties |
|
Hanneke Buter |
Intensivist |
bestuurslid NVIC |
Geen |
Geen restricties |
|
Michael Klemt-Kropp |
MDL-arts |
Geen |
Geen |
Geen restricties |
|
Natascha Raeijmaekers |
Diëtist Obesitas Centrum, ETZ. Betaald. |
Bestuur Netwerk Diëtisten Bariatrische chirurgie, onbetaald. |
Geen |
Geen restricties |
|
Ozlem Engin |
Oogarts |
Geen |
Geen |
Geen restricties |
|
Irma van Dijk |
Adviseur kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
José Maas |
Adviseur kennisinstituut van de Federatie Medisch specialisten |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van een afvaardiging van de Nederlandse ‘Stichting ‘Overgewicht’ in de werkgroep. Het verslag van de knelpunteninventarisatie [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Stichting en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijn op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Indicatie OSA onderzoek |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (<5.000 patiënten) maar zal naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven.
|
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de anesthesiologische zorg voor patiënten met obesitas. Tevens zijn er knelpunten aangedragen door relevante partijen via een schriftelijke knelpunteninventarisatie. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effect model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Database(s): Ovid/Medline, Embase |
Datum: 15-6-2022 |
|
Periode: 2000- |
Talen: nvt |
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
69 |
22 |
72 |
|
RCTs |
128 |
63 |
147 |
|
Observationele studies |
366 |
151 |
405 |
|
Prognostisch |
17 |
3 |
17 |
|
Totaal |
|
|
|
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#26 |
#9 AND #25 sleutelartikelen niet gevonden |
0 |
|
#25 |
#22 OR #23 OR #24 sleutelartikelen |
3 |
|
#24 |
association AND of AND unrecognized AND obstructive AND sleep AND apnea AND with AND postoperative AND cardiovascular AND events AND in AND patients AND undergoing AND major AND noncardiac AND surgery |
1 |
|
#23 |
preoperative AND screening AND for AND obstructive AND sleep AND apnea AND outcomes AND in AND pacu AND setaro |
1 |
|
#22 |
undiagnosed AND obstructive AND sleep AND apnea AND postoperative AND outcomes AND a AND prospective AND observational AND study. AND respiration AND devaraj |
1 |
|
#21 |
#18 NOT #17 NOT #16 NOT #15 Prognostisch |
17 |
|
#20 |
#17 NOT #16 NOT #15 OBS |
366 |
|
#19 |
#16 NOT #15RCT |
128 |
|
#18 |
#9 AND #14 |
101 |
|
#17 |
#9 AND (#12 OR #13) |
467 |
|
#16 |
#9 AND #11 |
140 |
|
#15 |
#9 AND #10 SR |
69 |
|
#14 |
'area under the curve'/exp OR 'brier score'/exp OR 'computer prediction'/exp OR 'c statistic'/exp OR 'c statistics'/exp OR 'integrated discrimination improvement'/exp OR 'net reclassification improvement'/exp OR 'net reclassification index'/exp OR 'prediction'/exp OR 'predictive model'/exp OR 'predictive modeling'/exp OR 'predictive validity'/exp OR 'predictive value'/exp OR 'regression analysis'/exp OR 'statistical model'/exp OR 'area under the curve':ti,ab,kw OR 'brier score*':ti,ab,kw OR 'c statistic*' OR 'computer prediction':ti,ab,kw OR 'decision curve anal*':ti,ab,kw OR (('net reclassification' NEAR/2 (improvement OR index)):ti,ab,kw) OR (((predict* OR statistical*) NEAR/3 (model* OR validity OR value)):ti,ab,kw) OR 'proportional hazards model*':ti,ab,kw OR 'r square*':ti,ab,kw OR regression:ti,ab,kw OR predict*:ti OR multivariate:ti,ab,kw |
2873597 |
|
#13 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
12697718 |
|
#12 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#11 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1839814 |
|
#10 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#9 |
#8 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
953 |
|
#8 |
#5 AND #7 |
1547 |
|
#7 |
#1 AND #3 |
2548 |
|
#6 |
#1 AND #3 AND #5 |
1700 |
|
#5 |
'adverse event'/exp OR 'side effect'/exp OR 'adverse outcome'/exp OR 'treatment failure'/exp OR 'complication'/exp OR 'death'/exp OR complication*:ti,ab,kw OR 'contraindication*':ti,ab,kw OR 'toxicity and intoxication'/exp/mj OR 'toxic*':ti,ab,kw OR poisoning:ti,ab,kw OR (((adverse* OR side OR toxic* OR intolerable OR harm* OR risk* OR undesirable OR unexpected) NEAR/2 (event* OR ?ffect* OR reaction*)):ab) OR death:ti,ab,kw OR 'surgical risk*':ti,ab,kw OR ((prolong* NEAR/1 admi*):ti,ab,kw) OR adverse*:ti,kw OR side:ti,kw OR toxic*:ti,kw OR intolerable:ti,kw OR harm*:ti,kw OR risk*:ti,kw OR undesirable:ti,kw OR unexpected:ti,kw |
7130234 |
|
#4 |
#1 AND #2 AND #3 |
297 |
|
#3 |
'general anesthesia'/exp OR 'general anaesthe*':ti,ab,kw OR 'general anesthe*':ti,ab,kw |
140185 |
|
#2 |
'sleep disordered breathing'/exp OR 'nocturnal apnea':ti,ab,kw OR 'nocturnal apnoea':ti,ab,kw OR 'obstructive sleep apnoea':ti,ab,kw OR 'sleep apnea':ti,ab,kw OR 'sleep apnoea':ti,ab,kw OR 'sleep disordered breathing':ti,ab,kw OR OSA:ti,ab,kw OR osa:ti,ab,kw |
101721 |
|
#1 |
'obesity'/exp OR obese*:ti,ab,kw OR obesit*:ti,ab,kw OR overweight*:ti,ab,kw OR 'over weight*':ti,ab,kw |
728473 |
Ovid/Medline
|
# |
Searches |
Results |
|
19 |
16 not 15 not 14 not 13 Prognostisch |
3 |
|
18 |
15 not 14 not 13 OBS |
151 |
|
17 |
14 not 13 RCT |
63 |
|
16 |
7 and 12 |
45 |
|
15 |
7 and (10 or 11) |
214 |
|
14 |
7 and 9 |
70 |
|
13 |
7 and 8 SR |
22 |
|
12 |
Area Under Curve/ or exp Forecasting/ or "Predictive Value of Tests"/ or exp Multivariate Analysis/ or exp Regression Analysis/ or exp Models, Statistical/ or area under the curve.ti,ab,kf. or brier score*.ti,ab,kf. or c statistic*.ti,ab,kf. or computer prediction.ti,ab,kf. or decision curve anal*.ti,ab,kf. or (net reclassification adj2 (improvement or index)).ti,ab,kf. or ((predict* or statistical*) adj3 (model* or validity or value)).ti,ab,kf. or proportional hazards model*.ti,ab,kf. or r square*.ti,ab,kf. or regression.ti,ab,kf. or predict*.ti. or multivariate.ti,ab,kf. |
2206952 |
|
11 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5177978 |
|
10 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4171889 |
|
9 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1383777 |
|
8 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
571068 |
|
7 |
6 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
399 |
|
6 |
limit 5 to yr="2000 -Current" |
415 |
|
5 |
3 and 4 |
523 |
|
4 |
exp "Drug-Related Side Effects and Adverse Reactions"/ or exp Drug Eruptions/ or Dose-Response Relationship, Drug/ or exp Treatment Failure/ or exp Contraindications/ or exp toxic actions/ or exp Death/ or ((adverse* or side or toxic or undesirable or unexpected) adj2 (event* or ?ffect* or reaction*)).ab. or (complicati* or contraindicat* or poisoning* or chemically induc*).ti,ab,kf. or (adverse* or side or toxic or undesirable or unexpected).ti,kf. |
3506436 |
|
3 |
1 and 2 |
1422 |
|
2 |
exp Anesthesia, General/ or general anesthe*.ti,ab,kf. or general anaesthe*.ti,ab,kf. |
102597 |
|
1 |
exp Obesity/ or obese*.ti,ab,kf. or obesit*.ti,ab,kf. or overweight*.ti,ab,kf. or 'over weight*'.ti,ab,kf. |
422081 |
