Laboratorium onderzoek bij alcoholmisbruik
Uitgangsvraag
Welke bevindingen bij laboratoriumonderzoek dragen bij om alcoholmisbruik aan te tonen in het kader van onderzoek naar rijgeschiktheid?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de diagnostische waarde van biomarkers in deze en welke zijn geschikt om alcoholmisbruik aan te tonen?
- Welke zijn de te hanteren beslisgrenzen?
- Wat is de diagnostische accuratesse van deze biomarkers?
Aanbeveling
Deelvraag 1 Diagnostische waarde biomarkers alcoholmisbruik
CDT en in mindere mate GGT zijn de meest geschikte laboratoriumparameters voor onderzoek naar alcoholmisbruik in het kader van rijgeschiktheidskeuringen. MCV, ASAT en ALAT zijn niet meer vereist in het kader van onderzoek naar rijgeschiktheid. Het meten van MCV, ASAT en ALAT levert geen meerwaarde op naast CDT en GGT en wordt niet meegenomen in de afweging van alcoholmisbruik. Door het wegvallen van MCV vervalt ook de noodzaak Hb, Ht en erytrocyten te laten bepalen en deze bepalingen worden daarom niet meer aanbevolen in het kader van onderzoek naar rijgeschiktheid.
Het meten van CDT is geschikt om met hoge mate van zekerheid alcoholmisbruik aan te tonen in het kader van onderzoek naar rijgeschiktheid. Voor kwantitatief onderzoek en bij hogere prevalentie, zoals bij onderzoek naar rijgeschiktheid, scoort CDT in vergelijking met andere algemeen gebruikte laboratoriumtesten het beste voor het opsporen van alcoholmisbruik. Aan de CDT-uitslag moet daarom de meeste waarde worden toegekend.
De werkgroep is van mening dat het meten van GGT bijdraagt aan het opsporen van alcoholmisbruik bij onderzoek naar rijgeschiktheid. Een solitair verhoogde GGT (boven het afkappunt) vormt alleen een aanwijzing voor alcoholmisbruik als andere mogelijke oorzaken, waaronder leverpathologie of enzyminductie, aannemelijk zijn uitgesloten.
Deelvraag 2: Beslisgrenzen (afkappunten) voor CDT en GGT
CDT
Een CDT-uitslag > 2,0% (het afkappunt), als enkelvoudige uitslag verkregen met een conform IFCC gestandaardiseerde methode of met de IFCC-referentiemethode, betekent een niet meer normale waarde, rekening houdend met de meetonzekerheid. Mits andere oorzaken aantoonbaar zijn uitgesloten kan een dergelijke CDT-uitslag dienen als bewijs voor alcoholmisbruik in de laatste weken.
Een uitslag hoger dan de bovengrens van het referentie interval (1,7%), maar lager of gelijk aan het afkappunt (2,0%) geldt niet als aanwijzing of bewijs voor alcoholmisbruik in de laatste weken.
GGT
Een GGT-uitslag > 74 U/L voor mannen en > 44 U/L voor vrouwen (de afkappunten), als enkelvoudige uitslag verkregen met de IFCC-methode bij 37°C of een daarop gestandaardiseerde methode, betekent een niet meer normale waarde, rekening houdend met de meetonzekerheid. Mits andere oorzaken aantoonbaar zijn uitgesloten, kan een dergelijke GGT-uitslag dienen als aanwijzing voor alcoholmisbruik.
Een uitslag hoger dan de bovengrens van het referentie interval (68 U/L voor mannen en 40 U/L voor vrouwen), maar lager of gelijk aan het afkappunt (74 U/L voor mannen en 44 U/L voor vrouwen) geldt niet als aanwijzing voor alcoholmisbruik in de laatste weken.
Deelvraag 3 Wat is de diagnostische accuratesse van de biomarkers CDT en GGT
CDT en in mindere mate GGT zijn geschikte laboratoriumparameters voor een beoordeling van alcoholmisbruik in het kader van onderzoek naar rijgeschiktheid.
Bij de gekozen afkappunten t.a.v. alcoholmisbruik in het kader van rijgeschiktheid kennen CDT en GGT (bij de aanbevolen methode) een relatief hoge specificiteit en lage sensitiviteit.
Overwegingen
Deelvraag 1 Diagnostische waarde biomarkers alcoholmisbruik
Area Under the Curve (AUC)
De gevonden AUC-waardes in de geïncludeerde studies varieerden. Dit komt mede door verschillen in het uitgevoerde labonderzoek, populatie verschillen (populaties met continue verdeling versus bimodale of trimodale populaties), referentiemethode zoals een interview of alcoholdagboekje en gehanteerde definities van drinkgedrag. Ook is zelf-gerapporteerd drinkgedrag gevoelig voor het geven van sociaal wenselijke antwoorden wat leidt tot rapportagebias. Toch wordt ervan uit gegaan dat ondanks een onderrapportage er wel onderscheid te maken is tussen mensen die heel veel drinken en mensen die weinig drinken.
Een AUC rond 0,6 of lager betekent ongeschiktheid van de marker, indien de studie correct is opgezet. Op basis van de AUC-waarden in de geïncludeerde studies blijkt dat CDT en in mindere mate GGT beter geschikt zijn dan ASAT, ALAT of MCV voor het opsporen van overmatig alcoholgebruik (voor nadere overwegingen rondom ASAT/ALAT en MCV zie de aanverwante producten ‘Toelichting overwegingen bij MCV’ en ‘bij ASAT en ALAT’.
CDT blijkt binnen de groep CDT, MCV, GGT, ASAT, ALAT het meest geschikt om recidieven te voorspellen van alcoholgebruik door automobilisten (Maenhout, 2014). De overige parameters scoorden nauwelijks beter dan willekeurig positief/negatief. In de algemene populatie en vergelijkende studies met de traditionele biomarkers GGT, MCV of ASAT en ALAT scoort CDT het beste, zoals onder meer uit de AUC-waarden blijkt (zie tabel 1).
Comorbiditeit
De ideale biomarker wordt niet of nauwelijks beïnvloed door comorbiditeit. Vaak worden bij studies van biomarkers voor alcoholisme de populaties opgeschoond voor andere pathologie zoals diabetes, hetgeen ten opzichte van de algemene populaties de resultaten kan beïnvloeden.
Comorbiditeit CDT
Een licht verhoogde waarde van CDT kan ook voorkomen bij ‘endstage’ leverziekten, bij sterk verlaagde transferrineconcentraties (Latex methode), bij een levercarcinoom en in de tweede helft van de zwangerschap (Arndt, 2001; Fleming, 2004; Bortolotti, 2006; Bergström CCA, 2008; Kenan, 2011). Bij studies met de N-Latex methode werd door sommigen een verminderde respons voor CDT gemeld bij vrouwen (Whitfield, 2008, Kok, 2015), dat kan ook te maken hebben met onderrapportage van het alcoholgebruik. Leeftijd is ook genoemd als factor (jongere mensen verwerken alcohol sneller) of geslacht (vrouwen hebben een lagere respons dan mannen), echter in een uitgebreide studie met de HPLC-methode was er geen significant verschil aantoonbaar voor geslacht, leeftijd, roken of BMI (Bergström, 2008) (zie ook de ‘Achtergronden bij de waarde van GGT als biomarker’ bij de aanverwante producten). Het voedingspatroon, frequent voorkomende ziektebeelden en het gebruik van de meest voorkomende geneesmiddelen in de huisartsenpraktijk blijken geen effect op de CDT-bepaling te hebben (Meerkerk, 1998; Fleming, 2004).
Comorbiditeit GGT
De waarde van GGT in het bloed kan ook verhoogd zijn door andere oorzaken. Er is een breed scala van klinische aandoeningen, die leiden tot een significant verhoogde GGT-waarde. Daarnaast geven leefstijl of omgevingsfactoren als roken of contact met xenobiotica verhoogde GGT-waarden terwijl ruim gebruik van koffie de GGT-waarde weer aanzienlijk kan doen dalen (zie ook de ‘Achtergronden bij de waarde van CDT als biomarker’ bij de aanverwante producten). Tabel 4 biedt een overzicht van voornaamste oorzaken van een verhoogde GGT-waarde.
Tabel 4 Voornaamste oorzaken verhoogd GGT
|
Galweg obstructie (galstenen, leververvetting) |
|
Enzym inductie (alcohol, geneesmiddelen en xenobiotica, zie onderaan deze tabel) |
|
Hepatitis (viraal, toxisch, alcoholisch), mononucleosis infectiosa |
|
Lever pathologie (cirrhose, tumor) |
|
Pancreas pathologie |
|
Chronische nierziekten |
|
Cardiovasculaire ziekten (leverstuwing/hartfalen, post AMI, hypertensie) |
|
Kanker (borst, prostaat, longen etc) |
|
Diabetes |
|
Colitis |
|
Hemochromatose |
|
Hodgkin & Non-Hodgkin |
|
Orale anticonceptie |
Enzyminductie leidt tot een maximaal twee a drievoudige GGT-verhoging ten opzichte van bovengrens normaal, naast alcohol moeten genoemd worden:
- Geneesmiddelen, waaronder barbituraten, psychofarmaca, statines, antidepressiva, fenytoïne, carbamazepine, rifampicine, antireumatica, MAO-remmers, anabole steroïden, thiazide diuretica, cytostatica, streptokinase, hoge paracetamol doses, NSAIDs, antibiotica, antifungica (voor een uitgebreide lijst raadpleeg Wu, 2006).
- Xenobiotica, waaronder oplosmiddelen als tetra, pesticiden.
Populatie
Studies worden idealiter uitgevoerd in de algemene populatie of bij mensen die worden uitgenodigd voor onderzoek naar rijgeschiktheid. Bergström en McDonald komen met hun selectie uit de algemene populatie het dichtste bij de werkelijke populatie in het kader van onderzoek naar rijgeschiktheid. Waar mogelijk is gekeken naar de discriminatie tussen ‘normaal’ en ‘at risk’ gebruik. Kharbouche bijvoorbeeld laat duidelijk zien dat ‘heavy’ gebruik gemakkelijker te diagnosticeren is met alle biomarkers, dat geldt vooral voor ASAT en ALAT (AUC heavy stijgt naar respectievelijk 0,79 en 0,73) en minder voor CDT en GGT (AUC heavy respectievelijk 0,84 en 0,79).
Nieuwe biomarkers
Naast de oude indirecte biomarkers als MCV, GGT, ASAT en ALAT (indirecte verhoging door cel schade of metabolisme storing na alcoholmisbruik) en de relatief nieuwe marker CDT trekken vooral de nieuwe directe biomarkers (alcohol metabolieten) in bloed, urine en haar-monsters de aandacht.
Voorbeelden van die directe biomarkers zijn ethylglucuronide (EtG) in bloed en urine, fosfatidylethanol (PEth) in bloed en EtG of vetzure ethylesters (FAEES) in haar. Een technische belemmering is dat het meten van de nieuwste biomarkers vaak erg gecompliceerd is en daardoor buiten het bereik van veel laboratoria valt. Eveneens belangrijk is dat voor onderzoek naar alcoholmisbruik in het kader van rijgeschiktheidskeuringen (dus voor forensisch gebruik) naast een goed gevalideerde methode ook terdege onderbouwde en geaccepteerde grenzen aanwezig moeten zijn. Aangezien dit nog niet het geval is, worden PEth, EtG in urine of haaranalyse buiten beschouwing gelaten in deze richtlijn (een korte toelichting wordt gegeven in ‘Nieuwe biomarkers bij opsporen alcoholmisbruik’ bij de aanverwante producten). Het meten van alcohol in bloed of in adem wordt niet ingezet bij onderzoek naar alcoholmisbruik in het kader van rijgeschiktheidskeuringen en valt daarmee buiten het bestek van deze richtlijn.
Deelvraag 2: Beslisgrenzen (afkappunten) voor CDT en GGT
CDT
Metingen ten behoeve van onderzoek naar rijgeschiktheid in het kader van alcoholmisbruik worden uitgevoerd in gespecificeerde laboratoria. Sinds 2019 zijn de resultaten van alle in Nederland toegelaten methoden gestandaardiseerd, dat wil zeggen herleidbaar naar de IFCC HPLC referentiemethode en leveren daardoor, voor hetzelfde monster, vergelijkbare resultaten. De NVKC hanteert de aanbevolen IFCC-bovengrens van het 95% referentiegebied (Schellenberg, 2017) van 1,7% voor de HPLC-referentiemethode, de meetonzekerheid van 0,3 procentpunt en het afkappunt (beslisgrens) van 2,0% voor forensisch gebruik, waaronder begrepen onderzoek naar rijgeschiktheid. Het afkappunt 2,0% is dus de hoogste waarde die nog voor kan komen bij de normale populatie, rekening houdend met de meetonzekerheid. Voor CDT komt dit afkappunt overeen met de waarde genoemd in de geldende NVKC Richtlijn ‘Geschiktheid van CDT-analysemethoden’.
Bij twijfel of bij dispuut van een uitslag gevonden met een commerciële methode, moet de IFCC-referentiemethode (HPLC volgens Helander, 2003) worden ingezet[1]. De uitslag van de referentiemethode is doorslaggevend. Rapportage van CDT-resultaten met de IFCC-referentiemethode of met een daarop gestandaardiseerde commerciële methode is herkenbaar door gebruik van de aanduiding CDTIFCC. Met de introductie van de CDTIFCC is het gebruiken van de overzichtstabel in de NVKC Richtlijn (2015) van methode afhankelijke bovengrenzen en afkappunten, verleden tijd geworden. De IFCC-standaardisatie, de bijbehorende bovengrens en het afkappunt zijn met ingang van 2019 overgenomen door het CBR (zie brief CBR aan laboratoria d.d. 14 december 2018). Daarmee ligt vast dat sensitiviteit, specificiteit en diagnostische accuratesse gekoppeld moet zijn aan een CDTIFCC van 2,0%.
GGT
De GGT-activiteit in serum of plasma wordt gemeten met een colorimetrische methode en glutamyl-carboxy p-nitroanalide als substraat. Aanbevolen wordt de IFCC-methode bij 37°C, dan wel een methode die hiertegen is gestandaardiseerd. Ingevroren monsters zijn een jaar stabiel bij -20°C.
Wat betreft beslisgrenzen wordt voor GGT uitgegaan van de bovengrens van normaal volgens internationaal IFCC-referentiegebieden onderzoek. Daarboven op komt voor forensisch gebruik, waaronder inbegrepen onderzoek naar rijgeschiktheid, een gepubliceerde marge voor de meetonzekerheid. Voor de IFCC-methode, uitgevoerd bij 37°C is uitgegaan van internationaal referentie-interval onderzoek (Ceriotti, 2010) plus de meetonzekerheid (9% volgens Zhou, 2018). Ceriotti (2010) vond een referentie interval van 12-68 U/L voor mannen, met 9% meetonzekerheid erbij wordt het afkappunt dan 74 U/L. Voor vrouwen werd een referentie interval van 6-40 U/L gevonden, met 9% meetonzekerheid erbij wordt het afkappunt dan 44 U/L.
Deelvraag 3 Wat is de diagnostische accuratesse van de biomarkers CDT en GGT
Doel bij onderzoek naar rijgeschiktheid is om met grote mate van zekerheid chronisch overmatig gebruik aan te tonen of uit te sluiten. Bij dergelijke forensische metingen is het van belang om het aantal fout-positieven laag te houden. Zowel voor GGT als voor CDT zijn de diagnostische prestaties bij de in deze richtlijn aanbevolen afkappunten zodanig dat er sprake is van een hoge specificiteit en een lage sensitiviteit.[2]
[1] Betrokkenen heeft recht om herkeuring op gebruikte bloedmonster te laten uitvoeren. Dit verzoek kan ook door advocaat worden gedaan (zie de module ‘Juridisch kader’).
[2] De sensitiviteit van een test is het percentage terecht positieve uitslagen onder personen die alcohol misbruiken. De specificiteit van een test is het percentage terecht negatieve testuitslagen onder de personen die geen alcohol misbruiken. Hoe hoger de specificiteit is, hoe beter de test mensen die geen alcohol misbruiken als negatief aanwijst. Een test met lage specificiteit geeft aan veel gezonde/normale deelnemers een afwijkende/te hoge uitslag. Bij onderzoek naar rijgeschiktheid zou dat betekenen dat veel verkeersdeelnemers onterecht de conclusie alcoholmisbruik zouden krijgen, hetgeen ongewenst is. Daarom is het afkappunt verhoogd om de kans op dergelijke fout positieve uitslagen laag te houden.
Onderbouwing
Achtergrond
Laboratoriumonderzoek kan gebruikt worden ter bevestiging van het diagnostische vermoeden van alcoholmisbruik, maar ook als confrontatiemiddel. Laboratoriumonderzoek geeft, afhankelijk van de gebruikte parameters, een weerslag van het alcoholgebruik over een bepaalde tijdsperiode, die kan variëren van minder dan één dag tot meerdere weken. Hiervoor zijn biochemische indicatoren, onderverdeeld in directe indicatoren (ethanol en metabolieten van ethanol) en indirecte indicatoren, die de effecten van alcohol op organen of de stofwisseling weerspiegelen, beschikbaar (Van de Wiel, 2009). Voor het bevestigen of weerleggen van chronisch overmatig alcoholgebruik wordt traditioneel zowel chemisch onderzoek (GGT, ASAT, ALAT, CDT) als hematologisch onderzoek (MCV) ingezet.[1] Laboratoriumonderzoek naar alcoholmisbruik in het kader van de rijgeschiktheid wordt op verzoek van de psychiater uitgevoerd door goedgekeurde medische laboratoria. Dit gebeurt conform de NVKC Richtlijn ' Geschiktheid van CDT-analysemethoden’ en de CBR-notitie ‘Kies het juiste laboratorium’.
Deelvraag 1 Diagnostische waarde biomarkers alcoholmisbruik
Bij een vergelijking van biomarkers naar alcoholmisbruik moet gekeken worden naar de aanwezigheid van een causale directe relatie tussen de biomarker en alcoholinname. Het niveau van de biomarker in het bloed wordt dan vergeleken met zelf-gerapporteerde alcoholinname. Er zijn geen studies bekend waarbij aan grotere groepen gedocumenteerd verschillende hoeveelheden alcohol werd toegediend en vervolgens de respons werd gemeten.
Bij deze uitgangsvraag wordt de diagnostische waarde van MCV, ASAT & ALAT, CDT en GGT onderling vergeleken met behulp van ROC-curves en AUC-waarden.[2]
Deelvraag 2: Beslisgrenzen (afkappunten) voor CDT en GGT
Bij het gebruik van biomarkers is het noodzakelijk om klinische ijkpunten te definiëren. De psychiatrische criteria t.a.v. alcoholmisbruik zijn echter niet direct te vertalen naar een corresponderend niveau van een biomarker. Als alternatief wordt daarom gekozen om de normale populatie vast te stellen plus de meetfout om met zekerheid vast te kunnen stellen wanneer iemand daarbuiten valt. Deze procedure is vergelijkbaar met onderzoek naar aanwezigheid van alcohol of drugs in bloed.
Bij de medische interpretatie van laboratoriumonderzoek wordt een uitslag doorgaans vergeleken met een grenswaarde zoals de bovengrens van een 'referentiegebied'. Een referentie gebied (of referentie interval) werd vroeger ook het normaalwaarde gebied genoemd. Het referentiegebied wordt gedefinieerd als de centrale waarden die met 95% van de gezonde populatie corresponderen, dwz 2,5% van de gezonden valt boven de bovengrens en 2,5% van de gezonden valt beneden de ondergrens. Gebruik van deze 95%-referentiegebied bovengrens, zonder rekening te houden met de meetfout, leidt tot een significant percentage fout positieven, hetgeen ongewenst is voor juridische of forensische zaken. Verder is de bovengrens van een normale populatie zeker niet hetzelfde als de ondergrens van een bewezen stoornis.
Bij juridische of forensische zaken wordt zo mogelijk gewerkt met een beslisgrens, ook afkappunt genoemd, waarboven de afwijking zeer waarschijnlijk is. Dit afkappunt is vastgesteld op basis van wetenschappelijk onderzoek en houdt rekening met de meetfout en met de intra-individuele variatie voor de betrokken biomarker. Het afkappunt wordt berekend op basis van de bovengrens plus de meetonzekerheid (meetfout en biologische variatie), zie figuur 1. Het afkappunt geldt voor één enkelvoudige meting in één van de goedgekeurde medische laboratoria. Voor een uitslag hoger dan het afkappunt mag met een statistische zekerheid van 95% gesteld worden, dat deze niet meer tot de normale populatie behoort.
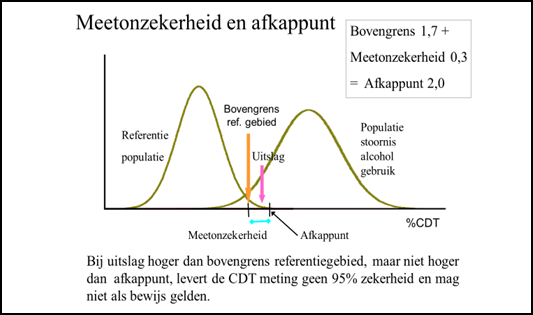
Figuur 1 Meetonzekerheid en afkappunt CDT
Het laboratorium rapporteert een bevinding voor de bepaalde biomarkers. Bij de interpretatie van laboratoriumonderzoek wordt deze waarde vergeleken met een grenswaarde. Boven deze grenswaarde is afwijkend alcoholgebruik zeer waarschijnlijk. Verder moet er bij het hanteren van een grenswaarde altijd rekening gehouden worden met de meetfout van de methode en met de intra-individuele variatie. Daarnaast moet bij de individuele beoordeling van een laboratoriumuitslag rekening gehouden worden met eventuele verstorende comorbiditeit (zie overwegingen onder deelvraag 1 in deze module) bij de betrokkene en indien van toepassing ook met monstertransport en opslagcondities.
Doel bij het onderzoek naar alcoholmisbruik in het kader van rijgeschiktheid is om met grote mate van zekerheid chronisch overmatig gebruik aan te tonen of uit te sluiten, het gaat niet om het meten van recent alcohol gebruik.
Deelvraag 3 Wat is de diagnostische accuratesse van de biomarkers CDT en GGT
Uit deelvraag 1 is naar voren gekomen dat CDT en in mindere mate GGT de meest geschikte laboratoriumparameters zijn voor een beoordeling van alcoholmisbruik in het kader van onderzoek naar rijgeschiktheid. Hier gaan we nader in op de diagnostische accuratesse van deze biomarkers bij de in deze richtlijn voorgestelde afkappunten.
[1] Alcohol wordt in het lichaam voornamelijk via acetaldehyde omgezet in acetyl-CoA en als brandstof gebruikt, dan wel als vet opgeslagen en leidt dan tot leversteatose. Overmatig alcoholgebruik leidt tot een reversibele steatose, die op de duur kan overgaan in fibrose, cirrose en soms leverkanker of alcoholische hepatitis. Acetaldehyde en het onder invloed van alcohol en/of roken door lipide peroxydatie ontstane malonaldehyde zijn vooral verantwoordelijk voor de levertoxiciteit. Deze aldehyden en ontstane radicalen zorgen zowel voor cel schade als voor een verlaging van de antioxidanten concentratie, waaronder glutathion.
Een CDT-verhoging ontstaat door een remming van acetaldehyde op de voor glycosylering van transferrine noodzakelijke enzymen in het zogenaamde golgicomplex van de levercel. Een GGT-verhoging wordt vooral veroorzaakt door enzyminductie ten gevolge van verlaging van de antioxidanten (glutathion) en verder door obstructieve leverziekten. ASAT en ALAT komen vrij bij levercel schade en in verhoogde mate (vooral mitochondriaal ASAT) bij het afsterven van levercellen. MCV-verhoging wordt zowel veroorzaakt door een effect van acetaldehyde op de erytropoëse in het beenmerg als door de vaak voorkomende B12/foliumzuur deficiënties bij alcoholici.
[2] Een ROC-curve is een grafiek waarin de sensitiviteit en specificiteit voor alle mogelijke afkapwaarden worden afgebeeld. Op de y-as staat de sensitiviteit en op de x-as staat 1-specificiteit. De curve loopt van linksonder (sensitiviteit 0%, specificiteit 100%) naar rechtsboven (sensitiviteit 100%, specificiteit 0%). De ROC-curve is ook een maat voor de waarde van een test, los van het afkappunt. Naarmate de curve meer in de linkerbovenhoek ligt, is de test beter omdat zowel de sensitiviteit als de specificiteit de ideale 100% dichter benaderen; de oppervlakte onder de ROC-curve (area under the curve, AUC) is daarom een samenvattende maat. De waarden 0,5 en 1,0 corresponderen met respectievelijk geen en een perfect diagnostisch vermogen.
Conclusies / Summary of Findings
Deelvraag 1 Diagnostische waarde biomarkers alcoholmisbruik
|
Laag GRADE |
Diagnostische waarde De diagnostische waarde van CDT en GGT was goed, respectievelijk redelijk, met voor CDT een AUC rond de 0,80 en voor GGT een AUC van 0,6 tot 0,8. Dat is duidelijk beter dan voor ASAT, ALAT en MCV, met diagnostische waarden grotendeels variërend tussen 0,6 en 0,7.
Bronnen: (Bergström, 2008; Kharbouche, 2012; McDonald, 2013; Pirro, 2011) |
Deelvraag 3 Wat is de diagnostische accuratesse van de biomarkers CDT en GGT
CDT
|
Laag GRADE |
Diagnostische testeigenschappen De sensitiviteit van CDT voor overmatige alcoholinname gevalideerd tegen zelf-gerapporteerde inname met een vragenlijst of gestructureerd interview varieerde van 36 tot 51% en de specificiteit varieerde van 91% tot 96%, bij gebruik van het afkappunt voor CDTifcc van 2,0%.
Bronnen: (Bergström, 2008; Pirro, 2011) |
Gamma GT
|
Laag/ Zeer laag GRADE |
Diagnostische testeigenschappen De sensitiviteit van GGT voor overmatige alcoholinname gevalideerd tegen zelf-gerapporteerde inname met een vragenlijst of gestructureerd interview varieerde van 30 tot 66%, en de specificiteit varieerde van 80% tot 81% bij gebruik van een bovengrens van afkappunt 64 en 80 iU/l.
Bronnen: (Bergström, 2008; McDonald, 2013; Pirro, 2011)) |
Samenvatting literatuur
Deelvraag 1 Diagnostische waarde biomarkers alcoholmisbruik
Literatuur analyse is gedaan voor de biomarkers MCV, ASAT & ALAT, CDT en GGT. Aanvullend wordt kort ingegaan op potentiële nieuwe markers als PEth, EtG en haaranalyse.
Vier onderzoeken zijn opgenomen in de systematische literatuuranalyse, zie tabel 1 en tabel 2 voor een overzicht van deze studies. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Tabel 1 Area under the ROC-curve (AUC) voor CDT, GGT, ALAT/ASAT en MCV van de geïncludeerde studies
|
Studie |
Methode CDT
|
Methode GGT
|
AUC CDT |
AUC GGT |
AUC ALAT/ASAT |
AUC MCV |
Type populatie |
|
Bergström 2008 |
HPLC, IFCC referentie- methode |
Reflexie spectrofo-tometrie Vitros |
0,83 man, en 0,82 vrouw |
0,69 |
- |
- |
‘Licht/ matig’ drinken versus ‘hevig drinken’ in algemene populatie gezondheidscentrum, continue verdeling |
|
Kharbouche 2012 |
CDT Capillaire elektroforese, Analis methode |
γGT Dimension® Xpand® Plus (Siemens) |
0,80 |
0,76 |
0,60 en 0,65 |
- |
Alcoholici, sociale drinkers en non-drinkers; drie gelijke groepen |
|
McDonald 2013 |
Capillaire elektroforese Sebia methode |
Kinetische colorimetrische methode |
0,75 |
0,61 |
ALAT 0,55
ASAT 0,61 |
0,70 |
Algemene gezondheidscheck en continue inname verdeling
|
|
Pirro 2011 |
HPLC, BioRad methode |
GGT, IFCC-methode |
0,77 |
0,83 |
0,73 en 0,61 |
0,73 |
Alcoholici, sociale drinkers en non-drinkers; drie gelijke groepen |
Tabel 2 Kenmerken van studies waarin de diagnostische waarde van CDT en GGT werd beschreven: setting land, onderzoeksdesign, %vrouwen, leeftijd, prevalentie hevig drinken, type bepaling, afkappunt en referentiestandaard
|
Studie referentie |
Studie kenmerken
|
Type studie |
Aantal patiënten |
Proportie vrouwelijk Geslacht |
Beschrijving alcoholgebruik
|
Leeftijd |
Prevalentie hevig drinken |
Methode CDT |
CDT-afkappunt |
Methode GGT |
GGT afkappunt (mg/g) |
Referentie standaard |
|
Bergström, 2008 |
Setting: algemene populatie
Land: Australië, Brazilië, Canada, Finland en Japan |
Cross-sectioneel |
1387 |
32% |
Niet drinken, licht tot matig drinken, hevig drinken
|
18-65 |
24% |
HPLC, IFCC referentie methode |
2,0% |
GGT (zie Conigrave et al., 2002) |
|
WHO/ISBRA Interview Schema |
|
Kharbouche, 2012 |
Setting: deelnemers werden geworven m.b.v. advertenties en posters
Land: Zwitserland |
Cross- sectioneel |
43 geheel- onthouders, 44 laag-risico drinkers, 38 at-risk drinkers |
55% |
‘geheelonthouders, laag-risico drinkers, at-risk drinkers’ |
Gemm. Geheel-onthouders 37,5 ±16,6, laag-risico drinkers 35,3 ± 13,1 risico drinkers 42,3 ± 14,0 |
30% risico drinken |
Capillaire elektroforese CDT |
via ROC geoptimaliseerde cutoff, waarde niet vermeld |
GGT gemeten met Dimension Xpand plus (Siemens) |
via ROC geoptimaliseerde cutoff, waarde niet benoemd niet vermeld |
Dagelijks alcohol zelf-rapportage dagboek gemeten over een driemaandelijkse periode |
|
Mc Donald, 2013 |
Setting: Algemene populatie
Land: Rusland |
Cross-sectioneel |
1023 |
0% |
Niet drinken, huidig drinken; gevaarlijk drink patroon |
27-59 |
Niet gespecificeerd |
Capillaire elektroforese, Sebia methode |
1,3% |
Kinetische colorimetrische methode |
referentie interval 80 IU/l |
Zelf-gerapporteerde alcohoinname mbv een vragenlijst |
|
Pirro, 2011 |
Setting: ontwenningskliniek en algemene populatie
Country: Italië |
Cross-sectioneel |
175 |
17% |
Niet drinken, sociaal drinken, hevig drinken |
22-74 |
59/175=34% |
HPLC BioRad methode |
2,0% |
GGT, in overeenstemming met de Internationale Federatie van Klinische Chemie (IFCC) aanbevelingen |
64 IU/l |
Audit vragenlijst en interviews door artsen |
Beschrijving van de studies
Bergström (2008) valideerde CDT tegen een gestructureerd interview bij 1387 personen in de WHO/ISBRA-studie. De deelnemers waren uit vijf landen afkomstig: Australië, Brazilië, Canada, Finland en Japan. De deelnemers waren 18 tot 65 jaar oud (gemiddeld 36,9; mediaan 35), 68% waren mannen (in Australië en Finland werden uitsluitend mannen geworven) en 32% vrouwen. Op basis van de interviews werden de deelnemers geclassificeerd als ‘niet-drinker’ (niet drinkend tot en met maximaal zes gelegenheden per jaar en niet meer dan 15g ethanol per keer), ‘lichte tot matige drinker’ (minstens eens per maand maar minder dan 210 g/week mannen en 140 g/week vrouwen), en ‘zware drinker’ (>210g/week mannen; >140 g/week vrouwen; geen geschiedenis van alcohol gerelateerde problemen).
Kharbouche (2012) includeerde 125 personen in de categorieën ‘geheelonthouders’, ‘laag-risicodrinkers’, ‘at-risk drinkers’ en ‘hevige drinkers’. Alcoholgebruik werd ingeschat aan de hand van een prospectief bijgehouden dagboek, de ‘daily alcohol self-monitoring log’ (DASM-log). De biomarkers CDT, GGT, ALAT/ASAT en EtG werden bepaald.
McDonald (2013) valideerde CDT tegen zelf-gerapporteerde alcoholinname bij 1023 mannen uit de algemene populatie in Izhevsk, Rusland. Deze mannen waren at random benaderd vanuit het bevolkingsregister, origineel als lid van de controlegroep van een andere studie. Voorwaarde voor deelname aan deze studie was de bepaling van minstens één biomarker. De interviews werden face-to-face uitgevoerd door getrainde sociologen met een vragenlijst die ontworpen was om zeer gedetailleerde alcoholinname uit te vragen gedurende de voorgaande 12 maanden. Na dit interview kregen deelnemers een gezondheidscheck aangeboden door een arts, daarbij werd ook bloed afgenomen. Bij net iets meer dan 50% van de deelnemers werd bloed afgenomen en waren drie of meer biomarkers beschikbaar. De volgende biomarkers waren bepaald: carbohydraatdeficiënt transferrine (CDT), gamma-glutamyl transferase (GGT), alanine aminotransferase (ALT), aspartate aminotransferase (AST) en mean cell volume of erythrocytes (MCV) en hepatitis B en C status. De diagnostische waarde werd bepaald in vergelijking met de zelf-gerapporteerde inname. Analyses werden beschreven voor drinkers versus niet-drinkers; ‘gevaarlijke drinkers (waarbij ook het drinken van alcohol die niet voor consumptie bedoeld was werd meegenomen)’ versus niet-gevaarlijke drinkers, >40g/dag versus <40g/dag en riskante versus niet riskante drinker. Gekozen werd om de data te gebruiken van de grenswaarde 40 g/dag
Pirro (2011) includeerde 175 deelnemers in twee alcoholontwenningsklinieken in Piedmont, Italie. Van deze deelnemers werden er 65 ingedeeld als niet-drinkers (dit waren deels vrijwilligers), 51 als sociale drinkers (in de kliniek vanwege een andere verslaving) en 59 als actieve hevige drinkers. Deze indeling werd gemaakt door artsen met gebruik van de Audit en uitgebreide interviews.
CDT werd bepaald met de HPLC reagent kit van BioRad (Munich, Germany) met een afkappunt van 2,0%. De biomarkers ASAT, ALAT, gamma-GT, CDT en MCV werden bepaald in bloed en ETG werd bepaald in haarsamples.
Beschrijving resultaten
In de vier studies werd telkens gevonden dat CDT en GGT een hogere area under the ROC-curve hadden dan ASAT/ALAT en MCV (zie tabel 1). De AUC-waardes varieerden tussen:
CDT 0,75 – 0,83
GGT 0,61 – 0,83
ALAT 0,55 – 0,73
ASAT 0,61 – 0,65
MCV 0,70 – 0,73
Bewijskracht van de literatuur
De bewijskracht voor de diagnostische waarde werd als laag gewaardeerd vanwege de volgende factoren: alcoholinname werd vaak niet uitgevraagd door een psychiater maar door anderen of met een (vaak niet-gevalideerde) vragenlijst. Hierbij is een hoog risico op bias aangezien alcoholconsumptie vaak wordt ondergerapproteerd. Verder kwam de populatie in deze studies niet overeen met de populatie van de richtlijn namelijk mensen die waren aangehouden wegens rijden met een te hoog alcoholpercentage, dus daarom werd de bewijskracht verlaagd wegens indirectheid. Een andere tekortkoming was de heterogeniteit in de studieopzet, de prevalentie van problematisch drinkgedrag varieerde van 24% tot 34%, of was niet aangegeven.
Deelvraag 3 Wat is de diagnostische accuratesse van de biomarkers CDT en GGT
Literatuur analyse is gedaan voor de biomarkers CDT en GGT.
Drie onderzoeken zijn opgenomen in de systematische literatuuranalyse, zie tabel 1 en tabel 2 voor een overzicht van deze studies. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Beschrijving resultaten
Voor een beschrijving van de geselecteerde studies wordt verwezen naar deelvraag 1 van deze module: wat is de diagnostische waarde van de geselecteerde biomarkers. De diagnostische accuratesse van de geselecteerde studies is weergegeven in tabel 3.
Bergström (2008) vond voor CDT bij een afkappunt van 2,0%, een sensitiviteit van 36,1% en een specificiteit van 95,9%. Voor GGT werd geen sensitiviteit en specificiteit beschreven en voor de andere biomarkers ook niet.
McDonald (2013) bepaalde CDT met capillaire elektroforese van Sebia met als afkappunt 1,3% zijnde de bovengrens van het referentiegebied. Aangezien dit bij lange na niet overeenkomt met 2,0% volgens de IFCC-referentiemethode, worden sensitiviteit en specificiteit hier niet beschreven. Voor GGT hanteerde deze studie een afkappunt van 80, dat dicht in de buurt zit van de 74 die deze richtlijn hanteert. Voor GGT werd een sensitiviteit van 30% gevonden en een specificiteit van 80%.
Pirro (2011) bepaalde CDT met de HPLC reagent kit van BioRad (Munich, Germany) met een afkappunt van 2,0%. en vond een sensitiviteit van 50,8% en een specificiteit van 90,5%. Voor GGT vond de studie van Pirro (2011) een sensitiviteit van 66,1% en een specificiteit van 81,0% wanneer een afkappunt van 64IU/l werd gehanteerd.
Tabel 3 Sensitiviteit, specificiteit voor CDT, GGT, ALAT/ASAT en MCV van de geïncludeerde studies
|
Studie |
Methode CDT Afkappunt |
Methode GGT Afkappunt |
Sensitiviteit CDT |
Sensitiviteit GGT |
Sensitiviteit ALAT en ASAT |
Sensitiviteit MCV |
Specificiteit CDT |
Specificiteit GGT |
Specificiteit ALAT en ASAT |
Specificiteit MCV |
Type populatie |
|
Bergström, 2008 |
HPLC, IFCC referentiemethode 2,0% |
Reflexie spectrofo-tometrie Vitros 40 IU/l |
36%
|
- |
- |
- |
96%
|
- |
- |
- |
‘Licht/ matig’ drinken versus ‘hevig drinken’ in algemene populatie gezondheidscentrum, continue verdeling |
|
Mcdonald, 2013 |
capillaire elektroforese, Sebia methode
1,3% |
Kinetische colorimetrische methode
referentie interval 80 IU/ |
niet beschreven wegens afkappunt van 1,3% |
30% |
ALAT 29%
ASAT 35% |
8,7% |
Niet beschreven wegens afkappunt 1,3%% |
80% |
ALAT 83%
ASAT 78% |
97% |
Algemene gezondheidscheck en continue inname verdeling |
|
Pirro, 2011 |
HPLC, Biorad methode 2,0% |
GGTIFCC-methode |
51% |
66% |
48% en 36% |
17% |
91% |
81% |
82% en 80% |
97 |
Alcoholici, sociale drinkers en non-drinkers; drie gelijke groepen |
Bewijskracht van de literatuur
De bewijskracht voor de diagnostische accuratesse in de vorm van sensitiviteit en specificiteit is met twee niveau verlaagd aangezien CDT en GGT biomarker werden gevalideerd tegen zelf-gerapporteerde alcoholinname. Deze alcoholinname werd vaak niet uitgevraagd door een psychiater maar door anderen of met een (vaak niet-gevalideerde) vragenlijst uitgevraagd. Hierbij is een hoog risico op bias aangezien alcoholconsumptie vaak wordt ondergerapporteerd. Tevens werd de bewijskracht verlaagd vanwege heterogeniteit in de studieopzet, waarbij o.a. de prevalentie van problematisch drinkgedrag, varieerde van 24% tot 34% of niet was aangegeven, de gebruikte afkappunten varieerden en de referentiemethode verschilde (zowel interviews als vragenlijsten).
Zoeken en selecteren
Literatuur analyse is gedaan voor de biomarkers CDT, GGT, MCV, ASAT & ALAT. Focus op deze markers is mede gebaseerd op het historisch gebruik in Nederland en de praktische uitvoerbaarheid en brede beschikbaarheid in medische en/of forensische laboratoria.
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Populatie: cliënt die door psychiater onderzocht moet worden vanwege mogelijk alcoholmisbruik;
Interventie: CDT, GGT, MCV, ALAT en ASAT-bepaling;
Outcome: diagnostische waarde (area under the ROC-curve voor vergelijking biomarkers) en diagnostische accuratesse van de biomarkers.
Zoeken en selecteren (Methode)
Gecombineerde biomarkers CDT, GGT, MCV, ALAT/ASAT en EtG
In het uitgevoerde literatuuronderzoek zijn studies geselecteerd die de gecombineerde diagnostische waarde van CDT, GGT, MCV en/of ALAT/ASAT beschreven. Vanwege voortschrijdend inzicht werd eerst in de databases Medline (OVID) en Embase op 08-08-2018 gezocht naar studies die de diagnostische waarde en accuratesse van CDT voor alcoholmisbruik in het kader van onderzoek naar rijgeschiktheid beschreven. Deze zoekactie leverde 249 treffers op. Vervolgens werd op 10 september 2018 in de databases Medline (OVID), Embase met relevante zoektermen gezocht naar studies die de diagnostische waarde en accuratesse van GGT, ethyl glucuronide (EtG) en MCV voor alcoholmisbruik in het kader van onderzoek naar rijgeschiktheid beschrijven. Hierbij werd beperkt op studies die driv*[1] in titel of abstract hadden. Deze literatuurzoekactie leverde 60 treffers op. Vanwege het ontbreken van een aantal belangrijke publicaties werd de literatuursearch op 19 februari 2019 uitgebreid, waarbij de beperking op driv* werd opgeheven. Deze literatuurzoekactie leverde 644 treffers op.
Studies werden geselecteerd op grond van de volgende criteria: studies naar diagnostische waarde van CDT, GGT en/of MCV en ALAT/ASAT in de algemene populatie of populaties die in aanmerking kwamen voor onderzoek naar rijgeschiktheid of bij mensen met alcoholproblematiek.
Geëxcludeerd werden case-control studies en studies naar de behandeling van alcoholmisbruik en bij alcoholverslaafden, artikelen over cognitieve functie, intoxicatiestudies, studies bij levertransplantatiepatiënten, studies over delirium tremens en postmortem studies.
Na raadpleging van de volledige tekst werden voor gecombineerde biomarkers uiteindelijk de volgende vier studies geïncludeerd: Bergström, 2008; Kharbouche, 2012; McDonald, 2013 en Pirro, 2011 (zie exclusietabel onder het tabblad Verantwoording voor de studies die eerst werden opgevraagd en later alsnog geëxcludeerd).
De zoekverantwoordingen zijn weergegeven onder het tabblad Verantwoording.
[1] Verwijzend naar ‘drivers’ en ‘drivers under influence (DUI).
Referenties
- Alatalo PI, Koivisto HM, Hietala JP, Puukka KS, Bloigu R, Niemelä OJ. Effect of moderate alcohol consumption on liver enzymes increases with increasing body mass index. Am J Clin Nutr. 2008 Oct;88(4):1097-103.
- Arndt T. Carbohydrate-deficient transferrin as a marker of chronic alcohol abuse: a critical review of preanalysis, analysis, and interpretation. Clin Chem. 2001 Jan;4fberf
- Aslinia F, Mazza JJ, Yale SH. Megaloblastic anemia and other causes of macrocytosis. Clin Med Res. 2006 Sep;4(3):236-41. Review. Erratum in: Clin Med Res. 2006 Dec;4(4):342. PubMed PMID: 16988104;
- Bergström JP, Helander A. Clinical characteristics of carbohydrate-deficient transferrin (%disialotransferrin) measured by HPLC: sensitivity, specificity, gender effects, and relationship with other alcohol biomarkers. Alcohol Alcohol. 2008; 43(4):436-41. PubMed PMID: 18411243.
- Bianchi V, Premaschi S, Raspagni A, Secco S, Vidali M. A comparison between serum carbohydrate-deficient transferrin and hair ethyl glucuronide in detecting chronic alcohol consumption in routine. Alcohol Alcohol. 2015 May;50(3):266-70. doi: 10.1093/alcalc/agv005.
- Bortolotti F, De Paoli G, Tagliaro F. Carbohydrate-deficient transferrin (CDT) as a marker of alcohol abuse: a critical review of the literature 2001-2005. J Chromatogr B Analyt Technol Biomed Life Sci. 2006 Sep 1;841(1-2):96-109
- Breitling LP, Arndt V, Drath C, Brenner H. Liver enzymes: interaction analysis of smoking with alcohol consumption or BMI, comparing AST and ALT to γ-GT. PLoS One. 2011;6(11): e27951. doi: 10.1371/journal.pone.0027951. Epub 2011 Nov 22. PubMed PMID: 22132177.
- Breitling LP, Arndt V, Drath C, Rothenbacher D, Brenner H. Smoking and γ-glutamyltransferase: opposite interactions with alcohol consumption and body mass index. PLoS One. 2010 Sep 30;5(9).
- Ceriotti F, Henny J, Queraltó J, Ziyu S, Özarda Y, Chen B, Boyd JC, Panteghini M; IFCC Committee on Reference Intervals and Decision Limits (C-RIDL); Committee on Reference Systems for Enzymes (C-RSE). Common reference intervals for aspartate aminotransferase (AST), alanine aminotransferase (ALT) and γ-glutamyl transferase (GGT) in serum: results from an IFCC multicenter study. Clin Chem Lab Med. 2010 Nov;48(11):1593-601.
- Chrostek L, Cylwik B, Szmitkowski M, Korcz W. The diagnostic accuracy of carbohydrate-deficient transferrin, sialic acid and commonly used markers of alcohol abuse during abstinence. 2006; Clinica Chimica Acta. 364; 167-171.
- Crunelle CL, Yegles M, De Doncker M, Dom G, Cappelle D, Maudens KE, van Nuijs AL, Covaci A, Neels H. Influence of repeated permanent coloring and bleaching on ethyl glucuronide concentrations in hair from alcohol-dependent patients. Forensic Sci Int. 2015 Feb;247: 18-22. doi: 10.1016/j.forsciint.2014.11.023.
- Danielsson J, Kangastupa P, Laatikainen T, Aalto M, Niemelä O. Impacts of common factors of lifestyle on serum liver enzymes. World J Gastroenterol. 2014 Sep 7;20(33):11743-52.
- Danielsson J, Kangastupa P, Laatikainen T, Aalto M, Niemelä O. Individual and joint impacts of ethanol use, BMI, age and gender on serum gamma-glutamyltransferase levels in healthy volunteers. Int J Mol Sci. 2013 Jun 4;14(6):11929-41. doi: 10.3390/ijms140611929.
- Fleming MF, Anton RF, Spies CD. A review of genetic, biological, pharmacological, and clinical factors that affect carbohydrate-deficient transferrin levels. Alcohol Clin Exp Res. 2004 Sep;28(9):1347-55.
- Fortman CS, Witte DL. Serum 5'-nucleotidase in patients receiving anti-epileptic drugs. Am J Clin Pathol. 1985 Aug;84(2):197-201. PubMed PMID: 2862788
- Gough G, Heathers L, Puckett D, Westerhold C, Ren X, Yu Z, Crabb DW, Liangpunsakul S. The Utility of Commonly Used Laboratory Tests to Screen for Excessive Alcohol Use in Clinical Practice. Alcohol Clin Exp Res. 2015 Aug;39(8):1493-500. PubMed PMID: 26110815.
- Hastedt M, Büchner M, Rothe M, Gapert R, Herre S, Krumbiegel F, Tsokos M, Kienast T, Heinz A, Hartwig S. Detecting alcohol abuse: traditional blood alcohol markers compared to ethyl glucuronide (EtG) and fatty acid ethyl esters (FAEEs) measurement in hair. Forensic Sci Med Pathol. 2013 Dec;9(4):471-7. doi: 10.1007/s12024-013-9416-8.
- Helander A, Wielders J, Anton R, Arndt T, Bianchi V, Deenmamode J, Jeppsson JO, Whitfield JB, Weykamp C, Schellenberg F; International Federation of Clinical Chemistry and Laboratory Medicine Working Group on Standardisation of Carbohydrate-Deficient Transferrin (IFCC WG-CDT). Standardisation and use of the alcohol biomarker carbohydrate-deficient transferrin (CDT). Clin Chim Acta. 2016 Aug 1; 459:19-24.
- Helander A, Zheng Y. Molecular species of the alcohol biomarker phosphatidylethanol in human blood measured by LC-MS. Clin Chem. 2009 Jul;55(7):1395-405.
- Helander A, Husa A, Jeppsson J-O. Improved HPLC method for carbohydrate-deficient transferrine in serum. Clin Chem 2003; 49:1881-1890.
- Keeffe EB, Sunderland MC, Gabourel JD. Serum gamma-glutamyl transpeptidase activity in patients receiving chronic phenytoin therapy. Dig Dis Sci. 1986 Oct;31(10):1056-61.
- Kenan N, Larsson A, Axelsson O, Helander A. Changes in transferrin glycosylation during pregnancy may lead to false-positive carbohydrate-deficient transferrin (CDT) results in testing for riskful alcohol consumption. Clin Chim Acta. 2011 Jan 14;412(1-2):129-33.
- Kharbouche H, Faouzi M, Sanchez N, Daeppen JB, Augsburger M, Mangin P, Staub C, Sporkert F. Diagnostic performance of ethyl glucuronide in hair for the investigation of alcohol drinking behavior: a comparison with traditional biomarkers. Int J Legal Med. 2012 Mar;126(2):243-50.
- Koenig G, Seneff S. Gamma-Glutamyltransferase: A Predictive Biomarker of Cellular Antioxidant Inadequacy and Disease Risk. Dis Markers. 2015; 2015:818570.
- Koivisto H, Hietala J, Anttila P, Parkkila S, Niemelä O. Long-term ethanol consumption and macrocytosis: diagnostic and pathogenic implications. J Lab Clin Med. 2006 Apr;147(4):191-6.
- Kok EE, Wielders JPM, Pasker-de Jong P, Defoury H, Rondes SJA en van de Wiel A. Biomarkers of excessive alcohol intake in alcohol addicts with a normal nutritional status. Ned Tijdschr Klin Chem Labgeneesk 2014; 39: 185-188.
- Maenhout TM, Poll A, Vermassen T, De Buyzere ML, Delanghe JR; ROAD Study Group. Usefulness of indirect alcohol biomarkers for predicting recidivism of drunk-driving among previously convicted drunk-driving offenders: results from the recidivism of alcohol-impaired driving (ROAD) study. Addiction. 2014 Jan;109(1):71-8.
- McDonald H, Borinskya S, Kiryanov N, Gil A, Helander A, Leon DA. Comparative performance of biomarkers of alcohol consumption in a population sample of working-aged men in Russia: the Izhevsk Family Study. Addiction. 2013 Sep;108(9):1579-89. PubMed PMID: 23692391.
- Meerkerk GJ, Njoo KH, Bongers IM, Trienekens P, van Oers JA. The specificity of the CDT assay in general practice: the influence of common chronic diseases and medication on the serum CDT concentration. Alcohol Clin Exp Res. 1998 Jun;22(4):908-13.
- Bergkamp F, Wielders J, Hoedemakers et al. Geschiktheid van CDT-analysemethoden ten behoeve van onderzoek naar chronisch overmatig alcoholgebruik (richtlijn CDT). NVKC Utrecht 2015.
- Pirro V, Valente V, Oliveri P, De Bernardis A, Salomone A, Vincenti M. Chemometric evaluation of nine alcohol biomarkers in a large population of clinically classified subjects: pre-eminence of ethyl glucuronide concentration in hair for confirmatory classification. Anal Bioanal Chem; 2011 ;401(7):2153-64. PubMed PMnaaronID: 21901464.
- Porpiglia NM, Bortolotti F, Dorizzi RM, Micciolo R, Tagliaro F. Critical Evaluation of the Association Between Elevated Mean Corpuscular Volume and Alcohol-Related Traffic Accidents: A Retrospective Study on 6244 Car Crash Cases. Alcohol Clin Exp Res. 2019 Apr 15.
- Pragst F, Rothe M, Moench B, Hastedt M, Herre S, Simmert D. Combined use of fatty acid ethyl esters and ethyl glucuronide in hair for diagnosis of alcohol abuse: interpretation and advantages. Forensic Sci Int. 2010 Mar 20;196(1-3):101-10.
- Poikolainen K. Biased cohort studies on alcohol abuse and mortality. Addiction. 1997 Jul;92(7):903-4. PubMed PMID: 9293048.
- Schellenberg F, Schwan R, Mennetrey L, Loiseaux MN, Pagès JC, Reynaud M. Dose-effect relation between daily ethanol intake in the range 0-70 grams and %CDT value: validation of a cut-off value. Alcohol Alcohol. 2005 Nov-Dec;40(6):531-4.
- Schellenberg F, Wielders J, Anton R, Bianchi V, Deenmamode J, Weykamp C, Whitfield J, Jeppsson JO, Helander A. IFCC approved HPLC reference measurement procedure for the alcohol consumption biomarker carbohydrate-deficient transferrin (CDT): Its validation and use. Clin Chim Acta. 2017 Feb; 465:91-100.
- Sillanaukee P, Massot N, Jousilahti P, Vartiainen E, Sundvall J, Olsson U, Poikolainen K, Pönniö M, Allen JP, Alho H. Dose response of laboratory markers to alcohol consumption in a general population. Am J Epidemiol. 2000 Oct 15;152(8):747-51.
- Targher G. Elevated serum gamma-glutamyltransferase activity is associated with increased risk of mortality, incident type 2 diabetes, cardiovascular events, chronic kidney disease and cancer - a narrative review. Clin Chem Lab Med. 2010 Feb;48(2):147-57.
- Ulwelling W, Smith K. The PEth Blood Test in the Security Environment: What it is; Why it is Important; and Interpretative Guidelines. J Forensic Sci. 2018 Nov;63(6):1634-1640. doi: 10.1111/1556-4029.13874.
- van Beek JHDA, de Moor MHM, Geels LM, Sinke MRT, de Geus EJC, Lubke GH, Kluft C, Neuteboom J, Vink JM, Willemsen G, Boomsma DI. The association of alcohol intake with γ-glutamyl transferase (GGT) levels: evidence for correlated genetic effects. Drug Alcohol Depend. 2014 Jan 1; 134:99-105.
- Van de Wiel A, Wielders JP. Biomarkers voor alcoholmisbruik. Ned Tijdschr Geneeskd. 2009 Apr 25;153(17):818-23.
- Viel G, Boscolo-Berto R, Cecchetto G, Fais P, Nalesso A, Ferrara SD. Phosphatidylethanol in blood as a marker of chronic alcohol use: a systematic review and meta-analysis. Int J Mol Sci. 2012 Nov 13;13(11):14788-812. doi: 10.3390/ijms131114788.
- Whitfield JB, Zhu G, Madden PAF, Montgomery GW, Heath AC, Martin NG. Biomarker and Genomic Risk Factors for Liver Function Test Abnormality in Hazardous Drinkers. Alcohol Clin Exp Res. 2019 Mar;43(3):473-482.
- Whitfield JB, Heath AC, Madden PA, Pergadia ML, Montgomery GW, Martin NG. Metabolic and biochemical effects of low-to-moderate alcohol consumption. Alcohol Clin Exp Res. 2013 Apr;37(4):575-86. PubMed PMID: 23134229.
- Whitfield JB, Dy V, Madden PA, Heath AC, Martin NG, Montgomery GW. Measuring carbohydrate-deficient transferrin by direct immunoassay: factors affecting diagnostic sensitivity for excessive alcohol intake. Clin Chem. 2008 Jul;54(7):1158-65. doi: 10.1373/clinchem.2007.101733. Epub 2008 May 16. PubMed PMID: 18487284.
- Whitfield JB. Gamma glutamyl transferase. Crit Rev Clin Lab Sci. 2001 Aug;38(4):263-355. Review. PubMed PMID: 11563810.
- Wu, A.H.B. Tietz Clinical Guide to Laboratory Tests Fourth Edition 4th Edition. Druk: 4th. 2006. ISBN 9781437719871.
- Zhou R, Qin Y, Yin H, Yang Y, Wang Q. Measurement uncertainty of γ-glutamyltransferase (GGT) in human serum by four approaches using different quality assessment data. Clin Chem Lab Med. 2018 Jan 26;56(2):242-248.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 27-03-2020
Beoordeeld op geldigheid : 31-03-2020
De herziene richtlijn gaat in per 1 juli 2020, maar is reeds beschikbaar op de Richtlijnendatabase. Er is voor een latere ingangsdatum gekozen zodat keurende psychiaters voldoende tijd hebben om zich voor te bereiden op de herziene richtlijn, dit mede gelet op deze Corona periode.
Voor het beoordelen van de actualiteit van deze richtlijn wordt de werkgroep na publicatie van deze richtlijn niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Psychiatrie of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Psychiatrie is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van het project is een herziening van de richtlijn diagnostiek van stoornissen in alcoholgebruik in het kader van CBR-keuringen uit 2011. Deze richtlijn voorziet psychiaters die een onderzoek naar rijgeschiktheid uitvoeren in opdracht van het CBR van informatie en een methode om tot een zorgvuldig klinisch oordeel te komen. In de richtlijn staan de eisen die gesteld worden aan onderzoek en rapportage. Met de richtlijn wordt beoogd een belangrijke bijdrage te leveren aan zorgvuldig onderzoek naar rijgeschiktheid om de verkeersveiligheid in Nederland te dienen.
De belangrijkste wijzigingen in deze richtlijn (ten opzichte van de vorige richtlijn) betreffen:
- Introductie van de DSM-5. In 2013 verscheen de Engelstalige versie van de DSM-5 (opvolger van de DSM IV) en in april 2014 volgde de Nederlandse vertaling. In de DSM-5 wordt geen onderscheid meer gemaakt in personen die verslaafd zijn aan alcohol (alcoholafhankelijkheid) en personen die op een riskante of anderszins schadelijke manier met alcohol omgaan (alcoholmisbruik). De richtlijn is derhalve herzien m.b.t. terminologie. Het in de vorige richtlijn gehanteerde begrip ‘alcoholmisbruik in ruime zin’ is verlaten. De herziene richtlijn spreekt over alcoholmisbruik, zoals in de wet bedoeld (paragraaf 8.8 van de Regeling eisen geschiktheid 2000, Wegenverkeerswet). Onder ‘alcoholmisbruik in de zin der wet’ wordt verstaan de (beschrijvende) psychiatrische diagnose, gebaseerd op alle klinisch relevante gegevens en/of de DSM-5 classificatie stoornis in alcoholgebruik.
- Nieuwe wetenschappelijke evidentie en inzichten inzake klinische chemie. Op grond van recent onderzoek zijn de aanbevelingen omtrent laboratoriumonderzoek (module ‘Laboratorium onderzoek’) aangescherpt. Voor het bevestigen of weerleggen van chronisch overmatig alcoholgebruik wordt traditioneel zowel chemisch onderzoek (GGT, ASAT, ALAT, CDT) als hematologisch onderzoek (MCV) ingezet.[1] Voortschrijdend wetenschappelijk inzicht toont aan dat gebruik van MCV, ASAT en ALAT geen meerwaarde oplevert naast CDTen GGT en daarom behoeven zij niet meer te worden bepaald in onderzoek naar alcoholmisbruik in het kader van rijgeschiktheidskeuringen.
- Veranderende wetgeving en juridische procedures. Sinds het verschijnen van de richtlijn in 2011 is nieuwe wet- en regelgeving geïntroduceerd die in het kader van onderzoek naar rijgeschiktheid van belang is. Zo is de richtlijn onder andere herzien op het gebied van de Algemene Verordening Gegevensbescherming (AVG), de Wet kwaliteit, klachten en geschillen zorg (Wkkgz), de recidiveregeling (art 123b Wvw) en recente jurisprudentie rondom het onderzoek naar alcoholmisbruik in het kader van rijgeschiktheidskeuringen (zie de modules ‘Achtergrond en juridische basis van vraagstelling CBR’ en ‘Juridisch kader’ en ‘Afweging van de onderzoeksbevindingen’).
- Evaluatie van de in de vorige richtlijn genoemde Bayesiaanse Alcoholisme Test-D. Door de Richtlijncommissie is na het bestuderen van jurisprudentie een groot aantal rapportages besloten deze methode te verlaten. In de praktijk wordt nagenoeg geen gebruik gemaakt van de methode. De werkgroep heeft hieruit geconcludeerd dat de methode niet relevant en/of toepasbaar blijkt voor de praktijk.
Doelgroep
De richtlijn is bedoeld ter ondersteuning van psychiaters die onderzoek naar alcoholmisbruik in het kader van rijgeschiktheidskeuringen verrichten, voortvloeiend uit het vorderingsonderzoek of het gezondheidsverklaringsonderzoek. Gegeven het wettelijk kader betreft dit een onafhankelijk psychiater die door het CBR wordt aangewezen voor het onderzoek (zie de module ‘Achtergrond en juridische basis van vraagstelling CBR’).
De richtlijn biedt inzicht in de verschillende stappen die de psychiater kan nemen om tot een zorgvuldig onderzoek en rapportage te komen. De richtlijn geeft ook de norm aan waar het aanvullend laboratoriumonderzoek aan dient te voldoen. Dit betreft onderzoek dat wijst op lichamelijke schade die direct of indirect het gevolg is van alcoholgebruik. De richtlijn is daarmee tevens richtinggevend voor de laboratoriumspecialist die het laboratoriumonderzoek uitvoert.
[1] MCV= mean corpuscular volume; ASAT=Aspartaat aminotransferase; ALAT=Alanine aminotransferase; CDT= Carbohydraat Deficiënt Transferrine; GGT= Gamma-glutamyltransferase (zie verder de module ‘Laboratorium onderzoek’ en de aanverwante producten ‘Toelichting en overwegingen bij MCV’ en ‘bij ASAT en ALAT’).
Samenstelling werkgroep
Werkgroep
- Dr. D.P. Ravelli, psychiater en medisch directeur, werkzaam bij Max Ernst GGZ. Afgevaardigd namens NVvP, voorzitter werkgroep.
- W. Dominicus, psychiater, werkzaam bij het Nederlands Instituut Forensische Psychiatrie en Psychologie te Amsterdam. Afgevaardigd namens NVvP.
- R.J.P. Hazewinkel, psychiater, werkzaam bij GGZ Centraal, locatie Zon en Schild te Amersfoort. Afgevaardigd namens NVvP.
- Prof. dr. A.C. Hendriks, hoogleraar gezondheidsrecht, werkzaam bij de Faculteit Rechtsgeleerdheid, Universiteit Leiden.
- K.R.M. Wettstein, psychiater en medisch directeur, werkzaam bij ADHDcentraal. Afgevaardigd namens NVvP.
- Dr. ir. J.P.M. Wielders, klinisch chemicus, voormalig hoofd klinisch chemisch laboratorium in het Meander Medisch Centrum te Amersfoort. Afgevaardigd namens NVKC.
Adviseurs
- Dr. A.F.A. Schellekens, psychiater, werkzaam bij het Radboudumc te Nijmegen en wetenschappelijk directeur bij Nijmegen Institute for Scientist Practioners in Addiction. Afgevaardigd namens NVvP.
- R.A. Bredewoud, arts, hoofd medische zaken CBR.
- Mr. E. van Pernis-van de Wal, manager bezwaar en beroep divisie rijgeschiktheid CBR.
Met ondersteuning van
- Dr. M.L. Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
- Dr. L.M.T. Schouten, zelfstandig adviseur.
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroep leden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroep leden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen liggen ter inzage bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroep |
||||
|
Lid werkgroep |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dominicus |
Psychiater bij Nederlands Instituut Forensische Psychiatrie en Psychologie |
Interim psychiater bij Ipse de Brugge |
Geen |
Geen actie. Gezien deze expertise gevraagd voor de werkgroep. |
|
Hazewinkel |
Psychiater |
Lid Commissie van Toezicht Van der Hoeven Kliniek, en Lid Klachtencommissie GGzCentraal |
Eigen praktijk voor psychiatrische expertises |
Geen actie. Gezien deze expertise gevraagd voor de werkgroep. |
|
Hendriks |
Hoogleraar gezondheidsrecht |
Lid Raad van Toezicht Erasmus MC (betaald) Plaatsvervangend rechter Rechtbank Rotterdam Adviseur Capra advocaten (betaald) Lid raad van advies Van Benthem en Keulen, Advocaten en Notariaat (onbetaald) |
Geen |
Geen actie. Gezien deze expertise gevraagd voor de werkgroep. |
|
Ravelli |
Medisch directeur Max Ernst GGZ |
Lector Academie Beleidspsychiatrie |
Eigen praktijk voor psychiatrische expertises |
Geen actie. Gezien deze expertise gevraagd voor de werkgroep. |
|
Wettstein |
Medisch directeur bij ADHDcentraal |
Medisch directeur bureau rijbewijskeuringen. |
Geen |
Geen actie. Gezien deze expertise gevraagd voor de werkgroep. |
|
Wielders |
Voormalig hoofd klinisch chemisch laboratorium, Meander Medisch Centrum |
Geen |
In verleden actief pleitbezorger van correct gebruik van laboratoriumonderzoek bij onderzoek naar rijgeschiktheid wegens alcohol. Tevens actief geweest als trekker van standaardisatie van alcohol biomarker CDT, zowel internationaal als nationaal.
|
Geen actie. Gezien deze expertise gevraagd voor de werkgroep. |
|
Adviseur |
|
|
|
|
|
|
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Schellekens |
Psychiater Radboud UMC |
Wetenschappelijk directeur bij Nijmegen Institute for Scientist Practioners in Addiction |
Geen |
Niet van toepassing |
|
Bredewoud |
Hoofd medische zaken CBR |
Waarnemer Gezondheidsraad (rijgeschiktheid) onbetaald, lid vervoersgeneeskundig samenwerkingsverband |
Geen |
Geen lid werkgroep, maar adviseur |
|
Van Pernis-van de Wal |
Manager bezwaar en beroep divisie rijgeschiktheid |
Geen |
Geen |
Geen lid werkgroep, maar adviseur |
Inbreng patiëntenperspectief
Gegeven het specifieke karakter van de richtlijn zijn vanuit Patiëntenfederatie Nederland en MIND geen aandachtspunten aangeleverd. Het perspectief van de cliënt is in vergadering ingebracht door een verkeersrechtadvocaat die betrokkenen bijstaat in procedures.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnherziening is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het disseminatie- en implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is herzien conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase zijn knelpunten geïnventariseerd door de werkgroep en de adviseurs. Via een schriftelijke invitatie is gevraagd knelpunten en aandachtspunten voor de herziening aan te leveren. Knelpunten en aandachtspunten zijn aangedragen door NHG, Patiëntenfederatie Nederland, IGJ, ZINL, Verslavingskunde NL en VVGN. Daarnaast is een knelpunten vragenlijst uitgezet onder onderzoekend psychiaters en een selecte groep klinisch chemici.
Uitgangsvragen
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld.
Expert opinion
Voor de modules ‘Achtergrond en juridische basis van vraagstelling CBR’ tot en met ‘Lichamelijk onderzoek’ en de module ‘Afweging van de onderzoeksbevindingen’ heeft de commissie zich gebaseerd op expert-opinion. Om deze uitgangsvragen te beantwoorden is kennisgenomen van bestaande richtlijnen, leerboeken op het terrein van de psychiatrie en relevante wetenschappelijke artikelen die bekend waren bij de richtlijncommissie.
De commissie heeft daarnaast gebruik gemaakt van de eigen -uitgebreide- ervaringen met het onderhavige onderzoek naar alcoholmisbruik van betrokkenen, de daaruit voortvloeiende verslagen en de bestaande jurisprudentie over het onderwerp. Voor deze uitgangsvragen is geen systematische literatuuranalyse verricht, omdat het karakter van deze vragen zich niet goed leent voor beantwoording door middel van een systematische review van origineel wetenschappelijk onderzoek. Gegeven de specifieke en met andere landen onvergelijkbare Nederlandse wet- en regelgeving ontbreekt het peer reviewed onderzoek in de internationale literatuur. Noch zijn er internationaal gezien richtlijnen op psychiatrisch vakgebied voorhanden over dit onderwerp. Ook in Nederland is geen recente research voorhanden over het onderwerp; onderzoek vóór 2010 is slechts sporadisch aanwezig.[1]
Systematisch literatuuronderzoek
Voor de module ‘Laboratorium onderzoek’ is systematisch literatuuronderzoek verricht.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen is gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroep leden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module ‘Laboratorium onderzoek’. De zoekstrategie is opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. De gevonden studies kwamen onvoldoende overeen voor een kwantitatieve meta-analyse.
Beoordelen van de kracht van het wetenschappelijke bewijs
Aangezien dit een herziening betreft van een richtlijn die in grote mate is gebaseerd op expert-opinion werd de kracht van het wetenschappelijke bewijs bepaald volgens de EBRO-methode.
De kracht van het wetenschappelijk bewijs met betrekking tot laboratoriumonderzoek en biomarkers werd bepaald met de ‘generieke GRADE-methode’. De biomarkers werden beoordeeld op diagnostische accuratesse en bruikbaarheid in de praktijk.
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
Formuleren van de conclusies
Voor het laboratoriumonderzoek werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroep leden maakten de balans op van elke biomarker (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de cliënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en meegewogen, zoals de expertise van de werkgroep leden, de waarden en voorkeuren van de cliënt (patiënt values and preferences), kosten, beschikbaarheid van voorzieningen, juridische aspecten en organisatorische zaken. Deze aspecten zijn, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op expert opinion (modules ‘Achtergrond en juridische basis van vraagstelling CBR’ tot en met ‘Lichamelijk onderzoek’ en de module ‘Afweging van de onderzoeksbevindingen’) dan wel het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen (module ‘Laboratorium onderzoek’). De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (juridische aspecten van het onderzoek)
In de knelpuntenanalyse en bij de herziening van de richtlijn is expliciet rekening gehouden met de juridische aspecten van het onderzoek: alle aspecten die randvoorwaardelijk zijn voor het uitvoeren van het onderzoek en het opstellen van het onderzoeksverslag.
Indicatorontwikkeling
Gegeven het specifieke onderwerp werd ervoor gekozen geen indicatoren te ontwikkelen bij deze richtlijn.
Kennislacunes
Deze werden niet geformuleerd.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (cliënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
[1] Mekking-Pompen I., Ravelli D.P., & Nijman HLI. (2009). Onderzoek naar rijgeschiktheid door de psychiater na rijden onder invloed; beschrijving van 101 overtreders en aanbevelingen voor preventie. Tijdschrift voor Psychiatrie, 1, 9-19.;
Korzec A. (2004) Confirming alcoholism in drivers under influence [proefschrift Universiteit van Amsterdam]. Amsterdam: Prometheus.
