Algemene inleiding PDO
Aanleiding voor het maken van de richtlijn
Er zijn ongeveer 1900 autosomaal recessieve aandoeningen bekend, waarvan vele ernstig en jong tot uiting komend (Solomon, 2013; Antonarakis, 2019). Geschat wordt dat iedereen drager is van gemiddeld 20 autosomaal recessieve aandoeningen (mild tot ernstig) (The 1000 Genomes Project Consortium, 2010; Gonzaga-Jauregui, 2012; Antonarakis, 2019).
Preconceptie dragerschapsonderzoek (PDO) (zie de definities en begrippen, het gaat om een combinatie van test en counseling) stelt paren met kinderwens in staat informatie te krijgen over een verhoogde kans op het krijgen van een kind met een ernstige recessieve aandoening. Als na een dragerschapstest beide partners drager blijken te zijn van dezelfde autosomaal recessieve aandoening, bestaat er in elke zwangerschap een verhoogde kans van 1 op 4 (ofwel 25%) op een aangedaan kind met deze aandoening. Met name indien paren deze informatie voorafgaande aan een zwangerschap hebben, kunnen zij meer geïnformeerd reproductieve beslissingen nemen en desgewenst de geboorte van een ernstig ziek kind voorkomen, dan wel zich voorbereiden op de geboorte van een aangedaan kind.
Beschikbare reproductieve opties voor dragerparen zijn: het risico accepteren; afzien van het krijgen van (meer) eigen kinderen; een kind adopteren; gebruik maken van eicel- of zaaddonatie; gebruik maken van kunstmatige bevruchting (IVF/ICSI) en pre-implantatie genetische diagnostiek (PGD) met embryoselectie; tijdens de zwangerschap gebruik maken van invasieve prenatale diagnostiek (vlokkentest of vruchtwaterpunctie) en eventueel kiezen voor een afbreking van de zwangerschap indien de foetus is aangedaan; tijdens de zwangerschap gebruik maken van niet-invasieve prenatale diagnostiek (NIPD;voor de meeste autosomaal recessieve aandoeningen is dit (nog) niet mogelijk). In sommige culturen wordt individuele dragerschapsinformatie ook gebruikt als criterium voor de paarvorming.
In Nederland is de algemene kans om samen drager te zijn van dezelfde autosomaal recessieve aandoening voor de gehele bevolking ongeveer 1 op 100. De kans om beide drager te zijn van één van 50 zeer ernstige, onbehandelbare autosomaal recessieve aandoeningen is ongeveer 1 op 150 (Francioli, 2014; Plantinga, 2016). Voor deze paren is de a priori kans op een aangedaan kind per zwangerschap 1 op 600.
Naast de gemiddelde risico’s voor de gehele bevolking zijn er zogenaamde ‘hoogrisicogroepen’ in de populatie. Voor hen geldt dat individuen en paren uit zo’n groep een hoger dan gemiddelde kans hebben om een drager en/of dragerpaar te zijn van één of meer (specifieke) autosomaal recessieve ziekten ten opzichte van het risico dat een willekeurig paar uit de gehele bevolking heeft op die ziekte(n). Paren kunnen behoren tot een hoogrisicogroep vanwege etnische of geografische afkomst en/of vanwege consanguïniteit (partners zijn verwant). Deze hogere kans geldt ook als de aandoening voor zover bekend nog niet eerder in de familie voorkwam. De ervaring leert dat paren uit een hoogrisicogroep zonder een positieve familieanamnese niet of onvoldoende geïnformeerd worden over de mogelijkheid om voorafgaande aan een zwangerschap na te gaan of zij (samen) drager zijn van een dergelijke ernstige (autosomaal) recessieve aandoening. Deze richtlijn beoogt hiervoor handvatten te geven en aan te geven welke tests voor welke hoogrisicogroepen geindiceerd zijn.
Binnen de klinisch genetische zorg (de VKGN en de afdelingen Klinische Genetica van de diverse UMC’s), maar ook binnen de disciplines die zich bezighouden met prenatale diagnostiek en preconceptiezorg in de 1e tot en met de 3e lijn zijn geen nationale richtlijnen of standaarden beschikbaar met betrekking tot PDO. Hoewel het behoren tot een hoogrisicogroep (vanwege etnische en/of geografische afkomst en/of consanguïniteit) geldt als medische indicatie voor PDO (op basis waarvan de test ook wordt vergoed uit de ziektekostenverzekering - afgezien van het eigen risico), zijn er geen heldere afspraken over het (al dan niet actief) informeren over, of het aanbieden van preconceptie dragerschapsonderzoek aan paren (of individuen) met kinderwens. Ook de Preconceptie Indicatie Lijst (College Perinatale Zorg, 2018) geeft op dit punt nog onvoldoende richting aan het dagelijks handelen. De NHG-Standaard Preconceptiezorg geeft aan dat het preconceptieconsult een goed moment is om in te gaan op de mogelijkheid van dragerschapsonderzoek, zoals bijvoorbeeld voor hemoglobinopathieën (thalassemie en sikkelcelziekte) (NHG, 2011). Dit soort consulten wordt echter nog zeer weinig gevraagd (Voorst, 2016). Daarnaast bestaat de aanbeveling aan huisartsen om aan ouders van kinderen bij wie dragerschap voor sikkelcelziekte is aangetoond via de hielprik (circa 800 per jaar), PDO aan te bieden. De huisarts kan de ouders verwijzen naar de klinische genetica. In de praktijk blijkt echter dat dit alles nauwelijks gebeurt (Kaufmann, 2014).
In het buitenland bestaan al wel richtlijnen ten aanzien van het aanbieden van dragerschapstests aan de gehele bevolking of aan hoogrisicogroepen, met name gericht op de screening van één of enkele aandoeningen (Figuur 1). In de Verenigde Staten bijvoorbeeld wordt dragerschapsscreening op taaislijmziekte ofwel cystic fibrosis (CF) en spinale spieratrofie (SMA) aan alle vrouwen met kinderwens en in de vroege zwangerschap geadviseerd (ACOG, 2017b). Ook wordt screening op dragerschap van klein aantal aandoeningen in diverse hoogrisicopopulaties aangeraden, zoals bijvoorbeeld geldt voor de Ashkenazi-Joodse gemeenschap (ACOG, 2017a; Gross, 2008). Daarnaast bestaan er uitgebreide internationale (onder andere Europese) richtlijnen voor de screening en diagnostiek van hemoglobinopathieën in hoogrisicopopulaties (zoals sikkelcelziekte en thalassemie), waaraan ook experts vanuit Nederland hebben gewerkt (ENERCA and TIF, 2013; Traeger-Synodinos, 2015).
In toenemende mate worden daarnaast handreikingen gedaan met betrekking tot het aanbieden van zogeheten brede dragerschapstests, aangeboden voorafgaand aan of tijdens de zwangerschap (zogenaamd ‘expanded carrier screening’: ECS) (ACOG, 2017a). Dit zijn tests waarbij, dankzij de toenemende genetische technologische ontwikkelingen, in één keer naar dragerschap van meerdere (enkele tientallen oplopend tot vele honderden) (autosomaal) recessief erfelijke aandoeningen kan worden gekeken. Een dergelijke brede test kan in principe aan elk willekeurig paar met kinderwens worden aangeboden (universeel aanbod) (Figuur 1), maar uiteraard ook aan hoogrisicogroepen. ‘Breed’ kan dus zowel betrekking hebben op de scope van de test als op de doelpopulatie. Voor dragerschapstests die in beide opzichten ‘breed’ zijn hanteert deze richtlijn de aanduiding 'Expanded Universal Carrier Screening’, afgekort als EUCS (Van der Hout 2016). Zie Figuur 1.
Door de European Society of Human Genetics (ESHG) zijn Europese aanbevelingen gepubliceerd ten aanzien van een verantwoorde implementatie van dergelijke EUCS (Henneman, 2016) en ook de American College of Medical Genetics (Edwards, 2015) en de American College of Obstetrics and Gynaecology hebben dergelijke aanbevelingen gepubliceerd (ACOG, 2017a; ACOG, 2017b). Inmiddels worden zowel in respectievelijk Australië als in België populatiebrede pilots verricht en voorbereid waarbij EUCS wordt aangeboden voor vele honderden aandoeningen (PDO Australië, PDO België). Daarnaast bieden commerciële partijen ook dit soort EUCS tests aan, waarbij de samenstelling, zowel wat aantal als ook wat type aandoeningen en ook wat kwaliteit betreft, erg kan verschillen (Chokoshvili, 2018).
Deze richtlijn gaat echter over PDO voor hoogrisicogroepen en niet over een populatiebreed aanbod. Wat betreft de samenstellling van de aandoeningen in de specifieke dragerschapstests is er in deze richtlijn voor gekozen, om per hoogrisicogroep te adviseren om voor nu alleen die specifieke ernstige autosomaal recessieve aandoeningen op te nemen in de dragerschapstest waarvoor geldt dat de kans op dragerschap voor mensen uit die hoogrisicogroep op basis van etnische en/of geografische afkomst, (sterk) verhoogd is ten opzichte van de kans op dragerschap op die specifieke aandoening(en) bij iemand uit de gehele bevolking in Nederland.
Figuur 1 Schematisch overzicht met verschillende types van (preconceptie) dragerschapstests, met voorbeelden
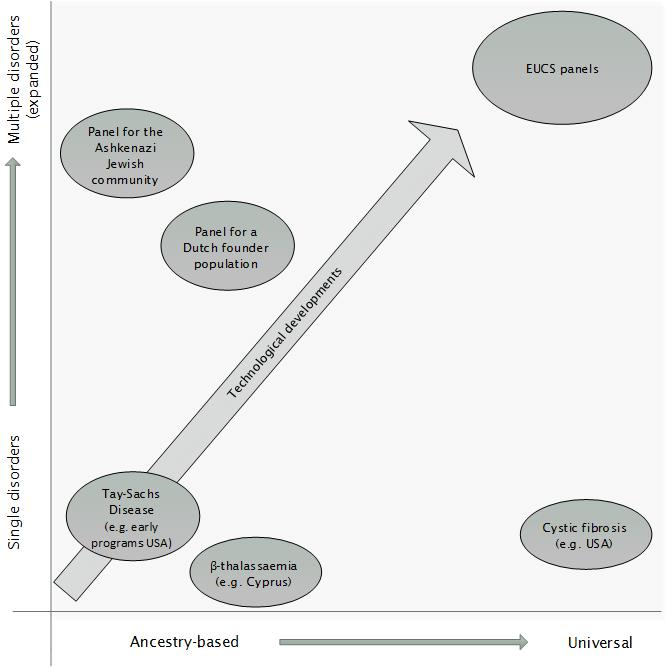
Tests kunnen worden aangeboden op basis van afkomst ‘ancestry-based’ of aan elk willekeurig paar met kinderwens ‘universal’ en gericht op één enkele versus meerdere ziekten tegelijk (‘expanded’). EUCS: expanded universal carrier screening (Bron: gebaseerd op figuur uit Proefschrift K. Holtkamp, 2017)
Uit onderzoek blijkt dat de Nederlandse bevolking in het algemeen, maar ook potentiële gebruikers en professionele zorgverleners positief staan tegenover dragerschapsonderzoek op autosomaal recessieve ziekten in de algemene bevolking (van den Heuvel, 2015; NIVEL, 2015; Plantinga, 2016). Hoogrisicogroepen in het bijzonder zijn positief over PDO (Holtkamp, 2016; Mathijssen, 2018). Dit hangt samen met de bekendheid met autosomaal recessieve ziekten en relatieve grote ziektelast en ernst van de betreffende aandoeningen in deze hoogrisicogroepen (Holtkamp, 2016).
Met de ontwikkeling en opkomst van (al dan niet brede) dragerschapstests binnen de Nederlandse reguliere gezondheidszorg (waarbij dit soort DNA onderzoek onder de Wet Bijzondere Medische Verrichtingen, WBMV, valt, met de academische ziekenhuizen als vergunninghouders) en de commerciële beschikbaarheid van brede tests, neemt de behoefte aan nationale afstemming en beleid toe. Ook binnen andere disciplines en beroepsgroepen en- verenigingen dan de VKGN spelen vragen over beleid rond een aanbod van (brede) dragerschapstests en PDO, zoals bij de NVOG, KNOV en NHG (zie ook Huisarts en Wetenschap). Hoogrisicogroepen zijn de eerst in aanmerking komende groepen uit de algemene bevolking voor wie genoemde afstemming binnen de zorg relevant is. Dit is dan ook de ratio achter deze eerste richtlijn over PDO.
Doel van de richtlijn
De richtlijn biedt handvatten voor de medische indicatiestelling en dus het, al dan niet actief, aanbieden van en verwijzen voor PDO (zie de definities en begrippen) aan hoogrisicogroepen. Dit stelt de door de test geïdentificeerde dragerparen met kinderwens uit deze hoogrisicogroepen in staat om, op basis van informatie over hun reproductieve risico, autonome reproductieve beslissingen te nemen (bijvoorbeeld prenatale diagnostiek of pre-implantatie genetische diagnostiek, zie het Normatieve Kader). Testen gebeurt bij voorkeur voorafgaand aan een zwangerschap (preconceptioneel) om daarmee het aantal reproductieve opties zo groot mogelijk te houden.
De handvatten die voortkomen uit deze richtlijn zijn gebaseerd op de huidige wetenschappelijke, beroepsinhoudelijke en maatschappelijke inzichten, door:
- Het definiëren van het doel van PDO voor hoogrisicogroepen.
- Het definiëren van specifieke hoogrisicogroepen waarvoor PDO geïndiceerd is: voor hen geldt dat individuen en paren uit zo’n groep een hoger dan gemiddelde kans hebben om een drager en/of dragerpaar te zijn van één of meer (specifieke) autosomaal recessieve ziekten ten opzichte van het risico dat een willekeurig paar uit de gehele bevolking heeft op die ziekte(n), op basis van etnische of geografische afkomst en/of consanguïniteit.
- Het bij patiënten/paren met kinderwens uit deze hoogrisicogroepen vaststellen van de indicaties voor het aanbieden van PDO binnen de medisch (specialistische) zorg en manieren waarop zorgverleners deze indicaties tot verwijzing kunnen herkennen en adresseren.
- Het per hoogrisicogroep in kaart brengen van de beschikbare DNA tests en biochemische technieken voor dragerschapstests binnen in Nederland geaccrediteerde DNA laboratoria en referentielaboratoria, vallend onder de WBMV.
- Het formuleren van de criteria (bijvoorbeeld ernst, prevalentie) ten aanzien van de aandoeningen die in een brede dragerschapstest moeten, mogen of kunnen worden opgenomen als deze, in verschillende situaties, binnen de medische zorg wordt aangeboden.
- Het formuleren van de aanbevelingen op grond waarvan een keuze gemaakt kan worden voor een (bepaalde) smalle of een brede dragerschapstest.
- Het formuleren van aanbevelingen ten aanzien van de te gebruiken technieken voor een dragerschapstest (biochemisch en/of DNA onderzoek) en aanbevelingen ten aanzien van rapportage van pathogene genvarianten en varianten in de uitslag.
- Het formuleren van criteria op grond waarvan besloten kan worden (alleen) een parenuitslag dan wel (ook) een individuele uitslag te genereren.
- Het vaststellen van (minimale) vereisten ten aanzien van het verwijzersconsult en van de pre-test en post-test counseling door verschillende medisch professionals, inclusief aanbevelingen voor (online) informatievoorziening.
- Het bespreken van de ethische aspecten van een aanbod van PDO aan hoogrisicogroepen.
Afbakening van de richtlijn
Om welke patiëntengroepen gaat het?
Deze richtlijn gaat over preconceptie dragerschapsonderzoek (PDO) voor hoogrisicogroepen. Met hoogrisicogroepen wordt bedoeld: paren (en individuen) die op basis van etniciteit of geografische afkomst en/of consanguïniteit een hogere kans hebben om een drager of dragerpaar te zijn van één of meerdere (specifieke) autosomaal recessieve aandoeningen ten opzichte van het algemene populatierisico van de gehele bevolking om drager of dragerpaar te zijn van die aandoening(en). De richtlijn is gericht op paren met een kinderwens (preconceptioneel). Complex hierbij is dat “paren met kinderwens” als zodanig geen patiëntengroep is die zich primair meldt bij de 1e lijnszorg dan wel bij een medisch specialist. Echter, deze richtlijn streeft ernaar dat paren met kinderwens uit een hoogrisicogroep die wel onder de zorg vallen van een, al dan niet direct bij reproductie betrokken, medisch specialist (voor zichzelf of voor hun kind) tijdig de mogelijkheid voor PDO krijgen aangeboden. Daarnaast betekent dit dat de 1e lijn handvatten voor bespreking en desgewenst verwijzing zal krijgen voor die paren uit een hoogrisicogroep die nog niet in medisch specialistische zorg bekend zijn of die primair de huisarts of verloskundige bezoeken met (vragen over) kinderwens.
In de richtlijn spreken wij over paren met kinderwens, terwijl het feitelijk om de ‘gameten’ gaat waarmee een zwangerschap spontaan tot stand komt dan wel tot stand wordt gebracht. De richtlijnkerngroep is zich bewust van het feit dat deze term “paren met kinderwens” die hier verwijst naar de relatie tussen een man en een vrouw, in de huidige tijd waarin er meerdere vormen van ouderschap bestaan, restrictief is. Er zullen bijvoorbeeld ook alleenstaande vrouwen, vrouwen van onvruchtbare mannen en/of lesbische vrouwen gebruik willen maken van donorsemen, al dan niet van een bekende donor. Ook zij zouden in principe in aanmerking komen voor PDO indien de recipient tot een hoogrisicogroep behoort en de potentiele donor eveneens. In Nederland bestaan nog geen richtlijnen voor PDO met behulp van dragerschapstests in de setting van voortplantingsgeneeskunde.
Individuen
Hoewel de richtlijn zich primair richt op paren uit een hoogrisicogroep met een mogelijke kinderwens, kan het ook gaan om het informeren en testen van individuen (vaak vrouwen) als de partner of (verondersteld) verwekker in geval van zwangerschap (op dat moment) niet beschikbaar is, of als gebruik is gemaakt van donorgameten (zie boven). Dit geldt met name als bekend of waarschijnlijk is dat de verwekker of de donor ook tot dezelfde hoogrisicogroep behoort. Dragerschapstests aan individuen uit een hoogrisicogroep kunnen dan overwogen worden en zijn in dat geval medisch geïndiceerd (zie de module ‘Individuele testuitslag versus parenuitslag’). Voor vrouwelijke draagsters uit bepaalde hoogrisicogroepen van wie de partner of verwekker van de foetus niet beschikbaar (of onbekend) is en het a priori risico op een aangedaan kind relatief hoog, is prenatale diagnostiek tijdens een zwangerschap een optie.
Zwangeren
Hoewel de richtlijn beoogt dat paren uit hoogrisicogroepen PDO aangeboden krijgen voordat ze aan een eventuele zwangerschap beginnen, is de praktijk dat sommige paren of vrouwen pas onder medische aandacht komen wanneer er al sprake is van een zwangerschap. Dit wordt ook gezien in het buitenland waarbij het aanbod van PDO al langer bestaat (Metcalfe, 2012). Daarom bevat de richtlijn ook aanbevelingen voor het informeren van paren uit hoogrisicogroepen die inmiddels zwanger zijn (zie de module ‘Definitie van hoogrisicogroepen’). Het aanbod voor PDO wordt in dat geval bij voorkeur vroeg in de zwangerschap gedaan. Indien beide partners drager blijken te zijn van dezelfde autosomaal recessieve aandoening, kunnen zij in dat geval nog in aanmerking komen voor prenatale diagnostiek. Eventuele zwangerschapsafbreking, indien gewenst, is tot 24 weken wettelijk toegestaan.
Om welke aandoeningen/ziekten gaat het?
In deze richtlijn over preconceptie dragerschapsonderzoek (PDO) voor hoogrisicogroepen ligt de primaire focus op het testen op dragerschap van ernstige, op de kinderleeftijd optredende (autosomaal) recessieve aandoeningen, conform een recente Europese aanbeveling (Henneman, 2016). Het gaat hier om aandoeningen waarop één of meer van de volgende kenmerken van toepassing zijn: aandoeningen die optreden op de (jonge) kinderleeftijd, gepaard gaande met een ernstige lichamelijke en/of verstandelijke beperking, en/of gepaard gaande met ernstige pijn en/of (zeer) frequente ziekenhuisbezoeken, waarvoor geen genezende therapie beschikbaar is, en/of waarvoor in het algemeen een verkorte levensverwachting geldt.
In de richtlijn wordt geen exacte definitie uitgewerkt met betrekking tot het onderscheid tussen ernstige en niet-ernstige aandoeningen.
De richtlijn beschrijft in praktische zin:
- welke hoogrisicogroepen in aanmerking komen voor PDO;
- hoe zorgverleners deze groepen kunnen herkennen en aan hen (informatie over) PDO kunnen aanbieden;
- welk type test en analysestrategie het meest geschikt is voor PDO in elke afzonderlijke hoogrisico groep;
- hoe het aanbod van PDO het best georganiseerd en uitgevoerd kan worden;
- welke aanbevelingen gelden voor pre- en post-test counseling door verschillende medisch zorgverleners en voor (online) informatievoorziening.
Afbakening richtlijn
Groepen die niet binnen de richtlijn vallen
Door de focus op hoogrisicogroepen op basis van etnische of geografische afkomst en/of consanguïniteit, wordt de richtlijn naar twee kanten begrensd:
- Buiten de richtlijn valt PDO bij paren of individuen met een hogere kans op dragerschap op grond van uitsluitend een positieve familieanamnese voor een autosomaal recessieve ziekte of dragerschap in de familie van de man of de vrouw terwijl zij niet tot een hoogrisicogroep behoren. Daarvoor bestaan al duidelijke afspraken/richtlijnen: namelijk dat de betrokkenen desgewenst verwezen kunnen worden naar de afdelingen Klinisch Genetica en getest kunnen worden op dragerschap van de in de familie/bij partner voorkomende aandoening. Zie onder andere de aanbevelingen in de Preconceptie Indicatie Lijst (PIL) van het College Perinatale Zorg (College Perinatale Zorg, 2018). Paren uit een hoogrisicogroep met (ook) een bekende positieve familieanamnese vallen wel binnen deze richtlijn.
- Ook buiten de richtlijn valt een aanbod van PDO aan de algemene Nederlandse bevolking, dus aan paren of individuen met een kinderwens die voor zover bekend niet behoren tot een hoogrisicogroep. Voor de algemene bevolking geldt zoals gezegd een gemiddeld a priori risico van 1 op 150 (0.6/100) om dragerpaar te zijn voor een zeer ernstige autosomaal recessieve aandoening (Francioli, 2014; Plantinga, 2016).De meest frequente zeer ernstige autosomaal recessieve aandoening in de algemene bevolking is SMA, met een risico een dragerpaar te zijn van respectievelijk 1 op 2025 (1/45 x 1/45) en de meest frequente ernstige aandoening is CF, met een risico van 1 op 900 (1/30 x 1/30).
Voor het informeren van de algemene bevolking over het risico een dragerpaar te zijn van (zeer) ernstige autosomaal recessieve aandoeningen (zoals SMA en CF) is wellicht een systematisch aanbod in de vorm van programmatische screening (bevolkingsonderzoek) een meer voor de hand liggende (maar ook meer ambitieuze) benadering.
Het debat over de beste vormgeving van zo’n aan alle paren in de vruchtbare leeftijd aan te bieden dragerschapsscreening is in ons land al meer dan tien jaar geleden begonnen. In die tijd kon er alleen nog op dragerschap van een of enkele aandoeningen gescreend worden, door technische belemmeringen. In 2007 kwam de Gezondheidsraad met het advies om een grootschalige pilotstudie uit te voeren naar preconceptie dragerschapsscreening voor enkele aandoeningen, waaronder CF, in de algemene bevolking (Gezondheidsraad, 2007). Deze aanbeveling is echter niet door de minister overgenomen en van die pilot is het nooit gekomen.
Onder verwijzing naar dat eerdere advies, heeft de Gezondheidsraad de discussie hierover recent nieuw leven ingeblazen met de aanbeveling om SMA niet alleen op te nemen in de hielprikscreening, maar daarnaast ook dragerschapsscreening voor deze aandoening te overwegen, die dan zou moeten worden ingebed in een breder programma waarin ook op dragerschap van andere aandoeningen zou worden getest (Gezondheidsraad, 2019). Mogelijk dat dit advies over SMA het debat over dragerschapsscreening in de algemene bevolking opnieuw op de politieke agenda plaatst, ook in aansluiting bij de lopende discussie over de wenselijkheid van een populatieaanbod met brede(re) dragerschapstests (EUCS) (Verslag Stakeholdermeeting POM project, 2016). De beleidsreactie van staatsecretaris Blokhuis van oktober 2019 (‘kamerbrief’; de Jonge, 2020) wijst hier wel op, net als de oproep aan de wetenschap vanuit het programma Ethiek en Gezondheid van ZonMw (december 2019) om verder bij te dragen aan wetenschappelijk onderzoek op dit gebied. Het onderzoek zal gericht zijn op de (ethische) kaders van en het maatschappelijk draagvlak voor preconceptionele dragerschapsscreening. Hierbij zullen ook de opbrengsten en gevolgen van kennis over dragerschap onderzocht worden en de potentiele gevolgen voor de hele reproductieve, preconceptionele, prenatale en neonatale screeningsketen.
De urgentie van die discussie wordt overigens snel groter, gelet op de commerciële beschikbaarheid van dergelijke brede dragerschapstests en het feit dat voor de paren die behoren tot een hoogrisicogroep op basis van consanguïniteit binnen de reguliere zorg vormen van brede tests wel reeds worden aangeboden. Een brede test, met enkele tientallen tot honderden aandoeningen, kan in principe aan elk willekeurig paar met kinderwens worden aangeboden (universeel aanbod), maar uiteraard ook aan hoogrisicogroepen, als de aandoeningen waarvoor een verhoogde kans op dragerschap bestaat in de test zijn opgenomen. Deze brede dragerschapstests voor hoogrisicogroepen worden dan ook besproken in de betreffende modules in deze richtlijn.
De relatie tussen preconceptie en neonataal screeningsaanbod
De Gezondheidsraad concludeerde in 2016 al dat als er rond de zwangerschap een gecoördineerd screeningsaanbod ontstaat dat enerzijds gericht is op gezondheidswinst voor het kind (neonatale hielprikscreening) en anderzijds op het vergroten van reproductieve autonomie van de ouders (preconceptie dragerschapsscreening), de keten in samenhang bezien moet worden en op elkaar zijn afgestemd (Gezondheidsraad, 2016). De relatie tussen de aandoeningen die in de Nederlandse hielprik zitten en (zouden moeten) komen en de aandoeningen die binnen de zorg aangeboden dragerschapstests opgenomen (zouden moeten) worden is derhalve een onderwerp dat nadere bespreking vergt. De uitwerking van dit onderwerp valt buiten deze richtlijn, maar zal in het Normatieve Kader wel kort toegelicht worden.
Een voorbeeld hierbij zijn de hemoglobinopathieën (HbP). Jaarlijks worden 40 tot 50 kinderen met een ernstige vorm van hemoglobinopathie (sikkelcelziekte, alfa-thalassemie (HbH ziekte) en bèta-thalassemie) gediagnosticeerd (www.rivm.nl/hielprik). Zij worden verwezen naar de kinderhematoloog. Dragerschapsonderzoek bij de ouders van deze kinderen en verwijzing naar een klinisch geneticus is geïndiceerd in het kader van een belaste familieanamnese. Daarnaast wordt aan ongeveer 800 kinderen via de huisarts dragerschap van sikkelcelziekte (HbS) als nevenbevinding gerapporteerd. Het advies is dat de huisarts met de ouders een pre-test counseling gesprek voert en vervolgens beide ouders desgewenst laat testen op dragerschap van hemoglobinopathie. Indien beide ouders drager zijn van een vorm van hemoglobinopathie, kunnen zij verwezen worden naar een klinisch geneticus. Dit alles gebeurt echter zelden (Kaufmann, 2014). In 2015 is door de Gezondheidsraad geadviseerd om de rapportage van de nevenbevinding ‘het aantonen van dragerschap van sikkelcelziekte’ stop te zetten (Gezondheidsraad, 2015). Het doel van de neonatale screening is immers het vroegtijdig opsporen van kinderen met een ernstige ziekte en niet van dragerschap. Dit advies door de minister vooralsnog niet opgevolgd en dragerschap wordt nog gemeld (Kamerbrief, 2015). Voorwaarde voor het stopzetten van rapportage van HbS dragers is namelijk dat er een goed alternatief is, met name op gebied van voorlichting aan de hemoglobinopathie hoogrisicogroep en het beter faciliteren van hemoglobinopathie dragerschapsonderzoek in de eerste lijn. Deze richtlijn heeft mede tot doel hieraan bij te dragen.
X-gebonden en autosomaal dominante aandoeningen
Dragerschapsonderzoek naar X-gebonden (recessieve) aandoeningen, zoals bijvoorbeeld Duchenne spierdystrofie en fragiele X-syndroom, is technisch goed mogelijk. De in deze richtlijn gedefinieerde hoogrisicogroepen voor autosomaal recessieve aandoeningen hebben echter geen verhoogde kans op dragerschap voor X-gebonden aandoeningen, vandaar dat dragerschapsonderzoek naar deze aandoeningen buiten deze richtlijn valt. Bij sommmige hoogrisicogroepen is er wel een verhoogde kans op aanleg voor bepaalde, late-onset en behandelbare, autosomaal dominante aandoeningen (zoals erfelijke borst/eierstokkanker). Een PDO-aanbod hiervoor is echter ongeschikt; verwijzing voor erfelijkheidsonderzoek bij de risicodragende wensouder(s) zelf ligt veel meer voor de hand.
Paren die in aanmerking komen voor geassisteerde reproductie maar niet tot een hoogrisicogroep behoren
De vraag of paren (inclusief recipient/donorparen) die in aanmerking komen voor geassisteerde reproductie maar die niet primair tot een hoogrisicogroep behoren op basis van etnische of geografische afkomst en/of consanguïniteit, ook in aanmerking zouden moeten komen voor PDO, valt buiten de behandeling van deze richtlijn.
Paren met een psychosociale indicatie voor PDO
Paren die niet afkomstig zijn uit een hoogrisicogroep maar bij wie mogelijk een psychosociale indicatie voor PDO bestaat, vanwege bijvoorbeeld de geboorte of zwangerschap van een (eerder) aangedaan ernstig ziek kind, vallen buiten deze richtlijn.
Beoogde gebruikers van de richtlijn
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen uit de 1e, 2e en 3e lijn die betrokken zijn bij de medische zorg voor patiënten/paren in de reproductieve leeftijd en/of hun nageslacht, uit de hiervoor omschreven hoogrisicogroepen. Al deze groepen werden betrokken en gehoord tijdens de invitational conference. Daarnaast is de richtlijn geschreven voor klinisch moleculair genetici en hun collega’s werkzaam in de laboratoria voor genoomdiagnostiek van de afdelingen Genetica van de UMC’s die zich bezighouden met het inrichten en uitvoeren van (preconceptie) dragerschapstests voor hoogrisicogroepen (zie de module ‘Criteria en tests per hoogrisicogroep’).
Aanbod PDO door de afdelingen Klinische Genetica (inclusief hun laboratoria voor genoomdiagnostiek)
Alle laboratoria voor genoomdiagnostiek van de afdelingen Klinische Genetica binnen de Universitair Medische Centra (UMC’s) in Nederland mogen DNA dragerschapstests aanbieden omdat zij een vergunning hebben in het kader van de WBMV, zie hierna. De bijbehorende complexe pre- en post-test counseling (erfelijkheidsadvisering) wordt, in datzelfde kader, verzorgd door de (sub)afdelingen Klinische Genetica binnen de UMC’s. DNA onderzoek en erfelijkheidsadvisering worden vergoed vanuit het basispakket van de zorgverzekering. Dit kan wel ten koste gaan van het eigen risico.
Verwijzing voor PDO naar alle afdelingen Klinische Genetica is mogelijk. Degene die de erfelijkheidsadvisering uitvoert (klinisch geneticus of de klinisch geneticus in opleiding, genetisch consulent of physician assistant/verpleegkundig specialist Genetica), kan in elk gewenst en in aanmerking komend UMC de dragerschapstest aanvragen die het meest van toepassing is bij het specifieke risico en situatie van het betreffend paar. Het aanbod van het soort tests en de uitvoering van de tests binnen de laboratoria is niet gekoppeld aan de locatie van waaruit de erfelijkheidsadvisering wordt gegeven: Het aanbod en de beschikbaarheid van tests vanuit de diverse laboratoria van de afdelingen Klinische Genetica varieert per UMC en kan in de loop der tijd veranderen. De landelijke Werkgroep Preconceptie Dragerschapsscreening (WPCS VKGN/VKGL), waarin vanuit alle afdelingen vertegenwoordigers zitten, streeft ernaar om het aanbod per indicatie en per test af te stemmen, hierbij onder meer rekening houdend met technische en ethische aspecten.
Het verrichten van DNA onderzoek voor monogene aandoeningen (waaronder dragerschapstests) in de klinische setting is in Nederland voorbehouden aan vergunninghouders (i.c. de UMC’s) onder de WBMV. Het staat mensen en paren uiteraard wel vrij om gebruik te maken van dit soort tests die, al dan niet commercieel, in het buitenland worden uitgevoerd, aangeboden door een zorgverlener, dan wel direct bij de aanbieder besteld (zogenaamd “direct-to-consumer”). Deze richtlijn beperkt zich evenwel tot PDO dat in de klinische setting wordt aangeboden aan paren uit hoogrisicogroepen en daarbinnen tot DNA dragerschapstests die onder vergunning van de laboratoria voor genoomdiagnostiek binnen de UMC’s worden verricht en tot biochemische tests die door de diverse referentie-laboratoria worden verricht.
Het aanbieden van PDO of verrichten van een dragerschapstest is niet vergunningplichtig in het kader van de Wet op het Bevolkingsonderzoek (WBO) (zie het Normatieve Kader).
Zie voor meer informatie over de afzonderlijke tests: (NB: zie implementatieplan: deze websites worden up to date gemaakt na verschijnen van deze richtlijn)
www.huisartsengenetica.nl/info/dragerschapstesten
Onderbouwing
Referenties
- ACOG Committee Opinion-690 (2017a). Carrier Screening in the Age of Genomic Medicine. American College of Obstetricians and Gynecologists. Obstet Gynecol; 129(3): e35-e40.
- ACOG Committee Opinion-691 (2017b). Carrier screening for genetic conditions. American College of Obstetricians and Gynecologists. Obstet Gynecol; 129: e41–55.
- Antonarakis (2019). Carrier screening for recessive disorders. Nat Rev Genet ; 20 : 549–561.
- Blokhuis P (2019) Beleidsreactie advies Gezondheidsraad Neonatale screening op SMA.
- Castellani C, Macek Jr M, Cassiman JJ, et al (2010). Benchmarks for cystic fibrosis carrier screening: a European consensus document. J Cyst Fibros; 9: 165–178.
- Chokoshvili D, Borry P, Vears DF (2018). A systematic analysis of online marketing materials used by providers of expanded carrier screening. Genet Med; 20(9): 976-984.
- College Perinatale Zorg (CPZ, 2018). Preconceptie Indicatie Lijst (PIL). Website bezocht 22-8-2019: www.kennisnetgeboortezorg.nl/wp-content/uploads/2019/06/Preconceptie_Indicatie_Lijst_PIL_.pdf.
- De Jonge (2020) Beleidsreactie op advies Gezondheidsraad Nenonatale Screening op Spinale Spieratrofie.
- Edwards JG., Feldman G, Goldberg J, et al (2015) Expanded Carrier Screening in Reproductive Medicine – Points to Consider. Obstet Gynecol;125:653-62.
- European Network for Rare and Congenital Anaemias (ENERCA) and Thalassaemia International Federation(TIF) (2013). Haemoglobinopathies on the move: Is Europe ready? Website bezocht 20-10-2019: www.enerca.org/media/upload/arxius/Training/Novartis_OncologyReport_2013.pdf.
- Francioli LC, Menelaou A, Pulit SL, et al. (2014). Whole‐genome sequence variation, population structure and demographic history of the Dutch population. Nat Genet; 46(8): 818‐825.
- Gezondheidsraad (2007). Preconceptiezorg: voor een goed begin. Den Haag: Gezondheidsraad; publicatienr. 2007/19.
- Gezondheidsraad. Screening: tussen hoop en hype. Den Haag: Gezondheidsraad, 2008; publicatienr. 2008/05.
- Gezondheidsraad (2009). Wet bevolkingsonderzoek: knelpunten in de toepassing – voorstellen ter verbetering. Den Haag: Gezondheidsraad; publicatienr. 2009/04.
- Gezondheidsraad (2014). Nevenbevindingen bij diagnostiek in de patiëntenzorg. Den Haag: Gezondheidsraad; publicatienr. 2014/13.
- Gezondheidsraad (2015). Neonatale screening: nieuwe aanbevelingen. Den Haag: Gezondheidsraad; publicatienr. 2015/08.
- Gezondheidsraad (2016). Prenatale screening. Den Haag: Gezondheidsraad; publicatienr. 2016/19.
- Gezondheidsraad (2019). Neonatale screening op spinale spieratrofie. Den Haag: Gezondheidsraad; publicatienr. 2019/15.
- Gonzaga- Jauregui, C., Lupski, J. R. & Gibbs, R. A. (2012). Human genome sequencing in health and disease. Annu Rev Med; 63: 35–61.
- Gross SJ, Pletcher BA, Monaghan KG (2008). Carrier screening in individuals of Ashkenazi Jewish descent. Genet Med; 10: 54–56.
- Henneman L, Borry P, Chokoshvili D, et al. (2016). Responsible implementation of expanded carrier screening. Eur J Hum Genet; 24(6): e1-e12.
- Holtkamp KCA, Van Maarle MC, Schouten MJ, Dondorp, WJ, Lakeman P, Henneman L. (2016). Do people from the Jewish community prefer ancestry-based or pan-ethnic expanded carrier screening? Eur J Hum Genet: 24(2): 171-177.
- Holtkamp KCA (2017) Implementing carrier screening in a changing landscape: Perspectives of public and professional stakeholders. Proefschrift, Vrije Universiteit Amsterdam.
- Kaufmann JO, Krapels IPC, Van Brussel BTJ et al (2014) After the introduction into the national newborn screening program: who is receiving genetic counseling for hemoglobinopathies in the Netherlands? Public Health Genomics; 17: 16-22.
- Mathijssen IB, Holtkamp KCA, Ottenheim CPE, et al. (2018) Preconception carrier screening for multiple diseases: Evaluation of a screening offer in a Dutch founder population. Eur J Hum Genet; 26: 166-175.
- Metcalfe S.A. (2012) Carrier screening in preconception consultation in primary care. J Community Genet; 3(3): 193–203.
- NIVEL (2015). Kennisvraag 2015: het maatschappelijke draagvlak voor preconceptie dragerschapscreening in Nederland. Utrecht: NIVEL. ISBN 978-94-6122-356-2.
- Plantinga M, Birnie E, Abbott KM, et al. (2016). Population‐based preconception carrier screening: how potential users from the general population view a test for 50 serious diseases. Eur J Hum Genet; 24(10): 1417‐1423.
- Solomon BD, Nguyen, AD, Bear KA, Wolfsberg TG (2013).Clinical genomic database. Proc Natl Acad Sci USA; 110: 9851–9855.
- The 1000 Genomes Project Consortium (2010). A map of human genome variation from population- scale sequencing. Nature; 467: 1061–1073.
- Traeger-Synodinos J, Harteveld CL, Old JM, et al. (2015). EMQN Best Practice Guidelines for molecular and haematology methods for carrier identification and prenatal diagnosis of the haemoglobinopathies. Eur J Hum Genet; 23: 426–437.
- van den Heuvel L, Langen I, Plantinga M,Verkerk M (2015). In aantocht: dragerschapstest voor meer ziekten tegelijk. Medisch Contact; 18: 914-917.
- Verhaart IEC, Robertson A, Wilson IJ, et al. (2017) Prevalence, incidence and carrier frequency of 5q-linked spinal muscular atrophy - a literature review. Orphanet J Rare Dis; 12(1): 124.
- van Voorst SF, Plasschaert SCN, de Jong-Potjer LC, Steegers EAP, Denktas S (2016) Current practice of preconception care by primary caregivers in the Netherlands. Eur J Contraception Reprod Health Care; 21: 251-258.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 02-03-2020
Laatst geautoriseerd : 02-03-2020
Geplande herbeoordeling : 01-01-2026
Voor het beoordelen van de actualiteit van deze richtlijn is de richtlijnkerngroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de VKGN of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan geschreven. Bij het opstellen van de richtlijn heeft de kerngroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. In een artikel van Burke (2019) wordt uiteengezet dat een evidence-based onderbouwing vaak erg lastig is voor genetische geneeskunde gezien de snelle veranderingen in genpanels en tests. Een andere aanpak voor het schrijven van evidence-based richtlijnmodules is daarom om de CPAD methode te volgen (Clinical practice advisory document) zoals beschreven in het artikel van Burke (2019). De kerngroep adviseert deze methode als uitgangspunt te nemen bij een herziening of aanvulling van deze richtlijn. Voor de ontwikkeling van deze richtlijn (gestart in januari 2018) kon deze methode niet als uitgangspunt genomen worden vanwege de verschijningsdatum.
De VKGN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
De richtlijn zal handvatten bieden voor de medische indicatiestelling en dus het, al dan niet actief, aanbieden van en verwijzen voor preconceptie dragerschapsonderzoek (PDO) aan hoogrisicogroepen. Dit stelt paren met kinderwens uit deze hoogrisicogroepen in staat om autonome reproductieve beslissingen te nemen bij voorkeur voorafgaande aan een zwangerschap (zie reproductieve opties in de Algemene inleiding).
Doelgroep
Deze richtlijn gaat over preconceptie dragerschapsonderzoek (PDO) voor hoogrisicogroepen. Met hoogrisicogroepen wordt bedoeld: paren (en individuen) die op basis van etniciteit of geografische afkomst en/of consanguïniteit een hogere kans hebben om een drager of dragerpaar te zijn van één of meerdere (specifieke) autosomaal recessieve aandoeningen ten opzichte van het algemene populatierisico van de gehele bevolking om drager of dragerpaar te zijn van die aandoening(en).
Beoogde gebruikers van de richtlijn
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen uit de 1e, 2e en 3e lijn die betrokken zijn bij de medische zorg voor patiënten/paren in de reproductieve leeftijd en/of hun nageslacht, uit de hiervoor omschreven hoogrisicogroepen. Daarnaast is de richtlijn geschreven voor klinisch moleculair genetici en hun collega’s werkzaam in de laboratoria voor genoomdiagnostiek van de afdelingen Genetica van de UMC’s die zich bezighouden met het inrichten en uitvoeren van (preconceptie) dragerschapstests voor hoogrisicogroepen (zie de module ‘Criteria en tests per hoogrisicogroep’).
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire richtlijnkerngroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de samenstelling van de kerngroep en de klankbordgroep).
De richtlijnkerngroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De richtlijnkerngroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
De klankbordgroep (onder meer bestaande uit afgevaardigden van de VKGN, VKGL, KNOV, NVOG, NVK, VvF, VSOP, en NHG) heeft de conceptteksten gelezen en hier feedback op gegeven vóórdat de richtlijn in commentaar is gegaan. De richtlijnkerngroep heeft de feedback vervolgens doorgenomen en indien nodig aanpassingen gedaan. De richtlijnkerngroep bepaalt de inhoud van de versie die aan externe partijen wordt voorgelegd tijdens de commentaarfase.
Kerngroep
- Prof. dr. I.M. (Irene) van Langen, klinisch geneticus & hoogleraar Klinische Genetica, werkzaam in het UMCG, Groningen, VKGN (voorzitter)
- Dr. P. (Phillis) Lakeman, klinisch geneticus werkzaam in het Amsterdam UMC, locatie AMC, Amsterdam, VKGN (vice-voorzitter)
- Dr. L. (Lidewij) Henneman, senior onderzoeker en universitair hoofddocent afdeling Klinische Genetica, werkzaam in het Amsterdam UMC, locatie VUmc, Amsterdam
- Dr. Ir. A.D.C. (Aimee) Paulussen, laboratoriumspecialist klinische genetica, werkzaam in het Maastricht UMC+, Maastricht, VKGL
- Prof. dr. W.J. (Wybo) Dondorp, Socrates hoogleraar Humanisme & ethiek van reproductieve genetica; universitair hoofddocent Biomedische ethiek, afdeling Health, Ethics & Society, Universiteit Maastricht
- Dr. S. (Sanne) van der Hout, assistant professor Biomedische ethiek, afdeling Health, Ethics & Society, Universiteit Maastricht
- Dr. I. (Ilse) Feenstra, klinisch geneticus, werkzaam in het Radboudumc, Nijmegen, VKGN
- Dr. S.C.E.H. (Suzanne) Sallevelt, klinisch geneticus, werkzaam in het Maastricht UMC+, Maastricht, VKGN
- Drs. J.J.T. (Jeske) van Harssel, klinisch geneticus, werkzaam in het UMC Utrecht, Utrecht, VKGN
- Drs. K.E. (Kyra) Stuurman, klinisch geneticus, werkzaam in het Erasmus MC, Rotterdam, VKGN
- Dr. N.S. (Nicolette) den Hollander, klinisch geneticus, werkzaam in het LUMC, Leiden, VKGN
- Dr. S. (Silvana) van Koningsbruggen, laboratoriumspecialist klinische genetica, werkzaam in Amsterdam UMC, locatie AMC, Amsterdam, VKGL
- Dr. T. (Trijnie) Dijkhuizen, laboratoriumspecialist klinische genetica, werkzaam in het UMCG, Groningen, VKGL
- Drs. E. (Elsbeth) van Vliet-Lachotzki, patiëntvertegenwoordiger, Vereniging Samenwerkende Ouder- en Patiëntenorganisaties, VSOP
- Dr. M. (Mirjam) Plantinga, senior onderzoeker afdeling Genetica, werkzaam in het UMCG, Groningen
Klankbordgroep
- Dr. K. (Kristin) Abbott, laboratoriumspecialist klinische genetica, werkzaam in het UMCG, Groningen, VKGL
- Dr. H.T. (Hennie) Brüggenwirth, laboratoriumspecialist klinische genetica, werkzaam in het Erasmus MC, Rotterdam, VKGL
- Dr. K. (Karin) Huijsdens- van Amsterdam, laboratoriumspecialist klinische genetica, werkzaam in het UMCU, Utrecht, VKGL
- Dr. C.L. (Kees) Harteveld, laboratoriumspecialist klinische genetica, werkzaam in het LUMC, Leiden, VKGL
- Dr. I. (Irene) Homminga, IVF-arts, werkzaam in het UMCG, Groningen, VvF
- Dr. L.C. (Lieke) de Jong - Potjer, huisarts, werkzaam bij Huisarts, werkzaam bij Huisartsenpraktijk het Kompas , NHG
- Dr. R.J.T. (Ron) van Golde, gynaecoloog, werkzaam in het Maastricht UMC+, Maastricht, NVOG
- Dr. M.F.C.M. (Maarten) Knapen, gynaecoloog-perinatoloog, werkzaam in het Erasmus MC, Rotterdam, NVOG
- Prof. mr. J.G. (Jaap) Sijmons, hoogleraar Gezondheidsrecht, werkzaam bij het UMCU, Utrecht
- Dr. C.R. (Carsten) Lincke, kinderarts, werkzaam in het ErasmusMC, Rotterdam, NVK
- Dr. M. (Marjolein) Peters, kinderarts, voorheen werkzaam in het Amsterdam UMC, Amsterdam, NVK
- Dr. S. (Suze) Jans, wetenschapsredacteur, Utrecht; onderzoeker, afdeling Child health TNO Leiden, KNOvV
Met ondersteuning van
- E.A. (Ester) Rake, MSc, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- M. (Margriet) Moret-Hartman, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- M. (Marjolein) de Weerd, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten (tot 1 augustus 2019)
Met dank aan
- Dr. M.E. (Marleen) Jansen, postdoc onderzoeker afdeling Klinische Genetica, werkzaam in het Amsterdam UMC, locatie VUmc, Amsterdam
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle kerngroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van de kerngroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de federatie Medisch Specialisten.
|
Kerngroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dijkhuizen |
Laboratoriumspecialist Klinische Genetica, UMCG |
Lid WPCS VKGN/VKGL (onbetaald) |
Betrokken bij aanbod dragerschapstesten via instelling. |
Geen |
|
Dondorp |
Bijzonder hoogleraar Humanisme & ethiek van reproductieve genetica (Stichting Socrates – Humanistisch Verbond); Universitair hoofddocent Faculteit Health, Medicine & Life Sciences, afd Health, Ethics & Society, Universiteit Maastricht, 0,8 fte |
Lid WPCS VKGN/VKGL (onbetaald)
|
Was co-auteur van position document over de verantwoorde introductie van preconceptionele dragerschapsscreening: Henneman L et al. Responsible implementation of expanded carrier screening. Eur J Hum Genet. 2016;24(6):e1-e12.
Was secretaris van Gezondheidsraadcommissie 'Screening en de rol van de overheid'. Schreef in die hoedanigheid het advies 'Screening: tussen hoop en hype' (GR 2008).
Was lid van Gezondheidsraadcommissie Prenatale screening (advies in 2016).
Als ethicus betrokken bij onderzoek naar verantwoord (toekomstig) aanbod van dragerschapstest/screening in het MUMC, Maastricht
Was medeaanvrager van het door ZonMw gehonoreerde (inmiddels afgeronde) POM-project (preconceptionele dragerschapsscreening op maat). |
Geen |
|
Feenstra |
Klinisch geneticus, Radboudumc |
Lid WPCS VKGN/VKGL (onbetaald) -Voorzitter werkgroep prenatale genetica (onbetaald) -Lid Raad van Advies stichting prenatale screening Nijmegen (vacatie) |
Geen |
Geen |
|
Harssel |
Klinisch Geneticus, UMC Utrecht |
Lid WPCS VKGN/VKGL (onbetaald) -Lid werkgroep prenatale genetica (onbetaald) -Lid commissie Kwaliteit VKGN (onbetaald) |
Geen |
Geen |
|
Henneman |
Senior onderzoeker (Associate professor) en Universitair Hoofddocent, afdeling Klinische Genetica VUmc (vakgebied community genetics en public health genomics) |
Voorzitter wetenschappelijke vereniging Nederlandse Associatie voor Community Genetics en Public Health Genomics (NACGG) (onbetaald). -Lid bestuur Nederlandse Vereniging voor Humane Genetica (NVHG) (onbetaald) -Lid Forum Biotechnologie en Genetica (FBG), (onbetaald). -Secretaris Stichting Preconceptiezorg Nederland, (onbetaald). -Lid WPCS VKGN/VKGL (onbetaald) -Lid Kerngroep Niet Invasieve Prenatale Testen (NIPT) Consortium, (onbetaald -Website redactielid: www.huisartsengenetica.nl (onbetaald). - Lid Gezondheidsraad commissie Screening rond zwangerschap en geboorte (advies screening op niet-behandelbare aandoeningen) (vacatie). |
Hoofdaanvrager ZonMw- gefinancierde onderzoeksprojecten:- POM studie (Preconceptionele dragerschapscreening Op Maat); project rond de ontwikkeling en verdere implementatie van preconceptionele dragerschapscreening en opzet website www.benikdrager.nl (i.s.m. Erfocentrum) (afgerond, looptijd 2015-2017).
ZonMw VIMP (Verspreidings- en lmplementatieplan) Preconceptie dragerschapsscreening Op Maat (POM) (looptijd 2018-2019). Werkzaam en verbonden aan een instelling (Amsterdam UMC) dat preconceptie dragerschapstesten aanbiedt (zonder winstoogmerk) www.dragerschapstesten.nl.
Betrokken (geweest) als onderzoeker bij een (onbetaald onderzoeksproject) naar de evaluatie van een kinderwensspreekuur in een genetisch geïsoleerde populatie, het aanbod via www.dragerschapstest.nl en (ZonMw gefinancieerd) www.vumc.nl/CFtest.
Was eerste auteur van het PPPC European Society of Human Genetics position document over de verantwoorde introductie van preconceptionele dragerschapsscreening: Henneman L et al. Responsible implementation of expanded carrier screening. Eur J Hum Genet. 2016;24(6):e1-e12.
Was lid van Gezondheidsraadcommissie Prenatale screening (advies in 2016). |
Geen |
|
Van Koningsbruggen |
Laboratorium specialist klinische genetica, AMC |
Lid WPCS VKGN/VKGL (onbetaald) |
Betrokken bij aanbod dragerschapstesten via instelling. |
Geen |
|
Lakeman |
Klinisch geneticus te AMC Amsterdam |
Lid WPCS VKGN/VKGL (onbetaald) -Lid werkgroep PIL (vacatie) |
Sinds mei 2016 biedt Amsterdam UMC, locatie AMC een preconceptie dragerschaptest aan voor paren met kinderwens aan hoogrisicogroepen en aan koppels zonder a priori verhoogd risico (www.dragerschapstesten.nl). Door de richtlijn zal meer aandacht komen voor deze en ander in NL beschikbare testen. Hierdoor zal er meer aanndacht zijn voor de wetenschappelijke studies over het aanbod van deze test.
Was co-auteur van onder andere het PPPC ESHC position document over de verantwoorde introductie van preconceptionele dragerschapsscreening: Henneman L et al. Responsible implementation of expanded carrier screening. Eur J Hum Genet. 2016 ;24(6):e1-e12.
Was medeaanvrager van het door ZonMw gehonoreerde (inmiddels afgeronde) POM-project (preconceptionele dragerschapsscreening op maat). |
Geen |
|
Den Hollander |
Klinisch geneticus LUMC 80% |
geen (Commissie kwaliteit VKGN onbetaald) lid |
Betrokken bij aanbod dragerschapstesten via instelling. |
Geen |
|
Paulussen |
Laboratorium Specialist Klinische Genetica (LSKG) MUMC+ |
Bestuurslid Nederlandse Vereniging Humane Genetica (NVHG, penningmeester) (onbetaald), Lid Registratie Commissie VKGL (onbetaald), Lid WPCS VKGN/VKGL (onbetaald) |
Klinisch 'kartrekker' van de dragerschapstest die op dit moment geïmplementeerd is (niet-commercieel) door de afdeling klinische genetica van het MUMC+ |
Geen |
|
Plantinga |
senior onderzoeker afdeling genetica UMCG (0,6 FTE) programma manager leidende coalitie patientenparticipatie UMCG (0,3 FTE) |
Visiting research fellow CELS Southampton (onbetaald) Secretaris landelijke PCS werkgroep (onbetaald) Secretaris NACGG (onbetaald) |
Betrokken bij UMCG onderzoek naar implementatie van dragerschapsscreening via de huisarts |
Geen |
|
Sallevelt |
klinisch geneticus MUMC+ |
Lid WPCS VKGN/VKGL (onbetaald) |
Klinisch 'kartrekker' van de PCS test die op dit moment geimplementeerd is (niet-commercieel) door de afdeling klinische genetica van het MUMC+ |
Geen |
|
Stuurman |
klinisch geneticus Erasmus MC |
Geen |
Geen |
Geen |
|
Van Langen |
Hoogleraar Klinische Genetica, UMCG, Groningen |
Lid van de vaste commissie bevolkingsonderzoek Gezondheidsraad. (vacatie) - Lid WPCS VKGN/VKGL (onbetaald) |
In het UMCG behoren wij tot de voorlopers met betrekking tot aanbod van en wetenschappelijk onderzoek op het gebied van (universele) dragerschapsscreeningstests. Ik heb een joint PhD (samen met collega A.Lucassen in Southampton) die de evaluatie van de pilot in 1e lijn doet (en deze pilot heeft uitgevoerd), dit is dus op ander vlak. Ook doet zij nu onderzoek naar verschillen (ethisch) naar aanbod in 1e lijn (alle paren met kinderwens) en in 2e/3e lijn binnen fertiliteitspopulatie. Tot stand komen/brengen van richtlijn zal haar/ons geen voordeel geven, voor zover ik kan inschatten. Promotie volgt in 2020. |
Geen |
|
Van Vliet |
Beleidsmedewerker VSOP patiënten perspectief ethiek, genetica en perinatale zorg. 18 uur Vanuit de VSOP gedetacheerd voor 45% bij Stichting Erfocentrum als project leider ZwangerWijzer.nl en medisch adviseur. |
Lid van de Beraadsgroep Gezondheidsraad (vacatiegeld). - Lid Programma commissie Prenatale Screening downsyndroom en SEO. Tevens lid werkgroep kwaliteit, voorlichting en onderzoek. Centrum voor bevolkingsonderzoek, RIVM, (vacatiegeld en reiskosten) - Lid werkgroep Preconceptie Indicatielijst (PIL) , College perinatale Zorg (vacatiegeld), in eindfase - Lid van het TRIDENT Consortium en TRIDENT 2 studie: onderzoek naar mening zwangeren over ervaringen NIPT in Nederland VUMC (project financiering ZONMW). - Lid begeleidingscommissie studie eerste trimester virtual reality echoscopie in de verloskundige zorg (project financiering) - Project lid Studie A loyalty program to motivate vulnerable women to engage in preconception care: ‘from voucher to tablet’”. (project financiering ZONMW) - Project lid APROPOS-II. A Stepped Wedge Cluster Randomized Controlled Trial to evaluate the effect of a locally tailored approach for Preconception Care (project financiering ZONMW) - Adviseur VIMP Preconceptionele dragerschap screening op maat (POM) (project financiering ZONMW) (afgerond) |
VSOP is een vereniging van circa 80 ouder- en patiëntenorganisaties betrokken bij zeldzame, vaak erfelijke, aangeboren aandoeningen |
Geen |
|
Van der Hout |
Universitair docent Biomedische Ethiek, Universiteit Maastricht |
Lid WPCS VKGN/VKGL (onbetaald) -Lid werkgroep Pre-implantatie Genetische Diagnostiek, MUMC Maastricht. (Onbetaald). -Lid Commissie Medisch-Ethische en -Juridische Aangelegenheden (CMEJA), MUMC Maastricht. (Onbetaald). |
Als ethicus betrokken bij onderzoek naar verantwoord (toekomstig) aanbod van dragerschapstest/screening in het MUMC, Maastricht
Co-auteur van richtlijn van de European Society of Human Embryology and Reproduction (ESHRE) over de ethiek van preconceptionele dragerschapsscreening aan paren die in aanmerking komen voor medisch geassisteerde voortplanting: De Wert et al. Ethics of Preconception Carrier Screening in Assisted Reproduction (work in progress). |
Geen |
|
Klankbord-groeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Abbott |
laboratoriumspecialist (buitengewoon), UMCG |
diagnostiek NGS analyse pipeline coördineren, plus laboratoriumspecialist taken |
Geen |
Geen |
|
Bruggenwirth |
Laboratoriumspecialist Klinische genetica |
Geen |
Geen |
Geen |
|
Harteveld |
Senior-Laboratorium Specialist Klinische Genetica LDGA, Leids Universitair Medisch |
Associate-Editor International Journal of Laboratory hematology (onbetaald) |
Geen |
Geen |
|
Homminga |
Fertiliteitsarts, UMCG |
Geen |
Geen |
Geen |
|
Huijsdens |
Laboratoriumspecialist klinische genetica, UMCU |
Geen |
Geen |
Geen |
|
Jans |
Wetenschappelijk Redacteur Tijd schrift voor verloskundigen (KNOV) 0,33 FTE Beleidsadviseur KNOV 0, 1 FTE |
Geen |
Geen |
Geen |
|
Jong-Potjer |
Vrijgevestigde huisarts te Zoetermeer (3 dagen/ week) |
Project kwetsbare zwangere in Zoetermeer, betaald vanuit subsidie gemeente |
Geen |
Geen |
|
Knapen |
gynaecoloog perinatoloog ErasmusMC, 0.6 fte |
gynaecoloog star/shl, gynaecologische consulten, betaald. |
Geen |
Geen |
|
Lincke |
kinderarts-erfelijke en aangeboren aandoeningen |
voorzitter Klinische Adviesraad en vaccincommissie Lareb (onbetaald) |
Geen |
Geen |
|
Peters |
Kinderarts-hematoloog |
Geen |
Geen |
Geen |
|
Sijmons |
partner Nysingh advocaten - notarissen NV, hoogleraar gezondheidsrecht Universiteit Utrecht (0,2) |
voorzitter voering voor gezondheidsrecht (onbetaald), raadsheer plaatsvervanger hof amsterdam (onbetaald), lid gezondheidsraad (onbetaald) lid redactie tijdschrift voor gezondeheidsrecht (onbetaald) hoofddocent Grotius academy opleiding gezondheidrecht (betaald) BV besturen binnen de zorg (onbetaald) |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntenvereniging in de kerngroep (VSOP). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Vereniging Samenwerkende Ouder- en Patiëntenorganisaties en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
In een artikel van Burke (2019) wordt uiteengezet dat een evidence-based onderbouwing vaak erg lastig is voor genetische geneeskunde gezien de snelle veranderingen in genpanels en tests. Een andere aanpak voor het schrijven van evidence-based richtlijnmodules is daarom om de CPADmethode te volgen (Clinical practice advisory document) zoals beschreven in het artikel van Burke. De kerngroep adviseert deze methode als uitgangspunt te nemen bij een herziening of aanvulling van deze richtlijn.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de kerngroep en de adviseur de knelpunten, mede op basis van 6 interviews met stakeholders. Tevens zijn er knelpunten aangedragen door de VKGL, VVF, KNOV, Stichting CZB, NVOG, VKGN, VSOP en diverse externe experts op persoonlijke titel via de invitational conference op 21 september 2018, waar ook een samenvatting van de resultaten van de interviews werd gepresenteerd. Een verslag hiervan is opgenomen onder de aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de kerngroep besproken waarna de kerngroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de kerngroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De kerngroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de kerngroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
De definiëring van hoogrisicogroepen (module 'Definitie van hoogrisicogroepen') is ontstaan door voortschrijdend inzicht. Er werd op 9 april 2019 oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews via Medline (OVID) en de Cochrane library. Er is breed gezocht naar hoogrisicogroepen en (expanded) dragerschapsonderzoek voor recessieve aandoeningen. Hierbij is naast preconceptionele screening ook prenatale screening meegenomen, omdat mensen buiten Nederland zich vaak pas tijdens de zwangerschap op dragerschap laten testen en deze literatuur ook relevant is voor deze richtlijn. Cascadescreening (familiescreening naar aanleiding van uitkomsten van een individuele dragerschapstest of aandoening in de familie) wordt buiten beschouwing gelaten. Omdat dit een oriënterende search is, werd alleen de P (Patiënten) gedefinieerd.
- P (Patiënten): (expanded) carrier screening, universal carrier screening, ancestry based carrier screening, preconception carrier screening, reproductive carrier screening, screening for autosomal recessive disorders, screening for (severe) childhood disorders, ethnicity based screening, targeted carrier screening.
Hoe breder de bevolking (de patiëntengroep) wordt ingedeeld, hoe meer mensen uit de bevolking kunnen worden gerelateerd aan een hoogrisicogroep. Echter, een beperkt aantal hoogrisicogroepen zijn door wetenschappelijk onderzoek in Nederland bekend.
Vervolgens werd voor een aantal afzonderlijke uitgangsvragen (zie de modules ‘Criteria en tests per hoogrisicogroep’ en 'Individuele testuitslag versus parenuitslag’) aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De kerngroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR -voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A. Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B. Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De kerngroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De gehele bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de kerngroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’. In deze richtlijn bleek uiteindelijk het opstellen van PICO’s en het selecteren van literatuur voor de analyse niet goed van toepassing (zie artikel Burke, 2019). Daarom is de gebruikte literatuur (veelal niet-systematisch literatuuronderzoek) beschreven in de Overwegingen en tezamen met alle argumenten (consensus based en expert based) meegenomen in het wegen en opstellen van de aanbevelingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de kerngroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Ontwikkeling van kwaliteitsindicatoren
De kerngroep heeft besloten geen indicatoren te ontwikkelen bij deze richtlijn omdat de UMC’s verschillende soorten tests aanbieden en de overige aanbevelingen volgens de kerngroep niet relevant zijn om een indicator op te stellen zonder onnodige verhoging van de administratielast.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de kerngroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de kerngroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de kerngroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd respectievelijk geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Cmaj, 182(18), E839-E842.
Burke, W., Clayton, E. W., Wolf, S. M., Berry, S. A., Evans, B. J., Evans, J. P., ... & McGuire, A. L. (2019). Improving recommendations for genomic medicine: building an evolutionary process from clinical practice advisory documents to guidelines. Genetics in Medicine. doi: 10.1038/s41436-019-0549-3.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ, 336(7653), 1106.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
