Definitie van hoogrisicogroepen bij PDO
Uitgangsvraag
Welke paren in de algemene bevolking behoren tot hoogrisicogroepen waarvoor een hogere kans geldt om een dragerpaar te zijn van een autosomaal recessieve aandoening met een verhoogd risico op een aangedaan kind, ten opzichte van het algemene risico in de algemene bevolking in Nederland?
De uitgangsvraag omvat de volgende onderdelen:
- Wanneer wordt gesproken over een hoger risico ten opzichte van het risico voor de algemene bevolking in Nederland?
- Welke “groepen” worden in deze richtlijn gedefinieerd als hoogrisicogroepen?
- Wanneer komen paren uit hoogrisicogroepen in aanmerking voor PDO?
- Door wie zouden paren uit hoogrisicogroepen geïnformeerd kunnen worden over de beschikbaarheid van PDO of een aanbod van een dragerschapstest kunnen ontvangen?
Aanbeveling
Voor zorgverleners uit de 1e, 2e en 3e lijn:
- Ga bij paren die aangeven een kinderwens te hebben na of zij tot één of meer hoogrisicogroepen behoren met een hogere kans om dragerpaar te zijn.*
- Overweeg bij paren die behoren tot hoogrisicogroepen na te gaan of zij een kinderwens hebben.
- Informeer de paren waarvan één of beide partners behoort tot een hoogrisicogroep over de beschikbaarheid van preconceptie dragerschapsonderzoek (PDO) en verwijs hen indien gewenst.
- Informeer ouders van kinderen bij wie dragerschap van sikkelcelziekte wordt aangetoond middels de neonatale hielprikscreening over PDO.
- Informeer ouders over het (bij toeval) vaststellen van consanguïniteit als dit naar voren is gekomen bij genoombreed diagnostisch onderzoek bij een eerder kind (bv. WES) en biedt hen de mogelijkheid van PDO aan als zij kinderwens hebben.
* Hoogrisicogroepen zijn in deze richtlijn gedefinieerd op basis van etnische of geografische afkomst en/of consanguïniteit. Het gaat om:
- Paren afkomstig uit endemische malaria landen met een hogere kans op dragerschap van hemoglobinopathieën (Afrika (inclusief alle mensen met Afrikaanse afkomst), De Antillen, het Caribisch Gebied, Suriname, landen rondom de Middellandse Zee (onder andere Turkije en Marokko), Nabij- en Midden Oosten (ondere andere Syrië, Irak, Iran, Afghanistan), Soedan, China, Hong Kong, India en Zuidoost-Azië).
- Paren afkomstig uit de Ashkenazi-Joodse gemeenschap.
- Paren uit genetisch geïsoleerde gemeenschappen (zoals Volendam); en/of
- Consanguine paren.
Ook wanneer slechts één van beide partners tot een hoogrisicogroep behoort, geldt voor het paar een hogere kans om een dragerpaar te zijn van die specifieke aandoening(en) ten opzichte van andere paren met kinderwens uit de algemene bevolking. In dergelijke gevallen kan het aanbieden van PDO daarom toch overwogen worden en zelfs gewenst zijn.
Hoewel de richtlijn zich primair richt op paren uit een hoogrisicogroep met een mogelijke kinderwens, kan het ook gaan om het informeren en testen van individuen (vaak vrouwen) als de partner (op dat moment) niet beschikbaar is of als gebruik is gemaakt van donorsemen.
Overwegingen
1. Wanneer wordt gesproken over hoger risico ten opzichte van het algemene risico voor de algemene bevolking in Nederland?
De term hoogrisicogroep verwijst naar paren (en individuen) die een hogere kans hebben om een drager of dragerpaar te zijn van één of meerdere (specifieke) autosomaal recessieve aandoeningen. Het gaat hierbij om een hogere kans op dragerschap ten opzichte van het algemene populatierisico om een drager of dragerpaar te zijn van die aandoening(en). Die hogere kans kan gebaseerd zijn op basis van etnische of geografische afkomst en/of consanguïniteit.
De uitslag van de dragerschapstest bepaalt of zij daadwerkelijk een dragerpaar zijn met een verhoogd risico van 1 op 4 (25%) in elke zwangerschap op het krijgen van een kind met één of meerdere specifieke recessieve aandoeningen. Een koppel is een dragerpaar als de man en de vrouw beiden (heterozygoot) drager zijn van een klasse 4 of 5 variant in hetzelfde gen.
In de richtlijn is er voor gekozen om geen exacte afbakening te hanteren voor een dragerschapsfrequentie van een specifieke aandoening voor de definitie van een hoogrisicogroep. De absolute hoogte van het risico om een dragerpaar te zijn, is niet doorslaggevend voor de indicatiestelling, maar het relatieve risico ten opzichte van het algemene risico voor de gehele bevolking op die aandoening en/of groep aandoeningen.
Hierbij wordt aangetekend dat paren met een positieve familieanamnese ook een hogere kans hebben om een dragerpaar te zijn en daarmee een indicatie voor dragerschapsonderzoek. Deze paren vallen buiten de doelstelling van deze richtlijn (zie H1 Inleiding).
2. Welke “groepen” worden in deze richtlijn gedefinieerd als hoogrisicogroepen?
2a. Hoogrisicogroepen op basis van oorspronkelijke etnische of geografische afkomst
In Nederland zijn in de algemene bevolking specifieke groepen aan te wijzen met een hoger risico ten opzichte van het algemene bevolkingsrisico op dragerschap van één of enkele specifieke autosomaal recessieve aandoeningen op basis van de oorspronkelijke etnische en/of geografische afkomst.
De term etnische afkomst verwijst in deze richtlijn naar de “genetische afkomst” gebaseerd op de zelf-gerapporteerde oorspronkelijke afkomst van de (verre) voorouders (Aspinall, 2003). De term etnische afkomst verwijst hier niet naar de ervaren (culturele) etniciteit. De zelf-gerapporteerde etnische afkomst is een betrouwbare tool gebleken om een inschatting te maken van de etnische “genetische” afkomst, beter dan een beoordeling op basis van uiterlijke verschijning of nationaliteit (Skoll, 2005). De KNOV heeft een protocol ontwikkeld voor het betrouwbaar uitvragen van etniciteit (zie KNOV - registratie etniciteit). Bij het uitvragen van etnische afkomst om in te schatten of een paar tot een hoogrisicogroep behoort, dient men alert te zijn op gemixte etnische achtergrond, maar ook op de gevoeligheden die gepaard kunnen gaan met het vragen naar etniciteit (Achterbergh, 2019).
Bepaalde ernstige autosomaal recessieve aandoeningen komen vaker voor bij specifieke etnische subpopulaties in de algemene bevolking. Dit kan het gevolg zijn van natuurlijke selectie, zoals er bijvoorbeeld meer kans is op hemoglobinopathie (HbP) dragerschap bij een persoon afkomstig uit een gebied waar in het verleden malaria epidemieën voorkwamen. (Allison 1954a , Williams, 2012). In het Verenigd Koninkrijk wordt om die reden aan alle zwangere vrouwen die afkomstig zijn uit een gebied met een hoog risico op dragerschap van hemoglobinopathieën screening op dragerschap van sikkelcelziekte aangeboden (NHS). Om het risico op dragerschap vast te stellen wordt gebruik gemaakt van een zogenaamde Family Origin Questionnaire (NHS). Daarnaast kan er sprake zijn van een foundereffect (stichtereffect: de invloed die de stichtende individuen hebben op de genenpool van de populatie die uit hun nakomelingen bestaat), bijvoorbeeld als een subgroep is ontstaan uit een kleine populatie en relaties en dus zwangerschappen vooral plaats vinden binnen deze founderpopulatie, zoals bijvoorbeeld wordt gezien in Volendam en Urk (Mathijssen, 2017).
Indien één van beide partners tot een hoogrisicogroep behoort
Paren waarvan één van beide partners tot een hoogrisicogroep behoort op basis van oorspronkelijke etniciteit en/of geografische afkomst, hebben wel een hogere kans om een dragerpaar te zijn van die specifieke aandoeningen ten opzichte van andere paren met kinderwens uit de algemene bevolking. In dergelijke gevallen kan het aanbieden van PDO daarom toch wel overwogen worden en zelfs gewenst zijn. Met name als door de aanwezigheid van (voor)ouders met gemixte afkomst of onduidelijke afkomst, het lastig is om de etniciteit van de partner met zekerheid te bepalen. Het advies is om dan eerst degene te testen die behoort tot hoogrisicogroep op basis van etniciteit en/of geografische afkomst (zie de module ‘Individuele testuitslag versus parenuitslag’). Indien het echter evident is dat andere partner niet tot de genoemde hoogrisicogroep behoort, kan overwogen worden van PDO af te zien, rekening houdend met een (kleine) restkans op aanwezigheid van gezamenlijk dragerschap van de betreffende aandoeningen.
Individuen
Hoewel de richtlijn zich primair richt op paren uit een hoogrisicogroep met een mogelijke kinderwens, kan het ook gaan om het informeren en testen van individuen (vaak vrouwen) als de partner (op dat moment) niet beschikbaar is, geen dragerschapstest wil laten verrichten, of als gebruik is gemaakt van donorsemen. Met name als bekend is of waarschijnlijk is dat de partner of de (anonieme) donor ook tot dezelfde hoogrisicogroep behoort. PDO aan individuen uit een hoogrisicogroep kunnen dan overwogen worden en zijn in dat geval medisch geïndiceerd (zie de module ‘Individuele testuitslag versus parenuitslag’). Voor vrouwelijke draagsters uit een hoogrisicogroep van wie de partner niet beschikbaar (of onbekend) is, is prenatale diagnostiek tijdens een zwangerschap somswel een optie. Uiteraard hangt dit erg af van de betreffende aandoening en is gedegen counseling en vereiste. In dergelijke gevallen is een dragerpaar uitslag geen optie.
Geen volledigheid bij definiëren alle potentiele hoogrisicogroepen
Deze richtlijn heeft niet tot doel om volledigheid na te streven en alle groepen te benoemen die een hoog risico hebben. In deze richtlijn zullen de hoogrisicogroepen beschreven worden die ten tijde van het verschijnen van de richtlijn in Nederland bekend zijn (Mathijssen, 2017). Ook is het denkbaar en waarschijnlijk dat naar aanleiding van toekomstig onderzoek en nieuwe wetenschappelijke publicaties nog meer specifieke autosomaal recessieve aandoeningen toegevoegd zouden kunnen worden aan een dragerschapstest binnen een hoogrisicogroep. Ook zouden er verhoogde risico’s kunnen bestaan in groepen die op dit moment nog niet bekend zijn omdat ze niet zijn onderzocht.
Indien een paar met kinderwens mogelijk tot een hoogrisicogroep behoort, kan overwogen worden een klinisch geneticus te consulteren of te verwijzen naar een afdeling Klinische Genetica. Het in deze richtlijn benoemen van specifieke, al bekende, populaties bij naam, heeft tot doel de huisarts, verloskundige en medisch specialist handvatten te bieden. Het is niet bedoeld om te stigmatiseren of discrimineren.
Hieronder volgt een beschrijving van de diverse aandoeningen die frequenter voorkomen in de verschillende hoogrisicogroepen. Een overzicht is ook te vinden in het stroomschema van de module ‘Criteria en tests per hoogrisicogroep’, waarbij tevens wordt aangegeven welke test het meest geschikt is per hoogrisicogroep.
- Paren afkomstig uit endemische malaria gebieden
Deze paren hebben hogere kans op dragerschap van hemoglobinopathieën. Hemoglobinopathieën is een verzamelnaam voor vormen van ernstige erfelijke bloedarmoede, zoals sikkelcelziekte, alfa-thalassemie en bèta-thalassemie. Deze aandoeningen komen door natuurlijke selectie veel voor in gebieden waar in het verleden malaria epidemieën hebben geheerst. De oorzaak is dat dragers van pathogene genvarianten beter beschermd waren tegen sterfte door een malaria infectie dan niet-dragers en dus een evolutionair voordeel habben. Zo ontstond een positieve selectie (Allison, 1954a; Allison, 1954b; Williams, 2012).
Mensen die zelf of wiens (voor)ouders oorspronkelijk afkomstig zijn uit Afrika, De Antillen, het Caribisch Gebied, Suriname, landen rondom de Middellandse Zee (onder andere Turkije en Marokko), Nabij- en Midden Oosten (onder andere Syrie, Irak, Iran, Afghanistan), Soedan, China, Hong Kong, India en Zuidoost-Azië, hebben een (sterk) verhoogde kans op dragerschap van sikkelcelziekte, bèta-thalassemie en/of alfa-thalassemie. Dit geldt ook voor alle personen met Afrikaanse (voor)ouders, waar zij ook ter wereld vandaan komen. Van de gehele wereldbevolking is 7% drager van een hemoglobinopathie, wordt geschat, waarvan 60 tot 70% woonachtig is of (oorspronkelijk) afkomstig is uit Afrika (Weatherall, 2001).
Figuur 1 Bron: www.who.int/genomics/public/Maphaemoglobin.pdf
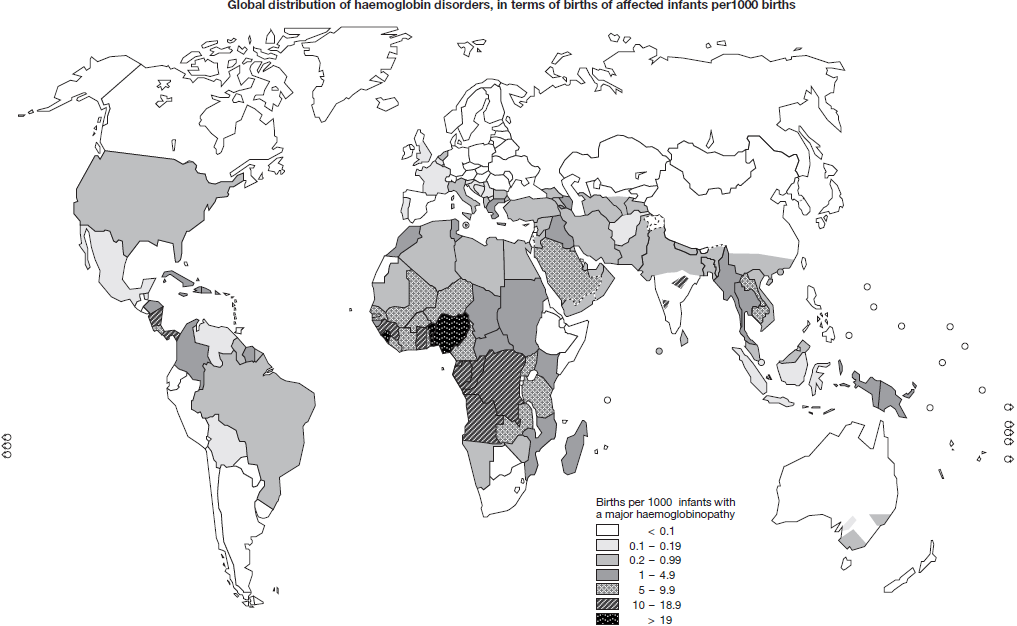
In Nederland is circa 1 op 10 mensen van oorspronkelijk niet-Westerse afkomst een drager van sikkelcelziekte en/of alfa- of bèta-thalassemie. Voorbeeld: in Suriname is circa 1 op 7 mensen drager van sikkelcelziekte; de kans op dragerschap van bèta-thalassemie voor iemand van Marokkaanse afkomst is circa 1 op 15 (Antonarakis, 2019).
Microcytair (hypochroom) bloedbeeld
Mensen die niet duidelijk uit deze hoogrisicogroepen komen, of van wie de afkomst niet goed bekend is, maar bij wie een microcytaire (hypochroom) bloedbeeld is aangetoond, met of zonder anemie zonder aanwijzingen voor een ijzergebrek, hebben overigens ook een verhoogde kans om drager te zijn van alfa-thalassemie en/of bèta-thalassemie (KNOV, 2010), soms ook in combinatie met Hb varianten zoals HbS. Zij komen daarom ook in aanmerking voor onderzoek naar de hemoglobinopathie dragerschap.
Ontdekken van (dragerschap van) hemoglobinopathie via de hielprikscreening
Ook via de neonatale hielprikscreening kan dragerschap van sikkelcelziekte worden ontdekt (HbS). Dragerschap van bèta-thalassemie wordt niet via de hielprik opgespoord en dragerschap van alfa-thalassemie wordt niet altijd gevonden. Dragerschap van andere Hb varianten (bv. HbC, HbD, HbE) wordt wel gezien bij de hielprikscreening, maar de Gezondheidsraad heeft ervoor gekozen deze niet te rapporteren. Indien dragerschap van HbS wordt aangetoond bij een pasgeborene, is één van beide ouders zeker ook een drager van HbS. Omdat de partner vaak tot dezelfde hoogrisicogroep behoort is PDO in deze situatie (ook) geïndiceerd (zie link).
- Paren afkomstig uit de Ashkenazi-Joodse gemeenschap
De Ashkenazische joden vormen een cultureel-religieuze groep binnen het jodendom. Personen die oorspronkelijk afkomstig zijn uit de Ashkenazi-Joodse gemeenschap, hebben een hogere kans op dragerschap van een aantal (ernstige) autosomaal recessieve ziekten (Scott, 2010; ACOG, 2017a).
De vijf meest voorkomende aandoeningen binnen deze hoogrisicogroep zijn:
|
Aandoening |
Dragerschapsfrequentie |
|
|
|
Ashkenazi-Joodse populatie |
Algemene bevolking |
|
Ziekte van Gaucher |
1 op 15 |
1 op 100 |
|
Cystic Fibrosis |
1 op 23 |
1 op 30 tot 1 op 90 |
|
Ziekte van Tay Sachs |
1 op 30 |
1 op 300 |
|
Familiaire dysautonomie |
1 op 35 |
< 1 op 150 |
|
Ziekte van Canavan |
1 op 50 |
< 1 op 150 |
(ACOG, 2017a).
De dragerschapsfrequenties van de andere genoemde aandoeningen in deze hoogrisicogroep liggen lager, maar wel veel hoger dan de dragerschapfrequenties wereldwijd (ACOG, 2017a; www.jewishgeneticdiseases.org).
|
Aandoening |
Dragerschapsfrequentie |
|
|
|
Ashkenazi-Joodse populatie |
Algemene bevolking |
|
Glycogeen stapelingsziekte type 1a |
1 op 75 |
|
|
Maple Syrup Urine Disease |
1 op 81 |
1 op 240 |
|
Fanconi Anemie type C |
1 op 82 |
< 1 op 790 |
|
Mucolipidose type 4 |
1 op 92 |
< 1 op 150 |
|
Nemaline myopathie |
1 op 95 |
< 1 op 150 |
|
Niemann-Pick type A |
1 op 98 |
< 1 op 150 |
|
Bloom syndroom |
1 op 117 |
< 1 op 150 |
|
Joubert syndroom type 2 |
1 op 137 |
< 1 op 500 |
- Genetisch geïsoleerde gemeenschappen
Genetisch geïsoleerde (founder)gemeenschappen bestaan over de hele wereld. Specifieke zeldzame autosomaal recessieve aandoeningen kunnen juist binnen deze gemeenschappen een relatief hoge prevalentie laten zien. In een artikel van Mathijssen (2017) wordt een overzicht gegeven van Nederlandse founder mutaties in (kleine) genetisch geïsoleerde gemeenschappen:
- Volendam
Mensen van wie de familie uit de Volendamse gemeenschap komt, hebben meer kans op een aantal ernstige autosomaal recessieve erfelijke ziektes. Dit komt omdat veel inwoners uit Volendam afstammen van zeven tot twintig families. In deze families kwamen een aantal zeldzame ernstige erfelijke ziektes voor. Paren waarvan beide voorouders uit Volendam komen, hebben daarom een verhoogde kans op een ziek kind met onder andere één of meer van de volgende ernstige ziektes: Pontocerebellaire hypoplasie type 2, rhizomele chondrodysplasia punctata type I, osteogenesis imperfecta type II en III, foetale akinesie (Pena-Shokeir syndroom) en een mitochondriële ziekte (varianten in POLG gen). In deze hoogrisicogroep wordt 1 op 3 personen geïdentificeerd als drager van één of meer van deze ernstige aandoeningen en bestaat er een kans van 1 op 25 (4%) om een dragerpaar te zijn (Mathijssen, 2015). Daarnaast komen ook andere aandoeningen frequenter voor in de Volendamse gemeenschap, die op dit moment niet standaard zijn opgenomen in de preconceptie dragerschapstest in Volendam, omdat deze niet primair voldoen aan de criteria voor inclusie van aandoeningen in een preconceptiedragerschapstest (Mathijssen, 2017). Het testen op dragerschap van deze aandoeningen wordt met het individuele paar besproken en eventueel ingezet indien daartoe een aanleiding bestaat op basis van een positieve familieanamnese of medische gegevens.
- Urk
De ziekte van Van Buchem is een zeldzame craniotubulaire hyperostose die gekarakteriseerd wordt door hyperostose van de schedel, de onderkaak, de sleutelbeenderen, de ribben en de diafyses van de lange beenderen, alsook van pijpbeenderen van de handen en voeten, die vaker voorkomt binnen de Urkse gemeenschap. Bij deze ziekte is er een onbalans tussen de aanmaak en de afbraak van botweefsel (Balemans, 2002). Het betreft een voor de algemene bevolking zeer zeldzame aandoening. In 2017 waren in totaal 31 patienten beschreven met deze ziekte, waarvan 29 patienten uit Urk en twee uit Duitsland (Van Lierop, 2017).
- Bunschoten-Spakenburg
Benigne Recidiverende Intrahepatische Cholestase, of kortweg BRIC, is een erfelijke stofwisselingsziekte die vaker voorkomt binnen de Spakenburgse gemeenschap. Bij deze stofwisselingsziekte hebben de patiënten last van ernstige galstuwing (cholestase), dat uit zich in onder meer geelzucht, een ophoping van bilirubine, waardoor de huid een gelige teint krijgt. Ophoping van bilirubine heeft ook tot gevolg dat de patiënten veel last van jeuk krijgen. BRIC komt in Nederland bij ongeveer 1 op de miljoen mensen voor. In Nederland zijn er in totaal zo’n 20 patiënten waarvan er 7 in het voormalig vissersdorp Bunschoten-Spakenburg wonen (De Koning, 1995; Houwen, 1994; Klomp, 2004) .
- Andere gemeenschappen
Voorbeelden van andere bekende gemeenschappen in Nederland waarvoor geldt dat er een hogere kans bestaat op dragerschap van meer of minder ernstige autosomaal recessieve aandoening zijn Rijnsburg (bv. Chudley-McCullough syndroom) en Rucphen (bv. ziekte van Batten) (Mathijssen, 2017; Zeegers, 2004; Taschner, 1995).
2b. Consanguine paren
Definitie en voorkomen consanguïniteit
Bij consanguïniteit is er sprake van genetische verwantschap tussen de man en de vrouw. Zij delen tenminste één gemeenschappelijke voorouder. De meeste consanguine relaties of huwelijken betreffen relaties tussen neef en nicht (gezamenlijke grootouders) of achterneef en achternicht (gezamenlijke overgrootouders). Maar ook een relatie tussen oom en nicht of tante en neef behoren tot een consanguine relatie (Hamamy, 2011). Wereldwijd heeft naar schatting 8,5% van de kinderen consanguïne ouders (Modell and Darr, 2002).
Figuur 2
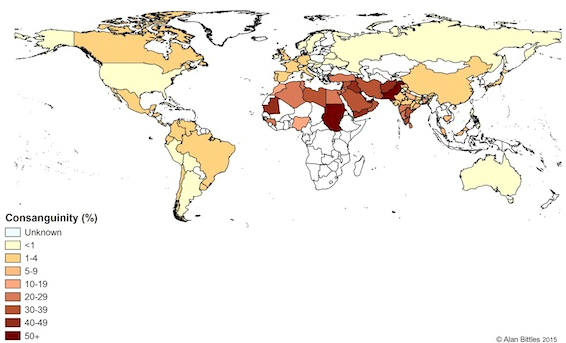
Bron: http://consang.net/index.php/Main_Page
Consanguïniteit komt met name veel voor in Noord-Afrika, Midden-Oosten en West-Azië bij tot 20 tot 30% van alle huwelijken /relaties (http://consang.net). Daarnaast komen in specifieke groepen consanguine huwelijken vaker voor zoals in sommige Joodse gemeenschappen en in kleine, vaak religieuze, gemeenschappen (RIVM, 2007). In Nederland is onder de deelnemers aan de Generation-R studie in Rotterdam aangetoond dat van alle pasgeborenen die geboren zijn tussen 2002 en 2005, 24% van de Nederlandse ouders van Turkse afkomst en 22% van de Nederlandse ouders van Marokkaanse afkomst consanguin gehuwd waren, terwijl dit bij ouders van Nederlandse afkomst 0.1% betrof (Ten Kate, 2014).
In de richtlijn wordt geen exacte definitie gegeven tot welke verwantschapsgraad er sprake is van consanguïniteit. Pragmatisch is om het paar te beschouwen als een consanguin paar als het zelf aangeeft (al dan niet in de verte) familie van elkaar te zijn.
Verhoogd risico bij consanguïniteit
In de algemene populatie is de kans 2 tot 3% op een kind met een zodanig ernstige aangeboren aandoening dat zij in het eerste levensjaar medische zorg nodig hebben. Kinderen uit consanguïne relaties hebben op basis van empirische getallen een extra kans van 1 tot 2% op een ernstige aangeboren aandoening (Cornel, 2003).
Neef‐nicht relaties hebben een berekend extra risico van 1.7% tot 2.8% (Bennet, 2002), dus voor hen geldt een totaal risico van 4 tot 6%. Het extra risico betreft grotendeels autosomaal recessief overervende aandoeningen. De kans dat er bij een neef en nicht beiden een identieke pathogene DNA variant, en dus dragerschap, aanwezig is van dezelfde autosomaal recessieve aandoening is verhoogd omdat zij één of meer gemeenschappelijke voorouders delen en daarmee dus een gedeelte van hun genen gemeenschappelijk hebben. Kinderen van consanguine paren hebben daarom een verhoogde kans op een autosomaal recessieve aandoening op basis van een homozygote pathogene genvariant. De kans dat dragerschap van een pathogene variant in een recessief gen bij een (over)grootouder terecht komt bij beide partners van een consanguin paar is afhankelijk van de zogeheten “inbreeding coefficient F”. Voor een neef-nicht relatie is de inbreeding coefficient F (de kans dat de pathogene genvariant zichzelf weer ontmoet) 1 op 16 (Hamamy, 2011).
Wanneer consanguine ouders een kind krijgen met een zeer zeldzame autosomaal recessieve ziekte, is de kans groot dat dit door de consanguïniteit komt. Echter, omgekeerd betekent dit niet dat de kans op een kind met een autosomaal recessieve ziekte bij een consanguin paar altijd heel groot is. De risicoverhoging geldt verder met name voor zeer zeldzame aandoeningen (tabel 1 en 2) (Cornel, 2005).
Tabel 1

Bron: Sandkuyl (1999)
Tabel 2

Bron: Cornel (2005)
Niet alle consanguine paren zijn uiteraard daadwerkelijk een dragerpaar. Naar schatting geldt dit voor een minderheid, namelijk 8% (6.8 tot 11.2%) van de consanguine paren (Teeuw, 2010; Hamamy, 2011;Ten Kate, 2015). Door de toegenomen mogelijkheden van genetisch onderzoek in deze doelgroep zal in de toekomst blijken of het werkelijk extra risico mogelijk nog hoger of lager ligt. Daarnaast geldt ook voor consanguine paren dat partners beiden drager kunnen zijn van een pathogene, maar niet-identieke DNA variant in hetzelfde autosomaal recessieve gen (Ten Kate, 2010; Teeuw, 2010).
Het is bij een negatieve familieanamnese vooraf niet goed na te gaan voor welke consanguine paren dit verhoogde risico geldt en om welke aandoening het dan specifiek gaat. Daarom biedt voor consanguine paren met kinderwens een (zeer) brede dragerschapstest de grootste kans op het identificeren van een dragerpaar met een verhoogd risico op het krijgen van een kind met een (zeldzame) (ernstige) autosomaal recessieve aandoening (zie de module ‘Criteria en tests per hoogrisicogroep’).
Ontdekken van (vermoeden op) consanguïniteit bij genoomdiagnostisch onderzoek
Niet in alle gevallen is een paar zich bewust van een consanguine relatie of is dit niet gemeld bij het inzetten van bijvoorbeeld WES gebaseerd genoombreed diagnostisch onderzoek bij een eerder kind van dit paar. Bij genoomdiagnostisch onderzoek bij een eerder kind waarbij ook het DNA van ouders wordt meegenomen voor het onderzoek, kan naar voren komen dat er (zeer waarschijnlijk) sprake is van consanguïniteit bij ouders. Indien ouders aangeven nog kinderwens te hebben kan hen PDO worden aangeboden.
3. Wanneer komen paren uit hoogrisicogroepen in aanmerking voor een preconceptie dragerschapstest?
Vergoede zorg op basis van een medische indicatie
Voor paren uit een hoogrisicogroep op basis van etnische en/of geografische afkomst en voor consanguine paren geldt ten tijde van het verschijnen van deze richtlijn reeds een medische indicatie voor PDO. Derhalve wordt het consult voor pre-test en post-test counseling en de dragerschapstests zelf (het DNA onderzoek) vergoed door de ziektekostenverzekering (afgezien van het bedrag van het eigen risico).
Voor de hemoglobinopathieën geldt dat deze ook in de 1e lijn middels een aantal eenvoudige laboratoriumbepalingen en een goedkopere HPLC test (Hb typering) aangevraagd en uitgevoerd kunnen worden (zie de module ‘Criteria en tests per hoogrisicogroep’ voor details). Ook deze testen worden vergoed door de ziektekostenverzekering. Bij het identificeren van een dragerpaar of vrouwelijke draagster met kinderwens is vervolgens tijdige verwijzing naar een klinisch genetisch centrum voor verdere counseling en bevestigend DNA onderzoek geïndiceerd.
De aanbeveling houdt enerzijds in dat zorgverleners in de 1e lijn (bijvoorbeeld huisartsen, verloskundigen), 2e en 3e lijn (bijvoorbeeld kinderartsen, gynaecologen, klinisch genetici) wordt geadviseerd om aan paren die uit de hoogrisicogroepen afkomstig zijn de vraag te stellen of bij hen sprake is van een toekomstige (nieuwe) kinderwens, conform het advies in de Preconceptie Indicatie Lijst (PIL) (College Perinatale Zorg, 2018). Hierbij is het goed te realiseren of te bedenken dat niet alle paren zelf aangeven dat zij kinderwens hebben en/of actief om (verwijzing voor) PDO vragen. Veelal zijn paren met kinderwens zich niet bewust van het hebben van een hoger risico op dragerschap.
Anderzijds is het advies om bij paren met kinderwens na te gaan of zij tot een hoogrisicogroep behoren en hen te informeren over hun hogere risico op dragerschap en over de beschikbaarheid van PDO en hen desgewenst hiervoor te verwijzen. Hierbij kan gebruik gemaakt worden van de folder “Wil je zwanger worden?”(VIMP ZonMW product POM project) door met het paar de genoemde hoogrisicogroepen op basis van etnische of geografische afkomst en/of consanguïniteit langs te lopen en hen de vraag te stellen of zij tot één of meer van deze groepen behoren.
Het kan hierbij gaan om:
-
- Ouders die de zorgverlener bezoeken in verband met diagnostiek bij een aangedaan kind.
- Paren die dragerschapsonderzoek naar een specifieke familiaire (autosomaal recessieve) aandoening wensen.
- Paren die verzoeken om prenatale diagnostiek in verband met een verhoogde kans op kind met specifieke aandoening.
- Paren die verzoeken om pre-implantatie genetische diagnostiek in verband met een verhoogde kans op een kind met een specifieke aandoening.
- Paren/patiënten (met kinderwens) die de praktijk of afdeling bezoeken om andere redenen.
- Paren waarvan de vrouw al zwanger is.
Het daadwerkelijk aanvragen van een preconceptie dragerschapstest kan, afhankelijk van de specifieke test, ofwel alleen nog door klinisch genetici worden gedaan, of ook door andere specialisten uit 2e en 3e lijn (bijvoorbeeld kinderartsen of gynaecologen, IVF-artsen) of ook door de 1e lijn (huisarts en verloskundige). In de module ‘Criteria en tests per hoogrisicogroep’ wordt per hoogrisicogroep aangegeven welke dragerschapstests beschikbaar zijn en wie deze kan aanvragen. In de module ‘Individuele testuitslag versus parenuitslag’ wordt aangegeven of de voorkeur gegeven zou moeten worden aan parallel inzetten van een dragerschapstest bij beide partners (en een parenuitslag) of dat sequentieel testen (al dan niet met individuele uitslagen) de voorkeur verdient en/of gebruikelijk is.
PDO ook bespreken tijdens zwangerschap?
Doel van de richtlijn is om te streven naar (verwijzing voor) een dragerschapstest in de preconceptie fase, dus voorafgaande aan de zwangerschap. Echter, indien een paar tot een hoogrisicogroep behoort, en de vrouw is reeds zwanger, is het advies om ook tijdens de zwangerschap zo snel mogelijk te informeren over hun hogere kans om beiden drager te zijn van één of meerdere (ernstige) autosomaal recessieve aandoeningen en de beschikbaarheid van dragerschapsonderzoek. Als het paar een dragerpaar zou blijken te zijn, kan vervolgens prenatale diagnostiek middels een vlokkentest of vruchtwaterpunctie worden overwogen. Als het kind is aangedaan, kan de zwangere (met haar partner) kiezen voor een zwangerschapsbeëindiging of voortzetten van de zwangerschap. Bij het kiezen voor een doorgaande zwangerschap of als de wettelijke termijn van 24 weken voor een eventuele mogelijkheid tot afbreking van de zwangerschap verstreken is, kan het weten van de diagnose voor de geboorte consequenties hebben voor het te voeren beleid in de zwangerschap en bij de partus. Indien gewenst, kunnen zwangere vrouwen (met hun partner) uit hoogrisicogroepen tijdens de zwangerschap met spoed verwezen worden naar een klinisch genetisch centrum voor een counselingsgesprek en eventueel onderzoek. Indien de biologische vader niet beschikbaar is, kan een verwijzing van een zwangere vrouw toch zinvol zijn als de biologische vader ook uit dezelfde hoogrisicogroep komt (bijvoorbeeld als beiden afkomstig zijn uit een regio met een verhoogde kans op dragerschap van een hemoglobinopathie). Hierbij dient opgemerkt te worden dat het doen van dergelijk onderzoek in een zwangerschap onder tijdsdruk moet plaatsvinden en meer onrust bij de zwangere of het paar teweeg kan brengen dan voorafgaande aan een zwangerschap.
4. Door wie zouden paren uit hoogrisicogroepen geïnformeerd kunnen worden over de beschikbaarheid van een dragerschapstest of een aanbod van een dragerschapstest kunnen ontvangen?
Zorgverleners in de 1e lijn (bijvoorbeeld huisartsen, verloskundigen), 2e en 3e lijn (bijvoorbeeld kinderartsen, gynaecologen, klinisch genetici) wordt geadviseerd om paren met kinderwens die behoren tot een hoogrisicogroep op basis van etnische of geografische afkomst en/of consanguïniteit te informeren over het feit dat voor hen een verhoogd risico bestaat om een dragerpaar te zijn van dezelfde (zeldzame) autosomaal recessieve aandoening, de optie van PDO met hen te bespreken en desgewenst hiervoor te verwijzen. Deze aanbeveling is als zodanig eerder ook opgenomen in de bredere lijst van aanbevelingen uit de Preconceptie Indicatie Lijst (PIL) om het risico op erfelijke aandoeningen voor een paar met kinderwens te inventariseren op basis van familie-, obstetrische en medische anamnese (College Perinatale Zorg, 2018) (zie ook de module ‘Pre- en post-test counseling bij PDO’).
Niet alle zorgverleners in de 1e, 2e of 3e lijn kunnen zelf een genetische dragerschapstest aanvragen. Paren uit hoogrisicogroepen kunnen worden verwezen voor PDO naar een afdeling Klinische Genetica in Nederland. Afhankelijk van familieanamnese, afkomst en specifieke risicogroep waartoe het paar behoort, kunnen verschillende tests worden overwogen. Er zijn in Nederland verschillende (gerichte) preconceptie dragerschapstests voor consanguine paren beschikbaar, alsmede voor paren van Ashkenazi-Joodse afkomst en voor paren uit geïsoleerde gemeenschappen (zoals Volendam) (zie de module ‘Criteria en tests per hoogrisicogroep’).
Voor paren die een verhoogd risico hebben op dragerschap van hemoglobinopathieën, hoeft niet in eerste instantie een dragerschapstest middels DNA onderzoek te worden aangevraagd. De meeste dragers van sikkelcelziekte en bèta-thalassemie zijn op te sporen middels een eenvoudige Hb-typering (HPLC test). Dragers van alfa-thalassemie hebben, net als dragers van bèta-thalassemie, meestal een microcytair (laag MCV), hypochroom (laag MCH) bloedbeeld, welke vaak, maar niet altijd, gepaard gaat met een milde anemie (laag Hb) (KNOV, 2010). Zie voor de specifieke aan te vragen bepalingen de module ‘Criteria en tests per hoogrisicogroep’.
Het is belangrijk te beseffen dat dragerschap van sikkelcelziekte niet gepaard gaat met anemie, tenzij er sprake is van een co-existerende dragerschap van alfa-thalassemie (wat vaak het geval is). Als bij een eerste hemoglobinopathie screening middels deze biochemische testen in de betreffende referentielaboratoria (een sterk vermoeden op) dragerschap wordt aangetoond van sikkelcelziekte of van alfa-thalassemie of bèta-thalassemie, kan het in tweede instantie geïndiceerd zijn om dit dragerschap met DNA onderzoek te bevestigen. Dit geldt vooral als beide partners drager zijn en het paar bijvoorbeeld prenatale diagnostiek of pre-implantatie genetische diagnostiek overweegt. Hiervoor kan het paar worden verwezen naar een afdeling Klinische Genetica in Nederland. Zie voor meer details de uitwerking in de module ‘Criteria en tests per hoogrisicogroep’.
In een artikel van Burke, 2019 wordt uiteengezet dat een evidence-based onderbouwing vaak erg lastig is voor genetische geneeskunde onder meer gezien de snelle veranderingen in genpanels en tests en de lange periode nodig om evidence te verzamelen (bij voorspellend onderzoek). Een andere aanpak voor het schrijven van evidence-based richtlijnmodules is daarom om de CPAD-methode te volgen (Clinical practice advisory document) zoals beschreven in het artikel van Burke. Hierbij worden door professionals binnen de (genetische) zorg en onderzoekers thema’s (technisch en op ELSI-gebied) geïdentificeerd die nader onderzoek of bespreking behoeven om tot richtlijnen te kunnen komen en wordt gewerkt met voorlopige documenten die in dit proces op basis van resultaten steeds verder kunnen worden aangevuld. Dit is ook de manier zoals binnen de klinische genetica in de Nederlands academische ziekenhuizen wordt gewerkt. De kerngroep adviseert deze methode als uitgangspunt te nemen bij een herziening of aanvulling van deze richtlijn.
Burke, W., Clayton, E. W., Wolf, S. M., Berry, S. A., Evans, B. J., Evans, J. P., ... & McGuire, A. L. (2019). Improving recommendations for genomic medicine: building an evolutionary process from clinical practice advisory documents to guidelines. Genetics in Medicine. doi: 10.1038/s41436-019-0549-3.
Onderbouwing
Achtergrond
De richtlijn preconceptie dragerschapsonderzoek voor hoogrisicogroepen richt zich op paren (en individuen) die op basis van etnische of geografische afkomst en/of consanguïniteit een hogere kans hebben om een drager of dragerpaar te zijn van één of meerdere (specifieke) autosomaal recessieve aandoeningen ten opzichte van het algemene populatierisico in Nederland van de gehele bevolking om drager of dragerpaar te zijn van die aandoening(en). Dragerparen hebben een verhoogd risico van 1 op 4 (25%) op het krijgen van een aangedaan kind in elke zwangerschap. Gemiddeld is 1 op 150 paren in de algemene Nederlandse bevolking een dragerpaar van een zeer ernstige autosomaal recessieve aandoening (Francioli, 2014; Plantinga, 2016).
Zoeken en selecteren
De definiëring van hoogrisicogroepen is ontstaan door voortschrijdend inzicht en op basis van nationale publicaties en buitenlandse richtlijnen. Er is door middel van een oriënterende search (zie de Verantwoording) breed gezocht naar hoogrisicogroepen en expanded carrier screening. Hoe breder de bevolking (de patiëntengroep) wordt ingedeeld, hoe meer mensen uit de bevolking kunnen worden gerelateerd aan een hoogrisicogroep. Voor de Nederlandse bevolking zijn echter slechts een aantal groepen relevant.
Referenties
- Achterbergh L, Suurmond J, Linthorst GE (2019). Respectvol etnisch profileren in de zorg, Ned Tijdschr Geneeskd;163D2716.
- ACOG (2017a). ACOG Committee Opinion No. 690. Carrier screening in the age of genomic medicine. Obstet Gynecol. 2017 Mar;129(3):e35-e40.
- Allison AC (1954a). The distribution of the sickle-cell trait in East Africa and elsewhere, and its apparent relationship to the incidence of subtertian malaria.Trans R Soc Trop Med Hyg 48: 312–318.
- Allison AC (1954b). Protection afforded by sickle- cell trait against subtertian malareal infection. Br. Med. J. 1, 290–294 (1954).
- Antonarakis SE (2019). Carrier screening for recessive disorders. Nat Rev Genet. 20(9):549-561.
- Aspinall PJ, Dyson SM, Anionwu EN (2003). The feasibility of using ethnicity as a primary tool for antenatal selective screening for sickle cell disorders: pointers from the research evidence. Soc Sci Med 56:285-297.
- Balemans W, Patel N, Ebeling M et al. (2002). Identification of a 52 kb deletion downstream of the SOST gene in patients with van Buchem disease. J Med Genet 39:91–97.
- Bennett RL, Motulsky AG, Bittles A, et al. (2002). Genetic Counseling and Screening of Consanguineous Couples and Their Offspring: Recommendations of the National Society of Genetic Counselors. J Genet Couns. 11(2):97-119.
- College Perinatale Zorg (CPZ, 2018). Preconceptie Indicatie Lijst (PIL). Website bezocht 22-8-2019: www.kennisnetgeboortezorg.nl/wp-content/uploads/2019/06/Preconceptie_Indicatie_Lijst_PIL_.pdf
- Cornel MC (2003). Consanguïniteit, ethniciteit en gezondheid, een epidemiologische benadering. In: Workshop Consanguïniteit . Verwant en kinderwens? Omvang, vooroordeel en beleid in Nederland. Nederlandse Associatie voor Community Genetics.
- Cornel MC (2005). Consanguïniteit. In: Bonnet-Breusers AJM, Hira Sing RA, Hoppenbrouwers K, Rensen HBH, Wagenaar-Fischer MM, eds. Praktijkboek Jeugdgezondheidszorg. Maarssen: Elsevier Gezondheidszorg:1.23-1-10.
- De Koning TJ, Sandkuijl LA, de Schryver JE et al. (1995). Autosomal-recessive inheritance of benign recurrent intrahepatic cholestasis. Am J Med Genet 57:479–482.
- Francioli LC, Menelaou A, Pulit SL, et al. (2014). Whole‐genome sequence variation, population structure and demographic history of the Dutch population. Nat Genet;46(8):818‐825.
- Hamamy H, Antonarakis SE, Cavalli-Sforza LL, et al. (2011). Consanguineous marriages, pearls and perils: Geneva International Consanguinity Workshop Report. Genet Med.;13(9):841-7.
- Henneman, L., Borry, P., Chokoshvili, D., et al. (2016). Responsible implementation of expanded carrier screening. Eur J Hum Genet; 24(6): e1-e12.
- Houwen RH, Baharloo S, Blankenship K et al. (1994). Genome screening by searching for shared segments: mapping a gene for benign recurrent intrahepatic cholestasis. Nat Genet 8:380–386.
- KNOV (2010) Standaard: Anemie in de verloskundige praktijk. Website: https://www.knov.nl/serve/file/knov.nl/knov_downloads/669/file/KNOV-Standaard%20Anemie%20in%20de%20verloskundige%20praktijk.pdf
- Klomp LW, Vargas JC, van Mil SW et al. (2004). Characterization of mutations in ATP8B1 associated with hereditary cholestasis. Hepatology 40: 27–38
- Mathijssen IB, Henneman L, van Eeten-Nijman JM et al. (2015). Targeted carrier screening for four recessive disorders: high detection rate within a founder population. Eur J Med Genet;58(3):123-8.
- Mathijssen IB, van Maarle MC, Kleiss IIM et al. (2017). With expanded carrier screening, founder populations run the risk of being overlooked. J Community Genet. 8(4):327-333.
- Modell B., Darr A. (2002). Science and society: genetic counselling and customary consanguineous marriage. Nat Rev Genet. 3(3):225-9.
- NHS Sickle Cell and Thalassaemia Screening Programme. Website bezocht 30-10-2019: www.nhs.uk/conditions/pregnancy-and-baby/screening-sickle-cell-thalassaemia-pregnant/. www.gov.uk/guidance/sickle-cell-and-thalassaemia-screening-programme-overview
- Plantinga M, Birnie E, Abbott KM, et al. (2016). Population‐based preconception carrier screening: how potential users from the general population view a test for 50 serious diseases. Eur J Hum Genet;24(10):1417‐1423.
- Rijksinstituut voor Volksgezondheid en Milieu (RIVM) (2007). Kinderwens van consanguïne ouders: risico’s en erfelijkheidsvoorlichting.
- Scott SA, Edelmann L, Liu L et al. (2010). Experience with carrier screening and prenatal diagnosis for 16 Ashkenazi Jewish genetic diseases. Hum Mutat; 31: 1240–1250.
- Skol AD, Xiao R, Boehnke M (2005). An algorithm to construct genetically similar subsets of families with the use of self-reported ethnicity information. Am J Hum Genet 2005;77:346-354.
- Taschner PE, de Vos N, Post JG et al. (1995). Carrier detection of batten disease (juvenile neuronal ceroid-lipofuscinosis). Am J Med Genet 57:333–337.
- Teeuw ME, Henneman L, Bochdanovits Z, et al. (2010). Do consanguineous parents of a child affected by an autosomal recessive disease have more DNA identical-by-descent than similarly-related parents with healthy offspring? Design of a case–control study. BMC Med Genet. 2010;11:113.
- Ten Kate LP, Teeuw M, Henneman L, Cornel MC (2010). Autosomal recessive disease in children of consanguineous parents: inferences from the proportion of compound heterozygotes. J Community Genet 2010; 1: 37–40.
- Ten Kate LP, Teeuw ME, Henneman L, Cornel MC. (2014). Consanguinity and Endogamy in the Netherlands: Demographic and Medical Genetic Aspects. Hum Hered;77(1-4):161-6.
- Ten Kate LP, Teeuw ME, Henneman L, Cornel MC. (2015). In: Alison Shaw and Aviad RazCousin Marriages. Chapter 2: Risk Calculations in Consanguinity. ISBN 978-1-78238-492-2.
- Van Lierop A, Appelman-Dijkstra NM, Papapoulos SE (2017). Sclerostin deficiency in humans. Bone;96:51-62.
- Weatherall DJ, Clegg JB. Inherited haemoglobin disorders: an increasing global health problem. (2001) Bull World Health Organ. 79(8):704-712.
- Williams and Weatherall (2012). World distribution, population genetics, and health burden of the hemoglobinopathies. Cold Spring Harb Perspect Med.;2(9).
- Zeegers MP, van Poppel F, Vlietinck R, Spruijt L, Ostrer H. (2004) Founder mutations among the Dutch. Eur J Hum Genet.;12(7):591-600.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 25-06-2020
Beoordeeld op geldigheid : 02-03-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de richtlijnkerngroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de VKGN of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan geschreven. Bij het opstellen van de richtlijn heeft de kerngroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten. In een artikel van Burke (2019) wordt uiteengezet dat een evidence-based onderbouwing vaak erg lastig is voor genetische geneeskunde gezien de snelle veranderingen in genpanels en tests. Een andere aanpak voor het schrijven van evidence-based richtlijnmodules is daarom om de CPAD methode te volgen (Clinical practice advisory document) zoals beschreven in het artikel van Burke (2019). De kerngroep adviseert deze methode als uitgangspunt te nemen bij een herziening of aanvulling van deze richtlijn. Voor de ontwikkeling van deze richtlijn (gestart in januari 2018) kon deze methode niet als uitgangspunt genomen worden vanwege de verschijningsdatum.
De VKGN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Definitie van hoogrisicogroepen |
VKGN |
2020 |
2025 |
Elke 5 jaar |
VKGN |
Niet van toepassing |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) kerngroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
De richtlijn zal handvatten bieden voor de medische indicatiestelling en dus het, al dan niet actief, aanbieden van en verwijzen voor preconceptie dragerschapsonderzoek (PDO) aan hoogrisicogroepen. Dit stelt paren met kinderwens uit deze hoogrisicogroepen in staat om autonome reproductieve beslissingen te nemen bij voorkeur voorafgaande aan een zwangerschap (zie reproductieve opties in de Algemene inleiding).
Doelgroep
Deze richtlijn gaat over preconceptie dragerschapsonderzoek (PDO) voor hoogrisicogroepen. Met hoogrisicogroepen wordt bedoeld: paren (en individuen) die op basis van etniciteit of geografische afkomst en/of consanguïniteit een hogere kans hebben om een drager of dragerpaar te zijn van één of meerdere (specifieke) autosomaal recessieve aandoeningen ten opzichte van het algemene populatierisico van de gehele bevolking om drager of dragerpaar te zijn van die aandoening(en).
Beoogde gebruikers van de richtlijn
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen uit de 1e, 2e en 3e lijn die betrokken zijn bij de medische zorg voor patiënten/paren in de reproductieve leeftijd en/of hun nageslacht, uit de hiervoor omschreven hoogrisicogroepen. Daarnaast is de richtlijn geschreven voor klinisch moleculair genetici en hun collega’s werkzaam in de laboratoria voor genoomdiagnostiek van de afdelingen Genetica van de UMC’s die zich bezighouden met het inrichten en uitvoeren van (preconceptie) dragerschapstests voor hoogrisicogroepen (zie de module ‘Criteria en tests per hoogrisicogroep’).
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire richtlijnkerngroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de samenstelling van de kerngroep en de klankbordgroep).
De richtlijnkerngroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De richtlijnkerngroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
De klankbordgroep (onder meer bestaande uit afgevaardigden van de VKGN, VKGL, KNOV, NVOG, NVK, VvF, VSOP, en NHG) heeft de conceptteksten gelezen en hier feedback op gegeven vóórdat de richtlijn in commentaar is gegaan. De richtlijnkerngroep heeft de feedback vervolgens doorgenomen en indien nodig aanpassingen gedaan. De richtlijnkerngroep bepaalt de inhoud van de versie die aan externe partijen wordt voorgelegd tijdens de commentaarfase.
Kerngroep
- Prof. dr. I.M. (Irene) van Langen, klinisch geneticus & hoogleraar Klinische Genetica, werkzaam in het UMCG, Groningen, VKGN (voorzitter)
- Dr. P. (Phillis) Lakeman, klinisch geneticus werkzaam in het Amsterdam UMC, locatie AMC, Amsterdam, VKGN (vice-voorzitter)
- Dr. L. (Lidewij) Henneman, senior onderzoeker en universitair hoofddocent afdeling Klinische Genetica, werkzaam in het Amsterdam UMC, locatie VUmc, Amsterdam
- Dr. Ir. A.D.C. (Aimee) Paulussen, laboratoriumspecialist klinische genetica, werkzaam in het Maastricht UMC+, Maastricht, VKGL
- Prof. dr. W.J. (Wybo) Dondorp, Socrates hoogleraar Humanisme & ethiek van reproductieve genetica; universitair hoofddocent Biomedische ethiek, afdeling Health, Ethics & Society, Universiteit Maastricht
- Dr. S. (Sanne) van der Hout, assistant professor Biomedische ethiek, afdeling Health, Ethics & Society, Universiteit Maastricht
- Dr. I. (Ilse) Feenstra, klinisch geneticus, werkzaam in het Radboudumc, Nijmegen, VKGN
- Dr. S.C.E.H. (Suzanne) Sallevelt, klinisch geneticus, werkzaam in het Maastricht UMC+, Maastricht, VKGN
- Drs. J.J.T. (Jeske) van Harssel, klinisch geneticus, werkzaam in het UMC Utrecht, Utrecht, VKGN
- Drs. K.E. (Kyra) Stuurman, klinisch geneticus, werkzaam in het Erasmus MC, Rotterdam, VKGN
- Dr. N.S. (Nicolette) den Hollander, klinisch geneticus, werkzaam in het LUMC, Leiden, VKGN
- Dr. S. (Silvana) van Koningsbruggen, laboratoriumspecialist klinische genetica, werkzaam in Amsterdam UMC, locatie AMC, Amsterdam, VKGL
- Dr. T. (Trijnie) Dijkhuizen, laboratoriumspecialist klinische genetica, werkzaam in het UMCG, Groningen, VKGL
- Drs. E. (Elsbeth) van Vliet-Lachotzki, patiëntvertegenwoordiger, Vereniging Samenwerkende Ouder- en Patiëntenorganisaties, VSOP
- Dr. M. (Mirjam) Plantinga, senior onderzoeker afdeling Genetica, werkzaam in het UMCG, Groningen
Klankbordgroep
- Dr. K. (Kristin) Abbott, laboratoriumspecialist klinische genetica, werkzaam in het UMCG, Groningen, VKGL
- Dr. H.T. (Hennie) Brüggenwirth, laboratoriumspecialist klinische genetica, werkzaam in het Erasmus MC, Rotterdam, VKGL
- Dr. K. (Karin) Huijsdens- van Amsterdam, laboratoriumspecialist klinische genetica, werkzaam in het UMCU, Utrecht, VKGL
- Dr. C.L. (Kees) Harteveld, laboratoriumspecialist klinische genetica, werkzaam in het LUMC, Leiden, VKGL
- Dr. I. (Irene) Homminga, IVF-arts, werkzaam in het UMCG, Groningen, VvF
- Dr. L.C. (Lieke) de Jong - Potjer, huisarts, werkzaam bij Huisarts, werkzaam bij Huisartsenpraktijk het Kompas , NHG
- Dr. R.J.T. (Ron) van Golde, gynaecoloog, werkzaam in het Maastricht UMC+, Maastricht, NVOG
- Dr. M.F.C.M. (Maarten) Knapen, gynaecoloog-perinatoloog, werkzaam in het Erasmus MC, Rotterdam, NVOG
- Prof. mr. J.G. (Jaap) Sijmons, hoogleraar Gezondheidsrecht, werkzaam bij het UMCU, Utrecht
- Dr. C.R. (Carsten) Lincke, kinderarts, werkzaam in het ErasmusMC, Rotterdam, NVK
- Dr. M. (Marjolein) Peters, kinderarts, voorheen werkzaam in het Amsterdam UMC, Amsterdam, NVK
- Dr. S. (Suze) Jans, wetenschapsredacteur, Utrecht; onderzoeker, afdeling Child health TNO Leiden, KNOvV
Met ondersteuning van
- E.A. (Ester) Rake, MSc, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- M. (Margriet) Moret-Hartman, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
- M. (Marjolein) de Weerd, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten (tot 1 augustus 2019)
Met dank aan
- Dr. M.E. (Marleen) Jansen, postdoc onderzoeker afdeling Klinische Genetica, werkzaam in het Amsterdam UMC, locatie VUmc, Amsterdam
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle kerngroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van de kerngroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de federatie Medisch Specialisten.
|
Kerngroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dijkhuizen |
Laboratoriumspecialist Klinische Genetica, UMCG |
Lid WPCS VKGN/VKGL (onbetaald) |
Betrokken bij aanbod dragerschapstesten via instelling. |
Geen |
|
Dondorp |
Bijzonder hoogleraar Humanisme & ethiek van reproductieve genetica (Stichting Socrates – Humanistisch Verbond); Universitair hoofddocent Faculteit Health, Medicine & Life Sciences, afd Health, Ethics & Society, Universiteit Maastricht, 0,8 fte |
Lid WPCS VKGN/VKGL (onbetaald)
|
Was co-auteur van position document over de verantwoorde introductie van preconceptionele dragerschapsscreening: Henneman L et al. Responsible implementation of expanded carrier screening. Eur J Hum Genet. 2016;24(6):e1-e12.
Was secretaris van Gezondheidsraadcommissie 'Screening en de rol van de overheid'. Schreef in die hoedanigheid het advies 'Screening: tussen hoop en hype' (GR 2008).
Was lid van Gezondheidsraadcommissie Prenatale screening (advies in 2016).
Als ethicus betrokken bij onderzoek naar verantwoord (toekomstig) aanbod van dragerschapstest/screening in het MUMC, Maastricht
Was medeaanvrager van het door ZonMw gehonoreerde (inmiddels afgeronde) POM-project (preconceptionele dragerschapsscreening op maat). |
Geen |
|
Feenstra |
Klinisch geneticus, Radboudumc |
Lid WPCS VKGN/VKGL (onbetaald) -Voorzitter werkgroep prenatale genetica (onbetaald) -Lid Raad van Advies stichting prenatale screening Nijmegen (vacatie) |
Geen |
Geen |
|
Harssel |
Klinisch Geneticus, UMC Utrecht |
Lid WPCS VKGN/VKGL (onbetaald) -Lid werkgroep prenatale genetica (onbetaald) -Lid commissie Kwaliteit VKGN (onbetaald) |
Geen |
Geen |
|
Henneman |
Senior onderzoeker (Associate professor) en Universitair Hoofddocent, afdeling Klinische Genetica VUmc (vakgebied community genetics en public health genomics) |
Voorzitter wetenschappelijke vereniging Nederlandse Associatie voor Community Genetics en Public Health Genomics (NACGG) (onbetaald). -Lid bestuur Nederlandse Vereniging voor Humane Genetica (NVHG) (onbetaald) -Lid Forum Biotechnologie en Genetica (FBG), (onbetaald). -Secretaris Stichting Preconceptiezorg Nederland, (onbetaald). -Lid WPCS VKGN/VKGL (onbetaald) -Lid Kerngroep Niet Invasieve Prenatale Testen (NIPT) Consortium, (onbetaald -Website redactielid: www.huisartsengenetica.nl (onbetaald). - Lid Gezondheidsraad commissie Screening rond zwangerschap en geboorte (advies screening op niet-behandelbare aandoeningen) (vacatie). |
Hoofdaanvrager ZonMw- gefinancierde onderzoeksprojecten:- POM studie (Preconceptionele dragerschapscreening Op Maat); project rond de ontwikkeling en verdere implementatie van preconceptionele dragerschapscreening en opzet website www.benikdrager.nl (i.s.m. Erfocentrum) (afgerond, looptijd 2015-2017).
ZonMw VIMP (Verspreidings- en lmplementatieplan) Preconceptie dragerschapsscreening Op Maat (POM) (looptijd 2018-2019). Werkzaam en verbonden aan een instelling (Amsterdam UMC) dat preconceptie dragerschapstesten aanbiedt (zonder winstoogmerk) www.dragerschapstesten.nl.
Betrokken (geweest) als onderzoeker bij een (onbetaald onderzoeksproject) naar de evaluatie van een kinderwensspreekuur in een genetisch geïsoleerde populatie, het aanbod via www.dragerschapstest.nl en (ZonMw gefinancieerd) www.vumc.nl/CFtest.
Was eerste auteur van het PPPC European Society of Human Genetics position document over de verantwoorde introductie van preconceptionele dragerschapsscreening: Henneman L et al. Responsible implementation of expanded carrier screening. Eur J Hum Genet. 2016;24(6):e1-e12.
Was lid van Gezondheidsraadcommissie Prenatale screening (advies in 2016). |
Geen |
|
Van Koningsbruggen |
Laboratorium specialist klinische genetica, AMC |
Lid WPCS VKGN/VKGL (onbetaald) |
Betrokken bij aanbod dragerschapstesten via instelling. |
Geen |
|
Lakeman |
Klinisch geneticus te AMC Amsterdam |
Lid WPCS VKGN/VKGL (onbetaald) -Lid werkgroep PIL (vacatie) |
Sinds mei 2016 biedt Amsterdam UMC, locatie AMC een preconceptie dragerschaptest aan voor paren met kinderwens aan hoogrisicogroepen en aan koppels zonder a priori verhoogd risico (www.dragerschapstesten.nl). Door de richtlijn zal meer aandacht komen voor deze en ander in NL beschikbare testen. Hierdoor zal er meer aanndacht zijn voor de wetenschappelijke studies over het aanbod van deze test.
Was co-auteur van onder andere het PPPC ESHC position document over de verantwoorde introductie van preconceptionele dragerschapsscreening: Henneman L et al. Responsible implementation of expanded carrier screening. Eur J Hum Genet. 2016 ;24(6):e1-e12.
Was medeaanvrager van het door ZonMw gehonoreerde (inmiddels afgeronde) POM-project (preconceptionele dragerschapsscreening op maat). |
Geen |
|
Den Hollander |
Klinisch geneticus LUMC 80% |
geen (Commissie kwaliteit VKGN onbetaald) lid |
Betrokken bij aanbod dragerschapstesten via instelling. |
Geen |
|
Paulussen |
Laboratorium Specialist Klinische Genetica (LSKG) MUMC+ |
Bestuurslid Nederlandse Vereniging Humane Genetica (NVHG, penningmeester) (onbetaald), Lid Registratie Commissie VKGL (onbetaald), Lid WPCS VKGN/VKGL (onbetaald) |
Klinisch 'kartrekker' van de dragerschapstest die op dit moment geïmplementeerd is (niet-commercieel) door de afdeling klinische genetica van het MUMC+ |
Geen |
|
Plantinga |
senior onderzoeker afdeling genetica UMCG (0,6 FTE) programma manager leidende coalitie patientenparticipatie UMCG (0,3 FTE) |
Visiting research fellow CELS Southampton (onbetaald) Secretaris landelijke PCS werkgroep (onbetaald) Secretaris NACGG (onbetaald) |
Betrokken bij UMCG onderzoek naar implementatie van dragerschapsscreening via de huisarts |
Geen |
|
Sallevelt |
klinisch geneticus MUMC+ |
Lid WPCS VKGN/VKGL (onbetaald) |
Klinisch 'kartrekker' van de PCS test die op dit moment geimplementeerd is (niet-commercieel) door de afdeling klinische genetica van het MUMC+ |
Geen |
|
Stuurman |
klinisch geneticus Erasmus MC |
Geen |
Geen |
Geen |
|
Van Langen |
Hoogleraar Klinische Genetica, UMCG, Groningen |
Lid van de vaste commissie bevolkingsonderzoek Gezondheidsraad. (vacatie) - Lid WPCS VKGN/VKGL (onbetaald) |
In het UMCG behoren wij tot de voorlopers met betrekking tot aanbod van en wetenschappelijk onderzoek op het gebied van (universele) dragerschapsscreeningstests. Ik heb een joint PhD (samen met collega A.Lucassen in Southampton) die de evaluatie van de pilot in 1e lijn doet (en deze pilot heeft uitgevoerd), dit is dus op ander vlak. Ook doet zij nu onderzoek naar verschillen (ethisch) naar aanbod in 1e lijn (alle paren met kinderwens) en in 2e/3e lijn binnen fertiliteitspopulatie. Tot stand komen/brengen van richtlijn zal haar/ons geen voordeel geven, voor zover ik kan inschatten. Promotie volgt in 2020. |
Geen |
|
Van Vliet |
Beleidsmedewerker VSOP patiënten perspectief ethiek, genetica en perinatale zorg. 18 uur Vanuit de VSOP gedetacheerd voor 45% bij Stichting Erfocentrum als project leider ZwangerWijzer.nl en medisch adviseur. |
Lid van de Beraadsgroep Gezondheidsraad (vacatiegeld). - Lid Programma commissie Prenatale Screening downsyndroom en SEO. Tevens lid werkgroep kwaliteit, voorlichting en onderzoek. Centrum voor bevolkingsonderzoek, RIVM, (vacatiegeld en reiskosten) - Lid werkgroep Preconceptie Indicatielijst (PIL) , College perinatale Zorg (vacatiegeld), in eindfase - Lid van het TRIDENT Consortium en TRIDENT 2 studie: onderzoek naar mening zwangeren over ervaringen NIPT in Nederland VUMC (project financiering ZONMW). - Lid begeleidingscommissie studie eerste trimester virtual reality echoscopie in de verloskundige zorg (project financiering) - Project lid Studie A loyalty program to motivate vulnerable women to engage in preconception care: ‘from voucher to tablet’”. (project financiering ZONMW) - Project lid APROPOS-II. A Stepped Wedge Cluster Randomized Controlled Trial to evaluate the effect of a locally tailored approach for Preconception Care (project financiering ZONMW) - Adviseur VIMP Preconceptionele dragerschap screening op maat (POM) (project financiering ZONMW) (afgerond) |
VSOP is een vereniging van circa 80 ouder- en patiëntenorganisaties betrokken bij zeldzame, vaak erfelijke, aangeboren aandoeningen |
Geen |
|
Van der Hout |
Universitair docent Biomedische Ethiek, Universiteit Maastricht |
Lid WPCS VKGN/VKGL (onbetaald) -Lid werkgroep Pre-implantatie Genetische Diagnostiek, MUMC Maastricht. (Onbetaald). -Lid Commissie Medisch-Ethische en -Juridische Aangelegenheden (CMEJA), MUMC Maastricht. (Onbetaald). |
Als ethicus betrokken bij onderzoek naar verantwoord (toekomstig) aanbod van dragerschapstest/screening in het MUMC, Maastricht
Co-auteur van richtlijn van de European Society of Human Embryology and Reproduction (ESHRE) over de ethiek van preconceptionele dragerschapsscreening aan paren die in aanmerking komen voor medisch geassisteerde voortplanting: De Wert et al. Ethics of Preconception Carrier Screening in Assisted Reproduction (work in progress). |
Geen |
|
Klankbord-groeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Abbott |
laboratoriumspecialist (buitengewoon), UMCG |
diagnostiek NGS analyse pipeline coördineren, plus laboratoriumspecialist taken |
Geen |
Geen |
|
Bruggenwirth |
Laboratoriumspecialist Klinische genetica |
Geen |
Geen |
Geen |
|
Harteveld |
Senior-Laboratorium Specialist Klinische Genetica LDGA, Leids Universitair Medisch |
Associate-Editor International Journal of Laboratory hematology (onbetaald) |
Geen |
Geen |
|
Homminga |
Fertiliteitsarts, UMCG |
Geen |
Geen |
Geen |
|
Huijsdens |
Laboratoriumspecialist klinische genetica, UMCU |
Geen |
Geen |
Geen |
|
Jans |
Wetenschappelijk Redacteur Tijd schrift voor verloskundigen (KNOV) 0,33 FTE Beleidsadviseur KNOV 0, 1 FTE |
Geen |
Geen |
Geen |
|
Jong-Potjer |
Vrijgevestigde huisarts te Zoetermeer (3 dagen/ week) |
Project kwetsbare zwangere in Zoetermeer, betaald vanuit subsidie gemeente |
Geen |
Geen |
|
Knapen |
gynaecoloog perinatoloog ErasmusMC, 0.6 fte |
gynaecoloog star/shl, gynaecologische consulten, betaald. |
Geen |
Geen |
|
Lincke |
kinderarts-erfelijke en aangeboren aandoeningen |
voorzitter Klinische Adviesraad en vaccincommissie Lareb (onbetaald) |
Geen |
Geen |
|
Peters |
Kinderarts-hematoloog |
Geen |
Geen |
Geen |
|
Sijmons |
partner Nysingh advocaten - notarissen NV, hoogleraar gezondheidsrecht Universiteit Utrecht (0,2) |
voorzitter voering voor gezondheidsrecht (onbetaald), raadsheer plaatsvervanger hof amsterdam (onbetaald), lid gezondheidsraad (onbetaald) lid redactie tijdschrift voor gezondeheidsrecht (onbetaald) hoofddocent Grotius academy opleiding gezondheidrecht (betaald) BV besturen binnen de zorg (onbetaald) |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntenvereniging in de kerngroep (VSOP). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Vereniging Samenwerkende Ouder- en Patiëntenorganisaties en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
In een artikel van Burke (2019) wordt uiteengezet dat een evidence-based onderbouwing vaak erg lastig is voor genetische geneeskunde gezien de snelle veranderingen in genpanels en tests. Een andere aanpak voor het schrijven van evidence-based richtlijnmodules is daarom om de CPADmethode te volgen (Clinical practice advisory document) zoals beschreven in het artikel van Burke. De kerngroep adviseert deze methode als uitgangspunt te nemen bij een herziening of aanvulling van deze richtlijn.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de kerngroep en de adviseur de knelpunten, mede op basis van 6 interviews met stakeholders. Tevens zijn er knelpunten aangedragen door de VKGL, VVF, KNOV, Stichting CZB, NVOG, VKGN, VSOP en diverse externe experts op persoonlijke titel via de invitational conference op 21 september 2018, waar ook een samenvatting van de resultaten van de interviews werd gepresenteerd. Een verslag hiervan is opgenomen onder de aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de kerngroep besproken waarna de kerngroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de kerngroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De kerngroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de kerngroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
De definiëring van hoogrisicogroepen (module 'Definitie van hoogrisicogroepen') is ontstaan door voortschrijdend inzicht. Er werd op 9 april 2019 oriënterend gezocht naar bestaande buitenlandse richtlijnen en systematische reviews via Medline (OVID) en de Cochrane library. Er is breed gezocht naar hoogrisicogroepen en (expanded) dragerschapsonderzoek voor recessieve aandoeningen. Hierbij is naast preconceptionele screening ook prenatale screening meegenomen, omdat mensen buiten Nederland zich vaak pas tijdens de zwangerschap op dragerschap laten testen en deze literatuur ook relevant is voor deze richtlijn. Cascadescreening (familiescreening naar aanleiding van uitkomsten van een individuele dragerschapstest of aandoening in de familie) wordt buiten beschouwing gelaten. Omdat dit een oriënterende search is, werd alleen de P (Patiënten) gedefinieerd.
- P (Patiënten): (expanded) carrier screening, universal carrier screening, ancestry based carrier screening, preconception carrier screening, reproductive carrier screening, screening for autosomal recessive disorders, screening for (severe) childhood disorders, ethnicity based screening, targeted carrier screening.
Hoe breder de bevolking (de patiëntengroep) wordt ingedeeld, hoe meer mensen uit de bevolking kunnen worden gerelateerd aan een hoogrisicogroep. Echter, een beperkt aantal hoogrisicogroepen zijn door wetenschappelijk onderzoek in Nederland bekend.
Vervolgens werd voor een aantal afzonderlijke uitgangsvragen (zie de modules ‘Criteria en tests per hoogrisicogroep’ en 'Individuele testuitslag versus parenuitslag’) aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De kerngroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR -voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A. Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B. Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De kerngroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De gehele bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de kerngroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’. In deze richtlijn bleek uiteindelijk het opstellen van PICO’s en het selecteren van literatuur voor de analyse niet goed van toepassing (zie artikel Burke, 2019). Daarom is de gebruikte literatuur (veelal niet-systematisch literatuuronderzoek) beschreven in de Overwegingen en tezamen met alle argumenten (consensus based en expert based) meegenomen in het wegen en opstellen van de aanbevelingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de kerngroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Ontwikkeling van kwaliteitsindicatoren
De kerngroep heeft besloten geen indicatoren te ontwikkelen bij deze richtlijn omdat de UMC’s verschillende soorten tests aanbieden en de overige aanbevelingen volgens de kerngroep niet relevant zijn om een indicator op te stellen zonder onnodige verhoging van de administratielast.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de kerngroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de kerngroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de kerngroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd respectievelijk geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Cmaj, 182(18), E839-E842.
Burke, W., Clayton, E. W., Wolf, S. M., Berry, S. A., Evans, B. J., Evans, J. P., ... & McGuire, A. L. (2019). Improving recommendations for genomic medicine: building an evolutionary process from clinical practice advisory documents to guidelines. Genetics in Medicine. doi: 10.1038/s41436-019-0549-3.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ, 336(7653), 1106.
Zoekverantwoording
Search datum: 19 april 2019
|
Database |
Zoektermen |
|
Medline (OVID)
Richtlijnen
2008 – april 2019 |
1. exp Genetic Carrier Screening/or (carrier adj3 (screen* or test*)).ti,ab,kw. (10406) 2. (screening adj4 disorder*).ti,ab,kw. and (exp Genetic Testing/or (genetic adj3 (screen* or test*)).ti,ab,kw. or prenatal.ti,ab,kw.) (336) 3. 1 or 2 (10661) 4. limit 3 to (english language and yr="2008 -Current") (949) 5. limit 4 to (guideline or practice guideline) (5) 6. guideline*.ti. (70476) 7. 4 and 6 (8) 8. 5 or 7 (13)
= 13 (11 uniek) |
|
Medline (OVID)
Systematische reviews (Cochrane)
2008 – april 2019 |
1. exp Genetic Carrier Screening/or (carrier adj3 (screen* or test*)).ti,ab,kw. (10406) 2. (screening adj4 disorder*).ti,ab,kw. and (exp Genetic Testing/or (genetic adj3 (screen* or test*)).ti,ab,kw. or prenatal.ti,ab,kw.) (336) 3. 1 or 2 (10661) 4. limit 3 to (english language and yr="2008 -Current") (949) 5. (meta-analysis/or meta-analysis as topic/or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/or Editorial/or Letter/or (animals/not humans/)) (388404) 6. 4 and 5 (56) 7. cochrane.jw. (14189) 8. 4 and 7 (3)
= 56 (55 uniek) SR
= 3 (3 uniek) Cochrane reviews |
Orienterende search
Datum: 19 april 2019
|
Database |
Zoektermen |
|
Medline (OVID)
Richtlijnen
2008 – april 2019 |
1. exp Genetic Carrier Screening/or (carrier adj3 (screen* or test*)).ti,ab,kw. (10406) 2. (screening adj4 disorder*).ti,ab,kw. and (exp Genetic Testing/or (genetic adj3 (screen* or test*)).ti,ab,kw. or prenatal.ti,ab,kw.) (336) 3. 1 or 2 (10661) 4. limit 3 to (english language and yr="2008 -Current") (949) 5. limit 4 to (guideline or practice guideline) (5) 6. guideline*.ti. (70476) 7. 4 and 6 (8) 8. 5 or 7 (13)
= 13 (11 uniek) |
|
Medline (OVID)
Systematische reviews (Cochrane)
2008 – april 2019 |
1. exp Genetic Carrier Screening/or (carrier adj3 (screen* or test*)).ti,ab,kw. (10406) 2. (screening adj4 disorder*).ti,ab,kw. and (exp Genetic Testing/or (genetic adj3 (screen* or test*)).ti,ab,kw. or prenatal.ti,ab,kw.) (336) 3. 1 or 2 (10661) 4. limit 3 to (english language and yr="2008 -Current") (949) 5. (meta-analysis/or meta-analysis as topic/or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/or Editorial/or Letter/or (animals/not humans/)) (388404) 6. 4 and 5 (56) 7. cochrane.jw. (14189) 8. 4 and 7 (3)
= 56 (55 uniek) SR
= 3 (3 uniek) Cochrane reviews |
