Biologics voor kinderen en adolescenten
Uitgangsvraag
In welk geval/bij welke indicatie worden biologics bij kinderen aanbevolen?
Wat zijn de (on)gunstige (lange termijn) effecten van biologics voor kinderen met psoriasis?
Welke screening en monitoring worden aanbevolen bij kinderen met psoriasis die met een biologic (gaan) worden behandeld?
Aanbeveling
Indicatie
- Bespreek met patiënt en ouders de wenselijkheid en haalbaarheid van de huidige therapie en beoordeel therapietrouw.
- Overweeg vóór start om de ziekte-ernst bij kinderen en adolescenten met psoriasis te objectiveren door gebruik te maken van de PASI en/of PGA en bij voorkeur ook de CDLQI. Neem in de beoordeling van ziekte-ernst ook de betrokkenheid van gelaat, handpalmen, voetzolen, genitalia, liezen, oksels, hoofdhuid en nagels mee.
- Overweeg biologics voor te schrijven aan kinderen (vanaf 4 jaar oud) en adolescenten met psoriasis, waarbij de ziekte niet goed genoeg onder controle is ondanks optimale topicale therapie én waar (bij voorkeur) een periode van 3 maanden behandeling met een conventioneel immunosuppressivum (methotrexaat, fumaarzuur) in een afdoende dosis is gegeven, tenzij er contra-indicaties voor of bijwerkingen van deze middelen zijn, of wanneer zeer snelle effectiviteit noodzakelijk is. Indien van tevoren geen conventioneel systemisch middel gegeven is, kunnen alleen de biologics met een eerstelijns label gegeven worden (zie overwegingen).
Keuze van middel
- Maak een keuze door middel van ‘Samen Beslissen’ met patiënt en ouder(s)/verzorger(s). Houd daarbij rekening met patiëntkenmerken (leeftijd, voorgeschiedenis, familie anamnese) co-morbiditeiten beschikbaarheid van het middel en de wensen en voorkeuren van de patiënt (injectiefrequentie, mogelijke bijwerkingen). De werkgroep kan op basis van de literatuur betreft effectiviteit en veiligheid (bijwerkingen) géén voorkeur uitspreken ten aanzien van de biologics ten opzichte van elkaar.
Screening
- Inventariseer of varicella zoster (waterpokken) is doorgemaakt ná de leeftijd van 1 jaar. Test bij twijfel of atypisch beloop varicella-antistoffen. Als antistoffen niet aantoonbaar zijn overleg over beleid met een kinderarts(-immunoloog) voor start biologicals.
- Screen op tuberculose en latente tuberculose-infectie volgens richtlijn: Screening op latente Tbc-infectie bij kinderen - Richtlijn - Richtlijnendatabase
- Bespreek bij meisjes in de vruchtbare leeftijd de mogelijke effecten van de behandeling op een zwangerschap. Sluit bij twijfel een eventuele zwangerschap uit in urine of bloed. Adviseer aan deze patiëntgroep adequate anticonceptie.
- Voer laboratoriumcontroles uit volgens Tabel 1.
- Check de vaccinatiestatus volgens het Rijksvaccinatieprogramma.
- Vaccineer niet met een levend (verzwakt) vaccin tijdens behandeling met een biologic (behalve in specifieke gevallen).
- Maak voor meer overwegingen en om te controleren of adviezen nog actueel zijn gebruik van de richtlijn Vaccinatie bij chronisch inflammatoire aandoeningen | LCI richtlijnen (rivm.nl)
- Overleg zo nodig in specifieke gevallen, bij het vervroegen van vaccinaties RVP of aanvullende vaccinaties met een kinderarts-immunoloog
Monitoring
- Voer laboratoriumcontroles uit volgens Tabel 1.
- Overweeg de effectiviteit van de behandeling met een biologic te objectiveren met de PASI en/of PGA en bij voorkeur ook de CDLQI.
Overwegingen
Kwaliteit van het bewijs
Voor uitgangsvraag één is de literatuur niet systematisch beoordeeld op kwaliteit; er is geen GRADE-analyse gedaan. Er werd gebruikt gemaakt van de Amerikaanse [Menter, 2020] en Duitse richtlijn [AWMF, 2021] voor behandeling van psoriasis bij kinderen en enkele aanvullende publicaties.
Voor uitgangsvraag twee is de literatuur systematisch beoordeeld op kwaliteit (GRADE). Een uiteenzetting is gegeven in ‘Professioneel perspectief en balans van gewenste en ongewenste effecten’. Voor de GRADE-analyses en conclusies zie ‘Conclusies’.
Voor uitgangsvraag drie is de literatuur niet systematisch beoordeeld op kwaliteit; er is geen GRADE-analyse gedaan. Voor het beantwoorden van uitgangsvraag 3 werd gebruikt gemaakt van meerdere richtlijnen;
- NVDV-richtlijn psoriasis (volwassenen): Biologics - Richtlijn - Richtlijnendatabase
- Duitse richtlijn systemische therapie kinderen en adolescenten met psoriasis: 013-094l_S2k_Therapie-der-Psoriasis-bei-Kindern-und-Jugendlichen_2022-04.pdf (awmf.org)
- NVR-richtlijn JIA: Startpagina - Juveniele idiopatische artritis (JIA) - Richtlijn - Richtlijnendatabase
- Kinderformularium
- NVALT-richtlijn: Screening op latente Tbc-infectie bij kinderen - Richtlijn - Richtlijnendatabase
- EULAR/PReS aanbevelingen: EULAR/PRES recommendations for vaccination of paediatric patients with autoimmune inflammatory rheumatic diseases: update 2021 (bmj.com)
Indien de aanbevelingen van de verschillende richtlijnen overeenkwamen, werden deze overgenomen. Eventuele verschillen tussen diverse richtlijnen en/of onduidelijkheden werden besproken binnen de werkgroep, waarin ook twee kinderreumatologen vertegenwoordigd zijn. Voor de vraagstelling ten aanzien van BMR-vaccinatie bij jonge kinderen die een biologic gaan starten, werd advies ingewonnen bij een auteur van de EULAR/PRES-aanbevelingen, en een internist-immunoloog gespecialiseerd in vaccinaties.
Professioneel perspectief
Een puur lokale behandeling (topicale therapie) is bij milde vormen van psoriasis vaak voldoende. Bij een onvoldoende respons op topicale therapie en bij matige en ernstige psoriasis is daarnaast een systemische therapie nodig [AWMF, 2021]. De indicatie voor het gebruik van systemische therapie wordt vaak bepaald op basis van de Psoriasis Area and Severity Index-score (PASI), Body Surface Area (BSA) en Children’s Dermatology Life Quality Index (CDLQI) -score, en is van toepassing wanneer ten minste één van deze waarden een score van 10 bereikt (de zogenaamde ‘Rule of Ten’ [AWMF, 2021; Finlay, 2005]. Het is belangrijk op te merken dat ernstige gelokaliseerde manifestaties, zoals op de hoofdhuid, in het gezicht, in huidplooien, op de geslachtsdelen, handpalmen en voetzolen, en op de nagels, onvoldoende worden weergegeven door PASI en BSA, zodat ook een hoge CDLQI-score alleen (in combinatie met onvoldoende effect van topicale therapie) al voldoende kan zijn voor de indicatiestelling systemische therapie. De International Psoriasis Council (IPC) heeft een consensus gebaseerd voorstel gedaan om de ziekte-ernst bij volwassenen met psoriasis in te delen in twee groepen: 1. patiënten die kandidaat zijn voor topicale therapie, of 2. patiënten die in aanmerking komen voor systemische therapie [Strober, 2020]. Deze laatste groep moet aan minstens één van de volgende criteria voldoen: (i) BSA >10%, (ii) ‘specifieke gebieden’ aangedaan (gelaat, handpalmen, voetzolen, genitalia, hoofdhuid, nagels), (iii) onvoldoende respons op topicale therapie. Behalve bovenstaande ‘Rule of Ten’ of de IPC-criteria, kunnen ook andere factoren meespelen bij de beslissing om te gaan starten met een systemische behandeling, zoals de aanwezigheid van bijvoorbeeld PsA [Menter, 2020].
De biologics ADA, IXE en SEC mogen volgens label gegeven worden als eerstelijns systemische behandeling van kinderen met psoriasis. Het is de vraag of het desondanks verstandig kan zijn om eerst een behandeling met MTX te starten, vanwege de goede werkzaamheid van MTX bij een subgroep van kinderen en de aanzienlijk lagere kosten. In een grote prospectieve studie bij 105 kinderen en adolescenten met psoriasis behield ongeveer een derde van de kinderen een PASI < 3 zonder persisterende bijwerkingen gedurende een behandeling van 2 jaar [Bruins, 2022]. Ook volgens de update van de Duitse kinderrichtlijn is er voor MTX nog steeds een plaats in behandeling van psoriasis bij kinderen [ANWF, 2021]. Gezien MTX voor de behandeling van psoriasis bij kinderen niet geregistreerd is en er goede alternatieven zijn wordt in de Duitse richtlijn de voorkeur gegeven aan ADA als eerste keus behandeling [ANWF, 2021]. De Amerikaanse richtlijn doet geen uitspraken over een volgordelijkheid betreft het inzetten van systemische behandelingen [Menter, 2020].
Het is belangrijk om in een gezamenlijke beslissing met de patiënt te komen tot een behandelstrategie, waarbij de voordelen en nadelen van de verschillende behandelingen (MTX vs biologics) dienen besproken te worden De volgende behandelstrategie kan worden overwogen: eerste keus behandeling middels MTX vanwege de effectiviteit bij een derde van de kinderen zonder bijwerkingen, alsook vanwege de aanzienlijk lagere kosten. In het geval van ineffectiviteit of bijwerkingen van MTX, kan worden overgegaan tot behandeling met biologics. Hierbij is het mogelijk om te kiezen uit alle vijf geregistreerde biologics, gezien eerst een conventioneel systemisch middel is geprobeerd. Bovenstaande behandelstrategie is echter minder geschikt bij een plotselinge ernstige verergering van psoriasis vanwege de langere tijd die nodig is voordat MTX effectief wordt.
Co-morbiditeiten
Co-morbiditeiten waarmee rekening gehouden moet worden bij het kiezen en starten van een biologic zijn voor de specifieke patiëntgroepen kinderen en adolescenten nog niet voldoende geïdentificeerd. Geadviseerd wordt ook bij kinderen bedacht te zijn op co-morbiditeiten en zo nodig gebruik te maken van de aanbevelingen in de modules uit de volwassenen richtlijn.
Screening en monitoring
Tabel 1. Laboratoriumcontroles
|
Parameter |
Bij intake |
Elke 3-6 maanden |
|
X |
Xb |
|
Xa |
Xb |
|
X |
Xb |
|
(X)c |
|
|
(X)d |
|
|
(X)e |
|
|
(X)f |
|
|
(X) = op indicatie aAls afwijkend overweeg leverlab en overleg zo nodig met een kinder MDL-arts. bVaker indien afwijkend. cPatiënten met risicofactoren voor een dergelijke infectie. Hepatitis B virus (HBV) zit sinds 2011 in RVP. dInventariseer of varicella zoster (waterpokken) is doorgemaakt ná de leeftijd van 1 jaar. Test bij twijfel of atypisch beloop varicella-antistoffen. Als antistoffen niet aantoonbaar zijn overleg over beleid met een kinderarts(-immunoloog) voor start biologicals . eBespreek bij meisjes die seksueel actief zijn de kans op een zwangerschap en voer bij twijfel een zwangerschapstest uit. fScreen op tuberculose en latente tuberculose-infectie (LTBI) volgens richtlijn: Screening op latente Tbc-infectie bij kinderen - Richtlijn - Richtlijnendatabase |
||
Varicella zoster virus (VZV):
Immunosuppressieve medicatie kan infecties zoals VZV ernstiger doen laten verlopen.
- Inventariseer of varicella zoster (waterpokken) is doorgemaakt ná de leeftijd van één jaar. Test bij twijfel of atypisch beloop varicella-antistoffen. Als antistoffen niet aantoonbaar zijn overleg over beleid met een kinderarts-immunoloog voor start biologicals.
Tuberculose:
Immunosuppressieve medicatie kan infecties zoals tuberculose ernstiger doen laten verlopen en onder deze therapie kan Latente tuberculose-infectie (LTBI) reactiveren.
- Screen op tuberculose en LTBI volgens richtlijn: Screening op latente Tbc-infectie bij kinderen – Richtlijn – Richtlijnendatabase
- Overleg met een kinderarts-infectioloog of kinderlongarts bij een positieve screening op (latente) tuberculose ten aanzien van beleid.
Virale hepatitis en Humaan immunodeficiëntie virus (HIV):
Immunosuppressieve medicatie kan infecties zoals, HIV en hepatitis B en C ernstiger doen laten verlopen.
- Routinematige screening op hepatitis B en C wordt bij kinderen en adolescenten niet aanbevolen. Screening is geïndiceerd enkel bij het bestaan van risicofactoren. Bovendien worden kinderen sinds 2011 gevaccineerd voor hepatitis B via het RVP, voor hen die gevaccineerd zijn is screening op hepatitis B in géén geval nodig.
- Overleg met een kindermaagdarmleverarts bij het bestaan van een infectie met hepatitis B of C.
Kinderwens en zwangerschap:
Bespreek bij meisjes in de vruchtbare leeftijd dat de behandeling schadelijk kan zijn voor de foetus tijdens een zwangerschap. Sluit bij verdenking van zwangerschap deze uit met een test (urine of bloed). Adviseer aan deze patiëntgroep adequate anticonceptie. Maak voor meer diepgang en overwegingen gebruik van de module ‘Kinderwens en zwangerschap bij systemische therapieën’ in de volwassenen richtlijn waarin o.a. aanbevelingen met betrekking tot biologics zijn geformuleerd.
Vaccinaties:
Het wordt aanbevolen om de vaccinatiestatus volgens het Rijksvaccinatieprogramma te controleren omdat infecties ernstiger kunnen verlopen bij het gebruik van biologics. Levend verzwakte vaccins zijn gecontra-indiceerd tijdens gebruik van biologics (behalve in specifieke gevallen). In het Rijksvaccinatieprogramma is de rotavirus vaccinatie levend verzwakt, deze wordt gegeven bij 6-9 weken en 3 maanden, en de BMR vaccinatie, deze wordt vanaf 2025 gegeven bij 14 maanden en 3 jaar. Vaccineer bij voorkeur minimaal 4 weken vóór start van biologics met een levend verzwakt vaccin. Bij al bestaande immuniteit is toediening van een tweede vaccinatie met levend verzwakt BMR/varicella zoster vaccin bij gebruik van lage doses van sommige immuunsuppressiva waarschijnlijk wel mogelijk in overleg. Echter, vanwege het ontbreken van een goede onderbouwing en ervaring wat dat voor de veiligheid van de individuele patiënt betekent, wordt vaccinatie in de meeste richtlijnen afgeraden. In tabel 4.3 in de richtlijn Vaccinatie bij chronisch inflammatoire aandoeningen | LCI richtlijnen (rivm.nl) wordt een overzicht gegeven van medicamenten/doseringen die als niet-immuunsupressief worden beschouwd. Overleg bij twijfel met een kinderarts-infectioloog/immunoloog.
Balans van gewenste en ongewenste effecten
Effectiviteit
RCT’s (12-16 behandelweken)
Over de effectiviteit van biologics (o.b.v. 12 behandelweken m.u.v. ADA: 16 behandelweken) kan op basis van PASI 75, PASI 90 en PGA 0/1 (of IGA mod. 2011 0/1) globaal gezegd worden dat deze middelen beter zijn dan placebo. Echter, alleen voor ETN en IXE werd een hoge bewijskracht gevonden (GRADE); een groot klinisch relevant verschil. Voor SEC- lage dosering (LD) en UST- standaard dosering (SD) was de bewijskracht laag (GRADE); mogelijk een groot klinisch relevant verschil. De werkgroep kan geen uitspraak doen over ADA- hoge dosering (H) op basis van een netwerk meta-analyse (NMA) van Huang et al. [2022] omdat deze analyse alleen iets zegt over PASI-90 en dit geen directe vergelijking betreft (GRADE: zeer laag). Voor ADA H ten opzichte van MTX (16 behandelweken) zou er op basis van PASI-75 mogelijk een voordeel kunnen zijn (GRADE: laag), over PASI 90 en PGA 0/1 kan de werkgroep geen uitspraak doen (GRADE: zeer laag). De studies die biologics onderling vergeleken voor een periode van 12 weken (SEC-LD vs. ETN en IXE vs. ETN) hebben o.a. een zeer kleine populatie en voor PASI 75 is de werkgroep onzeker over het effect betreft beiden vergelijkingen (GRADE: zeer laag). Hetzelfde geldt voor de PGA 0/1 in de vergelijking IXE vs. ETN (GRADE: zeer laag). Voor PASI-90 zou er mogelijk een voordeel kunnen zijn van SEC-LD en IXE t.o.v. ETN en voor de IGA mod. 2011 0/1 mogelijk een voordeel van SEC-LD t.o.v. ETN (GRADE: laag).
De NMA van Huang et al. [2022] gaf géén aanvullende terecht significante vergelijkingen tussen de biologics betreft de uitkomstmaten PASI 90 en PGA 0/1. PASI 75 werd niet beoordeeld in deze NMA.
Lange termijn studies
De effectiviteit van de verschillende biologics na bovengenoemde 12 weken (16 weken voor ADA) blijft grofweg gelijk of neemt zelfs nog licht toe ten opzichte van gevonden effectiviteit op 12 weken (16 weken voor ADA). Bij de meeste studies is de lange termijn effectiviteit in ieder geval tot ongeveer één jaar beschreven. Respectievelijk IXE, ETN, ETN en ADA [Paller, 2022; Paller, 2010; Paller, 2016; Thaçi, 2019]. Respectievelijk SEC en UST [Magnolo, 2022; Philipp, 2020].
Kwaliteit van leven
RCT’s (12-16 behandelweken)
Betreft de kwaliteit van leven (CDLQI 0/1) na 12 behandelweken gaven ETN, UST-SD, IXE en SEC-LD een significant hogere respons t.o.v. placebo. IXE resulteert in een groot klinisch relevant verschil (GRADE: hoog) en SEC-LD en UST-SD zouden kunnen resulteren in een klinisch relevant verschil (GRADE: laag). Echter, over ETN vs. placebo kan wegens de bewijskracht geen uitspraak worden gedaan (GRADE: zeer laag). Dit geldt ook voor SEC-LD vs. ETN (GRADE: zeer laag). Alle andere vergelijkingen waren niet significant of niet onderzocht; een geïncludeerde NMA [Huang, 2022] vond geen significante verschillen tussen de biologics betreft CDLQI 0/1.
Lange termijn studies
Het niveau in verbetering van kwaliteit van leven van de verschillende biologics gevonden tijdens de eerste 12-16 behandel weken, bleef ook gedurende een follow-up periode van ongeveer een jaar bestaan, of nam zelfs nog wat toe. Respectievelijk IXE, ETN, ETN en ADA [Paller, 2022; Paller, 2010; Paller, 2016; Thaçi, 2019]. Respectievelijk SEC en UST [Magnolo, 2022; Philipp, 2020].
Veiligheid
RCT’s (12-16 behandelweken)
Betreft AE’s en SAE’s (12-16 behandelweken) toonde geen van de vergelijkingen uit de initiële RCT’s – en de uitkomst van een NMA Cai et al. [2022] – een significant verschil met placebo (respectievelijk GRADE: redelijk, GRADE: zeer laag). Veel voorkomende bijwerkingen bij kinderen en adolescenten die biologics kregen waren bovenste luchtweginfecties (waaronder nasofaryngitis [significant voor ETN vs. placebo], rinitis, en streptokokken faryngitis) andere infecties (waaronder gastro-intestinale infecties en influenza), hoesten, misselijkheid en braken, en hoofdpijn [significant voor ETN vs. placebo] [Cai, 2022].
Wat betreft bijwerkingen van speciale interesse, werden injectieplaatsreacties vaker waargenomen in de interventiegroepen, evenals ernstige infecties. Echter, dit verschil was niet significant in vergelijking met de controlegroepen in de initiële RCT's, deze omvatten alle eerder besproken biologics [Cai, 2022]. Er werden twee gevallen gerapporteerd van een Candida-infectie bij patiënten die behandeld werden met SEC (2,5%). Er werd één geval beschreven met de ziekte van Crohn in de IXE groep (0,9%) [Cai, 2022]. Het ontwikkelen van maligniteiten, neurologische aandoeningen, opvlammingen van (latente) tuberculose, of hepatitis werd niet beschreven.
Lange termijn studies
Het lange termijn veiligheidsprofiel (ongeveer één jaar follow-up) van de verschillende biologics is niet wezenlijk anders dan de bijwerkingen die in de eerste 12-16 weken beschreven werden. In de IXE groep werden tijdens de onderhoudsbehandeling van 48 weken nog drie patiënten met een mogelijke ziekte van Crohn beschreven. Respectievelijk IXE, ETN, ETN en ADA [Paller, 2022; Paller, 2010; Paller, 2016; Thaçi, 2019]. Respectievelijk SEC en UST [Magnolo, 2022; Philipp, 2020].
|
Samenvatting effectiviteit, kwaliteit van leven en veiligheid De vijf geregistreerde biologics, ETN, ADA, UST, IXE en SEC, zijn allen effectief in de behandeling van kinderen met matige tot ernstige psoriasis. Behandeling met deze biologics verbetert de kwaliteit van leven van kinderen met matige tot ernstige psoriasis. Er werden geen significante verschillen in (ernstige) bijwerkingen gevonden tussen de biologics en de controlegroepen. Kinderen en adolescenten die biologics kregen vertoonden een acceptabel bijwerkingenprofiel. De lange termijn effectiviteit en veiligheid (bijwerkingen) laten tot nu toe geen nieuwe bevindingen zien. |
Waarden en voorkeuren van patiënten
Bij de beslissing om biologics voor te schrijven aan kinderen met psoriasis, spelen de waarden en voorkeuren van patiënten en hun ouders/verzorgers een cruciale rol. Samenwerking is essentieel om een behandelplan te ontwikkelen dat aansluit bij hun individuele behoeften en voorkeuren. Voor alle leeftijden is het belangrijk dat de patiënt betrokken wordt bij de keuze voor het gebruik van een biologic en dat de informatie wordt aangepast aan het kennis- en taalniveau van de patiënt. Daarnaast moeten patiënten en hun ouders/verzorgers de tijd en middelen krijgen om een weloverwogen keuze te maken voor een behandeling. Een (digitale) folder of keuzehulp kan hierbij helpen.
Psoriasis heeft een grote impact op de kwaliteit van leven en de ontwikkeling van een kind. Schaamte, het gevoel anders te zijn dan anderen en het leren omgaan met de aandoening spelen hierbij een rol, evenals de tijd en energie die het voortdurend behandelen van de huid kost. Vooral adolescenten zijn een kwetsbare patiëntengroep vanwege de grote sociaal-emotionele ontwikkeling die zij doormaken. Voor deze groep zijn adviezen over de beste manier om hun huid te behandelen belangrijk.
De voor- en nadelen van behandelingen zijn belangrijk voor adolescenten, zoals het gebruik van alcohol of voorbehoedsmiddelen. Onderwerpen als alcohol- of drugsgebruik en seksuele activiteit worden niet altijd in het bijzijn van ouders besproken. Bij de keuze voor het gebruik van biologics spelen ook de voorgeschiedenis van behandelingen, het toekomstperspectief van behandelingen, de mogelijkheden voor langdurig gebruik en de ervaren verminderde weerstand een rol. Dit moet besproken worden in het gesprek met de behandelaar. De voorkeur voor pillen of injecties speelt ook mee in de keuze. Bij jongere kinderen speelt de injectiefrequentie begrijpelijkerwijs een belangrijke rol. In het geval van prikangst kan worden gekozen voor een biologic met een lage injectiefrequentie. Een afweging hierbij is dat een biologic met een hogere frequentie makkelijker te onderbreken is in het geval van een virale of bacteriële infectie.
Het is belangrijk om aan ouders en kinderen uit te leggen waarom er screenend bloedonderzoek wordt gedaan en hoe de uitslagen geïnterpreteerd kunnen worden. Daarnaast moet besproken worden welke signalen in de gaten gehouden moeten worden, bij wie en wanneer men aan de bel moet trekken. Het is ook belangrijk om regelmatig te bespreken hoe zowel kinderen als ouders de afspraken willen invullen, met aandacht voor het eerste aanspreekpunt en of het een fysieke afspraak of zorg op afstand kan zijn.
Aanvaardbaarheid en haalbaarheid
De werkgroep acht het aannemelijk dat de toepasbaarheid van systemische medicatie (conventionele systemische therapie en biologics) voor kinderen met psoriasis in de dagelijkse praktijk in de komende jaren zal toenemen, rekening houdend met de geobjectiveerde ziekte ernst, invloed op de dagelijkse kwaliteit van leven en betrokkenheid van specifieke lichaamsdelen (gelaat, handpalmen, voetzolen, genitalia, liezen, oksels, hoofdhuid en nagels). Bij onvoldoende ervaring met het voorschrijven van systemische medicatie bij kinderen verdient het de voorkeur te overleggen met een dermatoloog die ervaring heeft met het voorschrijven van systemische therapie bij kinderen.
Onderbouwing
Achtergrond
Van de biologics die worden gebruikt voor de behandeling van psoriasis bij volwassenen, zijn er in Europa, ten tijde van het schrijven van deze richtlijn (oktober 2023), vijf middelen door European Medicines Agency (EMA) goedgekeurd voor kinderen en adolescenten vanaf 6 jaar oud: entanercept (ETA), adalimumab (ADA) (vanaf 4 jaar oud), ustekinumab (UST), ixekizumab (IXE) en secukinumab (SEC). ADA, IXE en SEC hebben een ‘eerstelijnslabel’.
Zie het kinderformularium voor actuele doseringen.
Conclusies / Summary of Findings
ETN vs. placebo
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Etanercept |
Placebo |
Relatief |
Absoluut |
||
|
Proportie patiënten met PASI 90 - 4 t/m 17 jaar oud [Paller, 2008; Paller 2020; Bodemer, 2021] |
||||||||||||
|
3 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
niet ernstig |
niet gevonden |
53/177 (29.9%) |
8/165 (4.9%) |
RR 5.12 |
⨁⨁⨁⨁ |
CRUCIAAL |
|
|
Conclusie: ETN resulteert in een grote, klinisch relevante, toename in de proportie patiënten die PASI 90 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met PASI 75 - 4 t/m 17 jaar oud [Paller, 2008; Paller 2020; Bodemer, 2021] |
||||||||||||
|
3 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
niet ernstig |
niet gevonden |
105/177 (59.3%) |
23/165 (13.9%) |
RR 3.99 |
|
⨁⨁⨁⨁ |
CRUCIAAL |
|
Conclusie: ETN resulteert in een grote, klinisch relevante, toename in de proportie patiënten die PASI 75 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met PGA 0/1 - 4 t/m 17 jaar oud [Paller, 2008; Paller 2020] |
||||||||||||
|
2 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
niet ernstig |
niet gevonden |
66/125 (52.8%) |
14/116 (12.1%) |
RR 4.21 |
|
⨁⨁⨁⨁ |
CRUCIAAL |
|
Conclusie: ETN resulteert in een grote, klinisch relevante, toename in de proportie patiënten die PGA 0/1 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met CDLQI 0/1 - 6 t/m 17 jaar oud [Bodemer, 2021] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga,b |
niet gevonden |
15/41 (36.6%) |
6/40 15.0%) |
RR 2.44 |
|
⨁◯◯◯ |
BELANGRIJK |
|
Conclusie: de werkgroep is onzeker of ETN een toename geeft van de proportie patiënten die CDLQI 0/1 bereikt ten opzichte van placebo. |
||||||||||||
CI: Confidence interval; RR: Risk ratio
Explanations
- Kleine groep. ETN groep is n=41
- Zowel klinisch als niet klinisch relevant voordeel mogelijk t.o.v. placebo.
ADA-H vs. placebo
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Adalimumab |
Placebo |
Relatief |
Absoluut |
||
|
Proportie patiënten met PASI 90 - 4 t/m 17 jaar oud [Huang, 2022] (initiële RCT Papp, 2017) |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
ernstiga |
zeer ernstigb |
niet gevonden |
11/38 (29.0%) |
2/38 (5.3%) |
RR 5.50 |
⨁◯◯◯ |
CRUCIAAL |
|
|
Conclusie: de werkgroep is onzeker of ADA-H een toename geeft van de proportie patiënten die PASI 90 bereikt ten opzichte van placebo. De werkgroep kan door de te extrapoleren kwaliteit van bewijs ook geen uitspraak over de andere uitkomstmaten (PASI 75, PGA 0/1) voor deze vergelijking. CDLQI 0/1 werd niet gescoord in de enige studie met ADA-H (Papp et al. 2017) |
||||||||||||
CI: Confidence interval; RR: Risk ratio
Explanations
a. Voor de netwerk meta-analyse werd adalimumab vergeleken met een imaginaire placebogroep (conform proportie PASI 90 in de placebogroepen in de andere studies (= 13/239; 5.4%; 0,054 x 38 = 2/38). Papp et al., 2017 heeft adalimumab echter vergeleken met MTX.
b. Kleine groep. Adalimumab groep is n=38
UST-SD vs. placebo
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Ustekinumab |
Placebo |
Relatief |
Absoluut |
||
|
Proportie patiënten met PASI 90 - 12 t/m 17 jaar oud [Landells, 2015] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
22/36 (62.1%) |
2/37 (5.4%) |
RR 11.31 |
⨁⨁◯◯ |
CRUCIAAL |
|
|
Conclusie: UST-SD zou kunnen resulteren in een grote, klinisch relevante, toename in de proportie patiënten die PASI 90 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met PASI 75 - 12 t/m 17 jaar oud [Landells, 2015] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
29/36 (80.1%) |
4/37 (10.8%) |
RR 7.45 |
|
⨁⨁◯◯ |
CRUCIAAL |
|
Conclusie: UST-SD zou kunnen resulteren in een grote, klinisch relevante, toename in de proportie patiënten die PASI 75 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met PGA 0/1 - 12 t/m 17 jaar oud [Landells, 2015] |
||||||||||||
|
1 |
|
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
25/36 (69.4%) |
2/37 (5.4%) |
RR 12.85 |
|
⨁⨁◯◯ |
CRUCIAAL |
|
Conclusie: UST-SD zou kunnen resulteren in een grote, klinisch relevante, toename in de proportie patiënten die PGA 0/1 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met CDLQI 0/1 - 12 t/m 17 jaar oud [Landells, 2015] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
17/30 (56.7%) |
4/30 (13.3%) |
RR 4.25 |
|
⨁⨁◯◯ |
CRUCIAAL |
|
Conclusie: UST-SD zou kunnen resulteren in een grote, klinisch relevante, toename in de proportie patiënten die CDLQI 0/1 bereikt ten opzichte van placebo. |
||||||||||||
CI: Confidence interval; RR: Risk ratio
Explanations
a. Kleine groep. UST-SD groep is n=36 of n=30
IXE vs. placebo
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Ixekizumab |
Placebo |
Relatief |
Absoluut |
||
|
Proportie patiënten met PASI 90 - 6 t/m 17 jaar oud [Paller,2020] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
niet ernstig |
niet gevonden |
90/115 (78.3%) |
3/56 (5.4%) |
RR 14.61 |
⨁⨁⨁⨁ |
CRUCIAAL |
|
|
Conclusie: IXE resulteert in een grote, klinisch relevante, toename in de proportie patiënten die PASI 90 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met PASI 75 - 6 t/m 17 jaar oud [Paller,2020] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
niet ernstig |
niet gevonden |
102/115 (88.7%) |
14/56 (25.0%) |
RR 3.55 |
|
⨁⨁⨁⨁ |
CRUCIAAL |
|
Conclusie: IXE resulteert in een grote, klinisch relevante, toename in de proportie patiënten die PASI 75 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met PGA 0/1 - 6 t/m 17 jaar oud [Paller,2020] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
niet ernstig |
niet gevonden |
93/115 (80.9%) |
6/56 (10.7%) |
RR 7.55 |
|
⨁⨁⨁⨁ |
CRUCIAAL |
|
Conclusie: IXE resulteert in een grote, klinisch relevante, toename in de proportie patiënten die PGA 0/1 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met CDLQI 0/1 - 6 t/m 17 jaar oud [Paller,2020] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
niet ernstig |
niet gevonden |
74/115 (64.4%) |
13/56 (23.2%) |
RR 2.77 |
|
⨁⨁⨁⨁ |
BELANGRIJK |
|
Conclusie: IXE resulteert in een grote, klinisch relevante, toename in de proportie patiënten die CDLQI 0/1 bereikt ten opzichte van placebo. |
||||||||||||
CI: Confidence interval; RR: Risk ratio
SEC-LD vs. placebo
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Secukinumab |
Placebo |
Relatief |
Absoluut |
||
|
Proportie patiënten met PASI 90 - 6 t/m 17 jaar oud [Bodemer, 2021] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
29/40 (72.5%) |
1/41 (2.4%) |
RR 29.73 |
⨁⨁◯◯ |
CRUCIAAL |
|
|
Conclusie: SEC-LD zou kunnen resulteren in een grote, klinisch relevante, toename in de proportie patiënten die PASI 90 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met PASI 75 - 6 t/m 17 jaar oud [Bodemer, 2021] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
32/40 (80.0%) |
6/41 (14.6%) |
RR 5.47 |
|
⨁⨁◯◯ |
CRUCIAAL |
|
Conclusie: SEC-LD zou kunnen resulteren in een grote, klinisch relevante, toename in de proportie patiënten die PASI 75 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met IGA mod. 2011 0/1 - 6 t/m 17 jaar oud [Bodemer, 2021] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
28/40 (70.0%) |
2/41 (4.9%) |
RR 14.35 |
|
⨁⨁◯◯ |
CRUCIAAL |
|
Conclusie: SEC-LD zou kunnen resulteren in een grote, klinisch relevante, toename in de proportie patiënten die IGA mod. 2011 0/1 bereikt ten opzichte van placebo. |
||||||||||||
|
Proportie patiënten met CDLQI 0/1 - 6 t/m 17 jaar oud [Bodemer, 2021] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
17/38 (44.7%) |
6/40 (15.0%) |
RR 2.98 |
|
⨁⨁◯◯ |
BELANGRIJK |
|
Conclusie: SEC-LD zou kunnen resulteren in klinisch relevante, toename in de proportie patiënten die IGA mod. 2011 0/1 bereikt ten opzichte van placebo. |
||||||||||||
CI: Confidence interval; RR: Risk ratio
Explanations
a. Kleine groep. SEC-L groep is n=40 of n=38
ADA-H vs. MTX
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Adalimumab |
MTX |
Relatief |
Absoluut |
||
|
Proportie patiënten met PASI 90 - 4 t/m 17 jaar oud [Papp, 2017] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga,b |
niet gevonden |
11/38 (29.0%) |
8/37 (21.6%) |
RR 1.34
|
⨁◯◯◯ |
CRUCIAAL |
|
|
Conclusie: de werkgroep is onzeker of ADA-H een toename geeft van de proportie patiënten die PASI 90 bereikt ten opzichte van MTX. |
||||||||||||
|
Proportie patiënten met PASI 75 - 4 t/m 17 jaar oud [Papp, 2017] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstigb,c |
niet gevonden |
22/38 (57.9%) |
12/37 (32.4%) |
RR 1.79 |
|
⨁⨁◯◯ |
CRUCIAAL |
|
Conclusie: ADA-H zou kunnen resulteren in een toename van de proportie patiënten die PASI 75 bereikt ten opzichte van MTX. |
||||||||||||
|
Proportie patiënten met PGA 0/1 - 4 t/m 17 jaar oud [Papp, 2017] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstigb,d |
niet gevonden |
23/38 (29.0%) |
15/37 (29.0%) |
RR 1.49 |
|
⨁◯◯◯ |
|
|
Conclusie: de werkgroep is onzeker of ADA-H een toename geeft van de proportie patiënten die PGA 0/1 bereikt ten opzichte van MTX. |
||||||||||||
CI: Confidence interval; RR: Risk ratio
Explanations
a. Op basis van CI zowel klinisch relevant voordeel als nadeel mogelijk betreft biologic t.o.v. MTX.
b. Kleine groep. Adalimumab groep is n=38
c. Mogelijk is verschil niet klinisch relevant (ondergrens CI).
d. Op basis van CI zowel klinisch relevant voordeel als geen effect mogelijk betreft biologic t.o.v. MTX.
SEC-LD vs. ETN
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Secukinumab |
Etanercept |
Relatief |
Absoluut |
||
|
Proportie patiënten met PASI 90 - 6 t/m 17 jaar oud [Bodemer, 2021] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
29/40 (72.5%) |
12/41 (29.3%) |
RR 2.48 |
⨁⨁◯◯ |
CRUCIAAL |
|
|
Conclusie: SEC-LD zou kunnen resulteren in een klinisch relevante toename in de proportie patiënten die PASI 90 bereikt ten opzichte van ETN. |
||||||||||||
|
Proportie patiënten met PASI 75 - 6 t/m 17 jaar oud [Bodemer, 2021] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga,b |
niet gevonden |
32/40 (80.0%) |
26/41 (63.4%) |
RR 1.26 |
|
⨁◯◯◯ |
CRUCIAAL |
|
Conclusie: de werkgroep is onzeker of SEC-LD een toename geeft van de proportie patiënten die PASI 75 bereikt ten opzichte van ETN. |
||||||||||||
|
Proportie patiënten met IGA mod. 2011 0/1 - 6 t/m 17 jaar oud [Bodemer, 2021] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
28/40 (70.0%) |
14/41 (34.2%) |
RR 2.05 |
|
⨁⨁◯◯ |
CRUCIAAL |
|
Conclusie: SEC-LD zou kunnen resulteren in een klinisch relevante toename in de proportie patiënten die IGA mod. 2011 0/1 bereikt ten opzichte van ETN. |
||||||||||||
|
Proportie patiënten met CDLQI 0/1 - 6 t/m 17 jaar oud [Bodemer, 2021] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga,c |
niet gevonden |
17/38 (44.7%) |
15/41 (36.6%) |
RR 1.22 |
|
⨁◯◯◯ |
BELANGRIJK |
|
Conclusie: de werkgroep is onzeker of SEC-LD een toename geeft van de proportie patiënten die CDLQI 0/1 bereikt ten opzichte van ETN. |
||||||||||||
CI: Confidence interval; RR: Risk ratio
Explanations
- Kleine groep. SEC-LD groep is n=40 of n=38
- Geen effect tot klinisch relevant voordeel mogelijk op basis van CI.
- Zowel klinisch relevant voordeel als nadeel mogelijk op basis van CI.
IXE vs. ETN (ernstige psoriasis)
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Ixekizumab |
Etanercept |
Relatief |
Absoluut |
||
|
Proportie patiënten met PASI 90 - 6 t/m 17 jaar oud [Paller, 2020] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga |
niet gevonden |
29/38 (76.3%) |
12/30 (40.0%) |
RR 1.91 |
⨁⨁◯◯ |
CRUCIAAL |
|
|
Conclusie: IXE zou kunnen resulteren in een klinisch relevante toename in de proportie patiënten met ernstige psoriasis die PASI 90 bereikt ten opzichte van ETN. |
||||||||||||
|
Proportie patiënten met PASI 75 - 6 t/m 17 jaar oud [Paller, 2020] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga,b |
niet gevonden |
32/38 (84.2%) |
19/30 (63.3%) |
RR 1.33 |
|
⨁◯◯◯ |
CRUCIAAL |
|
Conclusie: de werkgroep is onzeker of IXE een toename geeft van de proportie patiënten met ernstige psoriasis die PASI 75 bereikt ten opzichte van ETN. |
||||||||||||
|
Proportie patiënten met PGA 0/1 - 6 t/m 17 jaar oud [Paller, 2020] |
||||||||||||
|
1 |
gerandomiseerde trials |
niet ernstig |
niet ernstig |
niet ernstig |
zeer ernstiga,b |
niet gevonden |
29/38 (76.3%) |
16/30 (53.3%) |
RR 1.43 |
|
⨁◯◯◯ |
CRUCIAAL |
|
Conclusie: de werkgroep is onzeker of IXE een toename geeft van de proportie patiënten met ernstige psoriasis die IGA 0/1 bereikt ten opzichte van ETN. |
||||||||||||
CI: Confidence interval; RR: Risk ratio
Explanations
- Kleine groep. IXE groep is n=38
- Geen effect tot klinisch relevant voordeel mogelijk op basis van CI.
Biologics vs. controlegroep
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Biologics |
control |
Relatief |
Absoluut |
||
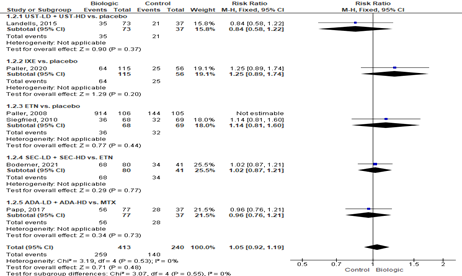
|
Adverse events (AE's) [Landell, 2015; Paller, 2020; Siegfried, 2010; Bodemer, 2021; Papp, 2017] |
||||||||||||
|
5 |
gerandomiseerde trials |
niet ernstig |
ernstiga |
niet ernstig |
niet ernstigb |
niet gevonden |
259/413 (62.7%) |
140/240 (58.3%) |
RR 1.05 |
29 meer per 1.000 |
⨁⨁⨁◯ |
BELANGRIJK |
|
Conclusie: biologics (UST, IXE, ETN, SEC, ADA) hebben waarschijnlijk geen effect op het aantal AE’s t.o.v. de controlegroep (placebo, ETN, MTX). |
||||||||||||
CI: Confidence interval; RR: Risk ratio
Explanations
a. Klinische heterogeniteit wegens verschillende controlegroepen (placebo 3x, MTX 1x en andere biologic 1x). De statistische heterogeniteit is echter I2=0%.
b. Etanercept vs. placebo (Paller, 2008) rapporteert bijwerkingen en de andere studies geven aantal patiënten met een bijwerking weer. Deze studie kon niet meegenomen worden in de meta-analyse.
Biologics vs. controlegroep
|
Certainty assessment |
Aantal patiënten |
Effect |
Certainty |
Importantie |
||||||||
|
Aantal studies |
Studieopzet |
Risk of bias |
Inconsistentie |
Indirect bewijs |
Onnauwkeurigheid |
Andere factoren |
Biologics |
control |
Relatief |
Absoluut |
||
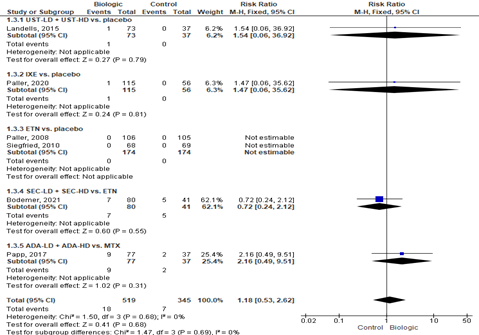
|
Serious AE's [Landell, 2015; Paller, 2020; Paller, 2008; Siegfried, 2010; Bodemer, 2021; Papp, 2017] |
||||||||||||
|
6 |
gerandomiseerde trials |
niet ernstig |
ernstiga |
niet ernstig |
zeer ernstigb |
niet gevonden |
18/519 (3.5%) |
7/345 (2.0%) |
RR 1.18 |
4 meer per 1.000 |
⨁◯◯◯ |
BELANGRIJK |
|
Conclusie: de werkgroep is onzeker over het effect van biologics (UST, IXE, ETN, SEC, ADA) op het aantal serious AE’s t.o.v. de controlegroep (placebo, ETN, MTX). |
||||||||||||
CI: Confidence interval; RR: Risk ratio
Explanations
a. Klinische heterogeniteit wegens verschillende controlegroepen (placebo 4x, MTX 1x en andere biologic 1x). De statistische heterogeniteit is echter I2=0%.
b. Op basis van CI zowel klinisch relevant voordeel als nadeel mogelijk betreft biologic t.o.v. placebo.
Samenvatting literatuur
Na titel en abstract beoordeling werden er 58 zoekresultaten over biologics voor de behandeling van kinderen met psoriasis geïdentificeerd. Er werden drie artikelen toegevoegd op basis van expert opinion. Op basis van full-tekst werden er van deze 61 publicaties 14 artikelen geïncludeerd. Specifieke redenen voor exclusie zijn beschreven in de exclusietabel.
Na full-tekst screening werden er initieel vijf primaire RCT’s geïdentificeerd [Bodemer, 2021; Landells, 2015; Paller, 2020; Paller, 2008; Papp, 2017] die allen worden besproken in de SR en NMA van Huang et al. [2022] welke is geïncludeerd voor risk of bias beoordeling en systematische literatuuranalyse middels GRADE betreft de effectiviteitsuitkomstmaten.
Betreft de veiligheidsuitkomstmaten werd gekozen voor de SR en NMA van Cai et al. [2022]. Deze SR rapporteert, in tegenstelling tot Huang et al. [2022], een uitgebreide AE-analyse. Echter, Cai et al. [2022] includeerde voor de NMA van de initiële placebogecontroleerde periode een studie die de (placebogecontroleerde) ‘withdrawal-retreatment’ periode van week 36 t/m week 48 rapporteerde [Siegfried, 2010] van een RCT waarvan de resultaten van de initiële placebogecontroleerde periode reeds geïncludeerd waren [Paller, 2008]. Dit werd door de werkgroep voor de AE-analyse wel bijdragend geacht maar voor de effectiviteitsanalyse zou dit bias induceren. Daarnaast werd ADA niet meegenomen in de effectiviteitsanalyse van NMA. Derhalve werd Cai et al. [2022] geïncludeerd voor risk of bias beoordeling en systematische literatuuranalyse middels GRADE betreft de veiligheidsuitkomstmaten.
Twee andere gevonden SR’s uit 2022 [Di Lernia, 2022; Sun, 2022] werden geëxcludeerd omdat deze reviews relatief minder Prevention Recovery Information System for Monitoring and Analysis (PRISMA)-items rapporteerden en daarnaast geen aanvullende RCT’s identificeerden. Enkele oudere systematisch reviews werden ook geëxcludeerd [Aslam, 2020; Duarte, 2017; Sanclemente, 2015; Van Geel, 2015].
De geïncludeerde studies betreft de lange termijn gegevens zijn globaal beschreven bij de overwegingen. Respectievelijk IXE, ETN, ETN en ADA [Paller, 2022; Paller, 2010; Paller, 2016; Thaçi, 2019]. Respectievelijk SEC en UST [Magnolo, 2022; Philipp, 2020].
Beschrijving van de studies
Huang et al. [2022] voerden een SR uit naar de effectiviteit en veiligheid van verschillende biologics voor de behandeling van matige tot ernstige psoriasis bij kinderen en adolescenten. De onderzoekers voerden voor de primaire uitkomstmaten een uit en includeerden alleen behandelingen die zijn goedgekeurd door de US FDA en/of de EMA. De behandelingen betroffen ETN, SEC, IXE, UST en ADA. De primaire uitkomsten van de studie waren de verbetering van PASI 90 en het stoppen van de behandeling vanwege bijwerkingen. Andere uitkomstmaten waren PGA 0/1 en CDLQI 0/1. Deze SR omvatte in totaal 798 deelnemers uit vijf RCT’s met een behandelperiode van 12 of 16 weken.
Cai et al. [2022] voerden een SR en meta-analyse uit van zes RCT’s. Ze analyseerden de gegevens uit deze onderzoeken om de effectiviteit van verschillende biologics en hun bijwerkingen te vergelijken. De specifieke biologics die in deze SR werden opgenomen waren SEC, IXE, ADA, UST en ETN. De onderzoekers beoordeelden het risico op bias in de opgenomen studies en vonden dat deze van hoge kwaliteit waren. Deze SR omvatte in totaal 864 deelnemers uit zes RCT’s met een behandelperiode van 12 of 16 weken. De geïncludeerde RCT’s vergeleken biologics met een placebo, met een andere biologic, of met MTX. De primaire uitkomsten van de SR waren PASI-75, AE’s en SAE’s. Deze uitkomstmaten (en een aantal specifieke AE’s) werden per uitkomstmaat middels meta-analyse vergeleken met elkaar. Er werd hiervoor gebruik gemaakt van de originele vergelijkingen uit de geïncludeerde RCT’s (bijvoorbeeld biologic vs. biologic, biologic vs. placebo). Aanvullend werd er een NMA verricht betreft de PASI-75, hierin werd ADA niet opgenomen.
Risk of bias
Voor beiden (netwerk) meta-analyses werd de risk of bias als ‘moderate’ beoordeeld. Er zijn enkele potentiële risico’s gevonden betreft ‘reden voor exclusie van geëxcludeerde studies’ en het ‘combineren van de studies voor (netwerk) meta-analyse’. Het eerste risico is waarschijnlijk niet reëel; er wordt verwezen naar de methode omtrent studieselectie maar we konden deze informatie niet traceren en inzien.
Voor de beoordeling middels GRADE werd bij elke uitkomstmaat en vergelijking opnieuw bekeken of de bovenstaande risico’s invloed zouden hebben op de kwaliteit van het bewijs; over het algemeen werd de risk of bias niet als een ernstige belemmering gezien op de kwaliteit van het bewijs.
Beschrijving van de resultaten
Met als doel de werkzaamheid van door de FDA en EMA goedgekeurde behandelingsregimes van biologische middelen voor pediatrische psoriasis te evalueren, werden door de werkgroep in de originele studies en in de NMA an Huang et al. [2022] alleen ETN, SEC-LD, UST, IXE en ADA-H, in vergelijking met een placebogroep, opgenomen.
Effectiviteit – PASI
Biologic vs. placebo
Voor PASI 75 en PASI 90 werden, o.b.v. de originele studies [Bodemer, 2021; Landells, 2015; Paller, 2020; Paller, 2008] significante en klinisch relevant hogere responsen gevonden voor alle biologics t.o.v. placebo na 12 behandelweken. Echter, voor ADA-H kon dit niet worden beoordeeld omdat in deze studie met MTX werd vergeleken [Papp, 2017].
In de NMA [Huang, 2022] vertoonden alle (inclusief ADA-H) behandelingsregimes met biologics een klinisch significant hogere respons van PASI 90 na 16 behandelweken in vergelijking met placebo.
ADA-H vs. MTX
Voor PASI 75 vertoonde ADA-H een significant voordeel boven MTX. Betreft PASI 90 vertoonde ADA-H géén significant verschil t.o.v. MTX [Papp, 2017]. Deze vergelijking was géén onderdeel van de (netwerk) meta-analyse.
Biologic vs. biologic
Er werd betreft PASI 75 geen significant verschil gevonden tussen SEC-LD vs. ETN [Bodemer, 2021] en IXE vs. ETN [Paller, 2020]. Betreft PASI 90 had zowel SEC-LD als IXE significant en klinisch relevant, betere uitkomsten dan ETN. De NMA [Huang, 2022] vond geen andere significante verschillen tussen de biologics voor deze uitkomstmaat (PASI 90). PASI 75 was geen uitkomstmaat in de NMA.
Effectiviteit - PGA 0/1
Biologic vs. placebo
Voor PGA 0/1 werd, o.b.v. de originele studies [Landells, 2015; Paller, 2020; Paller, 2008], significante en klinisch relevant hogere responsen gevonden voor alle biologics t.o.v. placebo na 12 behandelweken. Echter, voor ADA-H kon dit niet worden beoordeeld (Papp, 2017). NB. Voor SEC-LD vs. placebo werd de IGA mod 2011 0 of 1 score gebruikt.
In de NMA [Huang, 2022] vertoonden alle (inclusief ADA-H; NMA zonder SEC) behandelingsregimes met biologics een klinisch significant hogere respons van PASI 90 na 16 behandelweken in vergelijking met placebo.
ADA-H vs. MTX
Voor PGA 0/1 vertoonde ADA-H geen significant voordeel boven MTX [Papp, 2017]. Deze vergelijking was géén onderdeel van de NMA.
Biologic vs. biologic
Wat betreft PGA 0/1 toonde IXE geen significant betere resultaten dan ETN voor patiënten met ernstige psoriasis in de initiële RCT [Paller, 2020]. SEC-LD toonde wel significant betere resultaten dan ETN [Bodemer, 2021]. NB. Voor SEC-LD vs. ETN werd de IGA mod 2011 0 of 1 score gebruikt.
De NMA [Huang, 2022] toonde wel een significant verschil in PGA 0/1 aan voor IXE vs. ETN maar maakte geen correcte vergelijking (verkeerde placebogroep). Voor de andere vergelijkingen tussen de biologics werden geen significante verschillend gevonden tussen PGAs (NMA zonder SEC-LD); deze vergelijkingen werden wél correct gemaakt.
Kwaliteit van leven - CDLQI 0/1
In Paller et al. (2008) (ETN) en Papp et al. [2017] (ADA-H) werd de ‘gemiddelde verandering in CDLQI t.o.v van baseline’ als uitkomstmaat gerapporteerd. Deze uitkomstmaat is niet meegenomen.
Biologic vs. placebo
ETN, UST-SD, IXE en SEC-LD vertoonden een significant hogere respons op CDLQI 0/1 in vergelijking met placebo [Bodemer, 2021; Landells, 2015; Paller, 2020].
Dit is conform de NMA [Huang, 2022].
Biologic vs. biologic
Er werd betreft CDLQI 0/1 geen significant verschil gevonden tussen SEC-LD vs. ETN [Bodemer, 2021]. De NMA vond geen significante verschillen tussen de biologics betreft CDLQI 0/1 [Huang, 2022].
Veiligheid – AE’s en serious AE’s
Voor analyse van het totaal aantal AE’s en het totaal aantal serious AE’s t.o.v. de controlegroep werden de volgende vergelijkingen bekeken door Cai et al. [2022]: UST-LD en UST-HD vs. placebo, IXE vs. placebo, ETN vs. placebo, SEC-LD + SEC-HD vs. ETN, ADA-LD + ADA-H vs. MTX. Geen van de vergelijkingen had een significant verschil, zowel per vergelijking als de meta-analyse, voor beiden uitkomstmaten.
Cai et al. [2022] keek ook nog naar verschillende soorten bijwerkingen. Veel voorkomende bijwerkingen bij kinderen en adolescenten die biologics kregen waren bovenste luchtweginfecties (waaronder nasofaryngitis [significant voor ETN vs. placebo], rinitis, en streptokokken faryngitis) andere infecties (waaronder gastro-intestinale infecties en influenza), hoesten, misselijkheid en braken, en hoofdpijn [significant voor ETN vs. placebo] [Cai, 2022].
Betreft bijwerkingen van speciale interesse kwamen injectieplaatsreacties meer voor in de interventiegroepen evenals ernstige infecties, maar dit verschil was niet significant t.o.v. de controlegroepen in de initiële RCT’s betreft alle besproken biologics [Cai, 2022]. Er werden twee gevallen gerapporteerd van een Candida-infectie bij patiënten die behandeld werden met SEC (2,5%). Er werd één geval beschreven met de ziekte van Crohn in de IXE groep (0,9%) [Cai, 2022].
Zoeken en selecteren
Om de uitgangsvraag te beantwoorden is een systematische literatuuranalyse uitgevoerd. Voor dit onderzoek is de volgende PICO opgesteld:
| Voor de P: | Kinderen/adolescenten van 0 tot 18 jaar met milde, matige of ernstige psoriasis vulgaris |
| Voor de I: | Voor kinderen en adolescenten geregistreerde biologics (etanercept, adalimumab, ustekinumab, ixekizumab en secukinumab) |
| Voor de C: | Geen behandeling, placebo, concentionele systemische therapie of bovenstaande biologics met elkaar vergeleken |
| Voor de O: | Zie onderstaand |
De werkgroep definieerde de uitkomstmaten als volgt en hanteerde de in de studies gebruikte definities.
Cruciaal
- Effectiviteit na 2 weken, 12-16 weken en ≥24 weken weergegeven met PASI of PGA (zoals in studies)
- Jeuk (zoals gerapporteerd in de studie)
Belangrijk
- Bijwerkingen
- kwaliteit van leven ((C)DLQI)
- kosteneffectiviteit
- Drug survival
Er werd een systematische zoekstrategie uitgevoerd in de elektronische databases Embase en Medline. Studies werden geïncludeerd wanneer deze overeenkwamen met de elementen van de PICO en aan de volgende in- en exclusiecriteria voldeden:
|
Inclusiecriteria |
Exclusiecriteria |
|
Vergelijkend onderzoek (RCT’s en CCT’s of systematic reveviews van RCT’s of CCT’s) |
Case studies/series |
|
Volledige tekst beschikbaar in Nederlands of Engels |
Non-systematic reviews |
|
Real world data studies (alleen de prospectieve cohorten)
|
|
|
Observationele studies
|
|
Referenties
- * AWMF. (2021). S2k-leitlinie (013-094). Therapie der Psoriasis bei Kindern und Jugendlichen.
- * Aslam, N., Saleem, H., Murtazaliev, S., Quazi, S. J., & Khan, S. (2020). FDA Approved Biologics: Can Etanercept and Ustekinumab be Considered a First-Line Systemic Therapy for Pediatric/Adolescents in Moderate to Severe Psoriasis? A Systematic Review. Cureus, 12(8), e9812. doi:doi:
- * Blair, H. A. (2021). Secukinumab: A Review in Moderate to Severe Pediatric Plaque Psoriasis. Pediatric Drugs, 23(6), 601-608. doi:doi:10.1007/s40272-021-00476-w
- * Bodemer, C., Kaszuba, A., Kingo, K., Tsianakas, A., Morita, A., Rivas, E., . . . Papavassilis, C. (2021). Secukinumab demonstrates high efficacy and a favourable safety profile in paediatric patients with severe chronic plaque psoriasis: 52-week results from a Phase 3 double-blind randomized, controlled trial. Journal of the European Academy of Dermatology and Venereology, 35(4), 938-947. doi:doi:10.1111/jdv.17002
- * Bruins, F. M., Van Acht, M. R., Bronckers, I., Groenewoud, H. M. M., De Jong, E., & Seyger, M. M. B. (2022). Real-world Methotrexate Use in a Prospective Cohort of Paediatric Patients with Plaque Psoriasis: Effectiveness, Adverse Events and Folic Acid Regimen. Acta Derm Venereol, 102, adv00745. doi:10.2340/actadv.v102.1000
- * Cai, X. C., Ru, Y., Liu, L., Sun, X. Y., Zhou, Y. Q., Luo, Y., . . . Li, X. (2022). Efficacy and safety of biological agents for the treatment of pediatric patients with psoriasis: A bayesian analysis of six high-quality randomized controlled trials. Frontiers in Immunology, 13. doi:doi:10.3389/fimmu.2022.896550
- * Di Lernia, V., Macca, L., Peterle, L., Ingrasciotta, Y., Trifirò, G., & Guarneri, C. (2022). Efficacy of Systemic Biologic Drugs in Pediatric Psoriasis: Evidence From Five Selected Randomized Clinical Trials. Frontiers in Pharmacology, 13. doi:doi:10.3389/fphar.2022.847308
- * Duarte, A., Mebrahtu, T., Goncalves, P. S., Harden, M., Murphy, R., Palmer, S., . . . Rothery, C. (2017). Adalimumab, etanercept and ustekinumab for treating plaque psoriasis in children and young people: Systematic review and economic evaluation. Health Technology Assessment, 21(64), 1-243. doi:doi:10.3310/hta21640
- * Farmacotherapeutisch Kompas (2024a), Zorginstituut Nederland, secukinumab. Available at: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/s/secukinumab (Accessed: 28 August 2024).
- * Farmacotherapeutisch Kompas (2024b), Zorginstituut Nederland, ixekizumab. Available at: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/i/ixekizumab (Accessed: 28 August 2024).
- * Farmacotherapeutisch Kompas (2024c), Zorginstituut Nederland, ustekinumab. Available at: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/u/ustekinumab (Accessed: 28 August 2024).
- * Farmacotherapeutisch Kompas (2024d), Zorginstituut Nederland, adalimumab. Available at: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/a/adalimumab (Accessed: 28 August 2024).
- * Farmacotherapeutisch Kompas (2024e), Zorginstituut Nederland, etanercept. Available at: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/e/etanercept (Accessed: 28 August 2024).
- * Finlay, A. Y. (2005). Current severe psoriasis and the rule of tens. Br J Dermatol, 152(5), 861-867. doi:10.1111/j.1365-2133.2005.06502.x
- * Golhen, K., Winskill, C., Theiler, M., Buettcher, M., Yeh, Y. H., Zhang, N., . . . Pfister, M. (2022). Understanding efficacy-safety balance of biologics in moderate-to-severe pediatric psoriasis. Frontiers in Medicine, 9. doi:doi:10.3389/fmed.2022.944208
- * Huang, I. H., Yu, C. L., Tai, C. C., Tu, Y. K., & Chi, C. C. (2022). Biologics for pediatric moderate-to-severe plaque psoriasis: a systematic review and network meta-analysis. JDDG - Journal of the German Society of Dermatology, 20(9), 1201-1209. doi:doi:10.1111/ddg.14832
- * Landells, I., Marano, C., Hsu, M. C., Li, S., Zhu, Y., Eichenfield, L. F., . . . Randazzo, B. (2015). Ustekinumab in adolescent patients age 12 to 17 years with moderate-to-severe plaque psoriasis: results of the randomized phase 3 CADMUS study. Journal of the American Academy of Dermatology, 73(4), 594-603. doi:doi:
- * Langley, R. G., Paller, A. S., Hebert, A. A., Creamer, K., Weng, H. H., Jahreis, A., . . . Orlow, S. J. (2011). Patient-reported outcomes in pediatric patients with psoriasis undergoing etanercept treatment: 12-week results from a phase III randomized controlled trial. Journal of the American Academy of Dermatology, 64(1), 64-70. doi:doi:10.1016/j.jaad.2010.02.060
- * Magnolo, N., Kingo, K., Laquer, V., Browning, J., Reich, A., Szepietowski, J. C., . . . Patekar, M. (2022). Efficacy of Secukinumab Across Subgroups and Overall Safety in Pediatric Patients with Moderate to Severe Plaque Psoriasis: Week 52 Results from a Phase III Randomized Study. Paediatr Drugs, 24(4), 377-387. doi:10.1007/s40272-022-00507-0
- * Menter, A., Cordoro, K. M., Davis, D. M. R., Kroshinsky, D., Paller, A. S., Armstrong, A. W., . . . Elmets, C. A. (2020). Joint American Academy of Dermatology-National Psoriasis Foundation guidelines of care for the management and treatment of psoriasis in pediatric patients. J Am Acad Dermatol, 82(1), 161-201. doi:10.1016/j.jaad.2019.08.049
- * Paller, A. S., Seyger, M. M. B., Alejandro Magariños, G., Bagel, J., Pinter, A., Cather, J., . . . Papp, K. (2020). Efficacy and safety of ixekizumab in a phase III, randomized, double-blind, placebo-controlled study in paediatric patients with moderate-to-severe plaque psoriasis (IXORA-PEDS). Br J Dermatol, 183(2), 231-241. doi:10.1111/bjd.19147
- * Paller, A. S., Seyger, M. M. B., Magariños, G. A., Pinter, A., Cather, J. C., Rodriguez-Capriles, C., . . . Papp, K. A. (2022). Long-term Efficacy and Safety of Up to 108 Weeks of Ixekizumab in Pediatric Patients With Moderate to Severe Plaque Psoriasis: The IXORA-PEDS Randomized Clinical Trial. JAMA Dermatology, 158(5), 533-541. doi:doi:10.1001/jamadermatol.2022.0655
- * Paller, A. S., Siegfried, E. C., Eichenfield, L. F., Pariser, D., Langley, R. G., Creamer, K., & Kricorian, G. (2010). Long-term etanercept in pediatric patients with plaque psoriasis. Journal of the American Academy of Dermatology, 63(5), 762-768. doi:doi:10.1016/j.jaad.2010.04.004
- * Paller, A. S., Siegfried, E. C., Langley, R. G., Gottlieb, A. B., Pariser, D., Landells, I., . . . Jahreis, A. (2008). Etanercept Treatment for Children and Adolescents with Plaque Psoriasis. New England Journal of Medicine, 358(3), 241-251. doi:doi:10.1056/NEJMoa066886
- * Paller, A. S., Siegfried, E. C., Pariser, D. M., Rice, K. C., Trivedi, M., Iles, J., . . . Langley, R. G. (2016). Five-year open-label extension study of safety and efficacy of etanercept in children and adolescents with moderate to severe plaque psoriasis. Journal of the American Academy of Dermatology, 74(5), AB251. doi:doi:
- * Papp, K., Thaçi, D., Marcoux, D., Weibel, L., Philipp, S., Ghislain, P. D., . . . Williams, D. (2017). Efficacy and safety of adalimumab every other week versus methotrexate once weekly in children and adolescents with severe chronic plaque psoriasis: a randomised, double-blind, phase 3 trial. The Lancet, 390(10089), 40-49. doi:doi:10.1016/S0140-6736(17)31189-3
- * Philipp, S., Menter, A., Nikkels, A. F., Barber, K., Landells, I., Eichenfield, L. F., . . . Paller, A. S. (2020). Ustekinumab for the treatment of moderate-to-severe plaque psoriasis in paediatric patients (? 6 to < 12 years of age): efficacy, safety, pharmacokinetic and biomarker results from the open-label CADMUS Jr study. Br J Dermatol, 183(4), 664-672. doi:10.1111/bjd.19018
- * Sanclemente, G., Murphy, R., Contreras, J., García, H., & Bonfill Cosp, X. (2015). Anti-TNF agents for paediatric psoriasis. Cochrane Database of Systematic Reviews, 2015(11). doi:doi:10.1002/14651858.CD010017.pub2
- * Schneeweiss, M. C., Savage, T. J., Wyss, R., Jin, Y., Schoder, K., Merola, J. F., . . . Glynn, R. J. (2023). Risk of Infection in Children With Psoriasis Receiving Treatment With Ustekinumab, Etanercept, or Methotrexate Before and After Labeling Expansion. JAMA Dermatology, 8, 08. doi:doi:
- * Siegfried, E. C., Eichenfield, L. F., Paller, A. S., Pariser, D., Creamer, K., & Kricorian, G. (2010). Intermittent etanercept therapy in pediatric patients with psoriasis. Journal of the American Academy of Dermatology, 63(5), 769-774. doi:doi:10.1016/j.jaad.2009.10.046
- * Strober, B., Ryan, C., van de Kerkhof, P., van der Walt, J., Kimball, A. B., Barker, J., & Blauvelt, A. (2020). Recategorization of psoriasis severity: Delphi consensus from the International Psoriasis Council. J Am Acad Dermatol, 82(1), 117-122. doi:10.1016/j.jaad.2019.08.026
- * Sun, H. Y., Phan, K., Paller, A. S., & Sebaratnam, D. F. (2022). Biologics for pediatric psoriasis: A systematic review and meta-analysis. Pediatric Dermatology, 39(1), 42-48. doi:doi:10.1111/pde.14870
- * Thaçi, D., Papp, K., Marcoux, D., Weibel, L., Pinter, A., Ghislain, P. D., . . . Philipp, S. (2019). Sustained long-term efficacy and safety of adalimumab in paediatric patients with severe chronic plaque psoriasis from a randomized, double-blind, phase III study. British Journal of Dermatology, 181(6), 1177-1189. doi:doi:10.1111/bjd.18029
- Van Geel, M. J., Mul, K., De Jager, M. E. A., Van De Kerkhof, P. C. M., De Jong, E. M. G. J., & Seyger, M. M. B. (2015). Systemic treatments in paediatric psoriasis: A systematic evidence-based update. Journal of the European Academy of Dermatology and Venereology, 29(3), 425-437. doi:doi:10.1111/jdv.12749
Evidence tabellen
Overzicht van geëxcludeerde studies
|
Artikel |
Reden van exclusie |
|
Geen auteur, 2008 (Etanercept reduces plaque psorisasis. Australian Journal of Pharmacy 2008;89:84.)
|
Artikel niet gevonden |
|
Amin, 2017 |
Non-systematic review/ focus op volwassenen |
|
Aslam, 2020 |
SR niet bijdragend |
|
Bard, 2010 |
Non-systematic review |
|
Blair, 2021 |
Niet bijdragend |
|
Blauvelt, 2017 |
Verkeerde populatie |
|
Bodemer, 2021 (2) |
Duplicaat |
|
Bodemer, 2021 (3) |
Duplicaat |
|
Cather, 2021 |
Expert opinion |
|
Cline, 2019 |
Non-systematic review |
|
De Vries, 2017 |
Verkeerde populatie |
|
Di Lernia, 2022 |
SR niet bijdragend |
|
Duarte, 2017 |
SR niet bijdragend |
|
Ellis, 2019 |
Verkeerde populatie |
|
Fessler, 2009 |
Artikel niet gevonden |
|
Foulkes, 2018 |
Non-systematic review/ Te brede scope |
|
Golhen, 2022 |
Niet bijdragend |
|
Gottlieb, 2003 |
Verkeerde populatie |
|
Gottlieb, 2022 |
Verkeerde populatie |
|
Iversen, 2018 |
Verkeerde populatie |
|
Kaszuba, 2020 |
Journal abstract |
|
Landells, 2010 |
Artikel niet gevonden (waarschijnlijk enkel abstract) |
|
Landells, 2015 (2) |
Duplicaat |
|
Langley, 2011 |
Niet bijdragend |
|
Marji, 2010 |
Non-systematic review |
|
Menter, 2009 |
Verkeerde populatie |
|
Paller, 2010 (2) |
Journal abstract |
|
Paller, 2010 (3) |
Journal abstract |
|
Paller, 2022 (1) |
Journal abstract |
|
Pan, 2022 |
Verkeerde populatie |
|
Papp, 2005 |
Verkeerde populatie |
|
Papp, 2013 |
Journal abstract |
|
Papp, 2014 |
Journal abstract |
|
Papp, 2016 (1) |
Journal abstract |
|
Papp, 2016 (2) |
Duplicaat |
|
Philipp, 2015 |
Conference paper |
|
Philipp, 2017 |
Artikel niet gevonden |
|
Reich, 2017 |
Verkeerde populatie |
|
Samtsov, 2022 |
Verkeerde populatie |
|
Sanclemente, 2015 |
Review niet bijdragend |
|
Schneeweiss, 2022 |
Artikel niet gevonden |
|
Schneeweiss, 2023 |
Niet bijdragend |
|
Seyger, 2021 |
Poster presentation |
|
Sun, 2022 |
SR niet bijdragend |
|
Thaçi, 2017 |
Artikel niet gevonden |
|
Van Geel, 2015 |
Review niet bijdragend |
|
Young, 2011 |
Verkeerde populatie |
Risico op bias tabellen
Beoordeling risk of bias door middel van AMSTAR.
|
Study reference
(first author, publication year) |
Appropriate and clearly focused question?
Yes/no |
Comprehensive and systematic literature search?
Yes/partial yes/ no |
Description of included and excluded studies?
Yes/partial yes/ no |
Description of relevant characteristics of included studies?
Yes/partial yes/no |
Assessment of scientific quality of included studies?
Yes/partial yes/no |
Enough similarities between studies to make combining them reasonable?
Yes/partial yes/ no |
Potential risk of publication bias taken into account?
Yes/partial yes/ no |
Potential conflicts of interest reported?
Yes/partial yes/ no |
Rating overall confidence in the results of the systematic review |
|
|
|||||||||
|
Huang, 2022 |
Yes |
Yes |
Partial yes |
Yes |
Yes |
Partial yes |
Yes |
Yes |
Moderate
(more than one non-critical weakness) |
|
Cai, 2022 |
Yes |
Yes |
Partial yes |
Yes |
Yes |
Partial yes |
Yes |
Yes |
Moderate
(more than one non-critical weakness) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 20-02-2025
Beoordeeld op geldigheid : 22-11-2024
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep grotendeels in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update).
De Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) is regiehouder van deze richtlijn psoriasis en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Aanleiding en afbakening onderwerp
Op initiatief van de Nederlandse Vereniging voor Dermatologie en Venereologie is de richtlijn psoriasis in de periode 2023-2024 modulair herzien. Deze herziening betreft overwegend de toevoeging van nieuwe modules met klinische relevante onderwerpen welke ontbraken of toe waren aan herziening: screening, topicale middelen, nieuwe biologics, dosisreductie van biologics, biologics voor kinderen/adolescenten en ouderen en voorlichting voor patiënten.
Tabel 1: Overzicht betrokken partijen modulaire herziening psoriasis 2023-2024
|
Overzicht betrokken partijen Psoriasis 2023-2024* |
Zitting neming in werkgroep |
Knelpunten analyse |
Commentaarfase |
Autorisatie |
Opmerkingen |
|
Wetenschappelijke verenigingen |
|||||
|
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Psychiatrie (NVVP) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Kindergeneeskunde (NVK) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Reumatologie (NVR) |
X |
X |
X |
X |
|
|
Nederlandse Internisten Vereniging (NIV) |
|
X |
X |
|
Geen knelpunten aangeleverd |
|
Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) |
|
X |
X |
|
Geen knelpunten aangeleverd |
|
Nederlandse Vereniging van Ziekenhuisapothekers (NVZA) |
|
|
X |
X |
|
|
Overige organisaties |
|
|
|
|
|
|
Nederlands Huisartsen Genootschap (NHG) |
X |
X |
X |
X |
Module screening |
|
Verpleegkundigen & Verzorgenden Nederland (V&VN) |
X |
X |
X |
X |
Geen knelpunten aangeleverd |
|
Nederlandse Vereniging Huidtherapeuten (NVH) |
X |
X |
X |
X |
Geen knelpunten aangeleverd |
|
Nederlandse Associatie Physsian Assistants (NAPA) |
|
X |
|
|
Geen knelpunten aangeleverd Ondanks herhaalde herinneringen geen reactie op de vraag om extern commentaar. |
|
Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP) |
|
|
X |
|
|
|
Nederlands Kenniscentrum voor Farmacotherapie bij Kinderen (NKFK) |
|
|
|
|
Ondanks herhaalde herinneringen geen reactie op de vraag om extern commentaar. |
|
Patiëntenverenigingen |
|||||
|
Psoriasispatiënten Nederland (PN) |
X |
X |
X |
X |
|
|
Huid Nederland (HN) |
|
|
|
|
Ondanks herhaalde herinneringen geen reactie op de vraag om extern commentaar. |
|
Stakeholders |
|||||
|
Nederlandse Vereniging Ziekenhuizen (NVZ) |
|
X |
X |
|
Knelpunten schriftelijk aangeleverd |
|
Zorgverzekeraars Nederland (ZN) |
|
X
|
X |
|
Knelpunten schriftelijk aangeleverd |
|
Zorginstituut Nederland (ZiN) |
|
X
|
X |
|
Knelpunten schriftelijk aangeleverd |
|
Vereniging Innovatieve Geneesmiddelen (VIG) |
|
X
|
X |
|
|
|
Inspectie Gezondheidszorg en Jeugd (IGJ) |
|
|
X |
|
Afgemeld voor knelpunten |
|
Nederlandse Federatie van Universitair Medische Centra (NFU) |
|
|
|
|
Ondanks herhaalde herinneringen geen reactie op de vraag om extern commentaar. |
*alle partijen werden uitgenodigd voor de knelpuntenanalyse (invitational conference) en de commentaarfase.
Deelname aan de werkgroep en autorisatie wordt enkel aan de wetenschappelijke verenigingen, patiëntenverenigingen en overige organisaties voorgelegd.
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. De richtlijn geeft aanbevelingen over begeleiding en behandeling van patiënten met psoriasis.
Doelgroep
De richtlijn is bestemd voor leden van de medische en paramedische beroepsgroep. Daartoe behoren onder andere: Dermatologen, verpleegkundig specialisten, physcian assistants, huidtherapeuten. Secundair kan de richtlijn nuttig zijn voor kinderartsen, reumatologen, geriaters, huisartsen en apothekers. Voor patiënten werd informatie op thuisarts.nl en een patiënten folder ontwikkeld.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld. Bij het samenstellen van de werkgroep werd rekening gehouden met de geografische spreiding van de werkgroepleden en met een evenredige vertegenwoordiging van academische en niet-academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel lid ontving gunsten met het doel de richtlijnen te beïnvloeden. Naast de afgevaardigden van de verschillende beroepsgroepen is er ook een patiëntenvertegenwoordiger betrokken geweest bij de ontwikkeling van de richtlijn. Voor een volledig overzicht van voorgaande werkgroepen en alle betrokken partijen wordt verwezen naar tabel 1.
|
Werkgroepleden |
Vereniging |
|
Dhr. Dr. E.M. Baerveldt, dermatoloog (voorzitter) |
NVDV |
|
Mw. Prof. Dr. E.M.G.J. de Jong, dermatoloog |
NVDV |
|
Mw. Dr. M. Seyger, (kinder)dermatoloog |
NVDV |
|
Mw. Dr. J. van den Reek, wetenschappelijk onderzoeker |
NVDV |
|
Mw. Dr. L. van der Schoot, arts in opleiding tot dermatoloog |
NVDV |
|
Mw. Drs. C.A.M van Riel, PhD-kandidaat (vanaf januari 2023) |
NVDV |
|
Mw. Drs. N. Henckens, PhD-kandidaat (vanaf januari 2024) |
NVDV |
|
Mw. Dr. F.M. Bruins, arts in opleiding tot dermatoloog |
NVDV |
|
Mw. Dr. I.M.G.J. Broncker, dermatoloog |
NVDV |
|
Dhr. Dr. W.P. Arnold, dermatoloog (tot maart 2024) |
NVDV |
|
Mw. Drs. E. ter Haar, PhD-kandidaat |
NVDV |
|
Dhr. Dr. L.G.J.M. Plusjé, dermatoloog |
NVDV |
|
Dhr. Dr. D.M.W. Balak, dermatoloog |
NVDV |
|
Dhr. Dr. H.B. Thio, dermatoloog |
NVDV |
|
Dhr. Dr. S. Dieleman, psychiater |
NVVP |
|
Mw. Dr. E.J.H. Schatorjé, kinderreumatoloog |
NVK |
|
Mw. Drs. E. Hoppenreijs, kinderreumatoloog |
NVK |
|
Dhr. Dr. F.A. van Gaalen, reumatoloog |
NVR |
|
Mw. K. Sterkenburg, huidtherapeut |
NVH |
|
Mw. I. Laffra, verpleegkundig specialist |
V&VN |
|
Dhr. Drs. W. Eizenga, huisarts |
NHG |
|
Mw. I. van Ee, patiëntvertegenwoordiger |
PN |
|
Mw. F. van Oort, patiëntvertegenwoordiger |
PN |
|
Ondersteuning werkgroep |
Vereniging |
|
Dhr. Drs. M.O. Hoogeveen, arts-onderzoeker (vanaf januari 2023) |
NVDV |
|
Mw. Drs. D.S. Adams, arts-onderzoeker (vanaf maart 2023) |
NVDV |
|
Mw. Drs. T. M. Nlgisang, arts-onderzoeker (vanaf november 2023) |
NVDV |
|
Mw. Drs. T. A. Teunissen, arts-onderzoeker (vanaf oktober 2024) |
NVDV |
|
Mw. Drs. L.J. van den Oord, arts-onderzoeker (vanaf april 2024) |
NVDV |
|
Mw. Dr. W.A. van Enst, klinisch epidemioloog & directeur NVDV |
NVDV |
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de Nederlandse Vereniging voor Dermatologie en Venereologie.
|
Werkgroepleden |
Hoofdfunctie(s) |
Nevenfunctie(s) |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Dhr. Dr. E.M. Baerveldt (voorzitter) |
Dermatoloog Ijsselland ziekenhuis, SkinTwin |
NVDV: |
Geen |
Geen |
Geen |
Geen |
Geen |
3-11-2022 |
Geen |
|
Mw. Prof. Dr. E.M.G.J. de Jong |
Dermatoloog, Radboud UMC |
zie verder bij extern gefinancierd onderzoek |
Geen |
Geen |
heeft onderzoeksbeurzen ontvangen voor het onafhankelijke onderzoeksfonds van de afdeling dermatologie van het Radboud universitair medisch centrum Nijmegen, Nederland van AbbVie, BMS, Janssen Pharmaceutica, Leo Pharma, Lilly, Novartis, en UCB voor onderzoek naar psoriasis. heeft opgetreden als consultant en/of betaalde spreker en/of deelgenomen aan onderzoek gesponsord door bedrijven die medicijnen produceren voor de behandeling van psoriasis of eczeem, waaronder AbbVie, Amgen, Almirall, Boehringer-Ingelheim, Celgene, Galapagos, Janssen Pharmaceutica, Lilly, Novartis, Leo Pharma, Sanofi en UCB. Alle financiering is niet persoonlijk, maar gaat direct naar de instelling (Radboudumc). |
Geen |
Geen |
23-11-2022 |
Geen |
|
Mw. Dr. M. Seyger |
Dermatoloog, Radboud UMC |
Geen |
Geen |
Geen |
Onderzoeksgrant Janssen (2020): Unmet needs regarding treatment in young people with psoriasis |
Geen |
Geen |
31-10-2022 |
Geen |
|
Mw. Dr. J. van den Reek |
Dermatoloog, Radboud UMC |
1. Adviseur psoriasis blad, Psoriasispatiënten Nederland (onbetaald) |
Geen |
Geen |
Heeft klinische onderzoeken uitgevoerd voor AbbVie, Celgene, Almirall en Janssen. Alle financiering is niet persoonlijk, maar gaat naar het onafhankelijke onderzoeksfonds van de afdeling dermatologie van Radboudumc Nijmegen.
Ontving studiebeurzen van ZonMw voor studies over doseringsverlaging van biologics . heeft vergoedingen voor voordrachten ontvangen/deelgenomen aan adviesraden van AbbVie, Janssen, BMS, Almirall, LEO Pharma, Novartis, UCB en Eli Lilly en vergoeding voor het bijwonen van een symposium van Janssen, Pfizer, Celgene en AbbVie (voorzitter). Alle financiering is niet persoonlijk, maar gaat naar het onafhankelijke onderzoeksfonds van de afdeling dermatologie van Radboudumc Nijmegen.
|
Geen |
Geen |
6-9-2022 |
Geen |
|
Mw. Dr. L. van der Schoot |
Arts in opleiding tot dermatoloog, Radboud UMC |
Geen |
Geen |
Geen |
Uitvoeren van trials voor Janssen en Novartis en ontvangen sprekersvergoeding van Janssen en Eli Lilly. Alle financiering was onpersoonlijk en werd uitbetaald aan het onafhankelijke onderzoeksfonds van de afdeling dermatologie van het Radboudumc. |
Mogelijk 'Bescherming van de eigen reputatie/positie, positie van de werkgever of andere belangenorganisaties of verwerven van erkenning' vanwege promotieonderzoek op het gebied van behandeling van psoriasis met biologics, specifiek dosisreductie van biologics. |
Geen |
5-9-2022 |
Geen |
|
Mw. Drs. C.A.M van Riel |
Arts-onderzoeker, PhD-kandidaat Dermatologie Radboud UMC |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
5-3-2024 |
Geen |
|
Mw. Drs. N. Henckens, |
Arts-onderzoeker, PhD-kandidaat Dermatologie Radboud UMC. Onderzoek naar patiënten met psoriasis die behandeld worden middels biologicals (BioCAPTURE registry). |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
21-12-2023 |
Geen |
|
Mw. Dr. F.M. Bruins |
Arts in opleiding tot dermatoloog, Radboud UMC |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
7-9-2022 |
Geen |
|
Mw. Dr. I.M.G.J. Broncker |
Dermatoloog, Rijnstate |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
13-9-2022 |
Geen |
|
Dhr. Dr. W.P. Arnold |
Dermatoloog, Gelderse Vallei en Psoriasis dagcentrum Ede |
1. Lid cie Kwaliteit ZKH Gelderse Vallei (ZGV) |
Mede-eigenaar Psoriasis dagcentrum Ede |
Geen |
Geen |
Geen |
Geen |
7-9-2022 |
Geen |
|
Mw. Drs. E. ter Haar |
Arts-onderzoeker, PhD-kandidaat Dermatologie Radboud UMC |
Geen |
Geen |
Geen |
Uitvoeren van investigator-intiated research met financiele steun van Almirall en het uitvoeren van trials voor Novartis. Alle financiering was onpersoonlijk en werd uitbetaald aan het onafhankelijke onderzoeksfonds van de afdeling dermatologie van het Radboudumc. |
Mogelijk 'Bescherming van de eigen reputatie/positie, positie van de werkgever of andere belangenorganisaties of verwerven van erkenning' vanwege promotieonderzoek op het gebied van psoriasis bij de oudere patiënt. |
Geen |
12-9-2022 |
Geen |
|
Dhr. Dr. L.G.J.M. Plusjé |
Dermatoloog Rode Kruis ziekenhuis Beverwijk en |
Centrum voor Lipoedeem. Behandeling van patiënten met lipoedeem. Betreft niet-verzekerde zorg |
Geen |
Geen |
Geen |
Geen |
Geen |
14-9-2022 |
Geen |
|
Dhr. Dr. D.M.W. Balak |
Dermatoloog, LUMC |
Medisch adviseur Psoriasispatiënten NL (onbetaald) |
- Organisatie nascholing Brugge dagen sept 2023 Ii.s.n. AbbVie (betaald) - Spreker nascholing Dermatology at sea juni 2-23 (ism met Janssen) (betaald) - Deelname world congress Dermatology juli 2023 (ism Admirall) |
Geen |
Geen |
Geen |
Geen |
28-3-2023 |
Geen |
|
Dhr. Dr. H.B. Thio |
Dermatoloog Erasmus MC |
Geen
|
Ik treed betaald op als onderzoeker, als spreker en als lid van de medische adviesaden van de firma's Boehringen Ingelheim, Janssen, AbbVie, Galderma, Leo Pharma, Eli Lilly, en UCB. |
Geen |
Zie eerder. |
Geen |
Geen |
12-5-2023 |
Geen |
|
Dhr. Dr. S. Dieleman |
Psychiater en opleider psychiatrie Erasmus MC, deelnemer aan het multidisciplinaire psychodermatologie spreekuur in het Erasmus MC |
Geen |
Geen |
Geen |
Geen |
Geen |
eigen profilering op het gebied van psychodermatologie, maar dat is ongeacht de inhoud van de richtlijn |
7-11-2022 |
Geen |
|
Mw. Dr. E.J.H. Schatorjé |
Kinderreumatoloog/immunoloog St. Maartenskliniek en Radboud UMC |
secretaris Nederlands Vereniging voor Kinderreumatologie (NVKR): onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
20-10-2022 |
Geen |
|
Mw. Drs. E. Hoppenreijs |
Kinderreumatoloog St. Maartenskliniek en Radboud UMC |
1. lid NvK geneesmiddelen commissie |
Geen |
Geen |
Geen |
Geen |
Geen |
12-9-2022 |
Geen |
|
Dhr. Dr. F.A. van Gaalen |
Reumatoloog LUMC |
Lid van het ASAS uitvoerend comité Penningmeester van ASAS |
Adviesvergoedingen van Novartis, MSD, AbbVie, Bristol Myers Squibb, Eli Lilly |
Geen |
subsidies van Stichting Vrienden van Sole Mio, Stichting ASAS, UCB, Novartis en Jacobus Stichting |
Geen |
Geen |
23-9-2021 |
Geen |
|
Mw. K. Sterkenburg, |
Huidtherapeut en beleidsmedewerker NVH |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
5-9-2022 |
Geen |
|
Mw. I. Laffra |
Verpleegkundig specialist Rijnstate |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
11-9-2022 |
Geen |
|
Dhr. Drs. W. Eizenga |
Huisarts in Utrecht, manager bij de huisartsopleiding te Utrecht |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
8-11-2022 |
Geen |
|
Mw. I. van Ee |
Adviseur patientenbelang, PatientenfederatieNederland |
Coordinator patientenparticipatie Psoriasispatienten Nederland |
Geen |
Geen |
Freedom of disease Psoriasis: hoofdauteur |
Geen |
Geen |
7-8-2022 |
Geen |
|
Mw. F. van Oort |
Staffunctionaris beleid, zorg en kwaliteit. |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
7-11-2022 |
Geen |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiënten perspectief in alle modules van de herziende richtlijn psoriasis door zitting neming van afgevaardigden van Psoriasispatiënten Nederland (PN). De conceptrichtlijn is tevens voor commentaar voorgelegd aan PN.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (gebaseerd op het stroomschema ontwikkeld door FMS).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst Raming |
Toelichting |
|
Biologics voor kinderen en adolescenten |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt via het internet verspreid onder alle relevante beroepsgroepen en ziekenhuizen en er zal in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Tevens zal een samenvatting worden gemaakt. De voorlichtingsfolder van de NVDV zal worden afgestemd op de richtlijn. In verband met het modulaire onderhoud van deze richtlijn wordt het implementatieplan per module weergegeven in de bijlage van de betreffende module.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Onderstaand is de methode stapsgewijs beschreven.
Knelpuntenanalyse
In de voorbereidingsfase heeft een bijeenkomst plaatsgevonden waarvoor alle belanghebbenden zijn uitgenodigd. In deze bijeenkomst zijn knelpunten aangedragen door de werkgroepleden en gemandateerde van verschillende (wetenschappelijke) verenigingen en stakeholders. Voor een volledig overzicht wordt verwezen naar tabel 1.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse heeft de werkgroep uitgangsvragen opgesteld. Daarbij inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen en consultatie van experts. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. Literatuur is geselecteerd op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in bijlage 2.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen zijn overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs (2021)
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog
|
|
|
Redelijk
|
|
|
Laag
|
|
|
Zeer laag
|
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie)
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. (naar keuze: optie-1 ‘Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.’ Of optie-2 ‘De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode’).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overkoepelende bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overkoepelende conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk. Door gebruik te maken van de Guideline Development Tool werd het Evidence to decision framework conform GRADE methodiek toegepast. Alle werkgroepleden hebben systematisch antwoord gegeven op vragen over de grootte van het effect en grootte van negatieve consequenties, waarden en voorkeuren van de patiënt, kosten en kosteneffectiviteit, beschikbaarheid van voorzieningen, aanvaardbaarheid, en overwegingen voor subgroepen in de patiëntenpopulatie. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld voor deze richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling beschreven (zie bijlage 4).
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Een richtlijn beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een richtlijn in een register betekent dus niet noodzakelijkerwijs dat de in de richtlijn beschreven zorg verzekerde zorg is. Informatie over kosten zoals beschreven in de richtlijn is gebaseerd op beschikbare gegevens ten tijde van schrijven.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen, (patiënt) organisaties en stakeholders voorgelegd ter commentaar (zie ook tabel 1). De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter autorisatie.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. Available from www.handbook.cochrane.org.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.. Online beschikbaar op http://richtlijnendatabase.nl/ Laatst geraadpleegd op [DATUM geraadpleegd voor concepttekst]
Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html
Zoekverantwoording
De zoekstrategieën zijn uitgevoerd in de EMBASE en Medline database. Enkel de keywords gebruikt in de Medline database zijn weergeven. Experts op het gebied van psoriasis werden geraadpleegd voor eventuele ontbrekende artikelen en/of casereports.
Zoekverantwoording
Biologics voor kinderen
EMBASE (17-02-2023)
Zoektermen
#37. #17 AND #36
#36. #31 OR #35
#35. #32 OR #33 OR #34
#34. 'randomized controlled trial'/exp
#33. retracted AND 'article'/exp
#32. (((random*:ti,ab OR placebo*:ti,ab OR
single:ti,ab) AND blind*:ti,ab OR double:ti,ab)
AND blind*:ti,ab OR triple:ti,ab) AND
blind*:ti,ab
#31. #28 OR #29 OR #30
#30. (meta?anal*:ti,ab OR meta:ti,ab) AND anal*:ti,ab
OR 'meta anal*':ti,ab OR metaanal*:ti,ab OR
metanal*:ti,ab
#29. systematic*:ti,ab AND (review*:ti,ab OR
overview:ti,ab)
#28. #24 AND #27
#27. #25 OR #26
#26. 'retracted article'/exp
#25. medline:ti,ab OR medlars:ti,ab OR embase:ti,ab OR
pubmed:ti,ab OR cinahl:ti,ab OR amed:ti,ab OR
psychlit:ti,ab OR psyclit:ti,ab OR
psychinfo:ti,ab OR psycinfo:ti,ab OR
scisearch:ti,ab OR cochrane:ti,ab
#24. #18 OR #19 OR #20 OR #21 OR #22 OR #23
#23. systematic:ti,ab AND review:ti,ab
#22. 'systematic review':ti,ab
#21. 'meta analysis'/exp
#20. meta AND 'analysis'/exp
#19. literature:ti,ab AND review*:ti,ab
#18. 'review'/exp
#17. #6 AND #10 AND #16
#16. #11 OR #12 OR #13 OR #14 OR #15
#15. secukinumab:ti,ab OR cosentyx:ti,ab
#14. ixekizumab:ti,ab OR taltz:ti,ab
#13. ustekinumab:ti,ab OR stelara:ti,ab
#12. adalimumab:ti,ab OR amgevita:ti,ab OR
hukyndra:ti,ab OR humira:ti,ab OR hyrimoz:ti,ab
OR idacio:ti,ab OR imraldi:ti,ab OR yuflyma:ti,ab
#11. etanercept:ti,ab OR benepali:ti,ab OR
enbrel:ti,ab OR erelzi:ti,ab
#10. #7 OR #8 OR #9
#9. child*:ti,ab OR infant*:ti,ab OR babies*:ti,ab OR
boy*:ti,ab OR girl*:ti,ab OR pediatric*:ti,ab OR
paediatric*:ti,ab OR adolescen*:ti,ab
#8. 'adolescent'/exp
#7. 'child'/exp
#6. #1 OR #2 OR #3 OR #4 OR #5
#5. pustulosis:ti,ab AND palms:ti,ab AND soles:ti,ab
#4. 'pustulosis palmaris et plantaris':ti,ab
#3. palmoplantar*:ti,ab OR pustulosis:ti,ab
#2. psoria*:ti,ab
#1. ('psoriasis'/exp OR psoriasis) AND [embase]/lim
Resultaten = 151
MEDLINE (datum 17-02-2023)
Zoektermen
1 exp Psoriasis/ or psoria$.mp. 64635
2 palmoplantar$ pustulosis.mp. 690
3 pustulosis palmaris et plantaris.mp. 177
4 (pustulosis and palms and soles).mp. 109
5 or/1-4 64883
6 3925806
7 (child* or infant* or babies* or boy* or girl* or pediatric* or paediatric* or adolescen*).tw. 2383765
8 or/6-7 4525622
9 (etanercept or Benepali or Enbrel or Erelzi).ti,ab. 7790
10 (adalimumab or Amgevita or Hukyndra or Humira or Hyrimoz or Idacio or Imraldi or Yuflyma).ti,ab. 8643
11 (ustekinumab or Stelara).ti,ab. 2649
12 (ixekizumab or Taltz).ti,ab. 831
13 (secukinumab or Cosentyx).ti,ab. 1682
14 9 or 10 or 11 or 12 or 13 16942
15 5 and 8 and 14 560
16 review.pt. 3116934
17 (medline or medlars or embase or pubmed or cochrane).tw,sh. 325775
18 (scisearch or psychinfo or psycinfo).tw,sh. 55760
19 cinahl.tw,sh. 42288
20 ((hand adj2 search$) or (manual$ adj2 search$)).tw,sh. 16421
21 (electronic database$ or bibliographic database$ or computeri?ed database$ or online database$).tw,sh. 55647
22 (pooling or pooled or mantel haenszel).tw,sh. 141832
23 (peto or dersimonian or der simonian or fixed effect).tw,sh. 10305
24 (retraction of publication or retracted publication).pt. 26532
25 or/17-24 499619
26 16 and 25 212160
27 meta-analysis.pt. 175875
28 meta-analysis.sh. 175875
29 (meta-analys$ or meta analys$ or metaanalys$).tw,sh. 290043
30 (systematic$ adj5 review$).tw,sh. 312424
31 (systematic$ adj5 overview$).tw,sh. 3430
32 (quantitativ$ adj5 review$).tw,sh. 10252
33 (quantitativ$ adj5 overview$).tw,sh. 412
34 (quantitativ$ adj5 synthesis$).tw,sh. 4340
35 (methodologic$ adj5 review$).tw,sh. 8314
36 (methodologic$ adj5 overview$).tw,sh. 548
37 (integrative research review$ or research integration).tw. 172
38 or/27-37 464281
39 randomized controlled trial.pt. 586786
40 controlled clinical trial.pt. 95190
41 randomized.ab. 592812
42 placebo.ab. 235741
43 clinical trials as topic.sh. 200873
44 randomly.ab. 402003
45 trial.ti. 279377
46 or/39-45 1504090
47 26 or 38 or 46 1927811
48 15 and 47 141
Resultaten = 141
Alle resultaten
|
Database |
Datum |
# hits |
|
EMBASE |
17-02-2023 |
151 |
|
MEDLINE |
17-02-2023 |
141 |
|
Totaal |
292 |
|
|
Duplicates |
64 |
|
|
Netto aantal |
228 |
|
Biologics voor ouderen
EMBASE (datum 02-03-2023)
Zoektermen
#61. #26 AND #60
#60. #39 OR #58
#59. #26 AND #58
#58. #56 OR #57
#57. trial:ti,ab,kw
#56. #41 OR #42 OR #43 OR #44 OR #45 OR #46 OR #47 OR
#48 OR #49 OR #50 OR #51 OR #52 OR #53 OR #54 OR
#55
#55. 'single blind procedure'/exp
#54. 'randomized controlled trial'/exp
#53. 'double-blind procedure'/exp
#52. crossover AND 'procedure'/exp
#51. volunteer*:ti,ab,kw
#50. allocat*:ti,ab,kw
#49. assign*:ti,ab,kw
#48. singl*:ti,ab,kw AND blind*:ti,ab,kw
#47. doubl*:ti,ab,kw AND blind*:ti,ab,kw
#46. pracebo*:ti,ab,kw
#45. 'cross over*':ti,ab,kw
#44. 'cross over':ti,ab,kw
#43. crossover*:ti,ab,kw
#42. factorial*:ti,ab,kw
#41. random*:ti,ab,kw
#40. #26 AND #39
#39. #27 OR #28 OR #29 OR #30 OR #31 OR #32 OR #33 OR
#34 OR #35 OR #38
#38. #36 AND #37
#37. review:ti,ab,kw
#36. meta:ti,ab,kw OR synthesis:ti,ab,kw OR
(literature:ti,ab,kw AND database*:ti,ab,kw) OR
extraction:ti,ab,kw
#35. extensive:ti,ab,kw AND review*:ti,ab,kw AND
literature:ti,ab,kw
#34. pooled:ti,ab,kw AND analy*:ti,ab,kw
#33. review*:ti,ab,kw AND (database:ti,ab,kw OR
medline:ti,ab,kw OR embase:ti,ab,kw OR
cinahl:ti,ab,kw)
#32. methodologic:ti,ab,kw AND (overview*:ti,ab,kw OR
review*:ti,ab,kw)
#31. quantitativ*:ti,ab,kw AND (review*:ti,ab,kw OR
overview*:ti,ab,kw)
#30. systematic*:ti,ab,kw AND (review*:ti,ab,kw OR
overview*:ti,ab,kw)
#29. 'meta analy*':ti,ab,kw OR metaanaly*:ti,ab,kw
#28. 'systemic review'
#27. meta AND 'analysis'/exp
#26. #14 AND #25
#25. #15 OR #16 OR #17 OR #18 OR #19 OR #20 OR #21 OR
#22 OR #23 OR #24
#24. benepali:ti,ab,kw OR enbrel:ti,ab,kw OR
erelzi:ti,ab,kw OR flixabi:ti,ab,kw OR
inflectra:ti,ab,kw OR remicade:ti,ab,kw OR
remsima:ti,ab,kw OR zessly:ti,ab,kw OR
amgevita:ti,ab,kw OR hukyndra:ti,ab,kw OR
humira:ti,ab,kw OR hyrimoz:ti,ab,kw OR
idacio:ti,ab,kw OR imraldi:ti,ab,kw OR
yuflyma:ti,ab,kw OR stelara:ti,ab,kw OR
cosentyx:ti,ab,kw OR taltz:ti,ab,kw OR
kyntheum:ti,ab,kw OR tremfya:ti,ab,kw OR
cimzia:ti,ab,kw OR ilumetri:ti,ab,kw OR
skyrizi:ti,ab,kw OR bimzelx:ti,ab,kw
#23. etanercept:ti,ab,kw OR infliximab:ti,ab,kw OR
adalimumab:ti,ab,kw OR ustekinumab:ti,ab,kw OR
secukinumab:ti,ab,kw OR ixekizumab:ti,ab,kw OR
brodalumab:ti,ab,kw OR guselkumab:ti,ab,kw OR
'certolizumab pegol':ti,ab,kw OR
tildrakizumab:ti,ab,kw OR risankizumab:ti,ab,kw
OR bimekizumab:ti,ab,kw
#22. 'ustekinumab'/exp
#21. 'infliximab'/exp
#20. 'etanercept'/exp
#19. certolizumab AND pegol
#18. 'adalimumab'/exp
#17. biologic:ti,ab,kw OR biologics:ti,ab,kw
#16. biological:ti,ab,kw AND therap*:ti,ab,kw
#15. biological AND 'therapy'/exp
#14. #6 AND #13
#13. #7 OR #8 OR #9 OR #10 OR #11 OR #12
#12. (ageing:ti,ab OR aging:ti,ab OR centarian*:ti,ab
OR centenarian*:ti,ab OR 'community
dwelling':ti,ab OR elder*:ti,ab OR eldest:ti,ab
OR frail*:ti,ab OR geriatri*:ti,ab OR
nonagenarian*:ti,ab OR old:ti,ab) AND
people:ti,ab OR older:ti,ab OR oldest:ti,ab OR
psychogeriatrics:ti,ab OR septuagenarian*:ti,ab
OR sexagenarian:ti,ab OR
supercentenarian*:ti,ab,kw
#11. 'aging'/exp
#10. geriatric AND assessment
#9. nursing AND homes
#8. 'geriatrics'/exp
#7. 'aged'/exp
#6. #1 OR #2 OR #3 OR #4 OR #5
#5. pustulosis:ti,ab AND palms:ti,ab AND soles:ti,ab
#4. 'pustulosis palmaris et plantaris':ti,ab
#3. palmoplantar*:ti,ab OR pustulosis:ti,ab
#2. psoria*:ti,ab
#1. ('psoriasis'/exp OR 'psoriasis' OR
'psoriasis'/exp OR psoriasis) AND [embase]/lim
Resultaten = 591
MEDLINE (datum 01-03-2023)
Zoektermen
1 exp Psoriasis/ or psoria$.mp. 64810
2 palmoplantar$ pustulosis.mp. 691
3 pustulosis palmaris et plantaris.mp. 177
4 pustulosis palmaris et plantaris.mp. 177
5 or/1-4 65051
6 exp aged/ 3438050
7 exp geriatrics/ 31370
8 exp nursing homes/ 44011
9 geriatric assessment/ 32018
10 exp aging/ 289833
11 or/6-10 3662306
12 ((old adj2 adult*) or (old adj2 age*) or (old adj2 females) or (old adj2 males) or (old adj2 men) or (old adj2 patient*) or (old adj2 population) or (old adj2 subject*) or (old adj2 women) or (older adj2 adult*) or (older adj2 age*) or (older adj2 females) or (older adj2 males) or (older adj2 patient*) or (older adj2 population) or (older adj2 subject*) or (older adj2 women)).tw,kf. 443043
13 11 or 12 3864111
14 5 and 13 11361
15 exp Biological Therapy/ 767128
16 biological therap*.mp. 8617
17 (biologic or biologics).mp. 82290
18 Drug Therapy/ 31159
19 adalimumab/ 6778
20 certolizumab pegol/ 726
21 etanercept/ 6454
22 infliximab/ 11856
23 ustekinumab/ 1696
24 (Etanercept or Infliximab or Adalimumab or ustekinumab or secukinumab or ixekizumab or brodalumab or Guselkumab or certolizumab pegol or tildrakizumab or risankizumab or bimekizumab).ti,ab,kw. 27250
25 (benepali or enbrel or erelzi or flixabi or inflectra or remicade or remsima or zessly or amgevita or hukyndra or humira or hyrimoz or idacio or imraldi or yuflyma or stelara or cosentyx or taltz or kyntheum or tremfya or cimzia or ilumetri or skyrizi or bimzelx).ti,ab,kw. 1152
26 15 or 16 or 17 or 18 or 19 or 20 or 21 or 22 or 23 or 24 or 25 901812
27 14 and 26 1703
28 meta analysis.pt. 176717
29 (meta-anal$ or metaanal$).tw,kf. 263687
30 (systematic$ adj10 (review$ or overview$)).tw,kf. 308942
31 (quantitativ$ adj10 (review$ or overview$)).tw,kf. 12946
32 (methodologic$ adj10 (review$ or overview$)).tw,kf. 15669
33 medline.tw. and review.pt. 97627
34 (pooled adj3 analy*).tw,kf. 27990
35 "cochrane$".fc_jour. 16169
36 or/28-35 512143
37 27 and 36 44
38 randomized controlled trial.pt. 587992
39 randomized controlled trial/ 587992
40 Random Allocation/ 106905
41 Double-Blind Method/ 174496
42 single-blind method/ 32539
43 clinical trial.pt. 537247
44 exp clinical trial/ 964288
45 ((clinical$ or intervention$) adj5 (trial$ or study or studies)).tw. 1030999
46 ((singl$ or doubl$ or trebl$ or tripl$) adj5 (blind$ or mask$)).tw. 198354
47 Placebos/ 35925
48 (placebo$ or random$).tw. 1478927
49 Animals/ 7241998
50 Humans/ 21094808
51 49 not (49 and 50) 5064533
52 or/38-48 2681555
53 52 not 51 2461762
54 27 and 53 456
55 36 or 53 2754859
56 27 and 55 478
Resultaten = 478
Alle resultaten
|
Database |
Datum |
# hits |
|
EMBASE |
2-3-2023 |
591 |
|
MEDLINE |
1-3-2023 |
478 |
|
Totaal |
1069 |
|
|
Totaal na filteren op publicaties vanaf 2019 |
361 |
|
|
Duplicates |
20 |
|
|
Netto aantal |
341 |
|