SGLT-2-remmers bij diabetische nefropathie
Uitgangsvraag
Wat is de waarde van SGLT-2-remmers bij patiënten met type 1 of 2 diabetes en nefropathie, mede in relatie tot behoud van nierfunctie?
Aanbeveling
Geef vooralsnog geen SGLT-2-remmers bij mensen met diabetes type 1 en nefropathie, ook niet met als doel om de progressie van nierschade te stoppen of om te keren.
Overweeg het gebruik van SGLT-2-remmers bij personen met diabetes type 2 indien eGFR 30-60/min/1,73m2 met (een eerdere) ACR > 3 mg/mmol of eGFR ≥ 60/min/1,73m2 met (een eerdere) ACR > 30 mg/mmol vanwege de potentieel gunstige effecten op cardiovasculaire complicaties, albuminurie en renale eindpunten.
Wees terughoudend met het gebruik van SGLT-2-remmers indien er sprake is van recidiverende genitale (mycotische) infecties, alcoholisme, ondervoeding, bewezen perifeer arterieel vaatlijden of het al hebben gehad van een amputatie (zie richtlijn Diabetes mellitus type 2 in de tweede lijn; NIV, 2018).
Overweeg behandeling met SGLT-2-remmers te stoppen als de nierfunctie verslechtert tot eGFR < 30ml/min/1,73m2. Zie toe op een goede voetcontrole, mede in verband met een mogelijk verhoogd risico op amputaties bij gebruik van SGLT-2-remmers.
Licht de patiënten in over het mogelijk optreden en herkennen van genitale bijwerkingen (met name mycotische infecties, en heel zeldzaam het syndroom van Fournier).
Bespreek met de patiënt de risicofactoren en symptomen van ketoacidose en informeer de patiënt over de noodzaak om inname van de SGLT-2-remmer (tijdelijk) te staken bij misselijkheid, braken, extreme dorst en bij een chirurgische ingreep, en om in deze gevallen contact op te nemen met de behandelend arts.
Overweeg de behandeling met SGLT-2-remmers bij (kwetsbare) ouderen/ patiënten ouder dan 70 jaar tijdelijk te staken als er sprake is van een (dreigende) dehydratie. Als praktisch handvat voor beslissingen kan daarbij worden aangehouden:
- vijf dagen met een omgevingstemperatuur boven de 27 °C en/of;
- meer dan driemaal daags waterdunne diarree en/of;
- meer dan driemaal daags overgeven en/of;
- meer dan twee dagen koorts boven 38,5 °C.
Overwegingen
De onderstaande overwegingen gelden in principe voor het overgrote deel van de patiëntenpopulatie waarop de uitgangsvraag betrekking heeft. Voor de subgroep (kwetsbare) ouderen/patiënten ouder dan 70 jaar zijn echter aanvullende overwegingen van belang met betrekking tot de voor- en nadelen van de interventie. Deze aanvullende overwegingen worden bij de betreffende aspecten expliciet benoemd. De centrale vraag in de huidige richtlijn is hoe personen met diabetische nefropathie moeten worden behandeld, en niet wat de waarde is van SGLT-2-remmers en GLP-1-agonisten (zie submodule GLP-1-agonisten) in de preventie van nefropathie bij personen met diabetes. Voor de inzet van SGLT-2-remmers en GLP-1-agonisten bij personen met diabetes die nog geen nefropathie hebben ontwikkeld wordt verwezen naar de richtlijn Diabetes mellitus type 2 in de tweede lijn (NIV, 2018). Voor uitkomstmaten op het gebied van glucoseregulatie en veiligheid van SGLT-2-remmers en GLP-1-agonisten wordt eveneens verwezen naar voornoemde richtlijn.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Uit de systematische literatuuranalyse (zie Samenvatting literatuur en Conclusies op tabblad Onderbouwing) kan worden geconcludeerd dat de effecten van SGLT-2-remmers bij personen met diabetes type 2 en nefropathie maar beperkt in kaart zijn gebracht: empagliflozine is redelijk goed onderzocht bij deze patiëntengroep (3 RCT's, 2.313 patiënten) maar dat geldt niet voor andere SGLT-2-remmers (dapagliflozin: 2 RCT's, 324 patiënten; canagliflozin: 1 RCT 269, patiënten; luseogliflozin: 1 RCT, 145 patiënten; ipragliflozin: 1 RCT, 81 patiënten; LX4211, een SGLT-2/SGLT-1-remmer: 1 RCT, 31 patiënten). Door een gebrek aan onderzoeksresultaten zijn de literatuurconclusies voor een aantal cruciale uitkomstmaten onzeker (GRADE-bewijskracht laag), en voor enkele uitkomstmaten (eindstadium nierfalen, cardiovasculaire morbiditeit) is zelfs geen conclusie mogelijk.
Uit de literatuuranalyse komt naar voren dat behandeling met een SGLT-2-remmer in vergelijking met placebo:
- De glomerulaire filtratiesnelheid (beoordeeld via de eGFR) waarschijnlijk enigszins verlaagt (GRADE-bewijskracht: redelijk), de serum creatinine concentratie waarschijnlijk enigszins verhoogt (GRADE-bewijskracht: redelijk), en de albumine-creatinine concentratie in de urine waarschijnlijk enigszins verlaagt (GRADE-bewijskracht: redelijk). Deze effecten lijken echter gering en zijn mogelijk niet klinisch relevant.
- De totale mortaliteit mogelijk verlaagt (GRADE-bewijskracht: laag), cardiovasculaire mortaliteit mogelijk verlaagt (GRADE-bewijskracht: laag) en het risico op hartfalen waarschijnlijk verlaagt (GRADE-bewijskracht: redelijk).
- Het risico op acuut nierfalen mogelijk verlaagt (GRADE-bewijskracht: laag) en het risico op hyperkaliëmie waarschijnlijk verlaagt (GRADE-bewijskracht: redelijk).
- Het risico op genitale infecties waarschijnlijk verhoogt (GRADE-bewijskracht: redelijk).
- Mogelijk nauwelijks effect heeft op het risico op stoppen van medicatie als gevolg van adverse events, het risico op hypoglykemieën, het risico op hypovolemie, het risico op botbreuken, en het risico op bovenste luchtweginfecties (GRADE-bewijskracht: laag), en waarschijnlijk nauwelijks effect heeft op het risico op urineweginfecties (GRADE-bewijskracht: redelijk).
Voor de cruciale uitkomstmaten geldt dat de bewijskracht voor uitkomstmaten met betrekking tot mortaliteit en ernstige morbiditeit (eindstadium nierfalen, totale mortaliteit, cardiovasculaire mortaliteit en morbiditeit, en acuut nierfalen) laag tot zeer laag is (alleen voor de uitkomstmaat hartfalen is de bewijskracht redelijk). Voor de cruciale uitkomstmaten nierziekteprogressie (eGFR, serum creatinine) en proteïnurie is de bewijskracht redelijk. De overall bewijskracht over alle cruciale uitkomstmaten bij personen met diabetes type 2 en nefropathie is daarmee laag tot zeer laag door een gebrek aan onderzoeksgegevens over de effecten van SGLT-2-remmers op harde eindpunten (mortaliteit, ernstige morbiditeit). Voor personen met diabetes type 1 en nefropathie leverde de systematische literatuuranalyse geen resultaat op: er werd geen enkele relevante studie geïdentificeerd.
Extra overwegingen met betrekking tot effectiviteit van SGLT-2-remmers
Op basis van het ontbreken van bewijs ten aanzien van de cruciale uitkomstmaten kan er geen eenduidig besluit genomen worden over de waarde van SGLT-2-remmers bij patiënten met type 1 diabetes en nefropathie. De waarde van een behandeling met SGLT-2-remmers voor behoud of verbetering van de nierfunctie bij deze patiëntengroep is onbekend. Er zijn daarnaast aanwijzingen dat het risico op diabetische ketoacidose bij gebruik van SGLT-2-remmers verhoogd is bij mensen met diabetes type 1 (Peters, 2016; Buse, 2018).
De systematische literatuuranalyse geeft wel enig houvast bij het bepalen van de waarde van SGLT-2-remmers bij patiënten met type 2 diabetes en nefropathie: met name de voordelen van een mogelijk verlaagde cardiovasculaire en totale mortaliteit en een waarschijnlijk verlaagde kans op hartfalen, met daar tegenover het nadeel van een waarschijnlijk verhoogde kans op genitale (mycotische) infecties. Deze mycotische infecties zijn over het algemeen goed behandelbaar. Uit de literatuuranalyse die gebaseerd is op een recente Cochrane review (Lo, 2018) komt geen bewijs naar voren voor een klinisch relevant voordeel op de nierfunctie.
In de CANVAS-studies (CANVAS-program) is regressie van albuminurie een relevante (dichotome) uitkomstmaat, de mate van daling van albuminurie is een goede voorspeller van de kans op nierfunctieachteruitgang (Coresh, 2019). Helaas wordt albuminurie niet als continue uitkomstmaat gerapporteerd waardoor de validiteit van de dichotome uitkomstmaat niet kan worden beoordeeld. De resultaten van CANVAS zijn dan ook niet opgenomen in de Cochrane review van Lo (Lo, 2018). De resultaten van de CANVAS-trials suggereren dat behandeling met een SGLT-2-remmer een gunstig effect kan hebben op de nierfunctie bij personen met diabetische nefropathie: regressie van albuminurie kwam vaker voor in de canagliflozinegroep dan in de placebogroep (293 versus 188 personen met regressie van albuminurie per 1000 patiënt-jaren; Hazard ratio, HR= 1,70, 95% BI= (1.51; 1.91)). In de literatuuranalyse en genoemde Cochrane Review zijn voor nierfunctie uitsluitend enkelvoudige uitkomstmaten geanalyseerd en zijn samengestelde (composiet) uitkomstmaten niet meegenomen. Composiet uitkomstmaten zijn vaak moeilijk te interpreteren omdat de effecten op de samenstellende componenten onzichtbaar blijven. In het ergste geval wordt een tegengesteld effect op de samenstellende uitkomsten gemaskeerd. Daarom kan de validiteit van een composiet uitkomstmaat alleen worden beoordeeld als de individuele componenten ook worden gerapporteerd. In recente cardiovasculaire uitkomst trials (cardiovascular outcome trials, CVOT's; EMPA-REG OUTCOME, CANVAS-Program, DECLARE-TIMI 58; zie Zelniker, 2018) worden renale composiet uitkomstmaten gebruikt waarbij harde uitkomstmaten (eindstadium nierfalen, renale mortaliteit) worden gecombineerd met een zachte uitkomstmaat (verslechtering van nierfunctie, bijvoorbeeld personen met tenminste 40% afname in eGFR ten opzichte van baseline). Interpretatie wordt bemoeilijkt doordat de composiet uitkomstmaat gedomineerd wordt door de zachte uitkomstmaat, en doordat de samenstellende componenten niet afzonderlijk worden gerapporteerd (Home, 2019). Een bijkomend nadeel is dat het een dichotome uitkomstmaat betreft en aanvullende gegevens op groepsniveau over de effecten van behandeling op de glomerulaire filtratiesnelheid (beoordeeld via de eGFR) als continue uitkomstmaat ontbreken. Ondanks deze tekortkomingen kunnen aan de resultaten op de renale composiet uitkomstmaat wel aanvullende argumenten worden ontleend die de besluitvorming rondom de aanbevelingen ondersteunen. In een recente systematische review en meta-analyse (Zelniker, 2018; verschenen na de zoekdatum van de systematische literatuuranalyse) worden de effecten van SGLT-2-remmers bij personen met DM2 geanalyseerd op basis van de renale composiet-uitkomstmaat in de drie grootste CVOT's: empagliflozine (EMPA-REG OUTCOME), canagliflozine (CANVAS-Program), en dapagliflozine (DECLARE-TIMI 58; Wiviott, 2018, verschenen na de zoekdatum). Uit de meta-analyse blijkt dat SGLT-2-remmers de kans op het renale composiet eindpunt verminderen. Uit een subgroepanalyse blijkt dat dit effect, in mindere mate dan bij een goede nierfunctie, ook aanwezig was bij mensen met een verminderde nierfunctie op baseline (eGFR < 60 ml/min/1,73m2): gemiddeld 33% reductie in het risico op het renale composiet-eindpunt (Hazard ratio, HR= 0,67; 95%BI= (0,51; 0,89)). Tevens was er, met name in de groep met een verminderde nierfunctie (eGFR < 60 ml/min/1,73m2), een aanzienlijke reductie in het aantal ziekenhuisopnames ten gevolge van hartfalen: gemiddeld 40% reductie in het risico op ziekenhuisopnames ten gevolge van hartfalen HR= 0,60 (95%BI= (0,47; 0,77)). Deze resultaten bevestigen het verlaagde risico op hartfalen uit de systematische literatuuranalyse (41% risicoreductie, RR= 0,59; 95%BI= (0,41; 0,87); zie Samenvatting literatuur), en suggereren daarnaast dat SGLT-2-remmers nefroprotectief zijn. Deze conclusies worden ondersteund in een recente kritische review (Home, 2019). Home (2019) stelt terecht dat door de ongelijke opzet en verschillen in uitkomsten van de CVOT’s van empagliflozine (EMPA-REG), canagliflozine (CANVAS-Program) en dapagliflozine (DECLARE-TIMI) er nog steeds onduidelijkheid is over de effecten van SGLT-2-remmers op diverse harde eindpunten, met name cardiovasculaire eindpunten. Tegelijkertijd concludeert Home (2019) echter dat de bevindingen ten aanzien van renale protectie en een verminderde kans op hartfalen, sterk en consistent zijn tussen de drie CVOT’s en dat dit duidt op een klasse-effect. Vermeldingswaardig is ook dat de recente CREDENCE studie die canagliflozine vergelijkt met placebo bij personen met DM2 en een verminderde nierfunctie (eGFR 30 tot 90 ml/min/1,73m2 en ernstig verhoogde albuminurie) vroegtijdig is afgebroken vanwege sterke bevindingen op effectiviteit tijdens de interim-analyse (Perkovic, 2019). Er werd in de canagliflozine groep een 30% risicoreductie waargenomen op de composietuitkomstmaat van eindstadium nierfalen, verdubbeling van serum creatinine, renale en cardiovasculaire mortaliteit, met een risicoreductie van 22% tot 40% op de samenstellende elementen. Deze resultaten ondersteunen de nefroprotectieve effecten van SGLT-2-remmers. Hierbij moet wel worden aangetekend dat het vroegtijdig stoppen van deze RCT een risico met zich meebrengt op (ernstige) overschatting van de effectiviteit van de SGLT-2-remmer.
Extra overwegingen met betrekking tot bijwerkingen en veiligheid van SGLT-2-remmers
SGLT-2-remmers verhogen waarschijnlijk de kans op genitale (mycotische) infecties, maar deze infecties zijn over het algemeen mild tot matig van aard en goed behandelbaar (Arakaki, 2016). In tegenstelling tot eerdere berichten vanuit de FDA (FDA, 2016) lijken SGLT-2-remmers het risico op acuut nierfalen juist te verlagen in plaats van te verhogen, maar de bewijskracht hiervoor is laag (zie Samenvatting literatuur). Naar aanleiding van bijwerkingen die naar voren kwamen in de EMPA-REG OUTCOME en de CANVAS-studies, werden in de DECLARE-TIMI subanalyses uitgevoerd. Noch de EMPA-REG OUTCOME, noch de CANVAS-studie bleken in staat om het potentiële risico op ketoacidose goed te adresseren/in kaart te brengen. Op basis van de data uit de DECLARE-TIMI studie kan echter geconcludeerd worden dat ketoacidose een reëel risico is indien dapagliflozine tegelijk met insuline gebruikt wordt, maar dat de frequentie van voorkomen laag is (0,3% overall; 0,6% onder insuline gebruikers). Vanwege het amputatierisico in de CANVAS-trial zijn tijdens de DECLARE-TIMI studie mensen met een amputatie in de voorgeschiedenis geëxcludeerd en werd het gebruik van dapagliflozine gestaakt bij symptomen van perifeer vaatlijden, zoals perifere ischemie of infectie. Uit een subgroepanalyse van de EMPA-REG OUTCOME studie bij patiënten die bij aanvang perifeer vaatlijden hadden, kwam overigens geen verhoogd amputatierisico naar voren bij gebruik van empagliflozine in vergelijking met placebo, alhoewel het brede betrouwbaarheidsinterval een eventueel verhoogd amputatierisico ook niet uitsluit (HR= 0,84; 95%BI= (0,54; 1,32); Verma, 2018). Wel bleken mensen met perifeer vaatlijden een duidelijk hoger risico te hebben op amputaties dan mensen zonder perifeer vaatlijden. Een verhoogd fractuur risico bleek alleen in de CANVAS-studie op te treden, en was afwezig in de CANVAS-R studie en de EMPA-REG OUTCOME en DECLARE-TIMI (zie Home, 2019). In de richtlijn Diabetes mellitus type 2 in de tweede lijn (NIV, 2018) zijn de veiligheidsaspecten rondom het gebruik van SGLT-2-remmers nader beschreven. In de DECLARE-TIMI studie zijn geen nieuwe veiligheidsaspecten naar voren gekomen. Derhalve zijn de argumenten met betrekking tot de veiligheid van SGLT-2-remmers overgenomen uit de richtlijn Diabetes mellitus type 2 in de tweede lijn (NIV, 2018). Op basis van Post-Market Surveillance analyses is recent een waarschuwing (DHCP) uitgegaan voor een mogelijk verband tussen het gebruik van SGLT-2-remmers (canagliflozine, dapagliflozine, empagliflozine of ertugliflozine) en gangreen van Fournier (CBG, 2019). Gangreen van Fournier is een zeldzame, maar ernstige en mogelijk levensbedreigende infectie. Patiënten moet worden geadviseerd om bij klachten zoals hevige pijn, gevoeligheid, roodheid of zwelling van de geslachtsorganen of het gebied daaromheen, in combinatie met koorts of ongemak, direct contact op te nemen met hun behandelend arts. Behandelaars wordt geadviseerd om bij het vermoeden op gangreen van Fournier te stoppen met het gebruik van SGLT-2-remmers en onmiddellijk te starten met de behandeling. Voor bijwerkingen zoals deze die worden beschreven in de officiële productinformatie (Summary of Product Characteristics, SmPC) van geneesmiddelen, kunt u desgewenst de website van het College ter Beoordeling van Geneesmiddelen (CBG-MEB) raadplegen via https://www.cbg-meb.nl/.
Met betrekking tot de voor- en nadelen van de interventie geldt voor de belangrijke subgroep (kwetsbare) ouderen/patiënten ouder dan 70 jaar dat deze personen extra gevoelig zijn voor uitdroging, met name indien er reeds sprake is van een verminderde nierfunctie (eGFR < 60ml/min/min/1,73m2). Het gebruik van SGLT-2-remmers kan het risico op uitdroging verder vergroten en daarom wordt terughoudendheid geadviseerd ten aanzien van de inzet van SGLT-2-remmers. Het (tijdelijk) staken van inname kan geïndiceerd zijn bij bepaalde omstandigheden. Een praktische benadering met handvatten kan worden afgeleid van een voorlichtingsfolder van de Nierstichting en Nierpatiënten Vereniging Nederland (2016): overweeg het tijdelijk staken van SGLT-2-remmers bij vijf dagen met een omgevingstemperatuur boven de 27 0C, meer dan driemaal daags waterdunne diarree, meer dan driemaal daags overgeven, of meer dan twee dagen koorts boven 38,5 0C.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Patiënten hechten uiteraard belang aan effectiviteit, bijwerkingen en langetermijnveiligheid. Daarnaast hechten patiënten aan gebruiksgemak. Een voordeel van het gebruik van SGLT-2-remmers is de mogelijkheid van orale toediening en het lage risico op bijwerkingen, afgezien van een verhoogd risico op genitale (mycotische) infecties. In vergelijking met insuline-injecties is het ontbreken van de noodzaak tot glucose zelfcontrole een voordeel van SGLT-2-remmers ten opzichte van (basaal) insuline. Ook de vaste dosering van SGLT-2-remmers kan als voordeel worden gezien, terwijl de dosering van (basaal) insuline steeds moet worden ingesteld en soms wordt aangepast, hetgeen fouten kan veroorzaken. Voor patiënten die voor injectie van insuline of GLP-1-agonisten afhankelijk zijn van een zorgverlener (bijvoorbeeld thuiszorg of in een verpleeghuis) kan het praktischer zijn om te kiezen voor een oraal medicament zonder noodzaak voor glucosecontrole. De kosten kunnen een nadeel zijn voor de patiënt, niet alle personen met diabetes (met nefropathie) zullen de behandeling met een SGLT-2-remmer vergoed krijgen. Hiervoor gelden aanvullende criteria ten aanzien van gebruik van comedicatie of monotherapie (zie voor actuele criteria www.znformulieren.nl). Bij de behandeling van diabetes mellitus type 2 heeft gezamenlijke besluitvorming van patiënt en arts vanzelfsprekend een belangrijke plaats. Voor- en nadelen van SGLT-2-remmers ten opzichte van alternatieve behandelopties dienen helder en open besproken te worden, zodat de patiënt goed geïnformeerd deelneemt aan de gezamenlijke besluitvorming en gemotiveerd de behandeling kan voortzetten.
Kosten (middelenbeslag)
De behandelkosten van SGLT-2-remmers zijn waarschijnlijk vergelijkbaar met de behandelkosten van insuline, al hangt dit af van de benodigde hoeveelheid insuline, het aantal injecties en (geadviseerde) momenten van zelfcontrole en het insulinepreparaat. Daarnaast zijn er potentiële kosten (meerkosten of juist besparingen) van hypoglykemieën, cardiovasculaire en renale protectie, en bijwerkingen of complicaties. Het is belangrijk vast te stellen dat de meerkosten van SGLT-2-remmers in absolute zin per patiënt beperkt zijn, zeker als het een bepaalde periode betreft. Er zijn inmiddels een aantal kosteneffectiviteitsstudies uitgevoerd waarin behandeling met SGLT-2-remmers wordt vergeleken met placebo of alternatieve behandelopties zoals insuline, DPP-4-remmer, GLP-1-agonist, sulfonylureumderivaat of acarbose. Deze kosteneffectiviteitsstudies richten zich op personen met diabetes type 2, er is nog geen onderzoek gedaan naar kosteneffectiviteit van behandeling met SGLT-2-remmers specifiek bij personen met diabetes en nefropathie. Een recente systematische review (Rahman, 2018) dekt de literatuur tot juni 2018 en includeert 37 studies (15 voor dapagliflozine, 10 voor canagliflozine en 12 voor empagliflozine). Deze studies verschillen van elkaar in de analytische modellen die worden gebruikt, het perspectief dat wordt gehanteerd, en het land (gezondheidssysteem) waarop de studie betrekking heeft. De resultaten van recente cardiovasculaire trials (DECLARE-TIMI 58, CANVAS, EMPA-REG) zijn nog niet verwerkt in de kosteneffectiviteitsmodellen. Ondanks deze verschillen en tekortkomingen blijken de SGLT-2-remmers in alle gevallen kosteneffectief te zijn: de gezondheidswinst bij behandeling met SGLT-2-remmers woog op tegen de meerkosten, algemeen geaccepteerde grenzen voor kosteneffectiviteit (kosten per gewonnen levensjaar) werden niet overschreden (Rahman, 2018). Op basis hiervan acht de werkgroep het waarschijnlijk dat ook de inzet van SGLT-2-remmers bij patiënten met diabetes type 2 en nefropathie kosteneffectief zal blijken te zijn. Door het ontbreken van onderzoeksgegevens (effectiviteit, bijwerkingen en veiligheid) bij personen met diabetes type 1 is voor deze patiëntengroep geen uitspraak over kosteneffectiviteit mogelijk.
Aanvaardbaarheid voor de overige relevante stakeholders
Er zijn naar inschatting van de werkgroep voor dit aspect geen noemenswaardige bezwaren vanuit het veld, die van invloed zijn op de besluitvorming.
Haalbaarheid en implementatie
De werkgroep is van mening dat SGLT-2-remmers onder voorwaarden kunnen worden overwogen bij personen met diabetes mellitus type 2 en nefropathie (zie Rationale en Aanbeveling). De werkgroep is van mening dat behandeling met SGLT-2-remmers kan worden overwogen bij personen met diabetes type 2 en nefropathie en een eGFR > 30 ml/min/1,73m2, maar dat vanwege ontbrekend bewijs terughoudendheid op zijn plaats is bij ernstige nierinsufficiëntie (eGFR < 30 ml/min/1,73m2). Dit betekent een wijziging in het huidige beleid. In het huidige beleid worden SGLT-2-remmers voorgeschreven ter verbetering van de glucoseregulatie en niet aanbevolen bij matige tot ernstige nierinsufficiëntie (creatinineklaring < 60 ml/min/1,73m2). In de richtlijn Diabetes mellitus type 2 in de tweede lijn (NIV, 2018) wordt terughoudendheid geadviseerd bij een verminderde nierfunctie (eGFR < 60 ml/min/1,73m2). De werkgroep is van mening dat er voldoende bewijs is voor effectiviteit op cardiovasculaire en renale eindpunten die een uitbreiding van de indicaties voor SGLT-2-remmers rechtvaardigen. Vanwege potentieel gunstige effecten op cardiovasculaire complicaties en op de albuminurie kunnen SLGT-2-remmers met name worden overwogen bij personen met manifest vaatlijden of hartfalen, en personen die al een cardiovasculaire event hebben (gehad). Vanwege de wijziging ten opzichte van het huidige beleid zijn voor implementatie van de aanbeveling aanpassingen nodig in indicatiestelling en vergoeding van SGLT-2-remmers. In het huidige beleid zullen niet alle personen met diabetes (met nefropathie) de behandeling met een SGLT-2-remmer vergoed krijgen (zie voor actuele criteria www.znformulieren.nl).
Rationale - balans tussen de argumenten voor en tegen de interventie
Door het ontbreken van bewijs is de waarde van SGLT-2-remmers bij patiënten met type 1 diabetes en nefropathie onbekend. Er zijn daarnaast aanwijzingen dat het risico op diabetische ketoacidose bij gebruik van SGLT-2-remmers verhoogd is bij mensen met diabetes type 1. Derhalve kan de werkgroep het gebruik van SGLT-2-remmers vooralsnog niet aanbevelen bij mensen met diabetes type 1 en nefropathie. Het is van belang om vast te stellen dat de literatuur op het gebied van gebruik en effecten van SGLT-2-remmers zich snel uitbreidt, en dat er bij hernieuwde analyse mogelijk al op korte termijn tot andere conclusies zou kunnen worden gekomen. Voor een richtlijn zal op een gegeven moment de uiterste zoekdatum moeten worden vastgesteld en vastgehouden. Hierbij moet worden aangetekend dat dit onderwerp ook de aandacht krijgt bij de werkgroep Modulair onderhoud diabetes richtlijnen (NIV, 2020) waar momenteel de vraag wordt uitgewerkt naar de waarde van SGLT-2-remmers bij volwassenen met DM1 (bredere PICO, dus niet specifiek gericht op patiënten met DM1 en nefropathie). Voorstel is om de bevindingen van de werkgroep af te wachten. Deze bevindingen zullen dan gebaseerd zijn op weer meer recente literatuur.
Er zijn aanwijzingen dat SGLT-2-remmers de totale en cardiovasculaire mortaliteit en het risico op acuut nierfalen verlagen bij personen met diabetes type 2 maar de bewijskracht is laag. Daarnaast zijn er aanwijzingen dat SGLT-2-remmers nefroprotectief zijn maar dit is voornamelijk gebaseerd op een analyse van renale composiet uitkomstmaten waarin de geschatte glomerulaire filtratiesnelheid (eGFR) domineert. De lange termijn effecten op de nierfunctie zijn niet volledig duidelijk. Onvoldoende duidelijk is ook of er een klinisch (patiënt) relevant voordeel bestaat op harde renale eindpunten (eindstadium nierfalen, renale mortaliteit). De werkgroep is dan ook van mening dat er onvoldoende bewijs is voor een harde aanbeveling van SGLT-2-remmers bij behandeling van personen met diabetes type 2 en nefropathie. De werkgroep is wel van mening dat er voldoende bewijs is voor een zwakke (conditionele) aanbeveling: er zijn duidelijke aanwijzingen dat SGLT-2-remmers het risico op hartfalen en het risico op hyperkaliëmie verlagen, en albuminurie enigszins verlagen. Behandeling met SGLT-2-remmers kent weinig bijwerkingen en is relatief veilig. Bij de belangrijke subgroep (kwetsbare) ouderen/patiënten ouder dan 70 jaar met diabetes type 2 en nefropathie is wel extra aandacht nodig voor de gevaren van dehydratie bij inzet van SGLT-2-remmers. Behandeling met SGLT-2-remmers brengt meerkosten met zich mee maar is waarschijnlijk wel kosteneffectief. De primaire indicatie voor het gebruik van SGLT-2-remmers in het huidige beleid is hyperglykemie. Gezien het mechanisme van glucoseverlaging zijn SGLT-2-remmers mogelijk minder effectief bij een verminderde nierfunctie (eGFR < 60 ml/min/1,73m2), maar er zijn voldoende aanwijzingen voor een klinisch relevant voordeel op cardiovasculaire en renale eindpunten bij personen met verminderde nierfunctie (eGFR tussen 30 en 60 ml/min/1,73m2). Er zijn daarentegen onvoldoende onderzoeksgegevens over de effecten van SGLT-2-remmers bij een sterk verminderde nierfunctie (eGFR < 30 ml/min/1,73m2). Daarom adviseert de werkgroep om behandeling met SGLT-2-remmers te overwegen bij personen met diabetes type 2 en nefropathie en een eGFR > 30 ml/min/1,73m2. SGLT-2-remmers hebben potentieel gunstige effecten op cardiovasculaire complicaties en op de albuminurie, en de mogelijke cardiovasculaire voordelen zijn met name relevant voor mensen met een verhoogd cardiovasculair risico. Aanbevelingen gerelateerd aan bijwerkingen en veiligheid van SGLT-2-remmers zijn grotendeels overgenomen uit de richtlijn Diabetes mellitus type 2 in de tweede lijn (NIV, 2018). Vanwege de verhoogde kans op genitale (mycotische) infecties is enige terughoudendheid op zijn plaats bij personen met recidiverende genitale (mycotische) infecties. Terughoudendheid is ook op zijn plaats bij alcoholisme en ondervoeding. Vanwege een mogelijk verhoogd risico op amputaties worden SGLT-2-remmers afgeraden als er sprake is van een amputatie in de voorgeschiedenis of symptomatisch perifeer vaatlijden. Informeer de patiënt over een mogelijk verhoogd amputatierisico en het (zeer kleine) risico op gangreen van Fournier. Bij de inzet van SGLT-2-remmers moet worden toegezien op een goede voetcontrole. Adviseer patiënten om bij klachten zoals hevige pijn, gevoeligheid, roodheid of zwelling van de geslachtsorganen of het gebied daaromheen, in combinatie met koorts of ongemak, direct contact op te nemen met hun behandelend arts. Bij een vermoeden op gangreen van Fournier moet het gebruik van SGLT-2-remmers worden gestaakt en behandeling onmiddellijk worden gestart. Patiënten moeten goed worden voorgelicht over een mogelijk verhoogd risico op ketoacidose, met name bij combinatietherapie met insuline (NIV, 2018). Het verdient tenslotte aanbeveling om bij (kwetsbare) ouderen/ patiënten ouder dan 70 jaar met een verminderde nierfunctie behandeling met SGLT-2-remmers tijdelijk te staken als er sprake is van dehydratie of omstandigheden die het risico op dehydratie sterk vergroten.
In de NfN richtlijn “Behandeling van patiënten met diabetes mellitus en chronische nierschade stadium 3b of hoger (eGFR < 45 ml/min/1,73 m2)” (NfN 2018) wordt een belangrijke plaats ingeruimd voor de SGLT-2-remmers en GLP-1-agonisten bij behandeling van patiënten met DM2 . De argumenten voor het innemen van dit standpunt zijn in de richtlijn terug te vinden. Niettegenstaande dat heeft de werkgroep van de richtlijn diabetische nefropathie op basis van de door hen beoordeelde literatuur de volgende aanbevelingen geformuleerd. Ook hierbij moet worden aangetekend dat bij de modulaire herziening van de NIV diabetesrichtlijnen (NIV, 2020) momenteel wordt onderzocht of SGLT-2-remmers sterk zouden moeten worden aanbevolen voor alle patiënten met DM2 en een zeer hoog HVZ risico, waartoe ook patiënten met diabetische nefropathie behoren.
Onderbouwing
Achtergrond
Op dit moment is er in de behandeling van nefropathie (eGFR < 60 ml/min/1,73m2 en/of verhoogde albuminurie) geen plaats voor de GLP-1-agonisten en de SGLT-2-remmers. Er zijn aanwijzingen uit recente cardiovasculaire uitkomststudies (LEADER, EMPA-REG Outcome, CANVAS-R) dat het gebruik van GLP-1-agonisten en de SGLT-2-remmers een gunstige invloed kan hebben op het ontwikkelen en de progressie van albuminurie. Het is onduidelijk of dit een klasse-effect is of dat het effect op de albuminurie gerelateerd is aan specifieke GLP-1-agonisten respectievelijk SGLT-2-remmers. Daarnaast zijn er aanwijzingen dat het gebruik van SGLT-2-remmers bij bepaalde risicofactoren kan leiden tot acuut nierfalen (FDA, 2016). De vraag is derhalve: wat is de waarde van GLP-1-agonisten en SLGT-2-remmers bij patiënten met type 1 of 2 diabetes én nefropathie, mede in relatie tot behoud van de nierfunctie?
Conclusies / Summary of Findings
SGLT-2-remmers bij patiënten met type 2 diabetes en nefropathie
|
Redelijk1 GRADE |
Behandeling met een SGLT-2-remmer verlaagt waarschijnlijk enigszins de glomerulaire filtratiesnelheid (beoordeeld via de eGFR) bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De verlaging in eGFR is waarschijnlijk niet klinisch relevant.
Bronnen: (Lo, 2018; Grunberger, 2018) |
|
Redelijk2 GRADE |
Behandeling met een SGLT-2-remmer verhoogt waarschijnlijk enigszins de serum creatinine concentratie bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De verhoging in serum creatinine is waarschijnlijk niet klinisch relevant.
Bronnen: (Lo, 2018; Grunberger, 2018) |
|
- GRADE |
Het effect van SGLT-2-remmers op verdubbeling van serum creatinine is onbekend vanwege onvoldoende onderzoeksgegevens bij patiënten met DM2 en nefropathie.
Bronnen: (Lo, 2018; Grunberger, 2018) |
|
- GRADE |
Het effect van SGLT-2-remmers op eindstadium nierfalen is onbekend vanwege onvoldoende onderzoeksgegevens bij patiënten met DM2 en nefropathie.
Bronnen: (Lo, 2018; Grunberger, 2018) |
|
Redelijk3 GRADE |
Behandeling met een SGLT-2-remmer verlaagt waarschijnlijk enigszins de albumine-creatinine ratio in de urine (ACR) bij patiënten met DM2 en nefropathie, in vergelijking met placebo. De verlaging in ACR is waarschijnlijk niet klinisch relevant.
Bronnen: (Lo, 2018; Grunberger, 2018) |
|
Laag4 GRADE |
Behandeling met een SGLT-2-remmer verlaagt mogelijk de totale mortaliteit bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Bronnen: (Lo, 2018; Grunberger, 2018) |
|
Laag5
Laag6
Redelijk7
GRADE |
Behandeling met een SGLT-2-remmer verlaagt mogelijk de cardiovasculaire mortaliteit bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Het effect van SGLT-2-remmers op het risico op een myocardinfarct, en het risico op beroerte is onduidelijk bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Behandeling met een SGLT-2-remmer verlaagt waarschijnlijk het risico op hartfalen bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Bronnen: (Lo, 2018; Grunberger, 2018) |
|
Laag8 GRADE |
Behandeling met een SGLT-2-remmer verlaagt mogelijk het risico op acuut nierfalen bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Bronnen: (Lo, 2018; Grunberger, 2018) |
|
- GRADE |
Overige diabetes-gerelateerd complicaties (cruciale uitkomstmaat) worden niet gerapporteerd bij patiënten met DM2 en nefropathie.
Bronnen: (Lo, 2018; Grunberger, 2018) |
|
Laag9
Redelijk10
Laag11
Redelijk12
Redelijk13
- GRADE
|
Behandeling met een SGLT-2-remmer heeft mogelijk nauwelijks effect op het stoppen van medicatie als gevolg van adverse events bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Behandeling met een SGLT-2-remmer verlaagt waarschijnlijk het risico op hyperkaliëmie bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Behandeling met een SGLT-2-remmer heeft mogelijk nauwelijks effect op het risico op hypoglykemieën, het risico op hypovolemie, het risico op botbreuken, en het risico op bovenste luchtweginfecties, bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Behandeling met een SGLT-2-remmer heeft waarschijnlijk nauwelijks effect op het risico op urineweginfecties bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Behandeling met een SGLT-2-remmer resulteert waarschijnlijk in een verhoogd risico op genitale infecties bij patiënten met DM2 en nefropathie, in vergelijking met placebo.
Het effect van SGLT-2-remmers op het risico op diarree en het risico op diabetische ketoacidose is onbekend vanwege onvoldoende onderzoeksgegevens bij patiënten met DM2 en nefropathie.
Bronnen: (Lo, 2018; Grunberger, 2018) |
|
- GRADE |
Ziekenhuisopname, kwaliteit van leven (HRQoL), kosteneffectiviteit en patiënttevredenheid (belangrijke uitkomstmaten) worden niet gerapporteerd bij patiënten met DM2 en nefropathie.
Bronnen: (Lo, 2018; Grunberger, 2018) |
SGLT-2-remmers bij patiënten met type 1 diabetes en nefropathie
|
- GRADE |
Door het ontbreken van onderzoeksgegevens is er geen uitspraak mogelijk over de effecten van SGLT-2-remmers bij personen met DM1 en nefropathie.
Bronnen: (Lo, 2018; Grunberger, 2018) |
Samenvatting literatuur
De literatuuranalyse voor deze submodule is met betrekking tot personen met DM2 gebaseerd op een systematische review (Lo, 2018) aangevuld met een RCT (Grunberger, 2018). Er werden geen relevante SR’s of RCT’s gevonden met betrekking tot personen met DM1. Lo (2018) sloot RCT’s bij personen met DM1 niet uit, maar vond voor deze patiëntengroep geen RCT’s waarin de effecten van SGLT-2-remmers werden onderzocht.
Lo (2018). De SR van Lo (2018) is van zeer goede kwaliteit (zie evidencetabellen onder het tabblad Onderbouwing). Deze SR analyseert de effecten van insuline en andere glucoseverlagende middelen in vergelijking met elkaar of met placebo of standaard zorg, bij personen met diabetes en nefropathie. Nefropathie werd gedefinieerd als eGFR < 60 ml/min/1,73m2 of KDIGO GFR stadium 3 tot 5 (Kidney Disease Improving Global Outcomes; KDIGO, 2002, 2011). Lo (2018) dekt de literatuur tot 12 februari 2018 en includeert RCT’s, inclusief 'quasi-gerandomiseerde studies' en cross-over RCT’s, naar alle 11 klassen glucoseverlagende medicatie: metformine, insuline, sulfonylureumderivaten, glinides, glitazonen, glucosidaseremmers, GLP-1-agonisten, DPP-4-remmers, SGLT-2-remmers, amyline-analogen en bromocriptine. Studies bij patiënten met een nier-, pancreas- of eilandjestransplantaat werden uitgesloten.
Lo (2018) includeerde 44 RCT’s (128 publicaties; 13.036 deelnemers) waarvan 9 RCT’s betrekking hadden op SGLT-2-remmers (EMPA-REG BP, 2015; EMPA-REG OUTCOME, 2013; EMPA-REG RENAL, 2014; Haneda, 2016; Kaku, 2014; Kohan, 2014; LANTERN, 2015; Yale, 2013; Zambrowicz, 2015). Voor de studiekarakteristieken en resultaten van de SR en beoordeling van de individuele studieopzet (risk of bias) van de geïncludeerde studies wordt verwezen naar Lo (2018), een beknopt overzicht is opgenomen in de evidencetabel. De gemiddelde leeftijd van de deelnemers in de geïncludeerde studies varieerde tussen 59 en 68 jaar, en het aantal deelnemers met nefropathie varieerde tussen 31 (Zambrowicz, 2015) en 1.819 personen (EMPA-REG OUTCOME, 2013). In totaal betreft het 2.072 personen met nefropathie. De RCT’s betreffen empagliflozine (drie RCT’s), dapagliflozine (twee RCT’s), en luseogliflozine, ipragliflozine, canagliflozine en LX4211 (telkens een RCT). Lo (2018) analyseert een groot aantal uitkomstmaten waaronder nierfunctie, mortaliteit, micro- en macrovasculaire morbiditeit en veiligheid. De studiekwaliteit werd beoordeeld met de Cochrane risk of bias tool en was over het algemeen redelijk (matig risico op bias): door een gebrek aan informatie konden randomisering en blindering van de groepstoekenning niet goed beoordeeld worden bij vier RCT’s en blindering van uitkomstbeoordelaars bij zeven RCT’s. Tenslotte zijn vrijwel alle RCT’s gesponsord door de fabrikant van de SGLT-2-remmer en ontvingen coauteurs veelal financiële ondersteuning of waren in dienst bij de fabrikant. De SR van Lo (2018) is aangevuld met de recente RCT van Grunberger (2018; VERTIS RENAL trial).
Grunberger (2018). Grunberger (2018) vergeleek effectiviteit en veiligheid van ertugliflozine met placebo bij patiënten met DM2 en nefropathie (eGFR tussen 30 en 60 ml/min/1,73m2; N= 467 deelnemers) bij een behandelduur van 52 weken. De RCT kent een lage studiekwaliteit (hoog risico op bias) voor renale uitkomstmaten (eGFR; albumine-creatinine ratio in de urine, ACR) met name door een gebrekkige rapportage en het ontbreken van deze uitkomstmaten in het trial register. De RCT is uitgevoerd in opdracht van de fabrikant van de SGLT-2-remmer en de coauteurs waren in dienst bij de fabrikant.
Nierziekteprogressie (daling eGFR; stijging (verdubbeling van) serum creatinine; optreden eindstadium nierfalen, ESRD; cruciale uitkomstmaten)
Lo (2018) analyseert geschatte glomerulaire filtratiesnelheid (eGFR), serum creatinine, verdubbeling van serum creatinine en eindstadium nierfalen. De aanvullende studie (Grunberger, 2018) rapporteert eGFR.
eGFR
Behandeling met SGLT-2-remmers leidt tot een statistisch significante reductie in eGFR in vergelijking met een placebobehandeling: na meta-analyse bedraagt het gemiddelde groepsverschil bij een behandelduur van 24 tot 52 weken (figuur 1): MD= -1,75 ml/min/1,73m2 (95% betrouwbaarheidsinterval, 95%BI= (-2,56; -0,93); 5 studies, n=1.044 patiënten) in het voordeel van placebo. Er is geen sprake van relevante statistische heterogeniteit (I2= 0%). Het groepsverschil vertaalt zich in een gestandaardiseerd gemiddeld groepsverschil (SMD) van -0,24 (95%BI= (-0,37; -0,12)) dat geheel onder de GRADE-default grens voor klinische relevantie ligt (een verschil van een halve standaarddeviatie voor continue uitkomstmaten; zie Zoeken en selecteren op tabblad Onderbouwing). Het effect van SGLT-2-remmers op eGFR is daarmee statistisch significant maar waarschijnlijk niet klinisch relevant.
Figuur 1
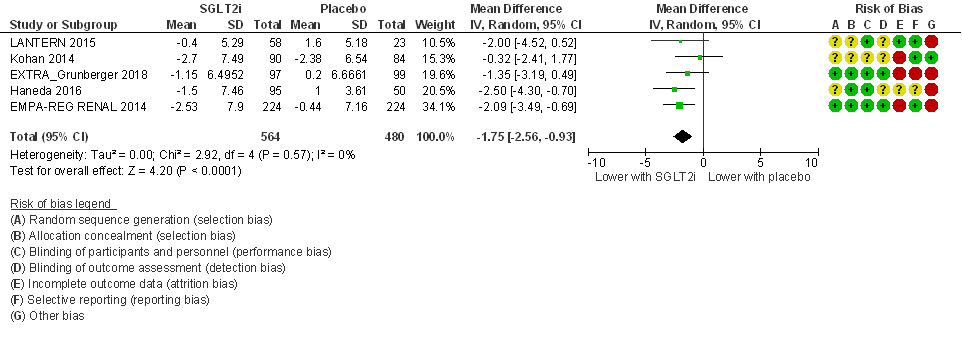
Meta-analyse en forest plot van het effect van SGLT-2-remmers in vergelijking met placebo op de geschatte glomerulaire filtratiesnelheid (eGFR). Behandelduur 24 tot 52 weken. Empagliflozine (EMPA-REG RENAL, 2014), luseogliflozine (Haneda, 2016), dapagliflozine (Kohan, 2014), ipragliflozine (LANTERN, 2015), en ertugliflozine (Grunberger, 2018). Uitkomstmaat: verandering in eGFR ten opzichte van baseline. Gemiddeld groepsverschil (mean difference, MD; random effects model). Individuele studiekwaliteit (risk of bias) gebaseerd op de Cochrane risk of bias tool. Gebaseerd op Lo (2018) met aanvullende studie (Grunberger, 2018)
Serum creatinine
Behandeling met SGLT-2-remmers leidt tot een statistisch significante toename in serum creatinine in vergelijking met een placebobehandeling: na meta-analyse bedraagt het gemiddelde groepsverschil bij een behandelduur van 24 tot 52 weken (figuur 2): MD= -3,82 μmol/L (95%BI= (1,45; 6.19); 4 studies, n= 848 patiënten) in het voordeel van de placebobehandeling. Er is nauwelijks sprake van statistische heterogeniteit (I2= 16%). Het groepsverschil vertaalt zich in een gestandaardiseerd gemiddeld groepsverschil (SMD) van 0,23 (95%BI= 0,07; 0,40) dat geheel onder de GRADE-default grens voor klinische relevantie ligt. Het effect van SGLT-2-remmers op serum creatinine is daarmee statistisch significant maar waarschijnlijk niet klinisch relevant.
Figuur 2
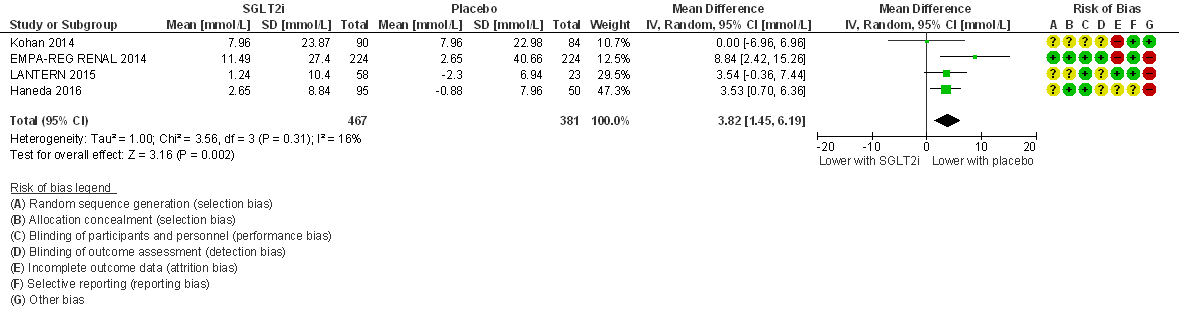
Meta-analyse en forest plot van het effect van SGLT-2-remmers in vergelijking met placebo op serum creatinine (SCr). Behandelduur 24 tot 52 weken. Uitkomstmaat: verandering in SCr ten opzichte van baseline. Gemiddeld groepsverschil (mean difference, MD; random effects model). Zie bijschrift bij Figuur 1 voor extra informatie over de geïncludeerde RCT’s. Gebaseerd op Lo (2018)
Verdubbeling van serum creatinine
Lo (2018) includeert twee RCT’s voor deze uitkomstmaat (Figuur 3). Er is geen conclusie mogelijk vanwege onvoldoende statistische power (zeer gering aantal events; 2 studies, n= 700 patiënten, 32 events) en onduidelijke studiekwaliteit van de bepalende RCT (Kohan, 2014), het brede betrouwbaarheidsinterval laat geen betrouwbare uitspraak toe. Deze uitkomstmaat wordt niet gerapporteerd in Grunberger (2018).
Figuur 3
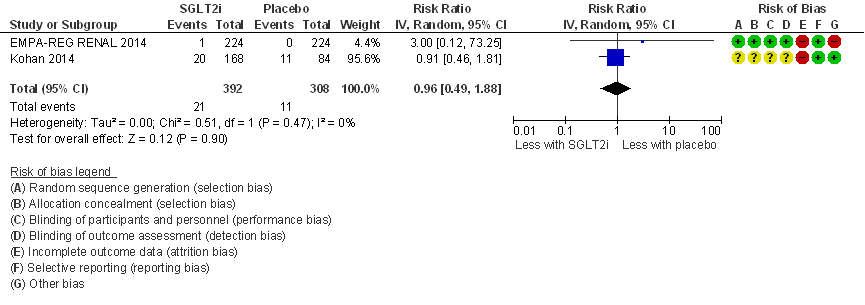
Meta-analyse en forest plot van het effect van SGLT-2-remmers in vergelijking met placebo op verdubbeling van serum creatinine. Behandelduur 24 of 52 weken. Uitkomstmaat: verdubbeling van serumcreatinine ten opzichte van baseline. Relatief risico (Risk Ratio, RR; random effects model). Zie bijschrift bij Figuur 1 voor extra informatie over de geïncludeerde RCT’s. Gebaseerd op Lo (2018)
Eindstadium nierfalen
Lo (2018) includeert twee RCT’s voor de uitkomstmaat eindstadium nierfalen (figuur 4). Er is geen conclusie mogelijk vanwege onvoldoende statistische power (zeer gering aantal events; 2 studies, n= 700 patiënten, 4 events), het brede betrouwbaarheidsinterval laat geen enkele uitspraak toe. Deze uitkomstmaat wordt niet gerapporteerd in Grunberger (2018).
Figuur 4
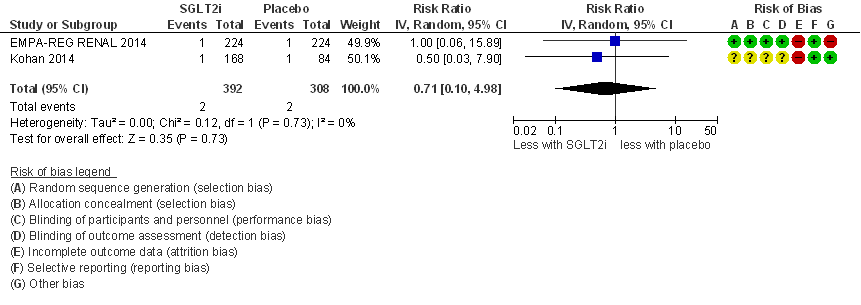
Meta-analyse en forest plot van het effect van SGLT-2-remmers in vergelijking met placebo op eindstadium nierfalen. Behandelduur 24 tot 52 weken. Uitkomstmaat: eindstadium nierfalen. Relatief risico (Risk Ratio, RR; random effects model). Gebaseerd op Lo (2018)
Samenvattend: in vergelijking met placebo verlagen SGLT-2-remmers enigszins de glomerulaire filtratiesnelheid (beoordeeld via de eGFR) en verhogen enigszins de serum creatinine concentratie, maar de effecten zijn klein en waarschijnlijk niet klinisch relevant. Er is geen uitspraak mogelijk voor de uitkomstmaten verdubbeling van serum creatinine en eindstadium nierfalen.
Proteïnurie (albuminurie; cruciale uitkomstmaat)
Lo (2018) analyseert de albumine-creatinine ratio in de urine.
Behandeling met SGLT-2-remmers leidt tot een statistisch significante afname van de albumine-creatinine ratio in de urine (ACR) in vergelijking met een placebobehandeling. Na meta-analyse bedraagt het gemiddelde groepsverschil bij een behandelduur van 24 tot 52 weken (figuur 5): MD= -8,14 mg/mmol creatinine (95%BI= (-14.51; -1.77); 5 studies, n= 1.153 patiënten) in het voordeel van de behandeling met SGLT-2-remmers. Er is nauwelijks sprake van statistische heterogeniteit (I2= 11%). Het groepsverschil vertaalt zich in een gestandaardiseerd gemiddeld groepsverschil (SMD) van -0,17 (95%BI= -0,28; -0,05) dat geheel onder de GRADE default grens voor klinische relevantie ligt. Het effect van SGLT-2-remmers op albuminurie is daarmee statistisch significant maar waarschijnlijk niet klinisch relevant. Grunberger (2018) rapporteert ACR niet als uitkomstmaat maar vermeld wel in de tekst dat progressie van normoalbuminurie naar microalbuminurie (proportie van de patiënten) vergelijkbaar was in interventie- en controlegroep.
Figuur 5
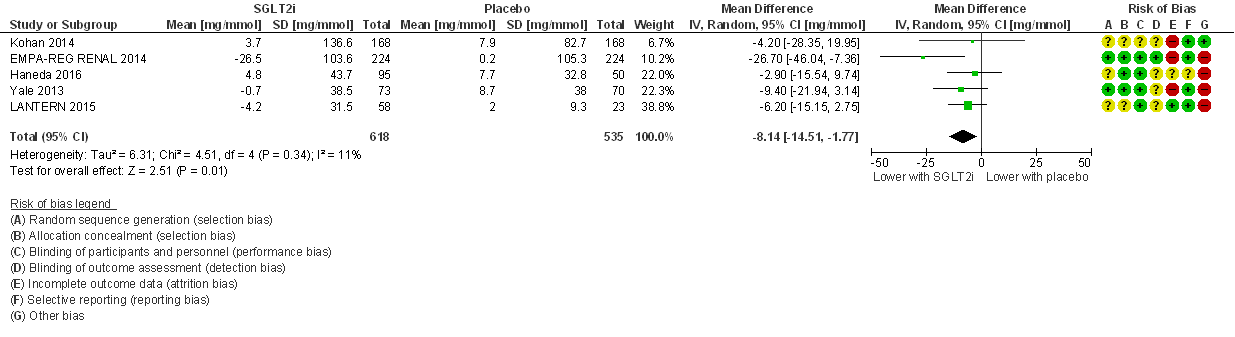
Meta-analyse en forest plot van het effect van SGLT-2-remmers in vergelijking met placebo op de albumine-creatinine ratio in de urine. Behandelduur 24 tot 52 weken. Uitkomstmaat: verandering in albumine-creatinine ratio ten opzichte van baseline. Gemiddeld groepsverschil (mean difference, MD; random effects model). Empagliflozine (EMPA-REG RENAL, 2014), luseogliflozine (Haneda, 2016), dapagliflozine (Kohan, 2014), ipragliflozine (LANTERN, 2015), en canagliflozine (Yale, 2013). Gebaseerd op Lo (2018)
Mortaliteit (totaal; all cause mortality; cruciale uitkomstmaat)
Totale mortaliteit is een uitkomstmaat in Lo (2018), en wordt ook gerapporteerd in Grunberger (2018). In vijf van in totaal zes RCT’s die deel uit maken van de meta-analyse (figuur 6) is het aantal events zeer gering (≤ 10 events). Alleen de EMPA-REG OUTCOME trial (EMPA-REG OUTCOME, 2013) heeft mede door inclusie van patiënten met een hoog cardiovasculair risico en de relatief lange looptijd van 192 weken een aanzienlijk aantal events (in totaal 187 events), en deze studie domineert de meta-analyse. Het relatief risico na pooling bedraagt: RR= 0,79 (95%BI= (0,61; 1,03); 6 studies, n= 3.242 patiënten; I2= 0%) in het voordeel van de behandeling met SGLT-2-remmers maar is statistisch niet significant. Uitgaande van het (hoge) sterfterisico in de EMPA-REG OUTCOME trial van 12% in de placebogroep (bij een behandelduur van 192 weken) komt een risicoreductie met 21% overeen met een number needed to treat (NNT) van 40 (NNT=29 bij extrapolatie naar een behandelduur van vijf jaar), maar het betrouwbaarheidsinterval is breed en overlapt met het nuleffect. Het effect van SGLT-2-remmers op de totale mortaliteit is daarmee mogelijk klinisch relevant maar ook onzeker vanwege ernstige imprecisie.
Figuur 6
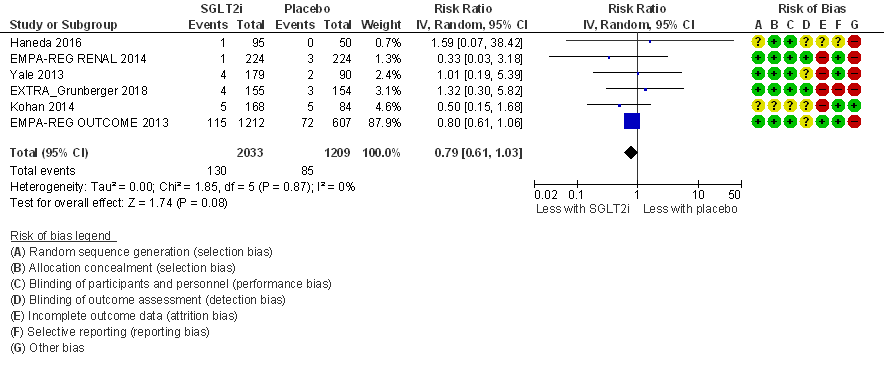
Meta-analyse en forest plot van het effect van SGLT-2-remmers in vergelijking met placebo op de totale mortaliteit. Behandelduur 24 tot 192 weken. Uitkomstmaat: totale mortaliteit. Relatief risico (Risk Ratio, RR; random effects model). Empagliflozine (EMPA-REG RENAL, 2014; EMPA-REG OUTCOME, 2013), luseogliflozine (Haneda, 2016), dapagliflozine (Kohan, 2014), canagliflozine (Yale, 2013), en ertugliflozine (Grunberger, 2018). Gebaseerd op Lo (2018) met aanvullende studie (Grunberger, 2018)
Hart- en vaatziekten (morbiditeit, mortaliteit; cruciale uitkomstmaat)
Lo (2018) analyseert cardiovasculaire mortaliteit, myocardinfarct, beroerte en hartfalen. Deze uitkomstmaten worden niet gerapporteerd in Grunberger (2018).
Cardiovasculaire mortaliteit
In drie van in totaal vier RCT’s die deel uit maken van de meta-analyse (figuur 7) is het aantal events zeer gering (3 events). Alleen de EMPA-REG OUTCOME trial (EMPA-REG OUTCOME, 2013) heeft mede door inclusie van patiënten met een hoog cardiovasculair risico en de relatief lange looptijd van 192 weken een aanzienlijk aantal events (in totaal 123 events), en deze studie domineert de meta-analyse. Het relatief risico na pooling bedraagt: RR= 0,78 (95%BI= (0,56; 1,10); 4 studies, n= 2.788 patiënten; I2= 0%) in het voordeel van de behandeling met SGLT-2-remmers maar is statistisch niet significant. Uitgaande van het (hoge) cardiovasculair sterfterisico in de EMPA-REG OUTCOME trial van 8% in de placebogroep (bij een behandelduur van 192 weken) komt een risicoreductie met 22% overeen met een NNT van 57 (NNT=41 bij extrapolatie naar een behandelduur van vijf jaar), maar het betrouwbaarheidsinterval is breed en overlapt met het nuleffect. Het effect van SGLT-2-remmers op de cardiovasculaire mortaliteit is daarmee mogelijk klinisch relevant maar ook onzeker vanwege ernstige imprecisie.
Figuur 7
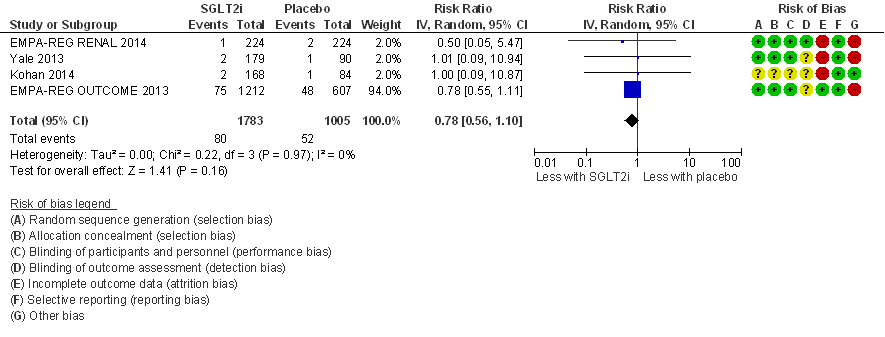
Meta-analyse en forest plot van het effect van SGLT-2-remmers in vergelijking met placebo op cardiovasculaire mortaliteit. Behandelduur 24 tot 192 weken. Uitkomstmaat: totale mortaliteit. Relatief risico (Risk Ratio, RR; random effects model). Zie bijschrift bij Figuur 6 voor extra informatie over de geïncludeerde RCT’s. Gebaseerd op Lo (2018)
Myocardinfarct
In drie van in totaal vier RCT’s die deel uit maken van de meta-analyse (figuur 8) is het aantal events zeer gering (≤ 7 events). Alleen de EMPA-REG OUTCOME trial (EMPA-REG OUTCOME, 2013) heeft mede door inclusie van patiënten met een hoog cardiovasculair risico en de relatief lange looptijd van 192 weken een aanzienlijk aantal events (in totaal 126 events), en deze studie domineert de meta-analyse. Het relatief risico na pooling bedraagt: RR= 0,63 (95%BI= (0,30; 1,34); 4 studies, n= 2.788 patiënten; I2= 30%) in het voordeel van de behandeling met SGLT-2-remmers maar is statistisch niet significant. Bij gebruik van een fixed effects model, dat minder gewicht toekent aan de kleine RCT’s, is er sprake van een minder grote risicoreductie: RR= 0,87 (95%BI= (0,62; 1,21)). Uitgaande van het (hoge) risico op een myocardinfarct in de EMPA-REG OUTCOME trial van 7% in de placebogroep (bij een behandelduur van 192 weken) komt een risicoreductie met 37% (uit de random effects meta-analyse) overeen met een NNT van 38 (NNT=27 bij extrapolatie naar een behandelduur van vijf jaar), maar het betrouwbaarheidsinterval is zeer breed en overlapt aan weerszijden met de grens voor klinische besluitvorming (bij NNT van 100 in het voordeel van interventie of controle). Een conclusie over het effect van SGLT-2-remmers op het risico op een myocardinfarct is daarmee niet mogelijk vanwege zeer ernstige imprecisie.
Figuur 8
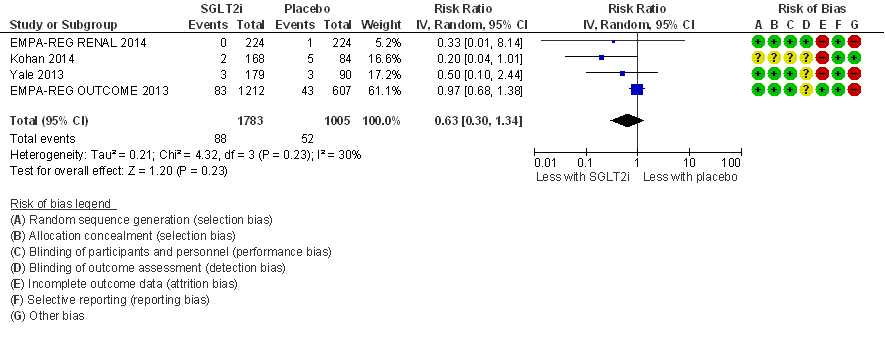
Meta-analyse en forest plot van het effect van SGLT-2-remmers in vergelijking met placebo op het risico op een myocardinfarct. Behandelduur 24 tot 192 weken. Uitkomstmaat: myocardinfarct. Relatief risico (Risk Ratio, RR; random effects model). Zie bijschrift bij Figuur 6 voor extra informatie over de geïncludeerde RCT’s. Gebaseerd op Lo (2018)
Beroerte
In drie van in totaal vier RCT’s die deel uit maken van de meta-analyse (figuur 9) is het aantal events zeer gering (≤ 4 events). Alleen de EMPA-REG OUTCOME trial (EMPA-REG OUTCOME, 2013) heeft mede door inclusie van patiënten met een hoog cardiovasculair risico en de relatief lange looptijd van 192 weken een groter aantal events (in totaal 77 events), en deze studie domineert de meta-analyse. Het relatief risico na pooling bedraagt: RR= 0,96 (95%BI= (0,63; 1,48); 4 studies, n= 2.933 patiënten; I2= 0%) en is statistisch niet significant. Deze resultaten suggereren een vergelijkbaar risico op beroerte in interventiegroep en controlegroep, maar het betrouwbaarheidsinterval is zeer breed en overlapt aan weerszijden met de grens voor klinische besluitvorming (bij NNT van 100 in het voordeel van interventie en controle). Een conclusie over het effect van SGLT-2-remmers op het risico op een beroerte is daarmee niet mogelijk vanwege zeer ernstige imprecisie.
Figuur 9
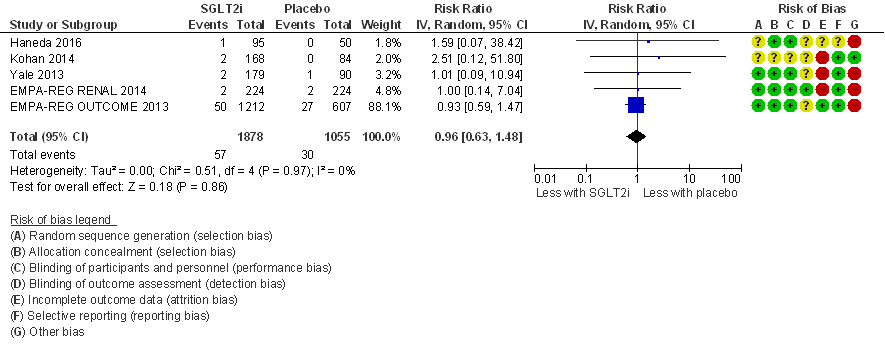
Meta-analyse en forest plot van het effect van SGLT-2-remmers in vergelijking met placebo op het risico op een beroerte. Behandelduur 24 tot 192 weken. Uitkomstmaat: beroerte. Relatief risico (Risk Ratio, RR; random effects model). Zie bijschrift bij Figuur 6 voor extra informatie over de geïncludeerde RCT’s. Gebaseerd op Lo (2018)
Hartfalen
In twee van in totaal drie RCT’s die deel uit maken van de meta-analyse (figuur 10) is het aantal events zeer gering (≤ 6 events). Alleen de EMPA-REG OUTCOME trial (EMPA-REG OUTCOME, 2013) heeft mede door inclusie van patiënten met een hoog cardiovasculair risico en de relatief lange looptijd van 192 weken een groter aantal events (in totaal 94 events), en deze studie domineert de meta-analyse. Het relatief risico na pooling bedraagt: RR= 0,59 (95%BI= (0,41; 0,87); 3 studies, n= 2.519 patiënten; I2= 0%) en is statistisch significant. Deze resultaten suggereren een aanzienlijk verlaagd risico op hartfalen bij behandeling met SGLT-2-remmers in vergelijking met placebobehandeling. Uitgaande van het (hoge) risico op hartfalen in de EMPA-REG OUTCOME trial van 7% in de placebogroep (bij een behandelduur van 192 weken) komt een risicoreductie met 41% (95%BI= (13%; 59%)) overeen met een NNT van 34 (95%BI= (24; 108); NNT=24 (17; 77) bij extrapolatie naar een behandelduur van vijf jaar). Het effect van SGLT-2-remmers op het risico op hartfalen is daarmee waarschijnlijk klinisch relevant maar er is ook enige onzekerheid vanwege imprecisie (door gering aantal events). Een belangrijke constatering is dat deze conclusie vrijwel geheel is gebaseerd op een enkele RCT (EMPA-REG OUTCOME, 2013).
Figuur 10
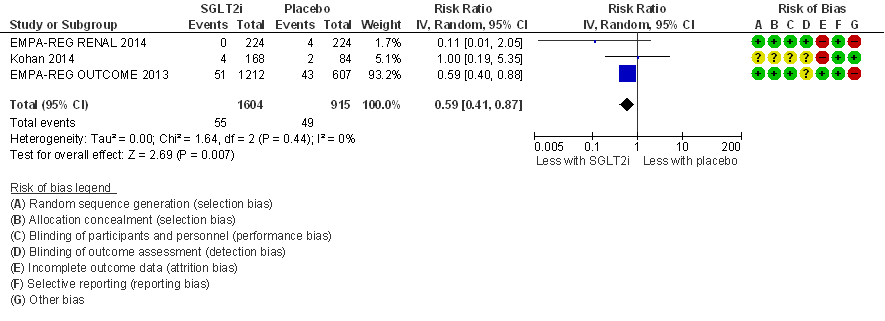
Meta-analyse en forest plot van het effect van SGLT-2-remmers in vergelijking met placebo op het risico op hartfalen. Behandelduur 24 tot 192 weken. Uitkomstmaat: hartfalen. Relatief risico (Risk Ratio, RR; random effects model Zie bijschrift bij Figuur 6 voor extra informatie over de geïncludeerde RCT’s. Gebaseerd op Lo (2018)
Samenvattend: in vergelijking met placebo leidt behandeling met SGLT-2-remmers mogelijk tot een reductie in de cardiovasculaire mortaliteit en waarschijnlijk tot een reductie in het risico op hartfalen, terwijl er geen conclusie mogelijk is over het effect van SGLT-2-remmers op het risico op een myocardinfarct of beroerte.
Acuut nierfalen (acute kidney injury, AKI; cruciale uitkomstmaat)
Lo (2018) analyseert acuut nierfalen. Deze uitkomstmaat wordt niet gerapporteerd in Grunberger (2018).
In drie van in totaal vier RCT’s die deel uit maken van de meta-analyse (figuur 11) is het aantal events zeer gering (≤ 6 events). Alleen de EMPA-REG OUTCOME trial (EMPA-REG OUTCOME, 2013) heeft een aanzienlijk aantal events (in totaal 223 events), en deze studie domineert de meta-analyse. Het relatief risico na pooling bedraagt: RR= 0,78 (95%BI= (0,61; 1,00); 4 studies, n= 2.788 patiënten; I2= 0%) in het voordeel van behandeling met SGLT-2-remmers. Deze resultaten suggereren een verlaagd risico op acuut nierfalen bij behandeling met SGLT-2-remmers in vergelijking met placebobehandeling. Uitgaande van het risico op acuut nierfalen in de EMPA-REG OUTCOME trial van 14% in de placebogroep (bij een behandelduur van 192 weken) komt een risicoreductie met 22% (95%BI= (39%; 0%)) overeen met een NNT van 32 (95%BI= (18; > 700); NNT=23 (13; > 500) bij extrapolatie naar vijf jaar behandeling), waarbij het betrouwbaarheidsinterval overlapt met de grens voor klinische besluitvorming (bij NNT van 100) en vrijwel overlapt met het nuleffect. Het effect van SGLT-2-remmers op het risico op acuut nierfalen is daarmee waarschijnlijk klinisch relevant maar er is ook onzekerheid vanwege ernstige imprecisie. Een belangrijke constatering is dat de effectschatting vrijwel uitsluitend is gebaseerd op een enkele RCT (EMPA-REG OUTCOME, 2013).
Figuur 11
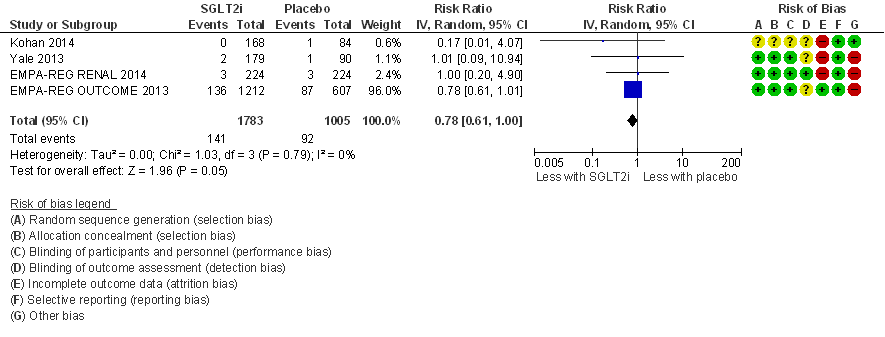
Meta-analyse en forest plot van het effect van SGLT-2-remmers in vergelijking met placebo op het risico op acuut nierfalen. Behandelduur 24 tot 192 weken. Uitkomstmaat: acuut nierfalen. Relatief risico (Risk Ratio, RR; random effects model). Zie bijschrift bij Figuur 6 voor extra informatie over de geïncludeerde RCT’s. Gebaseerd op Lo (2018)
Overige diabetes-gerelateerde complicaties (cruciale uitkomstmaat)
Lo (2018) rapporteert deze uitkomstmaat niet voor SGLT-2-remmers.
Adverse events (bijwerkingen, complicaties, ‘veiligheid’ van de interventie; belangrijke uitkomstmaat)
Lo (2018) analyseert stoppen met medicatie als gevolg van adverse events, hyperkaliëmie, hypoglykemie, hypovolemie, botbreuken, diarree, diabetische ketoacidose, bovenste luchtweginfecties, urineweginfecties en genitale infecties. Grunberger (2018) rapporteert stoppen met medicatie als gevolg van adverse events, hypovolemie, urineweginfecties en genitale infecties. Tabel 1 geeft een overzicht van de resultaten na meta-analyse.
Tabel 1
|
Outcome |
No. of studies |
No. of patients / events |
I2 (%) |
Statistical method |
Effect size (95% CI) |
Remarks |
|
Discontinuation of medication due to AEs |
5* |
1226 / 109 |
0 |
RR |
0.82 (0.58; 1.17) |
|
|
Hyperkalaemia |
4 |
2788 / 139 |
0 |
RR |
0.58 (0.42; 0.81) |
|
|
Hypoglycaemia
|
7 |
3086 / 301 |
0 |
RR |
0.88 (0.73; 1.07) |
Similar results for hypoglycemia requiring third party assistance: RR= 0.47 (0.17; 1.28) |
|
Hypovolaemia |
7* |
3314 / 184 |
33 |
RR |
1.17 (0.67; 2.04) |
|
|
Fractures |
5 |
2860 / 118 |
51 |
RR |
0.81 (0.31; 2.10) |
Statistical heterogeneity due to Kohan (2014) |
|
Diarrhoea |
1 |
448 / 4 |
NA |
RR |
3.00 (0.31; 28.62) |
EMPA-REG RENAL, 2014
|
|
Diabetic ketoacidosis |
2 |
1962 / 3 |
NA |
RR |
1.00 (0.09; 11.02) |
All events are from EMPA-REG OUTCOME, 2013 |
|
Upper respiratory tract infection |
2 |
593 / 47 |
6 |
RR |
0.79 (0.43; 1.44) |
|
|
Urinary tract infection |
8* |
3395 / 231 |
0 |
RR |
1.04 (0.81; 1.33) |
|
|
Genital infection |
8* |
3395 / 115 |
0 |
RR |
2.41 (1.49; 3.88) |
Most events from EMP-REG OUTCOME, 2013 |
|
*including Grunberger (2018) |
||||||
Overzicht van het effect van SGLT-2-remmers in vergelijking met placebo op het risico op adverse events. Relatief risico (RR, random effects model); statistisch significante effectgroottes zijn vetgedrukt. NA not applicable. Gebaseerd op Lo (2018) met aanvullende studie (Grunberger, 2018)
Het percentage patiënten dat stopt met medicatie als gevolg van adverse events, waaronder bijwerkingen van medicatie, is vergelijkbaar tussen de behandelgroepen: 3 tot 17% (gemiddeld 8,8%) bij behandeling met de SGLT-2-remmers versus 2 tot 26% (gemiddeld 9,0%) bij placebobehandeling (5 RCT’s; behandelduur tussen 24 en 52 weken). Het relatief risico na pooling bedraagt: RR= 0,82 (95%BI= (0,58; 1,17)) in het voordeel van de SGLT-2-remmers. Het relatief risico na pooling ligt onder de GRADE-default grens voor klinische relevantie (een verschil in relatief risico van 25% voor dichotome uitkomstmaten; zie Zoeken en selecteren op tabblad Onderbouwing) en het betrouwbaarheidsinterval is breed en overlapt met de grens voor klinische relevantie en het nuleffect. SGLT-2-remmers hebben mogelijk nauwelijks effect op het stoppen van medicatie als gevolg van adverse events, maar deze conclusie is onzeker vanwege ernstige imprecisie.
Het percentage patiënten met hyperkaliëmie varieert tussen 2 en 11% (gemiddeld 4,1%) bij behandeling met de SGLT-2-remmers, in vergelijking met 3 tot 15% (gemiddeld 6,6%) bij placebobehandeling (4 RCT’s; behandelduur tussen 24 en 192 weken). Het relatief risico na pooling bedraagt: RR= 0,58 (95%BI= (0,42; 0,81)) statistisch significant in het voordeel van de SGLT-2-remmers. Het relatief risico na pooling is ook klinisch relevant maar het betrouwbaarheidsinterval overlapt met de (default) grens voor klinische relevantie. Uitgaande van het gemiddelde risico op hyperkaliëmie in de placebogroepen (6,6%; niet gecorrigeerd voor behandelduur) komt een risicoreductie met 42% (95%BI= (19%; 58%)) overeen met een NNT van 36 (95%BI= (26; 80)). In vergelijking met placebo verlagen SGLT-2-remmers waarschijnlijk het risico op hyperkaliëmie maar er is enige onzekerheid vanwege imprecisie.
In geen van in totaal zes RCT’s die deel uit maken van de meta-analyse wordt een statistisch significant verschil in de incidentie van hypoglykemieën waargenomen. Het relatief risico na pooling bedraagt: RR= 0,88 (95%BI= (0,73; 1,07)) in het voordeel van de SGLT-2-remmers maar statistisch niet significant. Het betrouwbaarheidsinterval is breed en overlapt met de (default) grens voor klinische relevantie en het nuleffect. Een vergelijkbaar beeld ontstaat als de analyse wordt beperkt tot hypoglykemieën waarbij sprake is van noodzaak voor hulp door derden (zie tabel 1). In vergelijking met placebo hebben SGLT-2-remmers mogelijk nauwelijks effect op de incidentie van hypoglykemieën, maar deze conclusie is onzeker vanwege ernstige imprecisie.
In geen van in totaal zeven RCT’s die deel uit maken van de meta-analyse wordt een statistisch significant verschil in de incidentie van hypovolemie waargenomen. Het relatief risico na pooling bedraagt: RR= 1,17 (95%BI= (0,67; 2,04)) in het voordeel van placebo maar statistisch niet significant. Het betrouwbaarheidsinterval is breed en overlapt aan weerszijden met de (default) grens voor klinische relevantie. In vergelijking met placebo hebben SGLT-2-remmers mogelijk nauwelijks effect op de incidentie van hypovolemie, maar deze conclusie is onzeker vanwege ernstige imprecisie.
In geen van in totaal vijf RCT’s die deel uit maken van de meta-analyse wordt een statistisch significant verschil in de incidentie van botbreuken waargenomen. Het relatief risico na pooling bedraagt: RR= 0,81 (95%BI= (0,31; 2,10)) in het voordeel van SGLT-2-remmers maar statistisch niet significant. Het betrouwbaarheidsinterval is breed en overlapt aan weerszijden met de (default) grens voor klinische relevantie. In vergelijking met placebo hebben SGLT-2-remmers mogelijk nauwelijks effect op de incidentie van botbreuken, maar deze conclusie is onzeker vanwege ernstige imprecisie.
De uitkomstmaat diarree wordt maar in een RCT gerapporteerd, er is geen uitspraak mogelijk vanwege een te gering aantal events (totaal vier events; EMPA-REG RENAL, 2014). Dit geldt ook voor de uitkomstmaat diabetische ketoacidose (totaal drie events; EMPA-REG OUTCOME, 2013).
Bovenste luchtweginfecties worden in twee RCT’s gerapporteerd: relatief risico na pooling RR= 0,79 (95%BI= (0,43; 1,44)) in het voordeel van SGLT-2-remmers maar statistisch niet significant. Het betrouwbaarheidsinterval is breed en overlapt aan weerszijden met de (default) grens voor klinische relevantie. In vergelijking met placebo hebben SGLT-2-remmers mogelijk nauwelijks effect op het optreden van bovenste luchtweginfecties, maar deze conclusie is onzeker vanwege ernstige imprecisie.
In geen van in totaal acht RCT’s die deel uit maken van de meta-analyse wordt een statistisch significant verschil in de incidentie van urineweginfecties waargenomen. Het relatief risico na pooling bedraagt: RR= 1,04 (95%BI= (0,81; 1,33); statistisch niet significant). Het betrouwbaarheidsinterval is breed en overlapt met de (default) grens voor klinische relevantie. In vergelijking met placebo hebben SGLT-2-remmers waarschijnlijk nauwelijks effect op de incidentie van urineweginfecties, maar deze conclusie is enigszins onzeker vanwege imprecisie.
Het percentage patiënten met genitale infecties varieert tussen 0 en 9% (gemiddeld 4,4%) bij behandeling met de SGLT-2-remmers, in vergelijking met 0 tot 3,6% (gemiddeld 1,6%) bij placebobehandeling (8 RCT’s; behandelduur tussen 24 en 192 weken). Het relatief risico na pooling bedraagt: RR= 2,41 (95%BI= (1,49; 3,88)) statistisch significant en klinisch relevant in het voordeel van placebo. Uitgaande van het gemiddelde risico op genitale infecties in de placebogroepen (1,6%; niet gecorrigeerd voor behandelduur) komt dit verhoogde risico op genitale infecties bij behandeling met SGLT-2-remmers overeen met een number needed to harm (NNH) van 44 (95%BI= (22; 128)). In vergelijking met placebo resulteert behandeling met SGLT-2-remmers daarmee in een verhoogd risico op genitale infecties, maar deze conclusie is enigszins onzeker vanwege imprecisie (gering aantal events na pooling, vrijwel geheel gebaseerd op een RCT).
Samenvattend in vergelijking met placebo hebben SGLT-2-remmers mogelijk nauwelijks effect op het stoppen van medicatie als gevolg van adverse events, de incidentie van hypoglykemieën, hypovolemie, botbreuken, en bovenste luchtweginfecties. SGLT-2-remmers hebben waarschijnlijk nauwelijks effect op de incidentie van urineweginfecties. Behandeling met SGLT-2-remmers verlaagt daarentegen waarschijnlijk het risico op hyperkaliëmie, en verhoogt het risico op genitale infecties. Er is geen uitspraak mogelijk over de effecten van SGLT-2-remmers op de uitkomstmaten diarree en diabetische ketoacidose.
Overige uitkomstmaten (ziekenhuisopname, kwaliteit van leven (HRQoL), patiënttevredenheid en kosten; belangrijke uitkomstmaten)
Ziekenhuisopname, kwaliteit van leven (HRQoL) en patiënttevredenheid en kosten worden niet gerapporteerd in Lo (2018)
Bewijskracht van de literatuur
De bewijskracht (GRADE-methodiek) is bepaald per vergelijking en uitkomstmaat, en is in alle gevallen gebaseerd op resultaten uit gerandomiseerd onderzoek en start derhalve hoog. Vervolgens is de bewijskracht verlaagd als er sprake was van relevante tekortkomingen op een of meerdere GRADE-domeinen: risk of bias, inconsistentie, indirectheid, imprecisie, publicatiebias (zie Werkwijze op het tabblad Verantwoording).
De nummering verwijst naar de opeenvolgende literatuurconclusies:
- De bewijskracht is verlaagd met 1 niveau vanwege risk of bias; bewijskracht is REDELIJK.
- De bewijskracht is verlaagd met 1 niveau vanwege risk of bias; bewijskracht is REDELIJK.
- De bewijskracht is verlaagd met 1 niveau vanwege risk of bias; bewijskracht is REDELIJK.
- De bewijskracht is verlaagd met 2 niveaus vanwege ernstige imprecisie (overlap BI met het nuleffect); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege ernstige imprecisie (overlap BI met het nuleffect); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (zeer breed BI overlapt aan weerszijden met de grens voor klinische besluitvorming); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau vanwege imprecisie (gering aantal events); bewijskracht is REDELIJK.
- De bewijskracht is verlaagd met 2 niveaus vanwege imprecisie (breed BI overlapt met de grens voor klinische besluitvorming en vrijwel met het nuleffect); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 2 niveaus vanwege ernstige imprecisie (overlap BI met de grens voor klinische relevantie en het nuleffect); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau vanwege imprecisie (overlap BI met grens klinische relevantie); bewijskracht is REDELIJK.
- De bewijskracht is verlaagd met 2 niveaus vanwege ernstige imprecisie (overlap BI met een of beide grenzen voor klinische relevantie en het nuleffect); bewijskracht is LAAG.
- De bewijskracht is verlaagd met 1 niveau vanwege imprecisie (overlap met grens klinische relevantie); bewijskracht is REDELIJK.
- De bewijskracht is verlaagd met 1 niveau vanwege imprecisie (vrijwel geheel gebaseerd op een RCT; geringe statistische power); bewijskracht is REDELIJK.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (PICO):
P: volwassen patiënten met diabetes mellitus type 1 of type 2 met nefropathie;
I: SGLT-2-remmers;
C: placebo of GLP-1-agonist;
O: gunstige en ongunstige effecten van de interventies (zie ‘Relevante uitkomstmaten’).
Relevante uitkomstmaten
De werkgroep achtte nierziekteprogressie (daling van glomerulaire filtratiesnelheid (momenteel vaak bepaald door een formule: de eGFR); stijging (verdubbeling van) serum creatinine; optreden eindstadium nierfalen, ESRD), toename proteïnurie (albuminurie), mortaliteit (totaal), hart- en vaatziekten (morbiditeit, mortaliteit), optreden acute nierschade (AKI) en overige diabetes-gerelateerde complicaties, cruciale uitkomstmaten voor de besluitvorming. Ziekenhuisopname, kwaliteit van leven (HRQoL) en patiënttevredenheid, adverse events (bijwerkingen, complicaties, ‘veiligheid’ van de interventie) en kosten (kosteneffectiviteit) werden benoemd als belangrijke uitkomstmaten voor de besluitvorming. De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De huidige richtlijn focust op diabetische nefropathie en daarom is de literatuuranalyse met name gericht op renale eindpunten. Overige uitkomstmaten zoals cardiovasculaire eindpunten, glykemische controle en veiligheid van de interventies zijn eveneens van (groot) belang maar daarvoor wordt ook verwezen (zie Overwegingen) naar vigerende richtlijnen zoals de richtlijn Diabetes mellitus type 2 in de tweede lijn (NIV, 2018).
Als grenzen voor klinische relevantie werden de door de internationale GRADE working group voorgestelde default grenzen gehanteerd: een verschil in relatief risico van 25% bij dichotome uitkomstmaten, en een verschil van een halve standaarddeviatie voor continue uitkomstmaten. Voor ernstige (harde) uitkomstmaten (eindstadium nierfalen, mortaliteit, ernstige morbiditeit zoals beroerte, myocardinfarct, hartfalen en acute nierschade) werd een grens voor klinische besluitvorming gehanteerd op basis van absolute risicoreductie: een number needed to treat (NNT) van maximaal 100 bij vijf jaar behandeling.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Elsevier) is, in een gecombineerde zoekactie voor beide submodules, op 22 maart 2018 met relevante zoektermen vanaf 2010 gezocht naar systematische reviews (SR’s) die de effecten van SGLT-2-remmers en GLP-1-agonisten onderzochten bij personen met diabetes type 1 of type 2 en nefropathie. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De zoekactie werd niet beperkt tot personen met nefropathie om geen studies uit te sluiten die zijn uitgevoerd bij personen met diabetes ongeacht de nierfunctie op baseline, maar wel een subgroepsanalyse bevatten bij personen met nefropathie. De literatuurzoekactie leverde 429 treffers op. Op basis van titel en abstract werden in eerste instantie 13 SR’s voorgeselecteerd. Alle SR’s betroffen personen met DM2, er werden geen SR’s gevonden voor personen met DM1. De SR’s werden allen geëxcludeerd toen op 24 september 2018 een Cochrane review verscheen (Lo, 2018) die van zeer goede kwaliteit is en de uitgangsvraag (beide submodules) volledig dekt. Deze SR includeert RCT’s tot 12 februari 2018 en is aangevuld met recentere relevante RCT’s op basis van een zoekactie op 8 mei 2018 naar RCT’s bij personen met DM2. Van de 761 hits werden op basis van titel en abstract 6 studies verschenen in 2018 voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 5 studies geëxcludeerd (zie exclusietabel) en 1 definitief geselecteerd (Grunberger, 2018). Tenslotte is in een aparte zoekactie op 3 mei 2018 voor beide submodules gezocht vanaf 2010 naar relevante RCT’s bij personen met DM1. Van de 195 hits werden op basis van titel en abstract 9 studies voorgeselecteerd die na raadpleging van de volledige tekst allen werden geëxcludeerd (zie exclusietabel). Bij de literatuurselectie werden de volgende selectiecriteria gehanteerd: (systematisch review van) gerandomiseerd vergelijkend onderzoek bij volwassenen met diabetes mellitus type 1 of 2 en nefropathie (of een subgroepsanalyse bij personen met nefropathie); vergelijking van SGLT-2-remmer (submodule SGLT-2-remmers) of GLP-1-receptoragonist (submodule GLP-1-agonisten) met placebo of alternatieve interventie (SGLT-2-remmer of GLP-1-receptoragonist), tenminste 1 jaar follow-up en tenminste 50 patiënten per groep, en rapportage van een relevante uitkomstmaat met betrekking tot nierschade. RCT’s met een cross-over design werden uitgesloten. Systematische reviews met afwijkende inclusiecriteria werden niet a priori uitgesloten als relevante sensitiviteits- of subgroepanalyses mogelijk waren.
De literatuuranalyse voor de submodule SGLT-2-remmers is met betrekking tot personen met DM2 gebaseerd op een systematische review (Lo, 2018) aangevuld met een RCT (Grunberger, 2018). De literatuuranalyse voor de submodule GLP-1-agonisten is met betrekking tot personen met DM2 eveneens gebaseerd op de systematische review (Lo, 2018), er werden geen aanvullende RCT’s gevonden. Er werden geen relevante SR’s of RCT’s gevonden naar SGLT-2-remmers of GLP-1-agonisten bij personen met DM1. Lo (2018) sloot RCT’s bij personen met DM1 niet uit, maar vond voor deze patiëntengroep geen RCT’s waarin de effecten van SGLT-2-remmers of GLP-1-agonisten werden onderzocht.
De beoordeling van de individuele studieopzet (risk of bias) van de geselecteerde SR en aanvullende RCT is opgenomen in de risk of bias tabellen. De belangrijkste studiekarakteristieken en resultaten van de aanvullende studie zijn opgenomen in de evidencetabel. Voor de beoordeling van de individuele studieopzet (risk of bias), studiekarakteristieken en resultaten van de studies geïncludeerd in de Cochrane SR wordt verwezen naar de bewuste SR (Lo, 2018).
Referenties
- Arakaki RF. Sodium-glucose cotransporter-2 inhibitors and genital and urinary tract infections in type 2 diabetes. Postgrad Med. 2016 May;128(4):409-17. doi: 10.1080/00325481.2016.1167570. Epub 2016 Apr 4. Review. PubMed PMID: 26982554.
- Buse JB, Garg SK, Rosenstock J, et al. Sotagliflozin in Combination With Optimized Insulin Therapy in Adults With Type 1 Diabetes: The North American inTandem1 Study. Diabetes Care. 2018 Sep;41(9):1970-1980. doi: 10.2337/dc18-0343. Epub 2018 Jun 24. PubMed PMID: 29937430; PubMed Central PMCID: PMC6105319.
- CBG (2019). DHPC SGLT2-remmers. Risico op gangreen van Fournier bij gebruik van SGLT2-remmers.Link: https://www.cbg-meb.nl/documenten/brieven/2019/01/21/dhpc-sglt2-remmers (geraadpleegd 24 januari 2019).
- Coresh J, Heerspink HJL, Sang Y, et al.; Chronic Kidney Disease Prognosis Consortium and Chronic Kidney Disease Epidemiology Collaboration. Change in albuminuria and subsequent risk of end-stage kidney disease: an individual participant-level consortium meta-analysis of observational studies. Lancet Diabetes Endocrinol. 2019 Feb;7(2):115-127. doi: 10.1016/S2213-8587(18)30313-9. Epub 2019 Jan 8. PubMed PMID: 30635225.
- Davies MJ, D'Alessio DA, Fradkin J, et al. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2018 Dec;61(12):2461-2498. doi: 10.1007/s00125-018-4729-5. PubMed PMID: 30288571.
- FDA (2016). FDA Drug Safety Communication: FDA strengthens kidney warnings for diabetes medicines canagliflozin (Invokana, Invokamet) and dapagliflozin (Farxiga, Xigduo XR). Link: https://www.fda.gov/Drugs/DrugSafety/ucm505860.htm (geraadpleegd 9 april 2019).
- Grunberger G, Camp S, Johnson J, et al. Ertugliflozin in Patients with Stage 3 Chronic Kidney Disease and Type 2 Diabetes Mellitus: The VERTIS RENAL Randomized Study. Diabetes Ther. 2018 Feb;9(1):49-66. doi: 10.1007/s13300-017-0337-5. Epub 2017 Nov 20. PubMed PMID: 29159457.
- Home P. Cardiovascular outcome trials of glucose-lowering medications: an update. Diabetologia. 2019 Jan 3. doi: 10.1007/s00125-018-4801-1. (Epub ahead of print) Review. PubMed PMID: 30607467.
- KDIGO (2002). National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis. 2002 Feb;39(2 Suppl 1):S1-266. PubMed PMID: 11904577.
- KDIGO (2011). Levey AS, de Jong PE, Coresh J, El Nahas M, Astor BC, Matsushita K, Gansevoort RT, Kasiske BL, Eckardt KU. The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report. Kidney Int. 2011 Jul;80(1):17-28. doi: 10.1038/ki.2010.483. Epub 2010 Dec 8. Erratum in: Kidney Int. 2011 Nov;80(9):1000. Kidney Int. 2011 Nov 1;80(9):1000. PubMed PMID: 21150873.
- Lo C, Toyama T, Wang Y, et al. Insulin and glucose-lowering agents for treating people with diabetes and chronic kidney disease. Cochrane Database Syst Rev. 2018 Sep 24;9:CD011798. doi: 10.1002/14651858.CD011798.pub2. Review. PubMed PMID: 30246878.
- Muskiet MHA, Wheeler DC, Heerspink HJL. New pharmacological strategies for protecting kidney function in type 2 diabetes. Lancet Diabetes Endocrinol. 2018 Dec 19. pii: S2213-8587(18)30263-8. doi: 10.1016/S2213-8587(18)30263-8. (Epub ahead of print) Review. PubMed PMID: 30579729.
- NfN (2018). Richtlijn Behandeling van patiënten met diabetes mellitus en chronische nierschade stadium 3b of hoger (eGFR < 45 ml/min/1,73 m2). Link: https://www.nefro.nl/sites/www.nefro.nl/files/richlijnen/DM%20bij%20CNS%203b%20of%20hoger%2C%202018.pdf (geraadpleegd 15 februari 2019).
- Nierstichting en Nierpatiënten Vereniging Nederland (2016). Let op bij (dreigende) uitdroging: Soms moet u uw medicijnen even overslaan. Link: https://www.nierstichting.nl/media/filer_public/2d/97/2d97bbc9-140e-436a-8601-61a903dcba5d/folder_soms_moet_u_uw_medicijnen_even_overslaan.pdf (geraadpleegd 11 april 2019).
- NIV (2018). Diabetes mellitus type 2 in de tweede lijn. Link: https://richtlijnendatabase.nl/richtlijn/diabetes_mellitus_type_2_in_de_tweede_lijn (geraadpleegd 14 september 2018).
- NIV (2020). Modulaire revisie van diabetesrichtlijnen. Zie Link: https://richtlijnendatabase.nl/richtlijn/startpagina_diabetes_mellitus/startpagina_diabetes_mellitus_richtlijnen.html#tab-content-general (geraadpleegd 30 maart 2020).
- Perkovic V, Jardine MJ, Neal B, et al.; CREDENCE Trial Investigators. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med. 2019 Apr 14. doi: 10.1056/NEJMoa1811744. (Epub ahead of print) PubMed PMID: 30990260.
- Peters AL, Henry RR, Thakkar P, et al. Diabetic Ketoacidosis With Canagliflozin, a Sodium-Glucose Cotransporter 2 Inhibitor, in Patients With Type 1 Diabetes. Diabetes Care. 2016 Apr;39(4):532-8. doi: 10.2337/dc15-1995. PubMed PMID: 26989182.
- Rahman W, Solinsky PJ, Munir KM, Lamos EM. Pharmacoeconomic evaluation of sodium-glucose transporter-2 (SGLT2) inhibitors for the treatment of type 2 diabetes. Expert Opin Pharmacother. 2018 Nov 9:1-11. doi: 10.1080/14656566.2018.1543408. (Epub ahead of print) PubMed PMID: 30412008.
- Rosenstock J, Marquard J, Laffel LM, et al. Empagliflozin as Adjunctive to Insulin Therapy in Type 1 Diabetes: The EASE Trials. Diabetes Care. 2018 Dec;41(12):2560-2569. doi: 10.2337/dc18-1749. Epub 2018 Oct 4. PubMed PMID: 30287422.
- Vallon V, Thomson SC. Targeting renal glucose reabsorption to treat hyperglycaemia: the pleiotropic effects of SGLT2 inhibition. Diabetologia. 2017 Feb;60(2):215-225. doi: 10.1007/s00125-016-4157-3. Epub 2016 Nov 22. Review. PubMed PMID: 27878313; PubMed Central PMCID: PMC5884445.
- Verma S, Mazer CD, Al-Omran M, et al. Cardiovascular Outcomes and Safety of Empagliflozin in Patients With Type 2 Diabetes Mellitus and Peripheral Artery Disease: A Subanalysis of EMPA-REG OUTCOME. Circulation. 2018 Jan 23;137(4):405-407. doi: 10.1161/CIRCULATIONAHA.117.032031. Epub 2017 Nov 13. PubMed PMID: 29133602.
- Wiviott SD, Raz I, Bonaca MP, et al.; DECLARE–TIMI 58 Investigators. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2018 Nov 10. doi: 10.1056/NEJMoa1812389. (Epub ahead of print) PubMed PMID: 30415602.
- Zelniker TA, Wiviott SD, Raz I, et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet. 2019 Jan 5;393(10166):31-39. doi: 10.1016/S0140-6736(18)32590-X. Epub 2018 Nov 10. PubMed PMID: 30424892.
Evidence tabellen
Risk of bias table for intervention studies (randomized controlled trials)
Research question: What is the value of SGLT-2 inhibitors (subquestion-1) and GLP-1 agonists (subquestion-2) in the treatment of diabetic patients with nephropathy, in particular in relation to the preservation of kidney function?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Grunberger , 2018 |
Randomization implemented centrally using interactive voice response system/ integrated web response system |
Unlikely |
Unlikely*1 |
Unlikely*1 |
Unlikely*1 |
Likely*1 |
Unclear*1 |
Unclear*1 |
*1 The sponsor was unblinded after week 26 but stated that personnel and patients at contract research organization remained blinded; UACR and eGFR not included in the trial registry, UACR mentioned in methods section but poorly reported in results section, eGFR not mentioned in methods section and poorly reported in results section; eGFR data lack sufficient detail (not clear whether GFR is reported for 3A or 3B subcohort, number of patients unclear); overall high risk of bias (for UACR and eGFR)
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea, 2007; BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher, 2009; PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: What is the value of SGLT-2 inhibitors (subquestion-1) and GLP-1 agonists (subquestion-2) in the treatment of diabetic patients with nephropathy, in particular in relation to the preservation of kidney function?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Lo, 2018 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes*1 |
Yes |
*1 insufficient number of studies in meta-analyses to allow a statistical analysis of potential publication bias (funnel plot)
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Evidence table
Research question: What is the value of SGLT-2 inhibitors (subquestion-1) in the treatment of diabetic patients with nephropathy, in particular in relation to the preservation of kidney function?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
SGLT-2 inhibitors |
|||||||
|
Lo, 2018
PS. study characteristics and results are extracted from the SR (unless stated otherwise) |
Cochrane SR and meta-analysis of RCTs
Literature search up to feb 2018
9 RCTs on SGLT-2 inhibitors
A: EMPA-REG BP, 2015 B: EMPA-REG OUTCOME, 2013 C: EMPA-REG RENAL, 2014 D: Haneda, 2016 E: Kaku, 2014 F: Kohan, 2014 G: LANTERN, 2015 H: Yale, 2013 I: Zambrowicz, 2015
Study design: RCT (parallel)
Setting and Country: see Lo, 2018
Source of funding and conflicts of interest: funding source SR not reported, no COI for most authors; most included RCTs have commercial funding and several coauthors are employed by the sponsor: see Comments |
Inclusion criteria SR: RCTs, quasi-RCTs and cross-over studies (first phase only); comparison of metformin, insulin, sulphonylurea, glinides, glitazones, glucosidase inhibitors, GLP-1 agonists, DPP-4 inhibitors, SGLT2 inhibitors, amylin analogues, bromocriptine (head-to-head or to placebo, control, standard care); adults and children with diabetes and CKD.
Exclusion criteria: transplant recipients (kidney, pancreas and islet cell).
Definition CKD: eGFR < 60 mL/min/1.73 m2 or KDIGO GFR stages 3 to 5.
9 studies (2,072 participants with CKD) in SR and meta-analysis
Important patient characteristics at baseline: All studies enrolled only DM2. For more details see Lo, 2018
Mean age; % Male A: 60 (adults); 60% B: 67 (adults); 68% C: - ; - D: 68; 77% E: 59 (adults); 59% F: 67 (adults); 65% G: 64 (adults); 78% H: 68 (adults); 61% I: 66; 55%
PS. See column ‘Comments’ for the most relevant inclusion and exclusion criteria of the RCTs included in the systematic review |
SGLT-2 inhibitor Luseogliflozin: D Dapagliflozin: E, F Ipragliflozin: G Canagliflozin: H LX4211*: I *dual SGLT-1 /-2 inhibitor
N patients; daily dose A1: 276; 10 mg A2: 276; 25 mg B1: 2345; 10 mg B2: 2342; 25 mg C1: 98; 10 or 25 mg (CKD-2) C2: 188; 25 mg (CKD-3) C3: 37; 25 mg (CKD-4) D: 95; 2.5 mg E1: 86; 5 mg E2: 88; 10 mg F1: 83; 5 mg F2: 85; 10 mg G: 119; 50 mg H1: 89; 300 mg H2: 90; 100 mg I: 16; 400 mg
Several studies also include patients w/o CKD: below the number of patients with CKD
N patients eGFR<60 A1: 13 A2: 21 B: 1212 (B1 + B2) C2: 188; 25 mg (CKD-3) C3: 37; 25 mg (CKD-4) D: 95 E: 72 incl placebo group F1: 83 F2: 85 G: 58 H1: 89 H2: 90 I: 16
Total (all intervention and placebo groups): 2,072 patients with CKD
|
Placebo
A: 271 B: 2333 C1: 97 (CKD-2) C2: 187 (CKD-3) C3: 37 (CKD-4) D: 50 E: 86 F: 84 G: 46 H: 90 I: 15
N patients eGFR<60 A: 11 B: 607 C2: 187 (CKD-3) C3: 37 (CKD-4) D: 50 E: 72 incl interv groups F: 84 G: 23 H: 90 I: 15
|
End-point of follow-up: A: 12 (14) weeks B: 192 weeks C: 52 (55) weeks D: 24 (52) weeks E: 24 weeks F: 24 (52, 104) weeks G: 24 (52) weeks H: 26 (52) weeks I: 7 days
For how many participants were no complete outcome data available? (intervention/control) A1,2: 4%, 4% / 5.9% B: 3.5%, 2.7% / 2.9% C2: 12% / 7% (CKD-3) C3: 30% / 32% (CKD-4) D: not reported E1,2: 6%, 10% / 9.1 F1,2: 13%, 19 / 26.2 G: 10% / 9% H1,2: 26%, 15% / 29% I: 6% / 0%
Methods (statistics): Standard pairwise meta-analysis
|
Primary outcomes 1. HbA1c 2. Fasting blood glucose (FBG) Secondary outcomes 1. Kidney function (creatinine, estimated GFR (eGFR), albuminuria) 2. Systolic and diastolic BP 3. Lipids 4. Body weight 5. Death (all causes) 6. Macrovascular events 7. Microvascular events 8. Safety i) Hypoglycaemia ii) Discontinuation of medication due to adverse events iii) Other adverse events as described by the author
See guideline text for a summary of results (random-effects) on relevant outcomes
See Lo (2018) for more study details EMPA-REG BP, 2015 p102 EMPA-REG OUTCOME, 2013 p105 EMPA-REG RENAL, 2014 p108 Haneda, 2016 p113 Kaku, 2014 p121 Kohan, 2014 p122 LANTERN, 2015 p128 Yale, 2013 p158 Zambrowicz, 2015 p162 |
Authors conclude that SGLT2 inhibitors are probably efficacious for glucose-lowering and probably reduce BP, heart failure, and hyperkalaemia but increase genital infections, and slightly increase creatinine. More high quality studies are required to help guide therapeutic choice for glucose-lowering in diabetes and CKD.
Note: all studies enrolled only patienst with DM2
RoB: detailed RoB using Cochrane RoB tool (see Lo, 2018, p13); remarks: A: funding bias and COI B: funding bias and COI C: funding bias and COI D: not registered; funding bias and COI E: not registered; funding bias and COI F: placebo not mentioned G: funding bias and COI H: funding bias and COI I: funding bias and COI
Note: Lo (2018) includes all 11 classes of pharmacological glucose-lowering drugs; data in this table are limited to SGLT-2 inhibitors
Inclusion and exclusion criteria of included studies: A: ≥18 yrs, BMI≤45, DM2, hypertension; HbA1c 7-10%; 1-2 antihypertensive medications; drug naive or pretreated with antidiabetes therapy; Exclusion: secondary hypertension; indication liver disease; acute coronary syndrome, stroke, or TIA; anti-obesity drugs B: ≥18 years, BMI≤45, DM2; eGFR≥30; established CVD; no or stable glucose-lowering therapy for >12 weeks before randomisation; HbA1c 7-10%; Exclusion: uncontrolled hyperglycaemia; indication of liver disease; medical history of cancer; anti-obesity drugs; acute coronary syndrome, stroke, or TIA C: ≥ 18 yrs, DM2, BMI≥45; HbA1c 7-10%; eGFR< 90; no or stable therapy on antidiabetes drugs (excluding SGLT2 inhibitors) for >12 weeks before randomisation; Exclusion: uncontrolled hyperglycaemia; kidney transplant; eGFR<15; requirement for chronic or acute dialysis; acute coronary syndrome, stroke, or TIA; liver disease; cancer; anti-obesity drugs D: DM2; eGFR≥30-60; diet/exercise therapy or 1-2 OHAs at a fixed dose; Exclusion: kidney disease with severe proteinuria; a history of dialysis; at risk of developing ESKD before study completion E: ≥20 yrs; DM2; Exclusion: creatinine kinase >3× ULN; eGFR <45 or SCR>133 (men) and >124 (women); severe hepatic insufficiency or abnormal liver function; congestive HF; thiazolidinediones <6 months before enrolment F:≥18 yrs; DM2; HbA1c 7-11%; eGFR 30-59; BMI≤45; Exclusion: AST or ALT >3.0x ULN; history of DKA; uncontrolled hypertension; cardiovascular/vascular diseases within 6 months of enrolment; need for HD or RRT; history of rapidly progressing kidney disease, kidney transplant; hepatic disease G:20-74 yrs; DM2; diet/exercise therapy or in combination with alphaglucosidase inhibitor, SU or pioglitazone; HbA1c 6.9-8.9%; change in HbA1c ≤ 1.0% between visits 1 and 2; BMI 20-45; eGFR 60-90 or 30-60; Exclusion: insulin within 12 weeks before visit 1; current or scheduled dialysis; history clinically significant kidney disease; unstable angina, MI, vascular intervention or heart failure H: DM2; ≥25 yrs; HbA1c 7-10.5%; eGFR 30-50; not or stable glucose-lowering therapy; Exclusion: kidney disease requiring immunosuppressive therapy, dialysis or transplant; nephrotic syndrome or inflammatory kidney disease; MI, unstable angina, revascularization procedure or CVA I: DM2; eGFR<60; Exclusion: kidney allograft; expecting to require dialysis or undergo kidney transplantation; active hepatic disease; history of MI or stable angina or coronary revascularisation; congestive HF; uncontrolled hypertension; history of malignancy within 5 years of recruitment |
|
Grunberger , 2018
|
RCT
NCT01986855
2013-2016
Study design: RCT (parallel; 3 arms)
Setting and Country 121 centers in 13 countries (Argentina, Bulgaria, Colombia, Hungary, Israel, Mexico, Philippines, Poland, Romania, Russia, South Africa, United Kingdom, United States).
Source of funding and conflicts of interest: Merck Sharp & Dohme Corp. a subsidiary of Merck & Co., Inc., Kenilworth, NJ, USA and Pfizer Inc.; most coauthors employed by the sponsor (manufacturer of ertugliflozin)
|
Inclusion criteria: >=25 years; T2DM; stage 3 CKD (eGFR 30-60 mL/min/1.73m2 using MDRD equation); stable renal function; HbA1c 7.0–10.5% on diet/exercise with or without antihyperglycemic medication (including insulin and sulfonylureas).
Patients on metformin required to undergo >= 10-week metformin wash-off
Exclusion criteria: patients on metformin, rosiglitazone, and other SGLT2 inhibitors; history of DM1 or ketoacidosis; renal-related medical history, renal or systemic vasculitis, renal dialysis, renal transplant, or renal disease requiring immunosuppressive agents and others (see paper)
Definition stage 3 CKD: eGFR 30-60 mL/min/1.73m2 using MDRD equation
N=468 randomized N=467 received allocated intervention
Important patient characteristics at baseline:
Mean age; % Male 67 (adults); 50%
Dur DM2:14.2 yrs BMI 32.5 HbA1c 8.2% eGFR 46.6 antihyp glyc 97% Insulin 56% SU 40% |
Ertugliflozin
N patients; daily dose A1: 158; 5 mg A2: 155; 15mg
While continuing a diet/exercise regimen and background antihyper-glycemic therapy (if applicable)
|
Placebo
Placebo packaged identically C: 154
While continuing a diet/exercise regimen and background antihyper-glycemic therapy (if applicable)
|
End-point of follow-up: 26 (primary endpoint) + 26 extension (= 52 weeks) + 2 weeks (post-treatment assessment)
For how many participants were no complete outcome data available? A1: 17 (11%); 10 AE, 2 death, 1 Hypo, 1 physician decision, 3 withdrawal by patient A2: 16 (10%); 5 AE, 1 excluded medication, 2 physician decision, 8 withdrawal C: 17 (11%); 5 AE, 1 physician decision, 2 protocol violation, 2 patients moved, 7 withdrawal
% completion at week 26: A1/A2/C = 89%/89%/89% (84%/80%/84% at week 52)
|
At week 26: change from baseline in HbA1c (prim endpoint) in overall cohort; sec endpoints only analysed in stage 3A CKD cohort (eGFR 45-60 mL/min/1.73m2): change in HbA1c, body weight, SBP, FPG, proportion patients with HbA1c<7.0% and others*; safety analysis (26 and 52 weeks in overall cohort)
*change in eGFR (mL/min/1.73m2) eGFR analysed but only graph presented (Fig. 2 in paper): estimated at 52 weeks for highest dose of ertugliflozin (assuming stage 3A cohort w/o exclusion of metformin users, with N= 97 and 99 in intervention and control)
Mean and SD (or 95% CI) A2: -1.15 (SD 6.50) C: 0.2 (SD 6.67) Diff: -1.35 (-3.19; 0.49) NS
Safety (at week 52) % total patients A1/A2/C Any AEs 85/74/81 Drug-related AEs 25/10/15 Serious AEs 17/19/16 AEs discont 8/4/5 Deaths 1.9/2.6/1.9 Urin tr infection 6/12/14 Genital myco infect: Women 5.4/3.8/2.4 Men 3.6/0.0/0.0 Hypovolemia 4.4/2.6/0.6 Sympt Hypo 25/18/23
|
Authors conclude that reductions in blood glucose and body weight were observed with ertugliflozin in patients with T2DM and stage 3 CKD; and that ertugliflozin had an acceptable safety profile
Note: some analyses only performed in subcohort with eGFR 45-60 (stage 3A subcohort); RCT involved 121 centres i.e. on average only 4 patients per centre (seeding trial?); UACR is mentioned in the text but data are not shown; in post-hoc analyses metformin users (protocol violation) were excluded.
Note: eGFR outcome was not registered and is only presented in a graph; details are lacking: patient number etc were not provided. Therefore the eGFR estimate maybe inaccurate/ unreliable.
Note: patients, investigators, sponsor, and contract research organization personnel blinded to group assignments during first 26-week phase; only sponsor unblinded after week 26 (to allow clinical study report) |
Tabel Exclusie na het lezen van het volledige artikel (beide submodules)
|
Auteur en jaartal |
Redenen van exclusie |
|
Mogelijke SR’s (beide submodules; DM1, DM2) |
|
|
Zhang, 2018 |
Verkeerde PICO (DM2 zonder nefropathie) |
|
Seidu, 2018 |
SR zonder meerwaarde ten opzichte van Lo, 2018 |
|
Xu, 2017 |
SR zonder meerwaarde ten opzichte van Lo, 2018 |
|
Zou, 2017 |
Geen SR (narrative review) |
|
Dicembrini, 2017 |
SR zonder meerwaarde ten opzichte van Lo, 2018 |
|
Tang, 2017 |
SR zonder meerwaarde ten opzichte van Lo, 2018 |
|
Scheen, 2017 |
Geen SR (narrative review) |
|
Gargiulo, 2017 |
SR zonder meerwaarde ten opzichte van Lo, 2018 |
|
Storgaard, 2016 |
SR zonder meerwaarde ten opzichte van Lo, 2018 |
|
Patel, 2016 |
SR zonder meerwaarde ten opzichte van Lo, 2018 |
|
Roussel, 2015 |
SR van mindere kwaliteit, zonder meta-analyse |
|
Giorda, 2014 |
SR van mindere kwaliteit zonder meerwaarde ten opzichte van Lo, 2018 |
|
De Nicola, 2014 |
Geen SR (narrative review) |
|
Mogelijke RCT’s (aanvullende zoekactie voor beide submodules; DM2) |
|
|
Wanner, 2018 |
Opgenomen in sleutel-SR (Lo, 2018) |
|
Wanner, 2018b |
Geen RCT (narrative review) |
|
Guthrie, 2018 |
Geen RCT (narrative review) |
|
Guthrie, 2018b |
Geen RCT (narrative review) |
|
Dekkers, 2018 |
Cross-over RCT |
|
Mogelijke RCT’s (aanvullende zoekactie voor beide submodules; DM1) |
|
|
Kawanami, 2017 |
Geen RCT (narrative review) |
|
Katsiki, 2017 |
Geen RCT (narrative review) |
|
MacIsaac, 2016 |
Geen RCT (narrative review) |
|
Cherney, 2016 |
Geen RCT (selectieve gepoolde analyse), betreft DM2 |
|
Vallon, 2015 |
Geen RCT (narrative review) |
|
Škrtić, 2015 |
Geen RCT (narrative review) |
|
Maltese, 2015 |
Geen RCT (narrative review) |
|
Cherney, 2014 |
Geen RCT (narrative review) |
|
Filippatos, 2013 |
Geen RCT (narrative review) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-05-2020
Beoordeeld op geldigheid : 07-08-2020
Uiterlijk in 2022 bepaalt het bestuur van de Nederlandse Internisten Vereniging (NIV) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de module komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Nieuwe glucoseverlagende middelen: submodule SGLT-2-remmers |
NIV |
2020 |
2022 |
Eens in twee jaar |
NIV |
Lopend onderzoek, en beschikbaarheid nieuwe middelen |
Een aantal lopende onderzoeken zijn mogelijk van belang bij onderhoud: DaPa-CKD trial (NCT03036150, dapagliflozine; geschatte einddatum november 2020), de EMPA-KIDNEY trial (NCT03594110, empagliflozine; geschatte einddatum juni 2022) en VERTIS-CV trial NCT01986881, ertugliflozine; geschatte einddatum december 2019). Daarnaast zijn de resultaten van de CREDENCE trial (NCT02065791, canagliflozin; Perkovic, 2019) gepubliceerd na de zoekperiode en nog niet opgenomen in de systematische literatuuranalyse.
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
Het NHG autoriseert met uitzondering van het advies over de inzet van SGLT2-remmers vanwege diabetische nefropathie (in afwachting van de adviezen die voortkomen uit een gezamenlijk initiatief van NHG en NIV in het kader van Modulair onderhoud diabetesrichtlijnen waarin de plaats van SGLT-2-remmers en GLP-1-agonisten bij behandeling van personen met diabetes mellitus type 2 nader wordt bestudeerd; oplevering verwacht december 2020).
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Doel van de richtlijn is om een duidelijk en zoveel mogelijk evidence-based overzicht te bieden van kansen op nierschade bij diabetes, en de mogelijkheden om het proces richting (progressieve) nierschade te beïnvloeden, met aandacht voor de overeenkomsten en verschillen tussen volwassenen met diabetes mellitus type 1 (DM1) en volwassenen met diabetes mellitus type 2 (DM2). Doel is daarbij om de kansen op nierschade (met name als dit ook bijdraagt aan een verhoogde ziektelast) zo klein mogelijk te maken. In de laatste 20 jaar is er al veel bereikt, maar er zijn nog steeds mogelijkheden voor verbetering in preventie en behandeling, juist ook door consequente implementatie van reeds aanwezige kennis. De NIV richtlijn Diabetische nefropathie uit 2006 is verouderd. Dit project heeft ten doel de richtlijn diabetische nefropathie te herzien, zodat er een actuele en modulaire richtlijn diabetische nefropathie beschikbaar is. Daarnaast zal patiënteninformatie worden ontwikkeld die aansluit bij de informatie die al beschikbaar is op de website voor publieks- en patiënteninformatie Thuisarts.nl.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg en patiëntvoorlichting voor mensen (in het bijzonder volwassenen) met diabetes.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor personen met diabetische nefropathie (zie hiervoor de samenstelling van de werkgroep). De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. H.J.G. (Henk) Bilo, internist niet-praktiserend, Universitair Medisch Centrum, Groningen (voorzitter); Nederlandse Internisten Vereniging
- Dr. J. (Jan) Westerink, internist-vasculair geneeskundige, Universitair Medisch Centrum Utrecht, Utrecht; Nederlandse Internisten Vereniging
- Prof. dr. S.J.L. (Stephan) Bakker, internist-nefroloog, Universitair Medisch Centrum Groningen, Groningen; Nederlandse Internisten Vereniging en Nederlandse Federatie voor Nefrologie
- Dr. E.K. (Ellen) Hoogeveen, internist-nefroloog, Jeroen Bosch Ziekenhuis, Den Bosch, en UMC Leiden (nefrologie en epidemiologie); Nederlandse Internisten Vereniging en Nederlandse Federatie voor Nefrologie
- Dr. H. (Henk) Boom, internist-nefroloog, Reinier de Graaf Ziekenhuis, Delft; Nederlandse Internisten Vereniging en Nederlandse Federatie voor Nefrologie
- P.M. (Pauline) Heijstee, huisarts en kaderarts diabetes, Huisartsenpraktijk Lambermon&Heijstee, Rosmalen; Nederlands Huisartsen Genootschap
- J.M. (Anne-Margreeth) Krijger-Dijkema, apotheker, Apotheek Stevenshof, Leiden; Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie en Nederlandse Vereniging van Ziekenhuisapothekers
- P. (Petra) Philipse, diabetesverpleegkundige, Tergooi Ziekenhuis, Hilversum; Verpleegkundigen & Verzorgenden Nederland
- E. (Eglantine) Barents, senior beleidsmedewerker Diabetesvereniging Nederland, Leusden; Diabetesvereniging Nederland
- C. (Cora) van Dorp, patiëntvertegenwoordiger Diabetesvereniging Nederland, Leusden; Diabetesvereniging Nederland
Klankbordgroep
- Prof dr. S.P. (Stefan) Berger, internist-nefroloog, Hoofd Nier en Pancreastransplantatieprogramma, Universitair Medisch Centrum Groningen, Groningen; Nederlandse Internisten Vereniging en Nederlandse Federatie voor Nefrologie
- Dr. A.P.M. (Angèle) Kerckhoffs, Internist-ouderengeneeskunde, internist-nefroloog, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch; Nederlandse Internisten Vereniging
- N. (Nienke) Snitjer, specialist ouderengeneeskunde GERION/afdeling huisartsengeneeskunde en ouderengeneeskunde, VUmc en Amstelring Amsterdam; Verenso
Met ondersteuning van
- Dr. K.N.J. (Koert) Burger, epidemioloog, senior adviseur Kennisinstituut Federatie van Medisch Specialisten
- L. (Linda) Niesink (MSc), medisch informatiespecialist Kennisinstituut, Federatie van Medisch Specialisten
- N.F. (Natalia) Bullock, secretaresse, Kennisinstituut Federatie van Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd (KNAW/KNMG/GR/NHG/FMS, 2016). Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bilo (voorzitter) |
Hoogleraar inwendige geneeskunde UMC Groningen (nulaanstelling), directeur Kenniscentrum voor Ketenzorg Zwolle (deels betaald) |
Lid Stichting Langerhans (deels betaald), aandeelhouder IPADIC (organisatie opgezet om een nieuw model implanteerbare insulinepomp te ontwikkelen), directeur onderzoekstichting chronische ziekten in Zwolle (waarbij op basis van eigen vragen, maar ook op basis van vragen van derden , dus ook de farmaceutische industrie) data worden geanalyseerd afkomstig uit het databestand van het Kenniscentrum en de met andere partijen gekoppelde gegevens (bv Vektis, ziekenhuis, IKNL) |
Het overgrote deel van het onderzoek wordt voorgelegd aan de METC. Als het gaat om de contracten op farmaceutisch gebied, dan wordt er op projectbasis gewerkt aan projecten voor Novo Nordisk, Sanofi Aventis en MSD. Deze samenwerkingsverbanden worden omschreven in een onderzoeksopzet, vastgelegd in contracten die aan alle wettelijke eisen voldoen, en waar opportuun voorgelegd aan de METC. Er zijn geen door de farmaceutische industrie ondersteunde onderzoeken, die betrekking hebben op de onderwerpen zoals aan de orde komend in de NIV-richtlijn diabetische nefropathie. Wel betrokkenheid met een door de Nierstichting gesubsidieerd promotie traject gericht op het uit VEKTIS data opbouwen van een nieratlas voor Nederland. Echter, ook hierbij geen belangen die elkaar raken. |
Geen actie nodig (insulinepompen zijn geen onderwerp in de huidige richtlijn) |
|
Bakker |
Internist-Nefroloog werkgever: Universitair Medisch Centrum Groningen |
Lid van de vaste commissie Voeding van de Gezondheidsraad (onbetaald) |
Geen. In toekomst mogelijk betrokken bij trial over SGLT-2-remmers. |
Geen voortrekker op module SGLT-2-remmers |
|
Westerink |
Internist-vasculair geneeskundige, Universitair Medisch Centrum Utrecht |
Lid van de redactie van www.diabetesgeneeskunde.nl (onkostenvergoeding). De website geeft informatie over ontwikkelingen in de behandeling van diabetes met als focus POH/HA en internist. Voor ontwikkelen en onderhouden van deze website is sponsoring ontvangen van meerdere sponsoren. Op de website is meer informatie te vinden over de onafhankelijkheid van de website en de redactie. |
Momenteel en in het verleden ben ik lokale PI in meerdere door de farmacie gedreven studies geweest waarbij SGLT2 inhibitoren en een GLP1 analoog onderzocht werden/worden. In mijn hoedanigheid coördineerde ik de studie lokaal. Gelden voortkomend uit deze studies komen ten goede aan de afdeling vasculaire geneeskunde in het UMCU en niet aan mijn persoon. |
Geen voortrekker op module SGLT-2-remmers of GLP-1 analogen |
|
Krijger-Dijkema |
Openbaar apotheker (apotheek Stevenhof Leiden) en Senior onderzoeker Sir institute for Pharmacy Practice and Policy Leiden |
Lid Special Interest Group (SIG) diabetes KNMP en afgevaardigde (namens KNMP) in bestuur Nederlands diabetes federatie (NDF) (beide vacatiegelden). Lid Wetenschappelijke Advies Raad van het Diabetes Fonds (alleen reiskosten vergoeding). |
Geen |
Geen |
|
Phillipse-Visscher |
Gespecialiseerd verpleegkundige diabetes, ziekenhuis Tergooi, Hilversum |
Geen |
Geen |
Geen |
|
Heijstee |
Huisarts, huisartsenpraktijk Lambermon en Heijstee te Rosmalen |
Kaderarts diabetes zorggroep BeRoEmD (2 uur per week, betaald). Adviseur diabetes, Saltro eerstelijns diagnostisch centrum (1 dag/week, betaald). Kaderarts diabetes Beter in Bommelerwaard (1uur/maand, betaald). |
Geen |
Geen |
|
Hoogeveen |
Internist-nefroloog Jeroen Bosch Ziekenhuis, nefroloog-epidemioloog afdeling nefrologie en klinische epidemiologie LUMC |
Geen |
Geen |
Geen |
|
Dorp, van |
Ervaringsdeskundige namens Diabetesvereniging Nederland (DVN), Regiosecretaris bij DVN |
Ervaringsdeskundige: feedback vanuit patiëntenperspectief (onbetaald). Regiosecretaris DVN (onbetaald) |
Geen |
Geen |
|
Barents |
Senior beleidsadviseur Diabetesvereniging Nederland |
Bestuurslid Stichting BIDON (onbetaald). Werkgroep lid NHG standaard DM 2 (2017) en NIV richtlijn DM 2 in de 2de lijn (2017) |
Geen |
Geen |
|
Boom |
Internist-nefroloog, Reinier de Graaf Gasthuis, Delft |
Geen |
bijdrage (vergoeding gastvrijheid) van Farma/MD Roche Nederland B.V. voor lezing tijdens de nephroweek 2016 (San Diego); niet specifiek voor diabetes |
Geen |
|
Klankbordgroep leden (meelezers bij specifieke modules) |
||||
|
Kerckhoffs |
Internist nefroloog Jeroen Bosch ziekenhuis en Dialysecentrum Ravenstein; internist ouderen geneeskunde Jeroen Bosch Ziekenhuis |
Kerngroep interne ouderengeneeskunde NIV, sectie kwaliteit en richtlijnen (onbetaald) |
Geen |
Geen |
|
Berger |
Internist-nefroloog, hoofd onderafdeling nefrologie UMCG |
Bestuurslid Nefrovisie (onbetaald). Bestuurslid Groningen Transplantatie Centrum. Voorzitter Landelijk Overleg Niertransplantatie (onbetaald). |
Lid adviesraad Transplantatie Novartis |
Geen. Alleen meelezer op modules met betrekking tot nierfunctievervangende therapie en nier-pancreas-transplantatie. |
|
Snitjer |
Specialist ouderengeneeskunde (16 uur/week), Onderwijsontwikkelaar VUmc/geriatrie (20 uur/week) |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afvaardiging van Diabetesvereniging Nederland in de werkgroep. Nierpatiënten Vereniging Nederland en de Nierstichting (als stichting waarbinnen patiënten ook vaak hun stem laten horen) zijn eveneens gevraagd om knelpunten aan te leveren, en de conceptrichtlijn is voor commentaar voorgelegd aan genoemde organisaties.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten van de afzonderlijk (sub)modules. Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld (zie Indicatorontwikkeling onder Werkwijze).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een Invitational conference en een schriftelijke knelpuntanalyse op basis van het conceptraamwerk en de conceptnotulen van de invitational conference door: Nederlandse Internisten Vereniging, Nederlandse Federatie voor Nefrologie, Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie, Nederlandse Vereniging van Ziekenhuisapothekers, Nederlandse Vereniging voor Klinische Geriatrie, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlands Huisartsen Genootschap, Verpleegkundigen & Verzorgenden Nederland, Diabetesvereniging Nederland, Nierpatiënten Vereniging Nederland, Nederlandse Diabetes Federatie, Bijwerkingencentrum Lareb, Inspectie Gezondheidszorg en Jeugd, Nederlandse Vereniging van Diëtisten, Diëtisten Nierziekten Nederland, en Vereniging Maatschappelijk Werk Nefrologie. Een verslag van de invitational conference en schriftelijke knelpuntanalyse met toelichting van de richtlijnwerkgroep is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (zie hiervoor Zoeken en selecteren onder Onderbouwing). In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van patiënten (patient values and preferences), kosten, aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’. Hierbij is gebruik gemaakt van het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016).
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit (Agoritsas, 2017; Neumann, 2016), en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Indicatorontwikkeling
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. Daarnaast werden de volgende verenigingen en organisaties benaderd voor commentaar: Nederlandse Vereniging voor Klinische Geriatrie, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nierpatiënten Vereniging Nederland, Nierstichting, Nederlandse Diabetes Federatie, Bijwerkingencentrum Lareb, Inspectie Gezondheidszorg en Jeugd, Nederlandse Vereniging van Diëtisten, Diëtisten Nierziekten Nederland, Vereniging Maatschappelijk Werk Nefrologie, Nefemed, Nederlandse Federatie van Universitair Medische Centra, Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse Vereniging voor Urologie, Nederlandse Vereniging voor Cardiologie, Nederlandse Vereniging van Ziekenhuizen, Zelfstandige Klinieken Nederland, Samenwerkende Topklinische opleidingsZiekenhuizen, Nederlandse Zorgautoriteit, Patiëntenfederatie Nederland, Vereniging Innovatieve Geneesmiddelen (voorheen Nefarma), Diagnostica Associatie Nederland (Diagned), Zorginstituut Nederland en Zorgverzekeraars Nederland. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas, T., Merglen, A., Heen, A. F., Kristiansen, A., Neumann, I., Brito, J. P., ... & Guyatt, G. H. (2017). UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ open, 7(11), e018593.
Alonso-Coello P, Oxman AD, Moberg J, et al.; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, et al.; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Hultcrantz M, Rind D, Akl EA, et al. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184.
KNAW/KNMG/GR/NHG/FMS (2016). Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling. Link: https://www.knaw.nl/shared/resources/actueel/publicaties/pdf/gedragscode-belangenverstrengeling
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. Link: https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Neumann I., Santesso N., Ak, EA, et al. (2016). A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. Journal of clinical epidemiology, 72, 45-55.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al, editors. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2010 – maart 2018
Zoekdatum: 22-03-2018
DM1, DM2 SR’s
|
1 exp *DIABETES MELLITUS/ or diabet*.ti. or t1dm.ti. or t2dm.ti. or dmt1.ti. or dmt2.ti. (352663) 2 sodium-glucose transport proteins/ or sodium-glucose transporter 2/ or exp Glucagon-Like Peptide 1/ or glucagon-like peptide receptors/ or exp glucagon-like peptide-1 receptor/ or 'sodium glucose cotransporter 2'.ti. or 'sodium glucose co-transporter 2'.ti. or sglt2.ti. or 'sglt-2'.ti. or exp CANAGLIFLOZIN/ or canagliflozin.ti. or dapagliflozin.ti. or empagliflozin.ti. or glp1.ti. or 'glp-1'.ti. or exenatide.ti. or exp LIRAGLUTIDE/ or liraglutide.ti. or semaglutide.ti. or lixisenatide.ti. or albiglutide.ti. or dulaglutide.ti. or taspoglutide.ti. (11793) 3 1 and 2 (5426) 4 limit 3 to (english language and yr="2010 -Current") (4184) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (346664) 6 4 and 5 (332) = 332 (294 uniek) |
429 |
|
Embase (Elsevier) |
(('diabetes mellitus'/exp/mj OR diabet*:ti OR t1dm:ti OR t2dm:ti OR dmt1:ti OR dmt2:ti) AND ('sodium glucose cotransporter 2'/exp/mj OR 'sodium glucose cotransporter 2 inhibitor'/exp/mj OR 'sodium glucose cotransporter 2':ti OR 'sodium glucose co-transporter 2':ti OR sglt2:ti OR 'sglt-2':ti OR 'canagliflozin'/exp/mj OR canagliflozin:ti OR 'dapagliflozin'/exp/mj OR dapagliflozin:ti OR 'empagliflozin'/exp/mj OR empagliflozin:ti OR 'glucagon like peptide 1 receptor agonist'/exp/mj OR glp1:ti OR 'glp-1':ti OR 'exendin 4'/exp/mj OR exenatide:ti OR 'liraglutide'/exp/mj OR liraglutide:ti OR 'semaglutide'/exp/mj OR semaglutide:ti OR 'lixisenatide'/exp/mj OR lixisenatide:ti OR 'albiglutide'/exp/mj OR albiglutide:ti OR 'dulaglutide'/exp/mj OR dulaglutide:ti OR 'taspoglutide'/exp/mj OR taspoglutide:ti) AND (english)/lim AND (2010-2018)/py NOT 'conference abstract':it) AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) = 322 (316 uniek) |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
01-11-2016 – mei 2018
Zoekdatum: 08-05-2018
DM2 RCT’s
|
1 exp *DIABETES MELLITUS/ or diabet*.ti. or t1dm.ti. or t2dm.ti. or dmt1.ti. or dmt2.ti. (355942) 2 sodium-glucose transport proteins/ or sodium-glucose transporter 2/ or exp Glucagon-Like Peptide 1/ or glucagon-like peptide receptors/ or exp glucagon-like peptide-1 receptor/ or 'sodium glucose cotransporter 2'.ti. or 'sodium glucose co-transporter 2'.ti. or sglt2.ti. or 'sglt-2'.ti. or exp CANAGLIFLOZIN/ or canagliflozin.ti. or dapagliflozin.ti. or empagliflozin.ti. or glp1.ti. or 'glp-1'.ti. or exenatide.ti. or exp LIRAGLUTIDE/ or liraglutide.ti. or semaglutide.ti. or lixisenatide.ti. or albiglutide.ti. or dulaglutide.ti. or taspoglutide.ti. (12084) 3 1 and 2 (5593) 4 limit 3 to (english language and yr="2010 -Current") (4344) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (353922) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1753259) 7 4 and 5 (354) 8 4 and 6 (1883) 9 7 or 8 (1948) 10 8 not 7 (1594) 11 limit 10 to ed=20161101-20180508 (441) = 441 (437 uniek) |
761 |
|
Embase (Elsevier) |
((('diabetes mellitus'/exp/mj OR diabet*:ti OR t1dm:ti OR t2dm:ti OR dmt1:ti OR dmt2:ti) AND ('sodium glucose cotransporter 2'/exp/mj OR 'sodium glucose cotransporter 2 inhibitor'/exp/mj OR sglt2:ti OR 'sglt-2':ti OR 'canagliflozin'/exp/mj OR canagliflozin:ti OR 'dapagliflozin'/exp/mj OR dapagliflozin:ti OR 'empagliflozin'/exp/mj OR empagliflozin:ti OR 'glucagon like peptide 1 receptor agonist'/exp/mj OR glp1:ti OR 'glp-1':ti OR 'exendin 4'/exp/mj OR exenatide:ti OR 'liraglutide'/exp/mj OR liraglutide:ti OR 'semaglutide'/exp/mj OR semaglutide:ti OR 'lixisenatide'/exp/mj OR lixisenatide:ti OR 'albiglutide'/exp/mj OR albiglutide:ti OR 'dulaglutide'/exp/mj OR dulaglutide:ti OR 'taspoglutide'/exp/mj OR taspoglutide:ti) AND (english)/lim AND (1-11-2016)/sd NOT (9-5-2018)/sd NOT 'conference abstract':it) AND (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it)) NOT (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))) = 491 (490 uniek) |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2010 – mei 2018
Zoekdatum: 03-05-2018
DM1 RCT’s
|
1 exp Diabetes Mellitus, Type 1/ or ((diabetes or dm) adj2 "1").ab,ti. or t1dm.ti. or dmt1.ti. (83257) 2 sodium-glucose transport proteins/ or sodium-glucose transporter 2/ or exp Glucagon-Like Peptide 1/ or glucagon-like peptide receptors/ or exp glucagon-like peptide-1 receptor/ or 'sodium glucose cotransporter 2'.ti. or 'sodium glucose co-transporter 2'.ti. or sglt2.ti. or 'sglt-2'.ti. or exp CANAGLIFLOZIN/ or canagliflozin.ti. or dapagliflozin.ti. or empagliflozin.ti. or glp1.ti. or 'glp-1'.ti. or exenatide.ti. or exp LIRAGLUTIDE/ or liraglutide.ti. or semaglutide.ti. or lixisenatide.ti. or albiglutide.ti. or dulaglutide.ti. or taspoglutide.ti. (12038) 3 1 and 2 (490) 4 limit 3 to (english language and yr="2010 -Current") (341) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (352685) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1750539) 7 4 and 5 (18) 8 4 and 6 (129) 9 8 not 7 (118) = 118 (116 uniek) |
195 |
|
Embase (Elsevier) |
((((('insulin dependent diabetes mellitus'/exp OR (((diabetes OR dm) NEAR/2 1):ab,ti) OR t1dm:ti OR dmt1:ti) AND ('sodium glucose cotransporter 2'/exp/mj OR 'sodium glucose cotransporter 2 inhibitor'/exp/mj OR sglt2:ti OR 'sglt-2':ti OR 'canagliflozin'/exp/mj OR canagliflozin:ti OR 'dapagliflozin'/exp/mj OR dapagliflozin:ti OR 'empagliflozin'/exp/mj OR empagliflozin:ti OR 'glucagon like peptide 1 receptor agonist'/exp/mj OR glp1:ti OR 'glp-1':ti OR 'exendin 4'/exp/mj OR exenatide:ti OR 'liraglutide'/exp/mj OR liraglutide:ti OR 'semaglutide'/exp/mj OR semaglutide:ti OR 'lixisenatide'/exp/mj OR lixisenatide:ti OR 'albiglutide'/exp/mj OR albiglutide:ti OR 'dulaglutide'/exp/mj OR dulaglutide:ti OR 'taspoglutide'/exp/mj OR taspoglutide:ti) AND (english)/lim AND (2010-2018)/py NOT 'conference abstract':it) AND (('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it)) NOT (('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp))) = 147 (147 uniek) |
