Spierverslappers
Uitgangsvraag
Wat is de plaats van spierverslappers in de behandeling van beademde patiënten met ARDS?
Aanbeveling
Aanbeveling 1:
Overweeg het gebruik van spierverslappers bij patiënten met ARDS en een PaO2/FiO2-ratio <150 mmHg als long-protectieve beademing anderszins niet mogelijk is.
Aanbeveling 2:
Overweeg de toediening van spierverslappers na maximaal 24-48 uur te onderbreken of te stoppen.
Aanbeveling 3:
Overweeg de diepte van spierverslapping te monitoren bijvoorbeeld middels een TOF-monitor.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een literatuuranalyse verricht naar de effectiviteit van de toediening van spierverslappers bij patiënten met ARDS die worden beademd. De mortaliteit (28-daagse en 90-daagse) lijkt lager te zijn voor patiënten die spierverslappers krijgen toegediend. De bewijskracht voor deze cruciale uitkomstmaat is echter laag doordat er sprake is van klinische heterogeniteit tussen de geïncludeerde patiënten en de studies vaak zijn uitgevoerd in kleine patiëntgroepen.
Ten aanzien van de belangrijke, maar niet cruciale, uitkomstmaten lijkt het risico op barotrauma af te nemen bij ARDS-patiënten met een PaO2/FiO2 ratio <150 die worden behandeld met spierverslappers. Dit lijkt niet te gelden voor ARDS-patiënten met een PaO2/FiO2 ratio <200. Ook hiervoor is de bewijskracht laag. Het effect van spierverslappers op de duur van de beademing (aantal beademingsvrije dagen na 28 dagen), de lengte van het verblijf op de IC en het risico op ICU acquired weakness is onzeker.
Gegeven de hoge mortaliteit van matig-ernstige ARDS is naar mening van de werkgroep, ondanks het gebrek aan hoogwaardig wetenschappelijk bewijs, het gebruik van spierverslappers te rechtvaardigen bij patiënten met een PaO2/FiO2-ratio lager dan 150 mmHg. Alleen in deze groep patiënten is er het voordeel van minder barotrauma. Een potentieel belangrijk nadeel van het gebruik van spierverslappers is de hogere kans op IC-gerelateerde spierzwakte (ICU-acquired weakness), echter dat komt niet eenduidig uit de literatuur naar voren. Het is onduidelijk hoe de toename van ICU-acquired weakness zich verhoudt tot beademing in buikligging (zie module ‘Methode van beademing – Buikligging’) , het gebruik van sedativa, corticosteroÏden (zie module ‘Immunomodulatie – Corticosteroïden’) of andere interventies en de behandeling van ARDS met verschillen in PEEP (zie module ‘Methode van beademing – PEEP)’ en volumina (zie module ‘Methode van beademing – Volumina’). De ESICM richtlijn (Grasselli, 2023) beveelt aan spierverslappers niet routine matig voor te schijven bij patienten met (non-COVID) ARDS.
De duur van behandeling met spierverslappers in studieverband is wisselend, meestal 24 tot 48 uur. Ondanks dat potentiële complicaties van spierverslappers in deze meta-analyse lijken mee te vallen, is het in de optiek van de werkgroep wenselijk om na maximaal 48 uur de continuering van behandeling met spierverslappers te evalueren, omdat het onbekend is of langdurig gebruik van spierverslappers niet alsnog kan resulteren in bijvoorbeeld ICU-acquired weakness. In geen van de geanalyseerde studies is gebruik gemaakt van monitoring van de mate van verslapping. Desalniettemin is de werkgroep van mening dat dit wel wenselijk is omdat bij adequate spierverslapping het effect op de luchtwegdruk het grootst zal zijn. De wijze van monitoring van spierverslapping is niet beschreven, maar doorgaans wordt dit gedaan middels TOF-monitoring (train-of-four monitor). De werkgroep is vanuit expert-opinion van mening dat spierveslapping gemonitored zou moeten worden en dat dit het best kan middels TOF-monitoring, waarbij nagestreefd wordt dat diepe verslapping bereikt wordt.
Spierverslappers en spontane ademhaling
In de studies meegenomen in de literatuuranalyse was de aanwezigheid van spontane ademhalingspogingen, patiënt-ventilator asynchronie of de mate van work-of-breathing geen indicatie voor het toedienen van spierverslappers. Op basis van de literatuuranalyse kunnen hierover daarom geen aanbevelingen gedaan worden. De inzet van spierverslappers tijdens spontane ademhaling wordt door de werkgroep gezien als een kennishiaat. De werkgroep is van mening terughoudend te zijn met het toedienen van spierverslappers bij de volledige afwezigheid van spontane ademhalingspogingen en/of -activiteit.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
ARDS is een aandoening die gekenmerkt wordt door een hoge mortaliteit, waarvoor nog geen optimale behandeling voorhanden is. Vanuit patiëntenperspectief is het van belang om de overleving te optimaliseren, terwijl additieve beademingsschade zoveel als mogelijk dient te worden voorkomen. ICU-acquired weakness wordt beschouwd als een bijwerking van het gebruik van spierverslappers, maar uit de literatuuranalyse blijkt dat het effect van spierverslappers op ICU-acquired weakness onduidelijk is. Het effect van spierverslappers op ICU-acquired weakness is voor patiënten een belangrijke kennislacune.
Kosten (middelenbeslag)
Spierverslappers zijn veelal goedkope medicijnen; de bijkomende kosten zullen minimaal zijn. Het gebruiken van een TOF-monitor voor het meten van de mate van verslapping, kan een kleine investering voor de aanschaf van de monitor behoeven.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep verwacht geen belemmerende factoren ten aanzien van het toedienen van spierverslappers op de Intensive Care. Voor de monitoring van de mate van spierverslappers zou gebruik gemaakt kunnen worden van de TOF-monitor, het kan nodig zijn personeel hierin te scholen.
Rationale van aanbeveling 1: weging van argumenten voor en tegen de interventies
Het toedienen van spierverslappers lijkt de 28- en 60-dagen mortaliteit van patiënten met matig-ernstige ARDS te verlagen. Relatie tot andere therapieën, duur van de behandeling en monitoring zijn onbekend. Gegeven de hoge mortaliteit van ARDS wordt de inzet van spierverslappers aanbevolen, in het bijzonder bij patiënten met een PaO2/FiO2 < 150 mmHg, waarbij protectieve beademing op een andere manier niet mogelijk is.
De door de werkgroep geformuleerde aanbeveling verschilt woordelijk met de aanbeveling in de ESICM richtlijn (Grasselli, 2023), echter in essentie niet. De ESICM richtlijn (Grasselli, 2023) beveelt aan spierverslappers niet routine matig voor te schijven bij patienten met (non-COVID) ARDS. Dit is in lijn met de huidige richtlijn, waar dit alleen wordt aanbevolen dit te overwegen bij patienten met ARDS met een P/F-ratio van 150. Dat is daarmee al een subgroep van alle patienten met ARDS.
Rationale van aanbeveling 2: weging van argumenten voor en tegen de interventies
Er is geen duidelijkheid over de duur van het gebruik van spierverslappers, maar in de meeste studies wordt dit gedaan voor een periode van 24-48 uur. Alhoewel de bijwerkingen van spierverslappers lijken mee te vallen, is het advies van de werkgroep op basis van expert opinion om de inzet van spierverslappers na 24-48 te evalueren.
Rationale van aanbeveling 3: weging van argumenten voor en tegen de interventies
In geen van de onderzochte studies wordt gerapporteerd hoe de mate van spierverslapping wordt gemonitord; dit is waarschijnlijk niet gedaan. Ondanks dat, is het advies van de werkgroep op basis van expert opinion om de mate van spierverslapping wel te monitoren bijvoorbeeld middels TOF-monitoring, zodat daadwerkelijke spierverslapping bereikt kan worden.
Onderbouwing
Achtergrond
Bij de behandeling van ARDS worden spierverslappers ingezet voor verschillende doeleinden: vermindering van patiënt-ventilator asynchronie, vermindering van ‘work of breathing’ en verbetering van de oxygenatie. Het wel of niet toedienen van spierverslappers is echter nog onderwerp van discussie. Welke patiënten hebben baat bij de behandeling met spierverslappers? Wat zijn indicatoren voor het starten van toediening van spierverslappers en wat is de duur van de toediening? In welke fase van het ziekteproces spelen spierverslappers een rol? En welke invloed heeft het toedienen van spierverslappers op de lange termijn uitkomsten? Deze module gaat in op de plaats van spierverslappers in de behandeling van matig-ernstige ARDS.
Conclusies / Summary of Findings
|
Low GRADE |
Treatment with neuromuscular blocking agents may result in lower 21–28-day mortality compared to no treatment with neuromuscular blocking agents in mechanical ventilated patients with ARDS and a PaO2/FiO2 ratio <150, <200 or <300.
Source: Shao, 2020 (Forel, 2006; Gainnier, 2004; Lyu, 2014; Moss, 2019; Papazian, 2010; Rao, 2016) |
|
Low GRADE |
Treatment with neuromuscular blocking agents may result in lower 90-day mortality compared to no treatment with neuromuscular blocking agents in mechanical ventilated patients with ARDS and a PaO2/FiO2 ratio <150 or <300.
Source: Shao, 2020 (Gainnier, 2004; Guervilly, 2017; Moss, 2019; Papazian, 2010; Rao, 2016) |
|
- GRADE |
No conclusions could be drawn regarding the effect of neuromuscular blocking agents on in-hospital mortality in mechanical ventilated patients with ARDS as this outcome measure was not reported in the included literature.
Sources: - |
|
- GRADE |
No conclusions could be drawn regarding the effect of neuromuscular blocking agents on quality of life in mechanical ventilated patients with ARDS as this outcome measure was not reported in the included literature.
Sources: - |
|
- GRADE |
No conclusions could be drawn regarding the effect of neuromuscular blocking agents on duration of mechanical ventilation in mechanical ventilated patients with ARDS as this outcome measure was not reported in the included literature.
Sources: - |
|
Very low GRADE |
The evidence is very uncertain about the effect of neuromuscular blocking agents on the number of ventilator-free days at day 28 in mechanical ventilated patients with ARDS and a PaO2/FiO2 ratio <150 or <200.
Source: Shao, 2020 (Forel, 2006; Gainnier, 2004; Guervilly, 2017; Moss, 2019; Papazian, 2010) |
|
Very low GRADE |
The evidence is very uncertain about the effect of neuromuscular blocking agents on the number of days not in ICU at day 28 in mechanical ventilated patients with ARDS and a PaO2/FiO2 ratio <150.
Source: Shao, 2020 (Guervilly, 2017; Moss, 2019; Papazian, 2010) |
|
Low GRADE |
Treatment with neuromuscular blocking agents may result in a lower risk of barotrauma compared to no treatment with neuromuscular blocking agents in mechanical ventilated patients with ARDS and a PaO2/FiO2 ratio <150.
Treatment with neuromuscular blocking agents may result in little to no difference in risk of barotrauma compared to no treatment with neuromuscular blocking agents in mechanical ventilated patients with ARDS and a PaO2/FiO2 ratio <200.
Source: Shao, 2020 (Forel, 2006; Gainnier, 2004; Moss, 2019; Papazian, 2010) |
|
Very low GRADE |
The evidence is very uncertain about the effect of neuromuscular blocking agents on the risk of ICU-acquired weakness compared to no treatment with neuromuscular blocking agents in mechanical ventilated patients with ARDS and a PaO2/FiO2 ratio <150 or <200.
Source: Shao, 2020 (Forel, 2006; Moss, 2019; Papazian, 2010) |
Samenvatting literatuur
Summary of literature
Description of studies
Shao (2020) performed a meta-analysis regarding the efficacy of treatment with neuromuscular blocking agents (NMBA) versus placebo or standard treatment (no neuromuscular blocking agents) in patients with ARDS. A systematic search was performed on August 20th 2020 using PubMed, EMBASE, Cochrane Library, Web of Science and ClinicalTrials.gov. A total of seven RCTs was included. In Gainnier (2004), Forel (2006), Papazian (2010) and Moss (2019), NMBAs were given for 48 hours; in Lyu (2014), NMBAs were given for 24-48 hours; and in Rao (2016) and Guervilly (2017) duration of treatment with NMBAs was unknown. Some studies were assessed as high risk of bias due to lack of blinding (Forel, 2006; Guervilly, 2017; Moss, 2019; Rao, 2016) and some as unclear risk of bias (Gainnier, 2004; Lyu, 2014; Papazian, 2010). Participants were patients diagnosed with acute respiratory distress syndrome according to the consensus definition of the disease when the relevant study was published. In total, 1598 patients were included. Mean age of participants was reported per group for each study and varied between 35 and 72 years.
Shao (2020) performed a sensitivity analysis for difference in inclusion criteria for PaO2/FiO2 ratio (<150 mmHg, <200 mmHG and <300 mmHG) regarding 21–28-day mortality outcome. Reported PaO2/FiO2 ratios are shown in table 1.
Table 1: ARDS severity (PaO2/FiO2 ratio in mmHg)
|
Inclusion criteria PaO2/FiO2 ratio: |
Intervention group mean PaO2/FiO2 ratio (SD) |
Control group |
|
|
Forel, 2006 |
<200 |
Not reported |
Not reported |
|
Gainnier, 2004 |
<150 |
130 (34) |
119 (31) |
|
Guervilly, 2017 |
<150 |
Median (IQR) |
Median (IQR) |
|
Lyu, 2014 |
<150 |
140.95 (26.97) |
144.33 (24.09) |
|
Moss, 2019 |
<150 |
98.7 (27.9) |
99.5 (27.9) |
|
Papazian, 2010 |
<150 |
106 (36) |
115 (41) |
|
Rao, 2016 |
<300 |
176 (63) |
165 (53) |
Results
21–28-day mortality
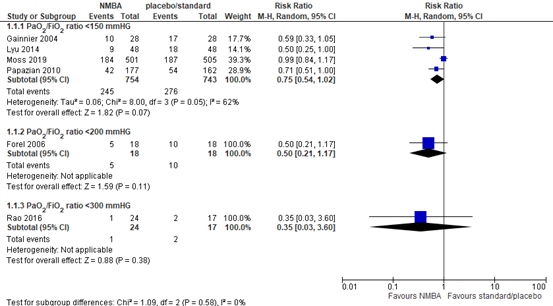
Six RCTs (Forel, 2006; Gainnier, 2004; Lyu, 2014; Moss, 2019; Papazian, 2010; Rao, 2016) included in Shao (2020) reported 21-28-day mortality in mechanical ventilated patients. In patients with a PaO2/FiO2 ratio <150 mmHg, a total of 245 out of 754 (32.5%) patients treated with neuromuscular blocking agents died compared to 276 out of 743 (37.1%) patients in the control group (RR 0.75; 95% CI 0.54 to 1.02, see figure 1). This is a clinically relevant difference in favour of treatment with neuromuscular blocking agents.
A similar effect was shown for patients with a PaO2/FiO2 ratio <200 (RR 0.50; 95%CI 0.21 to 1.17) and for patients with a PaO2/FiO2 ratio <300 (RR 0.35; 95%CI 0.03 to 3.60).
Figure 1: meta-analysis of 21-28-day mortality (data from Shao, 2020)
90-day mortality
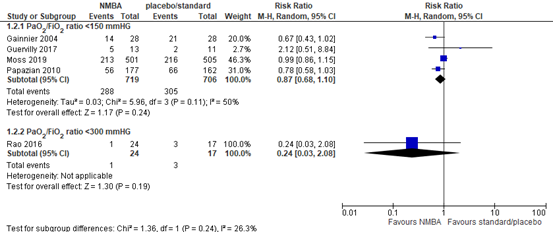
Five RCTs (Gainnier, 2004; Guervilly, 2017; Moss, 2019; Papazian, 2010; Rao, 2016) included in Shao (2020) reported 90-day mortality in mechanical ventilated patients. In patients with a PaO2/FiO2 ratio <150 mmHg, a total of 288 out of 719 (40.0%) patients treated with neuromuscular blocking agents died compared to 305 out of 706 (43.2%) patients in the control group (RR 0.87; 95% CI 0.68 to 1.10, see figure 2). This is a clinically relevant difference in favour of treatment with neuromuscular blocking agents. A similar effect was shown for patients with a PaO2/FiO2 ratio <300 (RR 0.24; 95%CI 0.03 to 2.08).
Figure 2: meta-analysis of 90-day mortality (data from Shao, 2020)
In-hospital mortality
Results regarding the outcome measure in-hospital mortality were not reported in Shao (2020).
Quality of life
Results regarding the outcome quality of life were not reported in Shao (2020).
Duration of mechanical ventilation
Results regarding the outcome duration of mechanical ventilation were not reported in Shao (2020).
Ventilator-free days at day 28
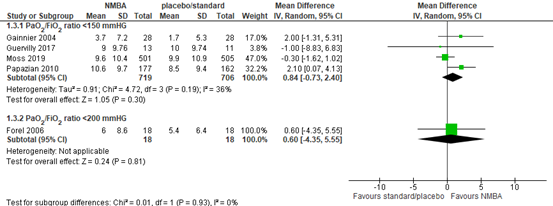
Five RCTs (Forel, 2006; Gainnier, 2004; Guervilly, 2017; Moss, 2019; Papazian, 2010) included in Shao (2020) reported the number of ventilator-free days at day 28 in mechanical ventilated patients. Patients treated with neuromuscular blocking agents showed no clinically relevant difference in the number of ventilator-free days compared to patients in the control group (see figure 3) in patients with a PaO2/FiO2 ratio <150 mmHg (MD 0.84; 95% CI -0.73 to 2.40 days). This was also concluded for patients with a PaO2/FiO2 ratio <200 (MD 0.60; 95% CI -4.35 to 5.55 days).
Figure 3: meta-analysis of Ventilator-free days at day 28 (data from Shao, 2020)
ICU length of stay
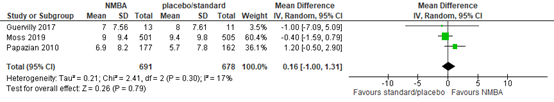
Three RCTs (Guervilly, 2017; Moss, 2019; Papazian, 2010) included in Shao (2020) reported the number of days not in ICU at day 28 in mechanical ventilated patients. Patients treated with neuromuscular blocking agents showed no clinically relevant difference in the number of days not in ICU compared to patients in the control group (MD 0.16; 95% CI -1.00 to 1.31 days, see figure 4).
Figure 4: meta-analysis of days not in ICU at day 28 (data from Shao, 2020)
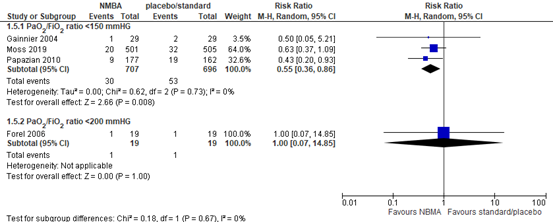
Barotrauma
Four RCTs (Forel, 2006; Gainnier, 2004; Moss, 2019; Papazian, 2010) included in Shao (2020) reported the number of barotraumas in mechanical ventilated patients. In patients with a PaO2/FiO2 ratio <150 mmHg, a total of 30 out of 707 (4.2%) patients treated with neuromuscular blocking agents had a barotrauma compared to 53 out of 696 (7.6%) patients in the control group (RR 0.55; 95% CI 0.36 to 0.86, see figure 5). This is a clinically relevant difference in favour of treatment with neuromuscular blocking agents. Patients with a PaO2/FiO2 ratio <200 did not show a clinically relevant difference (RR 1.00; 95%CI 0.07 to 14.85).
Figure 5: meta-analysis of Barotrauma (data from Shao, 2020)
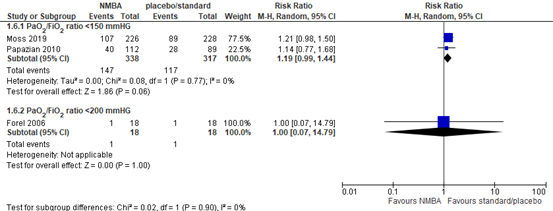
ICU-acquired weakness
Three RCTs (Forel, 2006; Moss, 2019; Papazian, 2010) included in Shao (2020) reported the number of patients with ICU-acquired muscle weakness in mechanical ventilated patients. In patients with a PaO2/FiO2 ratio <150 mmHg, a total of 147 out of 338 (43.5%) patients treated with neuromuscular blocking agents developed ICU-acquired muscle weakness compared to 117 out of 317 (36.9%) patients in the control group (RR 1.19; 95% CI 0.99 to 1.44, see figure 6). This is a clinically relevant difference in favour of the control group. Patients with a PaO2/FiO2 ratio <200 did not show a clinically relevant difference (RR 1.00; 95%CI 0.07 to 14.79).
Figure 6: meta-analysis of ICU-acquired weakness (data from Shao, 2020)
Level of evidence of the literature
21–28-day mortality, PaO2/FiO2 ratio <150
The level of evidence regarding the outcome measure 21-28-day mortality started at high and was downgraded to low level, because of clinical heterogeneity in included patients (inconsistency, one level) and because of small number of participants and events (imprecision, one level).
21-28 day mortality, PaO2/FiO2 ratio <200 and <300
The level of evidence regarding the outcome measure 21-28-day mortality started at high and was downgraded to low level, because of small number of participants and events in most studies and confidence intervals crossing the thresholds for clinical relevance (imprecision, two levels).
90-day mortality, PaO2/FiO2 ratio <150
The level of evidence regarding the outcome measure 90-day mortality started at high and was downgraded to low level, because of clinical heterogeneity in included patients (inconsistency, one level) and because of small number of events (imprecision, one level).
90-day mortality, PaO2/FiO2 ratio <300
The level of evidence regarding the outcome measure 90-day mortality started at high and was downgraded to low level, because of small number of events and confidence intervals crossing the thresholds for clinical relevance (imprecision, two levels).
In-hospital mortality
The level of evidence regarding the effect of neuromuscular blocking agents on in-hospital mortality in mechanical ventilated patients with ARDS could not be determined as this outcome measure was not reported in the included literature.
Quality of life
The level of evidence regarding the effect of neuromuscular blocking agents on quality of life in mechanical ventilated patients with ARDS could not be determined as this outcome measure was not reported in the included literature.
Duration of mechanical ventilation
The level of evidence regarding the effect of neuromuscular blocking agents on duration of mechanical ventilation in mechanical ventilated patients with ARDS could not be determined as this outcome measure was not reported in the included literature.
Ventilator-free days at day 28, PaO2/FiO2 ratio <150
The level of evidence regarding the outcome measure ventilator-free days at day 28 started at high and was downgraded to very low level, because of lack of blinding (risk of bias, one level), clinical heterogeneity in included patients (inconsistency, one level) and because of small number of participants (imprecision, one level).
Ventilator-free days at day 28, PaO2/FiO2 ratio <200
The level of evidence regarding the outcome measure ventilator-free days at day 28 started at high and was downgraded to very low level, because of lack of blinding (risk of bias, one level) and because of small number of participants and confidence intervals crossing the thresholds for clinical relevance (imprecision, two levels).
ICU length of stay
The level of evidence regarding the outcome measure ventilator-free days at day 28 started at high and was downgraded to very low level, because of lack of blinding (risk of bias, one level), clinical heterogeneity in included patients (inconsistency, one level) and a small number of participants (imprecision, one level).
Barotrauma, PaO2/FiO2 ratio <150
The level of evidence regarding the outcome measure barotrauma started at high and was downgraded to low level, because of clinical heterogeneity in included patients (inconsistency, one level) and a small number of events (imprecision, one level).
Barotrauma, PaO2/FiO2 ratio <200
The level of evidence regarding the outcome measure barotrauma started at high and was downgraded to low level, because of a very small number of events and confidence intervals crossing the thresholds for clinical relevance (imprecision, two levels).
ICU-acquired weakness, PaO2/FiO2 ratio <150
The level of evidence regarding the outcome measure ICU-acquired weakness started at high and was downgraded to very low level, because of lack of blinding (risk of bias, one level), clinical heterogeneity in included patients (inconsistency, one level) and a small number of events (imprecision, one level).
ICU-acquired weakness, PaO2/FiO2 ratio <200
The level of evidence regarding the outcome measure ICU-acquired weakness started at high and was downgraded to very low level, because lack of blinding (risk of bias, one level) and a very small number of events and confidence intervals crossing the thresholds for clinical relevance (imprecision, two levels).
Zoeken en selecteren
Search and select
A systematic review of the literature was performed to answer the following question: What is the effect of neuromuscular blockade agents on mortality, quality of life, duration of mechanical ventilation, ICU length of stay and adverse events/complications in the treatment of mechanical ventilated patients with ARDS compared to placebo or no treatment.
P: mechanical ventilated patients with ARDS (no ECLS treatment).
I: neuromuscular blockade agents (cisatracurium, rocuronium, vecuronium, pancuronium, actracurium).
C: placebo/no neuromuscular blockade agents.
O: 28-day mortality, 90-day mortality, in-hospital mortality, quality of life, duration of mechanical ventilation, ventilator-free days at day 28, ICU length of stay, barotrauma, ICU-acquired weakness.
Relevant outcome measures
The guideline development group considered mortality as a critical outcome measure for decision making; and quality of life, duration of mechanical ventilation, ventilator-free days at day 28, ICU length of stay, barotrauma and ICU-acquired weakness important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the following values as a minimal clinically (patient) important difference:
Mortality: 0.95 ≥ relative risk (RR) ≥ 1.05.
Quality of life: mean difference (MD) ≥ 10% of the maximum score on a validated questionnaire.
Duration of mechanical ventilation: MD ≥ 1 day.
Ventilator-free days at day 28: MD ≥ 1 day.
ICU length of stay: MD ≥ 1 day.
Barotrauma: 0.91 ≥ RR ≥ 1.10.
ICU-acquired weakness: 0.91 ≥ RR ≥ 1.10.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until February 3rd 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 305 hits. Studies were selected based on the following criteria:
- Systematic review or RCT.
- Mechanical ventilated patients with ARDS were included.
- Studies focusing on ARDS patients with COVID-19 were excluded.
- A group using neuromuscular blocking agents was compared with a group using placebo or no neuromuscular blocking agents.
- At least one of the outcome measures mortality, quality of life, duration of mechanical ventilation, ventilator-free days at day 28, ICU length of stay, barotrauma and ICU-acquired weakness was reported.
A total of 64 studies were initially selected based on title and abstract screening. After reading the full text, 63 studies were excluded (see the table with reasons for exclusion under the tab Methods), and one studies was included.
Results
One study (Shao, 2020) is included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Forel, J. M., Roch, A., Marin, V., Michelet, P., Demory, D., Blache, J. L., ... & Papazian, L. (2006). Neuromuscular blocking agents decrease inflammatory response in patients presenting with acute respiratory distress syndrome. Critical care medicine, 34(11), 2749-2757.
- Gainnier, M., Roch, A., Forel, J. M., Thirion, X., Arnal, J. M., Donati, S., & Papazian, L. (2004). Effect of neuromuscular blocking agents on gas exchange in patients presenting with acute respiratory distress syndrome. Critical care medicine, 32(1), 113-119.
- Grasselli G, Calfee CS, Camporota L, Poole D, Amato MBP, Antonelli M, Arabi YM, Baroncelli F, Beitler JR, Bellani G, Bellingan G, Blackwood B, Bos LDJ, Brochard L, Brodie D, Burns KEA, Combes A, D'Arrigo S, De Backer D, Demoule A, Einav S, Fan E, Ferguson ND, Frat JP, Gattinoni L, Guérin C, Herridge MS, Hodgson C, Hough CL, Jaber S, Juffermans NP, Karagiannidis C, Kesecioglu J, Kwizera A, Laffey JG, Mancebo J, Matthay MA, McAuley DF, Mercat A, Meyer NJ, Moss M, Munshi L, Myatra SN, Ng Gong M, Papazian L, Patel BK, Pellegrini M, Perner A, Pesenti A, Piquilloud L, Qiu H, Ranieri MV, Riviello E, Slutsky AS, Stapleton RD, Summers C, Thompson TB, Valente Barbas CS, Villar J, Ware LB, Weiss B, Zampieri FG, Azoulay E, Cecconi M; European Society of Intensive Care Medicine Taskforce on ARDS. ESICM guidelines on acute respiratory distress syndrome: definition, phenotyping and respiratory support strategies. Intensive Care Med. 2023 Jul;49(7):727-759. doi: 10.1007/s00134-023-07050-7. Epub 2023 Jun 16. PMID: 37326646; PMCID: PMC10354163.
- Guervilly, C., Bisbal, M., Forel, J. M., Mechati, M., Lehingue, S., Bourenne, J., ... & Papazian, L. (2017). Effects of neuromuscular blockers on transpulmonary pressures in moderate to severe acute respiratory distress syndrome. Intensive Care medicine, 43(3), 408-418.
- Lyu, G., Wang, X., Jiang, W., Cai, T., & Zhang, Y. (2014). Clinical study of early use of neuromuscular blocking agents in patients with severe sepsis and acute respiratory distress syndrome. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 26(5), 325-329.
- Moss, M. et al (National Heart, Lung, and Blood Institute PETAL Clinical Trials Network). (2019). Early neuromuscular blockade in the acute respiratory distress syndrome. New England Journal of Medicine, 380(21), 1997-2008.
- Papazian, L., Forel, J. M., Gacouin, A., Penot-Ragon, C., Perrin, G., Loundou, A., ... & Roch, A. (2010). Neuromuscular blockers in early acute respiratory distress syndrome. New England Journal of Medicine, 363(12), 1107-1116.
- Rao, Z., Li, J., & Yan, M. (2016). To retain spontaneous breathing or eliminate spontaneous breathing with neuromuscular blockers in acute respiratory distress syndrome patients. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 28(11), 973-977.
- Shao, S., Kang, H., & Tong, Z. (2020). Early neuromuscular blocking agents for adults with acute respiratory distress syndrome: a systematic review, meta-analysis and meta-regression. BMJ open, 10(11), e037737.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Shao, 2020
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCT
Literature search up to August, 2020
A: Gainnier, 2004 B: Forel, 2006 C: Papazian, 2010 D: Lyu, 2014 E: Rao, 2016 F: Guervily, 2017 G: Moss, 2019
Study design:
Setting and Country: A: France B: France C: France D: China E: China F: France G: USA
Source of funding and conflicts of interest: Foundation of China (grant number 81870004) and Beijing Municipal Bureau of Health (CN) (grant numbers 2016-1-1061); No competing interest declared. Not reported for included RCTs individually
|
Inclusion criteria SR: 2) adult (aged over 18 years) patients who were diagnosed with ARDS by the consensus definition of the disease when the relevant study was published 3) study groups that received neuromuscular blocking agents and control groups that received placebo without neuromuscular blocking agents 4) studies that accurately and clearly provided any of the outcomes (primary outcome: 90-day mortality; secondary outcome: 21-28 day mortality, days of free mechanical ventilation of day 28, days not in ICU of day 28, neuromuscular blocking agent related complications (barotrauma, pneumothorax and ICU-acquired muscle weakness), Medical Research Council score, APACHE II score, PaO2/FiO2 at 48 hours and 72 hours
Exclusion criteria SR: 1) case reports, letters, systematic reviews, meta-analyses, professional opinions or cohort studies 2) studies lacking risk ratios, 95%Cis or continuous variable outcomes that could be covered to the mean and SD 3) incorrect statistical methods that cannot be corrected 4) incomplete data and unclear outcomes
7 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age (SD) A: B: C:
Sex: A: B: C: not reported E: I: 87.5% Male F: I: 69% Male G: I: 58.1% Male C: 53.3% Male
Mean PaO2/FiO2 (SD) A: B: C: I: 141.0 (27.0) / 77.7 (11.2) E: I: 176 (63) F: I: median (IQR) 158 (131 to 185) G: I: 98.7 (27.9) C: 99.5 (27.9)
Groups comparable at baseline? |
A: “Bolus of 50 mg cisatracurium,followed by a continuous infusion at an initial rate of 5 μg·k·min for 48 hours” B: “A bolus of 0.2 mg/kg was followed by a continuous infusion at an initial rate of 5 μg·k·min for 48 hours” C: “A 3 mL rapid intravenous infusion of 15 mg of cisatracurium, followed by a continuous infusion of 37.5 mg/hour for 48 hours” D: “0.1 mg/kg vecuronium up to 0.05 mg/kg·hour for continuous intravenous infusion for 24–48 hours” E: “Vecuronium 1 g/kg·hour was given to maintain muscle relaxation and eliminate spontaneous respiration” F: “A 3 mL rapid intravenous infusion of 15 mg cisatracurium, followed by a continuous infusion of 37.5 mg/hour” G: “A bolus of 15 mg of cisatracurium, followed by a continuous infusion of 37.5 mg/hour for 48 hours”
|
A: “An infusion of saline at a rate of 4 mL/hour for 48 hours” B: “An infusion of placebo (saline) at a rate of 4 mL/hour for 48 hours” C: “A 3 mL rapid intravenous infusion of 15 mg of placebo, followed by a continuous infusion of 37.5 mg/hour for 48 hours” D: “Give patients regular treatment” E: “Give patients regular treatment” F: “Give patients regular treatment” G: “Give patients regular treatment without routine NMBAs”
|
End-point of follow-up:
A: not reported B: not reported C: not reported D: not reported E: not reported F: not reported G: not reported
For how many participants were no complete outcome data available? (intervention/control) A: not reported, but no attrition bias determined B: not reported, but no attrition bias determined C: not reported, but no attrition bias determined D: not reported, but no attrition bias determined E: not reported, but no attrition bias determined F: not reported, but no attrition bias determined G: not reported, but no attrition bias determined
|
21-28-day mortality
Effect measure: RR [95% CI]: A: 0.59 (0.33 to 1.05) B: 0.50 (0.21 to 1.17) C: 0.71 (0.51 to 1.00) D: 0.50 (0.25 to 1.00) E: 0.35 (0.03 to 3.60) G: 0.99 (0.84 to 1.17)
Pooled effect (random effects model): 0.71 [95% CI 0.53 to 0.96] favoring intervention group Heterogeneity (I2): 51%
Subgroup analysis PaO2/FiO2 <150 mmHg (A, C, D, G) 0.75 [95% CI 0.54 to 1.02] favoring intervention group Heterogeneity (I2): 62%
Subgroup analysis PaO2/FiO2 <200 mmHg (B) 0.50 [95% CI 0.21 to 1.17] favoring intervention group Heterogeneity (I2): N/A
Subgroup analysis PaO2/FiO2 <200 mmHg (E) 0.35 [95% CI 0.03 to 3.60] favoring intervention group Heterogeneity (I2): N/A
90-day mortality
Effect measure: RR [95% CI]: A: 0.67 (0.43 to 1.02) C: 0.78 (0.58 to 1.03) E: 0.24 (0.03 to 2.08) F: 2.12 (0.51 to 8.84) G: 0.99 (0.86 to 1.15)
Pooled effect (random effects model): 0.85 [95% CI 0.66 to 1.09] favoring intervention group Heterogeneity (I2): 46%
Hospital mortality
Not reported
Quality of life
Not reported
Hospital mortality
Not reported
Duration of mechanical ventilation
Not reported
Days free of mechanical ventilation at day 28
Effect measure: mean difference in days [95% CI]: A: 2.00 (-1.31 to 5.31) B: 0.60 (-4.35 to 5.55) C: 2.10 (0.07 to 4.13) F: -1.00 (-8.79 to 6.79) G: -0.30 (-1.62 to 1.02)
Pooled effect (random effects model): 0.54 [95% CI -0.47 to 1.56] favoring intervention group Heterogeneity (I2): 15%
Days not in ICU the at day 28
Effect measure: mean difference in days [95% CI]: C: 1.20 (-0.50 to 2.90) F: -1.00 (-7.09 to 5.09) G: -0.40 (-1.59 to 0.79)
Pooled effect (random effects model): 0.16 [95% CI -1.00 to 1.31] favoring intervention group Heterogeneity (I2): 17%
Barotrauma
Effect measure: RR [95% CI]: A: 0.50 (0.05 to 5.21) B: 1.00 (0.07 to 14.85) C: 0.43 (0.20 to 0.93) G: 0.63 (0.37 to 1.09)
Pooled effect (random effects model): 0.56 [95% CI 0.37 to 0.86] favoring intervention group Heterogeneity (I2): 0%
ICU-acquired muscle weakness
Effect measure: RR [95% CI]: B: 1.00 (0.07 to 14.79) C: 1.14 (0.77 to 1.68) G: 1.21 (0.98 to 1.50)
Pooled effect (random effects model): 1.19 [95% CI 0.99 to 1.44] favoring intervention group Heterogeneity (I2): 0%
|
Facultative:
Brief description of author’s conclusion: use of NMBAs may reduce short-term mortality, NMBArelated complications, and APACHE II scores and may be associated with increased PaO2/FiO2 within the first 48hours and 72hours among patients with ARDS, longterm survival was not significantly improved. Therefore, NMBAs should not be considered a regular treatment regimen for moderate to severe patients with ARDS. Considering the limitations of the available studies, additional high-quality RCTs should be performed to guide the optimisation of clinical therapeutic strategies for NMBAs in the future.”
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading: 90-day mortality: GRADE low (results of E and G were different from previous study and only 41 patients were included in E) 21-28 day mortality: GRADE low (Two-third of the trials involved fewer than 150 participants and there was publication bias among those trials through Egger’s test) Ventilator free days: GRADE low (the results of randomized trials published in 2010 are different from those of other randomized trials and there were fewer participants in two studies). Days not in ICU: GRADE moderate (reason for downgrading not reported) Barotrauma: GRADE Low (the result of C was different from other studies and two studies contained only 38 and 58 participants) ICU-acquired muscle weakness: GRADE moderate (In B, only 36 participants were included in the outcome)
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Shao, 2020 |
Yes |
Yes |
No |
Yes |
Not applicable (RCTs) |
Yes |
Yes |
Yes |
No |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Alhazzani, 2013 |
Review updated by Tarazan (2020) |
|
Alhazzani, 2020 |
No search strategy and search date available |
|
Annane, 2016 |
Narrative review |
|
Arroliga, 2008 |
Retrospective analysis ALI/ARDS |
|
Barmparas, 2018 |
Retrospective analysis |
|
Bein, 2016 |
Narrative review |
|
Bennett, 2011 |
Narrative review |
|
Chang, 2020 |
Review with more recent search date available |
|
De Prost, 2012 |
Narrative review |
|
Dodia, 2020 |
Narrative review/synopsis |
|
Duggal, 2015 |
More recent review available |
|
Forel, 2006 |
More recent review available |
|
Forel, 2006 |
More recent review available |
|
Forel, 2006 |
Included in Shao (2020) |
|
Forel, 2009 |
Focus on ARDS/ALI, more recent review available |
|
Frank, 2010 |
Narrative review |
|
Freebairn, 2005 |
Narrative review |
|
Freebairn, 2010 |
Narrative review |
|
Gainnier, 2004 |
Included in Shao (2020) |
|
Gao, 2019 |
Article in chinese |
|
Guervilly, 2017 |
Included in Shao (2020) |
|
Ho, 2020 |
Review with more recent search date available |
|
Horner, 2011 |
Narrative review |
|
Hraiech, 2012 |
More recent review available |
|
Hraiech, 2012 |
Narrative review |
|
Hraiech, 2014 |
Narrative review |
|
Hraiech, 2015 |
Narrative review |
|
Hraiech, 2020 |
Narrative review |
|
Hua, 2020 |
Review with more recent search date available |
|
Huang, 2017 |
Re-evaluation trial |
|
Lagneau, 2008 |
Narrative review |
|
Lyu, 2014 |
Included in Shao (2020) |
|
Lyu, 2020 |
Review with more recent search date available |
|
Matera, 2020 |
Narrative review |
|
Mefford, 2020 |
Narrative review |
|
Moss, 2019 |
Included in Shao (2020) |
|
Needham, 2012 |
Critical appraisal |
|
Neto, 2012 |
More recent review available |
|
Papazian, 2007 |
Narrative review |
|
Papazian, 2010 |
Included in Shao (2020) |
|
Paramore, 2018 |
More recent review available |
|
Pathak, 2011 |
Narrative review/synopsis |
|
Price, 2012 |
Narrative review |
|
Putensen, 2001 |
At risk for ARDS |
|
Puthucheary, 2012 |
Narrative review |
|
Rezaiguia-Delclaux, 2020 |
Survey of academic intensivists |
|
Schweickert, 2007 |
Narrative review |
|
Sottile, 2018 |
Retrospectieve analyse |
|
Tao, 2018 |
More recent review available |
|
Tarazan, 2020 |
Review with more recent search date available |
|
Tobar, 2009 |
No intervention |
|
Torbic, 2019 |
Narrative review |
|
Torbic, 2021 |
Review with more recent search date available |
|
Wang, 2013 |
Article in chinese |
|
Warr, 2011 |
More recent review available |
|
Wei, 2019 |
Review with more recent search date available |
|
Wei, 2020 |
Review with more recent search date available |
|
Wilcox, 2011 |
Narrative review |
|
Zappetti, 2019 |
Narrative review/synopsis |
|
Zheng, 2020 |
Review with more recent search date available |
|
Zhuo, 2014 |
Protocol article |
|
Zhuo, 2016 |
Protocol article |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 12-03-2024
Beoordeeld op geldigheid : 05-03-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met ARDS.
Werkgroep
- Dr. H. Endeman, internist-intensivist, NVIC
- Dr. R.M. Determann, internist-intensivist, NIV
- Drs. R. Pauw, longarts-intensivist, NVALT
- Drs. M. Samuels, anesthesioloog-intensivist, NVA
- Dr. A.H. Jonkman, klinisch technoloog, NVvTG
- J.W.M. Snoep, ventilation practitioner/IC-verpleegkundige, V&VN
- Drs. M.A.E.A. Brackel, patiëntvertegenwoordiger (tot 1-1-2022 bestuurslid FCIC/Voorzitter IC Connect), FCIC/IC Connect
Meelezers:
- Drs. F.Z. Ramjankhan, Cardio-thoracaal chirurg, NVT
- Dr. R.R.M. Vogels, Radioloog, NVvR
- Drs. R. ter Wee, Klinisch fysicus, NVKF
Met ondersteuning van:
- Drs. I. van Dusseldorp, literatuurspecialist, Kennisinsitituut van de Federatie van Medisch Specialisten
- Dr. S.N. Hofstede, senior-adviseur, Kennisinsitituut van de Federatie van Medisch Specialisten
- Dr. J.C. Maas, adviseur, Kennisinsitituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Endeman |
Internist-intensivist, opleider Intensive Care, Erasmus MC, Rotterdam |
Secretaris GIC, lid sectie IC NIV aanpassing juli 2022:
|
Travelgrant/speakers fee voor IC-symposium Kenya augustus 2018 door GETINGE
Advanced mechanical ventilation is een speerpunt van wetenschappelijk onderzoek van de Intensive Care van het Erasmus MC aanpassing juli 2022: gesponsord door Ventinova. Dat is een beademingsmachine. Open Lung Concept 2.0: Flow Controlled Ventilation |
Bij modules die specifiek gaan over apparatuur ontwikkeld door GETINGE: Wanneer dit onderwerp geprioriteerd wordt zal een vice-voorzitter worden aangewezen en werkgroeplid niet meebeslissen over dit onderwerp |
|
Pauw |
Intensivist longarts Martini Ziekenhuis Groningen |
Secretaris sectie IC NVALT (onbetaald), instructeur FCCS-cursus NVIC (vergoeding per gegeven cursus, gemiddeld 1-2x/jaar) |
Maart 2023: Spreker congres pulmonologie vogelvlucht: pulmonary year in review m.b.t. IC-onderwerpen |
Geen |
|
Jonkman |
* Technisch geneeskundige (klinisch technoloog), PhD kandidaat en research manager, afdeling Intensive Care Volwassenen, Amsterdam UMC, locatie Vumc (t/m 2021) * Research fellow dept. Critical Care Medicine, St. Michael’s Hospital, University of Toronto, Canada (gedetacheerd vanuit VUmc voor periode jan-dec 2020)
aanpassing juli 2022: |
Bestuurslid Nederlandse Vereniging voor Technische Geneeskunde (NVvTG), vice-voorzitter t/m mei 2021 |
Adviesfunctie (consultancy) bij Liberate Medical LLC (Kentucky, USA), een medical device company dat een niet-invasieve elektrische spierstimulator ontwikkelt voor het trainen van de expiratiespieren (buikspieren) tijdens kunstmatige beademing. Betaald consultancy werk, ongeveer 1-2 dagdelen per jaar (2018 -2020)
Deelname aan diverse nationale en internationale investigator-initiated wetenschappelijke onderzoeken naar gepersonaliseerde kunstmatige beademing middels advanced respiratory monitoring (o.a. ademspierfunctie en electrische impedantie tomografie) bij de IC-patiënt. Deels in het kader van voormalig promotieonderzoek Waaronder: * lid stuurgroep CAVIARDS-trial (Careful Ventilation in (COVID-19-induced) Acute Respiratory Distress Syndrome, NCT03963622), internationale investigator-initiated studie naar gepersonaliseerde beademingsstrategie bij ARDS, geen persoonlijke financiële vergoeding |
Onderwerpen niet-invasieve elektrische spierstimulatie en gepersonaliseerde kunstmatige beademing middels advanced respiratory monitoring worden niet behandeld in de richtijn. Mochten deze toch worden toegevoegd, dan zal werkgroep lid niet als auteur van deze specifieke modules worden aangesteld. |
|
Samuels |
Anesthesioloog – Intensivist, te Franciscus Gasthuis & Vlietland
aanpassing Juli 2022: Anesthesioloog-lntensivist, te HMC |
* MICU intensivist – betaald * FCCS teacher – betaald * bestuurslid sectie IC NVA
aanpassing Juli 2022: Waarnemer als lntensivist op de IC (betaald) Voorzitter sectie IC, NVA (onbetaald) |
Geen |
Geen |
|
De Graaff |
Intensivist – Internist, St Antonius ziekenhuis Nieuwegein, fulltime |
Bestuurslid Stichting NICE, vrijwilligerswerk |
Geen |
Geen |
|
Determann |
Intensivist OLVG |
Gastdocent Amstelacademie (betaald) |
Geen |
Geen |
|
Brackel-Welten |
* Voorzitter patiëntenorganisatie IC Connect, onbetaald, tot 1-1-2022 * Bestuurslid Stichting Family en patient centered Intensive Care (Stichting FCIC), onbetaald, tot 1-1-2022 * Jeugdarts KNMG, niet praktiserend * voormalig IC-patiënte |
Geen |
Voorzitterschap IC Connect, bestuurslid Stichting FCIC, tot 1-1-2022 |
Geen |
|
Snoep |
* Ventilation Practitioner 25% * IC-verpleegkundige 75%
aanpassing juli 2022: Leids Universitair Medisch Centrum
|
Hamilton Medicai expert panel Netherlands, sinds 2022. Onbetaald |
Geen |
Geen |
|
Ramjankhan |
Cardio-thoracaal chirurg UMCU |
Geen |
Geen |
Geen |
|
Ter Wee |
Klinisch Fysicus in opleiding - Medisch Spectrum Twente |
Geen |
Geen |
Geen |
|
Vogels |
*Radioloog met aandachtsgebied thoracale en abdominale radiologie * Fellow Thoraxradiologie
Maatschap Radiologie Oost Nederland (MRON) locatie MST Enschede
Toevoeging juli 2022: Radioloog met als aandachtsgebied thoracale en abdominale readiologie als maatschapslid bij MRON licatie ZGT Almelo/Hengelo |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland, Stichting FCIC, IC Connect en het Longfonds voor deelname aan de schriftelijke knelpunteninventarisatie en deelname van een afgevaardigde van Stichting FCIC en IC Connect in de werkgroep. De resultaten van de schriftelijke knelpunteninventarsiatie zijn besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Stichting FCIC, IC Connect en het Longfonds. De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Spierverslappers |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven.
|
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met ARDS. Tevens zijn IGJ, NFU, NHG, NVZ, Patiëntenfederatie Nederland, STZ, V&VN, NVIC, NVA, NIV, NVALT, NVvTG, NVVC, NVN, NVKF, Longfonds, FCIC/IC Connect en ventilation practitioners uitgenodigd om knelpunten aan te dragen via een enquête. Een overzicht hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties uit de werkgroep voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Grasselli G, Calfee CS, Camporota L, Poole D, Amato MBP, Antonelli M, Arabi YM, Baroncelli F, Beitler JR, Bellani G, Bellingan G, Blackwood B, Bos LDJ, Brochard L, Brodie D, Burns KEA, Combes A, D'Arrigo S, De Backer D, Demoule A, Einav S, Fan E, Ferguson ND, Frat JP, Gattinoni L, Guérin C, Herridge MS, Hodgson C, Hough CL, Jaber S, Juffermans NP, Karagiannidis C, Kesecioglu J, Kwizera A, Laffey JG, Mancebo J, Matthay MA, McAuley DF, Mercat A, Meyer NJ, Moss M, Munshi L, Myatra SN, Ng Gong M, Papazian L, Patel BK, Pellegrini M, Perner A, Pesenti A, Piquilloud L, Qiu H, Ranieri MV, Riviello E, Slutsky AS, Stapleton RD, Summers C, Thompson TB, Valente Barbas CS, Villar J, Ware LB, Weiss B, Zampieri FG, Azoulay E, Cecconi M; European Society of Intensive Care Medicine Taskforce on ARDS. ESICM guidelines on acute respiratory distress syndrome: definition, phenotyping and respiratory support strategies. Intensive Care Med. 2023 Jul;49(7):727-759. doi: 10.1007/s00134-023-07050-7. Epub 2023 Jun 16. PMID: 37326646; PMCID: PMC10354163.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Algemene informatie
|
Database(s): Embase, Ovid/Medline |
Datum: 3-2-2021 |
|
Periode: 2000- |
Talen: nvt |
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
90 |
45 |
94* |
|
RCTs |
188 |
83 |
211* |
|
Observationele studies |
76 |
49 |
83 |
|
Overig |
|
|
|
|
Totaal |
|
|
305* |
* opgenomen in Rayyan
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#18 |
#3 AND #17 sleutelartikelen |
2 |
|
#17 |
#12 OR #13 OR #14 |
1490 |
|
#16 |
#14 NOT #13 NOT #12 = OBS |
76 |
|
#15 |
#13 NOT #12 = RCT |
188 |
|
#14 |
#8 AND #11 |
181 |
|
#13 |
#8 AND #10 |
233 |
|
#12 |
#8 AND #9 = SR |
90 |
|
#11 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6335337 |
|
#10 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2500470 |
|
#9 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
533576 |
|
#8 |
#7 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
761 |
|
#7 |
#6 NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab OR child*:ti,ab OR schoolchild*:ti,ab OR infant*:ti,ab OR girl*:ti,ab OR boy*:ti,ab OR teen:ti,ab OR teens:ti,ab OR teenager*:ti,ab OR youth*:ti,ab OR pediatr*:ti,ab OR paediatr*:ti,ab OR puber*:ti,ab) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab OR man:ti,ab OR men:ti,ab OR woman:ti,ab OR women:ti,ab)) |
1308 |
|
#6 |
#4 AND #5 |
1490 |
|
#5 |
'neuromuscular blocking'/exp OR 'neuromuscular blocking agent'/exp OR 'curare like activity':ti,ab,kw OR 'curaremimetic drug':ti,ab,kw OR 'curariform agent':ti,ab,kw OR 'curarizing agent':ti,ab,kw OR (((myoneural OR 'nerve muscle*' OR neuromuscular) NEAR/3 (block* OR agent*)):ti,ab,kw) OR 'vecuronium'/exp OR 'musculax':ti,ab,kw OR 'nc 45':ti,ab,kw OR 'nc45':ti,ab,kw OR 'nocuron':ti,ab,kw OR 'norcuron':ti,ab,kw OR 'norcuronium':ti,ab,kw OR 'org nc 45':ti,ab,kw OR 'org nc45':ti,ab,kw OR 'orgnc 45':ti,ab,kw OR 'vecron*':ti,ab,kw OR 'vecural':ti,ab,kw OR 'vecurol':ti,ab,kw OR 'vecuron':ti,ab,kw OR 'cisatracurium'/exp OR '51w89':ti,ab,kw OR 'bw 51w89':ti,ab,kw OR 'bw51w89':ti,ab,kw OR 'cisatracurium':ti,ab,kw OR 'nimbex':ti,ab,kw OR 'rocuronium'/exp OR 'eslax':ti,ab,kw OR 'esmeron':ti,ab,kw OR 'org 9426':ti,ab,kw OR 'org9426':ti,ab,kw OR 'rocuronio':ti,ab,kw OR 'rocuronium':ti,ab,kw OR 'rocuxant':ti,ab,kw OR 'roqurum':ti,ab,kw OR 'zemuron':ti,ab,kw OR 'pancuronium'/exp OR 'pancuronium':ti,ab,kw OR 'pankuronium':ti,ab,kw OR 'atracurium besilate'/exp OR 'acrium':ti,ab,kw OR 'aculex':ti,ab,kw OR 'atracurium':ti,ab,kw OR 'bw 33 a':ti,ab,kw OR 'bw 33a':ti,ab,kw OR 'bw33a':ti,ab,kw OR 'genso':ti,ab,kw OR 'mycurium':ti,ab,kw OR 'relatrac':ti,ab,kw OR 'tracrium':ti,ab,kw OR 'tracur':ti,ab,kw OR 'tracurix':ti,ab,kw OR nmba:ti,ab,kw |
88730 |
|
#4 |
'respiratory distress syndrome'/exp OR 'ards':ti,ab,kw OR 'adult respiration distress*':ti,ab,kw OR 'adult respiratory distress*':ti,ab,kw OR 'lung shock':ti,ab,kw OR 'posttraumatic lung failure*':ti,ab,kw OR 'posttraumatic pulmonary insufficienc*':ti,ab,kw OR 'shock lung*':ti,ab,kw OR 'acute respiration distress':ti,ab,kw OR 'acute respiratory distress':ti,ab,kw OR 'acute chest syndrome'/exp OR 'acute chest syndrome*':ti,ab,kw |
94994 |
|
#3 |
#1 OR #2 |
2 |
|
#2 |
neuromuscular AND blockers AND in AND early AND acute AND respiratory AND distress AND syndrome AND morange AND 2010 |
1 |
|
#1 |
neuromuscular AND blockade AND in AND acute AND respiratory AND distress AND syndrome AND a AND systematic AND review AND 'meta analysis' AND of AND randomized AND controlled AND trials AND ho AND 2020 |
1 |
Ovid/Medline
Search Strategy:
|
# |
Searches |
Results |
|
14 |
12 not 11 not 10 = OBS |
49 |
|
13 |
11 not 10 =RCT |
83 |
|
12 |
5 and 9 |
81 |
|
11 |
4 and 9 |
117 |
|
10 |
3 and 9 = SR |
45 |
|
9 |
8 not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) |
304 |
|
8 |
7 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
317 |
|
7 |
limit 6 to yr="2000 -Current" |
365 |
|
6 |
1 and 2 |
406 |
|
5 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
3756022 |
|
4 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2085449 |
|
3 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
479969 |
|
2 |
exp Neuromuscular Blocking Agents/ or exp Neuromuscular Blockade/ or curare like activity.ti,ab,kf. or curaremimetic drug.ti,ab,kf. or curariform agent.ti,ab,kf. or curarizing agent.ti,ab,kf. or ((myoneural or nerve muscle* or neuromuscular) adj3 (block* or agent*)).ti,ab,kf. or musculax.ti,ab,kf. or nc 45.ti,ab,kf. or nc45.ti,ab,kf. or nocuron.ti,ab,kf. or norcuron.ti,ab,kf. or norcuronium.ti,ab,kf. or org nc 45.ti,ab,kf. or org nc45.ti,ab,kf. or orgnc 45.ti,ab,kf. or vecron*.ti,ab,kf. or vecural.ti,ab,kf. or vecurol.ti,ab,kf. or vecuron.ti,ab,kf. or 51w89.ti,ab,kf. or bw 51w89.ti,ab,kf. or bw51w89.ti,ab,kf. or cisatracurium.ti,ab,kf. or nimbex.ti,ab,kf. or eslax.ti,ab,kf. or esmeron.ti,ab,kf. or org 9426.ti,ab,kf. or org9426.ti,ab,kf. or rocuronio.ti,ab,kf. or rocuronium.ti,ab,kf. or rocuxant.ti,ab,kf. or roqurum.ti,ab,kf. or zemuron.ti,ab,kf. or pancuronium.ti,ab,kf. or pankuronium.ti,ab,kf. or acrium.ti,ab,kf. or aculex.ti,ab,kf. or atracurium.ti,ab,kf. or bw 33 a.ti,ab,kf. or bw 33a.ti,ab,kf. or bw33a.ti,ab,kf. or genso.ti,ab,kf. or mycurium.ti,ab,kf. or relatrac.ti,ab,kf. or tracrium.ti,ab,kf. or tracur.ti,ab,kf. or tracurix.ti,ab,kf. or nmba.ti,ab,kf. |
31899 |
|
1 |
exp Respiratory Distress Syndrome, Adult/ or exp acute chest syndrome/ or ards.ti,ab,kf. or adult respiration distress*.ti,ab,kf. or adult respiratory distress*.ti,ab,kf. or lung shock.ti,ab,kf. or posttraumatic lung failure*.ti,ab,kf. or posttraumatic pulmonary insufficienc*.ti,ab,kf. or shock lung*.ti,ab,kf. or acute respiration distress.ti,ab,kf. or acute respiratory distress.ti,ab,kf. or acute chest syndrome*.ti,ab,kf. |
34802 |