Methode van beademing - PEEP
Uitgangsvraag
Wat is de rol van positieve eind-expiratoire druk (PEEP) bij de beademing van een patiënt met matig-ernstige ARDS?
Aanbeveling
Wees bewust dat PEEP een belangrijk onderdeel is van beademing bij patiënten met matig-ernstige ARDS en gerelateerd is aan het ontstaan of verergeren van Ventilator Induced Lung Injury (VILI). De respons op het ophogen van PEEP varieert tussen patiënten, waardoor het niet mogelijk is om een generieke aanbeveling te geven voor het instellen van PEEP.
Overweeg een hogere PEEP toe te passen bij ernstige ARDS in afwezigheid van mogelijkheden om het optimale PEEP niveau te individualiseren.
Monitor de plateaudruk en de driving pressure na het ophogen van PEEP. Weeg de risico’s en overige voor- en nadelen van het verder ophogen van de PEEP af voor de individuele patiënt wanneer de vermoedelijke grenzen van long-protectief beademen (plateaudruk (28-30 cmH2O) en driving pressure (15 cmH2O)) worden bereikt.
Stel PEEP minimaal in op 5 cmH2O.
Wees bewust van het effect van PEEP op de hemodynamiek en de compliantie.
Overweeg de inzet van aanvullende diagnostische metingen zoals transpulmonale drukmetingen, elektrische impedantie tomografie, recruitment-to-inflation ratio en longmorfologie o.b.v. CT bij geïndividualiseerde PEEP titratie als de vaardigheden hiertoe aanwezig zijn in de kliniek. Wees je hierbij bewust dat er nog onvoldoende literatuur beschikbaar is om harde aanbevelingen te formuleren m.b.t. het instellen van PEEP op basis van deze methodes.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De werkgroep heeft een systematische literatuuranalyse uitgevoerd ten aanzien van de effectiviteit van de toepassing van een beademingsstrategie met hoge PEEP vergeleken met een beademingsstrategie met lage PEEP in patiënten met ARDS. De Express studie van Mercat (2008) was leidend in het beschrijven van de uitkomstmaten voor deze richtlijnmodule, daar dit de enige studie was die hoge versus lage PEEP heeft vergeleken zonder het toepassen van een long recruitment maneuver in de hoge PEEP groep.
Ten aanzien van de cruciale uitkomstmaat mortaliteit is het door de zeer lage bewijskracht onzeker of een beademingsstrategie met hoge PEEP ten opzichte van lage PEEP een effect heeft op de mortaliteit in patiënten met ARDS (PaO2/FiO2 ratio <300 mmHg). De zeer lage bewijskracht voor de cruciale uitkomstmaten wordt met name veroorzaakt doordat er maar één studie beschikbaar is welke het exclusieve effect van een hoge versus lage PEEP onderzocht heeft, en die beschikbare studie is daarnaast ook nog voortijdig beëindigd.
Belangrijke, maar niet cruciale uitkomstmaten, kunnen maar beperkt richting geven aan de klinische besluitvorming vanwege de (zeer) lage bewijskracht. Een beademingsstrategie met hoge PEEP lijkt te resulteren in een hogere oxygenatie vergeleken met een beademingsstrategie met lage PEEP in patiënten met ARDS (PaO2/FiO2 ratio <300 mmHg). Het effect op de SOFA-score in patiënten met ARDS (PaO2/FiO2 ratio <200 mmHg) en het effect op het aantal beademingsvrije dagen en het aantal barotrauma’s in patiënten met ARDS (PaO2/FiO2 ratio <300 mmHg) is onzeker.
Op basis van de besproken literatuur blijven er onduidelijkheden bestaan over het optimale PEEP niveau bij ARDS. Daarnaast blijft het discutabel welk PEEP niveau als ‘hoog’ wordt beschouwd, daar dit varieerde tussen de geïncludeerde studies in deze module (Literatuursamenvatting, Tabel 1), en deze interpretatie ook varieert tussen landen en zelfs verschillende centra in hetzelfde land. Op basis van de huidige literatuur, met name de studie van Mercat (2008), interpreteert de werkgroep een hoge PEEP als een PEEP tussen 12-15 cmH2O, en een lage PEEP als een PEEP tussen 5-9 cmH2O. Het minimale PEEP niveau van 5 cmH2O is in lijn met de Berlin criteria om aan ARDS te voldoen en tevens het laagste niveau wat toegepast is in de diverse studies.
Een recente meta-analyse van Danti (2022) is gepubliceerd na de afronding van de literatuuranalyse van deze richtlijn. De conclusies van deze meta-analyse, namelijk dat een hoge PEEP een betere uitkomst geeft dan een lagere PEEP, mits dit gebeurt zonder voorafgaande recruitment maneuver, is gelijk aan de conclusies van de hier beschreven literatuursamenvatting en in lijn met de opgestelde aanbevelingen. Men moet zich echter realiseren dat dit gaat om een zwakke aanbeveling wegens het gebrek aan sterk bewijs uit de literatuur.
Personaliseren van PEEP en invloed van lung recruitability
De ExPress methode van Mercat (2008) om hoge PEEP in te stellen is gebaseerd op het doel om de long te openen en gelijktijdig overdistentie te voorkomen, door het ophogen van PEEP totdat een plateaudruk van 28-30 cmH2O wordt bereikt. Dit is een eenvoudige en makkelijk te implementeren methode, maar garandeert helaas niet een optimale PEEP bij iedere patiënt. Deze methode zal daarnaast resulteren in een relatief hoge PEEP bij patienten met een hoge compliantie (lage driving pressure), wat contraintuitief is. Bij het interpreteren van alle beschreven studies is het belangrijk te realiseren dat geen van de studies heeft gepoogd om te identificeren welke patiënten baat hebben bij het ophogen van PEEP; er is geen rekening gehouden met de mate van lung recruitability.
Vanuit fysiologisch perspectief resulteert lung recruitment bij het ophogen van PEEP in verbetering van de gasuitwisseling en respiratoire mechanica. Verbeteringen in hypoxemie en dode ruimte of compliantie worden soms gebruikt om het effect van hoge PEEP te beoordelen. Retrospectieve analyse van de LOVS (Meade, 2008) en ExPress trials (Mercat, 2008) suggereert dat toepassing van een hoge PEEP positieve effecten heeft op de mortaliteit in patiënten met een oxygenatie response (>25mmHG toename in PaO2/FiO2 ratio) (Goligher, 2014), met sterkere effecten in patiënten met ernstigere hypoxemie. Het kijken naar alleen de oxygenatie respons en FiO2 behoefte is echter geen goede methode om de individuele respons te bepalen. De impact van PEEP op ventilator-induced lung injury (VILI) wordt hierin niet direct betrokken en veranderingen in oxygenatie kunnen ook worden beïnvloed door hemodynamische factoren door o.a. de invloed van PEEP op cardiac output.
Idealiter zou je gebruik willen maken van een geïndividualiseerde benadering om lung recruitability te voorspellen om op basis daarvan voor een hoge of lage PEEP te kiezen. Tot op heden zijn er echter geen betrouwbare en praktische methoden aan het bed beschikbaar om lung recruitability te meten en daarmee te beoordelen of een patiënt baat heeft bij hoge of lage PEEP. Klassieke technieken om de lung recruitability te meten zijn CT-scans voor het kwantificeren van de hoeveelheid gerekruteerd longvolume bij hoge PEEP, de nitrogen washin-washout techniek voor het meten van longvolumina, of het maken van meerdere druk-volume curves in combinatie met metingen van longvolumina (Chiumello, 2016; Amato, 2016). Deze methoden hebben praktische nadelen en zijn niet geschikt voor routinematige toepassing aan het bed. Toekomstige onderzoeken moeten uitwijzen wat de beste methode is om te bepalen welke patiënt baat kan hebben bij hoge PEEP. Hierbij valt te denken aan transpulmonale drukmetingen, elektrische impedantie tomografie (in combinatie met decremental PEEP-trial) (Frerichs, 2017), recruitment-to-inflation ratio (Chen, 2020), en morfologie o.b.v. CT of echografie van de long (Constantin, 2019; Bellani, 2017). Daarna dient onderzocht te worden of het instellen van PEEP op basis van die diagnostische methoden leidt tot betere klinische uitkomsten. Wegens het gebrek aan huidig bewijs kan de werkgroep geen specifieke aanbevelingen maken over de toepassing van deze technieken.
Totdat duidelijk is welke methodieken het beste de optimale (of minimale) PEEP op individueel patiënt niveau voorspellen, en de benodigde apparatuur hiervoor breed beschikbaar is, is de meest beschreven methode om onderscheid te maken o.b.v. de PaO2/FiO2 -ratio waarbij hogere PEEP kan worden toegepast bij matig-ernstige ARDS. Een alternatief op basis van fysiologie is de decremental PEEP trial (ART trial; Cavalcantie, 2017). Voor het bepalen van het minimale PEEP niveau dient rekening te worden gehouden met het airway closure fenomeen (Chen, 2018; Chen, 2020).
Een geïndividualiseerde benadering zou kunnen worden toegepast op basis van veschillende parameters. Deze worden hieronder kort toegelicht om ter overweging mee te geven.
Longmorfologie
Beoordeling van de longmorfologie op een CT-scan kan helpen in het selecteren van patiënten voor behandeling met hogere PEEP. Constantin (2019) rapporteerde in een intention-to-treat analyse geen verschil in uitkomsten tussen een geïndividualiseerde en standaard benadering. Een verschil werd wel gevonden na een post-hoc analyse, waarbij correctie plaatsvond voor patiënten waarbij longmorfologie verkeerd was beoordeeld op CT-scan of X-thorax. Interessant daarbij was dat met name de inschattingsfout een effect had op de uitkomst: een hogere mortaliteit werd gezien bij patiënten waar misclassificatie plaatsvond. Het goed kunnen inschatten van lung recruitability op basis van longmorfologie is gevoelig voor misinterpretatie en daardoor mogelijk lastig te implementeren.
Decremental PEEP trial
Het doel van een decremental PEEP trial is om het PEEP niveau te bepalen dat benodigd is om een long open te houden na long recruitment. Met deze benadering wordt een hoog PEEP niveau ingesteld (bijv. 20-25 cmH2O), waarna PEEP in stapjes van ±2 cmH2O wordt verlaagd, elke ±30-120 seconde. Op elk niveau wordt de compliantie gemeten om de PEEP behorende bij de optimale compliantie te bepalen (Cavalcanti, 2017). Andere studies gebruikten arteriële oxygenatie (Borges, 2006; Girgis, 2005; Toth, 2007) of dode ruimte (Fengmei, 2012) in plaats van compliantie als target parameter om de beste PEEP tijdens de decremental PEEP trial te bepalen. De bruikbaarheid van de decremental PEEP trial is echter nog wat discutabel, daar er in de literatuur verschillende methoden (incl. de duur van elke PEEP stap), te monitoren parameters, en methodes voor rekruteren voorafgaand aan de decremental PEEP trial worden gerapporteerd, alsmede wat de optimale PEEP moet zijn na de procedure.
Airway closure
Bij airway closure vallen de luchtwegen compleet dicht bij een druk onder de airway opening pressure (AOP). Airway closure heeft belangrijke consequenties daar het kan leiden tot een verhoogd risico op ventilator-induced lung injury (VILI) door het herhaaldelijk openen en sluiten van de distale luchtwegen wanneer PEEP onder de AOP staat ingesteld. Daarnaast kan het resulteren in een misleidende meting van de eind-expiratoire luchtwegdruk en dus een foutieve meting van de driving pressure: het zal resulteren in een overschatting van de daadwerkelijke driving pressure, en dus in een lagere compliantie dan daadwerkelijk het geval is. In de aanwezigheid van een airway closure fenomeen is het dus belangrijk dat het PEEP niveau minimaal ter hoogte van de AOP ingesteld wordt. Airway closure wordt vaak niet herkend aan het bed, maar kan worden gemeten met een druk-volume curve of druk-tijd curve tijdens een inflatie met lage flow (Chen, 2018; Chen, 2020).
PEEP-FiO2 tabellen
Combinaties van PEEP en FiO2 om een streef saturatie of PaO2 te behalen zijn gebruikt in ARDS Network studies en worden in diverse landen/centra toegepast. Alhoewel het gebruik van PEEP/FiO2 tabellen vanuit logistiek oogpunt handig lijkt, is de werkgroep van mening dat er eerst een poging gedaan zou moeten worden om PEEP individueel in te stellen, gebruikmakend van een van de bovenstaande technieken, alvorens terug te vallen op deze tabellen. Het gebruik van tabellen wordt bekritiseerd omdat PEEP hiermee niet ingesteld wordt op basis van individuele respiratoire mechanica en daarmee de tabellen maar weinig gebaseerd zijn op empirisch bewijs. Ondanks dat de tabellen op populatie-niveau niet inferieur waren aan andere vormen van PEEP instellen, hebben de PEEP/FiO2 tabellen de neiging om de hoogste PEEP te selecteren bij patiënten die niet reageren in termen van oxygenatie (Grasso, 2007; Terragni, 2007). De tabellen garanderen daarmee niet de optimale PEEP in elke individuele patient. De werkgroep doet daarnaast, bij gebrek aan bewijs, geen uitspraak over welke van de tabellen (lage PEEP/hoge FiO2 vs. hoge PEEP/lage FiO2) superieur is aan de ander.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Matig-ernstige ARDS wordt gekenmerkt door een significante mortaliteit, maar ook morbiditeit, ook op langere termijn. Het belang voor de patiënt is dat beademing met een optimale PEEP is gericht op het openhouden van de long en tegelijkertijd het voorkomen van additieve schade. Er is een noodzaak om de behandeling te individualiseren. Echter vooralsnog zijn de tools om dit uit te voeren niet beschikbaar. Hier ligt een voor patiënten belangrijke kennislacune.
Kosten (middelenbeslag)
Het toepassen van hoge of lage PEEP heeft geen invloed op kosten. Het individualiseren van het bepalen van PEEP in de toekomst kan vragen om te investeren in extra apparatuur, maar zou ook kunnen resulteren in kortere IC-opnameduur. Echter de kosteneffectiviteit hiervan is onbekend.
Aanvaardbaarheid, haalbaarheid en implementatie
Het instellen van het juiste PEEP niveau bij patiënten met matige-ernstige ARDS zal, ook met de adviezen uit deze richtlijn, een dagelijks dilemma blijven aan het bed van de patiënt. De belangrijkste aanbevelingen zijn dat het instellen van PEEP om een geïndividualiseerde benadering vraagt, echter dat de wijze waarop te individualiseren nog een onderwerp van wetenschappelijk onderzoek is. Dit maakt dat het van belang is om als vakgroep onderling af te spreken welke modaliteiten gebruikt worden om PEEP te optimaliseren, en bij de patiënt vast te leggen op welke wijze het optimale PEEP niveau bepaald is. Daarbij is het ook van belang dat IC-verpleegkundigen mee worden genomen in deze beslissingen via dagelijkse visites/overdracht en kennisdeling.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
PEEP is een belangrijk onderdeel van beademing bij matig-ernstige ARDS en gerelateerd aan het ontstaan of verergeren van ventilator induced lung injury (VILI) wanneer de druk in de longen to hoog wordt (Slutsky, 2013. Het klinisch voordelige effect van ofwel hoge of lage PEEP varieert tussen patiënten en is dus afhankelijk van de individuele response op PEEP: er is behoefte aan een gestandaardiseerde benadering, maar deze is nog niet beschikbaar. Op basis van de huidige literatuur is het daarom niet mogelijk om een generieke aanbeveling te schrijven voor het instellen van PEEP. Dit heeft er ook in geresulteerd dat de ESICM ARDS richtlijn geen uitspraak doet over het instellen van PEEP in ARDS in het algemeen en dat deze richtlijn uitsluitend een overweging geef voor het instellen van PEEP bij severe ARDS.
Bij het instellen van lage of hoge PEEP is het uiteraard belangrijk om long-protectieve beademing te continueren met lage teugvolumina en met de driving pressure binnen de vermoedelijke streefwaarden (zie Module ’Methode van beademing - Volumina’).
Op basis van bovenstaande overwegingen heeft de werkgroep besloten tot het formuleren van de volgende aanbevelingen.
Onderbouwing
Achtergrond
PEEP wordt toegepast om de gasuitwisseling en respiratoire mechanica van de long te verbeteren door het verhogen van het eind-expiratoire longvolume. Waar initieel PEEP vooral werd gebruikt als een tijdelijke methode om de oxygenatie te verbeteren, is het nu algemeen erkend dat de belangrijkste rol van PEEP is om de risico’s op het ontstaan of verergeren van ventilator-induced lung injury (VILI) te verminderen. Een adequaat PEEP niveau in atelectatische longregio’s, verbetert de regionale longcompliantie, vermindert shunt en vermindert het cyclisch sluiten en heropenen van alveoli, resulterend in een meer homogene (en minder schadelijke) ventilatie. Ondanks dat er diverse gerandomiseerde klinische studies naar hogere vs. lagere PEEP niveaus zijn verricht, blijft het onduidelijk welk PEEP niveau het beste kan worden toegepast bij kunstmatig beademde patiënten met matig-ernstige ARDS. Zijn er klinische factoren die kunnen identificeren welke patiënten baat kunnen hebben bij een hoge PEEP en welke patiënten baat kunnen hebben bij een lage PEEP? Hoe zou je het PEEP-niveau kunnen optimaliseren? Deze module vat het huidige bewijs voor het toepassen van hoge of lage PEEP samen, en bediscussieert mogelijke toekomstige methoden die gebruikt zouden kunnen worden voor het optimaliseren van het PEEP niveau bij de individuele patiënt. Het effect van rekruteren (recruitment) valt buiten de context van deze module.
Conclusies / Summary of Findings
|
Very low GRADE |
It is uncertain whether a higher PEEP strategy results in a difference in 28-day mortality in mechanically ventilated patients with ARDS (PaO2/FiO2 ratio <300 mmHg) compared to a lower PEEP strategy.
Sources: Mercat, 2008 (Guo, 2018; Walkey, 2017) |
|
Very low GRADE |
It is uncertain whether a higher PEEP strategy results in a difference in 60-day mortality in mechanically ventilated patients with ARDS (PaO2/FiO2 ratio <200 mmHg or <250 mmHg) compared to a lower PEEP strategy.
Sources: Kacmarek, 2016; Meade, 2008 (Guo, 2018; Walkey, 2017) |
|
Very low GRADE |
It is uncertain whether a higher PEEP strategy results in a difference in in-hospital mortality in mechanically ventilated patients with ARDS (PaO2/FiO2 ratio <300 mmHg) compared to a lower PEEP strategy.
Sources: Mercat, 2008 (Guo, 2018; Walkey, 2017) |
|
- GRADE |
No conclusions could be drawn on quality of life as no studies investigating the effect of higher versus lower PEEP on quality of life of patients with ARDS and meeting the inclusion criteria were found. |
|
Very low GRADE |
It is uncertain whether a higher PEEP strategy results in a difference in SOFA-score in mechanically ventilated patients with ARDS (PaO2/FiO2 ratio <200 mmHg) compared to a lower PEEP strategy.
Sources: Hodgson, 2011 (Walkey, 2017) |
|
Very low GRADE |
It is uncertain whether a higher PEEP strategy results in a difference in ventilator-free days at day 28 in mechanically ventilated patients with ARDS (PaO2/FiO2 ratio <300 mmHg) compared to a lower PEEP strategy.
Sources: Mercat, 2008 (Walkey, 2017) |
|
Low GRADE |
A higher PEEP strategy may result in a better oxygenation in mechanically ventilated patients with ARDS (PaO2/FiO2 ratio <300 mmHg) compared to a lower PEEP strategy.
Sources: Mercat, 2008 (Walkey, 2017) |
|
Very low GRADE |
It is uncertain whether a higher PEEP strategy results in a difference in number of barotrauma in mechanically ventilated patients with ARDS (PaO2/FiO2 ratio <300 mmHg) compared to a lower PEEP strategy
Sources: Mercat, 2008 (Guo, 2018; Walkey, 2017) |
Samenvatting literatuur
Summary of literature
Description of studies
Guo (2018) performed a systematic review and meta-analysis regarding the efficacy of using higher PEEP versus lower PEEP in patients with ARDS. A systematic search was performed in December 2017 using MEDLINE, CENTRAL, EMBASE, CINHAL and Web of Science. The authors included RCTs comparing higher PEEP with lower PEEP. Participants were adult patients with acute respiratory failure, acute lung injury or acute respiratory distress syndrome. A total of nine RCTs (n=3612) were included. Studies were assessed as low risk of bias. Four of the RCTs reported by Guo (2018) were included in the current review. The other five RCTs did not fulfilll the inclusion criteria of the current review (reasons for exclusion are noted in the evidence table).
Walkey (2017) performed a systematic review and meta-analysis regarding the efficacy of using higher PEEP versus lower PEEP in patients with ARDS. A systematic search was performed in September 2016 using MEDLINE, EMBASE and Cochrane Central register of controlled trial. The authors included RCTs comparing different strategies to determine PEEP levels. Participants were adult patients with acute lung injury or acute respiratory distress syndrome. In total, eight RCTs (n=2728; mean age: 55 years) were included. Studies were assessed as low risk of bias. The authors performed a sensitivity analysis stratifying by studies using protocolized recruitment maneuvers as cointervention with higher PEEP.
Five RCTs were relevant for the current review. The other three RCTs did not fulfill the inclusion criteria of the current review (reasons for exclusion are noted in the evidence table).
The RCTs included in both systematic reviews were:
Brower (2004), Cavalcanti (2017), Hodgson (2011), Kacmarek (2016), Meade (2006), and Mercat (2008). Important study characteristics and results are summarized in the evidence tables.
The studies of Brower (2004), Kacmarek (2016), Meade (2006) and Mercat (2008) were early terminated. Most studies limited enrolment of ARDS patients to disease severity of moderate-to-severe ARDS (PaO2/FiO2 ratio <200 mmHg) (Cavalcanti, 2017; Hodgson, 2011; Kacmarek, 2010), whereas some studies used selection criteria of patients with PaO2/FiO2 ratio <250 mmHg (Meade, 2008) or <300 mmHg (Brower, 2004; Mercat, 2008).
The comparison of high and lower PEEP level groups will be reported for each outcome measure. PEEP levels of the intervention and control groups are shown in table 1. In addition to the main comparison, a sensitivity analysis was performed for studies based on the use of protocolized recruitment maneuvers in the higher PEEP group (Cavalcanti, 2017; Hodgson, 2011; Kacmarek, 2016; Meade, 2006) or no protocolized recruitment maneuvers (Mercat, 2008). Note that Brower (2004) was reported as a different group since recruitment maneuvers were only performed in the first 80 patients enrolled.
Table 1: PEEP levels at day 1 (24h)
|
|
Level of higher PEEP (cmH2O) (intervention group) Mean ± SD |
Level of lower PEEP (cmH2O) (control group) Mean ± SD |
|
Brower (2004) |
14.7 ± 3.5 |
8.9 ± 3.5 |
|
Cavalcanti (2017) |
16.2 (95%CI: 15.9 to 16.6) |
12.0 (95%CI: 11.7 to 12.3) |
|
Hodgson (2011) |
15 ± 1 |
10 ± 0.5 |
|
Kacmarek (2016) |
15.8 ± 3.8 |
11.6 ± 3.5 |
|
Meade (2006) |
15.6 ± 3.9 |
10.1 ± 3.0 |
|
Mercat (2008) |
14.6 ± 3.2 |
7.1 ± 1.8 |
Results
28-day mortality
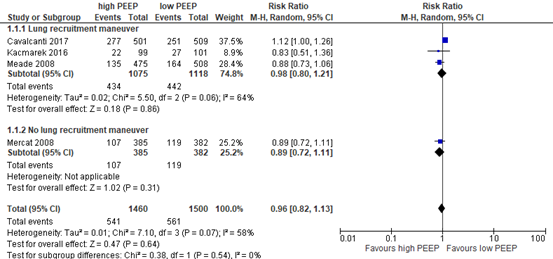
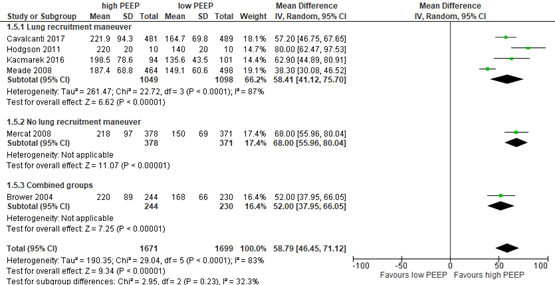
Four of the included RCTs in Walkey (2017) and Guo (2018) that were selected for the current review reported 28-day mortality rate in a population of 2960 patients (see meta-analysis in figure 1). Only Mercat (2008) reported the effect of a higher PEEP strategy without a lung recruitment maneuver versus a lower PEEP strategy. The difference was clinically relevant (RR; 0.89 95% CI 0.72 to 1.11) in favor of the higher PEEP strategy.
Figure 1: meta-analysis of effect of higher PEEP versus lower PEEP on 28-day mortality
60-day mortality
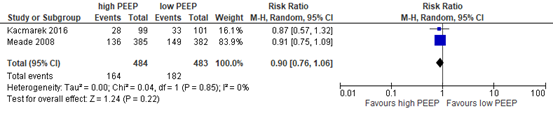
Two of the included relevant RCTs in Walkey (2017) and Guo (2018) reported 60-day mortality rate in a total population of 967 patients; both studies combined a higher PEEP strategy with a lung recruitment maneuver. The risk ratio between a higher PEEP strategy combined with a lung recruitment maneuver and a lower PEEP strategy was clinically relevant (RR 0.90; 95% CI 0.76 to 1.06, see figure 2) in favor of the higher PEEP strategy.
Figure 2: meta-analysis of effect of higher PEEP versus lower PEEP on 60-day mortality
In-hospital mortality
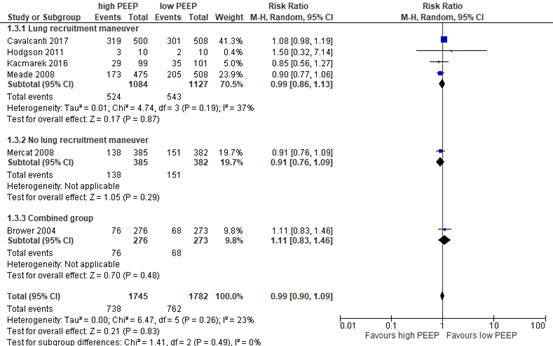
All included relevant RCTs reported in-hospital mortality rate in a total population of 3527 patients (see meta-analysis in figure 3). Only Mercat (2008) reported the effect of a higher PEEP strategy without a lung recruitment maneuver versus a lower PEEP strategy. The difference was clinically relevant (RR 0.91, 95% CI 0.76 to 1.09) in favor of the higher PEEP strategy.
Figure 3: meta-analysis of effect of higher PEEP versus lower PEEP on in-hospital mortality
Quality of life
No studies investigating the effect of higher versus lower PEEP on quality of life of patients with ARDS and meeting the inclusion criteria were found.
Organ failure
Only one of the included RCTs in Walkey (2017) (Hodgson, 2011) reported the SOFA score for organ failure in patients treated with a higher PEEP strategy combined with a lung recruitment maneuver compared to a lower PEEP strategy. The mean difference in SOFA score (-0.1; 95% CI -0.52 to 0.32) that was measured in 20 patients at day 7 after enrolment was not clinically relevant (intervention group mean 8.6 SD 0.3); control group mean (8.4 SD 0.6).
Ventilator-free days
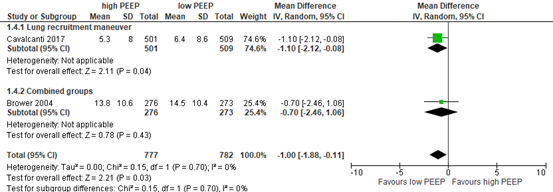
Five of the included RCTs in Walkey (2017) and Guo (2018) reported the number of ventilator free days on day 28. Two RCTs are included in the meta-analysis (MD
-1.00; 95% CI -1.88 to -0.11), see figure 4, n=1599) with effects in favor of the low PEEP group. Two RCTs reported median (IQR) values and could not be included (see table 2, n=967). Differences between medians were 1 and 4 days in favor of a higher PEEP strategy.
Table 2: Effect of higher PEEP versus lower PEEP on number of ventilator free days at day 28: median (IQR)
|
Study |
Higher PEEP |
Lower PEEP |
|
Lung recruitment maneuver |
||
|
Kacmarek, 2016 |
8 (0 to 20) |
7 (0 to 20) |
|
No lung recruitment maneuver |
||
|
Mercat, 2008 |
7 (0 to 19) |
3 (0 to 17) |
Figure 4: meta-analysis of effect of higher PEEP versus lower PEEP on ventilator free days at day 28
Only Mercat (2008) reported the effect of a higher PEEP strategy without a lung recruitment maneuver versus a lower PEEP strategy. The increased number of ventilator-free days in the higher PEEP group is considered as clinically relevant in ARDS patients with a PaO2/FiO2 <300 mmHg.
Oxygenation
Six of the included relevant RCTs in Walkey (2017) and Guo (2018) reported oxygenation for 3370 patients. Oxygenation was measured by PaO2/FiO2 ratio recorded approximately 24 hours after trial enrollment (see meta-analysis in figure 5) and was increased in the high PEEP group for all studies. Only Mercat (2008) reported the effect of a higher PEEP strategy without a lung recruitment maneuver versus a lower PEEP strategy. The mean difference was clinically relevant (MD 68.00; 95% CI 55.96 to 80.04 mmHg) in favor of the higher PEEP strategy.
Figure 5: meta-analysis of effect of higher PEEP versus lower PEEP on oxygenation
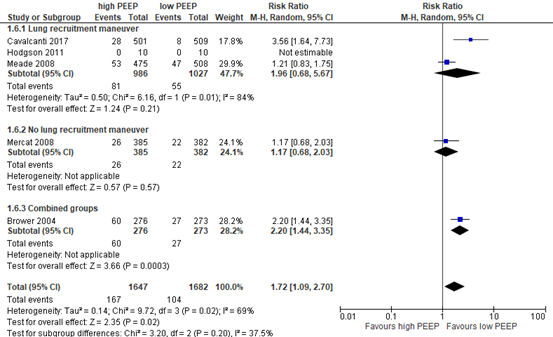
Barotrauma/pneumothorax
Five of the included relevant RCTs in Walkey (2017) and Guo (2018) reported rate of barotrauma for a total study population of 3329 patients (see meta-analysis in figure 6). Only Mercat (2008) reported the effect of a higher PEEP strategy without a lung recruitment maneuver versus a lower PEEP strategy. The difference was clinically relevant (RR 1.17; 95% CI 0.68 to 2.03) in favor of the lower PEEP strategy.
Figure 6: meta-analysis of effect of higher PEEP versus lower PEEP on barotrauma
Level of evidence of the literature
28-day mortality
To exclude indirectness due to combining a higher PEEP strategy with a lung recruitment maneuver, only the study investigating the effect of a higher PEEP strategy exclusively (Mercat, 2008) was graded. The level of evidence regarding the outcome measure started at high level and was downgraded to very low because of risk of bias (one level as study terminated early) and imprecision (two levels due to wide confidence crossing both borders of clinical relevance).
60-day mortality
The level of evidence regarding the outcome measure started at high level and was downgraded to very low because of risk of bias (one level as studies terminated early), indirectness (one level, because the intervention of higher PEEP was combined with lung recruitment maneuvers) and imprecision (two levels, due to wide confidence intervals crossing both borders of clinical relevance).
In-hospital mortality
To exclude indirectness due to combining a higher PEEP strategy with a lung recruitment maneuver, only the study investigating the effect of a higher PEEP strategy exclusively (Mercat, 2008) was graded. The level of evidence regarding the outcome measure started at high level and was downgraded to very low because of risk of bias (one level as study terminated early) and imprecision (two levels due to wide confidence intervals crossing both borders of clinical relevance).
Quality of life
The evidence could not be graded as no studies investigating the effect of higher versus lower PEEP on quality of life of patients with ARDS and meeting the inclusion criteria were found.
Organ failure
The level of evidence regarding the outcome measure started at high level and was downgraded to very low because of indirectness (one level, because the intervention of higher PEEP was combined with lung recruitment maneuvers) and imprecision (two levels, as only one study was included with very low numbers of participants).
Ventilator free days
To exclude indirectness due to combining a higher PEEP strategy with a lung recruitment maneuver, only the study investigating the effect of a higher PEEP strategy exclusively (Mercat, 2008) was graded. The level of evidence regarding the outcome measure started at high level and was downgraded to very low because of risk of bias (one level as study terminated early) and imprecision (two levels as only one study was included with unknown confidence intervals).
Oxygenation
To exclude indirectness due to combining a higher PEEP strategy with a lung recruitment maneuver, only one study investigating the effect of a higher PEEP strategy exclusively (Mercat, 2008) was graded. The level of evidence regarding the outcome measure started at high level and was downgraded to low because of risk of bias (one level as study terminated early) and imprecision (one level as only one study was included).
Barotrauma
To exclude indirectness due to combining a higher PEEP strategy with a lung recruitment maneuver, only the study investigating the effect of a higher PEEP strategy exclusively (Mercat, 2008) was graded. The level of evidence regarding the outcome measure started at high level and was downgraded to very low because of risk of bias (one level as study terminated early) and imprecision (two levels due to wide confidence interval crossing both borders of clinical relevance).
Zoeken en selecteren
Search and select
A systematic review of the literature was performed to answer the following question: What is the effect of using a higher PEEP in comparison to a lower PEEP strategy on mortality, ventilator-free days, oxygenation and barotrauma (i.e., pneumothorax) in patients with ARDS receiving mechanical ventilation?
P: Adult patients with ARDS receiving mechanical ventilation at ICU;
I: Higher PEEP strategy;
C: Lower PEEP strategy;
O: Mortality (28-day, hospital, or 60-day); Quality of life; Organ failure (SOFA score); Ventilator-free days on day 28; Oxygenation (PaO2/FiO2 ratio); Barotrauma/Pneumothorax.
Relevant outcome measures
The guideline development group considered mortality as a critical outcome measure for decision making; and quality of life, organ failure, ventilator-free days, oxygenation, barotrauma/pneumothorax as important outcome measures for decision making.
The working group defined the outcome measures as follows:
- Mortality: 28-day mortality, 60-day mortality, in-hospital mortality.
- Quality of life: as measured by validated questionnaires.
- Organ failure: as per the SOFA score.
- Ventilator-free days at day 28.
- Oxygenation, barotrauma/pneumothorax as per the definitions used in the included literature.
The working group defined the following values as minimal clinically (patient) important differences:
- Mortality: 0.95≥risk ratio (RR)≥1.05.
- Quality of life: mean difference (MD) >10% of maximum score.
- Organ failure (SOFA score): mean difference (MD)≤10%.
- Ventilator-free days: MD≥1 day.
- PaO2/FIO2 ratio: MD≥10%.
- Barotrauma/pneumothorax: 0.91 ≥ RR ≥ 1.10.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 29th of October 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 1408 hits. Studies were selected based on the following criteria:
- Systematic review.
- Published after the year 2000.
- Mechanically ventilated patients with ARDS were included.
- Comparison between higher and lower PEEP strategies.
- Not setting PEEP based on transpulmonary pressure targets using an esophageal balloon.
- Outcome measures were mortality, quality of life, organ failure, ventilator-free days, oxygenation and/or barotrauma.
Ten studies were initially selected based on title and abstract screening. After reading the full text, eight studies were excluded (see the table with reasons for exclusion under the tab Methods), and two systematic reviews were included.
To find relevant RCTs that were published after the search date (December 2017) of the included systematic reviews, an additional selection was performed. Studies were selected based on the following criteria:
- Randomized controlled trial.
- Published after December 2017.
- Mechanically ventilated patients with ARDS were included.
- Comparison between higher and lower PEEP strategies.
- Not setting PEEP based on transpulmonary pressure targets using an esophageal balloon.
- Outcome measures were mortality, quality of life, organ failure, ventilator free days, oxygenation and/or barotrauma.
No additional RCTs were selected based on title and abstract screening.
Results
Two systematic reviews (Walkey, 2017; Guo, 2018) were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Amato MB, Santiago RR. The Recruitability Paradox. Am J Respir Crit Care Med 2016; 193: 1192-1195.
- Bellani, G., Rouby, J.-J., Constantin, J.-M., & Pesenti, A. (2017). Looking closer at acute respiratory distress syndrome. Current Opinion in Critical Care, 23(1), 30-37.
- Borges JB, Okamoto VN, Matos GF, Caramez MP, Arantes PR, Barros F, et al. Reversibility of lung collapse and hypoxemia in early acute respiratory distress syndrome. Am J Respir Crit Care Med 2006;174(3):268-278.
- Brower, R. G. e.a.; National Heart, Lung, and Blood Institute ARDS Clinical Trials Network. (2004). Higher versus lower positive end-expiratory pressures in patients with the acute respiratory distress syndrome. New England Journal of Medicine, 351(4), 327-336.
- Cavalcanti, A. B., Suzumura, É. A., Laranjeira, L. N., de Moraes Paisani, D., Damiani, L. P., Guimarães, H. P., ... & de Carvalho, C. R. R. (2017). Effect of lung recruitment and titrated positive end-expiratory pressure (PEEP) vs lower PEEP on mortality in patients with acute respiratory distress syndrome: a randomized clinical trial. Jama, 318(14), 1335-1345.
- Chen L, DelSorbo L,Grieco DL, Shklar O, Junhasavasdikul D, Telias I, et al. Airway closure in acute respiratory distress syndrome: an underestimated and misinterpreted phenomenon. Am J Respir Crit Care Med. 1 janv 2018;197(1):132-6.
- Chen L, Del Sorbo L, Grieco DL, Junhasavasdikul D, Rittayamai N, Soliman I, Sklar MC, Rauseo M, Ferguson ND, Fan E, Richard JM, Brochard L. Potential for Lung Recruitment Estimated by the Recruitment-to-Inflation Ratio in Acute Respiratory Distress Syndrome. A Clinical Trial. Am J Respir Crit Care Med. 2020 Jan 15;201(2):178-187. doi: 10.1164/rccm.201902-0334OC.
- Constantin J-M, Jabaudon M, Lefrant J-Y, & Pereira B, Futier E (2019). Personalised mechanical ventilation tailored to lung morphology versus low positive end-expiratory pressure for patients with acute respiratory distress syndrome in France (the LIVE study): a multicentre, single-blind, randomized controlled trial. Lancet Respir Med, 7:870-80.
- Chiumello D, Marino A, Brioni M, Cigada I, Menga F, Colombo A, Crimella F, Algieri I, Cressoni M, Carlesso E, Gattinoni L. Lung Recruitment Assessed by Respiratory Mechanics and Computed Tomography in Patients with Acute Respiratory Distress Syndrome. What Is the Relationship? Am J Respir Crit Care Med 2016; 193: 1254-1263.
- Dianti J, Tisminetzky M, Ferreyro BL, Englesakis M, Del Sorbo L, Sud S, Talmor D, Ball L, Meade M, Hodgson C, Beitler JR, Sahetya S, Nichol A, Fan E, Rochwerg B, Brochard L, Slutsky AS, Ferguson ND, Serpa Neto A, Adhikari NK, Angriman F, Goligher EC. Association of PEEP and Lung Recruitment Selection Strategies with Mortality in Acute Respiratory Distress Syndrome: A Systematic Review and Network Meta-Analysis. Am J Respir Crit Care Med. 2022 Feb 18.
- Fengmei G, Jin C, Songqiao L, Congshan Y, Yi Y. Dead space fraction changes during PEEP titration following lung recruitment in patients with ARDS. Respir Care 2012; 57(10):1578-1585.
- Frerichs I, Amato MB, van Kaam AH, Tingay DG, Zhao Z, Grychtol B, Bodenstein M, Gagnon H, Bohm SH, Teschner E, Stenqvist O, Mauri T, Torsani V, Camporota L, Schibler A, Wolf GK, Gommers D, Leonhardt S, Adler A, group Ts. Chest electrical impedance tomography examination, data analysis, terminology, clinical use and recommendations: consensus statement of the TRanslational EIT developmeNt stuDy group. Thorax 2017; 72: 83-93
- Girgis K, Hamed H, Khater Y, Kacmarek RM. A decremental PEEP trial identifies the PEEP level that maintains oxygenation after lung recruitment. Respir Care 2006; 51(10):1132-1139.
- Grasso S, et al (2007) ARDSnet Ventilatory Protocol and Alveolar Hyperinflation: Role of Positive End-Expiratory Pressure. Am J Respir Crit Care Med 176:761-767
- Guo, L., Xie, J., Huang, Y., Pan, C., Yang, Y., Qiu, H., & Liu, L. (2018). Higher PEEP improves outcomes in ARDS patients with clinically objective positive oxygenation response to PEEP: a systematic review and meta-analysis. BMC anesthesiology, 18(1), 1-11.
- Goligher EC, Kavanagh BP, Rubenfeld GD, ... & Ferguson ND (2014). Oxygenation response to positive end-expiratory pressure predicts mortality in acute respiratory distress syndrome. A secondary analysis of the LOVS and ExPress trials. Am J Respir Crit Care Med.190(1):70-6
- Hodgson, C. L., Tuxen, D. V., Davies, A. R., Bailey, M. J., Higgins, A. M., Holland, A. E., ... & Nichol, A. D. (2011). A randomised controlled trial of an open lung strategy with staircase recruitment, titrated PEEP and targeted low airway pressures in patients with acute respiratory distress syndrome. Critical care, 15(3), 1-9.
- Kacmarek, R. M., Villar, J., Sulemanji, D., Montiel, R., Ferrando, C., Blanco, J., ... & Suárez-Sipmann, F. (2016). Open lung approach for the acute respiratory distress syndrome: a pilot, randomized controlled trial. Critical care medicine, 44(1), 32-42.
- Meade, M. O., Cook, D. J., Guyatt, G. H., Slutsky, A. S., Arabi, Y. M., Cooper, D. J., ... & Lung Open Ventilation Study Investigators, F. T. (2008). Ventilation strategy using low tidal volumes, recruitment maneuvers, and high positive end-expiratory pressure for acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. Jama, 299(6), 637-645.
- Mercat, A., Richard, J. C. M., Vielle, B., Jaber, S., Osman, D., Diehl, J. L., ... & Brochard, L. (2008). Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. Jama, 299(6), 646-655.
- Slutsky A.S., Ranieri, V.M. (2013), Ventilator-induced lung injury. N Engl J Med. Nov 28;369(22):2126-36
- Terragni PP, Rosboch G, Tealdi A, et al (2007) Tidal Hyperinflation during Low Tidal Volume Ventilation in Acute Respiratory Distress Syndrome. Am J Respir Crit Care Med 175:160-166
- Toth I, Leiner T, Mikor A, Szakmany T, Bogar L, Molnar Z. Hemodynamic and respiratory changes during lung recruitment and descending optimal positive end-expiratory pressure titration in patients with acute respiratory distress syndrome. Crit Care Med 2007; 35(3):787-793.
- Walkey, A. J., Del Sorbo, L., Hodgson, C. L., Adhikari, N. K., Wunsch, H., Meade, M. O., ... & Fan, E. (2017). Higher PEEP versus lower PEEP strategies for patients with acute respiratory distress syndrome. A systematic review and meta-analysis.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Walkey 2017 |
Yes |
Yes |
No |
No |
NA (only RCTs included) |
Yes |
Yes |
Yes |
No |
|
Guo 2018 |
Yes |
Yes |
No |
Yes |
NA (only RCTs included) |
Yes |
Yes |
Yes |
No |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Dianti, 2020 |
Does not fit PICO (wrong outcome) |
|
Kasenda, 2016 |
Different research question |
|
Santa Cruz, 2013 |
More recent review available |
|
Dasenbrook, 2011 |
More recent review available |
|
Briel, 2010 |
More recent review available |
|
Oba, 2009 |
More recent review available |
|
Phoenix, 2009 |
More recent review available |
|
Putensen, 2009 |
More recent review available |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 05-03-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financierder heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met ARDS.
Werkgroep
- Dr. H. Endeman, internist-intensivist, NVIC
- Dr. R.M. Determann, internist-intensivist, NIV
- Drs. R. Pauw, longarts-intensivist, NVALT
- Drs. M. Samuels, anesthesioloog-intensivist, NVA
- Dr. A.H. Jonkman, klinisch technoloog, NVvTG
- J.W.M. Snoep, ventilation practitioner/IC-verpleegkundige, V&VN
- Drs. M.A.E.A. Brackel, patiëntvertegenwoordiger (tot 1-1-2022 bestuurslid FCIC/Voorzitter IC Connect), FCIC/IC Connect
Meelezers:
- Drs. F.Z. Ramjankhan, Cardio-thoracaal chirurg, NVT
- Dr. R.R.M. Vogels, Radioloog, NVvR
- Drs. R. ter Wee, Klinisch fysicus, NVKF
Met ondersteuning van:
- Drs. I. van Dusseldorp, literatuurspecialist, Kennisinsitituut van de Federatie van Medisch Specialisten
- Dr. S.N. Hofstede, senior-adviseur, Kennisinsitituut van de Federatie van Medisch Specialisten
- Dr. J.C. Maas, adviseur, Kennisinsitituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Endeman |
Internist-intensivist, opleider Intensive Care, Erasmus MC, Rotterdam |
Secretaris GIC, lid sectie IC NIV aanpassing juli 2022:
|
Travelgrant/speakers fee voor IC-symposium Kenya augustus 2018 door GETINGE
Advanced mechanical ventilation is een speerpunt van wetenschappelijk onderzoek van de Intensive Care van het Erasmus MC aanpassing juli 2022: gesponsord door Ventinova. Dat is een beademingsmachine. Open Lung Concept 2.0: Flow Controlled Ventilation |
Bij modules die specifiek gaan over apparatuur ontwikkeld door GETINGE: Wanneer dit onderwerp geprioriteerd wordt zal een vice-voorzitter worden aangewezen en werkgroeplid niet meebeslissen over dit onderwerp |
|
Pauw |
Intensivist longarts Martini Ziekenhuis Groningen |
Secretaris sectie IC NVALT (onbetaald), instructeur FCCS-cursus NVIC (vergoeding per gegeven cursus, gemiddeld 1-2x/jaar) |
Maart 2023: Spreker congres pulmonologie vogelvlucht: pulmonary year in review m.b.t. IC-onderwerpen |
Geen |
|
Jonkman |
* Technisch geneeskundige (klinisch technoloog), PhD kandidaat en research manager, afdeling Intensive Care Volwassenen, Amsterdam UMC, locatie Vumc (t/m 2021) * Research fellow dept. Critical Care Medicine, St. Michael’s Hospital, University of Toronto, Canada (gedetacheerd vanuit VUmc voor periode jan-dec 2020)
aanpassing juli 2022: |
Bestuurslid Nederlandse Vereniging voor Technische Geneeskunde (NVvTG), vice-voorzitter t/m mei 2021 |
Adviesfunctie (consultancy) bij Liberate Medical LLC (Kentucky, USA), een medical device company dat een niet-invasieve elektrische spierstimulator ontwikkelt voor het trainen van de expiratiespieren (buikspieren) tijdens kunstmatige beademing. Betaald consultancy werk, ongeveer 1-2 dagdelen per jaar (2018 -2020)
Deelname aan diverse nationale en internationale investigator-initiated wetenschappelijke onderzoeken naar gepersonaliseerde kunstmatige beademing middels advanced respiratory monitoring (o.a. ademspierfunctie en electrische impedantie tomografie) bij de IC-patiënt. Deels in het kader van voormalig promotieonderzoek Waaronder: * lid stuurgroep CAVIARDS-trial (Careful Ventilation in (COVID-19-induced) Acute Respiratory Distress Syndrome, NCT03963622), internationale investigator-initiated studie naar gepersonaliseerde beademingsstrategie bij ARDS, geen persoonlijke financiële vergoeding |
Onderwerpen niet-invasieve elektrische spierstimulatie en gepersonaliseerde kunstmatige beademing middels advanced respiratory monitoring worden niet behandeld in de richtijn. Mochten deze toch worden toegevoegd, dan zal werkgroep lid niet als auteur van deze specifieke modules worden aangesteld. |
|
Samuels |
Anesthesioloog – Intensivist, te Franciscus Gasthuis & Vlietland
aanpassing Juli 2022: Anesthesioloog-lntensivist, te HMC |
* MICU intensivist – betaald * FCCS teacher – betaald * bestuurslid sectie IC NVA
aanpassing Juli 2022: Waarnemer als lntensivist op de IC (betaald) Voorzitter sectie IC, NVA (onbetaald) |
Geen |
Geen |
|
De Graaff |
Intensivist – Internist, St Antonius ziekenhuis Nieuwegein, fulltime |
Bestuurslid Stichting NICE, vrijwilligerswerk |
Geen |
Geen |
|
Determann |
Intensivist OLVG |
Gastdocent Amstelacademie (betaald) |
Geen |
Geen |
|
Brackel-Welten |
* Voorzitter patiëntenorganisatie IC Connect, onbetaald, tot 1-1-2022 * Bestuurslid Stichting Family en patient centered Intensive Care (Stichting FCIC), onbetaald, tot 1-1-2022 * Jeugdarts KNMG, niet praktiserend * voormalig IC-patiënte |
Geen |
Voorzitterschap IC Connect, bestuurslid Stichting FCIC, tot 1-1-2022 |
Geen |
|
Snoep |
* Ventilation Practitioner 25% * IC-verpleegkundige 75%
aanpassing juli 2022: Leids Universitair Medisch Centrum
|
Hamilton Medicai expert panel Netherlands, sinds 2022. Onbetaald |
Geen |
Geen |
|
Ramjankhan |
Cardio-thoracaal chirurg UMCU |
Geen |
Geen |
Geen |
|
Ter Wee |
Klinisch Fysicus in opleiding - Medisch Spectrum Twente |
Geen |
Geen |
Geen |
|
Vogels |
*Radioloog met aandachtsgebied thoracale en abdominale radiologie * Fellow Thoraxradiologie
Maatschap Radiologie Oost Nederland (MRON) locatie MST Enschede
Toevoeging juli 2022: Radioloog met als aandachtsgebied thoracale en abdominale readiologie als maatschapslid bij MRON licatie ZGT Almelo/Hengelo |
Geen |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland, Stichting FCIC, IC Connect en het Longfonds voor deelname aan de schriftelijke knelpunteninventarisatie en deelname van een afgevaardigde van Stichting FCIC en IC Connect in de werkgroep. De resultaten van de schriftelijke knelpunteninventarsiatie zijn besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Stichting FCIC, IC Connect en het Longfonds. De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Methode van beademing – PEEP |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven.
|
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met ARDS. Tevens zijn IGJ, NFU, NHG, NVZ, Patiëntenfederatie Nederland, STZ, V&VN, NVIC, NVA, NIV, NVALT, NVvTG, NVVC, NVN, NVKF, Longfonds, FCIC/IC Connect en ventilation practitioners uitgenodigd om knelpunten aan te dragen via een enquête. Een overzicht hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties uit de werkgroep voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Grasselli G, Calfee CS, Camporota L, Poole D, Amato MBP, Antonelli M, Arabi YM, Baroncelli F, Beitler JR, Bellani G, Bellingan G, Blackwood B, Bos LDJ, Brochard L, Brodie D, Burns KEA, Combes A, D'Arrigo S, De Backer D, Demoule A, Einav S, Fan E, Ferguson ND, Frat JP, Gattinoni L, Guérin C, Herridge MS, Hodgson C, Hough CL, Jaber S, Juffermans NP, Karagiannidis C, Kesecioglu J, Kwizera A, Laffey JG, Mancebo J, Matthay MA, McAuley DF, Mercat A, Meyer NJ, Moss M, Munshi L, Myatra SN, Ng Gong M, Papazian L, Patel BK, Pellegrini M, Perner A, Pesenti A, Piquilloud L, Qiu H, Ranieri MV, Riviello E, Slutsky AS, Stapleton RD, Summers C, Thompson TB, Valente Barbas CS, Villar J, Ware LB, Weiss B, Zampieri FG, Azoulay E, Cecconi M; European Society of Intensive Care Medicine Taskforce on ARDS. ESICM guidelines on acute respiratory distress syndrome: definition, phenotyping and respiratory support strategies. Intensive Care Med. 2023 Jul;49(7):727-759. doi: 10.1007/s00134-023-07050-7. Epub 2023 Jun 16. PMID: 37326646; PMCID: PMC10354163.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Algemene informatie
|
Database(s): Ovid/Medline, Embase |
Datum: 29-10-2020 |
|
Periode: 2000- |
Talen: nvt |
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
293 |
130 |
314* |
|
RCTs |
819 |
574 |
1094* |
|
Observationele studies |
527 |
444 |
675 |
|
Overig |
|
|
|
|
Totaal |
|
|
1408/2083 |
* In Rayyan
Zoekstrategie
Embase, 29-10-2020
|
No. |
Query |
Results |
|
#17 |
#16 NOT #11 NOT #10 = OBS |
527 |
|
#16 |
#9 AND #15 |
1097 |
|
#15 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6176170 |
|
#14 |
#9 AND #13 = Sleutelartikelen gevonden |
2 |
|
#13 |
#1 OR #2 |
2 |
|
#12 |
#11 NOT #10= RCT |
819 |
|
#11 |
#4 AND #9 |
957 |
|
#10 |
#3 AND #9 = SR |
293 |
|
#9 |
#8 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
4149 |
|
#8 |
#7 NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab OR child*:ti,ab OR schoolchild*:ti,ab OR infant*:ti,ab OR girl*:ti,ab OR boy*:ti,ab OR teen:ti,ab OR teens:ti,ab OR teenager*:ti,ab OR youth*:ti,ab OR pediatr*:ti,ab OR paediatr*:ti,ab OR puber*:ti,ab) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab OR man:ti,ab OR men:ti,ab OR woman:ti,ab OR women:ti,ab)) |
8739 |
|
#7 |
#5 AND #6 |
11607 |
|
#6 |
'positive pressure ventilation'/exp OR (((hyperbaric OR pressure) NEAR/2 (respirat* OR ventilat* OR breathing)):ti,ab,kw) OR 'positive end expiratory pressure':ti,ab,kw OR peep:ti,ab,kw |
72119 |
|
#5 |
'respiratory distress syndrome'/exp OR 'ards':ti,ab,kw OR 'adult respiration distress*':ti,ab,kw OR 'adult respiratory distress*':ti,ab,kw OR 'lung shock':ti,ab,kw OR 'posttraumatic lung failure*':ti,ab,kw OR 'posttraumatic pulmonary insufficienc*':ti,ab,kw OR 'shock lung*':ti,ab,kw OR 'acute respiration distress':ti,ab,kw OR 'acute respiratory distress':ti,ab,kw OR 'acute chest syndrome'/exp OR 'acute chest syndrome*':ti,ab,kw |
91797 |
|
#4 |
('randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
1978846 |
|
#3 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
676708 |
|
#2 |
20197533 AND briel = Sleutelartikel |
1 |
|
#1 |
29043834 AND walkey = Sleutelartikel |
1 |
Ovid/Medline, 29-9-2010
1 exp Respiratory Distress Syndrome, Adult/ or exp acute chest syndrome/ or ards.ti,ab,kf. or adult respiration distress*.ti,ab,kf. or adult respiratory distress*.ti,ab,kf. or lung shock.ti,ab,kf. or posttraumatic lung failure*.ti,ab,kf. or posttraumatic pulmonary insufficienc*.ti,ab,kf. or shock lung*.ti,ab,kf. or acute respiration distress.ti,ab,kf. or acute respiratory distress.ti,ab,kf. or acute chest syndrome*.ti,ab,kf. (33300)
2 exp positive pressure ventilation/ or ((hyperbaric or pressure) adj2 (respirat* or ventilat* or breathing)).ti,ab,kf. or 'positive end expiratory pressure'.ti,ab,kf. or peep.ti,ab,kf. (37722)
3 1 and 2 (4256)
4 3 not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) (4025)
5 4 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) (3022)
6 limit 5 to yr="2000 -Current" (2114)
7 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (458575)
8 (randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2039535)
9 6 and 7 (130) = SR
10 6 and 8 (654)
11 10 not 9 (574) = RCT
12 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3550570)
13 6 and 12 (740)
14 13 not 10 not 9 (444) = Observationeel
15 from 9 keep 1-130 (130)
16 from 11 keep 1-574 (574)
17 from 14 keep 1-444 (444)