Behandeling valrisico bij patiënten met de ziekte van Parkinson
Uitgangsvraag
Welke niet-medicamenteuze interventies zijn effectief om het risico op vallen te verminderen bij patiënten met de ziekte van Parkinson?
Aanbeveling
Aanbevelingen ten aanzien van signaleren en doorverwijzing
Analyseer bij iedere patiënt met de ziekte van Parkinson het valrisico. Vraag naar de valgeschiedenis van het afgelopen jaar. Vraag ook naar bijna vallen en valangst.
Bespreek met de patiënt naar aanleiding van de analyse een plan ten aanzien van het valrisico aangaande behandeling en/of doorverwijzing voor nadere (multidisciplinaire) analyse van valrisicofactoren.
Evalueer bij een verhoogd valrisico of er medisch behandelbare factoren zijn conform de richtlijn valpreventie bij ouderen (zoals visus, polyfarmacie en orthostase). Onderneem actie ten aanzien van eventuele medisch behandelbare factoren (zie richtlijn Valpreventie).
Verwijs bij verhoogd valrisico of twijfel hierover de persoon naar een fysiotherapeut met expertise op het gebied van de ziekte van Parkinson voor analyse en behandeling volgens de KNGF-richtlijn.
Verwijs bij een verhoogd valrisico of valangst naar een oefen- of ergotherapeut met expertise op het gebied van de ziekte van Parkinson voor analyse en behandeling van veiligheid van het handelen in de eigen omgeving volgens de richtlijn Ergotherapie bij de ziekte van Parkinson en de Ergotherapierichtlijn Valpreventie.
Aanbevelingen ten aanzien van interventies van fysio- en oefentherapie
Bespreek bij angst om te vallen of een verhoogd valrisico de mogelijkheid van een gecombineerde functie- en strategietraining en bied deze aan conform de richtlijn Fysiotherapie bij de ziekte van Parkinson (2017).
Aanbevelingen ten aanzien van interventies van ergotherapie
Bespreek de mogelijkheid van een ergotherapeutische interventie aan huis om het handelen in de eigen omgeving veiliger te maken door het aanpassen van de wijze van handelen, van de activiteiten of van de dagelijkse routine, en/of door het aanpassen van de omgeving conform de richtlijn Ergotherapie bij de ziekte van Parkinson (2008) en de Ergotherapierichtlijn Valpreventie (2016).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De opgenomen studies hebben vooral gekeken naar beweeginterventies gericht op het verbeteren van de intrinsieke risicofactoren mobiliteit en balans. Er zijn tal van studies die hebben gekeken naar het verbeteren van balans en mobiliteit bij mensen met parkinson, maar die hebben het verminderen van valangst of valfrequentie niet meegenomen als uitkomstmaat. Een probleem met het gevonden bewijs is dat de interventies erg divers waren qua inhoud, setting (thuis of kliniek), individueel/groep, mate van supervisie, frequentie en duur. Ook de follow-up tijd waarover het effect werd gemeten is divers. Hierdoor zijn de studies in veel opzichten moeilijk met elkaar te vergelijken.
Er zijn geen studies gevonden die valpreventie-interventies hebben onderzocht gericht op het veranderen van keuzes in het handelen, de methode van handelen (gedragsverandering), of het aanpassen van de fysieke of sociale omgeving. Dit zijn juist interventies die in de praktijk veel worden toegepast door ergotherapeuten en ook beschreven staan in de Ergotherapie richtlijn Valpreventie (Sturkenboom & Steultjens, 2016). In valpreventieonderzoek bij thuiswonende ouderen (niet specifiek ziekte van Parkinson) is sterk bewijs voor de meerwaarde van deze persoon-omgevingsinterventies (zie Richtlijn valpreventie bij ouderen).
Vallen bij de ziekte van Parkinson is een multifactorieel probleem. Vanuit kennis over de risicofactoren voor vallen bij mensen met de ziekte van Parkinson wordt in de literatuur aanbevolen individueel afgestemde multifactoriële en multidisciplinaire interventies aan te bieden (Fasano, 2017; Van der Marck, 2014). In de gevonden studies bij onze zoekvraag zijn soms wel meer trainingselementen opgenomen in de interventie, maar zijn geen multidisciplinaire interventies onderzocht. Bij valangst, zeker als deze tot vermijding leidt, kan verwijzing naar een psycholoog zinvol zijn.
Bij een toegenomen mobiliteit zullen mensen met de ziekte van Parkinson mogelijk meer bewegen en is de verwachting dat het aantal valincidenten toeneemt. Echter, dit is niet aangetoond in de wetenschappelijke literatuur. Dit impliceert dat er ten aanzien van veiligheid geen bezwaar lijkt om interventieprogramma’s gericht op reductie van het valrisico aan te bieden aan mensen met de ziekte van Parkinson.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Vallen, het valrisico of de mate waarin dit als probleem wordt ervaren, worden door de persoon zelf soms anders ervaren dan door de omgeving of behandelaren. Educatie op het gebied van vallen en valrisico is van groot belang. De mate waarin het door de patiënt zelf als probleem wordt ervaren, is namelijk bepalend voor de motivatie en daarmee voor de effectiviteit van interventies. De doelen voor de persoon zelf liggen veelal meer op beter functioneren in activiteiten of beter kunnen bewegen. De trainingsinterventies die in de studies gebruikt zijn, passen goed bij het doel van beter bewegen. De diversiteit aan trainingsvormen biedt keuzemogelijkheid voor de patiënt.
Haalbaarheid en implementatie
Er lijken geen barrières te zijn voor dergelijke trainingsinterventies bij patiënten met de ziekte van Parkinson. Het lijkt wenselijk om enerzijds een interventie te bieden passend bij het doel van meer bewegen en anderzijds te richten op het beweeggedrag van de patiënt in de context van het dagelijks leven en daarbij mogelijke obstakels of bedreigingen te identificeren die het risico op vallen vergroten. Vanwege het verhoogde valrisico bij mensen met de ziekte van Parkinson in het algemeen en het risico op inactiviteit vanuit angst om te bewegen, is inventarisatie van het valrisico altijd van groot belang. Een in Parkinson gespecialiseerde fysio-, oefen- of ergotherapeut kan een goede inschatting maken van risico’s en gevolgen. Ook voorlichting over het valrisico is van groot belang; mensen onderschatten dat nog wel eens. Ook kan overwogen worden om patiënten die vallen naar de klinisch geriater te verwijzen voor valanalyse, met name om andere bijkomende oorzaken voor het vallen op te sporen en/of uit te sluiten.
Patiënten met de ziekte van Parkinson verblijven, in vergelijking met patiënten zonder Parkinson, na een heupfractuur veelal langer in het ziekenhuis, hebben gedurende langere tijd postoperatieve revalidatie nodig, verloopt deze minder succesvol en is hun ontslagbestemming vaker het verpleeghuis (Jonsson, 2005). Deze cijfers benadrukken dat inventarisatie en adequate behandeling van vallen en valangst cruciaal is.
Aangezien fysio-, oefen- of ergotherapeuten met expertise op het gebied van de ziekte van Parkinson beschikbaar zijn, juist ook in de omgeving van de patiënt, zijn er in dat opzicht geen problemen te voorzien in haalbaarheid en implementatie.
Onderbouwing
Achtergrond
Afhankelijk van het ziektestadium valt twee derde van de patiënten met de ziekte van Parkinson een of meer keren per jaar. Het risico om te vallen is het hoogst in de matig ernstige ziektestadia (Hoehn en Yahr-stadium 3 en 4), als de balans en het lopen verstoord zijn maar patiënten nog wel voldoende mobiel zijn om daadwerkelijk ‘at risk‘ te zijn om te vallen. De lichamelijke, sociale en emotionele impact van een val is groot. De afgelopen jaren zijn er meerdere studies verschenen naar het effect van therapeutische interventies die het vallen kunnen verminderen. Het is daarom de moeite waard om deze evidenties te beoordelen met als doel tot aanbevelingen te komen die het valrisico bij patiënten met de ziekte van Parkinson verminderen.
Herkenning valrisico:
|
Er zijn veel factoren die zijn geassocieerd met een verhoogd valrisico bij mensen met de ziekte van Parkinson (Fasano, 2017). Belangrijke parkinsonspecifieke risicofactoren zijn een eerdere (bijna) val in het afgelopen jaar, freezing, valangst, balansproblemen, het uitvoeren van dubbeltaken, on/off fluctuaties, een lagere loopsnelheid en belemmeringen in het uitvoeren van activiteiten. Ook orthostatische hypotensie is een risicofactor. Daarnaast kunnen leeftijdgebonden generieke valrisicofactoren een rol spelen. Het Valpredictiemodel geeft, aan de hand van gegevens over (bijna) vallen, freezing en comfortabele loopsnelheid, een inschatting van het risico dat de patiënt een val doormaakt binnen zes maanden na het afnemen van de test. (KNGF-richtlijn ziekte van Parkinson 2017). Naast het in kaart brengen van de parkinsonspecifieke factoren, is het ook van belang om aandacht te hebben voor de context waarin de patiënt beweegt, en de interactie te analyseren tussen functionele mobiliteit, risicovol gedrag en de kenmerken van de activiteit en de omgeving van de patiënt (Ergotherapie richtlijn valpreventie 2016). . Herhaaldelijk vallen vroeg in het beloop van de ziekte vraagt om alertheid aangezien dit kan wijzen op een andere diagnose dan de ziekte van Parkinson (bijvoorbeeld PSP of multisysteematrofie (MSA) (Kwaliteitsstandaard atypische parkinsonismen, 2019). Voor meer informatie over preventie van valincidenten bij ouderen kan ook de multidisciplinaire richtlijn valpreventie worden geraadpleegd. |
Conclusies / Summary of Findings
Valfrequentie
|
Zeer Laag GRADE |
Het is onduidelijk wat het effect is van functie-, strategie of vaardigheidstraining op de valfrequentie bij patiënten met de ziekte van Parkinson
Bronnen: (Ashburn, 2007; Goodwin, 2009; Marjama-Lyons, 2002; Meek, 2010; Morris, 2017; Morris, 2015; Nieuwboer, 2007; Paul, 2014; Protas, 2005; Purchas, 2007; Song, 2018) |
Valangst
|
Laag GRADE
|
Alleen functietraining lijkt de valangst niet te reduceren bij patiënten met de ziekte van Parkinson.1
Alleen strategietraining lijkt de valangst niet te reduceren bij patiënten met de ziekte van Parkinson.2
Een gecombineerde functie- en strategietraining lijkt de valangst te reduceren bij patiënten met de ziekte van Parkinson.3
Een gecombineerde functie- en vaardigheidstraining lijkt de valangst niet te reduceren bij patiënten met de ziekte van Parkinson.4
Bronnen:1 (Allen, 2010; Cakit, 2007; Goodwin, 2009; Goodwin, 2011; Liao, 2015; Santos, 2017; Song, 2018; Sparrow, 2016) Bronnen:2 (Nieuwboer, 2007) Bronnen:3 (Canning, 2015) Bronnen:4 (Conradsson, 2015) |
Samenvatting literatuur
Beschrijving studies
De Cochrane review van Tomlinson (2013) is als basis gebruikt voor de uitwerking van de literatuur. Tomlinson (2013) includeert primair vergelijkend, gerandomiseerd onderzoek naar fysiotherapeutische interventies bij patiënten met de ziekte van Parkinson. Een belangrijk inclusiecriterium was dat de interventie werd vergeleken met een controle interventie. Hierdoor is het mogelijk om de effecten van verschillende type interventies, in vergelijking met een controle-interventie, indirect met elkaar te vergelijken in een overkoepelende meta-analyse. De controle-interventie is een placebo-interventie of reguliere standaardbehandeling waarin per definitie geen fysiotherapie is gegeven. Tomlinson (2013) beschrijft studies waarin patiënten met de ziekte van Parkinson zijn geïncludeerd, ongeacht leeftijd, ziekteduur, medicatiegebruik en verleden met fysiotherapeutische interventies. De fysiotherapeutische interventies hebben generiek als doel het functionele vermogen te verbeteren en secundaire complicaties te beperken door middel van oefentherapie en educatie. Fysiotherapie omvat een breed scala aan technieken; de interventies die in de review zijn geïncludeerd zijn als volgt ingedeeld: algemene fysiotherapie, training, loopbandtraining, cueing-interventies, danstherapie en Tai Chi training. Studies in Tomlinson (2013) die de voor de werkgroep relevante uitkomstmaten meenamen (respectievelijk vallen en valangst) worden meegenomen in deze literatuuranalyse. De systematische literatuur analyse van Tomlinson (2013) dekt de literatuur tot en met januari 2012. De huidige literatuuranalyse is aangevuld met studies die zijn gepubliceerd na januari 2012. In totaal zijn 19 studies opgenomen in de literatuursamenvatting. De belangrijkste studiekarakteristieken zijn gepresenteerd in Tabel 1. De indeling in modaliteiten is gebaseerd op de KNGF-richtlijn ziekte van Parkinson (2017); deze beschrijft vier behandelmodaliteiten: educatie, functietraining, vaardigheidstraining en strategietraining. Elke modaliteit kent verschillende interventietypen. De typen die zijn beschreven in deze literatuuranalyse zijn: conventionele fysiotherapie (functietraining); cueing (strategietraining); dubbeltaaktraining (vaardigheidstraining); loopbandtraining (functietraining); strategieën voor complexe bewegingen (strategietraining) en Tai Chi (functietraining).
Tabel 1 Studiekarakteristieken van de geïncludeerde studies.
|
Studie |
N* |
Interventie |
Controle |
Modaliteit* |
Uitkomst |
|
Allen, 2010 |
I: 24 C: 24 |
Krachttraining onderste extremiteit en balanstraining Sessie: 40-60 min Totaal: 48-72 uur Periode: 6 maanden |
Reguliere zorg met educatie over valpreventie |
Functietraining (conventionele FT) |
- Falls Efficacy Scale |
|
Ashburn, 2007 |
I: 70 C: 72 |
Gepersonaliseerd home-based trainings- en strategieprogramma Sessie: 60 min Totaal: 42 uur Periode: 6 weken |
Reguliere zorg en contact met de parkinsonverpleegkundigen. |
Functietraining (conventionele FT) + strategietraining
|
- Frequentie vallen
|
|
Cakit, 2007 |
I: 27 C: 27 |
Loopbandtraining middels een gestandaardiseerd, snelheidsafhankelijk protocol. Sessie: 30 min Totaal: 4 uur Periode: 8 weken |
Reguliere zorg, geen interventie |
Functietraining (loopbandtraining) |
- Falls Efficacy Scale
|
|
Canning, 2015 |
I: 115 C: 116 |
Balansoefeningen en krachtoefeningen voor de onderbenen in combinatie met cueingstrategieën Sessie: 40-60 minuten Totaal: 3x per week, 48 -72 uur Periode: 6 maanden |
Reguliere zorg en een boekje over standaard valpreventie-adviezen. |
Functietraining (conventionele FT) + strategietraining |
- Frequentie vallen - Falls Efficacy Scale |
|
Conradsson, 2015 |
I: 51 C: 49 |
Groepstraining gericht op balans en dubbeltaakoefeningen tijdens wandelen Sessie: 60 minuten Totaal: 30 uur (3x per week) Periode: 10 weken |
Reguliere zorg en geïnstrueerd om door te gaan met het uitvoeren van huidige activiteiten/oefeningen. |
Functietraining (conventionele FT) + vaardigheidstraining
|
- Falls Efficacy Scale |
|
Gao, 2014 |
I: 40 C: 40 |
Tai Chi Sessie: 60 minuten, 3x per week Totaal: 36 uur Periode: 12 weken |
Reguliere zorg |
Functietraining (tai chi) |
- Frequentie vallen |
|
Goodwin, 2009 |
I: 64 C: 66 |
Groepstraining gericht op kracht en balans Sessie: 60 min Totaal: 10 uur Periode: 10 weken |
Reguliere zorg met educatie over valpreventie |
Functietraining (conventionele FT) |
- Frequentie vallen - Falls Efficacy Scale
|
|
Goodwin, 2011 |
I: 64 C: 66 |
Groepstraining gericht op balans en kracht met ruimte voor persoonlijke oefeningen voor thuis Sessie: 60 minuten Totaal: 10 uur Periode: 10 weken |
Reguliere zorg, geen interventie |
Functietraining (conventionele FT) |
- Frequentie vallen - Falls Efficacy Scale
|
|
Liao, 2015 |
I: 12 C: 12 |
Trainingsprogramma gericht op rekken, kracht en balans aangevuld met loopbandtraining. Sessie: 60 minuten Totaal: 12 uur Periode: 6 weken |
Valpreventie-educatie en geïnstrueerd om door te gaan met huidige activiteiten |
Functietraining (conventionele FT + loopbandtraining) |
- Falls Efficacy Scale
|
|
Marjama-Lyons, 2002 |
I: 30 C: 30 |
Tai chi Sessie: 60 min Totaal: 24 uur Periode: 12 weken |
Placebo-oefeningen |
Functietraining (tai Chi) |
- Frequentie vallen
|
|
Meek, 2010 |
I: 20 C: 19 |
Gepersonaliseerd fitness programma gericht op kracht en conditie Sessie: 60 min Totaal: 12 uur Periode: 12 weken |
Reguliere zorg met educatie. |
Functietraining (conventionele FT) |
- Frequentie vallen
|
|
Morris, 2017 |
I: 67 C: 66 |
Individueel oefenprogramma (thuis) gericht op kracht en beweging aangevuld met valpreventie-educatie Sessie: 60 minuten Totaal: 12 uur, waarvan 6 uur begeleid Periode: 6 weken |
Placebo-interventie: leefstijlvaardigheden programma (6x60 minuten) met focus op ontspanning, spraak, slikken, communicatie, reizen, voeding, reisadvies en geheugentraining |
Functietraining (conventionele FT) |
- Frequentie vallen |
|
Morris, 2015 |
I1: 70 I2: 69 C: 71 |
Groepstraining gericht op kracht (I1) en beweging (I2) Sessie: 2 uur Totaal: 16 uur Periode: 8 weken |
Leefstijlpgrogramma (12u): sociale activiteiten, praktisch advies en informatiesessies/groepsdiscussies niet gerelateerd aan vallen/beweging. |
Functietraining (conventionele FT) |
- Frequentie vallen |
|
Nieuwboer, 2007 |
I: 76 C: 77 |
Cueing interventie aan huis (auditieve, visuele en somatosensorische cues) Sessie: 30 min Totaal: 4,5 uur Periode: 3 weken |
Reguliere zorg, geen interventie |
Strategietraining (cueing) |
- Frequentie vallen - Falls Efficacy Scale
|
|
Paul, 2014 |
I: 20 C: 20 |
Spierkrachttraining in een groep gericht op de beenextensoren, knie- en heupflexorenen heupabductoren Sessie: 45 minuten Totaal: 18 uur Periode: 12 weken |
Placebo-interventie: lage intenstiteitsoefeningen (voorgeschreven op een intensiteit waar geen trainingseffect van werd verwacht) van de vier spiergroepen, thuis uitgevoerd (aangeleerd door een fysiotherapeut). |
Functietraining (conventionele FT) |
- Frequentie vallen
|
|
Protas, 2005 |
I: 9 C: 9 |
Loopbandtraining Sessie: 60 min Totaal: 24 uur Periode: 8 weken |
Reguliere zorg, geen interventie |
Functietraining (loopbandtraining) |
- Frequentie vallen
|
|
Purchas, 2007 |
I: 10 C: 10 |
Tai chi Sessie: 60 min Totaal: 12 uur Periode: 12 weken |
Reguliere zorg, geen interventie |
Functietraining (tai Chi) |
- Frequentie vallen
|
|
Santos, 2017 |
I: 11 C: 11 |
Koorddansen gericht op balans en reguliere training gericht op fysieke activiteit Sessie: 23 minuten Totaal: 16,5 uur Periode: 6 weken |
Reguliere training gericht op fysieke activiteit |
Functietraining (conventionele FT) |
- Falls Efficacy Test |
|
Song, 2018 |
I: 31 C: 29 |
Individueel oefenprogramma gebaseerd op een dans/stapspel (lichtgevende blokjes op de grond geven volgende stap aan), aangeleerd door een fysiotherapeut en verder zelfstandig uitgevoerd Sessie: 15 minuten Totaal: 9 uur Periode: 12 weken |
Reguliere zorg, geen interventie |
Functietraining (conventionele FT) |
- Frequentie vallen - Falls Efficacy Scale |
*Het aantal deelnemers per groep is gebaseerd op de aantallen bij start van de studie. Indien geen intention to treat analyse werd gedaan, kunnen lagere aantallen voorkomen in de beschrijving van de resultaten.
Resultaten
Valfrequentie
In 14 RCT’s is de frequentie van vallen gemeten (Ashburn, 2007; Canning, 2015; Gao, 2014; Goodwin, 2009; Goodwin, 2011; Marjama-Lyons, 2002; Meek, 2010; Morris, 2017; Morris, 2015; Nieuwboer, 2007; Paul, 2014; Protas, 2005; Purchas, 2007; Song, 2018). Vallen werd bijgehouden met behulp van een meetdagboekje. Deze manier van meten kan verschillende vormen van bias introduceren (zoals recall bias of social desirability bias). Over het algemeen werd een trend gevonden voor een afname van het aantal vallen in de interventiegroep. Echter, in 11 RCT’s was deze trend niet significant in vergelijking met de controle-interventie (Ashburn, 2007; Canning, 2015; Goodwin, 2009; Goodwin, 2011; Meek, 2010; Morris, 2017; Nieuwboer, 2007; Paul, 2014; Protas, 2005; Purchas, 2007; Song, 2018). Twee RCT’s lieten zien dat functietraining resulteert in een significante afname van het aantal vallen (Gao, 2014; Morris, 2015). Marjama-Lyons (2002) rapporteerde een significante afname van de valfrequentie in de interventiegroep die tai Chi kreeg aangeboden.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘frequentie van vallen’ begint op hoog omdat de resultaten afkomstig zijn uit gerandomiseerd onderzoek. De bewijskracht is vervolgens met twee niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (risk of bias: geen blindering van de groepen en mogelijke recall bias bij de patiënten) en met één niveau verlaagd vanwege tegenstrijdige bevindingen (imprecisie). De bewijskracht van de literatuur voor de uitkomstmaat frequentie van vallen is zeer laag.
Valangst
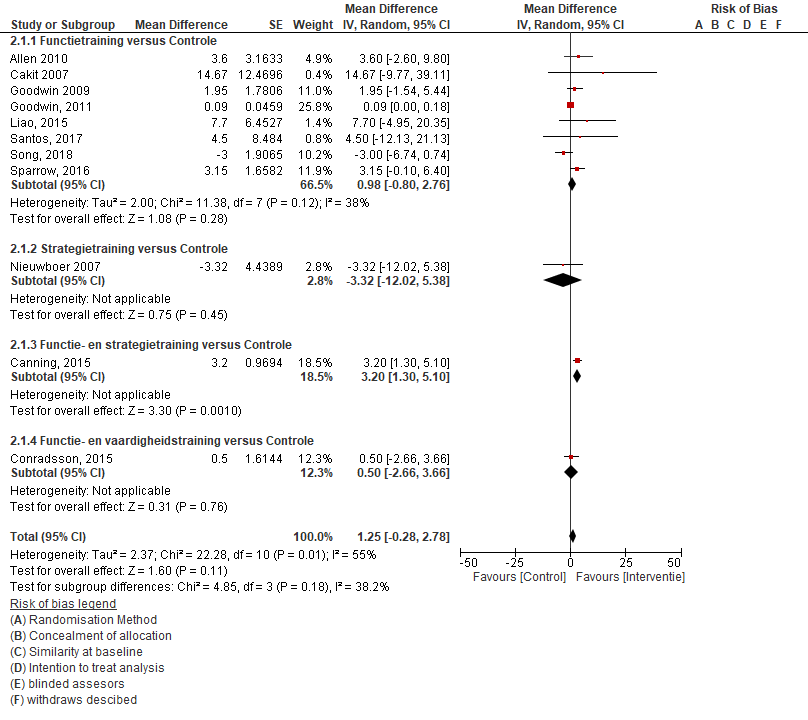
In de literatuur zijn 11 studies gevonden die het effect op valangst van verschillende typen interventies (functietraining, strategietraining, functie- en strategietraining en functie- en vaardigheidstraining) in vergelijking met een controle interventie onderzochten. Valangst is gemeten met de Falls Efficacy Scale (FES). Het effect van een functietraining op valangst is onderzocht in acht RCT’s (Allen, 2010; Cakit, 2007; Goodwin, 2009; Goodwin, 2011; Liao, 2015; Santos, 2017; Song, 2018; Sparrow, 2016). Het gemiddelde verschil in afname op de FES-score tussen de interventie- en controlegroep was 0,98 punten (95%BI -0,80 tot 2,76; p=0,28), geen statistisch significant verschil tussen beide groepen. Het effect van een strategietraining op valangst is in één studie onderzocht (Nieuwboer, 2007). Het gemiddelde verschil in afname op de FES-score tussen de interventie- en controlegroep was -3,32 punten (95%BI -12,02 tot 5,38; p=0,45), geen statistisch significant verschil tussen beide groepen. Het effect van een functie- en strategietraining op valangst is onderzocht in één studie (Canning, 2015). Het gemiddelde verschil in afname op de FES-score tussen de interventie- en controlegroep was 3,20 punten (95%BI 1,30 tot 5,10; p=0,001), statistisch significant in het voordeel van de functie- en strategietrainingsgroep. Het effect van een functie- en vaardigheidstraining op valangst is onderzocht in één studie (Conradsson, 2015). Het gemiddelde verschil in afname op de FES-score tussen de interventie- en controlegroep was 0,50 punten (95%BI 1,30 tot 5,10; p= 0,001), geen statistisch significant verschil tussen beide groepen. Pooling van de data laat geen overall interventie effect zien op de FES-score (Mean difference (MD)= 1,25 punten (95% BI -0,28 tot 2,78; p=0,11) (zie figuur 1).
Figuur 1 Systematische review met meta-analyse voor het effect van verschillende type interventies versus controle op de uitkomstmaat valangst gemeten met de Falls Efficacy Scale (FES).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat valangst is afkomstig uit gerandomiseerde studies en startte zodoende op hoog. De bewijskracht is vervolgens met één niveau verlaagd gezien beperkingen in onderzoeksopzet (risk of bias: geen blindering van de groepen) en met één niveau verlaagd omdat het betrouwbaarheidsinterval rondom het gepoolde effect zowel het nul effect als de grenzen voor klinische relevantie overschrijdt (imprecisie). De bewijskracht van de literatuur is laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn effectieve niet-medicamenteuze interventies om het risico op vallen te verminderen bij patiënten met de ziekte van Parkinson?
P: patiënten met de ziekte van Parkinson die vallen;
I: fysiotherapie, ergotherapie, revalidatie, houding- en beweegtherapie, niet-medicamenteus, Tai Chi, danstherapie;
C: reguliere zorg, controle interventie;
O: aantal vallen, valangst.
Relevante uitkomstmaten
De werkgroep achtte frequente van vallen en valangst gemeten op een gevalideerde schaal (zoals de Falls Efficacy Scale of de ABC schaal) voor de besluitvorming cruciale uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 17 september 2018 met relevante zoektermen gezocht naar studies die interventies beschrijven voor vallen bij patiënten met de ziekte van Parkinson. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 963 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: Studiedesign RCT’s of ander primair vergelijkend onderzoek, gepubliceerd na 2009, beschrijving van minimaal één van bovengenoemde uitkomstmaten, beschreven in het Engels of in het Nederlands. Op basis van titel en abstract werden onafhankelijk, door twee beoordelaars in eerste instantie 61 studies geselecteerd voor full-tekst selectie. Na raadpleging van de volledige tekst, werden vervolgens 50 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 11 studies definitief geselecteerd. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
In totaal zijn 11 publicaties opgenomen in de literatuuranalyse. Studies uit de Cochrane review van Tomlinson (2013) die voldoen aan de PICO-criteria zijn gebruikt als basis voor de uitwerking van de literatuur (n=9). De studie van Goodwin (2011) is gepubliceerd binnen de inclusieperiode van Tomlinson (2013) maar om onbekende reden niet opgenomen in de review, deze studie zal wel worden toegevoegd aan de literatuursamenvatting omdat Goodwin (2011) voldoet aan alle inclusiecriteria. De volgende negen studies uit Tomlinson (2013) zijn geïncludeerd: Allen, 2010; Ashburn, 2007; Cakit, 2007; Goodwin, 2009; Marjama-Lyons, 2002; Meek, 2010; Nieuwboer, 2007; Protas, 2005; Purchas, 2007. Tomlinson (2013) is verder aangevuld met negen recente publicaties (Canning, 2015; Conradsson, 2015; Gao, 2014; Liao, 2015; Morris, 2017; Morris, 2015; Paul, 2014; Santos, 2017; Song, 2018).
Referenties
- Amano S, Nocera JR, Vallabhajosula S, Juncos JL, Gregor RJ, Waddell DE, Wolf SL, Hass CJ. The effect of Tai Chi exercise on gait initiation and gait performance in persons with Parkinson's disease. Parkinsonism Relat Disord. 2013 Nov;19(11):955-60. doi: 10.1016/j.parkreldis.2013.06.007. Epub 2013 Jul 5. PubMed PMID: 23835431; PubMed Central PMCID: PMC3825828.
- Canning CG, Sherrington C, Lord SR, Close JC, Heritier S, Heller GZ, Howard K, Allen NE, Latt MD, Murray SM, O'Rourke SD, Paul SS, Song J, Fung VS. Exercise for falls prevention in Parkinson disease: a randomized controlled trial. Neurology. 2015 Jan 20;84(3):304-12. doi: 10.1212/WNL.0000000000001155. Epub 2014 Dec 31. PubMed PMID: 25552576; PubMed Central PMCID: PMC4335992.
- Conradsson D, Löfgren N, Nero H, Hagströmer M, Ståhle A, Lökk J, Franzén E. The Effects of Highly Challenging Balance Training in Elderly With Parkinson's Disease: A Randomized Controlled Trial. Neurorehabil Neural Repair. 2015 Oct;29(9):827-36. doi: 10.1177/1545968314567150. Epub 2015 Jan 21. PubMed PMID: 25608520; PubMed Central PMCID: PMC4582836.
- Fasano A, Canning CG, Hausdorff JM, Lord S, Rochester L. Falls in Parkinson's disease: A complex and evolving picture. Mov Disord. 2017 Nov;32(11):1524-1536. doi: 10.1002/mds.27195. Epub 2017 Oct 25. Review. PubMed PMID: 29067726.
- Goodwin VA, Richards SH, Henley W, Ewings P, Taylor AH, Campbell JL. An exercise intervention to prevent falls in people with Parkinson's disease: a pragmatic randomised controlled trial. J Neurol Neurosurg Psychiatry. 2011 Nov;82(11):1232-8. doi: 10.1136/jnnp-2011-300919. Epub 2011 Aug 19. PubMed PMID: 21856692.
- Jonsson PV, Lipsitz LA, Kelley M, Koestner J. Hypotensive responses to common daily activities in institutionalized elderly. A potential risk for recurrent falls. Arch Intern Med. 1990 Jul;150(7):1518-24. PubMed PMID: 2114834.
- Liao YY, Yang YR, Cheng SJ, Wu YR, Fuh JL, Wang RY. Virtual Reality-Based Training to Improve Obstacle-Crossing Performance and Dynamic Balance in Patients With Parkinson's Disease. Neurorehabil Neural Repair. 2015 Aug;29(7):658-67. doi: 10.1177/1545968314562111. Epub 2014 Dec 24. PubMed PMID: 25539782.
- Morris ME, Taylor NF, Watts JJ, Evans A, Horne M, Kempster P, Danoudis M, McGinley J, Martin C, Menz HB. A home program of strength training, movement strategy training and education did not prevent falls in people with Parkinson's disease: a randomised trial. J Physiother. 2017 Apr;63(2):94-100. doi: 10.1016/j.jphys.2017.02.015. Epub 2017 Mar 14. PubMed PMID: 28342682.
- Paul SS, Canning CG, Song J, Fung VS, Sherrington C. Leg muscle power is enhanced by training in people with Parkinson's disease: a randomized controlled trial. Clin Rehabil. 2014 Mar;28(3):275-88. doi: 10.1177/0269215513507462. Epub 2013 Nov 4. PubMed PMID: 24188914.
- Santos L, Fernandez-Rio J, Winge K, Barragán-Pérez B, Rodríguez-Pérez V, González-Díez V, Blanco-Traba M, Suman OE, Philip Gabel C, Rodríguez-Gómez J. Effects of supervised slackline training on postural instability, freezing of gait, and falls efficacy in people with Parkinson's disease. Disabil Rehabil.2017 Aug;39(16):1573-1580. doi: 10.1080/09638288.2016.1207104. Epub 2016 Jul 14. PubMed PMID: 27416005.Sparrow D, DeAngelis TR, Hendron K, Thomas CA, Saint-Hilaire M, Ellis T. Highly Challenging Balance Program Reduces Fall Rate in Parkinson Disease. J Neurol Phys Ther. 2016 Jan;40(1):24-30. doi: 10.1097/NPT.0000000000000111. PubMed PMID: 26655100; PubMed Central PMCID: PMC4681297.
- Tomlinson CL, Herd CP, Clarke CE, Meek C, Patel S, Stowe R, et al. Physiotherapy for parkinson's disease: A comparison of techniques. Cochrane Database of Systematic Reviews. 2014(6):1-119.
- van der Marck MA, Klok MP, Okun MS, Giladi N, Munneke M, Bloem BR; NPF Falls Task Force. Consensus-based clinical practice recommendations for the examination and management of falls in patients with Parkinson's disease. Parkinsonism Relat Disord. 2014 Apr;20(4):360-9. doi: 10.1016/j.parkreldis.2013.10.030. Epub 2013 Dec 30. PubMed PMID: 24484618.
- Wielinski CL, Erickson-Davis C, Wichmann R, Walde-Douglas M, Parashos SA. Falls and injuries resulting from falls among patients with Parkinson’s disease and other parkinsonian syndromes. Mov Disord. 2005 Apr;20(4):410-5. PubMed PMID: 15580552.
- Richtlijn Ergotherapie bij Parkinson (2008). Sturkenboom IHWM, Thijssen MCE, Gons-van de Elsacker JJ, Jansen IJH, Maasdam, A, Schulten M, Vijver-Visser D, Steultjens EJM, Bloem BR, Munneke M. Ergotherapie bij de ziekte van Parkinson, een richtlijn van Ergotherapie Nederland, Utrecht/Den Haag: Ergotherapie Nederland/Uitgeverij Lemma, 2008.
- Praktijkrichtlijn KNGF – Richtlijn ziekte van P arkinson (2017).
- Richtlijn Preventie van valincidenten bij ouderen (NVKG, 2017)
- Ergotherapierichtlijn Valpreventie (2016). Sturkenboom IHWM, Steultjens EMJ (2016) Ergotherapierichtlijn Valpreventie: evidence-based ergotherapie bij volwassenen met verhoogd valrisico. Nijmegen/Utrecht. Hogeschool van Arnhem en Nijmegen/Ergotherapie Nederland.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 14-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk vijf jaar na de autorisatiedatum besluit het bestuur van de NVN om de richtlijn te updaten. In principe zullen de modules jaarlijks beoordeeld worden of deze nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVN is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Naast de ontwikkelde modules, is een aantal onderwerpen niet uitgewerkt in de huidige richtlijn. De werkgroep adviseert om deze op korte termijn alsnog te ontwikkelen omdat hier in de praktijk vraag naar is, te weten:
- urogenitale stoornissen;
- seksuele gezondheid;
- interacties tussen medicijnen ;
- visusstoornissen;
- orthostatische hypotensie;
- mond- en keelklachten;
- obstipatie.
Tabel 1 Geldigheid en onderhoud richtlijnmodules
|
Module |
Regiehou-der(s) |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Diagnostiek |
NVN |
NVN |
Nieuwe inzichten, veranderingen in zorg |
|
Medicamenteuze behandeling de Novo patiënt |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Medicamenteuze behandeling van motorische klachten en responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Geavanceerde therapieën voor responsfluctuaties bij de ziekte van Parkinson |
NVN |
NVN, NVvN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling houdingsproblematiek bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Behandeling valrisico bij de ziekte van Parkinson |
VRA |
VRA, NVN, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Impulscontrolestoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Dopamine dysregulatie-stoornis bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Angststoornissen bij de ziekte van Parkinson |
NVN |
NVvP, NVN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Apathie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Depressie bij de ziekte van Parkinson |
NVN |
NVN, NVvP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Wanen en hallucinaties bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVKG |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Cognitieve stoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vermoeidheid bij de ziekte van Parkinson |
NVN |
NVN, NIP, NVKG |
Nieuwe inzichten o.b.v. RCT’s , veranderingen in zorg |
|
Slaapstoornissen bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Pijnklachten bij de ziekte van Parkinson |
NVN |
NVN, NVKG, NIP |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Coping met de ziekte van Parkinson |
NVN |
NVN, V&VN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Werk en arbeidsongeschiktheid |
NVN |
NVAB |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Rijgeschiktheid |
NVN, VRA |
NVN, VRA |
Nieuwe inzichten o.b.v. RCT’s of wet- of regelgeving |
|
Mantelzorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medicinale cannabis bij de ziekte van Parkinson |
NVN |
NVN, NVvP, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Mucuna Pruriens bij de ziekte van Parkinson |
NVN |
NVN, NVZA, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Vitamine B12 of D-suppletie bij de ziekte van Parkinson |
NVN |
NVN, NVD |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Multidisciplinaire revalidatieprogramma’s bij de ziekte van Parkinson |
VRA |
VRA, KNGF, EN |
Nieuwe inzichten o.b.v. RCT’s, veranderingen in zorg |
|
Palliatieve zorg |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Advance care planning |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
Medische symptoombehandeling in de stervensfase |
NVN |
NVN, V&VN |
Veranderingen in zorg |
|
eHealth bij de ziekte van Parkinson |
NVN |
NVN |
Veranderingen in zorg |
|
Netwerkzorg, casemanagement en verwijscriteria |
NVN, VRA |
NVN, ParkinsonNet |
Veranderingen in zorg |
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlands Huisartsen Genootschap (NHG)
- Parkinson Vereniging (PV)
- Vereniging van Specialisten Ouderengeneeskunde (Verenso)
- Verpleegkundigen & Verzorgenden Nederland (V&VN)
- Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF)
- Ergotherapie Nederland (EN)
- Nederlands Instituut van Psychologen (NIP)
- Nederlandse Vereniging van Diëtisten (NVD)
- ParkinsonNet, beroepsvereniging van professionals in sociaal werk (BPSW)
- Nederlandse Vereniging voor Logopedie en Foniatrie (NVLF)
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde (NVAB)
- Nederlandse Wetenschappelijke Vereniging voor Seksuologie (NVvS)
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie (KNMP)
- Vereniging van Oefentherapeuten Cesar en Mensendieck (VvOCM)
- Nederlandse Associatie Physician Assistants (NAPA)
- ParkinsonNet
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om een richtlijn te verkrijgen waarin de meeste recente (para)medische kennis omtrent de zorg voor patiënten met ziekte van Parkinson wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met de ziekte van Parkinson te maken hebben.
Werkgroep
- Prof. dr. T. (Teus) van Laar (voorzitter), neuroloog, NVN
- Dr. A.J.W. (Agnita) Boon, neuroloog, NVN
- Dr. J.I. (Jorrit) Hoff, neuroloog, NVN
- Dr. M.L. (Mark) Kuijf, neuroloog, NVN
- Dr. A.G. (Alexander) Munts, neuroloog, NVN
- Dr. B. (Bart) Post, neuroloog, NVN
- Dr. G. (Gerrit) Tissingh, neuroloog, NVN (tot ..)
- Dr. F.J. (Erik) Slim, vicevoorzitter, revalidatiearts, VRA
- Drs. W.J. (Willem) Oudegeest, , revalidatiearts, VRA
- Drs. S.P. (Susan) Meuleman, revalidatiearts, VRA
- Prof. dr. O.A. (Odile) van den Heuvel, psychiater, NVvP
- Prof. dr. A.F.G. (Albert) Leentjens, psychiater, NVvP
- Dr. G. (Bert) Ziere, klinisch geriater, NVKG
- Drs. H.J. (Hannie) Scheper, specialist Ouderengeneeskunde, Verenso
- Dr. A.L. (Abram) Rutgers, huisarts, NHG
- Dr. A.A. (Annelien) Duits, klinisch neuropsycholoog, NIP
- H.H. (Herma) Lennaerts – Kats MSc, Parkinsonverpleegkundige, V&VN, ParkinsonNet
- T. (Tiny) van Wieren-Beerda MSc, verpleegkundig specialist parkinson, V&VN
- Drs. M.M. (Masja) van het Hoofd, beleidsmedewerker, Parkinson Vereniging
- Drs. K.C. (Kaie) Klaassen, patiënt-onderzoeker, Parkinson Vereniging
- Drs. M. (Marianne) Luinstra, ziekenhuisapotheker, NVZA
- Dr. M. (Marlies) van Nimwegen, fysiotherapeut (niet praktiserend), KNGF, ParkinsonNet
- Dr. I.H.W.M. (Ingrid) Sturkenboom, ergotherapeut, EN, ParkinsonNet
- K. (Karin) Overbeek-Dekker, diëtist, NVD, ParkinsonNet
- Dr. M. (Marten) Munneke, ParkinsonNet
Klankbordgroep
- Dr. J.G. (Hanneke) Kalf, logopedist, NVLF, ParkinsonNet
- K. (Klaas) Kooistra MSc, apotheker, KNMP
- P.R.I. (Paul) Rabsztyn, verpleegkundig seksuoloog SH (seksuologische hulpverlening) &VPO (voorlichting preventie en onderwijs), NVvS
- Dr. F.J.A. (Anton) Meijer, Neuro- en hoofd-hals radioloog, NVvR
- Prof. Dr. Y. (Yasin) Temel, neurochirurg, NVvN
- Drs. J.P. (Jacqueline) Janssen, Bedrijfsarts, klinisch arbeidsgeneeskundige, NVAB
- M. (Marlinda) Bakker, Geriatrisch maatschappelijk werker, BPSW
- Drs. A.L.A.J. (Danny) Hommel, specialist ouderengeneeskunde, Verenso
- Drs. H. (Hajo) Jongepier, huisarts, NHG
Met ondersteuning van
- Dr. W.J. (Wouter) Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. ir. N.L. (Nikita) van der Zwaluw, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. L. (Linda) Niesink-Boerboom, literatuurspecialist, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- D.P. (Diana) Guiterrez, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
- S. (Sonja) Wouters, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door twee afgevaardigden van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Parkinson Vereniging.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door stakeholderpartijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn ziekte van Parkinson (NVN, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens de invitational conference. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013). De zekerheid van het bewijs wordt beïnvloed door beperkingen in studieopzet- of uitvoering (risk of bias), imprecisie, inconsistentie, indirectheid en publicatiebias.
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De formulering van de conclusies hangt af van de bewijskracht. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Netwerkzorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten in de bijlagen).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënten) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
