Verlaging valrisico bij thuiswonende ouderen
Uitgangsvraag
Welke valrisico verlagende interventies zijn effectief bij thuiswonenden?
Aanbeveling
Verricht een multifactoriële interventie bij thuiswonende vallers gericht op geidentificeerde valrisicofactoren. Gezien de sterke bewijskracht ten aanzien van bewegingsinterventies dient een multifactoriële val preventieve interventie ten minste één beweegcomponent te bevatten.
Beperken tot een enkelvoudige interventie kan overwogen worden bij eenmalige vallers zonder bijkomende factoren die zich niet met een acute val presenteren. Indien gekozen wordt voor een enkelvoudige interventie, dient dit een beweeginterventie te zijn, tenzij een specifieke andere valrisicofactor is vastgesteld.
Vraag uitdrukkelijk na wat de wensen zijn van de patiënt zijn en bespreek de mogelijkheden. Beslis samen met de patiënt wat de meest geschikte interventie is in zijn/haar situatie. Dit verhoogt de therapietrouw.
Verwerk in de multifactoriële interventie voor thuiswonende vallers de positief gescoorde valrisicofactoren en overweeg minimaal de volgende items:
|
Categorie |
Interventie |
|
Beweging |
Kies voor de interventie betreffende beweeginterventies een op (fysio- of oefentherapeutische) assessment gebaseerde vorm, bij voorkeur één met meerdere categorieën (individueel dan wel in groepsverband). Tai Chi kan overwogen worden. |
|
Cardiovasculaire aandoeningen (incl. orthostatische hypotensie) |
Overweeg orthostase adviezen (zie ook de module ‘Valpreventie bij orthostatische hypotensie’) en andere cardiovasculaire interventies conform ESC-guidelines. |
|
Kennisoverdracht |
Overweeg kennisoverdracht aan patiënten ten aanzien van valpreventie (waaronder beweeg- en alcoholadviezen) (zie ook de module ‘Compliantie van ouderen aan valpreventie’) |
|
Medicatieafbouw (cardiovasculaire medicatie) |
Overweeg (begeleid) afbouwen van cardiovasculaire medicatie, neem hierbij de indicatie en patiënt preferente wensen (behandeldoelen) in ogenschouw en betrek de hoofdbehandelaar (zie ook de richtlijn Polyfarmacie bij ouderen). |
|
Medicatieafbouw (psychofarmaca) |
Bouw psychofarmaca af om het valrisico te verlagen. Betrek hierbij de hoofdbehandelaar. |
|
Omgeving |
Voer als onderdeel van de multifactoriële interventie een persoonsomgevingsinterventie uit, of verwijs hiervoor naar de ergotherapeut voor een evidence based aanpak. |
|
Onderliggende ziektes/aandoeningen |
Voer specifieke interventies uit |
|
Operatief (cataract OK, pacemakerimplantatie bij cardioinhibitoire sinus caroticus overgevoeligheid) |
Adviseer cataractoperatie (van het eerste oog) bij vallers met cataract Adviseer pacemakerimplantatie bij cardioinhibitoire sinus caroticus overgevoeligheid |
|
Psychologische interventies |
Voer specifieke interventies uit |
|
Schoeisel/Voetproblemen |
Adviseer gebruik van veilig schoeisel, overweeg inschakelen van podiatrie |
|
Vertebril |
Adviseer gebruik van aparte vertebril (in plaats van multifocaal bril) voor buitenactiviteiten bij vallers die regelmatig zelfstandig buiten komen |
|
Vitamine D-suppletie |
Geef vitamine D-suppletie (800IE per dag) indien het vitamine D verlaagd is. Laad bij een ernstige deficiëntie (vitamine D < 30nmol/L) zo nodig op tot de normaalwaarde is bereikt. |
|
Vloeistof of voedingstherapie |
Behandel ondervoeding en dehydratie |
Overwegingen
Een val is een symptoom van onderliggende aandoeningen en/of ziekten met over het algemeen meerdere onderliggende risicofactoren tegelijkertijd. Zodoende dient een valrisicobeoordeling en bijbehorende interventie over het algemeen multifactorieel van aard te zijn. Belangrijke behandelbare valrisicofactoren zijn gestoorde mobiliteit, gebruik van valrisico verhogende medicatie, valangst, vitamine D te kort, omgevingsfactoren, onveilig schoeisel en slechtziendheid. Voor interventies gericht op cognitie of stemming, slechthorendheid en urine-incontinentie, is voor thuiswonenden geen bewijsvoering ten aanzien van effectiviteit als individuele interventie. Als component van de multifactoriële interventie kan het wel degelijk zinvol zijn om deze mee te nemen.
In het algemeen kan voor de multifactoriële interventie aangehouden worden dat gevonden afwijkingen worden behandeld. Gezien de sterke bewijskracht ten aanzien van bewegingsinterventies dient een multifactoriële valpreventieve interventie ten minste één beweegcomponent te bevatten (Sherrington, 2008). Daarnaast dienen de volgende interventies in ieder geval overwogen te worden: aanvullende beweeginterventies, verminderen van valangst, omgevingsinterventies, optimaliseren van de visus (cataract OK, aparte vertebril buiten), vitamine D (indien deficiënt), afbouwen van valrisico verhogende medicatie, patiënteducatie waaronder gebruik veilig schoeisel en orthostase adviezen. Ondanks dat algemene adviezen over beweging (beweeg dagelijks minaal 30 minuten laag intensief) en alcoholgebruik (beperk alcoholgebruik, bij voorkeur volledig staken) niet uit de evidence apart naar voren komen, gelden deze adviezen ook thuiswonenden met een verhoogd valrisico.
Patiënteducatie is voor het slagen van de multifactoriële interventie essentieel. Het doel is om inzicht te geven in de relatie tussen de risicofactoren en vallen om zodoende de compliantie te verbeteren. Wees ervan bewust dat autonomie en onafhankelijkheid van patiënten van grote waarde is. Soms is dit zwaarwegender dan het valrisico aan te pakken. Nederlandse trials hebben laten zien dat juist de (beperkte) compliantie de effectiviteit van de multifactoriële interventie in de weg lijkt te staan. Om compliantie te optimaliseren, is het belangrijk om in een gefaseerde aanpak van achtereenvolgens bewustwording van het valrisico, kennis ten aanzien van valrisicofactoren en toepassing van valpreventieve maatregelen aan de orde te laten komen. Hierbij is het belangrijk dat de voordelen van een interventie duidelijk zijn voor de patiënt en zijn/haar naasten. En eventueel aanwezige valangst en schaamte dienen te worden geïdentificeerd. Dit zorgt ervoor dat ouderen gemotiveerd zijn en daadwerkelijk maatregelen gaan nemen. Meestal vraagt dit om meerdere vervolgconsulten (zie ook de module ‘Compliantie van ouderen aan valpreventie’).
Ten aanzien van beweegprogramma’s blijkt uit de literatuur dat beweegprogramma’s die zich richten op balans, spierkracht en mobiliteit het meest effectief zijn om valrisico te verkleinen. Dit geldt zowel voor groepslessen als voor thuisprogramma’s. Over het algemeen is bij groepslessen aanpak van valangst een geïntegreerd onderdeel van het programma. Belangrijke onderdelen zijn daarnaast conditie, veilig loophulpmiddelgebruik en veilige transfers. Zowel individuele als groepsprogramma’s zijn effectief. Bij voorkeur wordt in overleg met een fysiotherapeut of een oefentherapeut een geïndividualiseerd beweegadvies gegeven onder andere omdat een beweeginterventie vooral effectief is als de oefeningen voldoende uitdagingen bieden. Ook hier dient zorgvuldig gezocht te worden naar iets waarbij een hoge therapietrouw te verwachten is. Het is hierbij belangrijk om aan te sluiten bij individuele doelen en motiverende/belemmerende factoren.
Ten aanzien van omgevingsinterventies blijkt uit het onderzoek van Pighills (2011) dat een persoon-omgevingsinterventie uitgevoerd door ergotherapeuten effectiever is dan dezelfde interventie uitgevoerd door hiertoe getrainde thuiszorgmedewerkers. Een ergotherapeutisch valpreventief consult bestaat uit het in kaart brengen van het motorisch en cognitief handelen binnen de context van de eigen omgeving door ergotherapeut (hiervoor wordt naar de richtlijn Valpreventie van de Ergotherapeuten verwezen) Minimaal wordt een checklist voor beoordeling thuis door de patiënt geadviseerd.
Ten aanzien van afbouw van valrisicoverhogende medicatie dient in ieder geval afbouw van psychotrope medicatie (sedativa) worden overwogen. Ten aanzien van cardiovasculaire medicatie is bewijsvoering beperkter, maar er zijn aanwijzingen dat een geïndividualiseerde afbouw effectief en veilig is (zie ook de module ‘Effect medicijnen op valrisico ouderen’). Een recente Nederlandse studie naar effectiviteit van medicatie afbouw liet geen effect van deze individuele interventie zien, opvallend hierbij was dat aan het einde van de studie het gebruikte aantal valrisico verhogende medicijnen gemiddeld hoger was als bij start. Dit benadrukt het belang van samenwerken in de keten bij valpreventieve interventies, zoals ook ondersteund wordt door de opzet van een bewezen effectieve medicatie afbouw studie onder leiding van apothekers, waar samenwerking met voorschrijvers goed was georganiseerd. De negatieve Nederlandse studie onderstreept eveneens het belang van goede patiënteducatie en betrokkenheid om compliantie te maximaliseren (zie ook de modules ‘Compliantie van ouderen aan valpreventie’ en ‘Organisatie van zorg bij valpreventie ouderen’). Bij medicatie afbouw wordt gekeken naar veilige opties voor verminderen of staken van valrisico verhogende medicatie. Indien aanwezig wordt deze zo mogelijk gestaakt, of vervangen door een veiliger middel. Ook kan dosisverlaging of wijziging van moment van inname leiden tot verlaging van het valrisico.
Voor vitamine D geldt dat een sufficiënte status een bijdrage heeft aan een betere botkwaliteit en daarnaast heeft het een gunstig effect op spierkracht en balans. Aanvullend gebruik met een streefwaarde van >60 nmol/l in het bloed leidt tot een verlaging van het valrisico. Over het algemeen is 800 IE per dag hiervoor afdoende, tenzij er sprake is van een ernstige vitamine D-deficiëntie (<30 nmol/l), dan is opladen wenselijk om de beoogde streefspiegel sneller te behalen. Dit kan bijvoorbeeld door het te kort te berekenen met behulp van de volgende formule: 40 x (75-gemeten vitamine D-spiegel) x lichaamsgewicht (Kg) en dit toe te dienen in porties van 25.000 IE per week oraal. Van belang is om niet te hoog te doseren, aangezien dit juist het valrisico weer kan verhogen evenals een verhoging van het cardiovasculair risico (van Dijk, 2015).
Bij laagrisicopatiënten kan een enkelvoudige interventie overwogen worden, dit betreft over het algemeen een mobiliteitsinterventie.
Al met al: bij de verschillende interventies is het belangrijk om bij de persoon zelf aandacht te hebben voor: zijn/haar autonomie, zoveel mogelijk aansluiten bij de wensen en behoefte van de cliënt, een goede uitleg over het belang van valpreventie en zorg te dragen voor een goede motivatie.
Onderbouwing
Achtergrond
Valpreventieve interventies bij thuiswonenden kunnen onderverdeeld worden in enkelvoudige, multipele en multifactoriële interventies. Omdat bij vallen over het algemeen meerdere factoren tegelijkertijd een rol spelen, heeft een multifactorieel preventieprogramma de meeste kans van slagen. Veel studies tonen aan dat het valrisico, dat wil zeggen het aantal valincidenten, bij ouderen effectief gereduceerd kan worden, met circa 40% (Gillespie, 2012; Karlsson, 2013). Uit onderzoek blijkt dat ten aanzien van valpreventie de meeste maatregelen alleen effectief zijn als ze in combinatie met andere maatregelen worden uitgevoerd. Enkelvoudige interventies worden wel toegepast en zijn over het algemeen gericht op optimalisering van de mobiliteit. Enkelvoudige interventies en worden bij voorkeur alleen uitgevoerd bij laagrisicopatiënten. Bij onbegrepen of recidiverend vallen wordt veelal een multifactoriële interventie verricht. Er is nog geen zekerheid ten aanzien van de optimale inhoud van de multifactoriële interventie, deze is verschillend in de verschillende studies. Dit vindt zijn vertaalslag in de praktijk, waarbij er regionale verschillen zijn, vaak afhankelijk van de omgeving waar de interventie wordt aangeboden (1e versus 2e lijn). Een belangrijke belemmering voor effectiviteit van de (multifactoriële) interventie is compliantie.
Conclusies / Summary of Findings
1. Lichamelijke oefeningen versus controle
Aantal vallers
|
Laag GRADE |
Groepsverband: Meerdere categorieën lichamelijke oefeningen Lichamelijke oefeningen in groepsverband bestaande uit meerdere categorieën verlagen het aantal vallers onder thuiswonenden vergeleken met controle.
Bronnen (Gillespie, 2012; Gianoudis, 2014; Kim, 2014; Patil, 2015) |
|
Laag GRADE |
Individueel: Meerdere categorieën lichamelijke oefeningen Individueel afgestemde lichamelijke oefeningen bestaande uit meerdere categorieën verlagen het aantal vallers onder thuiswonenden vergeleken met controle.
Bronnen (Gillespie, 2012; Gleeson, 2015; Suttanon, 2013) |
|
Laag GRADE |
Tai Chi (groepsverband) Tai Chi oefeningen in groepsverband verlagen het aantal vallers onder thuiswonenden vergeleken met controle.
Bronnen (Gillespie, 2012) |
Valfrequentie
|
Matig GRADE |
Groepsverband: Meerdere categorieën lichamelijke oefeningen Lichamelijke oefeningen in groepsverband bestaande uit meerdere categorieën verlaagt de valfrequentie bij thuiswonenden vergeleken met controle.
Bronnen (Gillespie, 2012; Freiburger, 2012; Gianoudis, 2014; Llife, 2014; Patil, 2015) |
|
Matig GRADE |
Individueel: Meerdere categorieën lichamelijke oefeningen Individuele lichamelijke oefeningen bestaande uit meerdere categorieën verlaagt de valfrequentie bij thuiswonenden vergeleken met controle.
Bronnen (Gillespie, 2012; Gleeson, 2015; Llife, 2014; Suttanon, 2013) |
|
Matig GRADE |
Tai Chi (groepsverband) Tai Chi oefeningen in groepsverband verlaagt de valfrequentie bij thuiswonenden vergeleken met controle.
Bronnen (Gillespie, 2012) |
Botbreuken
|
Matig GRADE |
Lichamelijke oefeningen verlagen het risico op een botbreuk bij thuiswonenden vergeleken met controle.
Bronnen (Gillespie, 2012; Gianoudis, 2014; Gleeson, 2015; Kim, 2014; Patil, 2015) |
2. Lichamelijke oefeningen versus lichamelijke oefeningen
|
- GRADE |
Vanwege het lage aantal trials per vergelijking is het niet mogelijk om een conclusie te formuleren over het effect van lichamelijke oefeningen vergeleken met andere lichamelijke oefeningen op het aantal vallers, valfrequentie of botbreuken.
Bronnen (Gillespie, 2012; day, 2015; Taylor, 2012; Yamada, 2013) |
3. Vitmine D supplementen versus geen vitamine D supplementen of calcium
Aantal vallers
|
Matig GRADE |
Vitamine D suppletie met of zonder calcium heeft geen effect op het aantal vallers vergeleken met controle, placebo of calcium bij thuiswonenden.
Bronnen (Subgroep – deelnemers met laag niveau) |
|
Matig GRADE |
Vitamine D suppletie met of zonder calcium verlaagt aantal vallers vergeleken met controle, placebo of calcium bij thuiswonenden met een laag vitamine D niveau.
Bronnen (Gillespie, 2012) |
Valfrequentie
|
Matig GRADE |
Vitamine D suppletie met of zonder calcium heeft geen effect op de valfrequentie vergeleken met controle, placebo of calcium bij thuiswonenden.
Bronnen (Gillespie, 2012; Uusi-Rasi, 2015) |
|
Matig GRADE |
Subgroep – deelnemers met laag vitamine D Vitamine D suppletie met of zonder calcium verlaagt de valfrequentie vergeleken met controle, placebo of calcium bij thuiswonenden met een laag vitamine D niveau.
Bronnen (Gillespie, 2012; Uusi-Rasi, 2015) |
Botbreuken
|
Hoog GRADE |
Vitamine D suppletie met of zonder calcium heeft geen effect op het risico op een botbreuk vergeleken met controle, placebo of calcium bij thuiswonenden.
Bronnen (Gillespie, 2012) |
4. Vloeistof of voedingstherapie versus controle
Geen conclusies
5. Omgeving interventies versus reguliere zorg
Aantal vallers
|
Hoog GRADE |
Persoon-omgeving interventies verlagen het aantal vallers onder thuiswonenden vergeleken met controle.
Bronnen (Gillespie, 2012; Kamei, 2015) |
Valfrequentie
|
Matig GRADE |
De valfrequentie onder thuiswonenden wordt door omgeving interventies verlaagd vergeleken met controle.
Bronnen (Gillespie, 2012; Kamei, 2015) |
Botbreuken
|
Zeer laag GRADE |
Het is onduidelijk of een omgeving interventie het risico op botbreuken verlaagt vergeleken met controle.
Bronnen (Gillespie, 2012) |
6. Multifactoriële interventies versus controle
Aantal vallers
|
Matig GRADE |
Multifactoriële interventies hebben geen effect op het aantal vallers onder thuiswonenden vergeleken met controle.
Bronnen (Gillespie, 2012; Lee, 2013; Fairhall, 2014; Moller, 2014; Palvanen, 2014) |
Valfrequentie
|
Laag GRADE |
De valfrequentie onder thuiswonenden is verlaagd bij multifactoriele interventies vergeleken met controle.
Bronnen (Gillespie, 2012; Perula, 2012; Lee, 2013; Fairhall, 2014; Palvanen, 2014) |
Botbreuken
|
Laag GRADE |
Het risico op een botbreuk is mogelijk verlaagd door multifactoriele interventies bij thuiswonenden vergeleken met controle.
Bronnen (Gillespie, 2012; Fairhall, 2014; Palvanen, 2014) |
Samenvatting literatuur
Beschrijving studies
Gillespie, 2012 heeft een systematische zoekactie gedaan naar de effecten van interventies om de incidentie van vallen in thuiswonende ouderen te verlagen. De zoekactie was in februari 2012 uitgevoerd. Uiteindelijk waren 159 trials met in totaal 79.193 deelnemers geïncludeerd. De meeste trials vergeleken een interventie voor valpreventie met geen interventie of met een interventie zonder verwacht effect op vallen. Oefeningen als een enkele interventie als ook multifactoriële programma’s waren de meest voorkomende onderzochte interventies. De volgende categorieën van interventie (met vergelijkende groep) ter preventie van vallen waren beschreven in het Cochrane review:
- beweeginterventie versus controle of andere lichamelijke oefeningen;
- vitamine D supplementen versus geen vitamine D supplementen of calcium;
- andere medicamenten versus controle;
- stoppen met medicatie versus controle;
- operatie versus controle;
- vloeistof of voedingstherapie versus controle;
- psychologische interventies versus controle;
- omgeving interventies versus reguliere zorg;
- kennisoverdracht interventies versus controle;
- meerdere interventies;
- multifactoriële interventies versus controle.
Beschrijving nieuwe studies
Uit de update van de Cochrane review werden 20 nieuwe trials met in totaal 7392 patiënten geïncludeerd. De geïncludeerde trials leverde additionele gegevens voor de volgende vergelijkingen:
- lichamelijke oefeningen versus controle of andere lichamelijke oefeningen;
- vitamine D supplementen versus geen vitamine D supplementen of calcium;
- vloeistof of voedingstherapie versus controle;
- omgeving interventies versus reguliere zorg;
- multifactoriële interventies versus controle.
Een overzicht van deze trials wordt in de onderstaande tabel gegeven.
|
|
|
|
Uitkomstmaten |
||
|
Auteur, jaar |
Interventie; Controle |
N |
Aantal vallers |
Val frequentie |
Botbreuken |
|
Day, 2015 |
Tai chi |
250 |
ü |
ü |
- |
|
|
Flexibiliteit en strekprogramma |
253 |
|
|
|
|
Gleeson, 2015 |
Alexander Technique lesson |
60 |
ü |
ü |
ü |
|
|
Reguliere zorg door een geleidehond |
60 |
|
|
|
|
Patil, 2015 |
Lichamelijke oefeningen |
205 |
ü |
ü |
ü |
|
|
Huidige fysieke activiteit |
204 |
|
|
|
|
Gianoudis, 2014 |
Lichamelijke oefeningen, osteoporose kennisoverdracht en gedragsverandering |
81 |
ü |
ü |
ü |
|
|
Reguliere zorg |
81 |
|
|
|
|
Kim, 2014 |
Lichamelijke oefeningen |
52 |
ü |
- |
ü |
|
|
Kennisoverdracht |
53 |
|
|
|
|
Lliffe, 2014 |
1 Home-based Otago Exercise Programma (OEP) 2 Community-based group exercise programma |
1: 411 2: 387 |
- |
ü |
- |
|
|
Reguliere zorg |
458 |
|
|
|
|
Suttanon, 2013 |
Lichamelijke oefeningen – balans en spierversterkende oefeningen |
19 |
ü |
ü |
-
|
|
|
Kennisoverdracht |
21 |
|
|
|
|
Yamada, 2013 |
Stapprogramma en lichamelijke oefeningen |
132 |
ü |
ü |
ü |
|
|
Wandelprogramma en lichamelijke oefeningen |
132 |
|
|
|
|
Clemson, 2012 |
|
1: 107 2: 105 |
ü |
ü |
-
|
|
|
Lichte lichamelijke oefeningen, gericht op flexibiliteit |
105 |
|
|
|
|
Taylor, 2012 |
|
1: 233 2: 220 |
ü |
ü |
ü |
|
|
Lichte lichamelijke oefeningen |
231 |
|
|
|
|
Suominen, 2015 |
Afgestemd voeding begeleiding met huisbezoeken |
50 |
- |
ü |
- |
|
|
Geschreven informatie over voedsel |
44 |
|
|
|
|
Uusi-Rasi, 2015 |
Vitamine D3 (800 IU per dag) |
102 |
- |
ü |
- |
|
|
Placebo |
102 |
|
|
|
|
Kamei, 2015 |
Kennisoverdracht en programma gericht op gevaren in huis. |
67 |
ü |
ü |
- |
|
|
Controle – kennisoverdracht veroudering en gezondheid |
63 |
|
|
|
|
Tchalla, 2013 |
Huis gebaseerd technologie met assistentie service tezamen met een valrisico verlagend programma |
49 |
ü |
ü |
-
|
|
|
Een valrisico verlagend programma |
47 |
|
|
|
|
Fairhall, 2014 |
Multifactorieel – individueel afgestemd lichamelijke oefeningen bovenop reguliere zorg |
120 |
ü |
ü |
ü |
|
|
Reguliere zorg |
121 |
|
|
|
|
Moller, 2014 |
Multifactorieel – casemanagement, algemene informatie over onder andere lichamelijke oefeningen en voeding, individueel afgestemde informatie en veiligheid |
80 |
ü |
- |
- |
|
|
Controle |
73 |
|
|
|
|
Palvanen, 2014 |
Multifactorieel – individueel afgestemd valreductieprogramma met lichamelijke oefeningen, medicatie beoordeling, voeding en beoordeling van gevaren in huis |
661 |
ü |
ü |
ü |
|
|
Controle bestaande uit een algemene brochure over het voorkomen van letsel |
653 |
|
|
|
|
Lee, 2013 |
Multifactorieel – lichamelijke oefeningen, kennisoverdracht gezondheid en beoordeling van gevaren in huis |
313 |
ü |
ü |
-
|
|
|
Controle – brochures, medicatie beoordeling |
303 |
|
|
|
|
Perula, 2012 |
Multifactorieel – individueel afgestemd advies, informatie brochure, lichamelijke oefeningen en huisbezoeken |
133 |
- |
ü |
- |
|
|
Controle – reguliere zorg met een brochure |
271 |
|
|
|
Vanwege de grootte van de Cochrane review zullen nu alleen de vergelijkingen worden beschreven waarvoor additionele data beschikbaar is. Voor de overige vergelijkingen wordt naar de Cochrane review verwezen.
Interventies ter preventie van vallen
1. Lichamelijke oefeningen versus controle
De Cochrane review van Gillespie (2012) kon met 11 trials worden geüpdatet. Vanwege de hoeveelheid aan studies is ervoor gekozen om geen korte beschrijving te geven, maar wordt verwezen naar de tabel met geïncludeerde studies.
Resultaten
I. Vallen
I.I Het aantal vallers
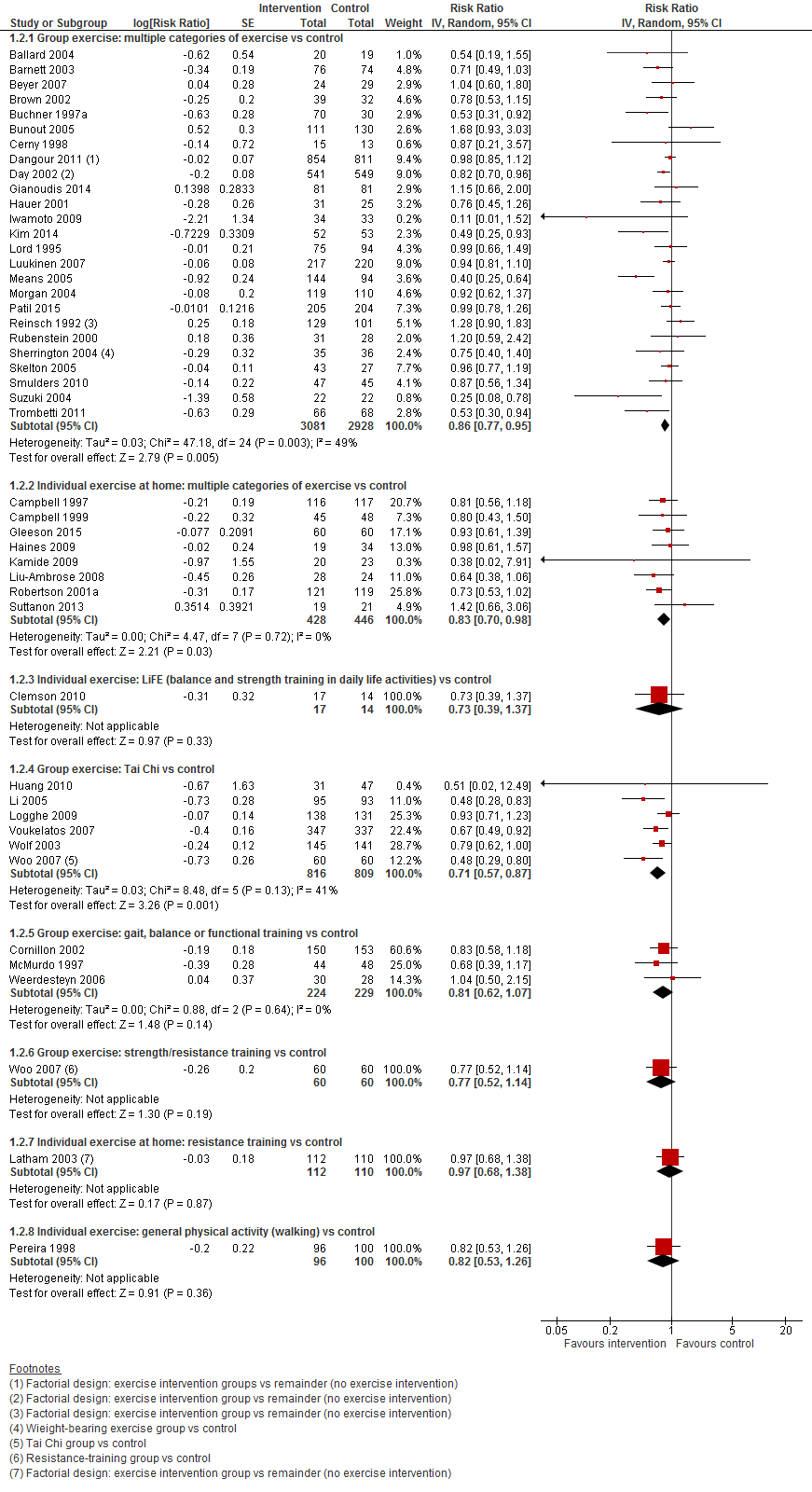
In figuur 1 staan de resultaten op de uitkomst het aantal vallers weergegeven. Hierbij zijn de resultaten per type interventie apart weergegeven. Zonder te focussen op een type van interventie is te zien dat alle interventies met lichamelijke oefeningen in ieder geval het risico om te vallen niet vergroten vergeleken met controle.
Bij een lichamelijke oefening bestaande uit meerdere categorieën in groepsverband is het risico om te vallen verlaagd. Het aantal thuiswonenden die dit type interventie kregen en vielen was met 14% verlaagd vergeleken met de controlegroep (RR 0,86 95%BI: 0,77 tot 0,95). Ook bij oefeningen die thuis gegeven waren, was het aantal vallers verlaagd (RR 0,83 95%BI: 0,70 tot 0,98). Het aantal vallers was ook verlaagd bij Tai Chi oefeningen gegeven in groepsverband. Het aantal vallers nam met 29% af vergeleken met controle (RR 0,71 95%BI: 0,57 tot 0,87).
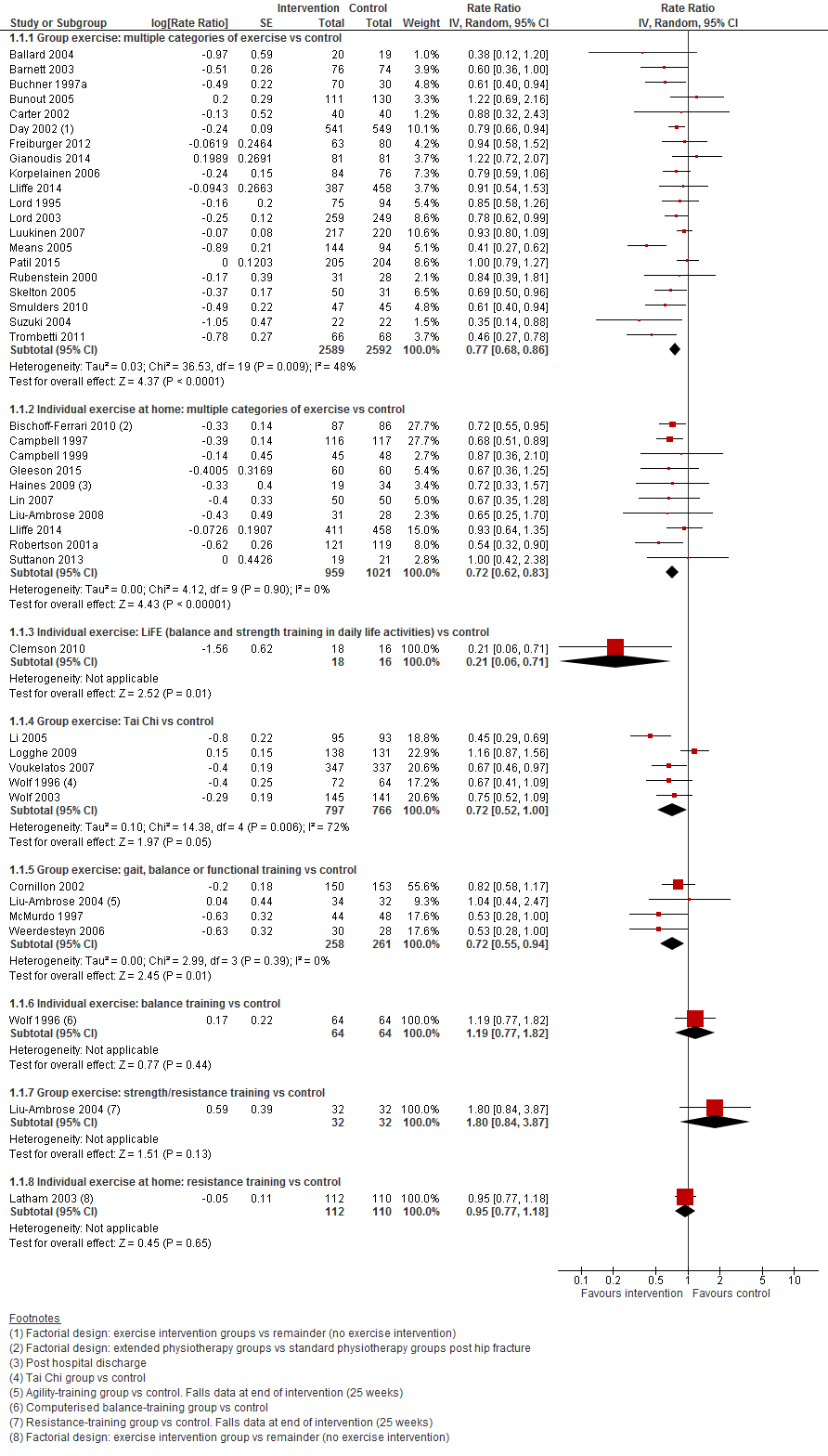
I.II Valfrequentie
In figuur 2 staan de resultaten op de uitkomst valfrequentie weergegeven. Hierbij zijn de resultaten per type interventie apart weergegeven. Over het algemeen verlagen de interventie de valfrequentie. Vergelijkbare resultaten als het aantal vallers werd gevonden. Bij een lichamelijke oefening bestaande uit meerdere categorieën in groepsverband was de valfrequentie met 33% afgenomen (RR 0,77 95%BI: 0,68 tot 0,86). Ook individueel gegeven lichamelijke oefeningen verlaagde de valfrequentie (RR 0,72 95%BI: 0,62 tot 0,83). Een vergelijkbaar effect werd waargenomen bij Tai Chi oefeningen al met een breder betrouwbaarheidsinterval (RR 0,72 95%BI: 0,52 tot 1,00).
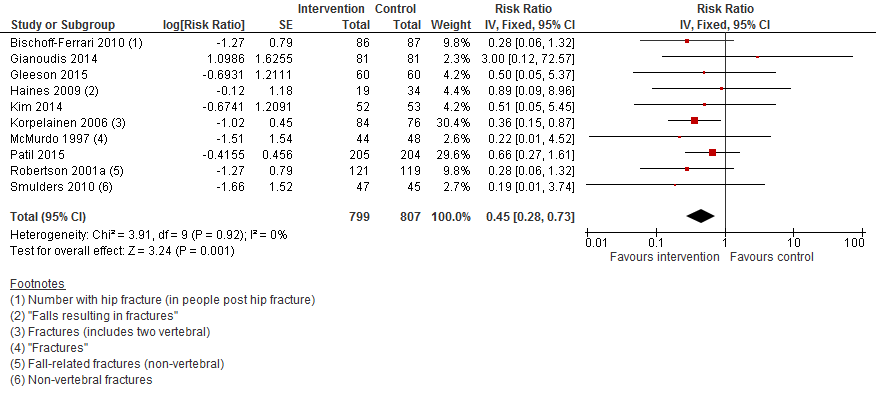
I.III Botbreuken
In figuur 3 staan de resultaten op de uitkomst botbreuken weergegeven. Vanwege het lage aantal trials heeft de Cochrane review deze niet per type interventie gestratificeerd. Ongeacht welke lichamelijke oefeningen worden gevonden en of dit individueel of in groepsverband werd gegeven, was het risico op een botbreuk met 55% verlaagd vergeleken met controle (RR 0,45 95%BI: 0,28 tot 0,73).
Figuur 1 Meta-analyse: lichamelijke oefeningen en uitkomst het aantal vallers
Figuur 2 Meta-analyse: lichamelijke oefeningen en uitkomst valfrequentie
Figuur 3 Meta-analyse: lichamelijke oefeningen en uitkomst botbreuken
Bewijskracht van de literatuur
Aantal vallers: De bewijskracht voor de uitkomstmaat het aantal vallers is met twee niveaus verlaagd gezien beperkingen in de onderzoeksopzet (gebrek aan blindering van toewijzers en deelnemers) en tegenstrijdige resultaten (inconsistentie) of het geringe aantal patiënten (imprecisie).
Valfrequentie: De bewijskracht voor de uitkomstmaat valfrequentie is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (gebrek aan blindering van toewijzers en deelnemers). Voor interventie Tai Chi is een extra niveau verlaagd vanwege imprecisie (breed betrouwbaarheidsinterval).
Botbreuken: De bewijskracht voor de uitkomstmaat botbreuken is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (gebrek aan blindering van toewijzers en deelnemers).
2. Lichamelijke oefeningen versus lichamelijke oefeningen
De Cochrane review van Gillespie, 2012 kon met 11 trials worden geüpdatet. Vanwege de hoeveelheid aan studies is ervoor gekozen om geen korte beschrijving te geven, maar wordt verwezen naar de tabel met geïncludeerde studies.
Resultaten
I. Vallen
I.I Het aantal vallers
In figuur 4 staan de resultaten op de uitkomst het aantal vallers weergegeven. Per type interventie was één of twee trials beschikbaar, waardoor het niet mogelijk was een conclusie te trekken.
I.II Valfrequentie
In figuur 5 staan de resultaten op de uitkomst valfrequentie weergegeven. Ook bij deze uitkomst waren er per type één of twee trials beschikbaar en daardoor was het moeilijk om een conclusie te formuleren.
I.III Botbreuken
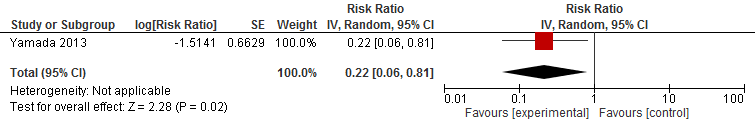
In figuur 6 staan de resultaten op de uitkomst botbreuken weergegeven. Echter, één trial had het effect van lichamelijke oefeningen vergeleken met andere lichamelijk oefeningen op botbreuken gerapporteerd.
Figuur 4 Lichamelijke oefeningen en uitkomst het aantal vallers
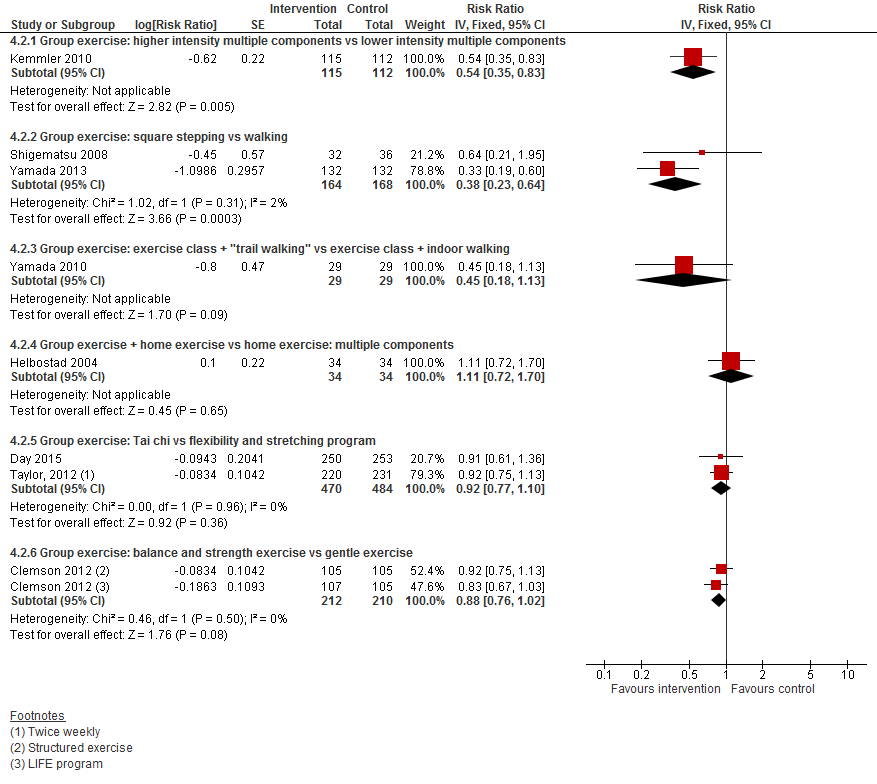
Figuur 5 Lichamelijke oefeningen en uitkomst valfrequentie
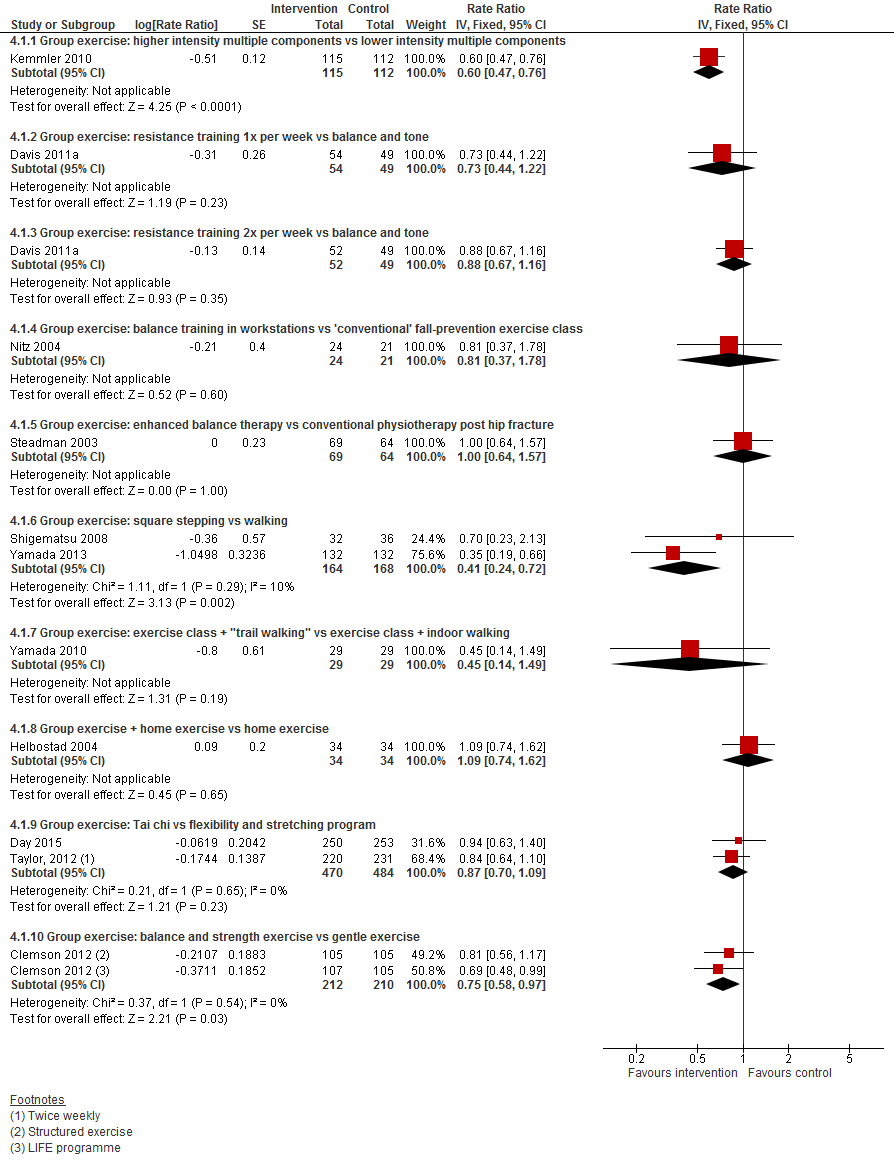
Figuur 6 Lichamelijke oefeningen en uitkomst botbreuken
Bewijskracht van de literatuur
Vanwege het lage aantal trials per vergelijking is het niet mogelijk om de bewijskracht te graderen of een conclusie te formuleren.
3. Vitmine D supplementen versus geen vitamine D supplementen of calcium
De Cochrane review van Gillespie (2011) kon met een additionele trial worden geüpdatet. In het kort, Uusi-Rasi (2015) vergeleek suppletie met vitamine D3 (800 IU per dag voor 24 maanden) met placebo bij vrouwen in de leeftijd tussen 70 en 80 jaar.
Resultaten
I. Vallen
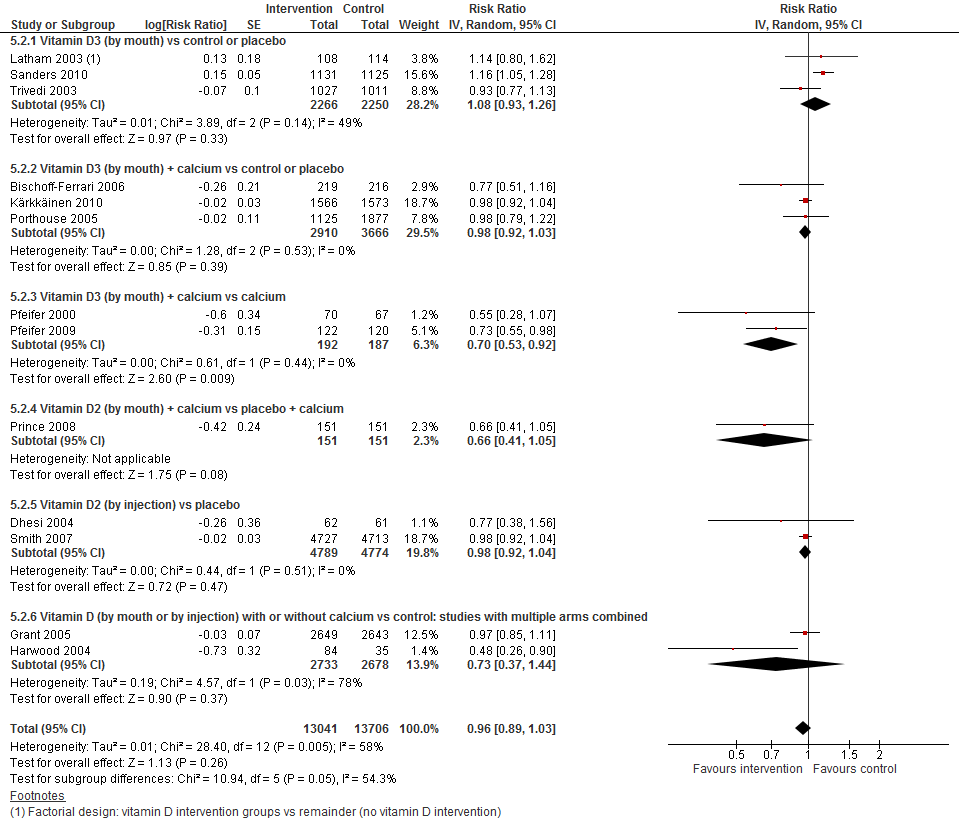
I.I Het aantal vallers
In figuur 7 staan de resultaten op de uitkomst het aantal vallers weergegeven. Per type interventie en vergelijking waren tussen de een en drie trials beschikbaar. Ongeacht de interventie en controlegroep heeft vitamine D suppletie geen effect op het aantal vallers (RR 0,96 95%BI: 0,89 tot 1,03). De meta-analyse lijkt te suggereren dat bij bepaalde interventies ook een potentieel verlagend effect hebben op het aantal vallers. Vanwege het lage aantal trials per vergelijking is het echter niet mogelijk om een conclusie te formuleren bij welke interventies thuiswonenden baat zouden hebben.
Figuur 7 Vitamine D suppletie en uitkomst aantal vallers
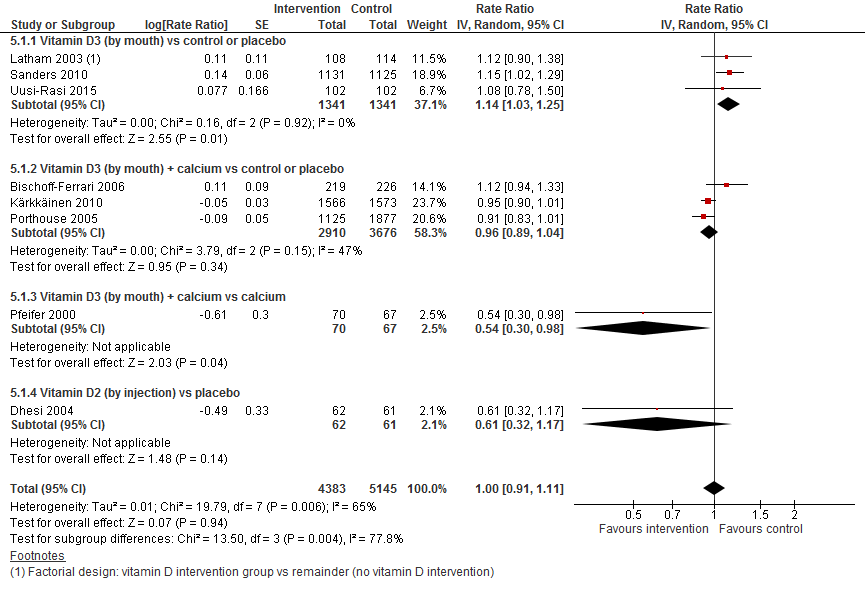
I.II Valfrequentie
In figuur 8 staan de resultaten op de uitkomst valfrequentie weergegeven. Per type interventie en vergelijking waren tussen de een en drie trials beschikbaar. Ongeacht de interventie en controlegroep heeft vitamine D suppletie geen effect op de valfrequentie (RR 1,00 95%BI: 0,91 tot 1,11). Dit overal effect wordt bevestigd door de resultaten van de subgroepen vitamine D suppletie versus controle of vitamine D tezamen met calcium versus controle.
Figuur 8 Vitamine D suppletie en uitkomst valfrequentie
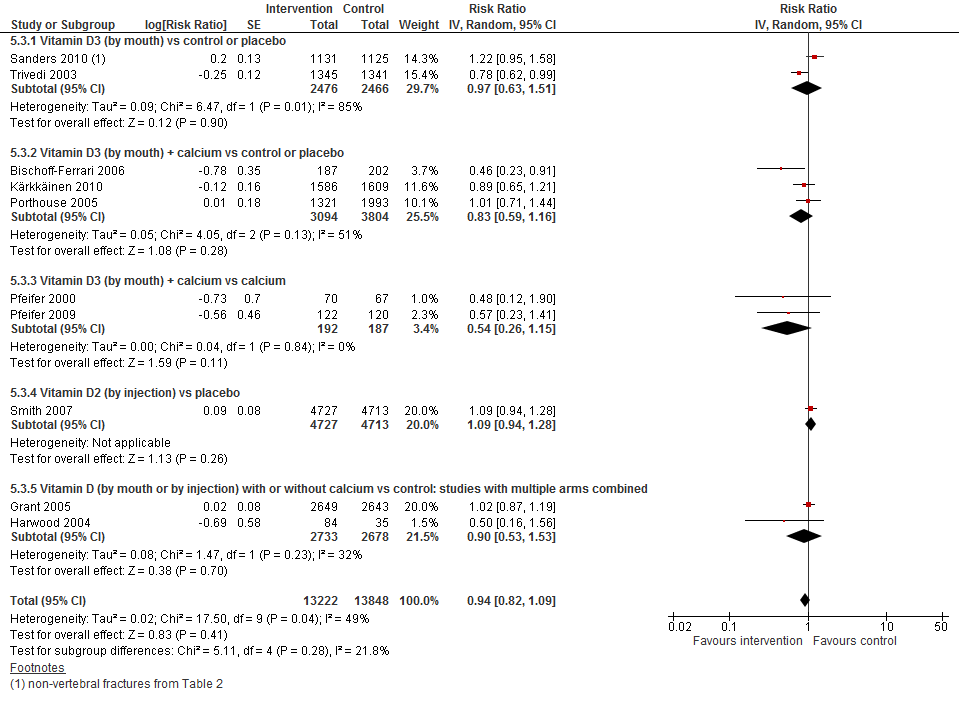
I.III Botbreuken
In figuur 9 staan de resultaten op de uitkomst botbreuken weergegeven. Vitamine D suppletie verlaagt niet het risico op een botbreuk bij thuiswonenden (RR 0,94 95%BI: 0,82 tot 1,09). Ook de gegevens uit de verschillende interventies laten hetzelfde effect zien. Alleen vitamine D tezamen met calcium vergeleken met alleen calcium suggereert een potentieel verlaagd effect.
Figuur 9 Vitamine D suppletie en uitkomst botbreuken
Subgroep analyse
Gillespie (2011) voerde een subgroep analyse uit met trials die alleen deelnemers met een laag vitamine D niveau includeerden. Het aantal vallers en de valfrequentie was lager bij gebruik van vitamine D suppletie door deelnemers met laag vitamine D versus controle (RR 0,70 95%BI: 0,56 tot 0,87 en RR 0,57 95%BI: 0,37 tot 0,89, respectievelijk). Voor de meta-analyses verwijzen we naar de Cochrane review van Gillespie (2011).
Bewijskracht van de literatuur
Aantal vallers: De bewijskracht voor de uitkomstmaat het aantal vallers is met een niveau verlaagd gezien tegenstrijdige resultaten (inconsistentie). Subgroep met laag vitamine D: De bewijskracht voor de uitkomstmaat het aantal vallers is met twee niveaus verlaagd gezien imprecisie (lage aantal deelnemers).
Valfrequentie: De bewijskracht voor de uitkomstmaat valfrequentie is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (gebrek aan blindering en follow-up). Subgroep met laag vitamine D: De bewijskracht voor de uitkomstmaat valfrequentie is met een niveau verlaagd gezien imprecisie (lage aantal deelnemers).
4. Vloeistof of voedingstherapie versus controle
De update van de Cochrane review leverde een trial (Suominen, 2015) op die individueel afgestemde voedingsbegeleiding vergeleek met een brochure over voeding. Suominen (2015) rapporteerde alleen het effect op de valfrequentie. Dit resultaat werd gecorrigeerd voor leeftijd, geslacht en MMSE. Tevens werd het effect berekend als controle versus interventie in plaats van de gebruikelijk vergelijking interventie versus controle. Om deze reden wordt dit resultaat niet meegenomen. Met andere woorden, gegevens van Suominen (2015) konden niet worden toegevoegd aan de beschikbare data uit de Cochrane review. Voor de resultaten op het aantal vallers wordt naar de review verwezen.
5. Omgeving interventies versus reguliere zorg
Twee additionele trials (Kamei, 2015; Tchalla, 2013) konden worden toegevoegd aan de reeds beschikbare data uit de review van Gillespie (2011). Kamei (2015) evalueerde een uitgebreid programma gericht op gevaren in huis, waarbij de interventie uitleg en oefeningen kregen gericht op gevaren en de controlegroep kregen informatie over ouder worden en gezondheid. In de trial van Tchalla (2013) deden alle deelnemers mee aan een programma om het vallen te verminderen en kreeg de interventiegroep additioneel een nachtlampje om vallen thuis te voorkomen. Tchalla (2013) rapporteerde geadjusteerde odds ratios en cumulatieve incidentie waardoor het niet mogelijk was om de data te poolen met de reeds beschikbare meta-analyse van Gillespie (2011).
Resultaten
I. Vallen
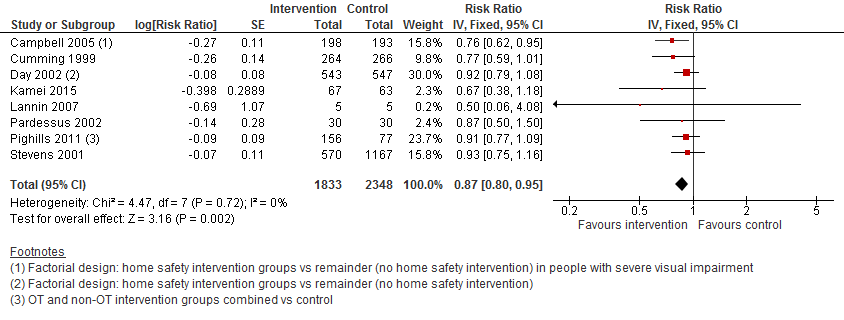
I.I Het aantal vallers
In figuur 10 staan de resultaten op de uitkomst het aantal vallers weergegeven. Een omgevingsgerichte interventies verlaagt het aantal vallers met 13% (RR 0,87 95%BI: 0,80 tot 0,95).
Figuur 10 Omgeving interventies en uitkomst het aantal vallers
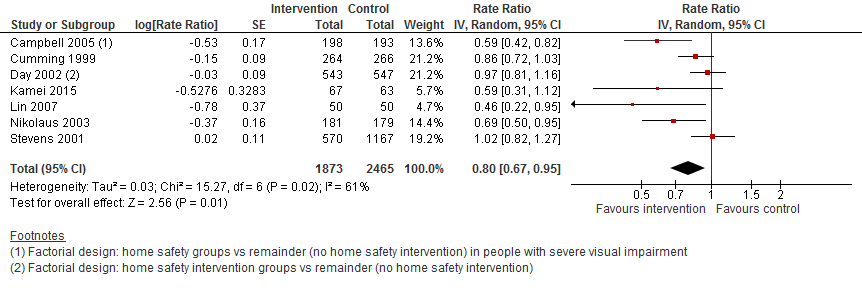
I.II Valfrequentie
In figuur 11 staan de resultaten op de uitkomst valfrequentie weergegeven. Een omgeving interventie verlaagt de valfrequentie met 20% vergeleken met controle (RR 0,80 95%BI: 0,67 tot 0,95).
Figuur 11 Omgeving interventies en uitkomst valfrequentie
Uit het onderzoek van Pighills (2011) blijkt dat een persoon-omgevingsinterventie uitgevoerd door ergotherapeuten effectiever is dan dezelfde interventie uitgevoerd door hiertoe getrainde thuiszorgmedewerkers. Het gaat hier om interventies waarin zowel de omgeving aangepast wordt als geoefend wordt in die omgeving, dit zijn niet enkel omgevingsinterventies.
I.III Botbreuken
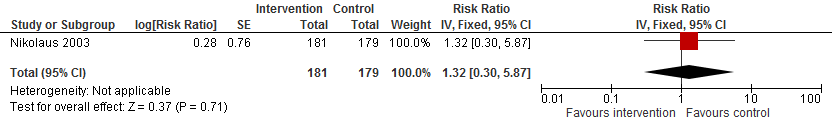
In figuur 12 staan de resultaten op de uitkomst botbreuken weergegeven. Alleen Nikolaus (2013) rapporteert het effect van een omgeving interventie op het risico op een botbreuk. Het risico is potentieel met 32% verhoogd (RR 1,32 95%BI: 0,30 tot 5,87).
Figuur 12 Omgeving interventies en uitkomst botbreuken
Bewijskracht van de literatuur
Valfrequentie: De bewijskracht voor de uitkomstmaat valfrequentie is met één niveau verlaagd gezien tegenstrijdige resultaten (inconsistentie).
Botbreuk: De bewijskracht voor de uitkomstmaat botbreuken is met drie niveaus verlaagd gezien beperkingen in studieopzet (risk of bias; outcome assessors waren niet geblindeerd) en imprecisie (laag aantal events en breed betrouwbaarheidsinterval).
6. Multifactoriële interventies versus controle
De zoekactie leverde vijf additionele trials op die multifactoriële interventies onderzocht. Vanwege het verschil in interventies wordt naar het overzicht met geïncludeerde trials verwezen voor een beschrijving van de interventie.
Resultaten
I. Vallen
I.I Het aantal vallers
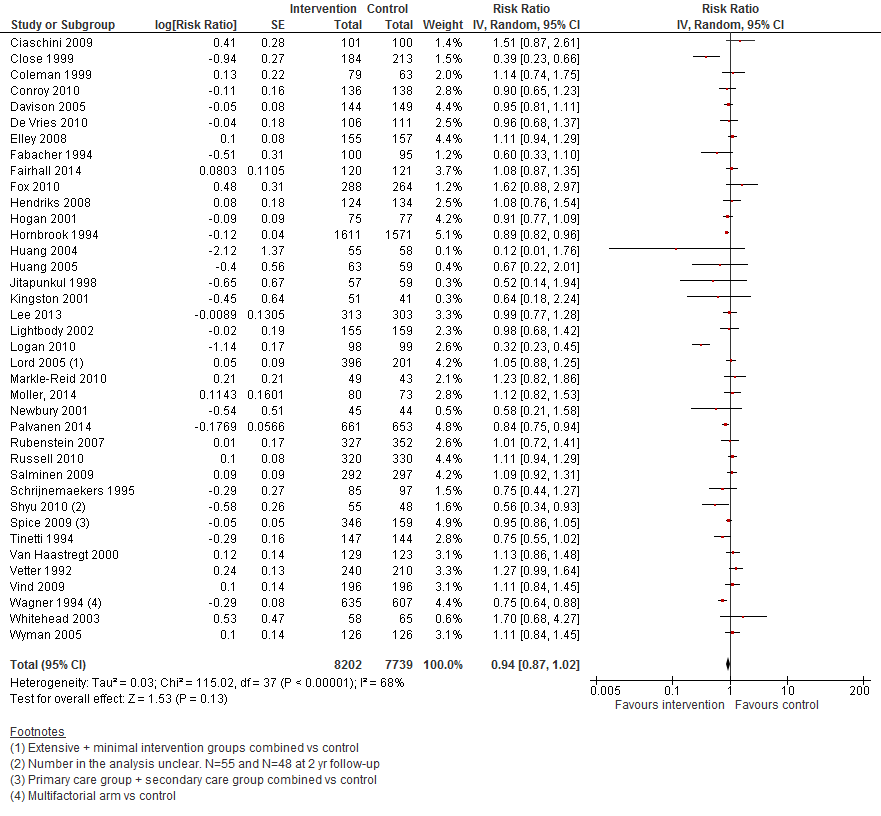
In figuur 13 staan de resultaten op de uitkomst het aantal vallers weergegeven. Multifactoriële interventies hebben geen effect op het aantal vallers vergeleken met controle (RR 0,94 95%BI: 0,87 tot 1,02).
Figuur 13 Multifactoriële interventies en uitkomst het aantal vallers
I.II Valfrequentie
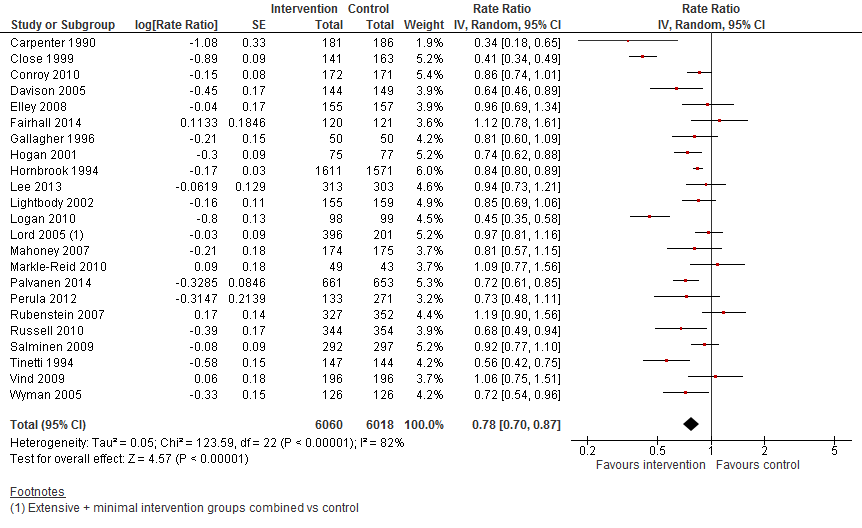
In figuur 14 staan de resultaten op de uitkomst valfrequentie weergegeven. Multifactoriële interventies verlagen de valfrequentie onder thuiswonenden met 22% (RR 0,78 95%BI: 0,70 tot 0,87).
Figuur 14 Multifactoriele interventies en uitkomst valfrequentie
I.III Botbreuken
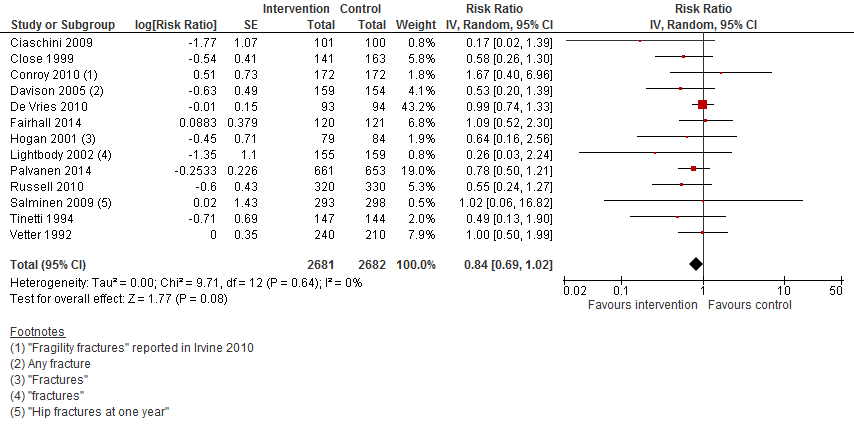
In figuur 15 staan de resultaten op de uitkomst botbreuken weergegeven. Multifactoriële interventies verlagen het risico op een botbreuk met 16% (RR 0,84 95%BI: 0,69 tot 1,02).
Figuur 15 Multifactoriële interventies en uitkomst botbreuken
Bewijskracht van de literatuur
Aantal vallers: De bewijskracht voor de uitkomstmaat aantal vallers is met één niveau verlaagd gezien beperkingen in studieopzet (risk of bias).
Valfrequentie: De bewijskracht voor de uitkomstmaat valfrequentie is met twee niveaus verlaagd gezien beperkingen in studieopzet (risk of bias) en tegenstrijdige resultaten (inconsistentie).
Botbreuk: De bewijskracht voor de uitkomstmaat botbreuken is met twee niveaus verlaagd gezien beperkingen in studieopzet (risk of bias) en tegenstrijdige resultaten (inconsistentie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling(en):
Wat is de effectiviteit en veiligheid van valrisico verlagende interventie vergeleken met geen interventie bij thuiswonende ouder patiënten met een valrisico?
P thuiswonende oudere patiënten met valrisico;
I interventies gericht op het verlagen van het valrisico;
C geen / andere interventies die geen effect hebben op vallen;
O valrisico (aantal vallers en valfrequentie) / botbreuken.
Relevante uitkomstmaten
De werkgroep achtte vallen een voor de besluitvorming kritieke uitkomstmaat; en botbreuken een voor de besluitvorming belangrijke uitkomstmaat.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Per uitkomstmaat: de werkgroep definieerde het verlagen van het aantal valincidenten evenals het voorkomen van valincidenten als een klinisch relevant verschil.
Zoeken en selecteren (Methode)
Voor de uitwerking van deze vraag wordt een bestaande Cochrane review geüpdatet. Gillespie, 2012 ondernamen een systematische literatuur zoekactie naar interventies om de incidentie van vallen in thuiswonende ouderen te verlagen. De Cochrane Bone, Joint and Muscle Trauma Group Specialised register, CENTRAL, Medline, EMBASE, CINAHL en online trial registers waren met relevante zoektermen doorzocht. Dezelfde zoekstrategie is gebruikt om de Cochrane review up te daten.
De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 2.923 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerde trials met interventies ter preventie van vallen in thuiswonende ouderen. Op basis van titel en abstract werden in eerste instantie 211 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 191 studies geëxcludeerd (zie exclusietabel), en 20 studies definitief geselecteerd.
Resultaten
Twintig onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De evidence-tabellen en beoordeling van individuele studiekwaliteit zijn opgenomen onder het tabblad Onderbouwing.
Referenties
- Clemson L, Fiatarone Singh MA, Bundy A, et al. Integration of balance and strength training into daily life activity to reduce rate of falls in older people (the LiFE study): randomised parallel trial. BMJ. 2012;345:e4547.
- Day L, Hill KD, Stathakis VZ, et al. Impact of tai-chi on falls among preclinically disabled older people. A randomized controlled trial. Journal of the American Medical Directors Association. 2015;16(5):420-6.
- Fairhall N, Sherrington C, Lord SR, et al. Effect of a multifactorial, interdisciplinary intervention on risk factors for falls and fall rate in frail older people: a randomised controlled trial. Age & Ageing. 2014;43(5):616-22.
- Gianoudis J, Bailey CA, Ebeling PR, et al. Effects of a targeted multimodal exercise program incorporating high-speed power training on falls and fracture risk factors in older adults: a community-based randomized controlled trial. Journal of Bone & Mineral Research. 2014;29(1):182-91.
- Gillespie LD, Robertson MC, Gillespie WJ, et al. Interventions for preventing falls in older people living in the community. Cochrane Database Syst Rev. 2012;(9):CD007146. doi: 10.1002/14651858.CD007146.pub3. Review. PubMed PMID: 22972103.
- Gleeson M, Sherrington C, Lo S, et al. Can the Alexander Technique improve balance and mobility in older adults with visual impairments? A randomized controlled trial. Clinical Rehabilitation. 2015;29(3):244-60.
- Iliffe S, Kendrick D, Morris R, et al. Multicentre cluster randomised trial comparing a community group exercise programme and home-based exercise with usual care for people aged 65 years and over in primary care. Health Technology Assessment (Winchester, England). 2014;18(49):vii-xxvii, 1-105.
- Kamei T, Kajii F, Yamamoto Y, et al. Effectiveness of a home hazard modification program for reducing falls in urban community-dwelling older adults: A randomized controlled trial. Japan Journal of Nursing Science: JJNS. 2015;12(3):184-97.
- Karlsson, MK, Vonschewelov T, Karlsson, C, et al. Prevention of falls in the elderly: A review. Scandinavian Journal of Public Health. 2013;41:442-54.
- Kim H, Yoshida H, Suzuki T. Falls and fractures in participants and excluded non-participants of a fall prevention exercise program for elderly women with a history of falls: 1-year follow-up study. Geriatrics & gerontology international. 2014;14(2):285-92.
- Lee HC, Chang KC, Tsauo JY, et al. Effects of a multifactorial fall prevention program on fall incidence and physical function in community-dwelling older adults with risk of falls. Archives of Physical Medicine & Rehabilitation. 2013;94(4):606-15, 15.e1.
- Moller UO, Kristensson J, Midlov P, et al. Effects of a one-year home-based case management intervention on falls in older people: a randomized controlled trial. Journal of Aging & Physical Activity. 2014;22(4):457-64.
- Palvanen M, Kannus P, Piirtola M, et al. Effectiveness of the Chaos Falls Clinic in preventing falls and injuries of home-dwelling older adults: a randomised controlled trial. Injury. 2014;45(1):265-71.
- Patil R, Uusi-Rasi K, Tokola K, et al. Effects of a Multimodal Exercise Program on Physical Function, Falls, and Injuries in Older Women: A 2-Year Community-Based, Randomized Controlled Trial. Journal of the American Geriatrics Society. 2015;63(7):1306-13.
- Perula LA, Varas-Fabra F, Rodriguez V, et al. Effectiveness of a multifactorial intervention program to reduce falls incidence among community-living older adults: a randomized controlled trial. Archives of Physical Medicine & Rehabilitation. 2012;93(10):1677-84.
- Pighills AC, Torgerson DJ, Sheldon TA, et al. Environmental assessment and modification to prevent falls in older people. J Am Geriatr Soc. 2011;59(1):26-33. doi: 10.1111/j.1532-5415.2010.03221.x. Erratum in: J Am Geriatr Soc. 2011;59(4):776. PubMed PMID: 21226674.
- Sherrington C, Whitney JC, Lord SR, et al. Effective exercise for the prevention of falls: a systematic review and meta-analysis. J Am Geriatr Soc. 2008;56(12):2234-43. doi: 10.1111/j.1532-5415.2008.02014.x. Review. PubMed PMID: 19093923.
- Suominen MH, Puranen TM, Jyväkorpi SK, et al. Nutritional guidance improves nutrient intake and quality of life, and may prevent falls in aged persons with Alzheimer disease living with a spouse (NuAD Trial). Journal of Nutrition, Health and Aging. 2015.
- Suttanon P, Hill KD, Said CM, et al. Feasibility, safety and preliminary evidence of the effectiveness of a home-based exercise programme for older people with Alzheimer's disease: a pilot randomized controlled trial. Clinical Rehabilitation. 2013;27(5):427-38.
- Taylor D, Hale L, Schluter P, et al. Effectiveness of tai chi as a community-based falls prevention intervention: a randomized controlled trial. Journal of the American Geriatrics Society. 2012;60(5):841-8.
- Tchalla AE, Lachal F, Cardinaud N, et al. Preventing and managing indoor falls with home-based technologies in mild and moderate Alzheimer's disease patients: pilot study in a community dwelling. Dementia & Geriatric Cognitive Disorders. 2013;36(3-4):251-61.
- Uusi-Rasi K, Patil R, Karinkanta S, et al. Exercise and vitamin D in fall prevention among older women: a randomized clinical trial. JAMA Internal Medicine. 2015;175(5):703-11.
- van Dijk SC, Sohl E, Oudshoorn C, et al. Non-linear associations between serum 25-OH vitamin D and indices of arterial stiffness and arteriosclerosis in an older population. Age Ageing. 2015;44(1):136-42. doi: 10.1093/ageing/afu095. PubMed PMID: 25038832.
- Yamada M, Higuchi T, Nishiguchi S, et al. Multitarget stepping program in combination with a standardized multicomponent exercise program can prevent falls in community-dwelling older adults: a randomized, controlled trial. Journal of the American Geriatrics Society. 2013;61(10):1669-75.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Exercises |
|||||||
|
Day, 2015 |
Type of study: RCT [parallel]
Setting: Disabled community-dwelling people
Country: Australia
Source of funding: Non-commercial |
Inclusion criteria:
N total at baseline: Intervention: 250 Control:253
Important prognostic factors2: Described for analysed population
Age category, n (%) I: 70-74 years: 69 (34) 75-79 years: 62 (30) 80-84 years: 50 (25) ≥85 years: 23 (11) C: 70-74 years: 64 (31) 75-79 years: 64 (31) 80-84 years: 56 (27) ≥85 years: 21 (10)
Sex: I: 30% M C: 30% M
Groups comparable at baseline? Yes |
Modified Sun style tai-chi and covered agility, mobility, balance, strength, breathing, and relaxation
Classes of 12-16 participants were held twice weekly for 60 minutes per class, for up to 24 weeks. |
Flexibility and stretching program, conducted primarily in the seated position
Classes of 12-16 participants were held twice weekly for 60 minutes per class, for up to 24 weeks. |
Length of follow-up: 24 weeks
Loss-to-follow-up: Intervention: N = 46 (18%) Reasons: refused fall calendars
Control: N = 48 (19%) Reasons: refused fall calendars
Incomplete outcome data: Intervention: N = 46 (18%) Reasons: refused fall calendars
Control: N = 48 (19%) Reasons: refused fall calendars |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 100 patient days
Number of fallers, risk ratio I: 38 (out of 204) C: 42 (out of 205) RR 0.91 (95%CI 0.61-1.35)
Rate of falls, rate ratio I: 56.7 (46.7-66.7) C: 60.6 (50.8-70.4) RR 0.94 (95%CI 0.63-1.38)
2. Fractures Not reported |
Not only community dwellers included, but also residents from retirement villages.
Follow-up lasted till 48 weeks; however, as not all participants could participate till 48 weeks due to budget limitations, only data from 24 weeks was considered. |
|
Gleeson, 2015 |
Type of study: RCT [parallel]
Setting: Participants’ homes
Country: Australia
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 60 Control: 60 Important prognostic factors2: Age ± SD: I: 74 (11) C: 74 (11)
Sex: I: 28% M C: 30% M
Groups comparable at baseline? Yes |
Alexander Technique lesson for 12 weeks in addition to usual care.
Lessons were typically 30 minutes in length. A lesson protocol was developed using everyday activities such as movements between sitting and standing, getting to and from the floor, and walking, climbing stairs and carrying everyday articles. |
Usual care provided by Guide Dog (see comment) |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 5 (7%) Reasons: 1 refusal, 4 withdrawals
Control: N = 4 (7%) Reasons: 2 deaths and 2 withdrawals
Incomplete outcome data: Intervention: N = 5 (7%) Reasons: 1 refusal, 4 withdrawals
Control: N = 4 (7%) Reasons: 2 deaths and 2 withdrawals |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 365 patient days
Number of fallers, risk ratio I: 25 (42) C: 27 (45) RR 0.93 (95%CI 0.61-1.39)
Number of falls per person years, rate ratio I1: 1.01 C: 1.49 RR 0.67 (95%CI 0.36-1.26)
2. Fractures Measured as the number of participants with a fracture related to a fall, n (%)
I: 1 (2) C: 2 (2) |
“Participants were recruited from the client database of a community organisation providing support for people with visual impairments in Sydney, Australia (Guide Dogs).”
Falls were collected through calendars over 12 months. Authors stated that the study was not powered to detect an effect on fall rates. |
|
Patil, 2015 |
Type of study: RCT [parallel]
Setting: Community
Country: Finland
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 205 Control: 204
Important prognostic factors2: Age ± SD: I: 74 (3) C: 74 (3)
Sex: I: 0% M C: 0% M
Groups comparable at baseline? Yes |
Exercise – Exercises classes twice a week for 12 months and once a week for the subsequent 12 months and home exercises |
Control – Current physical activity |
Length of follow-up: 24 months
Loss-to-follow-up: Intervention: N = 18 (9%) Reasons: 5 lost interest; 13 due to health reasons
Control: N = 21 (10%) Reasons; 6 lost interest; 10 due to health reasons; 4 died; 1 spouse unwell
Incomplete outcome data: Intervention: N = 18 (9%) Reasons: 5 lost interest; 13 due to health reasons
Control: N = 21 (10%) Reasons; 6 lost interest; 10 due to health reasons; 4 died; 1 spouse unwell |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 100 person years
Number of fallers, risk ratio I: 140 (68) C: 141 (69) RR 0.99 (95%CI 0.78-1.25)
Number of falls per person years, rate ratio I1: 233.8 C: 250.3 RR 1.00 (95%CI 0.79-1.26)
2. Fractures Measured as the number of participants with a fracture related to a fall, n (%)
I: 8 (4) C: 12 (6) RR 0.66 (95%CI 0.27-1.61) |
Data on falls was collected through monthly fall diaries. |
|
Gianoudis, 2014 |
Type of study: RCT [parallel]
Setting: Community
Country: Australia
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 81 Control: 81
Important prognostic factors2: Age ± SD: I: 67 (7) C: 67 (6)
Sex: I: 26% M C: 27% M
Groups comparable at baseline? Yes |
Osteo-cise: Strong Bones for Life multimodal exercise, osteoporosis education/awareness and behavioural change program |
Standard care self-management control group |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 5 (6%) Reasons: 1 death, 1 illness, 2 no time, 1 overseas
Control: N = 7 (9%) Reasons: 1 death; 1 illness, 5 lack of interest/other
Incomplete outcome data: Intervention: N = 5 (6%) Reasons: 1 death, 1 illness, 2 no time, 1 overseas
Control: N = 7 (9%) Reasons: 1 death; 1 illness, 5 lack of interest/other
|
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 365 patient days
Number of fallers, risk ratio I: 29 (36) C: 25 (31) RR 1.15 (95%CI 0.66-1.99)
Number of falls per person years, rate ratio I: 0.57 C: 0.42 RR 1.22 (95%CI 0.72-2.04)
2. Fractures Measured as the number of participants with a fracture related to a fall, n (%)
I: 1 (1) C: 0 (0) |
All participants were provided with and advised to take one vitamin D supplement and two calcium supplements each day throughout the study.
Data on falls were collected via monthly falls calendar. |
|
Kim, 2014 |
Type of study: RCT [parallel]
Setting: Community
Country: Japan
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 52 Control: 53
Important prognostic factors2: Age ± SD: I: 77 (4) C: 77 (4)
Sex: I: 0% M C: 0% M
Groups comparable at baseline? Yes |
Exercise – Group-based 60-min exercise class focusing on muscle strength and balance training twice a week for 3 months for a total of 24 sessions |
Education – 60-min class once a month for three months for a total of three times. The classes focused on undernutrition, cognitive function and oral hygiene. |
Length of follow-up: 1 year
Loss-to-follow-up: Intervention: N = 1 (2%) Reasons: 1 hip fracture
Control: N = 1 (2%) Reasons: 1 withdrew due to hospitalization
Incomplete outcome data: Intervention: N = 1 (2%) Reasons: 1 hip fracture
Control: N = 1 (2%) Reasons: 1 withdrew due to hospitalization |
1. Falls Measured as the number of fallers, n (%)
Number of fallers, risk ratio I: 10 (20) C: 21 (41) RR 0.49 (95%CI 0.25-0.93)
2. Fractures Measured as the number of participants with a fracture related to a fall, n (%)
I: 1 (2) C: 2 (4) |
Of all women aged 70 years or older, only 17% were included.
Fall were collected through diaries at the end of the one year follow-up. |
|
Lliffe, 2014 |
Type of study: RCT [parallel]
Setting: General practices
Country: United Kingdom
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention1: 411 Intervention2: 387 Control: 458
Important prognostic factors2: Only reported for the entire population together
Age (range): 73 (65-94)
Sex: 38% M
Groups comparable at baseline? Cannot be judged. |
1) Home-based Otago Exercise Programme (OEP) – 30 minutes of leg muscle strengthening and balance retraining exercises at home at least three times per week, and a walking plan for up to 30 minutes at a moderate pace two times per week for 24 weeks. 2) Community-based group exercise programme- 1-hour-long postural stability instructor-delivered group exercise class and two 30-minute home exercise sessions per week for 24 weeks. |
Usual care – participants were free to participate in any other non-trial-related exercise |
Length of follow-up: 18 months (6 month intervention and 12 follow-up)
Loss-to-follow-up: Intervention1: N = 158 (38%) Reasons: 27 at allocation; 13 GP excluded; 3 died; 43 through illness; 15 research burden; 17 other; 40 not known
Intervention2: N = 147 (38%) Reasons: 33 at allocation; 32 GP excluded; 3 died; 29 through illness; 12 research burden; 20 other; 18 not known
Control: N = 188 (41%) Reasons: 38 at allocation; 24 GP excluded; 4 died; 26 through illness; 30 research burden; 10 other; 56 not known
Incomplete outcome data: Intervention1: N = 158 (38%) Reasons: 27 at allocation; 13 GP excluded; 3 died; 43 through illness; 15 research burden; 17 other; 40 not known
Intervention2: N = 147 (38%) Reasons: 33 at allocation; 32 GP excluded; 3 died; 29 through illness; 12 research burden; 20 other; 18 not known
Control: N = 188 (41%) Reasons: 38 at allocation; 24 GP excluded; 4 died; 26 through illness; 30 research burden; 10 other; 56 not known |
1. Falls Measured as the rate of falls per 365 patient days
Number of falls per person years, rate ratio During intervention I1: 0.80 I2: 0.81 C: 0.87 I1 vs C: RR 0.93 (95%CI 0.64-1.37) I2 vs C: RR 0.91 (95%CI 0.54-1.52) Post intervention I1: 0.54 I2: 0.57 C: 0.71 I1 vs C: RR 0.76 (95%CI 0.53-1.09) I2 vs C: RR 0.74 (95%CI 0.55-0.99)
2. Fractures Not reported
|
Randomisation took place at the general practices level.
Statistical analyses were adjusted for effects of size, size of practice, deprivation of practice, and clustering due to practice |
|
Suttanon, 2013 |
Type of study: RCT [parallel]
Setting: Community
Country: Australia
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 19 Control: 21
Important prognostic factors2: Age ± SD: I: 83 (5) C: 80 (6)
Sex: I: 32% M C: 43% M
Groups comparable at baseline? Yes |
Exercise programme – standing balance and strengthening exercises and a graduated walking programme.
Participants and caregivers were encouraged to regular exercise (five days/week).
Participants in both groups continued with usual care and other activities while participating in their allocated programme. |
Control programme – education and information sessions on the topic of dementia and ageing.
Designed to provide the same number of home visits and phone calls as the exercise programme. |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 8 (42%) Reasons: 3 refused to continue; 3 moved to care facility; 1 hospitalisation; 1 passed away
Control: N = 3 (14%) Reasons: 2 refused to continue; 1 moved to care facility
Incomplete outcome data: Intervention: N = 8 (42%) Reasons: 3 refused to continue; 3 moved to care facility; 1 hospitalisation; 1 passed away
Control: N = 3 (14%) Reasons: 2 refused to continue; 1 moved to care facility |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 1000 patient days
Number of fallers, risk ratio I: 9 (47) C: 7 (33) RR 1.42 (95%CI: 0.66-3.06)
Number of falls per person years, rate ratio I: 3.10 C: 2.46 RR 1.00 (95%CI 0.42-2.39), adjusted for baseline measurements
2. Fractures Not reported |
Falls were reported by participants or caregivers at each of the home visits and follow-up phone calls. |
|
Yamada, 2013 |
Type of study: RCT [parallel]
Setting: Community
Country: Japan
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 132 Control: 132
Important prognostic factors2: Age ± SD: I: 76 (9) C: 77 (8)
Sex: I: 40% M C: 45% M
Groups comparable at baseline? Yes |
Multitarget stepping task combined twice a week for 24 weeks
30-minute physical exercise program (aerobic exercise, mild strength training and flexibility and balance exercises) |
Control – indoor walking program twice a week for 24 weeks
30-minute physical exercise program (aerobic exercise, mild strength training and flexibility and balance exercises) |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 20 (15%) Reasons: not stated
Control: N = 14 (11%) Reasons: not stated
Incomplete outcome data: Intervention: N = 20 (15%) Reasons: not stated
Control: N = 14 (11%) Reasons: not stated |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 365 patient days
Number of fallers, risk ratio I: 13 (12) C: 39 (33) RR 0.33 (95%CI: 0.19-0.60)
Number of falls per person years, rate ratio I: Not reported C: Not reported RR 0.35 (95%CI 0.19-0.66)
2. Fractures Measured as the number of participants with a fracture related to a fall, n (%)
I: 3 (3) C: 13 (11) RR 0.22 (95%CI: 0.06-0.80) |
No participant in either group received any specific instructions regarding activities undertaken outside the program or during the follow-up year.
Data on falls were collected through monthly diaries.
Fractures were ascertained through radiological evidence of fracture. |
|
Clemson, 2012 |
Type of study: RCT [parallel] Setting: Residents in metropolitan area
Country: Australia
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention1: 107 Intervention2: 105 Control: 105
Important prognostic factors2: Age ± SD: I1: 82 (4) I2: 84 (4) C: 83 (4)
Sex: I1: 45% M I2: 46% M C: 45% M
Groups comparable at baseline? Yes |
1: LIFE programme Movements specifically prescribed to improve balance or increase strength embedded within everyday activities
2: Structured exercise Seven exercises for balance and six for lower limb strength using ankle cuff weights; three times a week
Both interventions programs were taught over five sessions with two booster sessions and two follow-up phone calls over a six month period. |
Control (gentle exercise) 12 gentle and flexibility exercises while seated, lying down, or standing while holding on.
Exercises were taught over two sessions with one booster sessions and six follow-up phone calls. |
Length of follow-up: 12 months Loss-to-follow-up: Intervention1: N = 8 (7%) Reasons: 1 deceased; 1 too ill; 1 terminal illness; 2 injury or pain attributed to exercise; 2 partner need; 1 declined.
Intervention2: N = 9 (9%) Reasons: 3 deceased; 2 too ill; 1 terminal illness; 2 injury or pain attributed to exercise; 1 declined
Control: N = 14 (13%) Reasons: 3 deceased; 5 too ill; 2 terminal illness; 1 partner need; 3 declined
Incomplete outcome data: Intervention1: N = 8 (7%) Reasons: 1 deceased; 1 too ill; 1 terminal illness; 2 injury or pain attributed to exercise; 2 partner need; 1 declined.
Intervention2: N = 9 (9%) Reasons: 3 deceased; 2 too ill; 1 terminal illness; 2 injury or pain attributed to exercise; 1 declined
Control: N = 14 (13%) Reasons: 3 deceased; 5 too ill; 2 terminal illness; 1 partner need; 3 declined |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 365 patient days
Number of fallers, risk ratio I1: 60 I2: 65 C: 71 I1 vs C: RR 0.83 (95%CI 0.67-1.03) I2 vs C: RR 0.92 (95%CI 0.75-1.12)
Number of falls per person years, rate ratio I1: 1.66 I2: 1.90 C: 2.28 I1 vs C: RR 0.69 (95%CI 0.48-0.99) I2 vs C: RR 0.81 (95%CI 0.56-1.17)
2. Fractures Not reported |
Potential limitations discussed by authors: The control group received less contact time than both interventions, which could have caused a bias, but we saw no difference in the return rates of fall surveillance diaries, so this is unlikely.
The control group had an intervention that could have diluted the effect of the outcomes. Since the control exercises were gentle, flexible, mostly non-weightbearing, and not upgraded by the therapists, their effect on fall reduction or balance would have been marginal, although we did observe some minimal strength improvements. |
|
Freiberger, 2012 |
Type of study: RCT [parallel]
Setting: Community
Country: Germany
Source of funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention1: 63 Intervention2: 64 Intervention3: 73 Control: 80
Important prognostic factors2: Age ± SD: I1: 76 (4) I2: 75 (4) I3: 75 (4) C: 76 (4)
Sex: I1: 52% M I2: 64% M I3: 56% M C: 54% M
Groups comparable at baseline? Yes |
1) Strength and balance 2) Fitness (endurance training) 3) Multifaceted (fall risk education)
All lasting 16 weeks and including two 1-hour sessions per week. All interventions included strength and balance exercises. |
No intervention |
Length of follow-up: 24 months
Loss-to-follow-up: Intervention1: N = 14 (22%) Reasons: Not stated Intervention2: N = 16 (25%) Reasons: Not stated Intervention3: N= 15 (18%) Reasons: Not stated
Control: N = 28 (35%) Reasons: Not stated
Incomplete outcome data: Intervention1: N = 14 (22%) Reasons: Not stated Intervention2: N = 16 (25%) Reasons: Not stated Intervention3: N= 15 (18%) Reasons: Not stated
Control: N = 28 (35%) Reasons: Not stated |
1. Falls Measured as the number of falls
Number of falls, rate ratio I1: 74 I2: 51 I3: 90 C: 82 I1 vs C: RR 0.97 (95%CI 0.58-1.62) I2 vs C: RR 0.68 (95%CI 0.40-1.16) I3 vs C: RR 0.94 (95%CI: 0.58-1.53)
2. Fractures Not reported |
Participants were recruited from a health insurance company membership database, which includes approximately 25% of the population.
Data on falls were collected monthly via fall calendars. |
|
Taylor, 2012 |
Type of study: RCT [parallel]
Setting: Community
Country: New Zealand
Source of funding: Commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention1: 233 Intervention2: 220 Control: 231
Important prognostic factors2: Age ± SD: I1: 75 (7) I2: 74 (6) C: 73 (6)
Sex: I1: 31% M I2: 25% M C: 24% M
Groups comparable at baseline? Yes
|
1) Tai chi once a week 2) Tai chi twice a week for 20 weeks in a group setting |
Low-level exercise program for 20 weeks |
Length of follow-up: intervention for 20 weeks followed by 12 months follow-up
Loss-to-follow-up: Intervention1: N = 53 (23%) Reasons: 42 partially returned, 11 no returns of the calendars
Intervention2: N = 46 (21%) Reasons: 36 partially returned, 10 no returns of the calendars
Control: N = 57 (25%) Reasons: 40 partially returned, 17 no returns of the calendars
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 365 patient days
Number of fallers, risk ratio I1: 132 (60) I2: 111 (53) C: 140 (65) I1 vs C: RR 0.83 (95%CI 0.67-1.03) I2 vs C: RR 0.92 (95%CI 0.75-1.12)
Number of falls per person years, rate ratio I1: 1.55 (1.23-1.97) I2: 1.16 (0.92-1.48) C: 1.38 (1.24-1.53) I1 vs C: RR 1.13 (95%CI 0.87-1.45) I2 vs C: RR 0.84 (95%CI 0.64-1.11)
2. Fractures Measured as the number of participants with a fracture related to a fall, n (%)
I: 1 (1) C: 0 (0) |
Falls were collected through monthly falls calendars. |
|
Fluid or nutrition therapy |
|||||||
|
Suominen, 2015 |
Type of study: RCT [parallel]
Setting: Persons with Alzheimer disease living with a spouse
Country: Finland
Source of funding: Commercial and industry |
Inclusion criteria:
N total at baseline: Intervention: 50 Control: 44
Important prognostic factors2: Reported for analysed population (I: 40 and C: 38 participants) Age ± SD: I: 78 (6) C: 76 (6)
Sex: I: 53% M C: 47% M
Groups comparable at baseline? Yes |
Tailored nutritional guidance with home visits during one year |
Written guide about nutrition in older adults and all community-provided normal care |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 10 (20%) Reasons: 1 moved to another city; 3 long-term care; 3 died; 3 food records not received
Control: N = 11 (22%) Reasons: 4 refusals; 1 long-term care; 1 died; 5 food records not received
Incomplete outcome data: Intervention: N = 10 (20%) Reasons: 1 moved to another city; 3 long-term care; 3 died; 3 food records not received
Control: N = 11 (22%) Reasons: 4 refusals; 1 long-term care; 1 died; 5 food records not received |
1. Falls Measured as the rate of falls per 365 patient days
Number of falls per person year, rate ratio I: 0.55 (95%CI: 0.34-0.83) C: 1.39 (95%CI: 1.04-1.82) RR 3.74 (95%CI 2.16-6.46)*, adjusted for age, sex and MMSE
2. Fractures Not reported |
*Calculated with the intervention group as reference. This results could because of adjustment for age, sex and MMSE not be included in the meta-analysis.
Authors did not stated how data on falls was collected. |
|
Vitamin D |
|||||||
|
Uusi-Rasi, 2015 |
Type of study: RCT [parallel]
Setting: home-dwelling women
Country: Finland
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 102 Control: 102
Important prognostic factors2: Age ± SD: I: 74 (3) C: 74 (3)
Sex: I: 0% M C: 0% M
Groups comparable at baseline? Yes |
Vitamin D3 (800 IU/d) for 24 months |
Placebo |
Length of follow-up: 24 months
Loss-to-follow-up: Intervention: N = 14 (14%) Reasons: 4 lost interest; 7 health reasons; 1 spouse illness; 2 died
Control: N = 7 (7%) Reasons: 2 lost interest; 3 health reasons; 2 died
Incomplete outcome data: Intervention: N = 14 (14%) Reasons: 4 lost interest; 7 health reasons; 1 spouse illness; 2 died
Control: N = 7 (7%) Reasons: 2 lost interest; 3 health reasons; 2 died |
1. Falls Measured as the rate of falls per 100 person-years
Number of falls per 100 person-years, rate ratio I: 132.1 C: 118.2 RR 1.08 (95%CI: 0.78-1.52)
2. Fractures Not reported |
NB: same population as Patil, 2015
The number of falls was obtained from prospective fall diaries returned monthly via mail, and details of each registered fall were ascertained by a telephone call. |
|
Environment/ assistive technology |
|||||||
|
Kamei, 2015 |
Type of study: RCT [parallel]
Setting: Community
Country: Japan
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 67 Control: 63
Important prognostic factors2: Age ± SD: I: 75 (7) C: 75 (6)
Sex: I: 16% M C: 14% M
Groups comparable at baseline? Yes |
Home Hazard modification education program (HHMP) (weekly for 2 hours for a total of four weeks)
Week 1: Education: elder’s fall and safety + exercise program Week 2: Education: food and nutrition + exercise program Week 3: Education and practice home hazard self-modification program (HHMP) using mock up and equipment + exercise program Week 4: Education and practices: foot self-care + exercise program |
Control program (weekly for 2 hours for a total of four weeks)
Week 1: Education: elder’s fall and safety + exercise program Week 2: Education: food and nutrition + exercise program Week 3: Education: aging and health + exercise program Week 4: Education and practices: foot self-care + exercise program |
Length of follow-up: 52 weeks
Loss-to-follow-up: Intervention: N = 11 (16%) Reasons: Not stated
Control: N = 9 (14%) Reasons: Not stated
Incomplete outcome data: Intervention: N = 11 (16%) Reasons: Not stated
Control: N = 9 (14%) Reasons: Not stated |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 365 patient days
Number of fallers, risk ratio I: 15 (22) C: 21 (33) RR 0.67 (95%CI: 0.38-1.18)
Number of falls per person years, hazard ratio I: Not reported C: Not reported RR 0.59 (95%CI: 0.31-1.15)
2. Fractures Only reported for indoor falls |
Falls were monitored prospectively using a daily falls calendar and self-report. Moreover, participants were interviewed twice: once at the 12 week follow-up as a midterm evaluation and then again at 52 weeks for the 1 year evaluation. |
|
Tchalla, 2013 |
Type of study: Minimized trial [parallel]
Setting: Community
Country: France
Source of funding: Not stated |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 49 Control: 47
Important prognostic factors2: Age ± SD: I: 87 (7) C: 85 (6)
Sex: I: 23% M C: 23% M
Groups comparable at baseline? Yes |
Home-based technologies coupled with teleassistance service (a nightlight path for preventing falls at home)
All participants undertook a fall reduction program following the initial Comprehensive Gerontological Assessment |
All participants undertook a fall reduction program following the initial Comprehensive Gerontological Assessment |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 4 (8%) Reasons: 2 died; 2 admissions to institution
Control: N = 4 (9%) Reasons: 1 died; 3 admissions to institution
Incomplete outcome data: Intervention: N = 4 (8%) Reasons: 2 died; 2 admissions to institution
Control: N = 4 (9%) Reasons: 1 died; 3 admissions to institution |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 365 patient days
Number of fallers, odds ratio I: 15 (22) C: 21 (33) OR 0.37(95%CI: 0.15-0.88) adjusted for six variables (unclear which)
Cumulative incidence of falls I: 32.7% (95%CI: 21.2-46.6) C: 63.8% (95%CI: 49.5-76.0)
2. Fractures Not stated |
Because of the calculated OR and cumulative incidence these results could not be pooled with the data from the other trials.
Falls were collected by GPs and caregivers. |
|
Multifactorial interventions |
|||||||
|
Fairhall, 2014 |
Type of study: RCT [parallel]
Setting: Community
Country: Australia
Source of funding: Non-commercial |
Inclusion criteria:
N total at baseline: Intervention: 120 Control: 121
Important prognostic factors2: Age ± SD: I: 83 (6) C: 83 (6)
Sex: I: 33% M C: 32% M
Groups comparable at baseline? Yes |
Multifactorial, interdisciplinary intervention – Targeting frailty characteristics with an individualised home exercise programme prescribed in 10 home visits from a physiotherapist and interdisciplinary management of medical, psychological and social problems.
Participants also received usual care. |
Control – Usual care available to older residents from community services and their general practitioner |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 13 (11%) Reasons: 12 died; 1 withdrew
Control: N = 12 (10%) Reasons: 10 died; 2 withdrew
Incomplete outcome data: Intervention: N = 13 (11%) Reasons: 12 died; 1 withdrew
Control: N = 12 (10%) Reasons: 10 died; 2 withdrew |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 365 patient days
Number of fallers, risk ratio I: 72 (60) C: 67 (55) RR 1.08 (95%CI 0.87-1.35)
Number of falls per person, rate ratio I: 1.54 C: 1.50 RR 1.12 (95%CI 0.78-1.63)
2. Fractures Measured as the number of participants with a fracture related to a fall, n (%)
I: 13 (11) C: 12 (10) RR 1.09 (95%CI: 0.52-2.30) |
Authors of the paper were employee at an insurance company.
Data on falls were collected through monthly calendars and follow-up telephone calls. |
|
Moller, 2014 |
Type of study: RCT [parallel]
Setting: Urban and rural
Country: Sweden
Source of funding: Non-commercial |
Inclusion criteria:
N total at baseline: Intervention: 80 Control: 73
Important prognostic factors2: Age ± SD: I: 81 (6) C: 81 (7)
Sex: I: 35% M C: 31% M
Groups comparable at baseline? No, less participants fell in the last 3 months |
1 Case management 2 General information (e.g. exercise, nutrition, social activities, healthy system and other) 3 Specific information (participant’s individual needs, medication, and more) 4 Safety and continuity
At least one home visit per month for twelve months |
Control |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 24 (30%) Reasons: unclear
Control: N = 21 (29%) Reasons: unclear
Incomplete outcome data: Intervention: N = 24 (30%) Reasons: unclear
Control: N = 21 (29%) Reasons: unclear |
1. Falls Measured as the number of fallers, n (%)
Number of fallers, risk ratio I: 43 (54) C: 35 (48) RR 1.12 (95%CI 0.82-1.53)
2. Fractures Not reported |
After the pilot study, the intervention was expanded in 2008 by also employing two physiotherapists. 61 of 80 participants from the intervention group also received visitors from physiotherapists.
Data on falls was collected every three months. |
|
Palvanen, 2014 |
Type of study: RCT [parallel]
Setting: Fall prevention clinics
Country: Finland
Source of funding: Non-commercial |
Inclusion criteria:
At least one of the following risk factors for falls and injuries:
Exclusion criteria:
N total at baseline: Intervention: 661 Control: 653
Important prognostic factors2: Age ± SD: I: 77 (6) C: 77 (6)
Sex: I: 14% M C: 14% M
Groups comparable at baseline? Yes |
Multifactorial, individualized 12-month falls prevention program concentrating on strength and balance training, medical review and referrals, medication review, proper nutrition (calcium, vitamin D), and home hazard assessment and modification. Individually tailored preventive measures judged necessary at the baseline assessment. |
Control group – a general injury prevention brochure
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 72 (11%) Reasons: 35 illness/sickness; 31 refusal to continue; 3 died; 3 other reason
Control: N = 97 (15%) Reasons: 54 illness/sickness; 29 refusal to continue; 8 died; 4 moved; 2 other reason
Incomplete outcome data: Intervention: N = 72 (11%) Reasons: 35 illness/sickness; 31 refusal to continue; 3 died; 3 other reason
Control: N = 97 (15%) Reasons: 54 illness/sickness; 29 refusal to continue; 8 died; 4 moved; 2 other reason |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 100 person years
Number of fallers, risk ratio I: 296 (45) C: 349 (53) RR 0.84 (95%CI 0.75-0.94)
Number of falls per 100 person years, rate ratio I: 95 C: 131 RR 0.72 (95%CI 0.61-0.86)
2. Fractures Measured as the number of participants with a fracture related to a fall, n (%)
I: 33 (5) C: 42 (6) RR 0.78 (95%CI: 0.50-1.21) |
The Chaos Clinic professionals (who were not blinded to group allocation, as noted above) recorded the number of falls and fall-related injuries in three month intervals, by phone interview at 3 and 9 months, and at the follow-up visit at the Clinic at 6 and 12 months. |
|
Lee, 2013 |
Type of study: RCT [parallel]
Setting: Community
Country: Taiwan
Source of funding: Non-commercial |
Inclusion criteria:
Fulfilled 1 of the following criteria:
Exclusion criteria:
N total at baseline: Intervention: 313 Control: 303
Important prognostic factors2: Age ± SD: I: 75 (7) C: 76 (7)
Sex: I: 53% M C: 56% M
Groups comparable at baseline? Yes |
Intervention group – A risk-based multifactorial fall prevention program including exercise intervention, health education, and home hazards evaluation/modification, along with medication review and referral to an ophthalmologist or other specialists. |
Control group – health education brochures, along with medication review and medical referrals without direct exercise training and structures health education classes. |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 22 (7%) Reasons: not stated
Control: N = 25 (8%) Reasons: not stated
Incomplete outcome data: Intervention: N = 22 (7%) Reasons: not stated
Control: N = 25 (8%) Reasons: not stated |
1. Falls Measured as the number of fallers, n (%) and the rate of falls per 365 patient days
Number of fallers, risk ratio I: 86 (28) C: 84 (28) RR 0.99 (95%CI 0.77-1.28)
Number of falls per person year, rate ratio I: 0.41 C: 0.44 RR 0.94 (95%CI 0.73-1.21)
2. Fractures Not reported |
The participants in each group were contacted monthly through phone calls or outpatient department visits, whenever available, regarding fall occurrence, fall-related circumstances, and consequences for up to 12 months. For those who were cognitively impaired or unable to express themselves clearly, their primary caregivers were interviewed concurrently to confirm the information. |
|
Perula, 2012 |
Type of study: RCT [parallel]
Setting: Health centers
Country: Spain
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 133 Control: 271
Important prognostic factors2: Age ± SD: I: 76 (4) C: 76 (5)
Sex: I: 41% M C: 50% M
Groups comparable at baseline? Yes |
Multifactorial – individual advice, information leaflet, physical exercise workshop, and home visits |
Control group – a brief piece of advice at the consultation on falls prevention and an information leaflet and received the usual clinical care in their health center. |
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: N = 12 (9%) Reasons: 4 voluntary departures; 3 not found in the time of assessment; 2 illnesses unrelated to falls; 2 changes of address and location; 1 died
Control: N = 13 (5%) Reasons: 4 discontinued interventions; 2 voluntary departures; 1 not found in the time of assessment; 2 illnesses unrelated to falls; 2 changes of address and location; 2 died
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe) |
1. Falls Measured as the rate of falls
Number of falls over a year, rate ratio I: 17% C: 24% RR 0.73 (95%CI 0.48-1.12)
2. Fractures Not reported |
Data on falls was collected through a questionaire |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Exercise |
||||||||
|
Day, 2015 |
“Participants were randomized by the study statistician using a computerized random number generator. |
Likely. “The allocation list was e-mailed directly to the exercise program administrator who managed exercise class delivery, independent of the data collectors.” |
Likely |
Likely |
Unlikely. “The interviewer was blind to group assignment.” |
Unlikely. Trial was registered during enrolment. |
Unclear. Similar number of participants refused to return fall calendar, except the reasons for refusal were not clear. |
Unclear. Not stated. |
|
Gleeson, 2015 |
“[…] were then block-randomized (block permutation size 1, 2 and 4) using a computer generated list from […] kept by a separate centre-based investigator who had no contact with the participants.” |
Unlikely. List was kept separate from participants. |
Likely |
Likely |
Unlikely. “All outcome assessors remained masked to group allocation for all assessments and participants were asked not to reveal their allocation status.” |
Unlikely. Trial protocol prospectively registered and outcomes are reported in paper. |
Unlikely. Although twice as many participants withdrew in the intervention group, the numbers are very low (4 versus 2) |
Unlikely. “Data were analysed on an intention to treat basis.” |
|
Patil, 2015 |
“Participants were randomly assigned to an exercise or control group.” |
Unclear. Not stated |
Likely |
Likely |
Unclear. Not stated. |
Unclear. Trial was registered but this analyse was not stated. |
Unlikely. Similar number of dropouts for similar reasons. |
Unlikely. Analysed intention to treat |
|
Gianoudis, 2014 |
“Participants were randomized to one of the two groups, stratified by sex, by an independent staff member not involved in the study using a computer generated random numbers table.” |
Unclear. Not stated |
Likely |
Likely |
Unclear. Not stated. |
Unclear whether the trial was registered. |
Unlikely. Although more participants from the control group, dropped out because of lack of interest, this most likely would not affect the results. |
Unlikely. “All data were analysed on an intention-to-treat basis; ie, data from all participants were included in the analyses regardless of compliance.” |
|
Kim, 2014 |
“[…] based on computer generated random numbers, […]” |
Unlikely. “The randomization procedure was blinded, […]” |
Likely |
Likely |
Unclear. Only stated that the investigators evaluating the effects of the exercise treatment were blind to interventions allocations. |
Unclear whether the trial was registered. |
Unlikely. One participant in each arm was lost to follow-up |
Unclear, not stated |
|
Llife, 2014 |
“[…] using computer-generated random number tables, embedded in a computer for minimisation.” Minimisation on trial centre, practice size and index of multiple deprivation. |
Unlikely. “Practices were allocated to intervention or usual care, only after all participants had been recruited. The practices, their patients and the researchers undertaking baseline assessments were all blinded to allocation until this point. “ |
Likely |
Likely |
Likely. “Researchers assessing outcomes were not blinded for pragmatic reasons alone; […]” |
Unclear. Trial was registered, however, this was done retrospectively. |
Unlikely. Used the method described by Gillespie to evaluate this, because there is a large number of lost-to-follow-up. |
Unlikely. Data were analysed intention to treat. |
|
Suttanon, 2013 |
“[…], using a concealed randomization procedure. A random numbers table with group allocation was computer-generated by one of the research team who was not involved in assessments or interventions.“ |
Unlikely. “These allocations were placed in opaque sealed envelopes. Following, baseline assessment, the next numbered envelope was opened by another researcher who took no part in the assessments, […].” |
Likely |
Likely |
Unclear, not stated |
Unlikely. Trial was registered before start of enrolment and outcomes were reported in publication |
Likely. More participants were lost to follow-up in the intention group |
Unclear. Not clearly stated. |
|
Yamada, 2013 |
“Randomized controlled trial” According to the trial registration stratified and block randomization were used. |
Unclear, not stated |
Likely |
Likely |
Unclear, not stated for the outcome falls |
Unlikely. Trial was registered before start of enrolment and outcomes were reported in publication |
Unclear, reasons for withdrawal were not reported |
Unclear, not reported |
|
Clemson, 2012 |
“Randomisation done by computer generated random blocks, stratified by sex and fall history and concealed by an independent secure website.” |
Unlikely. “The randomisation […] and concealed by using an automated secure website that was operated by an off-site independent service.” |
Likely |
Likely |
Unlikely. “A research assistant blinded to group allocation telephoned participants if they failed to return the calendar to ascertain whether they had fallen. “ |
Unlikely. Trial was registered before start of enrolment and outcomes were reported in publication |
Unlikely. Small number of lost to follow-up with fairly similar reasons. |
Unlikely. “We did a ‘complete case’ intention to treat analysis.” |
|
Freiberger, 2012 |
“[…] were randomly assigned […]” |
Unlikely. “All randomizations were concealed. (A third party not involved in the study applied a computerized random-number generator.” |
Likely |
Likely |
Unlikely. “Outcome assessors were blinded to group assignment.” |
Unclear. Trial not registered |
Unclear. Number of lost to follow-up were different, unclear for what reasons. |
Unlikely. “All analyses were performed according to a modified intention-to-treat design. “ |
|
Taylor, 2012 |
“[…], participants were randomly assigned to one of the three arms using a central, Web-based, computer-generated blocked random number system.” |
Unlikely. “At the end of the baseline assessment, each participant was given a sealed opaque envelope containing group allocation details and was instructed to open the envelope after leaving the assessment venue and not to discuss the assignment with any of the assessors.” |
Likely |
Likely |
Unlikely. “[…], assessors blinded to group allocation collected data related to any falls over the telephone.” |
Likely. Trial was registered with the mention of a secondary outcome health quality of life. Results for this outcome were not reported. |
Unclear. Similar number of participants dropped out but the reasons are unclear. It is only stated that the fall calendars were not returned. |
Unclear, not stated |
|
Fluid or nutrition therapy |
||||||||
|
Suominen, 2015 |
“[…] were randomly allocated to the intervention and control groups according to a computer-generated, blocked randomisation list. The block size was six, […]” |
Unlikely. “A person unrelated to the investigation and unfamiliar with the procedure performed the randomisation.” |
Likely |
Likely |
Unclear. Not stated how data on falls were assessed |
Unclear. Authors do not state whether the trial was registered. |
Unlikely. Although reasons for lost to follow-up were slightly different, these differences could most likely not explain the results on the rate of falls. |
Likely. Only participants with follow-up were included. |
|
Vitamin D |
||||||||
|
Uusi-Rasi, 2015 |
“[…] were randomly assigned to 1 of 4 groups using a computer-generated list based on simple randomization with random allocation sequence to ensure equal group sizes.” |
Unclear. Not stated |
Unlikely. Placebo was used. |
Unlikely. Placebo was used. |
Unlikely. “Assessors were blinded to group assignments.” |
Unlikely. Trial was registered. Outcomes are reported. |
Likely. Reasons for lost to follow-up different and could have influenced the results. |
Unlikely. Stated that data was analysed intention to treat. |
|
Environment/ assistive technology |
||||||||
|
Kamei, 2015 |
“Research assistants allocated participants randomly into either the HHMP group or the control group and without the presence of the researchers.” |
Unclear. Not stated |
Likely |
Likely |
Unclear. Not stated |
Unclear. Not mentioned whether the trial was registered. |
Unclear. Number of participants who withdrew was reported and less than 20% in each arm. However, the reasons for withdrawal are not stated. |
Unlikely. Stated that analyses were undertaken on the basis of intention to treat. |
|
Tchalla, 2013 |
“[…] involved dyanamic random allocation using a minimization (criteria: age, sex, fall history in previous 12 months and MMSE scale) […]” |
Unclear. Not stated |
Likely |
Likely |
Unclear. Not stated |
Unclear. Not mentioned whether the trial was registered. |
Unlikely. Few participants were lost to follow-up with similar reasons |
Unclear. Not stated. |
|
Multifactorial interventions |
||||||||
|
Fairhall, 2014 |
“[…] research staff randomised participants to the intervention or control group, with stratification by degree of frailty […].” |
Unclear. “The group allocation schedule was generated and managed by an investigator independent of participant recruitment, using a computer-generated random number schedule with varying block sizes.” |
Likely |
Likely |
Unclear. Not stated |
Likely. Trial was registered. Falls was not defined as a primary or secondary outcome. |
Unlikely. Few participants were lost to follow-up with similar reasons |
Unclear. Not stated. |
|
Moller, 2014 |
“[…] participants were consecutively randomized by using sealed envelopes containing information about group allocation to the intervention group or a control group.” |
Unclear. “[…] participants were consecutively randomized by using sealed envelopes containing information about group allocation to the intervention group or a control group.” |
Likely |
Likely |
Likely. “[The data collection] was not blinded due to the nature of the intervention.” |
Likely. Trial was registered after completion of the trial. |
Unclear. Similar proportion of participants were lost to follow-up. The flow diagram is not clear about reasons for lost to follow-up. |
Unlikely. “[…] analyses according to the intention-to-treat principle using last observation carried forward as the imputation technique […]” |
|
Palvanen, 2014 |
“Randomisation was stratified by gender, age group and study clinic. Within each of these eight strata, randomly varying block size of 6, 8, or 12 was used to ensure the equality of group sizes. The randomisation schedule for each stratum was generated by a statistician who was not a part of the research team.” |
Unlikely. “[…] by sealed opaque envelopes. […] Group allocation remained fully concealed until opening of the envelope.” |
Likely. “[…] it was not possible to blind the participants of the Chaos Clinic professionals.” |
Likely. “[…] it was not possible to blind the participants of the Chaos Clinic professionals.” |
Likely. “The Chaos Clinic professionals (who were not blinded to group allocation, as noted above) recorded the number of falls and fall-related injuries in three month intervals, by phone interview at 3 and 9 months, and at the follow-up visit at the Clinic at 6 and 12 months.” |
Unlikely. Trial was registered with primary outcomes stated online reported in the paper. |
Likely. More participants in the control group were lost due to illness/sickness. Meaning the intervention group may potentially be ‘healthier’. |
Unlikely. “The data was analyzed on an intention-to-treat basis, using the data for all randomized participants. Follow-up time for falls, fallers and fall-induced injuries were calculated from the day of randomization to the end of the study period (12 months) or until participants died or withdrew the study.” |
|
Lee, 2013 |
“All randomizations were concealed through a computerized random number generator or lottery drawing dependent on the regular practice pattern of each study center.” |
Unclear. Not stated |
Likely |
Likely |
Unclear not stated. |
Unclear. Not mentioned whether the trial was registered. |
Unclear. Reasons for lost to follow-up not stated |
Unlikely. Analysed intention to treat. |
|
Perula, 2012 |
“[…] randomized by cluster at 2 parallel arms in a ratio of 1:2 and stratified by type of health center (urban and rural).” |
Unclear. Not stated. |
Likely |
Likely |
Unclear not stated. |
Unclear. Not mentioned whether the trial was registered. |
Unlikely. Few participants were lost to follow-up for similar reasons |
Unlikely. “[…], on an intention-to-treat basis.” |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusie na het lezen van het volledige artikel
|
Auteur en jaar |
Redenen van exclusie |
|
Exercises |
|
|
-, 2012 |
Conference report |
|
-, 2014 |
Editorial |
|
-, 2015 |
Studieprotocol van een lopende studie http://www.nets.nihr.ac.uk/projects/phr/1218107 |
|
Abreu, 2014 |
Betreft meting van een marker voor spiersterkte; geen relevante uitkomstmaten gerapporteerd |
|
Actrn., 2014 |
Trial registratie van een lopende trial https://www.anzctr.org.au/Trial/Registration/TrialReview.aspx?id=366245&isReview=true |
|
Ada, 2013 |
Patiënten met een beroerte |
|
Alfieri, 2012 |
Geen vergelijkende groep |
|
Almeida, 2013 |
Patiënten met een laag SES |
|
Ansai, 2015 |
Betreft de oudste ouderen populatie |
|
Ball, 2013 |
Geen vergelijkende groep; alleen voor en na meting gedaan (geen RCT) |
|
Barker, 2015 |
Review; interventie Pilates |
|
Batchelor, 2012 |
Therapietrouw aan de interventie |
|
Bhatt, 2012 |
Onderzochte vergelijking betreft de frequentie van de interventie |
|
Bolton, 2012 |
Relevante uitkomstmaten niet gerapporteerd |
|
Broska, 2013 |
Niet-gerandomiseerd onderzoek |
|
Buffart, 2015 |
Relevante uitkomstmaten niet gerapporteerd |
|
Burton, 2015 |
Review; patiënten met dementie |
|
Canning, 2015 |
Patiënten met Parkinson |
|
Chan, 2015 |
Review; gezocht tot juli 2013 |
|
Clemson, 2012 |
Zelfde als 507 |
|
Dargent-Molina, 2013 |
Studie protocol |
|
El-Khoury, 2013 |
Review |
|
Franco, 2014 |
Beschrijving van een review |
|
Franklin, 2013 |
Review |
|
Freiberger, 2013 |
Relevante uitkomstmaten niet gerapporteerd |
|
Freiberger, 2012 |
Reeds geincludeerd in Cochrane review |
|
Freiberger, 2013 |
Conference abstract |
|
Gleeson, 2014 |
Review |
|
Grabiner, 2012 |
Effect van een interventie na een lab geinduceerde trip |
|
Harro, 2014 |
Patiënten met Parkinson |
|
Hill, 2015 |
Review; home-based exercise |
|
Horne, 2014 |
Overtuigingen ten aanzien van val(risico) |
|
Ishigaki, 2014 |
Review |
|
Jimenez-Martin, 2014 |
Review |
|
Kamide, 2015 |
Letter to the editor |
|
Kim, 2012 |
Geen relevante uitkomstenmaten gerapporteerd |
|
Kovacs, 2013 |
Geen relevante uitkomstenmaten gerapporteerd |
|
Kristinsdottir, 2014 |
Niet gerandomiseerd onderzoek |
|
Kumar, 2014 |
Review |
|
Kwok, 2014 |
Deelnemers konden de interventie kiezen |
|
Li, 2012 |
Patiënten met Parkinson |
|
Li, 2013 |
Implementatie van valpreventie programma |
|
Liston, 2014 |
Geen relevante uitkomstmaten gerapporteerd |
|
Loftus, 2014 |
Niet gerandomiseerd onderzoek |
|
Lurie, 2013 |
Pilot trial |
|
Manckoundia, 2014 |
Niet gerandomiseerd onderzoek |
|
Mansfield, 2015 |
Review; pertubation-based exercises |
|
Martin, 2013 |
Review |
|
Mat, 2015 |
Review; patiënten met knie artrose |
|
Mulligan, 2014 |
Review |
|
Pai, 2014 |
Frequentie van training |
|
Pata, 2014 |
Geen vergelijkende groep |
|
Paul, 2014 |
Patiënten met Parkinson |
|
Pitkala, 2013 |
Interventie gericht op fysiek functioneren; patiënten met Alzheimer http://archinte.jamanetwork.com/article.aspx?articleid=1678811 |
|
Roaldsen, 2014 |
Relevante uitkomstmaten niet gerapporteerd |
|
Sakamoto, 2013 |
Na randomisatie werd pas de inclusive en exclusiecriteria nagelopen |
|
Schleicher, 2012 |
Review |
|
Seo, 2012 |
Geen relevante uitkomstmaten gerapporteerd |
|
Simek, 2012 |
Review |
|
Sola Serrabou, 2014 |
Spaans |
|
Taylor, 2014 |
Relevante uitkomstmaten niet gerapporteerd |
|
Taylor-Piliae, 2014 |
Patienten met een beroerte |
|
Tofthagen, 2012 |
Review |
|
Tomlinson, 2012 |
Review |
|
Tousignant, 2013 |
Onduidelijk wat de woonsituatie van deelnemers was. Patiënten werden geïncludeerd die zich presenteerde in het ziekenhuis en werden doorverwezen voor een valprobleem |
|
Tousignant, 2012 |
Zelfde populatie als Tousignant, 2013 |
|
Uusi-Rasi, 2015 |
Data reeds geïncludeerd (Patil, 2015) |
|
Von Schacht, 2012 |
Review |
|
Yoo, 2013 |
Geen relevante uitkomstmaten gerapporteerd |
|
Zhao, 2013 |
Review |
|
Medication |
|
|
Boye, 2015 |
Verschil tussen single en recurrent vallers |
|
Dawson-Hughes, 2012 |
Review |
|
Frankenthal, 2014 |
Betreft een onderzoek naar een screening tool |
|
Girgis, 2014 |
Review |
|
Girgis, 2014 |
Review |
|
Glendenning, 2012 |
Selectie van participanten heeft na randomization plaatsgevonden; exclusie op basis van de mening van de onderzoekers |
|
Hill, 2012 |
Review |
|
Salonoja, 2012 |
Sub analyse binnen een bestaande RCT waarbij de randomizatie verloren ging |
|
Tamblyn, 2012 |
Geen relevante uitkomstmaten gerapporteerd |
|
Fluid or nutrition therapy |
|
|
Cadth, 2014 |
Review |
|
Lopez-Torres Hidalgo, 2014 |
Niet geschreven in het Engels |
|
Ng, 2015 |
Unclear data reported on falls |
|
Rizzoli, 2014 |
Onduidelijk waar patiënten woonde |
|
Suominen, 2014 |
Poster presentatie |
|
Theodoratou, 2014 |
Review |
|
Wood, 2014 |
Gemiddelde leeftijd onder 65 jaar |
|
Zheng, 2015 |
Review |
|
Psychological |
|
|
STRIDE, 2012 |
Nog lopend onderzoek |
|
Batra, 2012 |
Geen controle groep |
|
Burns, 2012 |
Observationele cohort studie; geen vergelijkende groep |
|
Greenberg, 2015 |
Assessment van de bereidheid om te praten over vallen en valrisico door deelnemers |
|
Environment/assistive technology |
|
|
-, 2015 |
Niet beschikbaar |
|
Afifi, 2015 |
Review |
|
Afifi, 2014 |
Beschrijving van een trap voor gebruik een ouderenvriendelijke omgeving |
|
Gallagher, 2013 |
Uitkomst vallen niet gerapporteerd |
|
Keall, 2015 |
Gemiddelde leeftijd van deelnemers onder 65 jaar |
|
Kwong-Young, 2013 |
Geen ruwe data beschreven/beschikbaar |
|
Lam, 2012 |
Review |
|
Lau, 2012 |
Patiënten met een beroerte |
|
Laufer, 2014 |
Review |
|
Leland, 2012 |
Review |
|
Menz, 2014 |
Conference abstract |
|
Najafi, 2013 |
Beschrijving van studies gepubliceerd in speciale editie van het tijdschrift |
|
Parijat, 2015 |
Interventie VR training met slips inductie |
|
Patel, 2012 |
Assisted living facilities |
|
Sociale environment |
|
|
-, 2012 |
Betreft een supplementair tabel |
|
Actrn, 2014 |
Geregistreerde trial, nog bezig met inclusie van deelnemers |
|
Chase, 2012 |
Review |
|
Clemson, 2014 |
Problemen met implementatie van valpreventie interventie |
|
Di Monaco, 2012 |
Therapietrouw zijn aan de interventie |
|
Mayo-Wilson, 2014 |
Review |
|
Knowledge / education interventies |
|
|
Kamei, 2015 |
Al geincludeerd |
|
Potter, 2014 |
Gemiddelde leeftijd van deelnemers onder 65 jaar |
|
Ziden, 2014 |
Geen relevante uitkomstmaten gerapporteerd |
|
Multifactorial intervention |
|
|
Albert, 2015 |
Beoordeling van het studiedesign |
|
Albert, 2014 |
Niet gerandomiseerd |
|
Balzer, 2012 |
Review |
|
Balzer, 2012 |
Letter to the editor |
|
Batchelor, 2012 |
Patiënten met een beroerte
|
|
Booth, 2015 |
Review |
|
Cameron, 2012 |
Review |
|
Carette, 2013 |
Geen vergelijkende groep |
|
Choi, 2012 |
Review |
|
Clews, 2013 |
Nieuws artikel |
|
Close, 2013 |
Review |
|
Cohen, 2015 |
Groot verschil in het percentage tussen groepen dat na randomisatie ook de interventie/ controle ontvingen (63% vs 82% vs 100%) |
|
Dionyssiotis, 2012 |
Review |
|
Farrell, 2013 |
Case report |
|
Ferrer, 2014 |
Populatie: oudste-ouderen |
|
Flarity, 2013 |
Assessment van val risico |
|
Formosa, 2014 |
Vergelijking voor en na; geen controle groep |
|
Ganz, 2015 |
Uitkomst: alle botbreuken, niet per se val gerelateerd |
|
Gillespie, 2012 |
Review |
|
Goodwin, 2014 |
Review |
|
Griffin, 2014 |
Behandeling voor diabetes |
|
Guo, 2014 |
Review |
|
Guse, 2015 |
Wijze van implementatie en ondersteuning van Stepping on programma |
|
Harvey, 2014 |
Geen gerandomiseerd onderzoek; betrof een survey |
|
Kittipimpanon, 2012 |
Voor en na gemeten; geen controlegroep |
|
Kramer, 2014 |
Voor en na gemeten; geen controlegroep |
|
Landis, 2014 |
Assessment van een systeem voor het rapporteren van ongelukken en vallen |
|
Perez-Ros, 2014 |
Artikel in het Spaans
|
|
Skelton, 2013 |
Review |
|
Van Nimwegen, 2013 |
Betreft ziekenhuispatienten
|
|
Overig |
|
|
-, 2015 |
Lijst met deelnemers aan een congres – orale presentaties |
|
-, 2015 |
Lijst met deelnemers aan een congres – poster presentaties |
|
-, 2014 |
Aanbevelingen opgesteld door American Geriatrics Society Workgroup |
|
Bischoff-Ferrari, 2012 |
Gemiddelde leeftijd onder 65 jaar |
|
Black, 2012 |
Beschrijving van een presentatie |
|
Bolland, 2014 |
Review |
|
Bruyere, 2014 |
Review |
|
Carande-Kulis, 2015 |
Kosteneffectiviteit van valpreventie interventies |
|
Ceglia, 2013 |
Review |
|
Chen, 2013 |
Betreft patiënten opgenomen voor revalidatie en geen relevante uitkomstmaten gerapporteerd |
|
Combes, 2014 |
Review |
|
Elliott, 2014 |
Review |
|
Gianturco, 2013 |
Congres abstract |
|
Holt, 2012 |
Review |
|
Imhof, 2012 |
Uitkomst: het aantal drie maanden perioden met een val. |
|
Jacobs, 2014 |
Matched cohort studie naar het effect dual tasking op valrisico in PD patienten |
|
Kane, 2013 |
Review |
|
Karlsson, 2013 |
Review |
|
Karlsson, 2013 |
Review |
|
Karlsson, 2013 |
Review |
|
Korner-Bitensky, 2013 |
Patienten met een beroerte |
|
Krasniqi, 2012 |
Geen vergelijkende groep |
|
Lacerda, 2012 |
Onderzoek naar het voorkomen van en factoren geassocieerd met vallen |
|
Lee, 2012 |
Karakteristieken van vallen |
|
Leung, 2014 |
Uitkomst: vallen en botbreuken tezamen genomen |
|
Leung, 2014 |
Zelfde als 1501 |
|
Li, 2014 |
Geen relevante uitkomsten gerapporteerd |
|
Luck, 2013 |
Betreft de oudste ouderen populatie |
|
Metzelthin, 2014 |
Congres abstract |
|
Moreira, 2013 |
Jonger dan 65 jaar |
|
Moyer, 2012 |
Review |
|
Nyman, 2012 |
Review |
|
Ostaszkiewicz, 2013 |
Review |
|
Peyro Saint Paul, 2013 |
Artikel geschreven in het Frans |
|
Resnick, 2012 |
Deelnemers uit assisted living communities |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 31-03-2017
Beoordeeld op geldigheid : 01-02-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep wel in stand gehouden. Uiterlijk in 2022 bepaalt het bestuur van de Nederlandse Vereniging voor Klinische Geriatrie of de modules van deze richtlijn nog actueel zijn, behalve de module over het beoordelen van valrisicoverhogende medicatie. De actualiteit van deze module dient uiterlijk 2019 te worden beoordeeld, vanwege de verwachting dat een tegen die tijd gepubliceerde systematische review over valrisicoverhogende medicatie de aanbevelingen kan aanscherpen. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Klinische Geriatrie is regiehouder van deze richtlijnen eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen en handelingsinstructies ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het expliciteren van goed medisch handelen. De doelstelling is het ontwikkelen van een multidisciplinaire evidence-based richtlijn gericht op de secundaire en tertiaire preventie van valincidenten bij ouderen vanaf 65 jaar, toepasbaar in thuissituatie (zelfstandig wonende ouderen), verzorgingshuis, verpleeghuis en ziekenhuis.
Doelgroep
De gebruikers van de richtlijn zijn alle zorgverleners die met een oudere patiënt met een verhoogd valrisico te maken krijgen. Hierbij kan worden gedacht aan hulpverleners in de drie volgende omgevingen:
- thuissituatie (zelfstandig wonende ouderen);
- verzorgings- en verpleeghuis;
- ziekenhuis.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij valpreventie van ouderen van 65 jaar of ouder.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. N. (Nathalie) van der Velde, geriater en internist-ouderengeneeskunde, AMC Amsterdam, NVKG, (voorzitter)
- Dr. Y. (Yvonne) Schoon, geriater, RadboudUMC, Nijmegen, NVKG
- Dr. M.H. (Mariëlle) Emmelot-Vonk, geriater, UMCU Utrecht, NVKG
- Prof. dr. A.B. (Andrea) Maier, internist-ouderengeneeskunde, VUmc, Amsterdam, (tot januari 2016), NIV
- Drs. H.H.M. (Harianne) Hegge, internist-ouderengeneeskunde, UMCG, Groningen, (vanaf januari 2016), NIV
- Dr. J.H.W. (Joost) Rutten, internist-vasculair geneeskundig, RadboudUMC, Nijmegen, NIV
- Prof. dr. J.G. (Gert) van Dijk, neuroloog, LUMC, Leiden, NVN
- Dr. A.J.J. (Arnaud) Aerts, cardioloog, Stichting Zuyderland Medisch Centrum, Sittard-Geleen/Heerlen, NVVC
Klankbordgroep:
- Dr. E. (Ellen) Smulders, wetenschappelijk onderzoeker, RadboudUMC, Nijmegen, KNGF
- M. (Myrthe) Pruijn, ergotherapeut, Slotervaartziekenhuis, Amsterdam, EN
- M. (Miran) van Eijk, verpleegkundig specialist, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, V&VN
- R. (Rinie) Lammers, beleidsmedewerker, Patiëntenfederatie Nederland
- C. (Charlotte) Scherphof, beleidsmedewerker, Patiëntenfederatie Nederland (tot september 2016)
- W. (Willem) Vos, huisarts, huisartsenpraktijk W. Vos, NHG (tot maart 2016)
- C.S. (Corrie) Jongsma, huisarts, W.J.M. Brunninkhuis en C.S. Jongsma, huisartsen, Drachten, NHG (vanaf april 2016)
- Prof. dr. W. (Willem) Lems, reumatoloog, VUmc, Amsterdam, NVR
- M. (Marion) de Rooi, MSc, SEH-arts KNMG, Zaans Medisch Centrum, Zaandam, NVSHA
- Drs. A. (Anneke) van Strien- van Merkestein, specialist ouderengeneeskunde, Saffier de Residentie groep, Den Haag, Verenso
Met ondersteuning van:
- Dr. B.H. (Bernardine) Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
- Drs. E.E. (Eva) Volmeijer, adviseur, Kennisinstituut van Medisch Specialisten
- A.A. (Toon) Lamberts, MSc, beleidsadviseur, NVKG
- M. (Monique) Wessels, MSc, medisch informatiespecialist, Kennisinstituut van Medisch Specalisten
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van Medisch Specialisten
- D.P. (Diana) Gutierrez, projectsecretaresse, Kennisinstituut van Medisch Specialisten
Met dank aan:
- Dr. G. (Geeske) Peters, (senior) research fellow, Global Brain Health Institute, Brisbane Australië
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van der Velde |
Geriater en internist-ouderengeneeskunde |
Postdoc geriatrie Erasmus MC (onbetaald) werkgroeplid werkgroep wetenschap (onbetaald) Lid sectie NIV ouderengeneeskunde (vacatiegelden) Voorzitter SIG valnetwerk NVKG (onbetaald) Werkgroeplid EUGMS SIG falls fractive preventies (onbetaald) Voorzitter EU werkgroep “knowledge dissmination on fall-risk-increasing drugs (onbetaald) |
B-PROOF-NED ZonMW-effect. Genetische variatie op medicatie gerelateerd vallen Amsterdams Universitair Fonds: 'Val me Bij'project (kennisdissiminatie valrisicoverhogende medicatie) 'Gepersonaliseerde medicatieaanpassing bij oudere vallers' ZonMW 'SeniorStap' (medeaanvrager) RAAK: 'Bewegingsregistratie en Analyse voor Valrisicoschatting bij Ouderen' (medeaanvrager) |
Geen actie (valt buiten de afbakening van de richtlijn) |
|
Schoon |
Geriater |
Voorzitter regionaal valpreventie Netwerk Nijmegen |
Projectleider KWF beleidsprojecten |
Geen actie (vallen buiten de afbakening van de richtlijn) |
|
Emmelot-Vonk |
Geriater |
Bestuurslid stichting IWO (interdisciplinaire werkgroep osteoporose) (onkostenvergoeding). Voorzitter werkgroep wetenschap NVKG (onbetaald). Werkgroeplid SIG valnetwerk NVKG (onbetaald). Werkgroeplid EUGMS SIG Falls and fractures prevention (onbetaald). Full board member EUGMS (onbetaald). Lid werkgroep richtlijnen NVKG (onbetaald). |
- |
Geen actie |
|
Maier |
Internist-ouderengeneeskunde |
Bestuur Vilans |
Onderzoek met Nutricia sacropenie; onderzoek naar myalgie (FP7-project) |
Geen actie (vallen buiten de afbakening van de richtlijn) |
|
Hegge |
Geriater en internist-ouderengeneeskunde |
- |
- |
Geen actie |
|
Rutten |
Internist-vasculair geneeskundige |
- |
- |
Geen actie |
|
Van Dijk |
Neuroloog |
Voorzitter werkgroep Syncope |
- |
Geen actie |
|
Aerts |
Cardioloog |
Lid richtlijnenforum commissie kwaliteit NVVC Lid werkgroep Syncope |
Carelink studie stichting Epilepsie Instellingen Nederland |
Geen actie (valt buiten de afbakening van het de richtlijn) |
|
Smulders |
Hoofddocent Master Geriatric Physical Therapy Avans+ Wetenschappelijk onderzoeker Radboud UMC afdeling revalidatie |
Cursusleider en docent Paramedisch instituut (betaald)
|
- |
Geen actie |
|
Pruijn |
Ergotherapeut |
- |
- |
Geen actie |
|
Van Eijk |
Verpleegkundig specialist |
Gastdocent Radboud Zorgacademie (betaald) |
- |
Geen actie |
|
Lammers |
Beleidsmedewerker |
- |
- |
Geen actie |
|
Scherphof |
Beleidsmedewerker |
- |
- |
Geen actie |
|
Vos |
Huisarts |
- |
- |
Geen actie |
|
Jongsma |
Huisarts |
Bestuur Laego (betaald) |
- |
Geen actie |
|
Lems |
Reumatoloog |
Adviesraden (betaald) :MSD, Amgen, Eli Lilly, Takeda, Will Pharma, Pfizer, Servier, Novartis, Roche. Wetenschappelijk secretaris NV Reumatologie Hoofdredacteur tijdschrift reumatologie. |
- |
Geen actie (betreft advies over reumamedicatie of ostoeporose medicatie ) |
|
De Rooi |
SEH-arts KNMG |
- |
- |
Geen actie |
|
Van Strien-van Merkestein |
Specialist ouderengeneeskunde |
- |
- |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Patiëntenfederatie Nederland in de klankbordgroep op te nemen. Daarnaast is gebruik gemaakt van informatie uit kwalitatieve studies (compliantie en patiëntenpreferenties) die naar voren zijn gekomen door het zoekfilter patiëntenperspectief toe te passen. Tot slot is gebruik gemaakt van regionaal verkregen patientenfocusgroep informatie (regio Nijmegen).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft tevens interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken (zie Indicatorontwikkeling).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn “Richtlijn Preventie van valincidenten bij ouderen” NVKG 2004 op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door Ergotherapie, KNGF, KNMP, NHG, NIV, NVKG, NVSHA, NVZ, NVZA, V&VN, VeiligheidNL, Verenso en Zorginstituut Nederland via invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS-I – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|||||||||||||||||||||||||||||||||||||||
|
Medline (OVID) Aug. 2015 |
1 Accidental Falls/ (16942) 2 (falls or faller$1).tw. (32735) 3 1 or 2 (40806) 4 exp Aged/ (2494674) 5 (senior? or elderly or older).tw. (468589) 6 4 or 5 (2694517) 7 3 and 6 (17530) 8 limit 7 to yr="2012 -Current" (4769) 9 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial or comparative study).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2576065) 10 8 and 9 (1304) – 1190 uniek |
2923 |
|||||||||||||||||||||||||||||||||||||||
|
Embase (Elsevier) |
'falling'/exp OR falls:ab,ti OR fallers:ab,ti AND ('aged'/exp OR elderly:ab,ti OR senior*:ab,ti OR older:ab,ti) AND [2012-2015]/py AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR 'comparative study'/exp OR placebo*:ab,ti) NOT 'conference abstract':it AND [embase]/lim (1142) - 699 uniek |
||||||||||||||||||||||||||||||||||||||||
|
Cochrane (Wiley) |
#1 MeSH descriptor: [Accidental Falls] explode all trees #2 ("falls" or "faller*"):ti,ab #3 #1 or #2 #4 MeSH descriptor: [Aged] explode all trees #5 ("older" or "senior*" or "elderly"):ti,ab #6 #4 or #5 #7 #3 and #6 Publication Year from 2012 to 2015 (395) – 89 uniek |
||||||||||||||||||||||||||||||||||||||||
|
Cinahl |
|
