Palliatieve zorg bij COPD
Uitgangsvraag
Wat is palliatieve zorg bij (gevorderde) COPD en op welke wijze worden mensen met COPD met palliatieve zorgbehoeften geïdentificeerd?
Aanbeveling
Bij mensen met COPD (alle aanbevelingen niveau 1):
- Zet palliatieve zorg in als er sprake is van twee of meer van de volgende factoren:
- het antwoord ‘nee’ op de ‘surprise question’: ‘Zou het mij verbazen wanneer deze patiënt in de komende 12 maanden komt te overlijden?’
- klachten en/of problemen op lichamelijk, psychisch, sociaal en/of spiritueel gebied die ondanks optimale ziektegerichte behandeling onacceptabel zijn voor de patiënt en leiden tot afname van kwaliteit van leven
- slechte lichamelijke toestand (ernstige beperking in activiteiten, ADL-afhankelijkheid, Karnofsky performance status ≤ 50)
- ondergewicht, vastgesteld door middel van de volgende factoren:
- lage BMI (<21 kg/m2) en/of
- ongewenst gewichtsverlies van >5% in de laatste 6 maanden of >10% over een langere periode (>6 maanden) en/of
- lage vetvrije massa-index (VVMI, mannen <17 kg/m², vrouwen <15 kg/m²)
- ernstige dyspneu (MRC-score 5: te dyspnoïsch om uit huis te gaan of dyspneu tijdens aan- en uitkleden)
- FEV1 <30% van voorspeld
- (start) chronisch gebruik van zuurstof
- één of meer ziekenhuisopnames vanwege een longaanval per jaar
- ernstige comorbiditeit (bijvoorbeeld cor pulmonale, hartfalen, nierinsufficiëntie, diabetes mellitus, kanker)
- ‘mijlpalen’ zoals:
- arbeidsongeschiktheidsverklaring
- ziekenhuisopname met (niet-invasieve) beademing
- afwijzing voor longtransplantatie of bronchoscopische of chirurgische interventies ter vermindering van hyperinflatie
- overbelaste mantelzorger
- noodzaak tot verhuizing of aanpassing van de woning
- Besteed aandacht aan alle dimensies van het ziek zijn: fysiek, psychisch, sociaal en spiritueel. Ga daarbij uit van een interdisciplinaire benadering. Verleen basale palliatieve zorg op al deze gebieden. Signaleer tijdig klachten en problemen waarvoor consultatie en/of verwijzing noodzakelijk is.
- Voer regelmatig (ten minste jaarlijks en zo nodig vaker) een gesprek om (het begrip van) de situatie, de (gezondheids)vaardigheden en de wensen van de patiënt en diens naasten te evalueren. Ga tijdens het gesprek in op de symptomen en de betekenis daarvan voor het fysiek, psychisch, sociaal en spiritueel functioneren. Besteed daarbij ook aandacht aan de ziektelast. Maak hierbij zo nodig gebruik van meetinstrumenten (bijvoorbeeld Ziektelastmeter COPD, COPD Control Questionnaire (CCQ) of de COPD Assessment Test (CAT)). Exploreer gedachtes en wensen van de patiënt ten aanzien van de toekomst en behandeldoelen. Bespreek, indien mogelijk en gewenst, de prognose.
- Zet ziektegerichte behandeling (waaronder zuurstoftherapie ter verlenging van de overleving, niet-invasieve beademing en medicamenteuze behandeling (meestal bronchusverwijders, inhalatiecorticosteroïden en/of antibiotica)) gericht op verlichting van symptomen zo lang mogelijk door.
- Zet symptoomgerichte palliatie in als de klachten voor de patiënt onacceptabel zijn en/of als er klachten of problemen op psychisch, sociaal of spiritueel gebied zijn ondanks optimale ziektegerichte behandeling.
- Let bij palliatie in de stervensfase op belastende symptomen en signalen en richt het handelen vooral op comfort en verlichting van lijden en verbetering van de kwaliteit van sterven.
- Betrek de mantelzorger en naasten actief in de zorg. Besteed aandacht aan de (gezondheids)vaardigheden, draagkracht, draaglast, waarden, wensen en behoeften van de mantelzorger en naasten, zowel tijdens het ziekteproces als na het overlijden.
- Raadpleeg zo nodig de andere richtlijnen palliatieve zorg (https://www.pallialine.nl/).
- Vraag bij moeilijk behandelbare symptomen en/of complexe problemen advies aan deskundigen (indien nog niet betrokken), bijvoorbeeld een fysiotherapeut, logopedist, ergotherapeut, diëtist en/of gespecialiseerd team palliatieve zorg en/of verwijs naar gespecialiseerde zorgverleners (bijvoorbeeld psycholoog, psychiater, maatschappelijk werker, geestelijk verzorger).
Overwegingen
In het Kwaliteitskader palliatieve zorg Nederland wordt palliatieve zorg als volgt gedefinieerd: ‘Palliatieve zorg is zorg die de kwaliteit van leven verbetert van mensen en hun naasten die te maken hebben met een levensbedreigende aandoening of kwetsbaarheid, door het voorkomen en verlichten van lijden, door middel van vroegtijdige signalering en zorgvuldige beoordeling en behandeling van problemen van fysieke, psychische, sociale en spirituele aard. Gedurende het beloop van de ziekte of kwetsbaarheid heeft palliatieve zorg oog voor het behoud van autonomie, toegang tot informatie en keuzemogelijkheden’ [IKNL/Palliactief 2017].
Palliatieve zorg is gericht op:
- behandeling van symptomen
- verbetering dan wel handhaving van kwaliteit van leven en uiteindelijk kwaliteit van sterven
- vaststellen van zorgdoelen en bepalen waarden, wensen en behoeften van de patiënt
- ondersteuning van de naasten, zowel tijdens het ziektetraject als na het overlijden
Zie ook de Algemene principes van palliatieve zorg [PAZORI 2017].
Palliatieve zorg is multidimensioneel en omvat:
- de fysieke dimensie met aandacht voor lichamelijke klachten en problemen
- de psychische dimensie met aandacht voor klachten zoals angst (zie Richtlijn 'Angst' [IKNL 2009] en depressie (zie Richtlijn 'Depressie' [IKNL 2010]) en voor verwerkings- en aanpassingsvermogen
- de sociale dimensie met aandacht voor interacties met de omgeving en voor de draagkracht en draaglast van de naasten (zie Richtlijn ‘Mantelzorg’ [IKNL 2009])
- de spirituele dimensie met aandacht voor existentiële, ethische en zingevingvraagstukken (zie Richtlijn 'Zingeving en Spiritualiteit' [IKNL 2018])
Deze zorg wordt ook wel totale of integrale zorg genoemd en wordt interdisciplinair geleverd, waarbij de patiënt centraal staat [IKNL/Palliactief 2017]. Interdisciplinair wil zeggen dat de verschillende disciplines een gezamenlijk doel formuleren en een gemeenschappelijke taal hanteren. De disciplines werken samen in plaats van parallel aan elkaar. In figuur 1 wordt een schematische weergave gegeven van de interdisciplinaire benadering bij mensen met COPD [Maddocks 2017].
Figuur 1. Interdisciplinaire benadering bij palliatieve zorg [Maddocks 2017]. Reprinted with permission from Lancet
In Nederland wordt palliatieve zorg in de meeste gevallen verleend door generalisten. Bij mensen met COPD betreft het vooral huisartsen, specialisten ouderengeneeskunde, longartsen, klinisch geriaters, verpleegkundig specialisten, (long)verpleegkundigen en verzorgenden (zie module ‘Organisatie van zorg’).
In een enquête onder 256 longartsen (in opleiding) in Nederland gaf 55% aan de palliatieve zorg voor opgenomen mensen met COPD voor zijn/haar eigen rekening te willen nemen [Duenk 2017b]. In de poliklinische setting gaf 71% de voorkeur aan een gezamenlijke en multidisciplinaire benadering door longarts, huisarts en longverpleegkundige of verpleegkundig specialist of physician assistant.
Hoewel het literatuuronderzoek geen eenduidige conclusies oplevert over het effect van palliatieve zorg op kwaliteit van leven en symptomen bij mensen met COPD, is de werkgroep van mening dat palliatieve zorg tijdig moet worden ingezet bij mensen met gevorderde COPD.
De werkgroep is van mening dat het belangrijk is om regelmatig (ten minste jaarlijks en zo nodig vaker, als de situatie daar aanleiding toe geeft) een gesprek te voeren om (het begrip van) de situatie, de (gezondheids)vaardigheden en de wensen van de patiënt en diens naasten te evalueren. Daarbij wordt ingegaan op de symptomen, de betekenis daarvan voor het fysiek, psychisch, sociaal en spiritueel functioneren en de ziektelast. Bij het bepalen van symptomen kan zo nodig gebruik gemaakt worden van meetinstrumenten (bijvoorbeeld het Utrecht Symptoom Dagboek (USD) of de Lastmeter). Bij het bepalen van de ziektelast kan zo nodig gebruik gemaakt worden van meetinstrumenten (bijvoorbeeld de Ziektelastmeter COPD, de COPD Control Questionnaire (CCQ) of de COPD Assessment Test (CAT)). Daarnaast kunnen gedachtes en wensen van de patiënt ten aanzien van de toekomst en behandeldoelen geëxploreerd worden en kan, indien mogelijk en gewenst, de prognose besproken worden.
De zorgverlener is in staat om bij klachten of problemen te onderkennen of alledaagse aandacht voldoet en wanneer er behoefte bestaat aan begeleiding, behandeling of een crisisinterventie [IKNL/Palliactief 2017].
De naasten en mantelzorgers spelen een sleutelrol in het bieden van ondersteuning en zorg aan de patiënt. Een goede samenwerking tussen zorgverleners en mantelzorgers is essentieel. De zorgverlener besteedt apart aandacht aan (gezondheids)vaardigheden, draagkracht, draaglast, waarden, wensen en behoeften van de naasten, zowel tijdens het ziekteproces als na het overlijden (zie ook module ‘Problemen op psychosociaal en existentieel gebied’).
Bij COPD is er – anders dan meestal bij de ziekte kanker – geen scherpe scheiding te maken in de overgang naar de palliatieve fase. COPD is een ongeneeslijke en potentieel levensbedreigende ziekte. Het is onzeker of en vooral wanneer de patiënt aan de ziekte zal overlijden. Gedurende vrijwel het hele ziektetraject worden de symptomen (vooral dyspneu, vermoeidheid en in mindere mate hoesten) het beste verlicht door middel van ziektegerichte behandeling met medicatie (meestal bronchusverwijders en (vooral bij longaanvallen) eventueel corticosteroïden), zuurstoftherapie indien geïndiceerd, niet-invasieve beademing indien geïndiceerd en longrevalidatie. Bij een progressief beloop van de ziekte wordt het steeds moeilijker om de symptomen te controleren. Niet-medicamenteuze behandelingen (bijvoorbeeld ademhalingssoefeningen, rollator, ventilator) en opioïden kunnen worden ingezet voor betere controle van de dyspneu. Daarnaast kan er sprake zijn van toenemende psychische symptomen zoals somberheid en angst, waarvoor psychologische ondersteuning en soms antidepressiva en/of anxiolytica worden ingezet. Het geheel van deze maatregelen wordt wel symptoomgerichte palliatie genoemd (zie Algemene principes van palliatieve zorg [PAZORI 2017]).
Als er sprake is van moeilijk behandelbare symptomen en/of complexe problematiek kunnen de andere richtlijnen palliatieve zorg worden geraadpleegd (https://www.pallialine.nl/). Deze richtlijnen hebben betrekking op lichamelijke en psychische symptomen, zorg in de stervensfase, zorg op psychosociaal en spiritueel gebied (mantelzorg, spirituele zorg, rouw) en beslissingen rond het levenseinde (palliatieve sedatie, euthanasie).
Bij moeilijk behandelbare symptomen en/of complexe problemen kan advies gevraagd worden aan deskundigen (indien nog niet betrokken), bijvoorbeeld een fysiotherapeut, logopedist, ergotherapeut, diëtist en/of gespecialiseerd team palliatieve zorg. Ook kan worden verwezen naar gespecialiseerde zorgverleners (bijvoorbeeld een psycholoog, psychiater, maatschappelijk werker, geestelijk verzorger).
In de stervensfase verschuift de focus van kwaliteit van leven naar kwaliteit van sterven (zie Richtlijn ‘Zorg in de stervensfase’ [IKNL 2010]). De ziektegerichte behandeling wordt meestal tot kort voor het overlijden voortgezet. De mate van ziektegerichte behandeling neemt af naarmate het overlijden nadert en de palliatieve zorg neemt toe (zie figuur 2). Ten slotte omvat palliatieve zorg ook de zorg voor de nabestaanden na het overlijden.
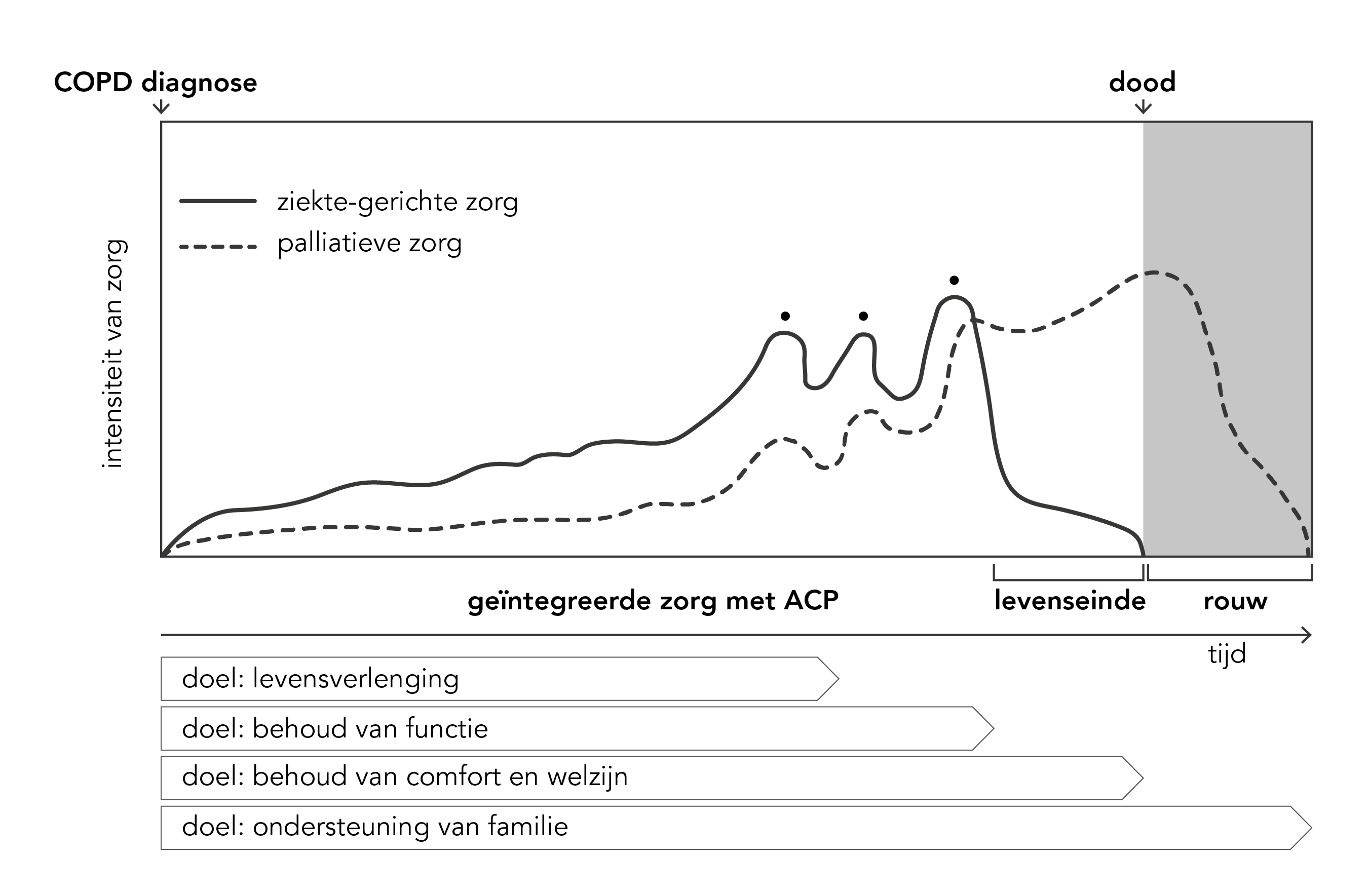
Figuur 2. Ziektegerichte behandeling en palliatieve zorg bij COPD [Harrington 2017].
Er is toenemende aandacht voor palliatieve zorg bij mensen met COPD [Fusi-Schmidhauser 2018, Hardin 2008, Harrington 2017, Lal 2014, Landers 2017, Lilly 2016, Maddocks 2017, Murray 2006, Seamark 2007, Sorathia 2019, Vermylen 2017]. Dit heeft geleid tot een verandering van focus bij mensen met gevorderde COPD met meer en vroeger in het ziektebeloop aandacht voor longrevalidatie, kwaliteit van leven, symptoombestrijding, communicatie en ACP.
Het ziektebeloop (en daarmee ook de prognose) is bij COPD moeilijk te voorspellen [Harrington 2017, Landers 2017, Lilly 2016, Sorathia 2019]. Mensen met COPD overlijden in 50-70% aan andere oorzaken zoals comorbiditeit [Gedebjerg 2018].
Zowel onderzoek als praktijk laten zien dat palliatieve zorg vaak (te) laat wordt ingezet bij mensen met COPD [Butler 2020, Gore 2000, Hardin 2008, Halpin 2018, Harris 2007]. Palliatieve zorg wordt later ingezet bij mensen met COPD dan bij mensen met longkanker, terwijl ze zeker niet minder klachten en problemen hebben [Gore 2000, Hardin 2008].
In een systematische literatuurstudie van Butler et al. [2020] zijn 19 publicaties geanalyseerd van onderzoek naar palliatieve zorg services, medicatie, levensverlengende interventies, plaats van overlijden, symptoomlast, gezondheidsgerelateerde kwaliteit van leven van mensen met COPD en longkanker. Uit de resultaten bleek dat zowel mensen met COPD als mensen met longkanker lage gezondheidsgerelateerde kwaliteit van leven in de laatste levensfase hebben en een vergelijkbare symptoomlast ervaren. Mensen met COPD ontvangen echter minder palliatieve zorg en slechtere symptoommanagement, maar meer levensverlengende interventies in de laatste levensfase dan mensen met longkanker.
Verklaringen voor het niet of te laat inzetten van palliatieve zorg bij mensen met COPD zijn [Epiphaniou 2014, Hardin 2008, Harrington 2017, Mason 2014, Vermylen 2017]:
- Gevorderde COPD wordt zowel door patiënten als door zorgverleners niet altijd als een levensbedreigende aandoening gezien.
- Misvattingen over palliatieve zorg. Palliatieve zorg wordt beschouwd als synoniem voor terminale zorg en het inzetten van palliatieve zorg wordt door patiënten, naasten en soms ook door zorgverleners gezien als een doodvonnis op korte termijn.
- Barrières van zowel patiënten als zorgverleners om het gesprek over het levenseinde aan te gaan.
- Het moeilijk kunnen voorspellen van het ziekteverloop en de levensverwachting (zie paragraaf ‘Prognostische factoren bij COPD en markering van de palliatieve fase’ in deze module).
Andere factoren die bijdragen aan het (te) laat inzetten van palliatieve zorg zijn [Stuurgroep Passende zorg in de laatste levensfase 2015]:
- ‘niet opgeven’ als basishouding
- doen is beter dan laten; opleidingen en richtlijnen zijn gericht op doen
- ziekte- i.p.v. mensgerichte benadering
- te veel zorgverleners en onvoldoende afstemming van de zorg
De vraag wanneer er sprake is van palliatieve zorg bij mensen met COPD roept veel discussie op. In de eerdergenoemde survey bij 256 longartsen (in opleiding) in Nederland gaf 92% aan dat markering van de palliatieve fase en tijdig inzetten van palliatieve zorg van groot belang is [Duenk 2017b]. Frequente ziekenhuisopnames, het oordeel van de longarts, de wens van de patiënt en ernstige comorbiditeit werden door meer dan 75% als criteria genoemd.
De werkgroep is er geen voorstander van om de palliatieve fase bij de diagnose te laten beginnen. COPD is immers niet altijd een progressieve ziekte. De stadiëring volgens GOLD lijkt evenmin geschikt voor markering van de palliatieve fase.
Bij het markeren van de palliatieve fase bij mensen met COPD wordt vaak gebruik gemaakt van factoren en indices, die onderzocht zijn op hun prognostische betekenis (voorspelling van overlijden op korte termijn), maar niet op hun predictieve waarde (voorspelling van noodzaak en effectiviteit van het inzetten van palliatieve zorg).
In onderstaande tekst wordt ingegaan op achtereenvolgens prognostische factoren bij COPD, de waarde van de ‘surprise question’ en ‘mijlpalen’ in het leven van mensen met COPD als aanleiding voor het inzetten van palliatieve zorg.
Prognostische factoren bij COPD en markering van de palliatieve fase.
De richtlijn ‘Palliatieve zorg voor mensen met COPD’ van LAN [2011] gaf aan de hand van referenties van O’Kelly [2007], Curtis [2008] en Murray [2006] aan dat de markering van de palliatieve fase wordt bepaald door (de verslechtering in) het klinische beeld, het ondergaan hebben van intensieve behandelingen zonder (blijvend) effect, de subjectieve inschatting en wensen van de patiënt en de inschatting van zorgverleners. Als hulpmiddelen werden genoemd FEV1 <30% van voorspeld, slechte bloedgassen, cor pulmonale (met pulmonale hypertensie), MRC-dyspneu schaal score van 5, BMI <21 kg/m2 of spiermassaverlies, slechte kwaliteit van leven-score (CCQ of SGRQ), relevante comorbiditeit (bijvoorbeeld hartfalen) en frequente ziekenhuisopnames vanwege een acute longaanval, steeds kortere intervallen tussen deze opnames en beperkte vooruitgang na opnames.
Een aantal recentere studies en reviews onderzochten welke factoren voorspellend zijn voor een overlijden en daarmee aanleiding zouden (kunnen) zijn voor het inzetten van palliatieve zorg [Almagro 2017 en 2019, Batzlaff 2014, Bloom 2019, Carone 2016, Singanayagam 2013, Smith 2017, Steer 2010]. Steer [2010] verrichtte een review naar welke factoren voorspellend waren voor overlijden (tijdens ziekenhuisopname of daarna) bij mensen met COPD, die waren opgenomen in het ziekenhuis vanwege een longaanval. Daarbij kwamen de volgende factoren consistent naar voren als voorspellers van overlijden na ontslag: oudere leeftijd, slechte voedingstoestand, comorbiditeit (cardiaal, diabetes mellitus, cor pulmonale), functionele beperkingen, slechte kwaliteit van leven, eerdere ziekenhuisopnames vanwege longaanvallen, onderhoudsbehandeling met corticosteroïden, hypercapnie, verhoogd troponine en lage FEV1.
Singanayagam [2013] verrichtte een systematische review van 37 studies bij in totaal 189.772 mensen met COPD, die vanwege een longaanval waren opgenomen in het ziekenhuis. Oudere leeftijd, mannelijk geslacht, lage BMI, comorbiditeit (cor pulmonale, hartfalen, nierfalen), verwardheid, langdurig gebruik van zuurstof, respiratoire acidose, oedeem aan de benen, GOLD stadium 4 en verhoogd troponine waren geassocieerd met overlijden op korte termijn.
Batzlaff [2014] onderzocht 591 mensen met COPD, die waren opgenomen vanwege een longaanval op een intensive care. Bij multivariate analyse waren leeftijd en duur van de opname op de intensive care onafhankelijke voorspellers van overleving na 1 jaar.
Carone [2016] onderzocht voorspellers van overleving bij 221 mensen met COPD, die behandeld werden met langdurige toediening van zuurstof of niet-invasieve beademing thuis. In de univariate analyse waren hogere leeftijd, lage vitale capaciteit, zuurstofgebruik in rust, slechte kwaliteit van leven en verminderde fysieke activiteit voorspellend voor overlijden. In de multivariate analyse waren alleen hogere leeftijd, zuurstofgebruik in rust en slechtere gezondheidsstatus (gemeten m.b.v. vragenlijsten) voorspellend voor overlijden.
In de review van Smith [2017] was geen enkele individuele variabele voorspellend voor een overlijden binnen 1 jaar. Er waren een aantal multivariabele indices (ADO, B-AE-D, BODE(x), e/mBODE, DOSE, SAFE) die wel voorspellend waren. Leeftijd >70 jaar, roken, FEV1 <30% van voorspeld, lage BMI, loopafstand, dyspneuscore, slechte kwaliteit van leven, eerdere ziekenhuisopname(s) vanwege een longaanval en comorbiditeit waren onderdeel van deze indices.
In de studie van Almagro [2017] werden een aantal variabelen (gekozen op basis van een systematische review) getest in een cohort van 797 mensen met COPD, die waren opgenomen vanwege een longaanval. Zeven variabelen waren voorspellend voor een overlijden binnen 1 jaar met een hazard ratio variërend van 1.6 tot 2.6:
- leeftijd >70 jaar
- slechte kwaliteit van leven (SGRQ-score >60)
- BMI <21 kg/m2
- serumalbumine <35 g/l
- depressie (Geriatric Depression Scale (GDS) >5)
- chronisch gebruik van zuurstof
- dyspneu (MRC-score >3)
Twee multivariabele indices (BODE en CODEX) waren het best voorspellend voor overlijden binnen 1 jaar (hazard ratio’s van resp. 3.74 en 2.42). BMI, FEV1 <30% van voorspeld, dyspneuscore, verminderde loopafstand, eerdere ziekenhuisopname(s) vanwege een longaanval en comorbiditeit waren onderdeel van deze indices. De sensitiviteit en specificiteit bedroegen 0.47 en 0.82 respectievelijk voor de BODE (afkappunt >7) en 0.49 en 0.73 respectievelijk voor de CODEX (afkappunt >7). Geen van de variabelen of indices had een area under the curve (AUC) >0.7 (NB een AUC van 0,7-0,8 is acceptabel; een AUC van >0,8 is uitstekend).
De studies van Amagro [2017] en Smith [2017] constateerden dat geen van de onderzochte variabelen en indices in staat waren om het overlijden van mensen met COPD goed te voorspellen [Almagro 2017, Smith 2017].
Guerra [2018] vergeleek 10 verschillende prognostische indices binnen 24 cohortstudies bij in totaal 15.762 mensen met COPD voor overlijden binnen 3 jaar. De mediane AUCs voor de verschillende indices varieerden van 0.613 (klassieke GOLD stadiëring, gebaseerd op FEV1) tot 0.679 (ADO, gebaseerd op leeftijd, dyspneuscore en FEV1).
In een tweede studie van Almagro [2019] werd de voorspellende waarde van de CODEX voor overlijden na 3 maanden, 1 en 10 jaar getest bij 3321 mensen met COPD. In de CODEX zijn opgenomen: comorbiditeit, FEV1, dyspneu en ziekenhuisopname vanwege COPD. De AUC bedroeg 0.72 voor overlijden binnen 3 maanden, 0.70 voor overlijden binnen 1 jaar en 0.76 voor overlijden binnen 10 jaar.
Bloom [2019] onderzocht de voorspellende waarde van de BARC-index voor overlijden binnen 1 jaar. Aan de hand van een cohort van 27.472 mensen met COPD (training set) werd de BARC-index ontwikkeld. In de BARC zijn 18 risicofactoren opgenomen: hoge leeftijd, mannelijk geslacht, roken, diverse comorbiditeiten (astma, atriumfibrilleren, CVA, dementie, nierinsufficiëntie, longkanker, longfibrose), lage BMI, hoge dyspneuscore, lage FEV1, ziekenhuisopnames vanwege longaanvallen en uitslagen laboratoriumonderzoek (laag Hb, hoge trombocyten, hoog serumcreatinine, laag serumalbumine). De index werd vervolgens getest in een testset van 27.518 patiënten en een externe set van 4931 mensen met COPD. De C-index van de BARC-index was 0.79 in de testset en 0.67 in de externe set (een C-index van 0,5-0,7 impliceert een zwak model, een C-index van 0,7-0,8 een goed model en een C-index >0,8 een uitstekend model). De AUCs bedroegen 0.781 in de testset en 0.695 in de externe set en waren hoger dan de AUCs van andere prognostische indices (ADO: 0.675 resp. 0.568); BODEX (0.483 en 0.413): DOSE (0.591 en 0.515)). De BARC was een nauwkeurige voorspeller van overlijden binnen 1 jaar (testset: voorspeld 30% versus 31% geobserveerd; externe set 27% versus 22%).
Recent is de ProPal-COPD tool ontwikkeld om mensen met COPD te identificeren die in aanmerking komen voor palliatieve zorg aan de hand van factoren die voorspellend waren voor overlijden binnen 1 jaar [Duenk 2017c]. Na onderzoek bij 155 mensen met COPD, die vanwege een longaanval waren opgenomen in het ziekenhuis, zijn in het uiteindelijke model als variabelen opgenomen: CCQ Score >3, MRC dyspneu-score 5, FEV1 <30% van voorspeld, eerdere ziekenhuisopname vanwege een longaanval, BMI <21 kg/m2, ernstige comorbiditeit (inclusief cor pulmonale) en antwoord ‘nee’ op de ‘surprise question’ (zie parafraaf ‘surprise question’ in deze module). Bij de gekozen cut-off bedroeg de sensitiviteit 0.90, de specificiteit 0.73 en de AUC 0.82. De ProPal-COPD was een betere voorspeller voor overlijden binnen 1 jaar dan de eerdergenoemde CODEX-index. Dit model zal in grotere groepen moeten worden getest.
In het afgelopen decennium zijn er ook diverse generieke instrumenten ontwikkeld om zorgverleners te helpen patiënten te identificeren die een verhoogde kans op achteruitgang of overlijden hebben en die dus baat zouden kunnen hebben bij het tijdig inzetten van palliatieve zorg [Maas 2013, Walsh 2015]. Ook hierbij is gebruik gemaakt van prognostische factoren.
Een van de eerste instrumenten was de RADPAC (RADboud indicators for PAlliative Care needs) [Thoonsen 2012, Smith 2017]. Deze is ontwikkeld voor huisartsen en bevat zes identificatiecriteria bij COPD, die elk zouden kunnen triggeren om palliatieve zorg in te zetten:
- De patiënt heeft veel hulp nodig en frequente medische verzorging (Karnofsky performance status < 50).
- De patiënt heeft fors gewichtsverlies (>10% binnen 6 maanden).
- Er is hartfalen aanwezig.
- De patiënt heeft orthopnoe.
- De patiënt geeft signalen het naderende einde in te zien.
- Er zijn objectieve tekenen van ernstige dyspneu aanwezig (beperkt inspanningsvermogen, dyspnoïsch bij spreken, gebruik van hulpademhalingsspieren en orthopnoe).
Rond dezelfde tijd werd in Edinburgh de SPICT (Supportive and Palliative Care Indicators Tool) ontwikkeld, welke jaarlijks geüpdatet wordt met commentaar vanuit zorgverleners [Highet 2014, Smith 2017] en ook jaarlijks in het Nederlands vertaald wordt (SPICT-NL). De SPICT overlapt gedeeltelijk met de RADPAC, maar is voor alle bij palliatieve zorg betrokken zorgverleners in de eerste en tweede lijn ontwikkeld. De SPICT bevat een aantal generieke identificatiecriteria en daarnaast per ziektegroep nog één of meerdere specifieke criteria. De generieke criteria, zoals geformuleerd in versie 2019, zijn:
- ongeplande ziekenhuisopnames
- functionele status is laag of gaat achteruit, met beperkt herstelvermogen (overdag 50% of meer in bed of op stoel)
- afhankelijk van anderen voor zorgbehoeften, door fysieke en/of mentale problemen
- de mantelzorger heeft meer hulp en ondersteuning nodig
- progressief gewichtsverlies, blijvend ondergewicht, lage spiermassa
- persisterende symptomen ondanks optimale behandeling van onderliggende aandoening(en)
- de patiënt (of diens naaste) vraagt om palliatieve zorg, kiest om verdere behandeling te verminderen, te staken of ervan af te zien of wenst een focus op kwaliteit van leven
De ziektespecifieke criteria van de SPICT voor respiratoire aandoeningen betreffen: ernstige, chronische ziekte met in de periode tussen longaanvallen dyspneu in rust of bij geringe inspanning, persisterende hypoxie waardoor chronische afhankelijkheid van zuurstof en/of eerdere beademing in verband met respiratoir falen of contra-indicatie voor beademing.
Verder is de Gold Standards Framework Proactive Identification Guidance (GSF-PIG) [Smith 2017] ontwikkeld om de zorg in de laatste levensfase te optimaliseren. De GSF-PIG gaat uit van een negatief antwoord op de ‘surprise question’ en geeft (naast een aantal algemene criteria) aan dat voor COPD ten minste voldaan moet zijn aan twee van de volgende criteria:
- ten minste drie ziekenhuisopnames in het afgelopen jaar vanwege longaanval
- ernstige dyspneu (MRC graad 4: dyspneu na 100 meter lopen)
- FEV1 <30% van voorspeld en/of persisterende symptomen ondanks optimale behandeling
- voldoet aan criteria voor chronische behandeling met zuurstof (PaO2 <55 mmg Hg (7,3 kPa))
- noodzaak voor (non-)invasieve beademing tijdens ziekenhuisopname
- andere factoren bijvoorbeeld cor pulmonale, anorexie/cachexie, >6 weken gebruik van corticosteroïden in de afgelopen 6 maanden, palliatieve medicatie voor dyspneu of (ex-)roker
De ‘surprise question’
Zowel de richtlijn van LAN [2011] als het Kwaliteitskader palliatieve zorg Nederland [IKNL/Palliactief 2017] bevelen aan om bij het markeren van de palliatieve fase de zogenaamde ‘surprise question’ te gebruiken: ‘Zou het mij verbazen wanneer deze patiënt in de komende 12 maanden komt te overlijden?’ [IKNL/Palliactief 2017]. Als het antwoord op deze vraag ‘nee’ is, kan dit gebruikt worden om de palliatieve fase te markeren en daarover met de patiënt in gesprek te gaan en palliatieve zorg vroegtijdig in te zetten.
De voorspellende waarde van de ‘surprise question’ ten aanzien van de sterfte binnen 1 jaar is niet goed onderzocht bij mensen met COPD. In een meta-analyse was de sensitiviteit bij mensen met een niet-maligne aandoening 60,7%, de specificiteit 75,9%, de voorspellende waarde van het antwoord ‘nee’ 31,3% en de voorspellende waarde van het antwoord ‘ja’ 93,2% [Downar 2017].
Een onderzoek bij 93 mensen met COPD, die in het ziekenhuis waren opgenomen vanwege een longaanval, onderzocht de relatie tussen het antwoord op de ‘surprise question’ en de behoefte aan palliatieve zorg, zoals gemeten met de criteria van de Gold Standards Framework (GSF) [Noppe 2019]. Er was een significant verschil in het aantal criteria waaraan voldaan werd (gemiddeld 4 bij het antwoord ‘nee’ en 1 bij het antwoord ‘ja’, p<0,001). Bij het antwoord ‘ja’ werden echter 74,1% van de patiënten gemist die minimaal aan 1 criterium van de GSF voldeden en 48,3% van de patiënten die minimaal aan 2 criteria van de GSF voldeden. In een andere studie bij 199 patiënten, opgenomen vanwege een longaanval, werden meer prognostisch ongunstige factoren gezien bij mensen waarbij het antwoord op de ‘surprise question’ ‘nee’ was [South 2011].
Het gebruik van de ‘surprise question’ bij mensen met COPD roept discussie op [Janssen 2015, Small 2010]. Tegenstanders van deze benadering voeren aan dat er geen betrouwbare criteria zijn om het overlijden op korte termijn van mensen met COPD te voorspellen en dat dit kan leiden tot de zogenaamde ‘prognostic paralysis’: palliatieve zorg wordt niet of (veel) te laat ingezet omdat het moment van overlijden niet goed voorspelbaar is [Cawley 2014, Epiphaniou 2014, Giacomini 2012, Kendall 2014, Murray 2006, Pinnock 2011]. Zij pleiten er voor om meer vanuit de beleving en het perspectief van de patiënt te denken [Disler 2014, Giacomini 2012, Pinnock 2011]. Andere tegenstanders (in Engeland) beargumenteren dat de palliatieve zorgbenadering ook relevant is voor mensen met een langere levensverwachting en zijn bang dat het ten koste zal gaan van de zorg door de behandelaar zelf [Small 2010]. Dit is voor de Nederlandse situatie niet erg relevant, omdat veel palliatieve teams niet zelf patiënten behandelen, maar alleen advies geven. De belangrijkste functie van de ‘surprise question’ zou kunnen zijn om bewustzijn bij de zorgverleners te creëren dat bepaalde mensen een risico hebben om binnen 12 maanden te overlijden, om de zorg, benadering en communicatie met de patiënt en diens naasten daarop aan te passen en om palliatieve zorg in te zetten en niet primair om de levensverwachting te voorspellen [Murray 2011, Janssen 2015, Noppe 2019]. De werkgroep deelt deze mening.
‘Mijlpalen’ als markering van de palliatieve fase
Verschillende auteurs pleiten er voor (aan de hand van interviews met mensen met COPD) om de palliatieve fase bij mensen met COPD te markeren aan de hand van ‘mijlpalen’: herkenbare momenten of gebeurtenissen in hun leven die aanleiding zijn om palliatieve zorg in te zetten [Cawley 2014, Landers 2015, Reinke 2008].
Daarbij worden als mijlpalen genoemd:
- ernstige beperkingen in fysieke activiteiten
- noodzaak voor ondersteuning bij zelfzorg
- angstaanvallen
- aanpassingen in het huis of noodzaak om te verhuizen, bijvoorbeeld naar gelijkvloerse woning of verpleeghuis
- overbelasting van de mantelzorg
- start van onderhoudsbehandeling met zuurstof
- ziekenhuisopnames vanwege longaanvallen
De werkgroep is van mening dat de volgende ‘mijlpalen’ ook relevant zijn:
- arbeidsongeschiktheidsverklaring
- afwijzing voor longtransplantatie of bronchoscopische of chirurgische interventies ter vermindering van hyperinflatie
- start van niet-invasieve beademing thuis
Samengevat is er niet een hard criterium voor het markeren van de palliatieve fase bij COPD. Er is geen onderzoek gedaan naar predictieve factoren (dat wil zeggen factoren die aangeven dat inzetten van palliatieve zorg noodzakelijk en effectief is). In de praktijk wordt gebruik gemaakt van prognostische factoren (dat wil zeggen factoren die voorspellen voor een korte overleving). Er is echter niet één duidelijke voorspellende factor voor de overleving en de onderzochte indices zijn onvoldoende voorspellend en/of in de dagelijkse praktijk niet bruikbaar. Er kan ook gebruik gemaakt worden van ‘mijlpalen’: momenten of gebeurtenissen in het leven van de patiënt, die aangeven dat er mogelijk behoefte is aan palliatieve zorg.
De werkgroep is daarom van mening dat palliatieve zorg ingezet moet worden indien er sprake is van twee of meer van de volgende factoren:
- het antwoord ‘nee’ op de ‘surprise question’: ‘Zou het mij verbazen wanneer deze patiënt in de komende 12 maanden komt te overlijden?’
- klachten en/of problemen op lichamelijk, psychisch, sociaal en/of spiritueel gebied die ondanks optimale ziektegerichte behandeling onacceptabel zijn voor de patiënt en leiden tot afname van kwaliteit van leven
- slechte lichamelijke toestand (ernstige beperking in activiteiten, ADL-afhankelijkheid, Karnofsky performance status ≤ 50%)
- ondergewicht, vastgesteld door middel van de volgende factoren:
- lage BMI (<21 kg/m2)
- ongewenst gewichtsverlies van >5% in de laatste 6 maanden of >10% over een langere periode (>6 maanden) en/of
- lage vetvrije massa-index (VVMI, mannen <17 kg/m², vrouwen <15 kg/m²)
- ernstige dyspneu (MRC-score 5: te dyspnoïsch om uit huis te gaan of dyspneu tijdens aan- en uitkleden)
- FEV1 <30% van voorspeld
- start chronisch gebruik van zuurstof
- één of meer ziekenhuisopnames vanwege een longaanval per jaar
- ernstige comorbiditeit (bijvoorbeeld cor pulmonale, hartfalen, nierinsufficiëntie, diabetes mellitus, kanker)
- ‘mijlpalen’ zoals:
- arbeidsongeschiktheidsverklaring
- opname met (niet-invasieve) beademing
- afwijzing voor longtransplantatie of bronchoscopische of chirurgische interventies ter vermindering van hyperinflatie
- overbelaste mantelzorger
- noodzaak tot verhuizing of aanpassing van de woning
Onderbouwing
Achtergrond
Mensen met gevorderde COPD hebben een hoge prevalentie van lichamelijke en psychische klachten die een negatieve invloed hebben op hun kwaliteit van leven (zie Tabel 1) [Fusi-Schmidhauser 2018, Harrington 2017, Janssen 2008, Lilly 2016, Maddocks 2017, Sorathia 2019, Vermylen 2015].
Tabel 1. Prevalentie van symptomen bij gevorderde COPD [Janssen 2008].
|
Symptoom |
Laatste jaar |
Laatste 1-2 weken |
|
Vermoeidheid |
68% |
80% |
|
Dyspneu |
94% |
90% |
|
Slaapproblemen |
65% |
51% |
|
Pijn |
68% |
49% |
|
Klachten van de mond |
63% |
48% |
|
Hoesten |
70% |
52% |
|
Gebrek aan eetlust |
51% |
64% |
|
Somberheid |
59% |
55% |
|
Angst |
53% |
|
|
Obstipatie |
36% |
25% |
|
Verwardheid |
23% |
22% |
|
Misselijkheid |
4% |
|
De kwaliteit van leven van mensen met gevorderde COPD is slechter dan die van mensen met longkanker [Gore 2000, Habraken 2009, Javadzadeh 2016]. Naast de gevolgen van de ziekte zelf speelt comorbiditeit vaak ook een rol. COPD gaat significant vaker gepaard met comorbiditeit dan andere chronische aandoeningen [Yin 2017]. Daarbij gaat het vooral om cerebrovasculaire aandoeningen, andere neurologische aandoeningen, psychiatrische aandoeningen, hypertensie, diabetes mellitus, hartfalen, andere longziekten, darm- en nierziekten, ziekten van het houdings- en bewegingsapparaat en kanker.
Conclusies / Summary of Findings
Over het effect van palliatieve zorg op kwaliteit van leven bij patiënten met COPD leveren de beschikbare gerandomiseerde studies tegenstrijdige informatie. Op basis van de beschikbare gegevens is het niet mogelijk aan te geven welke kenmerken van palliatieve zorg bepalend zijn voor een positief effect.
|
Lage GRADE |
Er is bewijs van lage kwaliteit dat case management of een psycho-educatieve interventie in de thuissituatie onder leiding van een verpleegkundige een positief effect heeft op kwaliteit van leven. [Aiken 2006, Bove 2016] |
|
Zeer lage GRADE |
Er is bewijs van lage tot zeer lage kwaliteit dat vroegtijdige holistische palliatieve zorg in de thuissituatie geen effect heeft op kwaliteit van leven. [Janssens 2019, Scheerens 2019] |
|
Zeer lage GRADE |
Er is bewijs van lage tot zeer lage kwaliteit dat case management of holistische palliatieve zorg buiten de thuissituatie die start tijdens of kort na een ziekenhuisopname vanwege een longaanval geen effect heeft op kwaliteit van leven. [Duenk 2017a, Egan 2002] |
|
Geen GRADE |
Over het effect van palliatieve zorg op dyspneu bij patiënten met COPD werden geen gerandomiseerde studies gevonden. |
|
Geen GRADE |
Over het effect van palliatieve zorg op vermoeidheid bij patiënten met COPD werden geen gerandomiseerde studies gevonden. |
Samenvatting literatuur
Literatuurbespreking
De literatuurzoektocht identificeerde vier relevante systematische reviews.
- In de Cochrane review van Gomes et al. [2013] werd gezocht naar vergelijkende studies die het effect van palliatieve zorg thuis evalueerden bij volwassenen met een gevorderde ziekte. Ze includeerden 23 studies (gepubliceerd tot november 2012), waarvan 3 gerandomiseerde studies patiënten met COPD hebben geïncludeerd. Twee studies hiervan [Brumley 2007, Rabow 2004] includeerden een heterogene populatie, maar rapporteerden geen aparte cijfers voor COPD. Aiken et al. [2006] evalueerden het effect van palliatieve zorg thuis bij 130 patiënten met chronisch hartfalen en 62 patiënten met COPD. De resultaten voor COPD werden apart gerapporteerd. Kwaliteit van leven werd gemeten met het SF-36 instrument.
- Mathews et al. [2017] zochten naar studies die het effect van palliatieve en levenseinde interventies evalueerden bij patiënten met gevorderde COPD (gepubliceerd tussen 2015 en 2017). Ze includeerden 19 studies waarvan 3 gerandomiseerde studies. Eén studie [Buckingham 2015] rapporteerde geen kwantitatieve data. Een andere studie [Shany 2017] evalueerde geen palliatieve interventie. Bove et al. [2016] evalueerden het effect van een psycho-educatieve interventie thuis bij 66 patiënten met gevorderde COPD en symptomen van angst. Kwaliteit van leven werd gemeten met het Chronic Respiratory Questionnaire (CRQ) instrument.
- Ora et al. [2019] zochten naar studies, gepubliceerd tussen januari 2008 en december 2018, die het effect bestudeerden van palliatieve interventies onder leiding van een verpleegkundige bij patiënten met COPD. Ze vonden 6 studies, waarvan 4 gerandomiseerde studies. Eén studie [Weber 2017] was echter enkel gepubliceerd als abstract. De studie van Buckingham rapporteerde geen kwantitatieve data [Buckingham 2015]. Een derde studie [Sinclair 2017] includeerde een heterogene populatie, maar rapporteerde geen afzonderlijke cijfers voor COPD. De vierde publicatie betrof het studieprotocol van de studie van Houben et al. [2019]; deze studie onderzocht echter alleen het effect van proactieve zorgplannign (advanced care planning; ACP) bij patiënten met COPD (zie module ‘Proactieve zorgplanning’).
- Singer et al. [2016] zochten naar gerandomiseerde studies, gepubliceerd tussen januari 2001 en augustus 2015, die het effect van palliatieve en levenseinde interventies evalueerden bij patiënten met een gevorderde ziekte. Ze includeerden 124 studies, waarvan in 19 studies patiënten met COPD werden geïncludeerd. Hiervan rapporteerden 3 studies aparte resultaten voor patiënten met COPD. De studie van Au et al. [2012] onderzocht het effect van communicatie over het levenseinde en wordt hier verder niet besproken. Egan et al. [2002] evalueerden het effect van casemanagement door verpleegkundigen bij 66 patiënten met COPD. Kwaliteit van leven werd gemeten met de St George Respiratory Questionnaire (SGRQ). Ook de studie van Aiken et al. [2006] werd geïncludeerd.
Aanvullend werden drie gerandomiseerde studies gevonden:
- Duenk et al. [2017a] evalueerden in een cluster-gecontroleerde studie het effect van vroegtijdige palliatieve zorg bij patiënten met COPD. Drie Nederlandse ziekenhuizen met een gespecialiseerd palliatief advies team werden gekozen als interventieziekenhuis (N=90 patiënten), drie ziekenhuizen zonder een dergelijk team fungeerden als controleziekenhuis (N=138 patiënten). De interventie bestond uit proactieve palliatieve zorg met een maandelijkse consultatie gedurende 1 jaar. De primaire uitkomstmaat was kwaliteit van leven, gemeten met de SGRQ.
- Janssens et al. [2019] randomiseerden 49 patiënten met COPD GOLD III of IV tussen vroegtijdige palliatieve thuiszorg gedurende 1 jaar (N=26) of reguliere zorg (N=23). De palliatieve interventie omvatte een maandelijks huisbezoek door een verpleegkundige van ongeveer 1,5 uur, waarbij onder andere werd gefocust op symptomen, voeding en ACP. Alle patiënten werden besproken met een arts palliatieve zorg, die desgewenst door de patiënten kon worden geconsulteerd. De primaire uitkomstmaat was het aantal ziekenhuisopnames, spoedopnames en opnames op de intensive care.
- Scheerens et al. [2019] randomiseerden 39 patiënten met eindstadium COPD (GOLD III of IV) tussen vroegtijdige geïntegreerde palliatieve zorg (N=20) of standaard zorg (N=19). De geïntegreerde palliatieve zorg omvatte een maandelijks huisbezoek gedurende 6 maanden, waarbij aandacht besteed werd aan verschillende zorgaspecten, onder andere ziekte-inzicht, zorgplanning, existentiële / spirituele ondersteuning, enzovoort. Een individueel zorgplan werd opgesteld en telkens aangepast. Kwaliteit van leven werd gemeten met het SF-36 instrument.
Kwaliteit van het bewijs
De review van Gomez et al. [2013] is van zeer goede kwaliteit. Er werd gezocht in meerdere databases zonder restrictie, het volledige reviewproces gebeurde door twee onafhankelijke onderzoekers. De drie andere reviews zijn van behoorlijke kwaliteit [Mathews 2017; Ora 2019; Singer 2016]. In deze reviews werd wel gezocht in een voldoende aantal databases, maar beperkte men zich tot Engelstalige literatuur. Bovendien werden slechts onderdelen van het reviewproces door twee onafhankelijke onderzoekers uitgevoerd.
De drie gerandomiseerde studies hadden een hoog risico op bias. Duenk et al. [2017a] alloceerden de behandeling op basis van de beschikbaarheid van een palliatief advies team (geen randomisatie), waarbij enkel de patiënten geblindeerd waren. Ze hebben geen intention-to-treat analyse uitgevoerd. Janssens et al. [2019] blindeerden noch de patiënten, noch de zorgverleners. Scheerens et al. [2019] blindeerden eveneens niet en hebben ook geen intention-to-treat analyse uitgevoerd.
Resultaten
Effect op dyspneu
Geen enkele van de geïncludeerde studies rapporteerde het effect van palliatieve zorg op dyspneu bij patiënten met COPD.
Effect op vermoeidheid
Geen enkele van de geïncludeerde studies rapporteerde het effect van palliatieve zorg op vermoeidheid bij patiënten met COPD.
Effect op kwaliteit van leven
Zes gerandomiseerde studies rapporteerden het effect van één of andere vorm van palliatieve zorg op kwaliteit van leven bij patiënten met COPD. Er zijn verschillende redenen waarom deze zes studies niet in een meta-analyse kunnen worden gecombineerd. Ten eerste zijn de beschreven interventies te heterogeen (al dan niet thuis en/of vroegtijdig, onder leiding van een verpleegkundige of niet, enzovoort). Bovendien werd kwaliteit van leven gemeten met verschillende instrumenten (SF-36 in drie studies, SGRQ in twee studies, CRQ in één studie). Om die redenen is onderstaande analyse louter beschrijvend.
Twee studies [Aiken 2006; Bove 2016] vonden een positief effect op kwaliteit van leven. Beide studies evalueerden een interventie in de thuissituatie onder leiding van een verpleegkundige. Aiken et al. (case management) vonden een positief effect gemeten met het SF-36 instrument (fysiek functioneren: helling +1,00 vs. -0,95, p < 0,05; algemene gezondheid: helling +0,54 vs. +1,67, p < 0,05), terwijl Bove et al. (psycho-educatieve interventie) een positief effect vonden gemeten met het CRQ-instrument (mastery: gemiddeld verschil na 3 maanden = 0,67; 95%BI 0,18 – 1,17; p=0,016).
Vier studies [Egan 2002; Duenk 2017a; Janssens 2019; Scheerens 2019] toonden geen effect aan op kwaliteit van leven. In twee studies [Janssens 2019; Scheerens 2019] werd een holistische palliatieve interventie in de thuissituatie geëvalueerd. In beide studies werd de interventie ‘vroegtijdig’ genoemd, maar was het niet duidelijk op welke basis. Janssens et al. vonden geen significant effect op kwaliteit van leven gemeten met het SF-36 instrument, maar ze rapporteerden geen cijfers. Scheerens et al. vonden eveneens geen significant effect op kwaliteit van leven gemeten met het SF-36 instrument (week 24; fysiek functioneren: 23,6 vs. 22,9; p=0,12; mentaal functioneren: 35,6 vs. 37,4; p=0,16). De twee andere studies [Egan 2002; Duenk 2017a] evalueerden een palliatieve interventie buiten de thuissituatie die startte tijdens of kort na een ziekenhuisopname vanwege een longaanval. Egan et al. (case management) vonden geen significant effect op kwaliteit van leven gemeten met het SGRQ-instrument na 1 maand (totaal: -1,6 vs. -1,5; p=0,621). Ook Duenk et al. [2017a] (vroegtijdige palliatieve zorg) vonden geen effect op kwaliteit van leven gemeten met het SGRQ-instrument na 3, 6, 9 en 12 maanden (gemiddeld verschil ten opzichte van basis na 12 maanden: -6,71 vs. +3,32; p=0,54).
Zoeken en selecteren
Onderzoeksvraag
Om de uitgangsvraag van deze module te beantwoorden is een systematische literatuurzoektocht uitgevoerd. De onderzoeksvraag die hiervoor is opgesteld is PICO-gestructureerd en luidt:
Wat is het effect van palliatieve zorg op symptomen en kwaliteit van leven van mensen met COPD?
P: patiënten met COPD
I: palliatieve zorg
C: reguliere zorg
O: dyspneu, kwaliteit van leven, vermoeidheid
Relevante uitkomstmaten
Cruciale uitkomstmaten: dyspneu en kwaliteit van leven
Belangrijke uitkomstmaat: vermoeidheid
Zoeken en selecteren
Zoekdatum 23 december 2019
Databases OVID Medline, Embase, Cochrane Library, Cinahl
Zoeklimieten Publicatiedatum: 2009-2019
Talen: Engels en Nederland
Studie design: meta-analyses, systematic reviews, randomized controlled trials
Resultaten
Zeven onderzoeken zijn opgenomen in de literatuuranalyse, vier systematische reviews en drie randomized controlled trials. De belangrijkste studiekarakteristieken en resultaten van de negen opgenomen studies zijn weergegeven in de evidence tabel. De beoordeling van de kwaliteit is opgenomen in het GRADE profiel.
Referenties
- Almagro P, Yun S, Sangil A, et al. Palliative care and prognosis in COPD: a systematic review with a validation cohort. Int J Chron Obstruct Pulmon Dis 2017; 12: 1721–1729.
- Almagro P, Martínez-Camblor P, Miravitlles M, et al. External Validation and Recalculation of the CODEX Index in COPD Patients. A 3CIAplus Cohort Study. COPD 2019; 16(1) 8–17.
- Au DH, Udris EM, Engelberg RA, Diehr PH, Bryson CL, Reinke LF, et al. A randomized trial to improve communication about end-of-life care among patients with COPD. Chest. 2012; 141(3): 726-35.
- Batzlaff CM, Karpman C, Afessa B, Benzo RP. Predicting 1-year mortality rate for patients admitted with an acute exacerbation of chronic obstructive pulmonary disease to an intensive care unit: an opportunity for palliative care. Mayo Clin Proc 2014; 89: 638–643.
- Bloom CI, Ricciardi F, Smeeth L, Stone P, Quint JK. Predicting COPD 1-year mortality using prognostic predictors routinely measured in primary care. BMC Med 2019; 17(1): 73.
- Bove DG, Jellington MO, Lavesen M, Marså K, Herling SF. Assigned nurses and a professional relationship: a qualitative study of COPD patients’ perspective on a new palliative outpatient structure named CAPTAIN. BMC Palliative Care. 2019; 18:24. https://doi.org/10.1186/s12904-019-0410-0.
- Brumley R, Enguidanos S, Jamison P, Seitz R, Morgenstern N, Saito S, et al. Increased satisfaction with care and lower costs: results of a randomized trial of in-home palliative care. J Am Geriatr Soc. 2007; 55(7): 993-1000.
- Buckingham S, Kendall M, Ferguson S, MacNee W, Sheikh A, White P, et al. HELPing older people with very severe chronic obstructive pulmonary disease (HELP-COPD): mixed-method feasibility pilot randomised controlled trial of a novel intervention. NPJ Prim Care Respir Med. 2015; 25: 15020.
- Butler SJ, Ellerton L, Gershon AS, Goldstein RS, Brooks D. Comparison of end-of-life care in people with chronic obstructive pulmonary disease or lung cancer: A systematic review. Palliat Med. 2020 Sep;34(8):1030-1043. doi: 10.1177/0269216320929556.
- Carone M, Antoniu S, Baiardi P, Digilio VS, Jones PW, Bertolotti G; QuESS Group. Predictors of Mortality in Patients with COPD and Chronic Respiratory Failure: The Quality-of-Life Evaluation and Survival Study (QuESS): A Three-Year Study. COPD 2016; 13(2): 130-138.
- Cawley D, Billings J, Oliver D, Kendall M, Pinnock H. Potential triggers for the holistic assessment of people with severe chronic obstructive pulmonary disease: analysis of multiperspective, serial qualitative interviews. BMJ Support Palliat Care 2014; 4(2): 152–160.
- Curtis JR. Palliative and end-of-life care for patients with severe COPD. Eur J Resp J 2008; 32: 796-803.
- Disler RT, Green A, Luckett T, et al. Experience of advanced chronic obstructive pulmonary disease: metasynthesis of qualitative research. J Pain Symptom Manage 2014; 48: 1182–1199.
- Downar J, Goldman R, Pinto R, Englesakis M, Adhikari NK. The "surprise question" for predicting death in seriously ill patients: a systematic review and meta-analysis. CMAJ 2017; 189(13): E484–E493.
- Duenk RG, Verhagen C, Bronkhorst EM, van Mierlo P, Broeders M, Collard SM, et al. Proactive palliative care for patients with COPD (PROLONG): a pragmatic cluster controlled trial. Int J Chron Obstruct Pulmon Dis. 2017a;12:2795-806.
- Duenk RG, Verhagen C, Dekhuijzen P, Vissers K, Engels Y, Heijdra Y. The view of pulmonologists on palliative care for patients with COPD: a survey study. Int J Chron Obstruct Pulmon Dis 2017b; 12: 299–311.
- Duenk RG, Verhagen C, Bronkhorst EM, et al. Development of the ProPal-COPD tool to identify patients with COPD for proactive palliative care. Int J Chron Obstruct Pulmon Dis 2017c; 12: 2121–2128.
- Egan E, Clavarino A, Burridge L, Teuwen M, White E. A randomized control trial of nursing-based case management for patients with chronic obstructive pulmonary disease. Lippincotts Case Manag. 2002; 7(5): 170-9.
- Epiphaniou E, Shipman C, Harding R, et al. Avoid 'prognostic paralysis'--just get ahead and plan and co-ordinate care. NPJ Prim Care Respir Med 2014; 24: 14085.
- Fusi-Schmidhauser T, Riglietti A, Froggatt K, Preston N. Palliative Care Provision for Patients with Advanced Chronic Obstructive Pulmonary Disease: A Systematic Integrative Literature Review. COPD 2018; 15(6): 600–611.
- Gedebjerg A, Szépligeti SK, Wackerhausen LH, et al. Prediction of mortality in patients with chronic obstructive pulmonary disease with the new Global Initiative for Chronic Obstructive Lung Disease 2017 classification: a cohort study. Lancet Respir Med 2018; 6(3): 204–212.
- Giacomini M, DeJean D, Simeonov D, Smith A. Experiences of living and dying with COPD: a systematic review and synthesis of the qualitative empirical literature. Ont Health Technol Assess Ser. 2012;12(13):1-47.
- Gomes B, Calanzani N, Curiale V, McCrone P, Higginson IJ. Effectiveness and cost-effectiveness of home palliative care services for adults with advanced illness and their caregivers. Cochrane Database Syst Rev. 2013; 2016(3).
- Gore JM, Brophy CJ, Greenstone MA. How well do we care for patients with end stage chronic obstructive pulmonary disease (COPD)? A comparison of palliative care and quality of life in COPD and lung cancer. Thorax. 2000; 55(12): 1000-1006.
- Guerra B, Haile SR, Lamprecht B, et al. Large-scale external validation and comparison of prognostic models: an application to chronic obstructive pulmonary disease. BMC Med. 2018; 16(1): 33.
- Habraken JM, ter Riet G, Gore JM, et al. Health-related quality of life in end-stage COPD and lung cancer patients. J Pain Symptom Manage. 2009; 37(6): 973-981.
- Halpin DMG. Palliative care for people with COPD: effective but underused. Eur Respir J. 2018; 51: 1702645.
- Hardin KA, Meyers F, Louie S. Integrating palliative care in severe chronic obstructive lung disease COPD 2008; 5: 207–220.
- Harrington SE, Rogers E, Davis M. Palliative care and chronic obstructive pulmonary disease: where the lines meet. Curr Opin Pulm Med 2017; 23(2): 154–160.
- Highet G, Crawford D, Murray SA, Boyd K. Development and evaluation of the Supportive and Palliative Care Indicators Tool (SPICT): a mixed-methods study. BMJ Support Palliat Care 2014; 4(3): 285–290.
- Houben CHM, Spruit MA, Luyten H, Pennings HJ, van den Boogaart VEM, Creemers J, et al. Cluster-randomised trial of a nurse-led advance care planning session in patients with COPD and their loved ones. Thorax. 2019; 74(4): 328-36.
- IKNL. Richtlijn ‘Angst’, versie 1.0. 2009. Beschikbaar op https://www.pallialine.nl/angst.
- IKNL. Richtlijn ‘Depressie’, versie 2.0. 2010. Beschikbaar op https://www.pallialine.nl/depressie.
- IKNL. Richtlijn ‘Mantelzorg’, versie 2.0. 2009. Beschikbaar op https://www.pallialine.nl/mantelzorg.
- IKNL. Richtlijn ‘Zingeving en spiritualiteit’, versie 2.0. 2010. Beschikbaar op https://www.pallialine.nl/zingeving-en-spiritualiteit.
- IKNL. Richtlijn ‘Zorg in de stervensfase’, versie 1.0. Beschikbaar op https://www.pallialine.nl/stervensfase.
- IKNL/Palliactief. Kwaliteitskader palliatieve zorg Nederland. 2017. Beschikbaar op https://www.pallialine.nl/index.php?pagina=/richtlijn/item/pagina.php&richtlijn_id=1078&unique=b5f5989e95da3c01e3d0a0985f4923c7.
- Javadzadeh S, Chowienczyk S, Booth S, Farquhar M. Comparison of respiratory health-related quality of life in patients with intractable breathlessness due to advanced cancer or advanced COPD. BMJ Support Palliat Care. 2016; 6(1): 105-108.
- Janssen DJA, Spruit MA, Wouters EFM, Schols JMGA, Daily symptom burden in end-stage chronic organ failure: a systematic review. Palliat Med 2008; 22: 938-948.
- Janssen DJA, van den Beuken-van Everdingen MHJ, Schols JMGA. Verrast door de ‘surprise question. Ned Tijdschr Geneesk 2015; 159: 730-733.
- Janssens JP, Weber C, Herrmann FR, Cantero C, Pessina A, Matis C, et al. Can Early Introduction of Palliative Care Limit Intensive Care, Emergency and Hospital Admissions in Patients with Severe Chronic Obstructive Pulmonary Disease? A Pilot Randomized Study. Respiration. 2019; 97(5): 406-15.
- Kendall M, Buckingham S, Ferguson S, Hewitt N, Pinnock H. We need to stop looking for something that is not there…. NPJ Prim Care Respir Med 2014; 24: 14031.
- Lal AA,, Case AA. Palliation of chronic obstructive pulmonary disease: a review article. Ann Palliat Med. 2014; 3(4): 276-285.
- Landers A, Wiseman R, Pitama S, Beckert L. Severe COPD and the transition to a palliative approach. Breathe (Sheff) 2017; 13: 310–316.
- Lilly EJ, Senderovich H. Palliative care in chronic obstructive pulmonary disease. J Crit Care. 2016;35:150–154.
- Maas, EA, Murray SA, Engels Y et al. What tools are available to identify patients with palliative care needs in primary care: a systematic literature review and survey of European practice. BMJ Support Palliat Care 2013; 3: 444-51.
- Maddocks M, Lovell N, Booth S, Man WD, Higginson IJ. Palliative care and management of troublesome symptoms for people with chronic obstructive pulmonary disease. Lancet 2017; 390(10098): 988–1002.
- Mason B, Nanton V, Epiphaniou E, et al. 'My body's falling apart.' Understanding the experiences of patients with advanced multimorbidity to improve care: serial interviews with patients and carers. BMJ Support Palliat Care 2016; 6: 60–65.
- Mathews G, Johnston B. Palliative and end-of-life care for adults with advanced chronic obstructive pulmonary disease: a rapid review focusing on patient and family caregiver perspectives. Curr Opin Support Palliat Care. 2017; 11(4): 315-27.
- Murray SA, Pinnock H, Sheikh A. Palliative care for people with COPD: we need to meet the challenge. Prim Care Respir J 2006; 15: 362-364.
- Murray SA, Boyd K, Using the ‘surprise question’ can identify people with advanced heart failure and COPD who would benefit from a palliative care approach. Palliat Med 2011; 25: 382.
- Noppe D, Veen HI, Mooren K. COPD patients in need of palliative care: Identification after hospitalization through the surprise question. Chron Respir Dis. 2019;16:1479972318796219.
- O’Kelly N, Smith J. Palliative care for patients with end-stage COPD. Prim Care Respir J 2007; 16: 57-58.
- Ora L, Mannix J, Morgan L, Wilkes L. Nurse-led integration of palliative care for chronic obstructive pulmonary disease: An integrative literature review. J Clin Nurs. 2019; 28(21-22): 3725-33.
- PAZORI. Algemene principes van palliatieve zorg, versie 3.1. 2017. Beschikbaar op https://www.pallialine.nl/algemene-principes-van-palliatieve-zorg.
- Pinnock H, Kendall M, Murray SA, et al. Living and dying with severe chronic obstructive pulmonary disease: multi-perspective longitudinal qualitative study. BMJ Support Palliat Care 2011; 1: 174–183.
- Rabow MW, Dibble SL, Pantilat SZ, McPhee SJ. The comprehensive care team: a controlled trial of outpatient palliative medicine consultation. Arch Intern Med. 2004; 164(1): 83-91.
- Reinke LF, Engelberg RA, Shannon SE, et al. Transitions regarding palliative and end-of-life care in severe chronic obstructive pulmonary disease or advanced cancer: themes identified by patients, families, and clinicians. J Palliat Med 2008; 11: 601–609.
- Scheerens C, Pype P, Van Cauwenberg J, Vanbutsele G, Eecloo K, Derom E, et al. Early-Integrated Palliative home care and standard care for end-stage COPD (EPIC): A Phase II pilot RCT testing feasibility, acceptability and effectiveness. J Pain Symptom Manage. 2020; 59(2): 206-224.
- Seamark DA, Seamark CJ, Halpin DM. Palliative care in chronic obstructive pulmonary disease: a review for clinicians. J R Soc Med. 2007; 100: 225-233.
- Shany T, Hession M, Pryce D, et al. A small-scale randomised controlled trial of home telemonitoring in patients with severe chronic obstructive pulmonary disease. J Telemed Telecare. 2017; 23(7): 650-656.
- Sinclair C, Auret KA, Evans SF, Williamson F, Dormer S, Wilkinson A, et al. Advance care planning uptake among patients with severe lung disease: a randomised patient preference trial of a nurse-led, facilitated advance care planning intervention. BMJ Open. 2017; 7(2): e013415.
- Singanayagam A, Schembri S, Chalmers JD. Predictors of mortality in hospitalized adults with acute exacerbation of chronic obstructive pulmonary disease. Ann Am Thorac Soc. 2013; 10(2): 81–89.
- Singer AE, Goebel JR, Kim YS, Dy SM, Ahluwalia SC, Clifford M, et al. Populations and Interventions for Palliative and End-of-Life Care: A Systematic Review. J Palliat Med. 2016; 19(9): 995-1008.
- Small N, Gardiner C, Barnes S, et al. Using a prediction of death in the next 12 months as a prompt for referral to palliative care acts to the detriment of patients with heart failure and chronic obstructive pulmonary disease. Palliat Med 2010; 24: 740-741.
- Smith LE, Moore E, Ali I, Smeeth L, Stone P, Quint JK. Prognostic variables and scores identifying the end of life in COPD: a systematic review. Int J Chron Obstruct Pulmon Dis 2017; 12: 2239–2256.
- Sorathia L. Palliative Care in Chronic Obstructive Pulmonary Disease. Med Clin North Am 2019; 103(3): 517–526.
- South G, Reddington O, Hatfield L, Phillips A, Wall H. End of life in COPD: there may be no surprises! Eur Resp J 2011; 38: 1241.
- Steer J, Gibson GJ, Bourke SC. Predicting outcomes following hospitalization for acute exacerbations of COPD. QJM. 2010; 103: 817–829.
- Stuurgroep Passende zorg in de laatste levensfase. Niet alles wat kan, hoeft. Utrecht, 2015. Beschikbaar op https://www.knmg.nl/advies-richtlijnen/dossiers/niet-alles-wat-kan-hoeft.htm.
- Thoonsen B, Engels Y, van Rijswijk E, et al. Early identification of palliative care needs in general practice: development of RADboud indicators for Palliative Care needs. Br J Gen Pract 2012; DOI: 10.3399/bjgp12X654597.
- Vermylen JH, Szmuilowocz E, Kalhan R. Palliative care in COPD: an unmet area for qyality improvement. Int J COPD 2015; 10: 1543-1551.
- Walsh RI, Mitchell G, Francis L, van Driel ML. What Diagnostic Tools Exist for the Early Identification of Palliative Care Patients in General Practice? A systematic review. J Palliat Care. 2015;31:118-23.
- Yin HL, Yin SQ, Lin QY, Xu Y, Xu HW, Liu T. Prevalence of comorbidities in chronic obstructive pulmonary disease patients: A meta-analysis. Medicine 2017; 96(19): e6836.
Evidence tabellen
Systematische reviews
|
Study ID |
Methods |
Patient characteristics |
Intervention |
Results |
Critical appraisal of study quality |
|
Gomes 2013 |
|
|
Home palliative care vs. usual care |
CRITICAL OUTCOMES
IMPORTANT OUTCOMES
|
Level of evidence: high risk of bias
|
|
Mathews 2017 |
|
|
Palliative and end-of-life care processes or interventions:
|
CRITICAL OUTCOMES
IMPORTANT OUTCOMES
|
Level of evidence: high risk of bias
|
|
Ora 2019 |
|
|
Nurse-led palliative care model interventions |
CRITICAL OUTCOMES
IMPORTANT OUTCOMES
|
Level of evidence: high risk of bias
|
|
Singer 2016 |
|
|
Interventions for palliative and end-of-life care |
CRITICAL OUTCOMES
IMPORTANT OUTCOMES
|
Level of evidence: high risk of bias
|
Primaire studies
|
Study ID |
Methods |
Patient characteristics |
Intervention |
Results |
Critical appraisal of study quality |
|
Duenk 2017 |
|
|
Proactive palliative care with monthly meetings with a specialized palliative care team + usual care (N=90)
vs.
Usual care alone (N=138) |
CRITICAL OUTCOMES
IMPORTANT OUTCOMES
|
Level of evidence: high risk of bias
|
|
Janssens 2019 |
|
|
Intervention: home early palliative care + usual care (N=26); monthly home visits by nurse for 12 months, focusing on symptom assessment and management, nutrition, understanding of illness and coping, anticipation and decision-making, support of relatives, social-spiritual needs, coordination between different health providers, and alternative approaches
vs.
Control: usual care (N=23) |
CRITICAL OUTCOMES
IMPORTANT OUTCOMES
|
Level of evidence: high risk of bias
|
|
Scheerens 2019 |
|
|
Early integrated palliative home care (N=20)
vs.
Standard care (N=19) |
CRITICAL OUTCOMES
IMPORTANT OUTCOMES
|
Level of evidence: high risk of bias
|
Abbreviations: 95%CI: 95% confidence interval; ACP: advance care planning; AECOPD: acute exacerbation of COPD; BMI: body mass index; CoI: conflicts of interest; COPD: chronic obstructive pulmonary disease; CRQ-M: chronic respiratory questionnaire – mastery; FEV1: forced expiratory volume in 1 second; GOLD: Global Initiative for Chronic Obstructive Lung Disease; HADS: Hospital Anxiety and Depression Scale; ICU: intensive care unit; IRR: incidence rate ratio; MD: mean difference; MRC: Medical Research Council; QOC: quality of communication; QOL: quality of life; RCT: randomized controlled trial; SD: standard deviation; SF-36: short form 36; SGRQ: St. George Resipratory Questionnaire.
GRADE profielen
Home-based nurse-led case management
|
Quality assessment |
No of patients |
Effect |
Quality |
Importance |
||||||||
|
No of studies |
Design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Intervention |
Control |
Relative |
Absolute |
||
|
Dyspnoea |
||||||||||||
|
0 |
No evidence from RCTs |
|||||||||||
|
Quality of life: SF-36 |
||||||||||||
|
1 |
RCT |
Serious1 |
No serious inconsistency |
No serious indirectness |
Serious2 |
None |
100 |
90 |
- |
Physical functioning: slope 1.00 vs. ‑0.95, p<0.05
General health: slope 0.54 vs. ‑1.67, p<0.05 |
LOW |
CRITICAL |
|
Fatigue |
||||||||||||
|
0 |
No evidence from RCTs |
IMPORTANT |
||||||||||
1 High risk of bias: possible issues with blinding; no ITT analysis.
2 No relative effect reported, no information on 95%CI.
Nurse-led case management
|
Quality assessment |
No of patients |
Effect |
Quality |
Importance |
|||||||||
|
No of studies |
Design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Intervention |
Control |
Relative |
Absolute |
|||
|
Dyspnoea |
|||||||||||||
|
0 |
No evidence from RCTs |
||||||||||||
|
Quality of life: SGRQ (median change) |
|||||||||||||
|
1 |
RCT |
Serious1 |
No serious inconsistency |
No serious indirectness |
Serious2 |
None |
27 |
26 |
- |
Symptoms: -17.5 vs. -9.3, p=0.384
Activities: 0 vs. 0.4, p=0.727
Impacts: -0.2 vs. -0.9, p=0.849
Total: -1.6 vs. -1.5, p=0.621 |
LOW |
CRITICAL |
|
|
Fatigue |
|||||||||||||
|
0 |
No evidence from RCTs |
IMPORTANT |
|||||||||||
1 High risk of bias: possible issues with blinding; no ITT analysis.
2 Insufficient data to estimate precision.
Home-based psycoeducative intervention
|
Quality assessment |
No of patients |
Effect |
Quality |
Importance |
|||||||||
|
No of studies |
Design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Intervention |
Control |
Relative |
Absolute |
|||
|
Dyspnoea |
|||||||||||||
|
0 |
No evidence from RCTs |
||||||||||||
|
Quality of life: CRQ-M |
|||||||||||||
|
1 |
RCT |
Serious1 |
No serious inconsistency |
No serious indirectness |
Serious2 |
None |
30 |
27 |
Difference 3 mo post-intervention: 0.67 (0.18-1.17) p=0.016 |
- |
LOW |
CRITICAL |
|
|
Fatigue |
|||||||||||||
|
0 |
No evidence from RCTs |
IMPORTANT |
|||||||||||
1 High risk of bias: possible issues with blinding; no ITT analysis.
2 SMD = 0.70 (95%CI 0.16-1.24): CI includes 0.5.
Proactive palliative care
|
Quality assessment |
No of patients |
Effect |
Quality |
Importance |
|||||||||
|
No of studies |
Design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Intervention |
Control |
Relative |
Absolute |
|||
|
Dyspnoea |
|||||||||||||
|
0 |
No evidence from RCTs |
||||||||||||
|
Quality of life: SGRQ (change from baseline) |
|||||||||||||
|
1 |
RCT |
Very serious1 |
No serious inconsistency |
No serious indirectness |
No serious imprecision2 |
None |
62 |
88 |
3 months: MD -0.79 (-4.61 to 3.34, p=0.70) |
- |
LOW |
CRITICAL |
|
|
Serious3 |
55 |
70 |
6 months: MD -2.20 (-6.63 to 2.22, p=0.36) |
VERY LOW |
|||||||||
|
Serious4 |
53 |
69 |
9 months: MD -4.26 (-8.55 to 0.03, p=0.07) |
VERY LOW |
|||||||||
|
Serious5 |
45 |
63 |
12 months: MD -1.70 (‑6.71 to 3.32, p=0.54) |
VERY LOW |
|||||||||
|
Fatigue |
|||||||||||||
|
0 |
No evidence from RCTs |
IMPORTANT |
|||||||||||
1 High risk of bias: no randomization; possible issues with blinding; no ITT analysis.
2 SMD = -0.17 (95%CI -0.49 to 0.16).
3 SMD = -0.24 (95%CI -0.59 to 0.12); CI includes -0.5.
4 SMD = -0.36 (95%CI -0.72 to 0.00); CI includes -0.5.
5 SMD = -0.19 (95%CI -0.57 to 0.20); CI includes -0.5.
“Early” home-based nurse-led palliative care
|
Quality assessment |
No of patients |
Effect |
Quality |
Importance |
|||||||||
|
No of studies |
Design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Intervention |
Control |
Relative |
Absolute |
|||
|
Dyspnoea |
|||||||||||||
|
0 |
No evidence from RCTs |
||||||||||||
|
Quality of life: SF-36 |
|||||||||||||
|
1 |
RCT |
Serious1 |
No serious inconsistency |
No serious indirectness |
Very serious2 |
None |
26 |
23 |
“None of the SF-36 items differed significantly between groups at inclusion or during follow-up” |
- |
VERY LOW |
CRITICAL |
|
|
Fatigue |
|||||||||||||
|
0 |
No evidence from RCTs |
IMPORTANT |
|||||||||||
1 High risk of bias: no blinding.
2 Insufficient data to estimate precision (only reported in graphs in supplementary file).
“Early’home-based palliative care
|
Quality assessment |
No of patients |
Effect |
Quality |
Importance |
|||||||||
|
No of studies |
Design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Intervention |
Control |
Relative |
Absolute |
|||
|
Dyspnoea |
|||||||||||||
|
0 |
No evidence from RCTs |
||||||||||||
|
Quality of life: SF-36 – physical |
|||||||||||||
|
1 |
RCT |
Serious1 |
No serious inconsistency |
No serious indirectness |
Serious2 |
None |
16
|
13
|
6w: 28.7 vs. 24.3 |
- |
LOW |
CRITICAL |
|
|
Serious3 |
17 |
14 |
12w: 28.3 vs. 23.4 |
LOW |
|||||||||
|
Serious4 |
14 |
14 |
18w: 27.1 vs. 23.7 |
LOW |
|||||||||
|
Very serious5 |
13 |
12 |
24w: 23.6 vs. 22.9 |
VERY LOW |
|||||||||
|
Quality of life: SF-36 – mental |
|||||||||||||
|
1 |
RCT |
Serious1 |
No serious inconsistency |
No serious indirectness |
Very serious6 |
None |
16
|
13
|
6w: 38.2 vs. 38.1
|
- |
VERY LOW |
CRITICAL |
|
|
Serious7 |
17 |
14 |
12w: 40.7 vs. 36.4 |
LOW |
|||||||||
|
Very serious8 |
14 |
14 |
18w: 38.4 vs. 38.4 |
VERY LOW |
|||||||||
|
Very serious9 |
13 |
12 |
24w: 35.6 vs. 37.4 |
VERY LOW |
|||||||||
|
Fatigue |
|||||||||||||
|
0 |
No evidence from RCTs |
IMPORTANT |
|||||||||||
1 High risk of bias: no blinding; no ITT analysis.
2 SMD = 0.64 (95%CI -0.11 to 1.39); CI includes 0.5.
3 SMD = 0.70 (95%CI -0.03 to 1.43); CI includes 0.5.
4 SMD = 0.52 (95%CI -0.24 to 1.27); CI includes 0.5.
5 SMD = 0.11 (95%CI -0.68 to 0.89); CI includes 0.5 at both sides.
6 SMD = 0.04 (95%CI -0.69 to 0.77); CI includes 0.5 at both sides.
7 SMD = 0.41 (95%CI -0.30 to 1.13); CI includes 0.5.
8 SMD = 0.00 (95%CI -0.74 to 0.74); CI includes 0.5 at both sides.
9 SMD = -0.19 (95%CI -0.98 to 0.60); CI includes 0.5 at both sides.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-12-2021
Beoordeeld op geldigheid : 03-08-2021
Actualisatie
Deze richtlijn is goedgekeurd op 3 augustus 2021. De Long Alliantie Nederland (LAN) bewaakt samen met betrokken verenigingen de houdbaarheid van (de modules van) deze richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. De geldigheidstermijn van de richtlijn is maximaal 5 jaar na vaststelling. Indien de richtlijn dan nog actueel wordt bevonden, wordt de geldigheidsduur van de richtlijn verlengd.
Houderschap richtlijn
De houder van de richtlijn (LAN) moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen.
IKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis van richtlijnen
Een richtlijn is een kwaliteitsstandaard. Een kwaliteitsstandaard beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een kwaliteitsstandaard in het Register van Zorginstituut Nederland betekent dus niet noodzakelijkerwijs dat de in de kwaliteitsstandaard beschreven zorg verzekerde zorg is.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van elke zorgverlener, zowel BIG-geregistreerd als niet BIG-geregistreerd.
Algemene gegevens
Financiering
Deze richtlijn is gefinancierd door IKNL. De inhoud van de richtlijnis niet beïnvloed door de financierende instantie.
Procesbegeleiding
IKNL is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg dat zich richt op het continu verbeteren van de oncologische en palliatieve zorg.
IKNL benadert preventie, diagnose, behandeling, nazorg en palliatieve zorg als een keten waarin de patiënt centraal staat. Om kwalitatief goede zorg te waarborgen ontwikkelt IKNL producten en diensten ter verbetering van de oncologische zorg, de nazorg en de palliatieve zorg, zowel voor de inhoud als de organisatie van de zorg binnen en tussen instellingen. Daarnaast draagt IKNL nationaal en internationaal bij aan de beleidsvorming op het gebied van oncologische en palliatieve zorg.
IKNL rekent het (begeleiden van) ontwikkelen, implementeren en evalueren van multidisciplinaire, evidence-based richtlijnen voor de oncologische en palliatieve zorg tot een van haar primaire taken. IKNL werkt hierbij conform de daarvoor geldende (inter)nationale kwaliteitscriteria. Bij ontwikkeling gaat het in toenemende mate om onderhoud (modulaire revisies) van reeds bestaande richtlijnen.
Doel en doelgroep
Doel
Een richtlijn is een aanbeveling ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek en consensus. De richtlijn 'Palliatieve zorg bij COPD' geeft aanbevelingen over begeleiding en behandeling van mensen met gevorderde COPD en beoogt hiermee de kwaliteit van de zorgverlening te verbeteren.
Doelpopulatie
Deze richtlijn is gericht op mensen met gevorderde COPD met palliatieve zorgbehoeften. De markering van de palliatieve fase bij mensen met gevorderde COPD wordt besproken in module ‘Palliatieve zorg bij COPD’. Als in deze richtlijn geschreven wordt over ‘gevorderde COPD’ doelen wij op mensen met gevorderde COPD en palliatieve zorgbehoeften. Ten behoeve van de leesbaarheid van de richtlijn is gekozen voor de kortere term ‘gevorderde COPD’.
Deze richtlijn is geschreven met het oog op zorg aan alle mensen met gevorderde COPD, ongeacht hun levensbeschouwing, religie of cultuur. Hierbij dient rekening gehouden te worden met de gezondheidsvaardigheden van de patiënt (onder andere het gemak waarmee geschreven tekst begrepen wordt). Wanneer een andere dan een autochtoon Nederlandse religieuze/culturele achtergrond van de patiënt invloed heeft op de beleving en keuzes in de zorg rondom het levenseinde, raadpleeg dan, naast deze richtlijn, de handreiking 'Palliatieve zorg aan mensen met een niet-westerse achtergrond' [IKNL 2011]. Tevens is er van Pharos de folder 'Lessen uit gesprekken over leven en dood' met algemene voorlichting over palliatieve zorg aan mensen met een migratieachtergrond [Pharos 2017].
Doelgroep
Deze richtlijn is bestemd voor alle zorgverleners die betrokken zijn bij de zorg voor mensen met gevorderde COPD, zoals huisartsen, longartsen, specialisten ouderengeneeskunde, artsen voor verstandelijk gehandicapten, overige medisch specialisten, (long)verpleegkundigen, verpleegkundig specialisten, physician assistants, fysiotherapeuten, ergotherapeuten, logopedisten, diëtisten, overige paramedici, apothekers, geestelijk verzorgers, IKNL-consulenten en psychologen. De inhoud van de richtlijn is ook relevant voor zorgverleners in het maatschappelijke en sociale domein en vrijwilligers en hun coördinatoren die werkzaam zijn in de palliatieve en terminale fase. Indien in de richtlijn wordt gesproken over zorgverleners rondom mensen met COPD, kunnen afhankelijk van de specifieke situatie van de patiënt alle bovengenoemde zorgverleners bedoeld worden.
Samenstelling werkgroep
Alle werkgroepleden en klankbordleden zijn afgevaardigd namens wetenschappelijke, beroeps- en patiëntenverenigingen en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is geprobeerd rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
Het patiëntperspectief is vertegenwoordigd door het Longfonds.
Werkgroepleden
|
Naam |
Functie |
Rol |
Vereniging |
|
Mw. dr. D.J.A. Janssen |
Specialist ouderengeneeskunde en kaderarts palliatieve zorg |
Voorzitter |
Verenso |
|
Mw. dr. E.M.L. Verschuur |
Projectleider Compassion, onderzoeker, docent |
Lid kerngroep |
LAN |
|
Dhr. F.J. Allema |
Kaderhuisarts en scenarts |
|
CAHAG (NHG) |
|
Mw. M. Bryobhokun |
Manager zorg |
|
Longfonds |
|
Dhr. J. Donkers |
Longervaringsdeskundige |
|
Longfonds |
|
Mw. H.H. Eijsbroek |
Openbaar apotheker |
|
KNMP |
|
Dhr. dr. A.de Graeff |
Internist-oncoloog |
|
NIV, Palliactief |
|
Mw. dr. C.H.M. Houben |
Psycholoog en onderzoeker |
|
NIP/PAZ LVMP |
|
Dhr. dr. J.W. de Jong |
Longarts |
|
NVALT |
|
Mw. M. Liefting |
Gespecialiseerd longverpleegkundige, verpleegkundige palliatieve zorg |
|
V&VN Longverpleeg-kundigen, |
|
Dhr. W. van Litsenburg |
Verpleegkundig specialist |
|
V&VN Longverpleeg-kundigen |
|
Mw. P. van Melick |
Diëtist |
|
NVD |
|
Mw. dr. K.J.M. Mooren |
Longarts |
|
NVALT |
|
Mw. M.E. Sackman-Gerritsen |
Ergotherapeut |
|
Ergotherapie Nederland |
|
Mw. A.L. van der Valk |
Fysiotherapeut |
|
KNGF |
Klankbordleden
|
Naam |
Functie |
Vereniging |
|
Mw. dr. G. Boland |
Projectleider programma Preventie en zorg chronische aandoeningen |
Pharos |
|
Mw. T.J. Klemmeier |
Longverpleegkundige |
IMIS |
|
Mw. E. Kuin-van der Velde |
Verpleegkundig specialist |
V&VN Praktijkverpleegkundigen en Praktijkondersteuners |
|
Mw. dr. A. Leendertse |
Longervaringsdeskundige |
Longfonds |
|
Mw. A. van der Pouw |
Verpleegkundig specialist |
V&VN Verpleegkundig Specialisten, V&VN Longverpleegkundigen |
|
Mw. F.F. Stok |
Logopedist |
NVLF |
|
Mw. drs. ir. E. bij de Vaate |
Longarts |
Kenniscentra Complex Chronische Longaandoeningen |
|
Dhr. dr. E.C. Vasbinder |
Ziekenhuisapotheker, opleider |
NVZA |
Leden Pallialine.be-redactieraad (Federatie Palliatieve Zorg Vlaanderen)
|
Naam |
Functie |
Organisatie |
|
Dhr. N. Derycke |
Stafmedewerker, equipearts |
Palliatieve Hulpverlening Antwerpen (PHA) |
|
Mw. A. Janssen |
Wetenschappelijk medewerker |
Federatie palliatieve zorg Vlaanderen |
|
Dhr. J. Wens |
Huisarts, hoofddocent, professor general practice |
Universiteit Antwerpen |
Ondersteuning
|
Functie |
Organisatie |
|
|
Mw. B.C.M. Borggreve |
Procesbegeleider, adviseur richtlijnen |
IKNL |
|
Mw. C.A. van den Berg |
Procesbegeleider, adviseur richtlijnen |
IKNL |
|
Mw. F.E.A.H. Essers |
Secretaresse |
IKNL |
|
Dhr. J. Vlayen |
Literatuuronderzoeker |
ME/TA |
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke en beroepsverenigingen.
Alle leden van de richtlijnwerkgroep hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Een onafhankelijkheidsverklaring ‘Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling' zoals vastgesteld door onder meer de KNAW, KNMG, Gezondheidsraad, CBO, NHG en Orde van Medisch Specialisten is door de werkgroepleden bij aanvang en bij afronding van het traject ingevuld. Deze vindt u in onderstaande tabel. De ondertekende belangenverklaring zijn opvraagbaar via info@iknl.nl,
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen voor aanvang |
Ondernomen actie |
Gemelde belangen na afronding |
Ondernomen actie |
|
D. Janssen |
|
Geen |
|
Geen |
|
Geen |
|
E. Verschuur |
|
Geen |
Geen |
- |
Geen |
- |
|
F. Allema |
|
|
|
Geen |
|
Geen |
|
M. Bryobhokun |
|
Geen |
|
Geen |
|
Geen |
|
J. Donkers |
|
|
Geen |
- |
Geen |
- |
|
H. Eijsbroek |
|
Geen |
|
Geen |
|
Geen |
|
A. de Graeff |
|
Geen |
Geen |
- |
Geen |
- |
|
C. Houben |
|
|
Geen |
- |
Geen |
- |
|
J.W. de Jong |
|
Geen |
Geen |
- |
Geen |
- |
|
M. Liefting |
|
Geen |
Geen |
- |
Geen |
- |
|
W. van Litsenburg |
|
|
Geen |
- |
Geen |
- |
|
P. van Melick |
|
|
Geen |
- |
Geen |
- |
|
K. Mooren |
|
|
Geen |
- |
Geen |
- |
|
M. Sacksman |
|
|
Geen |
- |
Geen |
- |
|
A. van der Valk |
|
|
|
Geen |
|
Geen |
|
Klankbordlid |
Functie |
Nevenfuncties |
Gemelde belangen voor aanvang |
Ondernomen actie |
Gemelde belangen na afronding |
Ondernomen actie |
|
G. Boland |
|
Geen |
Geen |
- |
Geen |
- |
|
T. Klemmeier |
|
|
Geen |
- |
Geen |
- |
|
E. Kuin |
|
|
Geen |
- |
Geen |
- |
|
A. van der Pouw |
|
|
Geen |
- |
Geen |
- |
|
F. Stok |
|
|
|
Geen |
|
Geen |
|
E. bij de Vaate |
|
|
|
Geen |
|
Geen |
|
E. Vasbinder |
|
|
|
- |
|
- |
Inbreng patiëntenperspectief
Twee patiëntvertegenwoordigers namen (via het Longfonds) zitting in de richtlijnwerkgroep: een ervaringsdeskundige (patiënt met COPD) en een beleidsmedewerker van het Longfonds. De input van patiëntvertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Door middel van onderstaande werkwijze is informatie verkregen en zijn de belangen van de patiënt meegenomen:
- Bij aanvang van het richtlijntraject hebben de patiëntvertegenwoordigers knelpunten aangeleverd.
- Via het Longfonds en sociale media is een enquête gehouden voor het inventariseren van knelpunten.
- De patiëntvertegenwoordigers waren aanwezig bij de vergaderingen van de richtlijnwerkgroep.
- De patiëntvertegenwoordigers hebben de conceptteksten beoordeeld om het patiëntperspectief in de formulering van de definitieve tekst te optimaliseren.
- Pharos heeft de conceptteksten beoordeeld om het patiëntperspectief voor mensen met beperkte gezondheidsvaardigheden in de formulering van de definitieve tekst zo goed mogelijk weer te geven.
- Het Longfonds is geconsulteerd in de externe commentaarronde.
- Het Longfonds heeft ingestemd met de inhoud van de richtlijn.
Informatie voor patiënten en/of een patiëntsamenvatting wordt opgesteld en gepubliceerd op de daarvoor relevante sites zoals bijvoorbeeld Thuisarts en www.overpalliatievezorg.nl.
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn. Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat zorgverleners de nieuwe kennis en kunde opnemen in hun routines van de palliatieve zorgpraktijk, inclusief borging daarvan. Als onderdeel van elke richtlijn stelt IKNL samen met de richtlijnwerkgroep een implementatieplan op. Activiteiten en interventies voor verspreiding en implementatie vinden zowel op landelijk als regionaal niveau plaats. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme. Informatie hierover is te vinden op https://iknl.nl/.
Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor de verschillende disciplines. Vragen over het implementatieplan kunnen gesteld worden aan info@iknl.nl.
Werkwijze
Elke module van de richtlijn bestaat uit een richtlijntekst. De teksten naar aanleiding van de uitgangsvragen zijn opgebouwd volgens het volgende vaste stramien: uitgangsvraag en aanbevelingen, literatuurbespreking, conclusies en overwegingen. De referenties zijn aangeleverd per module (of paragraaf) en de evidence tabellen en GRADE profielen staan in de bijlagen. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek. De modules die betrekking hebben op de onderwerpen palliatieve zorg bij COPD, ACP, angst, depressie, dyspneu en prikkelhoest zijn via de evidence-based systematische methodiek uitgewerkt. De modules die betrekking hebben op de onderwerpen organisatie van zorg, voorlichting, het sociale domein en zingeving & spiritualiteit zijn zonder systematisch literatuuronderzoek uitgewerkt, omdat de werkgroep verwachtte geen studies te vinden die antwoord geven op de vraag, specifiek voor de Nederlandse situatie.
De GRADE-methodiek
De modules die betrekking hebben op de onderwerpen palliatieve zorg bij COPD, ACP, angst, depressie, dyspneu en prikkelhoest zijn via de evidence-based GRADE methodiek uitgewerkt.
Selectie
Naast de selectie op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
- Gerandomiseerde gecontroleerde studies (RCT's).
- Niet gerandomiseerde gecontroleerde studies (CCT's).
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Kwaliteit van bewijs |
Onderzoeksopzet |
Verlagen als |
Verhogen als |
|
Hoog (A) |
Gerandomiseerde studie |
Beperkingen in de onderzoeksopzet -1 ernstig -2 zeer ernstig
Inconsistenties -1 ernstig -2 zeer ernstig
Indirectheid -1 ernstig -2 zeer ernstig
Imprecisie -1 ernstig -2 zeer ernstig
Publicatiebias -1 waarschijnlijk -2 zeer waarschijnlijk |
Sterke associatie + 1 sterk + 2 zeer sterk
Dosis-respons relatie + 1 bewijs voor deze relatie
Aanwezigheid van plausibele residuele confounding + 1 zou een aangetoond effect verminderen, of + 1 zou een onterecht effect suggereren als de resultaten geen effect laten zien |
|
Matig (B) |
|
||
|
Laag (C) |
Observationele studie |
||
|
Zeer laag (D) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn. Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs.
Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
- De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
- De uitkomstmaten wijzen in dezelfde richting (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen van de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat... (Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat... (Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat.... (Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat.... (Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag. |
||
Overwegingen en aanbevelingen
Aanbevelingen in richtlijnen geven een antwoord op de uitgangsvraag. De GRADE methodiek kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van de aanbevelingen reflecteert de mate van vertrouwen waarin - voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Tabel 3. Gradering van aanbevelingen
|
Sterkte aanbeveling |
Cijfer |
|
Sterke aanbeveling |
1 |
|
Zwakke aanbeveling |
2 |
|
Kwaliteit van de evidence |
Letter |
|
Hoog |
A |
|
Matig |
B |
|
Laag |
C |
|
Zeer laag |
D |
Formulering:
- Sterke aanbeveling: Doe / geef / enzovoort (gebiedende wijs)
- Zwakke/conditionele aanbeveling: Overweeg te doen / te geven / enzovoort
Naast het bewijs uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.
Figuur 1. Van bewijs naar aanbeveling
Bij de overwegingen kon men informatie kwijt over:
- veiligheid (bijvoorbeeld bijwerkingen, risico’s en complicaties)
- patiëntperspectief (waarden en voorkeuren van de patiënt)
- professioneel perspectief (bijvoorbeeld tijdsbesparing)
- beschikbaarheid, werkbaarheid en wenselijkheid van organisatie van zorg aspecten: kosten, voorzieningen, coördinatie, communicatie, gegevensverwerking, taakverdeling, verantwoordelijkheden, enzovoort
- kosteneffectiviteit, hierbij wordt aandacht besteed aan het perspectief (maatschappelijk perspectief versus gezondheidszorgperspectief)
Bij overwegingen kan men denken aan alle aspecten die niet vallen onder de systematische literatuuranalyse bij de uitgangsvraag, maar wel van belang zijn bij het formuleren van de aanbeveling.
Wijzigingen
Bij het opstellen van de conceptrichtlijn zijn enkele wijzigingen in de evidence-based uitgangsvragen doorgevoerd.
Binnen de module niet-medicamenteuze behandeling van dyspneu werd onder andere gezocht naar de effecten van voorlichting en de effecten van niet-invasieve beademing op dyspneu. Tijdens het schrijven van de modules is besloten de resultaten van de onderzoeksvraag Wat is het effect van voorlichting op dyspneu bij mensen met COPD? onder te brengen bij de module Voorlichting.
Tijdens het schrijven van de submodule Niet-invasieve beademing is besloten deze submodule niet meer evidence-based, maar consensus-based te schrijven. De rationale hiervoor is beschreven in de inleiding van deze submodule.
Tijdens het schrijven van module Hoesten is besloten de uitgangsvraag te wijzigen van Welke (niet-) medicamenteuze palliatieve behandeling is geschik voor hoesten bij mensen met gevorderde COPD? te wijzigen in Welke (niet-)medicamenteuze palliatieve behandeling is geschik voor prikkelhoest bij mensen met gevorderde COPD? De rationale hiervoor is beschreven in de inleiding van deze module.
Methodiek bij de modules zonder systematisch literatuuronderzoek
Bij de modules die betrekking hebben op de onderwerpen organisatie van zorg, voorlichting, het sociale domein en zingeving & spiritualiteit is geen systematisch literatuuronderzoek verricht, omdat de werkgroep verwachtte geen studies te vinden die antwoord geven op de vraag, specifiek voor de Nederlandse situatie.
Per module waren één of meerdere werkgroepleden verantwoordelijk voor het schrijven van de samenvatting literatuur, overwegingen, conclusies en aanbevelingen. De gehele werkgroep kon schriftelijk of tijdens de plenaire bijeenkomsten commentaar geven op deze teksten en aanbevelingen. Uiteindelijk werden de definitieve aanbevelingen in de plenaire bijeenkomst geaccordeerd.
De aanbevelingen zijn uitsluitend gebaseerd op overwegingen die zijn opgesteld door de werkgroepleden op basis van kennis uit de praktijk en waar mogelijk onderbouwd door (niet systematisch) literatuuronderzoek.
De teksten zijn gebaseerd op bewijs uit de literatuur, maar de artikelen zijn niet methodologisch beoordeeld. De overwegingen staan onder een apart kopje in de richtlijntekst. Hierin wordt de context van de dagelijkse praktijk beschreven en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties.
Evaluatie
De evaluatie van de richtlijn zal worden uitgevoerd door de regiehoudende vereniging.
Zoekverantwoording
2861 unique hits were screened on title and abstract (Table 1). Of these, 2804 were excluded. The most important reasons for exclusion were:
- Other intervention: interventions other than palliative interventions
- Wrong study design: narratieve reviews, case reports, letters, etc.
- Wrong study population: study was not about COPD
Of the remaining 57 papers, the full-text was retrieved. Based on the full-text, an additional 50 papers were excluded. Table 2 provides an overview of the excluded studies with reasons.
Table 1. Overall search results.
|
Database |
Number of hits |
|
OVID Medline |
1600 |
|
OVID PreMedline |
54 |
|
EMBASE.com |
1564 |
|
Cochrane Database of Systematic Reviews |
34 |
|
CENTRAL |
641 |
|
Cinahl |
467 |
|
Total hits |
4360 |
|
N excluded (language, duplicates) |
1499 |
|
Total unique eligible hits |
2861 |
Table 2. Overview of excluded studies based on full-text evaluation.
Search strings
MEDLINE (OVID)
1 Palliative Care/ (52422)
2 exp Terminal Care/ (50095)
3 Terminally Ill/ (6397)
4 palliat*.mp. (83314)
5 (terminal* adj6 (care or caring or ill*)).mp. (36149)
6 (terminal-stage* or terminal stage* or dying or (close adj6 death)).mp. (34178)
7 (end adj3 life).mp. (20123)
8 hospice*.mp. (14894)
9 ((end-stage* or end stage*) adj6 (disease* or ill* or care or caring)).mp. (43543)
10 ((incurable or advanced) adj6 (ill* or disease*)).mp. (47734)
11 1 or 2 or 3 or 4 or 5 or 6 or 7 or 8 or 9 or 10 (241121)
12 Lung Diseases, Obstructive/ (18159)
13 exp Pulmonary Disease, Chronic Obstructive/ (53627)
14 emphysema$.mp. (32776)
15 (chronic$ adj3 bronchiti$).mp. (10878)
16 (obstruct$ adj3 (pulmonary or lung$ or airway$ or airflow$ or bronch$ or respirat$)).mp. (104663)
17 COPD.mp. (37889)
18 COAD.mp. (253)
19 COBD.mp. (17)
20 AECB.mp. (210)
21 or/12-20 (140207)
22 11 and 21 (3475)
23 limit 22 to yr="2009 -Current" (1600)
PREMEDLINE (OVID)
1 Palliative Care/ (113)
2 exp Terminal Care/ (95)
3 Terminally Ill/ (6)
4 palliat*.mp. (1851)
5 (terminal* adj6 (care or caring or ill*)).mp. (253)
6 (terminal-stage* or terminal stage* or dying or (close adj6 death)).mp. (702)
7 (end adj3 life).mp. (925)
8 hospice*.mp. (381)
9 ((end-stage* or end stage*) adj6 (disease* or ill* or care or caring)).mp. (1092)
10 ((incurable or advanced) adj6 (ill* or disease*)).mp. (1096)
11 1 or 2 or 3 or 4 or 5 or 6 or 7 or 8 or 9 or 10 (4967)
12 Lung Diseases, Obstructive/ (5)
13 exp Pulmonary Disease, Chronic Obstructive/ (133)
14 emphysema$.mp. (268)
15 (chronic$ adj3 bronchiti$).mp. (64)
16 (obstruct$ adj3 (pulmonary or lung$ or airway$ or airflow$ or bronch$ or respirat$)).mp. (1359)
17 COPD.mp. (864)
18 COAD.mp. (6)
19 COBD.mp. (0)
20 AECB.mp. (0)
21 or/12-20 (1745)
22 11 and 21 (58)
23 limit 22 to yr="2009 -Current" (54)
EMBASE (VIA EMBASE.COM)
#1 'chronic obstructive lung disease'/exp (127439)
#2 emphysema*:ti,ab (36093)
#3 (chronic* NEAR/3 bronchiti*):ti,ab (15253)
#4 (obstruct* NEAR/3 (pulmonary OR lung* OR airway* OR airflow* OR bronch* OR respirat*)):ti,ab (120989)
#5 copd:ti,ab OR coad:ti,ab OR cobd:ti,ab OR aecb:ti,ab (82444)
#6 #1 OR #2 OR #3 OR #4 OR #5 (226402)
#7 'palliative therapy'/exp (106665)
#8 'terminal care'/exp (67127)
#9 'terminally ill patient'/exp (8354)
#10 palliat*:ti,ab (112637)
#11 (terminal* NEAR/6 (care OR caring OR ill*)):ti,ab (12585)
#12 (end NEAR/3 life):ti,ab (32777)
#13 hospice*:ti,ab (18760)
#14 'terminal stage*':ti,ab (4263)
#15 dying:ti,ab (43229)
#16 (close NEAR/6 death):ti,ab (1276)
#17 ((incurable OR advanced) NEAR/6 (ill* OR disease*)):ti,ab (86919)
#18 #7 OR #8 OR #9 OR #10 OR #11 OR #12 OR #13 OR #14 OR #15 OR #16 OR #17 (330156)
#19 #6 AND #18 (6099)
#20 #6 AND #18 AND ([article]/lim OR [article in press]/lim OR [review]/lim) AND ([dutch]/lim OR [english]/lim) AND ([embase]/lim OR [medline]/lim) AND [2009-2020]/py AND [medline]/lim (1564)
COCHRANE LIBRARY (VIA WILEY)
#1 MeSH descriptor: [Lung Diseases, Obstructive] explode all trees
#2 MeSH descriptor: [Pulmonary Disease, Chronic Obstructive] explode all trees
#3 emphysema*:ti,ab
#4 (chronic* NEAR/3 bronchiti*):ti,ab
#5 (obstruct* NEAR/3 (pulmonary or lung* or airway* or airflow* or bronch* or respirat*)):ti,ab
#6 COPD:ti,ab
#7 COAD:ti,ab
#8 COBD:ti,ab
#9 AECB:ti,ab
#10 #1 OR #2 OR #3 OR #4 OR #5 OR #6 OR #7 OR #8 OR #9
#11 MeSH descriptor: [Palliative Care] explode all trees
#12 MeSH descriptor: [Terminal Care] explode all trees
#13 MeSH descriptor: [Terminally Ill] explode all trees
#14 pallia*:ti,ab
#15 (terminal* NEAR/6 (care or caring or ill*)):ti,ab
#16 (terminal-stage* or terminal stage* or dying or (close NEAR/6 death)):ti,ab
#17 (end NEAR/3 life):ti,ab
#18 hospice*:ti,ab
#19 ((end-stage* or end stage*) NEAR/6 (disease* or ill* or care or caring)):ti,ab
#20 ((incurable or advanced) NEAR/6 (ill* or disease*))
#21 #11 or #12 or #13 or #14 or #15 or #16 or #17 or #18 or #19 or #20
#22 #10 AND #21 with Cochrane Library publication date Between Jan 2009 and Dec 2019
CINAHL
S1 (MH "Pulmonary Disease, Chronic Obstructive+") OR (MH "Lung Diseases, Obstructive+") (53845)
S2 emphysema* (4635)
S3 (chronic* N3 bronchiti*) (1067)
S4 (obstruct* N3 (pulmonary or lung* or airway* or airflow* or bronch* or respirat*)) (33148)
S5 COPD or COAD or COBD or AECB (20025)
S6 S1 OR S2 OR S3 OR S4 OR S5 (68153)
S7 MH Palliative Care (32587)
S8 MH Terminal Care (16418)
S9 MH Terminally Ill (12241)
S10 palliat* (47716)
S11 terminal* N3 (care OR caring OR ill*) (26701)
S12 terminal-stage* OR terminal stage* OR dying OR (close N5 death) (14791)
S13 end N2 life (18419)
S14 hospice* (18627)
S15 (end-stage* or end stage*) N5 (disease* or ill* or care or caring) (10411)
S16 (incurable or advanced) N5 (ill* or disease*) (10905)
S17 S7 OR S8 OR S9 OR S10 OR S11 OR S12 OR S13 OR S14 OR S15 OR S16 (99855)
S18 S6 AND S17 -> Limiters/Expanders: Limiters - Published Date: 20090101-20191231; Exclude MEDLINE records; Language: Dutch/Flemish, English; Expanders - Apply equivalent subjects (467)
