Proactieve zorgplanning bij COPD
Uitgangsvraag
Welke rol speelt proactieve zorgplanning (advance care planning, ACP) bij de zorg voor mensen met gevorderde COPD en hun naasten?
Aanbeveling
- Ga tijdig het gesprek over ACP aan met de patiënt. Gebruik voor het juiste moment de criteria en signalen van patiënten zoals aangegeven in de module ‘Palliatieve zorg bij COPD’. (1D)
- Overleg met andere betrokken zorgverleners over het multidisciplinair organiseren van gestructureerde ACP met oog voor ieders eigen expertise. (1D)
- Voer een gesprek over ACP of laat dit gesprek voeren door een andere bij de zorg betrokken en in ACP geschoolde zorgverlener. (1D)
- Betrek de naasten van een patiënt bij een gesprek over ACP. (1D)
- Stem de inhoud van een gesprek over ACP af op de wensen en behoeften van patiënt en diens naasten. Onderwerpen die in ACP aan de orde kunnen komen, zijn onder meer:
- nagaan wat de patiënt weet van zijn ziekte en welke verwachtingen hij heeft omtrent de toekomst met de ziekte
- levensbeschouwing en culturele achtergrond
- (niet)-behandelafspraken (zoals (niet-)invasieve beademing)
- angst om te stikken
- ziekenhuisopnames
- plaats van zorg en sterven
- crisissituaties (onder andere refractaire symptomen)
- wilsverklaring
- wettelijke vertegenwoordiging in de situatie van (acute) verslechtering en wilsonbekwaamheid
- levenseindebeslissingen (onder meer vochttoediening, voeding, antibiotica, reanimatie, staken van niet-invasieve beademing, uitzetten van implanteerbare cardioverter defibrillator (ICD), palliatieve sedatie, euthanasie, orgaandonatie, bewust stoppen met eten en drinken)
- nazorg
Wees u hierbij bewust van de barrières, zowel bij uzelf als zorgverlener als bij de patiënt en diens naasten. (1D)
- Stem inhoud van het gesprek over ACP af op de gezondheidsvaardigheden van de patiënt en diens naasten. (1)
- Leg de gemaakte afspraken over ACP vast in het dossier van de patiënt en in het individueel zorgplan. (1D)
- Communiceer en evalueer minimaal jaarlijks en zo nodig vaker met de patiënt en diens naasten om (levens)doelen en keuzes van de patiënt bij te stellen. (1D)
Overwegingen
Een survey studie onder 256 Nederlandse longartsen laat zien dat 82% van de respondenten ACP belangrijk vindt [Duenk 2017]. Een Ierse studie onder diverse zorgverleners, zoals huisartsen, verpleegkundigen en fysiotherapeuten, laat zien dat de beroepshouding ten aanzien van ACP positief is [Meehan 2019]. Een systematische review heeft aangetoond dat ACP een positief effect heeft op het aantal voltooide wilsverklaringen, het plaatsvinden van discussies over ACP en de mate van overeenstemming tussen gewenste en geleverde zorg in diverse volwassen patiëntenpopulaties [Houben 2014]. Ondanks voornoemde positieve beroepshouding wordt ACP in de klinische praktijk relatief weinig toegepast bij mensen met COPD. In de literatuur worden diverse door zorgverleners ervaren barrières beschreven voor ACP, zoals het gebrek aan vertrouwen om het gesprek over ACP aan te gaan, gebrek aan tijd, onzekerheid over het verloop van de ziekte, de gebrekkige kennis van de patiënt over zijn ziekte en prognose en de aanname dat ACP hoop wegneemt bij de patiënt en onnodig leidt tot stress [Jabbarian 2018 en Knauft 2005]. Hier tegenover staat dat zorgverleners die zelf in de privésfeer geconfronteerd zijn met een overlijden meer genegen zijn om ACP te agenderen [Meehan 2019]. Zorgverleners geven aan behoefte te hebben aan training op het gebied van ACP, waarbij ze vooral informatie wensen over de timing en juridische kant van ACP [Kelleher 2020]. Training helpt hen kennis over ACP te vergroten en leidt tot meer vertrouwen in het aangaan van een ACP-gesprek. Tevens geven zij aan dat wanneer er in de maatschappij meer bewustzijn gecreëerd zou worden ten aanzien van ACP, het initiëren van een dergelijk gesprek makkelijker zou zijn.
Patiënten en naasten geven op hun beurt aan ACP-gesprekken niet te initiëren vanuit de aanname dat de zorgverlener het onderwerp zal aansnijden als die dat nodig vindt [Heffner 1996]. Ze zijn zich onvoldoende bewust van de ernst van hun ziekte, hebben vaak onvoldoende kennis en gezondheidsvaardigheden over COPD en medische zaken en interpreteren achteruitgang als passend bij de leeftijd en relateren het niet aan COPD [Patel 2012]. Patiënten geven tevens aan informatie over hun ziekte op prijs te stellen, mits dit op een empathische manier wordt gedaan [Jabbarian 2018]. Patiënten die ervaring hebben met ACP en/of de dood geven aan makkelijker een ACP-gesprek te initiëren. Een goede arts-patiëntrelatie en de ervaring van de arts met ACP en behandeling van COPD worden eveneens als bevorderende factoren benoemd [Knauft 2005]. Naasten hebben vaak beperkt contact met de arts van de patiënt. Hierdoor zijn ze mogelijk minder betrokken bij het ziekteproces en beschikken ze over onvoldoende informatie over het ziekteverloop en de te verwachten zorgen over de toekomst [Simon 2015 en Van den Heuvel 2016].
Tavares heeft in een kwalitatieve studie gekeken naar de visie van mensen met COPD op ACP [Tavares 2020]. Hij heeft 33 patiënten geïnterviewd met verschillende stadia van COPD. Patiënten geven aan dat ze het gesprek over ACP het liefste voeren met een zorgverlener die veel kennis van zaken heeft en met wie ze een goede band hebben, meestal de medisch specialist. Patiënten willen graag veel informatie over de ziekte en de behandeling, maar rapporteren juist een gebrek daaraan. Patiënten wachten veelal op het initiatief van de arts voor een ACP-gesprek, zelfs wanneer ze zelf achteruitgang in hun gezondheid bemerken.
Concluderend kan gesteld worden dat er zeker behoefte is aan meer geplande en gestructureerde ACP, zowel vanuit zorgverleners- als patiëntenperspectief. Echter, er zijn verschillende factoren die implementatie in de klinische praktijk bemoeilijken.
Ten eerste is het in de klinische praktijk vaak onduidelijk wie verantwoordelijk is voor het oppakken van ACP. Actieve samenwerking en communicatie tussen zorgverleners komt in het algemeen weinig voor [O’Hare 2016]. De studie van Duenk et al. onder Nederlandse longartsen laat zien dat er een voorkeur is voor een interdisciplinaire benadering, waarbij alle zorgverleners met ieder hun eigen expertise een belangrijke rol spelen [Duenk 2017]. De studie van Houben et al. [2019] laat bijvoorbeeld de meerwaarde zien ten aanzien van communicatie van een interventie uitgevoerd door een getrainde longverpleegkundige, in afstemming met de behandelend longarts. Ook de huisarts en praktijkondersteuner kunnen ACP op een vergelijkbare wijze op zich nemen. Zeker gezien de hoge mate van comorbiditeit bij mensen met COPD en daardoor de betrokkenheid van diverse medisch specialisten is samenwerking en onderlinge communicatie van belang [Wong 2015]. De werkgroep is dan ook van mening dat voor goede ACP een multidisciplinaire benadering met goede onderlinge communicatie, ook tussen de eerste, tweede en derde lijn, cruciaal is. Overleg met andere betrokken zorgverleners over hoe gestructureerde ACP georganiseerd kan worden met oog voor ieders eigen expertise is hiervoor noodzakelijk. Zie hiervoor ook module 'Organisatie van zorg'.
Onderzoek heeft aangetoond dat ACP het meest succesvol is wanneer patiënten en hun naasten betrokken worden bij de gesprekken [Fried 2017]. Indien naasten een beslissing moeten nemen voor de patiënt in de laatste levensfase, voelen zij zich minder onzeker wanneer zij op de hoogte zijn van de wensen van de patiënt [Fried 2008 en Vig 2007]. Naasten blijken vaak niet op de hoogte te zijn van de voorkeuren voor zorg rondom het levenseinde van de patiënt [Shalowitz 2006] en zijn geneigd de mate waarin een patiënt levensverlengende behandelingen wenst te overschatten [Bravo 2016]. De werkgroep adviseert dan ook om naasten, bij voorkeur de wettelijke vertegenwoordiger(s), actief te betrekken bij ACP.
Ten tweede is het bepalen van het juiste moment voor de start van ACP bij mensen met COPD een uitdaging vanwege het onvoorspelbare ziekteverloop, het gebrek aan prognostische indicatoren [Hajizadeh 2015; zie ook module ‘Palliatieve zorg bij COPD’] en de overleving van eerdere longaanvallen [Vermijlen 2015]. De studie van Duenk laat zien dat 92% van de longartsen denkt de start van de palliatieve fase bij COPD aan te kunnen wijzen [Duenk 2017], hetgeen suggereert dat artsen in staat zijn tijdig voorkeuren voor zorg rondom het levenseinde te bespreken. Echter, onderzoek heeft laten zien dat ACP weinig wordt toegepast bij mensen met gevorderde COPD en dat dit ook niet verandert richting het levenseinde [Houben 2015]. In module ‘Palliatieve zorg bij COPD’ worden criteria aangegeven om palliatieve zorg in te zetten. Dit kan het moment zijn om het gesprek over ACP aan te gaan. Daarnaast is het belangrijk om voor het initiëren van ACP te luisteren naar signalen die de patiënt afgeeft [de Vleminck 2016] en rekening te houden met de vraag of een patiënt klaar is voor een gesprek. Ook kan ACP en educatie hierover geïntegreerd worden in longrevalidatieprogramma’s en geriatrische revalidatieprogramma’s.
Ten derde is het niet duidelijk welke elementen verantwoordelijk zijn voor effectieve ACP. Op basis van het Kwaliteitskader palliatieve zorg Nederland [IKNL/Palliactief 2017] en expertise is de werkgroep van mening dat de volgende onderwerpen onder meer aan de orde kunnen komen in een ACP-gesprek:
- nagaan wat de patiënt weet van zijn ziekte en welke verwachtingen hij heeft ten aanzien van de toekomst met de ziekte
- levensbeschouwing en culturele achtergrond
- (niet)-behandelafspraken (bijvoorbeeld niet-invasieve beademing)
- angst om te stikken
- ziekenhuisopnames
- plaats van zorg en sterven
- crisissituaties (onder andere refractaire symptomen)
- wilsverklaring
- wettelijke vertegenwoordiging in de situatie van (acute) verslechtering en wilsonbekwaamheid
- levenseindebeslissingen (onder meer vochttoediening, voeding, antibiotica, reanimatie, staken van niet-invasieve beademing, uitzetten van implanteerbare cardioverter defibrillator (ICD), palliatieve sedatie, euthanasie, orgaandonatie, bewust stoppen met eten en drinken)
- nazorg
In het contact met mensen met COPD moet rekening worden gehouden met hun gezondheidsvaardigheden. Bij COPD zijn lage gezondheidsvaardigheden geassocieerd met ernstiger ziektebeloop [Omachi 2012]. Met gezondheidsvaardigheden (zoals het gemak waarmee geschreven en gesproken tekst begrepen wordt) dient rekening gehouden te worden bij het voeren van een gesprek over ACP. Verschillende gesprekstools zijn ontwikkeld die mensen helpen na te denken en te praten met hun naasten en/of zorgverleners over hun wensen, zoals levenseinde.patientenfederatie.nl, https://www.thuisarts.nl/levenseinde en https://www.ikwilmetjepraten.nu/). Zorgverleners kunnen patiënten en hun naasten hiernaar verwijzen.
Voor mensen met een niet-westerse achtergrond wordt verwezen naar de ‘Handreiking ‘Palliatieve zorg bij mensen met een niet-westerse achtergrond’ [Nivel/IKNL/Pharos 2011].
Het is van belang de afspraken die tijdens het ACP-gesprek zijn gemaakt, vast te leggen in zowel het patiëntendossier als in het individueel zorgplan. Voor het vastleggen van behandelbesluiten kan ook gebruik gemaakt worden van het uniform format voor het vastleggen van ACP [PZNL 2020]. Het individueel zorgplan wordt meegegeven aan de patiënt, zodat hij eigen regie en zelfmanagement kan behouden of vergroten. Indien andere betrokken zorgverleners geen toegang hebben tot het patiëntendossier, breng hen dan zo nodig op andere wijze op de hoogte. De werkgroep is van mening dat voor effectieve ACP het noodzakelijk is om reeds bekende barrières te overwinnen en bevorderende factoren te stimuleren.
Tot slot is het belangrijk om ACP te zien als een continu en dynamisch proces van communicatie met regelmatige evaluatie en mogelijke bijstelling van (levens-)doelen en keuzes van de patiënt. Voer een ACP-gesprek minimaal jaarlijks en vaker als de situatie daarom vraagt of op aangeven van de patiënt en diens naasten.
Onderbouwing
Achtergrond
Proactieve zorgplanning (advance care planning, ACP) stelt mensen in staat hun levensdoelen en voorkeuren voor toekomstige medische zorg en behandeling te bepalen, deze levensdoelen en voorkeuren te bespreken met naasten en zorgverleners en vast te leggen en indien nodig tussentijds te herzien. Proactieve zorgplanning is een belangrijke voorwaarde voor het verlenen van hoogwaardige palliatieve zorg en is daarmee een essentieel onderdeel van palliatieve zorg voor mensen met COPD. Hoewel de aandacht voor proactieve zorgplanning de laatste decennia is toegenomen, wordt het nog maar beperkt toegepast in de praktijk. In deze richtlijn hanteren we voor proactieve zorgplanning (ACP) de definitie van het Kwaliteitskader palliatieve zorg Nederland [IKNL/Palliactief 2017].
Conclusies / Summary of Findings
|
Zeer lage GRADE |
Er is bewijs van zeer lage kwaliteit dat vroegtijdige palliatieve zorg (inclusief aandacht voor ACP) leidt tot een hoger aantal opnames op intensive care omwille van respiratoir falen. Het bewijs is beperkt tot één gerandomiseerde studie met allocation bias en een kleine populatie (waardoor het resultaat weinig precies is). Bij correctie voor multiple testing was het verschil niet significant. [Janssens 2019] |
|
Zeer lage GRADE |
Er is bewijs van lage tot zeer lage kwaliteit dat het gebruik van een patiënt-specifiek feedback formulier, met onder andere informatie over de gewenste zorg rondom het levenseinde en ACP, leidt tot een verbeterde communicatie over het levenseinde. Het bewijs is gebaseerd op twee gerandomiseerde studies. [Au 2012, Houben 2019] |
|
Geen GRADE |
Over het effect van ACP op de plaats van zorg kan geen uitspraak gedaan worden bij gebrek aan gerandomiseerde studies. |
|
Geen GRADE |
Over het effect van ACP op de plaats van overlijden kan geen uitspraak gedaan worden bij gebrek aan gerandomiseerde studies. |
Samenvatting literatuur
Literatuurbespreking
De literatuurzoektocht identificeerde drie relevante systematische reviews:
- Jabbarian et al. zochten naar kwantitatieve en kwalitatieve studies die het effect onderzochten van ACP bij volwassenen met een chronische longaandoening (zoekdatum juni 2015) [Jabbarian 2018]. Van de 21 geïncludeerde studies betroffen 13 studies patiënten met COPD, één hiervan was een gerandomiseerde studie. Au et al. randomiseerden in een cluster-RCT 92 clinici en 376 patiënten met COPD naar enerzijds een interventie om de communicatie over eindelevenszorg te verbeteren (N=194) en anderzijds reguliere zorg (N=182) [Au 2012]. In de interventiegroep werd gebruik gemaakt van een patiënt-specifiek feedback formulier, met onder andere informatie over de gewenste zorg rondom het levenseinde en ACP. Dit formulier werd gedeeld met de behandelend arts. De primaire uitkomstmaat was de kwaliteit van communicatie over het levenseinde, gemeten met het domein ‘communicatie over het levenseinde’ van de Quality of Communication (QOC) vragenlijst.
- Meehan et al. zochten naar studies, gepubliceerd tussen januari 2009 en mei 2019, die het effect onderzochten van ACP specifiek bij patiënten met COPD [Meehan 2019]. Ze vonden 28 studies, waarvan 4 gerandomiseerde studies. In één studie [Duenk 2017] maakte ACP echter deel uit van een bredere palliatieve interventie. Twee andere studies [Sinclair 2017, Thoonsen 2015] includeerden een heterogene populatie, maar rapporteerden geen afzonderlijke cijfers voor COPD. Houben et al. randomiseerden in een cluster-RCT 29 longartsen en 165 patiënten met COPD naar een gestructureerde sessie over ACP gedurende 1,5 uur onder leiding van een getrainde longverpleegkundige (N=89) enerzijds en reguliere zorg (N=76) anderzijds [Houben 2019]. Na de ACP-sessie werd in de interventiegroep een feedbackformulier opgesteld, met informatie over de gewenste zorg rondom het levenseinde en communicatie hierover. Dit formulier werd gedeeld met de behandelend longarts en huisarts. De primaire uitkomstmaat was de kwaliteit van de communicatie over het levenseinde, gemeten met het domein ‘communicatie over het levenseinde’ van de QOC vragenlijst.
- Ora et al. zochten naar studies, gepubliceerd tussen januari 2008 en december 2018, die het effect bestudeerden van palliatieve interventies onder leiding van een verpleegkundige bij patiënten met COPD [Ora 2019]. Ze vonden 6 studies, waarvan 4 gerandomiseerde studies. Eén studie [Weber 2017] was enkel gepubliceerd als abstract. Een andere studie [Buckingham 2015] betrof geen ACP. Een derde studie [Sinclair 2017] includeerde een heterogene populatie, maar rapporteerde geen afzonderlijke cijfers voor COPD. De vierde publicatie betrof het studieprotocol van de studie van Houben et al. [Houben 2019].
Aanvullend werd nog één gerandomiseerde studie (RCT) gevonden:
- Janssens et al. randomiseerden 49 patiënten met ernstig COPD (GOLD III of IV) naar vroegtijdige palliatieve thuiszorg gedurende 1 jaar (N=26) of reguliere zorg (N=23) [Janssens 2019]. De palliatieve interventie omvatte een maandelijks huisbezoek door een verpleegkundige gedurende ongeveer 1,5 uur, waarbij onder andere gefocust werd op symptomen, voeding en ACP. Alle patiënten werden besproken met een medisch specialist palliatieve zorg, die desgewenst door de patiënten geconsulteerd kon worden. De primaire uitkomstmaat was het aantal ziekenhuisopnames, spoedopnames en opnames op de intensive care.
Kwaliteit van het bewijs
De drie reviews waren van matige kwaliteit. Enkel Jabbarian et al. deden het volledige reviewproces met twee onafhankelijke reviewers [Jabbarian 2018]. Meehan et al. en Ora et al. deden enkel het selectieproces met twee onafhankelijke reviewers [Meehan 2019, Ora 2019]. Meehan et al. deden geen kwaliteitsbeoordeling gezien het een scoping review betrof. Geen enkele van de reviews deed een meta-analyse.
In geen enkele RCT was de manier van randomiseren zeer expliciet omschreven, twee van de drie studies gebruikten gesloten enveloppes voor de toewijzing aan de behandelgroepen [Houben 2019, Janssens 2019]. Blindering van de patiënten en behandelaars was uiteraard niet mogelijk, maar in twee RCT’s gebeurde de meting van de uitkomstmaten door onafhankelijke medewerkers [Au 2012, Janssens 2019]. Twee studies hadden een relatief hoge uitval [Au 2012, Houben 2019], één hiervan paste geen intention-to-treat analyse toe [Houben 2019].
Resultaten
Levensverlengende behandelingen
Janssens et al. rapporteerden een ongeveer viermaal hogere opname op de intensive care omwille van respiratoir falen in de groep die vroegtijdige palliatieve zorg kreeg dan in de controlegroep, maar dit verschil was niet statistisch significant (incidence rate ratio = 4,42; 95%BI 0,49 tot 20,92; p=0,163) [Janssens 2019].
Het effect op reanimaties en beademing werd in geen enkele studie gerapporteerd.
Tevredenheid van patiënten met communicatie
Au et al. rapporteerden een verbetering van de kwaliteit van communicatie in beide behandelgroepen (gemiddelde QOC score interventiegroep: van 23,3 naar 34,0 punten; controlegroep: van 19,2 naar 25,5 punten), maar de verbetering was significant groter in de interventiegroep (gecorrigeerd verschil: 5,74 punten; p=0,03) [Au 2012].
Houben et al. rapporteerden een significant verbeterde communicatiescore in de ACP-interventiegroep (verandering in QOC end-of-life score: 2,37 punten; 95%BI 1,76 tot 2,98; p < 0,001), maar niet in de controlegroep (verandering in QOC end-of-life score: 0,32 punten; 95%BI -0,15 tot 0,80; p=0,18) [Houben 2019]. Het verschil tussen beide groepen was statistisch significant (gecorrigeerd gemiddeld verschil: 2,01; 95%BI 1,07 tot 2,95; p < 0,001).
Ziekenhuisopnames
Janssens et al. rapporteerden een ongeveer tweemaal hoger aantal ziekenhuisopnames (incidence rate ratio = 1,87; 95%BI 1,04 tot 3,48; p=0,026) en spoedopnames (incidence rate ratio = 2,05; 95%BI 1,11 tot 3,94; p=0,014) bij vroegtijdig inzetten van palliatieve zorg [Janssens 2019]. Na correctie voor multiple testing verdween de significantie.
Plaats van zorg
Geen enkele gerandomiseerde studie rapporteerde het effect van ACP op de plaats van zorg.
Plaats van overlijden
Geen enkele gerandomiseerde studie rapporteerde het effect van ACP op de plaats van overlijden.
Zoeken en selecteren
Onderzoeksvraag
Om de uitgangsvraag van deze module te beantwoorden is een systematische literatuurzoektocht uitgevoerd. De onderzoeksvraag die hiervoor is opgesteld is PICO-gestructureerd en luidt:
Wat is het effect van proactieve zorgplanning (advance care planning, ACP) bij patiënten met COPD en hun naasten op levensverlengende behandelingen, tevredenheid, ziekenhuisopnames, plaats van zorg en plaats van overlijden?
P: patiënten met COPD
I: ACP
C: geen ACP, reguliere zorg
O: levensverlengende maatregelen, tevredenheid van patiënten en verzorgers, ziekenhuisopnames, plaats van zorg, plaats van overlijden
Relevante uitkomstmaten
Cruciale uitkomstmaten: levensverlengende maatregelen, tevredenheid van patiënten en verzorgers
Belangrijke uitkomstmaten: ziekenhuisopnames, plaats van zorg, plaats van overlijden
Zoeken en selecteren
Zoekdatum 22 december 2019
Databases OVID Medline, Embase, Cochrane Library, Cinahl
Zoeklimieten Publicatiedatum: 2009-2019
Talen: Engels en Nederland
Studie design: meta-analyses, systematic reviews, randomized controlled trials
Resultaten
Vier onderzoeken zijn opgenomen in de literatuuranalyse, drie systematische reviews en één randomized controlled trials. De belangrijkste studiekarakteristieken en resultaten van de vier opgenomen studies zijn weergegeven in de evidence tabel. De beoordeling van de kwaliteit is opgenomen in het GRADE profiel.
Referenties
- Au DH, Udris EM, Engelberg RA, Diehr PH, Bryson CL, Reinke LF, et al. A randomized trial to improve communication about end-of-life care among patients with COPD. Chest. 2012;141(3):726-35.
- Bravo G, Trottier L, Arcan M, et al. Promoting advance care planning among community-based older adults: a randomized controlled trial. Patient Educ Couns. 2016;99:1785-1795.
- De Vleminck A, Pardon K, Beernaert K, Houttekier D, Vander Stichele R, Deliens L. How do general practitioners conceptualise advance care planning in their practice? A qualitative study. PLoS One. 2016;11:e0153747.
- Duenk RG, Verhagen C, Dekhuijzen PNR, Vissers KCP, Engels Y, Heijdra Y. The view of pulomonologists on palliative care for patients with COPD: a survey study. Int J Chron Obstruct Pulmon Dis. 2017;12:299-311.
- Fried T, O’Leary JR. Using the experiences of bereaved caregivers to inform patient- and caregiver-centered advance care planning. J Gen Intern Med. 1008;23:1602-1607.
- Fried T, Zenoni M, Iannone L. A dyadic perspective on engagement in advance care planning. J Am Geriatr Soc. 2017;65:172-178.
- Hajazideh N, Uhler LM, Perez Figueroa RE. Understanding patients’ and doctors’ attitudes about shared decision making for advance care planning. Health Expect. 2015;18:2054-2065.
- Heffner JE, Fahy B, Barbieri C. Advance directive education during pulmonary rehabilitation. Chest. 1996;109(2):373-379.
- Houben CHM, Spruit MA, Groenen MTJ, Wouters EFM, Janssen DJA. Efficacy of advance care planning: a systematic review and meta-analysis. JAMDA. 2014;15(7):477-489.
- Houben CHM, Spruit MA, Schols JM, Wouters EFM, Janssen DJA. Patient-clinician communication about end-of-life care in patients with advanced chronic organ failure during one year. J Pain Symptom Manage. 2015;49(6):1109-1115.
- Houben CHM, Spruit MA, Luyten H, Pennings HJ, van den Boogaart VEM, Creemers J, et al. Cluster-randomised trial of a nurse-led advance care planning session in patients with COPD and their loved ones. Thorax. 2019;74(4):328-36.
- IKNL/Palliactief. Kwaliteitskader palliatieve zorg Nederland. 2017. Beschikbaar op https://www.pallialine.nl/index.php?pagina=/richtlijn/item/pagina.php&richtlijn_id=1078&unique=b5f5989e95da3c01e3d0a0985f4923c7.
- Jabbarian LJ, Zwakman M, van der Heide A, Kars MC, Janssen DJA, van Delden JJ, et al. Advance care planning for patients with chronic respiratory diseases: a systematic review of preferences and practices. Thorax. 2018;73(3):222-30.
- Janssens J-P, Weber C, Herrmann François R, Cantero C, Pessina A, Matis C, et al. Can Early Introduction of Palliative Care Limit Intensive Care, Emergency and Hospital Admissions in Patients with Severe Chronic Obstructive Pulmonary Disease? A Pilot Randomized Study. Respiration. 2019;97(5):406-15.
- Kelleher AB, Sweeney C, Foley T, Hally RM, Meehan E, Savage E, Korn B, Cornally N. An e-Delphi Study to Identify Priority Areas for Education on Advance Care Planning in COPD Management. Respiratory Care. 2020;65(3):347-354.
- Knauft E, Nielsen EL, Engelberg RA, Patrick DL, Curtis JR. Barriers and facilitators to end-of-life care communication for patients with COPD. Chest. 2005;127:2188-2196.
- Meehan E, Sweeney C, Foley T, Lehane E, Kelleher AB, Hally RM, Shanagher D, Korn B, Rabbitte M, Detering KM, Cornally N. Advance care planning in COPD: guidance development for healthcare professionals. BMJ Supportive and Palliative Care. 2019; epub ahead of print.
- Meehan E, Foley T, Kelly MC, Burgess Kelleher A, Sweeney C, Hally RM, et al. Advance care planning for individuals with chronic obstructive pulmonary disease: a scoping review of the literature. J Pain Symptom Manage. 2019.
- Meehan 2019. BMJ Support Palliat Care, Advance care planning in COPD: guidance development for healthcare professionals.
- Nivel/IKNL/Pharos. Handreiking ‘Palliatieve zorg bij mensen met een niet-westerse achtergrond’. 2011. Beschikbaar op https://www.pallialine.nl/allochtonen.
- Ora L, Mannix J, Morgan L, Wilkes L. Nurse-led integration of palliative care for chronic obstructive pulmonary disease: An integrative literature review. J Clin Nurs. 2019;28(21-22):3725-33.
- Patel K, Janssen DJA, Curtis JR. Advance care planning in COPD. Respirology. 2012;17(1):72-78.
- PZNL. Uniform vastleggen proactieve zorgplanning. 2020. Bezocht op 31 maart 2021. Beschikbaar op https://palliaweb.nl/getmedia/10d17b53-6e0f-4b11-8e14-645d3a03aa0e/Form_uniform_vastleggen_ACP_eerstinvullen.pdf.
- Shalowitz DI, Garret-Mayer E, Wendler D. The accuracy of surrogate decision makers: a systematic review. Arch Intern Med. 2006;166:493-497.
- Simon J, Porterfield P, Bouchal SR, Heyland D. ‘Not yet’ and ‘just ask’: barriers and facilitators to advance care planning: a qualitative descriptive study of the perspectives of seriously ill, older patients and their families. BMJ Support Palliat Care. 2015;5:54-62.
- Tavares N, Hunt KJ, Jarrett N, Wilkinson TM.The preferences of patients with chronic obstructive pulmonary disease are to discuss palliative care plans with familiar respiratory clinicians, but to delay conversations until their condition deteriorates: A study guided by interpretative phenomenological analysis. Palliat Med. 2020. Online ahead of print.
- Van den Heuvel LA, Spruit MA, Schols JM, Hoving C, Wouters EF, Janssen DJ. Barriers and facilitators to end-of-life communication in advanced chronic organ failure. Int J Palliat Nurs. 2016;22:222-229.
- Vermylen JH, Szmuilowicz E, Kalhan R. Palliative care in COPD: an unmet area for quality improvement. Int J Chron Obstruct Pulmon Dis. 2015;10:1543-1551.
- Vig EK, Starks H, Taylor JS, Hopley EK, Fryer-Edwards K. Surviving surrogate decision-making: what helps and hampers the experience of making medical decisions for others. J Gen Intern Med. 2007;22:1274-1279.
- Wong JS, Gottwald M. Advance care planning discussion in chronic obstructive pulmonary disease: a critical review. J Palliat Care. 2015;31:258-264.
Evidence tabellen
Systematische reviews
|
Study ID |
Methods |
Patient characteristics |
Intervention |
Results |
Critical appraisal of study quality |
|
Jabbarian 2018 |
PubMed, LILACS, SciELO, ProQuest and Google Scholar
|
|
ACP |
Discussed in detail below
|
Level of evidence: high risk of bias
|
|
Meehan 2019 |
|
|
ACP |
|
Level of evidence: high risk of bias
|
|
Ora 2019 |
|
|
Nurse-led interventions with integrated palliative care, including advance care planning. Two types: specialist palliative care nurses; experienced respiratory nurses having received palliative care training |
|
Level of evidence: high risk of bias
|
Primaire studies
|
Study ID |
Methods |
Patient characteristics |
Intervention |
Results |
Critical appraisal of study quality |
|
Janssens 2019 |
|
|
Intervention: home early palliative care + usual care (N=26); monthly home visits by nurse for 12 months, focusing on symptom assessment and management, nutrition, understanding of illness and coping, anticipation and decision-making, support of relatives, social-spiritual needs, coordination between different health providers, and alternative approaches
vs.
Control: usual care (N=23) |
CRITICAL OUTCOMES
IMPORTANT OUTCOMES
|
Level of evidence: high risk of bias
|
Abbreviations: 95%CI: 95% confidence interval; ACP: advance care planning; BMI: body mass index; CoI: conflicts of interest; COPD: chronic obstructive pulmonary disease; FEV1: forced expiratory volume in 1 second; GOLD: Global Initiative for Chronic Obstructive Lung Disease; HADS-A: Hospital Anxiety and Depression Scale – anxiety; ICU: intensive care unit; IRR: incidence rate ratio; MD: mean difference; QOC: quality of communication; QOL: quality of life; RCT: randomized controlled trial; SD: standard deviation.
GRADE profielen
ACP vs. no ACP
|
Quality assessment |
No of patients |
Effect |
Quality |
Importance |
||||||||||||
|
No of studies |
Design |
Risk of bias |
Inconsistency |
Indirectness |
Imprecision |
Other considerations |
Intervention |
Control |
Relative |
Absolute |
||||||
|
Admissions to ICU for respiratory failure |
||||||||||||||||
|
1 |
RCT |
Serious1 |
No serious inconsistency |
No serious indirectness |
Very serious2 |
None |
26 |
23 |
IRR = 4.42 (0.49-20.92) p=0.163 |
- |
VERY LOW |
CRITICAL |
||||
|
Satisfaction of patients and carers: rate of discussions about end-of-life care |
||||||||||||||||
|
1 |
RCT |
Very serious4 |
No serious inconsistency |
No serious indirectness |
Very serious5 |
None |
194 |
182 |
- |
Absolute difference of 18.6% (p<0.001) |
VERY LOW |
CRITICAL |
||||
|
Satisfaction of patients and carers: quality of communication score |
||||||||||||||||
|
2 |
RCT |
Very serious4 |
No serious inconsistency |
No serious indirectness |
Very serious5 |
None |
194 |
182 |
Adjusted difference in change from baseline = 5.74 p=0.03 |
- |
VERY LOW |
CRITICAL |
||||
|
RCT |
Very serious6 |
No serious inconsistency |
No serious indirectness |
No serious imprecision |
None |
71 |
63 |
Adjusted MD = 2.01 (1.07-2.95) p<0.001 |
- |
LOW |
CRITICAL |
|||||
|
Satisfaction of patients and carers: quality of death and dying score |
||||||||||||||||
|
1 |
RCT |
Very serious6 |
No serious inconsistency |
No serious indirectness |
Very serious5 |
None |
? |
? |
- |
Mean (SD): 80.01 (8.57) vs. 74.71 (11.51) p=0.17 |
|
CRITICAL |
||||
|
Hospital admissions: hospital admissions for respiratory failure |
||||||||||||||||
|
1 |
RCT |
Serious1 |
No serious inconsistency |
No serious indirectness |
Serious3 |
None |
26 |
23 |
IRR = 1.87 (1.04-3.48) p=0.026 |
- |
LOW |
IMPORTANT |
||||
|
Hospital admissions: hospital admissions for other reasons |
||||||||||||||||
|
1 |
RCT |
Serious1 |
No serious inconsistency |
No serious indirectness |
Very serious2 |
None |
26 |
23 |
IRR = 1.01 (0.32-3.28) p=0.988 |
- |
VERY LOW |
IMPORTANT |
||||
|
Hospital admissions: admissions to emergency ward |
||||||||||||||||
|
1 |
RCT |
Serious1 |
No serious inconsistency |
No serious indirectness |
Serious3 |
None |
26 |
23 |
IRR = 2.05 (1.11-3.94) p=0.014 |
- |
LOW |
IMPORTANT |
||||
|
Place of care (hospital, hospice, home…) |
||||||||||||||||
|
0 |
No evidence |
IMPORTANT |
||||||||||||||
|
Place of death |
||||||||||||||||
|
0 |
No evidence |
IMPORTANT |
||||||||||||||
1 High risk of bias: possible issues with allocation concealment, no blinding of patients and clinicians.
2 Very large confidence interval in both directions.
3 Confidence includes upper 25% limit.
4 High risk of bias: unclear allocation concealment, no blinding of patients and clinicians, selective outcome reporting for rate of discussions (no 95%CI reported).
5 Insufficient data to evaluate imprecision.
6 High risk of bias: unclear randomization, clinicians aware of intervention, no intention-to-treat analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-12-2021
Beoordeeld op geldigheid : 03-08-2021
Actualisatie
Deze richtlijn is goedgekeurd op 3 augustus 2021. De Long Alliantie Nederland (LAN) bewaakt samen met betrokken verenigingen de houdbaarheid van (de modules van) deze richtlijn. Zo nodig zal de richtlijn tussentijds op onderdelen worden bijgesteld. De geldigheidstermijn van de richtlijn is maximaal 5 jaar na vaststelling. Indien de richtlijn dan nog actueel wordt bevonden, wordt de geldigheidsduur van de richtlijn verlengd.
Houderschap richtlijn
De houder van de richtlijn (LAN) moet kunnen aantonen dat de richtlijn zorgvuldig en met de vereiste deskundigheid tot stand is gekomen.
IKNL draagt zorg voor het beheer en de ontsluiting van de richtlijn.
Juridische betekenis van richtlijnen
Een richtlijn is een kwaliteitsstandaard. Een kwaliteitsstandaard beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een kwaliteitsstandaard in het Register van Zorginstituut Nederland betekent dus niet noodzakelijkerwijs dat de in de kwaliteitsstandaard beschreven zorg verzekerde zorg is.
De richtlijn bevat aanbevelingen van algemene aard. Het is mogelijk dat deze aanbevelingen in een individueel geval niet van toepassing zijn. Er kunnen zich feiten of omstandigheden voordoen waardoor het wenselijk is dat in het belang van de patiënt van de richtlijn wordt afgeweken. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd gedocumenteerd te worden. De toepassing van de richtlijnen in de praktijk is de verantwoordelijkheid van elke zorgverlener, zowel BIG-geregistreerd als niet BIG-geregistreerd.
Algemene gegevens
Financiering
Deze richtlijn is gefinancierd door IKNL. De inhoud van de richtlijnis niet beïnvloed door de financierende instantie.
Procesbegeleiding
IKNL is het kennis- en kwaliteitsinstituut voor professionals en bestuurders in de oncologische en palliatieve zorg dat zich richt op het continu verbeteren van de oncologische en palliatieve zorg.
IKNL benadert preventie, diagnose, behandeling, nazorg en palliatieve zorg als een keten waarin de patiënt centraal staat. Om kwalitatief goede zorg te waarborgen ontwikkelt IKNL producten en diensten ter verbetering van de oncologische zorg, de nazorg en de palliatieve zorg, zowel voor de inhoud als de organisatie van de zorg binnen en tussen instellingen. Daarnaast draagt IKNL nationaal en internationaal bij aan de beleidsvorming op het gebied van oncologische en palliatieve zorg.
IKNL rekent het (begeleiden van) ontwikkelen, implementeren en evalueren van multidisciplinaire, evidence-based richtlijnen voor de oncologische en palliatieve zorg tot een van haar primaire taken. IKNL werkt hierbij conform de daarvoor geldende (inter)nationale kwaliteitscriteria. Bij ontwikkeling gaat het in toenemende mate om onderhoud (modulaire revisies) van reeds bestaande richtlijnen.
Doel en doelgroep
Doel
Een richtlijn is een aanbeveling ter ondersteuning van de belangrijkste knelpunten uit de dagelijkse praktijk. Deze richtlijn is zoveel mogelijk gebaseerd op wetenschappelijk onderzoek en consensus. De richtlijn 'Palliatieve zorg bij COPD' geeft aanbevelingen over begeleiding en behandeling van mensen met gevorderde COPD en beoogt hiermee de kwaliteit van de zorgverlening te verbeteren.
Doelpopulatie
Deze richtlijn is gericht op mensen met gevorderde COPD met palliatieve zorgbehoeften. De markering van de palliatieve fase bij mensen met gevorderde COPD wordt besproken in module ‘Palliatieve zorg bij COPD’. Als in deze richtlijn geschreven wordt over ‘gevorderde COPD’ doelen wij op mensen met gevorderde COPD en palliatieve zorgbehoeften. Ten behoeve van de leesbaarheid van de richtlijn is gekozen voor de kortere term ‘gevorderde COPD’.
Deze richtlijn is geschreven met het oog op zorg aan alle mensen met gevorderde COPD, ongeacht hun levensbeschouwing, religie of cultuur. Hierbij dient rekening gehouden te worden met de gezondheidsvaardigheden van de patiënt (onder andere het gemak waarmee geschreven tekst begrepen wordt). Wanneer een andere dan een autochtoon Nederlandse religieuze/culturele achtergrond van de patiënt invloed heeft op de beleving en keuzes in de zorg rondom het levenseinde, raadpleeg dan, naast deze richtlijn, de handreiking 'Palliatieve zorg aan mensen met een niet-westerse achtergrond' [IKNL 2011]. Tevens is er van Pharos de folder 'Lessen uit gesprekken over leven en dood' met algemene voorlichting over palliatieve zorg aan mensen met een migratieachtergrond [Pharos 2017].
Doelgroep
Deze richtlijn is bestemd voor alle zorgverleners die betrokken zijn bij de zorg voor mensen met gevorderde COPD, zoals huisartsen, longartsen, specialisten ouderengeneeskunde, artsen voor verstandelijk gehandicapten, overige medisch specialisten, (long)verpleegkundigen, verpleegkundig specialisten, physician assistants, fysiotherapeuten, ergotherapeuten, logopedisten, diëtisten, overige paramedici, apothekers, geestelijk verzorgers, IKNL-consulenten en psychologen. De inhoud van de richtlijn is ook relevant voor zorgverleners in het maatschappelijke en sociale domein en vrijwilligers en hun coördinatoren die werkzaam zijn in de palliatieve en terminale fase. Indien in de richtlijn wordt gesproken over zorgverleners rondom mensen met COPD, kunnen afhankelijk van de specifieke situatie van de patiënt alle bovengenoemde zorgverleners bedoeld worden.
Samenstelling werkgroep
Alle werkgroepleden en klankbordleden zijn afgevaardigd namens wetenschappelijke, beroeps- en patiëntenverenigingen en hebben daarmee het mandaat voor hun inbreng. Bij de samenstelling van de werkgroep is geprobeerd rekening te houden met landelijke spreiding, inbreng van betrokkenen uit zowel academische als algemene ziekenhuizen/instellingen en vertegenwoordiging van de verschillende verenigingen/disciplines.
Het patiëntperspectief is vertegenwoordigd door het Longfonds.
Werkgroepleden
|
Naam |
Functie |
Rol |
Vereniging |
|
Mw. dr. D.J.A. Janssen |
Specialist ouderengeneeskunde en kaderarts palliatieve zorg |
Voorzitter |
Verenso |
|
Mw. dr. E.M.L. Verschuur |
Projectleider Compassion, onderzoeker, docent |
Lid kerngroep |
LAN |
|
Dhr. F.J. Allema |
Kaderhuisarts en scenarts |
|
CAHAG (NHG) |
|
Mw. M. Bryobhokun |
Manager zorg |
|
Longfonds |
|
Dhr. J. Donkers |
Longervaringsdeskundige |
|
Longfonds |
|
Mw. H.H. Eijsbroek |
Openbaar apotheker |
|
KNMP |
|
Dhr. dr. A.de Graeff |
Internist-oncoloog |
|
NIV, Palliactief |
|
Mw. dr. C.H.M. Houben |
Psycholoog en onderzoeker |
|
NIP/PAZ LVMP |
|
Dhr. dr. J.W. de Jong |
Longarts |
|
NVALT |
|
Mw. M. Liefting |
Gespecialiseerd longverpleegkundige, verpleegkundige palliatieve zorg |
|
V&VN Longverpleeg-kundigen, |
|
Dhr. W. van Litsenburg |
Verpleegkundig specialist |
|
V&VN Longverpleeg-kundigen |
|
Mw. P. van Melick |
Diëtist |
|
NVD |
|
Mw. dr. K.J.M. Mooren |
Longarts |
|
NVALT |
|
Mw. M.E. Sackman-Gerritsen |
Ergotherapeut |
|
Ergotherapie Nederland |
|
Mw. A.L. van der Valk |
Fysiotherapeut |
|
KNGF |
Klankbordleden
|
Naam |
Functie |
Vereniging |
|
Mw. dr. G. Boland |
Projectleider programma Preventie en zorg chronische aandoeningen |
Pharos |
|
Mw. T.J. Klemmeier |
Longverpleegkundige |
IMIS |
|
Mw. E. Kuin-van der Velde |
Verpleegkundig specialist |
V&VN Praktijkverpleegkundigen en Praktijkondersteuners |
|
Mw. dr. A. Leendertse |
Longervaringsdeskundige |
Longfonds |
|
Mw. A. van der Pouw |
Verpleegkundig specialist |
V&VN Verpleegkundig Specialisten, V&VN Longverpleegkundigen |
|
Mw. F.F. Stok |
Logopedist |
NVLF |
|
Mw. drs. ir. E. bij de Vaate |
Longarts |
Kenniscentra Complex Chronische Longaandoeningen |
|
Dhr. dr. E.C. Vasbinder |
Ziekenhuisapotheker, opleider |
NVZA |
Leden Pallialine.be-redactieraad (Federatie Palliatieve Zorg Vlaanderen)
|
Naam |
Functie |
Organisatie |
|
Dhr. N. Derycke |
Stafmedewerker, equipearts |
Palliatieve Hulpverlening Antwerpen (PHA) |
|
Mw. A. Janssen |
Wetenschappelijk medewerker |
Federatie palliatieve zorg Vlaanderen |
|
Dhr. J. Wens |
Huisarts, hoofddocent, professor general practice |
Universiteit Antwerpen |
Ondersteuning
|
Functie |
Organisatie |
|
|
Mw. B.C.M. Borggreve |
Procesbegeleider, adviseur richtlijnen |
IKNL |
|
Mw. C.A. van den Berg |
Procesbegeleider, adviseur richtlijnen |
IKNL |
|
Mw. F.E.A.H. Essers |
Secretaresse |
IKNL |
|
Dhr. J. Vlayen |
Literatuuronderzoeker |
ME/TA |
Belangenverklaringen
Om de beïnvloeding van de richtlijnontwikkeling of formulering van de aanbevelingen door conflicterende belangen te minimaliseren zijn de leden van werkgroep gemandateerd door de wetenschappelijke en beroepsverenigingen.
Alle leden van de richtlijnwerkgroep hebben verklaard onafhankelijk gehandeld te hebben bij het opstellen van de richtlijn. Een onafhankelijkheidsverklaring ‘Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling' zoals vastgesteld door onder meer de KNAW, KNMG, Gezondheidsraad, CBO, NHG en Orde van Medisch Specialisten is door de werkgroepleden bij aanvang en bij afronding van het traject ingevuld. Deze vindt u in onderstaande tabel. De ondertekende belangenverklaring zijn opvraagbaar via info@iknl.nl,
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen voor aanvang |
Ondernomen actie |
Gemelde belangen na afronding |
Ondernomen actie |
|
D. Janssen |
|
Geen |
|
Geen |
|
Geen |
|
E. Verschuur |
|
Geen |
Geen |
- |
Geen |
- |
|
F. Allema |
|
|
|
Geen |
|
Geen |
|
M. Bryobhokun |
|
Geen |
|
Geen |
|
Geen |
|
J. Donkers |
|
|
Geen |
- |
Geen |
- |
|
H. Eijsbroek |
|
Geen |
|
Geen |
|
Geen |
|
A. de Graeff |
|
Geen |
Geen |
- |
Geen |
- |
|
C. Houben |
|
|
Geen |
- |
Geen |
- |
|
J.W. de Jong |
|
Geen |
Geen |
- |
Geen |
- |
|
M. Liefting |
|
Geen |
Geen |
- |
Geen |
- |
|
W. van Litsenburg |
|
|
Geen |
- |
Geen |
- |
|
P. van Melick |
|
|
Geen |
- |
Geen |
- |
|
K. Mooren |
|
|
Geen |
- |
Geen |
- |
|
M. Sacksman |
|
|
Geen |
- |
Geen |
- |
|
A. van der Valk |
|
|
|
Geen |
|
Geen |
|
Klankbordlid |
Functie |
Nevenfuncties |
Gemelde belangen voor aanvang |
Ondernomen actie |
Gemelde belangen na afronding |
Ondernomen actie |
|
G. Boland |
|
Geen |
Geen |
- |
Geen |
- |
|
T. Klemmeier |
|
|
Geen |
- |
Geen |
- |
|
E. Kuin |
|
|
Geen |
- |
Geen |
- |
|
A. van der Pouw |
|
|
Geen |
- |
Geen |
- |
|
F. Stok |
|
|
|
Geen |
|
Geen |
|
E. bij de Vaate |
|
|
|
Geen |
|
Geen |
|
E. Vasbinder |
|
|
|
- |
|
- |
Inbreng patiëntenperspectief
Twee patiëntvertegenwoordigers namen (via het Longfonds) zitting in de richtlijnwerkgroep: een ervaringsdeskundige (patiënt met COPD) en een beleidsmedewerker van het Longfonds. De input van patiëntvertegenwoordigers is nodig voor de ontwikkeling van kwalitatief goede richtlijnen. Goede zorg voldoet immers aan de wensen en eisen van zowel zorgverlener als patiënt.
Door middel van onderstaande werkwijze is informatie verkregen en zijn de belangen van de patiënt meegenomen:
- Bij aanvang van het richtlijntraject hebben de patiëntvertegenwoordigers knelpunten aangeleverd.
- Via het Longfonds en sociale media is een enquête gehouden voor het inventariseren van knelpunten.
- De patiëntvertegenwoordigers waren aanwezig bij de vergaderingen van de richtlijnwerkgroep.
- De patiëntvertegenwoordigers hebben de conceptteksten beoordeeld om het patiëntperspectief in de formulering van de definitieve tekst te optimaliseren.
- Pharos heeft de conceptteksten beoordeeld om het patiëntperspectief voor mensen met beperkte gezondheidsvaardigheden in de formulering van de definitieve tekst zo goed mogelijk weer te geven.
- Het Longfonds is geconsulteerd in de externe commentaarronde.
- Het Longfonds heeft ingestemd met de inhoud van de richtlijn.
Informatie voor patiënten en/of een patiëntsamenvatting wordt opgesteld en gepubliceerd op de daarvoor relevante sites zoals bijvoorbeeld Thuisarts en www.overpalliatievezorg.nl.
Methode ontwikkeling
Evidence based
Implementatie
Bevorderen van het toepassen van de richtlijn in de praktijk begint met een brede bekendmaking en verspreiding van de richtlijn. Bij verdere implementatie gaat het om gerichte interventies om te bevorderen dat zorgverleners de nieuwe kennis en kunde opnemen in hun routines van de palliatieve zorgpraktijk, inclusief borging daarvan. Als onderdeel van elke richtlijn stelt IKNL samen met de richtlijnwerkgroep een implementatieplan op. Activiteiten en interventies voor verspreiding en implementatie vinden zowel op landelijk als regionaal niveau plaats. Deze kunnen eventueel ook op maat gemaakt worden per instelling of specialisme. Informatie hierover is te vinden op https://iknl.nl/.
Het implementatieplan bij deze richtlijn is een belangrijk hulpmiddel om effectief de aanbevelingen uit deze richtlijn te implementeren voor de verschillende disciplines. Vragen over het implementatieplan kunnen gesteld worden aan info@iknl.nl.
Werkwijze
Elke module van de richtlijn bestaat uit een richtlijntekst. De teksten naar aanleiding van de uitgangsvragen zijn opgebouwd volgens het volgende vaste stramien: uitgangsvraag en aanbevelingen, literatuurbespreking, conclusies en overwegingen. De referenties zijn aangeleverd per module (of paragraaf) en de evidence tabellen en GRADE profielen staan in de bijlagen. De antwoorden op de uitgangsvragen (derhalve de aanbevelingen in deze richtlijn) zijn voor zover mogelijk gebaseerd op gepubliceerd wetenschappelijk onderzoek. De modules die betrekking hebben op de onderwerpen palliatieve zorg bij COPD, ACP, angst, depressie, dyspneu en prikkelhoest zijn via de evidence-based systematische methodiek uitgewerkt. De modules die betrekking hebben op de onderwerpen organisatie van zorg, voorlichting, het sociale domein en zingeving & spiritualiteit zijn zonder systematisch literatuuronderzoek uitgewerkt, omdat de werkgroep verwachtte geen studies te vinden die antwoord geven op de vraag, specifiek voor de Nederlandse situatie.
De GRADE-methodiek
De modules die betrekking hebben op de onderwerpen palliatieve zorg bij COPD, ACP, angst, depressie, dyspneu en prikkelhoest zijn via de evidence-based GRADE methodiek uitgewerkt.
Selectie
Naast de selectie op relevantie werd tevens geselecteerd op bewijskracht. Hiervoor werd gebruik gemaakt van de volgende hiërarchische indeling van studiedesigns gebaseerd op bewijskracht:
- Gerandomiseerde gecontroleerde studies (RCT's).
- Niet gerandomiseerde gecontroleerde studies (CCT's).
Waar deze niet voorhanden waren werd verder gezocht naar vergelijkend cohortonderzoek.
Critical appraisal
De kwaliteit van bewijs wordt weergegeven in vier categorieën: hoog, matig, laag en zeer laag. RCT's starten hoog en observationele studies starten laag. Vijf factoren verlagen de kwaliteit van de evidentie (beperkingen in onderzoeksopzet, inconsistentie, indirectheid, imprecisie, publicatie bias) en drie factoren kunnen de kwaliteit van de evidentie verhogen (sterke associatie, dosis-respons relatie, plausibele (residuele) confounding) (zie tabel 1).
Tabel 1. GRADE-methodiek voor het graderen van bewijs
|
Kwaliteit van bewijs |
Onderzoeksopzet |
Verlagen als |
Verhogen als |
|
Hoog (A) |
Gerandomiseerde studie |
Beperkingen in de onderzoeksopzet -1 ernstig -2 zeer ernstig
Inconsistenties -1 ernstig -2 zeer ernstig
Indirectheid -1 ernstig -2 zeer ernstig
Imprecisie -1 ernstig -2 zeer ernstig
Publicatiebias -1 waarschijnlijk -2 zeer waarschijnlijk |
Sterke associatie + 1 sterk + 2 zeer sterk
Dosis-respons relatie + 1 bewijs voor deze relatie
Aanwezigheid van plausibele residuele confounding + 1 zou een aangetoond effect verminderen, of + 1 zou een onterecht effect suggereren als de resultaten geen effect laten zien |
|
Matig (B) |
|
||
|
Laag (C) |
Observationele studie |
||
|
Zeer laag (D) |
|
Algehele kwaliteit van bewijs
Omdat het beoordelen van de kwaliteit van bewijs in de GRADE-benadering per uitkomstmaat geschiedt, is er behoefte aan het bepalen van de algehele kwaliteit van bewijs. Zowel voor als na het literatuuronderzoek wordt door de richtlijnwerkgroep bepaald welke uitkomstmaten cruciaal, belangrijk en niet belangrijk zijn. Het niveau van de algehele kwaliteit van bewijs wordt in principe bepaald door de cruciale uitkomstmaat met de laagste kwaliteit van bewijs.
Als echter de kwaliteit van het bewijs verschilt tussen de verschillende cruciale uitkomstmaten zijn er twee opties:
- De uitkomstmaten wijzen in verschillende richtingen (zowel gewenst als ongewenste effecten) of de balans tussen gewenste en ongewenste effecten is onduidelijk, dan bepaalt de laagste kwaliteit van bewijs van de cruciale uitkomstmaten de algehele kwaliteit van bewijs;
- De uitkomstmaten wijzen in dezelfde richting (richting gewenst of richting ongewenst effecten), dan bepaalt de hoogste kwaliteit van bewijs van de cruciale uitkomstmaat dat op zichzelf voldoende is om de interventie aan te bevelen van de algehele kwaliteit van bewijs.
Tabel 2. Formulering conclusies op basis van kwaliteit van bewijs per uitkomstmaat
|
Kwaliteit van bewijs |
Interpretatie |
Formulering conclusie |
|
Hoog |
Er is veel vertrouwen dat het werkelijk effect dicht in de buurt ligt van de schatting van het effect. |
Er is bewijs van hoge kwaliteit dat... (Referenties) |
|
Matig |
Er is matig vertrouwen in de schatting van het effect: het werkelijk effect ligt waarschijnlijk dicht bij de schatting van het effect, maar er is een mogelijkheid dat het hier substantieel van afwijkt. |
Er is bewijs van matige kwaliteit dat... (Referenties) |
|
Laag |
Er is beperkt vertrouwen in de schatting van het effect: het werkelijke effect kan substantieel verschillend zijn van de schatting van het effect. |
Er is bewijs van lage kwaliteit dat.... (Referenties) |
|
Zeer laag |
Er is weinig vertrouwen in de schatting van het effect: het werkelijke effect wijkt waarschijnlijk substantieel af van de schatting van het effect. |
Er is bewijs van zeer lage kwaliteit dat.... (Referenties) |
|
Formulering algehele kwaliteit van bewijs: hoog/matig/laag/zeer laag. |
||
Overwegingen en aanbevelingen
Aanbevelingen in richtlijnen geven een antwoord op de uitgangsvraag. De GRADE methodiek kent twee soorten aanbevelingen: sterke aanbevelingen of conditionele (zwakke) aanbevelingen. De sterkte van de aanbevelingen reflecteert de mate van vertrouwen waarin - voor de groep patiënten waarvoor de aanbevelingen zijn bedoeld - de gewenste effecten opwegen tegen de ongewenste effecten.
Tabel 3. Gradering van aanbevelingen
|
Sterkte aanbeveling |
Cijfer |
|
Sterke aanbeveling |
1 |
|
Zwakke aanbeveling |
2 |
|
Kwaliteit van de evidence |
Letter |
|
Hoog |
A |
|
Matig |
B |
|
Laag |
C |
|
Zeer laag |
D |
Formulering:
- Sterke aanbeveling: Doe / geef / enzovoort (gebiedende wijs)
- Zwakke/conditionele aanbeveling: Overweeg te doen / te geven / enzovoort
Naast het bewijs uit de literatuur (conclusies) zijn er andere overwegingen die meespelen bij het formuleren van de aanbeveling. Deze aspecten worden besproken onder het kopje ‘Overwegingen' in de richtlijntekst. Hierin worden de conclusies (op basis van de literatuur) geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van de conclusie(s) in combinatie met deze overwegingen.
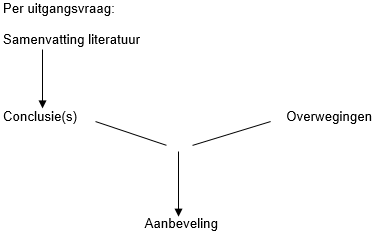
Figuur 1. Van bewijs naar aanbeveling
Bij de overwegingen kon men informatie kwijt over:
- veiligheid (bijvoorbeeld bijwerkingen, risico’s en complicaties)
- patiëntperspectief (waarden en voorkeuren van de patiënt)
- professioneel perspectief (bijvoorbeeld tijdsbesparing)
- beschikbaarheid, werkbaarheid en wenselijkheid van organisatie van zorg aspecten: kosten, voorzieningen, coördinatie, communicatie, gegevensverwerking, taakverdeling, verantwoordelijkheden, enzovoort
- kosteneffectiviteit, hierbij wordt aandacht besteed aan het perspectief (maatschappelijk perspectief versus gezondheidszorgperspectief)
Bij overwegingen kan men denken aan alle aspecten die niet vallen onder de systematische literatuuranalyse bij de uitgangsvraag, maar wel van belang zijn bij het formuleren van de aanbeveling.
Wijzigingen
Bij het opstellen van de conceptrichtlijn zijn enkele wijzigingen in de evidence-based uitgangsvragen doorgevoerd.
Binnen de module niet-medicamenteuze behandeling van dyspneu werd onder andere gezocht naar de effecten van voorlichting en de effecten van niet-invasieve beademing op dyspneu. Tijdens het schrijven van de modules is besloten de resultaten van de onderzoeksvraag Wat is het effect van voorlichting op dyspneu bij mensen met COPD? onder te brengen bij de module Voorlichting.
Tijdens het schrijven van de submodule Niet-invasieve beademing is besloten deze submodule niet meer evidence-based, maar consensus-based te schrijven. De rationale hiervoor is beschreven in de inleiding van deze submodule.
Tijdens het schrijven van module Hoesten is besloten de uitgangsvraag te wijzigen van Welke (niet-) medicamenteuze palliatieve behandeling is geschik voor hoesten bij mensen met gevorderde COPD? te wijzigen in Welke (niet-)medicamenteuze palliatieve behandeling is geschik voor prikkelhoest bij mensen met gevorderde COPD? De rationale hiervoor is beschreven in de inleiding van deze module.
Methodiek bij de modules zonder systematisch literatuuronderzoek
Bij de modules die betrekking hebben op de onderwerpen organisatie van zorg, voorlichting, het sociale domein en zingeving & spiritualiteit is geen systematisch literatuuronderzoek verricht, omdat de werkgroep verwachtte geen studies te vinden die antwoord geven op de vraag, specifiek voor de Nederlandse situatie.
Per module waren één of meerdere werkgroepleden verantwoordelijk voor het schrijven van de samenvatting literatuur, overwegingen, conclusies en aanbevelingen. De gehele werkgroep kon schriftelijk of tijdens de plenaire bijeenkomsten commentaar geven op deze teksten en aanbevelingen. Uiteindelijk werden de definitieve aanbevelingen in de plenaire bijeenkomst geaccordeerd.
De aanbevelingen zijn uitsluitend gebaseerd op overwegingen die zijn opgesteld door de werkgroepleden op basis van kennis uit de praktijk en waar mogelijk onderbouwd door (niet systematisch) literatuuronderzoek.
De teksten zijn gebaseerd op bewijs uit de literatuur, maar de artikelen zijn niet methodologisch beoordeeld. De overwegingen staan onder een apart kopje in de richtlijntekst. Hierin wordt de context van de dagelijkse praktijk beschreven en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties.
Evaluatie
De evaluatie van de richtlijn zal worden uitgevoerd door de regiehoudende vereniging.
Zoekverantwoording
2369 unique hits were screened on title and abstract (Table 1). Of these, 2338 were excluded. The most important reasons for exclusion were:
- Other intervention: interventions other than advanced care planning
- Wrong study design: narrative reviews, case reports, etc.
Of the remaining 31 papers, the full-text was retrieved. Based on the full-text, an additional 25 papers were excluded. Table 2 provides an overview of the excluded studies with reasons.
Table 1. Overall search results.
|
Database |
Number of hits |
|
OVID Medline |
408 |
|
OVID PreMedline |
14 |
|
EMBASE.com |
1676 |
|
Cochrane Database of Systematic Reviews |
26 |
|
CENTRAL |
263 |
|
Cinahl |
404 |
|
Total hits |
2791 |
|
N excluded (language, duplicates) |
422 |
|
Total unique eligible hits |
2369 |
Table 2. Overview of excluded studies based on full-text evaluation.
Search strings
MEDLINE (OVID)
1 Lung Diseases, Obstructive/ (18159)
2 exp Pulmonary Disease, Chronic Obstructive/ (53627)
3 emphysema$.mp. (32776)
4 (chronic$ adj3 bronchiti$).mp. (10878)
5 (obstruct$ adj3 (pulmonary or lung$ or airway$ or airflow$ or bronch$ or respirat$)).mp. (104663)
6 COPD.mp. (37889)
7 COAD.mp. (253)
8 COBD.mp. (17)
9 AECB.mp. (210)
10 or/1-9 (140207)
11 exp Advance Care Planning/ (8992)
12 (advance care adj (plan or plans or planning)).tw. (1993)
13 (advance adj (directive* or decision*)).tw. (3280)
14 living will*.tw. (1158)
15 Right to Die/ (4878)
16 right to die.tw. (887)
17 ((patient or patients) adj5 (advocat* or advocacy)).tw. (5513)
18 power of attorney.tw. (384)
19 ((end of life or EOL) adj5 (care or discuss* or decision* or plan or plans or planning or preference*)).tw. (12161)
20 Terminal Care/ (27355)
21 Treatment Refusal/ (11696)
22 exp Withholding Treatment/ (14956)
23 (treatment adj5 (refus* or withhold* or withdraw*)).tw. (14711)
24 future care planning.mp. (24)
25 anticipating care.mp. (3)
26 early palliative care.mp. (270)
27 timely palliative care.mp. (18)
28 or/11-27 (78860)
29 10 and 28 (746)
30 limit 29 to yr="2009 -Current" (408)
PREMEDLINE (OVID)
1 Lung Diseases, Obstructive/ (5)
2 exp Pulmonary Disease, Chronic Obstructive/ (133)
3 emphysema$.mp. (268)
4 (chronic$ adj3 bronchiti$).mp. (64)
5 (obstruct$ adj3 (pulmonary or lung$ or airway$ or airflow$ or bronch$ or respirat$)).mp. (1359)
6 COPD.mp. (864)
7 COAD.mp. (6)
8 COBD.mp. (0)
9 AECB.mp. (0)
10 or/1-9 (1745)
11 exp Advance Care Planning/ (23)
12 (advance care adj (plan or plans or planning)).tw. (171)
13 (advance adj (directive* or decision*)).tw. (73)
14 living will*.tw. (19)
15 Right to Die/ (0)
16 right to die.tw. (5)
17 ((patient or patients) adj5 (advocat* or advocacy)).tw. (205)
18 power of attorney.tw. (17)
19 ((end of life or EOL) adj5 (care or discuss* or decision* or plan or plans or planning or preference*)).tw. (518)
20 Terminal Care/ (63)
21 Treatment Refusal/ (17)
22 exp Withholding Treatment/ (27)
23 (treatment adj5 (refus* or withhold* or withdraw*)).tw. (230)
24 future care planning.mp. (3)
25 anticipating care.mp. (0)
26 early palliative care.mp. (23)
27 timely palliative care.mp. (0)
28 or/11-27 (1165)
29 10 and 28 (14)
30 limit 29 to yr="2009 -Current" (14)
EMBASE (VIA EMBASE.COM)
#1 'chronic obstructive lung disease'/exp (127439)
#2 emphysema*:ti,ab (36093)
#3 (chronic* NEAR/3 bronchiti*):ti,ab (15253)
#4 (obstruct* NEAR/3 (pulmonary OR lung* OR airway* OR airflow* OR bronch* OR respirat*)):ti,ab (120989)
#5 copd:ti,ab OR coad:ti,ab OR cobd:ti,ab OR aecb:ti,ab (82444)
#6 #1 OR #2 OR #3 OR #4 OR #5 (226402)
#7 'living will'/exp OR 'right to die'/exp OR 'patient advocacy'/exp OR 'power of attorney'/exp OR 'terminal care'/exp OR 'treatment refusal'/exp OR 'treatment withdrawal'/exp (304669)
#8 (living NEAR/1 will*):ab,ti (1577)
#9 ('advance care' NEAR/1 (plan OR plans OR planning)):ab,ti (4117)
#10 'right to die':ab,ti (966)
#11 ((patient OR patients) NEAR/5 (advocat* OR advocacy)):ab,ti (9405)
#12 'power of attorney':ab,ti (645)
#13 (('end of life' OR eol) NEAR/5 (care OR discuss* OR decision* OR plan OR plans OR planning OR preference*)):ab,ti (20535)
#14 'terminal care':ab,ti (1819)
#15 (treatment NEAR/2 (refus* OR withhold* OR withdraw*)):ab,ti (12327)
#16 'advance care planning'/exp (2366)
#17 'shared decision making'/exp (5652)
#18 #7 OR #8 OR #9 OR #10 OR #11 OR #12 OR #13 OR #14 OR #15 OR #16 OR #17 (331107)
#19 #6 AND #18 (4078)
#20 #6 AND #18 AND ([article]/lim OR [article in press]/lim OR [review]/lim) AND ([dutch]/lim OR [english]/lim) AND ([embase]/lim OR [medline]/lim) AND [2009-2020]/py AND [medline]/lim (1676)
COCHRANE LIBRARY (VIA WILEY)
#1 MeSH descriptor: [Lung Diseases, Obstructive] explode all trees
#2 MeSH descriptor: [Pulmonary Disease, Chronic Obstructive] explode all trees
#3 emphysema*:ti,ab
#4 (chronic* NEAR/3 bronchiti*):ti,ab
#5 (obstruct* NEAR/3 (pulmonary or lung* or airway* or airflow* or bronch* or respirat*)):ti,ab
#6 COPD:ti,ab
#7 COAD:ti,ab
#8 COBD:ti,ab
#9 AECB:ti,ab
#10 #1 OR #2 OR #3 OR #4 OR #5 OR #6 OR #7 OR #8 OR #9
#11 MeSH descriptor: [Advance Care Planning] explode all trees
#12 (advance care adj (plan or plans or planning)):ti,ab
#13 (advance adj (directive* or decision*)):ti,ab
#14 living will*:ti,ab
#15 MeSH descriptor: [Right to Die] explode all trees
#16 right to die:ti,ab
#17 ((patient or patients) adj5 (advocat* or advocacy)):ti,ab
#18 power of attorney:ti,ab
#19 (("end of life" or EOL) NEAR/5 (care or discuss* or decision* or plan or plans or planning or preference*)):ti,ab
#20 MeSH descriptor: [Terminal Care] explode all trees
#21 MeSH descriptor: [Treatment Refusal] explode all trees
#22 MeSH descriptor: [Withholding Treatment] explode all trees
#23 (treatment NEAR/5 (refus* or withhold* or withdraw*)):ti,ab
#24 future care planning:ti,ab
#25 anticipating care:ti,ab
#26 early palliative care:ti,ab
#27 timely palliative care:ti,ab
#28 #11 or #12 or #13 or #14 or #15 or #16 or #17 or #18 or #19 or #20 or #21 or #22 or #23 or #24 or #25 or #26 or #27
#29 #10 AND #28 with Cochrane Library publication date Between Jan 2009 and Dec 2019
CINAHL
S1 (MH "Pulmonary Disease, Chronic Obstructive+") OR (MH "Lung Diseases, Obstructive+") (53845)
S2 emphysema* (4635)
S3 (chronic* N3 bronchiti*) (1067)
S4 (obstruct* N3 (pulmonary or lung* or airway* or airflow* or bronch* or respirat*)) (33148)
S5 COPD or COAD or COBD or AECB (20025)
S6 S1 OR S2 OR S3 OR S4 OR S5 (68153)
S7 (MH "Advance Care Planning") (3027)
S8 (MH "Right to Die") (1554)
S9 (MH "Terminal Care+") (58993)
S10 (MH "Treatment Refusal") (4746)
S11 (MH "Euthanasia, Passive") (4365)
S12 ("advance care" N1 (plan or plans or planning)) (3793)
S13 (advance N1 (directive* or decision*) (5905)
S14 "living will*" (1214)
S15 "right to die" (1668)
S16 ((patient or patients) N5 (advocat* or advocacy)) (23779)
S17 "power of attorney" (893)
S18 (("end of life" or EOL) N5 (care or discuss* or decision* or plan or plans or planning or preference*)) (19966)
S19 (treatment N5 (refus* or withhold* or withdraw*)) (8335)
S20 "future care planning" (29)
S21 "anticipating care" (3)
S22 "early palliative care" (283)
S23 "timely palliative care" (20)
S24 S7 OR S8 OR S9 OR S10 OR S11 OR S12 OR S13 OR S14 OR S15 OR S16 OR S17 OR S18 OR S19 OR S20 OR S21 OR S22 OR S23 (98271)
S25 S6 AND S24 (1222)
S26 S6 AND S24 -> Limiters - Published Date: 20090101-20191231; Exclude MEDLINE records; Language: Dutch/Flemish, English (404)
