Diagnostiek en de behandeling nieuwe nefrologische problemen in verschillende trimesters bij zwangere vrouwen met chronische nierschade
Uitgangsvraag
Hoe dient de diagnostiek en de behandeling van nieuwe nefrologische problemen plaats te vinden (proteïnurie/nefrotisch syndroom of TMA) in verschillende trimesters van de zwangerschap?
Aanbeveling
Analyseer de oorzaak van de nierinsufficiëntie bij zwangeren bij wie in de eerste helft van de zwangerschap sprake is van een daling van de eGFR en/of proteïnurie > 300 mg/dag. Maak hierbij gebruik van diagnostiek die ook buiten de zwangerschap zou worden gebruikt (echografie, urine analyse en op indicatie specifieke immunologische bepalingen of een selectiviteitsindex). Denk aan specifieke oorzaken in verschillende fases van de zwangerschap (zie figuur 3 en 4 in overwegingen).
Behandel zwangeren met symptomatische urolithiasis primair conservatief overeenkomstig advies van de European Association of Urology.
Wees in het 3e trimester van de zwangerschap bij urolithiasis die onvoldoende reageert op conservatieve behandeling en/of bij nierinsufficiëntie met hydronefrose en met name bij (verdenking op) aanwezigheid van urineweginfectie terughoudend met retrograde urologische interventies in de urinewegen in verband met risico op inductie van weeënactiviteit en risico op urosepsis.
Weeg in multidisciplinair verband met gynaecoloog-perinatoloog, internist-nefroloog en uroloog de voor- en nadelen van enerzijds de meer definitieve oplossing van ureterorenoscopie +/- dubbel J katheter en anderzijds meer tijdelijke oplossing van nefrostomiecatheter tegen elkaar af.
Denk bij acute nierinsufficiëntie in combinatie met hemolyse in de zwangerschap en postpartum aan trombotische microangiopathie die geen onderdeel is van HELLP.
Overleg laagdrempelig en in een vroegtijdig stadium met een expertisecentrum TTP/aHUS, omdat therapie in de vorm van plasmaferese en eventueel eculizumab ernstige complicaties en progressie naar eindstadium nierfalen in een belangrijk deel van de patiënten met aHUS of TTP kan voorkomen. Raadpleeg hiervoor ook de ‘NVVH/NFN richtlijn voor behandeling van patiënten met trombotische microangiopathie’ die in 2019 werd gepubliceerd.
Overwegingen
Fysiologische veranderingen in de zwangerschap:
Als gevolg van fysiologische veranderingen van de hemodynamiek in de zwangerschap (toegenomen cardiac output en plasmavolume als gevolg van afgenomen perifere vaatweerstand) stijgt normaal gesproken de glomerulaire filtratiesnelheid in de eerste helft van de zwangerschap (zie onderstaande figuur).
Figuur 1 Glomerular filtration rate (GFR) and effective renal plasma flow (ERPF) during pregnancy. Gammill, Crit Care Med 2005.
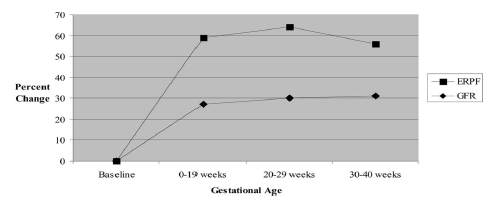
Deze ‘fysiologische hyperfiltratie’ kan leiden tot een beperkte mate van proteïnurie (< 300 mg/24 uur (Gammill, 2005)) zonder dat hieraan een nierziekte ten grondslag ligt. Zwangeren die een daling in plaats van een stijging van de eGFR doormaken of bij wie sprake is van meer proteïnurie dan zou mogen worden verwacht op basis van de beschreven fysiologie zouden nader onderzocht moeten worden om de oorzaak te achterhalen.
Door de hyperfiltratie zal het kreatinine tijdens de zwangerschap dalen, zodat normaalwaardes dan ook lager zullen zijn (zie onderstaande figuur). Bij twijfel over de nierfunctie dient laagdrempelig met een internist-nefroloog overlegd te worden.
Figuur 2 Mean Serum Creatinine Concentrations With 50th, 75th, and 95th Percentile Values Among 243.534 Women With Singleton Pregnancies and Apparently Healthy Renal Function; Harel, JAMA 2019

Incidentie van acute nierinsufficiëntie in de zwangerschap
In al wat oudere studies is de beschreven incidentie van zwangerschap gerelateerde acute nierinsufficiëntie in ontwikkelde landen 1:15.000 tot 1:20.000 (Fakhouri, 2012; Gammill, 2005). Het ontbreken van een gestandaardiseerde definitie van acute nierinsufficiëntie in de zwangerschap bemoeilijkt het genereren van exacte cijfers over de incidentie; zowel de RIFLE als AKIN criteria zijn niet gevalideerd voor zwangeren (Jim, 2017). Het is niet verrassend dat het risico op het ontwikkelen van een acute nierinsufficiëntie gedurende de zwangerschap hoger is bij patiënten met een pre-existente CNS.
Acute nierinsufficiëntie treedt het meest frequent op aan het einde van het 3e trimester en wordt in die gevallen meestal veroorzaakt door hypertensieve complicaties van de zwangerschap (pre-eclampsie, HELLP-syndroom). Acute nierinsufficiëntie treedt op bij ongeveer 1% van de patiënten met pre-eclampsie en 7 tot 15% van de patiënten met HELLP (Sibai, 1993). In het eerste trimester wordt acute nierinsufficiëntie daarentegen relatief vaak veroorzaakt door infectieuze problematiek zoals urosepsis of ‘septische miskraam’ (tegenwoordig voornamelijk nog in ontwikkelingslanden). Zie voor de timing van het ontstaan van verschillende oorzaken van acute nierinsufficiëntie ook onderstaande figuur (Fakhouri, 2012).
Figuur 3
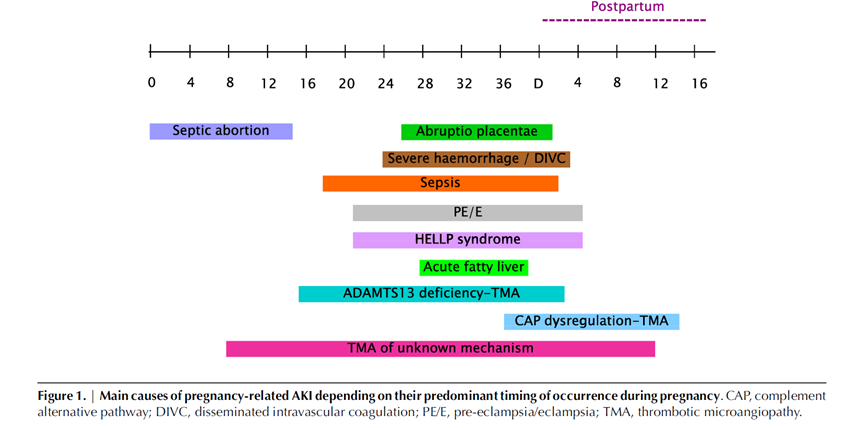
Oorzaken van acute nierinsufficiëntie tijdens zwangerschap (zie onderstaande figuur 4 uit Jim & Garovic, 2017)
Figuur 4
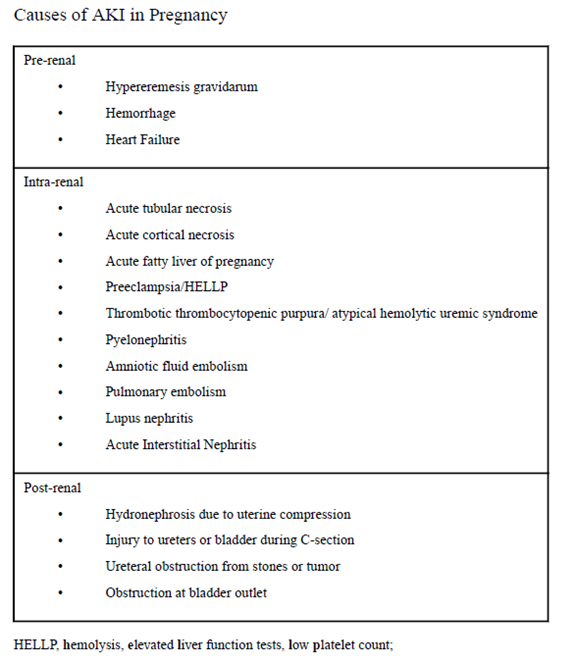
Bron: (Jim & Garovic, 2017)
1. Direct of indirect gerelateerd aan zwangerschap:
Acute nierinsufficiëntie tijdens de zwangerschap kan onder andere optreden als gevolg van condities specifiek voor de zwangerschap (pre-eclampsie, HELLP-syndroom, ‘acute fatty liver of pregnancy’) of door oorzaken die uitgelokt of verergerd kunnen worden door zwangerschap (hypovolemische shock (met in extreme gevallen renale corticale necrose), pyelonefritis, sepsis, trombotische microangiopathie, lupus nefritis).
2. Postrenale oorzaak:
In geval van een acute nierinsufficiëntie in de zwangerschap is het uiteraard zaak om pre- en postrenale oorzaken op te sporen en zo mogelijk te behandelen. Obstructie van de urinewegen door de zwangere uterus is zeer zeldzaam en wordt in de regel alleen gezien bij meerlingzwangerschappen of een fors polyhydramnion (Van Hook, 2014). Het is bovendien moeilijk om onderscheid te maken tussen vesico-ureterale reflux en daadwerkelijke obstructie. Obstructieve uropathie wordt in de meeste gevallen veroorzaakt door urolithiasis of compressie op de ureter-pyelum overgang en gaat gepaard met een hoge foetale mortaliteit. Afhankelijk van de amenorroeduur en de exacte oorzaak zal een individueel plan van aanpak gemaakt moeten worden, waarbij bijvoorbeeld een amniotomie (bij polyhydramnion), dubbel J katheter of percutane nefrostomiekatheter (NSK) nodig kan zijn (Jim, 2017).
Bij (verdenking op) urolithiasis adviseert de European Association of Urology primair een conservatief beleid en bij uitblijven van spontane passage van niersteen de plaatsing van een NSK of dubbel J katheter, waarbij ureterorenoscopie (URS) met steenextractie als goed alternatief voor meer definitieve oplossing wordt beschouwd (Türk EAU guidelines, 2020: https://uroweb.org/wp-content/uploads/EAU-Guidelines-on-Urolithiasis-2020v5.pdf). Hierbij moet men zich realiseren dat het manipuleren aan de urinewegen (met een dubbel J katheter en/of URS) mogelijk kan leiden tot het induceren van weeën.
In een grote retrospectieve Italiaanse single center case serie van 208 zwangeren, waarbij op verdenking van urolithiasis in 2e of 3e trimester een URS werd verricht, werd bij 7% van de 173 patiënten zonder tekenen van urineweginfectie premature weeënactiviteit gezien terwijl bij de 35 zwangeren met tekenen van urineweginfectie dit zelfs bij 26% werd waargenomen (Buttice, 2017).
In een systematic review van case series en observationele studies uit 2014 werd bij ureteroscopische behandeling van urolithiasis bij zwangeren als complicatie bij 2.5% premature weeënactiviteit gerapporteerd en bij 5% urineweginfecties (Ishii, 2014).
Deze gegevens werden deels bevestigd in een retrospectieve review van een grote dataset van Californië en Florida waarin 3904 zwangerschappen gecompliceerd werden door antepartum nefrolithiasis, die in 71.4% conservatief behandeld kon worden, terwijl bij 20.6% URS al dan niet met stentplaatsing werd verricht en bij 8.0% een NSK werd geplaatst (Drescher, 2019). Kans op premature partus was bij conservatief beleid 9.1%, bij URS +/- stent 11.2% en bij percutane NSK het hoogste met 19.6% (verschillen significant bij multivariate analyse). De kans op een urineweginfectie bij de partus liep ook geleidelijk op van 3.7% bij conservatief beleid naar 8.7% bij URS +/- stent naar 19.7% bij NSK. Belangrijk probleem bij deze laatste analyse op basis van ICD diagnoses in de antenatale periode vormt enerzijds bias by indication en anderzijds ontbreken van duidelijke tijdsrelatie tussen urologische interventie en de premature partus waardoor onduidelijk is of de interventie daadwerkelijk premature weeënactiviteit heeft geïnduceerd.
Op basis van bovenstaande gegevens lijkt het risico op premature weeënactiviteit en/of de kans op urineweginfectie verhoogd bij URS +/- dubbel J katheter, maar is het alternatief van percutane NSK ook zeker niet zonder risico’s. Afhankelijk van de amenorroeduur, aanwezigheid van premature contracties en verwachte duur tot aan de partus zullen in multidisciplinair verband de voor- en nadelen van enerzijds de meer definitieve oplossing van URS +/- dubbel J katheter en anderzijds meer tijdelijke oplossing van NSK tegen elkaar afgewogen moeten worden. Bij (verdenking op) urineweginfectie lijkt het echter wel verstandig om in eerste instantie de voorkeur te geven aan plaatsing van NSK en pas URS +/- dubbel J katheter te overwegen als de urineweginfectie adequaat behandeld is.
3. Onderscheid tussen pre-eclampsie en primair nefrologisch probleem:
Zoals beschreven onder uitgangsvraag 12A kan het erg moeilijk zijn om onderscheid te maken tussen pre-eclampsie en een primair nefrologisch probleem. Bovendien is in sommige gevallen sprake van een acute nierinsufficiëntie gesuperponeerd op een pre-eclampsie. Dit komt onder andere vaker voor bij patiënten met een abruptio placentae, diffuse intravasale stolling, HELLP-syndroom en antifosfolipiden syndroom en gaat gepaard met hoge perinatale mortaliteit en ongunstige renale uitkomsten, met name bij patiënten met pre-existente hypertensie of CNS (Gammill, 2005).
4. Trombotische microangiopathie (TMA) in de zwangerschap:
Een bijzondere entiteit in het veld van acute nierinsufficiëntie tijdens de zwangerschap is de trombotische microangiopathie (TMA), waarbij zwangerschap de uitlokkende factor is voor het manifest worden van een al latent aanwezig probleem (zoals bijvoorbeeld het atypisch hemolytisch uremisch syndroom (aHUS) of thrombotische thrombocytopenische purpura (TTP). In een Franse database met aHUS patiënten werd gevonden dat bij ongeveer 20% van deze patiënten de ziekte zich voor het eerst tijdens de zwangerschap of direct erna presenteerde (Fakhouri, 2010). Het is met name essentieel om deze beelden te onderscheiden van een ernstig HELLP-syndroom, omdat het missen van een TTP dodelijk kan zijn terwijl een HELLP-syndroom in de regel opklaart binnen enkele dagen na de bevalling. Het is derhalve van groot belang om onderscheid te maken tussen placentaire en niet-placentaire oorzaken van TMA (zie onderstaande figuur). Een belangrijk verschil is de mate van hemolyse (zie onderstaande figuur 4 uit Jim & Garovic, 2017): deze is uitgesproken in TTP en aHUS, terwijl de hemolyse bij patiënten met HELLP in de meeste gevallen subtiel is en zelfs niet aantoonbaar kan zijn. Ook is de mate van trombocytopenie bij TTP en aHUS meestal ernstiger dan bij het HELLP-syndroom, terwijl het laatste beeld zich juist kenmerkt door zeer hoge serum transaminase waarden (Pourrat, 2015). Bij patiënten met een HELLP-syndroom wordt slechts in een minderheid van de nierbiopten een beeld gevonden dat past bij TMA en wordt vaker acute tubulus necrose beschreven. De ADAMTS13 activiteit is noodzakelijk om uiteindelijk een TTP uit te sluiten en moet binnen 48 uur beschikbaar zijn. Van belang om te vermelden is het grote verschil in incidentie tussen het HELLP syndroom (1:500 zwangerschappen) en de veel zeldzamere TTP/aHUS (1:100.000 zwangerschappen). Voor nadere informatie en adviezen rondom diagnostiek en behandeling van TMA verwijzen wij naar de update van de NfN/NVvH ‘Richtlijn voor behandeling van patiënten met trombotische microangiopathie’ die in 2019 werd gepubliceerd en het in 2020 verschenen artikel van een internationale werkgroep (Fakhouri et al., Blood 2020).

Figuur 5
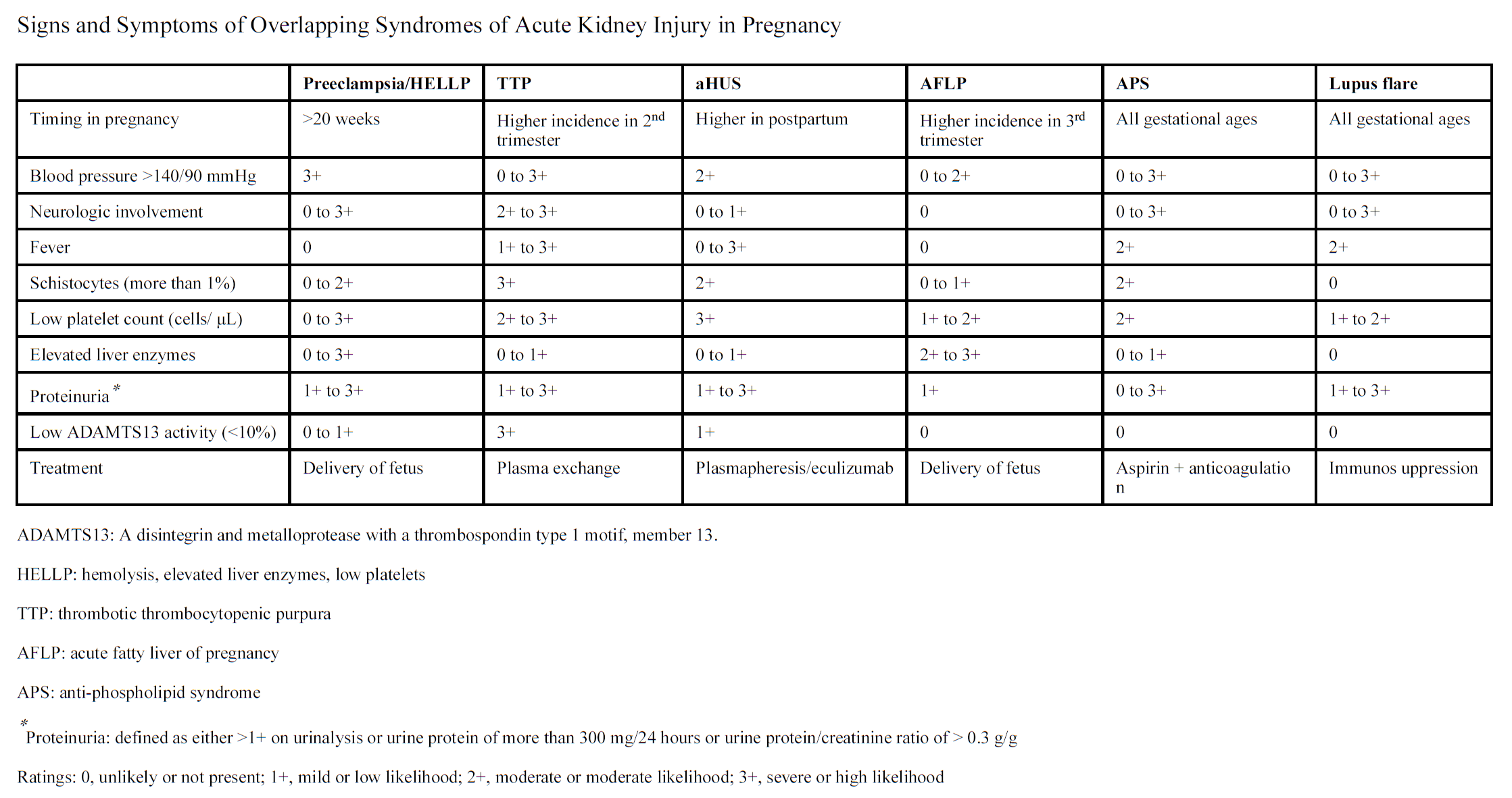
Bron: (Jim & Garovic, 2017)
Diagnostiek van acute nierinsufficiëntie in de zwangerschap
De traditionele indeling in prerenale, renale en postrenale oorzaken van acute nierinsufficiëntie zoals toegepast in de niet-zwangere populatie is ook in de zwangerschap een geschikt uitgangspunt bij het verrichten van aanvullend onderzoek naar de etiologie van het nieuw ontstane probleem. Dat betekent dat een echografie en urineonderzoek (kwantitatieve meting van proteïnurie, fractionele natriumexcretie, fractionele ureumexcretie bij gebruik van diuretica en eventuele aanwezigheid van (glomerulaire) hematurie) onmisbaar zijn in de differentiële diagnostiek. Hierbij moet men zich realiseren dat acute glomerulonefritis en pre-eclampsie ook gekenmerkt worden door lage fractionele natrium- en ureumexcreties doordat de tubulusfunctie daarbij intact is. Specifieke immunologische bepalingen (waaronder ANCA, anti-dsDNA, anti-GBM, anti-PLA2R) kunnen zeer behulpzaam zijn, evenals het bepalen van een selectiviteitsindex bij nefrotische range proteïnurie. Er is literatuur over het gebruik van de laatste parameter bij zwangeren; een hoog selectieve proteïnurie is geassocieerd met een steroïdgevoelig nefrotisch syndroom en past niet bij pre-eclampsie (Hamilton, 2014). Het bepalen hiervan kan dus een eenvoudige manier zijn om te voorkomen dat de zwangerschap ten onrechte vroegtijdig wordt beëindigd en om onnodige nierbiopten te voorkomen.
In de paragraaf ‘incidentie van acute nierinsufficiëntie in de zwangerschap’ is beschreven dat de differentiaaldiagnose mede afhankelijk is van de amenorroeduur, hoewel er aanzienlijke overlap bestaat tussen verschillende ziektebeelden zoals ook zichtbaar in figuur 3 (Fakhouri, 2012).
Tenslotte wordt in de module 'Indicatie voor nierbiopsie' de rol van het nierbiopt in de zwangerschap behandeld.
Behandeling van acute nierinsufficiëntie en de bijkomende metabole ontregeling in de zwangerschap
In algemene zin is de behandeling van een acute nierinsufficiëntie gedurende de zwangerschap ondersteunend. Het is essentieel om een goede hydratiestatus en daarmee de renale perfusie en perfusie van de placenta te waarborgen. Meer specifieke behandelingen (plasmaferese, immunosuppressieve therapie) zijn afhankelijk van de etiologie van de nierinsufficiëntie. Voor specifieke aanbevelingen (en de onderbouwing daarvan) aangaande het gebruik van immunosuppressieve medicatie in de zwangerschap wordt verwezen naar de module 'Immunosuppressieve behandeling'. (Aspecten van) nierfunctievervangende behandelingen gedurende de zwangerschap zijn beschreven in de module 'Dialyse en zwangerschap'.
Afhankelijk van de ernst van de problematiek en fase van de zwangerschap dient de optie van beëindiging van de zwangerschap overwogen en besproken te worden. Bovendien dient overwogen te worden om te overleggen met een centrum met expertise en patiënte zo nodig daarheen te verwijzen voor verdere behandeling.
Voor wat betreft het behandelen van een hyperkaliëmie bij zwangeren is er geen reden om af te wijken van de gangbare richtlijnen. Insuline/glucose en bicarbonaat zijn veilig in de zwangerschap, waarbij men zich moet realiseren dat er een fysiologische daling in het serum bicarbonaat optreedt als gevolg van de respiratoire alkalose die bij zwangeren bestaat. Kationenwisselaars (natrium- en calciumpolystyreensulfonaat, zirkonium en patiromeer) worden niet (of nauwelijks) geresorbeerd in het maagdarmkanaal, waardoor er geen nadelen voor de foetus worden verwacht bij het gebruik van deze middelen door de zwangere.
Het gebruik van ‘erytropoetin-stimulating agents’, ijzerpreparaten en bloedtransfusie wordt behandeld in de module 'Behandeling bijkomende nefrologische problemen' van de richtlijn; Diuretica en antihypertensieve therapie komen aan de orde in de module 'Behandeling hypertensie'.
Rationale van aanbevelingen
Als gevolg van hemodynamische veranderingen in de zwangerschap treedt er normaal gesproken een fysiologische stijging op van de glomerulaire filtratiesnelheid (en dus een daling van het serum kreatinine) in de eerste helft van de zwangerschap. Door de toegenomen renale bloedflow is een proteïnurie tot 300 mg/24 uur nog fysiologisch.
Het risico op het ontwikkelen van een acute nierinsufficiëntie gedurende de zwangerschap is duidelijk verhoogd bij patiënten met een pre-existente nierziekte.
Niet zelden is het zeer moeilijk om onderscheid te maken tussen een ernstig HELLP-syndroom en een trombotische microangiopathie in het kader van een TTP danwel aHUS. Dit onderscheid is echter essentieel, enerzijds om potentieel dodelijke en behandelbare ziektes als TTP en aHUS niet te missen en anderzijds om onnodig vroegtijdige beëindiging van de zwangerschap te voorkomen.
Onderbouwing
Zoeken en selecteren
Niet van toepassing. Er is geen systematische literatuuranalyse verricht, omdat de werkgroep van mening is dat deze vraag zich niet goed laat beantwoorden middels een literatuursamenvatting. Om tot aanbevelingen voor deze uitgangsvraag te komen is wel gezocht naar recente reviewartikelen en meta-analyses.
Referenties
- Agrawal, S., Cerdeira, A. S., Redman, C., & Vatish, M. (2018). Meta-Analysis and Systematic Review to Assess the Role of Soluble FMS-Like Tyrosine Kinase-1 and Placenta Growth Factor Ratio in Prediction of Preeclampsia: The SaPPPhirE Study. Hypertension, 71(2), 306-316. doi:10.1161/HYPERTENSIONAHA.117.10182.
- Ahmed, R., Dunford, J., Mehran, R., Robson, S., & Kunadian, V. (2014). Pre-eclampsia and future cardiovascular risk among women: a review. J Am Coll Cardiol, 63(18), 1815-1822.
- Butticè S, Laganà A, Vitale S. (2017). Ureteroscopy in pregnant women with complicated colic pain: Is there any risk of premature labor?Arch Ital Urol Androl. 2017 Dec 31;89(4):287-292
- Chen, H. H., Lin, H. C., Yeh, J. C., & Chen, C. P. (2001). Renal biopsy in pregnancies complicated by undetermined renal disease. Acta Obstet Gynecol Scand, 80(10), 888-893. doi:10.1034/j.1600-0412.2001.801004.x.
- Covella, B., Vinturache, A. E., Cabiddu, G., Attini, R., Gesualdo, L., Versino, E., & Piccoli, G. B. (2019). A systematic review and meta-analysis indicates long-term risk of chronic and end-stage kidney disease after preeclampsia. Kidney Int, 96(3), 711-727. doi:10.1016/j.kint.2019.03.033
- Day, C., Hewins, P., Hildebrand, S., Sheikh, L., Taylor, G., Kilby, M., & Lipkin, G. (2008). The role of renal biopsy in women with kidney disease identified in pregnancy. Nephrol Dial Transplant, 23(1), 201-206. doi:10.1093/ndt/gfm572.
- Fakhouri, F., Roumenina, L., Provot, F., Sallee, M., Caillard, S., Couzi, L.,. Fremeaux-Bacchi, V. (2010). Pregnancy-associated hemolytic uremic syndrome revisited in the era of complement gene mutations. J Am Soc Nephrol, 21(5), 859-867. doi:10.1681/ASN.2009070706
- Fakhouri, F., Vercel, C., & Fremeaux-Bacchi, V. (2012). Obstetric nephrology: AKI and thrombotic microangiopathies in pregnancy. Clin J Am Soc Nephrol, 7(12), 2100-2106. doi:10.2215/CJN.13121211.
- Fakhouri, Fadi, et al. "Management of thrombotic microangiopathy in pregnancy and postpartum: report from an international working group." Blood, The Journal of the American Society of Hematology 136.19 (2020): 2103-2117.
- Gammill, H. S., & Jeyabalan, A. (2005). Acute renal failure in pregnancy. Crit Care Med, 33(10 Suppl), S372-384. doi:10.1097/01.ccm.0000183155.46886.c6.
- Hamilton, P., Myers, J., Gillham, J., Ayers, G., Brown, N., & Venning, M. (2014). Urinary protein selectivity in nephrotic syndrome and pregnancy: resurrection of a biomarker when renal biopsy is contraindicated. Clin Kidney J, 7(6), 595-598. doi:10.1093/ckj/sfu103
- Harel Z, McArthur E, Hladunewich et al. Serum Creatinine Levels Before, During, and After Pregnancy. Research Letter. JAMA 2019; 321 (2) 205-6
- Ishii H, Aboumarzouk O, Somani B. (2014). Current status of ureteroscopy for stone disease in pregnancy. Urolithiasis (2014) 42:1–7
- Jim, B., & Garovic, V. D. (2017). Acute Kidney Injury in Pregnancy. Semin Nephrol, 37(4), 378-385. doi:10.1016/j.semnephrol.2017.05.010.
- Kleinrouweler, C. E., Wiegerinck, M. M., Ris-Stalpers, C., Bossuyt, P. M., van der Post, J. A., von Dadelszen, P.,... Collaboration, E. C. (2012). Accuracy of circulating placental growth factor, vascular endothelial growth factor, soluble fms-like tyrosine kinase 1 and soluble endoglin in the prediction of pre-eclampsia: a systematic review and meta-analysis. BJOG, 119(7), 778-787. doi:10.1111/j.1471-0528.2012.03311.x.
- Krauss, T., Pauer, H. U., & Augustin, H. G. (2004). Prospective analysis of placenta growth factor (PlGF) concentrations in the plasma of women with normal pregnancy and pregnancies complicated by preeclampsia. Hypertens Pregnancy, 23(1), 101-111. doi:10.1081/PRG-120028286.
- Lindheimer, M. D., & Davison, J. M. (1987). Renal biopsy during pregnancy: 'to b... or not to b...?'. Br J Obstet Gynaecol, 94(10), 932-934. doi:10.1111/j.1471-0528.1987.tb02265.x
- Maynard, S. E., Min, J. Y., Merchan, J., Lim, K. H., Li, J., Mondal, S.,... Karumanchi, S. A. (2003). Excess placental soluble fms-like tyrosine kinase 1 (sFlt1) may contribute to endothelial dysfunction, hypertension, and proteinuria in preeclampsia. J Clin Invest, 111(5), 649-658. doi:10.1172/JCI17189.
- McDonald, S. D., Malinowski, A., Zhou, Q., Yusuf, S., & Devereaux, P. J. (2008). Cardiovascular sequelae of preeclampsia/eclampsia: a systematic review and meta-analyses. Am Heart J, 156(5), 918-930. doi:10.1016/j.ahj.2008.06.042.
- Moore, A. G., Young, H., Keller, J. M., Ojo, L. R., Yan, J., Simas, T. A., & Maynard, S. E. (2012). Angiogenic biomarkers for prediction of maternal and neonatal complications in suspected preeclampsia. J Matern Fetal Neonatal Med, 25(12), 2651-2657. doi:10.3109/14767058.2012.713055.
- Packham, D. K., Mathews, D. C., Fairley, K. F., Whitworth, J. A., & Kincaid-Smith, P. S. (1988). Morphometric analysis of pre-eclampsia in women biopsied in pregnancy and post-partum. Kidney Int, 34(5), 704-711. doi:10.1038/ki.1988.236.
- Piccoli, G. B., Daidola, G., Attini, R., Parisi, S., Fassio, F., Naretto, C.,... Todros, T. (2013). Kidney biopsy in pregnancy: evidence for counselling? A systematic narrative review. BJOG, 120(4), 412-427. doi:10.1111/1471-0528.12111.
- Pourrat, O., Coudroy, R., & Pierre, F. (2015). Differentiation between severe HELLP syndrome and thrombotic microangiopathy, thrombotic thrombocytopenic purpura and other imitators. Eur J Obstet Gynecol Reprod Biol, 189, 68-72. doi:10.1016/j.ejogrb.2015.03.017.
- Rolfo, A., Attini, R., Nuzzo, A. M., Piazzese, A., Parisi, S., Ferraresi, M.,... Piccoli, G. B. (2013). Chronic kidney disease may be differentially diagnosed from preeclampsia by serum biomarkers. Kidney Int, 83(1), 177-181. doi:10.1038/ki.2012.348.
- Sibai, B. M., & Ramadan, M. K. (1993). Acute renal failure in pregnancies complicated by hemolysis, elevated liver enzymes, and low platelets. Am J Obstet Gynecol, 168(6 Pt 1), 1682-1687; discussion 1687-1690. doi:10.1016/0002-9378(93)90678-c.
- Türk C, Petrík A, Sarica K, et al. (2020). EAU guidelines on interventional treatment for urolithiasis. https://uroweb.org/wp-content/uploads/EAU-Guidelines-on-Urolithiasis-2020v5.pdf Van Hook, J. W. (2014). Acute kidney injury during pregnancy. Clin Obstet Gynecol, 57(4), 851-861. doi:10.1097/GRF.0000000000000069.
- Wide-Swensson, D., Strevens, H., & Willner, J. (2007). Antepartum percutaneous renal biopsy. Int J Gynaecol Obstet, 98(2), 88-92. doi:10.1016/j.ijgo.2007.03.049.
- Wiles, K., Chappell, L. C., Lightstone, L., & Bramham, K. (2020). Updates in Diagnosis and Management of Preeclampsia in Women with CKD. Clin J Am Soc Nephrol. doi:10.2215/CJN.15121219.
- Williams, W. W., Jr., Ecker, J. L., Thadhani, R. I., & Rahemtullah, A. (2005). Case records of the Massachusetts General Hospital. Case 38-2005. A 29-year-old pregnant woman with the nephrotic syndrome and hypertension. N Engl J Med, 353(24), 2590-2600. doi:10.1056/NEJMcpc059031.
- Zeisler, H., Llurba, E., Chantraine, F., Vatish, M., Staff, A. C., Sennstrom, M.,... Verlohren, S. (2016). Predictive Value of the sFlt-1:PlGF Ratio in Women with Suspected Preeclampsia. N Engl J Med, 374(1), 13-22. doi:10.1056/NEJMoa141483
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-09-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Internisten Vereniging of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Nieuwe nefrologische problemen tijdens de zwangerschap |
NIV |
2020 |
2025 |
5 jaar |
NIV en NVOG |
Nieuwe literatuur |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
De richtlijn heeft tot doel te komen tot een uniforme en zo mogelijk evidence based aanpak van de begeleiding en behandeling van vrouwen met CNS gedurende de zwangerschap, maar ook in de periode vooraf aan de zwangerschap (preconceptie) en gedurende de bevalling, en de periode van lactatie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met CNS en zwangerschap. Daarnaast is de richtlijn ook bedoeld voor zorgverleners die in aanraking komen met patiënten met CNS en een kinderwens, en patiënten met CNS en een neonaat.
Primair is deze richtlijn bedoeld voor internisten(nefrologen) en gynaecologen, maar zal ook zeker relevant zijn voor huisartsen, verloskundigen, klinisch genetici, diëtisten en alle andere zorgverleners die actief zijn in de ketenzorg rondom zwangerschap en geboorte.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met chronische nierschade (CNS) die zwanger willen worden of zijn.
De werkgroep leden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. H.W. (Henk) van Hamersvelt, internist-nefroloog, Radboud Universitair Medisch Centrum, Nijmegen, NIV/NFN (voorzitter)
- Dr. A.T. (Titia) Lely, gynaecoloog-perinatoloog, Universitair Medisch Centrum Utrecht en Wilhelmina Kinder Ziekenhuis, Utrecht, NVOG (vice-voorzitter)
- Dr. M.F.C. (Margriet) de Jong, internist-nefroloog, Universitair Medisch Centrum Groningen, Groningen, NIV/NFN
- Dr. O.W.H. (Olivier) van der Heijden, gynaecoloog-perinatoloog, Radboud Universitair Medisch Centrum, Nijmegen, NVOG
- Dr. Y.K.O. (Onno) Teng, internist-nefroloog, Leids Universitair Medisch Centrum, Leiden, NIV/NFN
- Dr. A.M. (Albertien) van Eerde, klinisch geneticus, Universitair Medisch Centrum Utrecht, Utrecht, VKGN
- Dr. R. (Renate) Bosma, internist, Medisch Centrum Amersfoort, Amersfoort, NIV/NFN
- Dr. H. (Heleen) Grootjans, internist-nefroloog, Universitair Medisch Centrum Groningen, Groningen, NIV/NFN
- Dr. R. (Rob) van der Pas, internist-nefroloog, Radboud Universitair Medisch Centrum, Nijmegen, NIV/NFN
- Dr. I.W.H. (Inge) van Empel, gynaecoloog-perinatoloog, Radboud Universitair Medisch Centrum, Nijmegen, NVOG
- Dr. E. (Ellen) Nijkamp, gynaecoloog, Universitair Medisch Centrum Utrecht, Utrecht, NVOG
- Drs. M. (Merlijn) Wind, gynaecoloog in opleiding, Leids Universitair Medisch Centrum, Leiden, NVOG
Namens Nierpatiënten Vereniging Nederland
- Dr. K. (Karen) Prantl, patiëntvertegenwoordiger en beleidsmedewerker, NVN (Nier)
- Dr. K. (Kim) van Ierssel, patiëntvertegenwoordiger en ervaringsdeskundige, NVN (Nier)
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroep leden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroep leden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Lely |
Gynaecoloog / peronatoloog WKZ |
0,7: Raad commissie ZonMw |
geen |
geen |
geen |
Deelnemer van landelijke werkgroep PARTOUT (Pregnancy After Renal Transplantation), onbetaald; de werkgroep ontvangt geen financiering |
geen |
12-9-2017 |
geen |
|
Van der Heijden |
Gynaecoloog-perinatoloog |
geen |
geen |
geen |
geen |
Deelnemer van landelijke werkgroep PARTOUT (Pregnancy After Renal Transplantation), onbetaald; de werkgroep ontvangt geen financiering |
geen |
5-12-2017 |
geen |
|
de Jong |
Internist-nefroloog UMCG |
Lid richtlijncommissie Nederlandse Federatie voor Nefrologie - onbetaald |
geen |
geen |
geen |
Deelnemer van landelijke werkgroep PARTOUT (Pregnancy After Renal Transplantation), onbetaald; de werkgroep ontvangt geen financiering |
geen |
30-1-2018 |
geen |
|
Teng |
Internist-nefroloog, Leids Universitair Medisch Centrum 1,0 ft |
geen |
geen |
geen |
geen |
geen |
geen |
4-2-2018 |
geen |
|
Prantl |
Beleidsmedewerker, nierpatiënten vereniging Nederland |
geen |
geen |
geen |
geen |
geen |
geen |
5-2-2018 |
geen |
|
Eerde |
Klinisch geneticus UMC Utrecht |
geen |
geen |
geen |
Ik heb subsidies voor wetenschappelijk onderzoek van Nierstichting Nederland en van Fonds Nuts - Ohra ontvangen |
Ik ben als klinisch geneticus expert op gebied van erfelijke nierziekten en coördinator van het Europees erkende expertise centrum voor erfelijke nierziekten in het UMC Utrecht en van de polikliniek erfelijke nierziekten. Mijn directe patiëntenzorg richt zich op mensen met een mogelijke nierziekte. ik draag bij aan patiënten-/publieksvoorlichting, onderwijs en richtlijnen met betrekking tot erfelijke nierziekte |
geen |
8-2-2018 |
geen |
|
Bosma |
Internist MC Amersfoort |
geen |
geen |
nee |
nee |
nee |
nee |
30-1-2018 |
geen |
|
Hamersvelt |
Internist-nefroloog Afdeling Nierziekten, Radboudumc Nijmegen |
Voorzitter richtlijncommissie Nederlandse Federatie voor Nefrologie - onbetaald, Lid Registratiecommissie Nederlandse Federatie voor Nefrologie - onbetaald, Lid bestuur Nederlandse Federatie voor Nefrologie - onbetaald |
geen |
geen |
geen extern gefinancierd onderzoek gerelateerd aan deze richtlijn |
geen |
geen |
8-2-2018 |
geen |
|
Ierssel |
Ervaringsdeskundige vrijwilliger |
geen |
geen |
geen |
geen |
geen |
geen |
5-2-2018 |
geen |
|
Grootjans |
Internist-nefroloog (in opleiding tot 27-3-2019) |
geen |
geen |
geen |
geen |
geen |
geen |
15-4-2019 |
geen |
|
Wind |
Gynaecoloog in opleiding |
geen |
geen |
geen |
geen |
geen |
geen |
30-4-2019 |
geen |
|
Van der Pas |
Internist-nefroloog i.o., Radboudumc |
geen |
geen |
geen |
geen |
geen |
geen |
30-4-2019 |
geen |
|
Van Empel |
Gynaecoloog en fellow perinatologie, Radboudumc |
Bestuurslid werkgroep perinatologie en maternale ziekten van de NVOG - niet betaald |
geen |
geen |
geen |
geen |
geen |
12-6-2019 |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van de Nierpatiëntenvereniging Vereniging Nederland. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging Nierpatiëntenvereniging Vereniging Nederland en Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de module “Organisatie van zorg”. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, om de registratielast niet toe te laten nemen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens werden stakeholders uitgenodigd voor een knelpuntenbijeenkomst (Invitational conference).
De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter, vice-voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Hieronder zijn de beoogde vragen en richtlijnmodules beschreven:
|
Preconceptie |
|
|
2. Wat is de plaats van preconceptionele counseling voor patiëntes met CNS en een kinderwens.
|
|
3. Welke patiënten komen in aanmerking voor preconceptionele genetische counseling?
|
|
4. Wat is de plaats van de verschillende geassisteerde voortplantingstechnieken bij patiëntes met CNSen een kinderwens? |
|
Gedurende de zwangerschap –patiëntes die dialyseren |
|
5. Hoe dient de begeleiding van zwangere vrouwen die nierfunctie vervangende therapie ondergaan eruit te zien?
|
|
6. Wat is de plaats van geavanceerd ultrageluid onderzoek (GUO) bij zwangeren met CNS en wanneer moet dat plaatsvinden? |
|
Gedurende zwangerschap – preventie |
|
7. Welke interventies zijn zinvol om de kans op pre-eclampsie te verkleinen bij zwangere patiënten met chronische nierschade?
|
|
8. Welke dieetbeperkingen en andere non-farmacologische interventies zijn zinvol/noodzakelijk bij verschillende groepen zwangere patiënten met chronische nierschade
|
|
Gedurende zwangerschap – behandeling |
|
9. Hoe dient de behandeling van hypertensie bij zwangere patiënten met chronische nierschade gedurende de verschillende trimesters eruit te zien? In hoeverre wijkt behandeling van hypertensie bij zwangere patiënten met chronische nierschade vóór de zwangerschap en tijdens de verschillende trimesters van de zwangerschap (inclusief pre-eclampsie) af van de MDR hypertensieve aandoeningen in de zwangerschap
|
|
10. Wat is de plaats van immunosuppressieve behandeling van patiënten met chronische nierschade tijdens zwangerschap?
|
|
11. Behandeling van bijkomende nefrologische problemen bij patiënten met chronische nierschade tijdens zwangerschap?
|
|
12. Benadering van nieuwe nefrologische problemen (proteïnurie/nefrotisch syndroom of TMA) in verschillende trimesters van zwangerschap?
|
|
Bevalling en lactatieperiode |
|
13. Hoe dient het beleid eruit te zien rondom de bevalling van een zwangere met CNS?
|
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroep leden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiënten perspectief zijn opgenomen in de zoekverantwoording.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroep leden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroep leden, de waarden en voorkeuren van de patiënt (patiënt values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten samen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten.
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat meeste aanbevelingen niet hard genoeg waren en er geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G.,... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E.,... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
