Dialyse en zwangerschap bij vrouwen met chronische nierschade
Uitgangsvraag
Hoe dient de begeleiding van zwangere vrouwen die nierfunctie vervangende therapie ondergaan eruit te zien?
De uitgangsvraag omvat de volgende deelvraag:
- Welke vorm van dialyse heeft de voorkeur?
- Welk dialyseschema en welke dialyse-efficiëntie is vereist?
- Worden er speciale eisen aan nierfunctie vervangende behandeling gesteld tijdens de zwangerschap?
Aanbeveling
Inventariseer bij hemodialyse patiënten, die zwanger willen worden, of niertransplantatie mogelijk is en of zwangerschap uitgesteld kan worden tot één jaar na niertransplantatie aangezien de resultaten van zwangerschap na niertransplantatie beduidend beter zijn dan de resultaten bij hemodialyse.
Behandel een zwangere dialysepatiënte bij voorkeur met (zeer) intensieve hemodialyse in plaats van peritoneale dialyse.
Verwijs een zwangere dialysepatiënte naar een centrum waar een multidisciplinair team met expertise over deze zeldzame patiëntengroep aanwezig is.
Intensiveer hemodialyse bij een zwangere patiënte afhankelijk van de residuale nierfunctie naar minimaal 20 uur/week zodat vanaf 2e trimester de maternale ureumspiegel steeds lager dan 17,5 mmol/L blijft.
Overweeg een hemodialyse patiënte zonder residuale nierfunctie gedurende de zwangerschap te behandelen met zeer intensieve hemodialyse, waarbij gestreefd wordt naar een dialyse-intensiteit van > 36 uur/week bijvoorbeeld met behulp van frequente nachtdialyse.
Gebruik Kt/V metingen niet als maat voor dialyse-efficiëntie bij zeer intensieve hemodialyse van een zwangere patiënte.
Overweeg (zeer) intensieve hemodialyse te starten bij zwangeren met ernstige nierinsufficiëntie, die nog niet met dialyse behandeld worden, als de maternale ureum concentratie ondanks adequaat, eiwitbeperkt dieet (eventueel aangevuld met aminozuren) niet onder de 17.5 mmol/L gehouden kan worden.
Verricht frequente foetale monitoring gedurende de gehele zwangerschap vanwege de hoge foetale morbiditeit en mortaliteit.
Streef bij zwangere dialysepatiënten die met (zeer) intensieve hemodialyse behandeld worden naar een dagelijkse eiwitinname van 1.5-1.8 g/kg ideaal gewicht/dag.
Verdubbel bij zwangere dialysepatiënten die met (zeer) intensieve hemodialyse behandeld worden de doseringen van wateroplosbare vitamines en start preconceptioneel met bewust hoge dosering foliumzuur 5 mg per dag omdat deze stoffen bij zeer intensieve hemodialyse in hogere mate uitgedialyseerd zullen worden.
Evalueer bij zwangere dialysepatiënten frequent de voedingsstatus onder intensieve controle van een diëtist omdat de langdurige behandeling met zeer intensieve hemodialyse van significante invloed is op de elektrolytenbalans en voedingsstatus van een zwangere patiënt.
Overwegingen
Bevindingen uit wetenschappelijk onderzoek
Er zijn geen studies gevonden die de zoekvraag beantwoorden. Wel heeft de werkgroep 3 studies geïdentificeerd, die niet aan de zoekvraag voldoen maar wel relevante informatie geven voor de richting van de aanbeveling (Normad, 2018, Piccoli, 2016, Saliem, 2018). Deze studies worden hieronder uitgebreider beschreven.
Piccoli (2016) analyseerde in een systematische review de relatie tussen dialyseschema/dialysemodaliteit en de uitkomsten van de zwangerschap bij zwangere vrouwen die chronische hemodialyse (HD) of peritoneale dialyse (PD) ondergaan.
De meta-analyse van Piccoli (2016) heeft alle studies gepubliceerd tussen 1 januari 2000 en 31 december 2014 meegenomen in de analyse, wat neerkwam op 26 case-series en 90 case reports. De literatuur werd door 2 onafhankelijke auteurs beoordeeld en uit de relevante artikelen werden de volgende data geëxtraheerd:
- vroeggeboorte (< 37 weken en < 34 weken amenorroeduur)
- extreme vroeggeboorte (< 28 weken)
- foetale groeirestrictie (geboortegewicht < 10de percentiel).
De volgende co-variabelen zijn geanalyseerd:
- aantal dialysesessies per week, continu of dichotoom bij zes sessies per week
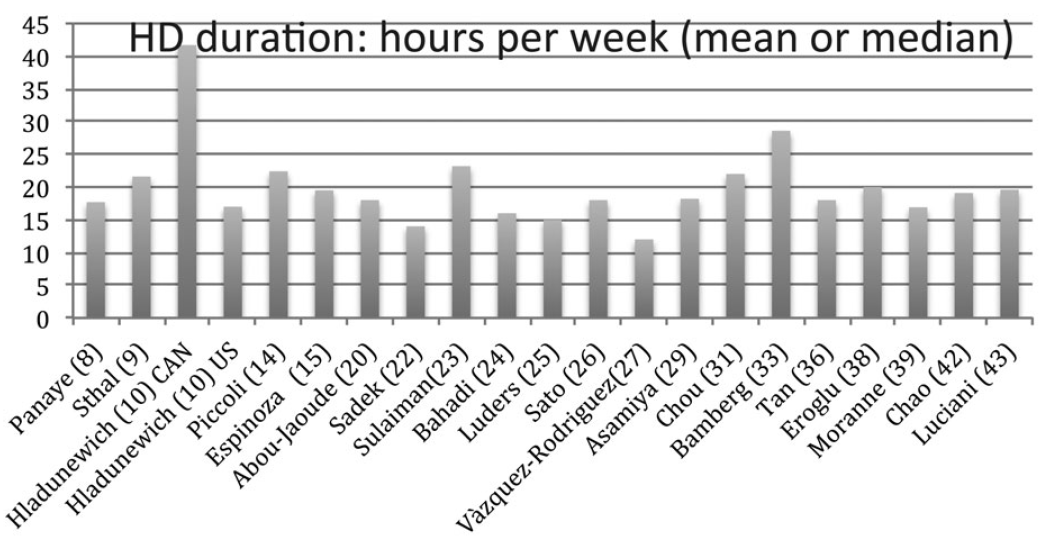
- aantal uur HD per week, continu of dichotoom bij 20 uur per week. Aangezien de uren dialyse per week per artikel anders zijn geformuleerd (mediaan, gemiddeld, per schema) hebben de auteurs indien mogelijk de opgegeven data in het model opgenomen.
Resultaten
Data van 574 zwangerschappen bij 543 dialysepatiënten werden geanalyseerd waarvan 523 zwangerschappen tijdens HD en 51 tijdens PD.
Dialysevoorschriften
- Schema’s werden alleen voor HD duidelijk beschreven maar niet voor PD. Meest voorkomende HD-voorschrift was 5 tot 6x per week gemiddeld 3.5 tot 4u leidend tot een dialyseduur rondom 20 uur per week
Foetale uitkomsten
- Prematuriteit was zeer frequent en de mediane zwangerschapsduur was 33 weken (range 26 tot 39)].
- Data aangaande spontane (vroege) miskramen (< 24wkn) alsmede foetale en neonatale mortaliteit konden niet betrouwbaar geëxtraheerd worden door de heterogeniteit van rapportage. Deze beperkingen in acht nemende werd perinatale mortaliteit gerapporteerd in 63 gevallen (17.5%) tegenover 298 levend geboren baby’s
- Foetale groeirestrictie werd gerapporteerd bij 32% van de neonaten in slechts 6 studies die hierover rapporteerden.
- Aangeboren afwijkingen werden gezien bij ~2% hetgeen overeenkomt met de algemene populatie waar 1 tot 5% wordt gerapporteerd.
Maternale uitkomsten
- Het was niet mogelijk om het maternale risico op overlijden te schatten. Maternale mortaliteit werd gerapporteerd bij 7 vrouwen gedurende 10 jaar follow-up waarvan 2 overleden in de eerste maanden na de bevalling. Hiermee was de maternale mortaliteit minimaal 0.4% (2/543).
Associatie dialyseduur en uitkomsten
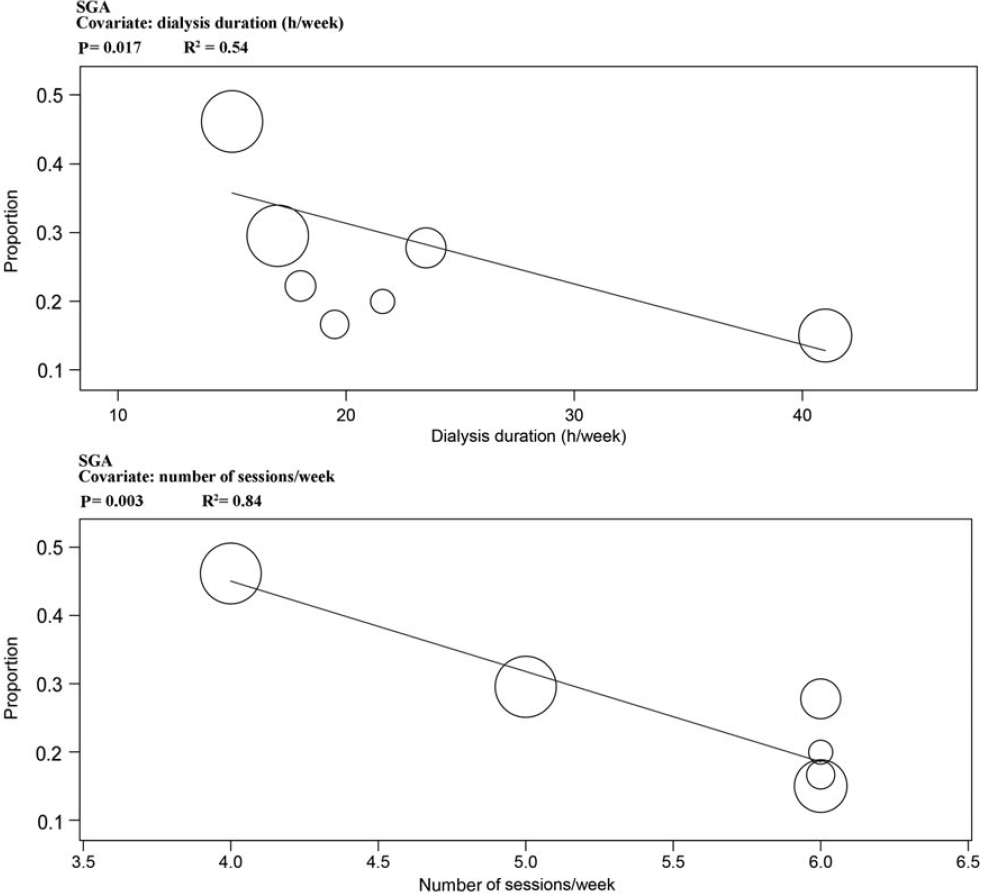
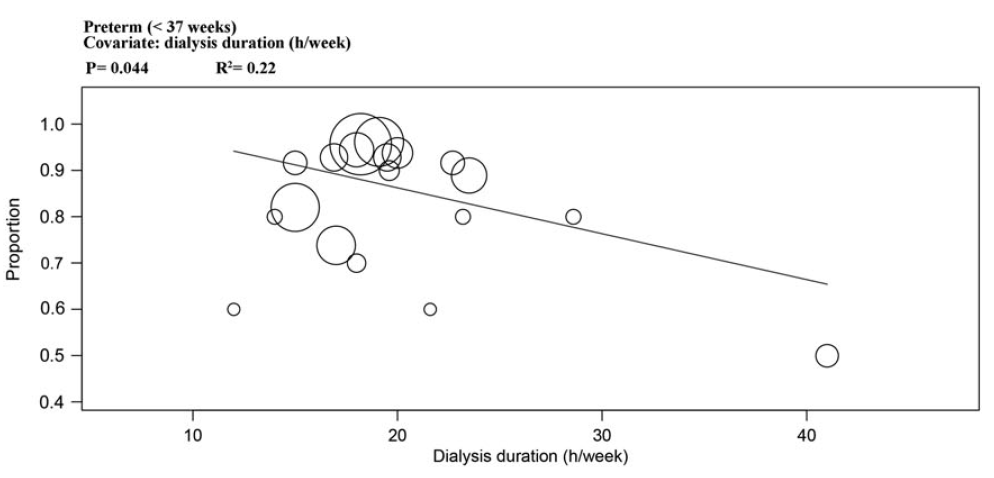
- Er werd een trend (niet statistisch significant) gezien in betere uitkomsten bij langere dialyseduur en hoger aantal dialysesessies per week.
- Er werd een significant omgekeerde lineaire correlatie gezien tussen het aantal dialysesessies/week en het risico op prematuriteit en groeivertraging. Het betrof een consistent en continu effect.
Associatie dialysemodaliteit en uitkomsten
- Er werd een significant hogere prevalentie van groeivertraging gezien bij PD (66,7%) versus HD (31%).
Conclusie
- Zwangerschappen bij dialysepatiënten zijn relatief zeldzaam en zijn ‘hoog-risico’ zwangerschappen ten aanzien van maternale morbiditeit en foetale uitkomsten.
- Er wordt in de literatuur zeer heterogeen en niet-gestructureerd gerapporteerd over zwangerschappen tijdens dialyse.
- Er lijkt enige aanwijzing te zijn dat verhogen van aantal dialysesessies per week alsook het verhogen van totaal aantal uren HD per week tot betere zwangerschapsuitkomsten kan leiden (zie onderstaande figuren over relatie met SGA=small for gestational age en vroeggeboorte=preterm <37 wks).
Saliem (2016) beschrijft een retrospectieve cohort studie in de USA waarin de uitkomsten van zwangerschap van vrouwen met een functionerend niertransplantaat worden vergeleken met die van vrouwen die hemodialyse ondergaan. De studie is uitgevoerd op basis van een nationale database in de Verenigde Staten met geboortes (HCUP-NIS) waarin moeders met ESRD tussen 1998 en 2011 geïdentificeerd werden.
Resultaten
In deze database met > 5 miljoen geboortes werden 264 geboortes bij niertransplantatie-patiënten geïdentificeerd en 267 geboortes bij dialysepatiënten. Er waren significant meer Afro-Amerikaanse patiënten in de dialysegroep en er werd vaker zwangerschapsdiabetes en hypertensie geobserveerd in de dialysegroep.
Een aantal relevante zwangerschapscomplicaties werden significant vaker gezien bij dialysepatiënten in vergelijking met transplantatiepatiënten:
- solutio placentae 6.7% (versus 0%)
- noodzaak voor bloedtransfusies 27% (versus 5.7%)
- postpartum infecties 4.9% (versus 0%)
- intra-uteriene vruchtdood (7.1% (versus 0%)
- foetale groeirestrictie 33% (versus 15%).
Een aantal relevante zwangerschapscomplicaties werden in gelijke mate beschreven tussen dialyse- en niertransplantatie-patiënten waaronder pre-eclampsie (25% versus 27%).
Conclusie: Zwangerschappen bij niertransplantatie-patiënten gaan gepaard met een significant lager risico op relevante zwangerschapscomplicaties in vergelijking met zwangerschappen bij dialysepatiënten.
Commentaar werkgroep: opvallend genoeg waren er in deze database meer geboortes bij dialyse patiënten dan na niertransplantatie hetgeen suggereert dat er in deze Amerikaanse studie erg veel ongeplande zwangerschappen waren, hetgeen ook weer kan leiden tot slechtere uitkomsten. In Nederland is zwangerschap tijdens dialyse een zeer grote uitzondering.
Normand (2018) beschrijft in een retrospectief multicenter onderzoek in Frankrijk welke risico-factoren samenhangen met maternale en foetale uitkomsten bij vrouwen die hemodialyse (HD) ondergaan. Nefrologen in Frankrijk uit verschillende soorten ziekenhuizen (universitaire medisch centra, regionale ziekenhuizen, privé-klinieken, non-profit ziekenhuizen) waren uitgenodigd om hieraan deel te nemen.
- De primaire uitkomstmaat werd gedefinieerd als een pasgeborene die levend uit het ziekenhuis werd ontslagen.
- Secundaire uitkomstmaten waren de duur van de zwangerschap en het geboortegewicht.
- Prematuriteit werd gedefinieerd als geboorte van een levende neonaat voor de 37e week van de zwangerschap.
- Foetale groeiretardatie (FGR) werd gedefinieerd als geboortegewicht onder de 10e percentiel en ernstige FGR als geboortegewicht onder de 5e percentiel.
- Doodgeboorte werd gedefinieerd als intra-uteriene foetale dood na minstens 24 weken van zwangerschap.
- Neonatale sterfte werd gedefinieerd als het overlijden van een levende zuigeling binnen 28 dagen na de geboorte.
- Foetale dood werd gedefinieerd in het geval van miskraam, doodgeboorte of een therapeutische abortus
- Algemene overleving werd gedefinieerd als de afwezigheid van foetale sterfte en neonatale sterfte.
De tijdsperiode van de studie was vanaf 2010, omdat vanaf dat jaar in Frankrijk de mogelijkheid van dagelijkse hemodialyse algemeen in gebruik werd genomen.
Resultaten:
Honderd zwangerschappen ontstonden bij 84 vrouwen die HD ondergingen in 41 dialysecentra. In 17.7% van de gevallen vond conceptie plaats voorafgaand aan de initiatie van chronische dialysebehandeling. Tijd dat de vrouwen al HD ondergingen voor de zwangerschap was gemiddeld 44.7 ± 59.7 maanden. Zwangerschap werd vastgesteld bij een gemiddelde zwagerschapsduur van 9.5 ± 5.4 weken. 50% van de zwangerschappen (43/86) ontstonden terwijl vrouwen residuele diurese hadden.
Dialyse management:
- De gemiddelde dialysetijd nam significant toe gedurende de zwangerschap van 14.6 ± 4.7 uur/week gedurende het eerste trimester tot 20.5 ± 3.9 uur/week gedurende het derde trimester.
- 89.4% (76/85) van de vrouwen ondergingen dagelijkse dialyse (6 dagen per week) met een start bij een gemiddelde zwangerschapsduur van 13.1 ± 6.5 weken.
- Door een toename van de totale dialysetijd per week nam de plasma ureum concentratie af gedurende de zwangerschap van een gemiddelde ureum concentratie van 17.0 ± 6.6 mmol/L aan het einde van het eerste trimester (n = 72) naar 13.4 ± 4.5 mmol/L aan het einde van het derde trimester (n = 62; p < 0.0001).
Obstetrische en foetale uitkomsten:
- Algemene foetale overleving was 78%, met 14 (14%) foetale sterfgevallen en 8 (8%) neonatale sterfgevallen.
- Pre-eclampsie ontstond bij 18 zwangerschappen (18/96, 18.8%)
- 42.2% (38/90) van de zwangerschappen werden gecompliceerd door een polyhydramnion.
- Modus partus was een sectio caesaria bij 62.9% van de geboortes.
- Bij de levend geboren zuigelingen was de gemiddelde zwangerschapsduur 33.2 ± 3.9 weken, met 76.9% (60/78) preterm geboortes (< 37 weken).
- Het gemiddelde geboortegewicht was 1,719.3 ± 730 g, waarbij 44.6% (33/74) van de levende neonaten een laag geboortegewicht hadden (onder de 10e percentiel).
Associatie van risico-factoren met uitkomstparameters:
- Algemene foetale overleving was 78% en er werd geen significante associatie gevonden met de aangenomen klassieke risicofactoren (leeftijd van de moeder, duur tussen start dialyse en ontstaan van de zwangerschap, dagelijkse dialyse gedurende eerste of derde trimester, zwangerschapstermijn bij overgang naar dagelijks HD eerste of derde trimester ureum, gemiddelde serum ureum gedurende de zwangerschap, hemoglobine waardes in het eerste of derde trimester, gemiddelde hemoglobine waardes).
- Hogere gemiddelde hemoglobine waardes tijdens zwangerschap waren gerelateerd aan een langere zwangerschapsduur (r2 = 0.039, p = 0.03) maar dit was een zeer zwak effect. Een vroegere start van dagelijkse dialyse tijdens zwangerschap leek ook geassocieerd met een gunstigere uitkomst (auteurs beschrijven niet welke secundaire uitkomst hier bedoeld wordt, zwangerschapsduur en/of geboortegewicht), maar met een zeer zwak en niet statistisch significant effect (p=0.83). Er werd geen relatie gevonden tussen het gemiddelde ureum en foetale uitkomsten.
De auteurs concluderen dat zwangerschap bij dialysepatiënten hoge risico’s heeft en relatief slechte foetale uitkomsten, ondanks zeer intensieve HD in dit cohort.
Conclusies uit de literatuur
Zwangere patiënten die hemodialyse ondergaan hebben een fors hoger risico op ongunstige uitkomsten van de zwangerschap, zoals solutio placentae, behoefte aan bloedtransfusies, postpartum infecties, intra-uteriene vruchtdood en intra-uteriene groeiretardatie, alles in vergelijking met zwangere patiënten die een functionerend niertransplantaat hebben (Saliem, 2016). Daarnaast hebben zwangere patiënten die peritoneale dialyse ondergaan een grotere kans op foetale groeirestrictie (67%) vergeleken met zwangere patiënten die HD ondergaan (31%) (Piccoli, 2016). Er lijkt een significante inverse lineaire correlatie te bestaan tussen enerzijds het aantal HD sessies per week en het totaal aantal uren HD per week en anderzijds het risico op prematuriteit en foetale groeiretardatie (Piccoli, 2016). Ondanks frequente HD van minimaal 20 uur per week, eindigen de meeste zwangerschappen van dialysepatiënten preterm rond de 33 weken, met een hoog risico op foetale groeirestrictie/laag geboortegewicht bij 32-42% en foetale mortaliteit bij 18-22% (Normand, 2018; Piccoli, 2016).
Aspecten ten behoeve van kinderwens counseling bij dialysepatiënten
De literatuur is eenduidig over het hoge risico dat een zwangerschap tijdens dialyse met zich meebrengt. Ondanks dat de maternale mortaliteit niet verhoogd lijkt, is het risico op pre-eclampsie 19 tot 45% (Normand, 2018; Piccoli, 2016; Sachdeva, 2017). Zwangere dialysepatiënten hebben ondanks behandeling met EPO een verhoogde kans op bloedtransfusies (ongeveer bij een kwart van de patiënten noodzakelijk) waarbij verschillende oorzaken te duiden zijn, zoals een lager (streef-) Hb-gehalte bij aanvang van de zwangerschap, de relatieve EPO-resistentie tijdens de zwangerschap en de fysiologische hemodilutie tijdens de zwangerschap. Hierbij is van belang om aan te tekenen dat er een associatie is aangetoond tussen een laag Hb-gehalte (< 6.8 mmol/L) en vroeggeboorte (zwangerschapsduur < 37 weken) (Milman, 1999; Rahmati 2020). Bij dialyse tijdens zwangerschap is er een significant verhoogd risico op ernstige foetale mortaliteit en morbiditeit. ‘Foetale mortaliteit’ is een heterogeen beschreven eindpunt waaronder verschillende termen kunnen vallen, zijnde late miskramen (spontaan dan wel geïnduceerd), foetale sterfte (na 24 weken) en neonatale sterfte. Voor zover uit de literatuur een onderscheid te maken is, kan daarom ook wel het omgekeerde gesteld worden: de kans om een zwangerschap succesvol te doorlopen met een levend geborene is 78 tot 83% (Hladunewich, Hou et al. 2014, Normand, Xu et al. 2018). Daarbij is er een significant verhoogd risico op prematuriteit met een mediane zwangerschapsduur in verschillende studies van 33 weken waarbij 80% wordt geboren bij een zwangerschapsduur < 37 weken (Piccoli, 2016). Vanzelfsprekend dient wel aangetekend te worden dat veel behandelaren ervoor kiezen om bij 37 weken de bevalling te induceren en dit zou van invloed kunnen zijn op de frequentie van de prematuriteit. Voorts werd foetale groeirestrictie (gedefinieerd als < 10de percentiel) beschreven in 32 tot 44% van de neonaten met een mediaan geboortegewicht van 1700 tot 1800 gram. (Normand, 2018; Piccoli, 2016). Het voorkomen van aangeboren afwijkingen lijkt niet verhoogd te zijn ten opzichte van wat men zou verwachten in een gezonde populatie zwangere vrouwen (Piccoli, 2016). Ter vergelijking de cijfers uit de Nederlandse populatie in 2018: vroeggeboorte 7.1% en foetale groeirestrictie 10.3% (PERINED, 2019).
Welke dialysemodaliteit heeft de voorkeur?
De bewijskracht voor het management van een dialyse-afhankelijke, zwangere patiënte is beperkt tot observationele studies met inherente beperkingen voor bewijsvoering (zoals publicatiebias en bias by indication). Een survey van 930 dialyse-units in de Verenigde Staten die zorg droegen voor 6230 dialysepatiënten jonger dan 44 jaar observeerde over een periode van 4 jaar 135 zwangerschappen (109 in HD-patiënten (2,4%) en 18 in PD-patiënten (1,1%)) (Okundaye, 1998). Er is slechts geringe literatuur, zich beperkend tot case-reports, over peritoneale dialyse in zwangere patiënten (Okundaye, 1998; Piccoli, 2014). Dit is in tegenstelling tot literatuur over (intensieve) hemodialyse bij zwangere patiënten. Een aannemelijke verklaring voor dit verschil is dat de fysiologische veranderingen van een zwangere een belemmering zijn om peritoneale dialyse te ondergaan en dat de maximale klaring bij PD onvoldoende kan zijn, zeker bij patiënten zonder restfunctie. Vanwege de beperkte literatuur over PD tijdens zwangerschappen, lijkt intensieve hemodialyse de voorkeur te verdienen tijdens de zwangerschap. Daarentegen dient de voorkeur van de zwangere patiënte als belangrijkste voorwaarde voor een goede behandeling met gezamenlijke besluitvorming.
Welk dialyseschema en welke dialyse-efficiëntie is vereist?
Verschillende cohortstudies en meta-analyses laten een associatie zien tussen zeer intensieve hemodialyse en zwangerschapsuitkomsten (Hoi, 1999; Piccoli, 2014; Piccoli, 2016). Hoewel dialysesessies doorgaans geïntensiveerd worden voor zwangere dialysepatiënten, bleek ‘zeer intensieve’ hemodialyse thuis in één centrum in Toronto in Canada bij 22 patiënten (studie mediaan 43 ± 5 uur/week) vergeleken met resultaten in Amerikaanse registry van 70 patiënten met ‘intensieve’ dialyses (studie mediaan 17 ± 5 uur/week) geassocieerd te zijn met een hoger percentage levend geborenen (86% versus. 61%), langere zwangerschapsduur (36 (32 tot37) weken versus 27 (21 tot 35) weken) en een hoger geboortegewicht (2118 ± 857g versus 1748 ± 949g) (Hladunewich, 2016). Bovendien werden in de zwangere patiënten met dialyse-intensiteit van 37 tot 56 uur/week een significant hoger percentage levend geborenen (85%) behaald in vergelijking tot 48% in patiënten met minder dan 20u/week (Hladunewich, 2014).
Een meta-analyse van 574 gerapporteerde zwangerschappen in 543 HD-patiënten bevestigde de trend dat intensievere dialyse (i.e. meer dialyse-uren/week) geassocieerd is met significant hoger percentage à terme bevallingen (> 37 weken), lager percentage ernstige prematuriteit en foetale groeirestrictie (Piccoli, 2016).
Op basis van vergelijking van de gepubliceerde resultaten in verschillende landen met verschillen in gemiddelde dialyseduur per land lijkt er sprake te zijn van dose-respons effect van aantal uren hemodialyse op obstetrische uitkomst (zie figuur en tabel uit Hladunewich 2016), maar er kunnen uiteraard ook vele andere oorzaken zijn voor de waargenomen verschillen tussen de landen waaronder bijvoorbeeld patiëntselectie en percentage ongeplande zwangerschappen.
Op basis van deze gegevens en de overige literatuur wordt geadviseerd de zwangerschap van een HD-patiënte te begeleiden met zeer-intensieve dialyses waarbij gestreefd wordt naar meer dan 36 uur/week.
37-56 uur/week dialyse is in de Nederlandse situatie alleen haalbaar bij nachtelijke thuis-hemodialyse of bij centra met mogelijkheid voor frequente nachtdialyse.
Een alternatief is het aanbieden van intensievere hemodialyse op basis van biochemische parameters waarbij de bewijskracht echter zeer beperkt is:
- In een retrospectieve studie van 28 zwangere, hemodialyse-afhankelijke patiënten werden biochemische parameters vergeleken tussen patiënten met een succesvol doorlopen zwangerschap versus wanneer dit niet het geval was (Asamiya, 2009). Ondanks dat er geen significant verschil was tussen de intensiteit van dialyse (19.2 uur/week versus 16.3 uur/week), waren de maternale ureum spiegels significant lager in patiënten met een succesvolle zwangerschap (16.2 mmol/L versus 23.9 mmol/L). Maternale ureumspiegels waren ook negatief gecorreleerd met geboortegewicht en zwangerschapsduur. Bij een afkappunt van het maternaal ureum < 17,5mmol/L was de zwangerschapsduur > 32 weken en het geboortegewicht > 1500g (Asamiya, 2009).
- Een andere studie die dialyse-intensiteit individualiseerde aan de hand van restdiurese, jaren dialyse vooraf aan de zwangerschap, gewicht(stoename), bloeddruk, polyhydramnion en uremische symptomen, vonden betere zwangerschapsuitkomsten onder een afkappunt van maternaal ureum 12.5 mmol/L (Luders, 2009).
Het gebruik van Kt/V (De adequaatheid van de dialyse wordt uitgedrukt middels de Kt/V. Dit is een logaritmische vergelijking waarbij: K = kunstnier klaring (ml/min) V = ureum distributie volume (ml) T = dialyseduur) is niet gevalideerd voor dialyse effectiviteit tijdens zwangerschap.
Moment van starten van hemodialyse bij zwangeren met pre-existent slechte nierfunctie of nierfunctie verslechtering tijdens de zwangerschap:
Tenslotte verdient het moment van starten van dialyse tijdens zwangerschap aandacht. Zoals hierboven beschreven, wordt op basis van expert consensus geadviseerd om zeer intensieve hemodialyse te initiëren bij een maternale ureum concentratie van >17.5 mmol/L ondanks adequate, beperkte eiwitinname, zo nodig op basis van aanvulling met aminozuren (zie de module 'Dieetbeperkingen'). Dit is conform het beleid gevoerd in de Canadese PreKID studie waarbij de waarde van zeer intensieve hemodialyse werd aangetoond (Hladunewich, 2014). Desondanks dient een geïndividualiseerde afweging gemaakt te worden waarbij de risico’s van vroeggeboorte afgewogen worden tegen de risico’s van het initiëren van hemodialyse, waarbij termijn van de zwangerschap een belangrijke rol zal spelen aangezien de invloed van het verhoogde ureum waarschijnlijk groter zal zijn in vroegere fase van de zwangerschap gezien observatie van frequent optreden van polyhydramnion rondom de 18 weken bij zwangere dialysepatiënten met een verhoogd ureum.. Naast zwangerschapsduur zullen beloop van nierfunctieachteruitgang, vochtbalans, biochemische/uremische parameters, bloeddruk(-schommelingen) en uremische symptomen allemaal van belang zijn bij deze afweging. Het wordt sterk aanbevolen om deze patiënten te behandelen in een centrum met expertise op het gebied van dialyse en zwangerschap.
Praktische aspecten van zeer intensieve hemodialyse bij zwangeren (zie ook tabel 1):
Ten aanzien van het volume van ultrafiltratie, is op basis van expert consensus te stellen dat een wekelijkse evaluatie van UF behoefte geïndiceerd is waarbij geanticipeerd wordt op een fysiologische toename in streefgewicht van 300g/week in 2e trimester en 300 tot 500g/week in 3e trimester. Ten aanzien van bloeddruk wordt gestreefd naar een post-dialyse bloeddruk van < 140/90 terwijl intra-dialytische hypotensie (< 120/70) vermeden moet worden (Hladunewich, 2016).
Het toepassen van langdurige, intensieve hemodialyse heeft significante invloed op de elektrolytenbalans en voedingsstatus van een zwangere patiënt. Derhalve wordt geadviseerd om de voedingsstatus frequent te evalueren onder intensieve controle van een diëtist (Cabiddu, 2015). Op basis van expert consensus wordt geadviseerd om zwangere dialysepatiënten behoudens de gebruikelijke natrium- en vochtbeperking geen extra dieetrestricties op te leggen en een eiwitrijke voeding na te streven (1.5 tot 1.8 g/kg ideaal lichaamsgewicht/dag; ideaal lichaamsgewicht (IG) = gewicht overeenkomend met BMI van 22). Elektrolytenbalans dient elke 2 weken gemonitord te worden waarop de dialyseconcentraten van kalium, calcium en fosfaat aangepast dienen te worden. Het is aan te bevelen om zo nodig magnesium te suppleren alsmede het verlies van foliumzuur en andere wateroplosbare vitamines verdubbelen in dosering.. Een hoge dosering foliumzuur van 5 mg/dag wordt reeds vanaf de preconceptionele periode aanbevolen.
Tabel 1 Speciale eisen aan en praktische adviezen voor nierfunctie vervangende therapie behandeling tijdens zwangerschap (geadapteerd van Tangren (2018)
|
Medicatie management
|
|
Dialyse-voorschrift
|
|
Hemodynamiek
|
|
Anemie
|
|
Dieetadviezen
|
|
Foetale monitoring
|
|
Postpartum
|
Onderbouwing
Achtergrond
Zwangerschap bij patiënten met terminaal nierfalen die behandeld worden met dialyse is zeldzaam. Het is reeds langer bekend dat zwangerschapsuitkomsten bij niertransplantatie-patiënten beter zijn dan in dialysepatiënten. Doorgaans wordt patiënten dan ook geadviseerd om een kinderwens uit te stellen tot na succesvolle niertransplantatie en stabiele nierfunctie nadien (Mohammadi, 2017). Dit komt mede voort uit het feit dat de kans op succesvolle conceptie en zwangerschap bij conventionele hemodialyse lange tijd als heel laag is ingeschat (Shahir, 2013). Waarschijnlijk spelen door uremie veroorzaakte schommelingen in regulatie van geslachtshormonen hier een rol (Lin, 2016). Echter, het kan niet voorkomen worden dat zo nu en dan dialysepatiënten toch (meestal ongepland) zwanger worden, en deze zwangerschap willen voldragen. Er is bovendien een erg kleine groep dialysepatiënten die niet meer in aanmerking komen voor een niertransplantatie en toch een grote kinderwens hebben die zij willen vervullen door tijdens dialyse zwanger te worden. Het is daarom noodzakelijk en relevant aanbevelingen te formuleren voor de begeleiding van dialysepatiënten met een zwangerschapswens of ongeplande zwangerschap tijdens dialyse en voor de zeldzame patiënten waar tijdens de zwangerschap de indicatie tot dialyse ontstaat. Daarbij is van belang dat de kans op succesvolle zwangerschap tijdens dialyse in de afgelopen jaren duidelijk is toegenomen door toepassing van (zeer) frequente nachtelijke hemodialyse tijdens gehele zwangerschap.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the effects of different dialysis schemes and modalities (intensive hemodialysis, overnight hemodialysis, peritoneal dialysis, dialysis modality, dialysis schedule, dialysis dose, dialysis efficiency) compared to standard intermittent hemodialysis on maternal and fetal or neonatal outcomes?
P: pregnant patient on dialysis;
I: intensive hemodialysis, overnight hemodialysis, peritoneal dialysis, dialysis modality, dialysis schedule, dialysis dose, dialysis efficiency;
C: standard intermittent hemodialysis (three times a week);
O: pregnancy outcome, pregnancy complication, live birth, perinatal mortality, asphyxia, Apgar < 7, 5min, gestational age, birth weight, intrauterine growth restriction, modus partus, polyhydramnion, preeclampsia/HELLP.
Description of studies
The databases Medline (via OVID) and Embase (via Embase.com)] were searched with relevant search terms from 1st of January 1998 until 15th of March 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 8526 hits. Studies were selected based on the following criteria: original studies (randomized controlled trials or observational studies) or systematic reviews that compared the maternal and fetal or neonatal outcomes in pregnant women with end stage kidney disease undergoing standard intermittent hemodialysis to another dialysis modality or schedule (intensive hemodialysis, overnight hemodialysis, peritoneal dialysis, dialysis modality, dialysis schedule, dialysis dose, dialysis efficiency).
71 studies were initially selected based on title and abstract screening. After reading the full text, all studies were excluded (see the table with reasons for exclusion under the tab Methods), and no studies were included that fulfilled all the inclusion criteria.
Results
Not applicable. No studies were found that answered the search question.
Referenties
- Asamiya Y, Otsubo S, Matsuda Y, Kimata N, Kikuchi KAN, Miwa N, et al. The importance of low blood urea nitrogen levels in pregnant patients undergoing hemodialysis to optimize birth weight and gestational age. Kidney international. 2009;75(11):1217-22.
- Cabiddu G, Castellino S, Gernone G, Santoro D, Giacchino F, Credendino O, et al. Best practices on pregnancy on dialysis: the Italian Study Group on Kidney and Pregnancy. Journal of nephrology. 2015;28(3):279-88.
- Hladunewich MA, Hou S, Odutayo A, Cornelis T, Pierratos A, Goldstein M, et al. Intensive hemodialysis associates with improved pregnancy outcomes: a Canadian and United States cohort comparison. Journal of the American Society of Nephrology: JASN. 2014;25(5):1103-9.
- Hladunewich M, Schatell D. Intensive dialysis and pregnancy. Hemodialysis international Symposium on Home Hemodialysis. 2016;20(3):339-48.
- Hou S. Pregnancy in chronic renal insufficiency and end-stage renal disease. American journal of kidney diseases: the official journal of the National Kidney Foundation. 1999;33(2):235-52.
- Josephson MA, McKay DB. Pregnancy and kidney transplantation. Semin Nephrol 2011; 31: 100–110
- Lin CT, Liu XN, Xu HL, Sui HY. Menstrual Disturbances in Premenopausal Women with End-Stage Renal Disease: A Cross-Sectional Study. Medical principles and practice: international journal of the Kuwait University, Health Science Centre. 2016;25(3):260-5.
- Luders C, Castro MC, Titan SM, De Castro I, Elias RM, Abensur H, et al. Obstetric outcome in pregnant women on long-term dialysis: a case series. American journal of kidney diseases: the official journal of the National Kidney Foundation. 2010;56(1):77-85.
- Milman N, Bergholt T, Byg KE, Eriksen L, Graudal N. Iron status and iron balance during pregnancy. A critical reappraisal of iron supplementation. Acta obstetricia et gynecologica Scandinavica. 1999;78(9):749-57.
- Mohammadi, F. A., Borg, M., Gulyani, A., McDonald, S. P., & Jesudason, S. (2017). Pregnancy outcomes and impact of pregnancy on graft function in women after kidney transplantation. Clinical transplantation, 31(10), e13089.
- Normand G, Xu X, Panaye M, Jolivot A, Lemoine S, Guebre-Egziabher F, et al. Pregnancy Outcomes in French Hemodialysis Patients. American journal of nephrology. 2018;47(4):219-27.
- Okundaye I, Abrinko P, Hou S. Registry of pregnancy in dialysis patients. American journal of kidney diseases: the official journal of the National Kidney Foundation. 1998;31(5):766-73.
- Perales-Puchalt A, Vila Vives JM, López Montes J et al. Pregnancy outcomes after kidney transplantation-immunosuppressive therapy comparison. J Matern Fetal Neonatal Med 2012; 25: 1363–1366
- Piccoli GB, Cabiddu G, Daidone G, Guzzo G, Maxia S, Ciniglio I, et al. The children of dialysis: live-born babies from on-dialysis mothers in Italy--an epidemiological perspective comparing dialysis, kidney transplantation and the overall population. Nephrology, dialysis, transplantation: official publication of the European Dialysis and Transplant Association - European Renal Association. 2014;29(8):1578-86.
- Piccoli GB, Minelli F, Versino E, Cabiddu G, Attini R, Vigotti FN, et al. Pregnancy in dialysis patients in the new millennium: a systematic review and meta-regression analysis correlating dialysis schedules and pregnancy outcomes. Nephrology, dialysis, transplantation: official publication of the European Dialysis and Transplant Association - European Renal Association. 2016;31(11):1915-34.
- Sachdeva M, Barta V, Thakkar J, Sakhiya V, Miller I. Pregnancy outcomes in women on hemodialysis: a national survey. Clinical kidney journal. 2017;10(2):276-81.
- Shahir AK, Briggs N, Katsoulis J, Levidiotis V. An observational outcomes study from 1966-2008, examining pregnancy and neonatal outcomes from dialysed women using data from the ANZDATA Registry. Nephrology (Carlton, Vic). 2013;18(4):276-84.
- Tangren J, Nadel M, Hladunewich MA. Pregnancy and End-Stage Renal Disease. Blood purification. 2018;45(1-3):194-200.Wyld ML, Clayton PA, Kennedy SE et al. Pregnancy outcomes for kidney transplant recipients with transplantation as a child. JAMA Pediatr 2015;169: e143626
Evidence tabellen
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Abou-Jaoude, 2012 |
Voldoet niet aan de PICO |
|
Adam, 2013 |
Voldoet niet aan de PICO |
|
Alkhunaizi, 2015 |
Voldoet niet aan de PICO |
|
Alsuwaida, 2012 |
Voldoet niet aan de PICO |
|
Ansari, 2008 |
Voldoet niet aan de PICO |
|
Bagon, 1998 |
Voldoet niet aan de PICO |
|
Bahloul, 2003 |
Voldoet niet aan de PICO |
|
Balofsky, 2016 |
Voldoet niet aan de PICO |
|
Bamberg, 2007 |
Voldoet niet aan de PICO |
|
Bili, 2013 |
Voldoet niet aan de PICO |
|
Blowey, 1998 |
Voldoet niet aan de PICO |
|
Blowey, 2007 |
Voldoet niet aan de PICO |
|
Cabiddu, 2015 |
Voldoet niet aan de PICO |
|
Castellano, 2011 |
Voldoet niet aan de PICO |
|
Chan, 1998 |
Voldoet niet aan de PICO |
|
Chao, 2002 |
Voldoet niet aan de PICO |
|
Chou, 2007 |
Voldoet niet aan de PICO |
|
Craig, 2010 |
Voldoet niet aan de PICO |
|
Davison, 2001 |
Voldoet niet aan de PICO |
|
Ghazizadeh, 2007 |
Voldoet niet aan de PICO |
|
Haase, 2005 |
Voldoet niet aan de PICO |
|
Hall, 2016 |
Voldoet niet aan de PICO |
|
Hladunewich, 2017 |
Voldoet niet aan de PICO |
|
Hladunewich, 2011 |
Voldoet niet aan de PICO |
|
Hladunewich, 2013 |
Voldoet niet aan de PICO |
|
Hladunewich, 2014 |
Voldoet niet aan de PICO |
|
Hladunewich, 2016 |
Voldoet niet aan de PICO |
|
Holley, 2003 |
Voldoet niet aan de PICO |
|
Hou, 1999 |
Voldoet niet aan de PICO |
|
Hou, 2003 |
Voldoet niet aan de PICO |
|
Hou, 2007 |
Voldoet niet aan de PICO |
|
Inal, 2012 |
Voldoet niet aan de PICO |
|
Jesudason, 2014 |
Voldoet niet aan de PICO |
|
Kazancioglu, 2003 |
Voldoet niet aan de PICO |
|
Luders, 2010 |
Voldoet niet aan de PICO |
|
Manisco, 2015 |
Voldoet niet aan de PICO |
|
Moranne, 2004 |
Voldoet niet aan de PICO |
|
Moranne, 2006 |
Voldoet niet aan de PICO |
|
Nadeau-Fredette, 2013 |
Voldoet niet aan de PICO |
|
Nakabayashi, 1999 |
Voldoet niet aan de PICO |
|
Normand, 2018 |
Voldoet niet aan de PICO |
|
Okundaye, 1998 |
Voldoet niet aan de PICO |
|
Piccoli, 2010 |
Voldoet niet aan de PICO |
|
Piccoli, 2014 |
Voldoet niet aan de PICO |
|
Piccoli, 2015 |
Voldoet niet aan de PICO |
|
Piccoli, 2016 |
Systmetaische review, includeerde studies die geen controlegroep hebben |
|
Piccoli, 2018 |
Voldoet niet aan de PICO |
|
Podymow, 2010 |
Voldoet niet aan de PICO |
|
Praveen, 2016 |
Voldoet niet aan de PICO |
|
Rashid, 2003 |
Voldoet niet aan de PICO |
|
Reddy, 2007 |
Voldoet niet aan de PICO |
|
Sachdeva, 2017 |
Voldoet niet aan de PICO |
|
Saliem, 2016 |
Voldoet niet aan de PICO |
|
Sefer, 2002 |
Voldoet niet aan de PICO |
|
Shahir, 2013 |
Voldoet niet aan de PICO |
|
Shemin, 2003 |
Voldoet niet aan de PICO |
|
Singh, 2015 |
Voldoet niet aan de PICO |
|
Stover, 2010 |
Voldoet niet aan de PICO |
|
Sulaiman, 2014 |
Voldoet niet aan de PICO |
|
Tan, 2006 |
Voldoet niet aan de PICO |
|
Tandgren, 2018 |
Voldoet niet aan de PICO |
|
Toma, 1999 |
Voldoet niet aan de PICO |
|
Vidaeff, 2008 |
Voldoet niet aan de PICO |
|
Vasquez-Rodriguez, 2010 |
Voldoet niet aan de PICO |
|
Wiles, 2018 |
Voldoet niet aan de PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-12-2021
Beoordeeld op geldigheid : 11-09-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Internisten Vereniging of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Nierfunctie vervangende behandeling |
NIV |
2020 |
2025 |
5 jaar |
NIV en NVOG |
Nieuwe literatuur, nieuwe dialysetechnieken, veranderingen in organisatie van zorg van dialyse |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
De richtlijn heeft tot doel te komen tot een uniforme en zo mogelijk evidence based aanpak van de begeleiding en behandeling van vrouwen met CNS gedurende de zwangerschap, maar ook in de periode vooraf aan de zwangerschap (preconceptie) en gedurende de bevalling, en de periode van lactatie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met CNS en zwangerschap. Daarnaast is de richtlijn ook bedoeld voor zorgverleners die in aanraking komen met patiënten met CNS en een kinderwens, en patiënten met CNS en een neonaat.
Primair is deze richtlijn bedoeld voor internisten(nefrologen) en gynaecologen, maar zal ook zeker relevant zijn voor huisartsen, verloskundigen, klinisch genetici, diëtisten en alle andere zorgverleners die actief zijn in de ketenzorg rondom zwangerschap en geboorte.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met chronische nierschade (CNS) die zwanger willen worden of zijn.
De werkgroep leden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. H.W. (Henk) van Hamersvelt, internist-nefroloog, Radboud Universitair Medisch Centrum, Nijmegen, NIV/NFN (voorzitter)
- Dr. A.T. (Titia) Lely, gynaecoloog-perinatoloog, Universitair Medisch Centrum Utrecht en Wilhelmina Kinder Ziekenhuis, Utrecht, NVOG (vice-voorzitter)
- Dr. M.F.C. (Margriet) de Jong, internist-nefroloog, Universitair Medisch Centrum Groningen, Groningen, NIV/NFN
- Dr. O.W.H. (Olivier) van der Heijden, gynaecoloog-perinatoloog, Radboud Universitair Medisch Centrum, Nijmegen, NVOG
- Dr. Y.K.O. (Onno) Teng, internist-nefroloog, Leids Universitair Medisch Centrum, Leiden, NIV/NFN
- Dr. A.M. (Albertien) van Eerde, klinisch geneticus, Universitair Medisch Centrum Utrecht, Utrecht, VKGN
- Dr. R. (Renate) Bosma, internist, Medisch Centrum Amersfoort, Amersfoort, NIV/NFN
- Dr. H. (Heleen) Grootjans, internist-nefroloog, Universitair Medisch Centrum Groningen, Groningen, NIV/NFN
- Dr. R. (Rob) van der Pas, internist-nefroloog, Radboud Universitair Medisch Centrum, Nijmegen, NIV/NFN
- Dr. I.W.H. (Inge) van Empel, gynaecoloog-perinatoloog, Radboud Universitair Medisch Centrum, Nijmegen, NVOG
- Dr. E. (Ellen) Nijkamp, gynaecoloog, Universitair Medisch Centrum Utrecht, Utrecht, NVOG
- Drs. M. (Merlijn) Wind, gynaecoloog in opleiding, Leids Universitair Medisch Centrum, Leiden, NVOG
Namens Nierpatiënten Vereniging Nederland
- Dr. K. (Karen) Prantl, patiëntvertegenwoordiger en beleidsmedewerker, NVN (Nier)
- Dr. K. (Kim) van Ierssel, patiëntvertegenwoordiger en ervaringsdeskundige, NVN (Nier)
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroep leden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroep leden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Lely |
Gynaecoloog / peronatoloog WKZ |
0,7: Raad commissie ZonMw |
geen |
geen |
geen |
Deelnemer van landelijke werkgroep PARTOUT (Pregnancy After Renal Transplantation), onbetaald; de werkgroep ontvangt geen financiering |
geen |
12-9-2017 |
geen |
|
Van der Heijden |
Gynaecoloog-perinatoloog |
geen |
geen |
geen |
geen |
Deelnemer van landelijke werkgroep PARTOUT (Pregnancy After Renal Transplantation), onbetaald; de werkgroep ontvangt geen financiering |
geen |
5-12-2017 |
geen |
|
de Jong |
Internist-nefroloog UMCG |
Lid richtlijncommissie Nederlandse Federatie voor Nefrologie - onbetaald |
geen |
geen |
geen |
Deelnemer van landelijke werkgroep PARTOUT (Pregnancy After Renal Transplantation), onbetaald; de werkgroep ontvangt geen financiering |
geen |
30-1-2018 |
geen |
|
Teng |
Internist-nefroloog, Leids Universitair Medisch Centrum 1,0 ft |
geen |
geen |
geen |
geen |
geen |
geen |
4-2-2018 |
geen |
|
Prantl |
Beleidsmedewerker, nierpatiënten vereniging Nederland |
geen |
geen |
geen |
geen |
geen |
geen |
5-2-2018 |
geen |
|
Eerde |
Klinisch geneticus UMC Utrecht |
geen |
geen |
geen |
Ik heb subsidies voor wetenschappelijk onderzoek van Nierstichting Nederland en van Fonds Nuts - Ohra ontvangen |
Ik ben als klinisch geneticus expert op gebied van erfelijke nierziekten en coördinator van het Europees erkende expertise centrum voor erfelijke nierziekten in het UMC Utrecht en van de polikliniek erfelijke nierziekten. Mijn directe patiëntenzorg richt zich op mensen met een mogelijke nierziekte. ik draag bij aan patiënten-/publieksvoorlichting, onderwijs en richtlijnen met betrekking tot erfelijke nierziekte |
geen |
8-2-2018 |
geen |
|
Bosma |
Internist MC Amersfoort |
geen |
geen |
nee |
nee |
nee |
nee |
30-1-2018 |
geen |
|
Hamersvelt |
Internist-nefroloog Afdeling Nierziekten, Radboudumc Nijmegen |
Voorzitter richtlijncommissie Nederlandse Federatie voor Nefrologie - onbetaald, Lid Registratiecommissie Nederlandse Federatie voor Nefrologie - onbetaald, Lid bestuur Nederlandse Federatie voor Nefrologie - onbetaald |
geen |
geen |
geen extern gefinancierd onderzoek gerelateerd aan deze richtlijn |
geen |
geen |
8-2-2018 |
geen |
|
Ierssel |
Ervaringsdeskundige vrijwilliger |
geen |
geen |
geen |
geen |
geen |
geen |
5-2-2018 |
geen |
|
Grootjans |
Internist-nefroloog (in opleiding tot 27-3-2019) |
geen |
geen |
geen |
geen |
geen |
geen |
15-4-2019 |
geen |
|
Wind |
Gynaecoloog in opleiding |
geen |
geen |
geen |
geen |
geen |
geen |
30-4-2019 |
geen |
|
Van der Pas |
Internist-nefroloog i.o., Radboudumc |
geen |
geen |
geen |
geen |
geen |
geen |
30-4-2019 |
geen |
|
Van Empel |
Gynaecoloog en fellow perinatologie, Radboudumc |
Bestuurslid werkgroep perinatologie en maternale ziekten van de NVOG - niet betaald |
geen |
geen |
geen |
geen |
geen |
12-6-2019 |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van de Nierpatiëntenvereniging Vereniging Nederland. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging Nierpatiëntenvereniging Vereniging Nederland en Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de module “Organisatie van zorg”. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, om de registratielast niet toe te laten nemen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens werden stakeholders uitgenodigd voor een knelpuntenbijeenkomst (Invitational conference).
De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter, vice-voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Hieronder zijn de beoogde vragen en richtlijnmodules beschreven:
|
Preconceptie |
|
|
2. Wat is de plaats van preconceptionele counseling voor patiëntes met CNS en een kinderwens.
|
|
3. Welke patiënten komen in aanmerking voor preconceptionele genetische counseling?
|
|
4. Wat is de plaats van de verschillende geassisteerde voortplantingstechnieken bij patiëntes met CNSen een kinderwens? |
|
Gedurende de zwangerschap –patiëntes die dialyseren |
|
5. Hoe dient de begeleiding van zwangere vrouwen die nierfunctie vervangende therapie ondergaan eruit te zien?
|
|
6. Wat is de plaats van geavanceerd ultrageluid onderzoek (GUO) bij zwangeren met CNS en wanneer moet dat plaatsvinden? |
|
Gedurende zwangerschap – preventie |
|
7. Welke interventies zijn zinvol om de kans op pre-eclampsie te verkleinen bij zwangere patiënten met chronische nierschade?
|
|
8. Welke dieetbeperkingen en andere non-farmacologische interventies zijn zinvol/noodzakelijk bij verschillende groepen zwangere patiënten met chronische nierschade
|
|
Gedurende zwangerschap – behandeling |
|
9. Hoe dient de behandeling van hypertensie bij zwangere patiënten met chronische nierschade gedurende de verschillende trimesters eruit te zien? In hoeverre wijkt behandeling van hypertensie bij zwangere patiënten met chronische nierschade vóór de zwangerschap en tijdens de verschillende trimesters van de zwangerschap (inclusief pre-eclampsie) af van de MDR hypertensieve aandoeningen in de zwangerschap
|
|
10. Wat is de plaats van immunosuppressieve behandeling van patiënten met chronische nierschade tijdens zwangerschap?
|
|
11. Behandeling van bijkomende nefrologische problemen bij patiënten met chronische nierschade tijdens zwangerschap?
|
|
12. Benadering van nieuwe nefrologische problemen (proteïnurie/nefrotisch syndroom of TMA) in verschillende trimesters van zwangerschap?
|
|
Bevalling en lactatieperiode |
|
13. Hoe dient het beleid eruit te zien rondom de bevalling van een zwangere met CNS?
|
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroep leden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiënten perspectief zijn opgenomen in de zoekverantwoording.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroep leden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroep leden, de waarden en voorkeuren van de patiënt (patiënt values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten samen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten.
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat meeste aanbevelingen niet hard genoeg waren en er geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G.,... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E.,... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Toelichting: Sleutelartikel pmid 22362906[uid] (Weinhandl) en 21775973[uid] (Rocco) komen niet uit de search aangezien deze niet specifiek over zwangerschap gaan. Met vriendelijke groeten, Eugenie Delvaux |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Pubmed 15-03-2019
Embase 15-03-2019
|
