Risicostratificatie van zwangere vrouwen met chronische nierschade en organisatie van zorg
Uitgangsvraag
Waar (eerste, tweede of derde lijn) dienen patiënten met chronische nierschade (CNS) en kinderwens/zwangerschap gecounseld en gecontroleerd te worden op basis van het risico op maternale en/of foetale complicaties?
Aanbeveling
Preconceptioneel
De werkgroep acht het zinvol om preconceptionele counseling van vrouwen met CNS stadium 1 en 2 zonder niertransplantatie of systemische autoimmuunziekte (met of zonder gebruik van immuunsuppressiva) in een academisch ziekenhuis te laten plaatsvinden, waar zo nodig ook aanvullend genetisch onderzoek kan worden verricht. Vervolgens kan samen met tweede lijn bepaald worden waar de antenatale controles het beste kunnen plaatsvinden.
Een preconceptioneel adviesconsult van vrouwen met CNS vanaf stadium 3 én vrouwen met CNS bij een niertransplantatie of systemische autoimmuunziekte (met of zonder gebruik van immuunsuppressiva) dient bij voorkeur in een academisch ziekenhuis te vinden door een gynaecoloog-perinatoloog en internist-nefroloog, beide met ervaring op het gebied van zwangerschap bij patiënten met CNS.
Zwangerschap
Patiënten met pre-existente CNS hebben onafhankelijk van het stadium altijd een medische indicatie volgens de Verloskunde Indicatie Lijst.
Zwangerschap bij patiënten met alle stadia CNS dient minimaal in de tweede lijn begeleid te worden omdat zwangerschap bij patiënten met alle stadia CNS gepaard gaat met nadelige zwangerschapsuitkomsten.
Begeleiding van zwangeren met CNS stadium 1 en 2 zonder niertransplantaat of systemische autoimmuunziekte (en zonder gebruik van immuunsuppressiva) kan in de tweede lijn plaatsvinden. Het verdient de voorkeur dat deze begeleiding geschiedt door een obstetrisch georiënteerde gynaecoloog met aandacht voor maternale ziekten samen met een internist-nefroloog met affiniteit voor zwangerschap bij CNS.
Bij verergering van ziekte en/of achteruitgang van nierfunctie dient overleg plaats te vinden met een academich ziekenhuis, en dient patiënte laagdrempelig daarheen verwezen te worden.
Begeleiding van zwangeren vanaf CNS stadium 3 dient bij voorkeur in een academisch ziekenhuis plaats te vinden door een gynaecoloog-perinatoloog en internist-nefroloog, beide met ervaring met zwangerschap bij patiënten met CNS.
Verwijzing naar een academisch ziekenhuis wordt dringend aanbevolen bij patiënten na niertransplantatie, bij patiënten met CNS op basis van systemische autoimmuunziekte (met of zonder gebruik van immuunsuppressiva) en bij dialysepatiënten.
Overwegingen
Pre-existente CNS heeft nadelige effecten op zowel maternale als foetale uitkomsten. Er bestaat een verhoogd risico op zwangerschapscomplicaties zoals hypertensie, pre-eclampsie, abruptio placentae, en achteruitgang van de nierfunctie bij de moeder tijdens de zwangerschap of postpartum, maar ook intra-uteriene groeivertraging en – deels iatrogene - vroeggeboorte bij de foetus (Piccoli, 2012, 2015, 2017; Bramham, 2016; Wiles, 2020; Zhang, 2015). Deze complicaties impliceren bijna altijd een opname in het ziekenhuis voor klinische bewaking van zowel moeder als foetus, waarvan de opnameduur stijgt met het stadium CNS. Daarnaast zijn de directe neonatale consequenties van prematuriteit een lange opnameduur op de kinderafdeling (zowel NICU, post-IC en high care afdelingen).
Onderstaande figuur illustreert deze complicaties.
Figuur 1 Maternale en foetale uitkomsten bij zwangerschappen met CNS (uitgedrukt in OR tov zwangerschappen zonder CNS)

Geadapteerd van Zhang (2015); IUVD = intra-uteriene vruchtdood; alle OR’s significant minimaal p<0.05
Maternale en foetale uitkomsten volgens CNS stadium
a. Uitkomsten bij CNS stadium 1
In een cohortstudie onder 225 vrouwen met CNS lieten Piccoli et al in een tertiair centrum zien dat het percentage sectio caesarea, vroeggeboorte < 34 wk en SGA (Small for Gestational Age - gedefinieerd als geboortegewicht < 10de percentiel) stijgt met het toenemen van de CNS stadia. Tevens is het aantal vrouwen dat bevalt van een prematuur en dysmatuur kind groter naarmate de ernst van het CNS stadium toeneemt (Piccoli, 2012).
Onder 127 vrouwen met CNS stadium 1 betrof het percentage vroeggeboorte < 37 wk 28% en < 34 wk 10%. Hoewel de gemiddelde amenorroe bij geboorte 37 wk bedroeg en het geboortegewicht gemiddeld 2855g, was de noodzaak tot NICU (Neonatal Intensive Care Unit) opname in deze Italiaanse studie 14% van de geboortes.
Achteruitgang van maternale nierfunctie door de zwangerschap was in deze observationele studie slechts gering met een mediane stijging van het serum kreatinine van 54.5 umol/l bij eerste controle naar 58.9 umol/l aan einde van de zwangerschap waargenomen, waarbij aangetekend moet worden dat bij een deel van de patiënten de eerste controle pas in eerste helft van de zwangerschap werd verricht waardoor uitgangswaarde van het serum kreatinine door hyperfiltratie lager zal zijn geweest dan preconceptionele waarde (zie ook figuur 2 in de module 'Diagnostiek en de behandeling nieuwe nefrologische problemen in verschillende trimesters').
b. Uitkomsten bij CNS stadium 2
In hetzelfde cohort vrouwen met CNS was het aantal zwangere vrouwen met CNS stadium 2 in totaal 27. Het percentage vroeggeboorte < 37 wk en < 34 wk was resp. 43% en 18%, en het percentage SGA 14%. Vijfentwintig percent van de geboren kinderen werd opgenomen op de NICU.
In deze kleine groep patiënten werd geen verschil gevonden tussen kreatinine bij eerste controle en einde van de zwangerschap.
c. Uitkomsten bij CNS stadium 3, 4 en 5
Ernstigere vormen van chronische nierschade (CNS stadium G3 en G4 met eGFR 15-60 ml/min/1.73m2) gaan gepaard met significante complicaties gedurende de zwangerschap. In een cohortstudie onder 297 vrouwen liet He zien dat bijna 60% prematuur beviel, en dat het percentage dysmaturiteit 44% bedroeg in 30 zwangeren met CNS stadia 3-4 (He, 2018). In het bovenbeschreven cohort van Piccoli et al. zijn deze percentages identiek, met nagenoeg 50% kans op vroeggeboorte < 34 wk en 75% kans op SGA. Meer dan de helft van de neonaten heeft NICU opname nodig.
Een recente retrospectieve cohortstudie van Wiles et al. liet zien dat onder 159 vrouwen de kans op foetale groeibeperking en vroeggeboorte significant hoger wordt bij oplopende CNS stadia (Wiles, 2020). Chronische hypertensie verslechtert de uitkomsten en speelt een negatieve prognostische rol in vroeggeboorte voor de 34ste zwangerschapsweek (0% bij normotensieve patiënten versus 34% bij patiënten met chronische hypertensie, waarbij het risico toeneemt van 20% naar 40% als de daling van kreatinine tijdens de zwangerschap minder dan 10% is (95% CI 26-56%)).
Ter illustratie:
Figuur 2 Neonatale uitkomsten (%) volgens CNS stadia
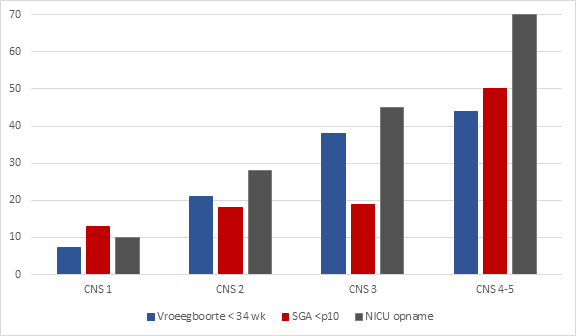
Geadapteerd van Piccoli (2012 tot 2017)
Figuur 3 Geboortegewicht (in gram) en percentage NICU opname (%) volgens CNS stadia
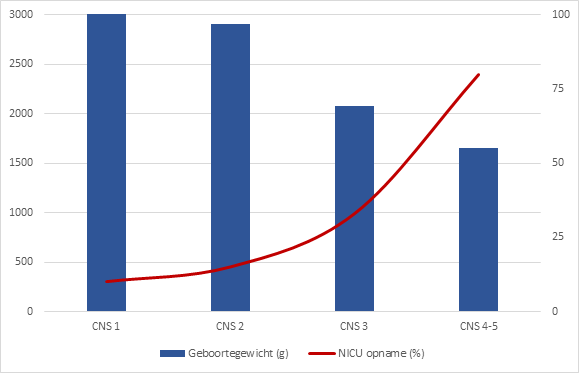
Geadapteerd van Van Gemert (2020); van Piccoli (2012 tot 2017)
Maternale (renale)complicaties gedurende de zwangerschap en postpartum naar stadium CNS
a. Zwangerschap
Zowel Piccoli et al., Bramham et al. en Wiles et al. lieten zien dat maternale (renale) complicaties gedurende de zwangerschap bij vrouwen met CNS toenemen naarmate het CNS stadium hoger is (Piccoli, 2015,; Bramham, 2016; Wiles, 2020). De novo hypertensie en verdubbeling van de proteïnurie zijn de meest kenmerkende onderdelen hiervan, met name bij patiënten met onderliggende systemische autoimmuunziekten.
Chronische hypertensie, proteinurie > 1 g/dag vóór de zwangerschap of in de eerste 20 weken van de zwangerschap, en afwezigheid van zwangerschapsgeïnduceerde daling van het serum creatinine (<10% ten opzichte van preconceptionele waarde) blijken verreweg de belangrijkste negatieve prognostische factoren voor ongunstige zwangerschaps- en maternale (renale) uitkomsten.
Figuur 4 Maternale complicaties (%) en opnameduur van de zwangere (dagen) bij zwangerschappen volgens CNS stadia

Geadapteerd van Piccoli et al (2012 tot 2017); van Gemert et al (2020); van Wiles 2020
b. Postpartum
In een cohort van 120 vrouwen met CNS lieten Bramham et al zien dat het verlies aan nierfunctie 6 maanden postpartum, uitgedrukt in 25% reductie van het eGFR tov preconceptionele eGFR, significant toeneemt met het CNS stadium (Bramham, 2016; figuur 5). Vermeldingswaardig is dat het kleine aantallen betreft van een single center studie.
Dit laatste werd bevestigd in een zeer recente retrospective cohortstudie onder 159 vrouwen met CNS 3-5 in 6 tertiaire centra in Engeland: Wiles et al. lieten zien dat deze 25% reductie in eGFR bij bijna de helft van alle vrouwen één jaar postpartum gezien werd, waarbij zelfs nierfunctie vervangende therapie in sommige gevallen nodig was (Wiles, 2020). Invloed op renale survival was groter naarmate preconceptionele nierfunctie slechter was met een verlies van respectievelijk 1.7, 1.8 en 4.9 jaarequivalenten van preconceptioneel nierfunctieverlies bij CNS stadia 3a, 3b en 4-5. Opvallend genoeg was de snelheid van nierfunctie achteruitgang na de acute drop in kreatinine postpartum tijdens de verdere follow-up niet veranderd ten opzichte van beloop preconceptioneel (zie figuur 6).
Figuur 5 Nefrologische uitkomsten 6 maanden postpartum, uitgedrukt als 25% afname van eGFR tov preconceptionele waarde, volgens CNS stadium (%).
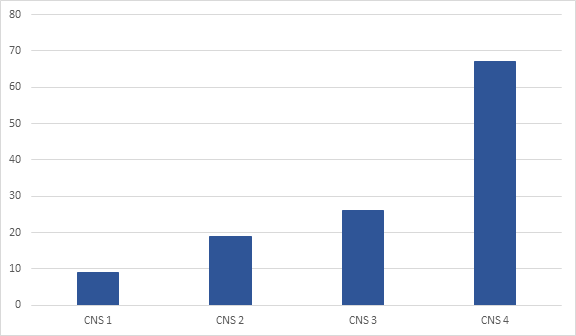
Geadapteerd van Bramham (2016)
Figuur 6 eGFR preconceptioneel en postpartum naar CNS stadium.
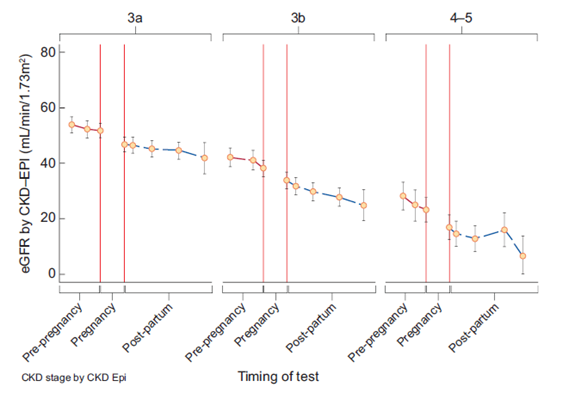
Wiles (2020)
Maternale en foetale uitkomsten bij vrouwen met systemische autoimmuunziekten
Zoals aangetoond door Piccoli et al in het TOCOS cohort is de kans op ongunstige maternale en foetale uitkomst bij patiënten met CNS stadium 1 met onderliggende systemische autoimmuunziekten (SLE, collageen ziektes of vasculitis), diabetische nefropathie en niertransplantatie vergroot, waarbij een 3 keer hogere kans op vroeggeboorte en bijna 6 keer zo hoge kans op NICU opname beschreven zijn (Piccoli, 2015). Bovendien hebben deze patiënten een hogere kans op verdubbeling van proteïnurie tijdens de zwangerschap.
Bij patiënten met SLE nefritis is het risico op obstetrische en maternale complicaties sterk verhoogd, vooral bij patiënten met actieve ziekte. Echter ook bij klinisch rustige ziekte is er een hoge incidentie van spontane miskraam, vroeggeboorte, intra-uteriene groeivertraging en perinatale sterfte beschreven (Rahman, 2005), waardoor alle zwangerschappen bij patiënten met SLE nefritis als hoog-risico zwangerschappen beschouwd dienen te worden.
Maternale en foetale uitkomsten na niertransplantatie
Verbetering in de transplantatiegeneeskunde en immuunsuppressie hebben de laatste 20 jaar gezorgd voor betere resultaten van niertransplantaties bij vrouwen in de fertiele levensfase. Zwangerschap na niertransplantatie gaat gepaard met significante risico’s voor moeder en kind. Bij de zwangere niertransplantatie patiënte kunnen complicaties optreden zoals acute rejectie, hypertensie, anemie, gecompliceerde urineweginfecties, en achteruitgang van de nierfunctie door calcineurineremmer toxiciteit, chronisch transplantaatfalen en recidief grondlijden. Bij de foetus kunnen onder andere – ernstige – foetale groeibeperking en prematuriteit optreden. Begeleiding in multidisciplinair verband met internist-nefroloog en gynaecoloog-perinatoloog, beide met ervaring en expertise op het gebied van zwangerschap bij patiënten met een niertransplantatie, en neonatoloog is van belang om deze complicaties te verminderen.
Zwangerschapsuitkomsten na niertransplantatie zijn over het algemeen gunstig bij patiënten met redelijke tot goede, stabiele nierfunctie zonder sterk verhoogde albuminurie (proteïnurie > 1 g/dag). Een recente meta-analyse liet onderstaande uitkomsten zien in 6712 zwangerschappen bij 4174 vrouwen. (Shah, 2019).
|
|
Percentage; betrouwbaarheidsinterval |
|
Levend geboren kinderen |
72.9 (95% C.I.; 70.0 – 75.6) |
|
Gemiddelde zwangerschapsduur bij geboorte |
34.6 wk |
|
Gemiddelde geboorte gewicht |
2470g ±265 |
|
Complicaties: |
|
|
Miskraam |
15.4 (95% C.I.; 13.8 – 17.2) |
|
Intra Uterine Vruchtdood |
5.1 (95% C.I.; 4.0 – 6.5) |
|
Pre-eclampsie |
21.5 (95% C.I.; 18.5 – 24.9) |
|
Zwangerschapshypertensie |
24.1 (95% C.I.; 18.1 – 31.5) |
|
Diabetes gravidarum |
5.7 (95% C.I.; 3.7 – 8.9) |
|
Vroeggeboorte |
38.7 (95% C.I.; 38.7 – 47.6) |
Adapted from Shah et al, 2019
Adviezen
Algemeen
Verreweg de meeste literatuur laat zien dat alle stadia van CNS gepaard gaan met nadelige zwangerschapsuitkomsten, zowel in meta-analyse (Zhang, 2015) als in cohortstudies (Piccoli, 2012, 2015, 2017; Bramham, 2016; Hladunewich, 2016; He, 2018; Wiles, 2020). Daarnaast zijn de nefrologische complicaties postpartum significant.
Hieruit volgt automatisch dat patiënten met pre-existente CNS onafhankelijk van het stadium altijd een medische indicatie hebben volgens de VIL (Verloskunde Indicatie Lijst, Verloskunde Vademecum 2003, eindrapport van de commissie verloskunde van het college van zorgverzekeringen), en dienen de zwangerschapscontroles verricht te worden door een gynaecoloog met aandacht voor maternale ziekten. Begeleiding in de eerste lijn bij patiënten met CNS is derhalve obsoleet.
Preconceptioneel advies
In veel gevallen zal een preconceptioneel adviesconsult reeds hebben plaatsgevonden waar risicostratificatie, potentieel teratogeen medicatiegebruik en een behandelplan gedurende de zwangerschap besproken zijn (zie verderop in deze richtlijn de module Preconceptionele counseling).
Indien dit niet heeft plaatsgevonden, vooral in milde gevallen (zoals CNS stadium 1 of 2 zonder co-morbiditeit en/of systemische autoimmuunziekten), is het zinvol om een dergelijk adviesconsult te voeren door hulpverleners met expertise op dit gebied, idealiter in een academisch ziekenhuis om gezamenlijk plaatsbepaling van antenatale controles te bespreken. Dat wil zeggen, kan de prenatale zorg op efficiënte en zorgvuldige wijze plaatsvinden in een tweedelijns ziekenhuis, rekening houdend met de ervaring van zowel gynaecoloog als internist-nefroloog, of is deze zorg doeltreffender in een tertiair centrum.
Rekening houdend met ernstige maternale en foetale complicaties bij vrouwen met CNS stadium 3 of hoger, én bij vrouwen met alle stadia CNS bij een niertransplantatie of systemische autoimmuunziekte (met of zonder immuunsuppressiva) is een preconceptioneel adviesconsult geïndiceerd in een academisch ziekenhuis door een gynaecoloog-perinatoloog en internist-nefroloog, beide met ervaring op het gebied van zwangerschap en CNS. Hierbij kan het adviesconsult uitgebreid worden met klinisch geneticus om eventuele aanvullende (genetische) diagnostiek in te zetten.
Op grond van deze gegevens staat vast dat de begeleiding van deze groep zwangeren in multidisciplinair verband gedaan moet worden waarbij nauwe samenwerking tussen gynaecoloog (perinatoloog) en internist-nefroloog, beide met ervaring met zwangerschap bij patiënten met CNS, belangrijk is.
Plaats van begeleiding in 2e of 3e lijn
Zwangeren met CNS hebben een verhoogd risico op maternale en foetale complicaties. Deze complicaties treden vaker op naarmate het CNS stadium hoger is (Piccoli, 2012, 2015) en er sprake is van een onderliggende systemische autoimmuunziekte of niertransplantatie (Piccoli, 2015). Antenatale controles dienen hierop aangepast te worden, waarbij het doel moet zijn om te anticiperen en tijdig behandelen van vroeg optredende signalen van renale complicaties zoals verergering van proteïnurie, hypertensie, anemie en ontregeling van elektrolyten. Bij tekenen van foetale problemen zoals intra-uteriene groeirestrictie dient foetale bewaking plaats te vinden.
De werkgroep acht het zinvol om regelmatig overlegmomenten te laten plaatsvinden met de derde lijn wanneer er twijfel is in de behandeling van patiënten die een indicatie hebben voor begeleiding in de 2de lijn (zie verderop in de text). Indien complicaties optreden, zoals maternaal (bijv. verslechtering van nierfunctie en/of verergering van proteinurie) of foetaal (foetale groei restrictie met doppler afwijkingen), dan is de werkgroep van mening dat verwijzing naar een academisch ziekenhuis geïndiceerd is. De meerwaarde van korte lijnen met de 3de lijn is belangrijk om de begeleiding van de zwangere met 2de lijnszorg indicatie zo optimaal mogelijk te maken. Vanuit patiënt perspectief is het wenselijk om de zorg dichtbij woonplaats te laten plaatvinden als het kan, en ver weg als het moet.
a. CNS stadium 1
Patiënten met CNS stadium 1 zonder niertransplantaat, zonder systemische autoimmuunziekte en zonder noodzaak tot gebruik van immuunsuppressiva hebben een mild verhoogd risico op zowel maternale als foetale complicaties. Begeleiding hiervan kan in de tweede lijn plaatsvinden door een obstetrisch georiënteerde gynaecoloog met aandacht voor maternale ziekten samen met een internist-nefroloog met affiniteit voor zwangerschap bij CNS. Bij proteïnurie en/of verergering van het onderliggend grondlijden is overleg met, en afhankelijk hiervan, verwijzing naar een academisch ziekenhuis geïndiceerd.
b. CNS stadium 2
De zwangerschap van patiënten met CNS stadium 2 zonder niertransplantaat, zonder systemische autoimmuunziekte en zondernoodzaak tot gebruik van immuunsuppressiva kan in de tweede lijn begeleid worden door een obstetrisch georiënteerde gynaecoloog met aandacht voor maternale ziekten samen met een internist-nefroloog met affiniteit voor zwangerschap bij CNS.
Indien er sprake is van een achteruitgang van nierfunctie en/of gecompliceerde ziekte en/of bijkomende co-morbiditeit, dan is overleg met een academisch ziekenhuis geïndiceerd. Vanuit patiëntperspectief is korte lijn tussen 2e en 3e lijn zeer relevant. Bij proteïnurie en/of verergering van het onderliggend grondlijden is verwijzing naar een academisch ziekenhuis geïndiceerd.
c. CNS stadium 3, 4 en 5
Vanaf CNS stadium 3 en hoger is het risico op zowel maternale als foetale risico’s sterk verhoogd, en is verwijzing voor antenatale begeleiding in een academisch ziekenhuis geïndiceerd.
Het is raadzaam deze groep patiënten in multidisciplinair verband te controleren in een team bestaande uit gynaecoloog-perinatoloog, internist-nefroloog, eventueel immunoloog, neonatoloog, (obstetrisch) anesthesist en klinisch geneticus.
d. Zwangerschap bij niertransplantatie en systemische autoimmuunziekten al dan niet gepaard gaand met gebruik van immuunsuppressiva
Na niertransplantatie en bij patiënten met systemische autoimmuunziekten, die al dan niet immuunsuppressiva moeten blijven gebruiken voor hun onderliggende nierziekte, is de werkgroep van mening dat begeleiding van de zwangerschap in een academisch ziekenhuis in multidisciplinair verband geïndiceerd is.
Onderbouwing
Achtergrond
In deze module zal besproken worden waar de counseling bij kinderwens, en zwangerschapscontroles van patiënten met CNS gehouden dienen te worden. Centraal staat vast dat zowel counseling als zwangerschapscontroles verricht dienen te worden door een obstetrisch georiënteerde gynaecoloog met affiniteit voor maternale ziekten. In gevallen van gevorderde stadia CNS dient dit in een academisch ziekenhuis plaats te vinden door gynaecoloog-perinatoloog en internist-nefroloog die ervaring en expertise hebben op het gebied van CNS en zwangerschap.
Het is nog onduidelijk hoe hoog het risico op zwangerschapscomplicaties is bij de verschillende stadia CNS en verschillende onderliggende nierziektes, maar ook welke prognostische factoren gebruikt kunnen worden om dit risico in te schatten. Afhankelijk van deze risico inschatting kan advies gegeven worden over plaats waar counseling en zwangerschapscontroles (eerste, tweede of derde lijn) plaats dienen te vinden.
Chronische nierschade (CNS) is een overkoepelende term voor nieraandoeningen met uiteenlopende klinische presentaties. Het betreft dus een heterogene patiëntengroep. De nierfunctie en de mate van proteïnurie (stadium van CNS) zijn de gemeenschappelijke parameters die onderzocht kunnen worden. Literatuur over de relatie tussen zwangerschapsuitkomsten en aard van de onderliggende nieraandoeningen is nauwelijks aanwezig, terwijl er wel literatuur is over zwangerschapsuitkomsten op basis van stadium van CNS. Voor deze uitgangsvraag zal niet gekeken worden naar de zwangerschapsuitkomsten bij individuele nierziekten op zich, maar naar de relatie tussen de verschillende stadia van CNS en zwangerschapsuitkomsten.
Conclusies / Summary of Findings
|
- GRADE |
No studies were found describing the relation between properties of CKD (degree of kidney insufficiency, degree of proteinuria, presence of hypertension) and maternal and fetal outcomes in women with CKD who are pregnant or wish to become pregnant taking in account correction for confounders.
Source: - |
|
- GRADE |
There is a body of literature that links adverse maternal and/or fetal outcome to women to all stages of CKD.
Pre-eclampsia, preterm birth, and impaired fetal growth are by far the most prevalent negative reproductive outcomes in these women.
Source: He, 2018; Hladunewich, 2014; Piccoli, 2015; Piccoli, 2016; Piccoli, 2012; Wiles, 2020; Zhang, 2015 |
Samenvatting literatuur
- Meta-analysis Zhang (2015): the authors undertook a systematic review and meta-analysis of cohort and case control studies to estimate the risk of pregnancy complications among patients with CKD versus those without CKD, and the risk of disease progression among women with CKD. Twenty-three studies with 504.700 pregnancies were included. Women with CKD and pregnancy had far worse pregnancy outcomes than women without CKD: the overall odds ratio (OR) for pre-eclampsia was 10.36 (95% CI, 6.28 to 7.09; p<0.001), pregnancy failure (described as still-birth and neonatal death) was 1.80 (95% CI, 1.03 to 3.13; p<0.04), prematurity (< 37 weeks gestation) was 5.72 (95% CI, 3.26 to 10.03; p<0.01), small for gestational age was 2.67 (95% CI, 2.01 to 3.57; p<0.001) and caesarean section was 4.85 (95% CI, 3.03 to 7.75; p<0.01). There were no significant differences in the occurrence of renal events (doubling of serum creatinin levels, 50% decrement of GFR, or end stage renal disease (ESRD)) during median follow-up of 5 years between CKD pregnant women with glomerular diseases (mainly IgA nephropathy) and those with similar diseases but without pregnancy (OR, 0.96; 95% CI, 0.69 to 1.35). However, in most of these 9 studies on renal events, patients with preserved renal function (CKD stages 1 and 2) were included.
- Piccoli (2012): two hundred and forty-nine pregnancies were monitored in 225 CKD patients over a 11-year period in a tertiary referral center in Italy. After exclusion for several reasons, 179 singleton pregnancies in CKD patients (127 CKD stage 1) were compared with a historical control group of 267 singleton ‘low-risk pregnancies’ in the same center Maternal and fetal outcome were described. CKD stage 1 patients were compared with healthy controls and with patients with CKD stages 2 to 4 using multivariate logistic regression analysis. As compared to healthy parous controls, pregnant patients with CKD stage 1 have a higher rate for preterm delivery < 37 weeks (OR 8.5; 95% CI 4.11 to 17.57), early preterm delivery < 34 weeks (OR 7.33; 95% CI 2.25 to 23.83) and need for NICU admission (OR 16.1; 95% CI 4.42 to 58.66). Furthermore, when compared to CKD stage 1, pregnancy in women with CKD stages 2 to 4 was associated with a greater OR for preterm delivery < 37 weeks (OR 2.84; 95% CI 1.30 to 6.20) and NICU admission (OR 2.59; 95% CI 1.10 to 6.06). Women with proteinuria > 1g had a greater risk of child admission to the NICU (OR 4.40; 95% CI 1.38 to 14.07). Clearly, the higher the CKD stage, the worse the fetal outcomes with increasing percentages of preterm delivery <37 weeks from 28% in stage 1 to 100% in stage 4 (controls 5%), early preterm delivery <34 weeks from 10% in stage 1 to 50% in stage 4 (controls 1.5%), small for gestational age <10 percentile from 14% in stage 1 to 75% in stage 4 (controls 10%), and need for NICU from 14% in stage 1 to 100% in stage 4 (controls 1%). Of note, only 17 patients with stage 3 and 4 patients with stage 4 were included in this analysis. In all stages of CKD, an increase in proteinuria and small rise in creatinin was observed from the first control to the last control during pregnancy. The increase in proteinuria showed a very wide scatter in all stages varying from no increase at all to nephrotic range proteinuria. The small overall rise in creatinin from 61.6 to 64.3 umol/L should be interpreted with caution because in a substantial part of the patients, the first control of creatinin was performed during the first half of pregnancy were physiologic hyperfiltration will have lowered creatinin.
- Piccoli (2015): in the Italian Torino-Cagliari observational TOCOS study, maternal and fetal outcome of 504 singleton pregnancies in women with CKD stages 1 to 5 were compared to those of 836 healthy parous controls. The risk for adverse perinatal outcome increased across CKD stages, where the combined outcome parameter preterm delivery < 37 weeks, SGA and NICU admissions rose form 34% in stage 1 to 90% in stage 4 to 5. Similarly, the combined parameters early preterm delivery < 34 weeks, SGA and NICU admissions rose from 21.4% in stage 1 to 80% in stage 4 to 5. In the largest cohort of women with CKD stage 1, preterm delivery was associated with baseline hypertension (OR 3.42; 95% CI 1.87 to 6.21), proteinuria (OR 3.69; 95% CI 1.63 to 8.36), and systemic disease consisting of diabetic nephropathy, SLE, collagen diseases or vasculitis, and kidney transplantation (OR 3.13; 95% CI 1.51 to 6.5). Moreover, even in the absence of baseline hypertension, proteinuria, or systemic disease, CKD stage 1 was still associated with the combined adverse perinatal outcome parameter of preterm delivery, NICU, and SGA (OR 1.88; 95% CI 1.27 to 2.79).
- Piccoli (2017): This study aimed to investigate the effect of common forms of glomerulonephritis on the pregnancy outcome in 126 women (CKD stage 1 to 5; 37 lupus glomerulonephritis and 33 IgA nephropathy) and compared these to 1418 low-risk parous controls without CKD from the TOCOS cohort. Using multiple regression analysis, preterm delivery < 37 weeks and early preterm delivery < 34 weeks rose significantly across CKD stages 1 to 5 (resp. from 33.3% in stage 1 to 82.4% in stages 3 to 5, p<0.001; and early preterm delivery from 9% to 35%, p<0.009). The risk for the development of new onset hypertension, new onset proteinuria and doubling of proteinuria also increased considerably across CKD stages.
- He (2018): nearly 300 pregnancies in women with CKD were studied retrospectively in a Chinese setting. The reproductive outcomes in stages 3-4 (n=30) in particular were described and compared to those of stages 1 (n=197) and 2 (n=73) and follow-up of stage 3-4 CKD was partly performed by telephone interview. Preterm birth was markedly increased in stages 3 to 4 as compared to staged 1 and 2 (57% versus 18% respectively, p<0.001), as was low birth weight (44% versus 15%, p<0.001). Renal function itself did not deteriorate throughout pregnancy per se, but the chance of progression to ESRD after pregnancy was higher in stage 3-4 CKD patients. However, in multivariate analysis the chance of developing ESRD in pregnant stage 3-4 CKD patients was comparable to the chance of ESRD in a control group of non-pregnant stage 3-4 CKD patients. In this multivariate analysis, only baseline serum creatinin and proteinuria were risk factors for renal function deterioration in patients with stage 3–4 CKD, while pregnancy itself did not increase the risk of renal function deterioration.
- Hladunewich (2014): pregnancy outcomes in women with end stage renal disease (ESRD) receiving hemodialysis were monitored in a comparison cohort study between Canadian (PreKid Clinic Registry) and United States ((American Registry for Pregnancy in Dialysis Patients) women. The 2 cohorts were comparable with respect to the causes of ESRD. Intensive hemodialysis throughout pregnancy resulted in a significant percentage live birth (86% in the Canadian cohort and 61% in the US cohort). In addition, only 6% of Canadian children born were classified as very low birth weight (versus 29% in the US cohort).
- Wiles (2020): the impact of CKD stages 3-5 on pregnancy outcomes was studied in 178 pregnancies beyond 20 weeks of gestation and included 43 women with renal transplants. The reproductive outcomes of these 159 women in 6 UK tertiary renal centers between 2003 and 2017 were studied and data were collected in a retrospective cohort analysis. Chronic hypertension was the strongest predictor of preterm delivery < 34 weeks gestation (32%) and this risk was higher (increasing from 20% to 40%) if the gestational fall in serum creatinine was < 10% of pre-pregnancy values. Pre-pregnancy proteinuria > 1 g/10 mmol creatinin increased the risk of birthweight below the 10th percentile with odds ratio of 2.57. Remarkably, there was a large drop in eGFR between pre-pregnancy and post-partum values, and this drop (4.5 mL/min/1.73m2) was much higher than the annual decline in eGFR prior to pregnancy (1.8 mL/min/1.73m2), resulting in considerable reduction of renal survival of 1.7, 2.1 and 4.9 years in CKD Stages 3a, 3b and 4–5, respectively. Th pregnancy associated decline in renal fuction was greater in women with chronic hypertension and in those with a gestational fall in serum creatinine of <10% of pre-pregnancy concentrations. As a consequence, the decline in renal function at 1 year postpartum was significant: almost half of all women had lost more than 25% of their pre-pregnancy eGFR or required renal replacement therapy.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
Which factors are related to complications of pregnancy in mother and/or child in different stages of chronic kidney disease (CKD)? How do these factors contribute to the estimated risk of maternal and fetal/neonatal complications?
P: patient women with CKD who are pregnant or wish to become pregnant;
I: intervention presence of prognostic factors: degree of kidney insufficiency, degree of proteinuria, presence of hypertension;
C: control absence of prognostic factors;
O: outcome measures maternal complications of pregnancy: maternal mortality; cardiovascular incidents/cerebrovascular incidents; preeclampsia/hypertensive disorders of pregnancy/HELPP; loss of renal function/worsening kidney function fetal complications: small for gestational age (SGA)/intrauterine growth restriction (IUGR)/dysmaturity/birth weight; premature birth/prematurity; fetal loss (stillbirth); birth defects; need for neonatal intensive care unit.
Relevant outcome measures
The guideline development group considered maternal mortality, maternal cardiovascular events and fetal mortality and birth defects as a critical outcome measures for decision making; and maternal preeclampsia/hypertensive disorders of pregnancy/HELLP and fetal growth restriction and need for neonatal intensive care unit as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com)] were searched with relevant search terms from 1st of January 1998 until 22nd of February 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 4821 hits. Studies were selected based on the following criteria: original studies or systematic reviews that described the relation between prognostic factors and maternal and neonatal outcomes in women with CKD who were pregnant or planning to get pregnant. The relation between these factors had to be corrected for confounders in a multivariate model. As a minimum the model had to be corrected for kidney function as a confounder.
Ninety-six studies were initially selected based on title and abstract screening. After reading the full text, all studies were excluded (see the table with reasons for exclusion under the tab Methods) because none of them fulfilled all the inclusion criteria.
Fourteen studies were found that did not report a multivariate model describing the relation between prognostic factors and maternal and neonatal outcomes in women with CKD who were pregnant or planning to become pregnant. However, these studies did report this relation in a univariate analysis. Six of the 14 studies are described below, in order to present at least an overview of less direct evidence. However, no GRADE-assessment of these studies is performed, since the minimum criteria for inclusion are not fulfilled.
One retrospective cohort study describing maternal and fetal outcome in patients with CKD 3-5 (Wiles, 2020), published after the closure of the search strategy (February 2019), was considered highly relevant for the guideline development and was included in the analysis.
Results
Fourteen studies did not meet the inclusion criteria but are described in the analysis of the literature, including one systematic review of the literature, because they are relevant for the direction of the recommendations.
Referenties
- Bramham K, et al. Diagnostic and predictive biomarkers for pre-eclampsia in patients with established hypertension and chronic kidney disease. Kidney Int 2016; 89: 874-885.
- Cabiddu G, Castellino S, Gernone G, et al. A best practice position statement on pregnancy in chronic kidney disease: the Italian Study Group on Kidney and Pregnancy. J Nephrol 2016; 29: 277-303.
- Van Gemert A, Lely AT. Adverse maternal and perinatal outcomes in pregnant women with different CKD stages. Verslag wetenschapstage UMCU 2020.
- He Y, Liu J, Cai Q, et al. The pregnancy outcomes in patients with stage 3-4 chronic kidney disease and the effects of pregnancy in the long term kidney function. J Nephrol 2018; 31: 953-960.
- Hladunewich M, Hou S, et al. Intensive hemodialysis associates with improved pregnancy outcomes: a Canadian and United States cohort comparaison. J Am Soc Nephrol 2014; 25: 1103-1109.
- Piccoli G, Fassio F, Attini R, et al. Pregnancy in CKD: whom should we follow and why? Nephrol Dial Transplant 2012; 27: 111-118.
- Piccoli G, Cabiddu G, Attini R, et al. Risk of adverse pregnancy outcomes in women with CKD. J Am Soc Nephrol 2015; 26: 2011-2022.
- Piccoli G, Attini R, et al. Maternal-foetal outcomes in pregnant women with glomerulonephritides. Are all glomerulonephritides alike in pregnancy? J Autoimmun. 2017; 79: 91-98.
- Rahman F., Rahman J, Al-Suleiman S, Rahman S. Pregnancy outcome in lupus nephropathy. Arch Gynecol Obstet (2005) 271: 222–226
- Shah S, Venkatesan R, Gupta A, et al. Pregnancy outcomes in women with kidney transplant: meta analysis and systematic review. BMC Nephrol 2019; 20:24
- VIL (Verloskunde Indicatie Lijst, Verloskunde Vademecum 2003, eindrapport van de commissie verloskunde van het college van zorgverzekeringen)
- Wiles K, Webster P, et al. The impact of chronic kidney disease stages 3-5 on pregnancy outcomes. Nephrol Dial Transplant (2020); 1-10
- Zhang J, Ma X, et al. A systematic review and meta-analysis of outcomes of pregnancy in CKD and CKD outcomes in pregnancy. Clin J Am Soc Nephrol 2015; 10: 1964-78
Evidence tabellen
Table of Exclusion after examination of full text
|
Author and Year |
Reason for exclusion |
|
Abou-Jaoude, 2012 |
Small population with no multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Aggarwal, 2011 |
No multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Aivazoglu, 2010 |
Small population with no multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Al Mashaleh, 2014 |
Small population with no multivariate analysis, and no mention of the actual kidney function. Population consisted out of SLE patients; only 20% of patients had lupus nephritis. |
|
Alshohaib, 2019 |
Narrative review |
|
Amine, 2014 |
Narrative review |
|
Andrade, 2008 |
no multivariate analysis including kidney function as a confounder, and no mention of the actual kidney function |
|
Barbhaiya, 2013 |
Narrative review |
|
Basaran, 2004 |
Small population with no multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Berardinelli, 1992 |
Small population with no multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Blom, 2017 |
No description between prognostic factors and maternal and/or neonatal/fetal outcomes specifically for women with CKD. |
|
Blume, 2014 |
Narrative review |
|
Bo, 2008 |
No multivariate analysis – no adjustment for confounders. Women with lupus nephritis only, and only prognostic factor studied is acL antibodies. |
|
Borella, 2014 |
No description between prognostic factors and maternal and/or neonatal/fetal outcomes specifically for women with CKD; this description is made for women with SLE; but kidney function is not reported or adjusted for |
|
Bramham, 2011 |
Small population with no multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Buyon, 2015 |
No description between prognostic factors and maternal and/or neonatal/fetal outcomes specifically for women with CKD; kidney function not reported or analysed as confounder |
|
Buyon, 2017 |
No description between prognostic factors and maternal and/or neonatal/fetal outcomes specifically for women with CKD; kidney function not reported or analysed as confounder |
|
Carmona, 2005 |
No multivariate analysis – no adjustment for confounders |
|
Clowse, 2007 |
Narrative review |
|
Czeizel, 2011 |
Wrong patient population (women with hypertension) |
|
Deshpanda, 2011 |
No multivariate analysis – no adjustment for confounders |
|
Dhananjaya, 2015 |
Wrong patient population (women with hypertension) |
|
Dinelli, 2017 |
No multivariate analysis – no adjustment for confounders |
|
Durst, 2015 |
Small population with no multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Ekborn, 2011 |
Wrong patient population with no multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Fischer, 2004 |
Wrong population (CKD patients versus non-CKD-patients). |
|
Gaggl, 2018 |
Wrong patient population with no multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Ghafari, 2008 |
Small population with no multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Grosfeld, 2010 |
Wrong patient population, narrative review. |
|
Guay-Woodford, 2010 |
Wrong patient population with no multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Hansen, 2015 |
Wrong patient population with no multivariate analysis and no description between prognostic factors and maternal and/or neonatal/fetal outcomes |
|
Hartung, 2014 |
Narrative review |
|
Hladunewich 2017 |
Narrative review |
|
Hladunewich, 2014 |
No multivariate analysis – no adjustment for confounders |
|
Hladunewich, 2016 |
Narrative review |
|
Hussein, 2016 |
Wrong patient population (SLE), kidney function not reported or included as confounder in the analysis |
|
Ionescu, 2015 |
Narrative review |
|
Jha, 2014 |
Letter to the editor |
|
Karkar, 2008 |
Narrative review |
|
Katz, 2005 |
Wrong patient population (not pregnant women), no multivariate analysis |
|
Kazancioglu, 2013 |
Narrative review |
|
Kaze, 2014 |
Wrong patient population (pre-ecclampsia), kidney finction not reported or analysed for |
|
Khamashta, 2006 |
Narrative review |
|
Khatun, 2003 |
Wrong patient population (patients with hypertension), no relation with predefined outcomes reported. |
|
Knight, 2017 |
Narrative review |
|
Kozlowska-Bozsko, 1996 |
No multivariate analysis – no adjustment for confounders |
|
Kukla, 2012 |
Narrative review (no systematic reporting of results), no multivariate analysis shown |
|
Kwinta, 2011 |
Wrong patiënt population (children with low birthweight, not pregnant women with kidney disease) |
|
Lannes, 2011 |
Wron patient population (SLE), small number (n=5), no multivariate analysis |
|
Li, 2018 |
No multivariate analysis |
|
Liu, 2016 |
No multivariate analysis |
|
Malik, 2005 |
No multivariate analysis |
|
Mathiesen, 2016 |
Narrative review |
|
Matok, 2011 |
Narrative review |
|
Mehrazma, 2012 |
Wrong patient population (children with congenital nephrotic syndrome) |
|
Mohamed Hassan, 2018 |
No multivariate analysis |
|
Morgan, 2011 |
Narrative review |
|
Moroni, 2003 |
Narrative review |
|
Moroni, 2004 |
Wrong patient population (patients are not pregnant or planning pregnancy) |
|
Moroni, 2016 |
No multivariate analysis |
|
Neill, 2011 |
Narrative review |
|
Nevis, 2011 |
Systematic review, but no multivariate analysis |
|
Nezvalov-Henriksen, 2001 |
Wrong patient population (women using triptan) |
|
North, 2000 |
No multivariate analysis |
|
Ostensen, 2013 |
Narrative review |
|
Packham, 2005 |
No multivariate analysis |
|
Phansenee, 2018 |
Wrong patient population (pregnant women with SLE). A subgroup analysis for women with renal involvement was performed, but this analysis was not adjusted for confounders. |
|
Piccoli, 2011 |
Systematic review with no multivariate analysis |
|
Piccoli, 2012 |
Answers search question, however, it is not clear for which variables an adjustment has been made in the multivariate analysis |
|
Piccoli, 2015 |
No multivariate analysis |
|
Piccoli, 2018 |
No multivariate analysis |
|
Pipli, 2011 |
Case report |
|
Ramin, 2006 |
Narative review |
|
Rezk, 2016 |
Wrong patient population (women with hypertension, no subgroup analysis for kidney disease), no mulitvariate analysis |
|
Sanfey, 2005 |
Narrative review |
|
Schell-Feith, 2000 |
Wrong patient population (preterm neonates), no multivariate analysis |
|
Schreuder, 2008 |
Wrong patient population (children with solitairy kidneys), no multivariate analysis |
|
Shah, 2019 |
No multivariate analysis |
|
Shimzu, 2010 |
No multivariate analysis for outcomes of interest for search question |
|
Shimzu, 2015 |
No multivariate analysis |
|
Smyth, 2010 |
No multivariate analysis |
|
Soh, 2014 |
Narrative review |
|
Solomon, 2011 |
Narrative review |
|
Sutton, 2018 |
Narrative review |
|
Tangren, 2018 |
Includes women that have had an episode of reversible acute kidney injury prior to pregnancy. Is this part of the patient population of interest? |
|
Tangren, 2018 |
Narrative review |
|
Tangren, 2017 |
Same paper as Tangren, 2018, see above. |
|
Watnick, 2008 |
Narrative review |
|
Webster, 2016 |
Narrative review |
|
Wu, 2018 |
Systematic review about maternal and fetal outcomes in women with lupus nephritis, but no multivariate analysis |
|
Yabu, 2009 |
Narrative review |
|
Yasmeen, 2001 |
Wrong patient population (pregnant women with SLE, no subgroup analysis with kidney disease), no multivariate analysis |
|
Yousif, 2006 |
Narrative review |
|
Yuen, 2008 |
Wrong patient population (pregnant women with SLE) |
|
Zhang, 2015 |
No multivariate analysis |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 11-09-2021
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Internisten Vereniging of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Risicostratificatie van zwangere vrouwen met chronische nierschade |
NIV |
2020 |
2025 |
5 jaar |
NIV en NVOG |
Nieuwe literatuur |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
De richtlijn heeft tot doel te komen tot een uniforme en zo mogelijk evidence based aanpak van de begeleiding en behandeling van vrouwen met CNS gedurende de zwangerschap, maar ook in de periode vooraf aan de zwangerschap (preconceptie) en gedurende de bevalling, en de periode van lactatie.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met CNS en zwangerschap. Daarnaast is de richtlijn ook bedoeld voor zorgverleners die in aanraking komen met patiënten met CNS en een kinderwens, en patiënten met CNS en een neonaat.
Primair is deze richtlijn bedoeld voor internisten(nefrologen) en gynaecologen, maar zal ook zeker relevant zijn voor huisartsen, verloskundigen, klinisch genetici, diëtisten en alle andere zorgverleners die actief zijn in de ketenzorg rondom zwangerschap en geboorte.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met chronische nierschade (CNS) die zwanger willen worden of zijn.
De werkgroep leden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. H.W. (Henk) van Hamersvelt, internist-nefroloog, Radboud Universitair Medisch Centrum, Nijmegen, NIV/NFN (voorzitter)
- Dr. A.T. (Titia) Lely, gynaecoloog-perinatoloog, Universitair Medisch Centrum Utrecht en Wilhelmina Kinder Ziekenhuis, Utrecht, NVOG (vice-voorzitter)
- Dr. M.F.C. (Margriet) de Jong, internist-nefroloog, Universitair Medisch Centrum Groningen, Groningen, NIV/NFN
- Dr. O.W.H. (Olivier) van der Heijden, gynaecoloog-perinatoloog, Radboud Universitair Medisch Centrum, Nijmegen, NVOG
- Dr. Y.K.O. (Onno) Teng, internist-nefroloog, Leids Universitair Medisch Centrum, Leiden, NIV/NFN
- Dr. A.M. (Albertien) van Eerde, klinisch geneticus, Universitair Medisch Centrum Utrecht, Utrecht, VKGN
- Dr. R. (Renate) Bosma, internist, Medisch Centrum Amersfoort, Amersfoort, NIV/NFN
- Dr. H. (Heleen) Grootjans, internist-nefroloog, Universitair Medisch Centrum Groningen, Groningen, NIV/NFN
- Dr. R. (Rob) van der Pas, internist-nefroloog, Radboud Universitair Medisch Centrum, Nijmegen, NIV/NFN
- Dr. I.W.H. (Inge) van Empel, gynaecoloog-perinatoloog, Radboud Universitair Medisch Centrum, Nijmegen, NVOG
- Dr. E. (Ellen) Nijkamp, gynaecoloog, Universitair Medisch Centrum Utrecht, Utrecht, NVOG
- Drs. M. (Merlijn) Wind, gynaecoloog in opleiding, Leids Universitair Medisch Centrum, Leiden, NVOG
Namens Nierpatiënten Vereniging Nederland
- Dr. K. (Karen) Prantl, patiëntvertegenwoordiger en beleidsmedewerker, NVN (Nier)
- Dr. K. (Kim) van Ierssel, patiëntvertegenwoordiger en ervaringsdeskundige, NVN (Nier)
Met ondersteuning van
- Dr. I.M. (Irina) Mostovaya, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroep leden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroep leden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Lely |
Gynaecoloog / peronatoloog WKZ |
0,7: Raad commissie ZonMw |
geen |
geen |
geen |
Deelnemer van landelijke werkgroep PARTOUT (Pregnancy After Renal Transplantation), onbetaald; de werkgroep ontvangt geen financiering |
geen |
12-9-2017 |
geen |
|
Van der Heijden |
Gynaecoloog-perinatoloog |
geen |
geen |
geen |
geen |
Deelnemer van landelijke werkgroep PARTOUT (Pregnancy After Renal Transplantation), onbetaald; de werkgroep ontvangt geen financiering |
geen |
5-12-2017 |
geen |
|
de Jong |
Internist-nefroloog UMCG |
Lid richtlijncommissie Nederlandse Federatie voor Nefrologie - onbetaald |
geen |
geen |
geen |
Deelnemer van landelijke werkgroep PARTOUT (Pregnancy After Renal Transplantation), onbetaald; de werkgroep ontvangt geen financiering |
geen |
30-1-2018 |
geen |
|
Teng |
Internist-nefroloog, Leids Universitair Medisch Centrum 1,0 ft |
geen |
geen |
geen |
geen |
geen |
geen |
4-2-2018 |
geen |
|
Prantl |
Beleidsmedewerker, nierpatiënten vereniging Nederland |
geen |
geen |
geen |
geen |
geen |
geen |
5-2-2018 |
geen |
|
Eerde |
Klinisch geneticus UMC Utrecht |
geen |
geen |
geen |
Ik heb subsidies voor wetenschappelijk onderzoek van Nierstichting Nederland en van Fonds Nuts - Ohra ontvangen |
Ik ben als klinisch geneticus expert op gebied van erfelijke nierziekten en coördinator van het Europees erkende expertise centrum voor erfelijke nierziekten in het UMC Utrecht en van de polikliniek erfelijke nierziekten. Mijn directe patiëntenzorg richt zich op mensen met een mogelijke nierziekte. ik draag bij aan patiënten-/publieksvoorlichting, onderwijs en richtlijnen met betrekking tot erfelijke nierziekte |
geen |
8-2-2018 |
geen |
|
Bosma |
Internist MC Amersfoort |
geen |
geen |
nee |
nee |
nee |
nee |
30-1-2018 |
geen |
|
Hamersvelt |
Internist-nefroloog Afdeling Nierziekten, Radboudumc Nijmegen |
Voorzitter richtlijncommissie Nederlandse Federatie voor Nefrologie - onbetaald, Lid Registratiecommissie Nederlandse Federatie voor Nefrologie - onbetaald, Lid bestuur Nederlandse Federatie voor Nefrologie - onbetaald |
geen |
geen |
geen extern gefinancierd onderzoek gerelateerd aan deze richtlijn |
geen |
geen |
8-2-2018 |
geen |
|
Ierssel |
Ervaringsdeskundige vrijwilliger |
geen |
geen |
geen |
geen |
geen |
geen |
5-2-2018 |
geen |
|
Grootjans |
Internist-nefroloog (in opleiding tot 27-3-2019) |
geen |
geen |
geen |
geen |
geen |
geen |
15-4-2019 |
geen |
|
Wind |
Gynaecoloog in opleiding |
geen |
geen |
geen |
geen |
geen |
geen |
30-4-2019 |
geen |
|
Van der Pas |
Internist-nefroloog i.o., Radboudumc |
geen |
geen |
geen |
geen |
geen |
geen |
30-4-2019 |
geen |
|
Van Empel |
Gynaecoloog en fellow perinatologie, Radboudumc |
Bestuurslid werkgroep perinatologie en maternale ziekten van de NVOG - niet betaald |
geen |
geen |
geen |
geen |
geen |
12-6-2019 |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door een afgevaardigde van de Nierpatiëntenvereniging Vereniging Nederland. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging Nierpatiëntenvereniging Vereniging Nederland en Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de module “Organisatie van zorg”. De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, om de registratielast niet toe te laten nemen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens werden stakeholders uitgenodigd voor een knelpuntenbijeenkomst (Invitational conference).
De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter, vice-voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Hieronder zijn de beoogde vragen en richtlijnmodules beschreven:
|
Preconceptie |
|
|
2. Wat is de plaats van preconceptionele counseling voor patiëntes met CNS en een kinderwens.
|
|
3. Welke patiënten komen in aanmerking voor preconceptionele genetische counseling?
|
|
4. Wat is de plaats van de verschillende geassisteerde voortplantingstechnieken bij patiëntes met CNSen een kinderwens? |
|
Gedurende de zwangerschap –patiëntes die dialyseren |
|
5. Hoe dient de begeleiding van zwangere vrouwen die nierfunctie vervangende therapie ondergaan eruit te zien?
|
|
6. Wat is de plaats van geavanceerd ultrageluid onderzoek (GUO) bij zwangeren met CNS en wanneer moet dat plaatsvinden? |
|
Gedurende zwangerschap – preventie |
|
7. Welke interventies zijn zinvol om de kans op pre-eclampsie te verkleinen bij zwangere patiënten met chronische nierschade?
|
|
8. Welke dieetbeperkingen en andere non-farmacologische interventies zijn zinvol/noodzakelijk bij verschillende groepen zwangere patiënten met chronische nierschade
|
|
Gedurende zwangerschap – behandeling |
|
9. Hoe dient de behandeling van hypertensie bij zwangere patiënten met chronische nierschade gedurende de verschillende trimesters eruit te zien? In hoeverre wijkt behandeling van hypertensie bij zwangere patiënten met chronische nierschade vóór de zwangerschap en tijdens de verschillende trimesters van de zwangerschap (inclusief pre-eclampsie) af van de MDR hypertensieve aandoeningen in de zwangerschap
|
|
10. Wat is de plaats van immunosuppressieve behandeling van patiënten met chronische nierschade tijdens zwangerschap?
|
|
11. Behandeling van bijkomende nefrologische problemen bij patiënten met chronische nierschade tijdens zwangerschap?
|
|
12. Benadering van nieuwe nefrologische problemen (proteïnurie/nefrotisch syndroom of TMA) in verschillende trimesters van zwangerschap?
|
|
Bevalling en lactatieperiode |
|
13. Hoe dient het beleid eruit te zien rondom de bevalling van een zwangere met CNS?
|
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroep leden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiënten perspectief zijn opgenomen in de zoekverantwoording.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroep leden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroep leden, de waarden en voorkeuren van de patiënt (patiënt values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten samen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten.
De werkgroep heeft besloten geen indicatoren te ontwikkelen bij de huidige richtlijn, omdat meeste aanbevelingen niet hard genoeg waren en er geen substantiële barrières konden worden geïdentificeerd die implementatie van de aanbeveling zouden kunnen bemoeilijken.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G.,... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E.,... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
