Diagnosegroepen
Uitgangsvraag
Welke groepen patiënten (diagnosegroepen) komen in aanmerking voor (onderdelen van) hartrevalidatie?
Aanbeveling
Verwijs patiënten met de volgende ‘absolute indicaties’ altijd voor hartrevalidatie:
- Patiënten met een uiting van coronairlijden, zowel acuut als chronisch, te weten:
- Patiënten met een acuut coronair syndroom , waaronder een acuut myocardinfarct en instabiele angina pectoris;
- Patiënten met stabiele angina pectoris;
- Patiënten die een Percutane Coronaire Interventie hebben ondergaan;
- Patiënten die een omleidingsoperatie (Coronary Artery Bypass Grafting) of open hartklepoperatie hebben gehad.
- Patiënten met chronisch hartfalen.
Overweeg verwijzing naar hartrevalidatie voor patiënten met de volgende ‘relatieve indicaties’.
- Patiënten met een aangeboren hartafwijking;
- Patiënten die een harttransplantatie hebben ondergaan;
- Patiënten die een hartklepoperatie hebben ondergaan;
- Patiënten die een ICD (Implantable Cardioverter Defibrillator) of een pacemaker hebben gekregen;
- Patiënten met atriumfibrilleren of andere (behandelde) ritmestoornissen;
- Patiënten met atypische thoracale pijnklachten (hartangst);
- Patiënten die een reanimatie hebben doorgemaakt en vanwege hun onderliggend lijden niet onder een van de absolute indicaties vallen;
- Patiënten met overige cardiothoracale chirurgische ingrepen.
Beoordeel bij de individuele patiënt met een relatieve indicatie vooral of hartrevalidatie het beloop van de aandoening positief kan beïnvloeden, met name als:
- Er sprake is van beweegangst;
- Er een ernstige beperking van het fysiek functioneren bestaat als gevolg van de hartaandoening die positief beïnvloed kan worden door een revalidatieprogramma
- Leefstijlfactoren het beloop van de ziekte negatief beïnvloeden;
- Er andere factoren zijn die participatie binnen de samenleving verhinderen en waarbij het vermoeden bestaat dat deze positief beïnvloed kunnen worden door een revalidatieprogramma.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor deze module is een literatuuranalyse gedaan naar de effectiviteit van hartrevalidatie bij verschillende diagnosegroepen. Hierbij is er in het bijzonder gekeken naar patiënten met coronairlijden (CAD), atriumfibrilleren (AF) of hartfalen (HF).
- Patiënten met CAD
De bewijskracht voor de cruciale uitkomstmaat was redelijk. De bewijskracht voor belangrijke uitkomstmaten was hoog tot laag. Hartrevalidatie bij patiënten met CAD verlaagt het risico om te overlijden en resulteert in een verlichting van depressieve symptomen en leidt niet tot een verandering in het aantal ziekenhuisopnames. Mogelijk leidt hartrevalidatie ook tot een verlaging in het risico op nieuwe hart- en vaatziekten.
- Patiënten met AF
De bewijskracht voor de cruciale en belangrijke uitkomstmaten was laag. Hartrevalidatie bij patiënten met AF heeft mogelijk geen effect op ziekenhuisopnames of verlichting van depressieve symptomen. Mogelijk resulteert hartrevalidatie wel in verbetering van angststoornissen.
- Patiënten met HF
De bewijskracht voor de cruciale uitkomstmaten was laag tot zeer laag. De bewijskracht voor belangrijke uitkomstmaten was redelijk tot zeer laag. Hartrevalidatie bij patiënten met HF verlaagt op de korte termijn (6 tot 12 maanden) mogelijk het risico op ziekenhuisopnames en verbetert mogelijk de kwaliteit van leven. We zijn onzeker over de effectiviteit van hartrevalidatie op mortaliteit. Op de lange termijn (> 12 maanden) zorgt hartrevalidatie mogelijk voor een afname in het risico op hart- en vaatziekten.
Het is belangrijk nog te benoemen dat er gefocust is op literatuur met een lange follow-up (> 12 maanden). Mogelijkerwijs kunnen er korte termijneffecten (< 12 maanden) zijn, maar deze zijn in de huidige analyse niet bekeken (behalve voor hartfalenpatiënten tussen 6 en 12 maanden). Daarnaast waren de interventies toegepast in de trials divers. Ondanks deze diversiteit aan vormen van hartrevalidatie blijven de positieve effecten op de genoemde uitkomsten behouden.
Indicaties: diagnosegroepen voor hartrevalidatie
Na het (recent) doormaken van een cardiaal incident worden de meeste hartpatiënten verwezen voor hartrevalidatie. Daarnaast kunnen ook hartpatiënten met een meer chronische ziekte in aanmerking komen voor hartrevalidatie. Al kan de timing van het verwijzen naar hartrevalidatie bij chronische ziekten soms lastig zijn. In het bijzonder bij patiënten met stabiele angina pectoris kan dit een issue zijn. Veelal worden patiënten verwezen na een cardiale interventie zoals een PCI of CABG, maar ook slechts een medicamenteuze behandeling is een voorkomende verwijsreden. Stabiele angina pectoris is, net al andere vormen van coronairlijden, onderdeel van het chronisch coronair syndroom. Het onderliggende lijden, te weten artherosclerose, is bij alle uitingen van coronairlijden hetzelfde. De meeste studies die gedaan zijn bij patiënten met coronairlijden includeren patiënten langs het hele spectrum van het chronisch coronair syndroom of enkel mensen na een acuut coronair syndroom of cardiale interventie. Aangezien studies naar patiënten met stabiele angina pectoris, in het bijzonder medicamenteus behandeld of met een PCI, niet voor handen zijn en het onderliggend lijden hetzelfde is, is voor de literatuuranalyse gekozen om te zoeken naar literatuur bij patiënten met coronairlijden. Uit deze analyse is naar voren gekomen dat hartrevalidatie bij patiënten met coronairlijden het risico om te overlijden verlaagt en mogelijk het risico hart- en vaatziekten verlaagt. Naast de literatuuranalyse onder patiënten met coronairlijden laat ook een recente Nederlandse observationele studie een positief effect zien op mortaliteit bij patiënten met stabiele angina pectoris. Uit deze studie (Eijsvogels, 2020) met een subgroepanalyse onder bijna 25.000 deelnemers met stabiele angina pectoris wordt een verlaagd risico op overlijden gevonden (HR 0,69 95%BI 0,63 tot 0,76, geadjusteerd voor belangrijke confounders). Tezamen nemend is er voldoende bewijs dat ook bij patiënten met stabiele angina pectoris, ongeacht de behandeling, hartrevalidatie baat heeft.
Hartrevalidatie is vrijwel altijd mogelijk, omdat het programma op maat wordt aangeboden (Jolliffe, 2001). Deze richtlijn maakt onderscheid in absolute indicatie (patiënten met aandoeningen waarvoor in principe altijd een indicatie voor hartrevalidatie geldt) en relatieve indicaties (patiënten waarbij in voorkomende gevallen een indicatie voor hartrevalidatie kan zijn)
Absolute indicaties
De diagnosegroepen die vallen onder de absolute indicaties en op basis hiervan altijd doorverwezen moeten worden zijn:
- Patiënten met een uiting van coronairlijden, hetzij acuut of chronisch (oftewel ongeacht welke vorm) te weten:
- Patiënten met een acuut coronair syndroom, waaronder een acuut myocardinfarct en instabiele angina pectoris;
- Patiënten met stabiele angina pectoris;
- Patiënten die een Percutane Coronaire Interventie hebben ondergaan;
- Patiënten die een omleidingsoperatie (Coronary Artery Bypass Grafting (CABG)) of open hartklepoperatie hebben gehad.
- Patiënten met chronisch hartfalen, ongeacht de gemeten linkerventrikelejectiefractie (dat wil zeggen, inclusief HFpEF, HFmrEF, HFrEF) en ongeacht of patiënten al dan niet een left ventricular assist device (LVAD) of ander cardiaal device hebben. Hierbij is de werkgroep wel van mening dat voor patiënten met een LVAD de revalidatie, gezien beperkte ervaring hiermee, het best kan worden verricht in een centrum dat hier expertise in heeft. Zie hiervoor ook module Complexe Hartrevalidatie.
Op grond van de literatuur kan gesteld worden dat voor bovenstaande groepen patiënten het bewijs is geleverd dat hartrevalidatie zinvol en effectief is. Met hartrevalidatie kunnen bij deze patiënten afhankelijk van de diagnose de volgende effecten worden bereikt:
- Afname van de cardiale mortaliteit;
- Afname van het risico op nieuwe of verergering van bestaande hart- en vaatziekten;
- Toename van inspanningscapaciteit;
- Toename van myocardiale oxygenatie;
- Verbetering van het lipidenprofiel (daling van LDL- en stijging van HDL-cholesterol);
- Toename van het zelfvertrouwen;
- Vermindering van depressieve symptomen en angstsymptomen.
Relatieve indicaties
Voor een aantal patiëntengroepen is het wetenschappelijk bewijs wat minder sterk. De projectgroep adviseert om bij de volgende patiëntengroepen, samen met de patiënt, hartrevalidatie te overwegen:
- Patiënten met een aangeboren hartafwijking;
- Patiënten die een harttransplantatie hebben ondergaan;
- Patiënten die een hartklepoperatie hebben ondergaan;
- Patiënten die een ICD (Implantable Cardioverter Defibrillator) of een pacemaker hebben gekregen;
- Patiënten met atriumfibrilleren of andere (behandelde) ritmestoornissen;
- Patiënten met atypische thoracale pijnklachten (hartangst);
- Patiënten die een reanimatie hebben doorgemaakt en vanwege hun onderliggend lijden niet onder een van de absolute indicaties vallen;
- Patiënten met overige cardiothoracale chirurgische ingrepen.
Bij twijfel dient een patiënt in elk geval te worden doorverwezen. Tijdens het intakegesprek kan via screening worden vastgesteld of er een indicatie voor hartrevalidatie is.
Contra-indicaties voor hartrevalidatie
Er bestaan voldoende relatief belemmerende factoren voor hartrevalidatie maar bijna geen absolute contra-indicaties voor hartrevalidatie an sich. Het komt vaker voor dat er een contra-indicatie is voor individuele onderdelen van de hartrevalidatie. Hiervoor verwijzen wij graag naar respectievelijk, de modules Contra-indicaties fysieke doelen en Contra-indicaties met betrekking tot psychisch functioneren. Ook kan er bijvoorbeeld een indicatie zijn voor gespecialiseerde revalidatie. Denk hierbij aan patiënten na een harttransplantatie en patiënten met een LVAD. Hiervoor verwijzen wij graag naar de module Complexe Hartrevalidatie.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het is belangrijk op te merken dat de waarden en voorkeuren van patiënten voor hartrevalidatie sterk kunnen variëren, omdat ze afhankelijk zijn van de individuele behoeften, doelen en omstandigheden van de patiënt. Over het algemeen kunnen de volgende punten worden beschouwd als waarden en voorkeuren die veel patiënten belangrijk vinden in het kader van hartrevalidatie:
- Kwaliteit van leven: Patiënten geven vaak de hoogste prioriteit aan het herstellen van hun kwaliteit van leven na een hartaandoening. Ze willen in staat zijn om dagelijkse activiteiten uit te voeren, weer actief te zijn en hun onafhankelijkheid te behouden.
- Informatie en educatie: Patiënten willen goed geïnformeerd worden over hun aandoening, behandelingsmogelijkheden en leefstijlveranderingen. Educatieve hulpmiddelen en voorlichting zijn belangrijk.
- Monitoren en meten van vooruitgang: Patiënten willen hun vooruitgang kunnen volgen en begrijpen. Het gebruik van meetbare doelen en regelmatige evaluaties kan nuttig zijn.
Kosten (middelenbeslag)
De kosteneffectiviteit van hartrevalidatie voor patiënten met hart- en vaatziekten kan variëren afhankelijk van verschillende factoren, waaronder de specifieke programma's, de gezondheidstoestand van de patiënt, de behandelingskosten en de uitkomsten die worden gemeten. Over het algemeen heeft hartrevalidatie aangetoond dat het kosteneffectief kan zijn, hoewel de exacte cijfers afhankelijk zijn van verschillende variabelen.
Hier zijn enkele punten om te overwegen:
- Verbetering van de gezondheid: Hartrevalidatieprogramma's richten zich op lichamelijke activiteit, dieetaanpassingen, psychosociale ondersteuning en educatie. Door deel te nemen aan deze programma's kunnen patiënten hun fysieke conditie verbeteren, risicofactoren verminderen en hun algemene gezondheidstoestand verbeteren, wat kan leiden tot een betere kwaliteit van leven en mogelijk lagere toekomstige gezondheidskosten.
- Voorkomen van heropnames: Hartrevalidatie kan helpen bij het verminderen van heropnames voor hart- en vaatziekten, waardoor de totale kosten van de gezondheidszorg kunnen worden verminderd.
- Productiviteit en arbeidsdeelname: Door de gezondheid van patiënten te verbeteren, kan hartrevalidatie hen in staat stellen om weer aan het werk te gaan of actief te blijven, wat de economische productiviteit kan bevorderen.
- Kosten van het programma: De kosteneffectiviteit kan ook afhangen van de kosten van het hartrevalidatieprogramma zelf, zoals de kosten van begeleiding, apparatuur, en de duur van het programma.
Over het algemeen suggereren veel studies en analyses dat hartrevalidatie kosteneffectief kan zijn, vooral op lange termijn, vanwege de gezondheidsvoordelen en de mogelijke kostenbesparingen in de gezondheidszorg. Echter, de exacte cijfers en conclusies kunnen variëren afhankelijk van de specifieke situatie en regio. Kosteneffectiviteitsanalyses kunnen worden uitgevoerd om de specifieke voordelen en kosten van hartrevalidatie in een bepaalde context te beoordelen. Het is belangrijk om te overleggen met zorgprofessionals en beleidsmakers om de meest relevante gegevens en aanbevelingen te verkrijgen voor uw specifieke situatie.
Aanvaardbaarheid, haalbaarheid en implementatie
Hartrevalidatie is een belangrijk onderdeel van de behandeling en zorg voor patiënten met hart- en vaatziekten. Hier zijn argumenten voor de aanvaardbaarheid, haalbaarheid en implementatie van hartrevalidatie:
Aanvaardbaarheid:
- Klinisch bewezen effectiviteit: Hartrevalidatieprogramma's hebben een aanzienlijke verbetering aangetoond in de klinische uitkomsten bij patiënten met hart- en vaatziekten. Dit maakt ze aanvaardbaar voor patiënten, omdat ze weten dat ze echt kunnen profiteren van deelname.
- Verbeterde levenskwaliteit: Hartrevalidatie kan de levenskwaliteit van patiënten verbeteren door hen te helpen fysiek en emotioneel sterker te worden en de angsten en zorgen over hun gezondheid aan te pakken.
- Individuele aanpassing: Hartrevalidatieprogramma's zijn vaak flexibel en kunnen worden aangepast aan de individuele behoeften van patiënten, wat de aanvaardbaarheid verhoogt.
Haalbaarheid:
- Beschikbaarheid van programma's: Hartrevalidatieprogramma's zijn wijdverspreid en toegankelijk, wat de haalbaarheid vergroot. Ze worden aangeboden in ziekenhuizen, klinieken en zelfs online.
- Interdisciplinaire aanpak: Hartrevalidatie omvat meerdere disciplines, waaronder cardiologen, fysiotherapeuten, diëtisten en psychologen, wat de haalbaarheid van een uitgebreide zorgbenadering verbetert.
- Verzekeringsdekking: Veel zorgverzekeringen dekken hartrevalidatieprogramma's, wat de financiële haalbaarheid vergroot voor patiënten.
Implementatie:
- Training van zorgverleners: Het trainen van zorgverleners om hartrevalidatieprogramma's op te zetten en uit te voeren, is essentieel voor de succesvolle implementatie.
- Ondersteuning van patiënten: Het betrekken van patiënten en hen informeren over het belang van hartrevalidatie en hoe ze kunnen deelnemen, is cruciaal voor een succesvolle implementatie.
- Technologische hulpmiddelen: Technologische vooruitgang maakt het mogelijk om hartrevalidatie op afstand aan te bieden, wat de implementatie vergemakkelijkt, vooral in landelijke of afgelegen gebieden.
Samengevat is hartrevalidatie aanvaardbaar en haalbaar vanwege de klinische voordelen, de beschikbaarheid van programma's en de interdisciplinaire benadering. De implementatie ervan kan worden verbeterd door training, patiënteneducatie en technologische ondersteuning. Het is belangrijk om hartrevalidatie te promoten als een integraal onderdeel van de zorg voor patiënten met hart- en vaatziekten om hun gezondheid en kwaliteit van leven te verbeteren.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Coronairlijden
Uit de literatuur komt naar voren dat er een reductie van de mortaliteit is na het volgen van een hartrevalidatieprogramma. Hierin wordt geen onderscheid gemaakt tussen verschillende uitingen van coronairlijden. Elke patiënt met coronairlijden heeft dus een absolute indicatie voor het volgen van een hartrevalidatieprogramma. Bij acute diagnoses is de timing hiervan eenvoudig. Denk hierbij aan een acuut myocardinfarct of interventie zoals een PCI of CABG. Bij een chronische diagnose zoals stabiele angina pectoris is timing van verwijzing minder duidelijk en dient dit dus gaandeweg het ziektebeeld besproken te worden met de patiënt. Bij voorkeur vindt verwijzing plaats bij een patiënt die stabiel is ingesteld op medicatie, en die op dat moment gemotiveerd is om te werken aan een gezonde leefstijl.
Atriumfibrilleren
Uit de literatuur komt geen duidelijke evidence naar voren, dat alle patiënten met atriumfibrilleren baat hebben bij hartrevalidatie. Derhalve blijft deze diagnose een relatieve indicatie houden. Echter, er is wel bewijs dat leefstijlfactoren en het beïnvloeden hiervan een grote rol kunnen spelen in het ontstaan of onderhouden van atriumfibrilleren. Daarnaast is bekend dat het beïnvloeden van risicofactoren kan zorgen voor betere ritme-controle (Rienstra, 2018; Pathak, 2014). Hartrevalidatie dient dus met name overwogen te worden bij patiënten met atriumfibrilleren waarbij het vermoeden bestaat dat leefstijl gerelateerde factoren een belangrijke rol spelen in het veroorzaken of onderhouden van het atriumfibrilleren. Voorbeelden hiervan zijn: overgewicht, stress, alcoholgebruik en fysieke inspanning. Het hartrevalidatieprogramma dient in deze gevallen met name gericht te zijn op het beïnvloeden van deze factoren, zoals ook aanbevolen in de ESC-richtlijn atriumfibrilleren 2020.
Hartfalen
Uit de literatuur komt naar voren dat er op de korte termijn een positief effect lijkt te zijn in het verminderen van het aantal ziekenhuisopnames en een verbeterde kwaliteit van leven. Op de lange termijn kunnen we dit resultaat niet bevestigen vanwege het ontbreken van evidence met een hoge kwaliteit. Wel lijkt er een positief effect te zijn in het verminderen van het risico op MACE (Major Adverse Cardiovascular Events) op de lange termijn. Over mortaliteit kan op basis van de literatuur geen uitspraak gedaan worden. Belangrijk nog om te vermelden is dat er geen nieuwe systematische literatuuranalyse gedaan is naar het effect van hartrevalidatie op de fysieke capaciteit (ook wel inspanningscapaciteit) bij patiënten met hartfalen. In de vorige editie van deze richtlijn werd reeds een positief effect beschreven van hartrevalidatie op de inspanningscapaciteit. Dit is echter onderbouwd door veelal gedateerde literatuur. Desalniettemin achtte de werkgroep het niet nodig hier een systematisch literatuuronderzoek naar te verrichten. Een recente meta-analyse (met een mix van studies van voor en na publicatie van de vorige richtlijn) toonde een verbetering van de inspanningscapaciteit (Peak VO2) in 17/18 geïncludeerde studies, waarbij bij de enige studie met een negatief resultaat er een significant verschil ten nadele van de HR-groep in op baseline gezien werd (Bjarnason-Wehrens, 2020). Hiermee acht de werkgroep het positieve effect van hartrevalidatie op de inspanningscapaciteit voldoende bewezen.
Hartrevalidatie heeft voor patiënten met hartfalen dus met name invloed op zachtere uitkomstmaten zoals kwaliteit van leven, ziekenhuisopnames en inspanningscapaciteit. Voor patiënten met hartfalen die vaak ernstige beperkingen in de inspanningscapaciteit hebben en vaak opgenomen worden in het ziekenhuis, beschouwt de werkgroep dit als zeer belangrijke uitkomstmaten en is de werkgroep ook van mening dat voor deze patiënten een absolute indicatie voor hartrevalidatie geldt. Dit is in lijn met de Europese richtlijn Hartfalen (McDonagh, 2022).
Overige relatieve indicaties
Voor ziektebeelden of interventies met een relatieve indicatie voor hartrevalidatie (zie lijst hierboven) is de werkgroep van mening dat hartrevalidatie met name overwogen dient te worden als er sprake is van:
-
- Beweegangst;
- Ernstige beperking van het fysiek functioneren als gevolg van de hartaandoening die positief beïnvloed kan worden door een revalidatieprogramma;
- Leefstijlfactoren die het beloop van de ziekte negatief beïnvloeden;
- Als er een cardiochirurgische interventie heeft plaatsgevonden;
- Andere factoren die participatie binnen de samenleving verhinderen en waarbij het vermoeden bestaat dat deze positief beïnvloed kunnen worden door een revalidatieprogramma.
Onderbouwing
Achtergrond
This module describes which groups of patients are eligible for (parts of) cardiac rehabilitation. It also discusses contraindications for participating in a rehabilitation program. The role of the cardiologist as a gatekeeper for cardiac rehabilitation is also explained, as well as the various ways in which this role can be fulfilled.
Compared to the previous guideline recommendations, the working group assessed for which indications new research might change the recommendations. Therefore, atrial fibrillation and heart failure were selected for a literature search.
In addition, the view has changed somewhat for patients with various forms of coronary artery disease (CAD) in recent years. In the previous guideline, an absolute indication is given for different manifestations of coronary artery disease (myocardial infact, unstable and stable angina pectoris). Internationally, coronary artery disease is often talked about as chronic coronary syndrome, which includes all its different manifestations. From a pathophysiological point of view, according to the working group (supported by the chronic coronary syndromes guideline of the ESC (Knuuti, 2020)), it is not useful to distinguish between different forms of coronary artery disease and the benefit of cardiac rehabilitation for these patients. The underlying disease (atherosclerosis) is the same in all patients. The working group has therefore chosen to search for evidence for cardiac rehabilitation in patients with coronary artery disease in general and to no longer distinguish between different manifestations of the disease.
Literature analysis
For the update of this module, three searches and literature analyses were performed focusing on patients with CAD, AF, or HF, respectively. The focus was on these three diagnosis groups because the assumption was that new literature could potentially change the recommendation.
1. Literature analysis of patients with CAD
2. Literature analysis of patients with AF
3. Literature analysis of patients with HF
Samenvatting literatuur
PICO 1 - CAD
Description of studies
Three systematic reviews were included. All three reviews included patients with CAD. The focus was slightly different for cardiac rehabilitation. Dibben (2021) studied exercise-based cardiac rehabilitation, Anderson (2017) patient education as part of CR and Richards (2017) a psychological intervention. Only trials with a minimum follow-up period of 13 months were included and described. In the table, a summary is given for each of the included reviews and included trials. See evidence table for more details.
|
Author, year |
Patients |
Intervention |
Outcomes (N studies) |
|
Dibben, 2021 |
Adult men and women who have had a MI, CABG or PCI, or have angina pectoris, or coronary artery disease.
|
Exercise-based CR
Defined as a supervised or unsupervised inpatient, outpatient, community- or home-based intervention which includes some form of exercise training that is applied to a cardiac patient population.
|
Hospital admissions (9 studies) MACE (21 studies) All-cause mortality (27 studies)
|
|
Anderson, 2017 |
Adults who had experienced a myocardial infarction (MI); who underwent revascularisation (coronary artery bypass grafting (CABG), percutaneous coronary intervention (PCI) or coronary artery stenting); or who had angina pectoris or CHD defined by angiography.
|
Patient education as part of CR
Defined as: 1. instructional activities 2. delivered as an inpatient, or outpatient in a community-based intervention setting or programme 3. included some form of structured knowledge transfer about CHD and 4. delivered in a face-to-face format, in groups or on a one-to-one basis. |
Hospital admissions (2 studies) MACE (1 study) All-cause mortality (7 studies)
|
|
Richards, 2017 |
Adults of all ages with CHD, with or without clinical psychopathology, managed in either hospital or community settings.
|
A psychological intervention.
Common aims of treatments included:
|
Hospital admissions (2 studies) MACE (8 studies) All-cause mortality (10 studies) Psychosocial recovery (5 studies) |
MACE, Major Adverse Cardiovascular Events.
Results
- Quality of life
All three reviews were not able to perform a meta-analysis for the results of quality of life. Primarily this was because of the different outcomes and methods used to assess quality of life. Dibben (2021) reported: “There were not enough data reported across trials at medium- and long-term follow-up for meta-analysis to be performed.” Anderson (2017) stated: “The wide variation in HRQoL outcomes and methods of reporting meant we were unable to meta-analyse results. Richards (2017) stated: “Direct comparisons between studies were difficult due to the different types of measures used to assess HRQoL.”
- Hospital admissions
The results are shown in figure 1. The pooled effect was a risk ratio of 0.92 (95%CI 0.84 to 1.00) meaning the risk of a hospital admission was potentially similar with cardiac rehabilitation compared with standard care among patients with CAD.
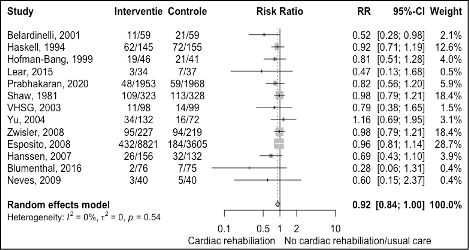
Figure 1 Meta-analyse of outcome hospitalization for cardiac rehabilitation versus usual care in patients with CAD
- MACE (Major Adverse Cardiovascular Events)
The results are shown in figure 2. The pooled effect was a risk ratio of 0.86 (95%CI 0.74 to 1.00) meaning the risk of a major adverse cardiovascular event was potentially reduced with cardiac rehabilitation compared with standard care among patients with CAD. The absolute risk difference was -1.27% (95%CI -2.41% to -0.13%) at follow-up > 12 months. This absolute risk difference was a clinically relevant effect as it is more than -0.5% at one year follow-up.
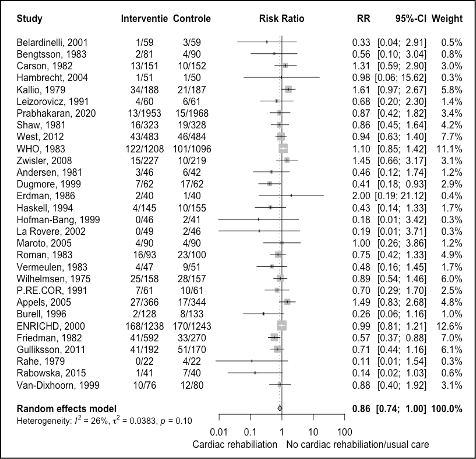
Figure 2 Meta-analyse of outcome MACE for cardiac rehabilitation versus usual care in patients with CAD
- All-cause mortality
The results are shown in figure 3. The pooled effect was a risk ratio of 0.88 (95%CI 0.80 to 0.97) meaning the risk of mortality was reduced with cardiac rehabilitation compared with standard care among patients with CAD. The corresponding absolute risk difference was -1.12% (95%CI -1.89% to -0.35%) at follow-up > 12 months. This absolute risk difference was a clinically relevant effect as it is more than -0.1% at one year follow-up.
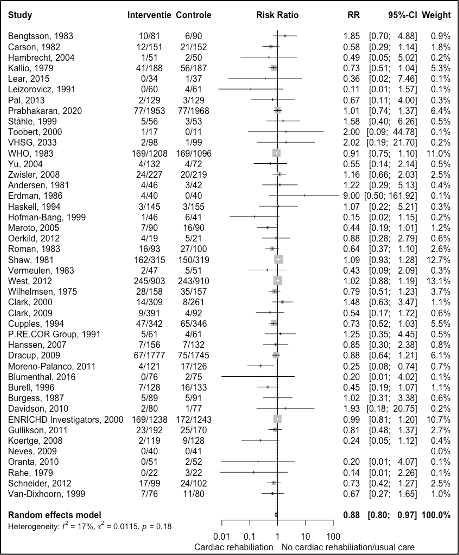
Figure 3 Meta-analyse of outcome all-cause mortality for cardiac rehabilitation versus usual care in patients with CAD
- Psychosocial recovery
Only the review by Richards (2017) assessed the outcome psychosocial recovery. The authors of this review reported data on depression symptoms and anxiety levels.
Depression symptoms
Five studies with a follow-up of > 12 months were included. The result of the meta-analysis is shown in Figure 4. After cardiac rehabilitation, there was a reduction in symptoms of depression compared with usual care (SMD -0.27 95%CI -0.47 to -0.06). The overall effect was a small benefit for cardiac rehabilitation.
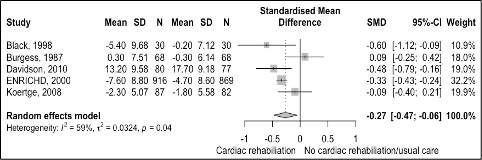
Figure 4 Meta-analyse of outcome depression symptoms for cardiac rehabilitation versus usual care in patients with CAD
Anxiety levels
Two studies reported on anxiety with a follow-up of > 12 months. Results were not pooled. One study (Burgess, 1987; SMD 0.05 95%CI -0.29 to 0.38) indicated no effect of cardiac rehabilitation on anxiety levels, while the other study showed a decrease in anxiety levels for cardiac rehabilitation (Davidson, 2010; SMD -0.34 95%CI -0.66 to -0.03).
Level of evidence of the literature
Hospitalizations: The level of evidence was downgraded by one level because of publication bias (see appendix for funnel plot; small and middle-sized studies with a potential increased risk of hospitalizations are missing).
MACE: The level of evidence was downgraded by two levels; one level because of imprecision (one clinically important boundary is crossed) and one level because of publication bias (see appendix for funnel plot; small and middle-sized studies with a potential increased risk are missing).
All-cause mortality: The level of evidence was not downgraded. Ten trials had potential high risk of bias. The sensitivity analysis excluded these trials with potential high risk of bias, did not change the pooled estimate (RR 0.86 95%CI 0.76 to 0.97). Therefore, the level of evidence was not downgraded for risk of bias. We also found no evidence for publication bias (see appendix for funnel plot).
Psychosocial recovery (depression symptoms): The level of evidence was downgraded by one level because of imprecision (boundary of a small effect was crossed by confidence interval); number of studies was too few to make a funnel plot.
Conclusions
Quality of life
|
- GRADE |
No conclusion can be drawn on the effect of cardiac rehabilitation in patients with CAD as the data were too different to perform a meta-analysis.
Source: Dibben, 2021; Anderson, 2017; Richards, 2017 |
Hospitalization
|
Moderate GRADE |
Cardiac rehabilitation likely results in little to no difference in the risk of hospitalization when compared with usual care in patients with CAD.
Source: Dibben, 2021; Anderson, 2017; Richards, 2017 |
MACE (Major Adverse Cardiovascular Events)
|
Low GRADE |
Cardiac rehabilitation may reduce the risk of MACE when compared with usual care in patients with CAD.
Source: Dibben, 2021; Anderson, 2017; Richards, 2017 |
All-cause mortality
|
High GRADE |
Cardiac rehabilitation reduces all-cause mortality when compared with usual care in patients with CAD.
Source: Dibben, 2021; Anderson, 2017; Richards, 2017 |
Depression symptoms
|
Moderate GRADE |
Cardiac rehabilitation probably results in a slight reduction in depressive symptoms when compared with usual care in patients with CAD.
Source: Richards, 2017 |
PICO 2 - AF
Description of studies
Risom (2020) performed a randomized controlled trial (CopenHeartRFA) to assess the effect of cardiac rehabilitation on hospitalization, quality of life and psychosocial recovery for patients treated for AF. A total of 210 patients from two Danish university hospitals treated with ablation for AF were included.
Patients were randomized either to cardiac rehabilitation (n=105) plus usual care or usual care alone (n=105). Cardiac rehabilitation consisted of a 12-week physical exercise program and psycho-educational consultations. The psychoeducational intervention consisted of education and information about AF which prepared the patients for expected symptoms and aimed to provide emotional support and improve coping skills and illness appraisal. The control group received usual care which was the standard medical follow-up for patients treated for AF. Follow-up was 24 months.
Patients receiving cardiac rehabilitation were 60 years of age (SD 9), and patients receiving usual care were 59 years (SD 12). The majority in both groups was male (74% and 77%, respectively).
De With (2019) performed a multicenter, randomized, open-label trial (RACE3) and investigated the effect of cardiac rehabilitation on quality of life in patients with early persistent AF and HF. Participants were recruited between May 2009 and November 2015 from 14 centers in the Netherlands and 3 in the UK. Patients were randomized to either targeted (n=114) or conventional therapy (n=116). The targeted group received on top of conditional therapy four additional therapies: mineralocorticoid receptor antagonists; statins; angiotensin converting enzyme inhibitors and/or receptor blockers; and cardiac rehabilitation. Cardiac rehabilitation consisted of physical activity, dietary restrictions, and counselling.
In total 230 patients with a mean age of 65 (SD 9) were included. 87% of the patients were male. Follow-up duration was 1 year.
Results
- Hospitalization (crucial)
Risom (2020) reported on hospitalization among patients with AF. During twenty-four months of follow-up (71 out of 105) 68% in the intervention group vs (60 out of 105) 57% in the control group were hospitalized. The authors did not rapport an effect estimate. Using the numbers provided in the article, the risk ratio was calculated. The risk of hospitalization is potentially 18% increased among patients receiving cardiac rehabilitation compared with usual care (RR 1.18 95%CI 0.96 to 1.46).
- Quality of life (crucial)
Risom (2020) and de With (2019) reported on quality of life using the SF-36 questionnaire. The results of the eight domains of the SF-36 are reported separately. Results could not be pooled because Risom (2020) did not report any measure of variation such as a SD or SE.
2.1 Bodily pain
Risom (2020) reported in the cardiac rehabilitation group a mean score of 77.97 at baseline and 85.69 after 24 months. In the usual care group, the mean score at baseline was 73.96 and after 24 months 85.84. The p-value between-group change was 0.12.
De With reported in the cardiac rehabilitation group a mean score of 80 (SD 22) at baseline and 85 (SD 21) after 12 months. In the usual care group, the mean score at baseline was 77 (SD 25) and after 12 months 81 (SD 22). The p-value between-group change was 0.83.
2.2 General health perception
Risom (2020) reported in the cardiac rehabilitation group a mean score of 65.34 at baseline and 62.64 after 24 months. In the usual care group, the mean baseline score at baseline was 65.85 and after 24 months 66.9. The p-value between-group change was 0.63.
De With reported in the cardiac rehabilitation group a mean score of 59 (SD 19) at baseline and 68 (SD 19) after 12 months, p-value <0.001. In the usual care group, the mean score at baseline was 59 (SD 19) and after 12 months 59 (SD 21), p-value 0.866. The p-value between-group change was <0.001.
2.3 Mental health index
Risom (2020) reported in the cardiac rehabilitation group a mean score of 69.05 at baseline and 78.82 after 24 months. In the usual care group, the mean baseline score at baseline was 70.38 and after 24 months 81.41. The p-value between-group change was 0.28.
De With reported in the cardiac rehabilitation group a mean score of 79 (SD 16) at baseline and 83 (SD 14) after 12 months, p-value 0.001. In the usual care group, the mean score at baseline was 77 (SD 15) and after 12 months 80 (SD 15), p-value 0.027. The p-value between-group change was 0.405.
2.4 Physical functioning index
Risom (2020) reported in the cardiac rehabilitation group a mean score of 81.40 at baseline and 86.61 after 24 months. In the usual care group, the mean baseline score at baseline was 80.45 and 86.95 after 24 months. The p-value between-group change was 0.95.
De With reported in the cardiac rehabilitation group a mean score of 67 (SD 23) at baseline and 79 (SD 21) after 12 months, p-value <0.001. In the usual care group, the mean score at baseline was 69 (SD 25) and after 12 months 75 (SD 23), p-value 0.024. The p-value between-group change was 0.007.
2.5 Role emotional index
Risom (2020) reported in the cardiac rehabilitation group a mean score of 67.51 at baseline and 80.17 after 24 months. In the usual care group, the mean baseline score at baseline was 58.21 and after 24 months 78.73. The p-value between-group change was 0.43.
De With reported in the cardiac rehabilitation group a mean score of 74 (SD 41) at baseline and 86 (SD 30) after 12 months, p-value 0.009. In the usual care group, the mean score at baseline was 77 (SD 38) and after 12 months 84 (SD 34), p-value 0.136. The p-value between-group change was 0.414.
2.6 Role physical index
Risom (2020) reported in the cardiac rehabilitation group a mean score of 44.38 at baseline and 74.22 after 24 months. In the usual care group, the mean baseline score at baseline was 49.88 and after 24 months 75.61. The p-value between-group change was 0.43.
De With reported in the cardiac rehabilitation group a mean score of 43 (SD 43) at baseline and 75 (SD 37) after 12 months, p-value <0.001. In the usual care group, the mean score at baseline was 51 (SD 45) and after 12 months 68 (SD 41), p-value 0.001. The p-value between-group change was 0.018.
2.7 Social functioning index
Risom (2020) reported on in the cardiac rehabilitation group a mean score of 75.39 at baseline and 88.89 after 24 months. In the usual care group, the mean baseline score at baseline was 77.87 and after 24 months 89.13. The p-value between-group change was 0.81.
De With reported in the cardiac rehabilitation group a mean score of 77 (SD 24) at baseline and 86 (SD 19) after 12 months, p-value 0.001. In the usual care group, the mean score at baseline was 81 (SD 20) and after 12 months 86 (SD 17), p-value 0.026. The p-value between-group change was 0.277.
2.8 Vitality index
Risom (2020) reported in the cardiac rehabilitation group a mean score of 50.73 at baseline and 66.37 after 24 months. In the usual care group, the mean baseline score at baseline was 50.51 and after 24 months 66.36. The p-value between-group change was 0.85.
De With reported in the cardiac rehabilitation group a mean score of 58 (SD 22) at baseline and 66 (SD 20) after 12 months, p-value <0.001. In the usual care group, the mean score at baseline was 60 (SD 21) and after 12 months 66 (SD 19), p-value 0.001. The p-value between-group change was 0.361.
- Psychosocial recovery (important):
Risom (2020) reported the HADS-A and HADS-D scores. A subscale score > 8 denotes anxiety or depression.
3.1 HADS-A
In the cardiac rehabilitation group, the mean HADS-A score was 5.81 points at baseline and 3.90 points after 24 months. HADS-A improved with 2.91 points. In the usual care group, the mean HADS-A score was 4.47 points at baseline and 4.73 after 24 months. HADS-A worsened with 0.26 points. Overall, HADS-A showed a improvement over time in favor of the cardiac rehabilitation group, p-value 0.004.
3.2 HADS-D
In the cardiac rehabilitation group, the mean HADS-D score was 3.25 points at baseline and 2.57 points after 24 months. HADS-D improved with 0.68 points. In the usual care group, the mean HADS-D score was 3.31 points at baseline and 2.86 after 24 months. HADS-D improved with 0.45 points. No difference over time was observed between the cardiac rehabilitation group and the usual care group, p-value 0.28.
- Mortality
Only Risom (2020) reported data on mortality. During the follow-up period, 1 patient died in each group. No conclusion will be drawn based on these few numbers.
- MACE (Major Adverse Cardiovascular Events) and cardiovascular disease
De With (2019) and Risom (2020) did not report any data on these outcome measures.
Level of evidence of the literature
The level of evidence regarding the outcome measure hospitalization was downgraded by two levels because confidence interval crossed a boundary of clinical important difference (imprecision). Although participants were not blinded, the outcome assessors were blinded. Data on hospitalization also came from a registry. Therefore, the level of evidence was not downgraded for risk of bias.
The level of evidence regarding the outcome measure quality of life (per domain) was not graded, because of baseline difference between intervention and control group and lack of measures of variation in one study.
The level of evidence regarding the outcome measure psychosocial recovery was downgraded by two levels because of study limitations (risk of bias, participants were not blinded) and optimal information size not met (imprecision).
The level of evidence regarding the outcome measure mortality was not graded because of too few numbers (one death in each group).
None of the included studies reported data on the effect of cardiac rehabilitation in patients with AF on the outcome measures MACE, and cardiovascular disease.
Conclusions
Hospitalization
|
Low GRADE |
Cardiac rehabilitation compared with usual care results in little to no difference on hospitalization in patients with atrial fibrillation.
Sources: Risom, 2020 |
Quality of life
|
- GRADE |
Because of baseline differences between intervention and control groups and lack of measures of variation in one study, no conclusion could be drawn on the effect of cardiac rehabilitation compared with usual care in patients with atrial fibrillation.
Sources: Risom, 2020; de With, 2019 |
Psychosocial recovery
|
Low GRADE |
Cardiac rehabilitation compared with usual care might improve anxiety in patients with atrial fibrillation.
Sources: Risom, 2020 |
|
Low GRADE |
Cardiac rehabilitation in comparison with usual care results in little to no difference on depression in patients with atrial fibrillation.
Sources: Risom, 2020 |
Mortality
|
- GRADE |
Because of too few numbers, no conclusion could be drawn on the effect of cardiac rehabilitation compared with usual care in patients with atrial fibrillation.
Sources: Risom, 2020 |
MACE (Major Adverse Cardiovascular Events)and cardiovascular disease
|
- GRADE |
None of the included studies reported data on the effect of cardiac rehabilitation on the outcome measures MACE or cardiovascular disease in patients with atrial fibrillation. |
PICO 3 - HF
Description of studies
Seven randomized controlled trials (Austin, 2008; Belardinelli, 1999; Belardinelli, 2012; Cowie, 2011; HF-ACTION, 2009; Jónsdóttir, 2006; Mueller, 2007) researched the effect of exercise training compared with usual care in patients with heart failure. Number of included participants ranged from 31 to 2331. Most participants were male (at least 64%) and with an average age of at least 53 years. The follow-up time in all trials was 2 years or more. See the evidence table for more details.
Results
- Quality of life
Short-term follow-up (6 to 12 months)
A total of 17 trials (one trial (Gary, 2010) with two comparisons) reported data on quality of life. All trials used the MLHF-HRQL questionnaire. The results of the pooled analysis are shown in figure 1. Overall, quality of life improved with cardiac rehabilitation compared with usual care for patients with heart failure (MD -7.10 (95%CI -10.34 to -3.86). However, the confidence interval crossed the boundary of a minimal clinically important difference of -5.
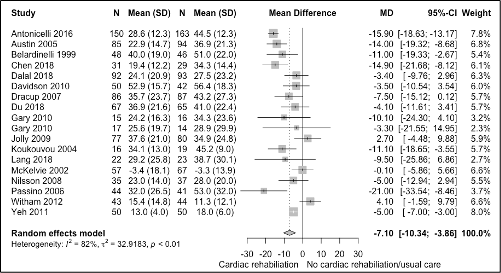
Figure 1 Meta-analysis of the short-term effect of cardiac rehabilitation on quality of life in heart failure patients
Long-term follow-up (>12 months)
Three trials (Austin, 2008; Belardinelli, 1999; Belardinelli, 2012) reported data on quality of life. All three used the MLHF-HRQL questionnaire. However, it was not possible to pool the results. One trial reported an average score for the groups, but it was unclear at which moment during follow-up these results were measured. The two other trials reported either no difference in score or a decrease in total score in favor of the intervention group. Therefore, no conclusion can be drawn on the effect of cardiac rehabilitation in patients with heart failure.
- Hospital admissions
Short-term follow-up (6 to 12 months)
The pooled results are shown in figure 2. The risk of hospital admissions is 27% lower with cardiac rehabilitation compared with usual care in patients with heart failure (Figure 2, RR 0.58 95%CI 0.58 to 0.92). This effect is clinically relevant.
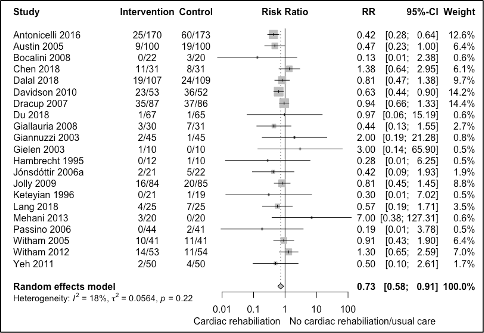
Figure 2 Meta-analysis of the short-term effect of cardiac rehabilitation on hospitalizations in heart failure patients
Long-term follow-up (>12 months)
All seven trials reported data on hospital admissions. All but one reported the number of participants who had at least on admission during follow-up. The pooled results are shown in figure 3. The risk of hospital admissions is 14% lower with cardiac rehabilitation compared with usual care in patients with heart failure (Figure 1, RR 0.86 95%CI 0.52 to 1.42). This effect is not clinically relevant according to the minimally important difference.
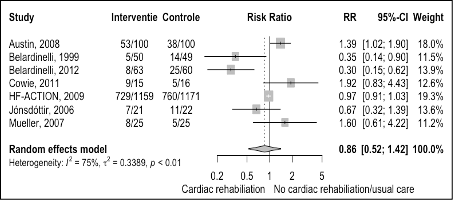
Figure 3 Meta-analysis of the effect of cardiac rehabilitation on hospital admissions in heart failure patients
- MACE (Major Adverse Cardiovascular Events)
Long-term follow-up (>12 months)
Only three trial reported data on MACE. The results are shown in figure 4. The risk of cardiovascular disease is 47% lower with cardiac rehabilitation compared with usual care in patients with heart failure (RR 0.53 95%CI 0.29 to 0.96). The absolute risk difference was -27.02% (95%CI -51.94% to -2.10%). This absolute risk difference was a clinically relevant effect as it is more than -1.0% at two-year follow-up.
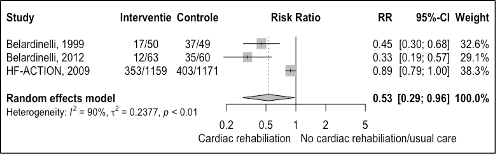
Figure 4 Meta-analysis of the effect of cardiac rehabilitation on cardiovascular diseases in heart failure patients
- All-cause mortality
Long-term follow-up (>12 months)
All but one trial reported data on mortality. Figure 5 shows the results of a meta-analysis. The risk of dying is decreased with 23% in patients who received cardiac rehabilitation compared with usual care (RR 0.77 95%CI 0.58 to 1.02). The absolute risk difference was -6.45% (95%CI -13.23 to 0.34). This absolute risk difference was a clinically relevant effect as it is more than -1.0% at two-year follow-up.
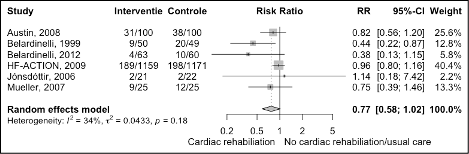
Figure 5 Meta-analysis of the effect of cardiac rehabilitation on mortality in heart failure patients
- Psychosocial recovery
None of the included trials reported any results on psychosocial recovery after cardiac rehabilitation.
Level of evidence of the literature
Quality of life:
- The level of evidence for short- term (Follow-up 6 to 12 months) was downgraded by two levels because of study limitations (risk of bias; majority of trials reported no information on randomization or allocation concealment) and inconsistency. We did not downgrade for imprecision as the broad confidence interval is linked to inconsistency.
- The level of evidence for long-term (Follow-up >12 months) was not graded because the results could not be pooled.
Hospital admissions:
- The level of evidence for short-term (Follow-up 6 to 12 months) was downgraded by two levels because of study limitations (risk of bias; majority of trials reported no information on randomization or allocation concealment) and imprecision (boundary of clinical important difference was crossed ).
- The level of evidence for long-term (Follow-up >12 months) was downgraded by three levels because of study limitations (risk of bias, one trial had issue with adherence to therapy. Five trials had some concerns due to no information on randomization or allocation concealment. One trial (Cowie, 2011) had high risk of bias because of selective outcome reporting); conflicting results (inconsistency); imprecision (confidence interval includes both boundaries of a minimally important difference).
MACE: The level of evidence for long-term (Follow-up >12 months) was downgraded by one level because of study limitations (risk of bias; two trials reported no information on randomization or allocation concealment).
All-cause mortality: The level of evidence for long-term (Follow-up >12 months) was downgraded by three levels because of study limitations (risk of bias, one trial had issue with adherence to therapy and five trials had some concerns due to no information on randomization or allocation concealment); conflicting results (inconsistency); imprecision (confidence interval includes one boundary of minimally important difference).
Psychosocial recovery: The level of evidence was not graded as none of the included trials reported any data on this outcome.
Conclusions
Quality of life
|
Low GRADE
- GRADE |
Short-term (Follow-up 6 to 12 months) Cardiac rehabilitation may improve quality of life when compared with usual care in patients with heart failure.
Source; Long, 2019
Long-term (Follow-up >12 months) No conclusion was drawn regarding the effect of cardiac rehabilitation on quality of life when compared with usual care in patients with heart failure because of inability to pool the results.
Source: Austin, 2008; Belardinelli, 1999; Belardinelli, 2012 |
Hospital admissions
|
Low GRADE
Very low GRADE |
Short-term (Follow-up 6 to 12 months) Cardiac rehabilitation may reduce the risk of hospital admissions when compared with usual care in patients with heart failure.
Source; Long, 2019
Long-term (Follow-up >12 months) The evidence is very uncertain about the effect of cardiac rehabilitation on hospital admissions when compared with usual care in patients with heart failure.
Source: Austin, 2008; Belardinelli, 1999; Belardinelli, 2012; Cowie, 2011; HF-ACTION, 2009; Jónsdóttir, 2006; Mueller, 2007 |
MACE (Major Adverse Cardiovascular Events)
|
Moderate GRADE |
Long-term (Follow-up >12 months) Cardiac rehabilitation likely reduces the risk of MACE when compared with usual care in patients with heart failure.
Source: Belardinelli, 1999; Belardinelli, 2012; HF-ACTION, 2009 |
All-cause mortality
|
Very low GRADE |
Long-term (Follow-up >12 months) The evidence is very uncertain about the effect of cardiac rehabilitation on all-cause mortality when compared with usual care in patients with heart failure.
Source: Austin, 2008; Belardinelli, 1999; Belardinelli, 2012; HF-ACTION, 2009; Jónsdóttir, 2006; Mueller, 2007 |
Psychosocial recovery
|
- GRADE |
No evidence was found regarding the effect of cardiac rehabilitation on psychosocial recovery when compared with usual care in patients with heart failure, as none of the included trials reported any data on this outcome. |
Zoeken en selecteren
Search and select
A systematic review of the literature was performed to answer the following question:
What are the favourable and unfavourable effects of cardiac rehabilitation compared with standard care for patients with coronary artery disease, atrial fibrillation or heart failure?
Table 1 PICO
|
Patients |
With:
|
|
Intervention |
Cardiac Rehabilitation |
|
Control |
Standard care |
|
Outcomes |
MACE (Major Adverse Cardiovascular Events), cardiovascular disease, mortality, quality of life, hospitalizations, psychosocial recovery |
|
Other selection criteria |
Study design: systematic reviews and randomized controlled trials Minimum follow-up: one year (preferably 5 for mortality) |
Relevant outcome measures
The guideline development group considered quality of life, and hospitalizations as critical outcome measures for decision making; and MACE, cardiovascular disease, mortality, and psychosocial recovery as important outcome measures for decision making.
A priori, the working group did not define the outcome measure MACE listed above but used the definitions used in the studies.
Minimal clinically important differences
Hospitalization: The working group defined a relative risk of 0.8 as a minimal clinically (patient) important difference.
MACE: The working group defined absolute risk reduction of > 5% over ten years as a minimal clinically (patient) important difference, which corresponds with a reduction of > 0.5% per year.
All-cause mortality: The working group defined absolute risk reduction of > 1% over ten years as a minimal clinically (patient) important difference, which corresponds with a reduction of > 0.1% per year.
Psychosocial recovery: The working group defined standardized mean differences of 0.2 to 0.5 as small, 0.5 to 0.8 as medium and > 0.8 as large.
Search and select (Methods) – PICO1
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 20 April 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 617 hits. For the selection criteria, see the PICO table. 33 studies were initially selected based on title and abstract screening. After reading the full text, 31 studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included (systematic reviews: Dibben, 2021 and Anderson, 2017). One additional review (Richards, 2017) was included from the reference list of a potential study. Of the three included reviews, two reviews (Anderson, 2017; Richards, 2017) performed a search more than two years ago. Our search found no RCTs after search date of these reviews.
Results – PICO1
Three studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables of the included systematic reviews.
Search and select (Methods) - PICO 2
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 20 October 2021. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 211 hits. For the selection criteria, see the PICO table. 6 studies were initially selected based on title and abstract screening. After reading the full text, 4 studies were excluded (see the table with reasons for exclusion under the tab Methods), and two studies were included (CopenHeartRFA trial (Risom, 2020) and RAE3 trial (De With, 2019)).
Results - PICO 2
Two studies concerning AF were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Search and select (Methods) - PICO 3
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 20 April 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 1124 hits. For the selection criteria, see the PICO table. 16 studies were initially selected based on title and abstract screening. After reading the full text, 15 studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included, a systematic review by Long (2019). This review included 44 trials comparing exercise-based cardiac rehabilitation with no exercise control in patients with heart failure. No other relevant trials were published after the search date by Long (2019). Authors performed analyses separately for trails with a follow-up of 6 to 12 months and trials with a follow-up of at least 13 months. In line with the literature analysis for PICO1 and PICO2, these analyses separated by follow-up were also adopted for this clinical question.
Results - PICO 3
Seven studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Anderson L, Brown JP, Clark AM, Dalal H, Rossau HK, Bridges C, Taylor RS. Patient education in the management of coronary heart disease. Cochrane Database Syst Rev. 2017 Jun 28;6(6):CD008895. doi: 10.1002/14651858.CD008895.pub3. PMID: 28658719; PMCID: PMC6481392.
- Austin J, Williams WR, Ross L, Hutchison S. Five-year follow-up findings from a randomized controlled trial of cardiac rehabilitation for heart failure. Eur J Cardiovasc Prev Rehabil. 2008 Apr;15(2):162-7.
- Belardinelli R, Georgiou D, Cianci G, Purcaro A. Randomized, controlled trial of long-term moderate exercise training in chronic heart failure: effects on functional capacity, quality of life, and clinical outcome. Circulation. 1999 Mar 9;99(9):1173-82.
- Belardinelli R, Georgiou D, Cianci G, Purcaro A. 10-year exercise training in chronic heart failure: a randomized controlled trial. J Am Coll Cardiol. 2012 Oct 16;60(16):1521-8.
- Bjarnason-Wehrens B, Nebel R, Jensen K, Hackbusch M, Grilli M, Gielen S, Schwaab B, Rauch B; German Society of Cardiovascular Prevention and Rehabilitation (DGPR). Exercise-based cardiac rehabilitation in patients with reduced left ventricular ejection fraction: The Cardiac Rehabilitation Outcome Study in Heart Failure (CROS-HF): A systematic review and meta-analysis. Eur J Prev Cardiol. 2020 Jun;27(9):929-952.
- Cowie A, Thow MK, Granat MH, Mitchell SL. A comparison of home and hospital-based exercise training in heart failure: immediate and long-term effects upon physical activity level. Eur J Cardiovasc Prev Rehabil. 2011 Apr;18(2):158-66.
- De With RR, Rienstra M, Smit MD, Weijs B, Zwartkruis VW, Hobbelt AH, Alings M, Tijssen JGP, Brügemann J, Geelhoed B, Hillege HL, Tukkie R, Hemels ME, Tieleman RG, Ranchor AV, Van Veldhuisen DJ, Crijns HJGM, Van Gelder IC. Targeted therapy of underlying conditions improves quality of life in patients with persistent atrial fibrillation: results of the RACE 3 study. Europace. 2019 Apr 1;21(4):563-571.
- Dibben G, Faulkner J, Oldridge N, Rees K, Thompson DR, Zwisler AD, Taylor RS. Exercise-based cardiac rehabilitation for coronary heart disease. Cochrane Database Syst Rev. 2021 Nov 6;11(11):CD001800. doi: 10.1002/14651858.CD001800.pub4. PMID: 34741536; PMCID: PMC8571912.
- Eijsvogels TMH, Maessen MFH, Bakker EA, Meindersma EP, van Gorp N, Pijnenburg N, Thompson PD, Hopman MTE. Association of Cardiac Rehabilitation With All-Cause Mortality Among Patients With Cardiovascular Disease in the Netherlands. JAMA Netw Open. 2020 Jul 1;3(7):e2011686.
- Jolliffe JA, Rees K, Taylor RS, Thompson D, Oldridge N, Ebrahim S. Exercise-based rehabilitation for coronary heart disease. Cochrane Database Syst Rev. 2001;(1):CD001800.
- Jónsdóttir S, Andersen KK, Sigurosson AF, Sigurosson SB. The effect of physical training in chronic heart failure. Eur J Heart Fail. 2006 Jan;8(1):97-101.
- Knuuti J, Wijns W, Saraste A, Capodanno D, Barbato E, Funck-Brentano C, Prescott E, Storey RF, Deaton C, Cuisset T, Agewall S, Dickstein K, Edvardsen T, Escaned J, Gersh BJ, Svitil P, Gilard M, Hasdai D, Hatala R, Mahfoud F, Masip J, Muneretto C, Valgimigli M, Achenbach S, Bax JJ; ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020 Jan 14;41(3):407-477.
- Long L, Mordi IR, Bridges C, Sagar VA, Davies EJ, Coats AJ, Dalal H, Rees K, Singh SJ, Taylor RS. Exercise-based cardiac rehabilitation for adults with heart failure. Cochrane Database Syst Rev. 2019 Jan 29;1(1):CD003331.
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, Burri H, Butler J, Čelutkienė J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Piepoli MF, Price S, Rosano GMC, Ruschitzka F, Skibelund AK; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. Rev Esp Cardiol (Engl Ed). 2022 Jun;75(6):523
- Mueller L, Myers J, Kottman W, Oswald U, Boesch C, Arbrol N, Dubach P. Exercise capacity, physical activity patterns and outcomes six years after cardiac rehabilitation in patients with heart failure. Clin Rehabil. 2007 Oct;21(10):923-31.
- O'Connor CM, Whellan DJ, Lee KL, Keteyian SJ, Cooper LS, Ellis SJ, Leifer ES, Kraus WE, Kitzman DW, Blumenthal JA, Rendall DS, Miller NH, Fleg JL, Schulman KA, McKelvie RS, Zannad F, Piña IL; HF-ACTION Investigators. Efficacy and safety of exercise training in patients with chronic heart failure: HF-ACTION randomized controlled trial. JAMA. 2009 Apr 8;301(14):1439-50.
- Pathak RK, Middeldorp ME, Lau DH, Mehta AB, Mahajan R, Twomey D, Alasady M, Hanley L, Antic NA, McEvoy RD, Kalman JM, Abhayaratna WP, Sanders P. Aggressive risk factor reduction study for atrial fibrillation and implications for the outcome of ablation: the ARREST-AF cohort study. J Am Coll Cardiol. 2014 Dec 2;64(21):2222-31.
- Rienstra M, Hobbelt AH, Alings M, Tijssen JGP, Smit MD, Brügemann J, Geelhoed B, Tieleman RG, Hillege HL, Tukkie R, Van Veldhuisen DJ, Crijns HJGM, Van Gelder IC; RACE 3 Investigators. Targeted therapy of underlying conditions improves sinus rhythm maintenance in patients with persistent atrial fibrillation: results of the RACE 3 trial. Eur Heart J. 2018 Aug 21;39(32):2987-2996.
- Richards SH, Anderson L, Jenkinson CE, Whalley B, Rees K, Davies P, Bennett P, Liu Z, West R, Thompson DR, Taylor RS. Psychological interventions for coronary heart disease. Cochrane Database Syst Rev. 2017 Apr 28;4(4):CD002902. doi: 10.1002/14651858.CD002902.pub4. PMID: 28452408; PMCID: PMC6478177.
- Risom SS, Zwisler AD, Sibilitz KL, Rasmussen TB, Taylor RS, Thygesen LC, Madsen TS, Svendsen JH, Berg SK. Cardiac Rehabilitation for Patients Treated for Atrial Fibrillation With Ablation Has Long-Term Effects: 12-and 24-Month Follow-up Results From the Randomized CopenHeartRFA Trial. Arch Phys Med Rehabil. 2020 Nov;101(11):1877-1886.
Evidence tabellen
PICO 1 - CAD
Evidence table for PICO1
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Dibben, 2021
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature searched up to June 2021
Only the results for a follow-up period of 13 months or more were described.
See Dibben, 2021 for details.
Study design: RCT
Setting and Country: See Dibben, 2021 (56% were undertaken in Europe).
Source of funding and conflicts of interest: 59% were funded by not-for-profit organisations; 33% did not report funding sources; 1% was funded by the industry; 7% were funded by a combination of industry and not-for-profit organisations. |
Inclusion criteria SR:
Exclusion criteria SR:
heart valve surgery, with heart failure, atrial fibrillation or heart transplants, or implanted with either cardiac-resynchronisation therapy or implantable cardiovertor defibrillators.
75 studies included
Important patient characteristics at baseline: See Dibben, 2021 for details.
|
Exercise-based CR is defined as a supervised or unsupervised inpatient, outpatient, community- or home-based intervention which includes some form of exercise training that is applied to a cardiac patient population. The intervention could be exercise training alone or exercise training in addition to psychosocial or educational interventions, or both (i.e. "comprehensive CR"). |
All CR interventions were compared to a 'no exercise' control, and both the intervention and control group received usual medical care. Usual care could include standard medical care, such as drug therapy, but without any form of structured exercise training or advice. |
End-point of follow-up: See Dibben, 2021 for details. Results were pooled at three follow-up timings: short-term (6 to 12 months); medium-term (> 12 to 36 months); and long-term (> 36 months).
Only the results of the medium-term and long-term were included.
For how many participants were no complete outcome data available? See Dibben, 2021 for details.
|
Outcome measure-1 Defined as quality of life (crucial)
” There were not enough data reported across trials at medium- and long-term follow-up for meta-analysis to be performed.”
Outcome measure-2 Defined as hospital admissions (crucial)
Medium-term (> 12 to 36 months) I: 392/3017 C: 417/2978 Pooled effect (random effects model): RR 0.92 [95% CI 0.82 to 1.03] favoring exercise-based CR Heterogeneity (I2): 0%
Outcome measure-3 Defined as MACE / cardiovascular disease. In the review defined as fatal or nonfatal MI.
Medium-term (> 12 to 36 months) I: 264/4830 C: 237/4735 Pooled effect (random effects model): RR 1.07 [95% CI 0.91 to 1.27] favoring usual care. Heterogeneity (I2): 0%
Long-term (> 36 months) I: 65/776 C: 102/784 Pooled effect (random effects model): RR 0.67 [95% CI 0.50 to 0.90] favoring Exercise-based CR. Heterogeneity (I2): 0%
Outcome measure-4 Defined as all-cause mortality.
Medium-term (> 12 to 36 months) I: 467/5611 C: 498/5462 Pooled effect (random effects model): RR 0.90 [95% CI 0.80 to 1.02] favoring exercise-based CR. Heterogeneity (I2): 0%
Long-term (> 36 months) I: 476/1902 C: 493/1926 Pooled effect (random effects model): RR 0.91 [95% CI 0.75 to 1.10] favoring exercise-based CR. Heterogeneity (I2): 35%
Outcome measure-5 Defined as psychosocial recovery.
Not reported for medium-term or long-term. |
Risk of bias (high, some concerns or low): Cochrane Risk of Bias tool See Dibben, 2021 for details.
|
|
Anderson, 2017
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs.
Literature search up to June, 2016
Only the results for a follow-up period of 13 months or more were described.
Study design: RCT
Setting and Country: See Anderson, 2017 for details (Eleven studies out of 22 were undertaken in Europe)
Source of funding and conflicts of interest: Eleven studies were funded by not-for-profit organisations; six studies did not report funding sources; one study was funded by the industry; four studies were funded by health insurance companies. |
Inclusion criteria SR:
Exclusion criteria SR: studies of education programmes which included participants who:
22 studies included
Important patient characteristics at baseline: See Anderson, 2017 for details.
|
Patient education as part of CR
Defined as: 1. instructional activities organised in a systematic way involving personal direct contact between a health professional and CHD patients with or without significant others: e.g. spouse, family member; 2. delivered as an inpatient, or outpatient in a community-based intervention setting or programme; 3. included some form of structured knowledge transfer about CHD, its causes, treatments, or methods of secondary prevention; and 4. delivered in a face-to-face format, in groups or on a one-to-one basis. We also included alternative interactive methods of educational delivery such as 'telehealth' (telephone, e-mail, Internet and teleconference between educator and patient). |
Usual care |
End-point of follow-up: See Anderson, 2017 for details.
Only the results of a follow-up of at less 13 months were included.
For how many participants were no complete outcome data available? See Anderson, 2017 for details.
|
Outcome measure-1 Defined as quality of life (crucial)
” The wide variation in HRQoL outcomes and methods of reporting meant we were unable to meta-analyse results.”
Outcome measure-2 Defined as hospital admissions (crucial)
Follow-up > 12 months, n/N Esposito, 2008 I: 432/8821 C: 184/3605 RR 0.96 [95%I 0.81 to 1.14] Hanssen, 2007 I: 26/156 C: 32/132 RR 0.69 [95%CI 0.43 to 1.09]
Results were not pooled as only two trials reported on hospitalizations with a follow-up of > 12 months.
Outcome measure-3 Defined as MACE / cardiovascular disease. In the review defined as fatal or non-fatal MI
Follow-up > 12 months, n/N P.RE.COR Group, 1991 I: 7/61 C: 10/61 RR 0.70 [95% CI 0.29 to 1.72]
Outcome measure-4 Defined as all-cause mortality.
Follow-up > 12 months I: 153/3157 C: 184/2855 Pooled effect (random effects model): RR 0.78 [95% CI 0.60 to 1.02] favoring education. Heterogeneity (I2): 19%
Outcome measure-5 Defined as psychosocial recovery.
Not reported. |
Risk of bias (high, some concerns or low): Cochrane Risk of Bias tool See Anderson, 2017 for details.
|
|
Richards, 2017
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to April, 2016
Only the results for a follow-up period of 13 months or more were described.
Study design: RCT
Setting and Country: See Richards, 2017 for details (51% of studies were undertaken in Europe)
Source of funding and conflicts of interest: Twelve studies did not report funding sources; seven received government research grants; six from charities; six rom a mix of charities and government funding; two a mix of private companies, government and charities; one university funded. |
Inclusion criteria SR:
Exclusion criteria SR:
35 studies included
Important patient characteristics at baseline: See Richards, 2017 for details.
|
A psychological intervention.
Common aims of treatments included:
Common components of psychological treatments included:
|
Common form of comparator was either 'usual medical care' or a 'cardiac rehabilitation programme in addition to usual medical care'. |
End-point of follow-up: See Richards, 2017 for details.
Only the results of a follow-up of at less 13 months were included.
For how many participants were no complete outcome data available? See Richards, 2017 for details.
|
Outcome measure-1 Defined as quality of life (crucial)
”Direct comparisons between studies were difficult due to the different types of measures used to assess HRQoL.”
Outcome measure-2 Defined as hospital admissions (crucial)
Follow-up > 12 months, n/N Blumenthal, 2016 I: 2/76 C: 7/75 RR 0.28 [95%I 0.06 to 1.31] Neves, 2009 I: 3/40 C: 5/40 RR 0.43 [95%CI 0.15 to 1.19]
Results were not pooled as only two trials reported on hospitalizations with a follow-up of > 12 months.
Outcome measure-3 Defined as MACE / cardiovascular disease. In the review defined as non-fatal MI.
Follow-up (> 12 months); only included relevant studies for these results I: 290/2655 C: 302/2302 Pooled effect (random effects model): RR 0.76 [95% CI 0.54 to 1.07] favoring Cardiac rehabilitation. Heterogeneity (I2): 59%
Outcome measure-4 Defined as all-cause mortality.
Follow-up (> 12 months); only included relevant studies for these results I: 232/2210 C: 270/2214 Pooled effect (random effects model): RR 0.77 [95% CI 0.59 to 1.01] favoring Cardiac rehabilitation. Heterogeneity (I2): 12%
Outcome measure-5 Defined as psychosocial recovery.
Depression Only relevant studies with follow-up > 12 months included (Black, 1998; Burgess, 1987; Davidson, 2010; Enrichd investigators, 2000; Koertge, 2008) Pooled effect (random effects model): SMD -0.27 (-0.47 to -0.06) favoring cardiac rehabilitation. Heterogeneity (I2): 59%
Anxiety Two studies reported on anxiety with a follow-up of > 12 months. Results were not pooled. Mean (SD), n Burgess, 1987 I: -0.5 (6.9), 68 C: -0.8 (0.2), 68 SMD 0.05 (-0.29 to 0.38) Davidson, 2010 I: 6.7 (4.3), 80 C: 8.4 (5.2), 77 SMD -0.34 (-0.66 to -0.03)
|
Risk of bias (high, some concerns or low): Cochrane Risk of Bias tool See Richards, 2017 for details.
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Deka P, Pathak D, Klompstra L, Sempere-Rubio N, Querol-Giner F, Marques-Sule E. High-Intensity Interval and Resistance Training Improve Health Outcomes in Older Adults With Coronary Disease. Journal of the American Medical Directors Association. 2022;23(1):60-5. |
Follow-up too short (8 weeks)
|
|
Bagheri H, Shakeri S, Nazari AM, Goli S, Khajeh M, Mardani A, et al. Effectiveness of nurse-led counselling and education on self-efficacy of patients with acute coronary syndrome: A randomized controlled trial. Nursing open. 2022;9(1):775-84. |
Follow-up too short (1 month) |
|
Shi Y, Lan J. Effect of stress management training in cardiac rehabilitation among coronary artery disease: a systematic review and meta-analysis. Reviews in cardiovascular medicine. 2021;22(4):1491-501. |
SR included trials with CR as control group. |
|
Mustansar A, Noor R, Mahmood S, Yaqoob T, Latif W, Laique T. Outcome of cardiac rehabilitation in improving quality of life among women having IHD: A randomized controlled trail. Pakistan Journal of Medical and Health Sciences. 2021;15(1):488-90. |
Unclear if participants were randomized; follow-up too short (6 months) |
|
Mansilla-Chacón M, Gómez-Urquiza JL, Martos-Cabrera MB, Albendín-García L, Romero-Béjar JL, Cañadas-De La Fuente GA, et al. Effects of supervised cardiac rehabilitation programmes on quality of life among myocardial infarction patients: A systematic review and meta-analysis. Journal of Cardiovascular Development and Disease. 2021;8(12). |
SR; majority of included trials had a too short follow-up
|
|
Kim C, Choi I, Cho S, Kim AR, Kim W, Jee S. Do Cardiac Rehabilitation Affect Clinical Prognoses Such as Recurrence, Readmission, Revascularization, and Mortality After AMI?: Systematic Review and Meta-Analysis. Annals of rehabilitation medicine. 2021;45(1):57-70. |
Only 2 RCT were included, specific population of acute MI.
|
|
Khan Z, Musa K, Abumedian M, Ibekwe M. Prevalence of Depression in Patients With Post-Acute Coronary Syndrome and the Role of Cardiac Rehabilitation in Reducing the Risk of Depression: A Systematic Review. Cureus. 2021;13(12):e20851. |
Unclear which studies were included
|
|
Hu Y, Li L, Wang T, Liu Y, Zhan X, Han S, et al. Comparison of cardiac rehabilitation (exercise + education), exercise only, and usual care for patients with coronary artery disease: A non-randomized retrospective analysis. Pharmacology Research and Perspectives. 2021;9(1). |
Not a RCT |
|
Cojocariu SA, Maștaleru A, Sascău RA, Stătescu C, Mitu F, Cojocaru E, et al. Relationships between psychoeducational rehabilitation and health outcomes—a systematic review focused on acute coronary syndrome. Journal of Personalized Medicine. 2021;11(6). |
SR on psycho-education interventions; Cochrane review available with a meta-analysis of results. |
|
Prabhakaran D, Chandrasekaran AM, Singh K, Mohan B, Chattopadhyay K, Chadha DS, et al. Yoga-Based Cardiac Rehabilitation After Acute Myocardial Infarction: A Randomized Trial. Journal of the American College of Cardiology. 2020;75(13):1551-61. |
Trial included in SR from Dibben |
|
McGregor G, Powell R, Kimani P, Underwood M. Does contemporary exercise-based cardiac rehabilitation improve quality of life for people with coronary artery disease? A systematic review and meta-analysis. BMJ open. 2020;10(6):e036089. |
SR into CR versus no CR with a focus on the outcome QoL (selection of included Cochrane review). |
|
Lee J, Lee R, Stone AJ. Combined Aerobic and Resistance Training for Peak Oxygen Uptake, Muscle Strength, and Hypertrophy After Coronary Artery Disease: a Systematic Review and Meta-Analysis. Journal of cardiovascular translational research. 2020;13(4):601-11. |
Outcomes not of interest |
|
Candelaria D, Randall S, Ladak L, Gallagher R. Health-related quality of life and exercise-based cardiac rehabilitation in contemporary acute coronary syndrome patients: a systematic review and meta-analysis. Quality of Life Research. 2020;29(3):579-92. |
SR into CR versus no CR with a focus on the outcome QoL (selection of included Cochrane review). |
|
Campo G, Tonet E, Chiaranda G, Sella G, Maietti E, Bugani G, et al. Exercise intervention improves quality of life in older adults after myocardial infarction: randomised clinical trial. Heart. 2020;106(21):1658-64. |
Education on lifestyle, etc. as controle group |
|
Bubnova MG, Aronov DM. Physical rehabilitation after acute myocardial infarction: Focus on body weight. Russian Journal of Cardiology. 2020;25(5):15-23. |
Included in Cochrane review Dibben
|
|
Avila A, Claes J, Buys R, Azzawi M, Vanhees L, Cornelissen V. Home-based exercise with telemonitoring guidance in patients with coronary artery disease: Does it improve long-term physical fitness? European journal of preventive cardiology. 2020;27(4):367-77 |
Participants already received CR phase II; randomisation to CR level III
|
|
Zheng X, Zheng Y, Ma J, Zhang M, Zhang Y, Liu X, et al. Effect of exercise-based cardiac rehabilitation on anxiety and depression in patients with myocardial infarction: A systematic review and meta-analysis. Heart and Lung. 2019;48(1):1-7. |
SR of trials with a follow-up of less than 1 year. |
|
Hegewald J, Ewegewitz U, Euler U, Van Dijk JL, Adams J, Fishta A, et al. Interventions to support return to work for people with coronary heart disease. Cochrane Database of Systematic Reviews. 2019;2019(3). |
Cochrane review with focus on work-related interventions. Possible trials were all included in review by Dibben, 2021. |
|
Rauch B, Davos CH, Doherty P, Saure D, Metzendorf M-I, Salzwedel A, et al. The prognostic effect of cardiac rehabilitation in the era of acute revascularisation and statin therapy: A systematic review and meta-analysis of randomized and non-randomized studies - The Cardiac Rehabilitation Outcome Study (CROS). European journal of preventive cardiology. 2016;23(18):1914-39. |
SR with similar inclusion criteria to Dibben. |
|
Devi R, Singh SJ, Powell J, Fulton EA, Igbinedion E, Rees K. Internet-based interventions for the secondary prevention of coronary heart disease. The Cochrane database of systematic reviews. 2015(12):CD009386. |
Internet-based interventions of CR |
|
Nery RM, Zanini M, Ferrari JN, Silva CA, Farias LF, Comel JC, et al. Tai Chi Chuan for cardiac rehabilitation in patients with coronary arterial disease. Arquivos brasileiros de cardiologia. 2014;102(6):588-92. |
Control group was any other form of exercise. |
|
Madssen E, Arbo I, Granoien I, Walderhaug L, Moholdt T. Peak oxygen uptake after cardiac rehabilitation: a randomized controlled trial of a 12-month maintenance program versus usual care. PloS one. 2014;9(9):e107924 |
Already included in Cochrane review bij Dibben |
|
West RR, Jones DA, Henderson AH. Rehabilitation after myocardial infarction trial (RAMIT): Multi-centre randomised controlled trial of comprehensive cardiac rehabilitation in patients following acute myocardial infarction. Heart. 2012;98(8):637-44. |
RCT included in SR by Dibben |
|
Wang W, Chair SY, Thompson DR, Twinn SF. Effects of home-based rehabilitation on health-related quality of life and psychological status in Chinese patients recovering from acute myocardial infarction. Heart and Lung: Journal of Acute and Critical Care. 2012;41(1):15-25 |
Follow-up too short (6 mnths) |
|
Reid RD, Morrin LI, Beaton LJ, Papadakis S, Kocourek J, McDonnell L, et al. Randomized trial of an internet-based computer-tailored expert system for physical activity in patients with heart disease. European Journal of Preventive Cardiology. 2012;19(6):1357-64. |
RCT included in SR by Dibben |
|
Houle J, Doyon O, Vadeboncoeur N, Turbide G, Diaz A, Poirier P. Effectiveness of a pedometer-based program using a socio-cognitive intervention on physical activity and quality of life in a setting of cardiac rehabilitation. The Canadian journal of cardiology. 2012;28(1):27-32. |
RCT included in SR by Dibben |
|
Eshah NF, Bond AE. Cardiac rehabilitation programme for coronary heart disease patients: an integrative literature review. International journal of nursing practice. 2009;15(3):131-9. |
Narrative description of results |
|
Clark AM, McAlister FA, Hartling L, Vandermeer B. Randomized Trials of Secondary Prevention Programs in Coronary Artery Disease: A Systematic Review [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2005 Dec 5. PMID: 25879129. |
Not recent search strategy; more recent SR included |
|
Claesson M, Birgander LS, Lindahl B, Nasic S, Åström M, Asplund K, et al. Women's hearts - Stress management for women with ischemic heart disease: Explanatory analyses of a randomized controlled trial. Journal of Cardiopulmonary Rehabilitation. 2005;25(2):93-102. |
RCT of stressmanagement long after event |
|
Mayou RA, Thompson DR, Clements A, Davies CH, Goodwin SJ, Normington K, et al. Guideline-based early rehabilitation after myocardial infarction: A pragmatic randomised controlled trial. Journal of Psychosomatic Research. 2002;52(2):89-95. |
Follow-up too short (3 mnth) |
Funnel plots
Outcome hospitalizations
Outcome MACE
Outcome all-cause mortality
PICO 2 - AF
Evidence tables for PICO2
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison/control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Risom, 2020 |
Type of study: RCT
Setting and country: university hospital, Denmark
Funding and conflicts of interest: Non-commercial |
Inclusion criteria: Patients treated with ablation for AF, ³18 years of age and Danish speaking.
Exclusion criteria: Patients unable to understand trial instructions, pregnant or breastfeeding, reduced ability to follow the planned program due to other physical illness, engaged in intense physical exercise or sports at a competitive level, patients who did not wish to participate, or were enrolled in a clinical trial that prohibited participation in addi- tional trials.
N total at baseline: Intervention: 105 Control: 105
Important prognostic factors2: Age ± SD: I: 60 (±9) C: 59 (±12.25)
Sex: I: 70% M C: 73% M
Percentage smokers (current): I:2% C:3%
Groups comparable at baseline? yes
|
Physical exercise and psychoeducational consultations. Physical exercise: A 12-week physical exercise program aimed at increasing exercise capacity. Psychoeducational consultations provided emotional support and aimed to improve coping skills and illness appraisal to enable the patients to respond appropriately to physical and psychological symptoms. |
No cardiac rehabilitation |
Length of follow-up: 24 months
Loss-to-follow-up: I:15% C:11%
Reason: unclear
Incomplete outcome data: I:25.7% C:22.9%
|
Outcome measures and effect size (include 95%CI):
Hospitalization (crucial): no effect measure reported
Percentage hospitalization I: n=71 (68%) C: n=60 (57%)
Admissions: total number (mean): I:327 (4.6) p-value=0.51
Quality of life (crucial): after 24 months of follow-up (no effect measure reported, no SD/SE/CI)
Bodily pain I: 85.69 C: 85.84 The p-value between-group change= 0.12
General health perception I: 62.64 C: 66.9 The p-value between-group change= 0.63
Mental health index I: 78.82 C: 81.41 The p-value between-group change= 0.28
Physical functioning index I: 86.61 C: 86.95 The p-value between-group change= 0.95
Role emotional index I: 80.17 C: 78.73 The p-value between-group change= 0.43
Role physical index I: 74.22 C: 75.61 The p-value between-group change= 0.43
Social functioning index I: 88.89 C: 89.13 The p-value between-group change= 0.81
Vitality index I: 66.37 C: 66.36 The p-value between-group change= 0.85
Psychosocial recovery (important): no effect measure reported
HADS-A (after 24 months) I: 3.90 points HADS-D (after 24 months) I:2.57 |
Authors conclusion: cardiac rehabilitation program for patients treated for atrial fibrillation with catheter ablation found sustained improvements with respect to anxiety compared to usual care but showed no difference on hospital admission.
Comment: only one author received received grants, personal fees, and other support from Medtronic and grants from Gilead, outside the submitted work. The other authors have nothing to disclose. |
| De With, 2019 |
Type of study: open-label RCT
Setting and country: multicenter, UK and the Netherlands
Funding: the Netherlands Heart Foundation and unrestricted grants from AstraZeneca, Bayer, Biotronik, Boehringer-Ingelheim, Boston Scientific, Medtronic, Sanofi- Aventis, and St Jude Medical paid to the Netherlands Heart Institute. Conflicts of interest: M.A. reports personal fees from Bayer, Boehringer-Ingelheim, Daiichi-Sankyo, Bristol-Myers-Squibb, Pfizer, and Sanofi. R.G.T. reports grants and personal fees from Bayer, Bristol-Myers-Squibb, Pfizer, and Daiichi-Sankyo. All other authors have no competing interests. |
Inclusion criteria: patients were enrolled if they had early symptomatic persistent AF [total AF history < 5 years, total persistent AF duration > 7 days but <6 months, <_1 electrical cardioversion (ECV)], and early (total history < 1 year) HF with a preserved ejection fraction (HFpEF) or HF with a reduced ejection fraction (HFrEF).
Exclusion criteria: Exclusion criteria included LVEF <25%, NYHA IV, left atrial size >50 mm, MRA use, and AF associated with surgery or acute illness.
N total at baseline: Intervention: 114 Control: 116
Important prognostic factors2: Age ± SD: I: 64 (±9) C: 65 (±8)
Sex: I: 78% M C: 78% M
Percentage smokers: Not reported
Groups comparable at baseline? yes |
Counseling on drug adherence, sodium restriction, dietary restriction, alcohol use, caffeine use, fluid restriction, and physyical activity | No cardiac rehabilitation |
Length of follow-up: 12 months
Loss-to-follow-up: unclear
Incomplete outcome data: unclear |
Outcome measures and effect size (include 95%CI):
Quality of life (crucial): Bodily pain I: 85±21 C: 81±22 The p-value between-group change= 0.830
General health perception I: 68±19 C: 59±21 The p-value between-group change= <0.001
Mental health index I: 83±14 C: 80±15 The p-value between-group change= 0.405
Physical functioning index I: 79±21 C: 75±23 The p-value between-group change= 0.007
Role emotional index I: 86±30 C: 84±34 The p-value between-group change= 0.414
Role physical index I: 75±37 C: 68±41 The p-value between-group change= 0.018
Social functioning index I: 86±19 C: 86±17 The p-value between-group change= 0.277
Vitality index I: 66±20 C: 66±19 The p-value between-group change= 0.361 |
Conclusion: targeted therapy including cardiac rehabilitation improved quality of life more compared with conventional therapy. Comments: possible chance of bias due to industry funding. |
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Risom, 2020 |
Probably yes
Reason: it was conducted according to a computer- generated allocation sequence with a varying block size kept unknown to the investigators. |
Probably yes
Reason: computer generated, neither the investigators nor the patients or relatives can influence the group to which the patients are allocated. |
Probably no
Reason: the intervention group is not blinded nor the investigators. Outcome assessors and data analysts were blinded. |
Probably yes
Reason: no information was provided for incomplete data. |
Probably yes
Reason: Methods description of results were stated in the results section. |
Probably yes
Reason: no other issues. |
Low risk of bias (hospitalization) Low risk of bias (quality of life) Low risk of bias (psychosocial recovery)
|
|
De With, 2019 |
Probably no
Reason: unclear, not reported. |
Probably no
Reason: unclear, not reported. |
Definitely no
Reason: open-label trial. |
Probably yes
Reason: no information was provided for incomplete data. |
Probably yes
Reason: Methods description of results were stated in the results section. |
Probably no
Reason: possible chance of bias due to industry funding. |
High risk of bias (quality of life)
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Palm P, Qvist I, Rasmussen TB, Christensen SW, Håkonsen SJ, Risom SS. Educational interventions to improve outcomes in patients with atrial fibrillation—a systematic review. International Journal of Clinical Practice. 2020;74(11). |
SR, majority of included studies had a follow-up < 13 months. Potential included studies was an SR without a clear search strategy. |
|
Nguyen BO, Wijtvliet EPJP, Hobbelt AH, De Vries SIM, Smit MD, Tieleman RG, et al. Effects of a simple cardiac rehabilitation program on improvement of self-reported physical activity in atrial fibrillation - Data from the RACE 3 study. International journal of cardiology Heart & vasculature. 2020;31:100673. |
RACE3 trial, no other relevant outcomes were reported. Publication of RACE3 trial (De With, 2019) included. |
|
Risom SS, Lind J, Dickson VV, Berg SK. Exploring the Mechanism of Effectiveness of a Psychoeducational Intervention in a Rehabilitation Program (CopenHeartRFA) for Patients Treated With Ablation for Atrial Fibrillation: A Mixed Methods Study. The Journal of cardiovascular nursing. 2019;34(4):336-43. |
More recent publication of CopenHeartRFA trial already included. |
|
Risom SS, Zwisler AD, Rasmussen TB, Sibilitz KL, Madsen TLS, Svendsen JH, et al. Cardiac rehabilitation versus usual care for patients treated with catheter ablation for atrial fibrillation: Results of the randomized CopenHeartRFA trial. American Heart Journal. 2016;181:120-9. |
More recent publication of CopenHeartRFA trial already included. |
PICO 3 - HF
Evidence tables for PICO3
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Long, 2019
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature searched up to January 2018
44 trials were included.
See Long, 2019 for details.
Study design: RCT
Setting and Country: See Long, 2019 (61% were undertaken in Europe).
Source of funding and conflicts of interest: Out of 26 trials who reported data on funding, only two received funding from the pharmaceutical industry. |
Inclusion criteria SR:
Exclusion criteria SR:
44 studies included
Important patient characteristics at baseline: See Long, 2019 for details.
|
Exercise-based interventions given alone or as a component of comprehensive CR (defined as programmes with components such as health education and psychological interventions, in addition to exercise interventions). |
May have received active intervention (i.e. education, psychological intervention) or usual medical care alone. |
End-point of follow-up: See Long, 2019 for details. Results were pooled at three follow-up timings: short-term (6 to 12 months); and long-term (> 12 months).
For how many participants were no complete outcome data available? See Long, 2019 for details.
|
Outcome measure-1 Defined as quality of life (crucial)
Short-term (6-12 months) I: 985 C: 1010 Pooled effect (random effects model): MD -7.10 [95% CI -10.34 to -3.86] favoring exercise-based CR Heterogeneity (I2): 82%
Long-term (> 12 months) Data too inconsistent to pool
Outcome measure-2 Defined as hospital admissions (crucial)
Short-term (6-12 months) I: 180/1093 C: 258/1089 Pooled effect (random effects model): RR 0.73 [95% CI 0.58 to 0.91] favoring exercise-based CR Heterogeneity (I2): 18%
Long-term (> 12 months) I: 819/1433 C: 858/1443 Pooled effect (random effects model): RR 0.86 [95% CI 0.52 to 1.42] favoring Exercise-based CR. Heterogeneity (I2): 75%
Outcome measure-3 Defined as MACE / cardiovascular disease.
Long-term (> 12 months) I: 382/1272 C: 475/1280 Pooled effect (random effects model): RR 0.53 [95% CI 0.29 to 0.96] favoring Exercise-based CR. Heterogeneity (I2): 90%
Outcome measure-4 Defined as all-cause mortality.
Long-term (>12 months) I: 244/1418 C: 280/1427 Pooled effect (random effects model): RR 0.77 [95% CI 0.58 to 1.02] favoring exercise-based CR. Heterogeneity (I2): 34%
Outcome measure-5 Defined as psychosocial recovery. Not reported. |
Risk of bias (high, some concerns or low): Cochrane Risk of Bias tool See Long, 2019 for details.
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Palmer K, Bowles KA, Paton M, Jepson M, Lane R. Chronic Heart Failure and Exercise Rehabilitation: A Systematic Review and Meta-Analysis. Arch Phys Med Rehabil. 2018 Dec;99(12):2570-2582. |
More recent review available. |
|
Ismail H, McFarlane JR, Nojoumian AH, Dieberg G, Smart NA. Clinical outcomes and cardiovascular responses to different exercise training intensities in patients with heart failure: a systematic review and meta-analysis. JACC Heart Fail. 2013 Dec;1(6):514-22. |
More recent review available. |
|
Dieberg G, Ismail H, Giallauria F, Smart NA. Clinical outcomes and cardiovascular responses to exercise training in heart failure patients with preserved ejection fraction: a systematic review and meta-analysis. J Appl Physiol (1985). 2015 Sep 15;119(6):726-33. |
No studies included with follow-up of 12 months or more & More recent review available. |
|
Neto MG, Martinez BP, Conceição CS, Silva PE, Carvalho VO. Combined Exercise and Inspiratory Muscle Training in Patients With Heart Failure: A SYSTEMATIC REVIEW AND META-ANALYSIS. J Cardiopulm Rehabil Prev. 2016 Nov/Dec;36(6):395-401. |
No studies included with follow-up of 12 months or more & More recent review available. |
|
van der Meer S, Zwerink M, van Brussel M, van der Valk P, Wajon E, van der Palen J. Effect of outpatient exercise training programmes in patients with chronic heart failure: a systematic review. Eur J Prev Cardiol. 2012 Aug;19(4):795-803. |
More recent review available. |
|
Jewiss D, Ostman C, Smart NA. The effect of resistance training on clinical outcomes in heart failure: A systematic review and meta-analysis. Int J Cardiol. 2016 Oct 15;221:674-81. |
No studies included with follow-up of 12 months or more. |
|
Cavalheiro AH, Silva Cardoso J, Rocha A, Moreira E, Azevedo LF. Effectiveness of Tele-rehabilitation Programs in Heart Failure: A Systematic Review and Meta-analysis. Health Serv Insights. 2021 Jun 15;14:11786329211021668. |
Focus on telerehabilitation; no studies similar elements as the PICO (incorrect control groups, incorrect outcomes, too short follow-up). |
|
Wang Z, Peng X, Li K, Wu CJ. Effects of combined aerobic and resistance training in patients with heart failure: A meta-analysis of randomized, controlled trials. Nurs Health Sci. 2019 Jun;21(2):148-156. |
No studies included with follow-up of 12 months or more & no search strategy published. |
|
Dallas K, Dinas PC, Chryssanthopoulos C, Dallas G, Maridaki M, Koutsilieris M, Philippou A. The effects of exercise on VO2peak, quality of life and hospitalization in heart failure patients: A systematic review with meta-analyses. Eur J Sport Sci. 2021 Sep;21(9):1337-1350. |
No data on follow-up period. |
|
Amirova A, Fteropoulli T, Williams P, Haddad M. Efficacy of interventions to increase physical activity for people with heart failure: a meta-analysis. Open Heart. 2021 Jun;8(1):e001687. |
Too strict inclusion criteria (studies need to have at least physical activity outcome), relevant individual studies missing. |
|
Chan E, Giallauria F, Vigorito C, Smart NA. Exercise training in heart failure patients with preserved ejection fraction: a systematic review and meta-analysis. Monaldi Arch Chest Dis. 2016 Oct 14;86(1-2):759. |
No studies included with follow-up of 12 months or more & More recent review available. |
|
Lewinter C, Doherty P, Gale CP, Crouch S, Stirk L, Lewin RJ, LeWinter MM, Ades PA, Køber L, Bland JM. Exercise-based cardiac rehabilitation in patients with heart failure: a meta-analysis of randomised controlled trials between 1999 and 2013. Eur J Prev Cardiol. 2015 Dec;22(12):1504-12. |
More recent review available. |
|
Bjarnason-Wehrens B, Nebel R, Jensen K, Hackbusch M, Grilli M, Gielen S, Schwaab B, Rauch B; German Society of Cardiovascular Prevention and Rehabilitation (DGPR). Exercise-based cardiac rehabilitation in patients with reduced left ventricular ejection fraction: The Cardiac Rehabilitation Outcome Study in Heart Failure (CROS-HF): A systematic review and meta-analysis. Eur J Prev Cardiol. 2020 Jun;27(9):929-952. |
Focus on a specific subgroup of the patient population |
|
Taylor RS, Walker S, Smart NA, Piepoli MF, Warren FC, Ciani O, Whellan D, O'Connor C, Keteyian SJ, Coats A, Davos CH, Dalal HM, Dracup K, Evangelista LS, Jolly K, Myers J, Nilsson BB, Passino C, Witham MD, Yeh GY; ExTraMATCH II Collaboration. Impact of Exercise Rehabilitation on Exercise Capacity and Quality-of-Life in Heart Failure: Individual Participant Meta-Analysis. J Am Coll Cardiol. 2019 Apr 2;73(12):1430-1443. |
Same review as Long (2019), but less detailed.
|
|
Taylor RS, Walker S, Smart NA, Piepoli MF, Warren FC, Ciani O, O'Connor C, Whellan D, Keteyian SJ, Coats A, Davos CH, Dalal HM, Dracup K, Evangelista L, Jolly K, Myers J, McKelvie RS, Nilsson BB, Passino C, Witham MD, Yeh GY, Zwisler AO; ExTraMATCH II Collaboration. Impact of exercise-based cardiac rehabilitation in patients with heart failure (ExTraMATCH II) on mortality and hospitalisation: an individual patient data meta-analysis of randomised trials. Eur J Heart Fail. 2018 Dec;20(12):1735-1743. |
Follow-up time too short & Majority of trials from Long (2019) were included.
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 02-10-2024
Beoordeeld op geldigheid : 17-09-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met hart- en vaatziekten.
Werkgroep
- Prof. dr. A.W.J. (Arnoud) van ‘t Hof, cardioloog, werkzaam in het Maastricht Universitair Medisch Centrum te Maastricht en Zuyderland MC te Heerlen [NVVC] (voorzitter)
- Dr. T. (Tom) Vromen, cardioloog, werkzaam in het Máxima Medisch Centrum te Eindhoven [NVVC]
- Dr. M. (Madoka) Sunamura, cardioloog, werkzaam in het Franciscus Gasthuis & Vlietland en Stichting Capri Hartrevalidatie te Rotterdam [NVVC]
- Dr. V.M. (Victor) Niemeijer, sportarts, werkzaam in het Elkerliek ziekenhuis te Helmond [VSG]
- Dr. J.A. (Aernout) Snoek, sportarts, werkzaam in het Isalaziekenhuis te Zwolle [VSG]
- D.A.A.J.H. (Dafrann) Fonteijn, revalidatiearts, werkzaam in het Reade centrum voor revalidatie en reumatologie te Amsterdam [VRA]
- Dr. H.J. (Erik) Hulzebos, klinisch inspanningsfysioloog-fysiotherapeut, werkzaam in het Universitair Medisch Centrum Utrecht te Utrecht [KNGF]
- E.A. (Eline) de Jong, Gezondheidszorgpsycholoog, werkzaam in het VieCuri Medisch Centrum te Venlo en Venray [LVMP] (vanaf mei 2023)
- Dr. N. (Nina) Kupper, associate professor, werkzaam in de Tilburg Universiteit te Tilburg [LVMP] (vanaf juli 2022)
- S.C.J. (Simone) Traa, klinisch psycholoog, werkzaam in het VieCuri Medisch Centrum te Venlo [LVMP] (tot mei 2023)
- Dr. V.R. (Veronica) Janssen, GZ-psycholoog in opleiding tot klinisch psycholoog, werkzaam in het Leids Universitair medisch centrum te Leiden [LVMP] (tot maart 2022)
- I.G.J. (Ilse) Verstraaten MSc., beleidsadviseur, werkzaam bij Harteraad te Den Haag [Harteraad] (vanaf december 2021)
- H. (Henk) Olk, ervaringsdeskundige [Harteraad] (vanaf juni 2022)
- A. (Anja) de Bruin, beleidsadviseur, werkzaam bij Harteraad te Den Haag [Harteraad] (tot november 2021)
- Y. (Yolanda) van der Waart, ervaringsdeskundige [Harteraad] (tot maart 2022)
- K. (Karin) Verhoeven-Dobbelsteen, gedifferentieerde hart en vaat verpleegkundige werkzaam als hartrevalidatie verpleegkundige, werkzaam in het Bernhoven Ziekenhuis te Uden [NVHVV] (vanaf juni 2022)
- R. (Regie) Loeffen, gedifferentieerde hart en vaat verpleegkundige werkzaam als hartrevalidatie verpleegkundige, werkzaam in het Canisius Wilhelmina Ziekenhuis te Nijmegen [NVHVV] (vanaf juni 2022)
- M.J. (Mike) Kuyper, MSc, verpleegkundig specialist, werkzaam in de Ziekenhuisgroep Twente te Almelo [NVHVV] (tot juni 2022)
- K.J.M. (Karin) Szabo-te Fruchte, gedifferentieerde hart en vaat verpleegkundige werkzaam als hartrevalidatie verpleegkundige, werkzaam in het Medisch Spectrum Twente te Enschede [NVHVV] (tot juni 2022)
Meelezers:
- Drs. I.E. (Inge) van Zee, revalidatiearts, werkzaam in Revant te Goes [VRA]
- T. (Tim) Boll, GZ-psycholoog, werkzaam in het St Antonius Ziekenhuis te Nieuwegein [LVMP]
- K. (Karin) Keppel-den Hoedt, medisch maatschappelijk werker, werkzaam in de Noordwest Ziekenhuisgroep te Den Helder [BPSW] (vanaf mei 2023)
- C. (Corrina) van Wijk, medisch maatschappelijk werker, werkzaam in het rode Kruis Ziekenhuis te Beverwijk [BPSW] (tot mei 2023)
- D. Daniëlle Conijn, beleidsmedewerker en richtlijnadviseur Koninklijk Nederlands Genootschap Fysiotherapie [KNGF]
Meelezers bij de module Werkhervatting, vanuit de richtlijnwerkgroep Generieke module Arbeidsparticipatie:
- Jeannette van Zee (senior adviseur patiëntbelang, PFNL)
- Michiel Reneman (hoogleraar arbeidsrevalidatie UMCG)
- Theo Senden (klinisch arbeidsgeneeskundige)
- Asahi Oehlers (bedrijfsarts, namens NVAB)
- Frederieke Schaafsma (bedrijfsarts en hoogleraar AmsterdamUMC)
- Anil Tuladhar (neuroloog)
- Ingrid Fakkert (arts in opleiding tot verzekeringsarts)
Met ondersteuning van
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. J.M.H. (Harm-Jan) van der Hart, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Mogelijke restrictie |
|
Van 't Hof (voorzitter) |
Hoogleraar Interventie Cardiologie Universiteit Maastricht |
|
|
Geen |
|
Fonteijn |
Revalidatiearts |
Geen |
Geen |
Geen |
|
Hulzebos |
Klinisch Inspanningsfysioloog - (sport)Fysiotherapeut |
|
Geen |
Geen |
|
Jong |
GZ-psycholoog, betaald, (poli-)klinische behandelcontacten binnen het ziekenhuis. |
Geen |
Geen |
Geen |
|
Kupper |
Associate professor bij Tilburg University (betaald) |
Associate editor bij Psychosomatic Medicine (betaald) |
Geen |
Geen |
|
Loeffen |
Hartrevalidatieverpleegkundige |
werkgroep hartrevalidatie NVHVV |
Geen |
Geen |
|
Niemeijer |
Sportarts Elkerliek Ziekenhuis Helmond |
Dopingcontrole official Dopingautoriteit 4u/mnd betaald (tot eind 2023) |
Geen |
Geen |
|
Olker |
Patiëntenvertegenwoordiger |
Geen |
Geen |
Geen |
|
Snoek |
Sportarts |
|
Geen |
Geen |
|
Sunamura |
Cardioloog |
Cardioloog, verbonden aan Stichting Capri Hartrevalidatie |
Geen |
Geen |
|
Verhoeven |
Hartrevalidatieverpleegkundige |
NVHVV voorzitter werkgroep Hartrevalidatie |
Geen |
Geen |
|
Verstraaten |
Beleidsadviseur Harteraad |
Geen |
Geen |
Geen |
|
Vromen |
Cardioloog |
Commissie Preventie en Hartrevalidatie NVVC (Onbetaald) Interdisciplinair Netwerk Hartrevalidatie (INH) (onbetaald) + Werkgroeplid KNGF Richtlijn hartrevalidatie 2024. |
Werkzaamheden voor PROFIT-trial, onderzoek naar het effect van hartrevalidatie/leefstijl bij stabiele angina pectoris. Onderzoek (maar niet mijn eigen bijdrage) gefinancierd door ZonMW |
Geen |
|
Werkgroepleden die niet langer meer participeren |
||||
|
De Bruin |
Beleidsadviseur |
Geen |
Geen |
Geen |
|
Janssen |
LUMC: GZ-psycholoog (0,4 fte) |
Docent NPi: cursus Hartrevalidatie |
CVON2016-12 (gaat over eHealth voor hartrevalidatie, sponsor: ZonMw en de Hartstichting) gepubliceerd Betrokken bij de ontwikkeling van een leidraad voor een online PEP-module Hartrevalidatie.
|
Geen |
|
Kuyper |
Verpleegkundig specialist cardiologie, Ziekenhuisgroep Twente (betaald, vast in loondienst) |
Werkgroeplid NVHVV (onbetaald) |
Geen |
Geen |
|
Szabo-te Fruchte |
Verpleegkundig coördinator hartrevalidatie |
Nederlandse Vereniging voor Hart- en Vaatverpleegkundigen (NVHVV) werkgroeplid hartrevalidatie |
Geen |
Geen |
|
Traa |
Klinisch psycholoog - psychotherapeut bi VieCuri Medisch Centrum, afdeling Medische Psychologie |
1 x per jaar docent RINO Zuid - GZ- & KP-opleiding |
Geen |
Geen |
Inbreng patiëntenperspectief
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigde patiëntenvereniging en patiëntvertegenwoordiger in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Diagnosegroepen |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel van de zorgaanbieders en zorgverleners al aan de norm voldoet en het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met hart- en vaatziekten. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule (NVVC, 2011) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 en R Studio werden gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Voor de volgende modules is gebruik gemaakt van ChatGPT voor het schrijven van de overwegingen:
- Module Diagnosegroepen;
- Module Screening van fysieke capaciteit en activiteit.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
Richtlijn: NVvC hartrevalidatie |
|
|
Zoekvraag: Wat zijn de (on)gunstige effecten van hartrevalidatie vergeleken met geen hartrevalidatie bij bepaalde patiëntengroepen?
|
|
|
Database(s): Ovid/Medline, Embase |
Datum: 20-10-2021, 20-4-2022 |
|
Periode: 2000- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: 20-4-2022 Naar aanleiding van de zoekstrategie AP wenst de werkgroep een aanvullende strategie uit te voeren naar coronair lijden. In afstemming met de werkgroep wordt voor coronair lijden gekozen voor de volgende trefwoorden in Embase: 'acute coronary syndrome'/exp/mj OR 'angina pectoris'/exp/mj OR 'coronary artery atherosclerosis'/de/mj OR 'coronary artery obstruction'/d/mj OR 'coronary artery thrombosis'/de/mj OR 'heart infarction'/exp/mj OR 'heart muscle ischemia'/de/mj OR 'silent myocardial ischemia'/de/mj OR 'coronary artery calcification'/de/mj OR 'coronary artery constriction'/exp/mj OR 'coronary artery dissection'/de/mj OR 'coronary artery occlusion'/exp /mjOR 'coronary bifurcation lesion'/de/mj
In overleg met de adviseur en de werkgroep is besloten om alleen met major terms te zoeken, wetende dat mogelijk relevante papers kunnen worden gemist. Er is gekozen om alleen de SRs en RCTs aan te bieden. De resultaten zijn ontdubbeld t.o.v. van de onderstaande zoekstrategieën.
20-10-2021 Voor deze vraag zijn drie verschillende strategieën uitgewerkt.
Angina pectoris AND heart rehabilitation Atrial fibrillation AND heart rehabilitation Heart failure AND heart rehabilitation
In afstemming met de adviseur is niet gezocht op non-pharmacological secondary prevention. (Dit is geen trefwoord; secondary prevention wel, maar dat geeft te veel ruis).
Alleen het artikel van Eijsvogels wordt gevonden in de strategie angina pectoris.(afgestemd met adviseur)
Vanwege de beperkte overlap zijn de strategieën van angina pectoris en atrial fibrillation niet ontdubbeld ten opzichte van elkaar. Vanwege de overlap in de set heart failure is deze set wel ontdubbeld ten opzichte van angina pectoris en atrial fibrillation. Dat betekent dat degene die voor AP en AF de selectie doen, enigszins alert moeten zijn op artikelen die over heart failure gaan
|
|
Zoekopbrengst
|
Coronair lijden, alleen gezocht met major terms |
Embase |
OVID/MEDLINE |
Ontdubbel t.o.v onderstaande strategieën |
|
SRs |
179 |
191 |
152 |
|
RCTs |
373 |
491 |
465 |
|
Observationele studies |
|
|
|
|
Totaal |
|
|
|
|
Heart failure |
EMBASE |
OVID/MEDLINE |
Ontdubbeld ook t.o.v. AF en AP |
|
SRs |
209 |
125 |
224 |
|
RCTs |
423 |
274 |
515 |
|
Observationele studies |
339 |
206 |
385 |
|
Overig |
|
|
|
|
Totaal |
|
|
1124 |
|
Atrial fibrillation (AF) |
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
36 |
9 |
34 |
|
RCTs |
100 |
32 |
105 |
|
Observationele studies |
68 |
40 |
72 |
|
Overig |
|
|
|
|
Totaal |
|
|
211 |
|
Angina Pectoris (AP) |
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
88 |
37 |
84 |
|
RCTs |
174 |
65 |
193 |
|
Observationele studies |
191 |
91 |
179 |
|
Overig |
|
|
|
|
Totaal |
|
|
456 |
Zoekstrategie
Embase
20-4-2022
|
No. |
Query |
Results |
|
#70 |
#66 NOT #65 NOT #64 OBS |
1523 |
|
#69 |
#65 NOT #64 RCT |
373 |
|
#68 |
#67 NOT (#44 OR #33 OR #21) |
1483 |
|
#67 |
#64 OR #65 OR #66 |
2328 |
|
#66 |
#59 AND (#62 OR #63) |
2135 |
|
#65 |
#59 AND #61 |
630 |
|
#64 |
#59 AND #60 SR |
179 |
|
#63 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
13036247 |
|
#62 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#61 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1839814 |
|
#60 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
816081 |
|
#59 |
#58 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
3522 |
|
#58 |
#56 AND #57 |
7372 |
|
#57 |
'heart rehabilitation'/exp OR (((cardiac OR coronar* OR heart OR infarct OR myocard*) NEAR/3 rehabilitation):ti,ab,kw) |
18373 |
|
#56 |
'acute coronary syndrome'/exp OR 'angina pectoris'/exp OR 'coronary artery atherosclerosis'/de OR 'coronary artery obstruction'/de OR 'coronary artery thrombosis'/de OR 'heart infarction'/exp OR 'heart muscle ischemia'/de OR 'silent myocardial ischemia'/de OR 'coronary artery calcification'/de OR 'coronary artery constriction'/exp OR 'coronary artery dissection'/de OR 'coronary artery occlusion'/exp OR 'coronary bifurcation lesion'/de OR angina:ti,ab,kw OR (('coronary artery' NEAR/3 (atherosclero* OR obstruct* OR thrombo* OR constrict* OR calcific* OR dissect* OR occlusi*)):ti,ab,kw) OR 'coronary bifurcation lesion*':ti,ab,kw OR (((heart OR cardiac OR cardial OR myocard*) NEAR/3 (infarct* OR ischemi*)):ti,ab,kw) |
745452 |
20-10-2021
|
No. |
Query |
Results |
|
#56 |
#53 NOT #52 NOT #51 OBS heart failure |
339 |
|
#55 |
#52 NOT #51 RCT heart failure |
423 |
|
#54 |
#51 OR #52 OR #53 |
971 |
|
#53 |
#15 AND #50 |
630 |
|
#52 |
#14 AND #50 |
537 |
|
#51 |
#13 AND #50 SR heart failure |
209 |
|
#50 |
#38 NOT #33 NOT #21 |
2031 |
|
#49 |
#8 AND #46 |
22051 |
|
#48 |
#4 NOT #47 |
1 |
|
#47 |
#4 AND #46 |
2 |
|
#46 |
#21 OR #33 OR #44 |
1609 |
|
#45 |
#4 AND #44 |
1 |
|
#44 |
#39 OR #40 OR #41 |
1409 |
|
#43 |
#41 NOT #40 NOT #39 |
449 |
|
#42 |
#40 NOT #39 |
520 |
|
#41 |
#15 AND #38 |
802 |
|
#40 |
#14 AND #38 |
665 |
|
#39 |
#13 AND #38 |
272 |
|
#38 |
#37 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
2509 |
|
#37 |
#35 AND #36 |
4117 |
|
#36 |
'heart rehabilitation'/exp OR (((cardiac OR coronar* OR heart OR infarct OR myocard*) NEAR/3 rehabilitation):ti,ab,kw) |
17456 |
|
#35 |
'heart failure'/exp OR 'decompensatio cordis':ti,ab,kw OR 'insufficientia cardis':ti,ab,kw OR (((heart OR cardiac OR cardial OR myocardial) NEAR/3 (failure OR decompensation OR incompetence OR insufficien* OR 'stand still' OR decompensation)):ti,ab,kw) |
639412 |
|
#34 |
#4 AND #33 |
0 |
|
#33 |
#28 OR #29 OR #30 |
204 |
|
#32 |
#30 NOT #29 NOT #28 OBS AF |
68 |
|
#31 |
#29 NOT #28 RCT AF |
100 |
|
#30 |
#15 AND #27 |
253 |
|
#29 |
#14 AND #27 |
221 |
|
#28 |
#13 AND #27 SR AF |
36 |
|
#27 |
#26 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
617 |
|
#26 |
#24 AND #25 |
614 |
|
#25 |
'heart rehabilitation'/exp OR (((cardiac OR coronar* OR heart OR infarct OR myocard*) NEAR/3 rehabilitation):ti,ab,kw) |
17456 |
|
#24 |
'atrial fibrillation'/exp OR (((atrial OR atrium OR auricular) NEAR/3 fibril*):ti,ab,kw) |
193674 |
|
#23 |
#4 NOT #22 |
2 |
|
#22 |
#4 AND #21 |
1 |
|
#21 |
#16 OR #17 OR #18 |
453 |
|
#20 |
#18 NOT #17 NOT #16 OBS AP |
191 |
|
#19 |
#17 NOT #16 RCT AP |
174 |
|
#18 |
#12 AND #15 |
312 |
|
#17 |
#12 AND #14 |
236 |
|
#16 |
#12 AND #13 SR AP |
88 |
|
#15 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6741093 |
|
#14 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3302394 |
|
#13 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#12 |
#11 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
667 |
|
#11 |
#9 AND #10 |
1209 |
|
#10 |
'heart rehabilitation'/exp OR (((cardiac OR coronar* OR heart OR infarct OR myocard*) NEAR/3 rehabilitation):ti,ab,kw) |
17456 |
|
#9 |
'angina pectoris'/exp OR 'angina':ti,ab,kw OR 'anginal attack':ti,ab,kw OR 'stenocardia':ti,ab,kw |
127396 |
|
#8 |
#5 OR #6 OR #7 |
4 |
|
#7 |
. AND 'exercise based' AND cardiac AND rehabilitation AND for AND adults AND with AND atrial AND fibrillation AND 2017 |
1 |
|
#6 |
long AND term AND effect AND of AND goal AND directed AND weight AND management AND in AND an AND atrial AND fibrillation AND cohort. AND pathak NOT gehi NOT gallagher |
1 |
|
#5 |
aggressive AND risk AND factor AND reduction AND study AND atrial AND fibrillation AND implications AND for AND the AND outcome AND of AND ablation |
2 |
|
#4 |
#1 OR #2 OR #3 |
3 |
|
#3 |
association AND of AND cardiac AND rehabilitation AND 'all cause' AND mortality AND among AND patients AND with AND cardiovascular AND disease AND in AND the AND netherlands AND eijsvogels |
1 |
|
#2 |
cardiac AND rehabilitation AND survival AND in AND a AND large AND representative AND community AND cohort AND of AND dutch AND patients |
1 |
|
#1 |
effectiveness AND nonpharmacological AND secondary AND prevention AND of AND coronary AND heart AND disease AND 'müller riemenschneider' |
1 |
Ovid/Medline
20-4-2022
|
# |
Searches |
Results |
|
14 |
12 not 11 not 10 OBS |
1041 |
|
13 |
11 not 10 RCT |
491 |
|
12 |
5 and (8 or 9) |
1544 |
|
11 |
5 and 7 |
631 |
|
10 |
5 and 6 SR |
191 |
|
9 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5133719 |
|
8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4123733 |
|
7 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1368093 |
|
6 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
559558 |
|
5 |
4 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
2501 |
|
4 |
limit 3 to yr="2000 -Current" |
2645 |
|
3 |
1 and 2 |
3808 |
|
2 |
Acute Coronary Syndrome/ or Angina Pectoris/ or Coronary Artery Disease/ or Coronary Occlusion/ or Coronary Stenosis/ or Coronary Thrombosis/ or exp Myocardial Infarction/ or Myocardial Ischemia/ or Coronary Aneurysm/ or angina.ti,ab,kf. or (coronary artery adj3 (atherosclero* or obstruct* or thrombo* or constrict* or calcific* or dissect* or occlusi*)).ti,ab,kf. or coronary bifurcation lesion*.ti,ab,kf. or ((heart or cardiac or cardial or myocard*) adj3 (infarct* or ischemi*)).ti,ab,kf. |
462494 |
|
1 |
Cardiac Rehabilitation/ or ((cardiac or coronar* or heart or infarct or myocard*) adj3 rehabilitation).ti,ab,kf. |
9993 |
21-1-2021
|
# |
Searches |
Results |
|
36 |
33 not 13 not 23 OBS heart failure |
206 |
|
35 |
32 not 12 not 22 RCT heart failure |
274 |
|
34 |
29 not 9 not 19 SR heart failure |
125 |
|
33 |
31 not 30 not 29 |
241 |
|
32 |
30 not 29 |
307 |
|
31 |
8 and 28 |
382 |
|
30 |
7 and 28 |
401 |
|
29 |
6 and 28 |
144 |
|
28 |
limit 27 to yr="2000 -Current" |
1165 |
|
27 |
26 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
1255 |
|
26 |
24 and 25 |
1317 |
|
25 |
Cardiac Rehabilitation/ or ((cardiac or coronar* or heart or infarct or myocard*) adj3 rehabilitation).ti,ab,kf. |
9575 |
|
24 |
exp heart failure/ or decompensatio cordis.ti,ab,kf. or insufficientia cardis.ti,ab,kf. or ((heart or cardiac or cardial or myocardial) adj3 (failure or decompensation or incompetence or insufficien* or stand still or decompensation)).ti,ab,kf. |
243332 |
|
23 |
21 not 20 not 19 OBS AF |
40 |
|
22 |
20 not 19 RCT AF |
32 |
|
21 |
8 and 18 |
55 |
|
20 |
7 and 18 |
37 |
|
19 |
6 and 18 SR AF |
9 |
|
18 |
limit 17 to yr="2000 -Current" |
113 |
|
17 |
16 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
122 |
|
16 |
14 and 15 |
124 |
|
15 |
Cardiac Rehabilitation/ or ((cardiac or coronar* or heart or infarct or myocard*) adj3 rehabilitation).ti,ab,kf. |
9575 |
|
14 |
exp Atrial Fibrillation/ or ((atrial or atrium or auricular) adj3 fibril*).ti,ab,kf. |
92662 |
|
13 |
11 not 10 not 9 OBS AP |
91 |
|
12 |
10 not 9 RCT AP |
65 |
|
11 |
5 and 8 |
123 |
|
10 |
5 and 7 |
97 |
|
9 |
5 and 6 SR AP |
37 |
|
8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
3966934 |
|
7 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2177371 |
|
6 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
524695 |
|
5 |
limit 4 to yr="2000 -Current" |
284 |
|
4 |
3 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
419 |
|
3 |
1 and 2 |
423 |
|
2 |
Cardiac Rehabilitation/ or ((cardiac or coronar* or heart or infarct or myocard*) adj3 rehabilitation).ti,ab,kf. |
9575 |
|
1 |
exp Angina Pectoris/ or angina.ti,ab,kf. or anginal attack.ti,ab,kf. or stenocardia.ti,ab,kf. |
72161 |
