Hypertensie bij chronische nierschade
Uitgangsvraag
Wat is de streefwaarde van de bloeddruk bij patiënten met chronische nierschade en hypertensie en hoe moeten deze patiënten worden behandeld?
Aanbeveling
Streefwaarde bloeddruk
- De werkgroep gaat uit van de in de spreekkamer gemeten bloeddruk.
- Behandel patiënten met chronische nierschade bij een bloeddruk > 130/80 mmHg met leefstijladvies en, afhankelijk van hun CNS risicoklasse en hun geschatte cardiovasculaire risico (waarbij CNS extra meetelt), met bloeddrukverlagende therapie. De streefwaarde is daarbij ≤ 130/80 mmHg.
- Individualiseren van de streefwaarden voor de bloeddruk wordt aanbevolen in samenspraak met de patiënt, met name op basis van leeftijd, aard van de nierziekte en comorbiditeit. Zo kan bijvoorbeeld voor patiënten met een levensverwachting < 10 jaar en voor patiënten met een laag cardiovasculair risico een minder strikt beleid en voor jonge patiënten met ernstig verhoogde albuminurie of een specifieke nierziekte juist een strikter beleid worden nagestreefd.
- Wees alert op houdingsafhankelijke duizeligheid en pas zo nodig het beleid aan.
De keuze van het bloeddrukverlagende middel
- Behandeling met een ACE-remmer of ARB wordt aanbevolen in geval van matig of ernstig verhoogde albuminurie (ACR≥ 3 mg/mmol).
- Bij het starten van een ACE-remmer of ARB bij patiënten met eGFR < 60 ml/min/1,73 m2 wordt na 1 - 2 weken controle van het serum kalium en de eGFR aanbevolen. Een daling van de eGFR van maximaal 20% wordt geaccepteerd.
- Voor de voorkeursmedicatie bij andere comorbide aandoeningen of condities wordt aanbevolen de multidisciplinaire richtlijn CVRM en NHG standaard Cardiovasculair risicomanagement te volgen.
Overwegingen
In tegenstelling tot de internationale richtlijnen adviseren de Nederlands multidisciplinaire richtlijn CVRM en NHG standaard CVRM tot op heden alleen systolische bloeddrukwaarden te hanteren om afwijkende waarden en streefniveaus aan te geven [NHG, 2011]. Reden hiervoor was de bevinding dat voor de indicatie cardiovasculair risicomanagement het zelden voorkomt dat een patiënt een normale systolische, maar afwijkende diastolische bloeddruk heeft. In de internationale richtlijnen worden wel diastolische bloeddrukwaarden gebruikt, omdat een normale systolische bloeddruk niet altijd gepaard gaat met een normale diastolische bloeddruk. Dit kan het geval zijn bij jongere patiënten met CNS (vaak op basis van primaire nierziekten) [KDIGO, 2013; ESH-ESC, 2013; NICE, 2015].
De bloeddrukwaarden die genoemd zijn als streefniveau, zijn bloeddrukwaarden zoals gemeten in de spreekkamer. In geval van twijfel of de zo gemeten bloeddruk representatief is, kan overwogen worden om 24 uurs bloeddrukmeting te laten verrichten, dan wel de patiënt te instrueren thuis de bloeddruk te meten. Men dient daarbij te beseffen dat voor een 24 uurs bloeddrukmeting, zowel als voor thuisbloeddrukmeting, lagere waarden worden aangenomen om hypertensie en streefniveau van bloeddrukregulatie te definiëren. Voor de exacte waarden en protocollaire wijze van bloeddrukmeting wordt verwezen naar de multidisciplinaire richtlijn CVRM en NHG standaard CVRM [NHG, 2011]. In de SPRINT studie is gebruik gemaakt van automatische bloeddrukmeting zonder aanwezigheid van een persoon. De richtlijnwerkgroep onderschrijft de resultaten van de SPRINT studie, maar merkt op dat bij spreekkamermeting van de bloeddruk, die in Nederland gebruikelijk is, een systolische bloeddruk streefwaarde < 120 mmHg te strikt kan zijn. Vanwege het hoge cardiovasculaire risico bij patiënten met CNS en de gunstige effecten van intensievere bloeddrukverlaging op dit risico, wordt aanbevolen om voor alle patiënten met CNS (gele, oranje en rode risicogroepen in de CNS stadiëringstabel) als streefwaarde voor de bloeddruk ≤ 130/80 mmHg te gebruiken. Individualisering van de streefwaarden voor de bloeddruk kan verstandig zijn op basis van leeftijd, aard van de nierziekte en comorbiditeit. Zo kan bijvoorbeeld voor patiënten ouder dan 80 jaar en voor patiënten met een laag cardiovasculair risico een minder strikt beleid en voor jonge patiënten met ernstig verhoogde albuminurie of een specifieke nierziekte juist een strikter beleid worden nagestreefd. Bij patiënten met erfelijke cystenieren wordt hierover laagdrempelig overleg geadviseerd tussen huisarts en nefroloog.
Er is uitgebreid bewijs uit de klinische praktijk dat veel patiënten de bloeddrukdoelen uit richtlijnen in werkelijkheid niet bereiken; de bereikte waarden hebben vaak een normale verdeling rond het bloeddrukdoel. Het nut van goede bloeddrukbehandeling is zo groot, dat geadviseerd wordt om te starten met behandeling als bij herhaling de streefwaarde wordt overschreden [Chobanian, 2003; ESH/ESC, 2013]. De discussie “The-lower-the-better vs. the J-shaped curve” is ook bij patiënten met CNS actueel. Belangrijk is zich te realiseren dat het concept “the lower the SBP and DBP achieved, the better the outcome” met name is gebaseerd op observationeel onderzoek onder miljoenen gezonde personen, die geen cardiovasculaire ziekte hadden aan het begin van de observatieperiode. Deze groep is dan ook niet representatief voor patiënten die deelnemen aan hypertensie RCT’s en zeker niet voor patiënten met CNS. Bovendien betekent een associatie niet automatisch een oorzakelijk verband. De J-shaped curve staat voor het concept dat het reduceren van SBP of DBP tot extreem lage waarden een kleiner voordeel heeft dan het reduceren tot minder lage waarden. Uit studies bij CNS komt naar voren dat het streven naar zeer lage bloeddrukwaarden vaker leidt tot nierfunctieverlies.
Bloeddrukstreefwaarden bij ouderen
Het meten en behandelen van hoge bloeddruk in de oudere patiëntencategorie wordt bemoeilijkt door het frequent voorkomen van atriumfibrilleren (bij 25% van de mensen > 70 jaar, CRIC studie) [Soliman, 2010], door het optreden van orthostase en door een toegenomen vaatwandstijfheid, resulterend in een hoge polsdruk. Bij ouderen voorspelt de systolische bloeddruk beter een toekomstige achteruitgang in nierfunctie dan diastolische bloeddruk, polsdruk of mean arterial pressure (SHEP studie [Young, 2002]). Het doel van bloeddrukbehandeling bij ouderen is anders dan bij niet-ouderen: er moet vooral gekeken worden naar cardiovasculaire uitkomsten en minder naar renale uitkomsten. Bij zeer oude patiënten moet de balans gezocht worden tussen het behandelen van hoge bloeddruk en het optreden van bijwerkingen als orthostase en andere factoren die de kwaliteit van leven beïnvloeden. Daarom wordt expliciet aangeraden de behandeling te individualiseren. In een Cochrane review werden 15 RCT’s beoordeeld, verricht bij patiënten > 60 jaar, waarbij actieve behandeling werd vergeleken met placebo [Musini, 2009]. Er was een reductie in totale mortaliteit (RR 0,90) en ook in gecombineerde cardiovasculaire mortaliteit en morbiditeit (RR 0,72). Bij patiënten ≥ 80 jaar was er geen reductie in mortaliteit, maar wel in gecombineerde cardiovasculaire mortaliteit en morbiditeit (RR 0,75). Deze gegevens worden bevestigd in observationeel onderzoek. Er zijn vier RCT’s waarin behandeling naar verschillende bloeddrukdoelen onderdeel uitmaakte van het ontwerp van de studie en waarin ook oudere patiënten waren betrokken. Hierin zijn alleen patiënten geïncludeerd met een eGFR > 30-40 ml/min/1,73m2. Deze studies lieten geen verschil in primaire uitkomsten zien tussen het lage en het hoge bloeddrukdoel.
Samenvattend kan er geen specifiek bloeddrukdoel gegeven worden voor patiënten ouder dan 70 jaar. Het lijkt redelijk hetzelfde bloeddrukdoel te hanteren als voor jongere patiënten, al moet men zich realiseren dat het bereiken hiervan gepaard kan gaan met ongunstige effecten. In elk geval wordt geadviseerd om bij ouderen, die behandeld worden met antihypertensiva, specifiek te vragen of zij last hebben van houdingsafhankelijke duizeligheid.
Keuze bloeddrukverlagend middel
Bij patiënten zonder verhoogde albuminurie wordt geen specifiek advies gegeven over het middel van keuze voor de behandeling van de hypertensie. Voor patiënten met matig verhoogde albuminurie (ACR 3-30 mg/mmol) wordt als antihypertensieve behandeling een ACE-remmer of ARB gesuggereerd, en voor mensen met een ernstig verhoogde albuminurie (ACR > 30 mg/mmol) wordt een ACE-remmer of ARB aanbevolen. Voorkeursbehandeling met ACE-remmers en ARB’s bij matig tot ernstig verhoogde albuminurie is gebaseerd op het feit dat gerandomiseerde studies hebben laten zien dat ACE-remmers en ARB’s progressie van CNS tegengaan, en wellicht ook een verbetering geven van cardiovasculaire uitkomstmaten. Wel gaat het in de meeste studies om subanalyses van de groep patiënten met CNS uit de algemene populatie, dus niet om studies die primair bij CNS verricht zijn [Matsushita, 2010; Hallan, 2009; Wachtell, 2003; Mann, 2001; Mann, 2003; Rahman, 2005; Rahman, 2006].
Betreffende de keuze tussen ACE-remmers en ARB’s is er geen bewijs dat één van deze klassen betere uitkomsten geeft en lijken deze middelen even effectief in het verbeteren van de uitkomsten bij patiënten met diabetes mellitus en verhoogde albuminurie. Men kan zich in de keuze dan ook laten leiden door het bewijs dat er voor elke klasse bestaat (meer studies met ACE-remmers bij diabetes mellitus type 1 en meer studies met ARB’s bij diabetes mellitus type 2), door bijwerkingen en door kostenoverwegingen. In geval van bijwerking van ACE-remmers (m.n. kriebelhoest) kunnen ARB’s worden gebruikt.
Zoals hierboven al aangegeven, wordt bij patiënten met een matig (ACR 3-30 mg/mmol; A2) of sterk (ACR > 30 mg/mmol; A3) verhoogde albuminurie de voorkeur gegeven aan een ACE-remmer of ARB. In de praktijk echter zijn vaak drie of meer antihypertensiva nodig. Hierbij dient opgemerkt te worden dat na starten van een ACE-remmer of ARB meestal een lichte daling van de GFR kan worden waargenomen [Apperloo, 1997]. Dit berust op een fysiologische intrarenale hemodynamische aanpassing. De initiële daling van de nierfunctie gaat daarna gepaard met een minder snelle achteruitgang van de nierfunctie [Apperloo, 1997]. Omdat bij CNS een verlies van renale autoregulatie optreedt, kan bloeddrukverlaging met elk antihypertensivum maar vooral met blokkers van het RAAS-systeem gepaard gaan met achteruitgang van de GFR. Een sterke stijging van het serum creatininegehalte wordt met name gezien bij patiënten met een significante dubbelzijdige nierarteriestenose (of een nierarteriestenose bij een (functionele) mononier). Bij het starten van RAAS-blokkade (ACE-remmers, A2-antagonisten en aldosteron antagonisten) bij patiënten met eGFR < 60 ml/min/1,73 m2 wordt daarom na 1-2 weken controle van het serum kalium en de eGFR aanbevolen. Een daling van de eGFR van maximaal 20% na start van de behandeling wordt geaccepteerd. Bij een daling van de eGFR van meer dan 20% na start van de behandeling wordt de behandeling gestaakt en de eGFR na 1-2 weken opnieuw gemeten. Verwijzen naar de tweede lijn wordt aanbevolen ter diagnostiek en advies m.b.t. behandeling. Bij tussentijdse doseringsverhoging of bij langdurig gebruik van al ingestelde RAAS-blokkade is geen extra controle van eGFR of kalium nodig.
Bij onvoldoende respons op een ACE-remmer of ARB dient eerst nagegaan te worden of de betrokken patiënt wel een zoutbeperkt dieet volgt (zie de module ‘Beleid en behandeling bij CNS’, submodule Leefstijl). Bij persisterende onvoldoende respons wordt geadviseerd een thiazidediureticum toe te voegen. Het is aangetoond dat natriumdepletie de werking van ACE-remmers en ARB’s versterkt en, andersom, dat gebruik van te veel zout de werking van deze middelen grotendeels antagoneert [Apperloo, 1997; Buter, 1998; Van der Kleij, 1997; Vogt, 2008]. Bij de meeste patiënten blijkt behandeling met een combinatie van bloeddrukverlagende middelen in combinatie met zoutbeperking noodzakelijk te zijn om de streefbloeddruk te bereiken.
Het nut van gecombineerde blokkade van het RAAS door ACE-remmers samen met ARB’s te geven, is tot nu toe niet bewezen voor belangrijke cardiovasculaire uitkomstmaten noch voor uitkomstmaten van nierfunctie. Wel zijn er nadelige effecten beschreven ten aanzien van CVA, hypotensie, hyperkaliëmie en nierfunctieverslechtering [Mann, 2008; Yusuf, 2008]. Daarom wordt geadviseerd zeer terughoudend te zijn met het combineren van deze middelen en dit alleen in de tweede lijn toe te passen.
Onderbouwing
Samenvatting literatuur
Streefwaarde bloeddruk
Bloeddruk en albuminurie
De KDIGO richtlijn uit 2013 stelt dat bij patiënten met CNS zonder verhoogde albuminurie (ACR < 3 mg/mmol; A1) de streefbloeddruk 140/90 mmHg of lager is. Voor patiënten met matig verhoogde ACR (3-30 mg/mmol; A2) of ernstig verhoogde albuminurie (> 30 mg/mmol; A3) ongeacht de aanwezigheid van diabetes mellitus wordt een streef bloeddrukwaarde van 130/80 mmHg geadviseerd voor zowel de grens waarboven therapie moet starten als ook het behandeldoel.
Bloeddruk zo laag mogelijk?
In de UKPDS (UK Prospective Diabetes Study) werd gevonden dat streven naar een bloeddruk < 150/85 mmHg betere uitkomsten gaf dan streven naar een bloeddruk < 180/105 mmHg [UKPDS, BMJ 1998]. In de HOT studie werd gevonden dat streven naar een diastolische bloeddruk ≤ 80 mmHg beter was dan naar hogere diastolische bloeddrukwaarden, maar gegevens over albuminurie ontbraken in deze studie [Hansson, 1998]. In de ABCD studie werd gerandomiseerd tussen een diastolische bloeddruk < 75 mmHg en een diastolische bloeddruk van 80-89 mmHg. Er was minder sterfte in de laagste bloeddrukgroep en geen verschil tussen renale en cardiovasculaire uitkomsten [Schrier, 2007]. Omdat in deze studie patiënten met normotensie en CNS geïncludeerd waren maar geen patiënten met hypertensie en CNS, kunnen de gegevens niet betrouwbaar geëxtrapoleerd worden naar de gehele populatie met CNS. In de ACCORD studie (n = 4730, 40% met verhoogde albuminurie) werd gerandomiseerd tussen een systolische bloeddruk < 140 en < 120 mmHg [Cushman, 2010]. Er werd geen verschil gevonden in de primaire uitkomstmaat (cardiovasculaire sterfte, niet-fataal hartinfarct, niet-fataal CVA). Echter in de lage bloeddrukgroep kregen minder patiënten een CVA, maar meer patiënten nierfunctie-verslechtering. Observationele studies tonen een verband tussen lagere bloeddruk en een lager risico op cardiovasculaire uitkomsten. Echter geen van deze studies geeft bewijs van causaliteit. Voorts zijn veel posthoc analyses van RCT’s verschenen (IDNT [Berl, 2005], UKPDS [Adler, 2000], INVEST [Pepine, 2003], ADVANCE [Patel, 2007]), waaruit o.a. naar voren kwam dat patiënten die een betere bloeddruk bereikten (130/85 in plaats van 140/90 mmHg), een lager risico op cardiovasculaire schade hadden dan patiënten die een hoge bloeddruk hielden. Ook dit geeft geen bewijs van causaliteit. Het is immers voorstelbaar dat degenen die een lagere bloeddruk bereiken minder ver voortgeschreden vaatwandsclerose hebben en/of een betere therapietrouw vertonen. In de Steno-2 studie werd een groep intensief behandelde diabetespatiënten met matig verhoogde albuminurie, waarbij een bloeddrukdoel van 140/85 en later 130/80 mmHg werd nagestreefd, vergeleken met een conventionele arm van patiënten bij wie < 160/95 en later 135/85 mmHg werd nagestreefd [Gaede, 2008]. Intensieve behandeling hield ook in dat er o.a. dieet- en inspanningsadvies werd gegeven, lipidenverlagende medicatie werd gestart, en intensieve glycemische controle werd nagestreefd. De intensieve behandeling was geassocieerd met een verminderd risico op cardiovasculaire ziekten, nefropathie, retinopathie en autonome neuropathie. Het is aannemelijk dat lagere bloeddrukdoelen hebben bijgedragen aan de gunstige resultaten bij de intensief behandelde patiënten. Twee recente meta-analyses laten zien dat een afname van cardiovasculaire morbiditeit en mortaliteit ontstaat bij een afname van bloeddruk < 130/80 mmHg bij patiënten met een hoog cardiovasculair risico, diabetes mellitus en/of CNS [Ettehad, 2016; Xie, 2016]. Ettehad et al. voerden een systematische review met meta-analyses uit, waarin zij de relatie tussen verlaging van de bloeddruk en cardiovasculaire aandoeningen en sterfte onderzochten [Ettehad, 2016]. In deze studie werden 123 RCT’s met ten minste 1000 patiëntjaren in elke onderzoeksarm geïncludeerd, met in totaal 613.815 patiënten. In deze studie werd een verband aangetoond tussen elke 10 mm Hg daling van de systolische bloeddruk en verlaging van het risico op cardiovasculaire eindpunten en mortaliteit (zie tabel 1). Hoe lager de systolische bloeddruk, hoe lager het relatief risico, maar de absolute risicoreductie was beperkt, zodat veel mensen behandeld moeten worden om één event te vermijden. Deze studie liet geen statistisch significante relatie zien tussen verlaging van de bloeddruk en nierfalen. In de studie werd geen onderscheid gemaakt tussen patiënten met en zonder CNS.
Tabel 1. Relatie tussen elke 10 mm Hg daling in systolische bloeddruk en cardiovasculair risico [Ettehad, 2016]
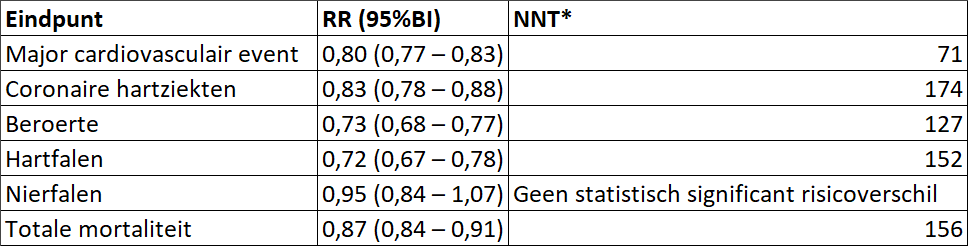
*NNT: number-needed-to-treat: aantal personen dat behandeld moet worden om 1 event te voorkomen.
Xie et al. voerden eveneens een systematische review met meta-analyses uit, met als doel de associatie tussen intensieve bloeddrukverlaging en cardiovasculaire en renale uitkomsten te bestuderen [Xie, 2016]. In deze studie werden 19 trials geïncludeerd, waarin intensieve met minder intensieve bloeddrukverlaging werd vergeleken, bij in totaal 44.989 patiënten. De verschillen in bereikte systolische bloeddruk tussen de onderzoeksarmen waren in deze studie over het algemeen beperkt voor de totale groep. Er is in deze analyse echter ook naar subgroepen gekeken. Wanneer werd gekeken naar de uitkomst major cardiovasculair event dan werd voor patiënten met CNS geen voordeel gevonden van intensieve bloeddrukverlaging ten opzichte van minder intensieve bloeddrukverlaging. Hierbij was sprake van imprecisie van het gevonden resultaat. Veel van de studies die in deze meta-analyse waren geïncludeerd, waren van matige kwaliteit, bijvoorbeeld vanwege niet-geblindeerde opzet.
In 2015 verscheen een grote RCT over bloeddrukregulatie bij patiënten met een systolische bloeddruk ≥ 130 mmHg en verhoogd cardiovasculair risico zónder diabetes mellitus [SPRINT, 2015]. In deze studie werden 9361 patiënten gerandomiseerd tussen twee groepen: systolisch bloeddruk streefwaarde < 140 mmHg (standaardbehandeling) en systolisch bloeddruk streefwaarde < 120 mmHg (intensieve behandeling). De mediane follow-up was 3,26 jaar (de studie werd vervroegd gestopt vanwege significante resultaten in de primaire uitkomst [optreden van myocardinfarct, acuut coronair syndroom, beroerte, hartfalen of cardiovasculaire mortaliteit]). De gemiddelde bloeddruk in de intensieve behandelgroep was 121,4 mmHg na één jaar, in de standaard behandelgroep was dat 136,2 mmHg. Na het eerste jaar bleef de bloeddruk stabiel. Het risico op de primaire uitkomst was lager in de intensieve behandelgroep (5,2%) in vergelijking met de standaard behandelgroep (6,8%) (HR: 0,75; 95%BI: 0,64-0,89). De NNT was 61. Op de secundaire uitkomstmaten myocardinfarct, acuut coronair syndroom en beroerte werd geen statistisch significant resultaat gezien. Wel hadden personen in de intensieve behandelgroep een lager risico op hartfalen (HR: 0,62; 95%BI: 0,45-0,84), cardiovasculaire sterfte (HR: 0,57; 95%BI: 0,38-0,85) en totale sterfte (HR: 0,73; 95%BI: 0,60-0,90).
Een vooraf geplande subgroepanalyse van de SPRINT trial toont voor de populatie met CNS soortgelijke bevindingen, alhoewel de meeste niet statistisch significant bleken [Cheung, 2017]. Dit wordt verklaard vanwege de kleinere aantallen in de subgroepen en de vroegtijdige beëindiging van de SPRINT-trial vanwege de behaalde eindpunten.
Zoeken en selecteren
Bij deze vraag is uitgegaan van de evidence uit de KDIGO richtlijn [KDIGO, 2013]. Na publicatie van die richtlijn verschenen twee grote meta-analyses die zijn opgenomen als aanvullend bewijs. [Ettehad, 2016; Xie, 2016]. Een recente RCT over bloeddruk streefwaarden werd daarnaast nog geïncludeerd [SPRINT, 2015]. Voor deze uitgangsvraag is geen systematisch literatuuronderzoek gedaan, vanwege de beschikbaarheid van de evidence in de KDIGO richtlijn. De werkgroep is van mening de nieuwste evidence van hoge kwaliteit te hebben toegevoegd.
Referenties
- Adler AI, Stratton IM, Neil HA et al. Association of systolic blood pressure with macrovascular and microvascular complica-tions of type 2 diabetes (UKPDS 36): prospective observational study. BMJ 2000;321:412-9
- Apperloo AJ, de Zeeuw D, de Jong PE. A short-term antihypertensive treatment-induced fall in glomerular filtration rate predicts long-term stability of renal function. Kidney Int 1997;51:793-7
- Berl T, Hunsicker LG, Lewis JB et al. Impact of achieved blood pressure on cardiovascular outcomes in the Irbesartan Diabetic Nephropathy Trial. J Am Soc Nephrol 2005;16:2170-9
- Buter H, Hemmelder MH, Navis G, de Jong PE, de Zeeuw D. The blunting of the antiproteinuric efficacy of ACE inhibition by high sodium intake can be restored by hydrochlorothiazide. Nephrol Dial Transplant 1998;13:1682-5
- Cheung AK, Tahman M, Reboussin DM, Craven TE, Greene T, Kimmel PL, et al. Effects of intensive BP control in CKD. J Am Soc Nephrol 2017; 28; doi: https://doi.org/10.1681/ASN.2017020148.
- Chobanian AV, Bakris GL, Black HR et al. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA 2003;289:2560-72
- Cushman WC, Evans GW, Byington RP et al. Effects of intensive bloodpressure control in type 2 diabetes mellitus. N Engl J Med 2010;362:1575-85
- Ettehad D, Amdein CA, Kiran A, Anderson SG, Callender T, Emberson J, et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet 2016; 387: 957-67.
- European Society of Hypertension / European Society of Cardiology. 2013 ESH/ESC Guidelines for the management of arterial hypertension. Eur Heart J 2013; 34: 2159-2219.
- Gaede P, Lund-Andersen H, Parving HH et al. Effect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med 2008;358:580-91
- Hallan SI, Ritz E, Lydersen S et al. Combining GFR and albuminuria to classify CKD improves prediction of ESRD. J Am Soc Nephrol 2009;20:1069-77
- Hansson L, Zanchetti A, Carruthers SG et al. Effects of intensive bloodpressure lowering and lowdose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial. HOT Study Group. Lancet 1998;351:1755-62
- Kidney Disease Improving Global Outcomes (KDIGO). KDIGO 2012 clinical practice guideline for the evaluation and man-agement of chronic kidney disease. Kidney International 2013; 3: S1-150.
- Kidney Disease: Improving Global Outcomes (KDIGO). Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int Suppl 2012;2:337-414
- Mann JF, Gerstein HC, Pogue J et al. Renal insufficiency as a predictor of cardiovascular outcomes and the impact of rami-pril: the HOPE randomized trial. Ann Intern Med 2001;134:629-36
- Mann JF, Gerstein HC, Yi QL et al. Development of renal disease in people at high cardiovascular risk: results of the HOPE randomized study. J Am Soc Nephrol 2003;14:641-7
- Mann JF, Schmieder RE, McQueen M et al. Renal outcomes with telmisartan, ramipril, or both, in people at high vascular risk (the ONTARGET study): a multicentre, randomised, double-blind, controlled trial. Lancet 2008;372:547-53
- Matsushita K, van der Velde M, Astor BC et al. for the Chronic Kidney Disease Prognosis Consortium: Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet 2010;375:2073-81
- Musini VM, Tejani AM, Bassett K et al. Pharmacotherapy for hypertension in the elderly. Cochrane Database Syst Rev 2009: CD000028.
- National Institute for Health and Care Excellence (NICE). Chronic kidney disease. Early identification and management of chronic kidney disease in adults in primary and secondary care. NICE, 2015.
- Nederlands Huisartsen Genootschap. Multidisciplinaire richtlijn Cardiovasculair risicomanagement. NHG, 2011.
- Patel A, MacMahon S, Chalmers J et al. Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial. Lancet 2007;370:829-40
- Pepine CJ, Handberg EM, Cooper-DeHoff RM et al. A calcium antagonist vs a non-calcium antagonist hypertension treat-ment strategy for patients with coronary artery disease. The International Verapamil-Trandolapril Study (INVEST): a ran-domized controlled trial. JAMA 2003;290:2805-16
- Peterson JC, Adler S, Burkart JM et al. Blood pressure control, proteinuria, and the progression of renal disease. The Modifi-cation of Diet in Renal Disease Study. Ann Intern Med 1995;123:754-62
- Rahman M, Pressel S, Davis BR et al. Cardiovascular outcomes in high-risk hypertensive patients stratified by baseline glomerular filtration rate. Ann Intern Med 2006;144:172-80
- Rahman M, Pressel S, Davis BR et al. Renal outcomes in high-risk hypertensive patients treated with an angiotensin-converting enzyme inhibitor or a calcium channel blocker vs a diuretic: a report from the Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT). Arch Intern Med 2005;165:936-46
- Schrier RW, Estacio RO, Mehler PS et al. Appropriate blood pressure control in hypertensive and normotensive type 2 dia-betes mellitus: a summary of the ABCD trial. Nat Clin Pract Nephrol 2007;3:428-38
- Soliman EZ, Prineas RJ, Go AS et al. Chronic kidney disease and prevalent atrial fibrillation: the Chronic Renal Insufficiency Cohort (CRIC). Am Heart J 2010;159:1102-7
- The SPRINT Research Group. A randomized trial of intensive versus standard blood-pressure control. New Engl J Med 2015; 373-2103-16.
- UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complica-tions in type 2 diabetes: UKPDS 38. UK Prospective Diabetes Study Group. BMJ 1998;317:703-13
- van der Kleij FG, Schmidt A, Navis GJ et al. Angiotensin converting enzyme insertion/ deletion polymorphism and short-term renal response to ACE inhibition: role of sodium status. Kidney Int Suppl 1997;63:S23-6
- Vogt L, Waanders F, Boomsma F, de Zeeuw D, Navis G. Effects of Dietary Sodium and Hydrochlorothiazide on the Antipro-teinuric Efficacy of Losartan. J Am Soc Nephrol 2008;19:999-1007
- Wachtell K, Ibsen H, Olsen MH et al. Albuminuria and cardiovascular risk in hypertensive patients with left ventricular hypertrophy: the LIFE study. Ann Intern Med 2003;139:901-6
- Xie X, Atkins E, Lv J, Bennett A, Neal B, Ninomiya T, et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: updated systematic review and meta-analysis. Lancet 2016; 387: 435-43.
- Young JH, Klag MJ, Muntner P et al. Blood pressure and decline in kidney function: findings from the Systolic Hypertension in the Elderly Program (SHEP). J Am Soc Nephrol 2002;13:2776-82
- Yusuf S, Teo KK, Pogue J et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008;358:1547-59
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 18-01-2018
Jaarlijks wordt door de initiatiefnemers van de ontwikkeling van deze richtlijn bepaald of actualisatie van de richtlijn nodig is. Indien actualisatie gewenst is, spannen de initiatiefnemers zich in om de hiervoor noodzakelijke voorwaarden (bijvoorbeeld financiering, samenstelling werkgroep) te realiseren. Nieuwe of nog niet behandelde knelpunten kunnen aanleiding zijn tot actualisatie van de richtlijn.
Bij publicatie van de nieuwe multidisciplinaire richtlijn Cardiovasculair Risicomanagement (die in 2017 in herziening is genomen) zullen de aanbevelingen die raakvlak hebben met de richtlijn Cardiovasculair Risicomanagement zo nodig worden geactualiseerd.
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Koninklijke Nederlandse Maatschappij ter Bevordering der Pharmacie
- Nederlandse Federatie voor Nefrologie
- Nederlandse Vereniging van Diëtisten / Diëtisten Nierziekten Nederland
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde
- Nierpatiënten Vereniging Nederland
Met ondersteuning van:
- Nederlands Huisartsen Genootschap
- Nederlandse Internisten Vereniging
- PROVA
De ontwikkeling van deze richtlijn is gefinancierd vanuit een projectbudget door de Stichting Kwaliteitsgelden Medisch Specialisten en het Nederlands Huisartsen Genootschap.
Doel en doelgroep
Doel
Het doel van deze richtlijn is de kwaliteit van zorg en patiëntveiligheid van patiënten met CNS te waarborgen en waar mogelijk te verbeteren. In deze richtlijn zijn aanbevelingen geformuleerd die professionals in de zorg hiertoe handvaten geven. Daarbij is het doel bovendien de zorg in de eerste en tweede lijn zoveel mogelijk op elkaar af te stemmen en daarbij uitdrukkelijk het patiëntenperspectief een plaats te geven.
Doelgroep
De doelgroep van deze richtlijn zijn professionals die zich bezig houden met de zorg voor patiënten met CNS. Hieronder worden in ieder geval verstaan: huisartsen, internisten, internist-nefrologen, apothekers, laboratoriumspecialisten klinische chemie en diëtisten. Ook andere professionals, zoals andere medisch specialisten, verpleegkundigen en maatschappelijk werkenden, kunnen hun voordeel doen met deze richtlijn.
Samenstelling werkgroep
Voor de ontwikkeling van deze richtlijn is een multidisciplinaire werkgroep ingesteld, onder voorzitterschap van dhr. dr. Marc Hemmelder, internist-nefroloog, en mw. drs. Jacintha van Balen, huisarts. In de werkgroep hebben gemandateerde vertegenwoordigers van de volgende beroepsverenigingen zitting:
- Koninklijke Nederlandse Maatschappij ter Bevordering der Pharmacie
- Nederlands Huisartsen Genootschap
- Nederlandse Internisten Vereniging / Nederlandse Federatie voor Nefrologie
- Nederlandse Vereniging van Diëtisten / Diëtisten Nierziekten Nederland
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde
Om het patiëntenperspectief in de werkgroep te waarborgen, hadden twee vertegenwoordigers van de Nierpatiënten Vereniging Nederland zitting in de werkgroep. De werkgroep werd procedureel en methodologisch ondersteund door PROVA. Logistieke ondersteuning is gegeven door de Nederlandse Internisten Vereniging en het Nederlands Huisartsen Genootschap. Het secretariaat is gevoerd door het Nederlands Huisartsen Genootschap.
Synchroon aan de ontwikkeling van deze multidisciplinaire richtlijn zijn de NHG-Standaard Chronische Nierschade en aanvullende NIV-modules Chronische Nierschade ontwikkeld. De werkgroepleden van de Standaardwerkgroep en van de NIV-werkgroep maakten deel uit van de werkgroep van de multidisciplinaire richtlijn, om zo alle trajecten zo veel mogelijk op elkaar af te stemmen.
- Mw. drs. Jacintha van Balen, huisarts, Nederlands Huisartsen Genootschap, Utrecht, namens het Nederlands Huisartsen Genootschap – voorzitter
- Dhr. dr. Marc Hemmelder, internist-nefroloog, Nefrovisie, Utrecht, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie – voorzitter
- Mw. drs. Mariska Tuut, epidemioloog, PROVA, Varsseveld – secretaris
- Dhr. Peter van Cuijk, Apeldoorn, ervaringsdeskundige, namens de Nierpatiënten Vereniging Nederland
- Dhr. prof. dr. Ron Gansevoort, internist-nefroloog, UMC Groningen, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie
- Dhr. dr. Wim de Grauw, huisarts te Berghem, Radboudumc, Nijmegen, namens het Nederlands Huisartsen Genootschap
- Mw. Inez Jans, diëtist, Ziekenhuis Gelderse Vallei, Ede, namens Nederlandse Vereniging van Diëtisten en Diëtisten Nierziekten Nederland
- Mw. dr. Birgit Koch, ziekenhuisapotheker-klinisch farmacoloog, Erasmus MC, Rotterdam, namens de Nederlandse Vereniging van Ziekenhuisapothekers
- Mw. drs. Karen de Leest, apotheker, Apotheek de Roerdomp, Nieuwegein, namens de Koninklijke Nederlandse Maatschappij ter Bevordering der Pharmacie
- Mw. drs. Karen Prantl, Bussum, coördinator kwaliteit & onderzoek, Nierpatiënten Vereniging Nederland, namens de Nierpatiënten Vereniging Nederland
- Dhr. dr. Paul Schenk, laboratoriumspecialist klinische chemie / klinisch chemicus, LUMC, Leiden, namens de Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde
- Mw. dr. Nynke Scherpbier, huisarts, Radboudumc, Nijmegen, namens het Nederlands Huisartsen Genootschap
- Mw. drs. Judith Tjin-A-Ton, huisarts, Amstelveen, namens het Nederlands Huisartsen Genootschap
- Mw. dr. Neelke van der Weerd, internist-nefroloog, AMC, Amsterdam, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie
Belangenverklaringen
|
Naam |
Namens |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis-valorisatie |
Overige belangen |
|
Jacintha van Balen |
NHG |
Huisarts 0,6 FTE; Teamleider afdeling Richtlijnen en Wetenschap |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Marc Hemmelder |
NIV / NFN |
Internist-nefroloog Medisch Centrum Leeuwarden (0,6 FTE) Uitvoerend bestuurder Nefrovisie (0,4 FTE) |
Geen |
Geen |
Geen |
Geen |
Dolomites studie van Astellas |
Renine, registratie van patiënten met nierfunctievervaning in Nederland. Onderdeel van Nefrovisie |
Geen |
|
Mariska Tuut |
onafhankelijk |
Eigenaar PROVA, adviesbureau voor procesmatige en methodologische ondersteuning bij de ontwikkeling van evidence-based richtlijnen en andere kwaliteitsinstrumenten |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Peter van Cuijk |
NVN |
Ruim 35 jaar gewerkt in de Jeugdhulpverlening als orthopedagoog en manager. Ervaring in diverse settingen en diverse functie's, zowel inhoudelijk, uitvoerend en in de aansturing/management. |
bestuursfunctie (penningmeester) amateur-theatervereniging De Apeldoornse Komedie |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
|
Ron Gansevoort |
NIV / NFN |
Internist-nefroloog, UMCG |
Lid bestuur Nederlandse Federatie voor Nefrologie (sectie Wetenschap); Lid Wetenschappelijke Adviesraad Nierstichting; Lid redactie wetenschappelijke tijdschriften: American Journal of Kidney Diseases, Clinical Journal of the American Society of Neprology, European Medical Journal Nephrology, Journal of Nephrology, Nephrology Dialysis and Transplantation, Nephron Clinical Practice (alle functies onbetaald) |
Geen |
Geen |
Lid wetenschappelijke adviesraad Nierstichting |
Geen |
Geen |
Geen |
|
Wim de Grauw |
NHG |
Huisarts te Berghem (0,7 fte); Senior staflid huisarts-onderzoeker afdeling Eerstelijns Geneeskunde Radboudumc Nijmegen (0,3 fte) |
Herder bij diverse professionele begrazingsbedrijven |
Geen |
Geen |
Onderzoek op het gebied van Chronische Nierschade is een belangrijk onderdeel van de onderzoekslijn vaatschade van de afdeling Eerstelijnsgeneeskunde Radboudumc in samenwerking met de afdeling Nefrologie Radboudumc |
De afdeling Eerstelijns Geneeskunde ontvangt subsidie van de Nierstichting Nederland voor onderzoek op het gebied van Chronische Nierschade |
Afdeling Eerstelijnsgeneeskunde Radboudumc heeft samen met de afdeling Nefrologie Radboudumc en Zorgdomein Telenefrologie ontwikkeld, een e-health applicatie voor consultatie tussen huisarts en nefroloog |
Geen |
|
Inez Jans |
NVD / DNN |
Diëtist, aandachtsgebied nierziekten en voedingsteam, Ziekenhuis Gelderse Vallei (fulltime dienstverband) |
Extern assessor Hogeschool van Arnhem en Nijmegen, opleiding Voeding en Diëtetiek (flex contract); Actief lid Diëtisten Nierziekten Nederland (voorzitter DNN werkgroep kwaliteit; lid DNN werkgroep richtlijnen); vanuit die rol lid van de werkgroep multidisciplinaire richtlijn chronisch nierfalen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Birgit Koch |
NVZA |
Ziekenhuisapotheker-klinisch farmacoloog 0,85 FTE |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
ZonMw: PK/PD antipsychotica; Stichting Coolsingel: middelenmisbruik zwangerschap |
n.v.t. |
n.v.t. |
|
Karen de Leest |
KNMP |
Apotheker, Apotheek de Roerdomp, Nieuwegein, 24 uur/week |
Wetenschappelijk medewerker KNMP, 10 uur/week |
Geen |
Geen |
Redactielid Vascuzine, tijdschrift v.d. Vasculitis patiënten vereniging, vrijwilligerswerk, geen boegbeeldfunctie |
Geen |
Geen |
Nee |
|
Karen Prantl |
NVN |
Beleidsmedewerker kwaliteit |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Paul Schenk |
NVKC |
Klinisch chemicus/ laboratoriumspecialist Klinische chemie, LUMC Leiden (voltijds, loondienst) |
Geen nevenwerkzaamheden buiten LUMC |
Geen persoonlijke financiële belangen |
Geen relevante persoonlijke relaties als hier bedoeld |
Geen relevante posities als hier bedoeld |
Geen relevant extern gefinancierd onderzoek |
Geen relevante valorisatie |
Nee, geen relevante overige belangen |
|
Nynke Scherpbier |
NHG |
Opleidingsdirecteur extramurale vervolgopleidingen RadboudUMC 0,8 FTE; huisarts 0,2 FTE |
Council member EURACT, Europese organisatie voor opleiden in de huisartsgeneeskunde (onbetaald) |
Geen |
Geen |
Geen |
Ik ben co-promotor van een promotietraject dat wordt gefinancierd door de Nierstichting met als doel te onderzoeken: 1. wat belemmerende en bevorderende factoren zijn in het naleven van de LTA; 2. hoe patiënten de voorlichting over CNS ervaren; 3. of het mogelijk is om veilige wijze bepaalde patiënten terug te verwijzen vanuit de tweede naar de eerste lijn |
Afdeling Eerstelijnsge-neeskunde Radbou-dumc heeft samen met de afdeling Nefro-logie Radboudumc en Zorgdomein Telenefrologie ontwikkeld, een e-health applicatie voor consultatie tus-sen huisarts en nefroloog |
Geen |
|
Judith Tjin-A-Ton |
NHG |
Huisarts |
Kaderhuisarts hart- en vaatziekten: kwaliteitscommissie en werkgroep HVZ bij Amstellandzorg BV (betaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Neelke van der Weerd |
NIV / NFN |
Internist-nefroloog AMC Amsterdam |
- |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
Methode ontwikkeling
Evidence based
Implementatie
Gedurende het hele proces van richtlijnontwikkeling is rekening gehouden met implementatie van de richtlijn in de praktijk, bijvoorbeeld bij de samenstelling van de werkgroep, de brede knelpunteninventarisatie en de uitgebreide commentaarronde. De werkgroep heeft adviezen voor implementatie (implementatieplan) en indicatoren geformuleerd. Deze zijn opgenomen onder de aanverwante producten.
Na autorisatie van de richtlijn wordt deze ten minste op de website van de Nederlandse Internisten Vereniging en het Nederlands Huisartsen Genootschap gepubliceerd. Ook andere deelnemende partijen zijn vrij de richtlijn op hun website te publiceren. De richtlijn wordt ter publicatie aangeboden aan www.richtlijnendatabase.nl. Daarnaast wordt getracht samenvattingen van de richtlijn in Nederlandse tijdschriften te publiceren, aandacht aan de richtlijn te besteden op congressen, en nascholingsmateriaal en voorlichtingsmateriaal te ontwikkelen, om zo de implementatie van de richtlijn te bevorderen.
Een voor patiënten begrijpelijke samenvatting van de aanbevelingen uit deze richtlijn komt beschikbaar via www.thuisarts.nl. Een verdieping daarvan komt beschikbaar via de website van de Nierstichting/Nederlandse Vereniging van Nierpatiënten.
Werkwijze
Knelpunteninventarisatie
De richtlijnwerkgroep heeft in de eerste werkgroepvergadering knelpunten benoemd in de zorg voor patiënten met CNS. Deze knelpunten zijn in een invitational conference voorgelegd aan belanghebbenden, waarbij ook is gediscussieerd over aanvullende knelpunten. Voor deze invitational conference zijn, naast vertegenwoordigers van verenigingen die in de werkgroep afgevaardigd zijn, de volgende partijen uitgenodigd:
- Federatie Medisch Coördinerende Centra
- Inspectie voor de Gezondheidszorg
- Nederlandse Federatie van Universitair Medische Centra
- Nederlandse Vereniging van Ziekenhuizen
- Nederlandse Zorgautoriteit
- Nierstichting Nederland
- Patiëntenfederatie Nederland
- Vereniging Innovatieve Geneesmiddelen
- Vereniging Maatschappelijk Werk Nefrologie
- Verpleegkundigen & Verzorgenden Nederland
- ZorgInstituut Nederland
- Zorgverzekeraars Nederland
De richtlijnwerkgroep heeft de input vanuit de knelpunteninventarisatie geanalyseerd en in de tweede werkgroepvergadering de knelpunten en uitgangsvragen vastgesteld.
Uitwerking knelpunten en uitgangsvragen in conceptrichtlijn
Per knelpunt werd door de werkgroep vooraf bepaald op welke wijze dit knelpunt zou worden behandeld: met behulp van systematisch literatuuronderzoek (evidence-based) of meer op basis van bestaande richtlijnen en professionele expertise in de werkgroep. Er was financiering voor de uitwerking van een beperkt aantal vragen met behulp van systematisch literatuuronderzoek. Om toch ook de andere belangrijke knelpunten een plaats te geven in deze richtlijn, is voor uitwerking van de resterende knelpunten voor een minder arbeidsintensieve wijze gekozen. De wijze van uitwerking van de knelpunten/uitgangsvragen staat per uitgangsvraag vermeld in de verschillende modules van deze richtlijn. De keuze van de knelpunten die met systematisch literatuuronderzoek zijn beantwoord is gemaakt door de gezamenlijke werkgroep, op basis van verwachting dat het literatuuronderzoek mogelijk tot nieuwe inzichten zou leiden en de afwezigheid van recente internationale richtlijnen over de specifieke uitgangsvraag.
De uitwerking van de knelpunten in conceptteksten werd voorbereid door de epidemioloog die bij de ontwikkeling van de richtlijn betrokken was. Per knelpunt werd deze inhoudelijk bijgestaan door een aantal werkgroepleden, afhankelijk van het onderwerp. De conceptteksten werden plenair tijdens de werkgroepvergaderingen besproken, en na discussie bijgesteld. De richtlijnwerkgroep is 9 maal bijeen geweest, alvorens de conceptrichtlijn is vastgesteld.
Bij veel uitgangsvragen is voor de onderbouwing gebruik gemaakt van internationale richtlijnen op het gebied van CNS. De KDIGO richtlijn en de NICE richtlijn over chronische nierschade zijn op kwaliteit beoordeeld bij aanvang van de ontwikkeling van deze multidisciplinaire richtlijn. De wijze van onderbouwing van deze internationale richtlijnen werd door de richtlijnwerkgroep als adequaat beoordeeld. Beide richtlijnen maakten gebruik van de GRADE methodiek.
Voor de uitgangsvragen die met behulp van systematisch literatuuronderzoek zijn uitgewerkt, is gebruik gemaakt van de principes van de GRADE Working Group. Voor achtergrondinformatie over deze methodiek wordt verwezen naar het Dutch GRADE Network (www.dutchgradenetwork.org). Vanwege de verschillende totstandkoming van de diverse aanbevelingen heeft de werkgroep ervoor gekozen om het graderen van aanbevelingen, zoals dit wordt gepropageerd in de GRADE-methodiek, niet door te voeren in deze richtlijn. Hiermee is eenheid in de formulering van aanbevelingen gecreëerd.
De module ‘Samenwerking bij CNS’ bevat samenwerkingsafspraken: aanbevelingen voor consultatie en verwijzing tussen eerste en tweede lijn, en aanbevelingen voor samenwerking met laboratoriumspecialisten klinische chemie, diëtisten en apothekers. Hierbij zijn geen specifieke uitgangsvragen genoemd, maar is uitgegaan van eerdere samenwerkingsafspraken en uitgangspunten en aanbevelingen uit de modules ‘Diagnostiek en stadiëring bij CNS’ en ‘Beleid en behandeling bij CNS’.
Daar waar in deze richtlijn ‘hij’ genoemd staat, kan ook ‘zij’ gelezen worden.
Commentaar en autorisatie
De conceptrichtlijn is ter commentaar aangeboden aan alle partijen die bij de knelpunteninventarisatie om input gevraagd zijn. Het binnengekomen commentaar is door de werkgroep beoordeeld en verwerkt in de richtlijn. Daarbij is beargumenteerd welke commentaren wel en welke niet zijn overgenomen.
Daarna is de richtlijn ter autorisatie voorgelegd aan de partijen die in de werkgroep vertegenwoordigd zijn. De richtlijn is geautoriseerd door de Nederlandse Internisten Vereniging, het Nederlands Huisartsen Genootschap, de Nederlandse Vereniging voor Diëtisten, de Nederlandse Vereniging voor Ziekenhuisapothekers en de Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde. Ook is de richtlijn goedgekeurd door de Nierpatiënten Vereniging Nederland.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence' gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Na autorisatie van de richtlijn door een beroepsvereniging, wordt de richtlijn gezien als deel van de ‘professionele standaard'. Aangezien de aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt', kunnen zorgverleners op basis van hun professionele autonomie waar nodig afwijken van de richtlijn. Afwijken van richtlijnen kan in bepaalde situaties zelfs noodzakelijk zijn. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
