Erfelijke spasticiteit
Uitgangsvraag
In hoeverre is de kennis over behandeling met botulinetoxine injecties, intrathecale baclofenbehandeling, en chirurgische behandelingen bij verworven cerebrale en spinale spasticiteit van toepassing bij volwassenen met erfelijke spasticiteit (HSP)? En zijn er voor deze doelgroep nog aanvullende overwegingen om tot behandelkeuzes te komen?
Aanbeveling
Behandel HSP in veel gevallen gelijk aan andere vormen van het Upper Motor Neuron (UMN) syndroom. Hieronder volgen specifieke aandachtspunten voor HSP.
Geef botulinetoxine type A (BoNT-A) injecties als eerste-keus-behandeling aan volwassenen met HSP en hinderlijke spasticiteit met een (multi-)focaal karakter. Het betreft vaak bilaterale behandeling van spieren in de posterieure onderbeenloge, heupadductoren, m. rectus femoris en/of hamstrings. Doseringen en behandelintervallen zijn doorgaans gelijk aan andere vormen van UMN-syndroom. BoNT-A injecties kunnen ook aanvullend aan intrathecale baclofen en na eventuele chirurgische interventies worden ingezet om resterende focale spasticiteit te behandelen. Zie ook de module Botulinetoxine.
Overweeg multidisciplinair de behandeling met intrathecale baclofen (ITB) bij volwassenen met HSP bij wie:
- de spasticiteit zodanig toegenomen of uitgebreid is dat focale spasmolyse onvoldoende effect geeft;
- of wanneer herhaalde injecties te belastend zijn (of worden).
Start voorafgaand aan ITB altijd een proeftraject ter beoordeling van (on)gewenst verlies van sta- of loopvaardigheid, bij voorkeur middels continue infusie door een extracorporele pomp. Hiermee kunnen zeer lage baclofenconcentraties (2,5-5 μg/ml) getest worden. Bolusinjecties kunnen bij HSP-patiënten snel leiden tot een te sterke respons met verlies van functionaliteit. Na pompimplantatie moet (opnieuw) de optimale dosering worden gezocht. Deze ligt bij lopende HSP-patiënten meestal < 100 μg/dag. Blijf de juiste dosering monitoren in de loop der tijd gezien de progressiviteit van HSP.
Overweeg selectieve neurectomie van de n. obturatorius en/of n. tibialis bij volwassenen met HSP die, respectievelijk, ernstig scharen vanuit de heupen en/of spastische enkel-voetdeformiteiten hebben met een nadelige impact op de sta- of loopvaardigheid of het zitcomfort. Baseer de indicatiestelling mede op een selectief zenuwblok met een lokaal anestheticum om het effect van de neurectomie beter te kunnen voorspellen.
Stel de indicatie voor een orthopedische interventie bij volwassenen met HSP die structurele enkel-voetdeformiteiten en/of holvoeten hebben ontwikkeld, waarbij er sprake is van nadelige impact op de sta- of loopvaardigheid of het zitcomfort. Ossale ingrepen verdienen in het algemeen de voorkeur boven weke-delen interventies gezien de progressiviteit van HSP. Stel bij een positieve indicatie deze chirurgie niet onnodig uit, gezien het risico op toenemend verlies van spierkracht en algehele conditie als gevolg van ziekteprogressie. Zie voor aanvullende algemene overwegingen de module Chirurgische behandelingen aan de bovenste en onderste extremiteit.
Overwegingen
Algemeen
Klinisch wordt (pure) HSP gekarakteriseerd door een combinatie van spasticiteit (verhoogde spiertonus) en parese (krachtsvermindering) in de benen. Dit is vergelijkbaar met andere vormen van Upper Motor Neuron (UMN)-syndroom (bijv. CVA, dwarslaesie, MS), maar er zijn ook verschillen. De belangrijkste klinische verschillen zijn:
- Hyperreflexie en hypertonie: Bij patiënten met HSP valt op dat de reflexontremming (hyperreflexie en hypertonie) vaak relatief ernstig is in vergelijking met de mate van krachtsvermindering, zeker in de vroege fasen van de aandoening.
- Motorische selectiviteit: Andere vormen van UMN-syndroom gaan vaak gepaard met onvermogen om individuele spiergroepen selectief aan te spannen, bijv. enkel dorsaalflexoren. Bij mensen met HSP blijft de selectieve aansturing van de beenspieren juist relatief lang intact, hoewel deze wel (sterk) vertraagd kan zijn.
- Sensibiliteit: bij HSP blijft de sensibiliteit relatief gespaard, in tegenstelling tot de meeste vormen van UMN-syndroom (b.v. CVA, dwarslaesie, MS). Toch gaat HSP vaak wel gepaard met een verminderde propriocepsis c.q. dieptesensibiliteit door retrograde axonale degeneratie van de achterstrengen.
- Progressiviteit: Bij HSP is het zeker dat de mechanismen die aan de aandoening ten grondslag liggen heel divers, maar altijd progressief zijn.
Bovengenoemde klinische verschillen hangen waarschijnlijk samen met het feit dat bij veel vormen van UMN-syndroom een deel van de corticospinale verbindingen afsterft, en dus geen functie meer kan uitoefenen in bijv. de benen. Daartegenover staat dat bij HSP alle corticospinale banen geleidelijk minder (snel) gaan geleiden, vooral de langste banen naar de benen, door een proces van retrograde axonale degeneratie. Dit betekent dat de beenspieren nog wel kunnen worden aangestuurd, maar (veel) trager en gehinderd door ontremde reflexen. Door deze verschillen is het onzeker in hoeverre de kennis over behandeling met botulinetoxine injecties, intrathecale baclofenbehandeling, en chirurgische behandelingen bij verworven cerebrale en spinale spasticiteit van toepassing is bij volwassenen met HSP.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor HSP ontbreekt vrijwel altijd gecontroleerd, vergelijkend onderzoek naar behandelmethodes en bovendien gaat het om een klein aantal studies. Om deze reden biedt de literatuur onvoldoende houvast voor bewijs betreffende interventies die als standaardzorg worden toegepast in Nederland en internationaal. Er zijn op basis van mechanistische kennis echter geen redenen om aan te nemen dat injecties met BoNT-A, ITB, of chirurgische interventies bij HSP-patiënten wezenlijk anders zouden uitpakken dan bij mensen met bijvoorbeeld een beroerte of een dwarslaesie. Toch is een aantal aanvullende overwegingen bij deze doelgroep van belang, temeer daar het gaat om een heterogene groep (zeer) zeldzame aandoeningen die bovendien (in wisselende mate) progressief zijn.
Botulinetoxine (BoNT-A)
De grootste studie naar BoNT-A behandeling bij HSP betreft de Spastox trial, een cross-over RCT naar de effecten van bilaterale BoNT-A injecties in de m. adductor magnus en de m. triceps surae (Diniz de Lima, 2021). Deze studie vond, behoudens een tonusreductie in de heupadductoren, geen veranderingen in de maximale loopsnelheid (primaire uitkomst), comfortabele loopsnelheid, spierkracht, vermoeidheid, pijn, of subjectief ervaren verbeteringen hierin. Een belangrijk bezwaar van deze studie is echter dat patiënten niet werden geselecteerd op basis van hun klachtenpatroon en/of lichamelijk en/of functioneel onderzoek, maar allemaal dezelfde (ongerichte) behandeling kregen. Bovendien was er geen sprake van vooraf gestelde behandeldoelen, werden de injecties gegeven op basis van palpatie (dus zonder geleiding op basis van echografie of elektrostimulatie), en met een relatief lage dosis. De validiteit van deze RCT kan derhalve ter discussie worden gesteld (zie commentaar door Nonnekes en Geurts, 2021). Drie kleinere, prospectieve cohortstudies (Rousseaux, 2007; de Niet, 2015; van Lith, 2019) die gericht patiënten hebben geïncludeerd en geïndividualiseerd hebben behandeld op basis van hinderlijke spasticiteit vonden wél een verbetering van de comfortabele loopsnelheid van ca. 7-9% in de periode 2 tot 4 maanden na de injecties, naast een duidelijke spiertonusreductie in alle behandelde spiergroepen. Deze resultaten zullen in grotere, gerandomiseerde studies moeten worden bevestigd t.a.v. de specifieke meerwaarde van botulinetoxine en de klinische relevantie van de tonusverlagende effecten op balans- en loopvaardigheidsniveau.
In de ervaring van de werkgroep vormen intramusculaire BoNT-A injecties een eerste stap in de behandeling van hinderlijke (multi-)focale spasticiteit bij HSP. BoNT-A doseringen en behandelintervallen zijn doorgaans gelijk aan die bij andere vormen van UMN-syndroom. De belangrijkste doelspieren betreffen de heupadductoren (in het bijzonder de m. gracilis, m. adductor magnus, en m. adductor longus), de m. rectus femoris, de hamstrings en de posterieure onderbeenspieren (in het bijzonder de m. triceps surae, m. tibialis posterior, en teenflexoren) (Paparella, 2020). BoNT-A injecties dienen – zoals bij alle doelgroepen – altijd te worden gecombineerd met een vorm van actieve of passieve oefentherapie. Dagelijkse rekoefeningen zijn van groot belang om de spierlengte van spastische spiergroepen te behouden en op lange termijn contracturen en de noodzaak tot chirurgisch ingrijpen te voorkómen. BoNT-A injecties kunnen op deze wijze ook een belangrijk preventief effect hebben dat in de literatuur niet is onderzocht.
Intrathecale baclofenbehandeling (ITB)
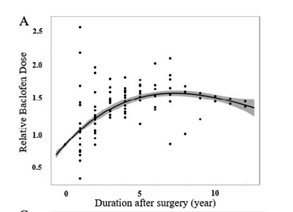
Al in 2015 werd in een consensus van de Interdisciplinaire Werkgroep voor Bewegingsstoornissen in Duitsland gesteld dat ITB een wijdverbreide behandelmethode is voor volwassenen en kinderen met spasticiteit van spinale of supraspinale origine (Dressler, 2015). Volgens deze consensus zou dit altijd moeten gebeuren op basis van interdisciplinaire indicatiestelling en begeleiding (waarbij o.a. de neuroloog/revalidatiearts/kinderarts, neurochirurg, en fysiotherapeut/ergotherapeut zijn betrokken). De typische dosering bij mensen met HSP is volgens deze consensus “relatief laag”, zonder dat hiervoor een nadere specificatie wordt gegeven. Toename van spasticiteit in de loop der tijd kan een verhoging van de dosering noodzakelijk maken, maar ook het omgekeerde kan het geval zijn: een verlaging van de dosering bij toename van krachtsverlies in de benen. In een recente publicatie (Kimoto, 2023) – gericht op dosisaanpassing in de tijd – werd voor HSP (20/21 lopende patiënten) een U-vormig doseringspatroon gevonden (zie figuur 1; op tijdstip 0 is de initiële individuele dosering genormaliseerd op 1.0). De gemiddelde absolute initiële baclofendosering was 65,3 μg/dag. Deze klom op tot 103,4 μg/dag na 3 jaar, om daarna min of meer stabiel te blijven tot 8 jaar na implantatie. Daarna was er een trend tot afname van de dosering. In de loop der jaren werd bij verschillende patiënten de ITB gestopt (zie figuur; minder stippen na 8 jaar).
Figuur 1. Relatieve jaarlijkse verandering in baclofendosering t.o.v. de initiële dosis (genormaliseerd naar “0”) bij patiënten met HSP (initiële N = 21).
Na verloop van tijd zijn er steeds minder patiënten die ITB continueren, waarbij na 8 jaar ook een trend tot afnemende dosering wordt gezien (Kimoto, 2023)
In de ervaring van de werkgroep is de optimale dosering bij lopende patiënten zelden hoger dan 100 μg/dag. Door de progressie van de aandoening is het van belang de optimale dosering nauwkeurig te vervolgen in de tijd. ITB is primair bedoeld voor matige tot ernstige gegeneraliseerde spasticiteit. Indien de ITB-dosering niet verder kan worden opgehoogd door hinderlijk krachtsverlies en/of verlies van sta- of loopvaardigheid én indien zich dan nog steeds hinderlijke symptomen van spasticiteit voordoen, is het een optie om ITB te combineren met focale behandeling, zoals BoNT-A injecties en chirurgische interventies.
Chirurgische interventies
Van belang bij alle chirurgie is dat, naast de biomechanische en neurofysiologische effecten, ook de impact van de noodzakelijke post-operatieve immobilisatie op het motorisch functioneren wordt meegewogen bij de indicatiestelling. Deze kan aanzienlijk zijn bij mensen met nog slechts een marginale sta- of loopvaardigheid. Dit is een belangrijke reden om – bij een gestelde indicatie – niet te lang te wachten met de daadwerkelijke interventie, gezien het progressieve karakter van HSP dat invloed heeft op het weerstandsvermogen om te herstellen van de operatie.
In de module Chirurgische behandelingen aan de bovenste en onderste extremiteit wordt gesteld dat alle chirurgische interventies bij mensen met cerebrale en spinale spasticiteit moeten geschieden op basis van interdisciplinaire diagnostiek (revalidatiearts, chirurg, paramedicus) en moeten worden verricht in een behandelcentrum met ruime ervaring met dergelijke ingrepen. Dit geldt nog meer voor de doelgroep HSP, gezien de lage incidentie, de juiste inschatting van progressiviteit en resterend functioneel weerstandsvermogen, en de complexe overwegingen rond (dikwijls bilaterale) chirurgische interventies.
Neurochirurgische interventies
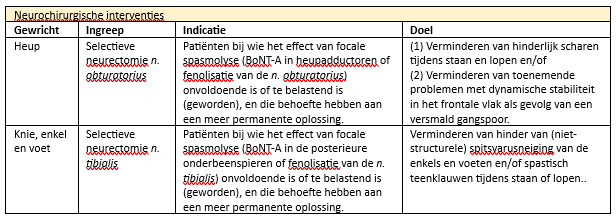
Neurochirurgisch kan een selectieve neurectomie worden uitgevoerd, hoewel hier weinig literatuur over beschikbaar is. Toch is de werkgroep van mening dat deze vorm van behandeling – net als bij andere vormen van Upper Motor Neuron syndroom (UMN) – kan worden overwogen bij HSP-patiënten. Zie tabel 2 voor de mogelijke neurochirurgische interventies bij HSP.
Een selectieve neurectomie dient altijd te worden voorafgegaan door een selectief proefblok met een lokaal anestheticum om het effect van de neurectomie beter in te kunnen schatten, zowel vanuit het perspectief van de behandelaar als dat van de patiënt en familie/verzorgers (zie voor meer details over de indicatiestelling in module Chirurgische behandelingen aan de bovenste en onderste extremiteit).
Tabel 2. Neurochirurgische interventies bij HSP
Orthopedisch-chirurgische interventies
I. Hinderlijk scharen of smal gangspoor
Tenotomie van de heupadductoren ter vermindering van hinderlijk scharen of smal gangspoor is een operatie die bij volwassenen met HSP in Nederland maar weinig wordt toegepast. Vrijwel altijd volstaat focale spasmolyse door middel van BoNT-A injecties of door fenolisatie, of selectieve neurectomie van de n. obturatorius. Tezamen met dagelijkse rekoefeningen kunnen ernstige contracturen meestal worden voorkomen, waardoor orthopedische chirurgie niet nodig is.
II. Spits(-varus)deformatie
Daarentegen is orthopedische chirurgie regelmatig geïndiceerd bij spits-varusdeformatie van de enkels en voeten. Spits-varusdeformatie gaat vaak gepaard met sleepneiging, klauwtenen, overbelasting van de laterale voetrand en met instabiliteit van de achtervoet, waardoor zwikneiging en balansproblemen ontstaan, alsmede drukproblemen en pijnklachten aan de laterale voetrand tijdens belasten. Een structurele spits-varusdeformatie kan alleen met een operatieve ingreep gecorrigeerd worden. Hierbij kan voor HSP hetzelfde indicatiealgoritme worden gehanteerd als besproken in de module Chirurgische behandelingen aan de bovenste en onderste extremiteit. In dit algoritme worden naast weke-delen interventies van de Achillespees, de pezen van m. tibialis posterior/anterior en de pezen van de teenflexoren, ook ossale interventies besproken, vooral ter correctie van pes varus. Bij HSP kunnen deze orthopedische interventies volgens dezelfde principes als bij andere vormen van UMN-syndroom worden toegepast. Waar mogelijk verdienen ossale interventies de voorkeur, gezien het progressieve karakter van HSP.
De ervaring leert dat bij een spitsdeformatie achillespeesverlenging niet alleen de lengte herstelt van het spier-peescomplex, maar vaak ook een belangrijke vermindering geeft van de kuitspasticiteit. Het kan dus ook geïndiceerd zijn bij ernstige kuitspasticiteit die onvoldoende reageert op focale spasmolyse, bijvoorbeeld door bijkomende niet-neurogene stijfheid. De besproken case studie (Nonnekes, 2021) maakt duidelijk dat achillespeesverlenging bij voorkeur moet worden verricht bij nog goede kuitspierkracht en motorische selectiviteit en dat – omgekeerd – voorzichtigheid met deze ingreep geboden is bij mensen met ernstige kuitzwakte. In dit laatste geval (indien men niet meer staande op 1 been, met balanssteun, de hiel van het standbeen met eigen kuitspierkracht goed van de grond kan brengen) verdient bij spits-varusdeformatie een zogenoemde Lambrinudi triple arthrodese de voorkeur. Hierbij wordt zowel de structurele varus gecorrigeerd (triple arthrodese) alsook de structurele equinus, doordat er ook een ossale wig uit de talus en calcaneus wordt gezaagd.
III. Holvoeten en teenklauwen
Bij sommige patiënten met HSP zien we ontwikkeling van holvoeten, zeker als er sprake is van bijkomende perifere polyneuropathie die de intrinsieke voetspieren verzwakt. Holvoeten gaan gepaard met een diepe positie van de MTP-gewrichten. Deze diepe MTP-positie bevordert overstrekking in de MTP-gewrichten, hetgeen eventueel aanwezig spastische teenklauwen versterkt. Andersom dwingt het spastisch klauwen van de tenen de metatarsalia naar plantair. Dikwijls treedt de diepstand het meest prominent op in de 1e straal. Een rigide, niet corrigeerbare diepstand van os metatarsale 1 kan het gevolg zijn. In staande positie dwingt deze diepstand de achtervoet in een varusstand. Bij structurele holvoeten bestaat een indicatie tot chirurgische correctie van midden- en voorvoet in de vorm van een oprichtingsosteotomie van de metatarsus in combinatie met correctie van klauwtenen. Daarbij worden de strekpezen verlengd, verplaatst of doorgenomen.
De hierboven genoemde neurochirurgische en orthopedische interventies voor spastische heupadductoren en voor pes equinovarus kunnen bij HSP-patiënten ook van nut zijn om het zitcomfort te verbeteren, vooral als zij voor een groot deel rolstoelgebonden zijn, of om problemen met de zelfverzorging of andere ADL te verminderen, zoals het verbeteren van transfers of beschoeibaarheid.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De voorkeuren van HSP-patiënten en hun familie of verzorgers spelen een grote rol bij de indicatiestelling voor invasieve interventies. Chirurgische interventies zijn in beginsel onomkeerbaar; de functionele effecten ervan kunnen dus niet zomaar worden teruggedraaid. Dit geldt niet voor ITB met pompimplantatie, omdat hierbij de dosering kan worden afgebouwd tot nul en de pomp eventueel kan worden verwijderd. BoNT-A injecties zijn in dit opzicht het meest laagdrempelig, omdat bij ongewenste uitkomsten de effecten vrijwel altijd al na ca. 3 tot 4 maanden zullen zijn verdwenen. Om die reden zijn BoNT-A injecties bij volwassenen met HSP, naast eventueel orale medicatie voor systemische symptoomreductie, de eerste stap in de behandeling van hinderlijke spasticiteit met een (multi-)focaal karakter (zie ook de module Botulinetoxine). De keuze wordt gemaakt op basis van shared decision making, waarbij patiënten en/of hun familie/verzorgers zo goed mogelijk moeten worden geïnformeerd over de werking van de te behandelen spieren en van BoNT-A: zo kunnen zij meedenken en beslissen over de beoogde functionele doelen, welke spieren behandeld worden, de dosering, en het optimale tijdsinterval tot de volgende behandeling.
Eventuele vervolgstappen richting ITB of chirurgie moeten in de loop van het ziektebeeld steeds worden overwogen op basis van klachtenpatroon, lichamelijk onderzoek en functioneel onderzoek. Voor ITB is de indicatie vaak een zodanige toename of uitbreiding van spasticiteit dat deze niet (meer) afdoende met focale spasmolyse kan worden behandeld, of dat herhaalde injecties te belastend zijn (of worden) (zie ook de module Intrathecale Baclofen). Zoals hierboven vermeld moet in de loop der tijd ook goed worden gecontroleerd of de ITB dosering nog effectief is, en of deze moet worden opgebouwd of juist afgebouwd. Hiervoor moeten de zorgverleners in de chronisch ambulante nazorg goed worden opgeleid. Wat betreft een indicatie voor chirurgie gaat het vooral om de ontwikkeling van ernstig scharen vanuit de heupen of van structurele enkel-voetdeformiteiten die een blijvende, nadelige impact hebben op de sta- en loopvaardigheid of het zitcomfort (zie ook de module Chirurgische behandelingen aan de bovenste en onderste extremiteit). De stappen richting ITB of chirurgie worden altijd genomen op basis van multidisciplinaire besluitvorming samen met de patiënt en/of familie (o.a. revalidatiearts, chirurg, paramedicus, anesthesioloog).
Kosten / middelenbeslag
De functionele verbetering en symptoomreductie die bovengenoemde interventies kunnen opleveren rechtvaardigen de (beperkte) kosten ervan. Er bestaan in de literatuur geen kosten-effectiviteitsstudies voor deze doelgroep, maar er zijn geen redenen om aan te nemen dat deze anders zouden uitpakken dan bij andere vormen van UMN-syndroom.
Gezien het progressieve karakter van HSP is het van belang te benadrukken dat effectieve focale behandeling van spasticiteit tezamen met dagelijkse rekoefeningen de ontwikkeling van contracturen als gevolg van spierverkortingen kan helpen voorkómen, en dus de noodzaak tot orthopedisch ingrijpen in een later stadium. In het geval van structurele enkel-voetdeformiteiten leidt orthopedisch ingrijpen overigens tot een besparing op het verstrekken van vaak dure, levenslange voorzieningen zoals orthopedisch schoeisel.
Aanvaardbaarheid, haalbaarheid en implementatie
Alle hierboven genoemde interventies blijken in de praktijk goed uitvoerbaar en worden op waarde geschat door HSP patiënten en hun familie/verzorgers (Kerstens, 2023). Ook al is de literatuur beperkt, genoemde interventies vormen de hoeksteen van de behandeling van hinderlijke spasticiteit bij volwassenen met HSP, naast gerichte oefentherapie (o.a. spierrekoefeningen) en eventuele orale medicatie voor systemische symptoomreductie.
Onderbouwing
Achtergrond
The literature on cerebral and spinal spasticity in adults predominantly focuses on acquired conditions such as stroke (CVA), multiple sclerosis (MS), and spinal cord injury. Consequently, these populations receive the most attention in this guideline. However, there is an important subgroup that is underrepresented in the literature: adults with hereditary spasticity, in particular the group of disorders classified under the term Hereditary Spastic Paraplegia (or Paraparesis) (HSP).
HSP is a collective designation for now over 100 known genetic defects that can, via diverse pathophysiological mechanisms, lead to impaired function primarily of the corticospinal tracts. The estimated incidence is approximately 1 in 5,000 live births, which meets the criteria for a rare disease. Clinically, a distinction is made between “pure HSP” and “complex HSP”:
- Pure HSP: Symptoms are limited to regions below the umbilicus, affecting mainly the lower extremities and bladder function.
- Complex HSP: Symptoms may also occur above the umbilical level (e.g., impairments in arm motor function, speech, cognition, vision, or hearing), and/or include motor symptoms beyond paresis or spasticity (e.g., ataxia, dystonia).
This module is confined to the discussion of pure HSP (hereafter referred to simply as “HSP”). The scope is further narrowed to focus on three invasive interventions that are commonly employed in clinical practice for this patient group:
(a) intramuscular injections with botulinum toxin type A (BoNT-A),
(b) intrathecal baclofen therapy (ITB), and
(c) surgical interventions.
Samenvatting literatuur
Botulinetoxine bij HSP
In een recente systematische review (Faccioli, 2023) werden diverse interventies geanalyseerd om het lopen bij mensen met HSP te verbeteren, met een accent op intramusculaire injecties met BoNT-A. Een zevental studies werd geïncludeerd dat het effect onderzocht van BoNT-A injecties, alle bij volwassen patiënten, overwegend met pure HSP (zie tabel 1).
Tabel 1. Overzicht geïncludeerde studies over BoNT-A injecties bij HSP in Faccioli (2023)
|
Auteur |
Design |
Populatie (n) |
Behandelde spieren |
Overige behandelingen |
|
Rousseaux |
Prospectief cohort |
15 |
mm. soleus, gastrocnemius, tibialis posterior, flexor digitorum longus, adductor longus, adductor magnus |
Fysiotherapie thuis |
|
De Niet |
Prospectief cohort |
15 |
m. triceps surae |
Zelf-rekoefeningen van de behandelde spieren |
|
Marvulli |
Retrospectief cohort |
10 |
m. adductor magnus, mm. gastrocnemius medialis en lateralis, m. soleus |
Fysiotherapie thuis |
|
Servelhere |
Prospectief cohort |
33 |
beenspieren |
- |
|
Van Lith |
Prospectief cohort |
25 |
mm. gracilis, adductor magnus, adductor longus |
Zelf-rekoefeningen van de behandelde spieren |
|
Paparella |
Retrospectief cohort |
18 |
hamstrings, adductoren, m. rectus femoris, mm. gastrocnemii |
Intensieve fysiotherapie in het ziekenhuis |
|
Diniz de Lima |
Cross-over RCT |
55 |
m. triceps surae, m. adductor magnus |
Fysiotherapie thuis |
Alle studies lieten een afname zien van de modified Ashworth score in de behandelde spieren. Na 4-5 maanden waren deze effecten terug op het uitgangsniveau. Tevens werd er een toename van het bewegingsbereik (ROM) gevonden in de vorm van meer enkeldorsaalflexie, knieflexie en heupabductie in een periode van 3 maanden na de injecties. In 19 van de 170 patiënten werden bijwerkingen opgemerkt, zoals krachtsvermindering, tijdelijke pijn, en verminderde loopkwaliteit. Van de vier studies die loopsnelheid onderzochten, toonden drie een toename in comfortabele loopsnelheid van 7-9% ca. 2 maanden na de injecties. In het algemeen werden geen aanvullende functionele veranderingen geobserveerd op klinische schalen (zoals de Berg Balance Scale, Timed Up & Go, 6-min Walk Test, ABC confidence scale, Functional Ambulation Categories, Rivermead Mobility Assessment, of op het gebruik van loophulpmiddelen). Bij dynamische posturografie werden evenmin verbeteringen gevonden in het sagittale vlak (De Niet, 2015), maar wel in het frontale vlak indien patiënten konden anticiperen op de richting van de balansverstoring (Van Lith, 2019). Verder keek één studie naar gangbreedte (primaire uitkomst) na injecties van de heupadductoren, waarbij een verbetering van 12.6%, dus een vermindering van het scharen vanuit de heupen, werd gevonden (Van Lith, 2019).
Intrathecale baclofen bij HSP
In een recente systematische review (Viana Pinto, 2024) werden 6 studies besproken (een mix van retrospectief en prospectief observationele designs), waarin totaal 50 volwassen HSP-patiënten werden geïncludeerd (tijd sinds diagnose 5-30 jaar). Alle patiënten ondergingen een pre-implantatie ITB test middels bolusinjectie(s) of continue infusie via een naar extern getunnelde katheter aangesloten op een uitwendige pomp. Definitieve pompimplantatie werd gebaseerd op symptomatische en/of functionele verbetering gedurende de testfase en leidde tot een variabele individuele baclofendosering om een ‘steady state’ te bereiken (gemiddeld 47-122 μg/dag). Hoeveel mensen precies doorgingen voor pompimplantatie wordt niet vermeld, maar in de discussie wordt de pre-implantatie testfase sterk aangeraden “omdat niet iedereen een responder is”. De zes geïncludeerde studies hadden een mediane follow-up van 5.39 jaar (range 0.5 tot28.4) en vonden een significante verlaging van de modified Ashworth score van gemiddeld 2 punten of legden de nadruk op subjectieve verbetering van spasticiteit en/of loopvaardigheid. Enkele studies keken naar objectieve verbetering van het lopen en vonden positieve of neutrale effecten. Omdat het vrijwel altijd om lopende patiënten ging, werd door diverse auteurs het belang van individuele fine-tuning van de baclofendosering benoemd om onwenselijk krachtsverlies en verlies van loopvaardigheid te voorkómen.
In een eerdere publicatie (Klebe, 2005) werd reeds gevonden dat 50% (5 van de 10) van de patiënten met HSP (of sporadische spastische paraplegie (SSP)) op klinische gronden “positieve responders” op intrathecale baclofen waren bij een testdosis van 25-50 μg. Bij de andere helft was dikwijls sprake van teveel krachtsverlies. De auteurs benadrukten dat in het algemeen veel van de patiënten met HSP/SSP een vorm van loopvaardigheid behouden, zelfs in verder gevorderde stadia van de aandoening, en dat het derhalve belangrijk is deze te behouden. Zij zagen bij de testdosis een afname van de Ashworth score, een toegenomen loopsnelheid, een grotere staplengte, en een smaller gangspoor. Met behulp van geïnstrumenteerde gangbeeldanalyse zagen ze bovendien een toename van enkel ROM tijdens de gangcyclus en een toename van knieflexie tijdens de zwaaifase. Echter, het betrof hier een relatief kleine groep en niet alle responders toonden dezelfde karakteristieke verbeteringen bij gangbeeldanalyse.
Chirurgie bij HSP
In de literatuur werd slechts één studie gevonden gericht op orthopedische chirurgie bij HSP. Het betreft een middels 3D-gangbeeldanalyse gedocumenteerde casusbeschrijving (Nonnekes, 2021) naar dubbelzijdige achillespeesverlenging bij een jonge vrouw met HSP (genetische typering: SPG3A) die, ondanks behandeling van spasticiteit in de kuitspieren en de m. tibialis posterior middels herhaalde BoNT-A injecties en intensief rekken, in de loop der tijd structurele spitsvoeten had ontwikkeld. Hiermee liep zij hoog op de tenen en ervoer zij toenemend loopinstabiliteit, verlies van loopefficiëntie en een sterk verminderde loopafstand. Naast bilaterale percutane achillespeesverlenging werd – in verband met pes varus en teenklauwen – tevens bilaterale tenotomie van de m. tibialis posterior en van de teenflexoren (dig. 2-5) uitgevoerd. In vergelijking met vóór de operatie, werd 1 jaar na de operatie een toegenomen spontane loopsnelheid gevonden (+42%, p<.0001) bij bilateraal genormaliseerde enkel-momentcurves en substantieel herstel van maximaal enkelvermogen tijdens de afzet. Tevens was er sprake van 20° toename van enkeldorsaalflexie beiderzijds, normalisatie van kuitspiertonus, en toename van kracht van de voetheffers beiderzijds. De kniestabiliteit bleef behouden. Subjectief was er sprake van een belangrijke toename van loopstabiliteit, loopefficiëntie en loopafstand. De auteurs benadrukken dat achillespeesverlenging bij goed geselecteerde patiënten niet hoeft te leiden tot verzwakking van de kuitspieren, maar dat deze interventie de kuitspieren juist in hun functie kan herstellen. Het succes van de casus werd toegeschreven aan een pre-operatieve combinatie van goede kuitspierkracht, motorische selectiviteit en sensibiliteit.
Zoeken en selecteren
In order to address the primary question, no systematic literature review was conducted, as Hereditary Spastic Paraplegia (HSP) is a rare disease, making it nearly impossible to investigate interventions for spasticity in this patient group with high-level evidence. Consequently, consensus literature and the expertise of the working group were considered.
Referenties
- Diniz de Lima F, Faber I, Servelhere KR, Bittar MFR, Martinez ARM, Piovesana LG, Martins MP, Martins CR Jr, Benaglia T, de Sá Carvalho B, Nucci A, França MC Jr. Randomized Trial of Botulinum Toxin Type A in Hereditary Spastic Paraplegia - The SPASTOX Trial. Mov Disord. 2021 Jul;36(7):1654-1663. doi: 10.1002/mds.28523. Epub 2021 Feb 17. PMID: 33595142.
- Dressler D, Berweck S, Chatzikalfas A, Ebke M, Frank B, Hesse S, Huber M, Krauss JK, Mücke KH, Nolte A, Oelmann HD, Schönle PW, Schmutzler M, Pickenbrock H, Van der Ven C, Veelken N, Vogel M, Vogt T, Saberi FA. Intrathecal Baclofen therapy in Germany: Proceedings of the IAB-Interdisciplinary Working Group for Movement Disorders Consensus Meeting. J Neural Transm (Vienna). 2015 Nov;122(11):1573-9. doi: 10.1007/s00702-015-1425-1. Epub 2015 Jul 16. PMID: 26179478.
- Faccioli S, Cavalagli A, Falocci N, Mangano G, Sanfilippo I, Sassi S. Gait analysis patterns and rehabilitative interventions to improve gait in persons with hereditary spastic paraplegia: a systematic review and meta-analysis. Front Neurol. 2023 Sep 20;14:1256392. doi: 10.3389/fneur.2023.1256392. PMID: 37799279; PMCID: PMC10548139.
- Kerstens HCJW. Smoothening the waves of spasticity: the value of personalized monitoring [Internet]. Nijmegen: Global Academic Press; 2023. Available from: https://www.globalacademicpress.com/ebooks/hans_kerstens/.
- Kimoto Y, Oshino S, Tani N, Hosomi K, Khoo HM, Fujita Y, Miura S, Iwata T, Emura T, Matsuhashi T, Onoda Y, Ishiuchi T, Yanagisawa T, Hirata M, Kishima H. Characteristics of Changes in Intrathecal Baclofen Dosage over Time due to Causative Disease. Neurol Med Chir (Tokyo). 2023 Dec 15;63(12):535-541. doi: 10.2176/jns-nmc.2022-0359. Epub 2023 Sep 23. PMID: 37743509; PMCID: PMC10788484.
- Klebe S, Stolze H, Kopper F, Lorenz D, Wenzelburger R, Deuschl G, Volkmann J. Objective assessment of gait after intrathecal baclofen in hereditary spastic paraplegia. J Neurol. 2005 Aug;252(8):991-3. doi: 10.1007/s00415-005-0792-1. Epub 2005 Mar 14. PMID: 15765194.
- van Lith BJH, den Boer J, van de Warrenburg BPC, Weerdesteyn V, Geurts AC. Functional effects of botulinum toxin type A in the hip adductors and subsequent stretching in patients with hereditary spastic paraplegia. J Rehabil Med. 2019 Jun 18;51(6):434-441. doi: 10.2340/16501977-2556. PMID: 30968942.
- de Niet M, de Bot ST, van de Warrenburg BP, Weerdesteyn V, Geurts AC. Functional effects of botulinum toxin type-A treatment and subsequent stretching of spastic calf muscles: a study in patients with hereditary spastic paraplegia. J Rehabil Med. 2015 Feb;47(2):147-53. doi: 10.2340/16501977-1909. PMID: 25325386.
- Nonnekes J, Geurts A. Letter to the Editor: Randomized Trial of Botulinum Toxin Type A in Hereditary Spastic Paraplegia-The SPASTOX Trial. Mov Disord. 2021 Jul;36(7):1733. doi: 10.1002/mds.28659. PMID: 34302383; PMCID: PMC8361968.
- Nonnekes J, Keijsers N, Witteveen A, Geurts A. Improved Gait Capacity after Bilateral Achilles Tendon Lengthening for Irreducible Pes Equinus Due to Hereditary Spastic Paraplegia: a Case Report. J Rehabil Med Clin Commun. 2021 May 6;4:1000059. doi: 10.2340/20030711-1000059. PMID: 34276903; PMCID: PMC8192886.
- Paparella G, Vavla M, Bernardi L, Girardi G, Stefan C, Martinuzzi A. Efficacy of a Combined Treatment of Botulinum Toxin and Intensive Physiotherapy in Hereditary Spastic Paraplegia. Front Neurosci. 2020 Feb 21;14:111. doi: 10.3389/fnins.2020.00111. PMID: 32153352; PMCID: PMC7046620.
- Rousseaux M, Launay MJ, Kozlowski O, Daveluy W. Botulinum toxin injection in patients with hereditary spastic paraparesis. Eur J Neurol. 2007 Feb;14(2):206-12. doi: 10.1111/j.1468-1331.2006.01617.x. PMID: 17250731.
- van de Venis L, van de Warrenburg BPC, Weerdesteyn V, van Lith BJH, Geurts ACH, Nonnekes J. COVID-19 reveals influence of physical activity on symptom severity in hereditary spastic paraplegia. J Neurol. 2020 Dec;267(12):3462-3464. doi: 10.1007/s00415-020-10016-0. Epub 2020 Jul 7. PMID: 32638108; PMCID: PMC7339095.
- van de Venis L, van de Warrenburg B, Weerdesteyn V, Geurts ACH, Nonnekes J. Gait-Adaptability Training in People With Hereditary Spastic Paraplegia: A Randomized Clinical Trial. Neurorehabil Neural Repair. 2023 Jan;37(1):27-36. doi: 10.1177/15459683221147839. Epub 2023 Jan 25. PMID: 36695288; PMCID: PMC9896539.
- Viana Pinto L, Romeiro I, Gouveia F, Ramalho J, Ribeiro Silva S, Táboas Simões MI, Rodrigues Leal J. Intrathecal baclofen for the management of hereditary spastic paraparesis: a systematic review. Int J Rehabil Res. 2024 Mar 1;47(1):3-9. doi: 10.1097/MRR.0000000000000607. Epub 2024 Jan 20. PMID: 38251093.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 06-01-2026
Beoordeeld op geldigheid : 06-01-2026
De Nederlandse Vereniging van Revalidatieartsen geeft bestuurlijke goedkeuring onder voorwaarde van autorisatie door de ALV van 17 april 2026.
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2023 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met Cerebrale en/of spinale spasticiteit.
Werkgroep
- prof. dr. A.C.H. Geurts (voorzitter), hoogleraar neurorevalidatie, Radboud UMC en Sint Maartenskliniek, namens de Nederlandse Vereniging voor Revalidatieartsen
- drs. A.M.V. Dommisse, revalidatiearts, Isala Klinieken Zwolle, namens de Nederlandse Vereniging voor Revalidatieartsen
- drs. P.J. van Dongen, patiëntvertegenwoordiger bij Hersenletsel.nl
- Dr. M. van Eijk, specialist ouderengeneeskunde, Marnix Medisch B.V., namens Verenso
- dr. J.F.M. Fleuren, revalidatiearts, Jeroen Bosch Ziekenhuis / Tolbrug, ‘s Hertogenbosch, namens de Nederlandse Vereniging voor Revalidatieartsen
- F. van Gorp-Swart, MSc, ziekenhuisapotheker, Diakonessenhuis, Utrecht/Zeist/Doorn, namens de Nederlandse Vereniging voor Ziekenhuisapothekers
- prof. dr. G. Kwakkel, hoogleraar neurorevalidatie, Amsterdam UMC, Amsterdam, namens het Koninklijk Nederlands Genootschap voor Fysiotherapie
- drs. E. Kurt, neurochirurg, Radboud UMC en Canisius Wilhelmina Ziekenhuis, Nijmegen, namens de Nederlandse Vereniging voor Neurochirurgie
- Prof. dr. C.G.M. Meskers, hoogleraar revalidatiegeneeskunde, Amsterdam UMC, Amsterdam, namens de Nederlandse Vereniging voor Revalidatieartsen
- dr. H.A. Moser, anesthesioloog, Radboud UMC, Nijmegen en Care4homecare, Bladel, namens de Nederlandse Vereniging voor Anesthesiologie
- drs. W.P. Polomski, revalidatiearts (gepensioneerd), voorheen in Spaarne Gasthuis, Hoofddorp, namens de Nederlandse Vereniging voor Revalidatieartsen
- drs. M.N. Ruissen-Eversdijk, ergotherapeut en bewegingswetenschapper, Reade, Amsterdam, namens Ergotherapie Nederland
- dr. A.V.C.M. Zeegers, orthopedisch chirurg, Medisch Spectrum Twente, Enschede, namens de Nederlandse Orthopaedische Vereniging
- dr. J.M. Zuidam, plastisch chirurg, Erasmus MC, namens de Nederlandse Vereniging voor Plastische Chirurgie
Klankbordgroep
- P.M. van Lamoen, gepensioneerd, namens Dwarslaesieorganisatie Nederland
- M. Pol, Dwarslaesie Organisatie Nederland, tot september 2024*
- Dr. A.E. Tigchelaar, Dwarslaesie Organisatie Nederland, vanaf september 2024
- Dr. W.J. Kruithof, revalidatiearts, Universitair Medisch Centrum Utrecht
- Dr. I.H. Zaal-Schuller, arts verstandelijk gehandicapten/kaderarts palliatieve zorg
*Overleden
Met ondersteuning van
- Dr. M.L. Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.M.J. van Rooijen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten via secretariaat@kennisinstituut.nl.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Geurts (voorzitter) |
Hoogleraar neurorevalidatie, Radboud UMC, Nijmegen en Sint Maartenskliniek |
|
Geen. |
Geen restricties. |
|
Dommisse |
Revalidatiearts, Vogellanden |
Geen |
Speakerfee bij Ipsen farmaceutica voor:
|
Geen restricties; e-learning en presentaties betreffen de volle breedte van de behandel opties |
|
van Dongen |
Patiëntvertegenwoordiger Hersenletsel.nl |
Deelname andere werkgroepen |
Geen |
Geen restricties. |
|
van Eijk |
Specialist Ouderengeneeskunde, Marnix Medisch B.V |
|
Extern gefinancierd onderzoek over heupfracturen: 1. FITHIP; onderzoek naar valangst bij patienten met heupfractuur 2. GR HIP; onderzoek naar herstel na heupfractuur 3. HIPCARE; onderzoek naar herstel en biomarkers bij heupfractuur |
Geen restricties; De webinars waren gericht op samenwerking specialisten ouderengeneeskunde en revalidatieartsen |
|
Fleuren |
Revalidatiearts, Tolbrug |
Bestuurslid VRA (onbetaald) |
Geen. |
Geen restricties. |
|
van Gorp |
Ziekenhuisapotheker |
Lid werkgroep interacties KNMP |
Geen. |
Geen restricties. |
|
Kwakkel |
Hoogleraar neurorevalidatie, Amsterdam UMC, locatie VUMC |
|
Geen |
Geen restricties. |
|
Kurt |
Neurochirurg, Radboud UMC, Nijmegen |
Geen |
Geen |
Geen restricties. |
|
Meskers |
Revalidatiearts, Amsterdam UMC locatie VUMC |
Geen |
Geen. |
Geen restricties. |
|
Moser |
Anesthesioloog, Radboud UMC, Nijmegen en Care4homecare, Bladel |
Geen |
Geen |
Geen restricties. |
|
Polomski |
Revalidatiearts Spaarne Gasthuis (gepensioneerd vanaf 1 mei 2023). |
Geen |
Lid Adviesraad Merz Benelux, raakt niet aan de modules |
Restrictie ten aanzien van besluitvorming met betrekking tot botulinetoxine |
|
Ruissen-Eversdijk |
Ergotherapeut bij Reade Revalidatie. |
Geen. |
Geen. |
Geen restricties. |
|
Zeegers |
Orthopedisch chirurg, Medisch Spectrum Twente, Enschede (tot 1-6-2025), en UMCG (vanaf 1-6-2025) |
|
Geen. |
Geen restricties. |
|
Zuidam |
Plastisch chirurg, Erasmus MC Rotterdam |
Geen. |
Geen. |
Geen restricties. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Hersenletsel.nl en Dwarslaesie Organisatie Nederland (DON) bij de schriftelijke knelpuntenanalyse. DON heeft een enquête bij hun achterban uitgezet, en knelpunten werden meegenomen in het proces. Het verslag van deze enquête is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. In de werkgroep heeft een vertegenwoordiger van Hersenletsel.nl deelgenomen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Hersenletsel.nl, DON, MS Nederland en Spierziekten Nederland.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase). Uit deze kwalitatieve raming bleek dat er geen grote financiële gevolgen te verwachten zijn.
|
Module |
Uitkomst raming |
Toelichting |
|
Erfelijke spasticiteit |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
Voor meer details over de gebruikte richtlijnmethodologie verwijzen wij u naar de Werkwijze. Relevante informatie voor de ontwikkeling/herziening van deze richtlijnmodule is hieronder weergegeven.