Streefwaarden LDL-C bij behandeling met lipidenverlagende medicatie tot en met een leeftijd van 70 jaar
Uitgangsvraag
Welke streefwaarden van LDL-C dienen te worden gehanteerd bij de behandeling met lipidenverlagende medicatie bij personen tot en met 70 jaar met een (zeer) hoog risico op hart- en vaatziekten?
Aanbeveling
LDL-C-streefwaarden voor patiënten ≤ 70 jaar die met lipidenverlagende medicatie worden behandeld
- Streef naar een LDL-C < 1,8 mmol/L# bij patiënten ≤ 70 jaar met doorgemaakte hart- en vaatziekten.
- Streef naar een LDL-C < 2,6 mmol/L# bij overige patiënten ≤ 70 jaar met een verhoogd risico op hart- en vaatziekten.
De streefwaarden voor mensen > 70 jaar staan beschreven in de module Lipidenverlagende behandeling en LDLc-streefwaarde bij (kwetsbare) ouderen >70 jaar
# Streefwaarden dienen met enige nuance gebruikt te worden; een waarde net boven de streefwaarde kan soms geaccepteerd worden. Het is aan de zorgverlener in overleg met de patiënt te bepalen hoe vér onder de grenzen van 2,6 en 1,8 mmol/L de individuele streefwaarde wordt vastgesteld, afhankelijk van het individuele risico, het verwachte behandelvoordeel en de wens van de patiënt.
* De genoemde leeftijdsgrens is geen absolute grens. Kwetsbaarheid of vitaliteit is niet altijd gebonden aan de leeftijd van de patiënt.
Overwegingen
In epidemiologische cohortonderzoeken vertoont LDL-cholesterol een continue en stabiel-graduele relatie met het risico op cardiovasculaire ziekte, net als in meta-analyses van de data uit gerandomiseerd klinisch onderzoek naar cholesterolverlagende medicatie (Ference, 2017). In meta-analyses die een onderscheid maken naar het type medicatie wordt de relatie tussen bereikt LDL-cholesterol en het risico op hart- en vaatziekten niet beïnvloed door het type medicament (Silverman, 2016).
Meta-analyses naar het effect van statines tonen aan dat er een dosis-afhankelijke relatieve vermindering in het optreden van hart- en vaatziekten bestaat bij verlaging van LDL-C. Elke vermindering van LDL-C met 1,0 mmol/L is bijvoorbeeld geassocieerd met een corresponderende 20 tot 25% reductie in mortaliteit ten gevolge van hart- en vaatziekten (Mihaylova, 2012). De causale en graduele relatie wordt ondersteund door pathofysiologisch en genetisch onderzoek. Uitvoerig experimenteel onderzoek ondersteunt de oorzakelijke relatie tussen LDL-cholesterol en de pathogenese van atherosclerotisch vaatlijden (Boren, 2020). Mendeliaans-randomisatieonderzoek laat zien dat genetische variatie in (en dus levenslange blootstelling aan) LDL-cholesterol) zich rechtlijnig verhoudt tot de hoogte van risico op hart- en vaatziekten (Ference, 2017).
Zoals uit de systematische literatuuranalyse blijkt, ondersteunen diverse gerandomiseerde onderzoeken dat meer intensieve medicamenteuze cholesterolverlaging het risico op hart- en vaatziekten meer doet dalen dan minder intensieve behandeling. Zoals elke behandel-intensificatie gaat intensieve cholesterolverlagende therapie wel gepaard met meer bijwerkingen.
In navolging van vrijwel alle bestaande (inter)nationale richtlijnen en conform de vorige CVRM-richtlijnen wordt ook in deze richtlijn een LDL-cholesterol-streefwaarde gegeven. Ten eerste bieden streefwaarden in de praktijk houvast voor de patiënt en voor de behandelaren. Ten tweede bevat de literatuur ook aanwijzingen dat de afwezigheid van streefwaarden tot lagere adherentie en effectiviteit kan leiden (Wei, 2007). Maar ook, zeker bij lage uitgangswaarden, in overbehandeling kan resulteren (Soran, 2017). Behandeling titreren op basis van een streefwaarde is ook niet minder effectief dan iedereen een hoge dosis voorschrijven (Hong, 2023). Ondanks de relatie tussen de hoogte van het LDL-cholesterol en het risico op hart- en vaatziekten is de hoeveelheid onderzoeksgegevens die extreem lage LDL-waardes ondersteunen beperkt. Dit maakt het moeilijk om een hele lage ondergrens van de LDL-cholesterol streefwaarde aan te bevelen.
Cruciaal is de betekenis die aan streefwaarden moet worden gehecht. Deze waarden geven richting aan het te kiezen beleid, maar dicteren dit niet. Indien intensivering van medicamenteuze therapie om welke reden dan ook ongewenst is, dan kan in overleg met de patiënt met een hogere waarde genoegen genomen worden. Streefwaarden vormen evenmin een rechtvaardiging om elk nieuw en/of kostbaar medicijn daarvoor in te zetten. Elke medicijn dient apart op effectiviteit, veiligheid en kosteneffectiviteit geëvalueerd te worden alvorens kan worden bepaald of en, zo ja, bij welke patiënten dit medicijn kan worden ingezet om streefwaarden te bereiken.
In deze context is het relevant dat in de afrondingsfase van deze richtlijn de vergoedingscriteria voor PCSK9-antistoftherapie verruimd zijn naar alle patiënten met een zeer hoog cardiovasculair risico vanwege vastgestelde hart- en vaatziekten . Naar het oordeel van de werkgroep betekent dit zeker niet dat alle mensen die voor vergoeding van deze medicatie in aanmerking komen automatisch een PCSK9-remmer aangeboden zouden moeten krijgen. Vergeleken met statines zijn er met PCSK9-remmers minder gerandomiseerde trials gedaan en is er een minder uitgebreid en jarenlang bestendigd repertoire aan ondersteunende epidemiologische studies beschikbaar over de (langere-termijn-) effecten en bijwerkingen. Dit rechtvaardigt enige terughoudendheid richting grootschalig gebruik van PCSK9-remmers. Daarbij is de stap naar parenterale therapie aanzienlijk en hangt deze vanzelfsprekend af van de motivatie van de patiënt. Ook is het relevant hoe ver men met orale therapie nog van de streefwaarde verwijderd is en hoeveel winst er met PCSK9-therapie te behalen zou zijn. Gemiddeld lijkt toevoeging van PCSK9-remmers op maximaal (getolereerde) statinebehandeling het risico op ziekte of sterfte door cardiovasculaire oorzaken met 15% te reduceren (Furtado, 2020).
Kortom, het valt niet exact aan te geven bij wie PCSK9-remmers moeten worden aangeboden als toevoeging aan maximale orale cholesterolverlagende therapie. Het is een kwestie van een zorgvuldige afweging van de motivatie, mate van verwijdering van de streefwaarde, de te boeken winst en de nog beperkte informatie over lange termijn effecten en bijwerkingen van deze therapie. Ten tijde van de afronding van deze richtlijn mogen PCSK9-remmers alleen in de tweede lijn worden voorgeschreven, waar ook de meeste patiënten met een extra verhoogd risico worden gezien. Patiënten in de eerste lijn kunnen, afhankelijk van bovenstaande overwegingen, voor PCSK9-remming in aanmerking komen, maar moeten daarvoor nu dus nog worden verwezen. Mocht in de toekomst de voorschrijfrestrictie worden opgeheven, dan zal deze keuze vaker in de eerste lijn moeten worden afgewogen.
Voor een exacte positiebepaling van bempedoïnezuur, een nieuwe orale cholesterolverlagende therapie, is het naar oordeel van de werkgroep nog te vroeg.
De gerandomiseerde klinische trials naar de effecten van cholesterolverlaging op het risico op hart- en vaatziekten waren doorgaans niet gericht op het bepalen van een optimale streefwaarde van de LDL-C-concentratie; in 2019 waren er geen gerandomiseerde trials waarbij twee expliciete streefwaarden werden vergeleken. De respectievelijke streefwaarden van 2,6 en 1,8 mmol/L in de CVRM-richtlijn van 2019 waren daarom vooral pragmatisch gekozen. Voor patiënten met hart- en vaatziekten bestaat recentelijk aanvullend bewijs, verkregen uit de eerste gerandomiseerde klinische trial (RCT) waarbij twee streefwaarden werden vergeleken, namelijk een LDL-C < 1.8 mmol/L versus een LDL-C tussen 2,3 en 2,8 mmol/L. Hieruit blijkt dat een LDL-C-streefwaarde van < 1,8 mmol/L gepaard gaat met een lager relatief risico op hart- en vaatziekten (Amarenco, 2020). Derhalve handhaaft de werkgroep de streefwaarde van < 1,8 voor patiënten tot 70 jaar met doorgemaakte hart- en vaatziekten.
Met deze streefwaarde wijkt de werkgroep af van de European Society of Cardiology richtlijn waarin in een aantal situaties voorgesteld wordt om te streven naar een LDL-C lager dan 1,4 mmol/L. Bij de update van deze module (2023) is uitgebreid gediscussieerd of in Nederland ook voor deze waarde gekozen moet worden. De keuze voor de streefwaarde van < 1,4 mmol/L in de Europese richtlijn blijkt een arbitraire keuze vanuit de argumentatie dat een lager LDL-C altijd beter is. Deze arbitraire streefwaarde had volgens de Europese richtlijn de voorkeur boven het door voorschrijvers en patiënten zelf laten bepalen hoeveel lager dan de (bewezen effectieve) streefwaarde < 1,8 mmol/L het LDL-C moet worden. Omdat het directe bewijs voor een streefwaarde van < 1,4 mmol/L ontbreekt en er evenmin aanwijzingen zijn dat de relatie tussen LDL-C en cardiovasculair risico een ‘knik’ vertoont rondom deze waarde van 1,4 mmol/L, heeft het richtlijncluster CVRM besloten geen aanbeveling voor < 1,4 mmol/L op te nemen. Het staat de zorgverlener vrij om, in overleg met de patiënt, te bepalen hoeveel lager dan 1,8 mmol/L de LDL-C-waarde idealiter zou moeten worden..
De streefwaarden < 2,6 mmol/L en < 1,8 mmol/L zijn derhalve onderdeel van een spectrum waarbinnen de individuele streefwaarde wordt bepaald op basis van het risico op hart- en vaatziekten en in overleg met de patiënt. Tijdens dit gesprek met de patiënt kan de risicotabel zoals die besproken wordt in de module ‘Schatten van het risico op hart en vaatziekten’ gebruikt worden.
In de Europese richtlijn wordt ook het advies gegeven om te streven naar < 1,4 mmol/L bij patiënten met diabetes met ernstige eindorgaanschade (zonder hart- en vaatziekten). Het richtlijncluster CVRM heeft besloten ook voor deze categorie de huidige streefwaarde van < 2,6 mmol/L aan te houden. Het belangrijkste argument om het Europese advies niet over te nemen is het ontbreken van direct bewijs. Ook hier kan, in overleg met de patiënt, besloten worden hoeveel lager dan 2,6 mmol/L gewenst is.
Patiënten met reumatoïde artritis hebben een vergelijkbaar risico op hart- en vaatziekten als patiënten met diabetes en behoren tot een van de risicogroepen bij wie een lagere LDL-c concentratie dan 2,6 mmol/L kan worden nagestreefd. Voor meer informatie over behandeling van hart- en vaatziekten bij reumatoïde artritis (RA) wordt naar de RA modules verwezen.
Voor patiënten boven de 70 jaar zijn de aanbevelingen omtrent lipidenverlagende behandeling beschreven in de module Lipidenverlagende behandeling en LDLc-streefwaarde bij (kwetsbare) ouderen >70 jaar.
Uitsluiting van secundaire oorzaken van dyslipidemie
De aanwezigheid van dyslipidemieën die secundair zijn aan andere aandoeningen moet worden uitgesloten voor het begin van de behandeling, want behandeling van de onderliggende aandoeningen leidt tot verbetering van de dyslipidemie zonder dat er lipidenverlagende medicatie nodig is. Dit geldt vooral voor hypothyroïdie en nefrotisch syndroom. Secundaire dyslipidemieën kunnen ook worden veroorzaakt door roken, overmatig alcoholgebruik, diabetes mellitus, syndroom van Cushing, leveraandoeningen en geneesmiddelen (bijvoorbeeld corticosteroïden). Voor meer informatie wordt naar de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn verwezen.
Onderbouwing
Achtergrond
Lipiden, zoals cholesterol en triglyceriden, circuleren in het bloedplasma als lipoproteïnen, waarbij de lipiden zijn verbonden aan eiwitten (met name apolipoproteïnen). De belangrijkste drager van cholesterol in plasma, LDL-C, is atherogeen. De rol van triglyceriderijke lipoproteïnen bij atherosclerose wordt momenteel nog onderzocht. Zeer hoge concentraties van triglyceriderijke lipoproteïnen kunnen pancreatitis veroorzaken (zie voor meer informatie de richtlijn (Erfelijke) Dyslipidemie in de tweede en derde lijn).
Cholesterol is een van de belangrijkste risicofactoren voor het ontwikkelen van hart- en vaatziekten. Verlaging van cholesterol vermindert de kans op hart- en vaatziekten. De streefwaarden voor LDL-C kunnen voor verschillende groepen patiënten verschillen.
Totaal en low-density lipoproteïnecholesterol
Binnen een breed bereik van concentraties is er een krachtige en gegradeerde positieve associatie tussen totaal-cholesterol en LDL-C enerzijds en het risico op hart- en vaatziekten anderzijds (Bóren, 2020). Die associatie geldt voor zowel mannen als vrouwen en zowel voor personen met- als zonder hart- en vaatziekten.
LDL-C kan rechtstreeks worden gemeten, maar in de meeste onderzoeken en in 40% van de laboratoria wordt LDL-C berekend aan de hand van de Friedewald-formule (Friedewald, 1972):
In mmol/l: LDL-C = totaal cholesterol − HDL-C − (0,45 × triglyceriden)
Veel laboratoria hanteren een triglyceridengrens van 4,5 mmol/l tot waar het LDL-C automatisch wordt berekend. Voor een nadere duiding hoe LDL-C kan worden gemeten verwijzen wij naar de richtlijnmodule Laboratoriumtechnische aspecten bij lipidendiagnostiek van de NVKC
Zeer hoge plasmaconcentraties LDL-C (>95ste percentiel in geslacht/leeftijdscategorie) in combinatie met een familiaire voorgeschiedenis van vroegtijdige hart- en vaatziekten en/of verhoogd cholesterol, en/of klinische kenmerken (peesxanthomen of arcus lipoides bij een leeftijd jonger dan 40 jaar) kunnen verder genetische evaluatie naar Familiaire Hypercholesterolemie rechtvaardigen (zie module Diagnostiek van dyslipidemieën uit de richtlijn (erfelijke) dyslipidemie in de tweede en derde lijn).
Steeds meer laboratoria berekenen en rapporteren automatisch non-HDL-C (= totaal-cholesterol – HDL-C). In grote populaties komt gemiddeld een LDL-C 1,8 mmol/l overeen met non-HDL-C 2,6 mmol/l, en LDL-C 2,6 mmol/l komt gemiddeld overeen met non-HDL-C 3,4 mmol/l (zie ook de modules 2.2.3 Non-HDL-cholesterol en Laboratoriumtechnische aspecten bij lipidendiagnostiek).
Conclusies / Summary of Findings
PICO1 – subgroep patiënten met hart- en vaatziekten ≤70 jaar
|
Hoog GRADE |
Een LDL-C-streefwaarde van <1,8 mmol/L vermindert bij patiënten met een herseninfarct het risico op majeure cardiovasculaire events vergeleken met een streefwaarde van 2,3 – 2,8 mmol/L
Bronnen: Amarenco, 2020 |
|
Laag GRADE |
Een LDL-C-streefwaarde van <1,8 mmol/L bij patiënten met een herseninfarct lijkt het risico op een MI of urgente revascularisatie te verminderen vergeleken met een streefwaarde van 2,3 – 2,8 mmol/L.
Bronnen: Amarenco, 2020 |
|
- GRADE |
Vanwege het ontbreken van gegevens over mogelijke bijwerkingen is het niet mogelijk een conclusie te trekken over het risico op bijwerkingen bij verschillende streefwaarden van LDL-C bij patiënten met een herseninfarct.
Bronnen: - |
PICO2
Hart- en vaatziekten
|
Redelijk GRADE |
Het risico op hart- en vaatziekten bij een intensieve behandeling met lipidenverlagende medicatie is waarschijnlijk lager dan bij een minder intensieve behandeling bij patiënten met hart- en vaatziekten.
Bronnen (A-Z; IDEAL; PROVE-IT; TNT; IMPROVE-IT; FOURIER; ODYSSEY-OUTCOMES; SPIRE-1/2) |
Mortaliteit
|
Laag GRADE |
Het risico om te overlijden ten gevolge van hart- en vaatziekten bij een intensieve behandeling met lipidenverlagende medicatie is mogelijk gelijk aan het risico bij een minder intensieve behandeling bij patiënten met hart- en vaatziekten gedurende de looptijd van de trials (mediane follow-up van 10 maanden tot 6 jaar).
Bronnen (A-Z; IDEAL; TNT; IMPROVE-IT; FOURIER; ODYSSEY-OUTCOMES; SPIRE-1/2) |
Bijwerkingen die resulteren in het stoppen van behandeling
|
Laag GRADE |
Het risico op een bijwerking gedurende de looptijd van de trials (mediane follow-up van 10 maanden tot 6 jaar) is mogelijk hoger bij een intensieve behandeling met lipidenverlagende medicatie dan bij een minder intensieve behandeling bij patiënten met hart- en vaatziekten.
Bronnen (A-Z; IDEAL; PROVE-IT; TNT; IMPROVE-IT; FOURIER; ODYSSEY-OUTCOMES; SPIRE-1/2) |
Samenvatting literatuur
PICO1 – subgroep patiënten met hart- en vaatziekten ≤70 jaar
Beschrijving studies
Amarenco (2020a; TST-trial) onderzocht de waarde van een streefwaarde van LDL-C van <1,8 mmol/L om het risico op hart- en vaatziekten te verlagen bij hoofdzakelijk patiënten met een herseninfarct. In totaal werden 2.148 patiënten geïncludeerd met een gemiddelde leeftijd van 67 (SD 11, bereik: 45 tot 89) jaar. 1.073 patiënten werden aan een streefwaarde van <1,8 mmol/L toegewezen en 1.075 patiënten aan een streefwaarde van 2,3 – 2,8 mmol/L. Op baseline was het gemiddelde niveau van LDL-C 3,5 mmol/L in beide groepen. De keuze voor type statine en dosering was aan de onderzoekers. Drie weken en elke zes maanden na randomisatie werd het LDL-C gemeten en afhankelijk van de uitslag werd de dosering van de statine aangepast of ezetimib toegevoegd. De follow-upduur was 5,3 jaar (mediaan). Over deze periode bereikte de interventiegroep (streefwaarde < 1,8) gemiddeld een LDL-C van 1,7 mmol/L vergeleken met 2,5 mmol/L in de controlegroep (streefwaarde 2,3 – 2,8).
NB: we gebruiken hier de resultaten van de publicatie over de Europese (Franse) studiedeelnemers. De resultaten in deze groep waren vergelijkbaar met die in de totale studiegroep, welke ook Zuid-Koreaanse deelnemers bevatte (Amarenco, 2020b)
Resultaten
1. Majeure cardiovasculaire events
De uitkomstmaat was een samengesteld eindpunt, bestaande uit niet-fataal herseninfarct of beroerte van onbekende oorzaak, niet-fataal myocardinfarct, ziekenhuisopname voor onstabiele angina, gevolgd door urgente revascularisatie van de kransslagader, TIA die dringende revascularisatie van de halsslagader vereist, of cardiovasculaire dood inclusief onverklaarde plotselinge dood. 103 (10%) deelnemers kregen een majeur cardiovasculair event bij een streefwaarde van < 1,8 mmol/L vergeleken met 139 (13%) deelnemers bij een streefwaarde van 2,3 – 2,8 mmol/L (absoluut risicoverschil 3%). Het relatieve risico op een majeur cardiovasculair event was 26% verlaagd bij een streefwaarde van < 1,8 vergeleken met 2,3 – 2,8 mmol/L (HR 0,74 95%BI: 0,57 tot 0,95, geadjusteerd en geanalyseerd met competing risk).
2. Myocardinfarct of urgente coronaire revascularisatie
In totaal kregen 18 (2%) een myocardinfarct of hadden een coronaire revascularisatie nodig bij een streefwaarde van < 1,8 mmol/l. Bij een streefwaarde van 2,3 – 2,8 mmol/L hadden 27 (3%) een myocardinfarct of een coronaire revascularisatie nodig. Het risico was daarmee potentieel 34% verlaagd bij een streefwaarde van < 1,8 mmol/L vergeleken met 2,3 – 2,8 mmol/L (HR 0,66 95%BI 0,37 tot 1,20).
3. Bijwerkingen
Er werden geen gegevens over mogelijke bijwerkingen bij een streefwaarde van < 1,8 mmol/L versus 2,3 – 2.8 mmol/L gerapporteerd.
Bewijskracht van de literatuur
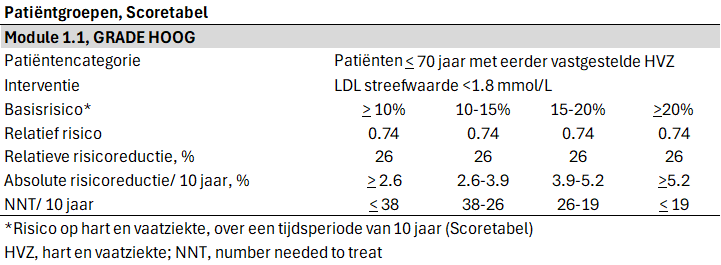
Onderstaande tabel combineert de uit de literatuursamenvatting gevonden relatieve risicoreductie op hart en vaatziekten met het basisrisico van de Scoretabellen, met daarbij de NNTs over een tijdsperiode van 10 jaar.
De bewijskracht start op een hoog niveau vanwege het therapeutische domein van de zoekvraag en dat het uitgevoerde onderzoek een klinische trial betreft.
Majeure cardiovasculaire events: De bewijskracht voor de uitkomstmaat is niet verlaagd.
Myocardinfarct of urgente coronaire revascularisatie: De bewijskracht voor de uitkomstmaat is met twee niveaus verlaagd gezien imprecisie.
Bijwerkingen: De bewijskracht voor de uitkomstmaat is niet beoordeeld vanwege het ontbreken van gegevens.
Beschrijving studies – PICO2
Chan (2011) ondernam een meta-analyse naar het effect van intensieve lipidenverlaging door statines op hart- en vaatziekten bij patiënten met een verhoogd risico op hart- en vaatziekten. RCT’s met ten minste een jaar follow-up kwamen in aanmerking als het intensief verlagen van lipiden werd onderzocht en de LDL-C-streefwaarde in de buurt van 2,1 mmol/L lag. De auteurs doorzochten de databases Medline en Embase tot april 2009.
Nuβbaumer (2016) ondernam een systematische review naar de effectiviteit en veiligheid van ezetimib toegevoegd aan statine op het voorkomen van hart- en vaatziekten bij patiënten met hyperlipidemie en atherosclerose en/of diabetes mellitus. Medline, EMBASE en de Cochrane Library werden tot juli 2015 doorzocht voor relevante artikelen. In totaal kwamen negen RCT’s in aanmerking. Alle RCT’s vergeleken ezetimib (10 milligram) in combinatie met een statine met alleen een statine.
Schmidt (2017) kwantificeerde de korte- en langetermijneffecten van PCSK9-antilichamen op lipidenmarkers en de incidentie van hart- en vaatziekten. De auteurs doorzochten tot mei 2016 CENTRAL, Medline, Embase en Web of Science. Lopende studies werden tijdens de selectie geïdentificeerd, waarvan drie in maart 2017 gepubliceerd waren. Deze studies zijn aan de review toegevoegd. Alleen RCT’s met een follow-up tijd van ten minste 24 weken kwamen in aanmerking. In totaal werden 20 studies geïncludeerd en beschreven. Van deze 20 studies bleken vijf studies alleen gepubliceerd te zijn als een congresabstract en zijn daarom buiten beschouwing gelaten.
Schwartz (2018; ODYSSEY OUTCOMES-trial) onderzocht het effect van een PCSK9-antilichaam op hart- en vaatziekten bij patiënten met acute coronair syndroom. In totaal werden 18.924 patiënten geïncludeerd die 1 tot 12 maanden geleden een acuut coronair syndroom hebben gehad en voldeden aan baseline niveau van LDL-C (>1,8 mmol/L), non-HDL-C (>2,6 mmol/L) of apoB (> 80 mg/dl). Alle patiënten gebruikten statine in een hoge dosering. Patiënten werden 1:1 gerandomiseerd naar een PCSK9-antilichaam of een overeenkomende placebo. Het primaire eindpunt was een samenstelling van overlijden door coronaire hartziekte, niet-fataal myocardinfarct, fatale of niet-fatale herseninfarct of onstabiele angina waarvoor ziekenhuisopname vereist is. De mediane follow-upduur was 2,8 jaar.
Personen zonder hart- en vaatziekten ≤70 jaar
Er zijn geen trials gedaan bij personen zonder hart- en vaatziekten die een intensieve behandeling met lipidenverlagende medicatie vergeleek met een minder intensieve behandeling, met als primaire uitkomst hart- en vaatziekten. UPDATE 2021: geen trials gevonden.
Patiënten met hart- en vaatziekten ≤70 jaar
In totaal evalueerden acht trials het effect van een intensieve behandeling met lipidenverlagende medicatie met een minder intensieve behandeling bij patiënten met hart- en vaatziekten en als primaire uitkomst hart- en vaatziekten hadden. Het ging om de volgende studies: A tot Z-trial, IDEAL-trial, PROVE-IT-trial, TNT-trial, IMPROVE-IT-trial, FOURIER-trial, ODYSSEY-OUTCOMES-trial en SPIRE-1/2-trial. In tabel 1 wordt een overzicht weergegeven van baseline en bereikte LDL-C-waarden.
Tabel 2.4 Overzicht van de LDL-verandering per trial
|
Trial |
Interventie (I) /controle (C) |
N patiënten |
Initieel LDL-C (mmol/l) |
Gemiddelde LDL-C tijdens behandeling (mmol/l) |
|
A-Z |
I: Simvastatine 40 mg, 1m/ 80 mg |
2265 |
2,90 (mediaan) |
1,71 (mediaan) |
|
|
C: placebo, 4m/ simvastatine 20 mg |
2232 |
2,87 (mediaan) |
2,10 (mediaan) |
|
PROVE-IT |
I: Atorvastatine 80 mg |
2099 |
2,74 (mediaan) |
1,60 |
|
|
C: Pravastatine 40 mg |
2063 |
2,74 (mediaan) |
2,46 |
|
IDEAL |
I: Atorvastatine 80 mg |
4439 |
3,14 |
2,07 |
|
|
C: Simvastatine 20 mg |
4449 |
3,14 |
2,58 |
|
TNT |
I: Atorvastatine 80 mg |
4995 |
2,51 |
1,99 |
|
|
C: Atorvastatine 10 mg |
5006 |
2,53 |
2,61 |
|
IMPROVE-IT |
I: Simvastatine 40 mg + ezetimib 10 mg |
9067 |
2,4 |
1,4 |
|
|
C: Simvastatine 40 mg + placebo |
9077 |
2,4 |
1,8 |
|
FOURIER |
I: Evolocumab (background therapy: statin) |
13784 |
2,4 (mediaan) |
0,8 |
|
|
C: Placebo (background therapy: statin) |
13780 |
2,4 (mediaan) |
2,3 |
|
ODYSSEY-OUTCOMES |
I: Alirocumab (background therapy: statin) |
9462 |
2,38 |
1,7 |
|
|
C: Placebo (background therapy: statin) |
9462 |
2,38 |
2,7 |
|
SPIRE-1 |
I: Bococizumab (background therapy: statin) |
8408 |
2,4 |
1,5 |
|
|
C: Placebo (background therapy: statin) |
8409 |
2,4 |
2,4 |
|
SPIRE-2 |
I: Bococizumab (background therapy: statin) |
5312 |
3,5 |
2,3 |
|
|
C: Placebo (background therapy: statin) |
5309 |
3,4 |
3,7 |
Resultaten
1. Hart- en vaatziekten
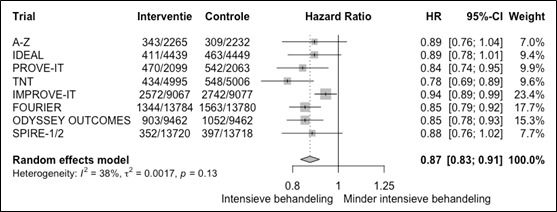
De resultaten van het risico op hart- en vaatziekten bij een intensieve behandeling versus een minder intensieve behandeling staan in figuur 2.5 weergegeven. Gepoold is het risico op een event gedurende follow-up 13% lager bij een intensieve behandeling vergeleken met een minder intensieve behandeling (HR 0,87 95%BI: 0,83 tot 0,91).
Figuur 2.5 Meta-analyse van trials die intensieve behandeling vergeleken met minder intensief bij patiënten met hart- en vaatziekten en het risico op hart- en vaatziekten
Interventie en controle, n/N
2. Mortaliteit hart- en vaatziekten
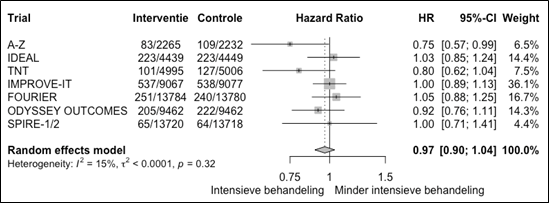
Op één trial na rapporteerden de trials gegevens over mortaliteit van hart- en vaatziekten die een meta-analyse mogelijk maakten. In figuur 2.6 is te zien dat het risico om te overlijden gedurende follow-up bij een intensieve behandeling gelijk is aan een minder intensieve behandeling (HR 0,97 95%BI: 0,90 tot 1,04).
Figuur 2.6 Meta-analyse van trials die intensieve behandeling vergeleken met minder intensief bij patiënten met hart- en vaatziekten en het risico om te overlijden aan hart- en vaatziekten
Interventie en controle, n/N
3. Bijwerkingen die resulteren in het stoppen van behandeling
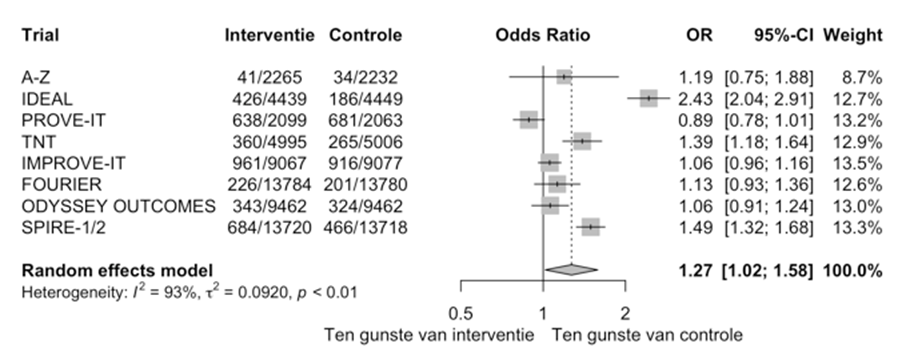
Alle acht trials hebben gegevens gerapporteerd over bijwerkingen die resulteerden in het stoppen met behandeling. Zowel de trialspecifieke resultaten als ook het gepoolde resultaat is in figuur 2.7 weergegeven. De odds ratio voor bijwerkingen resulterend in het stoppen van behandeling was 1,27 (95%BI: 1,02 tot 1,58), waarbij moet worden aangetekend dat het absolute verschil in stoppen met medicatie vanwege bijwerking tussen de intensieve en minder intensieve behandeling laag was. Tevens moet worden aangetekend dat voor deze analyse trials met intensieve statinebehandeling of toevoegen van ezetimib of PCSK9-antilichamen zijn gepoold. Bijwerkingen in de SPIRE1/2 trials hebben ertoe geleid dat bococizumab niet verder wordt ontwikkeld en niet klinisch beschikbaar komt. De gepoolde schatting van bijwerkingen die resulteerden in stoppen van de behandeling zonder het resultaat uit de SPIRE-1/2-trial was OR 1,24 95%BI 0,96 tot 1,59.
Figuur 2.7 Meta-analyse van trials die intensieve behandeling vergeleken met minder intensief bij patiënten met hart- en vaatziekten en het risico op bijwerkingen die resulteren in het stoppen van behandeling
Interventie en controle, n/N
Bewijskracht van de literatuur
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is met een niveau verlaagd vanwege indirectheid (vergelijking tussen intensieve en minder intensieve behandeling met lipidenverlagende medicatie in plaats van streefwaarden voor LDL-C).
Mortaliteit: De bewijskracht voor de uitkomstmaat mortaliteit is met twee niveaus verlaagd gezien imprecisie en indirectheid (vergelijking tussen intensieve en minder intensieve behandeling met lipidenverlagende medicatie in plaats van streefwaarden voor LDL-C).
Bijwerkingen die resulteren in het stoppen van behandeling: De bewijskracht voor de uitkomstmaat bijwerkingen is met twee niveaus verlaagd gezien heterogeniteit (I2 hoger dan 90% en verschil in effectschattingen (drie trials suggereren geen verschil in het risico, een trial een verlaagd risico en vier een verhoogd risico op een bijwerking)) en indirectheid (vergelijking tussen intensieve en minder intensieve behandeling met lipidenverlagende medicatie in plaats van streefwaarden voor LDL-C).
Patiënten met diabetes mellitus zonder hart- en vaatziekten
Verlaging van LDL-C bij patiënten met diabetes mellitus is effectief om het risico op hart- en vaatziekten te verlagen (Kearney, 2008). Er zijn geen trials gedaan bij patiënten met diabetes mellitus zonder hart- en vaatziekten waarbij een intensieve behandeling met lipidenverlagende medicatie is vergeleken met een minder intensieve behandeling, met hart- en vaatziekten als primaire uitkomst. UPDATE 2021: geen trials gevonden.
Patiënten met chronische nierschade
Verlaging van LDL-C bij patiënten met chronische nierschade zonder nierfunctievervangende therapie, is waarschijnlijk effectief om het risico op hart- en vaatziekten te verlagen (Baigent, 2010). Er zijn geen trials gedaan bij patiënten met chronische nierschade waarbij een intensieve behandeling met lipidenverlagende medicatie is vergeleken met een minder intensieve behandeling, met als primaire uitkomst hart- en vaatziekten. UPDATE 2021: geen trials gevonden.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Welke streefwaarde van LDL-C dient te worden gehanteerd bij de behandeling van patiënten met een verhoogd risico op hart- en vaatziekten?
PICO1
P1: patiënten met een verhoogd risico op hart- en vaatziekten;
I1: behandeling onder streefwaarde 1 van LDL-C;
C1: behandeling onder streefwaarde 2 van LDL-C;
O1: morbiditeit en mortaliteit van hart- en vaatziekten, bijwerkingen.
Mocht er weinig of geen trials beschikbaar zijn voor PICO1, zullen er ook studies worden geïncludeerd volgens PICO2, wat indirect bewijs oplevert.
PICO2
P2: patiënten met een verhoogd risico op hart- en vaatziekten;
I2: intensieve lipidenverlagende medicatie
C2: standaard lipidenverlagende medicatie
O2: morbiditeit en mortaliteit van hart- en vaatziekten, bijwerkingen.
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten en bijwerkingen voor de besluitvorming als kritieke uitkomstmaten; en mortaliteit van hart- en vaatziekten voor de besluitvorming als belangrijke uitkomstmaten.
Morbiditeit en mortaliteit van hart- en vaatziekten: De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. Deze definities komen overigens erg vaak overeen.
Zoeken en selecteren (Methode)
Zoekactie – juni 2017
In de databases Medline (via OVID) en Embase (via Embase.com) is op 26 juni 2017 met relevante zoektermen gezocht naar systematische reviews. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 828 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Systematische review van RCT’s met de vergelijking tussen verschillende streefwaarden voor LDL-C met een gedetailleerde zoekstrategie en evidence-tabellen.
Op basis van titel en abstract werden in eerste instantie 29 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 29 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en geen studies definitief geselecteerd. Er zijn geen gerandomiseerde studies gedaan waar specifieke streefwaarden voor LDL-C met elkaar zijn vergeleken.
Echter, er is wel literatuur beschikbaar over het effect van intensieve lipiden-verlaging (zoals hoge dosis atorvastatine (40 of 80 mg) of rosuvastatine (20 of 40 mg) of combinatie van gemiddelde dosis statine en ezetimib of PCSK9-antilichaam) met minder intensieve lipidenverlagende medicatie op morbiditeit en mortaliteit van hart- en vaatziekten. Ondanks dat dit niet voldoet aan de opgestelde PICO, kunnen de resultaten van deze studies wel een deel van de vraag beantwoorden.
Drie systematische reviews konden een deel van de vraag beantwoorden:
- Chan (2011) beschreef de resultaten van een systematische review naar een intensieve behandeling met een hoge dosis statine vergeleken met een normale dosis statine.
- Nuβbaumer (2016) ondernam een systematische zoekactie naar trials die ezetimib in combinatie met statine vergeleken met alleen statine.
- Schmidt (2017) beschreef een systematische review van studies die een behandeling met PCSK9-antilichamen vergeleken met placebo bovenop reguliere behandeling (statine met of zonder ezetimib).
De resultaten van de geïncludeerde trials zijn per trial beschreven. Een additioneel criterium is dat de trials als primaire uitkomst hart- en vaatziekten benoemd moeten hebben.
Update – december 2021
De zoekactie is op 16-12-2021 herhaald met een paar wijzigingen (zie zoekverantwoording voor meer detail). De selectiecriteria zijn hetzelfde gebleven.
Op basis van titel en abstract werden in eerste instantie 38 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 36 studies geëxcludeerd (zie exclusietabel Update 2021 onder het tabblad Verantwoording) en twee studies definitief geselecteerd. Een trial vergeleek twee streefwaarden met elkaar (TST-trial) en een trial onderzocht intensieve lipidenverlagende behandeling versus minder intensieve behandeling (ODYSSEY-OUTCOMES-trial).
Voor de uitwerking van de resultaten wordt er geen onderscheid gemaakt in het type lipidenverlagende medicatie; in de literatuursamenvatting zal alleen over lipidenverlagende medicatie worden gesproken. Zie voor toelichting de tekst bij Overwegingen.
De resultaten zijn per subgroep beschreven. Het gaat om de volgende subgroepen:
- personen zonder hart- en vaatziekten ≤70 jaar;
- patiënten met hart- en vaatziekten ≤70 jaar;
- patiënten met diabetes mellitus zonder hart- en vaatziekten;
- personen met chronische nierschade.
Europese richtlijn Cardiovascular disease prevention in clinical practice (2021)
De Europese richtlijn Cardiovascular disease prevention in clinical practice is in 2021 geüpdatet en gepubliceerd (Visseren, 2021). Bij het herzien van deze module zijn, naast de update van de literatuuranalyse, ook de overwegingen van de Europese richtlijn over LDL-streefwaarde bekeken en besproken. Voor meer detail zie de overwegingen.
Referenties
- Amarenco P, Kim JS, Labreuche J, Charles H, Giroud M, Lee BC, Mahagne MH, Nighoghossian N, Gabriel Steg P, Vicaut É, Bruckert E; Treat Stroke to Target Investigators. Benefit of Targeting a LDL (Low-Density Lipoprotein) Cholesterol <70 mg/dL During 5 Years After Ischemic Stroke. Stroke. 2020 Apr;51(4):1231-1239. doi: 10.1161/STROKEAHA.119.028718. Epub 2020 Feb 20. PMID: 32078484.
- Amarenco P, Kim JS, Labreuche J, Charles H, Abtan J, Béjot Y, Cabrejo L, Cha JK, Ducrocq G, Giroud M, Guidoux C, Hobeanu C, Kim YJ, Lapergue B, Lavallée PC, Lee BC, Lee KB, Leys D, Mahagne MH, Meseguer E, Nighoghossian N, Pico F, Samson Y, Sibon I, Steg PG, Sung SM, Touboul PJ, Touzé E, Varenne O, Vicaut É, Yelles N, Bruckert E; Treat Stroke to Target Investigators. A Comparison of Two LDL Cholesterol Targets after Ischemic Stroke. N Engl J Med. 2020 Jan 2;382(1):9. doi: 10.1056/NEJMoa1910355. Epub 2019 Nov 18. PMID: 31738483.
- Baigent C, Blackwell L, Emberson J, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376:16701681.
- Borén J, Chapman MJ, Krauss RM, Packard CJ, Bentzon JF, Binder CJ, Daemen MJ, Demer LL, Hegele RA, Nicholls SJ, Nordestgaard BG, Watts GF, Bruckert E, Fazio S, Ference BA, Graham I, Horton JD, Landmesser U, Laufs U, Masana L, Pasterkamp G, Raal FJ, Ray KK, Schunkert H, Taskinen MR, van de Sluis B, Wiklund O, Tokgozoglu L, Catapano AL, Ginsberg HN. Low-density lipoproteins cause atherosclerotic cardiovascular disease: pathophysiological, genetic, and therapeutic insights: a consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2020 Jun 21;41(24):2313-2330. doi: 10.1093/eurheartj/ehz962. PMID: 32052833; PMCID: PMC7308544.
- Chan DK, O'Rourke F, Shen Q, et al. Meta-analysis of the cardiovascular benefits of intensive lipid lowering with statins. Acta Neurol Scand. 2011;124(3):188-95. doi: 10.1111/j.1600-0404.2010.01450.x. Epub 2010 Oct 27. PubMed PMID: 20979581.
- Chapman MJ, Ginsberg HN, Amarenco P, et al. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eur Heart J. 2011;32:1345-1361.
- Demacker PN, Toenhake-Dijkstra H, de Rijke YB, Stalenhoef AF, Stuyt PM, Willems HL. On the presumed inaccuracy of the Friedewald formula in hypertriglyceridemic plasma: a role for imprecise analysis? Clin Chem. 1996 Sep;42(9):1491-4. PubMed PMID: 8787712.
- Ference BA, Ginsberg HN, Graham I, Ray KK, Packard CJ, Bruckert E, Hegele RA, Krauss RM, Raal FJ, Schunkert H, Watts GF, Borén J, Fazio S, Horton JD, Masana L, Nicholls SJ, Nordestgaard BG, van de Sluis B, Taskinen MR, Tokgözoglu L, Landmesser U, Laufs U, Wiklund O, Stock JK, Chapman MJ, Catapano AL. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2017 Aug 21;38(32):2459-2472. doi: 10.1093/eurheartj/ehx144. PMID: 28444290; PMCID: PMC5837225.
- Friedewald WT, Levy RI, Fredrickson DS. Estimation of the concentration of low density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem. 1972;18:499-502.
- Giugliano RP, Pedersen TR, Park JG, et al. Clinical efficacy and safety of achieving very low LDL-cholesterol concentrations with the PCSK9 inhibitor evolocumab: a prespecified secondary analysis of the FOURIER trial. Lancet. 2017;390(10106):1962-1971. doi: 10.1016/S0140-6736(17)32290-0. Epub 2017 Aug 28. PubMed PMID: 28859947.
- Hong SJ, Lee YJ, Lee SJ, Hong BK, Kang WC, Lee JY, Lee JB, Yang TH, Yoon J, Ahn CM, Kim JS, Kim BK, Ko YG, Choi D, Jang Y, Hong MK; LODESTAR Investigators. Treat-to-Target or High-Intensity Statin in Patients With Coronary Artery Disease: A Randomized Clinical Trial. JAMA. 2023 Apr 4;329(13):1078-1087. doi: 10.1001/jama.2023.2487. PMID: 36877807; PMCID: PMC9989958
- Kearney PM, Blackwell L, Collins R, et al. Efficacy of cholesterol-lowering therapy in 18,686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet. 2008;371(9607):117-25. doi: 10.1016/S0140-6736(08)60104-X. PubMed PMID: 18191683.
- Mihaylova B, Emberson J, Blackwell L, et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet. 2012;380:581-590.
- Nordestgaard BG, Chapman MJ, Ray K, et al. Lipoprotein(a) as a cardiovascular risk factor: current status. Eur Heart J. 2010;31:2844-2853.
- Nußbaumer B, Glechner A, Kaminski-Hartenthaler A, et al. Ezetimibe-Statin Combination Therapy. Dtsch Arztebl Int. 2016;113(26):445-53. doi: 10.3238/arztebl.2016.0445. PubMed PMID: 27412989; PubMed Central PMCID: PMC4946327.
- Preis SR, Hwang SJ, Coady S, et al. Trends in all-cause and cardiovascular disease mortality among women and men with and without diabetes mellitus in the Framingham Heart Study, 1950 to 2005. Circulation 2009;119:1728-1735.
- Reiner Z, Catapano AL, De Backer G, et al. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) the European Atherosclerosis Society (EAS). Eur Heart J. 2011;32:1769-1818.
- Sarwar N, Danesh J, Eiriksdottir G, et al. Triglycerides and the risk of coronary heart disease: 10,158 incident cases among 262,525 participants in 29 Western prospective studies. Circulation 2007;115:450-458.
- Schmidt AF, Pearce LS, Wilkins JT, et al. PCSK9 monoclonal antibodies for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2017;4:CD011748. doi: 10.1002/14651858.CD011748.pub2. Review. PubMed PMID: 28453187.
- Schwartz GG, Steg PG, Szarek M, Bhatt DL, Bittner VA, Diaz R, Edelberg JM, Goodman SG, Hanotin C, Harrington RA, Jukema JW, Lecorps G, Mahaffey KW, Moryusef A, Pordy R, Quintero K, Roe MT, Sasiela WJ, Tamby JF, Tricoci P, White HD, Zeiher AM; ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018 Nov 29;379(22):2097-2107. doi: 10.1056/NEJMoa1801174. Epub 2018 Nov 7. PMID: 30403574.
- Silverman MG, Ference BA, Im K, Wiviott SD, Giugliano RP, Grundy SM, Braunwald E, Sabatine MS. Association Between Lowering LDL-C and Cardiovascular Risk Reduction Among Different Therapeutic Interventions: A Systematic Review and Meta-analysis. JAMA. 2016 Sep 27;316(12):1289-97. doi: 10.1001/jama.2016.13985. PMID: 27673306.
- Soran H, Adam S, Durrington PN. Are recent statin recommendations to employ fixed doses and abandon targets effective for treatment of hypercholesterolaemia? Investigation based on number needed to treat. Eur J Prev Cardiol. 2017 Jan;24(1):76-83. doi: 10.1177/2047487316667785. Epub 2016 Sep 8. PMID: 27609614.
- Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, Benetos A, Biffi A, Boavida JM, Capodanno D, Cosyns B, Crawford C, Davos CH, Desormais I, Di Angelantonio E, Franco OH, Halvorsen S, Hobbs FDR, Hollander M, Jankowska EA, Michal M, Sacco S, Sattar N, Tokgozoglu L, Tonstad S, Tsioufis KP, van Dis I, van Gelder IC, Wanner C, Williams B; ESC National Cardiac Societies; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021 Sep 7;42(34):3227-3337. doi: 10.1093/eurheartj/ehab484. PMID: 34458905.
- Voight BF, Peloso GM, Orho-Melander M, et al. Plasma HDL cholesterol and risk of myocardial infarction: a mendelian randomisation study. Lancet. 2012;380:572580.
- Wei L, MacDonald TM, Watson AD, Murphy MJ. Effectiveness of two statin prescribing strategies with respect to adherence and cardiovascular outcomes: observational study. Pharmacoepidemiol Drug Saf. 2007 Apr;16(4):385-92. doi: 10.1002/pds.1297. PMID: 16998946.
Evidence tabellen
Evidence-tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Schmidt, 2017
(individual study characteristics deduced from Schmidt, 2017 )
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to May 2016
D: FOURIER S: SPIRE 1/2
Study design: All were RCTs
Setting: For all: outpatient care
Source of funding: All RCTs were funded by pharmaceutical companies.
|
Inclusion criteria SR:
Exclusion criteria SR:
20 studies included, of which five studies were only published as conference abstracts. These studies were excluded. A further 13 were excluded as the primary endpoint was not cardiovascular disease.
Important patient characteristics at baseline:
N, mean age D: 27564 patients, 63 (SD 9) yrs S: 27438 patients, 63 (SD 9) yrs
Sex: D: 75% Male S: 70% Male
History of CVD: D: 27564 (100%) S: 23198 (85%)
Participants with FH: D: NA S: 1072 (4%) |
D: Evolocumab S: Bococizumab
Background therapy: D: Statin therapy S: Statins and/or ezetimib
|
D: Placeb S: Placebo
|
End-point of follow-up:
D: 157 weeks S: 143 weeks
For how many participants were no complete outcome data available? (intervention/control) D: Unclear S: Unclear
|
Outcome measure-1 Defined as LDL
Results on LDL levels were deduced from the individual trial publications
Outcome measure-2 Defined as CVD
Results on CVD were deduced from the individual trial publications
Outcome measure-3 Defined as mortality due to CVD
Results on mortality due to CVD were deduced from the individual trial publications
Outcome measure-4 Defined as adverse events
Results on adverse events were deduced from the individual trial publications
|
S: Many participants were lost to follow-up due to antidrug antibody response |
|
Nusbaumer, 2016
(individual study characteristics deduced from Nusbaumer, 2016 )
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
See the full article for all relevant information https://www-ncbi-nlm-nih-gov.eur.idm.oclc.org/pubmed/27412989
|
|
|
|
|
|
|
|
Chan, 2011
(individual study characteristics deduced from Chan, 2011)
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to April 2009
A: De Lemos, 2004 B: Cannon, 2004 C: Pedersen, 2005 E: LaRosa, 2005
Study design: RCT (parallel)
Setting and Country: Not reported
Source of funding: Not reported for included studies; unclear what kind of funding the review received. |
Inclusion criteria SR:
7 studies included of which 3 were excluded as the primary endpoint was not cardiovascular disease
Important patient characteristics at baseline:
N, mean age A: 4497 patients, 61 yrs B: 4162, 58 yrs C: 8888, 62 yrs E: 10001, 61 yrs
Sex: Not reported
Criteria: A: Post acute coronary syndrome B: Post acute coronary syndrome C: Previous MI E: Clinically evident CHD, LDL<3.4 |
A: Simvastatin 40 mg, 1m/80 mg B: Atorvastatin 80 mg C: Atorvastatin 80 mg E: Atorvastatin 80 mg
|
A: placebo, 4 m/ simvastatin 20 mg B: Pravastatin 40 mg C: Simvastatin 20 mg E: Atorvastatin 10 mg
|
End-point of follow-up:
A: 0.5 to 2 years, median 2.0 years B: 1.5 to 3 years, mean 2 years C: 4.0 to 5.9 years, median 4.8 years E: Median 4.9 years
For how many participants were no complete outcome data available? (intervention/control) Not reported
|
Outcome measure-1 Defined as LDL-concentration, percent change from baseline (%) (mean LDL level during treatment (mmol/l)
A: I: -41.03 (1.71) C: -27.18 (2.10) B: I: -41.61 (1.60) C: -10.22 (2.46) C: I: -34.08 (2.07) C: -17.83 (2.58) E: I: -20.72 (1.99) C: 3.16 (2.61)
Outcome measure-2 Defined as major coronary events*, odds ratio (95%CI)
A: 0.88 (0.75 to 1.03) B: 0.86 (0.74 to 0.99) C: 0.77 (0.70 to 0.85) E: 0.79 (0.68 to 0.91)
Outcome measure-3 Defined as cardiovascular/coronary heart disease deaths, odds ratio (9%CI)
A: 0.74 (0.55 to 0.99) B: 0.78 (0.45 to 1.35) C: 0.98 (0.80 to 1.22) E: 0.79 (0.61 to 1.03)
Outcome measure-4 Defined as treatment discontinuation due to side effects, odds ratios (95%CI)
A: 1.19 (0.75 to 1.88) B: 0.89 (0.78 to 1.01) C: 2.43 (2.04 to 2.91) E: 1.39 (1.18 to 1.64)
|
* Definition of major cardiovascular events was not only an event of CVD, but also deaths.
Authors’ conclusions: In those at high risk of cardiovascular events, intensive lipid lowering with statins to LDL-C level <2.1 mmol/l significantly reduces risk of stroke, major coronary events and CVD or CHD deaths compared to LDL-C level ≥2.1 mmol/l.
Remarks:
|
Risk of Bias tabel
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Schmidt, 2017 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Yes |
|
Nuβbaumer, 2016 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
No |
Yes |
|
Chan, 2011 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Unclear |
Research question: Welke streefwaarde van LDL-C dient te worden gehanteerd bij de behandeling van patiënten met een verhoogd risico op hart- en vaatziekten?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
PICO 1 Cholesterol target |
|||||||
|
Amarenco, 2020 (TST trial) |
Type of study: RCT
Setting and country: France
Funding and conflicts of interest: Industry (unrestricted grants) |
Inclusion criteria:
N total at baseline: Intervention: 1081 (analysed 1073) Control: 1077 (analysed 1075)
Important prognostic factors2: Age ± SD: I: 67 (11) C: 67 (11)
Sex: I: 68% M C: 69% M
LDL-c at baseline (mean): I: 3.5 mmol/L C: 3.5 mmol/L
Groups comparable at baseline? Yes |
LDL cholesterol target of 1.8 mmol/L by use of any type and any dose of statin. 3 weeks after randomization, statin dose was adjusted or other lipid-lowering agents including ezetimibe were added to achieve the assigned LDL cholesterol target.
|
LDL cholesterol target of 2.4 mmol/L by use of any type and any dose of statin.
3 weeks after randomization, statin dose was adjusted or other lipid-lowering agents including ezetimibe were added to achieve the assigned LDL cholesterol target.
|
Length of follow-up: Median 5.3 years
Loss-to-follow-up: Intervention: N = 295 (27%) Reasons (lost to follow-up (62); no signed consent (8); withdrawn consent (121); serious adverse event (2); investigator’s decisions (102))
Control: N = 271 (25%) Reasons (lost to follow-up (49); no signed consent (2); withdrawn consent (108); serious adverse event (3); investigator’s decisions (109))
Incomplete outcome data: Intervention: N = 8 (0.7%) Reasons (no signed consent)
Control: N = 2 (0.2%) Reasons (no signed consent)
|
Outcome measure-1 Defined as major cardiovascular events* (primary outcome)
I: 103 (10%) C: 139 (13%) HR: 0.74 (0.57-0.95), adjusted for entry event (stroke or TIA), time since entry event, sex and age at baseline; HR based on Cox model with competing risk (Finn and Gray model)
Outcome measure-2 Defined is myocardial infarction or urgent coronary revascularisation
I: 18 (2%) C: 27 (3%) HR: 0.66 (0.37-1.20)
Outcome measure-3 Adverse event defined as intracranial hemorrhage
I: 13 (1.2%) C: 11 (1.0%) HR: 1.17 (0.53-2.62)
|
*The primary end point was a composite of adjudicated nonfatal cerebral infarction or stroke of undetermined source, nonfatal myocardial infarction, hospitalization for unstable angina followed by urgent coronary artery revascularization, TIA requiring urgent carotid revascularization, or cardiovascular death including unexplained sudden death. |
|
PICO 2 Intensive cholesterol treatment |
|||||||
|
Schwartz, 2018 (ODYSSEY OUTCOMES trial) |
Type of study: RCT
Setting and country: Multicentre, worldwide
Funding and conflicts of interest: Industry |
Inclusion criteria
N total at baseline: Intervention: 9462 Control: 9462
Important prognostic factors2: Age ± SD: I: 58 (9) C: 58 (9)
Sex: I: 75% M C: 75% M
LDL-c at baseline (mean): I: 2.4 mmol/L C: 2.4 mmol/L
Groups comparable at baseline? Yes |
Alirocumab
|
Matching placebo
|
Length of follow-up: Median 2.8 years
Loss-to-follow-up: Intervention: N = 37 (0%) Reasons (patient did not want to continue (n=23); lost to follow-up (n=9); other reasons (n=5))
Control: N = 49 (1%) Reasons (patient did not want to continue (n=25); lost to follow-up (n=14); other reasons (n=10))
Incomplete outcome data: Every patient included in efficacy analysis
|
Outcome measure-1 Defined as major cardiovascular events* (primary outcome)
I: 903 (10%) C: 1052 (11%) HR 0.85 (0.78 to 0.93)
Outcome measure-2 Defined as death from cardiovascular causes
I: 240 (3%) C: 271 (3%) HR 0.88 (0.74 to 1.05)
Outcome measure-3 Defined as serious adverse event
I: 2202 (23%) C: 2350 (25%) HR not presented
|
* composite of death from coronary heart disease, nonfatal myocardial infarction, fatal or nonfatal ischemic stroke, or unstable angina requiring hospitalization |
Research question: Welke streefwaarde van LDL-C dient te worden gehanteerd bij de behandeling van patiënten met een verhoogd risico op hart- en vaatziekten?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Amarenco, 2020 (TST trial) |
Definitely yes
Reason: From study protocol: “Randomization list has been created by the biostatistician of the clinical research unit of the Bichat Stroke Center, using SAS software version 9.1.”
|
Definitely yes
Reason: Computerized system with login was used. |
Probably no
Reason: Outcome assessors were blinded. However, due to the nature of the intervention, health providers were not blinded. It was unclear if participants were blinded. |
Definitely no
Reason: 25% and 27% in the intervention and control group, respectively, were lost to follow-up. Reasons were similar between groups. Participants were censored at last available follow-up. |
Definitely yes
Reason: Protocol was published and the trial was registered as well. Outcomes were reported as described in protocol. |
Definitely yes
Reason: Industry provided an unrestricted grant and were not involved in the trial, data collection or analysis. |
LOW (major cardiovascular events and myocardial infarction or urgent coronary revascularisation)
Reason: Due to the nature of the intervention and control, not being blinded most likely did not result in bias. Because participants lost to follow-up were censored (non-informative censoring), and reasons for lost to follow-up were similar, this most likely did not result in bias. |
|
Schwartz, 2018 (ODYSSEY OUTCOMES trial) |
Probably yes
Reason: Although not specifically stated, a call was used to assign treatment. Randomization was done stratified by country. |
No information
Reason: No information is provided on allocation concealment. |
Probably yes
Reason: Patients, healthcare providers, and outcome assessors were blinded. |
Definitely yes
Reason: Number of participants lost tot follow-up was less than 1%. |
Definitely yes
Reason: Trial was registered and study protocol was published with list of outcomes reported. |
Definitely no
Reason: Sponsor (industry) was involved in data collection, etc. Employees were authors. |
Some concerns
|
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-09-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het herzien van de richtlijnmodule is in 2021 een multidisciplinaire cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van het cluster) die betrokken zijn bij de zorg voor patiënten met (een hoog risico op) hart-en vaatziekten.
Per geprioriteerde module wordt door het cluster bekeken welke expertise gewenst is bij de uitwerking en wordt gezamenlijk een verdeling gemaakt in mate van betrokkenheid van clusterleden. Alle clusterexpertiseleden die direct betrokken waren bij de modules, staan hieronder per module vermeld.
Stuurgroep
- Prof. dr. A.W. (Arno) Hoes (voorzitter), klinisch epidemioloog, werkzaam in het UMC Utrecht te Utrecht
- Prof. dr. Y.M. (Yvo) Smulders (vicevoorzitter), internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NIV
- Drs. N.J.P. (Klaas) Borst, internist ouderengeneeskunde, werkzaam in het Isala ziekenhuis te Zwolle, NIV
- Dr. F.A.L. (Frans) van der Horst, klinisch chemicus, werkzaam in het Reinier Medisch Diagnostisch Centrum te Delft, NVKC
- Dr. A.H. (AnHo) Liem, cardioloog niet praktiserend, NVVC
- Prof. dr. F.M.A.C. (Fabrice) Martens, cardioloog, werkzaam in het Amsterdam UMC te Amsterdam, NVVC
- Prof. F. (Francesco) Mattace-Raso, klinisch geriater, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVKG
- Prof. E.P. (Eric) Moll van Charante, huisarts niet praktiserend, huisarts-onderzoeker, werkzaam in het Amsterdam UMC, locatie AMC te Amsterdam, NHG
- L.A.C. (Sanne) Ruigrok MSc, beleidsadviseur, werkzaam bij Harteraad te Den Haag, Harteraad
- Prof. dr. B.K. (Birgitta) Velthuis, radioloog, werkzaam in het UMC Utrecht te Utrecht, NVvR
- Prof. dr. F.L.J. (Frank) Visseren, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
- Dr. Tj. (Tjerk) Wiersma, senior-wetenschappelijk medewerker, werkzaam bij het Nederlands Huisartsen Genootschap te Utrecht, NHG
Betrokken expertisegroepleden bij cyclus 1
- Prof. Dr. B.J.H. (Bert-Jan) van den Born, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie AMC te Amsterdam, NIV
- Dr. J. (Jaap) Deinum, internist-vasculair geneeskundige, Radboud UMC, Nijmegen, NIV
- Dr. M.L. (Louis) Handoko, cardioloog, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NVVC
- Dr. O.W.H. (Olivier) van der Heijden, gynaecoloog-perinatoloog, werkzaam in het Radboud UMC te Nijmegen, NVOG
- Dr. K. (Karen) Konings, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk K. Konings te Maastricht, NHG
- Drs. M. (Marco) Krukerink, huisarts, werkzaam in Huisartsenpraktijk Krukerink & De Wolde te Borne, NHG
- Dr. R.N. (Nils) Planken, radioloog, werkzaam in het Amsterdam UMC, locatie AMC te Amsterdam, NVvR
- Dr. C. (Calin) Popa, reumatoloog, werkzaam in de Sint Maartenskliniek te Nijmegen, NVR
- Dr. J.E. (Jeanine) Roeters van Lennep, internist-vasculair geneeskundige, werkzaam in het Erasmus MC te Rotterdam, NIV
- Dr. P. (Pernette) de Sauvage Nolting, cardioloog, werkzaam in Hartkliniek Rotterdam te Rotterdam, NVVC
- Drs. P. (Paul) Smits, kaderhuisarts hart- en vaatziekten, werkzaam bij De HOEDT-huisartsen te Zoetermeer, NHG
- Dr. M. (Melanie) Tan, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Dr. S.E. (Sarah) Vermeer, neuroloog, werkzaam in het Rijnstate Ziekenhuis te Arnhem, NVN
- Prof. dr. R. (Rozemarijn) Vliegenthart, radioloog, werkzaam in het Universitair Medisch Centrum Groningen te Groningen, NVvR
- Dr. A.J. (Bart) Voogel, cardioloog, werkzaam in het Spaarne Gasthuis te Hoofddorp, NVVC
- Dr. M.E. (Janneke) Wittekoek, cardioloog, werkzaam bij Stichting Heartlife klinieken te Utrecht, NVVC
Betrokken clusterexpertiseleden
Module ‘Streefwaarden LDL-C bij behandeling met lipidenverlagende medicatie’ & Module Dyslipidemie bij (kwetsbare) ouderen
- Drs. M. (Marco) Krukerink, huisarts, werkzaam in Huisartsenpraktijk Krukerink & De Wolde te Borne, NHG
- Prof. F. (Francesco) Mattace-Raso, klinisch geriater, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVKG
- Dr. J.E. (Jeanine) Roeters van Lennep, internist-vasculair geneeskundige, werkzaam in het Erasmus MC te Rotterdam, NIV
- Dr. P. (Pernette) de Sauvage Nolting, cardioloog, werkzaam in Hartkliniek Rotterdam te Rotterdam, NVVC
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Dr. M.E. (Janneke) Wittekoek, cardioloog, werkzaam bij Stichting Heartlife klinieken te Utrecht, NVVC
- Prof. dr. Y.M. (Yvo) Smulders, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NIV
Met ondersteuning van:
- Dr. W.M. Lijfering, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2023)
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot augustus 2023).
- Dr. N.L. van der Zwaluw, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf april 2023)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen restrictie |
|
Hoes (voorzitter) |
Vice-voorzitter raad van bestuur / decaan, UMC Utrecht |
|
- |
Geen |
|
Smulders |
|
|
- |
Geen |
|
Visseren |
|
Voorzitter van de Task Force of the European Society of Cardiology for the 2021 European guidelines on cardiovascular disease prevention in clinical practice. |
Mede-initiatiefnemer van de U-Prevent website voor gebruik van risico algoritmes in de klinische praktijk. De website is eigendom van ORTEC. Betrokkenheid bestaat uit wetenschappelijk advies. |
Geen |
|
Borst |
Internist ouderengeneeskunde en vasculaire geneeskunde |
Lid Forum visitatorum (vacatievergoeding) |
- |
Geen |
|
Mattace-Raso |
|
2019-today: Aging Clinical and Experimental Research 2015-today: Clinical Interventions in Aging |
- |
Geen |
|
Liem |
Gepensioneerd cadioloog (eerder verbonden aan Franciscus gasthuis Rotterdam tot 31-12-2019)
|
- eerder lid richtlijnencommissie CVRM - eerder lid richtlijncommissie vetstofwisselingsstoornissen - lid Raad van Toezicht WCN (onbetaald) |
2018-2021: vergoeding op uurbasis voor presentaties en adviesraden op het gebied van CVRM Lipiden, antithrombotica, anti-diabetica) en Hartfalen. Deelname aan vele trials vanuit WCN. |
Geen, adviesraden zijn gestaakt gedurende het proces |
|
Martens |
Cardioloog Hoogleraar Preventieve Cardiologie |
Namens de NVVC voorzitter Werkgroep Geneesmiddelen Namens de DCVA voorzitter Commissie Preventie
|
Vergoeding voor presentaties op het gebied van CVRM (lipiden, antitrombotica en anti- diabetica), via bemiddeling bureau’s zoals Medcon, Sam Health, Health Investments, Springer Healthcare, Breau Prevents etc. |
Geen, adviesraden zijn gestaakt sinds lidmaatschap Stuurgroep CVRM |
|
Wiersma |
senior wetenschappelijk medewerker NHG |
- |
- |
Geen |
|
Moll van Charante |
Hoogleraar afdeling Huisartsgeneeskunde (0,5 fte) en afdeling Public & Occupational Health (0,5 fte) Amsterdam UMC. |
van VWS en het Deltaplan Dementie (ontwikkeld i.s.m Movisie, Nivel, Pharos, Trimbos-instituut en Vilans)
|
Betrokken bij de ontwikkeling van een app voor zelfmanagement van risicofactoren voor hartvaatziekten en dementie. Het aandeel van resp. Vital Health Software en Philips Vital Health in deze studie is gefinancierd vanuit een Europese grant. |
Geen |
|
Velthuis |
Radioloog |
|
Vergoedingen als spreker voor Nederlandse Vereniging voor Radiologie (NVvR). Philips research geld voor PhD onderzoeker vanaf 2023 |
Geen |
|
Van der Horst |
Laboratorium specialist klinische chemie en laboratoriumgeneeskunde
|
|
- |
Geen |
|
Ruigrok |
Beleidsadviseur |
Geen |
Geen |
Geen |
Expertisegroep
Module
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen restrictie |
|
Born, van den |
Internist-vasculair geneeskundige, |
|
|
Geen onderzoek betreft onderwerpen die niet in de herziene modules ter sprake komen.
|
|
De Sauvage Nolting |
Cardioloog |
- |
- |
Geen |
|
Deinum |
Internist Radboud UMC Nijmegen |
- |
- |
Geen |
|
Handoko |
Cardioloog |
Medical Lectures Handoko: |
Via Medical Lectures Handoko ontving/ontvang ik sprekersvergoeding / vergoeding voor advieswerk van Novartis, Boehringer Ingelheim, Daiichi Sankyo, Vifor Pharma, AstraZeneca, Bayer, MSD, Quin. |
Geen |
|
Heijden, van der |
Gynaecoloog-perinatoloog |
|
- |
Geen |
|
Konings |
|
Aspirant Directie-lid regionale zorggroep ZIO, betaald |
Schrijver van ECG-leerboek: ECG's beoordelen en begrijpen - De ECG 10+ methode – (royalties) |
Geen |
|
Krukerink |
Huisarts |
Podcastmaker, Huisartspodcast.nl gedeeltelijk betaald door vakblad H&W |
- |
Geen |
|
Planken |
Radioloog Amersterdam UMC, aandachtsgebied cardiovasculaire radiologie |
|
- Consultancy services: Bayer, Hemolens - Speakers fee: Bayer, Kalcio Healthcare |
Geen |
|
Popa |
Reumatoloog |
|
- |
Geen |
|
Roeters van Lennep |
Internist-vasculair geneeskundige |
|
Lokale PI bij verschillende internationale onderzoeken op het gebied van lipidenverlagende medicatie dat gefinancierd wordt door farmaceut. |
Geen |
|
Smits |
Huisarts |
|
- |
Geen |
|
Tan |
Internist-vasculair geneeskundige |
|
- |
Geen |
|
Tjin-A-Ton |
Huisarts - Huisartsenpraktijk Frakking & Tjin-A-Ton (40 uur) |
|
- |
Geen |
|
Vermeer |
Neuroloog Rijnstate |
- |
- |
Geen |
|
Vliegenthart |
Radioloog |
|
|
Geen |
|
Voogel |
Cardioloog Spaarne Gasthuis |
|
- |
Geen |
|
Wittekoek |
|
|
- |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van Harteraad in de clusterstuurgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens voor commentaar voorgelegd aan Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Streefwaarden LDL-C volwassenen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase inventariseerde het cluster de geldigheid van de modules binnen het cluster. Naast de betrokken wetenschappelijke verenigingen en patiëntenorganisaties zijn hier ook andere stakeholders voor benaderd in juni 2021.
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De modules die door één of meerdere partijen werden aangekaart als ‘niet geldig’ zijn meegegaan in de prioriteringsfase. Deze module is geprioriteerd door het cluster.
Voor de geprioriteerde modules zijn door de het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. R studio (versie 2023.06.0+421) werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie www.gradeworkinggroup.org. De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekverantwoording
|
Uitgangsvraag: Welke streefwaarden van LDL-C dienen te worden gehanteerd bij de behandeling met lipidenverlagende medicatie bij personen met een (zeer) hoog risico op hart- en vaatziekten? |
|
|
Database(s): Medline, Embase |
Datum: 26-06-2017, 16-12-2021 |
|
Periode: 2005-juni 2017, 2017- |
Talen: E N , nvt. 16-12-2021 |
|
Toelichting:
16-12-2021 Er is een update uitgevoerd van de strategie van 2017. Daarbij is ervoor gekozen om de totale strategie specifieker op te zetten. Er is geen beperking toegepast op taal en tijd en er is gezocht vanaf 1-1-2017.
|
|
Embase
16-12-2021
|
No. |
Query |
Results |
|
#16 |
#14 NOT #13 |
686 |
|
#15 |
#9 AND #14 |
1 |
|
#14 |
#11 AND #12 |
900 |
|
#13 |
#10 AND #12 |
362 |
|
#12 |
#4 AND [1-1-2017]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
3465 |
|
#11 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1852245 |
|
#10 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#9 |
a AND comparison AND of AND two AND ldl AND cholesterol AND targets AND after AND ischemic AND stroke AND p. AND amarenco, AND j.s. AND kim, AND labreuche, AND h. AND charles, AND j. AND abtan, AND y. AND béjot, AND l. AND cabrejo |
1 |
|
#8 |
#4 AND #7 |
3 |
|
#7 |
#5 OR #6 |
3 |
|
#6 |
efficacy AND safety AND more AND intensive AND lowering AND ldl AND cholesterol AND a AND 'meta analysis' AND of AND data AND from AND 170 AND 000 AND participants AND 2010 AND baigent |
2 |
|
#5 |
between AND achieved AND 'low density' AND lipoprotein AND levels AND major AND adverse AND cardiac AND events AND in AND patients AND with AND stable AND ischemic AND heart AND disease AND taking AND statin AND treatment |
1 |
|
#4 |
#1 AND #2 AND #3 |
17720 |
|
#3 |
'hydroxymethylglutaryl coenzyme a reductase inhibitor'/exp/mj OR 'hmg coa reductase inhibitor*':ti,ab OR statin*:ti,ab OR atorvastatin*:ti,ab OR lovastatin*:ti,ab OR meglutol*:ti,ab OR pravastatin*:ti,ab OR rosuvastatin*:ti,ab OR simvastatin*:ti,ab OR 'lipid modifying':ti OR 'lipid level*':ti,ab OR 'reference value'/exp OR 'reference value*':ti,ab,kw OR target*:ti,ab,kw |
2613098 |
|
#2 |
'cardiovascular disease'/exp/mj OR 'cardiovascular disease*':ti,ab OR cvd:ti,ab OR 'vascular disease*':ti,ab OR 'vascular event*':ti,ab OR 'coronary heart disease':ti,ab OR chd:ti,ab |
3228633 |
|
#1 |
'low density lipoprotein cholesterol'/exp/mj OR 'very low density lipoprotein cholesterol'/exp/mj OR (((ldl OR 'low-density lipoprotein*') NEAR/3 (c OR cholesterol)):ti,ab) |
101123 |
26-6-2021
|
Embase (Elsevier) |
'low density lipoprotein cholesterol'/exp/mj OR 'very low density lipoprotein cholesterol'/exp/mj OR ((ldl OR 'low-density lipoprotein*') NEAR/3 (c OR cholesterol)):ti,ab
AND ('cardiovascular disease'/exp/mj OR 'cardiovascular disease*':ti,ab OR cvd:ti,ab OR 'vascular disease*':ti,ab OR 'vascular event*':ti,ab OR 'coronary heart disease':ti,ab OR chd:ti,ab)
AND (preventi*:ti,ab OR control:ti,ab OR therapy:ti,ab OR 'drug therapy':lnk OR prevention:lnk OR 'hydroxymethylglutaryl coenzyme a reductase inhibitor'/exp/mj OR 'hmg coa reductase inhibitor*':ti,ab OR statin*:ti,ab OR atorvastatin*:ti,ab OR lovastatin*:ti,ab OR meglutol*:ti,ab OR pravastatin*:ti,ab OR rosuvastatin*:ti,ab OR simvastatin*:ti,ab OR target*:ti,ab OR risk:ti OR mortality:ti,ab OR incidence:ti OR relation*:ti OR association:ti OR 'lipid modifying':ti OR 'lipid level*':ti,ab OR reduction:ti,ab OR lowering:ti,ab OR 'reference value'/exp)
AND ([dutch]/lim OR [english]/lim) AND [embase]/lim AND [2005-2017]/py NOT 'conference abstract':it
AND ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp) (622) – 190 uniek
Specifiekere search voor RCTs:
(('low density lipoprotein cholesterol'/exp/mj OR 'very low density lipoprotein cholesterol'/exp/mj OR (((ldl OR 'low-density lipoprotein*') NEAR/3 (c OR cholesterol)):ti,ab))
AND ('cardiovascular disease'/exp/mj OR 'cardiovascular disease*':ti,ab OR cvd:ti,ab OR 'vascular disease*':ti,ab OR 'vascular event*':ti,ab OR 'coronary heart disease':ti,ab OR chd:ti,ab)
AND ('hydroxymethylglutaryl coenzyme a reductase inhibitor'/exp/mj OR 'hmg coa reductase inhibitor*':ti OR statin*:ti OR atorvastatin*:ti OR lovastatin*:ti OR meglutol*:ti OR pravastatin*:ti OR rosuvastatin*:ti OR simvastatin*:ti OR target*:ti) OR 'lipid lowering therapy':ti,ab OR 'intensive lipid lowering':ti,ab)
AND ((random*:ti OR 'randomized controlled trial'/exp) NOT 'conference abstract':it)
AND ([dutch]/lim OR [english]/lim) AND [embase]/lim AND [2009-2017]/py (539) – 197 uniek |
Ovid/Medline
16-12-2021
|
# |
Searches |
Results |
|
9 |
5 and 7 |
769 |
|
8 |
5 and 6 |
242 |
|
7 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1337375 |
|
6 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
536192 |
|
5 |
limit 4 to dt="20170101-20211231" |
2983 |
|
4 |
1 and 2 and 3 |
10338 |
|
3 |
exp Hydroxymethylglutaryl-CoA Reductase Inhibitors/ or (hmg coa reductase inhibitor* or statin* or Atorvastatin* or Lovastatin* or Meglutol* or Pravastatin* or Rosuvastatin* or Simvastatin*).ti,ab,kf. or Reference Values/ or target*.ti,ab,kf. or reference value*.ti,ab,kf. |
1985090 |
|
2 |
exp *Cardiovascular Diseases/ or (cardiovascular disease* or CVD or vascular disease* or vascular event* or coronary heart disease or CHD).ti,ab,kf. |
2339571 |
|
1 |
*Cholesterol, LDL/ or ((LDL or low-density lipoprotein) adj3 (C or cholesterol)).ti,ab,kf. |
67352 |
26-6-2017
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2005-juni 2017
Engels, Nederlands |
1 exp *Cardiovascular Diseases/ or (cardiovascular disease* or CVD or vascular disease* or vascular event* or coronary heart disease or CHD).ti,ab,kf. (1961435) 6 *Cholesterol, LDL/ or ((LDL or low-density lipoprotein) adj3 (C or cholesterol)).ti,ab,kf. (53396) 7 (preventi* or statin* or control or therapy).ti,ab,kf. (4244147) 8 (dt or tu or pc).fs. (3562424) 9 exp Hydroxymethylglutaryl-CoA Reductase Inhibitors/ (35783) 10 (hmg coa reductase inhibitor* or statin* or Atorvastatin* or Lovastatin* or Meglutol* or Pravastatin* or Rosuvastatin* or Simvastatin*).ti,ab,kf. (49677) 11 Reference Values/ or target*.ti,ab,kf. or risk.ti. or mortality.ti,ab. or incidence.ti. or relation*.ti. or association.ti. or lipid-modifying.ti. or lipid level*.ti,ab. or reduction.ti,ab. or lowering.ti,ab. (3613106) 12 7 or 8 or 9 or 10 or 11 (8796660) 13 1 and 6 and 12 (20559) 14 limit 13 to (yr="2005 -Current" and (dutch or english)) (12440) 15 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (331922) 16 14 and 15 (702) 26 remove duplicates from 16 (643) – 638 uniek
Specifiekere search voor RCTs:
1 exp *Cardiovascular Diseases/ or (cardiovascular disease* or CVD or vascular disease* or vascular event* or coronary heart disease or CHD).ti,ab,kf. (2068780) 6 *Cholesterol, LDL/ or ((LDL or low-density lipoprotein) adj3 (C or cholesterol)).ti,ab,kf. (56376) 7 exp *Hydroxymethylglutaryl-CoA Reductase Inhibitors/ (26564) 8 (hmg coa reductase inhibitor* or statin* or Atorvastatin* or Lovastatin* or Meglutol* or Pravastatin* or Rosuvastatin* or Simvastatin*).ti,kf. (28632) 9 ("lipid lowering therapy" or "intensive lipid lowering").ti,ab,kf. (2823) 10 7 or 8 or 9 (35798) 11 1 and 6 and 10 (4402) 15 limit 11 to (yr="2009 -Current" and (dutch or english)) (2216) 16 randomized controlled trial.pt. or random*.ti. (567019) 17 15 and 16 (608) – 487 uniek
|
828 SRs (vanaf 2005, sensiteve search)
684 RCTs, vanaf 2009, specifieke search |
|
|
|
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
Tabel update 2021
|
Referentie |
Reden |
|
Oyama K, Giugliano RP, Tang M, Bonaca MP, Saver JL, Murphy SA, et al. Effect of evolocumab on acute arterial events across all vascular territories: results from the FOURIER trial. European heart journal. 2021;42(47):4821-9. |
FOURIER-trial. Data reeds geïncludeerd. |
|
Jin S, Nie X, Li Y, Yuan J, Cui Y, Zhao L. Effect of More Intensive LDL-C-Lowering Therapy on Long-term Cardiovascular Outcomes in Early-Phase Acute Coronary Syndrome: A Systematic Review and Meta-analysis. Clinical therapeutics. 2021;43(7):e217-e29. |
SR, geen van de geïncludeerde trials komt in aanmerking. |
|
Elgendy IY, Elshazly MB. LDL-C-lowering therapies reduce major vascular events in patients aged >=75 y. Annals of internal medicine. 2021;174(4):JC38. |
Commentaar op een trial |
|
Deedwania P, Murphy SA, Scheen A, Badariene J, Pineda A, Lira o, et al. Efficacy and Safety of PCSK9 Inhibition With Evolocumab in Reducing Cardiovascular Events in Patients With Metabolic Syndrome Receiving Statin Therapy: Secondary Analysis From the FOURIER Randomized Clinical Trial. JAMA cardiology. 2021;6(2):139-47. |
FOURIER-trial: analyse bij patiënten met het metabool syndroom |
|
Amarenco P, Kim JS, Labreuche J, Charles H, Giroud M, Lee B-C, et al. Impact of Lower Versus Higher LDL Cholesterol Targets on Cardiovascular Events After Ischemic Stroke in Patients With Diabetes. Diabetes. 2021;70(8):1807-15. |
TST-trial: Analyse naar subgroup diabetes. Echter, alle deelnemers hebben een stroke gehad. |
|
Wiviott SD, Giugliano RP, Morrow DA, De Ferrari GM, Lewis BS, Huber K, et al. Effect of Evolocumab on Type and Size of Subsequent Myocardial Infarction: A Prespecified Analysis of the FOURIER Randomized Clinical Trial. JAMA cardiology. 2020;5(7):787-93. |
FOURIER-trial: analyse naar de uitkomst MI subtype |
|
Wang N, Fulcher J, Abeysuriya N, Park L, Kumar S, Di Tanna GL, et al. Intensive LDL cholesterol-lowering treatment beyond current recommendations for the prevention of major vascular events: a systematic review and meta-analysis of randomised trials including 327 037 participants. The Lancet Diabetes and Endocrinology. 2020;8(1):36-49. |
SR naar de daling in LDL |
|
Robinson JG, Jayanna MB, Bairey Merz CN, Stone NJ. Clinical implications of the log linear association between LDL-C lowering and cardiovascular risk reduction: Greatest benefits when LDL-C >100 mg/dl. PloS one. 2020;15(10):e0240166. |
Meta-analyse: daling in LDL |
|
Ödesjö H, Björck S, Franzén S, Hjerpe P, Manhem K, Rosengren A, et al. Adherence to lipid-lowering guidelines for secondary prevention and potential reduction in CVD events in Swedish primary care: A cross-sectional study. BMJ Open. 2020;10(10). |
Onderzoek naar adherentie en geen follow-up |
|
Gencer B, Mach F, Murphy SA, De Ferrari GM, Huber K, Lewis BS, et al. Efficacy of Evolocumab on Cardiovascular Outcomes in Patients With Recent Myocardial Infarction: A Prespecified Secondary Analysis From the FOURIER Trial. JAMA cardiology. 2020;5(8):952-7. |
FOURIER-trial: subgroepanalyse bij patiënten met MI |
|
Alkhalil M. Effects of intensive lipid-lowering therapy on mortality after coronary bypass surgery: A meta-analysis of 7 randomised trials. Atherosclerosis. 2020;293:75-8. |
SR bij patiënten die een CABG ondergingen |
|
Vallejo-Vaz AJ, Ray KK, Ginsberg HN, Davidson MH, Eckel RH, Lee LV, et al. Associations between lower levels of low-density lipoprotein cholesterol and cardiovascular events in very high-risk patients: Pooled analysis of nine ODYSSEY trials of alirocumab versus control. Atherosclerosis. 2019;288:85-93. |
Meta-analyse van ODYSSEY-trials en subgroepen comorbiditeiten (niet alleen vergelijking intensief versus minder-intensief of uitkomsten gerelateerd aan LDL-daling) |
|
Steg PG, Szarek M, Bhatt DL, Bittner VA, Bregeault M-F, Dalby AJ, et al. Effect of Alirocumab on Mortality After Acute Coronary Syndromes. Circulation. 2019;140(2):103-12. |
Duplicaat van publication ODYSSEY-OUTCOMES-trial |
|
Rosenson RS, Hegele RA, Koenig W. Cholesterol-Lowering Agents. Circulation research. 2019;124(3):364-85. |
Narratieve review |
|
Ray KK, Colhoun HM, Szarek M, Baccara-Dinet M, Bhatt DL, Bittner VA, et al. Effects of alirocumab on cardiovascular and metabolic outcomes after acute coronary syndrome in patients with or without diabetes: a prespecified analysis of the ODYSSEY OUTCOMES randomised controlled trial. The lancet Diabetes & endocrinology. 2019;7(8):618-28. |
Subgroepanalyse: diabetes (alle patiënten hadden HVZ) |
|
Murphy SA, Pedersen TR, Gaciong ZA, Ceska R, Ezhov MV, Connolly DL, et al. Effect of the PCSK9 Inhibitor Evolocumab on Total Cardiovascular Events in Patients With Cardiovascular Disease: A Prespecified Analysis From the FOURIER Trial. JAMA cardiology. 2019;4(7):613-9. |
Analyse FOURIER-trial van totaal aantal events |
|
Lee J, Holbrook A. Pooled RCTs: Lowering LDL-C levels using statins reduces major vascular events in all age groups. Annals of internal medicine. 2019;170(12):JC65. |
Commentaar op een meta-analyse |
|
Jukema JW, Zijlstra LE, Bhatt DL, Bittner VA, Diaz R, Drexel H, et al. Effect of Alirocumab on Stroke in ODYSSEY OUTCOMES. Circulation. 2019;140(25):2054-62. |
Analyse ODYSSEY OUTCOMES-trial naar effect op verschillende vormen van beroerte. |
|
Dicembrini I, Giannini S, Ragghianti B, Mannucci E, Monami M. Effects of PCSK9 inhibitors on LDL cholesterol, cardiovascular morbidity and all-cause mortality: a systematic review and meta-analysis of randomized controlled trials. Journal of Endocrinological Investigation. 2019;42(9):1029-39. |
SR: gezocht tot dec 2017 (recentere reviews beschikbaar) |
|
Soran H, Adam S, Durrington PN. Optimising treatment of hyperlipidaemia: Quantitative evaluation of UK, USA and European guidelines taking account of both LDL cholesterol levels and cardiovascular disease risk. Atherosclerosis. 2018;278:135-42. |
Onderzoek naar behandeling conform richtlijnen en het effect op LDL |
|
Sabatine MS, Wiviott SD, Im K, Murphy SA, Giugliano RP. Efficacy and safety of further lowering of low-density lipoprotein cholesterol in patients starting with very low levels: A meta-analysis. JAMA Cardiology. 2018;3(9):823-8. |
Onderzoek naar baseline LDL 1.8 en effect van verlaging |
|
Navarese EP, Robinson JG, Kowalewski M, Kolodziejczak M, Andreotti F, Bliden K, et al. Association Between Baseline LDL-C Level and Total and Cardiovascular Mortality After LDL-C Lowering: A Systematic Review and Meta-analysis. JAMA. 2018;319(15):1566-79. |
Meta-analyse: daling in LDL |
|
Koskinas KC, Siontis GCM, Piccolo R, Mavridis D, Räber L, Mach F, et al. Effect of statins and non-statin LDL-lowering medications on cardiovascular outcomes in secondary prevention: A meta-analysis of randomized trials. European Heart Journal. 2018;39(14):1172-80. |
SR: Trials hebben we reeds geïncudeerd in de module |
|
Kaasenbrood L, Ray KK, Boekholdt SM, Smulders YM, LaRosa JC, Kastelein JJP, et al. Estimated individual lifetime benefit from PCSK9 inhibition in statin-treated patients with coronary artery disease. Heart (British Cardiac Society). 2018;104(20):1699-705. |
Onderzoek naar het geschatte effect van PCSK9 |
|
Hong N, Lee YH, Tsujita K, Gonzalez JA, Kramer CM, Kovarnik T, et al. Comparison of the effects of ezetimibe-statin combination therapy on major adverse cardiovascular events in patients with and without diabetes: A meta-analysis. Endocrinology and Metabolism. 2018;33(2):219-27. |
SR: Effect bij diabetes. Geen van de geïncludeerde trials voldoet aan de huidige selectiecriteria (geen vergelijking tussen intensief vs minder intensief, patiënten met HVZ en diabetes of geen primaire uitkomstmaat HVZ). |
|
Soran H, Kwok S, Adam S, Ho JH, Durrington PN. Evidence for more intensive cholesterol lowering. Current Opinion in Lipidology. 2017;28(4):291-9. |
Recentere reviews beschikbaar |
|
He X, Liu T, Pan Y, Li X. Efficacy of LDL-C lowering therapy in patients with non-ST-segment elevation acute coronary syndrome: A meta-analysis. Chinese Journal of Evidence-Based Medicine. 2017;17(5):550-6. |
Effect van therapie bij NSTE-ACS |
|
Giugliano RP, Wiviott SD, Blazing MA, De Ferrari GM, Park J-G, Murphy SA, et al. Long-term Safety and Efficacy of Achieving Very Low Levels of Low-Density Lipoprotein Cholesterol : A Prespecified Analysis of the IMPROVE-IT Trial. JAMA cardiology. 2017;2(5):547-55. |
Effect van lage LDL-C-waarden na behandeling |
|
Giugliano RP, Keech A, Murphy SA, Huber K, Tokgozoglu SL, Lewis BS, et al. Clinical Efficacy and Safety of Evolocumab in High-Risk Patients Receiving a Statin: Secondary Analysis of Patients With Low LDL Cholesterol Levels and in Those Already Receiving a Maximal-Potency Statin in a Randomized Clinical Trial. JAMA cardiology. 2017;2(12):1385-91. |
Onderzoek of een lager LDL-niveau zinvol is. |
|
Ference BA, Ginsberg HN, Graham I, Ray KK, Packard CJ, Bruckert E, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement fromthe European Atherosclerosis Society Consensus Panel. European Heart Journal. 2017;38(32):2459-72. |
Causaliteit van LDL op ACS |
|
Davies GM, Vyas A, Baxter CA. Economic evaluation of ezetimibe treatment in combination with statin therapy in the United States. Journal of Medical Economics. 2017;20(7):723-31. |
Kosteneffectiviteit van ezetimibe en statine in Amerika |
|
Anonymous. Ezetimibe + statin: insufficient benefit. Prescrire international. 2016;25(175):245-6. |
Commentaar op een trial |
|
Fulcher J, O'Connell R, Voysey M, Emberson J, Blackwell L, Mihaylova B, et al. Efficacy and safety of LDL-lowering therapy among men and women: Meta-analysis of individual data from 174 000 participants in 27 randomised trials. The Lancet. 2015;385(9976):1397-405. |
Onderzoek naar man-vrouwverschil |
|
Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al. Ezetimibe added to statin therapy after acute coronary syndromes. New England Journal of Medicine. 2015;372(25):2387-97. |
Reeds geïncludeerd in de eerdere literatuuranalyse |
|
Yan YL, Qiu B, Hu LJ, Jing XD, Liu YJ, Deng SB, et al. Efficacy and safety evaluation of intensive statin therapy in older patients with coronary heart disease: A systematic review and meta-analysis. European Journal of Clinical Pharmacology. 2013;69(12):2001-9. |
SR: recentere reviews beschikbaar |
|
Baigent C, Blackwell L, Emberson J, Holl, LE, Reith C, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: A meta-analysis of data from 170 000 participants in 26 randomised trials. The Lancet. 2010;376(9753):1670-81. |
SR: recentere reviews beschikbaar |
Tabel 2017
|
Auteur en jaartal |
Redenen van exclusie |
|
Soran, 2017 |
Gezocht in 1 database; zoekstrategie niet beschikbaar |
|
Olsson, 2017 |
Narratieve review |
|
Bahiru, 2017 |
Niet alleen cholesterolverlagende medicatie; vergeleken met placebo |
|
Lafeber, 2017 |
RCT polypill versus usual care |
|
Schmidt, 2017 |
Systematische review naar effectiviteit van PCSK9-antilichamen |
|
Jena, 2016 |
Data uit een cohortstudie |
|
Peng, 2016 |
Geen Risk of Bias beoordeling per studie (wel voor publicatie bias) |
|
Webster, 2016 |
Geen systematische zoekactie |
|
Cai, 2015 |
Associatie tussen genetische afwijking en HVZ |
|
Cholesterol Treatment Trialists, 2015 |
Geen systematische zoekactie |
|
Karlson, 2015 |
Geen systematische zoekactie; gesponsord door farmaceut |
|
Preiss, 2015 |
RCT's vergeleken met placebo geïncludeerd |
|
Thomopoulos, 2015 |
RCT's vergeleken met placebo geïncludeerd |
|
Boekholdt, 2014 |
Gezocht in 1 database |
|
Bruckert, 2014 |
Narratieve review |
|
Gudzune, 2014 |
Systematische review van intensieve behandeling met lipidenverlagende medicatie versus minder intensief |
|
Naci, 2014 |
Effectschatters niet gerapporteerd omdat het doel van review het onderzoeken van industry-sponsored bias was |
|
Soran, 2014 |
Narratieve review |
|
Karlson, 2013 |
Geen systematische zoekactie; gesponsord door farmaceut |
|
Naci, 2013 |
Effectschatters niet gerapporteerd omdat het doel van review het onderzoeken van industry-sponsored bias was |
|
Ribeiro, 2013 |
Geen uitkomst LDL-waarde |
|
Ye, 2012 |
Uitkomst van interesse endotheel functie |
|
Morrone, 2012 |
Niet systematisch gezocht |
|
Cholesterol Treatment Trialists, 2012 |
Geen systematische zoekactie |
|
McKinney, 2012 |
RCT's vergeleken met placebo geïncludeerd |
|
Sniderman, 2011 |
Verschil tussen markers LDL, non-HDL en apoB |
|
Chan, 2011 |
Systematische review van intensieve behandeling met statines versus minder intensief |
|
Ramjee, 2011 |
Niet origineel; beschrijving van de CTT meta-analyse |
|
Seehusen, 2011 |
Case report met review van literatuur |