Medicamenteuze behandelingen bij PT
Uitgangsvraag
Wat is de waarde van medicamenteuze behandelingen, incl. injectietherapie, bij patiënten met patella tendinopathie?
Aanbeveling
Wees terughoudend met het toepassen van medicatie voor patella tendinopathie.
Behandel patella tendinopathie niet met injectietherapie.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Injecties met bloed
Op basis van de literatuur lijken injecties met autoloog bloed, plaatjesrijk plasma en plaatjesarm plasma geen klinisch relevant effect te hebben op de cruciale uitkomstmaten pijn en functie. De lage tot zeer lage bewijskracht wordt met name veroorzaakt door de kleine aantallen patiënten en het passeren van de grens van “geen effect”. Er ligt hier dan ook een kennislacune. De belangrijke uitkomstmaten kunnen geen verdere bijdrage leveren aan de richting van de besluitvorming. Ten aanzien van deze uitkomstmaten werd geen literatuur geïncludeerd in de samenvatting.
Passieve transcutane medicatie
Op basis van de literatuur lijkt behandeling met Glyceryl Trinitraat (GTN) alleen een klein klinisch relevant nadelig effect te hebben op de cruciale uitkomstmaat pijn na 12 maanden. Er lijkt geen klinisch relevant effect te zijn op functie. De lage bewijskracht wordt met name veroorzaakt doordat er slechts 1 RCT werd gevonden met weinig patiënten en het passeren van de grens van “geen effect”. Ook lijkt er geen klinisch relevant effect te zijn op de belangrijke uitkomstmaat patiënttevredenheid. De overige belangrijke uitkomstmaten kunnen geen verdere bijdrage leveren aan de richting van de besluitvorming. Ten aanzien van deze uitkomstmaten werd geen literatuur geïncludeerd in de samenvatting.
Actieve transcutane medicatie
Naast passieve transcutane medicatie, kan patella tendinopathie ook behandeld worden met actieve transcutane medicatie. Een voorbeeld hiervan is iontoforese. Echter waren er geen studies die deze behandeling beschreven en voldeden aan de selectiecriteria. Wel is deze behandeling onderzocht door een RCT met een follow-up van twee weken (Rigby, 2015). Hierin werd een klinisch relevant positief effect gevonden op de cruciale uitkomstmaten pijn, maar niet op functie en de belangrijke uitkomstmaten ziekteverzuim/staken sport, herstel, hervatting van werk/sport, patiënttevredenheid. Echter is een follow-up van twee weken te kort om te bepalen of op langere termijn (>3 maanden) de effecten van de behandeling ook blijven bestaan.
Paracetamol en NSAID’s
De zoekstrategie leverde geen studies op over paracetamol en NSAID’s. Daarnaast hebben NSAID’s, met name bij ouderen, ook een ongunstig bijwerkingsprofiel. Een ander potentieel nadeel van paracetamol en NSAID’s is het pijnstillende effect op korte termijn en daardoor de interferentie met de belastingsadviezen die de werkgroep adviseert. Door het gebruik van deze middelen wordt een pijnschaal minder betrouwbaar en dit kan ertoe leiden dat patiënten meer belaste activiteiten ontplooien dan op dat moment door de patellapees kan worden verdragen.
Injecties met corticostoroïden, met of zonder pijnstiller
De zoekstrategie leverde geen studies op over de toepassing van corticosteroïden. Het effect van corticosteroïd injecties is wel onderzocht bij de midportion achilles tendinopathie (zie de richtlijn Achilles tendinopathie). Daarbij zijn er aanwijzingen dat deze behandeling niet effectief is bij patiënten met midportion achilles tendinopathie, het een ongunstig effect heeft op lange termijn en er problemen zijn met de veiligheid van deze behandeling (dit geldt met name bij een toename in het aantal injecties) (Coombes, 2010; DaCruz, 1988; Seeger, 2006).
Hoog volume injecties met fysiologisch zout
De zoekstrategie leverde geen studies op over de toepassing van hoog volume injecties. Over de veiligheid is ook onvoldoende bekend. Hoog volume injecties worden daarom niet aanbevolen. Het wordt wel gezien als kennislacune.
Prolotherapie
De zoekstrategie leverde geen studies op over de toepassing van prolotherapie. Prolotherapie is wel onderzocht bij achilles tendinopathie (richtlijn Achilles tendinopathie). Deze richtlijn vermeld hierover dat de onzekerheid van het geschatte behandeleffect groot is. Bovendien was er bij het vergelijken van de effecten van verschillende types injectievloeistoffen niet één type injectie superieur in zijn effectiviteit boven de andere. Er bestaat derhalve grote onzekerheid over de meerwaarde van prolotherapie bij patella tendinopathie. Het wordt gezien als kennislacune.
Samenvattend
Samenvattend is de bewijskracht in de literatuur ten aanzien van de meerwaarde van medicamenteuze behandelingen voor patella tendinopathie uitermate beperkt. Het aantal RCT’s en systematische reviews is erg laag en deze gaan over drie verschillende interventies. Al met al kan geen interventie worden aangewezen waar op basis van de literatuur de voorkeur naar uit gaat. Om bovenstaande redenen adviseert de werkgroep terughoudend te zijn met het toepassen van paracetamol, NSAID’s en corticosteroïd injecties.
In één RCT worden nadelige effecten van injecties met bloed gerapporteerd (Scott, 2019). Acht van de 38 patiënten beschreven de vermindering op de 7-punten schaal voor ‘global rating of change’ na zes weken. Eén patiënt kon niet meedoen met het rehabilitatieprogramma vanwege lokale pijn. Er worden geen nadelige effecten gerapporteerd van actieve transcutane medicatie. Wel wordt er een nadelig effect gerapporteerd na passieve transcutane medicatie, namelijk jeuk (n=3). Hoofdpijn en contactdermatitis zijn veelvoorkomende bijwerkingen na behandeling met GTN volgens eerdere studies (Steunebrink, 2013).
De werkgroep verwijst naar de richtlijn ‘Conservatieve behandeling van artrose in heup of knie’ voor de belangrijkste bijwerkingen van paracetamol, orale NSAID’s en dermale NSAID’s. Daarnaast verwijst de werkgroep naar het Farmacotherapeutisch Kompas (ook als app beschikbaar) voor de beschrijving van medicijnen en mogelijke bijwerkingen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Om meer inzicht te krijgen in de waarden en voorkeuren van patiënten met patella tendinopathie is er in samenwerking met Patiëntenfederatie Nederland een vragenlijst opgesteld en uitgezet. Van de 9 patella tendinopathie patiënten die de vragenlijst hebben ingevuld, hebben 2 patiënten een vorm van medicatie gehad (ontstekingsremmer n = 1, injectietherapie n = 1). Geen van de patiënten heeft pijnstillers gekregen. Het belangrijkste voordeel om te kiezen voor ontstekingsremmers is om een ontsteking onder de knieschijf te verminderen (n=1) en voor injectietherapie is nog geen voordeel bemerkt (n=1).
De werkgroep concludeert uit bovenstaande dat medicamenteuze therapie wel wordt toegepast bij patella tendinopathie, maar er kunnen verder geen conclusies worden verbonden door de kleine steekproef. Medicamenteuze behandeling leveren geen aantoonbare voordelen op in de behandeling van patella tendinopathie. Alertheid is vereist op de bijwerkingen van een aantal middelen. De werkgroep ervaart dat patiënten pijnmedicatie niet zien als een duurzame oplossing.
Kosten (middelenbeslag)
Er zijn geen studies uitgevoerd naar de (kosten)effectiviteit van de medicamenteuze behandeling van patella tendinopathie. De kosten van pijnmedicatie (paracetamol, orale en dermale NSAID’s) zijn laag. Aan gebruik van dermale NSAID’s en de comedicatie met een maagbeschermer zijn enigszins hogere kosten verbonden, maar dit zou volgens de werkgroep kortdurend gebruik niet in de weg hoeven staan.
Een intra-articulaire injectie met autologe bloedplaatjes (PRP) wordt door de meeste zorgverzekeraars niet vergoed. Voor het uitvoeren van een dergelijke behandeling heeft de behandelaar centrifuge apparatuur nodig, zal steriel gewerkt moeten worden, en gegarandeerd kunnen worden dat alleen patiënteigen materiaal wordt gebruikt; de behandeling is hierdoor momenteel niet op elke kliniek of praktijk mogelijk.
Een intra-articulaire corticosteroïdinjectie wordt vergoed binnen het basispakket door de zorgverzekeraars en het te injecteren product is niet erg duur.
Aanvaardbaarheid, haalbaarheid en implementatie
Medicamenteuze behandeling van patella tendinopathie in de vorm van NSAID’s en injectietherapie wordt ondanks de afwezige bewijskracht in de praktijk wel toegepast. NSAID’s zijn makkelijk verkrijgbaar, maar PRP-injecties zijn niet overal beschikbaar en vanwege de ook zeer beperkte bewijskracht wordt dit niet aangeraden door de werkgroep. Alle andere vormen van medicamenteuze therapie bij patella tendinopathie zijn onvoldoende onderzocht en kunnen derhalve ook niet worden aangeraden.
Patiënten met patella tendinopathie kunnen dagelijks pijn hebben en daardoor ook beperkt zijn in hun dagelijks functioneren. Zij zijn op zoek naar een snelle oplossing en het voorschrijven van medicatie is in deze situaties soms onoverkomelijk. Als arts moet men er echter terdege van bewust zijn dat juist deze medicatie ook nadelen kan hebben in de vorm van afhankelijkheid en/of juist overbelasting door pijnonderdrukking. In uitzonderlijke situaties met veel pijn en beperkingen kan kortdurend gebruik van pijnmedicatie overwogen worden. De voorkeur van de werkgroep gaat dan op basis van mogelijke bijwerkingen uit naar 1e keus paracetamol en 2e keus dermale NSAID. Deze medicatie is makkelijk verkrijgbaar en de kosten zijn beperkt. De patiënt moet daarbij geïnformeerd worden dat medicatie geen oplossing is. De werkgroep adviseert om starten met oefentherapie en eventueel aanvullende conservatieve therapie (zie de modules Oefentherapie PT en Aanvullende conservatieve behandelingen PT).
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het beperkte aantal studies van lage kwaliteit maken het aanbevelen van een specifieke medicamenteuze behandeling niet mogelijk. De werkgroep raadt het gebruik van medicamenten voor de behandeling van patiënten met patella tendinopathie niet aan. De werkgroep adviseert om te starten met oefentherapie en eventueel aanvullende conservatieve therapie (zie de modules Oefentherapie PT en Aanvullende conservatieve behandelingen PT).
Bij heftige pijn kan kortdurend gebruik van orale of dermale pijnmedicatie worden overwogen (1 tot 2 weken). Als het gebruik van NSAID’s desondanks toch wordt overwogen, gaat de voorkeur uit naar het medicijn met de minste bijwerkingen en de laagste kosten, aangezien er geen bewijs is dat een bepaalde NSAID superieur is boven een andere.
Er zijn geen studies met betrekking tot de effectiviteit van paracetamol in het verminderen van de pijn bij patiënten met patella tendinpathie, maar gezien het betere veiligheidsprofiel in vergelijking met NSAID’s gaat hier de voorkeur naar uit.
Onderbouwing
Achtergrond
Patiënten willen vermindering van de pijn en verbetering van de belastbaarheid bij inspanning. Ze hebben het beweegpatroon en de intensiteit van inspanningen vaak noodgedwongen al aangepast. Soms hebben zij een periode paracetamol of NSAID’s geprobeerd voordat ze naar de fysio- of oefentherapeut of de arts zijn gegaan. Pijnstilling in de vorm van orale (paracetamol, NSAID’s) of lokale pijnmedicatie (NSAID-gel) bestaat al langer, maar wordt in de (sportgeneeskundige) praktijk weinig toegepast, omdat men er niet van overtuigd is dat dit op lange termijn effectief is.
Injectietherapie wordt optioneel toegepast als conservatieve behandeling geen of onvoldoende resultaat heeft opgeleverd. Injectietherapie kan bijwerkingen geven. In de medio oktober 2020 gepubliceerde richtlijn Achilles tendinopathie concludeert de werkgroep dat er een zeer grote onzekerheid is van de geschatte behandeleffecten van injectietherapie en dat dit geen grotere effectiviteit lijkt te hebben dan oefentherapie na 1 jaar follow-up.
Conclusies / Summary of Findings
Comparison 1. Blood agent injections
1.1 Pain (critical)
|
Very low GRADE |
It is unclear what the effect of blood agent injections is on pain in the short-term and in the long-term.
Sources: (Resteghini, 2016; Scott, 2019) |
1.2 Function (critical)
|
Very low GRADE |
It is unclear what the effect of blood agent injections is on function in the short-term and in the long-term.
Sources: (Resteghini, 2016; Scott, 2019) |
1.3 Return to sport/work, 1.4 Patient satisfaction, 1.5 Patient recovery and 1.6 Duration of absenteeism (important)
|
- GRADE |
The outcome measure ‘return to sports/work’, ‘patient satisfaction’, ‘patient recovery’ and ‘duration of absenteeism’ was not reported in the included studies. |
Comparison 2. Passive transcutaneous medication
2.1 Pain (critical)
|
Low GRADE |
The evidence suggests that passive transcutaneous medication (glyceryl trinitrate, GTN) results in little to no difference in pain in the short-term.
Sources: (Steunebrink, 2013) |
|
Low GRADE |
The evidence suggests that passive transcutaneous medication (glyceryl trinitrate, GTN) may result in a slightly negative effect on return to sports in the long-term.
Sources: (Steunebrink, 2013) |
2.2 Function (critical)
|
Low GRADE |
The evidence suggests that passive transcutaneous medication (glyceryl trinitrate, GTN) results in little to no difference in function in the short-term and in the long-term.
Sources: (Steunebrink, 2013) |
2.3 Return to sport/work, 3.5 Patient recovery and 3.6 Duration of absenteeism (important)
|
- GRADE |
The outcome measure ‘return to sports/work’, ‘patient recovery’ and ‘duration of absenteeism’ was not reported in the included studies. |
2.4 Patient satisfaction
|
Low GRADE |
The evidence suggests that passive transcutaneous medication (glyceryl trinitrate, GTN) results in little to no difference in patient satisfaction in the short-term and in the long-term.
Sources: (Steunebrink, 2013) |
Samenvatting literatuur
Description of studies
Lopez-Royo (2020) performed a systematic review and meta-analysis assessing the effectiveness of minimally invasive techniques in patients with chronic patella tendinopathy. A total of 10 RCTs, comprising 326 patients, were included in this review. Different minimally invasive techniques were evaluated: Dry needling, platelet-rich-plasma injections, corticosteroid injections, polidocanol injections, steroid injections, shockwave therapy and autologous blood injections. As a comparison, placebo injections, eccentric training and saline were used. To answer the clinical question, only the data from two RCTs was extracted from this review. The individual RCTs are described below:
1. Resteghini (2016) performed an RCT which compared autologous blood injections (ABI) to saline injections in 22 patients with chronic patella tendinopathy. All patients were prepared with chlorhexidine spray, followed by an injection of 2mL 1% lidocaine into subcutaneous tissue around the tendon to be injected. In the meantime, 2mL of autologous blood was withdrawn from the contralateral antecubital fossa using aseptic technique. In the ABI group, autologous blood was injected into the tendon under ultrasound guidance. In the saline group, the same volume of saline was injected under ultrasound guidance. All patients were advised on relative rest with normal activities of daily living and were only permitted to take paracetamol as an analgesia. The injections were given on two occasions, four weeks apart. Patients were evaluated after one month, after three months and after one year. Authors assessed pain (VAS) and function (VISA-P).
2. Scott (2019) performed a parallel randomized single-blind saline-controlled study with three injection arms: Leukocyte-poor platelet-rich plasma injections (LP-PRP), leukocyte-rich platelet-rich plasma injections (LR-PRP) and saline injections in 57 athletes with patellar tendinopathy. After injection the patient lay quietly with the knee extended for 15 minutes. Ice was applied for pain as desired by the patient. For 48 hours after injection, patients were instructed to refrain from exercise. After one week, rehabilitation began. All patients engaged in a supervised gym-based rehabilitation program based on the slow heavy loading program (concentric and eccentric). They trained in the rehabilitation facility three times per week for six weeks. At least 1 session per week was directly supervised by a physical therapist. Patients were evaluated after six weeks, 12 weeks, 24 weeks and one year. Authors assessed pain (NRS), function (VISA-P) and patient satisfaction (global rating of change GROC).
In addition to the RCTs included in the review of Lopez-Royo (2020), one separate RCT was added to the analysis (Steunebrink, 2013). Steunebrink (2013) a double-blind, placebo-controlled clinical trial comparing glyceryl trinitrate (GTN) treatment with placebo treatment in 33 patients with chronic patellar tendinopathy. The researcher (MS) prepared packages of the patches in one envelope for every patient for treatment lasting 12 weeks. Two kinds of patches were used, active and placebo patches. The active patches delivered 5mg of GTN every 24 h. The placebo patches used were blister-plasters. Patients were instructed to avoid the use of co-interventions within the follow-up period. Patients were also given a supply of 20 acetaminophen tablets (500 mg) and were instructed to use them for any headache that they might experience. All patients completed a self-administered questionnaire, consisting of standardised outcome measures at baseline and after six, 12 and 24 weeks. Authors assessed pain (VAS), function (VISA-P) and satisfaction.
Results
As different types of interventions and controls were compared in the included studies, we divided the results in two comparisons:
- Blood agent injection (Resteghini, 2016; Scott, 2019).
- Passive transcutaneous medication (glyceryl trinitrate, GTN) (Steunebrink, 2013).
Comparison 1. Blood agent injections
1.1 Pain (critical)
Pain was measures with a visual analogue scale (VAS) or by the numeric rating scale (NRS) (0=no pain to 10=worst pain) in two studies included in the review (Resteghini, 2016; Scott, 2019), comprising 79 patients. Resteghini (2016) presented mean pain scores in the short-term (after three months) and in the long-term (after 12 months). Standard deviations were estimated based on figure 2 of the article for pooling the results. Scott (2019) also presented pain in the short-term and in the long-term (mean ± SD). Scott (2019) distinguished between leukocyte-rich platelet-rich plasma and leukocyte-poor platelet-rich plasma. Pooled data is shown in a forest plot (Figure 1). In the short-term, data resulted in a MD of -0.31 (95% CI: -0.91 to 0.29), favoring the blood agent injection. This difference was not clinically relevant. In the long-term, data resulted in a MD of 0.60 (95% CI: -0.70 to 1.90). This difference was not clinically relevant.
Level of evidence of the literature
The level of evidence regarding the outcome pain started at high, because it was based on randomized controlled trials. In the short-term and in the long-term, the level of evidence was downgraded by three levels due to statistical heterogeneity (inconsistency, -1), limited number of included patients and crossing the border of clinical relevance (imprecision, -2). The final level is very low.
Figure 1 Pain after blood agent injections and saline injections
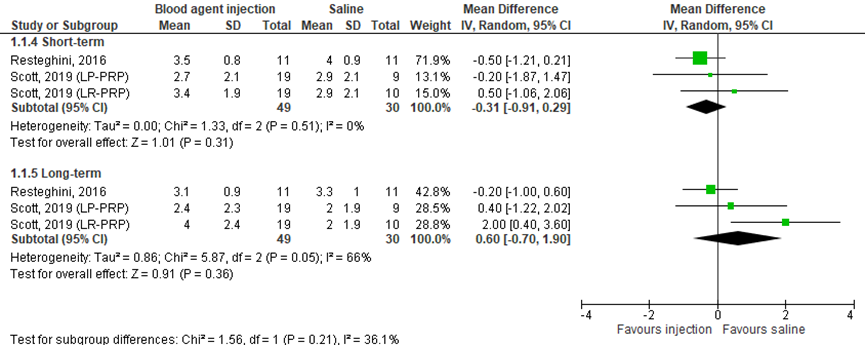
1.2 Function (critical)
Function was measured with the Victorian Institute of Sport Assessment-Patella (VISA-P) questionnaire (0=worst function to 100=best function) in two studies included in the review (Resteghini, 2016; Scott, 2019), comprising 79 patients. Resteghini (2016) presented mean function scores in the short-term (after three months) and in the long-term (after 12 months). Standard deviations were estimated based on figure 2 of the article for pooling the results. Scott (2019) presented function in the short-term and in the long-term (mean ± SD). Scott (2019) distinguished between leukocyte-rich platelet-rich plasma and leukocyte-poor platelet-rich plasma. Pooled data is shown in a forest plot (Figure 2). In the short-term, data resulted in a MD of 4.62 (95% CI: -13.18 to 22.41), favoring the blood agent injection. This difference was not clinically relevant. In the long-term, data resulted in a MD of -4.62 (95% CI: -27.72 to 18.47), favoring the saline injection. This difference was not clinically relevant.
Level of evidence of the literature
The level of evidence regarding the outcome function started at high, because it was based on randomized controlled trials. In the short-term and in the long-term, the level of evidence was downgraded by three levels due to inadequate blinding of care providers (-1; risk-of-bias), statistical heterogeneity (-1; inconsistency) and limited number of included patients (-1; imprecision). The final level is very low.
Figure 2 Function after blood agent injections and after saline injections
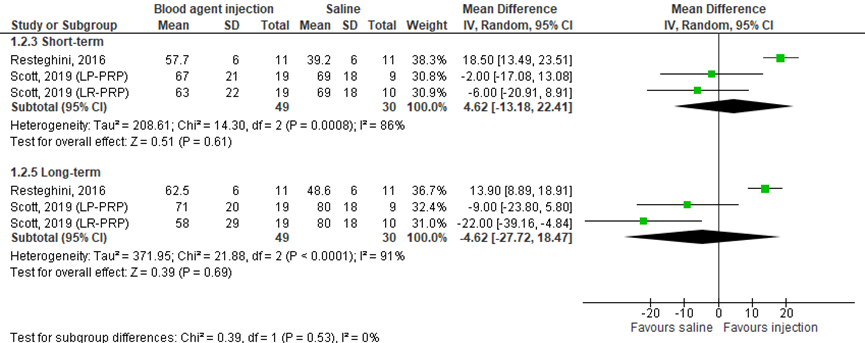
1.3 Return to sports/work; 1.4 Patient satisfaction; 1.5 Patient recovery; 1.6 Duration of Absenteeism (important) were not reported in the included studies
Level of evidence of the literature
The level of evidence regarding the outcomes ‘return to sports/work’, ‘patient satisfaction’, ‘patient recovery’ and ‘duration of absenteeism’ were not assessed due to lack of studies.
Comparison 2. Passive transcutaneous medication
2.1 Pain
Pain was measures with a visual analogue scale (VAS) (0=worst pain to 10=no pain) in one RCT (Steunebrink, 2013), comprising 33 patients. Steunebrink (2013) presented pain in the short-term (after three months) and in the long-term (after six months). In the short-term, data resulted in an equal score in both groups, MD of 0 (95% CI: -2.01 to 2.01). In the long-term, data resulted in a MD of -1.2 (95% CI: -3.31 to 0.91), favoring placebo. This difference was clinically relevant.
Level of evidence of the literature
The level of evidence regarding the outcome pain started at high, because it was based on a randomized controlled trial. In the short-term and in the long-term, the level of evidence was downgraded by two levels due to limited number of included patients and crossing the borders of clinical relevance (-2; imprecision). The final level is low.
2.2 Function
Function was measured with the Victorian Institute of Sport Assessment-Patella (VISA-P) questionnaire (0=worst function to 100=best function) in one RCT (Steunebrink, 2013), comprising 33 patients. Steunebrink (2013) presented function in the short-term (after three months) and in the long-term (after six months). In the short-term, data resulted in a MD of -0.70 (95% CI: -13.07 to 11.67), favoring placebo. In the long-term, data resulted in a MD of -5.7 (95% CI: -18.87 to 7.47), favoring placebo. These differences were not clinically relevant.
Level of evidence of the literature
The level of evidence regarding the outcome function started at high, because it was based on a randomized controlled trial. In the short-term and in the long-term, the level of evidence was downgraded by two levels due to limited number of included patients and crossing the borders of clinical relevance (-2; imprecision). The final level is low.
2.3 Return to sports/work
Return to sports/work was not reported in the included study.
Level of evidence of the literature
The level of evidence regarding the outcomes ‘return to sports/was not assessed due to lack of studies.
3.4 Patient satisfaction
Patient satisfaction was measured with a subjective satisfaction score (rated as poor, fair, good or excellent) in on RCT (Steunebrink, 2013), comprising 33 patients. Steunebrink (2013) presented patients satisfaction as the number of patients who rated their satisfaction good or excellent in the short-term (after three months) and in the long-term (after six months). In the short-term, data resulted in a RR of 1.06 (95% CI: 0.57 to 1.98), favoring placebo. In the long-term, data resulted in a RR of 0.83 (95% CI: 0.40 to 1.69), favoring placebo. These differences were not clinically relevant.
Level of evidence of the literature
The level of evidence regarding the outcome patient satisfaction started at high because it was based on a randomized controlled trial. At six weeks, 12 weeks and 24 weeks, the level of evidence was downgraded by two levels due to limited number of included patients and crossing the borders of clinical relevance (-2; imprecision). The final level is low.
3.5 Patient recovery; 3.6 Duration of absenteeism (important) were not reported in the included studies.
Level of evidence of the literature
The level of evidence regarding the outcomes ‘patient recovery’ and ‘duration of absenteeism’ were not assessed due to lack of studies.
Zoeken en selecteren
A systematic review of literature was performed to answer the following question:
What is the effect of a medical treatment, including injection therapy, in patients with patellar tendinopathy on pain, function, return to sport/work, duration of absenteeism, patients’ satisfaction, and patient recovery?
P: adult patients with patellar tendinopathy;
I: medical treatments, including injection therapy;
C: control group/ placebo/ wait and see policy;
O: pain, function, return to sports/ work, duration of absenteeism and patient satisfaction.
Relevant outcome measures
The working group considered pain and function as critical outcome measures for decision making; and return to sport/work, duration of absenteeism and patient satisfaction as important outcome measures for decision making.
The working group defined the outcome measures as following:
- Pain: as determined with the Visual Analogue Scale (VAS) or the Numeric Rating Scale (NRS).
- Function: as determined with the Victorian Institute of Sport Assessment-Patella (VISA-P) questionnaire, which is developed to measure severity of symptoms, pain, and function in patients with patellar tendinopathy, or the Kujala score/ Anterior Knee Pain Score (AKPS) could also be used.
- Return to sport/work: as determined with the Tegner score.
- Patient satisfaction: as determined on a Likert scale.
- Patient recovery: as determined on a Likert scale.
A priori, the working group did not define the outcome measure ‘duration of absenteeism’ but used the definitions used in the studies.
The working group defined a minimal clinically important difference of 2 cm (out of 10 cm) change on the VAS or NRS scale, in accordance with Crossley (2004). Additionally, a difference of 13 points in the VISA-P score was the minimal clinically important difference (Hernandez-Sanchez, 2014). For the Kujala score/ AKPS score, a difference of 10 point (out of 100 points) was defined as a minimal clinically (patient) important difference, according to Crossley (2004). A minimal clinically important difference for return to sport/work, duration of absenteeism, patient satisfaction, and patient recovery was not predefined.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2000 until November 2020. The detailed search strategy is presented under the tab Methods. The systematic literature search resulted in 200 hits. Studies were selected based on the following inclusion criteria:
- Systematic reviews (searched in at least two databases, detailed search strategy, risk of bias assessment, and results of individual studies available) or randomized controlled trials (RCTs).
- Answering the search question described above.
- > 1 month follow-up.
Initially, 31 studies were selected based on title and abstract screening. After reading the full text, 25 studies were excluded (see Table “reasons for exclusion” under the tab Methods). Eventually, one systematic review was included and two RCTs were included. To answer our clinical question, we distinguished between the short-term effects (after 12 weeks) and the long-term effects (after one year).
Results
Three studies were included in the analysis of the literature. Important study characteristics and results were summarized in the evidence tables. The risk of bias assessment is presented in the risk of bias tables.
Referenties
- López-Royo MP, Ortiz-Lucas M, Gómez-Trullén EM, Herrero P. (2020). The Effectiveness of Minimally Invasive Techniques in the Treatment of Patellar Tendinopathy: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Evid Based Complement Alternat Med.:8706283.
- Resteghini P, Khanbhai TA, Mughal S, Sivardeen Z. (2016) Double-Blind randomized controlled trial. Clinical Journal of Sport Medicine;26(1): 17–23.
- Rigby JH, Mortensen BB, Draper DO. Wireless Versus Wired Iontophoresis For Treating Patellar Tendinopathy: A Randomized Clinical Trial. Journal of Athletic Training;50(11):1165–1173.
- Scott A, LaPrade RF, Harmon KG et al. (2019) Platelet-rich plasma for patellar tendinopathy: a randomized controlled trial of leukocyte-rich PRP or leukocyte-poor PRP versus saline. American Journal of Sports Medicine;47(10): 1654–1661.
- Steunebrink M, Zwerver J, Brandsema R, Groeneboom P, Akker-Scheek I, Weir A. (2013) Topical glyceryl trinitrate treatment of chronic patellar tendinopathy: a randomised, double-blind, placebo-controlled clinical trial. Br J Sports Med;47, 34–39.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Resteghini, 2016 |
Type of study: RCT
Setting and country: Homerton Hospital Sports Medicine department.
Funding and conflicts of interest: The authors report no conflicts of interest.
|
Inclusion criteria: - >18 years. - Diagnosis of patella tendinopathy (by ultrasound examination).
Exclusion criteria:
N total at baseline: Intervention: 11 Control: 11
Important prognostic factors2: Age ± SD I: 38.9 ± 8.9 C: 42.5 ± 13.0
Sex: Duration of symptoms (mo ± SD) I: 16.7 ± 9.7 C: 19.2 ± 12.2
Tendon grade (neovascularity ± SD) I: 2.9 ± 0.3 C: 2.5 ± 0.7
Pain (mean VAS)
Groups comparable at baseline? n.r. |
ABI: The area of injection was prepared with chlorhexide spray, followed by an injection of 2 mL 1% lidocaine into subcutaneous tussue around the tendon to be injected. In the meantime, 2mL of autologous blood was withdrawn from the contralateral antecubital fossa using aseptic technique. Patients were asked to stay in the department for 20 minutes to monitor for adverse reactions. Patients were advised on relative rest with normal activities of daily living. Patients were advised that the only analgesia permitted was paracetamol, and that no form of nonsteroidal anti-inflammatory drug whether topical or parental was permitted so as not to confound results. |
Saline: The syringe was covered to disguise the contents and an identical syringe containing the same volume of control substance of normal saline was drawn up.
|
Length of follow-up: 1 year (minimum).
Loss-to-follow-up: I: 0 C: 0
Incomplete outcome data: n.r.
|
Pain
Control:
Function Measured with the Victoria institute of sport assessment for patella tendinopathy scores (VISA-P) Intervention: Control:
Return to sports
Absence duration n.r.
Satisfaction n.r.
|
Limitations: - The clinician injectingthe patient could have been able to differentiate whether saline or blood was being injected due to the viscosity difference when injecting.
Conclusions: This study demonstrated that both the ABI and saline groups experienced a significant improvement in symptoms. However, when the results were compared, there was no statistical difference between the 2 groups.
Comments: Baseline data of function differs. |
|
Scott, 2019 |
Type of study: RCT
Setting and country: Investigation performed at the University of Washington, Seattle, Washington, USA; Olympiatoppen, Oslo, Norway; the Rizzolli Institute, Bologna, Italy; and the University of British Columbia, Vancouver, British Columbia, Canada.
Funding and conflicts of interest: Funding by an unrestricted research grant from the American Orthopeadic Society for Sports Medicine. Cytomedix provided free PRP preparation kits. Cytomedix provided a free loan of centrifugation equipment to the University of Washington and Norway. The following authors received funds: A.S., L.E, S.D.V., K.G.H, R.F.L., G.F.,
|
Inclusion criteria: All patients were between 18 and 50 years old and were diagnosed by the physician investigators using standard diagnostic criteria for patella tendinopathy. Symptoms had to be resent for at least 6 months, and patients had to have already attempted to resolve their conditions with exercise-based rehabilitation for a minimum of 6 weeks.
Exclusion criteria: history of knee or patellar tendon surgery or any inflammatory or prominent degenerative joint condition affecting the knee (ie, physical examination and history suggestive of steoarthritis or chondral lesions).
N total at baseline: Intervention:
Important prognostic factors2: Age ± SD LR-PRP: 32 ± 9.8
Sex:
Body mass index (kg/m2)
Groups comparable at baseline? The 3 groups of 19 participants were demographically and clinically similar. |
LR-PRP/LP-PRP Venous blood (52 mL) was drawn, added to 8 mL of anticoagulant citrate dextrose solution–solution A, and then run through the collection system. At 1 study site an aliquot of the PRP was sent for hematological analysis by the local laboratory to determine the platelet and WBC counts (n = 6, LR-PRP; n = 6, LP-PRP). The LR-PRP contained 230.000 platelets and the LP-PRP contained 227.000 platelets before centrifugation.
After injection of up to 3.5 mL of PRP, the patient lay quietly with the knee extended for 15 minutes. Ice was applied for pain as desired by the patient. For 48 hours after injection, patients were instructed to refrain from exercise. After 1 week, rehabilitation began.
All patients engaged in a supervised gym-based rehabilitation program based on the slow heavy loading program (concentric and eccentric) described by Kongsgaard et al.20 They trained in the rehabilitation facility 3 times per week for 6 weeks. At least 1 session per week was directly supervised by a physical therapist.
|
Saline: saline (3.5 mL) was used to control for mechanical effects of the injected fluid, and patients assigned to saline also had blood withdrawn (then discarded) to maintain participant blinding.
After the injection the patient lay quietly with the knee extended for 15 minutes. Ice was applied for pain as desired by the patient. For 48 hours after injection, patients were instructed to refrain from exercise. After 1 week, rehabilitation began.
All patients engaged in a supervised gym-based rehabilitation program based on the slow heavy loading program (concentric and eccentric) described by Kongsgaard et al.20 They trained in the rehabilitation facility 3 times per week for 6 weeks. At least 1 session per week was directly supervised by a physical therapist.
|
Length of follow-up: 6wk, 12 wk, 24 wk and 1year.
Loss-to-follow-up: LR-PRP: 6
Reasons: participants leaving the study
Incomplete outcome data: Baseline: 1 24wk: 2
|
Pain
LR-PRP:
LP-PRP:
Control: - 6 wk: 3.4 ± 2.2
Function Measured with the VISA-P (1-100)
LR-PRP:
LP-PRP:
Control: - 6 wk: 63 ± 19
Return to sports n.r.
Absence duration n.r.
Satisfaction Measured with the global rating of change (GROC) score.
LR-PRP:
LP-PRP:
Control: - 6 wk: 5.0 ± 0.9 |
Limitations: The variability of treatment responses was higher than that accounted for in our sample size calculation, which leads to the possibility that the study is underpowered. Indeed, this is a relatively small clinical trial.
Conclusions: When combined with an exercise-based rehabilitation program, a single injection of LR-PRP or LP-PRP was no more effective than saline for the improvement of patellar tendinopathy symptoms.
Comments |
|
Steunebrink, 2013 |
Type of study: RCT
Setting and country: Department of Steunebrink Sportsmedicine, Eelde, The Netherlands Department of Sportsmedicine, University Medical Center Groningen, Groningen, The Netherlands Department of Sportsmedicine, Medical Center Haaglanden, Leidschendam, The Netherlands
Funding and conflicts of interest: No competing interests.
|
Inclusion criteria: presence of chronic patella tendinopathy and age of 18–40 years. The diagnosis was based on clinical findings by an experienced sports physician: all patients had a painful tendon related to activity and/or thickened tendon on palpation. Symptoms had to be present for >3 months. MRI and ultrasound were not used. If patients were diagnosed with bilateral patella tendinopathy, only the most painful knee was included. The other knee was treated with the eccentric training programme, but not by using patches.
Exclusion criteria (1) duration >24 months, a Victorian Institute of Sports Assessment-Patella (VISA-P) score of 80 or more, previous surgery or a local (corticosteroid) injection of the knee; (2) previous performance of a complete heavy-load eccentric exercise programme of the knee in the last 2 years or inability to perform it because of serious illness; or (3) current pregnancy or other contra-indication for GTN-use.follow-up
N total at baseline: I: 16
Important prognostic factors2: Age ± SD I: 31.9 ± 9.6
Sex:
Groups comparable at baseline? n.r. |
GTN The active patches (Minitran 5 glyceryltrinitrate patch 3M Pharma Nederland BV) delivered 5 mg of GTN every 24 h.
Patients were instructed on the use of the patches at the time of their initial visit. They were informed that the dosing regimen called for one-quarter of a transdermal patch to be applied daily to the affected patellar tendon. Each quarter patch was to be left in situ for 24 h and then replaced with a new quarter patch. The patches were to be applied at the site of maximal tenderness within a region of 1–2 cm around this point. The patients were instructed to rotate the application for the duration of the study in an attempt to avoid irritation of the skin. |
Control (Kruidvat Renswoude BV).
Patients were instructed on the use of the patches at the time of their initial visit. They were informed that the dosing regimen called for one-quarter of a transdermal patch to be applied daily to the affected patellar tendon. Each quarter patch was to be left in situ for 24 h and then replaced with a new quarter patch. The patches were to be applied at the site of maximal tenderness within a region of 1–2 cm around this point. The patients were instructed to rotate the application for the duration of the study in an attempt to avoid irritation of the skin. |
Length of follow-up: after 6, 12 and 24 weeks.
Loss-to-follow-up: GTN:
Control:
Incomplete outcome data: 0
|
Pain GTN: - 6wk: 5.9 ± 3.1
Control: - 6wk: 5.4 ± 3.3 - 12wk: 6.6 ± 3.7
Function Measured with the VISA-P (0-100)
GTN:
Control:
Return to sports n.r.
Absence duration n.r.
Satisfaction Measured with a 4 point scale (% patients who scored good/excellent)
GTN:
Control: |
Limitations: It was difficult to have a No MRI and no ultrasound imaging were performed. This could be considered a limitation of the study. It is well known, however, that there is limited correlation between clinical symptoms and ultrasound or MRI,31 32 and that they are not the gold standard. Another limitation of this study is that the tendon rehabilitation programme used in this clinical trial was home based and not supervised.
Conclusions: It seems that continuous topical GTN treatment in addition to an eccentric exercise programme does not improve clinical outcome in patients with chronic patella tendinopathy compared to placebo patches in combination with an eccentric exercise programme.
Comments |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Blood agent injections |
||||||||
|
Resteghini, 2016 |
Through a computer- generated randomization program, practitioner A could decipher whether this patient would receive autologous blood or normal saline. |
Unlikely.
|
Unlikely.
|
Unclear A limitation of our study was that despite our best attempts to keep this double blind, the experienced clinician injecting the patient may have been able to differentiate whether saline or blood was being injected due to the viscosity difference when injecting.
|
Unclear Not reported. |
Unlikely.
|
Unlikely.
|
Unlikely.
|
|
Scott, 2019 |
After the patient was registered, an allocation code was automatically generated (saline, LR-PRP, or LP-PRP). Randomization was created automatically by Tenalea in balanced blocks of 6 (1:1:1 ratio), stratified by age (18-34 and 36-50 years) and site. The participants were enrolled in and allocated to their treatment groups by the study coordinator at each treatment site independent of the authors. |
Unlikely.
|
Unlikely.
|
Likely. |
Unlikely.
|
Unlikely.
|
Unlikely.
|
Unlikely.
|
|
Passive transcutaneous medication |
||||||||
|
Steunebrink, 2013 |
Randomisation was performed using sealed opaque, identical envelopes. One unblinded sports physician (AW) coded the envelopes with A or B. To ensure concealment of allocation, data on allocation were stored in a secret location. |
Unlikely.
|
Unlikely.
|
Unclear. |
Unlikely.
|
Unlikely.
|
Unlikely. |
Unlikely. |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Aicale, 2020 |
Wrong studydesign (no systematic review) |
|
Andia, 2015 |
Included studies already included in more recent review. |
|
Andriolo, 2019 |
Included studies had wrong study design or wrong control group. |
|
Balasubramaniam, 2015 |
Included studies described wrong population or used wrong control group. |
|
Challoumas, 2019 |
Only one RCT describes patella tendinopathy, which is already included in our analysis. |
|
De Vos, 2010 |
Included studies had wrong design or described another population. |
|
Di Matteo, 2015 |
Included studies were already included in more recent review. |
|
Dragoo, 2014 |
Wrong control group used. |
|
Everhart, 2016 |
Included studies were already included in more recent review. |
|
Ferrero, 2012 |
Wrong study design (no RCT) |
|
Filardo, 2018 |
Included studies were already included in more recent review. |
|
Filardo, 2010 |
Wrong control group. |
|
Gaida, 2011 |
Included studies were already included in more recent review. |
|
Hoksrud, 2006 |
Wrong control group. |
|
Jeong, 2014 |
Included studies did not meet inclusion criteria for our analysis. |
|
Kaux, 2013 |
Wrong study design (no systematic review). |
|
Liddle, 2015 |
Included studies were already included in more recent review. |
|
Mautner, 2014 |
Wrong study design (no systematic review). |
|
Moreas, 2013 |
Included studies described wrong population or used another control group. |
|
Morath, 2020 |
One RCT met inclusion criteria but was already described in included review. |
|
Nourissat, 2015 |
Wrong study design (no systematic review). |
|
Rigby, 2015 |
Wrong follow-up (two weeks). |
|
Sisk, 2020 |
Wrong study design (no systematic review). |
|
Taylor, 2020 |
Included studies described other population or were not RCTs. |
|
Van Rijn, 2019 |
Included studies were already included in more recent review. |
|
Van der Doelen, 2020 |
One RCT met inclusion criteria but was already described in included review. |
|
Hart, 2011 |
Wrong study design (no systematic review). |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 09-05-2022
Beoordeeld op geldigheid : 25-01-2022
|
Module[1] |
Regiehouder(s)[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Medicamenteuze behandelingen patella tendinopathie |
VSG |
2022 |
2027 |
1x per 5 jaar |
VSG |
- |
[1] Naam van de module
[2] Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders)
[3] Maximaal na vijf jaar
[4] (half)Jaarlijks, eens in twee jaar, eens in vijf jaar
[5] regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft
[6] Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlandse Orthopaedische Vereniging
- Nederlandse Vereniging voor Radiologie
- Koninklijk Nederlands Genootschap voor Fysiotherapie
- Nederlandse Vereniging van Podotherapeuten
- Nederlands Huisartsen Genootschap
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde
De richtlijn is goedgekeurd door:
- Patiëntenfederatie Nederland (en ReumaNederland)
Het Nederlands Huisartsen Genootschap heeft een verklaring van geen bezwaar afgegeven.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met anterieure kniepijn.
Werkgroep
- Dr. S. van Berkel, sportarts, Isala Zwolle, VSG (voorzitter)
- Dr. M. van Ark, fysiotherapeut, bewegingswetenschapper, Hanzehogeschool Groningen, Peescentrum ECEZG, KNGF
- Drs. G.P.G. Boots, bedrijfsarts, zelfstandig werkzaam, NVAB
- Drs. S. Ilbrink, sportarts, Jessica Gal Sportartsen en Sport- en Beweegkliniek, VSG
- Dr. S. Koëter, orthopedisch chirurg, CWZ, NOV
- Dr. N. Aerts-Lankhorst, waarnemend huisarts, NHG
- Dr. R. van Linschoten, sportarts, zelfstandig werkzaam, VSG
- Bsc. L.M. van Ooijen, (sport)podotherapeut en manueel therapeut, Profysic Sportpodotherapie, NVvP
- MSc. M.J. Ophey, (sport)fysiotherapeut, YsveldFysio, KNGF
- Dr. T.M. Piscaer, Orthopedisch chirurg-traumatoloog, Erasmus MC, NOV
- Drs. M. Vestering, radioloog, Ziekenhuis Gelderse Vallei, NVvR
Met methodologische ondersteuning van
- Drs. Florien Ham, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. Mirre den Ouden - Vierwind, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. Saskia Persoon, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. Miriam van der Maten, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Ilbrink |
Sportarts |
Geen |
Geen |
Geen actie |
|
Van Ooijen |
Sportpodotherapeut bij Profysic Sportpodotherapie |
Geen |
Geen |
Geen actie |
|
Van Linschoten |
Sportarts, zelfstandig werkzaam |
Hoofdredacteur Sport&Geneeskunde |
Geen |
Geen actie |
|
Piscaer |
Orthopedisch chirurg-traumatoloog, ErasmusMC |
Geen |
Geen |
Geen actie |
|
Boots |
Bedrijfsarts, zelfstandig werkend voor Stichting Volandis (het kennis- en adviescentrum voor duurzame inzetbaarheid in de Bouw & Infra) en de arbodiensten Human Capital Care en Bedrijfsartsen5. |
Sportkeuringen bij Stichting SMA Gorinchem (betaald), commissie medische zaken "Dordtse Reddingsbrigade" (onbetaald) en |
Geen |
Geen actie |
|
Vestering |
Radioloog Ziekenhuis Gelderse Vallei, Ede |
Geen |
Geen |
Geen actie |
|
Van Ark |
Docent - Hanzehogeschool Groningen opleiding fysiotherapie |
Bij- en nascholing op het thema peesblessures voor verschillende organisaties (betaald) |
Geen |
Geen actie |
|
Ophey |
In deeltijd als fysiotherapeut werkzaam bij 1e lijns praktijk voor fysiotherapie "YsveldFysio" in Nijmegen, https://www.ysveldfysio.nl/ |
Bij- en nascholing van fysiotherapeuten voor verschillende organisaties in binnen-en buitenland), waarbij een enkele scholingsdag ook betrekking heeft op het thema "patellofemorale pijn". (betaald; gastdocent). |
Wetenschappelijk onderzoek gericht op mobiliteit in de kinetische keten bij patiënten met patellofemorale pijn (risicofactor) en op homeostase verstoringen in het strekapparaat (niet gesubsidieerd). |
Geen actie |
|
Van Berkel* |
Sportarts, Isala Zwolle |
Geen |
Geen |
Geen actie |
|
Aerts - Lankhorst |
Waarnemend huisarts |
Geen |
Geen |
Geen actie |
|
Koëter |
Orthopaedisch chirurg CWZ |
Deelopleider Sportgeneeskunde CWZ Hoofd research support office CWZ |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een vragenlijst uit te zetten onder patiënten. De respons op de vragenlijst is besproken in de werkgroep en de verkregen input is meegenomen bij het opstellen van de overwegingen (zie waarden en voorkeuren voor patiënten). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Anamnese en lichamelijk onderzoek PT |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Oefentherapie Patellofemorale pijn (PFP) |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Aanvullende conservatieve behandelingen PFP |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Medicamenteuze behandelingen bij PFP |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Open chirurgie PT en PFP |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Oefentherapie patella tendinopathie (PT) |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Aanvullende conservatieve behandelingen PT |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Medicamenteuze behandelingen PT |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patiënten met anterieure kniepijn. Tevens zijn er knelpunten aangedragen door Koninklijk Nederlands Genootschap voor Fysiotherapie, Nederlandse Vereniging van Podotherapeuten, Stichting LOOP, Vereniging voor Sportgeneeskunde en Zorginstituut Nederland via een schriftelijke Invitational conference. Een verslag hiervan is opgenomen in de bijlage.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: Anterieure kniepijn |
|
|
Uitgangsvraag: Wat is de plaats van medicamenteuze behandelingen, incl. injectietherapie, bij patiënten met patella tendinopathie? |
|
|
Database(s): Embase, Medline |
Datum: 18-11-2020 |
|
Periode: 2000 – 2020 |
Talen: Engels, Nederlands |
|
Literatuurspecialist: Miriam van der Maten |
|
|
Toelichting en opmerkingen: Voor deze vraag is gezocht op patella tendinopathie en medicamenteuze behandeling. Het opgegeven sleutelartikel van Konsgaard (2009) wordt gevonden met de zoekopdracht |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
Zoekopbrengst
|
|
Embase |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
54 |
42 |
36 |
|
RCT |
86 |
67 |
100 |
|
Observationeel |
19 |
31 |
36 |
|
Totaal |
159 |
140 |
200 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#11 |
#8 OR #9 OR #10 |
159 |
|
#10 |
#4 AND #7 NOT (#8 OR #9) |
19 |
|
#9 |
#4 AND #6 NOT #8 |
86 |
|
#8 |
#4 AND #5 |
54 |
|
#7 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'cohort analysis'/de OR cohort*:ab,ti OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
5749128 |
|
#6 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3159901 |
|
#5 |
'meta-analysis'/exp OR 'meta-analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
682078 |
|
#4 |
#1 AND (#2 OR #3) AND ((english)/lim OR (dutch)/lim) AND (2000-2020)/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
378 |
|
#3 |
'nonsteroid antiinflammatory agent'/exp OR 'lidocaine'/exp OR 'paracetamol'/exp OR ((('non steroid*' OR nonsteroid*) NEAR/2 ('anti inflammatry' OR antiinflammatory) NEAR/2 (drug* OR agent* OR compound*)):ti,ab,kw) OR lidocaine:ti,ab,kw OR paracetamol:ti,ab,kw OR acetaminophen*:ti,ab,kw OR 'diclofenac':ti,ab,kw OR voltaren:ti,ab,kw OR naproxen:ti,ab,kw OR ibuprofen:ti,ab,kw OR 'steroid'/exp OR steroid*:ti,ab,kw OR 'corticosteroid'/exp OR (((cortex OR cortical OR cortico OR adrenocortical) NEAR/2 (hormone* OR steroid*)):ti,ab,kw) OR corticoid*:ti,ab,kw OR corticosteroid*:ti,ab,kw OR cortisone:ti,ab,kw OR adrenocorticosteroid*:ti,ab,kw OR 'triamcinolone':ti,ab,kw OR kenacort:ti,ab,kw OR methylprednisolone:ti,ab,kw OR 'polidocanol'/exp OR 'polidocanol':ti,ab,kw OR 'glycosaminoglycan polysulfate'/exp OR 'glycosaminoglycan polysul*ate':ti,ab,kw OR 'hyaluronic acid'/exp OR 'hyaluronic acid':ti,ab,kw OR 'thrombocyte rich plasma'/exp OR 'platelet rich plasma':ti,ab,kw OR 'thrombocyte rich plasma':ti,ab,kw OR prp:ti,ab,kw OR 'autologous conditioned plasma':ti,ab,kw OR acp:ti,ab,kw OR 'autologous blood injection*':ti,ab,kw OR 'prolotherapy'/exp OR 'prolotherapy':ti,ab,kw OR 'proliferation therapy':ti,ab,kw OR 'regenerative injection therapy':ti,ab,kw OR 'stromal vascular fraction':ti,ab,kw OR svf:ti,ab,kw |
2586365 |
|
#2 |
'drug therapy'/exp OR (((drug OR pharma* OR medicament OR medicinal) NEAR/2 (treatment* OR therap*)):ti,ab,kw) OR 'pharmaco therapy':ti,ab,kw OR 'pharmaco treatment':ti,ab,kw OR pharmacotherapy:ti,ab,kw OR pharmacotreatment:ti,ab,kw OR 'injection'/exp OR injection*:ti,ab,kw |
3772793 |
|
#1 |
'patellar tendinopathy'/exp OR 'jumper* knee':ti,ab,kw OR 'patella apicitis':ti,ab,kw OR 'patellar apicitis':ti,ab,kw OR 'patella apex syndrome':ti,ab,kw OR 'patellar apex syndrome':ti,ab,kw OR 'patella tip syndrome':ti,ab,kw OR 'patellar tip syndrome':ti,ab,kw OR 'patella tenosynovitis':ti,ab,kw OR 'patellar tenosynovitis':ti,ab,kw OR (('patellar ligament'/exp OR 'patella'/exp OR 'patella':ti,ab,kw OR 'patellar':ti,ab,kw) AND ('tendinitis'/exp OR 'tendinopathy':ti,ab,kw OR 'tendinopathies':ti,ab,kw OR 'tendinosis':ti,ab,kw OR 'tendinoses':ti,ab,kw OR 'tendinitis':ti,ab,kw OR 'tendinitides':ti,ab,kw OR 'tendonitis':ti,ab,kw OR 'tendonitides':ti,ab,kw OR 'peritendinitis':ti,ab,kw OR 'paratenonitis':ti,ab,kw OR ('tendon':ti,ab,kw AND ('pathology':ti,ab,kw OR 'rupture':ti,ab,kw OR 'ruptures':ti,ab,kw)))) |
2856 |
Ovid/Medline
|
# |
Searches |
Results |
|
12 |
9 or 10 or 11 |
140 |
|
11 |
(5 and 8) not (9 or 10) |
31 |
|
10 |
(5 and 7) not 9 |
67 |
|
9 |
5 and 6 |
42 |
|
8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort*.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
3705519 |
|
7 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2226544 |
|
6 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
485243 |
|
5 |
limit 4 to (english language and yr="2000 -Current") |
256 |
|
4 |
1 and (2 or 3) |
310 |
|
3 |
exp "Anti-Inflammatory Agents, Non-Steroidal"/ or exp Lidocaine/ or exp Acetaminophen/ or (('non steroid*' or nonsteroid*) adj2 ('anti inflammatry' or antiinflammatory) adj2 (drug* or agent* or compound*)).ti,ab,kf. or lidocaine.ti,ab,kf. or paracetamol.ti,ab,kf. or acetaminophen*.ti,ab,kf. or 'diclofenac'.ti,ab,kf. or voltaren.ti,ab,kf. or naproxen.ti,ab,kf. or ibuprofen.ti,ab,kf. or exp Steroids/ or steroid*.ti,ab,kf. or exp "Adrenal Cortex Hormones"/ or ((cortex or cortical or cortico or adrenocortical) adj2 (hormone* or steroid*)).ti,ab,kf. or corticoid*.ti,ab,kf. or corticosteroid.ti,ab,kf. or cortisone.ti,ab,kf. or adrenocorticosteroid*.ti,ab,kf. or 'triamcinolone'.ti,ab,kf. or kenacort.ti,ab,kf. or methylprednisolone.ti,ab,kf. or Polidocanol/ or Polidocanol.ti,ab,kf. or Glycosaminoglycans/ or 'glycosaminoglycan polysul*ate'.ti,ab,kf. or exp Hyaluronic Acid/ or 'hyaluronic acid'.ti,ab,kf. or exp "Platelet-Rich Plasma"/ or 'platelet rich plasma'.ti,ab,kf. or 'thrombocyte rich plasma'.ti,ab,kf. or prp.ti,ab,kf. or 'autologous conditioned plasma'.ti,ab,kf. or acp.ti,ab,kf. or 'autologous blood injection*'.ti,ab,kf. or exp Prolotherapy/ or 'prolotherapy'.ti,ab,kf. or 'proliferation therapy'.ti,ab,kf. or 'regenerative injection therapy'.ti,ab,kf. |
1392099 |
|
2 |
exp Drug Therapy/ or dt.fs. or ((drug or pharma* or medicament or medicinal) adj2 (treatment* or therap*)).ti,ab,kf. or pharmaco-therapy.ti,ab,kf. or pharmaco-treatment.ti,ab,kf. or pharmacotherapy.ti,ab,kf. or pharmacotreatment.ti,ab,kf. or exp Injections/ or injection*.ti,ab,kf. |
3478317 |
|
1 |
("jumper* knee" or "patella apicitis" or "patellar apicitis" or "patella apex syndrome" or "patellar apex syndrome" or "patella tip syndrome" or "patellar tip syndrome" or "patella tenosynovitis" or "patellar tenosynovitis").ti,ab,kf. or ((exp Patellar Ligament/ or exp Patella/ or "Patella".ti,ab,kf. or "patellar".ti,ab,kf.) and (Tendinopathy/ or "Tendinopathy".ti,ab,kf. or "Tendinopathies".ti,ab,kf. or "tendinosis".ti,ab,kf. or "tendinoses".ti,ab,kf. or "tendinitis".ti,ab,kf. or "Tendinitides".ti,ab,kf. or "tendonitis".ti,ab,kf. or "Tendonitides".ti,ab,kf. or "peritendinitis".ti,ab,kf. or "paratenonitis".ti,ab,kf. or ("tendon" and ("pathology" or "rupture" or "ruptures")).ti,ab,kf.)) |
2223 |
