Conservatieve behandelopties bij achilles tendinopathie
Uitgangsvraag
Welke conservatieve behandeling is het meest effectief voor patiënten met achilles tendinopathie?
Aanbeveling
Midportion achilles tendinopathie en Insertie achilles tendinopathie
Adviseer in samenspraak met de patiënt een actieve behandeling. De behandeling dient verzorgd te worden door een zorgverlener die voldoende gekwalificeerd is (medisch of paramedisch zorgverlener).
Bespreek de initiële actieve behandelopties samen met de patiënt. Start bij de behandeling van patiënten met midportion achilles tendinopathie en insertie achilles tendinopathie met:
- Patiënt educatie:
- uitleg over de aandoening;
- uitleg over de prognose;
- pijn educatie.
- Belasting adviezen:
- tijdelijk staken van provocerende (sport)belasting;
- tijdelijk vervangen van provocerende (sport)belasting door niet-provocerende (sport)belasting;
- geleidelijke opbouw van (sport)belasting;
- gebruik een pijnschaal om de mate van klachten gerelateerd aan (sport)belasting te monitoren en aan te passen.
- Opbouwende krachtoefeningen van de kuitspieren gedurende minimaal 12 weken. De vorm van oefentherapie dient afgestemd te worden met de individuele patiënt. Overweeg hierin de motivatie, tijdsbelasting, pijnmonitoring en beschikbaarheid van faciliteiten een rol te laten spelen. Overweeg bij insertie achilles tendinopathie om de oefeningen initieel uit te voeren vanaf een vlakke ondergrond.
Indien patiënt educatie is toegepast en na 3 maanden structurele oefentherapie en opvolgen van belastingadviezen geen verbetering is opgetreden, overleg dan met de patiënt welke aanvullende behandelopties in overweging genomen kunnen worden. Bespreek de onzekerheid van het aanvullende effect en de voor- en nadelen van iedere aanvullende behandeling. In samenspraak met de patiënt kan dan tot de beste behandeloptie worden besloten.
De volgende aanvullende behandelopties kunnen bij onvoldoende effectiviteit van patiënt educatie, belasting adviezen en adequate oefentherapie worden overwogen in combinatie met oefentherapie:
- Extracorporale shockwave therapie (ESWT).
- Andere passieve modaliteiten (het gebruik van een nachtspalk, inlays, gebruik van collageen supplementen, toepassen van ultrageluid en frictie massages, laser therapie en licht therapie).
- Injectie behandelingen (injecties met polidocanol, lidocaïne, autoloog bloed, plaatjes-rijk plasma, stromale vasculaire fractie, hyaluronzuur, prolotherapie of een hoog-volume injectie) en acupunctuur (of intratendineuze needling).
Wees terughoudend met het toepassen van de volgende aanvullende behandelopties:
- Non-Steroidal Anti-Inflammatory Drugs (NSAIDs).
- Corticosteroïd injecties.
Overwegingen
In deze uitgangsvraag is de effectiviteit van conservatieve behandelopties bij patiënten met achilles tendinopathie beoordeeld.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Uit de resultaten blijkt dat er veel verschillende behandelopties voorhanden zijn voor achilles tendinopathie, met name voor het subtype midportion achilles tendinopathie. De bewijskracht voor deze behandelingen is echter in bijna alle gevallen laag tot zeer laag en de geschatte behandeleffecten overlappen elkaar grotendeels in vrijwel alle behandelcategorieën. Daar waar er geen overlap is, zijn de resultaten gebaseerd op twee kleine RCT’s (voor zowel acupunctuur als oefentherapie+shockwave therapie) met een hoog risico op bias (Rompe, 2009; Zhang, 2013). Dit geeft weer dat er een sterke onzekerheid is in de schattingen van de behandeleffecten en dat er dus ook geen sterke aanbevelingen mogelijk zijn. Daarnaast is het aantal studies voor insertie achilles tendinopathie zeer beperkt, waardoor ook voor dit subtype sterke aanbevelingen niet mogelijk zijn. De werkgroep is van mening dat voor veel behandelcategorieën de adviezen geëxtrapoleerd kunnen worden naar patiënten met insertie tendinopathie. In een klein aantal gevallen zal de aanbeveling echter zijn om deze entiteit anders te behandelen. Daar waar dit het geval is, zal dit duidelijk worden geëxpliciteerd.
De werkgroep tracht in deze overwegingen uiteen te zetten hoe het uiteindelijk tot de aanbevelingen is gekomen. De effectiviteit van de behandeling, de veiligheid van de behandeling, de tijd die de patiënt in de behandeling moet investeren, de kosten van de behandeling (voor de patiënt en/of de maatschappij indien het binnen de vergoede zorg valt) en de beschikbaarheid van de behandeling op nationaal niveau, evenals de klinische expertise van de behandelaar en voorkeuren van patiënten zijn in deze overwegingen meegenomen. De werkgroep is van mening dat bij het bespreken van de behandelopties sterk moet worden overwogen om het ‘shared decision-making’ model toe te passen, om zo de kans op een succesvolle uitkomst van de behandeling te verhogen (Bowen, 2020; Dijkstra, 2017; Spinnewijn, 2020).
Een actieve behandeling lijkt superieur aan een overwegend afwachtend beleid bij patiënten met midportion achilles tendinopathie. Omdat er gemiddeld een klinisch relevant verschil is tussen alle actieve behandelvormen en een overwegend afwachtend beleid, adviseert de werkgroep om een vorm van actieve behandeling toe te passen bij patiënten met achilles tendinopathie. Hoewel dit niet specifiek is onderzocht voor insertie achilles tendinopathie, acht de werkgroep het aannemelijk dat deze resultaten geëxtrapoleerd kunnen worden naar dit subtype tendinopathie. Andersom betekent dit dus dat de werkgroep adviseert om geen overwegend afwachtend beleid te hanteren. Dit advies is gebaseerd op onderzoeken bij patiënten met chronische achilles tendinopathie (langer dan 8 tot 12 weken bestaande klachten). Het is discutabel of dit kan worden geëxtrapoleerd naar de groep patiënten met kort bestaande (reactieve) achilles tendinopathie. Bij kort bestaande achilles tendinopathie kan wel eerst een korte periode van relatieve rust worden geïnitieerd als overbelasting een evidente risicofactor is in de anamnese van de individuele patiënt (Cook, 2009). De werkgroep adviseert echter ook voor patiënten met kort bestaande (reactieve) achilles tendinopathie een adequate follow-up af te spreken en actieve behandeling toe te passen om de belastbaarheid van de pees te vergroten en een geleidelijke terugkeer naar (sport)belasting te faciliteren. Onderstaande principes kunnen ook daar worden toegepast.
Patiënt educatie en het geven van belasting adviezen zijn niet eerder in RCT’s onderzocht op effectiviteit voor patiënten met achilles tendinopathie. De werkgroep geeft aan dat in de praktijk behandelingen normaliter worden gecombineerd met patiënt educatie en belasting adviezen. De werkgroep is van mening dat patiënt educatie bijdraagt aan een adequaat verwachtingsmanagement en plannen van meer realistische doelstellingen. De belasting adviezen hebben als belangrijk doel om de patiënt zelfbewuster en zelfredzamer te maken. Op basis van klinische expertise adviseert de werkgroep om patiënt educatie en belasting adviezen te overwegen als basis van de behandeling van achilles tendinopathie.
De term patiënt educatie wordt gebruikt voor het uitwisselen van kennis tussen de zorgverlener en patiënt op een interactieve manier. Effecten van patiënt educatie worden vaak onderbelicht. Recent onderzoek bij patiënten met gluteus medius tendinopathie laat zien dat patiënt eductie in combinatie met oefentherapie effectiever is dan een overwegend afwachtend beleid of een injectie met corticosteroïden (Mellor, 2018). Patiënt educatie voor patiënten met achilles tendinopathie heeft volgens de werkgroep 3 elementen: uitleg over de aandoening, uitleg over de prognose en pijn educatie. Concreet houdt dit in dat er uitleg wordt gegeven over het degeneratieve aspect van de aandoening met vaak langdurige klachten. Deze klachten kunnen een terugkerend karakter hebben, vooral indien de specifieke provocerende (sport)belasting wordt gecontinueerd. Pijn educatie houdt in dat zorgverleners hun kennis over pijn delen met de patiënt. Dit omvat uitleg van de neurofysiologie van acute en chronische pijn (inclusief centrale sensitisatie). In de vroege fase van een reactieve tendinopathie kan er nog sprake zijn van een acute (fysiologische) pijn, terwijl in de chronische fase de pijn pathologisch (dysfunctioneel) kan zijn (Rio, 2014). Naast lichamelijke factoren komt er steeds meer aandacht voor de invloed van psychosociale aspecten op langdurige pijnklachten. Uit recent onderzoek blijken deze psychosociale factoren ook een belangrijke rol te spelen bij patiënten met achilles tendinopathie (Mc Auliffe, 2017). Relatieve rust kan kortdurend waarschijnlijk de pees beschermen in de vroege (reactieve) fase van de tendinoapthie. Echter, factoren zoals angst voor het ontstaan van meer schade of een volledige ruptuur, bewegingsangst en catastroferen van de klachten, kunnen vooral bij langer bestaande klachten het herstel negatief beïnvloeden. Bij de aanwezigheid van dit soort factoren kan pijn educatie effectief zijn in het verbeteren van ervaren gezondheid en verminderen van de zorgconsumptie. Dit is voornamelijk bij patiënten met lage rugpijn onderzocht, maar nog niet bij patiënten met achilles tendinopathie (Louw, 2014).
Belasting advies bestaat uit het tijdelijk vervangen van provocerende (sport)belasting door niet-provocerende (sport)belasting, geleidelijke opbouw van (sport)belasting en het gebruik van een pijnschaal om de mate van pijnklachten gerelateerd aan (sport)belasting te monitoren en aan te passen. Hoewel ook deze strategie geaccepteerd is voor patiënten met tendinopathie, is het effect hiervan niet in een gerandomiseerde studie onderzocht (Davenport, 2005). Deze belasting adviezen hangen nauw samen met de patiënt educatie, waarbij het van belang is om beweging voldoende te stimuleren maar risicovol gedrag met een ‘flare-up’ van pijn juist te vermijden. Uiteindelijk zouden patiënten met deze strategie in staat moeten zijn om de belasting geleidelijk te verhogen binnen de acceptabele pijngrenzen.
De werkgroep adviseert bij de behandeling van patiënten met achilles tendinopathie te starten met een vorm van krachtoefeningen van de kuitspieren en de achillespees. Deze behandeling wordt geadviseerd voor een duur van minimaal 12 weken; op dit tijdstip mag na adequate oefentherapie verbetering in ervaren klachten worden verwacht en dit vormt een goede basis om de oefeningen verder op te bouwen. Dit advies wordt verstrekt aangezien de resultaten van oefentherapie veelal vergelijkbaar zijn met de resultaten van andere conservatieve behandelopties. Er zijn echter nog veel vragen over de rol van de krachtoefeningen en hoe deze gedoseerd moeten worden. Er zijn bij patiënten met achilles tendinopathie meerdere vormen van krachtoefeningen beschikbaar, waaronder excentrische oefentherapie, concentrische oefentherapie, opbouwende krachtoefeningen en ‘heavy slow resistance’ oefeningen. Er zijn geen duidelijke verschillen gevonden in de effectiviteit van deze vormen van oefentherapie. Daarnaast is er beperkte of onvoldoende kennis over de invloed van factoren zoals het optimale aantal sessies per week, het aantal herhalingen, het gebruik van externe gewichten en de mate van pijn tijdens oefeningen. Uit de resultaten van de submodule ‘Operatieve behandelopties’ komt naar voren dat er zeer laag bewijs is dat er geen invloed is van (1) de mate van therapietrouwheid gedurende het oefenprogramma, (2) de mate van toevoeging van extra gewicht waarmee de oefentherapie uitgevoerd is en (3) of de oefeningen technisch correct worden uitgevoerd op de effectiviteit van het programma. De keuze voor de vorm van oefentherapie dient daarom afgestemd te worden op het individu. Het toevoegen van gewichten kan worden overwogen, met name als de patiënt een hoge (sport)belasting van de pees eist. De werkgroep adviseert om de mate van pijn tijdens en na de oefeningen een rol te geven in de opbouw van dit programma (Stevens, 2014). Het gegeven dat de techniek van uitvoering van de oefeningen geen prominente rol speelt impliceert dat het gebruik van informatiefolders en websites met foto- en film materiaal opties zijn om de oefeningen uit te leggen aan patiënten.
Het meeste onderzoek is verricht naar de effectiviteit van excentrische oefentherapie. Omdat deze vorm als pijnlijk kan worden ervaren door patiënten, kan hiermee rekening worden gehouden in de opbouw. De werkgroep adviseert om de patiënt een serie van 15 isotonische oefeningen van de kuitspieren te laten uitvoeren en de mate van pijn te laten evalueren tijdens en na de oefeningen. Indien het pijn niveau (score 0 tot 10) op een score van vijf punten of hoger uitkomt of als de spiervermoeidheid het niet of nauwelijks mogelijk maakt om één serie uit te voeren, dan kan de patiënt starten met isometrische oefenvormen. De ervaring van de werkgroep is dat deze isometrische oefenvormen bij sommige patiënten minder pijn uitlokken. In die groep kan deze stap nuttig zijn. Recent onderzoek laat zien dat isometrische oefeningen bij patiënten met achilles tendinopathie gemiddeld genomen geen analgetisch effect hebben (O'Neill, 2019b; Van der Vlist, 2019b). Als de patiënt geen pijnreductie ervaart bij isometrische oefeningen, dan adviseert de werkgroep over te gaan naar minder zware isotonische vormen (door bijvoorbeeld tijdelijk met 2 benen te trainen of door het aantal herhalingen per serie te verlagen). Indien de isometrische oefeningen wel pijnreducerend zijn en de pijnscore vijf punten of minder is, dan kan de patiënt starten met isotonische vormen en deze opbouwen met gewichtstraining als de condities het toelaten. In de opbouw van deze oefeningen zal de mate van pijn tijdens en na de oefeningen steeds leidend zijn in de progressie (een pijnscore van vijf of minder kan worden geaccepteerd). Afhankelijk van de sportwens kan na afronding van een isotonische fase nog een fase plyometrische oefeningen worden gedaan. Zie figuur 3 voor een schematisch overzicht van deze patiënt-gecentreerde benadering, dat als voorbeeld dient.
Het overgrote deel van de onderzoeken die de effectiviteit van oefentherapie hebben beoordeeld zijn uitgevoerd in patiënten met een midportion achilles tendinopathie. Er dient daarom meer onderzoek uitgevoerd te worden naar de effectiviteit van oefentherapie bij patiënten met een insertie achilles tendinopathie. Er is onderzoek met zeer lage bewijskracht waaruit blijkt dat oefentherapie vanaf vlakke ondergrond effectiever is dan oefentherapie waarin er wordt getraind met een diepe dorsaalflexiehoek van de enkel bij patiënten met insertie achilles tendinopathie (niet geïncludeerd in de resultaten van deze uitgangsvraag) (Fahlstrom, 2003; Jonsson, 2008). De theorie is dat er in diepe dorsaalflexiehoeken een grotere compressiekracht is van de calcaneus en bursa retrocalcaneï op de achillespees insertie (Fahlstrom, 2003). Deze verhoogde druk kan leiden tot een zogeheten compressie tendinopathie (Cook, 2012). Het wegnemen van deze compressie in de eerste fase van oefentherapie kan hypothetisch effectief zijn. Hoogwaardige wetenschappelijke literatuur hiervoor ontbreekt momenteel echter.
In de praktijk wordt bij het inrichten van de oefentherapie ook vaak aandacht geschonken aan de rol van de kinetische keten en correctie daarvan. Met de kinetische keten wordt bedoeld dat het lichaam als één geheel functioneert en de eigenschappen van één gewricht daarom waarschijnlijk niet verklarend zijn voor het optreden van een blessure. Er is beperkt onderzoek gedaan naar de risicofactoren in de kinetische keten voor het ontstaan van achilles tendinopathie. Daarnaast is er geen onderzoek voorhanden over de effectiviteit van correcties op de kinetische keten. Om die reden heeft de werkgroep dit niet in de aanbevelingen opgenomen.
Er is een zeer lage tot lage bewijskracht dat acupunctuur en oefentherapie+shockwave therapie de meest effectieve behandelopties zijn na 3 maanden. Deze resultaten zijn echter gebaseerd op twee kleine gerandomiseerde studies die beiden een hoog risico op bias hadden. Voor de acupunctuur geldt daarnaast nog dat de procedure van de behandeling in de studie matig is beschreven en daardoor moeilijk reproduceerbaar is. Het is zeer discutabel of de onderzochte behandeling de klassieke vorm van acupunctuur betreft en of er geen sprake is geweest van intratendineuze needling. Daarnaast laten de betrouwbaarheidsintervallen een grote onzekerheid zien in de schattingen van de behandeleffecten. Beide studies tonen enkel de resultaten na 3 maanden, waardoor onbekend is wat het effect van deze behandelingen is op langere termijn. De resultaten bij 12 maanden follow-up wijzen uit dat andere conservatieve behandelingen (orthesen en injectiebehandelingen) niet effectiever zijn dan oefentherapie. Deze effectiviteit van de conservatieve behandelopties uit de andere behandelcategorieën worden onderstaand besproken.
Een frequent toegepaste medicamenteuze behandeling in de klinische praktijk is anti-inflammatoire medicatie. De effectiviteit van een transcutane (gel) vorm en tablet vorm is in twee RCT’s onderzocht (Auclair, 1989; Heinemeier, 2017). Patiënten met kortdurende (< 1 maand) en chronische (> 3 maanden) klachten zijn in deze onderzoeken geïncludeerd. De effecten van deze Non-Steroidal Anti-Inflammatory Drugs (NSAIDs) zijn daarin niet effectief gebleken op cruciale patiënt-gerapporteerde uitkomstmaten op korte termijn (1 tot 3 weken).
De effectiviteit van shockwave (radiale drukgolf) therapie is in meerdere RCT’s onderzocht (Lynen, 2017; Njawaya, 2017; Rompe, 2008; Rompe, 2009; Rompe, 2007). Op basis van de network meta-analysis kan worden geconcludeerd dat shockwave effectiever lijkt wanneer deze behandeling wordt gecombineerd met oefentherapie. Als shockwave therapie wordt overwogen, dan adviseert de werkgroep om dit toe te passen als aanvullende behandeling naast de krachtoefeningen voor de kuitspieren. Alle geïncludeerde RCT’s in de netwerk meta-analyse passen shockwave therapie toe in 3 sessies met een wekelijks interval, er is een spreiding in aantal shockwaves van 1500 tot 2000 pulses per sessie waarin de puls frequentie varieert van 4 tot 15 Hz en de druk/energiedichtheid niet consistent is beschreven in de betreffende onderzoeken. Na 3 sessies zou er dus een effect van shockwave therapie moeten worden verwacht. Er is bewijs dat het richten van de shockwave therapie op de locatie van de meeste klachten van de patiënt net zo effectief is als het richten van de shockwave op de locatie van de meeste echografische afwijkingen (Njawaya, 2017). In deze onderzoeken werd steeds radiale shockwave therapie toegepast en geen gefocusseerde shockwave therapie. Het is dus onbekend of deze resultaten geëxtrapoleerd kunnen worden naar de effecten van toepassing van gefocusseerde shockwave therapie. Wel is het effect van shockwave therapie onderzocht bij zowel insertie achilles tendinopathie als midportion achilles tendinopathie. Hoewel de resultaten op het gebeid van de insertie achilles tendinopathie niet konden worden meegenomen in een network meta-analysis, was de trend van een positief effect ook bij dit subtype tendinopathie zichtbaar.
Andere passieve behandelingen die in gerandomiseerde onderzoeken zijn onderzocht, zijn het gebruik van een nachtspalk, inlays, gebruik van collageen supplementen, toepassen van ultrageluid en frictie massages, laser therapie en licht therapie. De effecten van deze behandelingen op de VISA-A score, terugkeer naar sport en/of patiënttevredenheid lijken in het algemeen minder groot dan voor shockwave therapie. De onzekerheid van de geschatte behandeleffecten zijn ook hier echter groot. Een praktisch probleem bij het testen van de effectiviteit is het feit dat er veel aanpassingen op de behandelingen mogelijk zijn. Zo kan een nachtspalk in vele vormen en met verschillende materialen worden gemaakt en is de dorsaalflexiehoek van de enkel vaak variabel in te stellen. Een ander voorbeeld is het testen van de effectiviteit van inlays. Er bestaan geprefabriceerde inlays, maar deze kunnen ook ‘custom-made’ worden vervaardigd op basis van specifieke patiënt karakteristieken (lichamelijk onderzoek, standsafwijkingen en/of een dynamisch gangpatroon). Omdat deze laatste categorie een klinisch inzicht vereist en dus afhankelijk is van de individuele behandelaar, zal het altijd moeilijk blijven om de resultaten van een RCT op dit gebied te vertalen naar de lokale klinische praktijk.
Voor het toepassen van injectietherapie zijn er verschillende opties. Onderzochte opties in RCT’s zijn injecties met polidocanol, lidocaïne, autoloog bloed, plaatjes-rijk plasma, stromale vasculaire fractie, hyaluronzuur, prolotherapie, high-volume injectie. Andere behandelingen waarbij gebruik is gemaakt van naalden zijn acupunctuur en dry needling. Ook voor deze behandelingen geldt dat de onzekerheid van de geschatte behandeleffecten groot zijn. Op basis van de analyses die gedaan zijn naar effecten van de afzonderlijke types injectievloeistoffen, is er niet één type injectie dat superieur blijkt te zijn in effectiviteit boven de andere. Een praktisch probleem bij het testen van de effectiviteit is het feit dat er veel manieren zijn om de injecties toe te passen. De locatie van de injectie, gebruik van echografie tijdens de injectie, het volume en de dosering van de geïnjecteerde vloeistof, het toepassen van co-interventies en het aantal injecties zijn allemaal factoren die invloed kunnen hebben op de uitkomst.
Een aparte entiteit binnen de behandelcategorie injectietherapie zijn de corticosteroïden. Deze injectiebehandeling is niet in de network meta-analysis geïncludeerd omdat er geen geschikt onderzoek voorhanden was. Er is wel 1 kleine placebo-gecontroleerde RCT gepubliceerd die laat zien dat een peritendineuze injectie met corticosteroïden geen effect heeft bij patiënten met midportion achilles tendinopathie (DaCruz, 1988). Het gebruik van corticosteroïden bij tendinopathieën in het algemeen wordt ontraden wegens het slechte effect op lange termijn (Coombes, 2010).
Bijwerkingen of complicaties als gevolg van oefentherapie, orthosen, shockwave therapie, medicamenteuze therapie, acupunctuur en injectie therapie zijn weinig frequent voorkomend (tabel 5). Geen van deze conservatieve behandelopties lijkt te leiden tot serieuze bijwerkingen of complicaties. Van de oefentherapie, shockwave therapie en injectie therapie is beschreven dat deze behandelingen in de initiële fase kunnen leiden tot een toename van klachten. Shockwave therapie en injectie therapie kunnen daarnaast leiden tot respectievelijk prikkeling en roodheid van de lokale huid en zwelling van de pees. Specifiek voor corticosteroïd injecties is een verhoogde kans op een peesruptuur gerapporteerd, die toeneemt bij de toename in het aantal injecties (Seeger, 2006). Orthesen kunnen leiden tot klachten van discomfort en drukneuropathie. Medicamenteuze behandelingen zijn in een laag percentage van de gevallen geassocieerd met een milde allergische reactie. In de studie naar effecten van acupunctuur werden bijwerkingen niet gerapporteerd.
Een aantal aanvullende conservatieve behandelingen voor achilles tendinopathie is niet in RCT’s onderzocht, maar wordt wel in de praktijk toegepast. Voorbeelden daarvan zijn het toepassen van een hakverhoging, myofasciale technieken (dry needling) en Percutane Electrolyse Therapie (EPTE ofwel PNE). De werkgroepleden hebben de ervaring dat een schoenaanpassing of een hakverhoging kan leiden tot klachtenvermindering, met name als er een hoog klachten niveau in algemeen dagelijks functioneren is, zoals bij lang staan of wandelen. In de werkgroep is geen ervaring met myofasciale dry needling en Percutane Electrolyse Therapie. Gezien het ontbreken van voldoende gegevens over de effectiviteit, de veiligheid en het kostenaspect, heeft de werkgroep besloten dit soort behandelingen niet in de aanbevelingen mee te nemen.
Waarden en voorkeuren van individuen met achilles tendinopathie
Informatievoorziening over de uitvoering van oefentherapie is belangrijk voor patiënten. Welke informatie en kennis aan een patiënt moet worden overgedragen, wanneer en hoe vaak en op welke wijze de overdracht aan de patiënt optimaal kan verlopen is echter onvoldoende onderzocht en op dit moment onduidelijk. De werkgroep is van mening dat mondelinge informatie goed kan worden ondersteund door een andere vorm van informatie, bijvoorbeeld een informatiefolder of relevante informatie op betrouwbare internet bronnen (bijvoorbeeld www.sportzorg.nl). Er dient bij deze informatievoorziening tevens rekening gehouden te worden met het onderscheid tussen patiënten met een midportion achilles tendinopathie en patiënten met een insertie achilles tendinopathie. Voor de mondelinge overdracht van de informatie over tendinopathie, de monitoring van klachten, bespreken van doelen en verzorgen van persoonlijke begeleiding zijn sportartsen en (sport)fysiotherapeuten specifiek opgeleid. Andere zorgverleners met ervaring op dit gebied kunnen echter ook adequaat geëquipeerd zijn om deze taken uit te voeren. Welke specifieke zorgverlener de informatievoorziening en begeleiding verzorgt zal afhangen van de voorkeuren van de individuele patiënt. Daarnaast dient er nog rekening te worden gehouden met een patiëntengroep die een voorkeur hebben voor ‘self-management’. Communicatie om de specifieke wensen van de individuele patiënt te achterhalen is hierin van eminent belang volgens de werkgroep.
Bij de uitvoering van oefentherapie wordt er gevraagd om een tijdsbelasting voor de patiënt. Dit is vooral bij excentrische oefentherapie het geval (180 herhalingen per dag). In één studie is de duur van excentrische oefentherapie vergeleken met de duur van ‘heavy slow resistance’ oefeningen (Beyer, 2015). De duur van het excentrische oefenprogramma was 308 minuten per week, tegenover 107 minuten per week voor de ‘heavy slow resistance’ oefeningen. Deze ‘heavy slow resistance’ oefentherapie is echter praktisch lastig uit te voeren, omdat voor de oefeningen gebruik gemaakt dient te worden van een kuitspier machine in de sportschool of er dient specifieke apparatuur te worden aangeschaft.
Daarnaast adviseert de werkgroep om de patiënt te betrekken bij het opstellen van het oefentherapie programma. Eén studie heeft de effectiviteit van excentrische oefentherapie vergeleken met dosering van het aantal herhalingen van de excentrische oefentherapie binnen de acceptabele pijngrenzen. Hierbij bleken de patiënten die zelf het aantal herhalingen konden bepalen middels pijnmonitoring een betere uitkomst te hebben op korte termijn. Deze pijnmonitoring speelt ook bij de opbouwende oefentherapie een belangrijke rol (Figuur 3). Bij pijnklachten door druk van schoeisel op de achillespees tijdens de uitvoering van de oefeningen adviseert de werkgroep om de oefeningen zonder schoeisel uit te voeren.
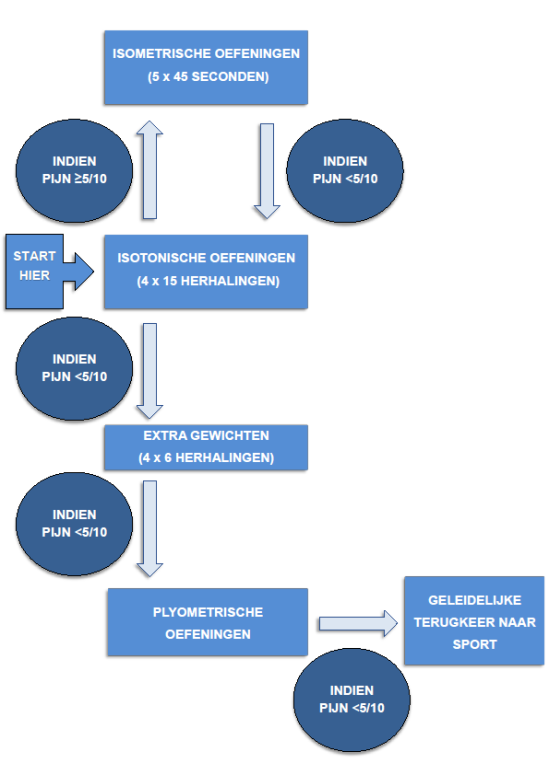
Figuur 3 Voorgesteld stroomschema om krachtoefeningen van de kuitspieren (gastrocnemius en soleus spieren) en plyometrische oefeningen op te bouwen. De mate van pijn (gemeten middels VAS-score of NRS-schaal) die tijdens en na de oefeningen voelbaar zijn en de spier vermoeidheid zijn leidend voor de snelheid van de opbouw
Kosten
Er zijn geen studies uitgevoerd naar de (kosten)effectiviteit van het geven van patiënt educatie, belasting adviezen en adviseren en begeleiden van oefentherapie. Verwacht wordt echter dat de kosten voor de initiële uitvoering van oefentherapie laag zijn, aangezien deze grotendeels zelfstandig uitgevoerd kunnen worden. De werkgroep geeft aan dat het kan worden overwogen om de patiënt educatie, belasting adviezen en advisering en instructie van de oefentherapie in de eerste fase te laten begeleiden door een gekwalificeerde zorgverlener. Hierbij kan de informatievoorziening mondeling worden gedaan, kunnen de oefeningen worden geïnstrueerd, en is er mogelijkheid tot het stellen van vragen. Informatie via folders of via een website kunnen dit ondersteunen en de noodzaak tot frequente vervolgbezoeken terugdringen.
De directe kosten als gevolg van behandeling met orthosen, shockwave therapie, medicamenteuze therapie, acupunctuur en injectie therapie zijn naar verwachting hoger dan het geven van patiënt educatie, belasting adviezen en adviseren en begeleiden van oefentherapie. Omdat dit echter niet eerder is onderzocht in een kosteneffectiviteit studie en er geen zicht is op de beïnvloeding van indirecte kosten, zal hier niet dieper op in worden gegaan.
Aanvaardbaarheid voor de overige stakeholders
Het verstrekken van informatie en educatie kost tijd, terwijl de huidige praktijkvoering hier vaak niet op ingericht is. Daarom dient hiervoor voldoende tijd vrijgemaakt te kunnen worden. Tevens dienen platformen waarop patiënten ingelicht worden onderhouden te worden, zodat patiënten met achilles tendinopathie aldaar een deel van de voorlichting en educatie kunnen vinden. Nader onderzoek is nodig hoe dit het beste in de klinische praktijk kan worden georganiseerd: zoals door wie (de behandelend arts, paramedisch zorgverlener of een zorgondersteuner), en in welke vorm (één-op-één, via een internetplatform, et cetera).
Haalbaarheid en implementatie
Voor het verstrekken van volledige en gestandaardiseerde informatie en educatie omtrent de aandoening en de advisering en uitvoering van oefentherapie is het wenselijk dat er overeenstemming is tussen de verschillende zorgverleners. Voor de Nederlandse situatie, waar veel disciplines betrokken zijn bij de behandeling van achilles tendinopathie, is nadere uitwerking daarvan waarschijnlijk bevorderlijk voor de implementatie.
Balans tussen de argumenten voor en tegen de interventie
Gezien de vergelijkbare resultaten tussen de verschillende conservatieve behandelopties, het lage risico op complicaties, de goede praktische uitvoerbaarheid en beschikbaarheid en de verwachte lage kosten adviseert de werkgroep om behandeling te starten met patiënt educatie, belasting adviezen en opbouwende oefentherapie.
Bij de overweging voor aanvullende conservatieve behandeling adviseert de werkgroep een aantal zaken mee te nemen. De werkgroep acht de volgende overwegingen voor het toepassen van aanvullende conservatieve behandelingen van belang: 1) de veiligheid; 2) de tijdsinvestering van de patiënt; 3) de kosten en 4) de beschikbaarheid. Op basis van deze overwegingen kan de werkgroep een advies uitbrengen over het toepassen van aanvullende conservatieve behandelingen.
Indien patiënt educatie, belasting adviezen en een adequaat uitgevoerd programma met opbouwende krachtoefeningen van de kuitspieren na 3 maanden geen effect op de klachten geven, kunnen andere conservatieve behandelopties worden overwogen. Bovenstaande gegevens laten echter zien dat er veel onzekerheid is over het toegevoegde klinisch relevante effect van aanvullende conservatieve behandelingen, zowel op korte - als lange termijn. Dit gegeven hoeft er niet per definitie toe te leiden dat aanvullende behandelingen niet moeten worden overwogen. Wel geeft de werkgroep aan dat communicatie met de patiënt over de onzekerheid van de toegevoegde waarde van de behandeling vooraf noodzakelijk is en dat de overwegingen voor het toepassen van aanvullende conservatieve behandelingen moeten worden besproken met de patiënt. Op basis hiervan kan met de individuele patiënt een gewogen keuze worden gemaakt uit onderstaande aanvullende conservatieve behandelingen:
Shockwave therapie kan worden overwogen naast het continueren van de krachtoefeningen voor de kuitspieren. Shockwave therapie is veilig en voldoende beschikbaar. Deze behandeling leidt wel in de meeste gevallen tot hogere directe kosten dan de initiële behandelingen (patiënt educatie, belasting adviezen en oefentherapie). De werkgroep adviseert om na 3 sessies een evaluatie te doen en de shockwave behandeling te staken bij weinig tot geen effect of bij een volledig herstel. Indien er verbetering is opgetreden zonder volledig herstel, adviseert de werkgroep om maximaal 5 sessies shockwave therapie te overwegen. De werkgroep acht het niet aannemelijk dat het toepassen van meer dan 5 sessies een klinisch relevant verschil zal geven.
Andere aanvullende passieve behandelingen (het gebruik van een nachtspalk, inlays, gebruik van collageen supplementen, toepassen van ultrageluid en frictie massages, laser therapie en licht therapie) kunnen volgens de werkgroep worden overwogen. Het is van belang om met de patiënt te delen dat voor een aantal van deze behandelingen binnen de behandelcategorie geldt dat het geen grotere effectiviteit heeft dan oefentherapie na 1 jaar follow-up. De veiligheid van deze behandelingen is voldoende gewaarborgd en in het algemeen zijn deze behandelingen beschikbaar. Het leidt wel in de meeste gevallen tot hogere directe kosten dan de initiële behandelingen.
Het toepassen van injectietherapie (injecties met polidocanol, lidocaïne, autoloog bloed, plaatjes-rijk plasma, stromale vasculaire fractie, hyaluronzuur, prolotherapie of een high-volume injectie) of acupunctuur (intratendineuze needling) kunnen worden overwogen. Het is van belang om met de patiënt te delen dat voor een aantal van deze behandelingen binnen de behandelcategorie geldt dat het geen grotere effectiviteit heeft dan oefentherapie na 1 jaar follow-up. De veiligheid van deze behandelingen is voldoende gewaarborgd en bij gecontroleerd gebruik, zoals in de RCT’s zijn geen serieuze bijwerkingen of complicaties gerapporteerd. Bij ongecontroleerd of frequent gebruik hebben injectie behandelingen mogelijk een groter complicatie risico (infectie en peesruptuur zijn gemeld post-injectie) (Redler, 2020; Seeger, 2006). Tevens is de ervaring van de werkgroep dat injectie behandelingen door de patiënt vaak als pijnlijk worden ervaren. De beschikbaarheid van injectie behandelingen in de Nederlandse setting is goed. Het leidt wel in de meeste gevallen tot hogere directe kosten dan de initiële behandelingen. Dit wordt mede veroorzaakt doordat artsen deze behandeling uitvoeren en doordat de geïnjecteerde medicatie leidt tot hogere directe kosten. In sommige gevallen (injecties met plaatjes-rijk plasma en prolotherapie) lijkt er een effectiviteit te zijn bij herhaalde injecties, waardoor de directe kosten verder toenemen.
De werkgroep adviseert terughoudend te zijn in het voorschrijven of toepassen van een aantal aanvullende conservatieve behandelingen. De effecten van Non-Steroidal Anti-Inflammatory Drugs (NSAIDs) zijn niet effectief gebleken. De NSAIDs hebben, met name bij ouderen, ook een ongunstig bijwerkingsprofiel. Een ander potentieel nadeel van deze medicatie is het pijnstillende effect op korte termijn en daardoor de interferentie met de belasting adviezen die de werkgroep adviseert. Het gebruik van een pijnschaal wordt hierdoor namelijk minder betrouwbaar en dit maskerende effect van de medicatie kan ertoe leiden dat patiënten meer belaste activiteiten ontplooien dan op dat moment door de achillespees kan worden verdragen. Om die reden adviseert de werkgroep terughoudend te zijn met het voorschrijven of adviseren van NSAIDs voor de behandeling van achilles tendinopathie.
De werkgroep adviseert terughoudend te zijn met het gebruik van injecties met corticosteroïden. Zoals bovenstaand vermeld, zijn er aanwijzingen dat deze behandeling niet effectief is bij patiënten met midportion achilles tendinopathie, het een ongunstig effect heeft op lange termijn, en er problemen zijn met de veiligheid van deze behandeling (dit geldt met name bij een toename in het aantal injecties) (Coombes, 2010; DaCruz, 1988; Seeger, 2006). Om bovenstaande redenen adviseert de werkgroep terughoudend te zijn met het toepassen van NSAIDs en corticosteroïd injecties.
In voorgaande nationale en internationale richtlijnen zijn er ook aanbevelingen gedaan voor de behandeling van achilles tendinopathie. In de multidisciplinaire richtlijn Chronische achilles tendinopathie (2007) is het onderwerp behandeling als aparte module beschreven. De werkgroep van de voorgaande richtlijn heeft op basis van de beschikbare literatuur beoordeeld dat de behandeling initieel dient te bestaan uit excentrische oefentherapie. In de richtlijn van 2007 wordt geadviseerd om niet te behandelen met NSAID’s, corticosteroïden en shockwave therapie. Behandelmethoden zoals scleroserende injecties en de nachtspalk dienden nader onderzocht te worden. In de NICE database zijn twee richtlijnen opgenomen over het gebruik van shockwave therapie en autoloog bloed injecties voor de behandeling van achilles tendinopathie. Hierin werd geconcludeerd dat er conflicterend bewijs van lage kwaliteit is voor het gebruik van zowel shockwave alsook autoloog bloed injecties, maar dat er geen belangrijke veiligheidsrisico’s zijn. Daarom werd aanbevolen om voor het gebruik van beide therapieën duidelijk kenbaar te maken aan de patiënt dat de effectiviteit van shockwave therapie en autoloog bloed injecties onduidelijk is. In de richtlijn van de Orthopedische sectie van de ‘American Physical Therapy Association’ worden de volgende aanbevelingen overwogen voor patiënten met midportion achilles tendinopathie: minimaal 2 maal per week oefentherapie binnen de acceptabele pijngrenzen, rekoefeningen indien er een beperkte dorsaalflexie van de enkel is, neuromusculaire oefeningen voor correctie van de kinetische keten ter vermindering van excentrische krachten op de achillespees, manuele therapie ter bevordering van range of motion van gewrichten, continueren van (sport)belasting binnen de pijngrenzen (geen complete rust), patiënt educatie, rigide taping ter vermindering van rekkrachten op de achillespees, iontoforese met dexamethason en dry needling ("Achilles Pain, Stiffness, and Muscle Power Deficits: Midportion Achilles Tendinopathy Revision 2018: Using the Evidence to Guide Physical Therapist Practice," 2018). In deze richtlijn was er onvoldoende bewijskracht om de volgende behandelingen te adviseren: een hakverhoging, een nachtspalk, orthosen en laser therapie. Behandeling met shockwave therapie, corticosteroïd injecties en plaatjes-rijk plasma injecties vielen buiten de scope van de betreffende richtlijn. Uit bovenstaande gegevens kan worden opgemaakt dat er enkele overeenkomsten en verschillen zijn met de aanbevelingen in bestaande richtlijnen. In grote lijnen komt in de verschillende richtlijnen de initiële behandeling (patiënt educatie, belasting adviezen en oefentherapie) als basis steeds naar voren en dit ondersteunt de werkgroep in de keuze om te starten met deze behandelstrategie.
Onderbouwing
Achtergrond
Probleemstelling
Bij de diagnose achilles tendinopathie wordt normaal gesproken gestart met een conservatieve behandeling. Deze conservatieve behandelingen kunnen onderverdeeld worden in verschillende categorieën. De evaluatie van de effectiviteit van conservatieve behandelingen kan middels verschillende controle groepen worden geëvalueerd. Om die reden zijn de volgende conservatieve interventies gedefinieerd: overwegend afwachtend beleid (‘wait-and-see’), placebo behandeling, oefentherapie, orthosen, shockwave therapie, medicamenteuze therapie, acupunctuur, injectie therapie en multimodale behandelingen. Het merendeel van de patiënten ontvangt meerdere behandelingen uit deze behandelcategorieën, wat een belangrijke impact heeft op de zorgconsumptie (van der Plas, 2012). Dit wordt voornamelijk veroorzaakt doordat er onvoldoende kennis is over de effectiviteit van de verschillende behandelingen ten opzichte van elkaar.
Definities
Bij het classificeren van achilles tendinopathie heeft de werkgroep initieel de factoren locatie en klachtenduur een prominente rol gegeven. Een reactieve tendinopathie werd gedefinieerd als korter dan 6 weken bestaand en een chronische tendinopathie 3 maanden of langer bestaand (Challoumas, 2019b). Omdat er gedurende het proces van de richtlijnontwikkeling duidelijk werd dat er weinig literatuur voorhanden was van de reactieve achilles tendinopathie, er in de literatuur inconsistente definities van een reactieve tendinopathie waren en er binnen de werkgroep verschillende opvattingen waren over de definitie van deze entiteit, werd ervoor gekozen om dit onderscheid niet te maken. Er zijn daardoor twee verschillende subclassificaties van achilles tendinopathie gedefineerd. Het onderscheid tussen deze subclassificaties is gebaseerd op de locatie en geobserveerde pathologie. Een insertie tendinopathie is gelokaliseerd binnen de eerste 2 cm van de aanhechting van de achillespees op het hielbeen. Er kan hierbij sprake zijn van een tendinopathie van de achillespees insertie, een geassocieerde prominentie van de calcaneus (Haglund morfologie) en/of een bursitis retrocalcaneï (Brukner, 2012). Een midportion tendinopathie is > 2 cm boven deze aanhechting gelokaliseerd en dit betreft volgens de huidige consensus een geïsoleerde tendinopathie van het middendeel van de achillespees (Brukner, 2012). Het onderscheid tussen deze twee subclassificaties is daarnaast gerechtvaardigd, omdat er een verschil in prognose lijkt te zijn tijdens conservatieve behandeling (Fahlstrom, 2003).
Conclusies / Summary of Findings
Uitkomstmaat VISA-A score
Midportion achilles tendinopathie
|
Zeer laag GRADE |
Alle volgende behandelcategorieën lijken effectiever te zijn dan een overwegend afwachtend beleid na 3 maanden: oefentherapie, injectie therapie, oefentherapie+injectie therapie, shockwave therapie, oefentherapie+shockwave therapie, oefentherapie+nachtspalk, acupunctuur en mucopolysacchariden supplementen+oefentherapie.
Bronnen: (van der Vlist, 2019c) |
|
Zeer laag GRADE |
Acupunctuur is mogelijk na 3 maanden superieur aan placebo injectie therapie, injectie therapie, oefentherapie, shockwave therapie, oefentherapie+injectie therapie en oefentherapie+nachtspalk, maar niet vergeleken met oefentherapie+shockwave therapie en mucopolysacchariden supplementen+oefentherapie.
Bronnen: (van der Vlist, 2019c) |
|
Zeer laag GRADE |
Oefentherapie+shockwave therapie is mogelijk na 3 maanden superieur aan een placebo injectie therapie, injectie therapie, oefentherapie, shockwave therapie, oefentherapie+injectie therapie en oefentherapie+nachtspalk, maar niet vergeleken met acupunctuur en mucopolysacchariden supplementen+oefentherapie.
Bronnen: (van der Vlist, 2019c) |
|
Zeer laag GRADE |
Na 12 maanden lijken oefentherapie, oefentherapie+injectie therapie en oefentherapie+nachtspalk een vergelijkbare uitkomst te hebben met injectie therapie.
Bronnen: (van der Vlist, 2019c) |
Insertie achilles tendinopathie
|
- GRADE |
Er is onvoldoende literatuur van voldoende kwaliteit beschikbaar om de effectiviteit van behandelopties bij insertie achilles tendinopathie te kunnen weergeven. |
Midportion en insertie tendinopathie
|
- GRADE |
Er is geen literatuur beschikbaar om de effectiviteit van de volgende veelgebruikte behandelopties te beoordelen: • Patiënt educatie. • Belasting advies. • Hakverhoging. • Percutane Electrolyse Therapie. • Non-Steroidal Anti-Inflammatory (NSAIDs). • Corticosteroïden injectie. |
Uitkomstmaat terugkeer naar sport
Midportion en insertie achilles tendinopathie
|
- GRADE |
Er is onvoldoende literatuur van voldoende kwaliteit beschikbaar om de effectiviteit van behandelopties middels de uitkomstmaat terugkeer naar sport te kunnen beoordelen. |
Uitkomstmaat patiënttevredenheid
Midportion en insertie achilles tendinopathie
|
- GRADE |
Er is onvoldoende literatuur van voldoende kwaliteit beschikbaar om de effectiviteit van behandelopties middels de uitkomstmaat patiënttevredenheid te kunnen beoordelen. |
Samenvatting literatuur
Beschrijving studies
Voor de beantwoording van deze uitgangsvraag zijn in totaal 29 gerandomiseerde studies geïncludeerd. De karakteristieken en belangrijkste resultaten van deze studies zijn terug te vinden in tabel 1. Het overgrote deel van de onderzoeken (25/29 studies) onderzocht de effectiviteit van de conservatieve behandeling bij patiënten met een midportion achilles tendinopathie. De overige vier studies voerden het onderzoek uit bij patiënten met een insertie achilles tendinopathie (2 studies) en bij patiënten met een niet-gespecificeerde achilles tendinopathie (2 studies). In twee gevallen was er sprake van meerdere publicaties van één studie (de Jonge, 2010; de Jonge, 2011b; De Vos, 2010; de Vos, 2007).
De populatiegrootte varieerde tussen de 28 en de 75 deelnemers (mediaan 54) waarbij het percentage ‘lost to follow-up’ varieerde van 0 tot 26% (mediaan 10%). De gemiddelde leeftijd lag tussen de 40 en 50 jaar (mediaan 48). Het percentage mannelijke deelnemers was groter in 11 studies, tegenover 13 studies waarin het percentage vrouwelijke deelnemers groter was (mediaan percentage mannelijke deelnemers 47%). In twee studies was de verhouding man/vrouw 50% en in drie studies is deze verhouding niet gerapporteerd. Het percentage van de populatie dat sportief actief was varieerde van 31% tot 100% (mediaan 72%) in de 12 studies die dit gerapporteerd hebben. De follow-up periode voor de studies varieerde tussen de 6 en 52 weken (mediaan 25 weken).
In totaal zijn er 38 behandelopties onderzocht bij patiënten met een midportion achilles tendinopathie, twee bij patiënten met een insertie achilles tendinopathie en vier bij patiënten met een niet nader gespecificeerde achilles tendinopathie. De resultaten zijn weergegeven voor de VISA-A score als cruciale uitkomstmaat en voor de secundaire uitkomstmaten patiënttevredenheid en de terugkeer naar sport. Er is een onderverdeling gemaakt voor deze drie uitkomstmaten, waarbij voor de cruciale uitkomstmaat een netwerk meta-analyse uitgevoerd is. De secundaire uitkomstmaten zullen descriptief gepresenteerd worden.
De beoordeling van het risico op bias werd door twee onafhankelijke beoordelaars gedaan met de Cochrane risk of bias 2.0 tool (Sterne, 2019). Bij een afwijkende beoordeling tussen beide beoordelaars werd er consensus gezocht en werd een 3e beoordelaar geconsulteerd indien dit noodzakelijk was. Tweeëntwintig studies (76%) lieten een hoog risico op bias zien en de overige zeven studies (24%) lieten enig risico op bias zien (tabel 2). Er waren geen studies met een laag risico op bias. Voor de gedetailleerde uitkomsten van de beoordeling van de kwaliteit van de studies verwijzen we naar tabel 2. De bewijskracht is eveneens door twee onafhankelijke beoordelaars uitgevoerd middels GRADE (Guyatt, 2008).
Resultaten
De resultaten voor deze uitgangsvraag zullen descriptief gepresenteerd worden op het niveau van behandelcategorieën. De onderverdeling van behandelopties in behandelcategorieën is weergegeven in tabel 3. Voor specificatie van de behandeling verwijzen we graag naar tabel 1. De resultaten van de netwerk meta-analyse (NMA) voor de cruciale uitkomstmaat (VISA-A score) zullen aan het einde van de resultatensectie beschreven worden (van der Vlist, 2019c). Daarin zal ook de mate van bewijskracht meegenomen worden.
Tabel 3 Onderverdeling van behandelopties in behandelcategorieën (‘classes’) van geïncludeerde studies in de NMA
|
Treatments |
Studies |
Classes |
|
Placebo-injection + eccentric exercises (high-dose) |
Bell 2013, Boesen 2017, De Jonge 2011 |
Exercise therapy + placebo injection |
|
Autologous blood injection + eccentric exercises (high-dose) |
Bell 2013, Pearson 2012 |
Exercise + injection therapy |
|
High-volume injection + eccentric exercises (high-dose) |
Boesen 2017 |
Exercise + injection therapy |
|
Platelet-rich plasma (PRP) -injection + eccentric exercises (high-dose) |
Boesen 2017, De Jonge 2011 |
Exercise + injection therapy |
|
Eccentric exercises (high-dose) |
Pearson 2012, Beyer 2015, De Jonge 2010, Silbernagel 2007, Yelland 2011, Rompe 2007, Rompe 2009, Zhang 2013, Balius 2016, Stevens 2014,, Roos 2004, Mafi 2001 |
Exercise therapy |
|
Heavy slow resistance exercises |
Beyer 2015 |
Exercise therapy |
|
Night splint + eccentric exercises (high-dose) |
De Jonge 2010, Roos 2004 |
Exercise + night splint therapy |
|
Continued sports activity + eccentric exercises (high-dose) |
Silbernagel 2007 |
Exercise therapy |
|
Prolotherapy injections |
Yelland 2011 |
Injection therapy |
|
Prolotherapy injections + Eccentric exercises (high-dose) |
Yelland 2011 |
Exercise + injection therapy |
|
Shockwave therapy |
Rompe 2007 |
Shockwave therapy |
|
Wait-and-see |
Rompe 2007 |
Wait-and-see |
|
Shockwave therapy + eccentric exercises (high-dose) |
Rompe 2009 |
Exercise + shockwave therapy |
|
Acupuncture treatment |
Zhang 2013 |
Acupuncture therapy |
|
Mucopolisaccharides supplement + eccentric exercises (high-dose) |
Balius 2016 |
Exercise + mucopolysaccharides supplement therapy |
|
Mucopolisaccharides supplement + passive stretching |
Balius 2016 |
Exercise + mucopolysaccharides supplement therapy |
|
Eccentric exercises as tolerated |
Stevens 2014 |
Exercise therapy |
Midportion achilles tendinopathie
Overwegend afwachtend beleid
Overwegend afwachtend beleid versus oefentherapie: Een overwegend afwachtend beleid was inferieur aan excentrische oefentherapie na 16 weken follow-up. De VISA-A score na 16 weken follow-up was 55,0 (SD 12,9) in de groep die een overwegend afwachtend beleid kreeg en 75,6 (SD 18,7) in de groep die excentrische oefentherapie uitvoerde (p<0,001) (Rompe, 2007).
Placebo behandeling
In totaal bestonden twee gerandomiseerde studies uit minstens één behandelarm met enkel een placebo behandeling zonder co-interventie. Er waren geen statistisch significante verschillen in patiënt-gerapporteerde uitkomstmaten na 1 tot 12 weken follow-up tussen de placebo behandeling en ibuprofen of lasertherapie (Heinemeier, 2017; Hutchison, 2013).
Oefentherapie
In totaal bestonden 12 gerandomiseerde studies uit minstens één behandelarm met alleen oefentherapie zonder co-interventie.
Oefentherapie versus overwegend afwachtend beleid: Excentrische oefentherapie was superieur aan een overwegend afwachtend beleid (wait-and-see) na 16 weken follow-up. De VISA-A score na 16 weken follow-up was 75,6 (SD 18,7) in de groep die excentrische oefentherapie uitvoerde en 55,0 (SD 12,9) in de groep die een overwegend afwachtend beleid kreeg (p<0,001) (Rompe, 2007).
Oefentherapie versus Shockwave: Er is conflicterend bewijs voor de effectiviteit van shockwave therapie in vergelijking met oefentherapie. Excentrische oefentherapie was inferieur aan shockwave therapie (3 behandelingen) na 16 weken follow-up in één van de twee geïncludeerde studies. De VISA-A score na 16 weken follow-up was in deze studie 86,5 (SD 16,0) in de groep die shockwave behandelingen onderging en 73,0 (SD 19,0) in de groep die excentrische oefentherapie uitvoerde (p=0,0016) (Rompe, 2009). Een eerdere studie van deze onderzoeksgroep met drie behandelarmen liet geen significant verschil zien in de patiënt-gerapporteerde uitkomstmaten tussen excentrische oefentherapie en shockwave therapie (3 behandelingen) na 16 weken follow-up. De VISA-A score na 16 weken follow-up was 70,4 (SD 16,3) in de groep die shockwave behandelingen onderging en 75,6 (SD 18,7) in de groep die excentrische oefentherapie uitvoerde (Rompe, 2007).
Oefentherapie versus Nachtspalk (in combinatie met oefentherapie): Twee studies rapporteerden geen significante verschillen in patiënt-gerapporteerde uitkomstmaten na 12-52 weken follow-up tussen oefentherapie en het gebruik van een nachtspalk naast de uitvoering van oefentherapie (de Jonge, 2010; Roos, 2004). Eén van de deze studies vergeleek tevens de effectiviteit van oefentherapie met een nachtspalk als monotherapie, waarbij de terugkeer naar sport hoger lag in de groep die oefentherapie uitvoerde (63% versus 10%). Er zijn geen statistische testen uitgevoerd om de significantie van de verschillen weer te geven (Roos, 2004).
Oefentherapie versus Injectie: Twee studies vergeleken excentrische oefentherapie zonder co-interventie met een vorm van injectietherapie. De eerste studie liet zien dat de VISA-A score significant hoger was na 6 tot 52 weken follow-up in de groep waarbij prolotherapie werd toegediend (4 tot 12 behandelingen) in combinatie met excentrische oefentherapie, in vergelijking met excentrische oefentherapie alleen (p<0,01). De VISA-A score na 52 weken follow-up was 91,4 (SD 9,9) in de groep die prolotherapie ondergingen in combinatie met excentrische oefentherapie en 84,9 (SD 18,2) in de groep die enkel excentrische oefentherapie uitvoerde. Er was geen significant verschil tussen excentrische oefentherapie en het alleen toepassen van prolotherapie (4 tot 12 behandelingen, zonder vorm van oefentherapie) op alle tijdspunten (Yelland, 2011). De tweede studie liet geen significante verschillen zien in VISA-A score na 6 tot 12 weken follow-up tussen excentrische oefentherapie en een injectie met autoloog bloed in combinatie met excentrische oefentherapie (Pearson, 2012).
Vergelijking tussen verschillende soorten oefentherapie programma’s: In vijf studies werden twee soorten oefentherapie programma’s direct met elkaar vergeleken. Twee studies lieten een significant effect van een specifieke vorm van oefentherapie zien. In de eerste studie was de patiënttevredenheid na 12 weken follow-up significant hoger in de groep die excentrische oefentherapie uitvoerde (88% tevreden), in vergelijking met de groep die concentrische oefentherapie uitvoerde (36% tevreden) (Mafi, 2001). In de tweede studie was de VISA-A score na 3 weken follow-up significant hoger in de groep die excentrische oefentherapie uitvoerde in een aantal dagelijkse herhalingen dat binnen de acceptabele pijngrenzen uitvoerbaar was (VISA-A score 56,2, SD 19,7), in vergelijking met de groep die een vast aantal van 180 herhalingen per dag voor dezelfde oefentherapie uitvoerde (41,0, SD 13,0, p=0,004). Na 6 weken follow-up waren er geen significante verschillen in VISA-A score tussen beide groepen. Daarnaast was er geen significant verschil in patiënttevredenheid tussen beide groepen na 6 weken follow-up (Stevens, 2014).
Drie studies lieten geen significante verbetering door een specifieke vorm van oefentherapie zien. In de eerste studie bestond er geen significant verschil in VISA-A score en patiënttevredenheid na 12 tot 52 weken follow-up tussen excentrische oefentherapie en ‘heavy slow resistance’ oefentherapie (Beyer, 2015). De tweede studie liet geen significant verschil in VISA-A score zien na 6 tot 52 weken follow-up tussen het voortzetten van de sportbelasting met een pijnschaal (maximale pijnscore 5 op een schaal van 10) in de eerste 6 weken van het herstel versus het staken van belastende sporten voor de achillespees in deze fase. Beide groepen voerden daarnaast excentrische oefentherapie uit (Silbernagel, 2007). De laatste studie liet geen significant verschil in terugkeer naar sport zien na 52 weken follow-up tussen isotone oefentherapie en geleidelijk opbouwende oefentherapie (gefaseerd programma van rekoefeningen naar concentrische en uiteindelijk excentrische oefenvormen). Beide groepen voerden daarnaast rekoefeningen uit (Silbernagel, 2001).
Orthosen
In totaal bestond één gerandomiseerde studie uit minstens één behandelarm met enkel een nachtspalk zonder co-interventie. Er zijn geen statistische testen uitgevoerd naar de verschillen in terugkeer naar sport. Wel bestond er de indruk dat de terugkeer naar sport lager was indien een nachtspalk als monotherapie toegepast werd (10%), in vergelijking met oefentherapie als monotherapie (63%) en met een combinatie van oefentherapie en een nachtspalk (38%) (Roos, 2004).
Shockwave therapie
In totaal bestonden twee gerandomiseerde studies uit minstens één behandelarm met enkel shockwave therapie zonder co-interventie. De eerste studie liet zien dat shockwave therapie (3 behandelingen) superieur is aan een overwegend afwachtend beleid na 16 weken follow-up. De VISA-A score na 16 weken follow-up was 70,4 (SD 16,3) in de groep die shockwave therapie onderging en 55,0 (SD 12,9) in de groep die een overwegend afwachtend beleid kreeg (p<0,001). Er was binnen deze zelfde studie met drie behandelarmen geen sprake van een significant verschil tussen shockwave therapie (3 behandelingen) en excentrische oefentherapie (Rompe, 2007). In de tweede studie was de VISA-A score na 12 en 26 weken follow-up significant lager in de groep die shockwave therapie onderging (VISA-A score na 12 weken 47,5 (SD 15,0), na 26 weken 52,0 (SD 15,0), in vergelijking met een tweetal peritendineuze hyaluronzuur injecties (VISA-A score na 12 weken 73,0 (SD 24,0), na 26 weken (75,0 (SD 22,0)) (Lynen, 2017).
Overige passieve modaliteiten
In totaal bestonden twee gerandomiseerde studies uit minstens één behandelarm met enkel een passieve modaliteit zonder co-interventie. In de eerste studie waren er geen statistisch significante verschillen in patiënt-gerapporteerde uitkomstmaten na 6 tot 12 weken follow-up tussen Intense Pulse Light (IPL; flitslamp) en een placebo behandeling met IPL (Hutchison, 2013). De tweede studie liet zien dat het toevoegen van excentrische oefentherapie aan passieve modaliteiten bestaande uit massage, therapeutisch ultrageluid en rekoefeningen een verbetering geeft ten opzichte van de passieve modaliteiten als monotherapie. De VISA-A score was 81 (SD 1) bij de passieve modaliteiten als monotherapie en 98 (SD 2) bij het toevoegen van excentrische oefeningen (p=0,01).
Medicatie
In totaal bestonden twee gerandomiseerde studies uit minstens één behandelarm met enkel een medicamenteuze behandeling zonder co-interventie. Er waren geen statistisch significante verschillen in patiënt-gerapporteerde uitkomstmaten na 1 tot 3 weken follow-up tussen de placebo behandeling en topicale NSAIDs (één studie) of ibuprofen tabletten (één studie) (Auclair, 1989; Heinemeier, 2017).
Acupunctuur
In totaal bestond één gerandomiseerde studies uit minstens één behandelarm met enkel acupunctuur behandeling zonder co-interventie. Deze studie liet zien dat de VISA-A score significant hoger was na 8 tot 24 weken follow-up in een groep die behandeld is met acupunctuur (24 behandelingen), in vergelijking met excentrische oefentherapie (P<0,0001). Na 24 weken follow-up was de VISA-A score in de acupunctuur groep 73,3 (SD 3,6) en in de groep die excentrische oefentherapie uitvoerde 62,4 (SD 4,2) (Zhang, 2013).
Injectiebehandeling
In totaal bestonden drie gerandomiseerde studies uit minstens één behandelarm met enkel een injectiebehandeling zonder co-interventie. Alle studies onderzochten een andere vorm van injectietherapie. De eerste studie liet zien dat de VISA-A score na 12 en 26 weken follow-up significant hoger was in de groep die twee peritendineuze hyaluronzuur injecties kreeg (VISA-A score na 12 weken 73,0 (SD 24,0), na 26 weken 75,0 (SD 22,0), in vergelijking met shockwave therapie (VISA-A score na 12 weken 47,5 (SD 15,0) en na 26 weken 52,0 (SD 15,0) (Lynen, 2017). De tweede studie liet geen significant verschil zien tussen excentrische oefentherapie en het alleen toepassen van prolotherapie (4 tot 12 behandelingen, zonder vorm van oefentherapie) (Yelland, 2011). De derde studie vergeleek twee verschillende injectietechnieken met elkaar, namelijk een injectie met Stromal Vascular Fraction (SVF, verkregen uit vetweefsel) en een intratendineuze injectie met plaatjesrijk-plasma. Deze studie liet zien dat de VISA-A score op zeer korte termijn (2 tot 4 weken follow-up) significant hoger was in de groep die een SVF injectie kreeg (VISA-A score na 4 weken 59,1 (SD 19,8), in vergelijking met de intratendineuze PRP-injectie (VISA-A score na 12 weken 47,5 (SD 15,9)). Na 4, 9, 17 en 26 weken waren er geen significante verschillen tussen de twee groepen (Usuelli, 2017).
Multimodale behandelopties
Er zijn in totaal 11 multimodale behandelingen (waarin twee of meer behandelingen tegelijkertijd zijn toegepast per behandelarm) in gerandomiseerde studies met elkaar vergeleken. Een overzicht van deze multimodale behandelingen is weergegeven in tabel 4.
Tabel 4 Overzicht van gerandomiseerde studies die multimodale behandelopties hebben vergeleken bij de behandeling van patiënten met een midportion achilles tendinopathie. De aanwezigheid van effectieve multimodale behandelopties is gemarkeerd middels een grijsgekleurde balk. Voor de bewijskracht verwijzen we naar de evidence tabellen.
|
Comparison |
Study (first author) |
|
|
Injection-based multimodal treatment |
|
|
|
Autologous blood injection+eccentric exercises (high-dose) versus. Dry-needling (placebo-injection)+eccentric exercises (high-dose) |
Bell = |
|
|
High-volume injection+eccentric exercises (high-dose) versus. Placebo injection + Eccentric training (high-dose) |
Boesen ↑ |
|
|
PRP-injection+eccentric exercises (high-dose) versus. Placebo injection + Eccentric training (high-dose) |
Boesen ↑, de Jonge = |
|
|
PRP-injection+eccentric training (low-dose) versus. placebo injection+eccentric exercises (low-dose) |
Krogh = |
|
|
Medication-based multimodal treatment |
|
|
|
MCVC tablet+eccentric exercises (high-dose) versus. MCVC tablets+passive stretching |
Balius = |
|
|
Orthoses-based multimodal treatment |
|
|
|
Customised foot orthoses+eccentric exercises (high-dose) versus. Sham foot orthoses+eccentric exercises (high-dose) |
Munteanu = |
|
|
Passive modalities-based multimodal treatment |
|
|
|
Continued sports activity+progressive Achilles tendon-loading strengthening program (high-dose) versus. Active rest group+progressive Achilles tendon-loading strengthening program (high-dose) |
Silbernagel 2007 = |
|
|
Low-level laser therapy + eccentric exercise therapy (high-dose) versus. Placebo laser therapy + eccentric exercise therapy (high-dose) |
Tumilty 2012 =, Tumilty 2016 = |
|
|
Low-level laser therapy + eccentric exercise therapy (low-dose) versus. Placebo laser therapy + eccentric exercise therapy (low-dose) |
Tumilty 2016 ↑ |
|
|
Low-level laser therapy + eccentric exercise therapy (high-dose) versus. Placebo laser therapy + eccentric exercise therapy (low-dose) |
Tumilty 2016 = |
|
|
Low-level laser therapy + eccentric exercise therapy (low-dose) versus. Placebo laser therapy + eccentric exercise therapy (high-dose) |
Tumilty 2016 ↑ |
|
|
Abbreviations: PRP, Platelet-rich plasma; MCVC, mucopolysaccharides, collagen type I, and vitamin C. |
|
|
Insertie achilles tendinopathie
Oefentherapie
Oefentherapie versus Shockwave: Excentrische oefentherapie was inferieur aan shockwave therapie (3 behandelingen) na 16 weken follow-up in één studie. De VISA-A score na 16 weken follow-up was in deze studie 79,4 (SD 10,4) in de groep die shockwave behandelingen onderging en 63,4 (SD 12,0) in de groep die excentrische oefentherapie uitvoerde (p=0,005) (Rompe, 2008).
Overwegend afwachtend (wait-and-see) beleid, placebo behandeling, orthesen, shockwaven therapie, medicatie, injectiebehandeling of multimodale behandelopties
Er zijn geen studies verricht die het effect van een overwegend afwachtend beleid, placebo behandeling, orthesen, shockwaven therapie, medicatie, injectiebehandeling of multimodale behandelopties hebben onderzocht.
Midportion en insertie achilles tendinopathie (niet gespecificeerd)
Shockwave therapie
Eén gerandomiseerde studie heeft onderzocht of er sprake is van een verschil in patiënt-gerapporteerde uitkomstmaten wanneer de plaats van shockwave toepassing wordt aangegeven door de patiënt (klinisch geleid) of wanneer deze wordt bepaald middels afwijkingen op beeldvorming (echografisch geleid). Er bleek geen significant verschil te zijn tussen beide groepen na 12 weken follow-up (Njawaya, 2017).
Injectiebehandeling
Eén gerandomiseerde studie bestond uit minstens één behandelarm met enkel een injectiebehandeling zonder co-interventie. Deze studie vergeleek de effectiviteit van een polidocanol injectie met een placebo injectie. Er was daarin geen verschil in patiënt-gerapporteerde uitkomstmaten tussen beide groepen (Ebbesen, 2018).
Overwegend afwachtend (wait and see) beleid, placebo behandeling, oefentherapie, orthesen, medicatie, injectiebehandeling of multimodale behandelopties
Er zijn geen studies verricht die het effect van een overwegend afwachtend beleid, placebo behandeling, oefentherapie, orthesen, medicatie, injectiebehandeling of multimodale behandelopties hebben onderzocht.
Netwerk meta-analyse (uitkomstmaat VISA-A score)
Midportion achilles tendinopathie
Figuur 1 a-c laten de directe vergelijkingen zien in studies waarbij een populatie met midportion achilles tendinopathie is geïncludeerd. Er zijn vanuit de overkoepelende categorie ‘multimodale behandeling’ meerdere behandelcategorieën gedefinieerd voor het vormen van het netwerk in de netwerk meta-analyse (tabel 3). Er konden 10 verschillende behandelcategorieën met in totaal 180 vergelijkingen in behandeling meegenomen worden in de NMA voor een midportion achilles tendinopathie met de VISA-A score als uitkomstmaat (van der Vlist, 2019c). Tabel 6 a-b laat de resultaten van de NMA op 3 en 12 maanden zien voor de behandelcategorieën. Deze kon niet uitgevoerd worden voor het tijdspunt van 6 maanden doordat er onvoldoende studies beschikbaar waren voor het vormen van een netwerk. De resultaten voor de vergelijkingen op het niveau van de afzonderlijke behandelingen wordt weergegeven in tabel 6.
VISA-A score op 3 maanden
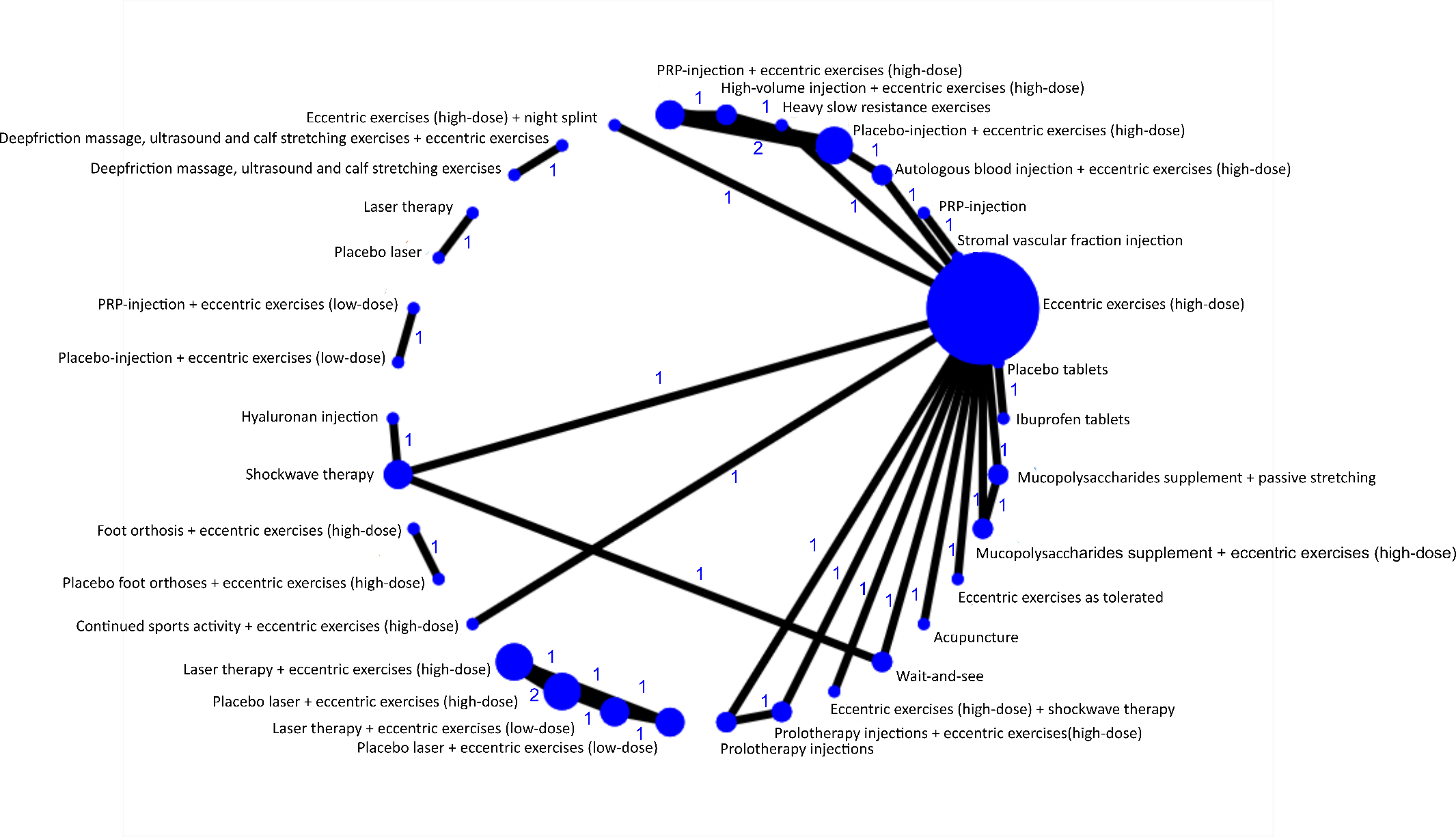
Figuur 1a. Weergave van netwerk voor de VISA-A score, gemeten na afzonderlijke behandelingen na 3, 6 en 12 maanden bij patiënten met een midportion achilles tendinopathie. De grootte van de cirkel geeft het aantal patiënten dat een behandeling heeft ondergaan weer en het cijfer de hoeveelheid vergelijkingen. PRP = Plaatjesrijk-plasma, VISA-A = Victorian Institute of Sport Assessment-Achilles.
Op het tijdspunt 3 maanden leek elke behandeling superieur te zijn ten opzichte van een overwegend afwachtend beleid omdat alle actieve behandelingen gemiddeld op 15 punten of hoger uitkomen: oefentherapie+placebo injectietherapie (gemiddelde verschil 19, 95%BI -3 tot 34), injectie therapie (23, 8 tot 38), oefentherapie (20, 11 tot 30), shockwave therapie (15, 6 tot 24), oefentherapie+injectie therapie (22, 7 tot 36), oefentherapie+shockwave therapie (34, 21 tot 47), oefentherapie+nachtspalk (21, 4 tot 39), acupunctuur (35, 25 tot 45) en mucopolysacchariden supplementen+oefentherapie (28, 14 tot 41).
Acupunctuur was superieur aan placebo injectie therapie ( gemiddelde verschil 16, 4 tot 30), injectie therapie (13, 0 tot 25), oefentherapie (15, 11 tot 19), shockwave therapie (20, 9 tot 31), oefentherapie+injectie therapie (13, 2 tot 25) en oefentherapie+nachtspalk (14, -1 tot 30), maar niet aan oefentherapie+shockwave therapie (1, -9 tot 11) en mucopolysacchariden supplementen+oefentherapie (7, -3 tot 19).
Oefentherapie+shockwave therapie was superieur aan placebo injectie therapie (gemiddelde verschil 15, 1 tot 31), injectie therapie (11, -4 tot 26), oefentherapie (14, 5 tot 23), shockwave therapie als monotherapie (19, 5 tot 32), oefentherapie+injectie therapie (12, -2 tot 27) en oefentherapie+nachtspalk (13, -4 tot 30), maar niet vergeleken met acupunctuur (-1, -11 tot 9) en mucopolysacchariden supplementen+oefentherapie (6, -7 tot 20).
VISA-A score op 6 maanden
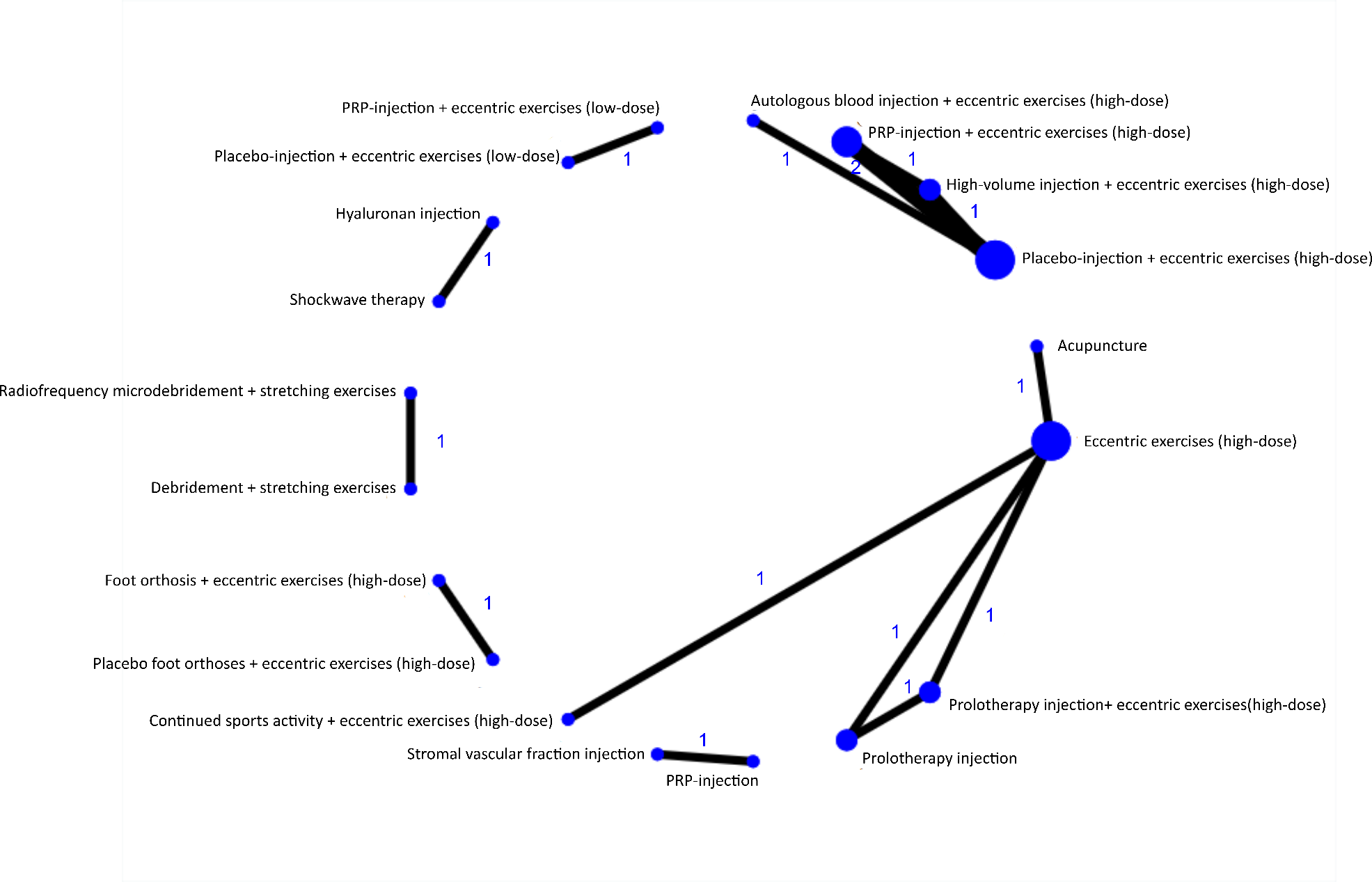
Figuur 1b. Weergave van netwerk voor de VISA-A score, gemeten na afzonderlijke behandelingen na 3, 6 en 12 maanden bij patiënten met een midportion achilles tendinopathie. De grootte van de cirkel geeft het aantal patiënten dat een behandeling heeft ondergaan weer en het cijfer de hoeveelheid vergelijkingen. PRP = Plaatjesrijk-plasma, VISA-A = Victorian Institute of Sport Assessment-Achilles.
VISA-A score op 12 maanden
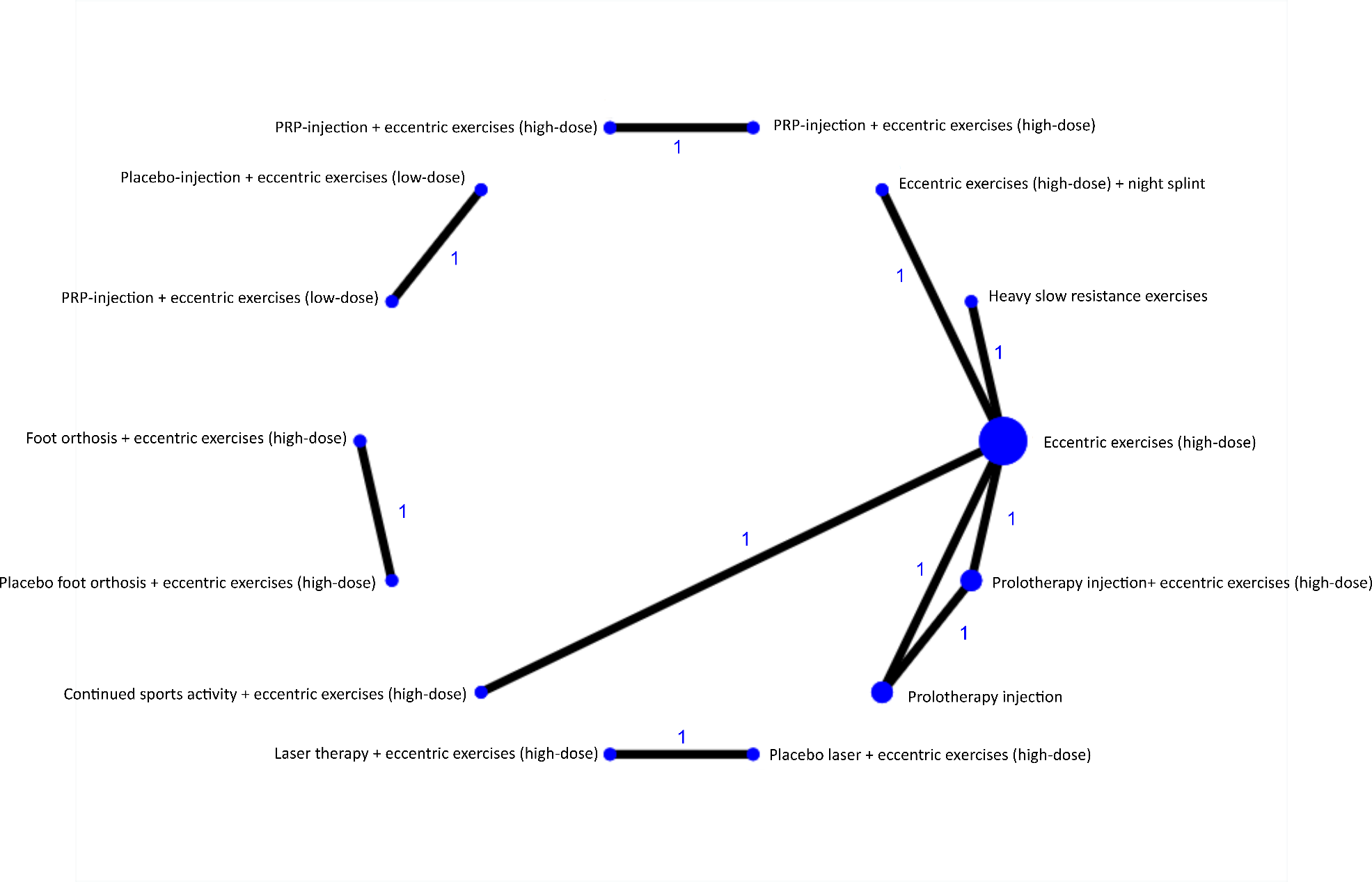
Figuur 1c. Weergave van netwerk voor de VISA-A score, gemeten na afzonderlijke behandelingen na 3, 6 en 12 maanden bij patiënten met een midportion achilles tendinopathie. De grootte van de cirkel geeft het aantal patiënten dat een behandeling heeft ondergaan weer en het cijfer de hoeveelheid vergelijkingen. PRP = Plaatjesrijk-plasma, VISA-A = Victorian Institute of Sport Assessment-Achilles.
Op het tijdspunt 12 maanden konden vier behandelcategorieën vergeleken worden in een netwerk. Oefentherapie (gemiddelde verschil -5, -19 tot 9), oefentherapie+injectie therapie (2, -10 tot 13) en oefentherapie+nachtspalk (3, -16 tot 22) hadden een vergelijkbare uitkomst met injectie therapie.
Insertie achilles tendinopathie
Voor insertie achilles tendinopathie en midportion en insertie achilles tendinopathie (niet gespecificeerd) konden door de kleine hoeveelheid studies zonder vergelijkbare behandelingen geen netwerken gevormd worden.
Bewijskracht van de literatuur
De bewijskracht is gebaseerd op resultaten uit RCT’s en start derhalve hoog. Alle vergelijkingen uit de NMA werden gegradeerd als laag-zeer laag, behalve voor oefentherapie+injectie met autoloog bloed versus oefentherapie+placebo injectie waarbij sprake was van een redelijke bewijskracht. De voornaamste reden om de bewijskracht te verlagen waren studie limitaties (n=180 vergelijkingen, 100%) en imprecisie (n=158 vergelijkingen, 88%) (tabel 7).
Netwerk meta-analyse (uitkomstmaten terugkeer naar sport en patiënttevredenheid)
Midportion en insertie achilles tendinopathie
Door een kleine hoeveelheid vergelijkingen in de studies die deze uitkomstmaten rapporteren heeft de werkgroep besloten om geen netwerk analyse uit te voeren voor de beantwoording van de huidige submodule.
Zoeken en selecteren
Voor de beantwoording van submodules ‘Conservatieve behandelopties’, ‘Operatieve behandelopties’ en ‘Factoren die de effectiviteit behandeling beïnvloeden’ is één systematische literatuuranalyse uitgevoerd, die is gericht op gerandomiseerde studies die de effectiviteit van behandelopties voor achilles tendinopathie beoordeeld hebben. Deze resultaten zullen ook apart gepubliceerd worden in een wetenschappelijk tijdschrift. De volgende PICO werd opgesteld voor de beantwoording van deze vraag:
P: patiënten met achilles tendinopathie;
I: actieve conservatieve behandelopties;
C: Overwegend afwachtend beleid, wachtlijst controle of een andere actieve behandeling;
O: ervaren klachten (VISA-A score, patiënttevredenheid en terugkeer naar sport).
Relevante uitkomstmaten
Relevante uitkomstmaten zijn bepaald op basis van informatie van vragenlijstonderzoek dat is uitgevoerd in samenwerking met de Patiëntenfederatie onder 97 patiënten met achilles tendinopathie. Daarnaast is er nog een diepte interview uitgevoerd bij negen patiënten met midportion achilles tendinopathie. De cruciale uitkomstmaat voor submodules ‘Overwegend afwachted (wait-and-see) beleid’, ‘Conservatieve behandelopties’ en ‘Operatieve behandelopties’ is de Victorian Institute of Sports Assessment-Achilles (VISA-A) score tijdens de laatste follow-up meting van het onderzoek. De gevalideerde VISA-A vragenlijst bestaat uit acht vragen die drie domeinen omvatten: pijn in ADL activiteiten, tijdens functie testen en (sport)belasting (Robinson, 2001). Een score van 100 punten is optimaal en staat voor een volledig belastbare achillespees zonder aanwezigheid van pijnklachten, een score van 0 punten representeert een zeer laag belastbare achillespees met de aanwezigheid van ernstige pijnklachten. Belangrijke (maar niet cruciale) uitkomstmaten zijn de patiënttevredenheid en terugkeer naar sport. De patiënttevredenheid dient patiënt-gerapporteerd te zijn, waarbij het type gehanteerde schaal niet een exclusie criterium is voor deze richtlijn. De terugkeer naar sport dient tevens patiënt-gerapporteerd te zijn, waarbij de gehanteerde schaal wederom niet een exclusie criterium is voor deze richtlijn. Bijwerkingen en complicaties van de behandeling werden ook in overweging genomen om de veiligheid van de verschillende behandelopties te beoordelen.
Klinisch relevante verschillen voor de VISA-A score zijn gerapporteerd in eerdere onderzoeken, maar kennen een grote spreiding van 6,5 tot 25 punten (de Jonge, 2010; Iversen, 2012; Khan, 2003; McCormack, 2015; Tumilty, 2008). In een recent onderzoek is er in een grote patiëntenpopulatie met de meest geaccepteerde ‘anchor-based’ methode berekend dat het klinisch relevante verschil van de VISA-A score 15 punten is na 3 maanden conservatieve behandeling (Lagas, 2019c). Omdat deze studie het meest betrouwbaar is en de waarde ook midden in de spreiding van de andere onderzoeksresultaten valt, baseert de werkgroep zich op het klinisch relevante verschil van 15 punten. De uitkomstmaten patiënttevredenheid en terugkeer naar sport zijn niet gevalideerd en daarvoor zijn geen klinisch relevante verschillen beschikbaar. Om die reden worden deze belangrijke uitkomstmaten ook in de overweging geïnterpreteerd, zonder het gebruik van vooraf gedefinieerde afkappunten.
Zoeken en selecteren (methode)
In samenwerking met de medische bibliothecaris van het Erasmus MC is op 26 februari 2019 een zoekopdracht opgesteld naar gerandomiseerde studies waarin de effectiviteit van een behandeloptie voor achilles tendinopathie beoordeeld is (zie werkwijze onder het tabblad verantwoording). Er is gezocht naar relevante literatuur in de volgende databases: Embase, Medline Ovid, Web of Science, Cochrane CENTRAL, CINAHL EBSCOhost, SportDiscuss EBSCOhost en Google Scholar. Er zijn geen taalrestricties gehanteerd. Potentieel relevante studies werden op basis van de onderstaande criteria beoordeeld.
Inclusiecriteria:
- Het artikel onderzoekt de effectiviteit van een conservatieve behandeloptie voor achilles tendinopathie.
- De diagnose achilles tendinopathie is gesteld op basis van klinische bevindingen (lokale pijn en verminderde belastbaarheid).
- De onderzoekspopulatie is 18 jaar of ouder.
- Het artikel heeft een gerandomiseerd studie design.
Exclusiecriteria:
- 10 of minder patiënten per behandelarm.
- Geen adequate controlegroep (bijvoorbeeld achillespees contralaterale zijde).
- Het design is een preklinisch onderzoek (dierstudie of in vitro design).
Voor de beantwoording van de uitgangsvraag is daarnaast gezocht naar de aanwezigheid van bestaande nationale en internationale richtlijnen: de multidisciplinaire richtlijn Chronische achilles tendinopathie (2007) en (inter)nationale richtlijndatabases van het Nederlands Huisartsen Genootschap (NHG), National Institute for Health and Care Excellence (NICE), National Guidelines Clearinghouse (NGC) en Guidelines International Network (G-I-N).
Resultaten
De systematische zoekactie naar de effectiviteit van behandelopties leverde in totaal 2779 referenties op na verwijdering van duplicaties. Alle gevonden referenties werden op titel en abstract beoordeeld. Na deze voorselectie werd de volledige tekst beoordeeld van 147 artikelen. In totaal werden 118 van deze artikelen geëxcludeerd. In de aanverwante producten is een flowchart opgenomen, met daarin de redenen voor exclusie. Uiteindelijk voldeden 29 studies aan de criteria en deze zijn geïncludeerd in de literatuuranalyse voor de effectiviteit van behandelopties. Twee studies betroffen een vervolgonderzoek van een eerder gepubliceerde studie (De Vos, 2010; de Vos, 2007).
Daarnaast heeft de werkgroep zich gebaseerd op de nationale richtlijn Chronische achilles tendinopathie, in het bijzonder de tendinosis, bij sporters (VSG, 2007). In de databases van de NHG, NICE, NGC en G-I-N werden geen bestaande richtlijnen op het gebied van behandeling van achilles tendinopathie gevonden. In de NICE database zijn twee richtlijnen opgenomen over het gebruik van shockwave therapie en autoloog bloed injecties voor de behandeling van achilles tendinopathie, welke door de werkgroep in overweging zijn genomen.
Referenties
- Achilles Pain, Stiffness, and Muscle Power Deficits: Midportion Achilles Tendinopathy Revision 2018: Using the Evidence to Guide Physical Therapist Practice. (2018). J Orthop Sports Phys Ther, 48(5), 425-426.
- Archambault, J. M., Wiley, J. P., Bray, R. C., Verhoef, M., Wiseman, D. A., & Elliott, P. D. (1998). Can sonography predict the outcome in patiënts with achillodynia? J Clin Ultrasound, 26(7), 335-339.
- Auclair, J., Georges, M., Grapton, X., Gryp, L., D'Hooghe, M., Meiser, R. G.,... Schmidtmayer, B. (1989). A double-blind controlled mutlicenter study of percutaneous niflumic acid gel and placebo in the treatment of Achilles heel tendinitis. CURR THER RES CLIN EXP, 46(4), 782-788.
- Balius, R., Álvarez, G., Baró, F., Jiménez, F., Pedret, C., Costa, E., & Martínez-Puig, D. (2016). A 3-Arm Randomized Trial for Achilles Tendinopathy: Eccentric Training, Eccentric Training Plus a Dietary Supplement Containing Mucopolysaccharides, or Passive Stretching Plus a Dietary Supplement Containing Mucopolysaccharides. CURR THER RES CLIN EXP, 78, 1-7.
- Bell, K. J., Fulcher, M. L., Rowlands, D. S., & Kerse, N. (2013). Impact of autologous blood injections in treatment of mid-portion Achilles tendinopathy: Double blind randomised controlled trial. BMJ (Online), 346(7908).
- Beyer, R., Kongsgaard, M., Hougs Kjær, B., Øhlenschlæger, T., Kjær, M., & Magnusson, S. P. (2015). Heavy Slow Resistance Versus Eccentric Training as Treatment for Achilles Tendinopathy: A Randomized Controlled Trial. AM J SPORTS MED, 43(7), 1704-1711.
- Boesen, A. P., Hansen, R., Boesen, M. I., Malliaras, P., & Langberg, H. (2017). Effect of High-Volume Injection, Platelet-Rich Plasma, and Sham Treatment in Chronic Midportion Achilles Tendinopathy: A Randomized Double-Blinded Prospective Study. AM J SPORTS MED, 45(9), 2034-2043.
- Bowen, L., Gross, A. S., Gimpel, M., Bruce-Low, S., & Li, F. X. (2019). Spikes in acute:chronic workload ratio (ACWR) associated with a 5-7 times greater injury rate in English Premier League football players: a comprehensive 3-year study. Br J Sports Med.
- Brukner, P., & Khan, K. (2012). Brukner & Khan's Clinical Sports Medicine. Sydney: McGraw-Hill.
- Challoumas, D., Clifford, C., Kirwan, P., & Millar, N. L. (2019). How does surgery compare to sham surgery or physiotherapy as a treatment for tendinopathy? A systematic review of randomised trials. BMJ Open Sport Exerc Med, 5(1), e000528.
- Cook, J. L., & Purdam, C. (2012). Is compressive load a factor in the development of tendinopathy? Br J Sports Med, 46(3), 163-168.
- Cook, J. L., & Purdam, C. R. (2009). Is tendon pathology a continuum? A pathology model to explain the clinical presentation of load-induced tendinopathy. Br J Sports Med, 43(6), 409-416.
- Coombes, B. K., Bisset, L., & Vicenzino, B. (2010). Efficacy and safety of corticosteroid injections and other injections for management of tendinopathy: a systematic review of randomised controlled trials. Lancet, 376(9754), 1751-1767.
- Costa, M. L., Shepstone, L., Donell, S. T., & Thomas, T. L. (2005). Shock wave therapy for chronic Achilles tendon pain: a randomized placebo-controlled trial. Clin Orthop Relat Res, 440, 199-204.
- DaCruz, D. J., Geeson, M., Allen, M. J., & Phair, I. (1988). Achilles paratendonitis: an evaluation of steroid injection. Br J Sports Med, 22(2), 64-65.
- de Jonge, S., de Vos, R. J., Van Schie, H. T., Verhaar, J. A., Weir, A., & Tol, J. L. (2010). One-year follow-up of a randomised controlled trial on added splinting to eccentric exercises in chronic midportion Achilles tendinopathy. Br J Sports Med, 44(9), 673-677.
- de Jonge, S., de Vos, R. J., Weir, A., van Schie, H. T., Bierma-Zeinstra, S. M., Verhaar, J. A.,... Tol, J. L. (2011a). One-year follow-up of platelet-rich plasma treatment in chronic Achilles tendinopathy: a double-blind randomized placebo-controlled trial. AM J SPORTS MED, 39(8), 1623-1629.
- de Jonge, S., de Vos, R. J., Weir, A., van Schie, H. T. M., Bierma-Zeinstra, S. M. A., Verhaar, J. A. N.,... Tol, J. L. (2011b). Platelet-rich plasma for chronic achilles tendinopathy: a double-blind randomised controlled trial with one year follow-up. British Journal of Sports Medicine British Journal of Sports Medicine, 45(2), e1.
- de Jonge, S., Tol, J. L., Weir, A., Waarsing, J. H., Verhaar, J. A., & de Vos, R. J. (2015). The Tendon Structure Returns to Asymptomatic Values in Nonoperatively Treated Achilles Tendinopathy but Is Not Associated With Symptoms: A Prospective Study. Am J Sports Med, 43(12), 2950-2958.
- de Vos, R. J., Weir, A., van Schie, H. T., Bierma-Zeinstra, S. M., Verhaar, J. A., Weinans, H., & Tol, J. L. (2010a). Platelet-rich plasma injection for chronic Achilles tendinopathy: a randomized controlled trial. Jama, 303(2), 144-149.
- De Vos, R. J., Weir, A., Van Schie, H. T. M., Bierma-Zeinstra, S. M. A., Verhaar, J. A. N., Weinans, H., & Tol, J. L. (2010b). Platelet-rich plasma injection for chronic Achilles tendinopathy: A randomized controlled trial. J Am Med Assoc, 303(2), 144-149.
- de Vos, R. J., Weir, A., Visser, R. J., de Winter, T., & Tol, J. L. (2007). The additional value of a night splint to eccentric exercises in chronic midportion Achilles tendinopathy: a randomised controlled trial. Br J Sports Med, 41(7), e5.
- Ebbesen, B. H., Mølgaard, C. M., Olesen, J. L., Gregersen, H. E., & Simonsen, O. (2018). No beneficial effect of Polidocanol treatment in Achilles tendinopathy: a randomised controlled trial. Knee Surg Sports Traumatol Arthrosc, 26(7), 2038-2044.
- Fahlstrom, M., Jonsson, P., Lorentzon, R., & Alfredson, H. (2003). Chronic Achilles tendon pain treated with eccentric calf-muscle training. Knee Surg Sports Traumatol Arthrosc, 11(5), 327-333.
- Goel, D. P., Chan, D., Watson, K., & Mohtadi, N. (2009). Safety and hospital costs of Achilles tendon surgery: the serendipitous impact of a randomized clinical trial. Can J Surg, 52(6), 467-472.
- Guyatt, G. H., Oxman, A. D., Vist, G. E., Kunz, R., Falck-Ytter, Y., Alonso-Coello, P.,... Group, G. W. (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. Bmj, 336(7650), 924-926.
- Heinemeier, K. M., Øhlenschlæger, T. F., Mikkelsen, U. R., Sønder, F., Schjerling, P., Svensson, R. B., & Kjaer, M. (2017). Effects of anti-inflammatory (NSAID) treatment on human tendinopathic tissue. J Appl Physiol, 123(5), 1397-1405.
- Herrington, L., & McCulloch, R. (2007). The role of eccentric training in the management of Achilles tendinopathy: A pilot study. Phys Ther Sport, 8(4), 191-196.
- Horstmann, T., Jud, H. M., Frohlich, V., Mundermann, A., & Grau, S. (2013). Whole-body vibration versus eccentric training or a wait-and-see approach for chronic Achilles tendinopathy: a randomized clinical trial. J Orthop Sports Phys Ther, 43(11), 794-803.
- Hulin, B. T., Gabbett, T. J., Blanch, P., Chapman, P., Bailey, D., & Orchard, J. W. (2014). Spikes in acute workload are associated with increased injury risk in elite cricket fast bowlers. Br J Sports Med, 48(8), 708-712.
- Hulin, B. T., Gabbett, T. J., Lawson, D. W., Caputi, P., & Sampson, J. A. (2016). The acute:chronic workload ratio predicts injury: high chronic workload may decrease injury risk in elite rugby league players. Br J Sports Med, 50(4), 231-236.
- Hunt, K. J., Cohen, B. E., Davis, W. H., Anderson, R. B., & Jones, C. P. (2015). Surgical Treatment of Insertional Achilles Tendinopathy with or Without Flexor Hallucis Longus Tendon Transfer. Foot Ankle Int, 36(9), 998-1005.
- Hutchison, A. M., Pallister, I., Evans, R. M., Bodger, O., Topliss, C. J., Williams, P., & Beard, D. J. (2013). Intense pulsed light treatment of chronic midbody Achilles tendinopathy: A double blind randomised placebo-controlled trial. Bone Jt J, 95 B(4), 504-509.
- Iversen, J. V., Bartels, E. M., & Langberg, H. (2012). The victorian institute of sports assessment - achilles questionnaire (visa-a) - a reliable tool for measuring achilles tendinopathy. Int J Sports Phys Ther, 7(1), 76-84.
- Johnston, R., Cahalan, R., Bonnett, L., Maguire, M., Nevill, A., Glasgow, P.,... Comyns, T. (2019). Training Load and Baseline Characteristics Associated With New Injury/Pain Within an Endurance Sporting Population: A Prospective Study. Int J Sports Physiol Perform, 14(5), 590-597.
- Jonsson, P., Alfredson, H., Sunding, K., Fahlstrom, M., & Cook, J. (2008). New regimen for eccentric calf-muscle training in patiënts with chronic insertional Achilles tendinopathy: results of a pilot study. Br J Sports Med, 42(9), 746-749.
- Khan, K. M., Forster, B. B., Robinson, J., Cheong, Y., Louis, L., Maclean, L., & Taunton, J. E. (2003). Are ultrasound and magnetic resonance imaging of value in assessment of Achilles tendon disorders? A two year prospective study. Br J Sports Med, 37(2), 149-153.
- Krogh, T. P., Ellingsen, T., Christensen, R., Jensen, P., & Fredberg, U. (2016). Ultrasound-Guided Injection Therapy of Achilles Tendinopathy With Platelet-Rich Plasma or Saline: A Randomized, Blinded, Placebo-Controlled Trial. AM J SPORTS MED, 44(8), 1990-1997.
- Lagas, I. F., Fokkema, T., Bierma-Zeinstra, S. M. A., Verhaar, J. A. N., Middelkoop, M., & De Vos, R. J. (2018). Risk factors for Achilles tendinopathy in runners: a large prospective cohort study. Paper presented at the International Scientific Tendinopathy Symposium (ISTS), Groningen, The Netherlands.
- Lagas, I. F., van der Vlist, A. C., van Oosterom, R. F., van Veldhoven, P. L. J., Reijman, M., Verhaar, J. A. N., & de Vos, R. J. (2019). The minimal clinically important difference and patiënt acceptable symptom state of the VISA-A score for Achilles tendinopathy. Submitted to Clin Orthop Relat Res.
- Lohrer, H., David, S., & Nauck, T. (2016). Surgical treatment for achilles tendinopathy - a systematic review. BMC Musculoskelet Disord, 17, 207.
- Lynen, N., De Vroey, T., Spiegel, I., Van Ongeval, F., Hendrickx, N. J., & Stassijns, G. (2017). Comparison of Peritendinous Hyaluronan Injections Versus Extracorporeal Shock Wave Therapy in the Treatment of Painful Achilles' Tendinopathy: A Randomized Clinical Efficacy and Safety Study. Arch Phys Med Rehabil, 98(1), 64-71.
- Macdermid, J. C., & Silbernagel, K. G. (2015). Outcome Evaluation in Tendinopathy: Foundations of Assessment and a Summary of Selected Measures. J Orthop Sports Phys Ther, 45(11), 950-964.
- Mafi, N., Lorentzon, R., & Alfredson, H. (2001). Superior short-term results with eccentric calf muscle training compared to concentric training in a randomized prospective multicenter study on patiënts with chronic Achilles tendinosis. Knee Surg Sports Traumatol Arthrosc, 9(1), 42-47.
- Mayer, F., Hirschmüller, A., Müller, S., Schuberth, M., & Baur, H. (2007). Effects of short-term treatment strategies over 4 weeks in Achilles tendinopathy. Br J Sports Med, 41(7), e6.
- McCormack, J., Underwood, F., Slaven, E., & Cappaert, T. (2015). The Minimum Clinically Important Difference on the Visa-a and Lefs for Patiënts with Insertional Achilles Tendinopathy. Int J Sports Phys Ther, 10(5), 639-644.
- Morrison, R. J. M., Brock, T. M., Reed, M. R., & Muller, S. D. (2017). Radiofrequency Microdebridement Versus Surgical Decompression for Achilles Tendinosis: A Randomized Controlled Trial. J Foot Ankle Surg, 56(4), 708-712.
- Munteanu, S. E., Scott, L. A., Bonanno, D. R., Landorf, K. B., Pizzari, T., Cook, J. L., & Menz, H. B. (2015). Effectiveness of customised foot orthoses for Achilles tendinopathy: a randomised controlled trial. Br J Sports Med, 49(15), 989-994.
- Njawaya, M. M., Moses, B., Martens, D., Orchard, J. J., Driscoll, T., Negrine, J., & Orchard, J. W. (2017). Ultrasound Guidance Does Not Improve the Results of Shock Wave for Plantar Fasciitis or Calcific Achilles Tendinopathy: A Randomized Control Trial. CLIN J SPORT MED.
- Paavola, M., Kannus, P., Paakkala, T., Pasanen, M., & Jarvinen, M. (2000). Long-term prognosis of patiënts with achilles tendinopathy. An observational 8-year follow-up study. Am J Sports Med, 28(5), 634-642.
- Pearson, J., Rowlands, D., & Highet, R. (2012). Autologous blood injection to treat achilles tendinopathy? A randomized controlled trial. J Sport Rehabil, 21(3), 218-224.
- Redler, A., Proietti, L., Mazza, D., Koverech, G., Vadala, A., De Carli, A., & Ferretti, A. (2020). Rupture of the Patellar Tendon After Platelet-Rich Plasma Treatment: A Case Report. Clin J Sport Med, 30(1), e20-e22.
- Robinson, J. M., Cook, J. L., Purdam, C., Visentini, P. J., Ross, J., Maffulli, N.,... Victorian Institute Of Sport Tendon Study, G. (2001). The VISA-A questionnaire: a valid and reliable index of the clinical severity of Achilles tendinopathy. Br J Sports Med, 35(5), 335-341.
- Rompe, J. D., Furia, J., & Maffulli, N. (2008). Eccentric loading compared with shock wave treatment for chronic insertional achilles tendinopathy: A randomized, controlled trial. J Bone Jt Surg Ser A, 90(1), 52-61.
- Rompe, J. D., Furia, J., & Maffulli, N. (2009). Eccentric loading versus eccentric loading plus shock-wave treatment for midportion achilles tendinopathy: A randomized controlled trial. AM J SPORTS MED, 37(3), 463-470.
- Rompe, J. D., Nafe, B., Furia, J. P., & Maffulli, N. (2007). Eccentric loading, shock-wave treatment, or a wait- and-see policy for tendinopathy of the main body of tendo Achillis: A randomized controlled trial. AM J SPORTS MED, 35(3), 374-383.
- Roos, E. M., Engström, M., Lagerquist, A., & Söderberg, B. (2004). Clinical improvement after 6 weeks of eccentric exercise in patiënts with mid-portion Achilles tendinopathy - A randomized trial with 1-year follow-up. Scand J Med Sci Sports, 14(5), 286-295.
- Seeger, J. D., West, W. A., Fife, D., Noel, G. J., Johnson, L. N., & Walker, A. M. (2006). Achilles tendon rupture and its association with fluoroquinolone antibiotics and other potential risk factors in a managed care population. Pharmacoepidemiol Drug Saf, 15(11), 784-792.
- Sierevelt, I., van Sterkenburg, M., Tol, H., van Dalen, B., van Dijk, N., & Haverkamp, D. (2018). Dutch version of the Victorian Institute of Sports Assessment-Achilles questionnaire for Achilles tendinopathy: Reliability, validity and applicability to non-athletes. World J Orthop, 9(1), 1-6.
- Silbernagel, K. G., Thomee, R., Eriksson, B. I., & Karlsson, J. (2007). Continued sports activity, using a pain-monitoring model, during rehabilitation in patiënts with Achilles tendinopathy: a randomized controlled study. Am J Sports Med, 35(6), 897-906.
- Silbernagel, K. G., Thomeé, R., Thomeé, P., & Karlsson, J. (2001). Eccentric overload training for patiënts with chronic Achilles tendon pain--a randomised controlled study with reliability testing of the evaluation methods. Scand J Med Sci Sports, 11(4), 197-206.
- Sterne, J. A. C., Savović, J., Page, M. J., Elbers, R. G., Blencowe, N. S., Boutron, I.,... Higgins, J. P. T. (2019). RoB 2: a revised tool for assessing risk of bias in randomised trials. Bmj, 366, l4898.
- Stevens, M., & Tan, C. W. (2014). Effectiveness of the Alfredson protocol compared with a lower repetition-volume protocol for midportion Achilles tendinopathy: a randomized controlled trial. J Orthop Sports Phys Ther, 44(2), 59-67.
- Tashjian, R. Z., Deloach, J., Porucznik, C. A., & Powell, A. P. (2009). Minimal clinically important differences (MCID) and patiënt acceptable symptomatic state (PASS) for visual analog scales (VAS) measuring pain in patiënts treated for rotator cuff disease. J Shoulder Elbow Surg, 18(6), 927-932.
- Tumilty, S., Mani, R., & Baxter, G. D. (2016). Photobiomodulation and eccentric exercise for Achilles tendinopathy: a randomized controlled trial. Lasers Med Sci, 31(1), 127-135.
- Tumilty, S., McDonough, S., Hurley, D. A., & Baxter, G. D. (2012). Clinical effectiveness of low-level laser therapy as an adjunct to eccentric exercise for the treatment of Achilles' tendinopathy: A randomized controlled trial. Arch Phys Med Rehabil, 93(5), 733-739.
- Tumilty, S., Munn, J., Abbott, J. H., McDonough, S., Hurley, D. A., & Baxter, G. D. (2008). Laser therapy in the treatment of achilles tendinopathy: a pilot study. Photomed Laser Surg, 26(1), 25-30.
- Usuelli, F. G., Grassi, M., Maccario, C., Vigano, M., Lanfranchi, L., Alfieri Montrasio, U., & de Girolamo, L. (2017). Intratendinous adipose-derived stromal vascular fraction (SVF) injection provides a safe, efficacious treatment for Achilles tendinopathy: results of a randomized controlled clinical trial at a 6-month follow-up.
- van der Plas, A., de Jonge, S., de Vos, R. J., van der Heide, H. J., Verhaar, J. A., Weir, A., & Tol, J. L. (2012). A 5-year follow-up study of Alfredson's heel-drop exercise programme in chronic midportion Achilles tendinopathy. Br J Sports Med, 46(3), 214-218.
- Vicenzino, B., de Vos, R. J., Alfredson, H., Bahr, R., Cook, J. L., Coombes, B. K.,... Zwerver, J. (2019). ICON 2019-International Scientific Tendinopathy Symposium Consensus: There are nine core health-related domains for tendinopathy (CORE DOMAINS): Delphi study of healthcare professionals and patiënts. Br J Sports Med.
- Yelland, M. J., Sweeting, K. R., Lyftogt, J. A., Ng, S. K., Scuffham, P. A., & Evans, K. A. (2011). Prolotherapy injections and eccentric loading exercises for painful Achilles tendinosis: a randomised trial. Br J Sports Med, 45(5), 421-428.
- Zhang, B. M., Zhong, L. W., Xu, S. W., Jiang, H. R., & Shen, J. (2013). Acupuncture for chronic achilles tendnopathy: A randomized controlled study. Chin J Integr Med, 19(12), 900-904.
Evidence tabellen
Risk of bias beoordeling van de geïncludeerde gerandomiseerde studies waarin de effectiviteit van conservatieve en operatieve behandelopties beoordeeld zijn
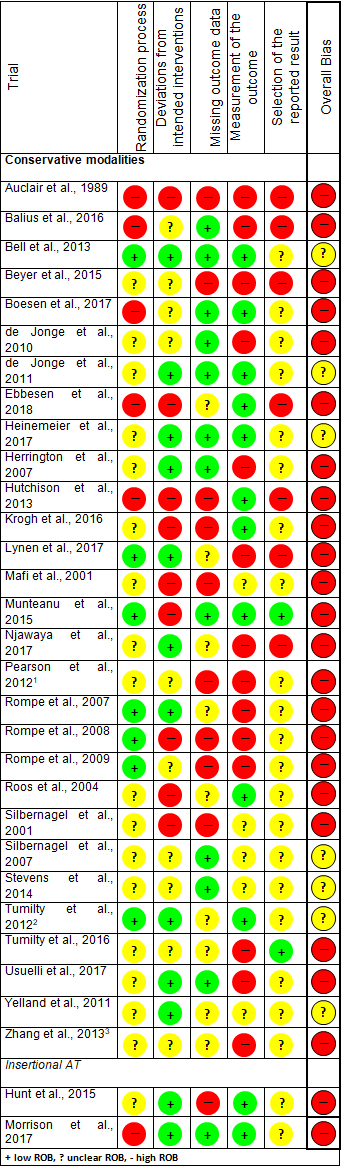
Evidence tabel van de geïncludeerde gerandomiseerde studies waarin conservatieve behandelopties voor achilles tendinopathie zijn onderzocht
|
Study |
Study characteristics |
Patiënt characteristics |
Treatment |
Follow-up |
Outcome measures |
Results |
Predictors |
|
(Auclair, 1989) |
Setting: Eight different centers participated (Army teaching hospital, paracommando training center, department of sports medicine, division of Rehabilitation and Sports Medicine, private practices, Medical Emergency division Fire Brigade) in France, Belgium and Germany
Source of Funding: NR |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Local application of niflumic acid percutaneous gel (2.5%) 3 times a day for 7 days.
Control: Local application of placebo percutaneous gel (2.5%) 3 times a day for 7 days.
|
Length of follow-up: 3 weeks
Loss to follow-up: 16/243, not reported specifically whether these were exclusions or withdrawals |
Primary outcome:
Secondary outcomes:
|
Resumption of normal sporting activity: There was no difference in resumption of normal sporting activity (intervention group 78%, control group 76%).
Adverse effects: 5/123 (4.1%) in the intervention group and 6/116 (5.2%) of placebo gel group experienced side effects. Most common were cutaneous eruptions. 1 patiënt in niflumic acid group stopped treatment after 2 days due to eruptions. |
None investigated |
|
(Balius, 2016) |
Setting: Five sports medicine centers in Spain
Source of Funding: Commercial funding1 |
Inclusion criteria:
Exclusion criteria:
|
Intervention 1: Capsule containing 435 mg mucopolysaccharides, 75 mg collagen type I, and 60 mg vitamin C three times daily for 12 weeks. Additionally, eccentric exercises were performed twice daily for 12 weeks.
Intervention 2: Capsule containing 435 mg mucopolysaccharides, 75 mg collagen type I, and 60 mg vitamin C three times daily for 12 weeks. Additionally, stretching exercises were performed daily for 12 weeks.
Control: Eccentric exercises were performed twice daily for 12 weeks.
|
Length of follow-up: 12 weeks
Loss to follow-up: 3/58; 3 did not attend the inclusion visit (2 in the MCVC+eccentric exercises group and 1 in the MCVC+passive stretching group)
|
Primary outcome:
Secondary outcomes:
|
VISA-A score: There was no significant difference at 12 weeks between the 3 treatment groups. The VISA-A score was 88 (SD 16) in intervention group 1, 84 (SD 22) in intervention group 2, and 79 (SD 18) in the control group.
Adverse effects: Not reported |
None investigated |
|
(Bell, 2013) |
Setting: Specialist multidisciplinary sports medicine clinic in New Zealand
Source of Funding: Specific declaration of no funding |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Unguided peritendinous autologous blood injections (twice; 1 at baseline and 1 after 1 month). Additionally, eccentric exercises were performed twice daily for a minimum of 12 weeks.
Control: Unguided peritendinous dry-needling (twice; 1 at baseline and 1 after 1 month). Additionally, eccentric exercises were performed twice daily for a minimum of 12 weeks. |
Length of follow-up: 26 weeks
Loss to follow-up: 2/53; 1 patiënt per group failed to attend all appointments. |
Primary outcome:
Secondary outcomes:
|
VISA-A score: There was no significant difference at any time point between both treatment groups. At 6 months, VISA-A change from baseline was 18.7 (95% CI: 12.3-25.1) in the intervention group and 19.9 (95% CI: 13.6-26.2) in the control group.
Return to sport: There was no significant difference at 26 weeks between both treatment groups. At 6 months, 52% of the patiënts in the intervention group returned to pre-injury level in their desired sport, compared to 36% in the control group.
Adverse effects: No complications or adverse events as a result of the injections |
Age, sex, ethnicity, level of physical activity, duration of symptoms, severity on ultrasonography, compliance with eccentric training, additional weight carried during eccentric training, and eccentric exercise technique did not influence the magnitude of the effect of treatment on the change in VISA-A score. |
|
(Beyer, 2015) |
Setting: Institute of Sports Medicine in a general hospital in Denmark
Source of Funding: NR |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Heavy slow resistance (HSR) exercises 3 times per week for 12 weeks using resistance equipment in a fitness center.
Control: Eccentric exercises twice daily for 12 weeks. |
Length of follow-up: 52 weeks
Loss to follow-up: 11/55; 6 withdrew from the intervention group (1 ankle pain, 1 back pain, 2 lack of time, and 2 moved away) and 5 withdrew from the control group (1 ankle pain, 2 back pain, and 2 lack of time) |
Primary outcome:
Secondary outcomes:
|
VISA-A score: There was no significant difference at any time point between both treatment groups. At 12 months, VISA-A score was 89 (SD 2.8) in the intervention group and 84 (SD 3.5) in the control group.
Patiënt satisfaction: There was no significant difference at 12 months between both treatment groups. At 12 months, patiënt satisfaction was 96% for the intervention group and 76% for the control group.
Adverse effects: Not reported |
None investigated |
|
(Boesen, 2017) |
Setting: Institute of Sports Medicine in a large district hospital in Denmark
Source of Funding: Commercial funding2 |
Inclusion criteria:
Exclusion criteria:
|
Intervention 1: Ultasonographic-guided high-volume injection with a mixture of 10 mL 0.5% bupivacaine hydrochloride and approximately 20 mg Depo-Medrol, immediately followed by 10 mL of injectable normal saline 4 times (total volume of 50 mL). Injection was performed once at baseline, but three more placebo injections were given at 2-weekly intervals. Additionally, eccentric exercises were performed twice daily for 24 weeks.
Intervention 2: PRP-injections were given at 2-weekly intervals. Additionally, eccentric exercises were performed twice daily for 24 weeks.
Control: Peritendinous dry-needling with a few drops of saline at 2-weekly intervals. Additionally, eccentric exercises were performed twice daily for 24 weeks. |
Length of follow-up: 24 weeks
Loss to follow-up: 3/60; 1 patiënt in intervention group 1 could not be contacted, the 2 other patiënts (1 each in the intervention group 2 and control group) left the trial after 6 weeks due to lack of compliance with the eccentric training regimen. |
Primary outcome:
Secondary outcomes:
|
VISA-A score: Improvement in VISA-A score was significantly greater in intervention group 1 (HVI) compared to intervention group 2 (PRP) and the control group at 6 and 12 weeks. At 24 weeks, improvement in VISA-A score was significantly greater in both intervention groups compared to the control group. Improvement in VISA-A score in intervention group 1 was 27.1 (SD 3.1) at 6 weeks, 28.8 (SD 4.1) at 12 weeks, and 22.2 (SD 4.6) at 24 weeks. Improvement in VISA-A score in intervention group 2 was 13.8 (SD 4.1) at 6 weeks, 14.8 (SD 3.1) at 12 weeks, and 19.6 (SD 4.5) at 24 weeks. Improvement in VISA-A score in the control group was 9.9 (SD 3.3) at 6 weeks, 10.6 (SD 3.0) at 12 weeks, and 8.8 SD (SD 3.3) at 24 weeks.
Return to running: At 24 weeks, 68% had returned to running in intervention group 1 (HVI), 53% in intervention group 2 (PRP), and 42% in the control group. No statistical tests were performed on this data.
Patiënt satisfaction: Patiënts in intervention group 1 (HVI) and in intervention group 2 (PRP) are more most frequently satisfied compared to the control group at both 12 and 24 weeks. At 24 weeks, 63% was satisfied in intervention group 1 (HVI), 58% in intervention group 2 (PRP), and 42% in the control group.
Adverse effects: No complications (infections, hematomas, or ruptures) were reported after the injection treatments. |
None investigated |
|
(de Jonge, 2010) |
Setting: Sports medicine department in a general hospital in the Netherlands
Source of Funding: NR |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Night splint worn every night between 0˚and 5˚dorsiflexion. Duration of treatment not reported. Additionally, eccentric exercises were performed twice daily for 12 weeks.
Control: Eccentric exercises were performed twice daily for 12 weeks. |
Length of follow-up: 52 weeks
Loss to follow-up: 8/70 (tendons); 4 did not receive allocated intervention (2 per group), 3 failed to attend, and 1 left to live overseas. |
Primary outcome:
Secondary outcomes:
|
VISA-A score: There was no significant difference at any time point between both treatment groups. VISA-A score was 78.2 (SD NR) at 52 weeks for the intervention group, compared to 75.7 (SD NR) for the control group.
Patiënt satisfaction: There was no significant difference at any time point between both treatment groups. Patiënt satisfaction was 70% in the intervention group, compared to 53% in the control group at 52 weeks.
Adverse effects: 3/36 (8.3%) in the intervention group, 2/34 (5.9%) in the control group; 2 patiënts (2 tendons) did not complete the treatment in the eccentric group. 1 patiënt experienced too much pain and 1 patiënt developed a subluxation of the peroneal tendon during the study, which prevented him from performing the exercises. In a few cases, the night splint caused minor symptoms, which did not prevent further treatment. 2 patiënts experienced painful pressure areas and 1 patiënt could not increase dorsiflexion of the night splint 0˚ because of paraesthesia of the foot. |
None investigated |
|
(de Jonge, 2011) |
Setting: Sports medicine department in a general hospital in the Netherlands
Source of Funding: Commercial funding3 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Ultrasound guided PRP injection in the degenerative area of the body of the tendon once at baseline. Additionally, eccentric exercises were performed twice daily for 12 weeks.
Control: Ultrasound guided saline injection (2 mL) in the degenerative area of the body of the tendon once at baseline. Additionally, eccentric exercises were performed twice daily for 12 weeks.
|
Length of follow-up: 52 weeks
Loss to follow-up: 0/54 |
Primary outcome:
Secondary outcomes:
|
VISA-A score: There was no significant difference at any time point between both treatment groups. VISA-A score was 78.2 (95% CI: 68.0-88.5) at 52 weeks for the intervention group, compared to 77.6 (95% CI: 70.8-84.4) for the control group.
Return to previous sports levels: There was no significant difference at 24 and 52 weeks between both treatment groups. At 52 weeks, 57% returned to their previous sports levels in the desired sport in the intervention group, compared to 42% in the control group.
Patiënt satisfaction: There was no significant difference at any time point between both treatment groups. Patiënt satisfaction was 59% in both groups at 52 weeks.
Adverse effects: Report there were no complications between 24 weeks and 1-year follow-up. |
Baseline VISA-A score did influence the magnitude of the effect of treatment on the change in VISA-A score. Duration of symptoms did not influence the magnitude of the effect of treatment on the change in VISA-A score. |
|
(Ebbesen, 2018) |
Setting: Department of Orthopedic Surgery in a university hospital in Denmark
Source of Funding: Non-commercial funding4 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Polidocanol (10 mg/mL) injections at the inlet of pathological vessels at the edge of the tendon until neovascularization disappeared. After 4 weeks, the procedure was repeated if neovascularization was still present.
Control: Lidocain (10 mg/mL) injections were performed following the same procedure as the intervention group. After 4 weeks, the procedure was repeated if neovascularization was still present.
|
Length of follow-up: 26 weeks
Loss to follow-up: 4/48; 1 in the intervention group (reason unknown) and 3 in the intervention group (1 swelling of the ankle, 1 had allergic reactions, and 1 reason unknown) |
Primary outcome:
Secondary outcomes:
|
VISA-A score: There was no significant difference at any time point between both treatment groups. VISA-A score was 72.0 (SD 18.1) at 26 weeks for the intervention group, compared to 69.9 (SD 20.0) for the control group.
Patiënt satisfaction: There was no significant difference at 12 and 26 weeks between both treatment groups. Patiënt satisfaction was 61% in the intervention group and 57% in the control group.
Adverse effects: None in the intervention group, 2/24 (8.3%) in the control group; No serious adverse events were found during this study. 1 patiënt in the control group developed allergic reaction (most likely to the lidocaine) and 1 patiënt in the control group had swelling of the ankle (not further specified)
|
None investigated |
|
(Heinemeier, 2017) |
Setting: Outpatiënt clinic at Institute of Sports Medicine in Denmark
Source of Funding: Non-commercial funding5 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Ibuprofen tablets (600 mg) three times/day for 1 week.
Control: Placebo tablets three times/day for 1 week.
|
Length of follow-up: 1 week
Loss to follow-up: NR, most likely no loss to follow-up |
Primary outcome:
Secondary outcomes:
|
VISA-A score: There was no significant difference at 1 week follow-up between both treatment groups. VISA-A score was 59 (SD 20) at 1 week for the intervention group, compared to 65 (SD 20) for the control group.
Adverse effects: Not reported
|
None investigated |
|
(Herrington, 2007) |
Setting: Public health service outpatiënts in the United Kingdom
Source of Funding: No funding received |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Eccentric exercises were performed twice daily for 12 weeks. Deepfriction massage, ultrasound over the most painful area of the Achilles tendon for 6 weeks by a physiotherapist. A stretching program was advised for 12 weeks.
Control: Deepfriction massage, ultrasound over the most painful area of the Achilles tendon for 6 weeks by a physiotherapist. A stretching program was advised for 12 weeks.
|
Length of follow-up: 12 weeks
Loss to follow-up: 0/25 |
Primary outcome:
Secondary outcomes:
|
VISA-A score: Improvement in VISA-A score was significantly greater in the intervention group compared the control group at 12 weeks. VISA-A score in the intervention group was 98 (SD 2) at 12 weeks, compared to 81 (SD 1) for the control group (p=0.01).
Adverse effects: Not reported |
None investigated |
|
(Hutchison, 2013) |
Setting: NR
Source of Funding: Commercial funding6 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Intense pulsed light (IPL) weekly treatments for a period of 3 weeks.
Control: Placebo intense pulsed light weekly treatments for a period of 3 weeks.
|
Length of follow-up: 12 weeks
Loss to follow-up: 4/46; 1 in the intervention group (failed to attend) and 3 in the control group (2 failed to attend and one sustained a fracture of the ankle) |
Primary outcome:
Secondary outcomes:
|
VISA-A score: There was no significant difference at any time point between both treatment groups. VISA-A score was 57.1 (SD 24.5) at 12 weeks for the intervention group, compared to 50.5 (SD 27.0) for the control group.
Adverse effects: Reported that there were no adverse events |
None investigated |
|
(Krogh, 2016) |
Setting: Public hospital in Denmark
Source of Funding: Commercial and non-commercial funding7 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Ultrasound guided intratendinous PRP injection once at baseline. Additionally, eccentric exercises, stretching exercises, and coordination exercises were performed (duration and frequency not reported).
Control: Ultrasound guided intratendinous saline (placebo) injection once at baseline. Additionally, eccentric exercises, stretching exercises, and coordination exercises were performed (duration and frequency not reported).
|
Length of follow-up: 52 weeks
Loss to follow-up: 16/24 at 52 weeks; 10/12 in PRP group and 6/12 in saline withdrew after 3 months due to "unsatisfactory effects". 0/24 at 3 months. |
Primary outcome:
Secondary outcomes:
|
VISA-A score: There was no significant difference at 3 months between both treatment groups. VISA-A score was 35.1 (SD NR) at 12 weeks for the intervention group, compared to 41.9 (SD NR) for the control group. Conclusions are limited to 12 weeks after the treatment due to a large dropout rate.
Adverse effects: 1/12 (8.3%) in the intervention group, none in the control group: 1 patiënt from the PRP group contacted the department within 5 weeks after the initial treatment because of concern about the level of increasing pain (the thickness of the Achilles tendon had increased from 7.9 to 9.2 mm). No events leading to hospitalization in any of the groups. |
None investigated |
|
(Lynen, 2017) |
Setting: Ambulatory care in two hospitals in Germany and Belgium
Source of Funding: Commercial funding8 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Two ultrasound guided peritendinous hyaluronan injections at weekly intervals. The performance of excessive sports or physical activities were discouraged during the study.
Control: Three sessions extracorporeal shock wave therapy at weekly intervals. The performance of excessive sports or physical activities were discouraged during the study. |
Length of follow-up: 26 weeks
Loss to follow-up: 4/62; 1 in the intervention group because of several deviations in the selection criteria and 3 in the control group (withdrawal of con-sent before treatment end, loss to follow-up, and lack of efficacy) |
Primary outcome:
Secondary outcomes:
|
VISA-A score: Improvement in VISA-A score was significantly greater in the intervention group compared to the control group at 12 and 26 weeks (p<0.01). The VISA-A scores in the intervention group was 73.0 (SD 24.0) at 12 weeks, and 75.0 (SD 22.0) at 26 weeks. In the control group, VISA-A score was 47.5 (SD 15.0) at 12 weeks, and 52.0 (SD 15.0) at 26 weeks.
Adverse effects: 3 patiënts (4.8%) in the intervention group (4 adverse events) and 5 patiënts (8.1%) in the control group (6 adverse events). None of these were considered serious. Eight adverse events were judged as not device or procedure related, and only 2 were thought to have a causal relationship with the study treatments. One participant reported transient, moderate tendon pain after HA injection on day 1, and another participant reported transient, moderate application site pain lasting 2 days after ESWT treatment. |
None investigated |
|
(Mafi, 2001) |
Setting: An Orthopedic Surgery department and Sports Medicine Unit in Sweden
Source of Funding: NR |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Eccentric training regimen on a daily basis for 12 weeks.
Control: Concentric training regimen on a daily basis for 12 weeks.
|
Length of follow-up: 12 weeks
Loss to follow-up: 0/44 |
Primary and secondary outcomes were not specified:
|
Patiënt satisfaction: Patiënt satisfaction was significantly greater at 12 weeks in the intervention group compared to the control group (p<0.002). 88% of the patiënts in the intervention group were satisfied, compared to 36% in the control group.
Adverse effects: Not reported |
None investigated |
|
(Munteanu, 2015) |
Setting: A university clinic and a radiology department of a private hospital in Australia. Source of Funding: Commercial funding9 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Customised foot orthoses in combination with a 12-week eccentric calf muscle training.
Control: Sham foot orthoses in combination with a 12-week eccentric calf muscle training. |
Length of follow-up: 52 weeks
Loss to follow-up: 41/140 at the primary endpoint (12 weeks); 18 patiënts in the intervention group (13 unable to be contacted, 2 no time, 2 unrelated medical condition, 1 reason not provided) and 23 in the control group (18 unable to be contacted, 1 no time, 2 unrelated medical condition, 2 adverse events, 1 reason not provided). 50/140 at 52 weeks. |
Primary outcome:
Secondary outcomes:
|
VISA-A score: There were no significant differences at 1, 3, 6, and 12 months between both treatment groups. VISA-A score was 82.1 (SD 16.3) at 12 months for the intervention group, compared to 79.2 (SD 20.0) for the control group.
Adverse effects: 27/54 (50%) in the intervention group, 23/55 (41.8%) in the control group within 1 month. No serious adverse events; 2 participants in sham orthosis group withdrew due to adverse events: 1 knee pain, 1 lower limb stress fracture.
|
None investigated |
|
(Njawaya, 2017) |
Setting: University sports medicine clinic in Australia
Source of Funding: Commercial funding10 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Patiënt-guided radial shock wave therapy at weekly intervals over 3 to 5 weeks
Control: Ultrasound-guided shock wave therapy at weekly intervals over 3 to 5 weeks
|
Length of follow-up: 26-52 weeks
Loss to follow-up: 4/31; Reasons for lost to follow-up not provided |
Primary outcomes:
Secondary outcomes:
|
VISA-A score There were no significant differences at 6, 12 and 26 weeks between both treatment groups. VISA-A score was 71.7 (SD 23.9) at 26 weeks for the intervention group, compared to 69.9 (SD 19.6) for the control group.
Adverse effects: Not clearly reported. Less than a fifth of participants reported any pain or side effects of treatment. None of the side effects were serious—they included pain, minor skin damage (rash or bleeding), and tingling. No one required surgery or injectable medications. |
None investigated |
|
(Pearson, 2012) |
Setting: Private sports medicine clinic in New Zealand
Source of Funding: Commercial funding11 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: A single peritendinous autologous blood injection at baseline in combination with twice daily eccentric-loading exercises for 12 weeks.
Control: Twice daily eccentric-loading exercises for 12 weeks. |
Length of follow-up: 12 weeks
Loss to follow-up: 12/40 tendons; 6 in the intervention group (2 withdrew from the study, 3 did not recover questionnaire, and 1 did not receive treatment) and 6 in the control group (2 withdrew from the study, 3 did not recover questionnaire, and 1 did not receive treatment) |
Primary outcome:
Secondary outcomes:
|
VISA-A score: There were no significant differences at 6 and 12 weeks between both treatment groups. VISA-A score was 67.1 (SD 21.7) at 12 weeks for the intervention group, compared to 58.9 (SD 20.9) for the control group.
Adverse effects: There were no infections and no tendon ruptures. |
The degree of neovascularization did not influence the magnitude of the effect of treatment on the change in VISA-A score. |
|
(Rompe, 2007) |
Setting: Primary care setting in Germany
Source of Funding: NR |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Three treatments of radial low-energy shock wave therapy at weekly intervals. It was encouraged to avoid pain-provoking activities.
Control group 1: Twice daily eccentric-loading exercises for 12 weeks. It was encouraged to avoid pain-provoking activities.
Control group 2: Wait and see treatment. Training modifications, implementation of stretching exercises, and ergonomic advice were discussed with the patiënt by an orthopedic surgeon. It was encouraged to avoid pain-provoking activities. |
Length of follow-up: 16 weeks
Loss to follow-up: 5/75; 1 in the intervention group (unwilling to come), 2 in control group 1 (1 unwilling to come, 1 discontinued intervention), and 2 in control group 2 (1 unwilling to come, 1 discontinued intervention). |
Primary outcome:
Secondary outcomes:
|
VISA-A score: Improvement in VISA-A score was significantly greater in the intervention group and control group 1 (eccentric loading) compared to control group 2 (wait and see policy) at 16 weeks follow-up (p<0.001). The VISA-A scores in the intervention group was 70.4 (SD 16.3) at 16 weeks, 75.6 (SD 18.7) in control group 1 (eccentric loading), and 55.0 (SD 12.9) om control group 2 (wait and see policy).
Adverse effects: There were no serious complications. In all patiënts, transient reddening of the skin occurred after low-energy SWT, but no bruising was seen. No device-related complications occurred. Patiënts reported ache in the calf after eccentric loading, but none had to interrupt the eccentric load training regimen because of this. There were no drug-related complications in group 3. During the study period, no patiënt sustained a rupture of the Achilles tendon. |
None investigated |
|
(Rompe, 2008) |
Setting: Primary care setting in Germany
Source of Funding: No funding received |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Three treatments of radial low-energy shock wave therapy at weekly intervals. It was encouraged to await further spontaneous improvement.
Control: Twice daily eccentric-loading exercises for 12 weeks. |
Length of follow-up: 16 weeks
Loss to follow-up: 5/50; 2 in the intervention group (persisting pain) and 3 in the control group (1 refused to attend but still had pain as reported on the telephone, 2 patiënts refused to attend but they reported by telephone that they were pain-free) |
Primary outcome:
Secondary outcomes:
|
VISA-A score: Improvement in VISA-A score was significantly greater in the intervention group compared to the control group at 16 weeks follow-up (p=0.005). The VISA-A scores in the intervention group was 79.4 (SD 10.4) at 16 weeks, compared to 63.4 (SD 12.0) in the control group.
Adverse effects: There were no serious complications. In all patiënts, transient reddening of the skin occurred after low-energy shock wave treatment, but there was no bruising. No device-related complications occurred. The patiënts reported aching in the calf after eccentric loading. |
None investigated |
|
(Rompe, 2009) |
Setting: Primary care setting in Germany
Source of Funding: NR |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Three treatments of radial low-energy shock wave therapy at weekly intervals combined with eccentric-loading exercises twice daily for 12 weeks. It was encouraged to avoid pain-provoking activities.
Control: Twice daily eccentric-loading exercises for 12 weeks. It was encouraged to avoid pain-provoking activities.
|
Length of follow-up: 16 weeks
Loss to follow-up: 7/68; 4 in the intervention group (3 unwilling to attend, 1 discontinued intervention) and 3 in the control group (2 unwilling to attend, 1 discontinued intervention) |
Primary outcome:
Secondary outcomes:
|
VISA-A score: Improvement in VISA-A score was significantly greater in the intervention group compared to the control group at 16 weeks follow-up (p=0.0016). The VISA-A scores in the intervention group was 86.5 (SD 16.0) at 16 weeks, compared to 73.0 (SD 19.0) in the control group.
Adverse effects: There were no serious complications. In all patiënts, transient reddening of the skin occurred after low-energy SWT, but no bruising. No device-related complications occurred. Patiënts reported ache in the calf after eccentric loading, but none had to interrupt the eccentric load training regimen because of this. During the study period, no patiënt sustained a rupture of the Achilles tendon. |
None investigated |
|
(Roos, 2004) |
Setting: NR
Source of Funding: Non-commercial funding12 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: An anterior night splint worn every night for 12 weeks in combination with twice daily eccentric-loading exercises for 12 weeks.
Control group 1: An anterior night splint worn every night for 12 weeks.
Control group 2: Twice daily eccentric-loading exercises for 12 weeks. |
Length of follow-up: 52 weeks
Loss to follow-up: 12/47; At 52 weeks 3 in the intervention group (2 did not return questionnaire and 1 had a lumbar hernia), 3 in control group 1 (1 did not return questionnaire, 2 wanted to try other treatment as they were not able to sleep), and 3 in control group 2 (2 did not return questionnaire, 1 could not be reached) |
Primary outcome:
Secondary outcomes:
|
Return to sport at pre-injury level: At 12 weeks, 3/8 patiënts in the intervention group returned to the same activity level, 1/10 in control group 1, and 5/8 in control group 2. No statistical tests were performed.
Adverse effects: 33% of patiënts reported muscle soreness after eccentric exercises; 4 patiënts had pressure-related problems from the night splint; 2 patiënts had sleep problems from the night splint.
|
None investigated |
|
(Silbernagel, 2001) |
Setting: NR
Source of Funding: NR |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Gradually progressive calf muscle exercise program combined with stretching exercises 1-3 times per day for 12 weeks.
Control: Isotonic calf muscle exercise training program combined with stretching exercises 3 times per day for 12 weeks. |
Length of follow-up: 52 weeks
Loss to follow-up: 9/49; 3 in the intervention group (stopped at their own request within two weeks of the start of the study) and 6 in the control group (2 decided to have surgery after 6 weeks, 1 patiënt underwent surgery for bursitis, 1 was not able to attend the evaluation and 2 withdrew without specifying the reason) |
Primary and secondary outcomes were not specified:
|
Return to physical activity: There was no significant difference in the percentage of patiënts that returned to the same activity level as before their problems. In the intervention group 11/20 patiënts returned to the same activity level, compared to 6/17 in the control group (p-value not presented).
Adverse effects: Not reported |
None investigated |
|
(Silbernagel, 2007) |
Setting: Physical therapy clinic in Göteborg, Sweden with the performance of a home-bases exercise program
Source of Funding: Non-commercial funding13 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Continued Achilles tendon-loading activity for the first 6 weeks of rehabilitation using a pain monitoring scale (VAS max. 5/10). Both groups performed a progressive Achilles tendon-loading strengthening program once daily for 12 weeks to 6 months.
Control: Achilles tendon-loading activity for the first 6 weeks of rehabilitation was discouraged. Both groups performed a progressive Achilles tendon-loading strengthening program once daily for 12 weeks to 6 months. |
Length of follow-up: 52 weeks
Loss to follow-up: 4/42; 2 participants in the intervention group (1 not able to attend any of the evaluations and 1 had pain in the ankle and knee that hindered participation) and 2 participants in the control group (1 because of self-reported noncompliance and one because of illness that did not allow him to start the treatment) |
Primary outcome:
Secondary outcomes:
|
VISA-A score: There were no significant differences at 6, 12, 26, and 52 weeks between both treatment groups. VISA-A score was 85 (SD 12.7) at 52 weeks for the intervention group, compared to 91 (SD 8.2) for the control group.
Adverse effects: Not reported
|
Baseline VISA-A score did influence the magnitude of the effect of treatment on the change in VISA-A score. Duration of symptoms did not influence the magnitude of the effect of treatment on the change in VISA-A score. |
|
(Stevens, 2014) |
Setting: Eight clinical sites (2 district hospitals and 6 general practitioner practices) in the United Kingdom
Source of Funding: NR |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Twice daily eccentric-loading exercises for 12 weeks with a number of repetitions per day that was tolerable (up to 180). It was encouraged to avoid pain-provoking activities.
Control: Twice daily eccentric-loading exercises for 12 weeks with a fixed number of repetitions per day (180). It was encouraged to avoid pain-provoking activities.
|
Length of follow-up: 6 weeks
Loss to follow-up: 6/28; 2 in the intervention group and 4 in the control group. Reasons for lost to follow-up not provided. |
Primary outcome:
Secondary outcomes:
|
VISA-A score: Improvement in VISA-A score was significantly greater in the intervention group compared to the control group at 3 weeks follow-up (p=0.004). The VISA-A score in the intervention group was 56.2 (SD 19.7) at 3 weeks, compared to 41.0 (SD 13.0) in the control group. Baseline VISA-A scores were 47.1 (SD 15.6) for the intervention group, and 49.6 (SD 10.2) for the control group (indicating worsening of symptoms in the control group).There was no significant difference at 6 weeks between both treatment groups. VISA-A score was 62.5 (SD 12.8) at 6 weeks for the intervention group, compared to 58.7 (SD 13.0) for the control group.
Patiënt satisfaction: There was no significant difference at 6 weeks between both treatment groups. Patiënt satisfaction was excellent/good 69% in the intervention group, and 47% in the control group.
Adverse effects: Not reported |
None investigated |
|
(Tumilty, 2012) |
Setting: Primary care clinic (not specifically stated where this clinic is located)
Source of Funding: Non-commercial funding14 |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Laser therapy (100 mW/cm2 infrared probe) 3 times per week for 4 weeks. Laser therapy was combined with twice daily eccentric-loading exercises for 12 weeks.
Control: Placebo laser therapy 3 times per week for 4 weeks. Placebo laser therapy was combined with twice daily eccentric-loading exercises for 12 weeks. |
Length of follow-up: 52 weeks
Loss to follow-up: 7/40; 3 in the intervention group and 4 in the control group. In 3 participants the reason for withdrawal were not ascertained, 2 shift work, 1 had travel constraints, and 1 could not be contacted (not mentioned to which group they belonged). |
Primary outcome:
Secondary outcomes:
|
VISA-A score: Improvement in VISA-A score was significantly greater in the control group compared to the intervention group at 4 weeks follow-up (p=0.016). The VISA-A score in the control group was 82.8 (SD 8.3) at 4 weeks, compared to 71.9 (SD 13.5) in the intervention group. There were no significant differences at 12 or 52 weeks between both treatment groups. VISA-A score was 83.0 (SD 14.5) at 52 weeks for the intervention group, compared to 90.9 (SD 10.1) for the control group.
Adverse effects: No reports of any adverse reactions from either the low-level laser therapy or the exercise program |
None investigated |
|
(Tumilty, 2016) |
Setting: University Physical Therapy Clinic in New Zealand
Source of Funding: Non-commercial funding15 |
Inclusion criteria:
Exclusion criteria:
|
Intervention group 1: Laser therapy (150 J for each part of the tendon) 2 times per week for 4 weeks. Laser therapy was combined with twice daily eccentric-loading exercises for 12 weeks.
Intervention group 2: Laser therapy (150 J for each part of the tendon) 2 times per week for 4 weeks. Laser therapy was combined with twice weekly eccentric-loading exercises for 12 weeks.
Control group 1: Placebo laser therapy 2 times per week for 4 weeks. Placebo laser therapy was combined with twice daily eccentric-loading exercises for 12 weeks.
Control group 2: Placebo laser therapy 2 times per week for 4 weeks. Placebo laser therapy was combined with twice weekly eccentric-loading exercises for 12 weeks. |
Length of follow-up: 12 weeks
Loss to follow-up: 16/80; 4 in intervention group 1(1 did not start, 3 had no time), 4 in intervention group 2(2 had an unrelated injury, 2 had muscle soreness), 7 in control group 1 (1 did not start, 3 had no time, and 2 had muscle soreness), and 1 in control group 2 (1 unrelated injury). |
Primary outcome:
Secondary outcomes:
|
VISA-A score: Improvement in VISA-A score was significantly greater in intervention group 2 compared to the other 3 groups at 12 weeks follow-up (p<0.01). There were no significant differences between the other 3 groups. The VISA-A score in intervention group 2 was 99.0 (95% CI 94.4-103.5) at 12 weeks, compared to 88.6 (95% CI 83.9-93.3) in intervention group 1, 80.4 (95% CI 75.2-85.7) in control group 1, and 87.6 (95% CI 83.5-91.7) in control group 2.
Adverse effects: 6 participants complained of delayed onset muscle soreness (DOMS) within the first week of starting treatment, three of these withdrew from the study; otherwise, no other adverse reactions were reported. |
None investigated |
|
(Usuelli, 2017) |
Setting: Foot and Ankle Unit of an orthopedic department in Italy
Source of Funding: NR |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Ultrasound-guided stromal vascular fraction (SVF, derived from abdominal subcutaneous tissue) intratendinous injections once at baseline. If pain persisted, the injection procedure was repeated after 2 months. No specific physical therapy was prescribed after the treatment.
Control: Ultrasound-guided intratendinous platelet-rich plasma (PRP)-injection once at baseline. If pain persisted, the injection procedure was repeated after 2 months. No specific physical therapy was prescribed after the treatment. |
Length of follow-up: 26 weeks
Loss to follow-up: 0/44 |
Primary and secondary outcomes were not specified:
|
VISA-A score: Improvement in VISA-A score was significantly greater in the intervention group compared to the control group at 15 and 30 days follow-up (p<0.05). At 30 days, the VISA-A score was 59.1 (SD 19.8) in the intervention group, compared to 47.5 (SD 15.9) in the control group. At all other time points (30, 60, 120, and 120 days), there were no significant differences between the 2 groups. The VISA-A score at the final end point was 71.1 (SD 19.8) in the intervention group, compared to 70.9 (SD 20.7) in the control group.
Adverse effects: Neither serious side effects nor adverse events were observed during the follow-up period. Five patiënts (25%) of the SVF groups complained for hematoma and cutaneous discomfort at the adipose tissue harvest site for about a week after the procedure. |
None investigated |
|
(Yelland, 2011) |
Setting: Five primary care centers in Australia
Source of Funding: Non-commercial funding16 |
Inclusion criteria:
Exclusion criteria:
|
Intervention group 1: Intratendinous prolotherapy injection (maximum of 20% glucose/0.1% lignocaine/0.1% ropivacaine solution) weekly for 4-12 treatment sessions. Patiënts were encouraged to gradually increase their activity levels.
Intervention group 2: Intratendinous prolotherapy injection (maximum of 20% glucose/0.1% lignocaine/0.1% ropivacaine solution) weekly for 4-12 treatment sessions. Twice daily eccentric-loading exercises were performed for 12 weeks. Patiënts were encouraged to gradually increase their activity levels.
Control: Twice daily eccentric-loading exercises for 12 weeks. |
Length of follow-up: 52 weeks
Loss to follow-up: 3/43; 1 in intervention group 1 and 2 in the control group. 1 participant had a heart attack, 1 discontinued because of time restraints and 1 sustained an unrelated injury during the study (not reported which group they belonged to). |
Primary outcome:
Secondary outcomes:
|
VISA-A score: Improvement in VISA-A score was significantly greater in intervention group 2 compared to the control group at 6 and 52 weeks follow-up (p=0.005/0.007). At 52 weeks, the VISA-A score was 91.4 (SD 9.9) in intervention group 2, compared to 84.9 (SD 18.2) in the control group. Intervention group 1 did not differ between the other 2 groups (VISA-A score at 52 weeks 89.6 (SD 20.1).
Adverse effects: None in both intervention groups, 1/15 (6.7%) in the control group; A participant in the control group had a partial calf tear while playing tennis. An independent sports physician did not attribute this to the ELE program. |
None investigated |
|
(Zhang, 2013) |
Setting: Two hospitals in a metropolitan city in China
Source of Funding: NR |
Inclusion criteria:
Exclusion criteria:
|
Intervention: Acupuncture intratendinous for 30 minutes per session. Sessions were performed 3 times per week for 8 weeks.
Control: Eccentric-loading exercises 2-3 sessions of 15 repetitions. Not reported how many days per week and for how many weeks exercises were performed. |
Length of follow-up: 24 weeks
Loss to follow-up: 4/64; 1 in the intervention group and 3 in the control group. Reasons for lost to follow-up not provided. |
Primary outcomes:
Secondary outcomes:
|
VISA-A score: Improvement in VISA-A score was significantly greater in the intervention group compared to the control group at 8, 16, and 24 weeks follow-up (p<0.0001). At 24 weeks, the VISA-A score was 73.3 (SD 3.6) in the intervention group, compared to 62.4 (SD 4.2) in the control group.
Adverse effects: Not reported |
None investigated |
|
Abbreviations: AT, achilles tendinopathy; FHL, flexor hallucis longus; NR, not reported; SD, standard deviation; VAS, visual analog scale 1 Bioiberica, SA, Palafolls, Spain (commercial) 2 Arthrex Danmark A/S 3 Direct financial support and donation of the platelet-separation kits used in the study were provided by Biomet Biologics LLC, Warsaw, Indiana. Biomet had no role in the design and conduct of the study or the interpretation of the data. 4 The study was supported by grants from Hans og Nora Buchards Fond, Speciallæge Heinrich Kopps Legat and Region of Northern Denmark. 5 The Danish Medical Research Council, Lundbeck Foundation, and Novo Nordisk Foundation provided financial support. 6 This study was sponsored by Cyden Ltd and the Intense Pulsed Light system was provided by Cyden Ltd. 7 Biomet Biologics provided a Platelet Concentrate Separation Kit and donated an unrestricted grant to the Regional Hospital Silkeborg. The Danish Rheumatism Association supported one of the authors with a 6 month grant. The Health Research Fund of Central Denmark Region supported one of the authors with a 3-month grant. 8 Ostenil was supplied by TRB Chemedica AG and the ESWT device by PiezoSon 100 plus, Richard Wolf GmbH. 9 The study was funded by the Prescription Foot Orthotic Laboratory Association (PFOLA). Footwork Podiatric Laboratory Pty Ltd (Melbourne, Australia) donated the customized foot orthoses for this study. 10 Manufacturers (Sonosite and DJO) provided free use of equipment for the duration of the study. 11 Pacific Radiology (Wellington, New Zealand) performed the ultrasounds free of charge to the patiënts. 12 Study supported by grants from the The Swedish National Center for Research in Sports, Zoega Foundation for Medical Research, The Swedish Research Council and Lund University Hospital and Medical Faculty. 13 This study was supported by grants from the Swedish National Centre for Research in Sports and the local Research and Development Council of Gothenburg and Southern Bohuslän. 14 Supported by the University of Otago Dean’s Establishment Grant. 15 This study was funded by the University of Otago Research Grant. 16 Musculoskeletal Research Foundation of Australia; Australian Podiatry Education and Research Foundation; Griffith University Office of Research |
|||||||
Vergelijkingen in VISA-A scores tussen verschillende behandelcategorieën voor patiënten met midportion achilles tendinopathie na 3 maanden (A) en 12 maanden (B) follow-up
A)
Mean differences on the VISA-A score with their 95% credible intervals from the network meta-analysis. For any cell, a negative mean difference favours the upper-left treatment, and a positive mean difference favours the lower-right treatment. Significant comparative treatment class effect differences are shown in bold and are marked grey. VISA-A = Victorian Institute of Sport Assessment-Achilles.
|
|
|
|
|
|
|
|
|
|
|
|
19 (-3 to 34) |
Exercise therapy + placebo injection |
|
|
|
|
|
|
|
|
|
23 (8 to 38) |
4 (-11 to 19) |
Injection therapy |
|
|
|
|
|
|
|
|
20 (11 to 30) |
1 (-10 to 15) |
-2 (-14 to 9) |
Exercise therapy |
|
|
|
|
|
|
|
15 (6 to 24) |
-4 (-19 to 13) |
-8 (-23 to 8) |
-5 (-15 to 5) |
Shockwave therapy |
|
|
|
|
|
|
22 (7 to 36) |
4 (-2 to 8) |
0 (-13 to 14) |
2 (-10 to 13) |
7 (-8 to 22) |
Exercise + injection therapy |
|
|
|
|
|
34 (21 to 47) |
15 (1 to 31) |
11 (-4 to 26) |
14 (5 to 23) |
19 (5 to 32) |
12 (-2 to 27) |
Exercise + shockwave therapy |
|
|
|
|
21 (4 to 39) |
2 (-18 to 21) |
-2 (-21 to 17) |
1 (-14 to 15) |
6 (-12 to 23) |
-1 (-20 to 17) |
-13 (-30 to 4) |
Exercise + night splint therapy |
|
|
|
35 (25 to 45) |
16 (4 to 30) |
13 (0 to 25) |
15 (11 to 19) |
20 (9 to 31) |
13 (2 to 25) |
1 (-9 to 11) |
14 (-1 to 30) |
Acupuncture therapy |
|
|
28 (14 to 41) |
9 (-7 to 25) |
5 (-11 to 20) |
7 (-3 to 17) |
13 (-2 to 26) |
6 (-10 to 20) |
-6 (-20 to 7) |
7 (-11 to 24) |
-7 (-19 to 3) |
Exercise + mucopolysaccharides supplement therapy |
B)
|
Injection therapy |
|
|
|
|
-5 (-19 to 9) |
Exercise therapy |
|
|
|
2 (-10 to 13) |
7 (-4 to 17) |
Exercise + injection therapy |
|
|
3 (-16 to 22) |
8 (-6 to 21) |
1 (-16 to 18) |
Exercise + night splint therapy |
Mean differences on the VISA-A with their 95% credible intervals from the network meta-analysis. For any cell, a negative mean difference favours the upper-left treatment, and a positive mean difference favours the lower-right treatment. Significant comparative treatment class effect differences are shown in bold (not present).
GRADE-beoordeling voor afzonderlijke behandelopties voor midportion achilles tendinopathie
|
Comparison |
Mean difference (95% credible interval) |
Risk of bias |
Inconsistencya |
Indirectnessb |
Imprecision |
Publication biasc |
Quality of evidence |
|
VISA-A score at 3 months |
|
|
|
|
|
|
|
|
Placebo injection + eccentric exercises v wait-and-see |
26 (-7 to 45) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Autologous blood Injection + eccentric exercises v wait-and-see |
28 (-9 to 46) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
High volume injection + eccentric exercises v wait-and-see |
37 (16 to 57) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
PRP injection + eccentric exercises v wait-and-see |
27 (6 to 47) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Prolotherapy v wait-and-see injection |
21 (7 to 36) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Prolotherapy injection + eccentric exercises v wait-and-see |
17 (0 to 35) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises v wait-and-see |
20 (11 to 29) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Heavy slow resistance exercises v wait-and-see |
24 (15 to 34) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Continued sports activity + eccentric exercises v wait-and-see |
20 (5 to 33) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Shock-wave therapy v wait-and-see |
15 (7 to 24) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + shockwave therapy v wait-and-see |
34 (22 to 46) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Eccentric exercises+ night splint v wait-and-see |
21 (4 to 38) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v wait-and-see |
35 (26 to 45) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Eccentric exercises as tolerated v wait-and-see |
24 (11 to 38) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v wait-and-see |
29 (15 to 43) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v wait-and-see |
26 (10 to 41) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Autologous blood Injection + eccentric exercises v Placebo injection + eccentric exercises |
1 (-8 to 11) |
Serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Moderate |
|
High volume injection + eccentric exercises v Placebo injection + eccentric exercises |
11 (4 to 17) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
PRP injection + eccentric exercises v Placebo injection + eccentric exercises |
1 (-5 to 7) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Prolotherapy injection v Placebo injection + eccentric exercises |
-5 (-25 to 16) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Prolotherapy injection + eccentric exercises v Placebo injection + eccentric exercises |
-9 (-31 to 14) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises v Placebo injection + eccentric exercises |
-6 (-23 to 11) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Heavy slow resistance exercises v Placebo injection + eccentric exercises |
-2 (-19 to 16) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Continued sports activity + eccentric exercises v Placebo injection + eccentric exercises |
-7 (-27 to 15) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Shock-wave therapy v Placebo injection + eccentric exercises |
-11 (-30 to 9) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + shockwave therapy v Placebo injection + eccentric exercises |
8 (-11 to 27) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Placebo injection + eccentric exercises |
-6 (-27 to 17) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Placebo injection + eccentric exercises |
9 (-8 to 27) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises as tolerated v Placebo injection + eccentric exercises |
-2 (-21 to 18) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Placebo injection + eccentric exercises |
2 (-17 to 23) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Placebo injection + eccentric exercises |
-1 (-22 to 21) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
High volume injection + eccentric exercises v Autologous blood Injection + eccentric exercises |
9 (-2 to 21) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
PRP injection + eccentric exercises v Autologous blood Injection + eccentric exercises |
-1 (-12 to 10) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Prolotherapy injection v Autologous blood Injection + eccentric exercises |
-6 (-26 to 14) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Prolotherapy injection + eccentric exercises v Autologous blood Injection + eccentric exercises |
-10 (-31 to 11) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises v Autologous blood Injection + eccentric exercises |
-7 (-23 to 8) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Heavy slow resistance exercises v Autologous blood Injection + eccentric exercises |
-3 (-19 to 13) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Continued sports activity + eccentric exercises v Autologous blood Injection + eccentric exercises |
-8 (-27 to 12) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Shock-wave therapy v Autologous blood Injection + eccentric exercises |
-12 (-31 to 6) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + shockwave therapy v Autologous blood Injection + eccentric exercises |
6 (-11 to 24) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Autologous blood Injection + eccentric exercises |
-7 (-28 to 15) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Autologous blood Injection + eccentric exercises |
8 (-8 to 24) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises as tolerated v Autologous blood Injection + eccentric exercises |
-3 (-22 to 15) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Autologous blood Injection + eccentric exercises |
1 (-17 to 20) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Autologous blood Injection + eccentric exercises |
-2 (-22 to 18) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
PRP injection + eccentric exercises v High volume injection + eccentric exercises |
-10 (-17 to -2) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Prolotherapy injection v High volume injection + eccentric exercises |
-16 (-37 to 7) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Prolotherapy injection + eccentric exercises v High volume injection + eccentric exercises |
-19 (-43 to 5) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises v High volume injection + eccentric exercises |
-17 (-35 to 2) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Heavy slow resistance exercises v High volume injection + eccentric exercises |
-13 (-31 to 6) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Continued sports activity + eccentric exercises v High volume injection + eccentric exercises |
-17 (-39 to 5) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Shock-wave therapy v High volume injection + eccentric exercises |
-22 (-42 to 0) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + shockwave therapy v High volume injection + eccentric exercises |
-3 (-23 to 18) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v High volume injection + eccentric exercises |
-16 (-39 to 8) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v High volume injection + eccentric exercises |
-2 (-20 to 17) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises as tolerated v High volume injection + eccentric exercises |
-13 (-33 to 9) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v High volume injection + eccentric exercises |
-8 (-29 to 14) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v High volume injection + eccentric exercises |
-11 (-34 to 11) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Prolotherapy injection v PRP injection + eccentric exercises |
-6 (-27 to 16) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Prolotherapy injection + eccentric exercises v PRP injection + eccentric exercises |
-10 (-33 to 14) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises v PRP injection + eccentric exercises |
-7 (-24 to 12) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Heavy slow resistance exercises v PRP injection + eccentric exercises |
-3 (-20 to 16) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Continued sports activity + eccentric exercises v PRP injection + eccentric exercises |
-7 (-28 to 14) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Shock-wave therapy v PRP injection + eccentric exercises |
-12 (-32 to 9) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + shockwave therapy v PRP injection + eccentric exercises |
7 (-13 to 27) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v PRP injection + eccentric exercises |
-6 (-29 to 17) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v PRP injection + eccentric exercises |
8 (-10 to 27) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises as tolerated v PRP injection + eccentric exercises |
-3 (-23 to 18) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v PRP injection + eccentric exercises |
2 (-19 to 23) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v PRP injection + eccentric exercises |
-1 (-23 to 21) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Prolotherapy injection + eccentric exercises v Prolotherapy injection |
-4 (-19 to 11) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises v Prolotherapy injection |
-1 (-13 to 11) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Heavy slow resistance exercises v Prolotherapy injection |
3 (-9 to 15) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Continued sports activity + eccentric exercises v Prolotherapy injection |
-2 (-18 to 15) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Shock-wave therapy v Prolotherapy injection |
-6 (-21 to 9) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + shockwave therapy v Prolotherapy injection |
13 (-6 to 31) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Prolotherapy injection |
-1 (-19 to 18) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Prolotherapy injection |
14 (2 to 26) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises as tolerated v Prolotherapy injection |
3 (-12 to 18) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Prolotherapy injection |
7 (-8 to 23) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Prolotherapy injection |
4 (-13 to 22) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises v Prolotherapy injection + eccentric exercises |
3 (-12 to 18) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Heavy slow resistance exercises v Prolotherapy injection + eccentric exercises |
7 (-8 to 22) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Continued sports activity + eccentric exercises v Prolotherapy injection + eccentric exercises |
2 (-16 to 21) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Shock-wave therapy v Prolotherapy injection + eccentric exercises |
-2 (-20 to 16) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + shockwave therapy v Prolotherapy injection + eccentric exercises |
17 (0 to 33) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Prolotherapy injection + eccentric exercises |
3 (-17 to 24) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Prolotherapy injection + eccentric exercises |
18 (3 to 33) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises as tolerated v Prolotherapy injection + eccentric exercises |
7 (-11 to 24) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Prolotherapy injection + eccentric exercises |
11 (-7 to 30) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Prolotherapy injection + eccentric exercises |
8 (-11 to 28) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Heavy slow resistance exercises v Eccentric exercises |
4 (2 to 6) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Continued sports activity + eccentric exercises v Eccentric exercises |
-1 (-12 to 11) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Shock-wave therapy v Eccentric exercises |
-5 (-15 to 5) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + shockwave therapy v Eccentric exercises |
14 (5 to 22) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Eccentric exercises |
0 (-14 to 15) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Eccentric exercises |
15 (12 to 17) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises as tolerated v Eccentric exercises |
5 (-6 to 14) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Eccentric exercises |
8 (-2 to 19) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Eccentric exercises |
5 (-8 to 18) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Continued sports activity + eccentric exercises v Heavy slow resistance exercises |
-5 (-16 to 7) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Shock-wave therapy v Heavy slow resistance exercises |
-9 (-19 to 1) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + shockwave therapy v Heavy slow resistance exercises |
10 (1 to 18) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Heavy slow resistance exercises |
-4 (-18 to 11) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Heavy slow resistance exercises |
11 (8 to 14) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Eccentric exercises as tolerated v Heavy slow resistance exercises |
0 (-10 to 10) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Heavy slow resistance exercises |
4 (-6 to 15) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Heavy slow resistance exercises |
1 (-12 to 14) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Shock-wave therapy v Continued sports activity + eccentric exercises |
-5 (-20 to 11) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + shockwave therapy v Continued sports activity + eccentric exercises |
14 (0 to 28) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Continued sports activity + eccentric exercises |
1 (-17 to 20) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Continued sports activity + eccentric exercises |
15 (4 to 27) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises as tolerated v Continued sports activity + eccentric exercises |
4 (-10 to 20) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Continued sports activity + eccentric exercises |
9 (-7 to 25) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Continued sports activity + eccentric exercises |
6 (-12 to 23) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + shockwave therapy v Shock-wave therapy |
19 |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Shock-wave therapy |
5 |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Shock-wave therapy |
20 |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises as tolerated v Shock-wave therapy |
9 |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Shock-wave therapy |
13 (-1 to 28) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Shock-wave therapy |
10 (-6 to 26) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Eccentric exercises + shockwave therapy |
-13 (-30 to 4) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Eccentric exercises + shockwave therapy |
1 (-7 to 10) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Eccentric exercises as tolerated v Eccentric exercises + shockwave therapy |
-10 (-22 to 3) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Eccentric exercises + shockwave therapy |
-5 (-19 to 8) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Eccentric exercises + shockwave therapy |
-8 (-24 to 7) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Eccentric exercises + night splint |
15 (0 to 29) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises as tolerated v Eccentric exercises + night splint |
3 (-14 to 21) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Eccentric exercises + night splint |
8 (-10 to 26) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Eccentric exercises + night splint |
5 (-15 to 24) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises as tolerated v Acupuncture |
-11 (-21 to -1) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Acupuncture |
-6 (-17 to 5) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Acupuncture |
-10 (-23 to 3) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + eccentric exercises v Eccentric exercises as tolerated |
5 (-10 to 9) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Eccentric exercises as tolerated |
1 (-15 to 17) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Mucopolysaccharides supplement + passive stretching v Mucopolysaccharides supplement + eccentric exercises |
-3 (-16 to 10) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Placebo laser + eccentric exercises (high-dose) v Placebo laser + eccentric exercises (low-dose) |
-4 (-12 to 6) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Laser therapy + eccentric exercises (low-dose) v Placebo laser + eccentric exercises (low-dose) |
11 (2 to 21) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Laser therapy + eccentric exercises (high-dose) v Placebo laser + eccentric exercises (low-dose) |
-3 (-11 to 6) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Laser therapy + eccentric exercises (low-dose) v Placebo laser + eccentric exercises (high-dose) |
15 (6 to 24) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Laser therapy + eccentric exercises (high-dose) v Placebo laser + eccentric exercises (high-dose) |
1 (-6 to 8) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Laser therapy + eccentric exercises (high-dose) v Laser therapy + eccentric exercises (low-dose) |
-14 (-23 to -5) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
VISA-A score at 6 months |
|
|
|
|
|
|
|
|
Eccentric exercises (high-dose) v Prolotherapy Injection |
-10 (-22 to 3) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Continued sports activity + eccentric exercises (high dose) v Prolotherapy Injection |
-12 (-29 to 4) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises (high dose) + prolotherapy injection v Prolotherapy Injection |
-5 (-21 to 10) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Prolotherapy Injection |
1 (-12 to 14) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Continued sports activity + eccentric exercises (high dose)v Eccentric exercises (high-dose) |
-2 (-13 to 9) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Eccentric exercises (high dose) + prolotherapy injection v Eccentric exercises (high-dose) |
4 (-11 to 20) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Eccentric exercises (high-dose) |
11 (9 to 13) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Eccentric exercises (high dose) + prolotherapy injection v Continued sports activity + eccentric exercises (high dose) |
7 (-12 to 26) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Continued sports activity + eccentric exercises (high dose) |
13 (2 to 25) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Acupuncture v Eccentric exercises (high dose) + prolotherapy injection |
7 (-9 to 22) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Autologous blood injection + eccentric exercises (high dose) v Placebo injection + eccentric exercises (high dose) |
0 (-11 to 11) |
Serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Moderate |
|
High volume injection + eccentric exercises (high dose) v Placebo injection + eccentric exercises (high dose) |
5 (-3 to 12) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
PRP injection + eccentric exercises (high dose) v Placebo injection + eccentric exercises (high dose) |
6 (0 to 13) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
High volume injection + eccentric exercises (high dose) v Autologous blood injection + eccentric exercises (high dose) |
5 (-8 to 19) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
PRP injection + eccentric exercises (high dose) v Autologous blood injection + eccentric exercises (high dose) |
6 (-6 to 19) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
PRP injection + eccentric exercises (high dose) v High volume injection + eccentric exercises (high dose) |
1 (-6 to 9) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
VISA-A score at 12 months |
|
|
|
|
|
|
|
|
Eccentric exercises (high-dose) v Prolotherapy Injection |
-5 (-18 to 9) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Continued sports activity + eccentric exercises (high dose) v Prolotherapy Injection |
-11 (-27 to 4) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Heavy slow resistance exercises v Prolotherapy Injection |
0 (-16 to 16) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises (high dose) + prolotherapy injection v Prolotherapy Injection |
2 (-10 to 13) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Prolotherapy Injection |
3 (-17 to 22) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Continued sports activity + eccentric exercises (high dose) v Eccentric exercises (high-dose) |
-6 (-13 to 1) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Heavy slow resistance exercises v Eccentric exercises (high-dose) |
5 (-4 to 14) |
Very serious |
NA |
No serious indirectness |
No serious imprecision |
NA |
Low |
|
Eccentric exercises (high dose) + prolotherapy injection v Eccentric exercises (high-dose) |
7 (-4 to 17) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Eccentric exercises (high-dose) |
7 (-6 to 20) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Heavy slow resistance exercises v Continued sports activity + eccentric exercises (high dose) |
11 (0 to 23) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises (high dose) + prolotherapy injection v Continued sports activity + eccentric exercises (high dose) |
13 (0 to 26) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Continued sports activity + eccentric exercises (high dose) |
14 (-1 to 29) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises (high dose) + prolotherapy injection v Heavy slow resistance exercises |
2 (-12 to 15) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Heavy slow resistance exercises |
2 (-14 to 18) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Eccentric exercises + night splint v Eccentric exercises (high dose) + prolotherapy injection |
1 (-16 to 17) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
|
Odds ratio's (95% credible interval) |
Risk of bias |
Inconsistency |
Indirectne ss |
Imprecision |
Publication bias |
Quality of evidence |
|
Return to sports at 6 months |
|
|
|
|
|
|
|
|
Autologous blood injection + eccentric exercises (high dose) v Placebo injection + eccentric exercises (high dose) |
0.54 (0.15 to 1.88) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
High volume injection + eccentric exercises (high dose) v Placebo injection + eccentric exercises (high dose) |
3.26 (0.96 to 12.23) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
PRP injection + eccentric exercises (high dose) v Placebo injection + eccentric exercises (high dose) |
1.68 (0.67 to 4.34) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
High volume injection + eccentric exercises (high dose) v Autologous blood injection + eccentric exercises (high dose) |
6.03 (1.02 to 37.81) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
PRP injection + eccentric exercises (high dose) v Autologous blood injection + eccentric exercises (high dose) |
3.12 (0.67 to 15.10) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
PRP injection + eccentric exercises (high dose) v High volume injection + eccentric exercises (high dose) |
0.52 (0.14 to 1.81) |
Very serious |
NA |
No serious indirectness |
Serious imprecision |
NA |
Very low |
|
Abbreviations: GRADE = Grading of Recommendations Assessment, Development, and Evaluation; NA = Not applicable; PRP = platelet-rich plasma; VISA-A = Victorian Institute of Sport Assessment-Achilles.
a Only 2 treatment comparisons were studied in multiple (i.e. 2) trials. Where this was the case, estimates and credible intervals showed substantial overlap. b Populations, treatments and outcomes measures followed those used in clinical practice, hence there was no indication of indirectness in the evidence. c Publication bias could not be assessed as there were <10 trials available for each of the comparisons. |
|||||||
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-09-2020
Beoordeeld op geldigheid : 15-10-2020
Uiterlijk in 2025 bepaalt het bestuur van de Vereniging voor Sportgeneeskunde (VSG) of deze richtlijn en de afzonderlijke modules nog actueel zijn. Indien noodzakelijk, wordt een nieuwe werkgroep geformeerd voor het herzien van de richtlijn of specifieke modules van deze richtlijn. Tijdens het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden. In een aantal gevallen zijn er aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn om een herziening te initiëren.
De VSG is regiehouder van deze richtlijn en eerstverantwoordelijke voor het beoordelen van de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Behandeling achilles tendinopathie |
VSG |
2020 |
2025 |
Eens per 5 jaar |
VSG |
Beschikbaarheid van uitkomsten consensus meeting ISTS congres 2020 (wordt verwacht eind 2020). Hoogkwalitatief onderzoek (n>50) die bijdragen aan de beantwoording van één van de submodules van de huidige uitgangsvraag. |
Algemene gegevens
Het Nederlands Huisartsen Genootschap heeft de richtlijn bestuurlijk goedgekeurd.
Deze richtlijn is ontwikkeld in samenwerking met:
-
Nederlandse Orthopaedische Vereniging
-
Nederlandse Vereniging voor Radiologie
- Nederlandse Health Professionals in de Reumatologie
- Koninklijk Nederlands Genootschap voor Fysiotherapie
- Patiëntenfederatie Nederland
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie van Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Op sommige plaatsen in deze richtlijn wordt verwezen naar de richtlijn ‘Chronische achillestendinopathie, in het bijzonder de tendinosis, bij sporters’ uit 2007. Deze richtlijn is op te vragen bij de VSG. Hoewel de huidige richtlijn als een herziening is opgezet, zijn de veranderingen in methodologie, geïdentificeerde knelpunten en wetenschappelijke kennis dusdanig groot dat deze huidige richtlijn uit 2020 als een vernieuwde richtlijn kan worden beschouwd.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn uit 2007 is een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor achilles tendinopathie. Bij deze revisie van de richtlijn is een herbeoordeling gedaan wegens voortschrijdend inzicht over deze aandoening en verandering van het zorglandschap. Dit heeft ertoe geleid dat er voor deze herziening vertegenwoordigers van andere relevante specialismen zijn uitgenodigd.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende drie jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. R.J. de Vos (voorzitter), sportarts, afdeling orthopedie en sportgeneeskunde, Erasmus MC, Universitair Medisch Centrum, Rotterdam; VSG
- Prof. dr. J. Zwerver, hoogleraar Sportgeneeskunde Universitair Medisch Centrum Groningen, sportarts Sports Valley, Ziekenhuis Gelderse Vallei, Ede; VSG
- Dr. D.E. Meuffels, orthopaedisch chirurg, afdeling orthopedie en sportgeneeskunde, Erasmus MC, Universitair Medisch Centrum, Rotterdam; NOV
- F.F. Smithuis, musculoskeletaal radioloog, afdeling radiologie & nucleaire geneeskunde, Amsterdam UMC, Amsterdam; NVvR
- R.D. van Ingen, kaderhuisarts Bewegingsapparaat, Huisartsenpraktijk Van Ingen - Breugem, Apeldoorn; NHG
- Dr. F.J. van der Giesen, physician assistant Reumatologie, afdeling Reumatologie Leids Universitair Medisch Centrum; Nederlandse Health Professionals in de Reumatologie
- E. Visser, Sportfysiotherapeut/Master Manueel therapeut, Sportgeneeskunde Rotterdam, KNGF en NVFS
Klankbordgroep
- Nederlandse Vereniging voor Reumatologie
- Nederlandse Vereniging voor Heelkunde
- Nederlandse Vereniging van Revalidatieartsen
- Nederlandse Vereniging voor Arbeids- en Bedrijfsgeneeskunde
- Nederlandse Vereniging van Podotherapeuten
- Nederlands Genootschap voor Sportmassage
- Nederlandse Vereniging voor Verzekeringsgeneeskunde
- Patiëntenfederatie Nederland
- Koninklijke Nederlandse Atletiekunie
Met medewerking van
- A.C. van der Vlist (coördinator ontwikkeling richtlijn), promovendus afdeling orthopedie en sportgeneeskunde, Erasmus MC, Universitair Medisch Centrum, Rotterdam
Met ondersteuning van
- Dr. A.C.J. Balemans, adviseur, Kennisinstituut van de Federatie Medisch Specialisten. Vanaf maart 2019
- Dr. M.A. Pols, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten. Vanaf maart 2019
- Dr. N. van Veen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten. Tot Maart 2019
- Dr. M. den Ouden - Vierwind, beleidsmedewerker VSG
Met dank aan
- Dr. M. Winters, fysiotherapeut en klinisch epidemioloog, Centre for General Practice, Aalborg University, Denemarken.
- Dr. A. Weir, sportarts, afdeling orthopedie en sportgeneeskunde, Erasmus MC Universitair Medisch Centrum, Rotterdam.
- Dr. C. Ardern, senior wetenschappelijk onderzoeker, Division of Physiotherapy, Karolinska Institute, Zweden.
- Prof. Dr. N.J. Welton, Hoogleraar Population Health Sciences, University of Bristol, Verenigd Koninkrijk.
- Dr. D.M. Caldwell, senior wetenschappelijk onderzoeker Population Health Sciences, University of Bristol, Verenigd Koninkrijk.
- W. Bramer, biomedisch informatie specialist, Erasmus MC, Universitair Medisch Centrum, Rotterdam
Belangenverklaringen
De KNMG-Code “Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd (KNAW 2016). Alle werkgroepleden hebben mondeling en schriftelijk verklaard of ze in de laatste vijf jaar directe of indirecte (financiële) belangen hebben gehad die in verband staan met het onderwerp van de richtlijn. Een overzicht van de belangen van werkgroepleden is weergegeven in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie |
|
Zwerver |
Hoogleraar sportgeneeskunde UMCG/ sportarts SportsValley |
Onderwijsactiviteiten op gebied van peesaandoeningen en Sportgeneeskunde (freelance) |
niet van toepassing |
nee |
niet van toepassing |
niet van toepassing |
Firma UTC Imaging heeft 2 maal kosten voor internationaal sportmedisch congres |
12-10-2018 |
Geen actie vereist |
|
Smithuis |
MSK radioloog AUMC locatie Meibergdreef |
Onderwijs in het AMC (onderdeel van hoofdfunctie): studenten, AIOS, |
geen |
neen |
geen |
geen |
nee |
13-11-2018 |
Geen actie vereist |
|
Meuffels |
Orthopedisch chirurg en traumatologisch chirurg Erasmus MC |
Buitengewoon staflid Rijndam Revalidatie Centrum Rotterdam; Consulent Feyenoord, Excelsior, Sparta; Consulent Scapino Ballet, Conny Jansen Danst; voorzitter werkgroep Sportorthopedie van NOV; Docent Rotterdam Hogeschool, Breederoode Hogeschool |
geen conflicts of interests |
geen conflicts of interests |
geen conflicts of interests |
geen conflicts of interests |
geen conflicts of interests |
22-11-2018 |
Geen actie vereist |
|
Visser |
Sportfysiotherapeut / manueel therapeut bij Sportgeneeskunde Rotterdam, gedetacheerd bij KNWV; Eigenaar E. Visser Sportfysiotherapie (eenmanszaak), werkzaam voor Scapino Ballet, ABN AMRO WTT, |
Multidisciplinair spreekuur EMC, onderdeel van Fit to Perform onderzoek |
geen persoonlijke financiële belangen |
geen |
geen financiële belangen van externen |
Er is in mijn opinie altijd winst op basis van intellectuele eigendom, met name door procesmatig werken met andere experts op dit gebied. Of dit leidt tot belangenverstrengeling is niet na te gaan. Een bepaalde mate van bekendheid werft men met het publiceren van een richtlijn, maar heeft voor zover ik kan inschatten geen invloed op de toekomst. |
geen andere belangen |
21-11-2018 |
Geen actie vereist |
|
van der Giesen |
Physician assistant |
Docent opleiding Handtherapie Erasmus MC Rotterdam en Docent opleiding Handtherapie, Nederlands Paramedisch Instituut |
geen |
nee |
nee |
nee |
nee |
27-11-2018 |
Geen actie vereist |
|
Van Ingen |
Huisarts, vrijgevestigd |
Lid stuurgroep Kader opleiding bewegingsapparaat, Erasmusuniversiteit (betaald) |
geen |
geen |
geen |
geen |
geen |
27-12-2018 |
Geen actie vereist |
|
De Vos |
Sportarts en wetenschappelijk onderzoeker Erasmus MC |
Clubarts SBV Excelsior |
geen persoonlijke financiële belangen |
nee |
er worden momenteel onderzoeksprojecten uitgevoerd onder mijn supervisie die worden gefinancierd door ReumaNederland, Annafonds, ZonMw, Maria Sklodowska-Curie, GE Healthcare en de National Basketball Association (NBA). Deze financiers hebben echter geen belangen bij de uitkomst van het advies of de richtlijn |
een van de persoonlijke drijfveren om deze richtlijn te herzien is dat het meer expertise zal verschaffen en daardoor zal leiden tot een betere reputatie in het wetenschappelijke veld. Een neven effect kan zijn dat het leidt tot herkenbaarheid van expertise bij verwijzende zorgverleners en zorgvragers. Dit zal echter geen invloed hebben op de uitkomst van het advies of de richtlijn. |
geen overige belangen |
13-12-2018 |
Geen actie vereist |
Inbreng patiëntenperspectief
Bij het opstellen en uitwerken van deze richtlijn is aandacht besteed aan het patiëntenperspectief door een afvaardiging van Patiëntenfederatie Nederland. Via deze organisatie is ook een online vragenlijst op nationaal niveau uitgezet met als doel om meer kennis te vergaren over het huidige zorgproces voor patiënten met achilles tendinopathie en de knelpunten die zij ervaren. Deze conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de afzonderlijke modules. Daarbij is ook de praktische uitvoerbaarheid van de aanbevelingen in ogenschouw genomen. Er is gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld (zie ook Indicatorontwikkeling onder Werkwijze).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een gedetailleerde beschrijving van de totstandkoming van een evidence-based richtlijn wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de coördinator de knelpunten. Tevens zijn er via een Invitational conference knelpunten aangedragen door de volgende verenigingen: Vereniging voor Sportgeneeskunde, Nederlandse Orthopaedische Vereniging, Nederlandse Vereniging voor Radiologie, Nederlands Huisartsen Genootschap, Nederlandse Health Professionals in de Reumatologie, Koninklijk Nederlands Genootschap voor Fysiotherapie en Nederlandse Vereniging voor Fysiotherapie in de Sportgezondheidszorg, Nederlandse Vereniging van Podotherapeuten en Patiëntenfederatie Nederland. Een verslag van de Invitational conference is opgenomen in de aanverwante producten van deze richtlijn.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de coördinator concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken en vervolgens zijn de definitieve uitgangsvragen vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn. Daarbij werden ook de resultaten van de enquête gebruikt die door Patiëntenfederatie Nederland is uitgezet. De werkgroep schatte vervolgens in welke uitkomstmaten cruciaal (kritiek voor de besluitvorming) of belangrijk (maar niet cruciaal) werden geacht. Tevens definieerde de werkgroep - waar mogelijk - voor de cruciale uitkomstmaten welke verschillen als klinisch relevant konden worden beschouwd. Dit klinisch relevante verschil kan worden vertaald als een verschil dat voor de patiënt ook als relevante verandering kan worden gemerkt. Deze klinisch relevante verschillen werden zoveel mogelijk gebaseerd op bestaande wetenschappelijke literatuur.
Strategie voor zoeken en selecteren van literatuur
De zoekstrategie werd op verschillende manieren uitgezet. Er werd oriënterend gezocht naar bestaande binnenlandse en buitenlandse richtlijnen en systematische reviews. Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van een specifieke zoekopdracht gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. Deze zoekstrategie werd opgesteld in samenwerking met een biomedisch informatiespecialist. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn in iedere afzonderlijke (sub)module terug te vinden.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden op een systematische wijze beoordeeld. Dit werd gedaan op basis van opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten te kunnen inschatten (risk of bias beoordeling). Deze beoordelingen zijn per afzonderlijke (sub)module zichtbaar in de Risk of bias (ROB) tabellen.
Samenvatten van de literatuur
De relevante gegevens van alle geselecteerde artikelen in de afzonderlijke modules zijn overzichtelijk weergegeven in de zogenoemde evidencetabellen. De belangrijkste wetenschappelijke bevindingen zijn beschreven in de samenvatting van de literatuur. Indien het aantal studies voldoende was en er aanvaardbare overeenkomstigheid was tussen de studies (homogeniteit) werden de gegevens ook kwantitatief samengevat (meta-analyse). Daarnaast werd een poging gedaan om afzonderlijke behandelingen in een netwerk met elkaar te kunnen vergelijken (netwerk meta-analyse).
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE is een afkorting voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties refereren naar de mate van zekerheid die er bestaat over de conclusie op basis van de wetenschappelijke literatuur (Schünemann, 2013). Er zijn verschillende GRADE-classificatie systemen gebruikt, omdat vraagstellingen gericht op prognose anders zijn dan vraagstellingen gericht op effectiviteit van behandeling. Daarnaast is een aparte GRADE-classificatie gebruikt bij het toepassen van een netwerk meta-analyse.(Guyatt, 2008)
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het graderen van de kracht van het wetenschappelijk bewijs volgens de GRADE-methodiek is het van belang om grenzen van klinische relevantie te bepalen, die de uiteindelijke besluitvorming beïnvloeden (Hultcrantz, 2017). Overschrijding van deze grenzen kunnen een sterkere aanleiding geven tot het wijzigen van de aanbeveling. De grenzen voor klinische besluitvorming zijn gebaseerd op het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Echter, de klinische besluitvorming moet altijd in het klinische perspectief worden beoordeeld. Bij bijvoorbeeld de beoordeling van een eenvoudige en goedkope interventie die geen belangrijke nadelen heeft, kan worden geaccepteerd dat de effectiviteit van de betreffende interventie onder de drempel van de MCID ligt (Hultcrantz, 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat is het wetenschappelijk bewijs samengevat in een of meerdere conclusies. Bij de formulering van deze conclusies is de gradering van het bewijs geïncorporeerd.
Overwegingen (van bewijs naar aanbeveling)
De overwegingen vormen de brug van het wetenschappelijke bewijs naar de uiteindelijke aanbeveling. In dit proces worden, naast (de kwaliteit van) het wetenschappelijke bewijs, ook andere belangrijke aspecten meegewogen. Een aantal belangrijke onderwerpen die in deze weging zijn meegenomen zijn: de waarden en voorkeuren van de patiënt, de expertise van de werkgroepleden, veiligheid, beschikbaarheid en zorgkosten. Deze aspecten zijn per module vermeld en beoordeeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op een combinatie van het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat de werkgroep toekent aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Dit leidt ertoe dat de kracht van het wetenschappelijke bewijs alleen niet doorslaggevend is voor de sterkte en richting van de aanbeveling die gedaan wordt. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle gezamenlijke relevante argumenten.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is rekening gehouden met de organisatie van zorg. Aspecten die een randvoorwaarde zijn voor zorgverlening zijn onder andere: coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur. Deze randvoorwaarden zijn, waar van toepassing, onderdeel van de overwegingen in een module.
Indicatorontwikkeling
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld. Potentiele indicatoren voor deze richtlijn zouden kunnen zijn: Welk percentage patiënten krijgt terecht beeldvorming? Welk percentage patiënten wordt door de huisarts terecht naar een medisch specialist verwezen? Welk percentage patiënten ondergaat een operatieve ingreep en op welke termijn na het starten van adequate conservatieve therapie wordt dit besluit genomen? De werkgroep was van mening dat het meten van dit soort relevante indicatoren op praktische problemen zal stuiten. In alle gevallen zou moeten worden bepaald of er sprake is van een terechte of onterechte medische besluitvorming. Daarvoor is toepassing van strikte criteria en een adequate verslaglegging in EPD of patiëntendossier noodzakelijk. Een standaardisering van de verslaglegging kan in de toekomst mogelijk wel aanknopingspunten bieden voor het ontwikkelen van indicatoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is getracht om al het beschikbare wetenschappelijke bewijs te verzamelen dat een adequaat antwoord kan geven op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er belangrijke hiaten zijn in de wetenschappelijke kennis. Dit kan richting geven aan toekomstig wetenschappelijk onderzoek binnen dit werkveld. Een overzicht van deze kennislacunes staat in de Kennislacunes weergegeven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en Patiëntenfederatie Nederland voorgelegd voor commentaar. Daarnaast werden de volgende verenigingen en organisaties benaderd voor commentaar: Bijwerkingencentrum Lareb, Zorginstituut Nederland, Zelfstandige Klinieken Nederland, de Nederlandse Federatie van Universitair Medische Centra, de Nederlandse Vereniging van Ziekenhuizen, de Samenwerkende Topklinische opleidingsZiekenhuizen, Zorgverzekeraars Nederland, Inspectie Gezondheidszorg en Jeugd, de Nederlandse Zorgautoriteit, Beroepsvereniging Verzorgenden Verpleegkundigen, Nederlandse Associatie Physician Assistants en Runners world. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G.,... Consortium, A. N. S. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Cmaj, 182(18), E839-842.
Hultcrantz, M., Rind, D., Akl, E. A., Treweek, S., Mustafa, R. A., Iorio, A.,... Guyatt, G. (2017). The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol, 87, 4-13.
Zoekverantwoording
Submodule 2, 3 en 4: ‘Behandelopties en factoren die effectiviteit behandeling beïnvloeden’
|
|
Initial search |
After deduplication |
|
Embase.com |
969 |
944 |
|
Medline Ovid |
1131 |
627 |
|
Web of science |
1375 |
785 |
|
Cochrane CENTRAL |
453 |
90 |
|
CINAHL EBSCOhost |
533 |
141 |
|
SportDiscuss EBSCOhost |
493 |
72 |
|
Google scholar |
200 |
120 |
|
Total |
5154 |
2779 |
|
Database |
Search terms |
|
Embase.com |
('achilles tendinitis'/exp OR ((tendinitis/de OR pathology/de) AND 'achilles tendon'/de) OR (((achilles OR calcaneal) AND (tendinitis* OR tendinopath* OR tendinosis* OR tendonitis* OR tendon-patholog* OR pain* OR injur*)) OR achillodyn*):ab,ti) AND ('crossover procedure':de OR 'double-blind procedure':de OR 'randomized controlled trial':de OR 'single-blind procedure':de OR (random* OR factorial* OR crossover* OR cross NEXT/1 over* OR placebo* OR doubl* NEAR/1 blind* OR singl* NEAR/1 blind* OR assign* OR allocat* OR volunteer*):de,ab,ti) |
|
Medline Ovid |
(((Tendinopathy/ OR Pathology/) AND "achilles tendon"/) OR "achilles tendon"/pa OR (((achilles OR calcaneal) AND (tendinitis* OR tendinopath* OR tendinosis* OR tendonitis* OR tendon-patholog* OR pain* OR injur*)) OR achillodyn*).ab,ti.) AND (Exp Controlled clinical trial/ OR "Double-Blind Method"/ OR "Single-Blind Method"/ OR "Random Allocation"/ OR (random* OR factorial* OR crossover* OR cross over* OR placebo* OR ((doubl* OR singl*) ADJ blind*) OR assign* OR allocat* OR volunteer* OR trial OR groups).ab,ti.) NOT (Animals/ NOT Humans/) |
|
Web of science |
TS=(((((achilles OR calcaneal) AND (tendinitis* OR tendinopath* OR tendinosis* OR tendonitis* OR tendon-patholog* OR pain* OR injur*)) OR achillodyn*))) AND TS=(random* OR trial* OR rct) |
|
Cochrane CENTRAL |
((((achilles OR calcaneal) AND (tendinitis* OR tendinopath* OR tendinosis* OR tendonitis* OR tendon-patholog* OR pain* OR injur*)) OR achillodyn*):ab,ti) |
|
CINAHL EBSCOhost |
(((MH Tendinopathy OR MH Pathology) AND MH "achilles tendon") OR TI (((achilles OR calcaneal) AND (tendinitis* OR tendinopath* OR tendinosis* OR tendonitis* OR tendon-patholog* OR pain* OR injur*)) OR achillodyn*) OR AB (((achilles OR calcaneal) AND (tendinitis* OR tendinopath* OR tendinosis* OR tendonitis* OR tendon-patholog* OR pain* OR injur*)) OR achillodyn*)) AND (MH Clinical trials OR MH Randomized Controlled Trials OR MH Double-Blind Studies OR MH Single-Blind Studies OR MH Triple-Blind Studies OR MH Random Assignment OR TI (random* OR factorial* OR crossover* OR cross over* OR placebo* OR ((doubl* OR singl*) N1 blind*) OR assign* OR allocat* OR volunteer* OR trial OR groups) OR AB (random* OR factorial* OR crossover* OR cross over* OR placebo* OR ((doubl* OR singl*) N1 blind*) OR assign* OR allocat* OR volunteer* OR trial OR groups)) NOT (MH Animals+ NOT MH Humans+) |
|
SportDiscuss EBSCOhost |
(((MH TENDINITIS OR MH TENDINOSIS OR MH Pathology) AND MH "achilles tendon") OR TI (((achilles OR calcaneal) AND (tendinitis* OR tendinopath* OR tendinosis* OR tendonitis* OR tendon-patholog* OR pain* OR injur*)) OR achillodyn*) OR AB (((achilles OR calcaneal) AND (tendinitis* OR tendinopath* OR tendinosis* OR tendonitis* OR tendon-patholog* OR pain* OR injur*)) OR achillodyn*)) AND (TI (random* OR factorial* OR crossover* OR cross over* OR placebo* OR ((doubl* OR singl*) N1 blind*) OR assign* OR allocat* OR volunteer* OR trial OR groups) OR AB (random* OR factorial* OR crossover* OR cross over* OR placebo* OR ((doubl* OR singl*) N1 blind*) OR assign* OR allocat* OR volunteer* OR trial OR groups)) |
|
Google scholar |
"achilles|calcaneal tendinitis|tendinopathy|tendinosis|tendonitis" intitle:trial|randomized|randomised|rct |
