Interdisciplinaire revalidatie
Uitgangsvraag
Wat is de waarde van een interdisciplinaire behandeling bij de zorg voor patiënten met aanhoudende klachten na licht THL?
Aanbeveling
Overweeg bij de subgroep van patiënten met interacterende klachten inzet van interdisciplinaire revalidatiebehandeling, rekening houdend met de hulpvraag van patiënt.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het doel van de uitgangsvraag is het beoordelen van de meerwaarde van interdisciplinaire revalidatie ten opzichte van standaard zorg. Vikane (2017) beschrijft een multidisciplinaire interventie met inzet van een psycho-educatiegroep in combinatie met contacten met maatschappelijk werk, ergotherapie, verpleegkundige en eventueel revalidatiearts en neuropsycholoog. Een schema werd opgesteld gericht op terugkeer naar werk. Inhoud van de contacten zijn niet beschreven. Zo is het niet duidelijk of er met name gesprekken plaatsvonden, of dat bijvoorbeeld angst- of stemmingsbehandeling plaatsvond. Er werden geen verschillen gevonden in klachtafname 12 maanden na letsel tussen de interventiegroep en de groep die alleen psycho-educatie en eventueel een doorverwijzing ontving. Wel was er een verschil in absolute scores ten gunste van de interventiegroep. Dat wil zeggen: na 12 maanden rapporteerden patiënten uit de interventiegroep minder klachten. Er was een trend zichtbaar in terugkeer naar werk na 12 maanden ten gunste van de controlegroep. Mogelijk dat wet- en regelgeving van het betreffende land rondom ziekte en terugkeer naar werk een rol heeft gespeeld. Patiënten behielden namelijk het recht op uitkering zolang een behandeling gaande was. Daarnaast kan de duur en intensiteit van de behandeling gelijktijdige re-integratie in te weg hebben gestaan.
Thastum (2019) beschrijft een interventiegroep die psycho-educatie in combinatie met een interdisciplinair traject doorliep, gericht op het veranderen van de ziekteperceptie in combinatie met graduele opbouw van activiteiten. De controlegroep ontving psycho-educatie. Beide groepen laten vermindering van klachten zien, waarbij de interventiegroep significant en klinisch relevante vermindering van klachten laat zien ten opzichte van de controlegroep. Met name somatische en emotionele klachten verbeterden.
Rytter (2019) vergelijkt standaard zorg met een interventiegroep die behandeling ontving bestaande uit psycho-educatie, psychologische behandeling met componenten van cognitieve gedragstherapie met daarnaast fysieke opbouw middels graded activity en verder opbouw van activiteiten met betrekking tot werk. Cognitieve gedragstherapie was gericht op verbetering van coping, omgang met stress, angst- en depressie, plus compensatie strategieën ten behoeve van omgang met mentale vermoeidheid. Exposure, traumatherapie en vestibulaire revalidatie waren geen onderdeel van de interventie. Standaardzorg is vergelijkbaar met zorg in Nederland en bestond uit inzet van therapie op verwijzing van de huisarts. Beide groepen lieten verbetering zien. Het verschil in verbetering van klachten direct na de interventie was significant ten gunste van de interventiegroep. Patiënten uit de controlegroep maakten gebruik van zorg uiteenlopend van consultatie van medisch specialisten, ergotherapie fysiotherapie en psychologie tot ontspanningstherapie, massage en Tai Chi. Het verschil in verbetering tussen de twee groepen was 6 maanden na de interventie verder toegenomen. 6 maanden na de behandeling was er in de interventiegroep meer tevredenheid met de werkstatus en vrijetijdsbesteding. De spreiding in scores is in beide groepen echter groot.
Samenvattend is er, gekeken naar de conclusies met betrekking tot de cruciale uitkomstmaat symptoms and complaints, sprake van een klinisch relevant effect van interdisciplinaire revalidatie na een follow-up van 3-12 maanden ten opzichte van standaard zorg bij patiënten met aanhoudende klachten na licht THL. De bewijskracht voor dit gevonden effect was zeer laag vanwege beperkingen in de studieopzet (blindering) en brede betrouwbaarheidsintervallen (imprecisie). Direct na de interventie was het gevonden effect niet klinisch relevant, maar de bewijskracht van deze bevinding was zeer laag. Dit maakt de overall bewijskracht van de literatuurconclusies zeer laag. Voor de belangrijke uitkomstmaten anxiety, mood, fatigue en quality of life werden geen klinisch relevant verschillen gevonden tussen de interventie en de controleconditie. Echter waren er in de studies bij aanvang al lage angst- en stemmingscores te meten. De bewijskracht van de belangrijke uitkomstmaten was ook laag tot zeer laag vanwege beperkingen in de studieopzet (blindering) en brede betrouwbaarheidsintervallen (imprecisie).
Hiermee geven de uitkomsten van de literatuursearch voor zowel de cruciale als de belangrijke uitkomstmaten geen richting aan de besluitvorming. Toch passen de bevindingen van met name klachtafname op lange termijn na interdisciplinaire behandeling bij ervaring uit de praktijk. Psycho-educatie gericht op geruststelling vanwege het te verwachten positieve beloop, in combinatie met adviezen om activiteiten geleidelijk op te bouwen en “alles of niets” gedrag te vermijden heeft bij een deel van de patiënten al een positief effect op de klachten. Behandeling gericht op veranderen van ziektepercepties en cognities ten aanzien van de klachten gecombineerd met opbouw van sociale, cognitieve en fysieke activiteiten heeft een meerwaarde en zodra patiënten deze methode eigen hebben gemaakt kunnen zij dit zelfstandig voortzetten met nog maandenlange verbetering van functioneren.
Er was een grote spreiding te zien in het effect van de interdisciplinaire revalidatie op Klachten. Zoals beschreven in de module Symptoomclusters en diagnostiek kunnen patiënten zich presenteren met symptomen die binnen verschillende symptoomclusters vallen. In de studies is vestibulo-oculaire behandeling geen onderdeel van het interdisciplinaire traject. De verwachting is dat juist patiënten met deze klachten meer profiteren van een traject waarbij vestibulo-oculaire training onderdeel van de behandeling is (zie module Vestibulaire therapie en visuele training). Bij een studie naar het effect van multidisciplinaire revalidatie bij militairen waarbij PTSS-behandeling en vestibulaire revalidatie onderdeel waren werd een positief effect gevonden op klachten (Janak, 2017).
Er werd geen effect gevonden op uitkomstmaten die angst en depressie meten. In de studies worden specifieke angst- en stemmingsinterventies niet beschreven. Inzet van specifieke interventies dit kan mogelijk het effect op angst en stemming vergroten (zie module Psychotherapie).
De voorzichtig positieve resultaten van de studies op klachtenniveau in combinatie met praktijkervaring maakt dat interdisciplinaire revalidatie voor een deel van de patiënten meerwaarde kan hebben. De patiëntengroep is heterogeen en een groot deel van de patiënten zal voldoende baat hebben bij psycho-educatie of monodisciplinaire interventies. De praktijk laat echter zien dat dit niet voor iedereen voldoende is. Maatwerk blijft van belang. Rosenblatt (2021) analyseerde met behulp van artificial intelligence klinische uitkomstmaten van patiënten in een “concussion clinic” in Canada. Uitkomstmaten waren onder andere PROMIS, DHI, een pijnschaal en een uitkomstmaat voor directe gevolgen van het letsel inclusief een cognitieve testmaat. De clustermethode identificeerde 5 onafhankelijke clusters welke te onderscheiden waren op basis van complexiteit (minimaal, mild, gemiddeld, hoog en extreem). De clusters hoog en extreem kenmerken zich door hoge scores op angst en cognitieve functies op de PROMIS en afwijkende scores op de DHI. Mogelijk is er voor deze patiëntengroep met interacterende problematiek meerwaarde voor interdiscipinaire behandeling. Nguyen (2022) heeft een studieprotocol gepubliceerd voor een gerandomiseerde case series met multiple baseline design. Totdat deze studie uitgevoerd zal zijn bestaat er nog geen onderzoek naar interdisciplinaire revalidatie waarbij rekening wordt gehouden met symptoomclusters en patiëntfactoren in bij het evalueren van het effect. Dit is een kennislacune.
Er werden geen bijwerkingen benoemd in de gevonden literatuur. In de praktijk komen ernstige bijwerkingen/complicaties bij interdisciplinaire behandeling nauwelijks voor. Patiënten benoemen soms een (tijdelijke) toename van hun klachten, zoals van prikkelgevoeligheid, bij aanvang van de behandeling door meer blootstelling aan prikkels en uitbreiden van activiteiten. Deze klachten nemen gewoonlijk gedurende behandeling af, wanneer de belastbaarheid van de patiënt toeneemt. Het is belangrijk om hier psycho-educatie over te geven, waarbij wordt aangegeven dat tijdelijke toename van klachten normaal is en dat herstelmomenten van belang zijn.
Inhoudelijk kan behandeling bestaan uit fysiotherapie, ergotherapie, psychologische begeleiding of een combinatie hiervan. Psycho-educatie heeft bij al deze behandelingen een belangrijke plaats (zie module Psycho-educatie). Als deze behandeling onvoldoende effect heeft of wanneer de inschatting is dat dit onvoldoende effect zal hebben, wordt de stap gemaakt naar interdisciplinaire behandeling. Hierbij is van belang dat de revalidatiebehandeling past bij de belastbaarheid van patiënt, om de succeskans te verhogen. Bij overbelastingsklachten kan worden gekozen voor een periode van herstel van de energiebalans alvorens te starten met opbouw.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Bij behandeling van aanhoudende klachten na licht THL is de wens van de patiënt van groot belang. Het volgen van een interdisciplinaire behandeling is een intensief traject waarbij de patiënt in de meeste gevallen meerdere momenten per week therapie heeft, gericht op het faciliteren van herstel en verhoging van het activiteitenniveau. De praktijk leert dat het van groot belang is voor het daadwerkelijk behalen van de revalidatiedoelen, dat de patiënt bereid is dit intensieve traject te volgen. De doelen van de behandeling zijn individueel bepaald, maar in het algemeen zijn deze gericht op het verminderen van klachten en het verbeteren van het functioneren. Doelen worden opgesteld door de patiënt in samenspraak met de therapeut. Door zelf doelen op te stellen is de patiënt eigenaar van zijn/haar revalidatiebehandeling. Dit draagt bij aan een positieve uitkomst. Een ander belangrijke overweging is, zoals hierboven ook beschreven, de belastbaarheid van de patiënt. De behandeling kan intensief zijn en zal alleen succesvol zijn als de patiënt zich voldoende kan inzetten en voldoende therapietrouw is.
Kosten (middelenbeslag)
Interdisciplinaire revalidatie behandeling is een dure behandeling. Naar de impact van deze behandeling op besparing van maatschappelijke kosten door bijvoorbeeld het verminderen van zorgconsumptie en terugkeer naar werk is onvoldoende wetenschappelijk onderzoek verricht. In de praktijk wordt gezien dat patiënten baat kunnen hebben bij interdisciplinaire revalidatie behandeling. Revalidatiedoelen worden gesteld op het niveau van activiteiten en participatie, bijvoorbeeld terugkeer naar werk. Dit heeft grote waarde voor de maatschappij (zie module Terugkeer naar werk). Mogelijk leidt daarnaast inzet van interdisciplinaire behandeling tot minder aanvullende zorgconsumptie door de geïntegreerde aanpak van problematiek. Vikane (2017) zag in zijn studie deze trend van verminderde zorgconsumptie in de interventiegroep. Rytter (2018) zag dat er in een subgroep van de controlepopulatie opvallend veel zorg werd ingeschakeld in een aantal maanden tijd, waarbij niet alleen medisch specialisten werden geconsulteerd, maar ook het alternatieve circuit werd ingezet. Onderzoek naar de kosten van verhoogde zorgconsumptie en verminderde arbeidsparticipatie zou inzicht kunnen geven in de daadwerkelijke kosten en opbrengst van een interdisciplinaire revalidatiebehandeling. Tegelijkertijd is gezien de kosten van het traject, gerichte inzet voor een beperkte patientengroep gerechtvaardigd. Zie hiervoor ook de module Organisatie van zorg over passende zorg.
Aanvaardbaarheid, haalbaarheid en implementatie
De interdisciplinaire revalidatiebehandeling wordt momenteel op diverse plekken in Nederland aangeboden. De zorg is echter nog niet ingericht op het effectief verwijzen van patiënten voor (interdisciplinaire) revalidatiebehandeling, waardoor een deel van de patiënten soms jarenlang op zoek is naar de juiste zorg. Verwijscriteria zijn ook helpend voor het deel van de patiënten dat profiteert van alleen psycho-educatie of monodisciplinaire behandeling (zie module Organisatie van zorg). Vanwege het ontbreken van een behandelrichtlijn in het verleden bestaat er momenteel nog grote variatie in de door zorgprofessionals aangeboden behandeling. Afspraken binnen de beroepsgroepen over verwijsstromen en de inhoud van het interdisciplinair traject is gewenst. Gezien het belang van ziekte-percepties en de meerwaarde van psycho-educatie dient de boodschap die aan patiënt gebracht wordt over de hele zorgketen heen congruent te zijn. Hiertoe is het essentieel om samen te werken met huisartsen en 1e lijns therapeuten en om richtlijnen en behandelkaders op elkaar af te stemmen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Interdisciplinaire/multidisciplinaire behandeling in de geselecteerde studies bleek effectief in vermindering van klachten, welke voortzette op lange termijn. Echter er is een lage bewijskracht voor de effectiviteit van deze behandelingen op klachten en andere uitkomstmaten. De lage bewijskracht wordt veroorzaakt door het gebrek aan goed opgezette studies. Een klein aantal studies, grote spreiding van uitkomsten bij een heterogene patientengroep alsook gebrek aan blindering spelen hierbij een rol. Hiermee geven de uitkomsten van de literatuursearch alleen geen richting aan de besluitvorming. De werkgroep is van mening dat gerichte interdisciplinaire behandeling (aangeboden binnen de medisch specialistische revalidatiezorg) voor een subgroep van patiënten van meerwaarde kan zijn boven monodisciplinaire of multidisciplinaire behandeling. Met name wanneer er sprake is van interactie tussen verschillendefactoren is inzet van interdisciplinaire behandeling te overwegen. Er zijn aanwijzingen voor minder zorgconsumptie bij patiёnten die een interdisciplinair revalidatietraject volgen. Het advies is om bij de keuze voor 1e of 2e lijns zorg rekening te houden met symptoomclusters, beїnvloedende en persoonlijke factoren. Meer onderzoek is nodig om te bepalen voor welke subgroepen interdisciplinaire behandeling van meerwaarde is ten opzichte van monodisciplinaire of multidisciplinaire behandeling en of toevoeging van traumabehandeling en vestibulaire training aan het behandelprogramma tot verbetering van uitkomsten zal leiden.
Onderbouwing
Achtergrond
Bij een multidisciplinaire samenwerking is er een gezamenlijk probleem, onderwerp of thema dat vanuit de verschillende disciplines wordt bekeken en vertaald. Elke discipline blijft vanuit zijn eigen vak en expertise denken en werken. De resultaten daarvan worden na afronding van de diagnostiek samengevoegd. Bij een interdisciplinaire samenwerking hebben de disciplines elkaar nodig om een probleem op te lossen. De wederzijdse beïnvloeding bepaalt de inhoud. De inzichten die hierdoor ontstaan overstijgen de grenzen van het eigen vak (Huiber 2010). In het vervolg zal de term interdisciplinaire revalidatiebehandeling worden gebruikt volgens de definitie van Gatchel (zie Search and Select, pagina 2).
In Nederland wordt interdisciplinaire revalidatie aangeboden binnen de medisch specialistische revalidatie, waarvan de specialistische GGZ geen standaard onderdeel is. Therapeuten zijn getraind om vakoverstijgend te denken en te behandelen. De aansturing van het interdisciplinaire team binnen de medisch specialistische revalidatie gebeurt door de revalidatiearts. Dit is een arts met een specialistenopleiding op het gebied van neurologische problematiek en problematiek van het bewegingssysteem, evenals de behandeling van lange termijn gevolgen hiervan. Tevens is de revalidatiearts getraind in aansturing en kwaliteitsontwikkeling van interdisciplinaire teams en transmuraal werken binnen een zorgnetwerk. Revalidatieartsen zijn in staat om een analyse te maken van de interatie tussen fysieke en cognitieve klachten, persoonlijkheidsfactoren en psychosociale stressoren. Patiënten met aanhoudende klachten na een licht THL komen binnen de medisch specialistische revalidatie terecht omdat de participatieproblemen die zij ervaren zeer groot kunnen zijn en een deel van de patiënten onvoldoende geholpen wordt middels monodisciplinaire of multidisciplinaire behandeling. Deze uitgangsvraag gaat in op de meerwaarde van interdisciplinaire revalidatie omdat – in tegenstelling tot monodisciplinaire behandeling en multidisciplinaire behandeling- onderlinge effecten van verschillende therapieën relevant lijken bij aanhoudende klachten na licht THL. Dit omdat deze klachten onderling kunnen interacteren en de benaderingswijze binnen de ene therapie effect kan hebben op klachten die worden behandeld binnen een andere therapie.
In de huidige literatuur wordt, hoewel nog beperkt, met name het effect van monodisciplinaire revalidatiebehandeling beschreven (psychologische, fysiotherapeutische, vestibulaire interventies). Echter is het aanbieden van monodisciplinaire behandeling mogelijk beperkt effectief aangezien er meerdere factoren een rol spelen in het ontstaan en instandhouden van aanhoudende klachten na licht THL.
De effectiviteit aantonen van (een maatwerk) interdisciplinaire behandeling is lastig. Echter, er is wel enige evidence voor de effectiviteit van multidisciplinaire behandelingen bij bijvoorbeeld adolescenten (Bailey 2019; McCarty, 2016). Meer inzicht in de effectiviteit van interdisciplinaire behandeling bij volwassenen kan ondersteunend zijn aan de keuze voor behandeling volgens het principe van passende zorg (zie module Organisatie van zorg).
Conclusies / Summary of Findings
- Symptoms and complains (crucial)
End of treatment
|
Very low GRADE |
The evidence is very uncertain about the effect of interdisciplinary rehabilitation on symptoms and complains at the end of treatment compared to usual care in patients with remaining complains after mild traumatic brain injury.
Source: Rytter, 2019; Thastum, 2019 |
3-9 months of follow-up
|
Low GRADE |
Interdisciplinary rehabilitation may improve symptoms and complaints in patients with remaining complains after 3-9 months of follow-up after mild traumatic brain injury when compared with usual care.
Source: Rytter, 2019; Thastum, 2019; Vikane, 2017 |
- Anxiety (important)
12 months of follow-up
|
Very low GRADE |
The evidence is very uncertain about the effect of interdisciplinary rehabilitation on anxiety at 12 months follow-up compared to usual care in patients with remaining complains after mild traumatic brain injury.
Source: Vikane, 2017 |
- Mood (important)
3-9 months of follow-up
|
Low GRADE |
Interdisciplinary rehabilitation may result in little to no difference in mood in patients with remaining complains after 12 months of follow-up after mild traumatic brain injury when compared with usual care.
Source: Rytter, 2019; Vikane, 2017 |
- Fatigue (important)
End of treatment and 6 months follow-up
|
Low GRADE |
Interdisciplinary rehabilitation may result in little to no difference in fatigue at the end of treatment and after 6 months follow-up in patients with remaining complains after mild traumatic brain injury when compared with usual care. Source: Rytter, 2019 |
- Participation (important)
6 months of follow-up
|
Very low GRADE |
The evidence is very uncertain about the effect of interdisciplinary rehabilitation on participation at six months follow-up compared to usual care in patients with remaining complains after mild traumatic brain injury.
Source: Vikane, 2017 |
- Quality of life (important)
3-9 months of follow-up
|
Low GRADE |
Interdisciplinary rehabilitation may result in little to no difference in quality of life in patients with remaining complains after 3-9 months of follow-up after mild traumatic brain injury when compared with usual care.
Source: Rytter, 2019; Thastum, 2019 |
Samenvatting literatuur
Description of studies
Rytter (2021) assessed the evidence for outcomes related to nonpharmacological interventions for persistent (>4 weeks) postconcussion symptoms in a systematic review. A literature search was performed in seven databases (Embase, MEDLINE, PsychINFO, CINAHL, PEDro, OT seeker and Cochrane Reviews) from inception up to March 3, 2020. Seven nonpharmacological interventions were evaluated, including early information and advice, graded physical exercise, vestibular rehabilitation, manual treatment of the neck and back, oculomotor vision treatment, psychological treatment and interdisciplinary coordinated rehabilitative treatment. Studies were included if 1) a control group was included; 2) focus was on symptoms after concussion or mTBI; 3) studies including moderate-severe TBI when data was separately analyzed; 4) participated were aged >18 years and diagnosed with concussion or mTBI or adolescent participants only represented a minority of the sample. In total, the review of Rytter (2021) included 19 individual RCTs. The review’s authors assessed the quality of the included studies by using the Cochrane risk of bias tool for RCTs and the Appraisal of Guidelines for Research and Evaluated or Assessment of Multiple Systematic Reviews for systematic reviews (from which RCTs were extracted).
To answer the PICO of this module, only three RCTs were eligible, regarding interdisciplinary coordinated rehabilitative treatment (Rytter, 2019; Thastum, 2019 and Vikane, 2017). 16 RCTs described other types of interventions. Outcome measures that were assessed were symptoms and complains (Rivermead Post-concussion Questionnaire) at the end of treatment and after 3-9 months follow-up, anxiety (HADS), participation (Satisfaction with current working conditions and leisure life and return to work) and quality of life (SF-36 Healicht THL survey). It is important to note that, due to lack of studies, the selected RCTs did not strictly meet the selection criteria concerning the chronic phase after mTBI. Characteristics of the included studies ware shown in Table 1.
Table 1. Overview of the RCTs from the review by Rytter (2021)
|
Study |
Population (description, (size)) |
Intervention and duration (n) |
Controls (n) |
Outcomes |
Follow-up |
|
Rytter, 2019 |
Specialized post-acute outpatient hospital patients with documented concussion, persistent PCS for >6 months postinjury (89) |
A comprehensive interdisciplinary rehabilitation emphasizing the integration of the different therapeutic interventions within the context of a therapeutic environment, for 22 weeks (45) |
Usual treatment offered by the public municipality services assuming symptoms recover spontaneously. When symptoms persisted, the municipality offered individual treatment sessions (or series) performed by a relevant therapist. (44) |
Symptoms and complaints (RPQ) Quality of life (SF-36) Mood (MDI) Fatigue (MFI-20) |
End of treatment and 6 months follow-up |
|
Thastum, 2019 |
Concussion patients within 2-6 months according to the World Healicht THL Organization’s diagnostic criteria, high levels of PCS defined as ≥20 points on the RPQ (112) |
Interdisciplinary intervention program based on cognitive behavioral therapy and gradual return to activities, including group and individual sessions, for eight weeks (57) |
Enhanced usual care including reassurance and individual psychoeducation on Enhanced usual care including reassurance and individual psychoeducation on good prognosis and gradual resumption of premorbid activities (55) |
Symptoms and complaints (RPQ) Quality of life (QOLIBRI-OS) |
End of treatment and 3 months follow-up |
|
Vikane, 2017 |
Adults patients admitted to the Department of Neurosurgery for TBI with sustained symptoms at six to eight weeks post-mTBI (151) |
Multidisciplinary outpatient follow-up programme consisting of individual contacts with different therapists (social worker/occupational therapist/nurse/medical doctor/neuropsychologist) and a psycho-educational group intervention, once a week for four weeks (81). Patients received return to work schedule (81). |
Follow-up by a GP after the multidisciplinary examination and was offered their typical, regular treatment, which so far is not standardised(70) |
Symptoms and complaints (RPQ) Anxiety (HADS) Participation (return to work) Mood (HADS-D) |
12 months |
Abbreviations (alphabetical): PCS: post-concussion symptoms, SF-36: Short form – 36, MDI: Major Depression Inventory, HADS: Hospital Anxiety and Depression Scale, QOLIBRI-OS: Quality of Life after Brain Injury – Overall Scale.
Results
- Symptoms and complains (crucial)
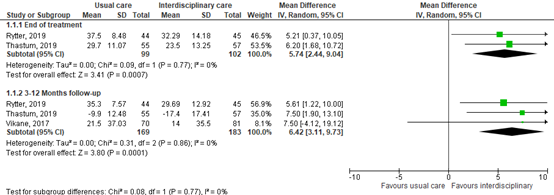
All included RCTs reported on the severity of symptoms and complaints, assessed by the Rivermead Post-concussion Symptoms Questionnaire (RPQ) (n=352). This is a 16-item measure of the severity and impact of post-concussion symptoms. Each item can be scored from 0 to 4, resulting in a maximum score of 64. A higher score represents a higher symptom burden. At the end of treatment, pooled mean difference was 5.74 (95% CI 2.44 to 9.04) in favor in interdisciplinary rehabilitation. After 3-9 months follow-up pooled mean difference was 6.42 in favor of interdisciplinary rehabilitation. Only after 3-12 months of follow-up this difference was clinically relevant in favor of the intervention group receiving interdisciplinary rehabilitation. Results are show in a forest plot (Figure 1).
Figure 1. Forest plot and pooled mean difference in RPQ score at the end of treatment or after 3-12 months of follow-up.
- Anxiety (important)
One RCT reported on the effect of interdisciplinary rehabilitation on anxiety through the Hospital Anxiety and Depression Scale (HADS-A) (Vikane, 2017; n=151), scoring a total from 0 to 21 over seven questions. A lower score denotes lower anxiety levels. No difference in HADS-A score was found, with a score of 6 both in the intervention group (range 0 to 18) and the control group (range 0 to 16) after 12 months.
- Mood (important)
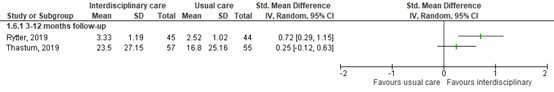
Two RCTs reported on the effect of interdisciplinary rehabilitation on mood after 3-9 months of follow-up (n=213). Rytter (2019) assessed mood through the major depression inventory (MDI) (Rytter, 2019), scoring a total from 0 to 50 over ten questions. A lower score denotes a better mood (lower depression). The intervention group scored a mean of 13.07 (SD 9.27), compared to a mean score of 18.52 (SD 10.29) in the control group after six months.
Vikane (2017) assessed mood through the Hospital Anxiety and Depression Scale (HADS-D), scoring a total from 0 to 21 over seven questions. A lower score denotes lower depression levels. The intervention group scored a mean of 3.0 (SD 0.16), compared to a mean score of 3.5 (SD 0.14) in the control group after 12 months.
Both differences were not considered clinically relevant. Results are show in a forest plot (Figure 2).
Figure 2. Forest plot and pooled standardized mean difference in mood at 3-12 months of follow-up.
- Fatigue (important)
One RCT report on the effect of interdisciplinary rehabilitation on fatigue through the Multidimensional Fatigue Inventory (MFI-20) (Rytter, 2019; n=89, scoring a total from 4 to 84 over 20 items in 5 domains (general fatigue, physical fatigue, reduced activities, reduced motivation and mental fatigue). A lower score denotes less fatigue. Results are shown in table 2. For general and metal fatigue, a medium effect size was found. However, this was not considered clinically relevant.
Table 2. Results on fatigue, assessed by the MFI-20 (extracted from Rytter, 2019).
|
|
Post-treatment |
6 months follow-up |
||
|
SC (mean ± SD) |
IR (mean ± SD) |
SC (mean ± SD) |
IR (mean ± SD) |
|
|
General fatigue |
75.68 ± 18.48 |
73.00 ± 16.04 |
75.57 ± 16.71 |
71.11 ± 19.83 |
|
Physical fatigue |
68.86 ± 18.92 |
61.11 ± 19.21 |
69.55 ± 20.17 |
61.89 ± 21.03 |
|
Reduced activities |
69.21 ± 19.53 |
64.44 ± 20.87 |
68.86 ± 17.58 |
57.11 ± 23.32 |
|
Reduced motivation |
49.77 ± 16.70 |
47.87 ± 16.77 |
48.89 ± 13.18 |
44.00 ± 16.76 |
|
Mental fatigue |
72.16 ± 17.23 |
65.11 ± 16.36 |
69.89 ± 13.75 |
62.00 ± 19.32 |
Abbreviations (alphabetical): SC: standard care, IR: interdisciplinary rehabilitation, SD: standard deviation.
- Participation (important)
One RCT reported on the effect of interdisciplinary rehabilitation on participation through the number of patients who returned to work (%) and the number days to sustainable return to work (Vikane, 2017; n=151). 49 patients (60%) in the intervention group have returned to work within 12 months, compared to 50 patients (70%) in the control group (p-value of Chi-square test 0.173). Patients receiving interdisciplinary rehabilitation resumed work after a median of 90 days (range: 0 to 366), whereas patients only followed up by their GP returned to work after a median of 71 days (range 0 to 366). These differences were not significant.
- Quality of life (important)
Two RCTs reported on the effect of interdisciplinary rehabilitation on quality of life (n=201). Thastum (2019) assessed quality of life by the improvement from baseline up to 3 months follow-up, measured by the QOLIBRI-OS. QOLIBRI-OS total score ranges from 0 – 100, where a higher score means a better outcome. Rytter (2019) reported assessed difference in quality of life by the Short Form 36 (SF-36) between baseline and three months follow-up, a questionnaire containing 36 questions concerning perceived healicht THL-related quality of life on eight scales. On each scale the score can range from 0-100 with a high score indicating a better perceived healicht THL.
Only the effect that was shown by Rytter (2019) was considered clinically relevant in favor of the intervention group receiving interdisciplinary rehabilitation. Results are show in a forest plot (Figure 3).
Figure 3. Forest plot and standardized mean difference in quality of life at 3-12 months follow-up.
Level of evidence of the literature
The level of evidence regarding all outcome measures started at high because it was based on randomized controlled trials. Per outcome measure, the level of evidence was downgraded as follow:
- Symptoms and complains (crucial)
End of treatment
- Risk of performance bias and detection bias due to lack of blinding (-1, risk of bias).
- Wide confidence intervals, crossing both borders of clinical relevance (-2, imprecision).
The final level is very low.
3-9 months of follow-up
- Risk of performance bias and detection bias due to lack of blinding (-1, risk of bias).
- Wide confidence intervals, crossing one border of clinical relevance (-1, imprecision).
The final level is low.
- Anxiety (important)
12 months of follow-up
- Risk of performance bias and detection bias due to lack of blinding (-1, risk of bias).
- Within study heterogeneity, resulting in wide ranges of the effect size (-2, imprecision).
The final level is very low.
- Mood (important)
3-9 months of follow-up
- Risk of performance bias and detection bias due to lack of blinding (-1, risk of bias).
- Statistical heterogeneity (-1, inconsistency).
The final level is low.
- Fatigue (important)
End of treatment and 6 months follow-up:
- Risk of performance bias and detection bias due to lack of blinding (-1, risk of bias).
- Only one study with small sample size reporting on the outcome (-1, imprecision).
The final level is low.
- Participation (important)
6 months of follow-up
- Risk of performance bias and detection bias due to lack of blinding (-1, risk of bias).
- Risk of bias due to confounding (-1, risk of bias)
- Only one study with a small sample size reporting on the outcome (-1, imprecision).
The final level is low.
- Quality of life (important)
3-9 months of follow-up
- Risk of performance bias and detection bias due to lack of blinding (-1, risk of bias).
- Only two study with small sample sizes reporting on the outcome (-1, imprecision).
The final level is low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the effect of interdisciplinary care for patients with remaining complains after mild traumatic brain injury after three months?
P: Patients with remaining complains after mild traumatic brain injury after three months;
I: Interdisciplinary care;
C: Placebo, usual care, no treatment;
O: Symptoms and complaints, anxiety, mood, fatigue, participation, quality of life.
Relevant outcome measures
The guideline development group considered symptoms and complaints as a critical outcome measure for decision making; and anxiety, mood, fatigue, participation and quality of life as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined a 10% difference for continuous outcome measures, 20% for dichotomous outcome measures informing on relative risk (0.8 ≤ RR ≥ 1.25), and 0.5 for Cohen’s d in standardized mean difference (-0.5 ≤ SMD ≥ 0.5) as minimal clinically (patient) important differences.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until December 15th, 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 131 hits. Studies were selected based on the following criteria:
- Systematic review and/or meta-analysis, or randomized controlled trial (RCT);
- Included adult patients (18+);
- Describing interdisciplinary care as an intervention, according to the definition by Gatchel, 2014:
(a) a common philosophy treatment in line with the biopsychosocial model;
(b) a treatment component where patients actively participated by means of tasks, training and/or exercise;
(c) at least three different healicht THLcare professionals from various disciplines that provided the interdisciplinary treatment;
(d) a single facility where each patient received treatment. This last criterion excluded care-network settings, but not multicenter trials.
- Described placebo, usual care or no treatment as a comparison;
- Described at least one of the outcome measures as described in the PICO;
- Included at least 10 patients per treatment arm.
Eight studies were initially selected based on title and abstract screening. After reading the full text, seven studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One study was included in the analysis of the literature, from which three RCTs were extracted. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Because a limited number of studies was found, we decided to also discuss studies that included patients 6 -12 weeks after trauma and studies that described multidisciplinary care
Referenties
- Bailey C, Meyer J, Briskin S, Tangen C, Hoffer SA, Dundr J, Brennan B, Smith P. Multidisciplinary Concussion Management: A Model for Outpatient Concussion Management in the Acute and Post-Acute Settings. J Head Trauma Rehabil. 2019 Nov/Dec;34(6):375-384. doi: 10.1097/HTR.0000000000000527. PMID: 31479082.
- McCarty CA, Zatzick D, Stein E, Wang J, Hilt R, Rivara FP; Seattle Sports Concussion Research Collaborative. Collaborative Care for Adolescents With Persistent Postconcussive Symptoms: A Randomized Trial. Pediatrics. 2016 Oct;138(4):e20160459. doi: 10.1542/peds.2016-0459. Epub 2016 Sep 13. PMID: 27624513; PMCID: PMC5051206.
- Janak JC, Cooper DB, Bowles AO, Alamgir AH, Cooper SP, Gabriel KP, Pérez A, Orman JA. Completion of Multidisciplinary Treatment for Persistent Postconcussive Symptoms Is Associated With Reduced Symptom Burden. J Head Trauma Rehabil. 2017 Jan/Feb;32(1):1-15. doi: 10.1097/HTR.0000000000000202. PMID: 26709579.
- Nguyen JVK, McKay A, Ponsford J, Davies K, Makdissi M, Drummond SPA, Reyes J, Willmott C. Interdisciplinary Rehabilitation for Concussion Recovery (i-RECOveR): protocol of an investigator-blinded, randomised, case series with multiple baseline design to evaluate the feasibility and preliminary efficacy of a 12-week treatment for persistent post-concussion symptoms. Pilot Feasibility Stud. 2022 Sep 5;8(1):198. doi: 10.1186/s40814-022-01153-6. PMID: 36064489; PMCID: PMC9441831.
- Rosenblatt CK, Harriss A, Babul AN, Rosenblatt SA. Machine Learning for Subtyping Concussion Using a Clustering Approach. Front Hum Neurosci. 2021 Sep 30;15:716643. doi: 10.3389/fnhum.2021.716643. PMID: 34658816; PMCID: PMC8514654.
- Rytter HM, Westenbaek K, Henriksen H, Christiansen P, Humle F. Specialized interdisciplinary rehabilitation reduces persistent post-concussive symptoms: a randomized clinical trial. Brain Inj. 2019;33(3):266-281. doi: 10.1080/02699052.2018.1552022. Epub 2018 Nov 30. PMID: 30500267.
- Rytter HM, Graff HJ, Henriksen HK, Aaen N, Hartvigsen J, Hoegh M, Nisted I, Næss-Schmidt ET, Pedersen LL, Schytz HW, Thastum MM, Zerlang B, Callesen HE. Nonpharmacological Treatment of Persistent Postconcussion Symptoms in Adults: A Systematic Review and Meta-analysis and Guideline Recommendation. JAMA Netw Open. 2021 Nov 1;4(11):e2132221. doi: 10.1001/jamanetworkopen.2021.32221. PMID: 34751759; PMCID: PMC8579233.
- Thastum MM, Rask CU, Næss-Schmidt ET, Tuborgh A, Jensen JS, Svendsen SW, Nielsen JF, Schröder A. Novel interdisciplinary intervention, GAIN, vs. enhanced usual care to reduce high levels of post-concussion symptoms in adolescents and young adults 2-6 months post-injury: A randomised trial. EClinicalMedicine. 2019 Dec 16;17:100214. doi: 10.1016/j.eclinm.2019.11.007. PMID: 31891145; PMCID: PMC6933237.
- Vikane E, Hellstrøm T, Røe C, Bautz-Holter E, Aßmus J, Skouen JS. Multidisciplinary outpatient treatment in patients with mild traumatic brain injury: A randomised controlled intervention study. Brain Inj. 2017;31(4):475-484. doi: 10.1080/02699052.2017.1280852. Epub 2017 Mar 15. PMID: 28296510.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Rytter, 2021 |
SR and meta-analysis of systematic reviews of RCTs and RCTs
Literature search up to March 3, 2020
A: Rytter, 2019 B: Thastum, 2019 C: Vikane, 2017
Study design: RCTs
Setting and Country: A: Specialized post-acute outpatient hospital
Source of funding and conflicts of interest: Dr. Rytter, Dr Graff, Mr Aaen, Dr Hartvisgsen received grants from the Danish Ministery of Healicht THL. Dr Hoegh received personal fees from the Danish Healicht THL Authority and Acatalepsia, Mr Nisted received fees from the Danish Healicht THL Authority, Ms Pederson received personal fees from the Danish Concussion Center and the Danish Healicht THL Authority. Dr Callesen received personal fees from the Danish Concussion Center.
The study was supported partly by the Danish Ministry of Healicht THL (members of the project group and working group received financial compensation). Additional funding was provided by the Danish Center.
The funders had no role in the design and conduct of the study.
|
Inclusion criteria SR: (1) be intervention studies within the areas of the predefined clinical questions, (2) include a control group, and (3) focus on symptoms after concussion or mTBI. Studies including both concussion or mTBI and moderate to severe TBIwere only included if it was possible to extract separate data for the concussion/mTBI population. Participants had to be aged 18 years or older and be diagnosed with concussion or mTBI. Consent (written or oral) from the participants was not obtained, as the study only used data from previously published studies. Studies including adolescents were included only if adolescent participants represented a minority of the study sample.
Exclusion criteria SR: n.r.
3 studies included
Important patient characteristics at baseline:
N, mean age A: 89 patients, 18-65 yrs B: 112 patients, 22.0 yrs C: 151 patients, 31 yrs
Sex: A: 34% Male B: 21% Male C: 61% Male
Groups comparable at baseline? Yes |
A: Interdisciplinary rehabilitation program with individual- and group-based interventions within neuropsychology, cognitive behavioral therapy, and physical therapy. B: Interdisciplinary intervention program based on cognitive behavioral therapy and gradual return to activities, including group and individual sessions. C: Multidisciplinary outpatient follow-up program consisting of individual contacts and psychoeducational group intervention.
|
A: Usual treatment offered by the public municipality services. B: Enhanced usual care including reassurance and individual psychoeducation on good prognosis and gradual resumption of premorbid activities. C: regular unstandardized treatment at GP.
|
Endpoint of follow-up:
A: 6 months B: 3 months C: 12 months
For how many participants were no complete outcome data available? n.r.
|
Symptoms and complains Measured with the RPQ.
Effect measure: mean difference [95% CI]: End of treatment A: 5.21 [0.37 – 10.05] B: 6.20 [1.68 – 10.72 C: n.r.
Pooled effect (random effects model): 5.74 [95% CI 2.44 to 9.04] favoring interdisciplinary revalidation Heterogeneity (I2): 0%
3-9 months follow-up A: 5.61 [1.22 – 10:00]
Pooled effect (random effects model): 6.42 [95% CI 3.11 to 9.73] favoring interdisciplinary revalidation Heterogeneity (I2): 0%
Anxiety Measured with the HADS-A.
Effect measure: median [range]: 3-9 months follow-up A: n.r.
Mood Defined by emotional status
Effect measure: standardized mean difference [95% CI]: 3-9 months follow-up A: 0.55 [0.13 – 0.98] B: n.r. C: 0.07 [-0.25 – 0.39]
Participation Defined by the number of patients who returned to work and the number of days to sustainable return to work.
Patients who returned to work Effect measures: risk ratio [95% CI]: 6 months follow-up A: n.r.
Days to sustainable return to work Effect measures: median [range]: 6 months follow-up A: n.r.
Quality of life Effect measure: standardized mean difference [95% CI]: 3-9 months follow-up A: 0.72 [0.29 – 1.15]
|
Author’s conclusion: There is an urgent need for more methodologically robust research evaluating the outcomes of nonpharmacological treatments for persistent symptoms after concussion or mTBI. Given the best available evidence to date, and based on the findings of this systematic review and meta-analysis, active management and treatment of PPCS is recommended, both through individual disciplines targeting specific problems and through interdisciplinary rehabilitation. There was agreement on this recommendation across the available guidelines, including the one presented here, regardless of their applied methodology.
Risk of bias A: Moderate (performance bias and detection bias due to lack of blinding) |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Rytter, 2021 |
Yes |
Yes |
Yes |
No |
Not applicable |
Yes |
Yes |
Yes |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Cooper DB, Bunner AE, Kennedy JE, Balldin V, Tate DF, Eapen BC, Jaramillo CA. Treatment of persistent post-concussive symptoms after mild traumatic brain injury: a systematic review of cognitive rehabilitation and behavioral healicht THL interventions in military service members and veterans. Brain Imaging Behav. 2015 Sep;9(3):403-20. doi: 10.1007/s11682-015-9440-2. PMID: 26330376. |
Wrong study design (only observational studies included and not systematically analysed) |
|
Dharm-Datta S, Gough MR, Porter PJ, Duncan-Anderson J, Olivier E, McGilloway E, Etherington J. Successful outcomes following neurorehabilitation in military traumatic brain injury patients in the United Kingdom. J Trauma Acute Care Surg. 2015 Oct;79(4 Suppl 2):S197-203. doi: 10.1097/TA.0000000000000721. PMID: 26406431. |
Wrong study design (observational study) |
|
Hauger SL, Borgen IMH, Løvstad M, Lu J, Forslund MV, Kleffelgård I, Andelic N, Røe C. Community-Based Interventions After Acquired Brain Injury-A Systematic Review of Intervention Types and Their Effectiveness. J Head Trauma Rehabil. 2022 Sep-Oct 01;37(5):E355-E369. doi: 10.1097/HTR.0000000000000765. Epub 2022 Feb 3. PMID: 35125426. |
Included studies did not concern the population or intervention of interest. |
|
Howe EI, Fure SCR, Løvstad M, Enehaug H, Sagstad K, Hellstrøm T, Brunborg C, Røe C, Nordenmark TH, Søberg HL, Twamley E, Lu J, Andelic N. Effectiveness of Combining Compensatory Cognitive Training and Vocational Intervention vs. Treatment as Usual on Return to Work Following Mild-to-Moderate Traumatic Brain Injury: Interim Analysis at 3 and 6 Month Follow-Up. Front Neurol. 2020 Nov 10;11:561400. doi: 10.3389/fneur.2020.561400. PMID: 33240196; PMCID: PMC7683428. |
Wrong control group (received combined cognitive and vocational intervention) |
|
Silverberg ND, Cairncross M, Brasher PMA, Vranceanu AM, Snell DL, Yeates KO, Panenka WJ, Iverson GL, Debert CT, Bayley MT, Hunt C, Baker A, Burke MJ; Canadian Traumatic Brain Injury Research Consortium (CTRC). Feasibility of Concussion Rehabilitation Approaches Tailored to Psychological Coping Styles: A Randomized Controlled Trial. Arch Phys Med Rehabil. 2022 Aug;103(8):1565-1573.e2. doi: 10.1016/j.apmr.2021.12.005. Epub 2021 Dec 28. PMID: 34971596. |
Wrong intervention (only two healicht THLcare professionals involved) and wrong comparison (operant condition-based pacing strategies and mindfulness training) |
|
Thastum MM, Rask CU, Næss-Schmidt ET, Tuborgh A, Jensen JS, Svendsen SW, Nielsen JF, Schröder A. Novel interdisciplinary intervention, GAIN, vs. enhanced usual care to reduce high levels of post-concussion symptoms in adolescents and young adults 2-6 months post-injury: A randomised trial. EClinicalMedicine. 2019 Dec 16;17:100214. doi: 10.1016/j.eclinm.2019.11.007. PMID: 31891145; PMCID: PMC6933237. |
RCT was included in the review of Rytter (2021) |
|
Vikane E, Hellstrøm T, Røe C, Bautz-Holter E, Aßmus J, Skouen JS. Multidisciplinary outpatient treatment in patients with mild traumatic brain injury: A randomised controlled intervention study. Brain Inj. 2017;31(4):475-484. doi: 10.1080/02699052.2017.1280852. Epub 2017 Mar 15. PMID: 28296510. |
RCT was included in the review of Rytter (2021) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-03-2024
Beoordeeld op geldigheid : 11-03-2024
Algemene gegevens
In samenwerking met het Nederlands Huisartsen Genootschap.
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
De richtlijn is bestemd voor alle zorgverleners die betrokken zijn bij de diagnostiek, advisering of behandeling bij mensen met langer bestaande klachten (3 maanden) na licht traumatisch hoofd/hersenletsel, met name voor neurologen, revalidatieartsen en paramedici. De NHG-standaard Hoofdtrauma is leidend voor de huisartsen. Naast deze professionals is het van groot belang dat patiënten zelf ook weten waar ze in welk stadium met welke klachten terecht kunnen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten aanhoudende klachten na licht THL.
Werkgroep
- drs. E.W.J. Agterhof, revalidatiearts, VRA
- drs. A. Baars, ergotherapeut, EN
- prof. dr. C.A.M van Bennekom, revalidatiearts/manager, VRA
- dr. N.L. Frankenmolen, i.o. tot klinisch neuropsycholoog, NIP
- drs. P.A.W. Frima-Verhoeven, neuroloog BreinPoli, NVN
- drs. E.A. Goedhart, bondsarts/manager sportgeneeskunde, VSG
- drs. R. Grond, revalidatiearts, VRA
- drs. A. Hansma, huisarts, NHG
- drs. E. Jagersma, revalidatiearts, VRA
- prof. dr. G. Kwakkel, hoogleraar Neurorevalidatie AUMC, KNGF
- drs. S.M. de Lange, bedrijfsarts, NVAB
- mr. M.A.C. Lindhout, Beleidsmedewerker patiëntenvereniging Hersenletstel.nl
- prof. dr. J. van der Naalt, neuroloog, NVN
- prof. dr. R.W.H.M. Ponds, klinisch neuropsycholoog, NIP
- drs. J.M. Schuurman, revalidatiearts, VRA
- prof. dr. J.M. Spikman, klinisch neuropsycholoog, hoogleraar klinische neuropsychologie, NIP
- dr. Melloney Wijenberg, GZ-psycholoog i.o., afdeling neurologie, Adelante, NIP
Met ondersteuning van:
- drs. F. Ham, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- drs. A.A. Lamberts, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bennekom, van |
Revalidatiearts/ manager R&D, revalidatiecentrum Heliomare te Wijk aan Zee |
Bijzonder hoogleraar revalidatie en arbeid, AUMC te Amsterdam, lid WHR (onbetaald) |
Geen. |
Geen. |
|
Schuurman |
Revalidatiearts Stichting Klimmendaal Revalidatiespecialisten |
Lid WHR (onbetaald) |
Geen. |
Geen. |
|
Jagersma |
Revalidatiearts, Basalt Den Haag |
Voorzitter Werkgroep Hersenletsel Revalidatie (WHR) van de VRA (onbetaalde nevenfunctie) |
Geen. |
Geen. |
|
Agterhof |
Revalidatiearts en medisch manager (0,6 en 0,2) bij de Hoogstraat Revalidatie |
Lid WHR (onbetaald) |
Geen. |
Geen. |
|
Grond |
Revalidatiearts Basalt en HMC (0,4 fte en 0,4 fte). Gedetacheerd vanuit Basalt naar HMC |
Lid stafbestuur Basalt (onbetaald), Lid WHR (onbetaald) |
Geen. |
Geen. |
|
Naalt |
Neuroloog Universitair Medisch Centrum Groningen |
Vanuit expertise in de neurotraumatologie lid van diverse regionale en landelijke commissies, allen onbezoldigd. |
Er is geen financier die belangen heeft bij de uitkomst van de richtlijn. Lopend onderzoek gefinancierd onderzoek door derden betreft:
T-Scemo4all gesubsidieerd door de Hersenstichting: Sociale cognitie en sociaal gedrag verbeteren bij diverse hersenaandoeningen (start 2020). Rol: Medeaanvrager UMCG, nationale multicenter studie.
BRAIN-ReADAPT studie naar het effect van veroudering bij NAH- patienten gesubsidieerd door Zon-MW (start 2021). Rol: PI UMCG, nationale multicenter studie. |
Geen. |
|
Frima-Verhoeven |
Neuroloog bij stichting BreinPoli |
Advies opdrachten bij het CCE, gemiddeld één per anderhalf jaar, betaald. |
Geen. |
Geen. |
|
Goedhart |
Bondarts/ Manager sportgeneeskunde KNVB |
Adviseur Stichting Hersenschudding - onbetaald |
Geen. |
Geen. |
|
Lindhout |
Beleidsmedewerker bij patiëntenvereniging Hersenletstel.nl |
Bestuurslid bij CVA-Kennisnetwerk, onbetaald |
Geen. |
Geen. |
|
Kwakkel |
* Hoogleraar Neurorevalidatie AUMC |
Geen |
Geen. |
Geen. |
|
Hansma |
Huisarts |
Geen |
Geen. |
Geen. |
|
Lange, de |
AIOS bedrijfsgeneeskunde vierde jaar SGBO |
Geen |
Geen. |
|
|
Baars |
Ergotherapeut en mede-eigenaar Plan4 (ergotherapie praktijk in de 1e lijn) |
Voorzitter werkgroep ergotherapie en hersenletsel van Ergotherapie Nederland |
Geen. |
Geen. |
|
Wijenberg |
* Psycholoog, Afdeling Neurologie/ NAH, Adelante Revalidatiecentrum., Hoensbroek 0,8 fte * Docent, Faculty of Psychology and Neuroscience (PFN), Maastrciht University, Maastricht, 0,2 fte |
Bestuurslid Sectie Revalidatie, Nederlands Instituut van Psychologen (NIP), onbetaald
Ik geef les over neuropsychologische onderwerpen vanuit mijn functie als psycholoog bij Adelante (Adelante ontvangt hier een compensatie voor). Dit verricht ik voor meerdere partijen w.o. RINO Zuid, Pro-Education, Maastiricht Univeristy |
Geen. |
Geen. |
|
Frankenmolen |
* GZ-psycholoog in opleiding tot klinisch neuropsycholoog, Klimmendaal Revalidatiespecialisten - 27 uur per week. * Senior onderzoeker, Klimmendaal Revalidatiespecialisten - 8 uur per week |
* Docent Praktijkresearch voor de KP-opleiding bij het RCSW, Nijmegen (betaald) * Gastdocent 'Pain and Psychology' voor de opleiding psychologie van de Radboud Universiteit Nijmegen (betaald) * Lid werkgroep Onderzoek binnen de sectie Revalidatie van het NIP (onbetaald) |
Geen. |
Geen. |
|
Ponds |
* klinisch neuropsycholoog * Hoogleraar Medische Psychologie, VU * Hoofd afdeling Medische Psychologie, Amsterdam UMC |
* Voorzitter Nederlandse Vereniging voor Gezondheidszorgpsychologie (NVGzP), maandvergoeding * Bestuurslid TOP opleidingsplaatse, vacatiegeld * Bestuurslid PAON (post-acad. Opleiding klinisch neuropscycholoog), geen vergoeding * Bestuurslid P3NL, vacatiegeld |
Extern gefinancierd onderzoek: Hersenstichting - PsyMate: e-healicht THL interventue vermoeidheid na hersenletsel – projectleider |
Geen. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntvereniging Hersenletsel.nl te betrekken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop “Waarden en voorkeuren van patiënten”). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en Stichting hersenschudding.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Symptoomclusters en diagnostiek |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Beïnvloedbare factoren |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Psycho-educatie |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Psychotherapie |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
(Graded) physical activity |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Exposure |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Vestibulaire therapie en visuele training |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Sensorische integratie interventies |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Terugkeer naar werk |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Interdisciplinaire revalidatie |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Organisatie van zorg |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
Implementatie
Inleiding
Dit plan is opgesteld ter bevordering van de implementatie van de richtlijn aanhoudende klacht na licht THL. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het toepassen en naleven van de aanbevelingen. Daarbij heeft de richtlijncommissie een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die voor verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
• per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
• de verwachtte impact van implementatie van de aanbeveling op de zorgkosten;
• randvoorwaarden om de aanbeveling te kunnen implementeren;
• mogelijk barrières om de aanbeveling te kunnen implementeren;
• mogelijke acties om de implementatie van de aanbeveling te bevorderen;
• verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbevelingen is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord. Er kan een onderscheid worden gemaakt tussen “sterk geformuleerde aanbevelingen” en “zwak geformuleerde aanbevelingen”. In het eerste geval doet de richtlijncommissie een duidelijke uitspraak over iets dat zeker wel of zeker niet gedaan moet worden. In het tweede geval wordt de aanbeveling minder zeker gesteld (bijvoorbeeld “Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe meer uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”. Bij elke module is onderstaande tabel opgenomen.
|
Aanbeveling |
Tijdspad voor implementatie: 1 tot 3 jaar of > 3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
Overige opmerkingen |
|
|
|
|
|
|
|
|
|
1 Barrières kunnen zich bevinden op het niveau van de professional, op het niveau van de organisatie (het ziekenhuis) of op het niveau van het systeem (buiten het ziekenhuis). Denk bijvoorbeeld aan onenigheid in het land met betrekking tot de aanbeveling, onvoldoende motivatie of kennis bij de specialist, onvoldoende faciliteiten of personeel, nodige concentratie van zorg, kosten, slechte samenwerking tussen disciplines, nodige taakherschikking, et cetera.
2 Denk aan acties die noodzakelijk zijn voor implementatie, maar ook acties die mogelijk zijn om de implementatie te bevorderen. Denk bijvoorbeeld aan controleren aanbeveling tijdens kwaliteitsvisitatie, publicatie van de richtlijn, ontwikkelen van implementatietools, informeren van ziekenhuisbestuurders, regelen van goede vergoeding voor een bepaald type behandeling, maken van samenwerkingsafspraken.
3 Wie de verantwoordelijkheden draagt voor implementatie van de aanbevelingen, zal tevens afhankelijk zijn van het niveau waarop zich barrières bevinden. Barrières op het niveau van de professional zullen vaak opgelost moeten worden door de beroepsvereniging. Barrières op het niveau van de organisatie zullen vaak onder verantwoordelijkheid van de ziekenhuisbestuurders vallen. Bij het oplossen van barrières op het niveau van het systeem zijn ook andere partijen, zoals de NZA en zorgverzekeraars, van belang. Echter, aangezien de richtlijn vaak enkel wordt geautoriseerd door de (participerende) wetenschappelijke verenigingen is het aan de wetenschappelijke verenigingen om deze problemen bij de andere partijen aan te kaarten.
Implementatietermijnen
Voor “sterk geformuleerde aanbevelingen” geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Voor de meeste “sterk geformuleerde aanbevelingen” betekent dat dat zij komend jaar direct geïmplementeerd moeten worden en dat per 2023 dus iedereen aan deze aanbevelingen dient te voldoen.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met aanhoudende klachten na licht THL in de chronische fase. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Psychiatrie, Inspectie Gezondheidszorg en Jeugd, Koepels van zorginstellingen, Verpleegkundigen & Verzorgenden Nederland, Vereniging Innovatieve Geneesmiddelen, Nederlandse Associate Physician Assistants, Zorginstituut Nederland, Zorgverzekeraars Nederland, Vereniging van Oefentherapeuten Cesar en Mesendieck, CZ en Zilveren Kruis via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healicht THLcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healicht THLcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in healicht THL care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for healicht THL professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Algemene informatie
|
Richtlijn: NVN Aanhoudende klachten na licht THL |
|
|
Uitgangsvraag: Wat is de waarde van een interdisciplinaire samenwerking bij de zorg voor patiënten met aanhoudende klachten met licht THL? |
|
|
Database(s): Medline (OVID), Embase |
Datum: 15-12-2022 |
|
Periode: >2000 |
Talen: Geen beperking |
|
Literatuurspecialist: Linda Niesink |
|
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
→ Voor deze vraag is gezocht op de elementen licht-traumatisch hersenletsel (in het blauw) in de chronische fase (in het groen) en interdisciplinaire samenwerking (in het oranje).
→ De sleutelartikelen van Nguyen (2022), Rytter (2021), Rytter (2019), Thastum (2019), Vikane (2017) zitten in de zoekopbrengst. Caplan (2017) valt erbuiten omdat dit geen SR of RCT is, maar zou anders wel gevonden worden.
→ Resultaten staan in Rayyan.
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase (via embase.com) en Medline (via OVID) is op 15-12-2022 met relevante zoektermen gezocht vanaf 2000 naar systematische reviews en RCT’s over interdisciplinaire samenwerking bij de zorg voor patiënten met chronisch licht-traumatisch hersenletsel. De literatuurzoekactie leverde 131 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SR’s |
45 |
29 |
47 |
|
RCT’s |
67 |
51 |
84 |
|
Totaal |
112 |
80 |
131 |
Zoekstrategie
|
Database |
Zoektermen |
|||||||||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Brain Injuries, Traumatic/ or exp Brain Concussion/ or exp Head Injuries, Closed/ or exp Chronic Traumatic Encephalopathy/ or exp Post-Concussion Syndrome/ or (traumatic adj2 (brain or cerebral) adj2 (injur* or lesion*)).ti,ab,kf. or 'brain system trauma*'.ti,ab,kf. or ((brain or cerebral or cerebrovascular) adj2 trauma*).ti,ab,kf. or ((traumatic or posttraumatic) adj2 encephalopath*).ti,ab,kf. (62402) 2 (chronic* or persistent or sustain* or 'post injur*').ti,ab,kf. (2038711) 3 (multidisciplin* or interdisciplin* or crossdisciplin* or multimodal or integrated or integrative or holistic).ti,ab,kf. (571397) 4 1 and 2 and 3 (466) 5 limit 4 to yr="2000-Current" (449) 6 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (607114) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2332853) 8 5 and 6 (29) – SRs 9 (5 and 7) not 8 (51) – RCT’s 10 8 or 9 (80) |