Psycho-educatie
Uitgangsvraag
Wat is de plaats van psycho-educatie bij aanhoudende klachten na licht THL?
Aanbeveling
Pas psycho-educatie toe bij patiënten met aanhoudende klachten na licht THL als onderdeel van de behandeling.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Psychoeducatie; het informeren van een patiënt over relevante aspecten van de opgelopen aandoening in het algemeen, en de specifieke gevolgen (zoals vastgesteld in een (neuro)psychologisch onderzoek) van die aandoening voor de patiënt in het bijzonder, alsmede over de kenmerken van de patiënt die hierop van invloed zijn, wordt beschouwd als een belangrijk onderdeel van en zelfs essentiële voorwaarde voor (neuro)psychologische behandeling. Er is slechts een beperkt aantal studies uitgevoerd dat de effecten van psychoeducatie als afzonderlijke behandelvorm voor klachten, symptomen en kwaliteit van leven heeft onderzocht bij patiënten met langdurige klachten na licht traumatisch hersenletsel. Deze literatuur laat geen klinisch relevant effect zien van psychoeducatie op post-concussion symptoms of kwaliteit van leven, in patiënten met aanhoudende klachten (>3 maanden) na licht THL. Het overall niveau van bewijskracht is zeer laag, vanwege het kleine aantal studies, beperkingen in studieopzet, het subjectief rapporteren van uitkomsten zonder blindering van de beoordelaar, en de kleine onderzochte populatie.
Nadelige effecten van psychoeducatie worden amper benoemd. Bell (2017) en Kjeldgaard (2014) rapporteren wel positieve uitkomsten van psychoeducatie op “psychological distress” in vergelijking met de controlegroep die geen behandeling of enkel educatie kreeg. Er zijn echter geen studies die psychoeducatie als afzonderlijke interventie onderzoeken. Hier ligt een kennislacune.
Er is te weinig onderzoek gedaan om op basis van de uitkomsten hiervan al te stellige uitspraken te kunnen doen over voor- danwel nadelen van psychoeducatie. Op theoretische gronden, maar zeker ook op gedeelde klinische ervaring, kan zonder meer gezegd worden dat psychoeducatie een essentieel en veelal eerste onderdeel moet zijn van elke psychologische behandeling; patiënten hebben er recht op geïnformeerd te worden over wat er vanuit wetenschappelijk onderzoek bekend is over hun aandoening en specifiek, om de uitslagen te horen van (neuro)psychologisch onderzoek dat bij hen is afgenomen, en op basis daarvan meer inzicht en duidelijkheid te verkrijgen over relevante factoren die een rol spelen bij hun aandoening en mee zullen wegen bij het stellen van behandeldoelen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Goede uitleg ofwel psycho-educatie wordt in het algemeen zeer gewaardeerd door zowel patiënt als zijn directie omgeving. Aanhoudende klachten na licht THL zijn meestal niet verwacht (en ook is het vaak zo uitgelegd) en roepen daarom veel vragen en onrust op bij patiënt en omgeving over mogelijke oorzaken en het verwachte verdere beloop. Het is belangrijk hier voldoende tijd voor te nemen, omdat het hier vaak een complexe samenhang van mogelijke oorzaken betreft waarbij vrijwel altijd een psychische component (bv. stemming, coping) een belangrijke rol speelt. Dit kan gemakkelijk leiden tot de onterechte gedachte bij patiënt of omgeving dat het louter ‘psychisch’ is of ‘tussen de oren’ en daarmee minder ernstig is of zelfs verwijtbaar. Het is zeer belangrijk de onjuistheid hiervan tijdig en voldoende te adresseren in de uitleg.
Kosten (middelenbeslag)
Momenteel ontbreekt goed wetenschappelijk onderzoek naar de effectiviteit en kosteneffectiviteit psycho-educatie bij deze doelgroep. Daarnaast is psycho-educatie meestal integraal onderdeel van een ingezette behandeling(en) waardoor het lastig is hierover specifiek uitspraken te doen.
Aanvaardbaarheid, haalbaarheid en implementatie
Psycho-educatie is vaak integraal onderdeel van ingezette behandeling(en). Het wordt in de regel zeer gewaardeerd door patiënt en omgeving. Negatieve of nadelige effecten zijn onbekend. Belangrijk is dat bij inzet van meerderen hulpverleners of disciplines iedereen goed op de hoogte is van de psycho-educatie die gegeven is en het model dat onderliggend is aan de aanhoudende klachten bij de patiënt zodat de verschillende interventies hier goed op zijn afgestemd.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
Er zijn geen nadelen en veelal beperkte kosten verbonden aan psychoeducatie. Psychoeducatie is zeer aanvaardbaar en haalbaar voor patiënten. Klinische ervaring leert dat het door de patiënten ook als zeer zinvol en helpend wordt ervaren. Het verdient wel aanbeveling om hiervoor ook contactmomenten te hebben met de patiënt om de kennis over herstel en de individuele factoren die hierbij een rol spelen af te stemmen op de specifieke situatie en persoonskenmerken van de patient. Omdat psychoeducatie geen doel op zich is, maar voorwaardenscheppend is voor het kunnen in zetten van een behandeling, is er in feite geen reden om te onderzoek of psychoeducatie als afzonderlijk ingrediënt van een interventie werkzaam is. Daarentegen zijn er theoretische argumenten aan te voeren (zie eerder) dat patiënten in feite recht hebben op de informatie die middels psychoeducatie verstrekt wordt en waarom psychoeducatie van groot belang is om behandelingen beter af te kunnen stemmen. Derhalve kan psychoeducatie zonder meer worden aanbevolen.
Onderbouwing
Achtergrond
Psychoeducatie betreft het verschaffen van relevante informatie aan patiënten met aanhoudende klachten na licht THL, met betrekking tot wat er bekend is over de medische en psychologische aspecten van de aandoening in het algemeen, en de specifieke factoren die bij de individuele patiënt een rol kunnen spelen (gebaseerd op wat bekend is uit medisch dossier en (neuro)psychologisch onderzoek) in het bijzonder. Psychoeducatie gaat hierbij verder dan alleen het verstrekken van informatiefolders of websites en omvat in de regel ook behandelcontacten met een deskundige zoals een (neuro)psycholoog of revalidatiearts. Het doel is het verstrekken van duidelijkheid over mogelijke prognose, geruststelling en heldere adviezen over wat wel en niet helpend is en wat een goede opbouw van activiteiten is. Psychoeducatie is meestal geen aparte behandelvorm, maar vormt wel een belangrijk onderdeel van de meeste behandelingen die geboden kunnen worden aan patiënten met licht traumatisch hersenletsel in de acute fase. Het vormt een onderdeel van de adviezen bij ontslag uit het ziekenhuis, en bestaat uit geruststelling, wat te verwachten na ontslag, en advies over het geleidelijk hervatten van de dagelijkse activiteiten (zie module Adviezen bij ontslag). Psycho-educatie kan individueel aangeboden worden, maar ook in een groep. In zowel de acute fase als chronische fase is psychoeducatie geïndiceerd moeten en geintergreerd in de de behandeling. Juist in de chronische fase spelen psychologische factoren (bijv. ongerustheid en somberheid) en omgevingsfactoren (bijv. druk op werk, familieproblemen) vaak een onderhoudende rol in het aanhouden van de klachten en het cruciaal patiënten hier inzicht in te verschaffen. Het specifiek effect van psychoeducatie bij aanhoudende klachten na licht THL is nog grotendeels onbekend.
Conclusies / Summary of Findings
- Post-concussion symptoms
|
Very low GRADE |
The evidence is uncertain about the effect that psychoeducation – compared to no active treatment or educational brochures – has on post-concussion symptoms in patients with chronic mild traumatic brain injury.
Source: Bell 2017, Kjeldgaard 2014, Vikane 2017 |
- Anxiety
|
Very low GRADE |
The evidence is unclear about the effect of psychoeducation – compared to follow-up by a general practitioner– on anxiety in patients with persistent complaints after mild traumatic brain injury.
Source: Vikane 2017 |
- Reassurance
|
No GRADE |
No studies about psychoeducation for patients with mild traumatic brain injury reported results on reassurance. |
- Participation
|
Very low GRADE |
It is unclear whether psychoeducation improves participation or return to work in patients with chronic complaints after mild traumatic brain injury, compared to follow-up by a general practitioner or educational brochures.
Source: Bell 2017, Vikane 2017 |
- Quality of life
|
Low GRADE |
The evidence suggests no effect of psychoeducation compared to no active treatment or educational brochures on quality of life, in patients with persisting complaints after mild traumatic brain injury.
Source: Bell 2017, Kjeldgaard 2014 |
Samenvatting literatuur
Description of studies
Teo (2020) evaluated the effects of cognitive and psychological interventions, among which psychoeducation, for the reduction of postconcussion symptoms (PCS) in the chronic phase in patients with mild traumatic brain injury (TBI) in a systematic review. A literature search was performed in six databases (CINAHL, Medline, PubMed, PsychINFO, Web of Science, and the Cochrane Database of Systematic Reviews) from January 1998 to December 2017. English RCTs were included if 1) these reported on cognitive and/or psychological interventions that focus on the reduction of post-concussion symptoms; 2) the interventions were performed on patients with mild traumatic brain injury (age ≥ 18 years); 3) these included an assessment of PCS using the Rivermead Post-concussion Symptoms Questionnaire (RPQ) as primary outcome at three and six months. Articles were excluded if the researched interventions were not of cognitive and/or psychological nature (e.g. visual rehabilitation, transcranial magnetic stimulation, exercise). Teo (2020)’s review included 17 studies. The review’s authors assessed the quality of included studies through the use of the Physiotherapy Evidence Database (PEDro) scale (score 0-10), classifying a study with a score of 6 or higher as “high quality”.
To answer the PICO of this module, only three RCTs were eligible, since nine RCTs reported on acute mild TBI patients (injury sustained within three months before treatment) (Scheenen 2017; Bell 2008; Matuseviciene 2013; Matuseviciene 2016; Varner 2017; Ghaffar 2006; Elgmark Andersson 2007; Belanger 2015 and Silverberg 2013). Another three RCTS were excluded for studying the wrong population (including patients with moderate TBI) (Twamley 2014; Wade 1998 and Bomyea 2017). One study reported on a duplicate patient group (Vuletic 2016), and in one study the intervention went further than psychoeducation, offering patients 12 weeks of cognitive behavioural therapy (Potter 2016). Characteristics of the included studies are shown in Table 1.
Table 1. Overview of the RCTs from the review by Teo (2020)
|
Study |
Population (description, (size)) |
Intervention and duration (n) |
Controls (n) |
Outcomes (including FU) |
Methodo-logical quality (PEDro scale) |
|
Vikane 2017 |
Patients 16-56 years with persistent post-concussion symptoms 2 months after mild TBI (151) |
4 weeks psychoeducation group intervention and individual follow-ups based on individual need in first year (81) |
Follow-up by GP (70) |
Return to work, post-concussion symptoms (at 12 months) |
8 |
|
Kjeldgaard 2014 |
Patients with chronic post-traumatic headache, attributed to mild head injury, >3 months postinjury (90) |
9 weeks CBT (with focus on education and coping strategy), 2-hour group sessions. (45) |
No active treatment/ waiting list (45) |
Symptom reduction and quality of life (after 26 weeks) |
6 |
|
Bell 2017 |
Post-deployment active duty service members with mild TBI sustained in <24 months (365) |
12 biweekly calls with problem-solving treatment and educational brochures (178) |
Educational brochures addressing problems common to mild TBI (178) |
Psychological distress and post-concussive symptom(reduction) (after 6 and 12 months) |
7 |
Abbreviations (alphabetical): CBT: cognitive behavioural therapy, FU: follow-up, GP: general practitioner, PCS: post-concussion symptoms, TBI: traumatic Brain Injury
Results
- Post-concussion symptoms
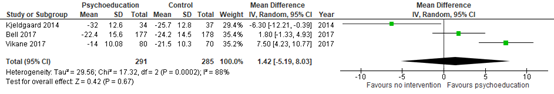
All included RCTs evaluating a form of psychoeducation (Vikane 2017, Kjeldgaard 2014, Bell 2017) assessed the presence and severity of post-concussion symptoms through the Rivermead Post-concussion Symptoms Questionnaire (RPQ). This is a 16-item measure of the severity and impact of post-concussion symptoms. Each item can be scored from 0 to 4, resulting in a maximum score of 64. A higher score represents a higher symptom burden. The analyses resulted in a pooled mean difference of -1.50 (95%CI -6.91 to 3.91) in RPQ score at end of follow up (favouring the psychoeducation group). These end of follow-up points varied from 12 months (Bell, 2017; Vikane, 2017) to 26 weeks (Kjeldgaard, 2014). Results are shown in a forest plot (Figure 1).
As Vikane (2017) reported median, minimum and maximum for RPQ scores, the median was used as an estimate for the mean (Hozo, 2005), considering that the sample size was >25. The standard deviation was calculated as proposed by Walter & Yao (2007), using the range and a conversion factor.
Figure 1. Forest plot and pooled mean difference in RPQ score at follow-up. The scores are multiplied by factor -1 to show a higher score for better outcomes.
- Anxiety
One RCT reported on the effect of psychoeducation on anxiety through the Hospital Anxiety and Depression Scale (HADS-A) (Vikane 2017), scoring a total from 0 to 21 over seven questions. A lower score denotes lower anxiety levels. No difference in HADS-A score was found, with a score of 6 both in the intervention group (range 0 to 18) and the control group (range 0 to 16) after 12 months.
- Reassurance
No studies reported on the outcome reassurance.
- Participation
Two authors reported on participation through different outcome measures. Vikane (2017) analysed return to work: 49 patients (60%) in the psychoeducation group have returned to work within 12 months, compared to 50 patients (70%) in the control group (p-value of Chi-square test 0.173). Patients receiving psychoeducation resumed work after a median of 90 days (range: 0 to 366), whereas patients only followed up by their GP returned to work after a median of 71 days (range 0 to 366).
Bell (2017) uses the Sheehan Disability Scale (SDS), a measure of functional impairment in the work, social life, and family life domains. A lower score represents less functional impairments. Scores at baseline did not differ significantly between the problem solving treatment group and education only group, nor at 6 months, and after 12 months follow-up scores were also relatively comparable: mean of 9.1 (95%CI 7.7 to 10.5) in the intervention group, and mean of 8.9 (95%CI 7.7 to 10.1) in the education only group (p-value 0.906).
- Quality of life
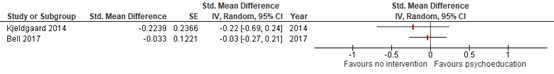
Quality of life was reported by two authors (Bell 2017 and Kjeldgaard 2014) through different instruments. Bell (2017) presented quality of life outcome through the EuroQoL-5D questionnaire. The healicht THL state of a patient can be filled out on a visual analogue scale from 0 to 100, with a higher score representing a higher quality of life.
Kjeldgaard (2014) assessed quality of life via the Short Form 36 (SF-36), a questionnaire containing 36 questions concerning perceived healicht THL-related quality of life on eight scales. On each scale the score can range from 0-100 with a high score indicating a better perceived healicht THL.
Post-intervention quality of life scores is depicted in figure 2, through a standardized mean difference as different scales were used by the different studies. A mean score of the eight different SF-36 scores was calculated and used for analysis.
Figure 2. Forest plot with standardized mean differences in quality of life scores at follow-up.
The observed effects are extremely small and not of clinical relevance, nor statistical significance.
Level of evidence of the literature
- Post-concussion symptoms (critical)
The level of evidence regarding the outcome post-concussion symptoms started at high, because it was based on RCTs, yet was downgraded because of the use of self-reported outcomes without patient, therapist, and assessor blinding, and deviations from intended interventions occurred (-1, risk of bias). In addition, the pooled effect is based on studies with methodological heterogeneity (-1, inconsistency), and the confidence interval of the pooled effect crosses borders of clinical relevance (-1, imprecision). The final level of evidence is very low.
- Anxiety (important)
The level of evidence regarding the outcome anxiety started at high, because it was based on an RCT, yet was downgraded because of the use of self-reported outcomes without patient, therapist, and assessor blinding; and the lack of intention to treat analyses (-1, risk of bias). In addition the included study contains a small sample size which is additionally not powered for the assessment of anxiety (-2, imprecision). The final level of evidence is very low.
- Reassurance (important)
No studies reported on the outcome reassurance, therefore no level of evidence assessment can be made.
- Participation (important)
The level of evidence regarding the outcome participation started at high, because it was based on RCTs, yet was downgraded because of the use of self-reported outcomes without patient and therapist blinding; unclear adequacy allocation concealment in one study; and the lack of intention to treat analyses (-1, risk of bias). In addition, participation is assessed through different means such as SDS or return to work (-1, indirectness), and studies contain small sample sizes (-1, imprecision). The final level of evidence is very low.
- Quality of life (important)
The level of evidence regarding the outcome quality of life started at high, because it was based on RCTs, yet was downgraded because of the use of self-reported outcomes without patient, therapist, and assessor blinding; unclear adequacy of allocation concealment; and the lack of intention to treat analyses (-1, risk of bias). In addition, the optimal information size has not been reached (-1, imprecision). The final level of evidence is low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of psychoeducation after mild traumatic brain injury in patients with remaining complaints after three months on reassurance and insight into the causality of complaints?
P: Patients with remaining complains after mild traumatic brain injury after three months;
I: Psychoeducation (comprising explanation of multicausality of complaints, through e.g. shift of focus, gradual return to daily activities, telephonic intervention);
C: Placebo, usual care, no treatment;
O: Symptoms and complaints, anxiety, reassurance, participation, quality of life.
Relevant outcome measures
The guideline development group considered post-concussion symptoms as a critical outcome measure for decision making; and anxiety, reassurance, participation and quality of life as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined a 10% difference for continuous outcome measures, 20% for dichotomous outcome measures informing on relative risk (0.8 ≤ RR ≥ 1.25), and 0.5 for Cohen’s d in standardized mean difference (-0.5 ≤ SMD ≥ 0.5) as minimal clinically (patient) important differences.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 1990 until February 1st 2022. The detailed search strategy can be found under the tab Methods. The systematic literature search resulted in 99 hits. Studies were selected based on the following criteria:
- Systematic review and/or meta-analysis, or randomized controlled trial (RCT);
- Included adult patients (18+);
- Described any type of psychoeducation as an intervention;
- Described placebo, usual care or no treatment as a comparison;
- Described at least one of the outcome measures as described in the PICO;
- Included at least 10 patients per treatment arm.
Twenty-one studies were initially selected based on title and abstract screening. After reading the full text, 20 studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One study was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- Bell KR, Fann JR, Brockway JA, Cole WR, Bush NE, Dikmen S et al. Telephone Problem Solving for Service Members with Mild Traumatic Brain Injury: A Randomized, Clinical Trial. J Neurotrauma. 2017 Jan; 34(2): 313-21. doi: 10.1089/neu.2016.4444. Epub 2016 Oct 13. PMID: 27579992. PMCID: PMC6436019.
- Hozo SP, Djulbegovic B, Hozo I. Estimating the mean and variance from the median, range, and the size of a sample. BMC Med Res Methodol. 2005 Apr 20;5:13. doi: 10.1186/1471-2288-5-13. PMID: 15840177; PMCID: PMC1097734.
- Kjeldgaard D, Forchhammer HB, Teasdale TW, Jensen RH. Cognitive behavioural treatment for the chronic post-traumatic headache patient: a randomized controlled trial. J Headache Pain. 2014 Dec; 15(1): 81. doi: 10.1186/1129-2377-15-81. PMID: 25441170. PMCID: PMC4266545.
- Teo SH, Fong KNK, Chen Z, Chung RCK. Cognitive and psychological interventions for the reduction of post-concussion symptoms in patients with mild traumatic brain injury: a systematic review. Brain Injury. 2020; 34(10): 1305-21. doi: 10.1080/02699052.2020.1802668. Epub 2020 Aug 10. PMID: 32772725.
- Vikane E, Hellstrøm T, Røe C, Bautz-Holter E, A?mus J, Skouen JS. Multidisciplinary outpatient treatment in patients with mild traumatic brain injury: A randomised controlled intervention study. Brain Inj. 2017; 31(4): 475-84. doi: 10.1080/02699052.2017.1280852. Epub 2017 Mar 15. PMID: 28296510
- Walter SD, Yao X. Effect sizes can be calculated for studies reporting ranges for outcome variables in systematic reviews. J Clin Epidemiol. 2007 Aug;60(8):849-52. doi: 10.1016/j.jclinepi.2006.11.003. Epub 2007 Mar 23. PMID: 17606182.
Evidence tabellen
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Teo, 2020 |
Yes |
No |
Yes |
Yes |
not applicable |
Yes |
Unclear: same patient population and outcome measures, but methodological heterogeneity |
No |
Yes, but no funding information reported. |
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Teo, 2020
|
SR and meta-analysis of RCTs
Literature search up to December 2017
A: Vikane, 2017 B: Kjeldgaard, 2014 C: Bell, 2017
Study design: RCT
Setting and Country: Hong Kong, Singapore
Source of funding and conflicts of interest: The authors report no conflict of interest. Information on funding not disclosed. |
Inclusion criteria SR: (1) RCTs with cognitive/ psychological interventions that focus on reduction of post-concussion symptoms; (2) patients ≥18 years with MTBI; (3) assessment of PCS using Rivermead Post-concussion symptoms questionnaire (RPQ) as primary outcome at 3-6 months; (4) English full text
Exclusion criteria SR: interventions not of cognitive and/or psychological nature
17 studies included
Important patient characteristics at baseline: Number of patients; age, time since injury, cause of injury
N, mean age A: 151 participants, age 32 (SD 16.6) B: 90 participants, age 34 (SD 11.3) C: 356 participants, age 29.4 (SD 7.2)
Sex: not reported
Groups comparable at baseline? not reported |
Describe intervention:
A: Psycho-education education group intervention once a week over 4 weeks and individual follow-ups throughout the first year (varied according to individual needs B: 9 weekly 2-hour sessions of CBT in group format C: 12 scheduled biweekly calls + educational brochures addressing problems common to MTBI
|
Describe control:
A: follow-up by GP B: no active treatment C: educational brochures addressing problems common to MTBI
|
End-point of follow-up:
A: 12 months B: 26 weeks C: 12 months
For how many participants were no complete outcome data available? (intervention/ control) A: 11/14 B: 10/8 C: 36/21
|
Post-concussive symptoms Defined as: posttraumatic complaints measured through RPQ.
Effect measure: mean difference [95% CI]: A: -7.50 [-10.77 to -4.23] B: 6.30 [0.39 to 12.21] C: -1.80 [-4.93 to 1.33]
Pooled effect (random effects model): multiplied with factor -1 1.42 [95% CI -5.19 to 38.03] favoring psychoeducation Heterogeneity (I2): 88%
Anxiety Effect measure: mean difference [95% CI]: Measured through HADS-A: A: 0 [-1.13 to 1.13]
Measured through GSI: B: 3.6 [-0.78 to 7.98] C: -0.50 [-2.97 to 1.97]
Reassurance No outcomes reported.
Participation A: expressed in return to work C: reported through SDS scores
Quality of Life Effect measure: standardized mean difference [95% CI]: B: -0.22 [0.69 to 0.24] C: -0.03 [-0.27 to 0.21]
Pooled effect (random effects model): -0.07 [95% CI -0.29 to 0.14] favoring no intervention. Heterogeneity (I2): 0% |
Brief description of author’s conclusion: “Current cognitive and psychological interventions for PCS showed a small effect size in functional outcomes for patients with MTBI at 6-month but there was no effect on symptom reduction”
Personal remarks on study quality: included studies were of relatively low quality, due to unclear allocation concealment, the lack of blinding of patients, therapists and assessors, no intention-to-treat analyses, underpowered for researched primary outcome, high amount of loss to follow up
There is significant heterogeneity between included studies, due to the difference in interventions (clinical) and the follow-up time (methodological).
|
Abbreviations: SR: systematic review, RCT: Randomized Controlled Trial, MTBI: mild traumatic brain injury, PCS: post concussive symptoms, CBT: cognitive behavioural therapy, GP: general practitioner,
Table of excluded studies from review of Teo (2020)
|
Reference |
Reason for exclusion |
|
Potter, 2016 |
Wrong intervention (including 12 weeks cognitive behavioural therapy) |
|
Scheenen, 2017 |
Acute MTBI patients and intervention <3 months after injury |
|
Bell, 2008 |
Acute MTBI patients and intervention <3 months after injury |
|
Matuseviciene 2013 |
Acute MTBI patients and intervention <3 months after injury |
|
Matuseviciene, 2016 |
Acute MTBI patients |
|
Varner, 2017 |
Acute MTBI patients |
|
Ghaffar, 2006 |
Acute MTBI patients |
|
Elgmark Andersson, 2007 |
Acute MTBI patients |
|
Silverberg, 2013 |
Acute MTBI patients |
|
Belanger, 2015 |
Mixgroup of acute and chronic MTBI patients |
|
Bomyea, 2017 |
Wrong intervention (psychotherapy) and wrong population (mild-moderate TBI) |
|
Twamley, 2014 |
Wrong population |
|
Wade 1998 |
Wrong population |
|
Vuletic, 2016 |
Same population as Bell, 2017 (which is included) |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Belanger HG, Barwick F, Silva MA, Kretzmer T, Kip KE, Vanderploeg RD. Web-based psychoeducational intervention for postconcussion symptoms: a randomized trial. Mil Med. 2015 Feb;180(2):192-200. doi: 10.7205/MILMED-D-14-00388. PMID: 25643387. |
Wrong population (mixgroup of acute and chronic MTBI patients) |
|
Belanger HG, Vanderploeg RD, Curtiss G, Armistead-Jehle P, Kennedy JE, Tate DF, Eapen BC, Bowles AO, Cooper DB. Self-efficacy predicts response to cognitive rehabilitation in military service members with post-concussive symptoms. Neuropsychol Rehabil. 2020 Jul;30(6):1190-1203. doi: 10.1080/09602011.2019.1575245. Epub 2019 Feb 15. PMID: 30764711. |
duplicate population (same as Cooper 2017) |
|
Bell KR, Brockway JA, Hart T, Whyte J, Sherer M, Fraser RT, Temkin NR, Dikmen SS. Scheduled telephone intervention for traumatic brain injury: a multicenter randomized controlled trial. Arch Phys Med Rehabil. 2011 Oct;92(10):1552-60. doi: 10.1016/j.apmr.2011.05.018. PMID: 21963122. |
Wrong population (moderate or severe TBI) |
|
Bell KR, Hoffman JM, Temkin NR, Powell JM, Fraser RT, Esselman PC, Barber JK, Dikmen S. The effect of telephone counselling on reducing post-traumatic symptoms after mild traumatic brain injury: a randomised trial. J Neurol Neurosurg Psychiatry. 2008 Nov;79(11):1275-81. doi: 10.1136/jnnp.2007.141762. Epub 2008 May 9. PMID: 18469027. |
Wrong population (patients <3 months after mTBI) |
|
Bell KR, Temkin NR, Esselman PC, Doctor JN, Bombardier CH, Fraser RT, Hoffman JM, Powell JM, Dikmen S. The effect of a scheduled telephone intervention on outcome after moderate to severe traumatic brain injury: a randomized trial. Arch Phys Med Rehabil. 2005 May;86(5):851-6. doi: 10.1016/j.apmr.2004.09.015. PMID: 15895327. |
Wrong population (moderate or severe TBI) |
|
Caplain S, Chenuc G, Blancho S, Marque S, Aghakhani N. Efficacy of Psychoeducation and Cognitive Rehabilitation After Mild Traumatic Brain Injury for Preventing Post-concussional Syndrome in Individuals With High Risk of Poor Prognosis: A Randomized Clinical Trial. Front Neurol. 2019 Sep 4;10:929. doi: 10.3389/fneur.2019.00929. PMID: 31551902; PMCID: PMC6737662. |
Wrong population (patients <3 months after mTBI) |
|
Cooper DB, Bowles AO, Kennedy JE, Curtiss G, French LM, Tate DF, Vanderploeg RD. Cognitive Rehabilitation for Military Service Members With Mild Traumatic Brain Injury: A Randomized Clinical Trial. J Head Trauma Rehabil. 2017 May/Jun;32(3):E1-E15. doi: 10.1097/HTR.0000000000000254. PMID: 27603763. |
Wrong control (psychoeducation) |
|
Cooper DB, Bunner AE, Kennedy JE, Balldin V, Tate DF, Eapen BC, Jaramillo CA. Treatment of persistent post-concussive symptoms after mild traumatic brain injury: a systematic review of cognitive rehabilitation and behavioral healicht THL interventions in military service members and veterans. Brain Imaging Behav. 2015 Sep;9(3):403-20. doi: 10.1007/s11682-015-9440-2. PMID: 26330376. |
Wrong population (mild and moderate TBI), more recent systematic review available. |
|
Dhandapani TPM, Garg I, Tara A, Patel JN, Dominic JL, Yeon J, Memon MS, Gergal Gopalkrishna Rao SR, Bugazia S, Khan S. Role of the Treatment of Post-Concussion Syndrome in Preventing Long-Term Sequela Like Depression: A Systematic Review of the Randomized Controlled Trials. Cureus. 2021 Sep 23;13(9):e18212. doi: 10.7759/cureus.18212. PMID: 34722025; PMCID: PMC8544623. |
Wrong study design (scoping review) |
|
Dobney DM, Miller MB, Tufts E. Non-pharmacological rehabilitation interventions for concussion in children: a scoping review. Disabil Rehabil. 2019 Mar;41(6):727-739. doi: 10.1080/09638288.2017.1400595. Epub 2017 Nov 20. PMID: 29157025. |
Wrong population (mean age <19 years) |
|
Hart T, Brockway JA, Whyte J, Bell KR, Neuberger S, Chervoneva I. Analyzing the ingredients of a telephone counseling intervention for traumatic brain injury. Disabil Rehabil. 2013 Sep;35(19):1668-75. doi: 10.3109/09638288.2012.751131. Epub 2013 Jan 22. PMID: 23336123. |
Wrong study design (retrospective analysis) |
|
Heslot C, Cogné M, Guillouët E, Perdrieau V, Lefevre-Dognin C, Glize B, Bonan I, Azouvi P. Management of unfavorable outcome after mild traumatic brain injury: Review of physical and cognitive rehabilitation and of psychological care in post-concussive syndrome. Neurochirurgie. 2021 May;67(3):283-289. doi: 10.1016/j.neuchi.2020.09.001. Epub 2020 Oct 10. PMID: 33049290. |
Wrong study design (non-systematic review) |
|
King EG, Kretzmer TS, Vanderploeg RD, Asmussen SB, Clement VL, Belanger HG. Pilot of a novel intervention for postconcussive symptoms in active duty, veterans, and civilians. Rehabil Psychol. 2013 Aug;58(3):272-9. doi: 10.1037/a0033116. Epub 2013 Jul 1. PMID: 23815304. |
Wrong study design (single-arm intervention) |
|
Kreutzer JS, Marwitz JH, Sima AP, Mills A, Hsu NH, Lukow HR 2nd. Efficacy of the resilience and adjustment intervention after traumatic brain injury: a randomized controlled trial. Brain Inj. 2018;32(8):963-971. doi: 10.1080/02699052.2018.1468577. Epub 2018 May 24. PMID: 29792533. |
Wrong population (mixgroup with moderate and severe TBI) |
|
Minen M, Jinich S, Vallespir Ellett G. Behavioral Therapies and Mind-Body Interventions for Posttraumatic Headache and Post-Concussive Symptoms: A Systematic Review. Headache. 2019 Feb;59(2):151-163. doi: 10.1111/head.13455. Epub 2018 Dec 1. PMID: 30506568. |
Wrong population (mixgroup of acute and chronic MTBI patients), more recent systematic review available. |
|
Samuelson KW, Engle K, Abadjian L, Jordan J, Bartel A, Talbot M, Powers T, Bryan L, Benight C. Cognitive Training for Mild Traumatic Brain Injury and Posttraumatic Stress Disorder. Front Neurol. 2020 Nov 26;11:569005. doi: 10.3389/fneur.2020.569005. PMID: 33324318; PMCID: PMC7726225. |
Wrong population (mixed group with mTBI en PTSD) |
|
Scheenen ME, Visser-Keizer AC, de Koning ME, van der Horn HJ, van de Sande P, van Kessel M, van der Naalt J, Spikman JM. Cognitive Behavioral Intervention Compared to Telephone Counseling Early after Mild Traumatic Brain Injury: A Randomized Trial. J Neurotrauma. 2017 Oct 1;34(19):2713-2720. doi: 10.1089/neu.2016.4885. Epub 2017 May 17. PMID: 28335664. |
Wrong population (patients <3 months after mTBI) |
|
Sullivan KA, Kaye SA, Blaine H, Edmed SL, Meares S, Rossa K, Haden C. Psychological approaches for the management of persistent postconcussion symptoms after mild traumatic brain injury: a systematic review. Disabil Rehabil. 2020 Aug;42(16):2243-2251. doi: 10.1080/09638288.2018.1558292. Epub 2019 Feb 11. PMID: 30741023. |
Wrong population (patients <3 months after mTBI), more recent systematic review available. |
|
Vanderploeg RD, Cooper DB, Curtiss G, Kennedy JE, Tate DF, Bowles AO. Predicting treatment response to cognitive rehabilitation in military service members with mild traumatic brain injury. Rehabil Psychol. 2018 May;63(2):194-204. doi: 10.1037/rep0000215. PMID: 29878826. |
duplicate population (overlap with Cooper 2017) |
|
Vikane E, Hellstrøm T, Røe C, Bautz-Holter E, Aßmus J, Skouen JS. Multidisciplinary outpatient treatment in patients with mild traumatic brain injury: A randomised controlled intervention study. Brain Inj. 2017;31(4):475-484. doi: 10.1080/02699052.2017.1280852. Epub 2017 Mar 15. PMID: 28296510. |
Included in systematic review of Teo, 2020 |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-03-2024
Beoordeeld op geldigheid : 11-03-2024
Algemene gegevens
In samenwerking met het Nederlands Huisartsen Genootschap.
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
De richtlijn is bestemd voor alle zorgverleners die betrokken zijn bij de diagnostiek, advisering of behandeling bij mensen met langer bestaande klachten (3 maanden) na licht traumatisch hoofd/hersenletsel, met name voor neurologen, revalidatieartsen en paramedici. De NHG-standaard Hoofdtrauma is leidend voor de huisartsen. Naast deze professionals is het van groot belang dat patiënten zelf ook weten waar ze in welk stadium met welke klachten terecht kunnen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten aanhoudende klachten na licht THL.
Werkgroep
- drs. E.W.J. Agterhof, revalidatiearts, VRA
- drs. A. Baars, ergotherapeut, EN
- prof. dr. C.A.M van Bennekom, revalidatiearts/manager, VRA
- dr. N.L. Frankenmolen, i.o. tot klinisch neuropsycholoog, NIP
- drs. P.A.W. Frima-Verhoeven, neuroloog BreinPoli, NVN
- drs. E.A. Goedhart, bondsarts/manager sportgeneeskunde, VSG
- drs. R. Grond, revalidatiearts, VRA
- drs. A. Hansma, huisarts, NHG
- drs. E. Jagersma, revalidatiearts, VRA
- prof. dr. G. Kwakkel, hoogleraar Neurorevalidatie AUMC, KNGF
- drs. S.M. de Lange, bedrijfsarts, NVAB
- mr. M.A.C. Lindhout, Beleidsmedewerker patiëntenvereniging Hersenletstel.nl
- prof. dr. J. van der Naalt, neuroloog, NVN
- prof. dr. R.W.H.M. Ponds, klinisch neuropsycholoog, NIP
- drs. J.M. Schuurman, revalidatiearts, VRA
- prof. dr. J.M. Spikman, klinisch neuropsycholoog, hoogleraar klinische neuropsychologie, NIP
- dr. Melloney Wijenberg, GZ-psycholoog i.o., afdeling neurologie, Adelante, NIP
Met ondersteuning van:
- drs. F. Ham, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- drs. A.A. Lamberts, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bennekom, van |
Revalidatiearts/ manager R&D, revalidatiecentrum Heliomare te Wijk aan Zee |
Bijzonder hoogleraar revalidatie en arbeid, AUMC te Amsterdam, lid WHR (onbetaald) |
Geen. |
Geen. |
|
Schuurman |
Revalidatiearts Stichting Klimmendaal Revalidatiespecialisten |
Lid WHR (onbetaald) |
Geen. |
Geen. |
|
Jagersma |
Revalidatiearts, Basalt Den Haag |
Voorzitter Werkgroep Hersenletsel Revalidatie (WHR) van de VRA (onbetaalde nevenfunctie) |
Geen. |
Geen. |
|
Agterhof |
Revalidatiearts en medisch manager (0,6 en 0,2) bij de Hoogstraat Revalidatie |
Lid WHR (onbetaald) |
Geen. |
Geen. |
|
Grond |
Revalidatiearts Basalt en HMC (0,4 fte en 0,4 fte). Gedetacheerd vanuit Basalt naar HMC |
Lid stafbestuur Basalt (onbetaald), Lid WHR (onbetaald) |
Geen. |
Geen. |
|
Naalt |
Neuroloog Universitair Medisch Centrum Groningen |
Vanuit expertise in de neurotraumatologie lid van diverse regionale en landelijke commissies, allen onbezoldigd. |
Er is geen financier die belangen heeft bij de uitkomst van de richtlijn. Lopend onderzoek gefinancierd onderzoek door derden betreft:
T-Scemo4all gesubsidieerd door de Hersenstichting: Sociale cognitie en sociaal gedrag verbeteren bij diverse hersenaandoeningen (start 2020). Rol: Medeaanvrager UMCG, nationale multicenter studie.
BRAIN-ReADAPT studie naar het effect van veroudering bij NAH- patienten gesubsidieerd door Zon-MW (start 2021). Rol: PI UMCG, nationale multicenter studie. |
Geen. |
|
Frima-Verhoeven |
Neuroloog bij stichting BreinPoli |
Advies opdrachten bij het CCE, gemiddeld één per anderhalf jaar, betaald. |
Geen. |
Geen. |
|
Goedhart |
Bondarts/ Manager sportgeneeskunde KNVB |
Adviseur Stichting Hersenschudding - onbetaald |
Geen. |
Geen. |
|
Lindhout |
Beleidsmedewerker bij patiëntenvereniging Hersenletstel.nl |
Bestuurslid bij CVA-Kennisnetwerk, onbetaald |
Geen. |
Geen. |
|
Kwakkel |
* Hoogleraar Neurorevalidatie AUMC |
Geen |
Geen. |
Geen. |
|
Hansma |
Huisarts |
Geen |
Geen. |
Geen. |
|
Lange, de |
AIOS bedrijfsgeneeskunde vierde jaar SGBO |
Geen |
Geen. |
|
|
Baars |
Ergotherapeut en mede-eigenaar Plan4 (ergotherapie praktijk in de 1e lijn) |
Voorzitter werkgroep ergotherapie en hersenletsel van Ergotherapie Nederland |
Geen. |
Geen. |
|
Wijenberg |
* Psycholoog, Afdeling Neurologie/ NAH, Adelante Revalidatiecentrum., Hoensbroek 0,8 fte * Docent, Faculty of Psychology and Neuroscience (PFN), Maastrciht University, Maastricht, 0,2 fte |
Bestuurslid Sectie Revalidatie, Nederlands Instituut van Psychologen (NIP), onbetaald
Ik geef les over neuropsychologische onderwerpen vanuit mijn functie als psycholoog bij Adelante (Adelante ontvangt hier een compensatie voor). Dit verricht ik voor meerdere partijen w.o. RINO Zuid, Pro-Education, Maastiricht Univeristy |
Geen. |
Geen. |
|
Frankenmolen |
* GZ-psycholoog in opleiding tot klinisch neuropsycholoog, Klimmendaal Revalidatiespecialisten - 27 uur per week. * Senior onderzoeker, Klimmendaal Revalidatiespecialisten - 8 uur per week |
* Docent Praktijkresearch voor de KP-opleiding bij het RCSW, Nijmegen (betaald) * Gastdocent 'Pain and Psychology' voor de opleiding psychologie van de Radboud Universiteit Nijmegen (betaald) * Lid werkgroep Onderzoek binnen de sectie Revalidatie van het NIP (onbetaald) |
Geen. |
Geen. |
|
Ponds |
* klinisch neuropsycholoog * Hoogleraar Medische Psychologie, VU * Hoofd afdeling Medische Psychologie, Amsterdam UMC |
* Voorzitter Nederlandse Vereniging voor Gezondheidszorgpsychologie (NVGzP), maandvergoeding * Bestuurslid TOP opleidingsplaatse, vacatiegeld * Bestuurslid PAON (post-acad. Opleiding klinisch neuropscycholoog), geen vergoeding * Bestuurslid P3NL, vacatiegeld |
Extern gefinancierd onderzoek: Hersenstichting - PsyMate: e-healicht THL interventue vermoeidheid na hersenletsel – projectleider |
Geen. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntvereniging Hersenletsel.nl te betrekken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop “Waarden en voorkeuren van patiënten”). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en Stichting hersenschudding.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Symptoomclusters en diagnostiek |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Beïnvloedbare factoren |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Psycho-educatie |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Psychotherapie |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
(Graded) physical activity |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Exposure |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Vestibulaire therapie en visuele training |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Sensorische integratie interventies |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Terugkeer naar werk |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Interdisciplinaire revalidatie |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
|
Organisatie van zorg |
Geen financiële gevolgen |
Gebruikmakend van het stroomschema komt de module uit op uitkomst 2 (geen financiele gevolgen). De omvang van de patiëntenpopulatie ligt tussen de 5.000 en 40.000. Er zijn voor de voorgestelde aanpassingen geen substantiële financiele investeringen nodig. |
Implementatie
Inleiding
Dit plan is opgesteld ter bevordering van de implementatie van de richtlijn aanhoudende klacht na licht THL. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het toepassen en naleven van de aanbevelingen. Daarbij heeft de richtlijncommissie een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die voor verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
• per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
• de verwachtte impact van implementatie van de aanbeveling op de zorgkosten;
• randvoorwaarden om de aanbeveling te kunnen implementeren;
• mogelijk barrières om de aanbeveling te kunnen implementeren;
• mogelijke acties om de implementatie van de aanbeveling te bevorderen;
• verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbevelingen is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord. Er kan een onderscheid worden gemaakt tussen “sterk geformuleerde aanbevelingen” en “zwak geformuleerde aanbevelingen”. In het eerste geval doet de richtlijncommissie een duidelijke uitspraak over iets dat zeker wel of zeker niet gedaan moet worden. In het tweede geval wordt de aanbeveling minder zeker gesteld (bijvoorbeeld “Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe meer uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”. Bij elke module is onderstaande tabel opgenomen.
|
Aanbeveling |
Tijdspad voor implementatie: 1 tot 3 jaar of > 3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
Overige opmerkingen |
|
|
|
|
|
|
|
|
|
1 Barrières kunnen zich bevinden op het niveau van de professional, op het niveau van de organisatie (het ziekenhuis) of op het niveau van het systeem (buiten het ziekenhuis). Denk bijvoorbeeld aan onenigheid in het land met betrekking tot de aanbeveling, onvoldoende motivatie of kennis bij de specialist, onvoldoende faciliteiten of personeel, nodige concentratie van zorg, kosten, slechte samenwerking tussen disciplines, nodige taakherschikking, et cetera.
2 Denk aan acties die noodzakelijk zijn voor implementatie, maar ook acties die mogelijk zijn om de implementatie te bevorderen. Denk bijvoorbeeld aan controleren aanbeveling tijdens kwaliteitsvisitatie, publicatie van de richtlijn, ontwikkelen van implementatietools, informeren van ziekenhuisbestuurders, regelen van goede vergoeding voor een bepaald type behandeling, maken van samenwerkingsafspraken.
3 Wie de verantwoordelijkheden draagt voor implementatie van de aanbevelingen, zal tevens afhankelijk zijn van het niveau waarop zich barrières bevinden. Barrières op het niveau van de professional zullen vaak opgelost moeten worden door de beroepsvereniging. Barrières op het niveau van de organisatie zullen vaak onder verantwoordelijkheid van de ziekenhuisbestuurders vallen. Bij het oplossen van barrières op het niveau van het systeem zijn ook andere partijen, zoals de NZA en zorgverzekeraars, van belang. Echter, aangezien de richtlijn vaak enkel wordt geautoriseerd door de (participerende) wetenschappelijke verenigingen is het aan de wetenschappelijke verenigingen om deze problemen bij de andere partijen aan te kaarten.
Implementatietermijnen
Voor “sterk geformuleerde aanbevelingen” geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Voor de meeste “sterk geformuleerde aanbevelingen” betekent dat dat zij komend jaar direct geïmplementeerd moeten worden en dat per 2023 dus iedereen aan deze aanbevelingen dient te voldoen.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met aanhoudende klachten na licht THL in de chronische fase. Tevens zijn er knelpunten aangedragen door de Nederlandse Vereniging voor Psychiatrie, Inspectie Gezondheidszorg en Jeugd, Koepels van zorginstellingen, Verpleegkundigen & Verzorgenden Nederland, Vereniging Innovatieve Geneesmiddelen, Nederlandse Associate Physician Assistants, Zorginstituut Nederland, Zorgverzekeraars Nederland, Vereniging van Oefentherapeuten Cesar en Mesendieck, CZ en Zilveren Kruis via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healicht THLcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healicht THLcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in healicht THL care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for healicht THL professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
23 |
13 |
24 |
|
RCTs |
54 |
43 |
58 |
|
Observationele studies |
(13) |
(13) |
17 |
|
Totaal |
77 (90) |
56 (69) |
99 |
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Brain Injuries, Traumatic/ or exp Brain Concussion/ or exp Head Injuries, Closed/ or exp Chronic Traumatic Encephalopathy/ or exp Post-Concussion Syndrome/ or (traumatic adj2 (brain or cerebral) adj2 (injur* or lesion*)).ti,ab,kf. or 'brain system trauma*'.ti,ab,kf. or ((brain or cerebral or cerebrovascular) adj2 trauma*).ti,ab,kf. or ((traumatic or posttraumatic) adj2 encephalopath*).ti,ab,kf. or ((postconcussion* or 'post concussion*') adj2 (syndrom* or symptom*)).ti,ab,kf. (58561) 2 (psychoeducat* or 'psycho educat*' or (telephon* adj2 (counsel* or consult*))).ti,ab,kf. or (management adj3 complaint*).ti,ab,kf. (10711) 3 1 and 2 (103) 4 limit 3 to ((english or dutch) and yr="1990-Current") (100) 5 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) (544872) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2218130) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (4058155) 8 4 and 5 (13) – SRs 9 (4 and 6) not 8 (43) - RCTs 10 (4 and 7) not (8 or 9) (13) - observationeel 11 8 or 9 or 10 (69) 12 8 or 9 (56)
|