C2 Gonorroe
C2 Gonorroe
C2.1 Algemeen
Gonorroe is een seksueel overdraagbare aandoening (soa) en wordt soms ook wel druiper genoemd. De verwekker Neisseria gonorrhoeae (Ng) ofwel de gonokok werd in 1879 aangetoond door Neisser en in 1882 voor het eerst gekweekt door Leistikov. Voor de komst van antibiotica was deze soa slecht te behandelen. Aanvankelijk waren de gonokokken gevoelig voor vele antibiotica. Langzamerhand ontstond resistentie tegen de gebruikte antibiotica door chromosomale mutaties en plasmiden met resistentiegenen.
C2.2 Ziekte
C2.2.1 Verwekker
De bacterie Neisseria gonorrhoeae (Ng) is een gramnegatieve, niet-beweeglijke en niet-sporenvormende diplokok met als enige reservoir de mens.
C2.2.2 Pathogenese
Gonokokken invaderen de epitheelcellen van slijmvliezen waarmee ze in contact komen. De pili van de gonokok bewerkstelligen aanhechting aan slijmvliezen van de tractus urogenitalis (vaak urethra- of cervixslijmvlies) gevolgd door opname van gonokokken in deze epitheelcellen.
Gonokokken vermenigvuldigen zich vervolgens intracellulair. Na ongeveer 2 à 3 dagen komen de bacteriën vrij in de submucosale weefsels. Op de plaats van de infectie verzamelen zich polymorfonucleaire granulocyten. Dit kan leiden tot kleine abcessen in de submucosa, met exsudaat en pusvorming. In sommige gevallen kan de bacterie zich direct of via de bloedbaan verplaatsen naar andere delen van het lichaam en aldus complicaties veroorzaken.
C2.2.3 Incubatieperiode
De incubatieperiode duurt doorgaans 2 dagen tot 3 weken (gemiddeld 5 dagen) (Korenromp, 2002). Na transmissie ontstaan bij mannen klinische symptomen van urogenitale gonorroe, bij 95% binnen 21 dagen. De langst beschreven incubatietijd bedroeg 57 dagen (Sherrard, 1996). Bij vrouwen bestaan hier geen gegevens over; wel is beschreven dat geïnfecteerde vrouwen 180 dagen na een contact met verhoogde kans op Ng asymptomatisch bleven (Nielsen, 1975). Bij 30-60% van vrouwen met urogenitale gonorroe en bij de meerderheid van orofaryngeale en rectale gonorroe (70-90%) blijft de infectie asymptomatisch (Morris, 2006).
C2.2.4 Ziekteverschijnselen
Bij de vrouw
Bij een groot deel van de vrouwen met urogenitale gonorroe treden nauwelijks of geen klachten op. Als er bij de vrouw klachten optreden, gaat het meestal om een toegenomen hoeveelheid vaginale afscheiding. Andere verschijnselen zijn tussentijds bloedverlies, pijn en branderigheid bij het plassen (dysurie). Complicaties bij de vrouw zijn bartholinitis en PID.
PID is de meest voorkomende complicatie van onbehandelde urogenitale gonorroe. PID is een ontsteking in het kleine bekken ten gevolge van verspreiding van micro-organismen, doorgaans vanuit de vagina en de cervix naar het endometrium, de tubae en aangrenzende structuren (zie hoofdstuk B4). Het is niet bekend hoe vaak een PID voorkomt na een onbehandelde gonorroe. Vrouwen met een PID kunnen klagen over pijn in de onderbuik, abnormale vaginale afscheiding, koorts en onregelmatige menstruaties. PID bij gonorroe kan ook symptoomloos verlopen en in een aantal gevallen op langere termijn leiden tot complicaties als verminderde vruchtbaarheid en EUG’s.
Minder dan de helft van de gevallen van PID wordt veroorzaakt door Chlamydia trachomatis (Ct) of Ng (Mitchell, 2021); schattingen van het aandeel veroorzaakt door Ng variëren tussen studies en hangen o.a. af van de gebruikte definitie van PID. Bij een klinische definitie en aangetoonde endometritis ligt het percentage van PID waarbij Ng in de hogere genitale tractus wordt aangetroffen tussen de 9 en 25%.
Bij de man
Bij de man staat urethritis op de voorgrond. Urethritisklachten ontstaan meestal binnen enkele dagen na de blootstelling. De klachten bestaan uit een branderig gevoel, pijn bij het plassen en een veelal pussende afscheiding, die gering maar ook heel hevig kan zijn (‘druiper’).
Complicaties bij de man zijn epididymitis, prostatitis en (bij chronische urethrale infectie) urethrale stricturen. Bij de man verloopt circa 10% van de urogenitale infecties asymptomatisch (Jungmann, 2004; Kent, 2005).
Bij neonaten
Bij neonaten kan een conjunctivitis ontstaan door besmetting met gonokokken tijdens passage door het geboortekanaal. Deze ontstaat sneller dan een infectie met Chlamydia trachomatis, meestal 3 dagen na de geboorte. Ook hier is onbehandeld het beeld snel progressief tot een keratitis met ulcus en corneaperforatie tot gevolg.
Bij man en vrouw
Anale infecties kunnen zowel bij mannen als bij vrouwen voorkomen. Symptomen van anale infectie zijn irritatie, jeuk en soms slijmerige afscheiding. In geval van anorectale gonorroe bij vrouwen is er meestal ook sprake van cervicale gonorroe. De meeste (tot 85%) anorectale gonorroe is asymptomatisch (Kent, 2005).
Faryngeale infecties kunnen ook zowel bij mannen als vrouwen optreden. Bij infectie van de keel is meestal sprake van geen of weinig uitgesproken klachten (Morris, 2006). Soms is er sprake van purulente faryngitis (Wiesner, 1973).
Middels onder andere (auto)inoculatie kan gonorroe een acute conjunctivitis veroorzaken met purulente uitvloed, pseudomembranen en gezwollen lymfeklieren. Onbehandeld kan het snel een keratitis tot gevolg hebben, soms gevolgd door een corneaperforatie.
Zowel bij de man als bij de vrouw komt het sporadisch voor dat gonokokken in de bloedbaan terecht komen (bacteriëmie) en een gegeneraliseerde infectie veroorzaken (Carlin, 2021; Klausner, 2022). De gonokokken kunnen dan op andere plaatsen in het lichaam terechtkomen en daar een infectie veroorzaken. Voorbeelden hiervan zijn een septische artritis, een zeer pijnlijke (meestal verspringende) polyartralgie in de extremiteiten, sepsis, endocarditis of meningitis.
Een andere ernstige, maar zeldzame complicatie van gonorroe is perihepatitis (syndroom van Fitz-Hugh-Curtis), een ontsteking van het leverkapsel die voornamelijk bij vrouwen voorkomt. Deze complicatie gaat gepaard met pijn in de rechterbovenbuik, koorts en verhoogde leverenzymen in het bloed.
Gonokokkenconjunctivitis en gonokokkenkeratitis (volwassenen)
Ooginfecties zoals conjunctivitis en keratitis als gevolg van een Ng-infectie nemen zowel in Nederland als in de rest van de wereld toe (Milligan, 2024). Het kan eenzijdige of bilaterale conjunctivitis, en in een deel van deze gevallen ook keratitis, veroorzaken. Dit is veelal een fulminant beeld met heftige purulente acute klachten en kan snel resulteren in cornea perforatie; Ng is een van de weinige bacteriën die het intacte epitheel van de cornea kan penetreren. Snelle diagnostiek en therapie zijn van uiterst belang: bij hoge klinische verdenking dient de patiënt met spoed (dezelfde dag) naar de oogarts doorverwezen en gezien te worden.
Er is weinig bekend over de antibioticagevoeligheidspatronen van de Ng-stammen die keratitis veroorzaken, hoewel dit van bijzonder belang is gezien de toenemende resistentie van deze organismen tegen de algemeen gebruikte antibiotica (Kate, 2021).
Zie paragraaf C2.9.1 voor de adviezen bij verdenking op en behandeling van gononokkokenconjunctivitis en gonokokkenkeratitis.
C2.2.5 Immuniteit
Een eerder doorgemaakte infectie met Ng resulteert niet in bescherming tegen herinfectie. Lokale antistoffen tegen Ng zijn wel gevonden in het slijmvliesepitheel, waardoor aanhechting van gonokokken mogelijk wordt verhinderd, maar de antistoffen verdwijnen zodra de infectie is verdwenen. Systemische antistoffen worden ook gevonden, maar deze blijken niet of slechts tijdelijk en partieel tegen herinfectie te beschermen. Infecties met gonokokken zijn doorgaans lokaal, maar sommige stammen kunnen een gegeneraliseerde infectie veroorzaken (Cartee, 2022). Ook deze gegeneraliseerde infecties resulteren niet in blijvende bescherming en immuniteit.
C2.3 Transmissie
C2.3.1 Reservoir
Alleen de mens.
C2.3.2 Transmissieroute
Transmissie vindt plaats via seksueel contact waarbij slijmvliezen met elkaar in aanraking komen. De belangrijkste verspreidingswegen zijn genitaal contact, te weten penis-vagina (genitogenitaal contact) en penis-anus (genito-anaal contact), en daarnaast orogenitaal (pijpen of beffen) of oro-anaal contact (rimmen). De transmissie kan zowel via insertief als receptief contact plaatsvinden. Anale infectie met gonorroe kan ook ontstaan door geïnfecteerde genitale secreta en hoeft niet altijd door anale seks te worden veroorzaakt. Ook is de verspreiding via de handen (bij vingeren en aftrekken) mogelijk. Daarnaast is infectie van de ogen door contact met infectieuze genitale secreta ook mogelijk.
Een tweede transmissieroute is perinataal (verticale transmissie). Tijdens de vaginale baring kan het kind worden geïnfecteerd. Meestal gaat het dan om een conjunctivitis gonorrhoica.
Australische onderzoekers hebben aannemelijk gemaakt dat transmissie van gonorroe via tongzoenen mogelijk is (Chow, 2019; Tran, 2022). Hoe vaak dat voorkomt en in welke mate deze transmissieroute bijdraagt aan de verspreiding van gonorroe is onduidelijk.
Ng infecteert in de meeste gevallen eerst het epitheel van de tractus urogenitalis. Primaire infectie van het rectum en de keel komen ook veel voor. Infectie van de ogen is in Nederland zeldzaam.
C2.3.3 Infectieuze periode
Gonorroe is tijdens de incubatietijd al besmettelijk. Vierentwintig uur na het einde van behandeling met antibiotica waarvoor de stam gevoelig is, is de besmettelijkheid voorbij.
Het is onduidelijk of de mate van overdraagbaarheid bij een asymptomatische infectie anders is dan bij een infectie waarbij zich wel klachten voordoen.
C2.3.4 Overdraagbaarheid
De transmissiekans is afhankelijk van de plaats van infectie, van het aantal seksuele contacten, en van de infectieuze dosis, maar is bij gonorroe over het algemeen hoog (Lycke, 1980; Cohen 1994).
De kans op transmissie bij eenmalig onbeschermd vaginaal seksueel contact is met behulp van een model geschat op 20% van vrouw naar man en op 50% van man naar vrouw. Voor MSM werd d.m.v. modellering de kans van urethraal naar rectaal op 80% geschat, van urethraal naar farynx op 60%. Van rectaal naar urethra werd uitgegaan van een kans van 2%, van farynx naar urethra 8% (Hui, 2015). Bij meer seksuele contacten met dezelfde partner zullen deze kansen toenemen tot ongeveer 50% bij vrouw naar man en 90% bij man naar vrouw.
Buiten het lichaam is de bacterie slechts kort levensvatbaar, onder andere door de grote gevoeligheid voor uitdroging. Dit is van belang bij het transport van voor kweek aangeboden materialen.
C2.4 Diagnostiek
C2.4.1 Klinische diagnostiek
Zie paragraaf C2.2.4.
C2.4.2 Microbiologische diagnostiek
- NAAT (nucleïnezuuramplificatietest);
- kweek (plus resistentiebepaling);
- grampreparaat of methyleenblauwkleuring (alleen bij mannen, sneldiagnostiek).
NAAT
Mannen
NAAT van de eerstestraals urine is de eerste keus om urogenitale gonorroe bij mannen aan te tonen of uit te sluiten. Als alternatief kan gekozen worden voor NAAT van pus uit de urethra; een urethra-uitstrijk (onaangenaam en pijnlijk) voor diagnostiek middels NAAT wordt afgeraden. Bij MSM dient routinematig op 3 locaties getest te worden (urethra, orofarynx en rectaal).
Vrouwen
Bij vrouwen is de eerste keus NAAT van materiaal diep vaginaal door de patiënt zelf afgenomen (zelfswab) (Hoebe, 2006). Bij vaginaal onderzoek kan materiaal van de cervix afgenomen worden door de zorgverlener. De zelfswab heeft de voorkeur, vanwege de patiëntvriendelijkheid. In een vergelijking bleek dat de sensitiviteit van de NAAT op materiaal van de diep vaginaal afgenomen wattenstok voor Ng 100% was, terwijl die van de endocervixswab 95% bedroeg (Fang, 2008). Een ander onderzoek vond bij gebruik van een Aptima-assay een sensitiviteit van 96% bij beide materialen (Schachter, 2005). Een mogelijke tweede keus bij vrouwen is een NAAT (of kweek) van eerstestraals urine. Bij vrouwen wordt diagnostiek op eerstestraals urine echter als minder sensitief beschouwd en daarom ontraden (Bignell, 2011; Cook, 2005).
Mannen en vrouwen
Bij anamnestische blootstelling (receptief anale en/of orale seks) en/of klachten kan zowel bij mannen als bij vrouwen een uitstrijk van keel en/of proctum en/of conjunctiva voor NAAT worden afgenomen (Moncada, 2009). De tweede keus is een kweek.
De sensitiviteit van de NAAT is hoger dan van de kweek, waarbij het wel uitmaakt welke NAAT op welk materiaal wordt gebruikt (Luyt, 2005; Schachter, 2008). De specificiteit van de huidige generatie NAAT ligt bij urogenitale monsters hoog en benadert voor sommige NAAT’s de 100% (Masek, 2009; Maze, 2011). RNA en DNA kunnen nog steeds aanwezig zijn na succesvolle behandeling, en het aantonen ervan d.m.v. een NAAT te snel na behandeling geeft dan ook geen uitsluitsel over het al dan niet persisteren van de infectie (Wind, 2016). Voor NAAT’s die RNA detecteren kan bij urogenitale infecties vanaf één week na behandeling opnieuw getest worden; en bij orofaryngeale infecties na twee weken (Barbee, 2022). Voor NAAT’s die DNA detecteren kan bij urogenitale infecties pas vanaf twee weken na behandeling opnieuw getest worden (Wind, 2016); de termijn waarop bij orofaryngeale infecties met DNA-gebaseerde NAAT’s een ‘test-of-cure’ kan worden gedaan is onbekend. Voor specifieke NAAT’s kan dit afwijken; raadpleeg hiervoor eventueel de arts-microbioloog of medisch moleculair microbioloog van het laboratorium.
Commerciële NAAT’s zijn doorgaans gevalideerd voor urogenitale materialen. Wanneer deze testen door laboratoria ook voor diagnostiek op proctum- en keeluitstrijken gebruikt worden, is het de verantwoordelijkheid van het uitvoerend laboratorium om te valideren of een confirmatietest na een uitgevoerde NAAT nog noodzakelijk is. Schachter et al. (2008) beschrijven een specificiteit van de Strand Displacement Assay (BD) en de Aptima Combo 2 (Genprobe, tegenwoordig Hologic) voor deze materialen van meer dan 99%. Maar ook bij een specificiteit van meer dan 99% kunnen toch foutpositieve resultaten voorkomen (afhankelijk van de in het laboratorium gebruikte NAAT). Bij grote consequenties van een positief testresultaat (bijvoorbeeld bij verdenking van seksueel misbruik bij kinderen (D2)) kan een confirmatietest toch zeer wenselijk zijn (Tielemans, 2022).
Kweek
Een positieve kweek is bewijzend voor gonorroe, maar een kweek is minder gevoelig dan NAAT. Een kweek op Ng met resistentiebepaling dient in elk geval te worden verricht bij aanhoudende klachten na behandeling. In het licht van de toenemende frequentie van stammen die verminderd gevoelig zijn voor derdegeneratie-cefalosporinen (zie paragraaf C2.6.2) verdient het aanbeveling om bij elke patiënt met door NAAT aangetoonde gonorroe ook te kweken voor resistentiebepaling. De gevoeligheid van kweken varieert tussen anatomische locaties: de gevoeligheid is het grootst bij urethra-materiaal (86%), minder bij de anus (55%) en cervix (50%), en het minste bij de keel (26%) (Kayaert, 2023).
Optimaal is dat het afgenomen materiaal bij kamertemperatuur getransporteerd en bewaard wordt en binnen 6 uur in het microbiologisch laboratorium wordt verwerkt, omdat bij langere transporttijden de gevoeligheid van de kweek drastisch afneemt.
Indien de transporttijd naar het laboratorium langer is dan 6 uur kan (naast materiaal voor NAAT) een extra wattenstok afgenomen worden en verzonden worden in e-swabmedium. Het is ook mogelijk een e-swab in versgeloosde urine te dopen en daarna in e-swabmedium te transporteren. Afhankelijk van transporttijd (24 of 48 uur) en materiaal (urine geeft betere resultaten dan rectale en cervicale uitstrijken) is de sensitiviteit van een binnen 48 uur ingezette kweek nog 50-90% (Wind, 2015). Zo is het dus mogelijk om een kweek te verrichten bij alle symptomatische Ng en alle aangetoonde Ng bij patiënten met een hoge kans op soa’s die gezien worden bij de CSG en in de tweede lijn.
Grampreparaat of methyleenblauwkleuring
Grampreparaat of methyleenblauwkleuring van urine of urethraswab bij mannen met urethraal ecoulement toont intracellulaire (gramnegatieve) diplokokken in neutrofiele granulocyten en heeft in dergelijke gevallen een goede sensitiviteit. Bij vrouwen daarentegen heeft het directe preparaat van cervicale of vaginale materialen een geringe sensitiviteit en specificiteit voor de diagnostiek van gonorroe. Het gebruik ervan wordt daarom afgeraden bij vrouwen. Ook bij anale secreten hebben gram- en methyleenblauwpreparaten een geringe sensitiviteit en specificiteit.
Overwegingen bij keuze diagnostiek
Bij gedissemineerde gonorroe is kweek en/of NAAT van pustels, bloed, synoviale vloeistof of liquor geïndiceerd.
Wanneer men bij een persoon gonorroe wil uitsluiten na een contact met verhoogde kans om Ng te hebben opgelopen, moet men rekening houden met de incubatietijd; in deze windowfase is een foutnegatieve uitslag mogelijk. Het is onbekend of na een contact de NAAT voor Ng al positief wordt voordat er klachten ontstaan. Een andere vraag is hoe lang asymptomatische gonorroe kan persisteren. Voor de praktijk geldt: wanneer het contact (met verhoogde kans om Ng te hebben opgelopen) langer geleden is en de persoon nog geen klachten heeft, is het zinvol om tot 3 maanden na dit contact te testen op asymptomatische urogenitale gonorroe bij mannen en vrouwen, en op indicatie op orofaryngeale en rectale gonorroe.
C2.4.3 Overige diagnostiek
Serologie
Serologische bepalingen bij de diagnostiek van een infectie met Ng zijn niet zinvol.
Thuisafnametesten/zelftesten
Er zijn (onder andere via internet) ook commerciële (zelf)testen beschikbaar waarbij de afname thuis kan worden gedaan. Bij sommige van deze testen dient het afgenomen materiaal naar een erkend laboratorium te worden gestuurd voor diagnostiek (thuisafnametesten); bij andere testen kan het testresultaat direct thuis worden afgelezen (zelftesten). De betrouwbaarheid van deze laatste categorie is vooralsnog onvoldoende gevalideerd. Soa Aids Nederland heeft een publiek toegankelijke testwijzer waarin verwezen wordt naar zowel aanbieders van soa-thuisafnametesten als hiv-zelftesten die tegen een vaste set criteria getoetst zijn ( https://www.soaaids.nl/nl/soa-test/soa-thuistest).
C2.5 Sleutelpopulatie
C2.5.1 Verhoogde kans op infectie
Sleutelpopulaties zijn MSM, personen die een partnernotificatie ontvingen, personen die klachten hebben passend bij gonorroe, sekswerkers, en migranten of kinderen van migranten afkomstig uit gebieden met hoge prevalentie. Onder gebieden met hoge prevalentie vallen: Suriname, de voormalige Nederlandse Antillen, Turkije, Marokko, Afrika, Zuid-Amerika, Azië en Oost-Europa.
C2.5.2 Verhoogde kans op ernstig beloop
Bij instrumentele intra-uteriene ingrepen, waarbij de cervixbarrière wordt doorbroken (abortus, plaatsing van een spiraaltje), is de kans verhoogd op het opstijgen van een cervicale Ng-infectie en complicaties. Infectie tijdens de zwangerschap kan resulteren in een septische abortus, chorioamnionitis, te vroeg gebroken vliezen en postpartumendometritis.
Factoren die de kans vergroten op gedisseminieerde gonorroe zijn complement-deficiënties en gebruik van eculizumab (Cartee, 2022).
C2.6 Epidemiologie
C2.6.1 Verspreiding in de wereld
Van de geschatte 220 miljoen incidente bacteriële seksueel overdraagbare infecties in 2016 betroffen 87 miljoen gevallen gonorroe (Rowley, 2019). In 2018 werden in Europa 100.673 infecties gerapporteerd aan het ECDC. Gonorroe werd in Europa drie keer zo vaak bij mannen gediagnosticeerd. Bijna de helft van alle Europese infecties werd bij MSM gevonden (ECDC, 2020).
Europese data over 2019 van Euro-GASP lieten zien dat 0,9% van isolaten resistent waren tegen cefixim (MIC >0,125 mg/L); in de vijf voorgaande jaren was dat stabiel tussen 1,4% en 2,1% geweest van 2014 tot 2018 met een stabiel aantal landen dat ten minste één resistente stam rapporteerde (n=14). Resistentie tegen ceftriaxon blijft in Europa vooralsnog uiterst zeldzaam. Het aantal ceftriaxonresistente isolaten in Europa was 3 in 2019, op een getest aantal van bijna 4200 monsters (ECDC, 2021).
Resistentie tegen ceftriaxon is in het buitenland, ook in Europa, sporadisch vastgesteld (Pinto, 2020; Public Health England, 2022; Pleininger, 2022; Unemo, 2021), maar in Nederland nog niet (De Greeff, 2022; Van Wees, 2022). In China komt resistentie tegen ceftriaxon inmiddels frequent voor (Yan, 2021). In een single study werd 30% resistentie gezien. Er bestaat een reëel risico dat in de toekomst ook ceftriaxon niet meer als eerste keus kan worden ingezet. In China worden met hoge doseringen ceftriaxon overigens nog wel goede therapeutische resultaten gezien (Han, 2020).
C2.6.2 Voorkomen in Nederland
Naast de bijna 8.000 gonorroe-infecties die jaarlijks bij de Centra voor Seksuele Gezondheid (CSG) worden opgespoord, worden elk jaar naar schatting ook nog eens 14.300 gonorroe-infecties door huisartsen gevonden (Van Wees, 2022). Het aantal nieuwe gevallen van gonorroe in Nederland stijgt al meer dan 10 jaar. Het aantal diagnoses is sinds 2019 ook toegenomen doordat mensen die hiv-PrEP gebruiken 4 maal per jaar worden getest voor bacteriële soa’s; er worden dan ook vaker soa’s, waaronder gonorroe, gevonden.
In Nederland wordt gonorroe vaker bij mannen dan bij vrouwen vastgesteld. De verhouding man-vrouw is ongeveer 9:1, vooral door de hoge frequentie onder MSM. In 2021 werd 58% van de in totaal 7842 diagnoses in de CSG gesteld bij consulten met MSM in de ASG-regeling, 26% bij consulten met MSM in de Nationale PrEP-pilot, 5% bij heteroseksuele mannen, en 11% bij vrouwen. (Van Wees, 2022). Bij MSM steeg zowel het absolute aantal opgespoorde gevallen van gonorroe als het percentage positieve testen in de periode 2008-2021. In 2022 nam het aantal gonorroediagnoses bij de CSG’s met 33% toe ten opzichte van 2021. Deze toename was het sterkst bij vrouwen (van 831 naar 1.458; +75%) en heteroseksuele mannen (van 421 naar 666; +58%), met name in de tweede helft van 2022 (RIVM, april 2023).
Resistentieontwikkeling in Nederland
Tot nu toe wist Ng na kortere of langere tijd resistentie te ontwikkelen tegen alle gebruikte antibiotica (Koedijk, 2010; Peerbooms, 2001; Van Dam, 2014). Daarom is het zeer wel mogelijk dat het slechts een kwestie van tijd is eer ook resistentie tegen het enige nog empirisch effectief te gebruiken middel (ceftriaxon) ontstaat (Unemo, 2019).
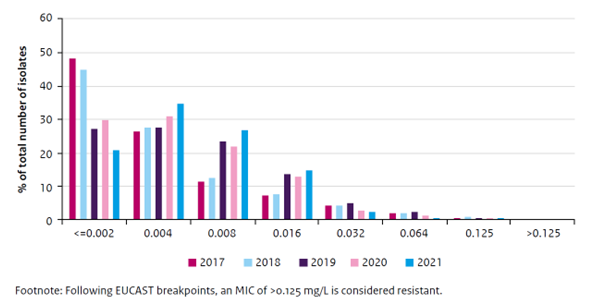
In Nederland bestaat een continue landelijke resistentiesurveillance onder het acroniem GRAS (gonokokkenresistentie tegen antibioticasurveillance) (Visser, 2022). Ongeveer twee derde van de CSG’s, bij elkaar goed voor >80% van de gonorroediagnosen bij CSG’s, participeerde in 2021 in GRAS. Het aantal infecties waarbij een resistentiepatroon was bepaald is al jaren stabiel op 40% van alle gediagnosticeerde gonorroe (Van Wees, 2022). In Nederland is nog geen resistentie tegen ceftriaxon is vastgesteld, maar wel neemt de gemiddelde MIC (minimum inhibitory concentration) gestaag toe (zie Figuur 4). Therapiefalen na gebruik van ceftriaxon is in Nederland nog niet gerapporteerd, maar wel elders in Europa (Pinto, 2020; Public Health England, 2022; Pleininger, 2022; Unemo, 2021; ECDC, 2020; ECDC, 2021).
Figuur 4: MIC (= minimum inhibitory concentration) distributie voor ceftriaxon in Nederland, 2017-2021. Bron: Van Wees, 2022.
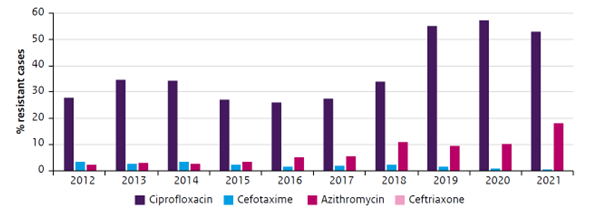
De resistentie tegen ciprofloxacine is de laatste jaren weer toegenomen, tot 53% in 2021. Resistentie tegen azitromycine is de laatste jaren gestaag gestegen, tot 18% in 2021 (zie Figuur 5; De Greeff, 2022).
Figuur 5: Gonokokkenresistentie (volgens EUCAST breakpoints) in Nederland; proportie van resistente gevallen, 2012-2021. Bron: Van Wees, 2022.
Omdat het afkappunt voor azitromycine waarop een stam als gevoelig of resistent werd beoordeeld zoals vastgesteld door het European Committee on Antimicrobial Susceptibility Testing (EUCAST) binnen de verdeling van de MIC’s van natuurlijk voorkomende stammen ligt, geeft EUCAST nu geen breekpunt meer voor azitromycine. Wel geeft EUCAST een ‘epidemiologische cut-off’ (ECOFF) van 1 mg/ml aan (EUCAST, 2024). Er zijn relatief veel stammen met een MIC op of boven deze ECOFF, passend bij verworven resistentiemechanismen. De continue toename van de MIC over de tijd ondersteunt echter de observatie dat Ng in Nederland in toenemende mate resistentiemechanismen tegen macroliden heeft verworven (Hofstraat, 2016; De Greeff, 2022), waarmee het inzetten van azitromycine als reservemiddel niet opportuun is.
Zolang er geen alternatief middel beschikbaar is, is vroegopsporing van eventuele verminderd gevoelige en resistente stammen essentieel om verspreiding te voorkomen en tijd te winnen. Het is van belang dat de winst in de bestrijding van gonorroe die behaald is door de snelle en sensitieve NAAT-diagnostiek, niet verloren gaat door het niet meer beschikbaar zijn van kweken voor gevoeligheidsbepalingen, waardoor resistentie pas na verspreiding zal blijken. Gevoeligheidsbepalingen o.b.v. kweek zijn essentieel om te bepalen of huidige behandelrichtlijnen nog voldoen of moeten worden bijgesteld.
C2.7 Preventie
C2.7.1 Immunisatie
Een vaccin tegen gonorroe is niet beschikbaar. Er is enige bescherming aangetoond van sommige vaccins gericht tegen meningokokken-B (Abara, 2022; Marshall, 2022; Petousis-Harris, 2017; Whelan, 2016). Nader onderzoek naar het beschermende effect tegen gonorroe loopt. Op dit moment wordt vaccinatie met meningokokken-B-vaccin om gonorroe te voorkomen niet aanbevolen.
C2.7.2 Algemene preventieve maatregelen
Vermijden dat geïnfecteerde urethrale, vaginale of anale excreten van de ene partner in aanraking komen met het slijmvlies van de andere partner.
Seksuele overdracht van gonorroe kan sterk worden verminderd door het gebruik van condooms en/of beflapjes. Verschillende factoren kunnen van invloed zijn op het al dan niet gebruiken van een condoom (attitude, gedrag, vaardigheden). Het is van belang om deze te bespreken tijdens counseling (zie hoofdstuk D3).
C2.7.3 Desinfectie
Niet van toepassing.
C2.8 Maatregelen
C2.8.1 Meldingsplicht
Voor individuele gevallen bestaat geen meldingsplicht. Sinds december 2008 geldt voor alle artsen een meldplicht aan de GGD als zij een voor hun praktijk ongewoon aantal gevallen van gonorroe vaststellen, als die een gevaar vormen voor de volksgezondheid (Wet Publieke Gezondheid, Hfdst V, paragraaf 2, Artikel 21.3).
C2.8.2 Contactonderzoek en partnernotificatie
Zie hoofdstuk D3 voor partnernotificatie en partnerbehandeling. In paragraaf D3.7 zijn tevens per soa (Tabel 10) en per syndroom (Tabel 11) de volgende zaken samengevat: wie en periode van inlichten, overdraagbaarheid na behandeling, advies seksuele onthouding en management sekspartner(s).
C2.8.3 Maatregelen ten aanzien van patiënt en contacten
Zie hoofdstuk D3 voor partnernotificatie en partnerbehandeling. In paragraaf D3.7 zijn tevens per soa (Tabel 10) en per syndroom (Tabel 11) de volgende zaken samengevat: wie en periode van inlichten, overdraagbaarheid na behandeling, advies seksuele onthouding en management sekspartner(s).
Zie het stroomschema voor de keuze van directe behandeling en follow-up bij partners in paragraaf D3.6.
Voorlichting
Het is van belang dat er zo snel mogelijk een gesprek wordt gehouden met de patiënt en voorlichting wordt gegeven over de transmissieroute, de infectieuze periode, de overdraagbaarheid, behandeling en preventie. Daarnaast is het belangrijk om gedragsverandering te ondersteunen door counseling. Motivational interviewing kan hierbij een goed hulpmiddel zijn.
C2.9 Behandeling
C2.9.1 Primaire behandeling
Geadviseerd wordt om behandeling te starten als een van de onderstaande diagnostische testen positief is:
- een positieve amplificatietest (NAAT);
- een positieve kweek;
- een positief grampreparaat/methyleenblauwkleuring van urinesediment of urethrale purulente ecoulement bij mannen (cave: foutpositieve testuitslag ten gevolge van aanwezigheid van andere Neisseriaceae) (Leeman, 1996).
Behandeling kan eveneens worden gestart na afname van materiaal voor diagnostiek bij:
- syndroommanagement van een persoon met urethritisklachten (dysurie en/of exsudaat) bij een eerste visite (zie hoofdstuk B1);
- sekspartner(s), zie hiervoor het stroomschema voor de keuze van directe behandeling en follow-up bij sekspartners in paragraaf D3.6.
Bij hoge verdenking op gonokokkenconjunctivitis op basis van het klinisch beeld dient de patiënt met spoed (dezelfde dag) naar de oogarts doorverwezen en gezien te worden voor microbiologische diagnostiek en uitsluiten gonokokkenkeratitis. Behandeling verloopt via de oogarts, zie onderstaand voor uitgebreid beleid en behandeling.
Aanbevolen behandeling van gonorroe
Bij een klinisch verdachte urethrale/anale gonorroe:
- ceftriaxon 500 mg i.m., eenmalig; poeder (500 mg) voor i.m. injectie oplossen in 2 ml lidocaïnehydrochloride 10 mg/ml (1%) oplossing (pijnpreventie).
Soms zijn ampullen à 500 mg niet leverbaar of voorradig; in dat geval kan 1000 mg i.m. gegeven worden. Het wordt afgeraden een dosering van 1000 mg te delen, omdat er mogelijk ongelijke deling plaatsvindt (en dus mogelijk te lage dosering), en vanwege mogelijke verwisselingen en kruisbesmettingen.
Bij klinisch verdachte of bewezen faryngeale gonorroe:
- ceftriaxon 1000 mg i.m., eenmalig; poeder (1000 mg) voor i.m. injectie oplossen in 3,5 ml lidocaïnehydrochloride 10 mg/ml (1%) oplossing (pijnpreventie).
Indien patiënt reeds behandeld is met ceftriaxon 500 mg, dan is nieuwe behandeling niet noodzakelijk maar wordt nacontrole middels NAAT geadviseerd na 3 weken.
Contra-indicaties voor het geven van ceftriaxon:
- absolute contra-indicatie: ernstige onmiddellijke of vertraagde allergische reactie op ceftriaxon of een cefalosporine met een vergelijkbare zijketen;
- relatieve[1] contra-indicatie: een voorgeschiedenis van ernstige overgevoeligheid (zoals een anafylactische reactie) voor andere bètalactamantibiotica (d.w.z. een penicilline, monobactam of carbapenem).
[1] De kruisactiviteit met cefalosporinen in patiënten met gerapporteerde penicilline-allergie is ongeveer 1%. Zie voor aanbevelingen: ‘SWAB guideline for the approach to suspected Antibiotic Allergy’.
Sommige internationale richtlijnen (o.a. Australië en IUSTI-Europe) bevelen een combinatie van cefalosporinen en azitromycine aan als eerste keus voor de behandeling van ongecompliceerde gonorroe (Unemo, 2020; ASHM, 2022). Andere internationale richtlijnen (m.n. van de VS en het VK) die voorheen ook deze combinatie aanraadden, zijn in hun meest recente versie daarop teruggekomen en raden nu weer ceftriaxonmonotherapie aan (Workwoski, 2021; Fifer, 2020). Ook voor Nederland raadt deze richtlijn combinatietherapie niet aan, vanwege:
- het vooralsnog uitblijven van gerapporteerde ceftriaxonresistentie en/of therapiefalen na ceftriaxonbehandeling in Nederland;
- het gebrek aan bewijs dat combinatietherapie effectief is voor de behandeling van ceftriaxonresistente Ng;
- het gebrek aan bewijs dat combinatietherapie effectief is in het vertragen of voorkomen van de verspreiding van gonorroeresistentie; en
- de al relatief hoge resistentie tegen azitromycine in Nederland (al jaren ver boven de 5% die WHO als afkappunt hanteert om een middel niet meer empirisch in te zetten).
Alternatieve behandeling van gonorroe
Indien ceftriaxon niet beschikbaar is, is een goed alternatief:
- cefotaxim 1000 mg i.m., eenmalig.
Alleen op geleide gevoeligheidsbepaling (kweek of moleculair):
- ciprofloxacine 500 mg p.o., eenmalig.
Tweede keuze bij absolute contra-indicatie voor ceftriaxon i.m. (en dus ook voor cefotaxim i.m.) en ontbreken van resistentiepatroon van de stam:
- azitromycine, 2000 mg p.o., eenmalig (4 tabletten van 500 mg).
Hoewel deze behandeling in het verleden bewezen effectief was (Handsfield, 1994) is intussen resistentie voor azitromycine en therapiefalen beschreven. In Nederland lag het resistentiepercentage in 2021 op 18% en het is niet onaannemelijk dat dit verder toeneemt. Daarnaast zijn de gastro-intestinale bijwerkingen bij deze dosering aanzienlijk groter dan na een dosering van 1 g, maar deze laatste dosering is niet bewezen effectief. Na orale behandeling met azitromycine is een controle middels NAAT vanaf 1 à 2 weken na behandeling geïndiceerd, afhankelijk van welke test gebruikt wordt. - ertapenem, 1000 mg i.m., eenmalig.
Recent heeft een Nederlandse RCT de effectiviteit van ertapenem voor behandeling van Ng aangetoond (De Vries, 2022). Het is echter onbekend of ertapenem ook effectief is tegen stammen met resistentie tegen ceftriaxon.
In de meest recente IUSTI/WHO-richtlijn worden als alternatieve therapie bij ceftriaxon-therapiefalen de volgende combinaties geadviseerd (Unemo, 2020):
- combinatie van ceftriaxon 1000 mg i.m., eenmalig en azitromycine 2000 mg p.o., eenmalig;
- combinatie van gentamicine 240 mg i.m., eenmalig en azitromycine 2000 mg p.o., eenmalig;
- combinatie van spectinomycine (in Nederland niet verkrijgbaar) 2000 mg i.m., eenmalig en azitromycine 2000 mg p.o., eenmalig.
De combinatie van gentamicine 240 mg plus azithromycine 2 g voor de behandeling van anogenitale en orofaryngeale gonorroe was zeer effectief (100% [95%CI 95–100%] in twee recente RCT’s (Rob, 2020; Kirkcaldy, 2014; Unemo, 2020). De combinatie gentamicine 240 mg met azitromycine 1g bleek in een grote Engelse RCT minder effectief (91%) (Ross, 2019). Indien een kweek beschikbaar is, kan een antibioticum geselecteerd worden waar Ng nog wel gevoelig voor is. NB: Er zijn geen EUCAST-breekpunten voor ertapenem, azitromycine en gentamicine.
Behandeling van kinderen
Behandeling voor gonorroe bij kinderen kan worden overwogen als er een verhoogde kans op infectie bestaat, bijvoorbeeld bij seksueel misbruik waarbij de dader mogelijk besmet is, als testen niet kunnen worden gedaan of worden geweigerd, als niet wordt verwacht dat het kind terugkomt voor behandeling, of als tijdens de follow-up klachten zijn ontstaan (Woods, 2005).
De behandeling van kinderen <18 jaar in geval van gonorroe bestaat uit:
- ceftriaxon 50 mg/kg i.m., eenmalig, maximaal 500 mg.
In het geval van gedissemineerde gonorroe:
- ceftriaxon 50 mg/kg/24 uur i.v. (maximaal 1 gram/24 uur), gedurende 7 dagen.
Behandeling van gonokokkenconjunctivitis bij volwassenen
Bij hoge klinische verdenking op gonokokkenconjunctivitis (heftig en acuut purulent beeld) dient de patiënt met spoed (dezelfde dag) naar de oogarts doorverwezen en gezien te worden voor (aanvullende) microbiologische diagnostiek, behandeling en uitsluiten gonokokkenkeratitis. Een kweek met resistentiebepaling, NAAT en grampreparaat (cito) dienen te worden aangevraagd door de oogarts. Geadviseerd wordt om behandeling te starten zodra een van deze diagnostische testen positief is.
Behandeling:
- ceftriaxon 500 mg i.m., eenmalig;
- lokale ooglidhygiëne (ieder uur);
- lokale behandeling: omdat gonokokkenconjunctivitis niet vaak voorkomt en gegevens over de bij volwassenen beperkt is, overleg met een internist-infectioloog en/of arts-microbioloog of lokale behandeling moet worden gestart.
Behandeling van gonokokkenkeratitis bij volwassenen
Bij hoge klinische verdenking op gonokokkenkeratitis (heftig en acuut purulent beeld, pijn, lichtschuwheid) dient de patiënt met spoed (dezelfde dag) naar de oogarts doorverwezen en gezien te worden voor (aanvullende) microbiologische diagnostiek en behandeling van de (eventuele) keratitis. Een kweek met resistentiebepaling, NAAT en grampreparaat (cito) dienen te worden aangevraagd door de oogarts.
Behandeling:
- start bij verdenking op gonokokkenkeratitis, na afname van diagnostiek en ook zonder zonder dat deze diagnostiek bekend is, per direct met ofloxacine oogdruppels, ieder uur;
- start met ceftriaxon 500 mg i.m., eenmalig, zodra één van de diagnostische testen positief is. Benadrukt moet worden dat een gram-preparaat dat gram-negatieve diplokokken aantoont in combinatie met typische symptomen voldoende is om de behandeling met systemische antibiotica te starten;
- de (topicale) behandeling met antibiotica kan worden aangepast op geleide van het resistentiepatroon, zodra deze beschikbaar is. Stem zo nodig de keuze voor antibiotica af met internist-infectioloog, arts-microbioloog en de apotheker;
- het oog dient elk uur gespoeld te worden.
Behandeling in bijzondere situaties (bij bewezen Ng-infectie):
1. Faryngeale Ng-infectie (bijzondere situatie vanwege afwijkende dosering ceftriaxon; echter ook reeds hierboven genoemd):
- 1e keus: ceftriaxon 1000 mg i.m., eenmalig;
- 2e keus: ciprofloxacine 500 mg p.o., eenmalig (indien stam bewezen chinolonengevoelig).
2. Ng-infectie bij borstvoeding of zwangerschap:
- 1e keus: ceftriaxon 500 mg i.m., eenmalig;
- alternatief: op geleide gevoeligheidsbepaling (kweek), bijvoorbeeld amoxicilline 3000 mg p.o., eenmalig.
3. Anafylaxie voor penicilline, in het geval dat ceftriaxon na overwegen niet wordt gekozen (Farmacotherapeutisch Kompas; Campagna, 2012; Pichichero, 2014):
- ertapenem, 1000 mg i.m., eenmalig.
- ciprofloxacine 500 mg p.o., eenmalig (alleen bij bewezen gevoeligheid);
- azitromycine 2000 mg p.o., eenmalig 4 tabletten van 500 mg (met nacontrole, zie boven).
4. Ophthalmia neonatorum door Ng-infectie:
- 1e keus: ceftriaxon 50 mg/kg i.v. of i.m. eenmalig (max. 125 mg);
- 2e keus: cefotaxim 100 mg/kg eenmalig i.m of i.v.
NB: Bij verdenking op keratitis dient de neonaat door een oogarts onderzocht te worden.
5. Gegeneraliseerde infectie (bacteriёmie):
- ceftriaxon 2000 mg i.m. of i.v., elke 24 uur gedurende 7 dagen; bij klinische verbetering en bewezen gevoeligheid voor ciprofloxacine kan na 48 uur overgegaan worden op ciprofloxacine p.o., 2 dd 500 mg.
C2.9.2 Profylaxe
Er is geen indicatie voor profylactische behandeling. Voor meer informatie over pre- en postexpositieprofylaxe wordt verwezen naar paragraaf D1.6.
C2.9.3 Nacontrole
Controle na behandeling is niet nodig indien behandeld is volgens de eerste keus standaardbehandeling (ceftriaxon i.m.).
Controle is wel geïndiceerd:
- na elke alternatieve behandeling van gonorroe en behandeling die niet conform bovenstaande richtlijn is geschied of die niet behandeld is met preparaat van eerste keus;
- bij persisterende klachten (in dit geval ook kweek afnemen);
- bij re-expositie aan onbehandelde bron (in dat geval ook testen op andere soa’s).
Omdat de behandeling van orofaryngeale gonorroe minder effectief is dan de behandeling van ongecompliceerde anogenitale gonorroe, en vanuit het oogpunt van monitoring van optredende resistentie is het controleren na behandeling van faryngeale gonorroe zinvol. Dit is echter kostbaar wegens de vele extra bezoeken, en wordt inmiddels nauwelijks meer gedaan.
De controletest dient indien NAAT o.b.v. RNA plaatsvindt minimaal 1 week na het beëindigen van de behandeling plaats te vinden voor anogenitale gonorroe, en minimaal 2 weken na het eindigen van de behandeling voor orofaryngeale gonorroe. Kweekonderzoek met resistentiebepaling bij persisterende klachten kan al 3-4 dagen na het beëindigen van de behandeling gedaan worden (De Vries, 2022).
Bij syndromale behandeling van gonorroe (op basis van evidente klachten of directe diagnostiek) wordt een mogelijke Ct-infectie niet meebehandeld, maar wordt de testuitslag afgewacht.
Als algemene richtlijn: bij een adequate therapie is de kans op overdracht waarschijnlijk binnen 24 uur verdwenen, maar over het algemeen wordt geadviseerd tot een week na de behandeling geen seksueel contact te hebben. Dit is o.a. om partnerbehandeling mogelijk te maken (zie verder paragraaf C2.8 of hoofdstuk D3).
Ten slotte: zowel bij vrouwen als heteroseksuele mannen met vastgestelde gonorroe is het advies om te testen op hiv en syfilis (bij MSM is deze test standaard, ook zonder gonorroediagnose).
Onderbouwing
Referenties
- Abara WE, Bernstein KT, Lewis FMT, Schillinger JA, Feemster K, Pathela P, Hariri S, Islam A, Eberhart M, Cheng I, Ternier A, Slutsker JS, Mbaeyi S, Madera R, Kirkcaldy RD. Effectiveness of a serogroup B outer membrane vesicle meningococcal vaccine against gonorrhoea: a retrospective observational study. Lancet Infect Dis. 2022 Jul;22(7):1021-1029.
- ASHM. Gonorrhoea. Australian STI Management Guidelines for use in primary care. Via: https://sti.guidelines.org.au/sexually-transmissible-infections/gonorrhoea. Geraadpleegd op 28-10-2022.
- Barbee LA, Soge OO, Khosropour CM, LeClair A, Golden MR. Time to Clearance of Neisseria gonorrhoeae RNA at the Pharynx following Treatment. J Clin Microbiol. 2022 Jun 15;60(6):e0039922.
- Bignell C, Fitzgerald M. UK national guideline for the management of gonorrhoea in adults, 2011. Int J STD AIDS 2011; 22: 541-547. https://www.bashh.org/guidelines.
- Bignell C, Unemo M. 2012 European guideline on the diagnosis and treatment of gonorrhoea in adults. Revision date: 1 November 2012. IUTSI, 2012. https://www.iusti.org/regions/europe/pdf/2012/Gonorrhoea_2012.pdf.
- Campagna JD, Bond MC, Schabelman E, Hayes BD. The use of cephalosporins in penicillin-allergic patients: a literature review. J Emerg Med 2012; 42: 612-620.
- Carlin E, Marzo-Ortega H, Flew S. British Association of Sexual Health and HIV national guideline on the management of sexually acquired reactive arthritis 2021. Int J STD AIDS. 2021 Oct;32(11):986-997.
- Cartee JC, Joseph SJ, Weston E, Pham CD, Thomas JC 4th, Schlanger K, St Cyr SB, Farley MM, Moore AE, Tunali AK, Cloud C, Raphael BH. Phylogenomic Comparison of Neisseria gonorrhoeae Causing Disseminated Gonococcal Infections and Uncomplicated Gonorrhea in Georgia, United States. Open Forum Infect Dis. 2022 May 13;9(7):ofac247.
- CDC. Gonoccocal infections. In: 2015 Sexually transmitted diseases treatment guidelines. Centers for Disease Control and Prevention, 2015. https://www.cdc.gov/std/tg2015/gonorrhea.htm.
- Chow EPF, Cornelisse VJ, Williamson DA, et al. Kissing may be an important and neglected risk factor for oropharyngeal gonorrhoea: a cross-sectional study in men who have sex with men. Sex Transm Infect. 2019;95(7):516521.
- Cohen MS, Cannon JG, Jerse AE, Charniga LM, Isbey SF, Whicker LG. Human experimentation with Neisseria gonorrhoeae: rationale, methods, and implications for the biology of infection and vaccine development. J Infect Dis. 1994 Mar;169(3):532-7. doi: 10.1093/infdis/169.3.532. PMID: 8158024.
- De Greeff SC, Kolwijck E, Schoffelen AF, Verduin CM. Nethmap 2022. Consumption of antimicrobial agents and antimicrobial resistance among medically important bacteria in the Netherlands in 2021. SWAB, RIVM. Juni 2022; 172-175.
- De Vries HJC, de Laat M, Jongen VW, Heijman T, Wind CM, Boyd A, de Korne-Elenbaas J, van Dam AP, Schim van der Loeff MF; NABOGO steering group. Efficacy of ertapenem, gentamicin, fosfomycin, and ceftriaxone for the treatment of anogenital gonorrhoea (NABOGO): a randomised, non-inferiority trial. Lancet Infect Dis. 2022 May;22(5):706-717.
- EUCAST, 2024. Clinical Breakpoints and Dosing of Antibiotics, www.eucast.org, geraadpleegd op 15/3/2024.
- European Centre for Disease Prevention and Control. Gonorrhoea. In: ECDC. Annual epidemiological report for 2018. Stockholm: ECDC; 2020
- European Centre for Disease Prevention and Control. Gonococcal antimicrobial susceptibility surveillance in the EU/EEA: Summary of results for 2019. Stockholm: ECDC; 2021.
- Fang J, Husman C, DeSilva L, Chang R, Peralta L. Evaluation of self-collected vaginal swab, first voided urine and endocervical swab specimens for the detection of Chlamydia trachomatis and Neisseria gobnorrhoeae in adolescent females. J Pediatr Adolesc Gynecol 2008; 21: 355-360.
- Farmacotherapeutisch Kompas. Geneesmiddelen, Ceftriaxon. Via: https://www.farmacotherapeutischkompas.nl/bladeren/preparaatteksten/c/ceftriaxon#contra-indicaties. Geraadpleegd op 28-10-2022.
- Fifer H, Saunders J, Soni S, Sadiq ST, FitzGerald M. 2018 UK national guideline for the management of infection with Neisseria gonorrhoeae. Int J STD AIDS. 2020 Jan;31(1):4-15.
- Han Y, Yin Y, Dai X, Chen S, Yang L, Zhu B, Zhong N, Cao W, Zhang X, Wu Z, Yuan L, Zheng Z, Feng L, Liu J, Chen X. Widespread Use of High-dose Ceftriaxone Therapy for Uncomplicated Gonorrhea Without Reported Ceftriaxone Treatment Failure: Results From 5 Years of Multicenter Surveillance Data in China. Clin Infect Dis. 2020 Jan 1;70(1):99-105.
- Handsfield HH, Dalu ZA, Martin DH, Douglas JM Jr, McCarty JM, Schlossberg D. Multicenter trial of single-dose azithromycin vs. ceftriaxone in the treatment of uncomplicated gonorrhoea: Azithromycin Gonorrhea Study Group. Sex Transm Dis 1994; 21: 107-111.
- Hoebe JPA, Rademaker CW, Brouwers EEHG et al. Acceptability of self taken vaginal swabs and first-catch urine samples for the diagnosis urogenital Chlamydia trachomatis and Neisseria gonorrhoeae with an amplified DNA assay in young women attending a public health sexually transmitted disease clinic. Sex Transm Dis 2006; 33: 491-495.
- Hofstraat S, van Benthem B, van Dam A, Linde I. Trends en determinanten van resistentie van Neisseria gonorrhoeae in Nederland. NVMM 2016; 24: 69-74.
- Hui B, Fairley CK, Chen M, Grulich A, Hocking J, Prestage G, Walker S, Law M, Regan D. Oral and anal sex are key to sustaining gonorrhoea at endemic levels in MSM populations: a mathematical model. Sex Transm Dis 2015; 91: 365-369.
- Jungmann E, Ison C, Martin IM, Fenton KA. Gonorrhoea in young heterosexuals attending urban STD clinics in Britain: a cross-sectional survey. Int J STD AIDS 2004; 15: 243-248.
- Kate A, Bagga B, Ramazanova K, Joshi V, Mohamed A, Sharma S. Risk factors, clinical features and outcomes of Neisseria keratitis. Int Ophthalmol. 2021; 41 (10): 3361-3369.
- Kayaert L et al. Sexually transmitted infections in the Netherlands in 2022. RIVM report 2023-0161. RIVM, Bilthoven, 2023
- Kent CK, Chaw JK, Wong W, et al. Prevalence of rectal, urethral, and pharyngeal chlamydia and gonorrhea detected in 2 clinical settings among men who have sex with men: San Francisco, California, 2003. Clin Infect Dis 2005; 41: 67-74.
- Kirkcaldy RD, Weinstock HS, Moore PC, et al. The efficacy and safety of gentamicin plus azithromycin and gemifloxacin plus azithromycin as treatment of uncomplicated gonorrhea. Clin Infect Dis 2014; 59: 10831091.
- Klausner JD, Marrazzo J, Bloom A. Disseminated gonococcal infection. Via: https://www.uptodate.com/contents/disseminated-gonococcal-infection. Geraadpleegd op: 28-10-2022.
- Koedijk FDH, van Veen MG, de Neeling AJ, Linde GB, van der Sande MAB. Increasing trend in gonococcal resistance to ciprofloxacin in The Netherlands, 2006-8. Sex Transm Infect 2010; 86: 41-45.
- Korenromp EL, Sudaryo MK, de Vlas SJ, Gray RH, Sewankambo NK, Serwadda D, Wawer MJ, Habbema JD. What proportion of episodes of gonorrhoea and chlamydia becomes symptomatic? Int J STD AIDS 2002; 13: 91-101.
- Lancaster JW, Mahoney MV, Mandal S, Lawrence KR. Update on treatment options for gonococcal infections. Pharmacotherapy 2015; 35: 856-868.
- Leeman FWJ, van Voorst Vader PC van, Mulder JG, Tensen A. Besmetting met anogenitale meningokokken. SOA-bulletin 1996; 17: 18-20.
- Lycke E, Lowhagen GB, Hallhagen G, Johanisson G, Ramstedt K. The risk of transmission of genital Chlamydia trachomatis infection is less than that of genital Neisseria gonorrhoea infection. Sex Transm Dis 1980; 7: 6-10.
- Marshall HS, Andraweera PH, Ward J, Kaldor J, Andrews R, Macartney K, et al. An Observational Study to Assess the Effectiveness of 4CMenB against Meningococcal Disease and Carriage and Gonorrhea in Adolescents in the Northern Territory, Australia-Study Protocol. Vaccines (Basel). 2022 Feb 16;10(2):309
- Masek BJ, Arora N, Quinn N, Aumakhan B, Holden J, Hardick A, Agreda P, Barnes M, Gaydos CA. Performance of three nucleic acid amplification tests for detection of Chlamydia trachomatis and Neisseria gonorrhoeae by use of self-collected vaginal swabs obtained via an Internet-based screening program. J Clin Microbiol 2009; 47: 1663-1667.
- Maze MJ, Young S, Creighton J, Anderson T, Werno A. Nucleic acid amplification of the opa gene for detection of Neisseria gonorrhoeae: experience from a diagnostic laboratory. J Clin Microbiol 2011; 49: 112
- Milligan AL, Randag A, Lekkerkerk S, Fifer H. Increased incidence of adult gonococcal keratoconjunctivitis at two tertiary eye hospitals in Western Europe: clinical features, complications and antimicrobial susceptibility. Br J Ophthalmol. Published online February 16, 2024. doi:10.1136/bjo-2023-324750
- Mitchell CM, Anyalechi GE, Cohen CR, Haggerty CL, Manhart LE, Hillier SL. Etiology and Diagnosis of Pelvic Inflammatory Disease: Looking Beyond Gonorrhea and Chlamydia. J Infect Dis. 2021 Aug 16;224(12 Suppl 2):S29-S35. 8-1129.
- Moncada J, Schachter J, Liska S, Shayevich C, Klausner JD. Evaluation of self-collected glans and rectal swabs from men who have sex with men for detection of Chlamydia trachomatis and Neisseria gonorrhoeae by use of nucleic acid amplification tests. J Clin Microbiol 2009; 47: 1657-1662.
- Monfort L, Caro V, Devaux Z, Delannoy AS, Brisse S, Sednaoui P. First Neisseria gonorrhoeae genotyping analysis in France: identification of a strain cluster with reduced susceptibility to ceftriaxone. J Clin Microbiol 2009; 47: 3540-3545.
- Morris SR, Klausner JD, Buchbinder SP, Wheeler SL, Koblin B, Coates T, Chesney M, Colfax GN. Prevalence and incidence of pharyngeal gonorrhea in a longitudinal sample of men who have sex with men: the EXPLORE study. Clin Infect Dis 2006; 43: 1284-1289.
- Nielsen R, Søndergaard J. Asymptomatic male and female gonorrhoea. Acta Derm Venereol 1975; 55: 499-501.
- Ohnishi M, Saika T, Hoshina S, Iwasaku K, Nakayama S, Watanabe H, Kitawaki J. Ceftriaxone-resistant Neisseria gonorrhoeae, Japan. Emerg Infect Dis 2011; 17: 148-149.
- Ohnishi M, Golparian D, Shimuta K, Saika T, Hoshina S, Iwasaku K, Nakayama S, Kitawaki J, Unemo M. Is Neisseria gonorrhoeae initiating a future era of untreatable gonorrhea?: detailed characterization of the first strain with high-level resistance to ceftriaxone. Antimicrob Agents Chemother 2011; 55: 3538-3545.
- Peerbooms PGH, Spaargaren J, Fennam JSA, Cairo I, Coutinho RA. Toename van chinolonresistentie bij Neisseria gonorrhoeae in Amsterdam. Ned Tijdschrift Geneeskd 2001; 145: 1899-1900.
- Petousis-Harris H, Paynter J, Morgan J, Saxton P, McArdle B, Goodyear-Smith F, Black S. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 2017 Sep 30;390(10102):1603-1610.
- Pichichero ME, Zagursky R. Penicillin and cephalosporin allergy. Ann Allergy Asthma Immunol 2014; 112: 404-412.
- Pinto M, Matias R, Rodrigues JC, Duarte S, Vieira L, Gonçalves I, Gonçalves MJ, Ramos MH, Gomes JP, Borrego MJ. Cephalosporin-Resistant Neisseria gonorrhoeae Isolated in Portugal, 2019. Sex Transm Dis. 2020 Nov;47(11):e54-e56.
- Pleininger S, Indra A, Golparian D, Heger F, Schindler S, Jacobsson S, Heidler S, Unemo M. Extensively drug-resistant (XDR) Neisseria gonorrhoeae causing possible gonorrhoea treatment failure with ceftriaxone plus azithromycin in Austria, April 2022. Euro Surveill. 2022 Jun;27(24):2200455.
- Public Health England. More cases of antibiotic resistant gonorrhoea identified in England. UK Health Security Agency. 2020 Feb. GOV.UK via: https://www.gov.uk/government/news/more-cases-of-antibiotic-resistant-gonorrhoea-identified-in-england. Geraadpleegd op 28-10-2022.
- Read PJ, Limnios EA, McNulty A, Whiley D, Lahra MMl. One confirmed and one suspected case of pharyngeal gonorrhoea treatment failure following 500 mg ceftriaxone in Sydney, Australia. Sex Health 2013; 10: 460-462.
- "Thermometer seksuele gezondheid" - april 2023 (rivm.nl)
- Rob F, Klubalova´ B, Nycova´ E, et al. Gentamicin 240 mg plus azithromycin 2 g vs. ceftriaxone 500 mg plus azithromycin 2 g for treatment of rectal and pharyngeal gonorrhoea: a randomized controlled trial. Clin Microbiol Infect 2020; 26: 207212.
- Rowley J, Vander Hoorn S, Korenromp E, Low N, Unemo M, Abu-Raddad LJ, Chico RM, Smolak A, Newman L, Gottlieb S, Thwin SS, Broutet N, Taylor MM. Chlamydia, gonorrhoea, trichomoniasis and syphilis: global prevalence and incidence estimates, 2016. Bull World Health Organ. 2019 Aug 1;97(8):548-562P.
- Schachter J, Chernessky MA, Willis DE, Fine PM, Martin DH, Fuller D, Jordan JA, Janda W, Hook EW. Vaginal swabs are the specimens of choice when screening for Chlamydia trachomatis and Neisseria gonorrhoeae: results from a multicenter evaluation of the Aptima Assays for both infections. Sex Transm Dis 2005; 32: 725-728.
- Schachter J, Moncada J, Liska S, Shayevich C, Klausner JD. Nucleic acid amplification tests in the diagnosis of chlamydial and gonococcal infections of the orofarynx and rectum in men who have sex with men. Sex Transm Dis 2008; 35: 637-642.
- Sherrard J, Barlow D. Gonorrhoea in men: clinical and diagnostic aspects. Genitourin Med 1996; 72: 422-426.
- Tielemans M, van Westreenen M, Klaassen C, Götz HM. Confirmatory testing of Neisseria gonorrhoeae in a sexual health clinic: implications for epidemiology and treatment policy. Sex Transm Infect. 2022 Mar;98(2):121-124.
- Tran J, Ong JJ, Bradshaw CS, Chen MY, Kong FYS, Hocking JS, Aung ET, Maddaford K, Fairley CK, Chow EPF. Kissing, fellatio, and analingus as risk factors for oropharyngeal gonorrhoea in men who have sex with men: A cross-sectional study. EClinicalMedicine. 2022 Jul 14;51:101557.
- Unemo M, Golparian D, Syversen G, Vestrheim DF, Moi H. Two cases of verified clinical failures using internationally recommended first-line cefixime for gonorrhoea treatment, Norway, 2010. Euro Surveill 2010; 15: pii:19721.
- Unemo M, Golparian D, Eyre DW. Antimicrobial Resistance in Neisseria gonorrhoeae and Treatment of Gonorrhea. Methods Mol Biol. 2019;1997:37-58.
- Unemo M, Ross J, Serwin AB, Gomberg M, Cusini M, Jensen JS. 2020 European guideline for the diagnosis and treatment of gonorrhoea in adults. Int J STD AIDS. 2020 Oct 29.
- Unemo M, Ross J, Serwin AB, Gomberg M, Cusini M, Jensen JS. Background review for the '2020 European guideline for the diagnosis and treatment of gonorrhoea in adults'. Int J STD AIDS. 2021 Feb;32(2):108-126.
- Van Dam AP, van Ogtrop ML, Golparian D, Mehrtens J, de Vries HJ, Unemo M. Verified clinical failure with cefotaxime 1 g for treatment of gonorrhoea in the Netherlands: a case report. Sex Transm Infect 2014; 90: 513-514.
- Visser M, Götz HM, van Dam AP, van Benthem BH. Trends and regional variations of gonococcal antimicrobial resistance in the Netherlands, 2013 to 2019. Euro Surveill. 2022 Aug;27(34):2200081.
- Weinstock H, Workowski KA. Pharyngeal gonorrhea: an important reservoir of infection? Clin Infect Dis 2009; 49: 1798-1800.
- Whelan J, Kløvstad H, Haugen IL, Holle MR, Storsaeter J. Ecologic Study of Meningococcal B Vaccine and Neisseria gonorrhoeae Infection, Norway. Emerg Infect Dis. 2016 Jun;22(6):1137-9.
- Wiesner PJ, Tronca E, Bonin P, Pedersen AH, Holmes KK. Clinical spectrum of gonococcal pharyngitis. N Engl J Med 1973; 288: 181-185.
- Wind CM, de Vries HJ, Schim van der Loeff MF, Unemo M, van Dam AP. Successful combination of nucleic acid amplification test diagnostics and targeted deferred Neisseria gonorrhoeae culture. J Clin Microbiol 2015; 53: 1884-1890.
- Wind CM, Schim van der Loeff MF, Unemo M, Schuurman R, van Dam AP, de Vries HJC. Test of Cure for Anogenital Gonorrhoea Using Modern RNA-Based and DNA-Based Nucleic Acid Amplification Tests: A Prospective Cohort Study. Clin Infect Dis. 2016 Jun 1;62(11):1348-1355.
- Woods CR. Gonococcal infections in neonates and young children. Semin Pediatr Infect Dis 2005; 16: 258-270.
- Workowski KA, Bachmann LH, Chan PA, Johnston CM, Muzny CA, Park I, Reno H, Zenilman JM, Bolan GA. Sexually Transmitted Infections Treatment Guidelines, 2021. MMWR Recomm Rep. 2021 Jul 23;70(4):1-187.
- WHO. Guidelines for the treatment of Neisseria gonorrhoeae. World Health Organization, 2016.
- Xiridou M, Soetens LC, Koedijk FD, van der Sande MAB, Wallinga J. Public health measures to control the spread of antimicrobial resistance in Neisseria gonorrhoeae in men who have sex with men. Epidemiol Infect 2015; 143: 1575-1584.
- Yan J, Chen Y, Yang F, Ling X, Jiang S, Zhao F, Yu Y, van der Veen S. High percentage of the ceftriaxone-resistant Neisseria gonorrhoeae FC428 clone among isolates from a single hospital in Hangzhou, China. J Antimicrob Chemother. 2021 Mar 12;76(4):936-939.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 27-03-2024
Laatst geautoriseerd : 27-03-2024
Geplande herbeoordeling :
De Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van het richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van deze richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Opmerking bij autorisatie:
Betreft ‘C.1.10: Paradigmashift testbeleid chlamydia bij asymptomatische patiënten’; deze paragraaf geeft aan dat er nieuwe inzichten zijn met betrekking tot het al dan niet testen op chlamydia bij personen zonder klachten, maar gaat niet over tot ontraden. De richtlijn geeft helder aan dat nog niet duidelijk is wat de consequenties zijn op de langere termijn als men stopt met het testen en dat een (maatschappelijk) gesprek over het nut en de noodzaak hiervan is geboden. De NVMM, de NIV en het NHG willen benadrukken dat een breed debat met alle stakeholders eerst moet plaatsvinden alvorens men deze richtlijn interpreteert als een advies om niet meer te testen op chlamydia bij personen zonder klachten.
Doel en doelgroep
Deze richtlijn doet aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering en is gericht op het vaststellen van goed medisch handelen.
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad.
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld. Bij het samenstellen van de werkgroep werd rekening gehouden met geografische spreiding van de werkgroepleden en met evenredige vertegenwoordiging van academische en niet-academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel lid ontving gunsten met het doel de richtlijnen te beïnvloeden. Naast de afgevaardigden van de verschillende beroepsgroepen zijn er vertegenwoordigers van patiëntenverenigingen en belangenorganisaties betrokken geweest bij de ontwikkeling van de richtlijn.
Tabel 1: Overzicht werkgroepleden herziening 2022-2024.
|
Werkgroepleden |
Functie |
Vereniging of affiliatie |
|
Prof. dr. H.J.C. de Vries (voorzitter) |
Dermatoloog |
NVDV |
|
Dr. A.P. van Dam (vicevoorzitter) |
Arts-microbioloog |
NVMM |
|
Drs. E. Ab |
Huisarts |
NHG |
|
Dr. A.H. Adriaanse |
Gynaecoloog |
NVOG |
|
Drs. C.A.J. van Bokhoven |
Arts Maatschappij en Gezondheid |
NVIB/WASS |
|
Drs. H. Bos (vanaf mei 2022) |
Arts Maatschappij en Gezondheid |
Soa Aids Nederland |
|
Drs. M.D. Esajas |
Gynaecoloog |
NVOG |
|
Drs. M.A.M. van den Elshout |
Arts seksuele gezondheid |
GGD regio Utrecht |
|
Dr. H.M. Götz |
Arts Maatschappij en Gezondheid, epidemioloog |
NVIB/WASS |
|
Drs. M.O. Hoogeveen (vanaf april 2023) |
Arts-onderzoeker |
NVDV |
|
Dr. E. Hoornenborg |
Internist-infectioloog |
NVHB (NIV) |
|
Drs. A.G.W van Hulzen |
Verpleegkundig specialist |
V&VN |
|
Drs. R. Joosten |
Arts Maatschappij en Gezondheid |
RIVM |
|
Drs. D.M. van Loon (sept 2022-mei 2023) |
Arts-onderzoeker |
NVDV |
|
Dr. G. Losonczy |
Oogarts |
NOG |
|
Drs. B. Meijer |
Uroloog |
NVU |
|
Dr. J.M. Oldhoff |
Dermatoloog |
NVDV |
|
Prof. Dr. M.F. Schim van der Loeff |
Arts Maatschappij en Gezondheid, epidemioloog |
GGD Amsterdam |
|
Drs. F.W. Sintenie |
Belangenvertegenwoordiger |
Treat it Queer |
|
Drs. M. Stolting (tot december 2022) |
Arts-onderzoeker |
NVDV |
|
E.N.J. Stronck (vanaf april 2022) |
Patiëntvertegenwoordiger |
Poz&Proud (Hiv Vereniging) |
|
Dr. A.H. Teeuw |
Kinderarts |
NVK |
|
Dr. S.O. Verboeket |
Belangenvertegenwoordiger |
PrEPnu |
|
Dr. C.E. Vergunst |
Dermatoloog |
NVDV |
|
Dr. S.M.E. Vrouenraets |
Internist-infectioloog |
NVHB (NIV) |
|
Drs. M.I.L.S. Werner |
Arts Maatschappij en Gezondheid |
NVIB/WASS |
|
Dr. M. van Westreenen |
Arts-microbioloog |
NVMM |
|
Dr. C. Zemouri |
Gezondheidswetenschapper |
Zemouri Public Health Research & Consultancy |
|
Klankbordleden |
|
|
|
Dr. J. Schouten |
Neuroloog |
NVN |
Tabel 2: Overzicht betrokken partijen herziening 2022-2024.
|
Overzicht betrokken partijen* |
Zitting nemend in werkgroep |
Knelpuntenanalyse |
Commentaarfase |
Autorisatie |
Opmerkingen |
|
Wetenschappelijke verenigingen |
|||||
|
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Medische Microbiologie (NVMM) |
X |
X |
X |
X |
|
|
Nederlands Huisartsen Genootschap (NHG) |
X |
X |
X |
|
Voor huisartsen gelden de NHG-standaarden. |
|
Nederlandse Vereniging voor Urologie (NVU) |
X |
X |
X |
X |
Geen extern commentaar geleverd. |
|
Nederlandse Internisten Vereniging (NIV) namens de Nederlandse Vereniging van Hiv-Behandelaren (NVHB) en de Nederlandse Vereniging voor Internist-infectiologen (NVII) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging Infectieziektebestrijding (NVIB) namens de Werkgroep Artsen Seksuele gezondheid en Soa (WASS) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) |
X |
|
X |
X |
Zijn later (na knelpuntanalyse) aangeschoven. |
|
Nederlandse Vereniging voor Kindergeneeskunde (NVK) |
X |
|
X |
X |
Zijn later (na knelpuntanalyse) aangeschoven. |
|
Nederlandse Vereniging voor Neurologie (NVN) |
|
|
X |
|
Gemandateerd klankbordgroep lid. |
|
Nederlands Oogheelkundig Genootschap (NOG) |
X |
|
X |
X |
Zijn later (na knelpuntanalyse) aangeschoven. |
|
Overige organisaties |
|||||
|
Rijksinstituut voor Volksgezondheid en het Milieu-Centrum voor Infectieziektebestrijding (RIVM-Cib) |
X |
X |
X |
|
|
|
Soa Aids Nederland |
X |
X |
X |
|
|
|
Verpleegkundigen & Verzorgenden Nederland (V&VN) |
X |
X |
X |
X |
Geen extern commentaar geleverd. |
|
Nederlandse Vereniging voor Ziekenhuis Apothekers (NVZA) |
|
|
X |
|
|
|
Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) |
|
|
X |
|
Per abuis niet uitgenodigd voor knelpuntanalyse. Er is afgesproken dit in de toekomst wel te doen. |
|
Nederlandse Associatie Physician Assistants (NAPA) |
|
|
X |
|
Geen extern commentaar geleverd. |
|
Patiëntenverenigingen |
|||||
|
Poz&Proud |
X |
X |
X |
X |
Geautoriseerd via Patiëntfederatie Nederland |
|
Treat it Queer |
X |
X |
X |
X |
Geautoriseerd via Patiëntfederatie Nederland |
|
PrEPnu |
X |
X |
X |
|
Geen extern commentaar geleverd. |
|
Huid Nederland |
|
|
X |
|
Geen extern commentaar geleverd. |
|
Stakeholders |
|||||
|
Zorginstituut Nederland (ZiN) |
|
|
X |
|
Uitgenodigd. Geen commentaar ontvangen. |
|
Nederlandse Vereniging Ziekenhuizen (NVZ) |
|
|
X |
|
|
|
Nederlandse Federatie van Universitair Medische Centra (NFU) |
|
|
X |
|
Uitgenodigd. Geen commentaar ontvangen. |
|
Zorgverzekeraars Nederland (ZN) |
|
|
X |
|
Uitgenodigd. Geen commentaar ontvangen. |
|
Inspectie Gezondheidszorg en Jeugd (IGJ) |
|
|
X |
|
Uitgenodigd. Geeft geen commentaar. |
* Alle partijen werden uitgenodigd voor de knelpuntenanalyse (invitational conference) en de commentaarfase.
Deelname aan de werkgroep en autorisatie wordt enkel aan de wetenschappelijke verenigingen, patiëntenverenigingen en overige organisaties voorgelegd.
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling (2021) is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de Nederlandse Vereniging voor Dermatologie en Venereologie.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen, persoonlijke relaties, reputatiemanagement |
Extern gefinancierd onderzoek |
Overige belangen |
Getekend op |
Acties |
|
Prof. dr. H.J.C. de Vries |
Dermatoloog, CSG GGD Amsterdam & afdeling dermatologie, Amsterdam UMC |
Chair of CBK Zuidoost foundation, onbetaald |
- |
- |
- |
07-12-2022 |
- |
|
Drs. E. Ab |
Huisarts UMCG |
- Kaderarts urogynaecologie (onbetaald) - Expertgroep seksuele gezondheid (onbetaald) |
- |
- |
- |
10-02-2022 |
- |
|
Dr. A.H. Adriaanse |
Gynaecoloog, Noordwest Ziekenhuisgroep, locatie Alkmaar |
- Medisch manager OK-organisatie Noordwest Ziekenhuisgroep - Lid Calamiteiten commissie Noordwest Ziekenhuisgroep - Opleider Internationale Gezondheidszorg en Tropengeneeskunde, Noordwest Ziekenhuisgroep (deze functies zijn onderdeel van het dienstverband binnen de Noordwest Ziekenhuisgroep) |
- |
- |
- |
27-08-2023 |
- |
|
Drs. C.A.J. van Bokhoven |
Arts maatschappij en gezondheid, infectieziektebestrijding, GGD Gelderland-Zuid |
- Lid visitatiecommissie Seksuele gezondheid GGD’en (vergoeding valt onder reguliere financiering) - Lid werkgroep kwaliteitsprofiel ASG (betaald door VWS) |
- |
- |
- |
23-02-2022 |
- |
|
Dr. H. Bos |
Arts M+G infectieziektebestrijding, strategisch adviseur Soa Aids Nederland (0,8) |
- |
- |
- |
- |
24-02-2022 |
- |
|
Dr. A.P. van Dam |
Arts-microbioloog Amsterdam UMC (0,9 FTE) met detachering naar - GGD Amsterdam (0,2 FTE) - RIVM (COMmer) (0,2 FTE) |
- Vanuit Amsterdam UMC: lid redactieraad Tijdschrift voor Infectieziekten (onbetaald) - Vanuit GGD: labvertegenwoordiger NL voor SOA-ECDC (onbetaald) |
Geen specifieke intellectuele belangen of reputatie. In het algemeen is het zo dat het definiëren van een bepaalde conditie als een ziektebeeld, waarop diagnostiek en behandeling moet volgen door een professional, leidt tot een groter belang van deze professional en zijn/haar werkgever. Dit geldt ook voor mij als arts-microbioloog, en mijn werkgevers. |
Onderzoek naar effectiviteit van zolidoflacin voor behandeling voor gonorroe (iov GARDP) Onderzoek naar M. genitalium bij PID, financier OLVG research fonds -Onderzoek naar diagnostische waarde geautomatiseerde moleculaire test voor T. pallidum (Hologic financiert kits, geen honoraria) |
- |
16-01-2023 |
- |
|
Drs. M.A.M. van den Elshout |
- Medisch coördinator afd. seksuele gezondheid, GGD regio Utrecht (36u) - Arts-onderzoeker AMPrEP, AMR / Amsterdam UMC /GGD Amsterdam (8u) -Arts seksuele gezondheid, GGD Amsterdam, Gemeente Amsterdam (0,77u) |
Registratiecommissie SOAP, lid namens ASG-stuurgroep, leden geven advies aan de directeur RIVM/CIb over de gegevens die aangeleverd moeten worden t.b.v. de in het SOAP gebruikersreglement genoemde doelen (onbetaald). |
- |
- |
- |
14-11-2022 |
- |
|
Drs. M.D. Esajas |
Gynaecoloog UMCG |
Docent BVO Nederland, onbetaald |
- |
- |
- |
24-11-2022 |
- |
|
Dr. H.M. Götz |
Arts M+G IZB GGD Rotterdam- Rijnmond |
- |
- |
- |
- |
09-02-2022 |
- |
|
Drs. M.O. Hoogeveen |
Arts-onderzoeker, NVDV |
Klinisch onderzoek pediatrie Virtual Reality Hypnosis |
- |
- |
- |
25-01-2022 |
- |
|
Dr. E. Hoornenborg |
- Hoofd Centrum voor Seksuele Gezondheid GGD Amsterdam (1,0 fte) - Internist-infectioloog, DC Lairesse, Amsterdam (0,1 fte) |
- |
- |
GGD Amsterdam ontvangt in 2023 een grant van Gilead Sciences voor outreach HIV en STI testing. Geen belang bij uitkomst met betrekking tot de MDR. |
- |
23-08-2023 |
- |
|
Drs. A.G.W. van Hulzen |
Verpleegkundig Specialist AGZ (hiv- en hepatitis behandelcentrum) Isala Zwolle (24u) |
- |
- |
- |
- |
29-11-2022 |
- |
|
Drs. D.M. van Loon |
Arts-onderzoeker NVDV |
- |
- |
- |
- |
01-02-2023 |
- |
|
Drs. R. Joosten |
Arts Maatschappij en Gezondheid, profiel Infectieziektebestrijding RIVM |
- |
- |
- |
- |
24-11-2022 |
- |
|
Dr. G. Losonczy |
Oogarts, corneachirurg, Radboud UMC Nijmegen |
- |
- |
- |
- |
19-07-2023 |
- |
|
Drs. B. Meijer |
Uroloog, ACIBADEM, Amsterdam |
Lid werkgroep bekwaamheidseisen (beperkte) genitale chirurgie (onbetaald) |
- |
- |
- |
11-2-2022 |
- |
|
Dr. J.M. Oldhoff |
Dermatoloog, UMCG |
- Voorzitter domeingroep SOA en huidinfecties, NVDV - Hoofd SOA GGD Groningen (betaald via samenwerkingsverband met de afd. dermatologie UMCG) |
- |
- |
- |
10-02-2022 |
- |
|
Prof. Dr. M.F. Schim van der Loeff |
- Senior epidemioloog bij afdeling infectieziekten, GGD Amsterdam (fulltime) - Bijzonder hoogleraar van epidemiologie van Seksueel Overdraagbare Infecties, Amsterdam UMC (1 dag per week) |
Bestuurslid Stichting Virus Actiefonds (onbetaald) tot november 2022 |
- |
Mijn werkgever, GGD Amsterdam, stimuleert medewerkers om deel te nemen aan adviescommissies en richtlijncommissies, zoals deze. Alle betalingen uit bovenstaande functies gaan naar werkgever. - Hoofdonderzoeker op onderzoek CONTROL, gefinancierd door ZonMw (juli 2020-heden) - Projectleider op onderzoek NABOGO, gefinancierd door ZonMw (2016-2022) - Co-PI op onderzoek EZI-PrEP, gefinancierd door AidsFonds (2019-heden) - Deelnemer van Advisory board MSD (november 2020 en juni 2021) - Lid van Advisory Board Novosanis (oktober 2022-heden) - Hoofdonderzoeker van Ivestigator-Initiated Research grant bij GSK (oktober 2022-nu) |
23-2-2022 |
- |
|
|
Dr. J. Schouten |
- Neuroloog, Rijnstate Ziekenhuis Arnhem |
Forensisch neuroloog, Pieter Baan Centrum (betaald) |
- |
- |
- |
24-07-2023 |
- |
|
Drs. F. W. Sintenie |
- Penningmeester bij Treat it Queer (i.p. onbetaald) - ANIOS verslavingsgeneeskunde bij Jellinek (betaald) |
- |
- |
- |
Treat it Queer zet zich in voor betere zorg voor de LHBTI+ gemeenschap middels onderwijs, onderzoek en advies. Alle oprichters zijn zelf onderdeel van de gemeenschap, maar hebben ook alleen een achtergrond in de geneeskunde en/of global health. Derhalve zou het theoretisch kunnen dat de stichting Treat it Queer meer bekendheid krijgt door de richtlijn, en hierdoor sneller of makkelijker gevraagd wordt om projecten te organiseren of hieraan deel te nemen. Er spelen geen directe financiële belangen. (zie verder uitleg de belangenverklaring) |
18-2-2022 |
- |
|
Drs. M. Stolting |
Arts-onderzoeker NVDV |
- |
- |
- |
- |
05-06-2022 |
- |
|
E.N.J. Stronck |
Coördinator Poz&Proud, onderdeel van de hiv vereniging |
- |
- |
- |
- |
24-11-2022 |
- |
|
Dr. A.H. Teeuw |
Kinderarts sociale pediatrie, Emma Kinderziekenhuis-Amsterdam UMC |
- LECK kinderarts (onbetaald) - CSG kinderarts (onbetaald) |
- |
- |
- |
22-01-2023 |
- |
|
Dr. S.O. Verboeket |
Arts in opleiding tot verslavingsarts, SBOH / Stichting Arkin |
Lid actiegroep PrEPnu (voorheen voorzitterschap; vrijwilligerswerk) |
- |
- |
Als lid van actiegroep PrEPnu ben ik er bij gebaat dat PrEP beter en breder toegankelijk wordt dan op dit moment sprake van is. Met deze visie, en mede daardoor, ben ik betrokken bij de totstandkoming van deze richtlijn |
11-12-2022 |
- |
|
Dr. C.E. Vergunst |
- Dermatoloog GGD Amsterdam (18u per week - Dermatoloog Centrum Oosterwal, gedetacheerd NoordWestZiekenhuisgroep (18u per week) |
-Lid domeingroep SOA en huidinfecties (onbetaald) - Docent NSPOH (betaald) |
Recent gepubliceerd wetenschappelijk onderzoek mede van mijn hand zal in de nieuwe richtlijn verwerkt worden |
Betrokkenheid bij onderzoek naar klinische relevantie Mg infecties, momenteel intern gefinancierd door GGD Amsterdam, in verleden is studie deels gesponsord door Hologic (levering test-kits) |
-Bevestiging reputatie als expert op het gebied van SOA. -De richtlijn wordt ook doorgevoerd, voor zover van toepassing, in de door mij en mijn collega’s beheerde lokale protocollen van de GGD Amsterdam. |
14-02-2022 én |
- |
|
Dr. S.M.E. Vrouenraets |
Internist-infectioloog, OLVG. Tevens gedetacheerd vanuit OLVG naar AvL voor het uitvoeren HRA (hoog risico anoscopieën) en A-team werkzaamheden |
- |
- |
- |
- |
22-11-2022 |
- |
|
Drs. M.I.L.S. Werner |
Arts Maatschappij en Gezondheid, GGD Zuid Limburg |
- |
- |
- |
- |
23-11-2022 |
- |
|
Dr. M. van Westreenen |
Arts-microbioloog, Erasmus MC en STAR-SHL |
- GRAS werkgroep (onbetaald) - ECDC SOHO network focal point organs (onbetaald) |
- |
- |
- |
21-11-2022 |
- |
|
Dr. C. Zemouri |
- Onderzoeker COVID-19 aanbevelingen, Amsterdam Medisch Centrum - Zelfstandig onderzoeker en consultant, Zemouri Public Health Research & Consultancy |
- |
- |
- |
- |
06-04-2022 |
- |
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door deelname van een aantal patiënten/sleutelpopulatie organisaties zoals Poz&Proud, PrEP.nu, en Treat it Queer. Afgevaardigden van deze organisaties waren aanwezig bij alle vergaderingen en hebben als auteurs en commentators een directe en actieve bijdrage geleverd aan het tot stand komen van de richtlijn.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt via het internet verspreid onder alle relevante beroepsgroepen en ziekenhuizen en er zal in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Tevens is er een samenvatting gemaakt inzake de belangrijkste wijzigingen en is de ‘MDR Soa App’ geüpdatet aan de hand van de wijzigingen voortvloeiende uit deze herziening; deze is voor iedereen beschikbaar die daar kennis van wil nemen. Het volledige implementatieplan is opgenomen in bijlage implementatieplan.
Werkwijze
Aanleiding
Op initiatief van de Nederlandse Vereniging voor Dermatologie en Venereologie en de Nederlandse Vereniging voor Medische Microbiologie is de richtlijn Seksueel Overdraagbare Aandoeningen (SOA) in 2022-2024 herzien. De laatste grote herziening dateert uit 2018. In 2019 heeft er een kleine modulaire herziening plaatsgevonden. Voor deze huidige herziening kwamen meerdere modules in aanmerking, omdat er relevante ontwikkelingen hebben plaatsgevonden omtrent epidemiologie (mpox en scabiës), therapie (chlamydia), testbeleid (chlamydia en Mycoplasma genitalium-infectie) en biomedische interventies (PrEP).
Knelpuntenanalyse
In de voorbereidingsfase heeft een bijeenkomst plaatsgevonden waarvoor alle belanghebbenden zijn uitgenodigd. Zie bijlage 2, tabel 2 voor de aanwezigheid van de verschillende partijen bij deze eerste bijeenkomst.
Samenstelling van de werkgroep
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld. Bij het samenstellen van de werkgroep werd rekening gehouden met geografische spreiding van de werkgroepleden en met evenredige vertegenwoordiging van academische en niet-academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel lid ontving gunsten met het doel de richtlijnen te beïnvloeden. Naast de afgevaardigden van de verschillende beroepsgroepen zijn er vertegenwoordigers van patiëntenverenigingen en belangenorganisaties betrokken geweest bij de ontwikkeling van de richtlijn. Zie bijlage 2, tabel 1 voor een volledig overzicht van de betrokken partijen.
Wetenschappelijke bewijsvoering
De voorlaatste update van de richtlijn dateert uit 2019, welke tot stand is gekomen op basis van commentaar op de vorige versie (2018), en evaluatie door de werkgroep. Er zijn toen geen substantiële wijzigingen aangebracht, maar storende fouten zoals in doseringen zijn gecorrigeerd en verduidelijkingen zijn waar nodig aangebracht. De richtlijnwerkgroep werkte in de periode 2021-2023 aan een nieuwe conceptrichtlijntekst. De werkgroepleden werden verdeeld in subgroepen die zich elk bogen over een module. Als basistekst is uitgegaan van de 2019 MDR Soa die eerder door de in Nederland aanwezige deelexperts zijn samengesteld.
De aanbevelingen uit deze richtlijn zijn, voor zover mogelijk, gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Voor een groot deel van de adviezen die in de richtlijn worden gegeven is onvoldoende bewijs voorhanden dat vandaag de dag noodzakelijk wordt geacht voor opname in een richtlijn. Zo is de huidige behandeling van syfilis terug te voeren op kennis en ervaring stammend uit het midden van de 20e eeuw, ver voor de implementatie van de ”evidence based medicine”-criteria die nu als standaard worden vereist als onderbouwing van medisch beleid. Er bestaat echter geen twijfel aan de keuze voor benzathinebenzylpenicilline als eerstekeuzebehandeling voor syfilis. Dit geldt overigens niet alleen voor seksueel overdraagbare aandoeningen; het overgrote deel van de 3000 dermatologische diagnoses kent geen behandeling die op stevig bewijs rust; toch bestaat ook daar behoefte aan therapeutische adviezen.
Er is in 2002 een Soa-richtlijn verschenen die geheel volgens de toen geldende standaard van wetenschappelijke bewijsvoering is opgesteld. Op basis van vooraf opgestelde vragen werden zoekopdrachten uitgevoerd en een poging tot beantwoording van de vragen gedaan. Helaas bleek voor de meest klinisch relevante ‘uitgangsvragen’ geen systematische onderbouwing vanuit de literatuur voorhanden (er kwamen geen adviezen met een bewijskracht boven niveau 4 uit). De meest prangende vragen omtrent diagnostiek en behandeling konden zodoende niet worden beantwoord en kwamen ook niet aan bod. Vanwege het teleurstellende resultaat en de kritiek op deze richtlijn is bij de volgende versie afgestapt van het model van vooraf opgestelde vragen en is weer gekozen voor de voorheen gehanteerde werkwijze zoals bij de 1997 richtlijn die bestond uit vaste paragrafen per syndroom en infectie (zoals epidemiologie, diagnostiek en behandeling). Vanaf 2012 is de richtlijn daarom hoofdzakelijk gebaseerd op een combinatie van de mening van de werkgroep (expert opinie) na uitvoerige discussie, aanvullend gericht literatuuronderzoek (niet systematisch beoordeeld) en recent gepubliceerde internationale en nationale richtlijnen, waarin naast standaarden van het Nederlands Huisartsen Genootschap (NHG), de Amerikaanse CDC, de Britse BASHH, de Europese IUSTI en de WHO-richtlijnen het meest leidend zijn geweest. De internationale richtlijnen volgen ook het door ons gekozen stramien van vaste paragrafen per syndroom/infectie die al dan niet is onderbouwd met wetenschappelijk onderzoek dan wel met expert opinie. Per hoofdstuk of passage wordt duidelijk gerefereerd naar nationale of internationale richtlijnen waaruit zaken overgenomen zijn. Daarnaast heeft er voor alle modules/hoofdstukken gedurende het gehele herzieningsproces, intensieve samenwerking met het RIVM/LCI plaatsgevonden. Daar waar geen gepubliceerd bewijs voorhanden was, is per definitie gebruik gemaakt van expert opinies zoals deze tijdens de verschillende overlegmomenten werden geformuleerd.
Voor de onderbouwing van de diagnostiek en behandel adviezen van chlamydiasis is wel meer bewijs voorhanden. Voor het hoofdstuk C1. Chlamydiasis (inclusief lymphogranuloma venereum) hebben we dankbaar gebruikgemaakt van de NHG-Standaard: Het soa-consult (NHG, 2022). Deze NHG-Standaard is recent (2022) voor wat betreft de non-LGV-chlamydia-infecties herzien door het Nederlands Huisartsen Genootschap, waarbij er gebruik is gemaakt van de GRADE-methodiek om meerdere uitgangsvragen te beantwoorden. Deze methodiek is terug te vinden in het document ‘totstandkoming en methoden’ van deze NHG-Standaard. Daar waar is afgeweken van het advies in deze standaard staat dat nadrukkelijk vermeld in de tekst. De hoofdstukken B1. Urethritis, B2. Fluor vaginalis en vaginitis, B3. Acute epididymitis (bij volwassenen) zijn eveneens grotendeels afkomstig uit de NHG-Standaarden en NHG-Behandelrichtlijnen (‘Het soa-consult’, ‘Fluor vaginalis’ en ‘Acute epididymitis bij volwassenen’’) met enkele aanpassingen en toevoegingen uit recentere literatuur. Voor achtergrondinformatie bij de tekst van dit hoofdstuk (inclusief een uitvoerige onderbouwing) verwijzen we naar de volledige NHG-Standaard en diens ‘totstandkoming en methoden’.
De conceptteksten werden tijdens verschillende subgroepvergaderingen en een eendaagse plenaire bijeenkomst besproken. De conceptteksten zijn vervolgens, na verwerking van de commentaren van verschillende betrokken wetenschappelijke en beroepsverenigingen en instanties, eind 2023 aangeboden ter autorisatie (zie: initiatief en autorisatie). De richtlijn biedt de mogelijkheid om per gezondheidechelon (0e lijn, GGD; 1e lijn, huisarts; 2e lijn, ziekenhuis) de meest geëigende keuzes te maken in het te voeren beleid. Dit houdt bijvoorbeeld in dat er verschillen kunnen bestaan in testbeleid voor urogenitale chlamydia-infecties tussen de verschillende echelons.
Belangrijkste wijzigingen
Zie de ‘Algemene inleiding’ van de MDR Soa.
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld voor deze richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is gezocht naar en gebruik gemaakt van onderzoek waarvan de resultaten bijdragen aan een antwoord op relevante vraagstukken uit de klinische praktijk. Voor deze herziening is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om vraagstukken te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is te raadplegen in bijlage 4.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar, voor zover mogelijk, wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Een richtlijn beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een richtlijn in een register betekent dus niet noodzakelijkerwijs dat de in de richtlijn beschreven zorg verzekerde zorg is. Informatie over kosten zoals beschreven in de richtlijn is gebaseerd op beschikbare gegevens ten tijde van schrijven.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen, (patiënt)organisaties en stakeholders voorgelegd ter commentaar (zie ook tabel 2). De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd ter autorisatie.