Soort vaattoegang en locatie voor hemodialyse
Uitgangsvraag
Wat is de optimale soort en locatie van een nieuwe vaattoegang voor hemodialyse?
Aanbeveling
Kies in overleg met de patiënt in geval van een lange levensverwachting bij voorkeur voor een distale arterioveneuze fistel (volgorde: radiocephalica fistel, brachiocephalica fistel, brachiobasilica fistel) en in tweede instantie voor een arterioveneuze graft.
Kies in overleg met de patiënt in geval van een beperkte levensverwachting bij voorkeur voor een arterioveneuze fistel of een arterioveneuze graft.
Volg voor het gepland starten van hemodialyse met een tijdelijke of permanente dialysekatheter de richtlijn ‘Zorg voor eindstadium nierfalen’.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de optimale soort en locatie van een nieuwe vaattoegang voor hemodialyse. De KDOQI richtlijn (Lok, 2020) vond beperkt literatuur die richting kon geven aan de besluitvorming. Niet alle uitkomstmaten werden beschreven en de kwaliteit van bewijs was laag tot zeer laag. Er is dus zowel voor de optimale soort als de optimale locatie van een nieuwe vaattoegang voor hemodialyse sprake van een kennislacune. De aanbevelingen worden daarom gebaseerd op consensus en expert opinion, waar mogelijk onderbouwd met (indirecte) literatuur.
Arterioveneuze fistels en grafts
Wanneer een arterioveneuze fistel zich heeft ontwikkeld tot een functionele vaattoegang, is het aantal interventies dat nodig is om de vaattoegang te behouden lager dan bij een arterioveneuze graft. Bovendien is de functionele secundaire patency langer en de kans op infectieuze complicaties kleiner bij arterioveneuze fistels ten opzichte van grafts. Helaas ontwikkelt in Nederland slechts 54% van de arterioveneuze fistels zich spontaan tot een functionele vaattoegang en zal 22% van de aangelegde arterioveneuze fistels ondanks aanvullende interventies om maturatie te bevorderen nooit functioneel worden (Van Vliet, 2023). Risicofactoren voor een niet-functionele vaattoegang zijn hogere leeftijd, vrouwelijk geslacht, perifeer arterieel vaatlijden, diabetes mellitus en radiocephalica fistels (Lok, 2006; Yan, 2018; Voorzaat, 2018).
Om tijd te geven voor de ontwikkeling tot een functionele vaattoegang worden arterioveneuze fistels bij voorkeur 3 tot 6 maanden voor de verwachte start met hemodialyse aangelegd. Het verloop van de nierfunctie en het ontstaan van uremische klachten is echter moeilijk in te schatten. In Nederland was 40% van de patiënten die een arterioveneuze fistel kreeg in de voorbereidingsfase voor hemodialyse een jaar later niet gestart met dialysebehandeling (Shunt Simulatie Studie, 2021). Dit vormt met name bij oudere patiënten een bezwaar, omdat hun nierfunctie vaker stabiel blijft en omdat zij kunnen overlijden voordat dialyse nodig is. Hierdoor blijft 35% van de arterioveneuze fistels die bij ouderen in de voorbereidingsfase voor hemodialyse worden aangelegd uiteindelijk ongebruikt (Lee, 2015).
Het gebruik van arterioveneuze grafts kent een omgekeerd patroon van voor- en nadelen. Arterioveneuze grafts kunnen vrijwel direct na plaatsing gebruikt worden en resulteren in Nederland in 94% van de gevallen in een functionele vaattoegang (Voorzaat, 2018). Het is dus niet nodig om grafts op voorhand te plaatsen. Het aantal interventies dat nodig is om de vaattoegang te behouden is echter hoger dan bij arterioveneuze fistels, met name doordat de ontwikkeling van intima hyperplasie bij de graft-veneuze anastomose op de middellange termijn aanleiding geeft tot stenose en trombose van de vaattoegang. In Nederland waren hierdoor 3,3 interventies per jaar nodig voor arterioveneuze grafts en 1,6 interventies per jaar voor arterioveneuze fistels vanaf het moment dat deze vaattoegangen functioneel waren (Voorzaat, 2020).
In diverse observationele studies is de levensduur van de arterioveneuze fistels en grafts vergelijkbaar wanneer de follow-up begint op het moment dat de vaattoegang wordt aangelegd (Maya, 2009; Lok, 2013; Voorzaat, 2020). Wanneer de follow-up begint op het moment waarop de vaattoegang wordt gebruikt ontstaat een bias doordat niet-functionele fistels worden weggelaten uit de analyse. Deze bias zorgt ervoor dat in analyses van landelijke dialyseregistraties arterioveneuze fistels een betere patency lijken te hebben dan arterioveneuze grafts.
Samengevat hebben arterioveneuze grafts voordelen op de korte termijn en hebben arterioveneuze fistels voordelen op de lange termijn. Het plaatsen van een arterioveneuze graft kan bovendien de mogelijkheden beperken om later een arterioveneuze fistel aan te leggen. Hieruit volgt dat arterioveneuze fistels de voorkeur hebben bij patiënten met een lange levensverwachting en dat arterioveneuze grafts met name geschikt zijn voor patiënten met een beperkte levensverwachting en met risicofactoren voor non-maturatie.
Ten aanzien van de locatie van de vaattoegang lijken radiocephalica fistels zich in de Nederlandse praktijk minder vaak te ontwikkelen tot een functionele vaattoegang dan brachiocephalica en brachiobasilica fistels (76% versus 89%; Voorzaat, 2018). Functionele radiocephalica fistels hebben echter minder interventies nodig om te blijven functioneren (1,3 versus 1,8 interventies per jaar; Voorzaat, 2020). Radiocephalica fistels hebben als voordelen dat er minder risico op handischemie en high-flow is dan bij elleboogfistels en dat de mogelijkheden voor toekomstige vaattoegangen optimaal worden gebruikt. Een gerandomiseerde studie laat geen verschil zien tussen de functie van brachiocephalica fistels en brachiobasilica fistels (Koksoy, 2009). Het aanleggen van een brachiobasilica fistel is echter een uitgebreidere operatie dan het aanleggen van een brachiocephalica fistel. Hieruit volgt dat radiocephalica fistels de voorkeur hebben bij patiënten met een lange levensverwachting of met een verwacht goede maturatie en dat brachiocephalica fistels de voorkeur hebben bij patiënten met een beperkte levensverwachting of met risicofactoren voor non-maturatie. Voor arterioveneuze grafts werd in een observationele studie geen verschil gevonden in de levensduur van grafts in de onderarm of in de bovenarm en tussen een loop of een straight configuratie (Farber, 2015).
Centraal veneuze katheters
Van oudsher wordt in internationale richtlijnen geadviseerd om centraal veneuze katheters pas als laatste keuze te gebruiken als permanente vaattoegang voor hemodialyse. Nadelen van centraal veneuze katheters zijn het risico op lijnsepsis en op thoracale centraal veneuze obstructies. Stapsgewijze verbeteringen in de verpleegkundige zorg voor dialysekatheters hebben er echter toe geleid dat in recente gerandomiseerde studies de incidentie van lijnsepsis is gedaald tot minder dan 0,3 episodes per 1000 katheterdagen (zie Module ‘Gebruik en verzorging’). Ongeveer de helft van de patiënten met een lijnsepsis wordt hiervoor in het ziekenhuis opgenomen en slechts 1% van de patiënten overlijdt als gevolg van een lijnsepsis (Farrington, 2019). De kans op een ernstige infectie als gevolg van een centraal veneuze katheter is dus erg klein voor individuele patiënten (gemiddeld eens in de 20 jaar).
Toch wordt er in observationele studies meer dan 50% hogere mortaliteit waargenomen bij patiënten met een centraal veneuze katheter dan bij patiënten met een arterioveneuze fistel (Ravani, 2013). Het is zeer waarschijnlijk dat een belangrijk deel van deze verhoogde mortaliteit wordt verklaard door confounding. Het starten van hemodialyse via een arterioveneuze fistel is alleen mogelijk wanneer patiënten bekend zijn bij een nefroloog en tijdig verwezen zijn voor het aanleggen van een vaattoegang en wanneer de bloedvaten in de arm van voldoende kwaliteit zijn voor het creëren en ontwikkelen van een functionele arterioveneuze fistel. Patiënten die zich acuut presenteren met nierfalen, die vanwege cardiovasculaire ziekte of ongeschikte bloedvaten geen arterioveneuze fistel kunnen krijgen of bij wie een aangelegde fistel zich niet ontwikkelt tot een functionele vaattoegang, worden genoodzaakt om een centraal veneuze katheter te gebruiken. Deze omstandigheden zorgen ervoor dat patiënten met een functionele arterioveneuze fistel een betere prognose hebben dan patiënten met een centraal veneuze katheter zonder dat dit door de vaattoegang zelf wordt veroorzaakt. Statistische correctie voor confounding en vergelijking van specifieke patiëntengroepen met minder kans op confounding maken aannemelijk dat minstens de helft van het mortaliteitseffect niet veroorzaakt wordt door de vaattoegang zelf (Brown, 2017; Grubbs, 2014; Quinn, 2017).
Voordelen van centraal veneuze katheters zijn dat ze direct gebruikt kunnen worden voor hemodialyse en dat het niet nodig is om te cannuleren en af te drukken. Bovendien kunnen centraal veneuze katheters voor uitzonderlijke patiënten de enige mogelijkheid zijn om een permanente vaattoegang voor hemodialyse te creëren, bijvoorbeeld bij patiënten met ernstig hartfalen of handischemie (zie richtlijn ‘Zorg voor eindstadium nierfalen’). Centraal veneuze katheters kunnen uiteraard ook tijdelijk worden gebruikt voor patiënten die zich acuut presenteren met nierfalen, voor patiënten met complicaties bij peritoneaal dialyse of bij hemodialyse via een arterioveneuze fistel of graft en voor patiënten die op korte termijn (binnen 6 maanden) een niertransplantatie zullen ontvangen van een levende donor.
Een centraal veneuze dialysekatheter kan op verschillende locaties worden geplaatst, waarbij het gebruikelijk is om de volgende rangorde aan te houden: v. jugularis rechts, v. jugularis links, v. femoralis, v. subclavia, complexe locaties (translumbaal of transhepatisch; KDOQI 2019 Update, recommendation 3.2). Er zijn geen gerandomiseerde studies gedaan waarin deze locaties bij chronische hemodialyse patiënten worden vergeleken. In 1 gerandomiseerde studie bij 750 patiënten op de intensive care unit hadden niet-getunnelde dialysekatheters in v. femoralis een vergelijkbare kans op lijnsepsis als niet-getunnelde dialysekatheters in v. jugularis (Parienti, 2008). In de Nederlandse observationele DUCATHO studie bij 1603 patiënten lijkt het risico op infectie en disfunctie van niet-getunnelde dialysekatheters in v. femoralis echter groter dan van niet-getunnelde dialysekatheters in v. jugularis (Van Oevelen, 2019). In observationele studies wordt bovendien minder infectie en disfunctie gezien bij getunnelde dialysekatheters in v. jugularis rechts dan in v. jugularis links (Engstrom, 2013; Shingarev, 2013). Wanneer al is besloten om een arterioveneuze fistel in de rechter arm aan te leggen, kan het verstandig zijn om toch te kiezen voor een dialysekatheter in v. jugularis links om thoracale centraal veneuze obstructie aan de zijde van de toekomstige vaattoegang te voorkomen. Dialysekatheters in v. subclavia worden bij voorkeur vermeden om thoracale centraal veneuze obstructies te voorkomen (zie richtlijn ‘Zorg voor eindstadium nierfalen’).
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Een goed functionerende vaattoegang is van groot belang voor dialysepatiënten en hun zorgverleners. Interventies aan de vaattoegang kunnen belastend zijn voor patiënten. Het is daarom wenselijk om met zo min mogelijk interventies een functionele vaattoegang te bereiken en behouden. De strategie om een functionele vaattoegang te creëren dient te passen binnen het overkoepelende beleid dat samen met de patiënt is opgesteld om een leven lang nierfunctievervangende behandeling te kunnen garanderen. Daarnaast is het een belangrijke praktische overweging om rekening te houden met de dominante arm wanneer patiënten zelf willen cannuleren of hun arm willen gebruiken tijdens de dialyse behandelingen.
In een enquête onder 224 dialysepatiënten en hun verzorgers waren de functie van de vaattoegang, infecties, aneurysmata, cannulatie problemen en ziekenhuisopnames de 5 belangrijkste uitkomstmaten voor onderzoeken naar de vaattoegang voor hemodialyse (Viecelli, 2020). In een systematische review van 46 kwalitatieve studies bij 1034 patiënten werd een thematische synthese gepresenteerd van het perspectief van de patiënt bij het aanleggen van een vaattoegang voor hemodialyse (Casey, 2014). Hieruit wordt duidelijk dat het aanleggen van een vaattoegang voor patiënten veel meer betekent dan een chirurgische operatie. Patiënten kunnen hun vaattoegang ervaren als een uiterlijke verminking, als een voortdurende bron van kwetsbaarheid en als een mechanisatie van hun lichaam. Daarnaast vormt het starten van hemodialyse voor patiënten een bron van confronterende beslissingen, een inbreuk op hun levenswijze en een aanzet tot zelfbehoud en regie. Zorgen over cannulatie en aanvullende interventies bij non-maturatie van arterioveneuze fistels zijn voor patiënten belangrijke redenen om een voorkeur te geven aan het gebruik van een centraal veneuze katheter. Tijdige voorlichting is belangrijk om patiënten emotioneel voor te bereiden op het aanleggen van een vaattoegang voor hemodialyse en de lange termijn consequenties van een leven met eindstadium nierfalen. Daarbij is het belangrijk dat de principes van ‘Samen beslissen’ worden toegepast (zie Module ‘Randvoorwaarden (Organisatie van zorg)’).
Kosten (middelenbeslag)
Ten aanzien van de soort vaattoegang is er een observationele studie uit de Verenigde Staten waarin de medische kosten gerelateerd aan de vaattoegang werden bijgehouden voor 479 patiënten die startten met dialyse via een tijdelijke centraal veneuze katheter (Al-Balas, 2017). De jaarlijkse medische kosten waren gemiddeld $10.642 voor patiënten die een arterioveneuze fistel kregen, $6.810 voor patiënten die een arterioveneuze graft kregen en $28.709 voor patiënten die bleven dialyseren met een centraal veneuze katheter. Vanwege het risico op bias door de observationele onderzoeksopzet en het andere financiële zorgsysteem levert deze studie echter onvoldoende bewijs om de kosteneffectiviteit van verschillende soorten of locaties van de vaattoegang voor hemodialyse te kunnen beoordelen.
Aanvaardbaarheid, haalbaarheid en implementatie
Het acceptabele risico op een niet-functionele vaattoegang is afhankelijk van kenmerken van de patiënt. Zo is het voor een jonge patiënt met een lange levensverwachting belangrijk om zo veel mogelijk opties voor vaattoegangen te behouden. Voor oudere patiënten met een korte levensverwachting weegt een vlotte maturatie van de vaattoegang zonder aanvullende interventies zwaarder, waardoor eerder gekozen zal worden voor een configuratie met een grotere kans om snel een functionele vaattoegang te bereiken.
De inschatting van de levensverwachting wordt door het behandelteam gemaakt, waarbij gebruik kan worden gemaakt van klinische predictiemodellen. In een meta-analyse van 32 predictiemodellen die de levensverwachting voorspellen van patiënten die starten met dialyse, was de discriminatie van de predictiemodellen met externe validatie redelijk tot goed (c-statistic 0,70; 95% CI: 0,68 tot 0,71) en was er onvoldoende informatie over de kalibratie van deze modellen (Anderson, 2019). De manier waarop deze predictiemodellen kunnen worden ingezet bij de zorg voor patiënten met eindstadium nierfalen is echter nog niet duidelijk.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het is van belang om samen met de patiënt een individueel behandelplan te maken op basis van de voordelen en nadelen van de mogelijke vaattoegangen. Hierbij zijn naast de kwaliteit van de bloedvaten ook comorbiditeit, de beschikbare tijd ter voorbereiding van de vaattoegang, de verwachte duur van hemodialyse en de levensverwachting van de patiënt van belang. Het behandelplan dient bovendien te passen binnen het overkoepelende beleid om een leven lang nierfunctievervangende behandeling te kunnen garanderen (eindstadium nierfalen levensplan; zie richtlijn ‘Zorg bij eindstadium nierfalen’). Hierbij wordt rekening gehouden met de toekomstige behandelopties, de sociale en klinische situatie van de patiënt en de behandelvoorkeuren van de patiënt.
Arterioveneuze fistels hebben de voorkeur bij patiënten met een lange levensverwachting vanwege het kleinere aantal interventies op de lange termijn en het behoud van toekomstige mogelijkheden voor vaattoegangen. Arterioveneuze grafts zijn met name geschikt voor patiënten met een beperkte levensverwachting (minder dan 2 jaar) om aanvullende interventies bij non-maturatie en het aanleggen van een ongebruikte vaattoegang te vermijden. Radiocephalica fistels hebben de voorkeur bij jonge patiënten met een zeer lange levensverwachting of met een verwacht goede maturatie om toekomstige mogelijkheden voor vaattoegangen te behouden. Brachiocephalica fistels hebben de voorkeur bij patiënten met een minder lange levensverwachting of met risicofactoren voor non-maturatie om aanvullende interventies bij non-maturatie te vermijden. Het gebruik van permanente centraal veneuze katheters wordt in observationele studies geassocieerd met een verhoogd risico op mortaliteit. Hoewel dit risico grotendeels verklaard wordt door confounding, lijkt het de werkgroep toch verstandig om het gebruik van permanente centraal veneuze katheters niet aan te bevelen, behalve voor patiënten met een zeer korte levensverwachting (minder dan 6 maanden) of wanneer geen andere vaattoegang mogelijk is. Mogelijk zal dit standpunt veranderen op basis van de resultaten van diverse gerandomiseerde onderzoeken die in de komende jaren worden uitgevoerd. Een van deze onderzoeken is de Nederlandse OASIS zorgevaluatie waarin arterioveneuze fistels, arterioveneuze grafts en centraal veneuze katheters worden vergeleken bij oudere patiënten met een beperkte levensverwachting die starten met hemodialyse; andere onderzoeken zijn ELDERLY (NCT03065972), ACCESS HD (NCT02675569) en AUSTRIA (NCT03764358). Het gebruik van een permanente centraal veneuze katheter bij patiënten met een lange levensverwachting wordt afgeraden vanwege het risico op thoracale centraal veneuze obstructie waardoor de toekomstige mogelijkheden voor een alternatieve vaattoegang sterk kunnen worden beperkt. De werkgroep sluit hierbij aan bij de aanbevelingen van de KDOQI 2019. Indicaties voor het gepland starten van hemodialyse met een tijdelijke of permanente dialysekatheter worden behandeld in de richtlijn ‘Zorg voor eindstadium nierfalen’.
Inbedding in de zorg
Behalve deze geprioriteerde uitgangsvragen zijn er in de dagelijkse praktijk diverse andere aandachtspunten van belang, die kort zijn samengevat in de onderstaande tekst. De werkgroep sluit zich hiervoor aan bij de aanbevelingen van nationale en internationale richtlijnen. Voor verdere toelichting en onderbouwing wordt verwezen naar de betreffende richtlijnen.
Operatieve techniek bij arterioveneuze fistels en grafts
Arterioveneuze anastomose
De configuratie van de vasculaire anastomose bepaalt het hemodynamische stroomprofiel in een arterioveneuze fistel. Een afwijkend stroomprofiel kan een stenose als gevolg van intima hyperplasie veroorzaken. De vaatchirurg bepaalt tijdens de operatie het type anastomose (side artery-to-end vein, side artery-to-side vein, of end artery-to-side vein bij een radiocephalica fistel). In 4 gerandomiseerde studies bij 567 patiënten waarin een side artery-to-end vein anastomose werd vergeleken met een side artery-to-side vein anastomose werd echter geen functioneel verschil gevonden tussen de mogelijke configuraties van de arterioveneuze anastomose.
Recent werden medische hulpmiddelen geintroduceerd die het mogelijk maken om een endovasculaire arterioveneuze anastomose te maken. In vergelijkende observationele onderzoeken lijken deze technieken geassocieerd te zijn met een minder goede functie van de vaattoegang (gedefinieerd als een kleiner percentage functionele vaattoegangen, een lagere secundaire patency of een groter aantal interventies aan de vaattoegang) ten opzichte van een chirurgisch aangelegde anastomose ter hoogte van de elleboog. Wel heeft de endovasculaire techniek een kortere operatieduur en is de kans op handischemie en een high-flow vaattoegang opvallend laag.
Veneuze transpositie
Wanneer een brachiobasilica fistel wordt gecreëerd, dient de v. basilica gesuperficialiseerd te worden om cannulatie mogelijk te maken. De vaatchirurg heeft de keuze om dit in één operatie te doen (one-stage) of om de vene pas na een periode van maturatie te superficialiseren (two-stage). In een meta-analyse van 2 gerandomiseerde studies bij 56 patiënten en 10 observationele studies bij 1080 patiënten werd geen verschil gevonden tussen een one-stage en een two-stage benadering in het percentage functionele fistels en in de levensduur van de vaattoegang. Het nadeel van de two-stage benadering is dat de patiënt tweemaal geopereerd moet worden. Het lijkt daarom verstandig om een one-stage benadering te kiezen, tenzij op basis van de kwaliteit van de bloedvaten twijfel bestaat over de maturatie van de brachiobasilica fistel.
Materiaal vaatprothese
De standaard vaatprothese die voor een arterioveneuze graft wordt gebruikt is een standard-wall 6mm PTFE buis. Andere materialen zoals dacron of polyurethaan resulteerden in kleine gerandomiseerde studies niet in een betere functie van de vaattoegang. Ook diverse modificaties van de vaatprothese, zoals een dunnere wand, een taps toelopend uiteinde of een inwendige coating met heparine gaven in kleine gerandomiseerde studies geen verbetering in de functie van de vaattoegang. In een meta-analyse van 3 gerandomiseerde studies met 257 patiënten had ook een wijde cuff bij de veneuze anastomose geen significant effect op primaire en secundaire patency van de vaattoegang.
Voor patiënten die snel moeten dialyseren bestaan er specifieke vaatprothesen met meerdere lagen PTFE die bloedingen in een recent tunneltraject voorkomen (bijvoorbeeld Flixene en Acuseal). Gebruik deze early cannulation grafts wanneer de vaattoegang binnen 2 weken gebruikt moet worden (KDOQI 2019 Update, recommendation 4.2). Wanneer in uitzonderlijke omstandigheden een arterioveneuze graft in een geïnfecteerd gebied moet worden aangelegd kan een biosynthetische graft (bijvoorbeeld Omniflow) worden overwogen (ESVS Clinical Practice Guidelines, recommendation 23). Volledig biologische grafts voor hemodialyse zijn bij het verschijnen van deze richtlijn niet beschikbaar in Nederland.
Kwaliteitscontrole
Bij het creëren van een arterioveneuze fistel of graft dient aan het einde van de operatie een thrill en een souffle aanwezig te zijn. Als dit niet het geval is, dient de oorzaak van het probleem te worden opgespoord en verholpen (ESVS Clinical Practice Guidelines, recommendation 25). Bij hypotensie kan de bloeddruk worden verhoogd door rehydratie en vasopressie. Bij vasospasme kan lokaal papaverine op de bloedvaten worden aangebracht. Tenslotte kan de afvoerende vene worden gecontroleerd op draaien en knikken en kan de vasculaire anastomose worden gecontroleerd op stolsels en technische fouten.
Operatieve techniek bij centraal veneuze katheters
Beeldvorming bij het inbrengen van centraal veneuze katheters
Bij het inbrengen van een centraal veneuze katheter kan beeldvorming worden ingezet om succesvolle plaatsing van de katheter te bevorderen en complicaties zoals arteriële punctie te voorkomen. In een meta-analyse van 14 gerandomiseerde studies bij 3172 volwassen patiënten gaf echogeleide punctie van v. jugularis minder complicaties (3% versus 12%) en meer succesvolle ingrepen (99% versus 90%) dan bij punctie zonder echografie. In een meta-analyse van 4 gerandomiseerde studies bij 311 patiënten voorkwam echogeleide punctie van v. femoralis geen complicaties maar was de eerste punctie wel vaker succesvol dan bij punctie zonder echografie. Maak daarom gebruik van echogeleide punctie bij het inbrengen van een centraal veneuze katheter in v. jugularis en overweeg om dit te doen wanneer de katheter in v. femoralis wordt ingebracht (KDOQI 2019 Update, recommendation 9.1).
Om een goede functie van de dialysekatheter te waarborgen dient de kathetertip in het midden van het rechter atrium te liggen. Controleer bij het inbrengen van een centraal veneuze katheter in v. jugularis daarom tijdens de ingreep de positie van de katheter met röntgendoorlichting (KDOQI 2019 Update, recommendation 9.1). Bij het inbrengen van een centraal veneuze katheter in v. jugularis rechts kan om logistieke redenen worden overwogen om de positie van de katheter pas na afloop van de ingreep te controleren met röntgendoorlichting.
Ontwerp van centraal veneuze katheters
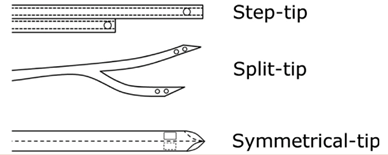
Centraal veneuze dialysekatheters zijn verkrijgbaar met verschillende vormen van de kathetertip: een step-tip, een split-tip en een symmetrical-tip (zie figuur). Het ontwerp van de kathetertip heeft invloed op het hemodynamische stroomprofiel. In een meta-analyse van 7 gerandomiseerde studies bij 786 patiënten en 1 observationele studie bij 204 patiënten was er echter geen verschil in infectie, trombose of levensduur van de katheter op basis van het ontwerp van de kathetertip. In twee kleine gerandomiseerde studies werd geen voordeel gevonden van antimicrobiële coating met zilver op dialysekatheters.
Tunnelen van centraal veneuze katheters
Er zijn geen gerandomiseerde studies gedaan waarin het effect van het inbrengen van centraal veneuze katheters via een subcutane tunnel werd onderzocht. De grootste observationele studie die niet-getunnelde en getunnelde centraal veneuze katheters vergeleek is de Nederlandse DUCATHO studie bij 1603 patiënten met een eerste katheter voor intermitterende hemodialyse. In een multivariabele regressieanalyse werden geen significante verschillen gevonden in infectie of disfunctie tussen niet-getunnelde en getunnelde centraal veneuze katheters in v. jugularis. Niet-getunnelde katheters werden echter significant sneller verwijderd vanwege infectie of disfunctie dan getunnelde katheters (HR 0,52, 95% CI: 0,36 tot 0,74). In Nederland worden relatief veel precurved niet-getunnelde dialysekatheters gebruikt die comfortabeler zijn dan rechte niet-getunnelde katheters. Hoewel precurved katheters minder snel werden verwijderd dan rechte niet-getunnelde katheters, werden ze eerder verwijderd dan getunnelde katheters. Breng daarom een getunnelde centraal veneuze katheter in wanneer dit de permanente vaattoegang voor hemodialyse is (KDOQI 2019 Update, recommendation 2.10). Overweeg om een getunnelde of een precurved niet-getunnelde centraal veneuze katheter in te brengen wanneer dit een tijdelijke vaattoegang voor hemodialyse is en de katheter naar verwachting op korte termijn (binnen ongeveer 6 weken) kan worden verwijderd (KDOQI 2019 Update, recommendation 2.11).
Onderbouwing
Conclusies / Summary of Findings
1. Type of vascular access
|
Low GRADE |
Patients undergoing hemodialysis with an arteriovenous fistula may have fewer access-related interventions (better access function) compared with patients with a central venous catheter.
Sources: (Lok, 2020) |
|
Low GRADE |
Patients undergoing hemodialysis with an arteriovenous fistula may have fewer access-related interventions (better access function) compared with patients with an arteriovenous graft.
Sources: (Lok, 2020) |
|
- GRADE |
For vascular access type, it was not possible to draw conclusions or grade the level of evidence for the outcome (health-related) quality of life, due to the absence of data. |
|
Low GRADE |
Patients starting hemodialysis with an arteriovenous fistula may have fewer blood stream infections (complications) compared with patients with a central venous catheter.
Sources: (Lok, 2020) |
|
- GRADE |
It was not possible to draw conclusions or grade the level of evidence for the outcome complications between arteriovenous fistula and grafts, due to the absence of data. |
|
Low GRADE |
In patients undergoing hemodialysis with an arteriovenous fistula, mortality may be lower compared with patients with an arteriovenous graft.
Sources: (Lok, 2020) |
|
Very low GRADE |
It is unclear whether mortality is different between patients with an arteriovenous fistula or graft compared with patients with a central venous catheter.
Sources: (Lok, 2020) |
|
- GRADE |
For vascular access type, it was not possible to draw conclusions or grade the level of evidence for the outcome patient satisfaction, due to the absence of data. |
2. Vascular access location
|
Low GRADE |
Vascular access function may not be different between a brachiobasilic fistula and a brachiocephalic fistula in patients undergoing hemodialysis.
Sources: (Lok, 2020) |
|
Very low GRADE |
It is unclear whether vascular access location affects vascular access function in patients with an arteriovenous graft for hemodialysis.
Sources: (Lok, 2020) |
|
- GRADE |
For vascular access location, it was not possible to draw conclusions or grade the level of evidence for the outcome (health-related) quality of life, due to the absence of data. |
|
- GRADE |
For vascular access location, it was not possible to draw conclusions or grade the level of evidence for the outcome complications, due to the absence of data. |
|
Very low GRADE |
It is unclear whether mortality is different between patients with a brachiobasilic fistula and a brachiocephalic fistula.
Sources: (Lok, 2020) |
|
- GRADE |
For arteriovenous graft location, it was not possible to draw conclusions or grade the level of evidence for the outcome mortality, due to the absence of data. |
|
- GRADE |
For vascular access location, it was not possible to draw conclusions or grade the level of evidence for the outcome patient satisfaction, due to the absence of data. |
Samenvatting literatuur
Description of studies
Only studies of low to moderate risk of bias were included in the KDOQI guideline (Lok, 2020). Heterogeneity in study populations and methods prevented data pooling. We refer to the guideline for study details.
Results
1. Type of vascular access
Vascular access function
For patients starting hemodialysis treatment, no outcome indicative for vascular access function was reported. For patients on hemodialysis treatment, vascular access events requiring intervention were reported in one observational study, reporting an OR of 0.30 (95% CI: 0.22 to 0.43) in arteriovenous fistulas compared to central venous catheters. The difference was considered clinically relevant, and the level of evidence was considered low.
When comparing arteriovenous fistulas and grafts, one observational study reported an OR for vascular access events requiring intervention of 0.28 (95% CI: 0.20 to 0.38) in favor of fistulas. The difference was considered clinically relevant, and the level of evidence was considered low.
Health-related quality of life
The outcome health-related quality of life was not reported for type of vascular access in the KDOQI guideline.
Complications
In one study, blood stream infections were lower among patients starting hemodialysis treatment with an arteriovenous fistula (6.4%) versus a central venous catheter (15%), resulting in a HR of 0.28 (95% confidence interval not reported). The difference was considered clinically relevant, with a low level of evidence. Complications were not compared between patients with an arteriovenous fistula and graft.
Mortality
For patients starting hemodialysis treatment, 3 observational studies with follow-up to 5 years compared mortality between arteriovenous fistulas or grafts (n=99,738) and central venous catheters (n=438,241) and found a hazard ratio of 0.69 (95% CI: 0.64 to 0.66), 0.63 (95% CI: 0.57 to 0.69) and 0.56 (95% CI: 0.46 to 0.63). The level of evidence was considered very low. Therefore, these results cannot help in clinical decision making. For patients on hemodialysis treatment, mortality was described in 2 observational studies. With hazard ratios of 0.48 (95% CI: 0.34 to 0.68) and 0.72 (95% CI: 0.68 to 0.76), mortality was lower with an arteriovenous fistula or graft versus a central venous catheter. The difference was considered clinically relevant, but the level of evidence was considered very low.
When comparing arteriovenous fistulas and grafts, one observational study reported a hazard ratio of 0.89 (95% CI: 0.84 to 0.93) in favor of fistulas (Lok, 2020). The difference was considered clinically relevant, and the level of evidence was considered low.
Patient satisfaction
The outcome patient satisfaction was not reported for type of vascular access in the KDOQI guideline.
2. Vascular access location
One RCT and eight observational studies evaluated different vascular access locations.
Vascular access function
For arteriovenous fistula location, one study was included in the analysis. In one RCT (n=100) among patients in whom a previous forearm fistula had failed or a forearm fistula was not feasible, primary patency was not significantly different with a brachiobasilic fistula versus a brachiocephalic fistula at 1 year (RR 0.98; 95% CI: 0.84 to 1.34) or 3 years (RR 0.90; 95% CI: 0.73 to 1.11). Similarly, secondary patency was not significantly different with a brachiobasilic fistula versus a brachiocephalic fistula at 1 year (RR 1.02; 95% CI: 0.88 to 1.19) or 3 years (RR 1.02; 95% CI: 0.80 to 1.32). The level of evidence was low, because of applicability (bias due to indirectness) and limited number of included patients (imprecision).
Seven of the observational studies compared various arteriovenous fistula configurations, including radiocephalic, brachiocephalic, and brachiobasilic fistulas. Three studies had high risk of bias and were not extracted or used in this analysis. The remaining studies could not be used for clinical decision making due to the poor quality and inconsistent evidence (Lok, 2020).
For arteriovenous graft location, only a secondary analysis of an RCT evaluating the effect of dipyridamole plus aspirin was available. In this study, both primary and secondary patency did not differ by location at 1 year of follow-up. Primary patency was 30% in forearm grafts and 22% in upper arm grafts. Secondary patency was 67% and 64% for forearm and upper arm grafts, respectively (adjusted HR 1.36; 95% CI: 0.94 to 1.97). Due to the limitations in study design, the small study population, and the overlap of confidence intervals with the limits of clinical decision-making, the level of evidence was considered very low.
Health-related quality of life
The outcome health-related quality of life was not reported for vascular access location in the KDOQI guideline.
Complications
The outcome complications was not reported for vascular access location in the KDOQI guideline.
Mortality
In the RCT comparing brachiobasilic with brachiocephalic fistulas described previously, the relative risk for mortality was 0.56 (95% CI: 0.29 to 1.09) in favor of brachiobasilic fistulas. The level of evidence was very low, because of applicability (bias due to indirectness), the limited study population, and the overlap of the confidence interval with the limits of clinical decision making (both imprecision).
Patient satisfaction
The outcome patient satisfaction was not reported for vascular access location in the KDOQI guideline.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
1. Type of vascular access
a. fistula/graft vs. central venous catheter
P: patients receiving a new vascular access for hemodialysis;
I: autologous arteriovenous fistula or synthetic arteriovenous graft;
C: central venous catheter;
O: health-related quality of life, vascular access function (access-related intervention rate, proportion of functional vascular access), complications, patient satisfaction, mortality.
b. fistula versus graft
P: patients receiving a new vascular access for hemodialysis;
I: autologous arteriovenous fistula;
C: synthetic arteriovenous graft;
O: health-related quality of life, vascular access function (access-related intervention rate, proportion of functional arteriovenous fistulas or grafts), complications, patient satisfaction, mortality.
2. Location of vascular access
a. fistula
P: patients receiving a new arteriovenous fistula for hemodialysis;
I: radiocephalic fistula / brachiocephalic fistula / brachiobasilic fistula;
C: other location (including location mentioned under I);
O: health-related quality of life, vascular access function (access-related intervention rate, proportion of functional arteriovenous fistulas), complications, patient satisfaction, mortality.
b. graft
P: patients receiving a new arteriovenous graft for hemodialysis;
I: upper arm graft;
C: forearm graft;
O: health-related quality of life, vascular access function (access-related intervention rate, proportion of functional arteriovenous grafts), complications, patient satisfaction, mortality.
Relevant outcomes
The guideline development group considered health-related quality of life and vascular access function (i.e. access-related intervention rates and the proportion of functional arteriovenous fistulas or grafts) as a critical outcome for decision making; and patient satisfaction, complications, and mortality as important outcomes for decision making.
The working group did not define the outcomes listed above a priori, but followed the definitions used in the studies.
As minimal clinically (patient) important differences, the working group used 5% for mortality (risk ratio, RR), 25% for other RR, 0.8 interventions per patient per year for access-related intervention rate, 10% of the maximum score for continuous outcomes (quality of life scales) and 0.5 for standardized mean differences.
Search and select (Methods)
During the development of the guideline, the American National Kidney Foundation published the Kidney disease outcomes quality initiative (KDOQI) clinical practice guideline for vascular access: 2019 update (Lok, 2020). This Clinical Practice Guideline for Vascular Access is a comprehensive document, developed according to the GRADE approach, both internally and externally validated, intended to assist multidisciplinary practitioners care for chronic kidney disease patients and their vascular access. This guideline addressed the same research question. Therefore, the scientific evidence analysis of the KDOQI guideline was followed which included a search of literature published until October 2016. The level of evidence in the KDOQI guideline was followed if specified. We refer to the guideline for the search strategy. The working group interpreted the scientific evidence for the Dutch clinical situation.
Referenties
- Al-Balas A, Lee T, Young CJ, Kepes JA, Barker-Finkel J, Allon M: The clinical and economic effect of vascular access selection in patients initiating hemodialysis with a catheter. J Am Soc Nephrol 2017;28: 3679–3687.
- Allon M, Greene T, Dember LM, Vita JA, Cheung AK, Hamburg NM, Imrey PB, Kaufman JS, Robbin ML, Shiu YT, Terry CM, Umphrey HR, Feldman HI; Hemodialysis Fistula Maturation Study Group. Association between Preoperative Vascular Function and Postoperative Arteriovenous Fistula Development. J Am Soc Nephrol. 2016 Dec;27(12):3788-3795.
- Anderson RT, Cleek H, Pajouhi AS, Bellolio MF, Mayukha A, Hart A, Hickson LJ, Feely MA, Wilson ME, Giddings Connolly RM, Erwin PJ, Majzoub AM, Tangri N, Thorsteinsdottir B. Prediction of Risk of Death for Patients Starting Dialysis: A Systematic Review and Meta-Analysis. Clin J Am Soc Nephrol. 2019;14:1213-1227.
- Brown RS, Patibandla BK, Goldfarb-Rumyantzev AS. The Survival Benefit of "Fistula First, Catheter Last" in Hemodialysis Is Primarily Due to Patient Factors. J Am Soc Nephrol. 2017 Feb;28(2):645-652.
- Casey JR, Hanson CS, Winkelmayer WC, et al. Patients’ perspectives on hemodialysis vascular access: a systematic review of qualitative studies. Am J Kidney Dis. 2014;64(6):937-953.
- Dua A, Rothenberg KA, Mikkineni K, Sgroi MD, Sorial E, Toca MG. Secondary interventions in patients with implantable cardiac devices and ipsilateral arteriovenous access. J Vasc Surg. 2019;70(4):1242-1246. doi:10.1016/j.jversus2018.12.029.
- Engstrom BI, Horvath JJ, Stewart JK, Sydnor RH, Miller MJ, Smith TP, Kim CY. Tunneled internal jugular hemodialysis catheters: impact of laterality and tip position on catheter dysfunction and infection rates. J Vasc Interv Radiol. 2013 Sep;24(9):1295-302.
- Farber A, Tan TW, Hu B, Dember LM, Beck GJ, Dixon BS, Kusek JW, Feldman HI; Dialysis Access Consortium (DAC) Study Group; Dialysis Access Consortium DAC Study Group. The effect of location and configuration on forearm and upper arm hemodialysis arteriovenous grafts. J Vasc Surg. 2015 Nov;62(5):1258-64.
- Farrington CA, Allon M. Complications of Hemodialysis Catheter Bloodstream Infections: Impact of Infecting Organism. Am J Nephrol. 2019;50(2):126-132.
- Farrington CA, Robbin ML, Lee T, Barker-Finkel J, Allon M. Early Predictors of Arteriovenous Fistula Maturation: A Novel Perspective on an Enduring Problem. J Am Soc Nephrol. 2020 Jul;31(7):1617-1627.
- Grubbs V, Wasse H, Vittinghoff E, Grimes BA, Johansen KL. Health status as a potential mediator of the association between hemodialysis vascular access and mortality. Nephrol Dial Transplant. 2014 Apr;29(4):892-8.
- Hernandez D, Diaz F, Rufino M, Lorenzo V, Perez T, Rodriguez A, et al. Subclavian vascular access stenosis in dialysis patients: natural history and risk factors. J Am Soc Nephrol. 1998;9(8):1507-10.
- Hussain T, Farooqui F. Outcome of Permanent Vascular Access with Vein ≤ 2.2 mm in Diameter. World J Surg. 2020 Aug;44(8):2813-2818.
- Kian K, Shapiro JA, Salman L, Khan RA, Merrill D, Garcia L, Eid N, Asif A, Aldahan A, Beathard G. High brachial artery bifurcation: clinical considerations and practical implications for an arteriovenous access. Semin Dial. 2012 Mar-Apr;25(2):244-7.
- Kim JJ, Mills JL, Braun J, Barshes N, Kougias P, Younes HK. Arteriovenous fistula maturation rate is not affected by ipsilateral tunneled dialysis catheter. J Vasc Surg. 2019;70(5):1629-1633. doi:10.1016/j.jversus2019.01.084.
- Korkeila P, Nyman K, Ylitalo A, Koistinen J, Karjalainen P, Lund J, et al. Venous obstruction after pacemaker implantation. Pacing Clin Electrophysiol. 2007;30(2):199-206.
- Lee T, Thamer M, Zhang Y, Zhang Q, Allon M. Outcomes of Elderly Patients after Predialysis Vascular Access Creation. J Am Soc Nephrol. 2015 Dec;26(12):3133-40.
- Lioupis C, Mistry H, Junghans C, Haughey N, Freedman B, Tyrrell M, Valenti D. High brachial artery bifurcation is associated with failure of brachio-cephalic autologous arteriovenous fistulae. J Vasc Access. 2010 Apr-Jun;11(2):132-7.
- Lok CE, Allon M, Moist L, Oliver MJ, Shah H, Zimmerman D. Risk equation determining unsuccessful cannulation events and failure to maturation in arteriovenous fistulas (REDUCE FTM I). J Am Soc Nephrol. 2006 Nov;17(11):3204-12.
- Lok CE, Sontrop JM, Tomlinson G, Rajan D, Cattral M, Oreopoulos G, Harris J, Moist L: Cumulative patency of contemporary fistulas versus grafts (2000-2010). Clin J Am Soc Nephrol 2013; 8: 810–818.
- Lok CE, Huber TS, Lee T, et al; KDOQI Vascular Access Guideline Work Group. KDOQI clinical practice guideline for vascular access: 2019 update. Am J Kidney Dis 2020;75:S1-S164.
- Maya ID, O'Neal JC, Young CJ, Barker-Finkel J, Allon M. Outcomes of brachiocephalic fistulas, transposed brachiobasilic fistulas, and upper arm grafts. Clin J Am Soc Nephrol. 2009 Jan;4(1):86-92.
- Mendes RR, Farber MA, Marston WA, Dinwiddie LC, Keagy BA, Burnham SJ. Prediction of wrist arteriovenous fistula maturation with preoperative vein mapping with ultrasonography. J Vasc Surg. 2002 Sep;36(3):460-3.
- Ozpak B, Yilmaz Y. Arteriovenous fistulas ipsilateral to internal jugular catheters for hemodialysis have decreased patency rates. Vascular. 2019;27(3):270-276. doi:10.1177/1708538118811483.
- Parienti JJ, Thirion M, Mégarbane B, Souweine B, Ouchikhe A, Polito A, Forel JM, Marqué S, Misset B, Airapetian N, Daurel C, Mira JP, Ramakers M, du Cheyron D, Le Coutour X, Daubin C, Charbonneau P; Members of the Cathedia Study Group. Femoral versus jugular venous catheterization and risk of nosocomial events in adults requiring acute renal replacement therapy: a randomized controlled trial. JAMA. 2008 May 28;299(20):2413-22.
- Quinn RR, Oliver MJ, Devoe D, et al. The effect of predialysis fistula attempt on risk of all-cause and access-related death. J Am Soc Nephrol. 2017;28(2):613-620.
- Schmidli J, Widmer M. Vascular Access: 2018 clinical practical guidelines of the European Society for Vascular Surgery. Eur J Vasc Endovasc Surg 2018;55:757-818.
- Shingarev R, Barker-Finkel J, Allon M. Association of hemodialysis central venous catheter use with ipsilateral arteriovenous vascular access survival. Am J Kidney Dis. 2012;60(6):983-989. doi:10.1053/j.ajkd.2012.06.014.
- Koksoy C, Demirci RK, Balci D, Solak T, Kose SK. Brachio- basilic versus brachiocephalic arteriovenous fistula: a prospective randomized study. J Vasc Surg. 2009;49(1):171-177.e175.
- Ravani P, Palmer SC, Oliver MJ, et al. Associations between hemodialysis access type and clinical outcomes: a systematic review. J Am Soc Nephrol. 2013;24(3):465-473.
- Shingarev R, Barker-Finkel J, Allon M. Natural history of tunneled dialysis catheters placed for hemodialysis initiation. J Vasc Interv Radiol. 2013 Sep;24(9):1289-94.
- Tan CS, Jie C, Joe J, et al. The impact of transvenous cardiac devices on vascular access patency in hemodialysis patients. Semin Dial. 2013;26(6):728-732. doi:10.1111/sdi.12073.
- Tedla FM, Clerger G, Distant D, Salifu M. Prevalence of Central Vein Stenosis in Patients Referred for Vein Mapping. Clin J Am Soc Nephrol. 2018;13(7):1063-8.
- van Oevelen M, Abrahams AC, Weijmer MC, Nagtegaal T, Dekker FW, Rotmans JI, Meijvis SC; DUCATHO study group. Precurved non-tunnelled catheters for haemodialysis are comparable in terms of infections and malfunction as compared to tunnelled catheters: A retrospective cohort study. J Vasc Access. 2019 May;20(3):307-312.
- Viecelli AK, Howell M, Tong A, Teixeira-Pinto A, O'Lone E, Ju A, Craig JC, Hooi LS, Lee T, Lok CE, Polkinghorne KR, Quinn RR, Vachharajani TJ, Vanholder R, Zuo L, Tordoir J, Pecoits-Filho R, Yuo T, Kopperschmidt P, Smith R, Irish AB, Mori TA, Pascoe EM, Johnson DW, Hawley CM. Identifying critically important vascular access outcomes for trials in haemodialysis: an international survey with patients, caregivers and health professionals. Nephrol Dial Transplant. 2020 Apr 1;35(4):657-668.
- Voorzaat BM, van der Bogt KEA, Janmaat CJ, van Schaik J, Dekker FW, Rotmans JI; Dutch Vascular Access Study Group. Arteriovenous Fistula Maturation Failure in a Large Cohort of Hemodialysis Patients in the Netherlands. World J Surg. 2018 Jun;42(6):1895-1903.
- Voorzaat BM, Janmaat CJ, van der Bogt KEA, Dekker FW, Rotmans JI. Patency outcomes of arteriovenous fistulas and grafts for hemodialyis access: a trade-off between nonmaturation and long-term complications. KIDNEY360 2020;1:916-924.
- Wilmink T, Corte-Real Houlihan M. Diameter Criteria Have Limited Value for Prediction of Functional Dialysis Use of Arteriovenous Fistulas. Eur J Vasc Endovasc Surg. 2018 Oct;56(4):572-581.
- Wong V, Ward R, Taylor J, Selvakumar S, How TV, Bakran A. Factors associated with early failure of arteriovenous fistulae for haemodialysis access. Eur J Vasc Endovasc Surg. 1996 Aug;12(2):207-13.
- Yan Y, Ye D, Yang L, Ye W, Zhan D, Zhang L, Xiao J, Zeng Y, Chen Q. A meta-analysis of the association between diabetic patients and AVF failure in dialysis. Ren Fail. 2018 Nov;40(1):379-383.
- Zhang F, Yunming L, Wang T, Tao J, Zhu J, Wei M, Mo L et al. Influence of cephalic vein dilation on arteriovenous fistula maturation in patients with small cephalic veins. Medicine 2020;99(1):e18576.
- van Vliet LV, Zonnebeld N, Bouwman LH, Cuypers PW, Huisman LC, Lemson S, Schlösser FJ, de Smet AA, Toorop RJ, Snoeijs MG; Shunt Simulation Study Group. Editor's Choice - Interventions to Achieve Functionality in Newly Created Arteriovenous Fistulas in the Shunt Simulation Study Cohort. Eur J Vasc Endovasc Surg. 2023 Apr;65(4):555-562. doi: 10.1016/j.ejvs.2023.01.007.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 24-02-2022
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten die een vaattoegang voor hemodialyse hebben of krijgen.
Werkgroep
- Dr. M.G.J. Snoeijs, vaatchirurg in Maastricht UMC+, NVvH (voorzitter)
- Dr. R.D. Toorop, vaatchirurg in UMC Utrecht, NVvH
- Dr. F. van Hoek, vaatchirurg in Radboudumc, NVvH
- Dr. M.J. Molegraaf, vaatchirurg in Isala ziekenhuis, NVvH
- Dr. M. Schouten, internist-nefroloog in Tergooi, NIV
- Dr. J.I. Rotmans, internist-nefroloog in LUMC, NIV
- Drs. R.J.B. Brans, radioloog in Maastricht UMC+, NVvR
- M. ter Meer, praktijkbegeleider dialyse en dialyseverpleegkundige OLVG, V&VN
- Drs. K. Prantl, Beleidsmedewerker kwaliteit & onderzoek, NVN
- H.Th. Hubbers, ervaringsdeskundige, NVN
Met ondersteuning van
- Dr. K.N.J. Burger, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot mei 2021)
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Snoeijs |
Vaatchirurg Maastricht UMC+ |
Geen |
Leading the Change, OASIS Zorgevaluatie (Wat is de beste vaattoegang voor oudere dialysepatienten?), rol als projectleider.
ZonMW, FLOW Zorgevaluatie (Is het detecteren en preventief behandelen van stenoses in de vaattoegang zinvol?), rol als projectleider.
Nierstichting, Shunt Simulatie Studie (Helpen computer simulaties van de flow bij het aanleggen van arterioveneuze fistels?), geen rol als projectleider.
Australasian Kidney Trials Network, VALID (Validatie van interventies aan de vaattoegang als care outcome measure), geen rol als projectleider.
Ik ben verantwoordelijk voor het expertisecentrum met topreferente zorgfunctie voor vaattoegangschirurgie in Maastricht UMC+. |
Geen actie |
|
Toorop |
Vaat-en transplantatiechirurg UMC Utrecht |
geen |
geen |
Geen actie |
|
Van Hoek |
Vaat- en transplantatiechirurg, Radboudumc |
geen |
geen |
Geen actie |
|
Molegraaf |
vaatchirurg MSB Isala Ziekenhuis |
geen |
geen |
Geen actie |
|
Rotmans |
Internist-nefroloog LUMC |
geen |
Uitvinder op meerdere patenten op het gebied van vaattoegang voor dialyse maar geen eigenaar (patenten zijn van LUMC). VIDI-grant ZonMW onderzoekssubsidie. Unrestricted research grant van Enceladus Pharmaceuticals (inmiddels afgerond) betrof een grant voor een investigator-initiated placebo-gecontroleerde klinische studie naar de effectiviteit van liposomaal prednisolon voor het verbeteren van shuntrijping (maturatie). Deze studie is afgerond maar nog niet gepubliceerd (is under review). De shunt maturatie bleek in beide groepen vergelijkbaar (dus geen gunstig effect van liposomaal prednison). |
Geen moduleschrijver voor uitgangsvragen met betrekking tot maturatie |
|
Schouten |
internist-nefroloog Tergooi |
Richtlijncommissie Nederlandse Federatie voor Nefrologie (betaald) |
geen |
Geen actie |
|
Brans |
Interventieradioloog Maastricht UMC+ |
Secretaris commissie accreditatie NVvR (onbetaald) |
geen |
Geen actie |
|
Ter Meer |
Praktijk begeleider dialyse OLVG te Amsterdam en |
Gast docent Amstel Academie voor opleiding dialyseverpleegundige en dialyse assistent betaald (verzorgen van lessen over vaattoegang) Gast docent albeda college opleiding vaattoegang tot 2021 betaald (verzorgen van de les VSA) Presentatie voor firma Baxter 4 x betaald, presentatie over nieuwe ontwikkelingen op gebied van vaattoegangszorg voor verpleegkundigen. |
geen |
Geen actie |
|
Prantl |
beleidsmedewerker kwaliteit & onderzoek NVN |
geen |
Namens de NVN heb ik meegedacht met de ontwikkeling van de Vascoscope, een nieuw echoapparaat dat het aanprikken waarschijnlijk kan vereenvoudigen. Inmiddels geen betrokkenheid meer bij dit onderzoek. |
Geen actie |
|
Hubbers |
Ervaringsdeskundige |
Geen |
Namens de NVN heb ik als vrijwilliger twee keer deelgenomen in de werkgroep Vascoscoop in het UMC Utrecht. Doel hiervan was te komen tot een handzaam echoapparaatje dat zowel een verpleegkundige als patiënt makkelijk zelf kan bedienen/gebruiken om misprikken bij vaattoegang voor hemodialyse te voorkomen. Nadien heb ik het doorontwikkelde apparaat twee keer gezien waarvan 1x getest in de praktijk. |
Geen actie |
|
Burger |
Senior adviseur bij Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie |
|
Ruiter |
Adviseur bij Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntperspectief door Patiëntenfederatie Nederland en andere relevante patiëntenorganisaties uit te nodigen voor een schriftelijke knelpuntenanalyse. Het verslag hiervan (zie aanverwante producten) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen. Bovendien werd het patiëntperspectief vertegenwoordigd door afvaardiging van patiëntenorganisatie Nierpatiënten Vereniging Nederland in de werkgroep. Tot slot werden de modules voor commentaar voorgelegd aan Patiëntenfederatie Nederland en andere relevante patiëntenorganisaties en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst. Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module 1 Operatieve besluitvorming |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2 Perioperatieve zorg |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 3 Gebruik en verzorging |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 4 Monitoring en surveillance |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 5 Flow disfunctie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 6 Infectie van de vaattoegang |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 7 Ischemie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 8 High-flow vaattoegang |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 9 Ongebruikte vaattoegang |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module 10 Randvoorwaarden (Organisatie van zorg) |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor de vaattoegang voor hemodialyse. Tevens zijn er knelpunten aangedragen door stakeholders door middel van een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek. Daarnaast vond de werkgroep het wenselijk om aan de overwegingen een sectie toe te voegen die de uitgangsvraag in een bredere context plaatst. In dit onderdeel “inbedding in de zorg” zijn op basis van bestaande internationale richtlijnen aandachtpunten behandeld die van belang zijn in de dagelijkse praktijk. Voor verdere toelichting en onderbouwing wordt verwezen naar de betreffende richtlijnen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.


