Cognitieve screening na een SAB
Uitgangsvraag
Wat is de plaats van een cognitief screeningsinstrument in de subacute fase bij patiënten met een subarachnoïdale bloeding (SAB)?
Aanbeveling
Overweeg bij patiënten die een subarachnoïdale bloeding hebben gehad in de ziekenhuisfase te screenen op cognitief functioneren. Gebruik bij voorkeur de Montreal Cognitive Assessment (MoCA) volgens leeftijd- en opleidingsniveau gecorrigeerde normwaarden. Neem de MoCA bij voorkeur af in de tweede week na de subarachnoïdale bloeding bij een belastbare en medisch stabiele patiënt.
Realiseer dat een goede score op de MoCA (gecorrigeerd voor leeftijd en opleidingsniveau) cognitieve stoornissen, dan wel achteruitgang niet uitsluit.
Observaties van naasten, verpleging en paramedici spelen een belangrijke rol in de signalering van cognitieve problemen. Neem zo nodig een (kort screenend) neuropsychologisch onderzoek af bij aanhoudende twijfel over de aanwezigheid van cognitieve problemen.
Het is wenselijk om binnen de keten een nazorgmoment af te spreken waarbij specifiek aandacht is voor cognitieve problemen en hun eventuele impact op dagelijks functioneren thuis en zo nodig op werk.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Om de rol van cognitieve screeningsinstrumenten bij subarachnoïdale bloeding (SAB) patiënten in de subacute fase in kaart te brengen, is in de literatuur gezocht naar studies die de diagnostische accuratesse en klinische impact van cognitieve screeningsinstrumenten hebben geëvalueerd. Er werd één systematische review (Cornea, 2022) gevonden die twee cross-sectionele studies includeerde (Schweizer, 2012; Wong, 2013). Slechts één studie onderzocht de diagnostische accuratesse van de Montreal Cognitive Assessment (MoCA) en Mini-Mental State Examination (MMSE) in de subacute fase en vergeleek deze met de referentiestandaard (uitgebreide neuropsychologische evaluatie) om cognitieve problemen bij patiënten met een SAB te beoordelen om daarmee het neuropsychologisch functioneren op lange termijn te voorspellen. De bewijskracht voor de diagnostische accuratessematen was echter zeer laag vanwege methodologische tekortkomingen (risico op vertekening) en brede betrouwbaarheidsintervallen. De uitkomstmaten participatie en dagelijks functioneren werden niet gerapporteerd. Het is aannemelijk dat toekomstige studies zullen leiden tot nieuwe resultaten en er kunnen op basis van de literatuur geen harde conclusies geformuleerd worden.
Wong (2013) beschrijft enkel resultaten in aneurysmatische SAB patiënten. Er is in de literatuur geen onderzoek beschikbaar die de diagnostische accuratesse beschrijft van cognitieve screeningsinstrumenten in patiënten met een niet-aneurysmatische of perimesencefale bloeding. Verder was er nauwelijks literatuur beschikbaar die de impact van cognitieve screeningsinstrumenten op klinische uitkomstmaten beschrijft.
Door het lage niveau van bewijskracht, waarbij slechts één studie heeft gekeken naar de accuratesse in de subacute fase, kunnen er geen harde uitspraken gedaan worden of en welk screeningsinstrument geschikt is om cognitieve problemen te signaleren in de subacute fase na een SAB. Hoewel de MoCA een hogere sensitiviteit lijkt te hebben dan de MMSE, hebben beide screeningsinstrumenten een sensitiviteit onder het afgesproken afkappunt. Hierdoor bestaat het risico dat cognitieve problemen bij een patiënt niet onderkend worden en er geen passende nazorg wordt ingezet.
In lijn met de richtlijn herseninfarct en hersenbloeding lijkt het aannemelijk om te adviseren om bij patiënten met een SAB de MoCA af te nemen. Uit eerder onderzoek komt namelijk naar voren dat de MoCA gevoeliger is dan de MMSE voor detectie van veranderingen in cognitie bij patiënten met een herseninfarct of hersenbloeding (Sivakumar, 2014). Daarnaast test de MoCA in tegenstelling tot de MMSE ook op executief functioneren. Juist dit domein is frequent aangedaan bij mensen met een SAB (Schweizer, 2012). Tevens is de MoCA in meerdere talen en parallelle versies beschikbaar, cultuursensitief en zijn er recentelijk voor geslacht- en leeftijd gecorrigeerde normwaarden gepubliceerd (Kessels, 2022). Hierbij is belangrijk te realiseren dat een niet-afwijkende prestatie op een cognitief screeningsinstrument geenszins de aanwezigheid van cognitieve stoornissen, danwel cognitieve achteruitgang ten opzichte van het premorbide niveau uitsluit. Informatie op basis van observaties (verpleging, paramedici), ergotherapeutisch en/of logopedisch onderzoek en heteroanamnese zijn belangrijk om een zo compleet mogelijke inschatting van de cognitieve beperkingen te maken, voor een optimaal vervolgbeleid (waarbij indien nodig volledig NPO in subacute/chronische fase). Ten aanzien van de toepassing van ergotherapeutische observaties/instrumenten voor het signaleren van cognitieve problemen bij patiënten verwijzen we naar de monodisciplinaire ergotherapie richtlijn hersenletsel, waarbij moet worden opgemerkt dat de genoemde instrumenten niet gevalideerd zijn voor de beoogde patiëntenpopulatie zoals beschreven in deze richtlijn (patiënten met een SAB in de ziekenhuisfase).
De prognostische waarde van vroegtijdig signaleren van cognitieve problemen in relatie tot het dagelijks functioneren van patiënten na ontslag uit het ziekenhuis is beperkt en afhankelijk van meerdere factoren. Hiertoe is het wenselijk om binnen de keten een nazorgmoment af te spreken waarbij specifiek aandacht is voor cognitieve problemen en hun eventuele impact op dagelijks functioneren thuis en zo nodig op werk.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De afname van een cognitief screeningsinstrument wordt over het algemeen als weinig belastend ervaren. Er is geen schade of nadelig effect te verwachten bij het afnemen van een cognitief screeningsinstrument. Er kunnen vanuit de patiënt meerdere redenen zijn om cognitieve screening niet te willen, hierbij valt te denken aan patiënten die dusdanig ernstig aangedaan zijn dat ze te laag belastbaar zijn als ook patiënten die op dat moment niet te motiveren zijn voor extra onderzoek. Beide zijn verdedigbaar omdat medewerking vanuit patiënt nodig is om een betrouwbare uitslag te krijgen.
Kosten (middelenbeslag)
De MoCA kan snel worden afgenomen (ongeveer 20 minuten) en is gratis verkrijgbaar. Op de middellange termijn kan het tijdig signaleren van cognitieve problemen mogelijk ondersteunen in tijdige behandeling.
Aanvaardbaarheid, haalbaarheid en implementatie
Voor patiënten met een migratieachtergrond bestaan er taal- en cultuur sensitieve versies van de MoCA (mocatest.org). Echter, door gebrek aan personeel dat de taal beheerst, is het in de dagelijkse praktijk denkbaar dat bij deze patiënten niet altijd de juiste versie afgenomen kan worden. Tevens is de MOCA niet betrouwbaar af te nemen bij mensen met taalproblemen (afasie) (Nasreddine, 2005) en visuele of auditieve beperking. Verder kunnen er drempels worden ervaren om een cognitief screeningsinstrument in te zetten bij op het oog goed herstelde patiënten, waarbij het nut en de inzet van schaars personeel mogelijk niet altijd wordt ingezien. Echter, uit onderzoek blijkt dat bij 40-70% van de patiënten na een SAB cognitieve problemen en/of stoornissen aanwezig zijn die het dagelijks leven kunnen beïnvloeden, ook bij ogenschijnlijk goed herstelde patiënten (Nussbaum, 2021).
Rationale van de aanbeveling: weging van argumenten voor en tegen cognitieve screening
Het in kaart brengen (screenen) van cognitie tijdens de ziekenhuisfase is aan te bevelen gezien de consequenties voor de (middel)lange termijn. Gezien de lage diagnostische waarde van screenings-instrumenten voor het vaststellen van stoornissen in cognitieve functies in de subacute fase na SAB, zijn kwalitatieve beoordelingen door verpleging, naasten en ergotherapeut belangrijk om cognitieve problemen te signaleren. Een ergotherapeut kan cognitieve beperkingen in dagelijks handelen van de patiënt beoordelen middels verschillende betrouwbare en valide instrumenten (Ergotherapierichtlijn CVA, 2013). Bij twijfel over cognitie en/of gedrag kan een neuropsycholoog betrokken worden ter beoordeling en voor eventueel aanvullend neuropsychologisch onderzoek om cognitieve stoornissen in kaart te brengen. Ondanks dat de bewijslast zeer laag is en er geen duidelijke voorkeur voor de MoCA of MMSE naar boven komt, is de aanbeveling om elke patiënt indien mogelijk te screenen op cognitieve problemen, ideaal gezien met behulp van de MoCA. Deze aanbeveling is in lijn met de richtlijn herseninfarct en hersenbloeding, mede doordat de MoCA betere psychometrische eigenschappen heeft en breder inzetbaar is (meerdere talen, parallelle versies en voor leeftijd- en geslacht gecorrigeerd) dan de MMSE.
Onderbouwing
Achtergrond
Cognitive impairment is common after subarachnoid hemorrhage (SAH), even in patients who appear to have recovered well (Al-Khindi, 2010; Nussbaum, 2021). Cognitive impairment has a negative impact on the perceived quality of life and daily functioning of patients with SAH (Taufique, 2015; Passier, 2013). Similar to ischemic stroke or intracerebral hemorrhage, early detection of cognitive impairment in patients with aneurysmal SAH is important to support decisions regarding discharge, and appropriate rehabilitation treatment (Paolucci, 2000), and to provide accurate psychoeducation to the patient and their relatives. Early identification and diagnostics are therefore desirable, followed by referral for treatment and guidance. Identification of an efficient, reliable, and valid cognitive measure is desired. At present there is no consensus when and how to screen for cognition in patients with subarachnoid hemorrhage. Consequently, considerable practice variation exists across hospitals. As such, it is still unclear whether and, if so, which screening instrument is sensitive enough to detect cognitive impairment as compared to the gold standard (neuropsychological examination) and predict functioning on the mid- and long-term.
The most common cognitive screening tools are the Mini Mental State Exam (MMSE) and the Montreal Cognitive Assessment (MoCA), both quick and easy to administer in clinical settings.
Conclusies / Summary of Findings
1. Diagnostic accuracy
1.1 MoCA
|
Very low GRADE |
The confidence in the reported diagnostic accuracy (sensitivity, specificity, NPV, PPV) of the MoCA for detecting cognitive impairment in patients with aneurysmal subarachnoid hemorrhage is very low.
Source: Cornea, 2022* *Including: Wong, 2013. |
1.2 MMSE
|
Very low GRADE |
The confidence in the reported diagnostic accuracy (sensitivity, specificity, NPV, PPV) of the MMSE for detecting cognitive impairment in patients with aneurysmal subarachnoid hemorrhage is very low.
Source: Cornea, 2022* *Including: Wong, 2013. |
2. Participation, 3. Daily functioning
|
no GRADE |
No evidence was found regarding the clinical impact of cognitive screening instruments on participation and daily functioning in patients with aneurysmal SAH.
Source: - |
Samenvatting literatuur
Description of studies
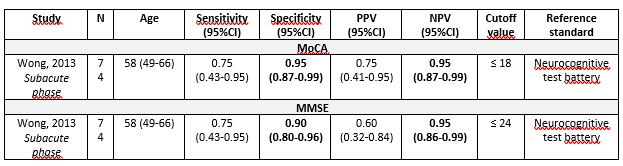
Cornea (2022) performed a systematic review to investigate the evidence for using the Montreal Cognitive Assessment (MoCA) test as a screening tool for cognitive impairment in subarachnoid hemorrhage (SAH) patients. The electronic databases PubMed, Scopus, Web of Science, PsycINFO, and Latin American and Caribbean Health Sciences Literature (LILACS) were searched with relevant search terms from inception to January 16, 2022. The main types of eligible studies were: cross-sectional studies in which participants received the index test (MoCA) and a reference standard diagnostic assessment; case-control studies that compare MoCA to a battery of tests; and studies comparing MoCA to another short cognitive test (e.g., MMSE). Studies were included if 1) adults aged >18 years with confirmed SAH were included, 2) the index test was any full version of MoCA, 3) the target condition was cognitive impairment, including mild cognitive impairment (MCI) or dementia, 4) the reference standard was a complex neuropsychological evaluation. Studies were excluded if 1) fewer than 10 participants were included or 2) patients with confounding factors such as neurological disorders, drug or alcohol addiction, and active infections were included. Based on these criteria, two cross-sectional studies comparing the MoCA and Mini-Mental State Examination (MMSE) to an extensive cognitive battery of tests (as the reference test) were included in the systematic review (Schweizer, 2012; Wong, 2013). Wong (2013) administered MoCA and MMSE twice, 2-4 weeks after SAH (subacute phase) and one year after SAH (chronic phase). Schweizer (2012) administered MoCA and MMSE at least six months after aneurysmal SAH (chronic phase). Both studies included aneurysmal SAH patients only. Because this module focuses on the subacute phase, results of Wong (2013) were described only. Functional status of participants was assessed by Hunt and Hess grade, WFNS grade, Fisher grade and mRS. Characteristics of the individual study are displayed in Table 1.
Table 1. Characteristics of included studies
|
|
Data is presented as mean ± SD or median (IQR). Abbreviations: MMSE = Mini Mental State Examination; MoCA = Montreal Cognitive Assessment; mRS = modified Rankin Scale; WFNS = World Federation of Neurological Surgeons.
* Optimal cutoff values were derived at the ROC coordinate points, where both sensitivity and specificity were optimised using the maximised Youden Index (= sensitivity + specificity -1)
Results
1. Diagnostic accuracy
Diagnostic accuracy is assessed below for the following cognitive tests (Wong, 2013):
- MoCa
- MMSE
Wong (2013) used a cognitive domain-specific neuropsychological tests as the reference standard, including the following domains: 1) verbal and visuospatial memory, 2) attention and working memory, 3) executive functions, 4) psychomotor speed, and 5) language.
1.1 MoCA
1.1.1 Sensitivity and specificity
Wong (2013) reported on the sensitivity of the MoCA to detect cognitive impairment in patients with aneurysmal SAH.
Wong (2013) reported a sensitivity of MoCA of 0.75 (95%CI 0.43-0.95) and a specificity of 0.95 (95%CI 0.87-0.99) in the subacute phase. The optimal cutoff for MoCA was ≤18 at 2-4 weeks after SAH (subacute phase) (Table 2).
1.1.2 Negative and positive predictive value
Wong (2013) reported on the NPV and PPV of the MoCA to detect cognitive impairment in patients with aneurysmal SAH (Table 2). In the subacute phase, NPV was 0.95 (95%CI 0.87-0.99) and PPV was 0.75 (95%CI 0.41-0.95).
Table 2. Diagnostic accuracy of the MoCA and MMSE
Values displayed in bold were considered clinically relevant. Age is presented as median (IQR), diagnostic accuracy measures are presented as value (95%CI). Abbreviations: CI = confidence interval; NPV = negative predictive value; PPV = positive predictive value
1.2 MMSE
1.2.1 Sensitivity and specificity
Wong (2013) reported on the sensitivity and specificity of the MMSE to detect cognitive impairment in patients with aneurysmal SAH.
Wong (2013) reported that, in the subacute phase, MMSE cutoff score ≤24 provided a sensitivity of 0.75 (95%CI 0.43-0.95) and a specificity of 0.90 (95%CI 0.80-0.96) (Table 2).
1.2.2 Negative and positive predictive value
Wong (2013) reported on the NPV and PPV of the MMSE to detect cognitive impairment in patients with aneurysmal SAH (Table 2). In the subacute phase, NPV was 0.95 (95%CI 0.86-0.99) and PPV was 0.60 (95%CI 0.32-0.84).
2. Participation (e.g. return to work), 3. Daily functioning
Wong (2013) did not report on the outcome measures participation and daily functioning.
Level of evidence of the literature
1. Diagnostic accuracy
1.1.1 Sensitivity and specificity (MoCA)
The level of evidence regarding the outcome measures sensitivity and specificity was downgraded by three levels to very low because of study limitations regarding missing information about sampling of patients, lack of information on whether results of the index test were interpreted without knowledge of the results of the reference standard, and unknown blinding of assessors (risk of bias: -2). Furthermore, confidence intervals overlap with the thresholds for clinical relevance and a low number of patients is included (imprecision: -1).
1.1.2 Negative and positive predictive value (MoCA)
The level of evidence regarding the outcome measures negative and positive predictive value was downgraded by three levels to very low because of study limitations regarding missing information about sampling of patients, lack of information on whether results of the index test were interpreted without knowledge of the results of the reference standard, and unknown blinding of assessors (risk of bias: -2). Furthermore, confidence intervals overlap with the thresholds for clinical relevance and a low number of patients is included (imprecision: -1).
1.2.1 Sensitivity and specificity (MMSE)
The level of evidence regarding the outcome measures sensitivity and specificity was downgraded by three levels to very low because of study limitations regarding missing information about sampling of patients, lack of information on whether results of the index test were interpreted without knowledge of the results of the reference standard, and unknown blinding of assessors (risk of bias: -2). , confidence intervals overlap with the thresholds for clinical relevance and a low number of patients is included (imprecision: -1).
1.2.2 Negative and positive predictive value (MMSE)
The level of evidence regarding the outcome measures negative and positive predictive value was downgraded by three levels to very low because of study limitations regarding missing information about sampling of patients, lack of information on whether results of the index test were interpreted without knowledge of the results of the reference standard, and unknown blinding of assessors (risk of bias: -2). Furthermore, confidence intervals overlap with the thresholds for clinical relevance and a low number of patients is included (imprecision: -1).
2. Participation, 3. Daily functioning
The level of evidence regarding the outcome measures participation and daily functioning could not be assessed.
Zoeken en selecteren
A systematic search of the literature was performed to answer the following question:
What is the diagnostic accuracy of cognitive screening instruments to assess cognitive and neuropsychological functioning in relation to daily life functioning and participation in patients with aneurysmal subarachnoid hemorrhage (SAH)?
| P: |
Patients with aneurysmal SAH |
| I: |
Cognitive screening instrument (e.g., MMSE, MoCA) |
| C: |
Other cognitive screening instrument / no cognitive screening instrument |
| R: |
Neuropsychological examination (golden standard) |
| O: |
Diagnostic accuracy (sensitivity, specificity, Negative Predictive Value (NPV), Positive Predictive Value (PPV)), participation (including return to work), daily functioning |
| T/S: | From seven days after admission to hospital (subacute phase) |
Relevant outcome measures
The aim of screening for cognitive functioning is to detect the presence of cognitive impairment in patients with aneurysmal SAH. Herewith, it is important to keep the number of false negatives low.
The specificity of a test is its ability to designate an individual without cognitive impairment as negative. Sensitivity refers to a test’s ability to designate an individual with cognitive impairment as positive. A highly sensitive test means that there are few false negatives results, and thus fewer patients with cognitive impairment are missed, which is desirable. Therefore, (high) sensitivity and (high) NPV are considered as critical outcome measures for decision making.
The working group defined a sensitivity, specificity, NPV, and PPV ≥0.8 as minimal clinically relevant. For all other outcome measures, no minimal clinically important difference was defined.
Search and select (Methods)
The databases Medline (via OVID), Embase (via Embase.com) and PsycINFO were searched with relevant search terms from 2015 up to 31 October 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 147 hits.
Studies were selected based on the following criteria:
- Systematic reviews or studies with an observational design (case control or cohort studies);
- Studies performed in adults with SAH;
- English full-text available;
- Studies according to the PICO.
Six studies were initially selected based on title and abstract screening. After reading the full text, five studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One systematic review was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- 1 - Al-Khindi T, Macdonald RL, Schweizer TA. Cognitive and functional outcome after aneurysmal subarachnoid hemorrhage. Stroke. 2010 Aug;41(8):e519-36. doi: 10.1161/STROKEAHA.110.581975. Epub 2010 Jul 1. PMID: 20595669.
- 2 - Cornea A, Simu M, Rosca EC. Montreal Cognitive Assessment for Evaluating Cognitive Impairment in Subarachnoid Hemorrhage: A Systematic Review. J Clin Med. 2022 Aug 10;11(16):4679. doi: 10.3390/jcm11164679. PMID: 36012917; PMCID: PMC9409824.
- 3 - Kessels RPC, de Vent NR, Bruijnen CJWH, Jansen MG, de Jonghe JFM, Dijkstra BAG, Oosterman JM. Regression-Based Normative Data for the Montreal Cognitive Assessment (MoCA) and Its Memory Index Score (MoCA-MIS) for Individuals Aged 18-91. J Clin Med. 2022 Jul 13;11(14):4059. doi: 10.3390/jcm11144059. PMID: 35887823; PMCID: PMC9318507.
- 4 - Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, Cummings JL, Chertkow H. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc. 2005 Apr;53(4):695-9. doi: 10.1111/j.1532-5415.2005.53221.x. Erratum in: J Am Geriatr Soc. 2019 Sep;67(9):1991. doi: 10.1111/jgs.15925. PMID: 15817019.
- 5 - Nussbaum ES, Mikoff N, Paranjape GS. Cognitive deficits among patients surviving aneurysmal subarachnoid hemorrhage. A contemporary systematic review. Br J Neurosurg. 2021 Aug;35(4):384-401. doi: 10.1080/02688697.2020.1859462. Epub 2020 Dec 21. PMID: 33345644.
- 6 - Paolucci S, Antonucci G, Grasso MG, Morelli D, Troisi E, Coiro P, Bragoni M. Early versus delayed inpatient stroke rehabilitation: a matched comparison conducted in Italy. Arch Phys Med Rehabil. 2000 Jun;81(6):695-700. doi: 10.1016/s0003-9993(00)90095-9. PMID: 10857508.
- 7 - Passier PE, Visser-Meily JM, Rinkel GJ, Lindeman E, Post MW. Determinants of health-related quality of life after aneurysmal subarachnoid hemorrhage: a systematic review. Qual Life Res. 2013 Jun;22(5):1027-43. doi: 10.1007/s11136-012-0236-1. Epub 2012 Sep 6. PMID: 22956388.
- 8 - Schweizer TA, Al-Khindi T, Macdonald R. Mini-Mental State Examination versus Montreal Cognitive Assessment: Rapid assessment tools for cognitive and functional outcome after aneurysmal subarachnoid hemorrhage. J. Neurol. Sci. 2012 May 15;316(1-2):137-140. doi: 10.1016/j.jns.2012.01.003.
- 9 - Sivakumar L, Kate M, Jeerakathil T, Camicioli R, Buck B, Butcher K. Serial montreal cognitive assessments demonstrate reversible cognitive impairment in patients with acute transient ischemic attack and minor stroke. Stroke. 2014 Jun;45(6):1709-15. doi: 10.1161/STROKEAHA.114.004726. Epub 2014 Apr 22. PMID: 24757105.
- 10 - Taufique Z, May T, Meyers E, Falo C, Mayer SA, Agarwal S, Park S, Connolly ES, Claassen J, Schmidt JM. Predictors of Poor Quality of Life 1 Year After Subarachnoid Hemorrhage. Neurosurgery. 2016 Feb;78(2):256-64. doi: 10.1227/NEU.0000000000001042. PMID: 26421590.
- 11 - Wong GK, Lam SW, Wong A, Ngai K, Poon WS, Mok V. Comparison of montreal cognitive assessment and mini-mental state examination in evaluating cognitive domain deficit following aneurysmal subarachnoid haemorrhage. PLoS One. 2013;8(4):e59946. doi: 10.1371/journal.pone.0059946. Epub 2013 Apr 3. PMID: 23573223; PMCID: PMC3616097.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics
|
Index test (test of interest) |
Reference test
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Cornea, 2022
[individual study characteristics deduced from [Cornea, 2022]] |
Systematic review
Literature search up to 16 January 2022
A: Wong, 2013
Study design: Cross-sectional
Setting and Country: A: China
Source of funding and conflicts of interest: No external funding was received. The authors declare no conflict of interest.
|
Inclusion criteria SR: - Adults (>18 years) with confirmed SAH - Index test was any full version of MoCA - Target condition was (mild) cognitive impairment, including dementia - Reference standard was a complex neuropsychological evaluation.
Exclusion criteria SR: - Studies with less than 10 participants - Patients with neurological disorders, drug or alcohol addiction, and active infections.
One study included
Important patient characteristics: N, mean age A: 74, 58 (49-66) years
Sex (%female): A: 68%
Education (years): A: NR
Disease duration: A: 2-4 weeks |
Describe index and comparator tests* and cut-off point(s):
A-1: MoCA; ≤18 A-2: MoCA; ≤22 |
Describe reference test and cut-off point(s):
A: Neuropsychological evaluation
Prevalence (%) [based on refence test at specified cut-off point] A: NR
For how many participants were no complete outcome data available? N (%) A: NR
Reasons for incomplete outcome data described? A: N/A |
Endpoint of follow-up: A: 12 months |
Outcome measures and effect size (include 95%CI and p-value if available):
Sensitivity A-1: 0.75 (0.43-0.95) A-2: 1.00 (0.74-1.00)
Specificity A-1: 0.95 (0.87-0.99) A-2: 0.75 (0.63-0.85)
NPV A-1: 0.95 (0.87-0.99) A-2: 1.00 (0.93-1.00)
PPV A-1: 0.75 (0.41-0.95) A-2: 0.41 (0.24-0.61)
|
Study quality (ROB): Unmodified Quality Assessment of Diagnostic Accuracy Studies 2 tool A: Higha,b,c
a No information about methods used to sample SAH patients. b Missing information regarding interpretation of results of the index test without knowledge of the reference standard scores. c No data on the blinding of assessors with regard to the reference standard.
Place of the index test in the clinical pathway: screening tool
Choice of cut-off point: A: Calculated optimal cutoff scores
Author’s conclusion This study presents an accurate state of knowledge on the accuracy of MoCA in detecting cognitive impairment in SAH patients. Included studies report a fair accuracy of the MoCA in diagnosing post-aneurysmal SAH at both subacute and chronic stages.
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Nussbaum ES, Mikoff N, Paranjape GS. Cognitive deficits among patients surviving aneurysmal subarachnoid hemorrhage. A contemporary systematic review. Br J Neurosurg. 2021 Aug;35(4):384-401. doi: 10.1080/02688697.2020.1859462. Epub 2020 Dec 21. PMID: 33345644. |
Results are narratively described; wrong outcome (no diagnostic accuracy measures) |
|
Rautalin IM, Sebök M, Germans MR, Korja M, Dannecker N, Zindel-Geisseler O, Brugger P, Regli L, Stienen MN. Screening tools for early neuropsychological impairment after aneurysmal subarachnoid hemorrhage. Neurol Sci. 2020 Apr;41(4):817-824. doi: 10.1007/s10072-019-04159-w. Epub 2019 Dec 4. PMID: 31802342; PMCID: PMC7160061. |
Wrong outcome (no diagnostic accuracy measures) |
|
Geraghty JR, Lara-Angulo MN, Spegar M, Reeh J, Testai FD. Severe cognitive impairment in aneurysmal subarachnoid hemorrhage: Predictors and relationship to functional outcome. J Stroke Cerebrovasc Dis. 2020 Sep;29(9):105027. doi: 10.1016/j.jstrokecerebrovasdis.2020.105027. Epub 2020 Jun 20. PMID: 32807442; PMCID: PMC7438604. |
Wrong outcome (no diagnostic accuracy measures) |
|
Eagles ME, Tso MK, Macdonald RL. Cognitive Impairment, Functional Outcome, and Delayed Cerebral Ischemia After Aneurysmal Subarachnoid Hemorrhage. World Neurosurg. 2019 Apr;124:e558-e562. doi: 10.1016/j.wneu.2018.12.152. Epub 2019 Jan 10. PMID: 30639483. |
Wrong outcome (no diagnostic accuracy measures) |
|
Zaki Ghali MG, Srinivasan VM, Wagner K, Rao C, Chen SR, Johnson JN, Kan P. Cognitive Sequelae of Unruptured and Ruptured Intracranial Aneurysms and their Treatment: Modalities for Neuropsychological Assessment. World Neurosurg. 2018 Dec;120:537-549. doi: 10.1016/j.wneu.2018.06.178. Epub 2018 Jun 30. PMID: 29966787. |
Wrong publication type (literature review); results are narratively described |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 27-08-2025
Beoordeeld op geldigheid : 19-08-2025
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire cluster ingesteld. Dit cluster bestaat uit vertegenwoordigers van alle relevante organisaties die betrekking hebben op de zorg voor patiënten met cerebrovasculaire ziekten.
Het cluster Cerebrovasculaire ziekten bestaat uit meerdere richtlijnen, zie hier voor de actuele clusterindeling. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden worden indien nodig gevraagd om hun expertise in te zetten voor een specifieke richtlijnmodule. Het cluster Cerebrovasculaire ziekten bestaat uit de volgende personen:
Clusterstuurgroep
- Dhr. dr. M.D.I. (Mervyn) Vergouwen (voorzitter), neuroloog, UMC Utrecht, namens de NVN
- Dhr. dr. I.R. (Ido) van den Wijngaard, neuroloog, Leiden UMC, namens de NVN
- Dhr. prof. dr. B. (Bob) Roozenbeek, neuroloog, Erasmus MC, namens de NVN
- Dhr. dr. R. (René) van den Berg, (interventie neuro-) radioloog, Amsterdam UMC, namens de NVvR
- Dhr. M.A.C. (Michiel) Lindhout, patiëntvertegenwoordiger, namens Harteraad
- Mevr. dr. M. (Margriet) van der Werf, revalidatiearts, Rijndam, namens de VRA
- Dhr. prof. dr. H.D. (Jeroen) Boogaarts, neurochirurg, Radboud UMC, namens de NVvN
Clusterexpertisegroep
- Dhr. prof. dr. W.H. (Werner) Mess, neuroloog, Maastricht UMC, namens de NVN
- Dhr. prof. dr. B. (Bart) van der Zwan, neurochirurg, UMC Utrecht, namens de NVvN
- Dhr. prof. dr. G.J. (Gert-Jan) de Borst, vaatchirurg, UMC Utrecht, namens de NVvH
- Dhr. dr. J.A.H.R. (Jurgen) Claassen, klinisch geriater, Radboud UMC, namens de NVKG
- Mevr. prof. dr. ir. Y.M.C. (Yvonne) Henskens, klinisch chemicus, namens de NVKC
- Mevr. dr. M.J.J. (Marleen) Gerritsen, klinisch neuropsycholoog, namens het NIP
- Dhr. I. (Ivar) Spin, fysiotherapeut, namens de KNGF
- Dhr. dr. R.H. (Raymond) Wimmers, namens de Hartstichting
- Dhr. prof. dr. W. (Wim) van Zwam, radioloog, Maastricht UMC, namens de NVvR
- Dhr. dr. T.H. (Rob) Lo, radioloog, UMC Utrecht, namens de NVvR
- Dhr. dr. B.J. (Berto) Bouma, cardioloog, Amsterdam UMC, namens de NVVC
- Mevr. dr. F.H.M. (Fianne) Spaander, neuroloog, namens de NVN
- Mevr. M. (Mathilde) Nijkeuter, internist, UMC Utrecht, namens de NIV
- Dhr. T.T. (Thomas) van Sloten, internist, Maastricht MC, namens de NIV
- Mevr. dr. C.W.E. (Astrid) Hoedemaekers, intensivist, Radboud UMC, namens de NVIC
- Dhr. prof. dr. G.J.E. (Gabriel) Rinkel, neuroloog, UMC Utrecht, namens de NVN
- Mevr. prof. dr. Y.M. (Ynte) Ruigrok, neuroloog, UMC Utrecht, namens de NVN
- Mevr. J. (Jamie) Manuputty, neuroloog, Elisabeth-TweeSteden Ziekenhuis, namens de NVN
- Mevr. dr. F. (Femke) Nouwens, logopediste, namens de NVLF
- Mevr. C.C. (Carola) Deurwaarder, patiëntvertegenwoordiger, namens Hersenaneurysma Patiëntenplatform
- Mevr. dr. M.J.E. (Marlies) Kempers, klinisch geneticus, Radboud UMC, namens de VKGN
- Mevr. S. (Sabine) van Erp, ergotherapeut, namens EN
- Dhr. prof. dr. C.G.M. (Carel) Meskers, revalidatiearts, Amsterdam UMC, namens de VRA
Met ondersteuning van
- Mevr. M.M. (Marja) Molag, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. L.C. (Laura) van Wijngaarden, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterstuurgroepleden en actief betrokken expertisegroepsleden (fungerend als schrijver en/of meelezer bij tenminste één van de geprioriteerde richtlijnmodules) hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een richtlijnmodule worden wijzigingen in belangen aan de projectleider doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase. Een overzicht van de belangen van de clusterleden en betrokken expertisegroepsleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Clusterstuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bob Roozenbeek |
Neuroloog, Erasmus MC |
Voorzitter richtlijnwerkgroep ‘Herseninfarct en hersenbloeding’ namens de NVN |
Coördinator van klinische onderzoeksprojecten op gebied van acute beroertezorg gesubsidieerd door Stichting BeterKeten, Sitchting Theia (Zilveren Kruis), ZonMw en Hartstichting. Deze subsidies werden betaald aan werkgever Erasmus MC. |
Geen restricties |
|
Ido van den Wijngaard |
Neuroloog, Haaglanden MC |
Commissielid NVN richtlijn |
Geen |
Geen restricties |
|
Jeroen Boogaarts |
Neurochirurg, Radboud UMC |
Voorzitter Stichting Kwaliteitsbevordering Neurochirurgie. |
Subsidie van hartstichting en ZonMw binnen CONTRAST 2. Hartstichting; registratie SAB patienten (CONTRAST 2, WP6). ZonMw; intracerebrale bloedingen trial (DIST). Consultant voor stryker neurovascular, inkomsten worden aan de afdeling Neurochirurgie van het Radboudumc betaald. |
Geen restricties |
|
Margriet van der Werf |
Revalidatiearts, Rijndam Revalidatie |
Geen |
Geen |
Geen restricties |
|
Mervyn Vergouwen |
Neuroloog, UMC Utrecht |
Geen |
CSL Behring: deelname aan advisory board meeting, betaling aan UMC Utrecht Bayer: onderzoeksgeld voor Investigator Initiated Research, betaling aan UMC Utrecht |
Geen restricties |
|
Michiel Lindhout |
Patiëntvertegenwoordiger, Hersenletsel.nl |
Bestuurder patiëntenperspectief Kennisnetwerk CVA Nederland (onbezoldigd) |
Geen |
Geen restricties |
|
René van den Berg |
(Interventie-) Neuroradioloog, Amsterdam UMC |
Geen |
Geen |
Geen restricties |
Clusterexpertisegroep
Richtlijn Subarachnoïdale bloeding: Module 1 ‘Mobiliseren na een SAB’
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Carel Meskers |
Revalidatiearts en hoogleraar, Amsterdam UMC |
Geen |
Health Holland; Care4Muscle, projectleider DCVA; Contrast 2.0, projectleider |
Geen restricties |
|
Margriet van der Werf |
Revalidatiearts, Rijndam Revalidatie |
Geen |
Geen |
Geen restricties |
Richtlijn Subarachnoïdale bloeding: Module 2 ‘Cognitieve screening na een SAB’
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Margriet van der Werf |
Revalidatiearts, Rijndam Revalidatie |
Geen |
Geen |
Geen restricties |
|
Marleen Gerritsen |
Klinisch neuropsycholoog, Deventer Ziekenhuis |
Gastvrijheidsovereenkomst UMCG |
Geen |
Geen restricties |
Richtlijn Subarachnoïdale bloeding: Module 3 ‘Behandeling gebarsten aneurysma – geavanceerde technieken’
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Mervyn Vergouwen |
Neuroloog, UMC Utrecht |
Geen |
CSL Behring: deelname aan advisory board meeting, betaling aan UMC Utrecht Bayer: onderzoeksgeld voor Investigator Initiated Research, betaling aan UMC Utrecht |
Geen restricties |
|
René van den Berg |
(Interventie-) Neuroradioloog, Amsterdam UMC |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door deelname van relevante patiëntenorganisaties aan de need-for-update en/of prioritering. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijnmodule is tevens ter commentaar voorgelegd aan alle relevante patiëntenorganisaties in de stuur- en expertisegroep (zie ‘Samenstelling cluster’ onder ‘Verantwoording’) en aan alle patiëntenorganisaties die niet deelnemen aan de stuur- en expertisegroep, maar wel hebben deelgenomen aan de need-for-update (zie ‘Need-for-update’ onder ‘Verantwoording’). De eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
De kwalitatieve raming volgt na de commentaarfase.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase (februari 2023) inventariseerde het cluster de geldigheid van de richtlijnmodules binnen het cluster. Naast de partijen die deelnemen aan de stuur- en expertisegroep zijn hier ook andere stakeholders voor benaderd. Per richtlijnmodule is aangegeven of deze geldig is, herzien moet worden, kan vervallen of moet worden samengevoegd. Ook was er de mogelijkheid om nieuwe onderwerpen aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De richtlijnmodules waarbij door één of meerdere partijen werd aangegeven herzien te worden, werden doorgezet naar de prioriteringsronde. Ook suggesties voor nieuwe richtlijnmodules werden doorgezet naar de prioriteringsronde. Afgevaardigden vanuit de partijen in de stuur- en expertisegroep werden gevraagd om te prioriteren (zie ‘Samenstelling cluster’ onder ‘Verantwoording’). Hiervoor werd de RE-weighted Priority-Setting (REPS) – tool gebruikt. De uitkomsten (ranklijst) werd gebruikt als uitgangspunt voor de discussie. Voor de geprioriteerde richtlijnmodules zijn door de het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd indien mogelijk gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
Gradaties voor de kwaliteit van wetenschappelijk bewijs
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in een richtlijnmodule volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
Sterkte van de aanbevelingen
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de richtlijnmodule Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd voorgelegd aan alle partijen die benaderd zijn voor de need-for-update fase. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd ter autorisatie of goedkeuring voorgelegd aan de partijen die beschreven staan bij ‘Initiatief en autorisatie’ onder ‘Verantwoording’.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Cluster/richtlijn: Cluster cerebrovasculaire ziekten Module 2 |
|
|
Uitgangsvraag/modules: Kan een cognitief screeningsinstrument in de subacute fase worden ingezet? |
|
|
Database(s): Embase.com, Ovid/Medline en PsychInfo |
Datum: 31-10-2023 |
|
Periode: vanaf 2015 |
Talen: geen restrictie |
|
Literatuurspecialist: Alies van der Wal en Esther van der Bijl |
Rayyan review: https://rayyan.ai/reviews/828967 |
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht op de elementen:
→ De sleutelartikelen PMID36012917 en PMID33345644 worden gevonden met deze search.
→ De sleutelartikelen PMID31802342 en PMID20595669 worden niet gevonden met deze search vanwege het diagnostisch filter. |
|
|
Te gebruiken voor richtlijntekst: In de databases Embase.com en Ovid/Medline is op 31 oktober 2023 systematisch gezocht naar systematische reviews en observationele studies over het inzetten van een cognitieve screeningsinstrument in de subacute fase. De literatuurzoekactie leverde 147 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
OVID/PSYCHINFO |
Ontdubbeld |
|
SR |
12 |
5 |
11 |
24 |
|
RCT |
- |
- |
- |
- |
|
Observationeel |
73 |
53 |
25 |
123 |
|
Totaal |
85 |
58 |
36 |
147* |
*in Rayyan
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#1 |
'subarachnoid hemorrhage'/exp OR 'perimesencephalic hemorrhage'/exp OR 'perimesencephalic subarachnoid hemorrhage'/exp OR 'perimesencephalic nonaneurysmal subarachnoid hemorrhage'/exp OR (((subarachnoid* OR perimesencephalic) NEAR/4 (hemorrhag* OR haemorrhag* OR bleed* OR blood OR hematoma* OR haematoma* OR aneurysm* OR aneurism*)):ti,ab,kw) OR asah:ti,ab,kw OR sah:ti,ab,kw OR sab:ti,ab,kw OR pmsah:ti,ab,kw |
70035 |
|
#2 |
'cognition assessment'/exp OR 'cognitive impairment assessment'/exp OR 'neuropsychological assessment'/exp OR (('cognition'/exp OR 'disorders of higher cerebral function'/exp OR (((cognitive OR cognition OR neurocognit* OR neuropsychological*) NEAR/3 (disorder* OR defect* OR disability OR impair* OR dysfunction* OR deficit* OR decline)):ti,ab,kw)) AND ('screening test'/exp OR 'screen* test*':ti,ab,kw OR 'screen* instrument*':ti,ab,kw OR 'screen* tool*':ti,ab,kw)) OR (((cognitive OR cognition OR neurocognit* OR neuropsychological*) NEAR/3 (screen* OR assessment* OR evaluat* OR examin* OR test* OR instrument*)):ti,ab,kw) OR 'montreal cognitive assessment'/exp OR 'montreal cognitive assessment':ti,ab,kw OR moca:ti,ab,kw OR 'mini mental state examination'/exp OR 'mini mental state':ti,ab,kw OR mmse:ti,ab,kw OR 'mini addenbrooke*':ti,ab,kw OR 'm ace':ti,ab,kw OR 'mini ace':ti,ab,kw OR (('perceive recall plan' NEAR/2 perform):ti,ab,kw) OR ((prpp NEAR/3 (assess* OR system OR task OR cognit*)):ti,ab,kw) |
310207 |
|
#3 |
'sensitivity and specificity'/de OR sensitivity:ab,ti OR specificity:ab,ti OR predict*:ab,ti OR 'roc curve':ab,ti OR 'receiver operator':ab,ti OR 'receiver operators':ab,ti OR likelihood:ab,ti OR 'diagnostic error'/exp OR 'diagnostic accuracy'/exp OR 'diagnostic test accuracy study'/exp OR 'inter observer':ab,ti OR 'intra observer':ab,ti OR interobserver:ab,ti OR intraobserver:ab,ti OR validity:ab,ti OR kappa:ab,ti OR reliability:ab,ti OR reproducibility:ab,ti OR ((test NEAR/2 're-test'):ab,ti) OR ((test NEAR/2 'retest'):ab,ti) OR 'reproducibility'/exp OR accuracy:ab,ti OR 'differential diagnosis'/exp OR 'validation study'/de OR 'measurement precision'/exp OR 'diagnostic value'/exp OR 'reliability'/exp OR 'predictive value'/exp OR ppv:ti,ab,kw OR npv:ti,ab,kw OR (((false OR true) NEAR/3 (negative OR positive)):ti,ab) |
6203582 |
|
#4 |
#1 AND #2 AND #3 |
237 |
|
#5 |
#4 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
179 |
|
#6 |
#5 AND [2015-2023]/py |
104 |
|
#7 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
971817 |
|
#8 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
7897170 |
|
#9 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
14520057 |
|
#10 |
#6 AND #7 – SR’s |
12 |
|
#11 |
#6 AND (#8 OR #9) NOT #10 – Observationele studies |
73 |
|
#12 |
#10 OR #11 |
85 |
Ovid/Medline
|
# |
Searches |
Results |
|
1 |
exp Subarachnoid Hemorrhage/ or ((subarachnoid* or perimesencephalic) adj4 (hemorrhag* or haemorrhag* or bleed* or blood or hematoma* or haematoma* or aneurysm* or aneurism*)).ti,ab,kf. or asah.ti,ab,kf. or sah.ti,ab,kf. or sab.ti,ab,kf. or pmsah.ti,ab,kf. |
41764 |
|
2 |
exp Neuropsychological Tests/ or Cognitive Dysfunction/di or exp Neurocognitive Disorders/ or ((exp Cognition/ or ((cognitive or cognition or neurocognit* or neuropsychological*) adj3 (disorder* or defect* or disability or impair* or dysfunction* or deficit* or decline)).ti,ab,kf.) and (screen* test* or screen* instrument* or screen* tool*).ti,ab,kf.) or ((cognitive or cognition or neurocognit* or neuropsychological*) adj3 (screen* or assessment* or evaluat* or examin* or test* or instrument*)).ti,ab,kf. or montreal cognitive assessment.ti,ab,kf. or moca.ti,ab,kf. or mini mental state.ti,ab,kf. or mmse.ti,ab,kf. or mini addenbrooke*.ti,ab,kf. or m ace.ti,ab,kf. or mini ace.ti,ab,kf. or (perceive recall plan adj2 perform).ti,ab,kf. or (prpp adj3 (assess* or system or task or cognit*)).ti,ab,kf. |
496974 |
|
3 |
exp "Sensitivity and Specificity"/ or (sensitivity or specificity).ti,ab. or (predict* or ROC-curve or receiver-operator*).ti,ab. or (likelihood or LR*).ti,ab. or exp Diagnostic Errors/ or (inter-observer or intra-observer or interobserver or intraobserver or validity or kappa or reliability).ti,ab. or reproducibility.ti,ab. or (test adj2 (re-test or retest)).ti,ab. or "Reproducibility of Results"/ or accuracy.ti,ab. or Diagnosis, Differential/ or Validation Study/ or ((false or true) adj3 (negative or positive)).ti,ab. |
4926335 |
|
4 |
1 and 2 and 3 |
218 |
|
5 |
4 not (comment/ or editorial/ or letter/) not ((exp animals/ or exp models, animal/) not humans/) |
212 |
|
6 |
limit 5 to yr=2015-2023 |
75 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
702951 |
|
8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4565335 |
|
9 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5542376 |
|
10 |
6 and 7 – SR’s |
5 |
|
11 |
(6 and (8 or 9)) not 10 – Observationele studies |
53 |
|
12 |
10 or 11 |
58 |
Ovid/PsychInfo
|
# |
Searches |
Results |
|
1 |
exp Subarachnoid Hemorrhage/ or ((subarachnoid* or perimesencephalic) adj4 (hemorrhag* or haemorrhag* or bleed* or blood or hematoma* or haematoma* or aneurysm* or aneurism*)).ti,ab,id. or asah.ti,ab,id. or sah.ti,ab,id. or sab.ti,ab,id. or pmsah.ti,ab,id. |
2203 |
|
2 |
exp Psychological Assessment/ or exp Cognitive Dysfunction/ or exp Neurocognitive Disorders/ or ((exp Cognition/ or ((cognitive or cognition or neurocognit* or neuropsychological*) adj3 (disorder* or defect* or disability or impair* or dysfunction* or deficit* or decline)).ti,ab,id,tm.) and (screen* test* or screen* instrument* or screen* tool*).ti,ab,id,tm.) or ((cognitive or cognition or neurocognit* or neuropsychological*) adj3 (screen* or assessment* or evaluat* or examin* or test* or instrument*)).ti,ab,id,tm. or montreal cognitive assessment.ti,ab,id,tm. or moca.ti,ab,id,tm. or mini mental state.ti,ab,id,tm. or mmse.ti,ab,id,tm. or mini addenbrooke*.ti,ab,id,tm. or m ace.ti,ab,id,tm. or mini ace.ti,ab,id,tm. or (perceive recall plan adj2 perform).ti,ab,id,tm. or (prpp adj3 (assess* or system or task or cognit*)).ti,ab,id,tm. |
319426 |
|
3 |
1 and 2 |
240 |
|
4 |
3 and 2015:2023.(sa_year). |
84 |
|
5 |
((literature review or systematic review or meta analysis).md. or "literature review"/ or meta analysis/ or (((meta adj2 analy*) or metaanaly* or (synthes* adj2 (literature* or research* or studies or data)) or (pooled and analys*) or ((data adj1 pool*) and studies) or medline or medlars or embase or cinahl or scisearch or psychlit or psyclit or cinhal or cancerlit or cochrane or bids or pubmed or ovid or ((hand or manual or database* or computer*) adj1 search*) or (electronic adj1 (database* or data base or data bases))).ti,ab,id. or (review* or overview).ti. or (bibliograph* or relevant journals or ((review* or overview*) adj9 (systematic* or methodologic* or quantitativ* or research* or literature* or studies or trial* or effective*))).ab.)) not (((retrospective* or record* or case* or patient*) adj1 review*) or ((patient* or review*) adj1 chart*)).ti,ab,id. |
480744 |
|
6 |
Epidemiologic studies/ or case control studies/ or exp Cohort Analysis/ or Controlled Before-After Studies/ or Case control.tw. or cohort*.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ |
463312 |
|
7 |
4 and 5 – SR’s |
11 |
|
8 |
(4 and 6) not 7 – Observationele studies |
25 |
|
9 |
7 or 8 |
36 |