Primaire tumor onbekend - Diagnostische strategie
Uitgangsvraag
Welke diagnostische strategie is het meest effectief bij patiënten met een metastase van een onbekende primaire tumor wanneer gekeken wordt naar de diagnostische opbrengst?
Aanbeveling
De diagnostiek bij patiënten met een metastase van onbekende primaire herkomst is erop gericht behandelbare tumoren uit te sluiten en om te bepalen of patiënten ingedeeld kunnen worden in een van de behandelbare subgroepen zonder aantoonbare primaire tumor (zie Tabel 1). Behandelbare subgroepen en het daarbij aanbevolen diagnostische traject staan vermeld in onderstaand schema, waarbij ervan uitgegaan wordt dat pathologie onderzoek van de metastase, inclusief immuunfenotypering, is verricht:
Uitsluiten van een primaire hoofd/hals tumor bij patiënten met een halslymfkliermetastase van een cytologisch bewezen carcinoom (vooral plaveiselcelcarcinoom, incidenteel adenocarcinoom)
- Inspectie van gezicht- en (behaarde) hoofdhuid en gehoorgang, evenals alle slijmvliezen van de bovenste lucht- en voedselweg, vooral: neusholte en mondholte.
- FDG-PET/CT of MRI van het hoofd-halsgebied. Bij plaveiselcelcarcinomen wordt beeldvormend onderzoek van het hele lichaam aanbevolen bij metastasen in het onderste 1/3 deel van de hals. Bij adenocarcinomen wordt beeldvormend onderzoek van het hele lichaam aanbevolen onafhankelijk van de lokalisatie van de metastase.
- Endoscopisch onderzoek van farynx, larynx en cervicale oesofagus.
- Op basis van beeldvorming gestuurde, gerichte biopten.
- Bilaterale tonsillectomie bij aanwezigheid van identificeerbaar (rest)tonsillair weefsel.
- ‘Blinde' biopten van overige locaties zoals tongbasis of nasofarynx kan worden overwogen.
Wegens de kans op entmetastasen wordt een histologisch biopt van een halslymfklier (i.c. een open biopt of een dikke-naaldbiopt) afgeraden. Een biopt dient pas te worden uitgevoerd na twee niet-conclusieve cytologische puncties. Indien noodzakelijk heeft een lymfklierexcisiebiopt de voorkeur boven een incisiebiopt.
Uitsluiten van een primair longcarcinoom bij patiënten met een metastase van een hooggradig grootcellig neuroendocrien carcinoom
- CT thorax en abdomen en klachtengericht onderzoek
Uitsluiten van een mammacarcinoom bij patiënten met een oksellymfkliermetastase van een adenocarcinoom (met name bij vrouwen)
- Mammografie.
- Dynamische contrast-MRI van de mamma: overwegen indien bij standaard onderzoek van de mamma geen mammatumor is aangetoond, om laesies te identificeren die gericht kunnen worden gebiopteerd.
Uitsluiten van een ovariumcarcinoom bij vrouwen met peritonitis carcinomatosa en een verhoogd CA-125
- Lichamelijk inwendig onderzoek.
- Gericht beeldvormend onderzoek (echo en indien deze negatief is CT) naar de aanwezigheid van een ovariumtumor.
- Eventueel diagnostische laparoscopie als geen ovarium- of tubacarcinoom aantoonbaar is middels lichamelijk en beeldvormend onderzoek.
Uitsluiten van een prostaatcarcinoom bij mannen met een verhoogd serum PSA en botmetastasen
- Evt. prostaatbiopten.
Uitsluiten van een kiemceltumor bij metastasen met midline distributie (vooral bij mannen)
- Echo testes.
- Serologie: AFP en (β-)HCG.
Bij geïsoleerde metastasen in de lies van met name plaveiselcelcarcinoom
- Uitsluiten van een vulva- en een vaginacarcinoom via gericht lichamelijk onderzoek en eventueel via aanvullend beeldvormend onderzoek (colposcopie).
- Uitsluiten van anus- en peniscarcinoom via gericht lichamelijk onderzoek.
- Overweeg FDG-PET/CT bij operabele patiënten.
Bij solitaire metastasen
- Overweeg FDG-PET/CT bij operabele patiënten.
- Coloscopie bij patiënten met een levermetastase, ook indien de immunfenotypering niet past bij een primair coloncarcinoom.
Overwegingen
De literatuur bleek vrijwel geen bruikbaar onderzoek te leveren met de vraagstelling welke diagnostische strategie het meest effectief is bij patiënten met een metastase van een onbekende primaire tumor. De onderstaande aanbevelingen zijn daarom (evenals in de NICE richtlijn) consensus-cq expert-based en niet zozeer evidence-based. Deze aanbevelingen zijn afgeleid van de normale diagnostische procedures zoals deze worden uitgevoerd op zoek naar een primaire tumor in een specifiek orgaan en gaan uit van het principe dat de patiënt geen mogelijke behandelopties onthouden moet worden. De aanbevelingen om specifieke tumoren uit te sluiten zijn mede gebaseerd op de conclusies zoals die geformuleerd zijn in Beeldvormend onderzoek, Endoscopisch onderzoek, Exploratieve chirurgie en Serumbepalingen, maar zijn voor de overzichtelijkheid in deze tabel opgenomen.
Onderbouwing
Conclusies / Summary of Findings
| Niveau 3 |
De diagnostiek dient gericht te zijn op het identificeren van patiënten bij wie geen primaire tumor aantoonbaar is maar die ingedeeld kunnen worden bij een van de behandelbare subgroepen (zie Tabel 1). |
Samenvatting literatuur
Inleiding
De patiënt met een onbekende primaire tumor kan zich op verschillende manieren klinisch presenteren. Het is onjuist om voor iedere patiënt dezelfde diagnostische strategie te volgen. De volgorde van de diagnostiek is erop gericht patiënten te identificeren die behoren tot de behandelbare subgroepen en de patiënt in eerste instantie zo min mogelijk te belasten.
Er zijn behandelbare subgroepen bekend:
Tabel 1: Behandelbare entiteiten.
Wetenschappelijke onderbouwing
Voor deze uitgangsvraag in deze paragraaf is gebruik gemaakt van de NICE-richtlijn.
Vertaling ‘Short Summary' vanuit NICE richtlijn (1):
- In een aantal expert reviews werden diagnostische strategieën voorgesteld voor de identificatie van primaire tumoren bij patiënten die zich presenteerden met metastasen. Het doel hiervan was het zo snel mogelijk identificeren van behandelbare tumoren. Er zijn echter geen studies waarbij een diagnostische strategie werd vergeleken met tests uitgevoerd in willekeurige volgorde.
- Er is beperkt bewijs, uit patiëntenseries, waarin wordt gesuggereerd dat de meeste primaire tumoren kunnen worden geïdentificeerd met een beperkt arsenaal basale tests. Dit impliceert dat aanvullende tests in een vroeg stadium meestal geen toegevoegde waarde hebben en dat fout-positieve diagnosen de daadwerkelijke diagnose in een aantal gevallen kunnen vertragen.
- Er is consensus in de literatuur dat, wanneer basale diagnostiek niet tot identificatie van de primaire tumor leidt, aanvullende tests selectief behoren te worden toegepast, op geleide van klachten en symptomen van de patiënt en met het doel behandelbare tumoren te identificeren.
Vertaling deel ‘Evidence summary' vanuit NICE richtlijn:
Basale tests voor patiënten die zich presenteren met een metastase van onbekende origine
Een aantal studies suggereerde een basaal panel van diagnostische tests. Er was consensus over de tests die bij alle patiënten gedaan zouden moeten worden: anamnese, uitvoerig lichamelijk onderzoek, biopt met histopathologische en immunohistochemische bepalingen, volledig bloedonderzoek, beeldvorming van de thorax (X-thorax of CT) en biochemische tests. Veel studies includeerden CT van de bovenbuik en bekken. Er was verdeeldheid over de uitvoering van mammografie bij alle vrouwen. Een aantal studies suggereerde het meten van serum PSA, AFP en -HCG bij alle mannen, terwijl in andere studies deze tumormarkers selectiever werden gebruikt.
Bij sommige patiënten kan beeldvorming van het bot en een technetium botscan richting geven aan de plaats van een biopt.
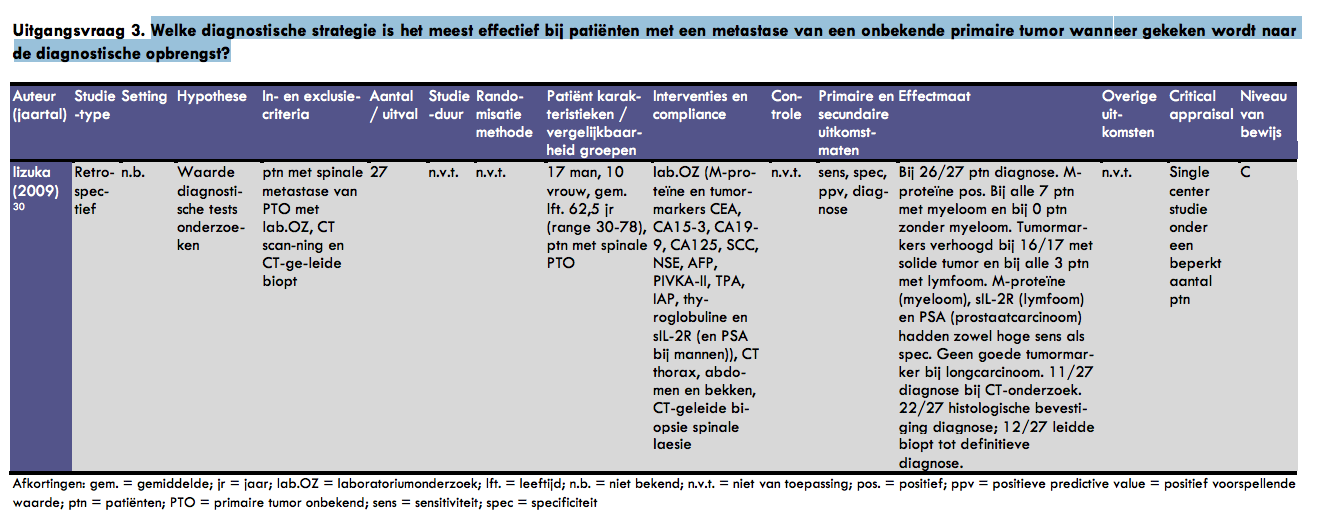
De literatuursearch die in de NICE richtlijn is gedaan, is voor deze richtlijn geactualiseerd. Daarnaast is er nog wat ruimer gezocht naar systematische reviews op het gebied van diagnostische strategieën voor de identificatie van primaire tumoren bij patiënten die zich presenteren met een metastase van onbekende primaire origine (zie ook bijlage 4). Na de literatuursearch en literatuurselectie bleven 25 artikelen over, die full-tekst werden opgevraagd. Bij bestudering van de full-tekst artikelen bleek dat opnieuw selectie nodig was vanwege methodologische tekortkomingen (zie criteria literatuurselectie in bijlage 5) of vanwege inhoudelijke argumenten (omdat het artikel niet aan de uitgangsvraag beantwoordde) (2) (3) (4) (5) (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24) (25). Het artikel van Iizuka et al. wordt inhoudelijk beschreven in Beeldvormend onderzoek.
Referenties
- 1 - NICE. NIfHaCE. Diagnosis and management of metastatic malignant disease of unknown primary origin. Full Guideline. 2010 [cited; Available from: http://www.nice.org.uk/nicemedia/live/13044/49864/49864.pdf
- 2 - Bannas P, Weber C, Derlin T, Lambert J, Leypoldt F, Adam G, et al. 18F-FDG-PET/CT in the diagnosis of paraneoplastic neurological syndromes: a retrospective analysis. Eur Radiol. 2010; 20(4): 923-30.
- 3 - de Bresser J, de Vos B, van der Ent F, Hulsewe K. Breast MRI in clinically and mammographically occult breast cancer presenting with an axillary metastasis: a systematic review. Eur J Surg Oncol. 2010; 36(2): 114-9.
- 4 - Ferte C, Penel N, Bonneterre J, Adenis A. Individual life expectancy estimation using validated prognostic scores for patients with cancer of unknown primary. Oncology. 2010; 78(2): 87-93.
- 5 - Idikio HA. Immunohistochemistry in diagnostic surgical pathology: contributions of protein life-cycle, use of evidence-based methods and data normalization on interpretation of immunohistochemical stains. Int J Clin Exp Pathol. 2009; 3(2): 169-76.
- 6 - Kwee TC, Kwee RM. Combined FDG-PET/CT for the detection of unknown primary tumors: systematic review and meta-analysis. Eur Radiol. 2009; 19(3): 731-44.
- 7 - Kwee TC, Basu S, Cheng G, Alavi A. FDG PET/CT in carcinoma of unknown primary. Eur J Nucl Med Mol Imaging. 2010; 37(3): 635-44.
- 8 - McKeon A, Apiwattanakul M, Lachance DH, Lennon VA, Mandrekar JN, Boeve BF, et al. Positron emission tomography-computed tomography in paraneoplastic neurologic disorders: systematic analysis and review. Arch Neurol. 2010; 67(3): 322-9.
- 9 - Moll R. [The initial CUP situation and CUP syndrome: pathological diagnostics]. Pathologe. 2009; 30 Suppl 2: 161-7.
- 10 - Morawietz L, Floore A, Stork-Sloots L, Folprecht G, Buettner R, Rieger A, et al. [Comparing immunohistochemical diagnosis of cancer of unknown primary with gene expression-based tumor classification]. Pathologe. 2009; 30 Suppl 2: 168-72.
- 11 - Padovani D, Aimoni C, Zucchetta P, Paluzzi A, Pastore A. 18-FDG PET in the diagnosis of laterocervical metastases from occult carcinoma. Eur Arch Otorhinolaryngol. 2009; 266(2): 267-71.
- 12 - Pavlidis N, Fizazi K. Carcinoma of unknown primary (CUP). Crit Rev Oncol Hematol. 2009; 69(3): 271-8.
- 13 - Pentheroudakis G, Lazaridis G, Pavlidis N. Axillary nodal metastases from carcinoma of unknown primary (CUPAx): a systematic review of published evidence. Breast Cancer Res Treat. 2010; 119(1): 1-11.
- 14 - Pentheroudakis G, Golfinopoulos V, Pavlidis N. Switching benchmarks in cancer of unknown primary: from autopsy to microarray. Eur J Cancer. 2007; 43(14): 2026-36.
- 15 - Prasad V, Ambrosini V, Hommann M, Hoersch D, Fanti S, Baum RP. Detection of unknown primary neuroendocrine tumours (CUP-NET) using (68)Ga-DOTA-NOC receptor PET/CT. Eur J Nucl Med Mol Imaging. 2010; 37(1): 67-77.
- 16 - Quon G, Morris Q. ISOLATE: a computational strategy for identifying the primary origin of cancers using high-throughput sequencing. Bioinformatics. 2009; 25(21): 2882-9.
- 17 - Rabban JT, Krasik E, Chen LM, Powell CB, Crawford B, Zaloudek CJ. Multistep level sections to detect occult fallopian tube carcinoma in risk-reducing salpingo-oophorectomies from women with BRCA mutations: implications for defining an optimal specimen dissection protocol. Am J Surg Pathol. 2009; 33(12): 1878-85.
- 18 - Roh JL, Kim JS, Lee JH, Cho KJ, Choi SH, Nam SY, et al. Utility of combined (18)F-fluorodeoxyglucose-positron emission tomography and computed tomography in patients with cervical metastases from unknown primary tumors. Oral Oncol. 2009; 45(3): 218-24.
- 19 - Schwab FD, Burger H, Isenschmid M, Kuhn A, Mueller MD, Gunthert AR. Suspicious axillary lymph nodes in patients with unremarkable imaging of the breast. Eur J Obstet Gynecol Reprod Biol. 2010; 150(1): 88-91.
- 20 - Vollmer RT. Differential diagnosis in immunohistochemistry with Bayes theorem. Am J Clin Pathol. 2009; 131(5): 723-30.
- 21 - Waltonen JD, Ozer E, Hall NC, Schuller DE, Agrawal A. Metastatic carcinoma of the neck of unknown primary origin: evolution and efficacy of the modern workup. Arch Otolaryngol Head Neck Surg. 2009; 135(10): 1024-9.
- 22 - Wei S, Said-Al-Naief N, Hameed O. Estrogen and progesterone receptor expression is not always specific for mammary and gynecologic carcinomas: a tissue microarray and pooled literature review study. Appl Immunohistochem Mol Morphol. 2009; 17(5): 393-402.
- 23 - Yanagawa T, Shinozaki T, Iizuka Y, Takagishi K, Watanabe H. Role of 2-deoxy-2-[F-18] fluoro-D-glucose positron emission tomography in the management of bone and soft-tissue metastases. J Bone Joint Surg Br. 2010; 92(3): 419-23.
- 24 - Yapar Z, Kibar M, Yapar AF, Paydas S, Reyhan M, Kara O, et al. The value of 18F-fluorodeoxyglucose positron emission tomography/computed tomography in carcinoma of an unknown primary: diagnosis and follow-up. Nucl Med Commun. 2010; 31(1): 59-66.
- 25 - Zemskova MS, Gundabolu B, Sinaii N, Chen CC, Carrasquillo JA, Whatley M, et al. Utility of various functional and anatomic imaging modalities for detection of ectopic adrenocorticotropin-secreting tumors. J Clin Endocrinol Metab. 2010; 95(3): 1207-19.
- 26 - Iizuka Y, Iizuka H, Tsutsumi S, Nakagawa Y, Nakajima T, Sorimachi Y, et al. Diagnosis of a previously unidentified primary site in patients with spinal metastasis: diagnostic usefulness of laboratory analysis, CT scanning and CT-guided biopsy. Eur Spine J. 2009; 18(10): 1431-5.
Evidence tabellen
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 24-06-2012
Commentaar en autorisatie
Na het vaststellen van de conceptrichtlijn door de kerngroep is deze ter commentaar rondgestuurd naar de gehele werkgroep. Na verwerking van dit commentaar door de kerngroep is de richtlijn voor commentaar gestuurd naar de verenigingen aan wie ook een knelpunteninventarisatie is gestuurd. Ook hierbij werd het commentaar door de kerngroep verwerkt. Tot slot is de richtlijn ter autorisatie naar de besturen van de (wetenschappelijke) verenigingen gestuurd. Na autorisatie is de richtlijn de professionele standaard voor de leden van die verenigingen. Tijdens de bijeenkomst op 3 en 4 februari 2011 is besloten dat de richtlijn is geaccepteerd, wanneer tenminste de verenigingen die vertegenwoordigd zijn in de kerngroep, aangevuld met de Nederlandse Vereniging voor Radiotherapie en Oncologie, de richtlijn hebben geautoriseerd.
Juridische betekenis
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence' gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Na autorisatie van de richtlijn door een beroepsvereniging, wordt de richtlijn gezien als deel van de ‘professionele standaard'.
Aangezien de aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt', kunnen zorgverleners op basis van hun professionele autonomie waar nodig afwijken van de richtlijn. Afwijken van richtlijnen kan in bepaalde situaties zelfs noodzakelijk zijn. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Herziening
De werkgroep vindt dat de richtlijn regelmatig geëvalueerd moet worden en zo nodig op onderdelen moet worden herzien, bijvoorbeeld door 1x per jaar na te gaan of er ontwikkelingen dan wel onbeantwoorde knelpunten zijn die nopen tot bijstelling van de richtlijn. Dat vereist dat de werkgroepleden door hun wetenschappelijke vereniging hiertoe zijn gemandateerd en dat de werkgroep een procedure hanteert waarbij werkgroepleden tussentijds kunnen worden vervangen indien dat wenselijk is. Een werkwijze die men hiervoor kan hanteren is bijvoorbeeld dat ieder werkgroeplid voor de duur van drie jaar wordt benoemd en dat die na drie jaar nog eens voor drie jaar kan worden herbenoemd. Een volgende benoeming kan alleen plaatsvinden indien vanuit de werkgroep door de voorzitter of door de wetenschappelijke vereniging expliciet wordt gevraagd het desbetreffende werkgroeplid nogmaals te benoemen voor drie jaar. Die wijze van herbenoeming kan daarna nog meerdere malen worden herhaald. Bij elke bijstelling is autorisatie vereist door de wetenschappelijke verenigingen die deel uitmaken van de kernwerkgroep. De bijgestelde richtlijn wordt uitgebracht via de daarvoor aangewezen kanalen. De werkgroep zal deze werkwijze proberen uit te voeren, maar is afhankelijk van structurele financiering door bijvoorbeeld de SKMS.
De werkgroep vindt het van belang dat in een revisie van deze richtlijn meer aandacht aan patiëntenvoorlichting zou moeten worden gegeven.
Doel en doelgroep
Doel van de richtlijn
Het doel van deze richtlijn is het bieden van ondersteuning aan zorgverleners bij het realiseren van een uniform en zoveel mogelijk evidence-based beleid voor nadere diagnostiek, behandeling en nazorg van patiënten met een onbekende primaire tumor. Hiermee wordt voorts beoogd diagnostiek te verminderen, samenwerkingsafspraken tussen verschillende specialismen te bevorderen en de informatieoverdracht naar de patiënt te verbeteren.
Deze richtlijn is primair geschreven voor behandelaars van deze patiënten.
Huidige tekortkomingen in het beleid bij patiënten met een onbekende primaire tumor
De diagnostiek en het behandelbeleid bij patiënten met een metastase van onbekende primaire tumor is complex, variabel en niet perfect. De tekortkomingen in het bestaande beleid kunnen worden toegeschreven aan de volgende factoren:
· Het ontbreken van een richtlijn voor deze patiënten
· Gebrek aan wetenschappelijk onderzoek
· Weinig kennis over cellulaire factoren die van belang zijn voor prognose en eventuele therapie keuzes
Samenstelling werkgroep
Om de knelpunten in de zorg voor patiënten met een onbekende primaire tumor te verbeteren is in juni 2010 een multidisciplinaire werkgroep samengesteld. Deze werkgroep bestond uit een kernwerkgroep, die de conceptaanbevelingen opstelde en een ‘schil' die betrokken was bij de inventarisatie van de knelpunten en de commentaarronde. De werkgroepleden hebben onafhankelijk gehandeld en zijn gemandateerd door hun vereniging. De werkgroep werd ondersteund door PROVA en de Nederlandse Vereniging voor Pathologie. Aan de werkgroepleden is gevraagd een belangenverklaring in te vullen, waarin hun eventuele relaties met commerciële bedrijven konden worden aangegeven (zie Belangenverklaringen).
Kerngroep
- Dr. J.J. (Joost) Oudejans, patholoog, Diakonessenhuis, Utrecht, namens de Nederlandse Vereniging voor Pathologie (voorzitter)
- Mw. drs. M.K. (Mariska) Tuut, epidemioloog, PROVA, Varsseveld (secretaris)
- Dr. M.R.W. (Marc) Engelbrecht, radioloog, Academisch Medisch Centrum, Amsterdam, namens de Nederlandse Vereniging voor Radiologie (vanaf december 2010)
- Dr. R.J.J. (Robert) van Es, kaakchirurg-oncoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Werkgroep Hoofd-Hals Tumoren en de Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Mw. dr. H.M. (Houke) Klomp, chirurgisch oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Chirurgische Oncologie - Nederlandse Vereniging voor Heelkunde
- Dr. J.A. (Alain) Kummer, patholoog, Antonius Ziekenhuis, Nieuwegein, namens de Nederlandse Vereniging voor Pathologie
- Mw. drs. C.A.H. (Charlotte) Lange, radioloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Radiologie (tot november 2010)
- Prof. dr. H.A.M. (Henri) Marres, KNO-arts, Radboud Universitair Medisch Centrum, Nijmegen, namens de Nederlandse Vereniging van Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-halsgebied en de Nederlandse Werkgroep Hoofd-Hals Tumoren
- Prof. dr. J. (Hans) Morreau, patholoog, Leids Universitair Medisch Centrum, Leiden, namens de Nederlandse Vereniging voor Pathologie
- Mw. dr. A.J. (Yes) van de Wouw, internist-oncoloog, VieCuri Medisch Centrum Venlo, namens de Nederlandse Vereniging voor Medische Oncologie
Overige werkgroepleden
- Dr. J.D. (Jeroen) van Bergeijk, Maag-, Darm-, Leverarts, Gelderse Vallei, Ede, namens de Nederlandse Vereniging voor Maag-, Darm- en Leverartsen
- Mw. drs. T. (Thea) Brouwer, psycholoog, Arnhem, namens de Nederlandse Federatie van Kankerpatiëntenorganisaties
- Drs. H.M.J. (Harry) Groen, longarts, Universitair Medisch Centrum Groningen, namens de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Dr. J.M.G. (Hans) Bonfrer, klinisch chemicus, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Klinische Chemie
- Dr. W.V. (Wouter) Vogel, nucleair geneeskundige, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Nucleaire Geneeskunde
- Mw. drs. E. (Eleonora) van Dorst, gynaecoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. A.P. (Adriaan) Visser, psycholoog, De Vruchtenburg, centrum voor begeleiding bij kanker, Rotterdam, namens de Nederlandse Vereniging voor Psychosociale Oncologie
- Dr. C.H.J. (Chris) Terhaard, radiotherapeut-oncoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Vereniging voor Radiotherapie en Oncologie
Betrokken bij knelpunten en commentaarronde:
- Integraal Kankercentrum Nederland (IKNL)
- Nederlands Huisartsen Genootschap
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging voor Urologie
- Verpleegkundigen en Verzorgenden Nederland
Belangenverklaringen
Een overzicht van deze belangenverklaringen is opgenomen. De leden van de kerngroep, alsook de extra ondersteuners, hebben tijdens de tweedaagse op 3 en 4 februari allen een belangenverklaring ingevuld, waarin zij hebben aangegeven of en welke activiteiten zij in de laatste vier jaar hebben ontplooid op uitnodiging van of met subsidie/sponsoring van een farmaceutische industrie, in relatie tot het onderwerp van de richtlijn.
De resultaten van deze inventarisatie staan in een overzicht weergegeven.
|
Naam |
Activiteiten op uitnodiging van of met subsidie/sponsoring van een farmaceutische industrie, in relatie tot het onderwerp van de richtlijn, gedurende de laatste vier jaar |
|
Joost Oudejans (voorzitter) |
Geen |
|
Mariska Tuut (secretaris) |
Geen |
|
Marc Engelbrecht |
Geen |
|
Robert van Es |
Geen |
|
Alain Kummer |
Geen |
|
Hans Morreau |
Geen |
|
Henri Marres |
Geen |
|
Houke Klomp |
Geen |
|
Yes van de Wouw |
Geen |
|
Rinke Borgonjen (procesbegeleider tijdens tweedaagse) |
Geen |
|
Jannes van Everdingen (procesbegeleider tijdens tweedaagse) |
Geen |
|
Geert Kleinnibbelink (procesbegeleider tijdens tweedaagse) |
Geen |
Methode ontwikkeling
Evidence based
Werkwijze
Knelpunteninventarisatie
In december 2009 - januari 2010 is een knelpunteninventarisatie verricht onder verenigingen die betrokken zijn bij de zorg voor mensen met een onbekende primaire tumor. Op basis hiervan is een knelpuntenlijst door de werkgroep vastgesteld in juni 2010.
In de knelpunteninventarisatie is een brief met een voorbereide lijst met mogelijke knelpunten gestuurd naar:
- Nederlands Huisartsen Genootschap
- Nederlandse Federatie van Kankerpatiëntenverenigingen
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Heelkunde
- Nederlandse Vereniging voor Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-Halsgebied
- Nederlandse Vereniging voor Klinische Chemie
- Nederlandse Vereniging voor Maag-, Darm- en Leverartsen
- Nederlandse Vereniging voor Neurologie
- Nederlandse Vereniging voor Nucleaire Geneeskunde
- Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Nederlandse Vereniging voor Pathologie
- Nederlandse Vereniging voor Psychosociale Oncologie
- Nederlandse Vereniging voor Radiologie
- Nederlandse Vereniging voor Radiotherapie en Oncologie
- Nederlandse Werkgroep voor Hoofd-Hals Tumoren
- Vereniging voor Integrale Kankercentra
- Verpleegkundigen en Verzorgenden Nederland - Oncologie
Onderstaande mogelijke knelpunten waren in deze brief opgenomen, met de vraag of de betreffende vereniging deze knelpunten onderschreef en of er aanvulling nodig was.
- Het is onduidelijk welk diagnostisch traject optimaal is om een primaire tumor aan te tonen bij patiënten die zich presenteren met een metastase van onbekende origine.
- Wat is het optimale diagnostische traject om een primaire tumor aan te tonen voor de patholoog met behulp van morfologie, immuunhistochemie,en additionele technieken (moleculaire technieken, genome profiling)
- Welke tumoren moeten in eerste instantie worden uitgesloten vanwege eventuele effectieve behandelingsopties
- Het is onduidelijk welk beeldvormend onderzoek moet worden ingezet bij welke patiënten
- Uitwendig
- Inwendig (endoscopisch)
- Het is onduidelijk wanneer en welke exploratieve chirurgische technieken moeten worden ingezet bij welke patiënten
- Het is onduidelijk welke biochemische testen bij welke patiënten moeten worden ingezet bij welke patiënten
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn voor wie aanvullend onderzoek geen of weinig zin heeft
- Het is onduidelijk wat het optimale traject is voor patiënten bij wie na aanvullend onderzoek geen primaire tumor wordt aangetroffen
- Het is onbekend wat de winst en de kosten zijn van systemische en locoregionale behandeling
- Het is onbekend of er valide prognostische factoren zijn voor de respons op systemische therapie
- Het optimale begeleidingstraject voor patiënten met een tumor van onbekende origine is niet duidelijk
In juni 2010 is door de werkgroep de lijst met onderstaande knelpunten vastgesteld:
- Er is behoefte aan een eenduidige definitie van het begrip ‘metastase van onbekende origine / primaire tumor onbekend';
- Het is onduidelijk welk diagnostisch traject optimaal is om een primaire tumor aan te tonen bij patiënten die zich presenteren met een metastase van onbekende origine;
- Wat is het optimale diagnostische traject om een primaire tumor aan te tonen voor de patholoog met behulp van morfologie, immuunhistochemie,en additionele technieken (moleculaire technieken, genome profiling);
- Welke tumoren moeten in eerste instantie worden uitgesloten vanwege eventuele effectieve behandelingsopties;
- Het is onduidelijk welk beeldvormend onderzoek moet worden ingezet bij welke patiënten;
- Uitwendig;
- Inwendig (endoscopisch);
- Het is onduidelijk wanneer en welke exploratieve chirurgische technieken moeten worden ingezet bij welke patiënten;
- Het is onduidelijk wat de rol is van klierextirpatie zonder een cytologische punctie vooraf;
- Het is onduidelijk welke biochemische testen bij welke patiënten moeten worden ingezet bij welke patiënten;
- Het is onvoldoende duidelijk omschreven welke groepen patiënten te identificeren zijn:
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn voor wie aanvullend onderzoek geen of weinig zin heeft;
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn met een relatief gunstige prognose;
- Het is onduidelijk wat het optimale traject is voor patiënten bij wie na aanvullend onderzoek geen primaire tumor wordt aangetroffen;
- Het is onbekend wat de winst en de kosten zijn van systemische en locoregionale behandeling;
- Het is onbekend of er valide prognostische factoren zijn voor de respons op systemische therapie;
- Het optimale begeleidingstraject (inclusief psychosociale begeleiding) voor patiënten met een tumor van onbekende origine is niet duidelijk;
- Het is onbekend hoe groot de behoefte is aan lotgenotencontact en/of psychosociale begeleiding;
- Het is onduidelijk of er een noodzaak bestaat tot het herhalen van de primaire screening bij patiënten met een langere overleving;
- Verwijzingscriteria van eerste naar tweede lijn en omgekeerd zijn niet duidelijk.
Literatuuronderzoek
Bij elk van de uitgangsvragen is uitgebreid gezocht naar literatuur. De recente richtlijn ‘Diagnosis and management of metastatic malignant disease of unknown primary origin' van NICE werd waar mogelijk als input gebruikt, waarbij de literatuur werd geactualiseerd. Voor uitgangsvragen waarbij geen overlap met de NICE richtlijn werd gevonden, is uitgebreid literatuur gezocht. De beschrijving van de literatuursearches is opgenomen in Zoekverantwoording.
Na het zoeken van de literatuur, waarbij grote lijsten met abstracts werden verkregen, is de literatuur geselecteerd. Op basis van de abstracts werd vooral geselecteerd op onderwerp. De artikelen moesten in hoofdzaak gaan over primaire tumor onbekend. Daarnaast werd geselecteerd op origineel onderzoek (bijvoorbeeld systematische reviews, gerandomiseerde klinische trial, cohortonderzoeken) en geen editorials, letters of reviews. Een overzicht van de literatuurselectie per uitgangsvraag is opgenomen in Zoekverantwoording. Daarna werd de literatuur full-tekst opgevraagd en beoordeeld op kwaliteit en inhoud. Dit leidde tot verdere selectie, omdat op basis van de full-tekst ook nog artikelen afvielen. Dit staat beschreven in de afzonderlijke hoofdstukken over de verschillende uitgangsvragen. De gebruikte literatuur is samengevat in de inhoudelijke hoofdstukken van deze richtlijn onder het kopje ‘wetenschappelijke onderbouwing'. De korte samenvattingen die gepubliceerd zijn in de evidence review van de NICE-richtlijn zijn, waar van toepassing, integraal overgenomen in het Nederlands.
De literatuur is daarnaast per uitgangsvraag samengevat in evidence tabellen volgens het format van CoCanCPG (bijlage 2). De evidence tabellen (zie Evidence tabellen) zijn ook volgens het format van CoCanCPG en gegradeerd naar mate van bewijs volgens de indeling in bijlage 3.
De literatuur uit de NICE richtlijn is niet separaat gegradeerd. Elke wetenschappelijke onderbouwing is afgesloten met één of meerdere conclusies. Ook aan deze conclusies is een niveau toegekend. Alle gebruikte literatuur is opgenomen in de referentielijst.
Het literatuuronderzoek werd uitgevoerd door een epidemioloog (M.K. Tuut) met input van de werkgroep. Voor de literatuursearches werd ondersteuning verkregen van het CBO.
Totstandkoming aanbevelingen
In een tweedaagse bijeenkomst op 3 en 4 februari 2011 hebben de leden van de kerngroep het evidence rapport (wetenschappelijke onderbouwing en conclusies) beoordeeld en vastgesteld. Op basis van de evidence zijn vervolgens aanbevelingen geformuleerd. Echter, naast de evidence uit de literatuur zijn er ook andere overwegingen die meespelen bij het formuleren van aanbevelingen. Deze zogeheten overige overwegingen zijn expliciet vermeld en zijn onder andere onderstaande overwegingen:
- Klinische relevantie
- Veiligheid
- Patiënten-perspectief
- Professioneel perspectief
- Beschikbaarheid van voorzieningen
- Zorgorganisatie
De aanbevelingen zijn gebaseerd op de evidence, de overige overwegingen en discussie in de werkgroep. De aanbevelingen zijn afgeleid van de antwoorden op de uitgangsvragen. Deze zijn niet gegradeerd. Vanwege zeer recent beschikbaar gekomen evidence is in de autorisatiefase een wijziging doorgevoerd in module over behandelbare metastasen in het hoofd-halsgebied. Hierover is consensus bereikt door de Nederlandse Werkgroep Hoofd Hals Tumoren, Nederlandse Vereniging van Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-halsgebied, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie en de Nederlandse Vereniging voor Radiotherapie en Oncologie.
Zoekverantwoording
De literatuursearches zijn per uitgangsvraag weergegeven (bijlage 4). De vetgedrukte regels zijn de bestanden waarvan de abstracts zijn beoordeeld in de literatuurselectie.
Alle abstracts die gevonden zijn in de literatuursearch (bijlage 5) zijn beoordeeld op relevantie. Daarbij zijn met name artikelen die niet over onbekende primaire tumoren gingen afgevallen. Ook werd gekeken naar de methodologie. Artikelen waarbij zeker was dat het geen systematisch onderzoek betrof, werden geëxcludeerd (bijvoorbeeld narratieve reviews, letters, case reports). De referenties (ref's) die overbleven na de literatuurselectie werden full-tekst opgevraagd en beoordeeld op kwaliteit en inhoud. In de tekst per module is beschreven welke artikelen op basis van full-tekst alsnog afvielen.
