Primaire tumor onbekend - Exploratieve chirurgie
Uitgangsvraag
Wat is de diagnostische opbrengst van exploratieve chirurgische technieken zoals blinde biopten bij patiënten met een metastase van een onbekende primaire tumor?
Aanbeveling
Bij een halslymfkliermetastase met plaveiselcelcarcinoom: Verrichten van, op basis van beeldvorming gestuurde, gerichte biopten. Verrichten van een bilaterale tonsillectomie bij aanwezigheid van identificeerbaar (rest)tonsillair weefsel. Het nemen van ‘blinde' biopten van overige locaties zoals tongbasis of nasofarynx kan worden overwogen.
Wegens de kans op entmetastasen wordt een histologisch biopt van de halslymfklier (i.c. een open biopt of een dikke-naaldbiopt) afgeraden.
Een biopt dient pas te worden uitgevoerd na twee niet-conclusieve cytologische puncties. Indien noodzakelijk heeft een lymfklierexcisiebiopt de voorkeur boven een incisiebiopt.
Bij vrouwen met een lieslymfkliermetastase: Diagnostische laparoscopie om een ovarium-/tubacarcinoom uit te sluiten indien geen ovarium- of tubacarcinoom aantoonbaar is bij lichamelijk en beeldvormend onderzoek.
Overwegingen
Het voordeel van exploratieve chirurgie is de mogelijke detectie van de primaire tumor, op basis waarvan gerichtere therapie kan worden ingezet. Het nadeel van exploratieve chirurgie is dat het een invasieve ingreep betreft, met risico's voor de patiënt.
Op basis van bovenstaande literatuur blijkt, dat er geen gefundeerd wetenschappelijk bewijs bestaat voor een optimale exploratieve strategie naar een occulte primaire tumor in de mucosa van de bovenste lucht- en voedselweg. Er zijn wel voldoende argumenten om te adviseren dat:
- gerichte biopten moeten worden genomen van bij beeldvorming suspecte gebieden;
- een tonsilbiopt inferieur is aan een tonsillectomie;
- wegens de lastige beeldvorming van de Ring van Waldeyer tenminste een ipsilaterale tonsillectomie moet worden verricht en ongerichte (‘blinde') biopten van tongbasis en nasofarynx kunnen worden overwogen.
Vanwege het ontbreken van goed gerichte prospectieve studies, alsmede een grote variatie in aantal en volgorde van willekeurige diagnostische interventies bij retrospectieve studies, valt uit de beschikbare literatuur niet te op te maken:
- of bilaterale tonsillectomie beter is dan een unilaterale en;
- of het gezien de beschikbare moderne beeldvorming nog steeds zinvol is ongerichte (d.w.z. ‘blinde', niet door beeldvorming gestuurde) biopten te nemen; en zo ja, van welke mucosale locaties.
Uit genoemde studies blijkt dat kleine tonsilcarcinomen soms (1-21%) bilateraal voorkomen en soms (1-5%) naar contralateraal metastaseren. Bij aanwezigheid van indentificeerbaar (rest)tonsillair weefsel zou het verrichten van een bilaterale tonsillectomie daarom de voorkeur hebben.
Met betrekking tot de tonsillectomie geldt voorts dat:
- De FDG-PETscan een lage specificiteit voor tonsillaire tumoren kent (15);
- Een bilaterale diagnostische tonsillectomie mogelijk een betere 5-jaars overleving geeft (10);
- Een diagnostische tonsillectomie aan de andere zijde dan de halslymfeklier metastase slechts geringe extra morbiditeit veroorzaakt.
De aanbeveling voor het uitsluiten van een ovarium-/tubacarcinoom is gebaseerd op goed gebruik in de klinische praktijk (17) (18).
Onderbouwing
Conclusies / Summary of Findings
| Niveau 3 |
Er zijn aanwijzingen dat bilaterale tonsillectomie en biopten van de nasofarynx nuttig zijn bij patiënten met een halslymfklier metastase van een onbekende primaire tumor. De diagnostische waarde van blinde tongbasisbiopten lijkt beperkt. |
Samenvatting literatuur
Wetenschappelijke onderbouwing
Na de literatuursearch en de literatuurselectie bleven 11 artikelen over, die full-tekst zijn beoordeeld. Hierbij vielen opnieuw artikelen af vanwege methodologische tekortkomingen of inhoudelijke redenen (omdat het artikel de uitgangsvraag niet beantwoordde) (1) (2) (3) (4) (5) (6) (7) (8) (9).
Exploratieve chirurgie in het hoofd-hals gebied: tonsillectomie en biopten van de bovenste lucht-en voedselweg
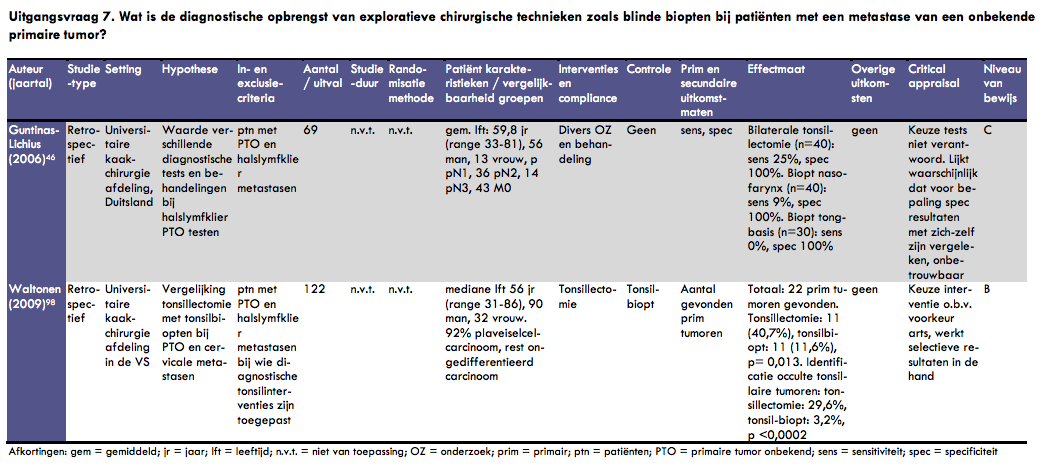
In het artikel van Guntinas-Lichius et al. worden de resultaten van een retrospectieve studie naar de diagnostiek en behandeling van patiënten met een halslymfklier metastase van een onbekende primaire tumor gerapporteerd (10). In dit onderzoek werden de dossiers van alle patiënten die met een onbekende primaire hoofd-halstumor die tussen 1987 en 2002 naar een universitaire kaakchirurgie afdeling werden verwezen, bestudeerd. In dit onderzoek werden 69 patiënten opgenomen. De gemiddelde leeftijd van deze patiënten was 60 jaar (range 33-81); er waren 56 mannen en 13 vrouwen. De primaire tumor bevond zich in de palatinale tonsil (n=8, 35%), tongbasis (n=6, 26%), long (n=4, 17%), nasofarynx (n=2, 9%) en oesofagus, parotis, huid, supraglottische larynx en tong (n=1, 4%, ieder). De resultaten van diverse diagnostische tests als ook resultaten van behandeling staan in dit artikel beschreven. Daarbij valt op, dat patiënten die een diagnostische bilaterale tonsillectomie ondergingen, een significant betere 5-jaars overleving hadden. Het betrof evenwel een univariate analyse. Deze review beperkt zich echter tot de resultaten op het gebied van exploratieve chirurgie (die slechts beperkt beschreven zijn). Bij 40 patiënten werd een bilaterale tonsillectomie uitgevoerd. Hierbij werd een sensitiviteit van 25% en een specificiteit van 100% gevonden. Eveneens bij 40 patiënten werd een biopt van de nasofarynx gedaan. Hierbij werd een sensitiviteit van 9% en een specificiteit van 100% gerapporteerd. Bij 30 patiënten werd een biopt van de tongbasis gedaan, waarbij geen extra primaire tumoren werden gevonden, wat betekent dat de gevonden sensitiviteit 0% bedraagt. De keuze voor bepaalde diagnostische tests bij bepaalde patiënten is in dit artikel niet verantwoord. Dat maakt selectie van patiënten voor bepaalde diagnostische tests op basis van vooronderstellingen waarschijnlijk. Ook is er een opmerking te maken over de gevonden resultaten. De specificiteit is bij alle drie genoemde diagnostische tests ‘100%, terwijl een adequate gouden standaard ontbreekt.
In het artikel van Waltonen uit 2009 is retrospectief gekeken naar een vergelijking van tonsilbiopt met tonsillectomie bij patiënten met een onbekende primaire tumor (11). In dit onderzoek werden 122 patiënten geïncludeerd met een gemetastaseerd carcinoom in het hoofd-halsgebied zonder dat bij lichamelijk en beeldvormend onderzoek en panendoscopie een primaire tumor was gevonden. De mediane leeftijd van deze patiënten was 56 jaar (range 31-86), er waren 90 mannen en 32 vrouwen. De gevonden metastasen waren in 92% van de gevallen plaveiselcelcarcinoom.De rest was een slecht gedifferentieerd carcinoom. Bij alle patiënten werden bilaterale biopten van de tongbasis, hypofarynx en nasofarynx genomen. Bij 95 patiënten werden bilaterale biopten van de tonsillen verricht en bij 27 patiënten werd een tonsillectomie uitgevoerd (16 unilateraal, 11 bilateraal). De voorkeur van de arts bepaalde de keuze voor één van beide tonsilinterventies. In totaal werden 22 primaire tumoren gevonden door middel van biopt of tonsillectomie, 11 in beide groepen (11,6% bij biopt versus 40,7% bij tonsillectomie, p = 0,013). De opbrengst van de identificatie van occulte tonsillaire tumoren was bij tonsillectomie significant hoger dan bij tonsilbiopten (29,6% versus 3,2%, p < 0,0002). Vanwege het retrospectieve karakter van deze studie moet met mogelijk selectieve resultaten rekening worden gehouden, vooral vanwege de invloed van de voorkeur van de arts op de keuze van de interventie (bijvoorbeeld biopt bij conditioneel slechtere patiënten).
Uit extra in 2e instantie niet-systematisch literatuuronderzoek dat voor deze richtlijn werd verricht, kwamen een aantal bevindingen naar voren: Roh verrichtte een prospectief onderzoek naar de effectiviteit van de FDG-PET/CT in de periode 2004-2007 bij 44 patiënten met halskliermetastasen van onbekende primaire tumoren, waarvan 33 met plaveiselcelcarcinoom, 3 met ongedifferentieerd carcinoom en 1 met anaplastisch carcinoom (12). Zij deden geleide biopten op basis van beeldvorming en kliniek tijdens scopie. Bij 16 patiënten (36%) werd een occulte primaire tumor gevonden, waarvan 9 (56%) in de tonsilnis, 2 (13%) in the nasofarynx, 2 (13%) in de tongbasis en 1 (6%) in resp. de hypofarynx, mondholte en schildklier. De bij FDG-PET/CT enige fout-negatieve bevinding bevond zich in de tonsilnis. Cianchetti et al. verrichtten een review en deden een retrospectieve analyse over de periode 1983-2008 waarin allerlei diagnostiek in wisselende volgorde werd toegepast (13). Daarin zitten vermoedelijk ook al de patiënten die werden geanalyseerd in de studie van Mendenhall in 2001. Zij vonden 126 (53%) occulte primairen bij 236 patiënten. De meest voorkomende primaire locaties waren de tonsilnis (n=59, 45%) en de tongbasis (n=58, 44%). Of blinde biopten zijn genomen is niet duidelijk. Zij adviseren ‘gerichte biopten te nemen' van ‘gebieden die verdacht zijn' zonder dit nader te specificeren. Waltonen et al. deden een retrospectieve analyse over de periode 1997-2007 (1). Zij vonden 84 (46%) occulte primaire tumoren bij 183 patiënten. De meest voorkomende primaire locaties waren de tonsilnis (n=34, 41%) en de tongbasis (n=28, 33%); daarnaast de orofarynx bij 6 (7%), de hypofarynx bij 11 (13%), de nasofarynx bij 4 (5%). Alle occulte primaire tumoren werden ontdekt na gerichte biopten op basis van beeldvorming en inspectie. Zij adviseren derhalve alleen gerichte biopten uit te voeren en vinden tonsillectomie optioneel. Haas ontdekte in een retrospectieve studie over de periode 1981-2000 bij 57 patiënten 19 (33%) occulte primaire tumoren, waarvan 14 (74%) in de tonsilnis en 5 (26%) in de nasofarynx (14). Rusthoven toonde aan dat de FDG-PETscan een lage sensitiviteit voor tongbasismaligniteiten en een lage specificiteit voor tonsillaire tumoren heeft (15). Er zijn enkele studies waaruit het optreden van bilaterale of contralaterale tonsilcarcinomen bij een halskliermeatstase van een onbekende primaire kan worden afgeleid: Koch vond 16 kleine tonsilcarcinomen in een groep van 41 patiënten met een halskliermeatstase van een onbekende primaire tumor (16). Daarvan waren er 2 (5%) met bilaterale synchrone primaire tonsilcarcinomen en 2 (5%) met een contralateraal tonsilcarcinoom. Kothari identificeerde uit een groep van 24 patienten met een onbekende primaire zelfs 5 (21%) patiënten met synchrone (bilaterale) tonsilcarcinomen (2). Geen van deze patiënten had een duidelijk identificeerbare primaire tumor in de tonsil bij klinische inspectie of op MRI. Bovendien was de PET/CT-scan suggestief voor iets verhoogde activiteit in alleen de ipsilaterale tonsil bij slechts 3 patiënten. Waltonen identificeerde slechts 1 (1%) bilateraal tonsilcarcinoom en 1 (1%) tonsilcarcinoom met bilaterale metastasen bij 84 geïdentificeerde primaire tumoren uit een groep van 183 patiënten met halskliermetastasen (1).
Referenties
- 1 - Waltonen JD, Ozer E, Hall NC, Schuller DE, Agrawal A. Metastatic carcinoma of the neck of unknown primary origin: evolution and efficacy of the modern workup. Arch Otolaryngol Head Neck Surg. 2009; 135(10): 1024-9.
- 2 - Kothari P, Randhawa PS, Farrell R. Role of tonsillectomy in the search for a squamous cell carcinoma from an unknown primary in the head and neck. Br J Oral Maxillofac Surg. 2008; 46(4): 283-7.
- 3 - Hewitt MJ, Anderson K, Hall GD, Weston M, Hutson R, Wilkinson N, et al. Women with peritoneal carcinomatosis of unknown origin: Efficacy of image-guided biopsy to determine site-specific diagnosis. BJOG. 2007; 114(1): 46-50.
- 4 - Eickhoff A, Spiethoff A, Hartmann D, Jakobs R, Weickert U, Schilling D, et al. [Space-occupying lesions in the liver: incidence of adenocarcinoma metastases of unknown primary site]. Dtsch Med Wochenschr. 2007; 132(8): 369-74.
- 5 - Goldenberg D, Sciubba J, Koch WM. Cystic metastasis from head and neck squamous cell cancer: a distinct disease variant? Head Neck. 2006; 28(7): 633-8.
- 6 - Han CM, Lee CL, Huang KG, Chu CM, Lin SM, Wang CJ, et al. Diagnostic laparoscopy in ascites of unknown origin: Chang Gung Memorial Hospital 20-year experience. Chang Gung Med J. 2008; 31(4): 378-83.
- 7 - Hauswald H, Lindel K, Rochet N, Debus J, Harms W. Surgery with complete resection improves survival in radiooncologically treated patients with cervical lymph node metastases from cancer of unknown primary. Strahlenther Onkol. 2008; 184(3): 150-6.
- 8 - Oien KA. Pathologic evaluation of unknown primary cancer. Semin Oncol. 2009; 36(1): 8-37.
- 9 - Peter S, Eltoum I, Eloubeidi MA. EUS-guided FNA of peritoneal carcinomatosis in patients with unknown primary malignancy. Gastrointest Endosc. 2009; 70(6): 1266-70.
- 10 - Guntinas-Lichius O, Peter Klussmann J, Dinh S, Dinh M, Schmidt M, Semrau R, et al. Diagnostic work-up and outcome of cervical metastases from an unknown primary. Acta Otolaryngol. 2006; 126(5): 536-44.
- 11 - Waltonen JD, Ozer E, Schuller DE, Agrawal A. Tonsillectomy vs. deep tonsil biopsies in detecting occult tonsil tumors. Laryngoscope. 2009; 119(1): 102-6.
- 12 - Roh JL, Kim JS, Lee JH, Cho KJ, Choi SH, Nam SY, et al. Utility of combined (18)F-fluorodeoxyglucose-positron emission tomography and computed tomography in patients with cervical metastases from unknown primary tumors. Oral Oncol. 2009; 45(3): 218-24.
- 13 - Cianchetti M, Mancuso AA, Amdur RJ, Werning JW, Kirwan J, Morris CG, et al. Diagnostic evaluation of squamous cell carcinoma metastatic to cervical lymph nodes from an unknown head and neck primary site. Laryngoscope. 2009; 119(12): 2348-54.
- 14 - Haas I, Hoffmann TK, Engers R, Ganzer U. Diagnostic strategies in cervical carcinoma of an unknown primary (CUP). Eur Arch Otorhinolaryngol. 2002; 259(6): 325-33.
- 15 - Rusthoven KE, Koshy M, Paulino AC. The role of fluorodeoxyglucose positron emission tomography in cervical lymph node metastases from an unknown primary tumor. Cancer. 2004; 101(11): 2641-9.
- 16 - Koch WM, Bhatti N, Williams MF, Eisele DW. Oncologic rationale for bilateral tonsillectomy in head and neck squamous cell carcinoma of unknown primary source. Otolaryngol Head Neck Surg. 2001; 124(3): 331-3.
- 17 - Liao YT, Wu MH, Wang MY, Lee PC, Yang CY, Lin MT, et al. Gasless laparoscopy-assisted surgery for intraabdominal/retroperitoneal tumor of unknown origin: a bridge between total laparoscopic surgery and conventional open surgery. J Laparoendosc Adv Surg Tech A. 2010; 20(10): 825-30.
- 18 - Yoon YJ, Ahn SH, Park JY, Chon CY, Kim do Y, Park YN, et al. What is the role of diagnostic laparoscopy in a gastroenterology unit? J Gastroenterol. 2007; 42(11): 881-6.
Evidence tabellen
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 24-06-2012
Commentaar en autorisatie
Na het vaststellen van de conceptrichtlijn door de kerngroep is deze ter commentaar rondgestuurd naar de gehele werkgroep. Na verwerking van dit commentaar door de kerngroep is de richtlijn voor commentaar gestuurd naar de verenigingen aan wie ook een knelpunteninventarisatie is gestuurd. Ook hierbij werd het commentaar door de kerngroep verwerkt. Tot slot is de richtlijn ter autorisatie naar de besturen van de (wetenschappelijke) verenigingen gestuurd. Na autorisatie is de richtlijn de professionele standaard voor de leden van die verenigingen. Tijdens de bijeenkomst op 3 en 4 februari 2011 is besloten dat de richtlijn is geaccepteerd, wanneer tenminste de verenigingen die vertegenwoordigd zijn in de kerngroep, aangevuld met de Nederlandse Vereniging voor Radiotherapie en Oncologie, de richtlijn hebben geautoriseerd.
Juridische betekenis
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence' gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Na autorisatie van de richtlijn door een beroepsvereniging, wordt de richtlijn gezien als deel van de ‘professionele standaard'.
Aangezien de aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt', kunnen zorgverleners op basis van hun professionele autonomie waar nodig afwijken van de richtlijn. Afwijken van richtlijnen kan in bepaalde situaties zelfs noodzakelijk zijn. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Herziening
De werkgroep vindt dat de richtlijn regelmatig geëvalueerd moet worden en zo nodig op onderdelen moet worden herzien, bijvoorbeeld door 1x per jaar na te gaan of er ontwikkelingen dan wel onbeantwoorde knelpunten zijn die nopen tot bijstelling van de richtlijn. Dat vereist dat de werkgroepleden door hun wetenschappelijke vereniging hiertoe zijn gemandateerd en dat de werkgroep een procedure hanteert waarbij werkgroepleden tussentijds kunnen worden vervangen indien dat wenselijk is. Een werkwijze die men hiervoor kan hanteren is bijvoorbeeld dat ieder werkgroeplid voor de duur van drie jaar wordt benoemd en dat die na drie jaar nog eens voor drie jaar kan worden herbenoemd. Een volgende benoeming kan alleen plaatsvinden indien vanuit de werkgroep door de voorzitter of door de wetenschappelijke vereniging expliciet wordt gevraagd het desbetreffende werkgroeplid nogmaals te benoemen voor drie jaar. Die wijze van herbenoeming kan daarna nog meerdere malen worden herhaald. Bij elke bijstelling is autorisatie vereist door de wetenschappelijke verenigingen die deel uitmaken van de kernwerkgroep. De bijgestelde richtlijn wordt uitgebracht via de daarvoor aangewezen kanalen. De werkgroep zal deze werkwijze proberen uit te voeren, maar is afhankelijk van structurele financiering door bijvoorbeeld de SKMS.
De werkgroep vindt het van belang dat in een revisie van deze richtlijn meer aandacht aan patiëntenvoorlichting zou moeten worden gegeven.
Doel en doelgroep
Doel van de richtlijn
Het doel van deze richtlijn is het bieden van ondersteuning aan zorgverleners bij het realiseren van een uniform en zoveel mogelijk evidence-based beleid voor nadere diagnostiek, behandeling en nazorg van patiënten met een onbekende primaire tumor. Hiermee wordt voorts beoogd diagnostiek te verminderen, samenwerkingsafspraken tussen verschillende specialismen te bevorderen en de informatieoverdracht naar de patiënt te verbeteren.
Deze richtlijn is primair geschreven voor behandelaars van deze patiënten.
Huidige tekortkomingen in het beleid bij patiënten met een onbekende primaire tumor
De diagnostiek en het behandelbeleid bij patiënten met een metastase van onbekende primaire tumor is complex, variabel en niet perfect. De tekortkomingen in het bestaande beleid kunnen worden toegeschreven aan de volgende factoren:
· Het ontbreken van een richtlijn voor deze patiënten
· Gebrek aan wetenschappelijk onderzoek
· Weinig kennis over cellulaire factoren die van belang zijn voor prognose en eventuele therapie keuzes
Samenstelling werkgroep
Om de knelpunten in de zorg voor patiënten met een onbekende primaire tumor te verbeteren is in juni 2010 een multidisciplinaire werkgroep samengesteld. Deze werkgroep bestond uit een kernwerkgroep, die de conceptaanbevelingen opstelde en een ‘schil' die betrokken was bij de inventarisatie van de knelpunten en de commentaarronde. De werkgroepleden hebben onafhankelijk gehandeld en zijn gemandateerd door hun vereniging. De werkgroep werd ondersteund door PROVA en de Nederlandse Vereniging voor Pathologie. Aan de werkgroepleden is gevraagd een belangenverklaring in te vullen, waarin hun eventuele relaties met commerciële bedrijven konden worden aangegeven (zie Belangenverklaringen).
Kerngroep
- Dr. J.J. (Joost) Oudejans, patholoog, Diakonessenhuis, Utrecht, namens de Nederlandse Vereniging voor Pathologie (voorzitter)
- Mw. drs. M.K. (Mariska) Tuut, epidemioloog, PROVA, Varsseveld (secretaris)
- Dr. M.R.W. (Marc) Engelbrecht, radioloog, Academisch Medisch Centrum, Amsterdam, namens de Nederlandse Vereniging voor Radiologie (vanaf december 2010)
- Dr. R.J.J. (Robert) van Es, kaakchirurg-oncoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Werkgroep Hoofd-Hals Tumoren en de Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Mw. dr. H.M. (Houke) Klomp, chirurgisch oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Chirurgische Oncologie - Nederlandse Vereniging voor Heelkunde
- Dr. J.A. (Alain) Kummer, patholoog, Antonius Ziekenhuis, Nieuwegein, namens de Nederlandse Vereniging voor Pathologie
- Mw. drs. C.A.H. (Charlotte) Lange, radioloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Radiologie (tot november 2010)
- Prof. dr. H.A.M. (Henri) Marres, KNO-arts, Radboud Universitair Medisch Centrum, Nijmegen, namens de Nederlandse Vereniging van Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-halsgebied en de Nederlandse Werkgroep Hoofd-Hals Tumoren
- Prof. dr. J. (Hans) Morreau, patholoog, Leids Universitair Medisch Centrum, Leiden, namens de Nederlandse Vereniging voor Pathologie
- Mw. dr. A.J. (Yes) van de Wouw, internist-oncoloog, VieCuri Medisch Centrum Venlo, namens de Nederlandse Vereniging voor Medische Oncologie
Overige werkgroepleden
- Dr. J.D. (Jeroen) van Bergeijk, Maag-, Darm-, Leverarts, Gelderse Vallei, Ede, namens de Nederlandse Vereniging voor Maag-, Darm- en Leverartsen
- Mw. drs. T. (Thea) Brouwer, psycholoog, Arnhem, namens de Nederlandse Federatie van Kankerpatiëntenorganisaties
- Drs. H.M.J. (Harry) Groen, longarts, Universitair Medisch Centrum Groningen, namens de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Dr. J.M.G. (Hans) Bonfrer, klinisch chemicus, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Klinische Chemie
- Dr. W.V. (Wouter) Vogel, nucleair geneeskundige, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Nucleaire Geneeskunde
- Mw. drs. E. (Eleonora) van Dorst, gynaecoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. A.P. (Adriaan) Visser, psycholoog, De Vruchtenburg, centrum voor begeleiding bij kanker, Rotterdam, namens de Nederlandse Vereniging voor Psychosociale Oncologie
- Dr. C.H.J. (Chris) Terhaard, radiotherapeut-oncoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Vereniging voor Radiotherapie en Oncologie
Betrokken bij knelpunten en commentaarronde:
- Integraal Kankercentrum Nederland (IKNL)
- Nederlands Huisartsen Genootschap
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging voor Urologie
- Verpleegkundigen en Verzorgenden Nederland
Belangenverklaringen
Een overzicht van deze belangenverklaringen is opgenomen. De leden van de kerngroep, alsook de extra ondersteuners, hebben tijdens de tweedaagse op 3 en 4 februari allen een belangenverklaring ingevuld, waarin zij hebben aangegeven of en welke activiteiten zij in de laatste vier jaar hebben ontplooid op uitnodiging van of met subsidie/sponsoring van een farmaceutische industrie, in relatie tot het onderwerp van de richtlijn.
De resultaten van deze inventarisatie staan in een overzicht weergegeven.
|
Naam |
Activiteiten op uitnodiging van of met subsidie/sponsoring van een farmaceutische industrie, in relatie tot het onderwerp van de richtlijn, gedurende de laatste vier jaar |
|
Joost Oudejans (voorzitter) |
Geen |
|
Mariska Tuut (secretaris) |
Geen |
|
Marc Engelbrecht |
Geen |
|
Robert van Es |
Geen |
|
Alain Kummer |
Geen |
|
Hans Morreau |
Geen |
|
Henri Marres |
Geen |
|
Houke Klomp |
Geen |
|
Yes van de Wouw |
Geen |
|
Rinke Borgonjen (procesbegeleider tijdens tweedaagse) |
Geen |
|
Jannes van Everdingen (procesbegeleider tijdens tweedaagse) |
Geen |
|
Geert Kleinnibbelink (procesbegeleider tijdens tweedaagse) |
Geen |
Methode ontwikkeling
Evidence based
Werkwijze
Knelpunteninventarisatie
In december 2009 - januari 2010 is een knelpunteninventarisatie verricht onder verenigingen die betrokken zijn bij de zorg voor mensen met een onbekende primaire tumor. Op basis hiervan is een knelpuntenlijst door de werkgroep vastgesteld in juni 2010.
In de knelpunteninventarisatie is een brief met een voorbereide lijst met mogelijke knelpunten gestuurd naar:
- Nederlands Huisartsen Genootschap
- Nederlandse Federatie van Kankerpatiëntenverenigingen
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Heelkunde
- Nederlandse Vereniging voor Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-Halsgebied
- Nederlandse Vereniging voor Klinische Chemie
- Nederlandse Vereniging voor Maag-, Darm- en Leverartsen
- Nederlandse Vereniging voor Neurologie
- Nederlandse Vereniging voor Nucleaire Geneeskunde
- Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Nederlandse Vereniging voor Pathologie
- Nederlandse Vereniging voor Psychosociale Oncologie
- Nederlandse Vereniging voor Radiologie
- Nederlandse Vereniging voor Radiotherapie en Oncologie
- Nederlandse Werkgroep voor Hoofd-Hals Tumoren
- Vereniging voor Integrale Kankercentra
- Verpleegkundigen en Verzorgenden Nederland - Oncologie
Onderstaande mogelijke knelpunten waren in deze brief opgenomen, met de vraag of de betreffende vereniging deze knelpunten onderschreef en of er aanvulling nodig was.
- Het is onduidelijk welk diagnostisch traject optimaal is om een primaire tumor aan te tonen bij patiënten die zich presenteren met een metastase van onbekende origine.
- Wat is het optimale diagnostische traject om een primaire tumor aan te tonen voor de patholoog met behulp van morfologie, immuunhistochemie,en additionele technieken (moleculaire technieken, genome profiling)
- Welke tumoren moeten in eerste instantie worden uitgesloten vanwege eventuele effectieve behandelingsopties
- Het is onduidelijk welk beeldvormend onderzoek moet worden ingezet bij welke patiënten
- Uitwendig
- Inwendig (endoscopisch)
- Het is onduidelijk wanneer en welke exploratieve chirurgische technieken moeten worden ingezet bij welke patiënten
- Het is onduidelijk welke biochemische testen bij welke patiënten moeten worden ingezet bij welke patiënten
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn voor wie aanvullend onderzoek geen of weinig zin heeft
- Het is onduidelijk wat het optimale traject is voor patiënten bij wie na aanvullend onderzoek geen primaire tumor wordt aangetroffen
- Het is onbekend wat de winst en de kosten zijn van systemische en locoregionale behandeling
- Het is onbekend of er valide prognostische factoren zijn voor de respons op systemische therapie
- Het optimale begeleidingstraject voor patiënten met een tumor van onbekende origine is niet duidelijk
In juni 2010 is door de werkgroep de lijst met onderstaande knelpunten vastgesteld:
- Er is behoefte aan een eenduidige definitie van het begrip ‘metastase van onbekende origine / primaire tumor onbekend';
- Het is onduidelijk welk diagnostisch traject optimaal is om een primaire tumor aan te tonen bij patiënten die zich presenteren met een metastase van onbekende origine;
- Wat is het optimale diagnostische traject om een primaire tumor aan te tonen voor de patholoog met behulp van morfologie, immuunhistochemie,en additionele technieken (moleculaire technieken, genome profiling);
- Welke tumoren moeten in eerste instantie worden uitgesloten vanwege eventuele effectieve behandelingsopties;
- Het is onduidelijk welk beeldvormend onderzoek moet worden ingezet bij welke patiënten;
- Uitwendig;
- Inwendig (endoscopisch);
- Het is onduidelijk wanneer en welke exploratieve chirurgische technieken moeten worden ingezet bij welke patiënten;
- Het is onduidelijk wat de rol is van klierextirpatie zonder een cytologische punctie vooraf;
- Het is onduidelijk welke biochemische testen bij welke patiënten moeten worden ingezet bij welke patiënten;
- Het is onvoldoende duidelijk omschreven welke groepen patiënten te identificeren zijn:
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn voor wie aanvullend onderzoek geen of weinig zin heeft;
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn met een relatief gunstige prognose;
- Het is onduidelijk wat het optimale traject is voor patiënten bij wie na aanvullend onderzoek geen primaire tumor wordt aangetroffen;
- Het is onbekend wat de winst en de kosten zijn van systemische en locoregionale behandeling;
- Het is onbekend of er valide prognostische factoren zijn voor de respons op systemische therapie;
- Het optimale begeleidingstraject (inclusief psychosociale begeleiding) voor patiënten met een tumor van onbekende origine is niet duidelijk;
- Het is onbekend hoe groot de behoefte is aan lotgenotencontact en/of psychosociale begeleiding;
- Het is onduidelijk of er een noodzaak bestaat tot het herhalen van de primaire screening bij patiënten met een langere overleving;
- Verwijzingscriteria van eerste naar tweede lijn en omgekeerd zijn niet duidelijk.
Literatuuronderzoek
Bij elk van de uitgangsvragen is uitgebreid gezocht naar literatuur. De recente richtlijn ‘Diagnosis and management of metastatic malignant disease of unknown primary origin' van NICE werd waar mogelijk als input gebruikt, waarbij de literatuur werd geactualiseerd. Voor uitgangsvragen waarbij geen overlap met de NICE richtlijn werd gevonden, is uitgebreid literatuur gezocht. De beschrijving van de literatuursearches is opgenomen in Zoekverantwoording.
Na het zoeken van de literatuur, waarbij grote lijsten met abstracts werden verkregen, is de literatuur geselecteerd. Op basis van de abstracts werd vooral geselecteerd op onderwerp. De artikelen moesten in hoofdzaak gaan over primaire tumor onbekend. Daarnaast werd geselecteerd op origineel onderzoek (bijvoorbeeld systematische reviews, gerandomiseerde klinische trial, cohortonderzoeken) en geen editorials, letters of reviews. Een overzicht van de literatuurselectie per uitgangsvraag is opgenomen in Zoekverantwoording. Daarna werd de literatuur full-tekst opgevraagd en beoordeeld op kwaliteit en inhoud. Dit leidde tot verdere selectie, omdat op basis van de full-tekst ook nog artikelen afvielen. Dit staat beschreven in de afzonderlijke hoofdstukken over de verschillende uitgangsvragen. De gebruikte literatuur is samengevat in de inhoudelijke hoofdstukken van deze richtlijn onder het kopje ‘wetenschappelijke onderbouwing'. De korte samenvattingen die gepubliceerd zijn in de evidence review van de NICE-richtlijn zijn, waar van toepassing, integraal overgenomen in het Nederlands.
De literatuur is daarnaast per uitgangsvraag samengevat in evidence tabellen volgens het format van CoCanCPG (bijlage 2). De evidence tabellen (zie Evidence tabellen) zijn ook volgens het format van CoCanCPG en gegradeerd naar mate van bewijs volgens de indeling in bijlage 3.
De literatuur uit de NICE richtlijn is niet separaat gegradeerd. Elke wetenschappelijke onderbouwing is afgesloten met één of meerdere conclusies. Ook aan deze conclusies is een niveau toegekend. Alle gebruikte literatuur is opgenomen in de referentielijst.
Het literatuuronderzoek werd uitgevoerd door een epidemioloog (M.K. Tuut) met input van de werkgroep. Voor de literatuursearches werd ondersteuning verkregen van het CBO.
Totstandkoming aanbevelingen
In een tweedaagse bijeenkomst op 3 en 4 februari 2011 hebben de leden van de kerngroep het evidence rapport (wetenschappelijke onderbouwing en conclusies) beoordeeld en vastgesteld. Op basis van de evidence zijn vervolgens aanbevelingen geformuleerd. Echter, naast de evidence uit de literatuur zijn er ook andere overwegingen die meespelen bij het formuleren van aanbevelingen. Deze zogeheten overige overwegingen zijn expliciet vermeld en zijn onder andere onderstaande overwegingen:
- Klinische relevantie
- Veiligheid
- Patiënten-perspectief
- Professioneel perspectief
- Beschikbaarheid van voorzieningen
- Zorgorganisatie
De aanbevelingen zijn gebaseerd op de evidence, de overige overwegingen en discussie in de werkgroep. De aanbevelingen zijn afgeleid van de antwoorden op de uitgangsvragen. Deze zijn niet gegradeerd. Vanwege zeer recent beschikbaar gekomen evidence is in de autorisatiefase een wijziging doorgevoerd in module over behandelbare metastasen in het hoofd-halsgebied. Hierover is consensus bereikt door de Nederlandse Werkgroep Hoofd Hals Tumoren, Nederlandse Vereniging van Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-halsgebied, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie en de Nederlandse Vereniging voor Radiotherapie en Oncologie.
Zoekverantwoording
De literatuursearches zijn per uitgangsvraag weergegeven (bijlage 4). De vetgedrukte regels zijn de bestanden waarvan de abstracts zijn beoordeeld in de literatuurselectie.
Alle abstracts die gevonden zijn in de literatuursearch (bijlage 5) zijn beoordeeld op relevantie. Daarbij zijn met name artikelen die niet over onbekende primaire tumoren gingen afgevallen. Ook werd gekeken naar de methodologie. Artikelen waarbij zeker was dat het geen systematisch onderzoek betrof, werden geëxcludeerd (bijvoorbeeld narratieve reviews, letters, case reports). De referenties (ref's) die overbleven na de literatuurselectie werden full-tekst opgevraagd en beoordeeld op kwaliteit en inhoud. In de tekst per module is beschreven welke artikelen op basis van full-tekst alsnog afvielen.
