Primaire tumor onbekend - Beeldvormend onderzoek
Uitgangsvraag
Wat is de diagnostische opbrengst van radiologische/nucleaire technieken (echo, Röntgen, MRI, FDG PET/CT) bij patiënten met een metastase van een onbekende primaire tumor?
Aanbeveling
Beeldvormend onderzoek dient te worden aangevraagd op geleide van de resultaten van pathologie onderzoek, op basis van klachten en symptomen en afhankelijk van de locatie van metastasen, zoals:
- Hoofd-hals metastase: FDG-PET/CT of MRI van het hoofd-halsgebied. Bij plaveiselcelcarcinomen wordt beeldvormend onderzoek van het hele lichaam aanbevolen bij metastasen in het onderste 1/3 deel van de hals. Bij adenocarcinomen wordt beeldvormend onderzoek van het hele lichaam aanbevolen onafhankelijk van de lokalisatie van de metastase.
- Axillaire metastase bij vrouwen: mammografie en zonodig MRI van de mammae.
- Lieslymfkliermetastase: overweeg FDG-PET/CT.
- Bij klinische verdenking op kiemceltumor: Echo testes.
- Overige lokalisaties: overweeg FDG-PET/CT. Overweeg mammografie.
- Bij klinische verdenking op een ovariumcarcinoom: echo onderbuik en eventueel CT.
- Bij een niet-kleincellige neuro-endocriene tumor: overweeg een Indium111-octreotide SPECT(/CT). Ook kan bij deze patiënten een 68Ga-DOTA-NOC-PET(/CT) overwogen worden.
Overwegingen
Een PET/CT met 68Ga-Dota-taat tracer wordt in Nederland in slechts een centrum (NKI-AVL) aangeboden. In bijna alle centra is echter wel de 111Indium-octreotide SPECT(/CT) beschikbaar, die iets minder gevoelig is (55). Deze test geeft ook aan of de tumor kan reageren op systemische Lutetium-octreotaat therapie. Daarmee kan ook bij uitgebreide ziekte nog een goede palliatie of remissie bereikt worden (56).
De diagnostische waarde van mammografie bij metastasen (anders dan axillair) blijkt uit de literatuur beperkt. Bij een positieve uitslag van de mammografie verandert echter wel het therapeutisch beleid. Dit kan mammografie rechtvaardigen als histologisch onderzoek mammacarcinoom niet uitsluit.
Voor halslymfkliermetastasen is het van belang om onderscheid te maken tussen metastase van een plaveiselcelcarcinoom en een adenocarcinoom, evenals de locatie in de hals. Bij een plaveiselcelcarcinoom in regio I, II en/of III van de hals (het bovenste 2/3 deel) is de kans groot dat de primaire tumor zich in het hoofd-hals gebied bevindt. Bij een metastase van een adenocarcinoom in regio IV en/of VB (de supraclaviculaire regio's) van de hals is een primaire tumor in het hoofd-hals gebied minder waarschijnlijk. Dan is de kans op een thoracale of abdominale primaire maligniteit groter.
Onderbouwing
Conclusies / Summary of Findings
|
|
Mammografie en MRI lijken zinvol voor het aantonen, maar niet voor het uitsluiten, van primaire mammacarcinomen bij vrouwen met een axillaire metastase van een onbekende primaire tumor. |
| Niveau 3 |
Uit gepoolde data van twee systematische reviews blijkt dat PET/CT een sensitiviteit en specificiteit van circa 80% heeft voor de detectie van onbekende primaire tumoren. Bij een aantal locaties van metastasen waren de patiëntenaantallen echter zeer laag. Deze studies zijn echter onvoldoende om een definitieve voorkeur uit te spreken over PET/CT danwel MRI als primair beeldvormend onderzoek voor detectie van onbekende primaire tumoren bij patiënten met metastasen in het hoofd/hals gebied. |
|
CT-onderzoek van thorax, abdomen en bekken bij patiënten met een botmetastase van onbekende primaire origine is waardevol. |
|
Bij patiënten met een metastase van een onbekend primair neuroendocrien carcinoom is een PET/CT met 68Ga-DOTA-NOC of vergelijkbare tracer mogelijk nuttig in de diagnostiek naar een onbekende primaire tumor, hoewel de behandelconsequenties vanwege gevorderde ziekte beperkt lijken. |
Samenvatting literatuur
Wetenschappelijke onderbouwing
Vertaling ‘Short Summary' vanuit NICE richtlijn (1):
Mammografie
De diagnostische opbrengst van mammografie bij vrouwen met lymfkliermetastase in de oksel (zonder palpabele afwijking in de borst), varieerde van 0 tot 19%.
MRI
In tien patiëntenseries van vrouwen met axillaire lymfadenopathie en onbekende primaire tumor bleken 25 tot 100% van deze vrouwen een occult mammacarcinoom te hebben. De meeste van deze primaire mammacarcinomen waren zichtbaar op een MRI van de mamma.
Er was beperkt bewijs, vanuit twee studies, dat een negatieve MRI van de mamma een rol zou kunnen hebben in het uitsluiten van mammacarcinoom in deze populatie. Echter, vanwege de hoge prevalentie van mammacarcinoom zou een significant aantal occulte mammacarcinomen kunnen worden gemist.
Vanwege de onzekere specificiteit van MRI van de mamma, zou verder diagnostisch onderzoek (zoals een mammabiopt) nodig zijn, voordat behandeling bij een positieve MRI kan worden gestart.
MRI lijkt behandelingsbeslissingen te beïnvloeden. Evaluatie van de uitgebreidheid van ziekte, gevonden op een MRI van de mamma, wordt gebruikt om mammachirurgie te plannen en voor de selectie van patiënten voor radiotherapie en neoadjuvante chemotherapie.
Er is geen aantoonbaar verschil in uitkomsten tussen vrouwen die wel en die geen MRI van de mamma hebben gehad.
Vertaling deel ‘Evidence summary' vanuit NICE richtlijn:
FDG-PET/CT
Gepoolde data suggereren een relatief hoge sensitiviteit en specificiteit (circa 80%) voor de detectie van de primaire tumor. FDG-PET/CT lijkt een hogere sensitiviteit en specificiteit te hebben dan PET. Het aantal patiënten was laag bij een aantal locaties van metastasen. Er waren minder dan 30 patiënten in de volgende groepen: peritoneum, bot, lever, long, pleura/mediastinum en huid, en de overeenkomstige gepoolde resultaten zijn waarschijnlijk niet informatief.
Twee systematische reviews bevatten meta-analyses over het nut van FDG-PET/CT voor de detectie van onbekende primaire tumoren. Kwee en Kwee (2009) (2) rapporteerden een gepoolde sensitiviteit en specificiteit van FDG-PET/CT van 84% (95% BI: 78%-88%) respectievelijk 84% (95% BI: 78%-89%). Bij Dong et al. (2008) was de gepoolde sensitiviteit en specificiteit van FDG-PET/CT 81% (95% BI: 74%-87%) respectievelijk 83% (95% BI: 78%-87%).
Vijf studies rapporteerden het aandeel inconclusieve PET of FDG-PET/CT resultaten (waarbij PET beelden niet konden worden beoordeeld als positief of negatief voor de primaire tumor). Het gepoolde aandeel niet-beoordeelbare resultaten was 16% (95% BI: 11%-23%).
Er zijn geen studies gevonden die de timing van PET-onderzoeken bestudeerden. In alle gevonden studies was gebruik gemaakt van PET of FDG-PET/CT na negatieve uitkomst van specifieke diagnostische tests.
Er zijn geen studies gevonden die het effect van het maken van een PET-scan op de overleving bestudeerden. Echter, vier studies vergeleken de totale overleving van patiënten bij wie een tumor op een PET-scan was gevonden, met patiënten bij wie geen tumor was gevonden. Twee studies rapporteerden dat de totale overleving significant lager was bij patiënten bij wie een primaire tumor zichtbaar was op de PET-scan; twee andere studies vonden geen verschil in de totale overleving.
Twintig studies rapporteerden het aandeel patiënten bij wie het beleid was veranderd op basis van het PET of FDG-PET/CT resultaat. PET-resultaten beïnvloedden het beleid in ongeveer 38% van de gevallen. Slechts één studie beschouwde of deze beleidsbeslissingen achteraf correct waren. Joshi et al. (2004) (3) rapporteerden het aandeel gunstige en ongunstige beleidsbeslissingen op basis van PET-resultaten (27% respectievelijk 5%).
De literatuursearch die voor de NICE richtlijn is gedaan, is geactualiseerd. Daarnaast is extra gezocht naar studies over andere radiologische technieken dan in de NICE richtlijn beschreven. Na de literatuursearch en literatuurselectie bleven 54 artikelen over die full-tekst zijn beoordeeld. Een aantal artikelen viel vervolgens af omdat deze over PET of PET/CT of mammografie of MRI van de mamma gingen en binnen de inclusiecriteria van de NICE evidence review vielen (2) (4) (5) (6) (7) (8) (9) (10) (11) (3) (12) (13) (14) (15) (16) (17) (18) (19) (20) (21) (22) (23) (24) (25) (26) (27) (28).Additioneel werd een aantal artikelen geëxcludeerd vanwege methodologische tekortkomingen of inhoudelijke redenen (omdat het artikel de uitgangsvraag niet beantwoordde) (29) (30) (31) (32) (33) (34) (35) (36) (37) (38) (39) (40) (41) (42) (43) (44) (45) (46) (47) (48).
Metastasen in het hoofd/hals gebied
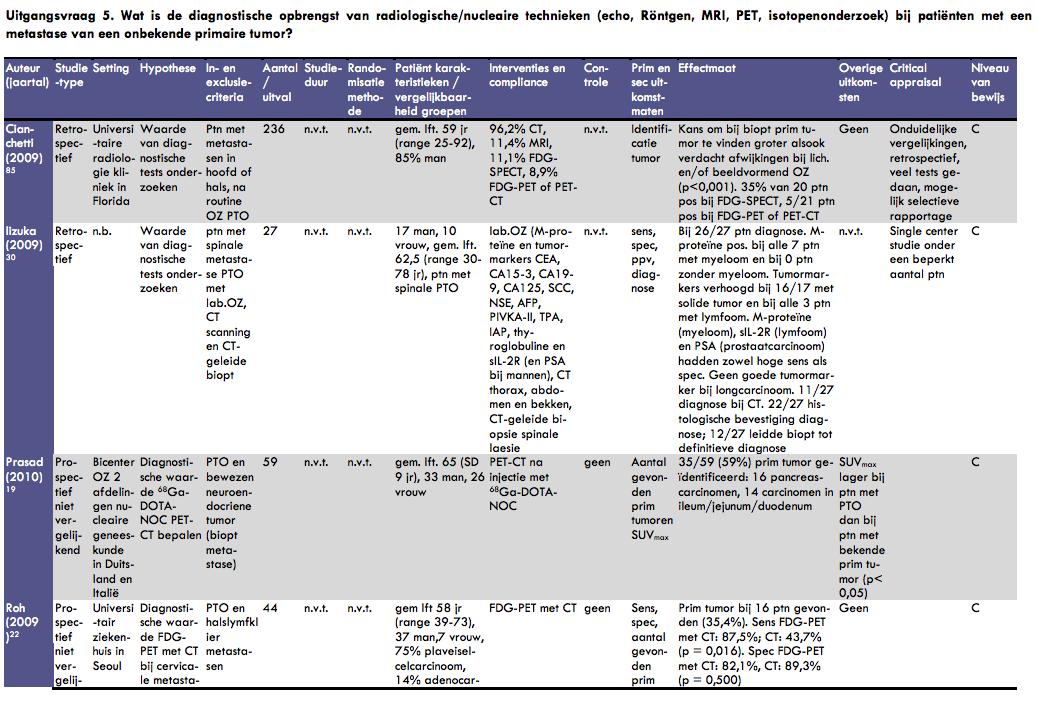
Cianchetti et al. publiceerden in 2009 een retrospectieve analyse over de diagnostiek bij patiënten met een halskliermetastase van een onbekende primaire tumor in het hoofd-halsgebied (49). In dit onderzoek werden patiënten geïncludeerd bij wie na routine onderzoek geen primaire tumor werd gevonden. Als referentieonderzoek werd panendoscopie en/of laryngoscopie met biopsie uitgevoerd. In de analyse werden 236 patiënten opgenomen, met een gemiddelde leeftijd van 59 jaar (range 25-92 jaar), 85% van hen was man. Van alle patiënten onderging 96% een CT-onderzoek, 11% kreeg een MRI, 11% een FDG-SPECT onderzoek en 9% een FDG-PET of PET/CT. Bij 126 werd uiteindelijk een primaire tumor gevonden (bevestigd met biopsie). De kans om bij biopsie een primaire tumor te identificeren was groter als er bij lichamelijk onderzoek en/of beeldvormend onderzoek verdachte afwijkingen waren gevonden (p < 0,001). Twintig patiënten ondergingen FDG-SPECT onderzoek; bij 35% hiervan werd hiermee een primaire tumor opgespoord. Bij 21 patiënten werd een FDG-PET of PET/CT onderzoek uitgevoerd; in vijf gevallen werd hierbij de primaire tumor gevonden. De vergelijkingen die in dit onderzoek zijn gedaan zijn bijzonder onduidelijk beschreven. Bovendien is het onderzoek retrospectief uitgevoerd; dat wil zeggen dat achteraf is bekeken welke diagnostische tests zijn uitgevoerd. Er is daardoor geen sprake van een gecontroleerd experimenteel design, hetgeen de betrouwbaarheid van de resultaten groter zou maken.
Van Roh et al. verscheen in 2009 een publicatie over het gebruik van FDG-PET in combinatie met CT om de primaire tumor op te sporen bij patiënten met een halslymfklier metastase van onbekende origine (50). De studie werd uitgevoerd in een universitair ziekenhuis in Seoul. In dit prospectieve cohortonderzoek werden 44 opeenvolgende patiënten geïncludeerd. Alle patiënten werden met behulp van hoofd en hals CT en FDG-PET geëvalueerd voor uitvoering van endoscopie en gerichte biopsie. De gemiddelde leeftijd van de patiënten was 58 jaar (range 39-73) en het cohort bestond uit 37 mannen en 7 vrouwen. De halsmetastasen waren bij 33 patiënten (75%) plaveiselcelcarcinomen, bij 6 patiënten adenocarcinomen en bij 3 patiënten ongedifferentieerde carcinomen. Bij 16 patiënten (35%) werd een primaire tumor gevonden (9 in de tonsillen, 2 in de nasofarynx, 2 in de tongbasis, 1 in de hypofarynx, 1 in de mondholte, 1 in de schildklier). Met de FDG-PET scan werden naast de gevonden primaire tumoren ook nog 5 fout-positieven gevonden. De combinatie FDG-PET met CT was sensitiever dan CT alleen (88% versus 44%, p = 0,016), de specificiteit van beide methoden was vergelijkbaar (82% versus 89%, P = 0,50).
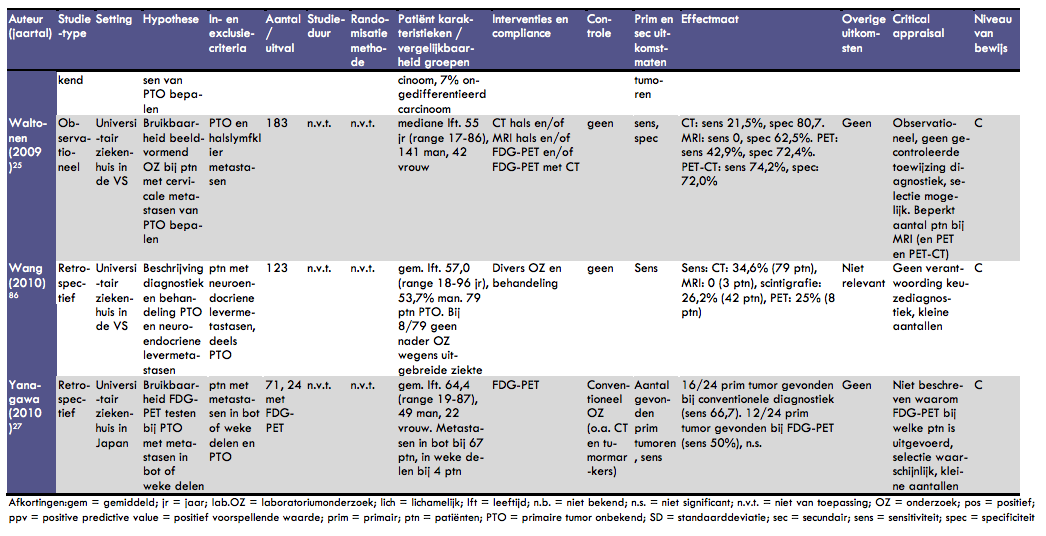
Waltonen et al. beschreven de resultaten van beeldvormend onderzoek bij patiënten met een halslymfklier metastase van een onbekende primaire tumor (30). In dit observationele onderzoek werden 183 patiënten geïncludeerd. De mediane leeftijd van de patiënten was 55 jaar (range 17-86) en 141 van hen was man. Er werden verschillende beeldvormende onderzoeken gedaan: 146 patiënten kregen een CT-scan van de hals, 13 patiënten kregen een MRI van de hals, 41 patiënten ondergingen een FDG-PET-scan en 41 een combinatie van een FDG-PET en CT-scan. De sensitiviteit van de CT-scan alleen was bij deze patiënten 22% en de specificiteit was 81%. Bij gebruik van een MRI van de hals werden geen primaire tumoren gevonden; de sensitiviteit was dan ook 0; de specificiteit was 63%. Opgemerkt moet worden dat maar zeer weinig mensen een MRI van de hals ondergingen. Bij gebruik van een PET-scan was de sensitiviteit van de identificatie van een primaire tumor 43% en de specificiteit 72%. Bij een combinatie van FDG-PET met CT tenslotte was de sensitiviteit 74% en de specificiteit 72%. De redenen voor de keuze van een bepaalde diagnostische test staan niet in dit artikel vermeld. Door het beperkte gebruik van MRI, PET of PET/CT is het wel mogelijk dat sprake is van selectieve resultaten.
Metastasen van neuroendocriene carcinomen
Prasad et al. publiceerden in 2010 de resultaten van een prospectief niet-vergelijkend onderzoek over de diagnostische waarde van 68Ga-DOTA-NOC-PET/CT voor de detectie van primaire tumoren bij patiënten met een metastase van een neuroendocriene tumor (51). In dit bi-center onderzoek werden 59 patiënten met een histologisch bewezen neuroendocriene tumor van een onbekende primaire origine geïncludeerd. Bij lichamelijk onderzoek en uitgebreid beeldvormend onderzoek (X-thorax, multislice CT, MRI, echografie) is bij deze patiënten geen primaire tumor geïdentificeerd. Bij alle patiënten werd een PET/CT onderzoek uitgevoerd na injectie van 68Ga-DOTA-NOC. Bij 35 van de 59 patiënten (59%) kon met dit onderzoek de primaire tumor geïdentificeerd worden. Het merendeel hiervan had een tumor in de pancreas (n=16) of in het ileum/jejunum/duodenum (n = 14). Wanneer alleen naar de CT-resultaten werd gekeken werd de primaire tumor in 12 van de 59 patiënten (20%) bevestigd. In het artikel staat voorts beschreven dat PET alleen ook een minder resultaat gaf dan de combinatie PET/CT, maar dit is niet gekwantificeerd. De SUVmax van de patiënten met een onbekende primaire tumor werd vergeleken met de SUVmax van patiënten met een pancreastumor en patiënten met een ileum/jejunum/duodenum tumor. De SUVmax was significant lager bij patiënten met een onbekende primaire tumor (p < 0,05). Bij 6 van de 59 patiënten werd op basis van de resultaten van de 68Ga-DOTA-NOC receptor PET/CT uitslag een operatie uitgevoerd waarbij de primaire tumor werd verwijderd. Bij de overige patiënten bij wie een primaire tumor werd geïdentificeerd was een operatie niet nuttig vanwege vergevorderde ziekte.
Levermetastasen
In het artikel van Wang et al. wordt het diagnostische en behandeltraject van patiënten met levermetastasen van een onbekende primaire neuroendocriene tumor beschreven (52). In een groep van 123 patiënten met levermetastasen (gemiddelde leeftijd 57 jaar (range 18-96), 54% man) was bij 79 patiënten de primaire tumor niet bekend. Bij 8 van deze patiënten werd vanwege uitgebreide ziekte of comorbiditeit geen nader onderzoek gedaan. De overige 71 patiënten werden nader onderzocht, tenminste met een CT-scan. De sensitiviteit van de CT-scan bij deze populatie was 35%. Bij 42 patiënten werd scintigrafie uitgevoerd; de sensitiviteit hiervan was 26%. Een PET-scan tenslotte werd bij 8 patiënten gedaan; bij 2 patiënten werd hiermee de primaire tumor gevonden (sensitiviteit 25%). De methodologie van dit onderzoek is summier beschreven, de keuze voor bepaalde diagnostische onderzoeken is niet verantwoord. Bovendien zijn sommige onderzoeken (met name MRI en PET-scan) bij zeer weinig patiënten toegepast in dit onderzoek, hetgeen de kans op toevalsresultaten vergroot.
Bot/weke delen
In 2009 verscheen een artikel van Iizuka et al., waarin zij ingingen op de diagnostische waarde van laboratoriumonderzoek, CT-onderzoek en biopsie bij patiënten met een wervelkolommetastase van een onbekende primaire tumor (53). In dit retrospectieve onderzoek werd bij 43 opeenvolgende patiënten bekeken of zij voldeden aan de inclusiecriteria: laboratoriumonderzoek (M-proteïne en tumormarkers CEA, CA15-3, CA19-9, CA125, SCC, NSE, AFP, PIVKA-II, TPA, IAP, thyroglobuline en sIL-2R (en PSA bij mannen)), CT-onderzoek van de thorax, abdomen en bekken, en CT-geleide biopsie van de spinale laesie. Dat bleek bij 27 patiënten het geval. Het is niet bekend in welke setting het onderzoek gedaan is (bijv. universitair, perifeer). De gemiddelde leeftijd van de patiënten (17 mannen en 10 vrouwen) was 63 jaar (range 30-78 jaar). Uiteindelijk werd bij 26 patiënten de primaire tumor vastgesteld. Bij 7 patiënten werd een myeloom vastgesteld; M-proteïne was positief in al deze patiënten en negatief in alle andere patiënten. Tumormarkerlevels waren verhoogd bij 16 van de 17 patiënten met een solide tumor en bij alle drie patiënten met een lymfoom. Bij myeloom (M-proteïne), lymfoom (sIL-2R) en prostaatcarcinoom (PSA) werd een tumormarker gevonden met zowel een hoge sensitiviteit als een hoge specificiteit. Bij patiënten met een longcarcinoom werd geen marker gevonden met een dergelijke diagnostische power. Van de 27 patiënten kon bij 11 patiënten op basis van CT-onderzoek een diagnose gesteld worden. De biopsie leidde bij 22 van de 27 patiënten (82%) tot een histologische bevestiging van de diagnose. Bij 12 patiënten leidden de histologische bevindingen tot een definitieve klinische diagnose. De auteurs concluderen dat een laboratoriumanalyse, gelimiteerd tot enkele specifieke tumormarkers en proteïne electroforese zinvol is om tot een diagnose te komen. Voor solide tumoren is volgens de auteurs CT-onderzoek nuttig. De studie betreft een tamelijk nette retrospectieve analyse, al had wat meer informatie gegeven kunnen worden over de setting van het onderzoek. Dat het onderzoek met maar 27 patiënten en in waarschijnlijk een enkel centrum is uitgevoerd, maakt de betrouwbaarheid van de resultaten wat beperkt.
In het onderzoek van Yanagawa et al. is de rol van FDG-PET in de diagnostiek van primaire tumoren bij patiënten met botmetastasen en metastasen in weke delen van onbekende primaire origine onderzocht (54). Het betreft een retrospectieve analyse van 99 patiënten, bij wie histologisch metastasen zijn vastgesteld. Uit deze analyse zijn 28 patiënten geëxcludeerd, omdat de primaire tumor reeds gevonden en behandeld was. De overige 71 patiënten werden geïncludeerd. De gemiddelde leeftijd van deze groep was 64 jaar (range 19-87) en de groep bestond uit 49 mannen en 22 vrouwen. Botmetastasen kwamen voor bij 67 patiënten en metastasen in de weke delen bij 4 patiënten. Alle patiënten hadden al conventionele diagnostiek ondergaan, waaronder verschillende CT-onderzoeken, endoscopisch onderzoek en onderzoek naar verschillende tumormarkers. Bij 24 patiënten was een FDG-PET gedaan. Bij 54 patiënten werd met het conventionele onderzoek een primaire tumor gevonden. Bij het FDG-PET onderzoek werd in 12 van de 24 gevallen een primaire tumor gevonden. De sensitiviteit van de set conventionele onderzoeken was 67%, die van FDG-PET (bij een subgroep) was 50%. Dit verschil was niet statistisch significant. In dit onderzoek is niet duidelijk beschreven waarom bij bepaalde patiënten de keuze voor FDG-PET onderzoek gemaakt werd. Dit maakt selectie van de patiënten waarschijnlijk. Bovendien zijn de resultaten, vooral voor wat betreft de FDG-PET resultaten, gebaseerd op weinig patiënten.
Referenties
- 1 - NICE. NIfHaCE. Diagnosis and management of metastatic malignant disease of unknown primary origin. Full Guideline. 2010 [cited; Available from: http://www.nice.org.uk/nicemedia/live/13044/49864/49864.pdf
- 2 - Kwee TC, Kwee RM. Combined FDG-PET/CT for the detection of unknown primary tumors: systematic review and meta-analysis. Eur Radiol. 2009; 19(3): 731-44.
- 3 - Joshi U, van der Hoeven JJ, Comans EF, Herder GJ, Teule GJ, Hoekstra OS. In search of an unknown primary tumour presenting with extracervical metastases: the diagnostic performance of FDG-PET. Br J Radiol. 2004; 77(924): 1000-6.
- 4 - Padovani D, Aimoni C, Zucchetta P, Paluzzi A, Pastore A. 18-FDG PET in the diagnosis of laterocervical metastases from occult carcinoma. Eur Arch Otorhinolaryngol. 2009; 266(2): 267-71.
- 5 - Alberini JL, Belhocine T, Hustinx R, Daenen F, Rigo P. Whole-body positron emission tomography using fluorodeoxyglucose in patients with metastases of unknown primary tumours (CUP syndrome). Nucl Med Commun. 2003; 24(10): 1081-6.
- 6 - Dong MJ, Zhao K, Lin XT, Zhao J, Ruan LX, Liu ZF. Role of fluorodeoxyglucose-PET versus fluorodeoxyglucose-PET/computed tomography in detection of unknown primary tumor: a meta-analysis of the literature. Nucl Med Commun. 2008; 29(9): 791-802.
- 7 - Fogarty GB, Peters LJ, Stewart J, Scott C, Rischin D, Hicks RJ. The usefulness of fluorine 18-labelled deoxyglucose positron emission tomography in the investigation of patients with cervical lymphadenopathy from an unknown primary tumor. Head Neck. 2003; 25(2): 138-45.
- 8 - Guntinas-Lichius O, Peter Klussmann J, Dinh S, Dinh M, Schmidt M, Semrau R, et al. Diagnostic work-up and outcome of cervical metastases from an unknown primary. Acta Otolaryngol. 2006; 126(5): 536-44.
- 9 - Gutzeit A, Antoch G, Kuhl H, Egelhof T, Fischer M, Hauth E, et al. Unknown primary tumors: detection with dual-modality PET/CT--initial experience. Radiology. 2005; 234(1): 227-34.
- 10 - Haas I, Hoffmann TK, Engers R, Ganzer U. Diagnostic strategies in cervical carcinoma of an unknown primary (CUP). Eur Arch Otorhinolaryngol. 2002; 259(6): 325-33.
- 11 - Johansen J, Buus S, Loft A, Keiding S, Overgaard M, Hansen HS, et al. Prospective study of 18FDG-PET in the detection and management of patients with lymph node metastases to the neck from an unknown primary tumor. Results from the DAHANCA-13 study. Head Neck. 2008; 30(4): 471-8.
- 12 - Jungehulsing M, Scheidhauer K, Damm M, Pietrzyk U, Eckel H, Schicha H, et al. 2[F]-fluoro-2-deoxy-D-glucose positron emission tomography is a sensitive tool for the detection of occult primary cancer (carcinoma of unknown primary syndrome) with head and neck lymph node manifestation. Otolaryngol Head Neck Surg. 2000; 123(3): 294-301.
- 13 - Kaya AO, Coskun U, Unlu M, Akdemir UO, Ozdemir NY, Zengin N, et al. Whole body 18F-FDG PET/CT imaging in the detection of primary tumours in patients with a metastatic carcinoma of unknown origin. Asian Pac J Cancer Prev. 2008; 9(4): 683-6.
- 14 - Kolesnikov-Gauthier H, Levy E, Merlet P, Kirova J, Syrota A, Carpentier P, et al. FDG PET in patients with cancer of an unknown primary. Nucl Med Commun. 2005; 26(12): 1059-66.
- 15 - Kothari P, Randhawa PS, Farrell R. Role of tonsillectomy in the search for a squamous cell carcinoma from an unknown primary in the head and neck. Br J Oral Maxillofac Surg. 2008; 46(4): 283-7.
- 16 - McMahon K, Medoro L, Kennedy D. Breast magnetic resonance imaging: an essential role in malignant axillary lymphadenopathy of unknown origin. Australas Radiol. 2005; 49(5): 382-9.
- 17 - Miller FR, Hussey D, Beeram M, Eng T, McGuff HS, Otto RA. Positron emission tomography in the management of unknown primary head and neck carcinoma. Arch Otolaryngol Head Neck Surg. 2005; 131(7): 626-9.
- 18 - Miller FR, Karnad AB, Eng T, Hussey DH, Stan McGuff H, Otto RA. Management of the unknown primary carcinoma: long-term follow-up on a negative PET scan and negative panendoscopy. Head Neck. 2008; 30(1): 28-34.
- 19 - Nieder C, Gregoire V, Ang KK. Cervical lymph node metastases from occult squamous cell carcinoma: cut down a tree to get an apple? Int J Radiat Oncol Biol Phys. 2001; 50(3): 727-33.
- 20 - Paul SA, Stoeckli SJ, von Schulthess GK, Goerres GW. FDG PET and PET/CT for the detection of the primary tumour in patients with cervical non-squamous cell carcinoma metastasis of an unknown primary. Eur Arch Otorhinolaryngol. 2007; 264(2): 189-95.
- 21 - Pelosi E, Pennone M, Deandreis D, Douroukas A, Mancini M, Bisi G. Role of whole body positron emission tomography/computed tomography scan with 18F-fluorodeoxyglucose in patients with biopsy proven tumor metastases from unknown primary site. Q J Nucl Med Mol Imaging. 2006; 50(1): 15-22.
- 22 - Perie S, Talbot JN, Monceaux G, Grahek D, Kerrou K, Montravers F, et al. Use of a coincidence gamma camera to detect primary tumor with 18fluoro-2-deoxy-glucose in cervical lymph node metastases from an unknown origin. Ann Otol Rhinol Laryngol. 2000; 109(8 Pt 1): 755-60.
- 23 - Rades D, Kuhnel G, Wildfang I, Borner AR, Knapp W, Karstens JH. [The value of positron emission tomography (PET) in the treatment of patients with cancer of unknown primary (CUP)]. Strahlenther Onkol. 2001; 177(10): 525-9.
- 24 - Regelink G, Brouwer J, de Bree R, Pruim J, van der Laan BF, Vaalburg W, et al. Detection of unknown primary tumours and distant metastases in patients with cervical metastases: value of FDG-PET versus conventional modalities. Eur J Nucl Med Mol Imaging. 2002; 29(8): 1024-30.
- 25 - Scott CL, Kudaba I, Stewart JM, Hicks RJ, Rischin D. The utility of 2-deoxy-2-[F-18]fluoro-D-glucose positron emission tomography in the investigation of patients with disseminated carcinoma of unknown primary origin. Mol Imaging Biol. 2005; 7(3): 236-43.
- 26 - van Veen SA, Balm AJ, Valdes Olmos RA, Hoefnagel CA, Hilgers FJ, Tan IB, et al. Occult primary tumors of the head and neck: accuracy of thallium 201 single-photon emission computed tomography and computed tomography and/or magnetic resonance imaging. Arch Otolaryngol Head Neck Surg. 2001; 127(4): 406-11.
- 27 - Wartski M, Le Stanc E, Gontier E, Vilain D, Banal A, Tainturier C, et al. In search of an unknown primary tumour presenting with cervical metastases: performance of hybrid FDG-PET-CT. Nucl Med Commun. 2007; 28(5): 365-71.
- 28 - Wong WL, Saunders M. The impact of FDG PET on the management of occult primary head and neck tumours. Clin Oncol (R Coll Radiol). 2003; 15(8): 461-6.
- 29 - Bannas P, Weber C, Derlin T, Lambert J, Leypoldt F, Adam G, et al. 18F-FDG-PET/CT in the diagnosis of paraneoplastic neurological syndromes: a retrospective analysis. Eur Radiol. 2010; 20(4): 923-30.
- 30 - Waltonen JD, Ozer E, Hall NC, Schuller DE, Agrawal A. Metastatic carcinoma of the neck of unknown primary origin: evolution and efficacy of the modern workup. Arch Otolaryngol Head Neck Surg. 2009; 135(10): 1024-9.
- 31 - Yapar Z, Kibar M, Yapar AF, Paydas S, Reyhan M, Kara O, et al. The value of 18F-fluorodeoxyglucose positron emission tomography/computed tomography in carcinoma of an unknown primary: diagnosis and follow-up. Nucl Med Commun. 2010; 31(1): 59-66.
- 32 - Adenis A, Ferte C, Penel N. Phase II trials in patients with carcinoma of unknown primary: a pooled data analysis. Invest New Drugs. 2010; 28(2): 178-84.
- 33 - Agazzi S, Pampallona S, Pica A, Vernet O, Regli L, Porchet F, et al. The origin of brain metastases in patients with an undiagnosed primary tumour. Acta Neurochir (Wien). 2004; 146(2): 153-7.
- 34 - Al-Brahim N, Ross C, Carter B, Chorneyko K. The value of postmortem examination in cases of metastasis of unknown origin-20-year retrospective data from a tertiary care center. Ann Diagn Pathol. 2005; 9(2): 77-80.
- 35 - Culine S, Lortholary A, Voigt JJ, Bugat R, Theodore C, Priou F, et al. Cisplatin in combination with either gemcitabine or irinotecan in carcinomas of unknown primary site: results of a randomized phase II study--trial for the French Study Group on Carcinomas of Unknown Primary (GEFCAPI 01). J Clin Oncol. 2003; 21(18): 3479-82.
- 36 - Destombe C, Botton E, Le Gal G, Roudaut A, Jousse-Joulin S, Devauchelle-Pensec V, et al. Investigations for bone metastasis from an unknown primary. Joint Bone Spine. 2007; 74(1): 85-9.
- 37 - Glockner JF, White LM, Sundaram M, McDonald DJ. Unsuspected metastases presenting as solitary soft tissue lesions: a fourteen-year review. Skeletal Radiol. 2000; 29(5): 270-4.
- 38 - Hawksworth J, Geisinger K, Zagoria R, Kavanagh P, Howerton R, Levine EA, et al. Surgical and ablative treatment for metastatic adenocarcinoma to the liver from unknown primary tumor. Am Surg. 2004; 70(6): 512-7.
- 39 - Hayashi T, Muto M, Hayashi R, Minashi K, Yano T, Kishimoto S, et al. Usefulness of narrow-band imaging for detecting the primary tumor site in patients with primary unknown cervical lymph node metastasis. Jpn J Clin Oncol. 2010; 40(6): 537-41.
- 40 - Hewitt MJ, Anderson K, Hall GD, Weston M, Hutson R, Wilkinson N, et al. Women with peritoneal carcinomatosis of unknown origin: Efficacy of image-guided biopsy to determine site-specific diagnosis. BJOG. 2007; 114(1): 46-50.
- 41 - Lazaridis G, Pentheroudakis G, Fountzilas G, Pavlidis N. Liver metastases from cancer of unknown primary (CUPL): a retrospective analysis of presentation, management and prognosis in 49 patients and systematic review of the literature. Cancer Treat Rev. 2008; 34(8): 693-700.
- 42 - Lortholary A, Abadie-Lacourtoisie S, Guerin O, Mege M, Rauglaudre GD, Gamelin E. [Cancers of unknown origin: 311 cases]. Bull Cancer. 2001; 88(6): 619-27.
- 43 - Mylona S, Stroumpouli E, Pomoni M, Galani P, Ntai S, Thanos L. Radiofrequency ablation of liver metastases from cancer of unknown primary site. Diagn Interv Radiol. 2009; 15(4): 297-302.
- 44 - Pavlidis N, Briasoulis E, Hainsworth J, Greco FA. Diagnostic and therapeutic management of cancer of an unknown primary. Eur J Cancer. 2003; 39(14): 1990-2005.
- 45 - Ruda R, Borgognone M, Benech F, Vasario E, Soffietti R. Brain metastases from unknown primary tumour: a prospective study. J Neurol. 2001; 248(5): 394-8.
- 46 - Sorgho-Lougue LC, Luciani A, Kobeiter H, Zelek L, Malhaire C, Deux JF, et al. Adenocarcinomas of unknown primary (ACUP) of the mediastinum mimicking lymphoma: CT findings at diagnosis and follow-up. Eur J Radiol. 2006; 59(1): 42-8.
- 47 - Subramaniam RM, Truong M, Peller P, Sakai O, Mercier G. Fluorodeoxyglucose-positron-emission tomography imaging of head and neck squamous cell cancer. AJNR Am J Neuroradiol. 2010; 31(4): 598-604.
- 48 - Weber A, Schmoz S, Bootz F. CUP (carcinoma of unknown primary) syndrome in head and neck: clinic, diagnostic, and therapy. Onkologie. 2001; 24(1): 38-43.
- 49 - Cianchetti M, Mancuso AA, Amdur RJ, Werning JW, Kirwan J, Morris CG, et al. Diagnostic evaluation of squamous cell carcinoma metastatic to cervical lymph nodes from an unknown head and neck primary site. Laryngoscope. 2009; 119(12): 2348-54.
- 50 - Roh JL, Kim JS, Lee JH, Cho KJ, Choi SH, Nam SY, et al. Utility of combined (18)F-fluorodeoxyglucose-positron emission tomography and computed tomography in patients with cervical metastases from unknown primary tumors. Oral Oncol. 2009; 45(3): 218-24.
- 51 - Prasad V, Ambrosini V, Hommann M, Hoersch D, Fanti S, Baum RP. Detection of unknown primary neuroendocrine tumours (CUP-NET) using (68)Ga-DOTA-NOC receptor PET/CT. Eur J Nucl Med Mol Imaging. 2010; 37(1): 67-77.
- 52 - Wang SC, Parekh JR, Zuraek MB, Venook AP, Bergsland EK, Warren RS, et al. Identification of unknown primary tumors in patients with neuroendocrine liver metastases. Arch Surg. 2010; 145(3): 276-80.
- 53 - Iizuka Y, Iizuka H, Tsutsumi S, Nakagawa Y, Nakajima T, Sorimachi Y, et al. Diagnosis of a previously unidentified primary site in patients with spinal metastasis: diagnostic usefulness of laboratory analysis, CT scanning and CT-guided biopsy. Eur Spine J. 2009; 18(10): 1431-5.
- 54 - Yanagawa T, Shinozaki T, Iizuka Y, Takagishi K, Watanabe H. Role of 2-deoxy-2-[F-18] fluoro-D-glucose positron emission tomography in the management of bone and soft-tissue metastases. J Bone Joint Surg Br. 2010; 92(3): 419-23.
- 55 - Srirajaskanthan R, Kayani I, Quigley AM, Soh J, Caplin ME, Bomanji J. The role of 68Ga-DOTATATE PET in patients with neuroendocrine tumors and negative or equivocal findings on 111In-DTPA-octreotide scintigraphy. J Nucl Med. 2010; 51(6): 875-82.
- 56 - Pool SE, Krenning EP, Koning GA, van Eijck CH, Teunissen JJ, Kam B, et al. Preclinical and clinical studies of peptide receptor radionuclide therapy. Semin Nucl Med. 2010; 40(3): 209-18.
Evidence tabellen
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 24-06-2012
Commentaar en autorisatie
Na het vaststellen van de conceptrichtlijn door de kerngroep is deze ter commentaar rondgestuurd naar de gehele werkgroep. Na verwerking van dit commentaar door de kerngroep is de richtlijn voor commentaar gestuurd naar de verenigingen aan wie ook een knelpunteninventarisatie is gestuurd. Ook hierbij werd het commentaar door de kerngroep verwerkt. Tot slot is de richtlijn ter autorisatie naar de besturen van de (wetenschappelijke) verenigingen gestuurd. Na autorisatie is de richtlijn de professionele standaard voor de leden van die verenigingen. Tijdens de bijeenkomst op 3 en 4 februari 2011 is besloten dat de richtlijn is geaccepteerd, wanneer tenminste de verenigingen die vertegenwoordigd zijn in de kerngroep, aangevuld met de Nederlandse Vereniging voor Radiotherapie en Oncologie, de richtlijn hebben geautoriseerd.
Juridische betekenis
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence' gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Na autorisatie van de richtlijn door een beroepsvereniging, wordt de richtlijn gezien als deel van de ‘professionele standaard'.
Aangezien de aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt', kunnen zorgverleners op basis van hun professionele autonomie waar nodig afwijken van de richtlijn. Afwijken van richtlijnen kan in bepaalde situaties zelfs noodzakelijk zijn. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Herziening
De werkgroep vindt dat de richtlijn regelmatig geëvalueerd moet worden en zo nodig op onderdelen moet worden herzien, bijvoorbeeld door 1x per jaar na te gaan of er ontwikkelingen dan wel onbeantwoorde knelpunten zijn die nopen tot bijstelling van de richtlijn. Dat vereist dat de werkgroepleden door hun wetenschappelijke vereniging hiertoe zijn gemandateerd en dat de werkgroep een procedure hanteert waarbij werkgroepleden tussentijds kunnen worden vervangen indien dat wenselijk is. Een werkwijze die men hiervoor kan hanteren is bijvoorbeeld dat ieder werkgroeplid voor de duur van drie jaar wordt benoemd en dat die na drie jaar nog eens voor drie jaar kan worden herbenoemd. Een volgende benoeming kan alleen plaatsvinden indien vanuit de werkgroep door de voorzitter of door de wetenschappelijke vereniging expliciet wordt gevraagd het desbetreffende werkgroeplid nogmaals te benoemen voor drie jaar. Die wijze van herbenoeming kan daarna nog meerdere malen worden herhaald. Bij elke bijstelling is autorisatie vereist door de wetenschappelijke verenigingen die deel uitmaken van de kernwerkgroep. De bijgestelde richtlijn wordt uitgebracht via de daarvoor aangewezen kanalen. De werkgroep zal deze werkwijze proberen uit te voeren, maar is afhankelijk van structurele financiering door bijvoorbeeld de SKMS.
De werkgroep vindt het van belang dat in een revisie van deze richtlijn meer aandacht aan patiëntenvoorlichting zou moeten worden gegeven.
Doel en doelgroep
Doel van de richtlijn
Het doel van deze richtlijn is het bieden van ondersteuning aan zorgverleners bij het realiseren van een uniform en zoveel mogelijk evidence-based beleid voor nadere diagnostiek, behandeling en nazorg van patiënten met een onbekende primaire tumor. Hiermee wordt voorts beoogd diagnostiek te verminderen, samenwerkingsafspraken tussen verschillende specialismen te bevorderen en de informatieoverdracht naar de patiënt te verbeteren.
Deze richtlijn is primair geschreven voor behandelaars van deze patiënten.
Huidige tekortkomingen in het beleid bij patiënten met een onbekende primaire tumor
De diagnostiek en het behandelbeleid bij patiënten met een metastase van onbekende primaire tumor is complex, variabel en niet perfect. De tekortkomingen in het bestaande beleid kunnen worden toegeschreven aan de volgende factoren:
· Het ontbreken van een richtlijn voor deze patiënten
· Gebrek aan wetenschappelijk onderzoek
· Weinig kennis over cellulaire factoren die van belang zijn voor prognose en eventuele therapie keuzes
Samenstelling werkgroep
Om de knelpunten in de zorg voor patiënten met een onbekende primaire tumor te verbeteren is in juni 2010 een multidisciplinaire werkgroep samengesteld. Deze werkgroep bestond uit een kernwerkgroep, die de conceptaanbevelingen opstelde en een ‘schil' die betrokken was bij de inventarisatie van de knelpunten en de commentaarronde. De werkgroepleden hebben onafhankelijk gehandeld en zijn gemandateerd door hun vereniging. De werkgroep werd ondersteund door PROVA en de Nederlandse Vereniging voor Pathologie. Aan de werkgroepleden is gevraagd een belangenverklaring in te vullen, waarin hun eventuele relaties met commerciële bedrijven konden worden aangegeven (zie Belangenverklaringen).
Kerngroep
- Dr. J.J. (Joost) Oudejans, patholoog, Diakonessenhuis, Utrecht, namens de Nederlandse Vereniging voor Pathologie (voorzitter)
- Mw. drs. M.K. (Mariska) Tuut, epidemioloog, PROVA, Varsseveld (secretaris)
- Dr. M.R.W. (Marc) Engelbrecht, radioloog, Academisch Medisch Centrum, Amsterdam, namens de Nederlandse Vereniging voor Radiologie (vanaf december 2010)
- Dr. R.J.J. (Robert) van Es, kaakchirurg-oncoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Werkgroep Hoofd-Hals Tumoren en de Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Mw. dr. H.M. (Houke) Klomp, chirurgisch oncoloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Chirurgische Oncologie - Nederlandse Vereniging voor Heelkunde
- Dr. J.A. (Alain) Kummer, patholoog, Antonius Ziekenhuis, Nieuwegein, namens de Nederlandse Vereniging voor Pathologie
- Mw. drs. C.A.H. (Charlotte) Lange, radioloog, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Radiologie (tot november 2010)
- Prof. dr. H.A.M. (Henri) Marres, KNO-arts, Radboud Universitair Medisch Centrum, Nijmegen, namens de Nederlandse Vereniging van Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-halsgebied en de Nederlandse Werkgroep Hoofd-Hals Tumoren
- Prof. dr. J. (Hans) Morreau, patholoog, Leids Universitair Medisch Centrum, Leiden, namens de Nederlandse Vereniging voor Pathologie
- Mw. dr. A.J. (Yes) van de Wouw, internist-oncoloog, VieCuri Medisch Centrum Venlo, namens de Nederlandse Vereniging voor Medische Oncologie
Overige werkgroepleden
- Dr. J.D. (Jeroen) van Bergeijk, Maag-, Darm-, Leverarts, Gelderse Vallei, Ede, namens de Nederlandse Vereniging voor Maag-, Darm- en Leverartsen
- Mw. drs. T. (Thea) Brouwer, psycholoog, Arnhem, namens de Nederlandse Federatie van Kankerpatiëntenorganisaties
- Drs. H.M.J. (Harry) Groen, longarts, Universitair Medisch Centrum Groningen, namens de Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Dr. J.M.G. (Hans) Bonfrer, klinisch chemicus, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Klinische Chemie
- Dr. W.V. (Wouter) Vogel, nucleair geneeskundige, Antoni van Leeuwenhoek Ziekenhuis, Amsterdam, namens de Nederlandse Vereniging voor Nucleaire Geneeskunde
- Mw. drs. E. (Eleonora) van Dorst, gynaecoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. A.P. (Adriaan) Visser, psycholoog, De Vruchtenburg, centrum voor begeleiding bij kanker, Rotterdam, namens de Nederlandse Vereniging voor Psychosociale Oncologie
- Dr. C.H.J. (Chris) Terhaard, radiotherapeut-oncoloog, Universitair Medisch Centrum Utrecht, namens de Nederlandse Vereniging voor Radiotherapie en Oncologie
Betrokken bij knelpunten en commentaarronde:
- Integraal Kankercentrum Nederland (IKNL)
- Nederlands Huisartsen Genootschap
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging voor Urologie
- Verpleegkundigen en Verzorgenden Nederland
Belangenverklaringen
Een overzicht van deze belangenverklaringen is opgenomen. De leden van de kerngroep, alsook de extra ondersteuners, hebben tijdens de tweedaagse op 3 en 4 februari allen een belangenverklaring ingevuld, waarin zij hebben aangegeven of en welke activiteiten zij in de laatste vier jaar hebben ontplooid op uitnodiging van of met subsidie/sponsoring van een farmaceutische industrie, in relatie tot het onderwerp van de richtlijn.
De resultaten van deze inventarisatie staan in een overzicht weergegeven.
|
Naam |
Activiteiten op uitnodiging van of met subsidie/sponsoring van een farmaceutische industrie, in relatie tot het onderwerp van de richtlijn, gedurende de laatste vier jaar |
|
Joost Oudejans (voorzitter) |
Geen |
|
Mariska Tuut (secretaris) |
Geen |
|
Marc Engelbrecht |
Geen |
|
Robert van Es |
Geen |
|
Alain Kummer |
Geen |
|
Hans Morreau |
Geen |
|
Henri Marres |
Geen |
|
Houke Klomp |
Geen |
|
Yes van de Wouw |
Geen |
|
Rinke Borgonjen (procesbegeleider tijdens tweedaagse) |
Geen |
|
Jannes van Everdingen (procesbegeleider tijdens tweedaagse) |
Geen |
|
Geert Kleinnibbelink (procesbegeleider tijdens tweedaagse) |
Geen |
Methode ontwikkeling
Evidence based
Werkwijze
Knelpunteninventarisatie
In december 2009 - januari 2010 is een knelpunteninventarisatie verricht onder verenigingen die betrokken zijn bij de zorg voor mensen met een onbekende primaire tumor. Op basis hiervan is een knelpuntenlijst door de werkgroep vastgesteld in juni 2010.
In de knelpunteninventarisatie is een brief met een voorbereide lijst met mogelijke knelpunten gestuurd naar:
- Nederlands Huisartsen Genootschap
- Nederlandse Federatie van Kankerpatiëntenverenigingen
- Nederlandse Internisten Vereniging
- Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose
- Nederlandse Vereniging voor Heelkunde
- Nederlandse Vereniging voor Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-Halsgebied
- Nederlandse Vereniging voor Klinische Chemie
- Nederlandse Vereniging voor Maag-, Darm- en Leverartsen
- Nederlandse Vereniging voor Neurologie
- Nederlandse Vereniging voor Nucleaire Geneeskunde
- Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Nederlandse Vereniging voor Pathologie
- Nederlandse Vereniging voor Psychosociale Oncologie
- Nederlandse Vereniging voor Radiologie
- Nederlandse Vereniging voor Radiotherapie en Oncologie
- Nederlandse Werkgroep voor Hoofd-Hals Tumoren
- Vereniging voor Integrale Kankercentra
- Verpleegkundigen en Verzorgenden Nederland - Oncologie
Onderstaande mogelijke knelpunten waren in deze brief opgenomen, met de vraag of de betreffende vereniging deze knelpunten onderschreef en of er aanvulling nodig was.
- Het is onduidelijk welk diagnostisch traject optimaal is om een primaire tumor aan te tonen bij patiënten die zich presenteren met een metastase van onbekende origine.
- Wat is het optimale diagnostische traject om een primaire tumor aan te tonen voor de patholoog met behulp van morfologie, immuunhistochemie,en additionele technieken (moleculaire technieken, genome profiling)
- Welke tumoren moeten in eerste instantie worden uitgesloten vanwege eventuele effectieve behandelingsopties
- Het is onduidelijk welk beeldvormend onderzoek moet worden ingezet bij welke patiënten
- Uitwendig
- Inwendig (endoscopisch)
- Het is onduidelijk wanneer en welke exploratieve chirurgische technieken moeten worden ingezet bij welke patiënten
- Het is onduidelijk welke biochemische testen bij welke patiënten moeten worden ingezet bij welke patiënten
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn voor wie aanvullend onderzoek geen of weinig zin heeft
- Het is onduidelijk wat het optimale traject is voor patiënten bij wie na aanvullend onderzoek geen primaire tumor wordt aangetroffen
- Het is onbekend wat de winst en de kosten zijn van systemische en locoregionale behandeling
- Het is onbekend of er valide prognostische factoren zijn voor de respons op systemische therapie
- Het optimale begeleidingstraject voor patiënten met een tumor van onbekende origine is niet duidelijk
In juni 2010 is door de werkgroep de lijst met onderstaande knelpunten vastgesteld:
- Er is behoefte aan een eenduidige definitie van het begrip ‘metastase van onbekende origine / primaire tumor onbekend';
- Het is onduidelijk welk diagnostisch traject optimaal is om een primaire tumor aan te tonen bij patiënten die zich presenteren met een metastase van onbekende origine;
- Wat is het optimale diagnostische traject om een primaire tumor aan te tonen voor de patholoog met behulp van morfologie, immuunhistochemie,en additionele technieken (moleculaire technieken, genome profiling);
- Welke tumoren moeten in eerste instantie worden uitgesloten vanwege eventuele effectieve behandelingsopties;
- Het is onduidelijk welk beeldvormend onderzoek moet worden ingezet bij welke patiënten;
- Uitwendig;
- Inwendig (endoscopisch);
- Het is onduidelijk wanneer en welke exploratieve chirurgische technieken moeten worden ingezet bij welke patiënten;
- Het is onduidelijk wat de rol is van klierextirpatie zonder een cytologische punctie vooraf;
- Het is onduidelijk welke biochemische testen bij welke patiënten moeten worden ingezet bij welke patiënten;
- Het is onvoldoende duidelijk omschreven welke groepen patiënten te identificeren zijn:
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn voor wie aanvullend onderzoek geen of weinig zin heeft;
- Het is onduidelijk of er, op basis van prognostische informatie, groepen patiënten te identificeren zijn met een relatief gunstige prognose;
- Het is onduidelijk wat het optimale traject is voor patiënten bij wie na aanvullend onderzoek geen primaire tumor wordt aangetroffen;
- Het is onbekend wat de winst en de kosten zijn van systemische en locoregionale behandeling;
- Het is onbekend of er valide prognostische factoren zijn voor de respons op systemische therapie;
- Het optimale begeleidingstraject (inclusief psychosociale begeleiding) voor patiënten met een tumor van onbekende origine is niet duidelijk;
- Het is onbekend hoe groot de behoefte is aan lotgenotencontact en/of psychosociale begeleiding;
- Het is onduidelijk of er een noodzaak bestaat tot het herhalen van de primaire screening bij patiënten met een langere overleving;
- Verwijzingscriteria van eerste naar tweede lijn en omgekeerd zijn niet duidelijk.
Literatuuronderzoek
Bij elk van de uitgangsvragen is uitgebreid gezocht naar literatuur. De recente richtlijn ‘Diagnosis and management of metastatic malignant disease of unknown primary origin' van NICE werd waar mogelijk als input gebruikt, waarbij de literatuur werd geactualiseerd. Voor uitgangsvragen waarbij geen overlap met de NICE richtlijn werd gevonden, is uitgebreid literatuur gezocht. De beschrijving van de literatuursearches is opgenomen in Zoekverantwoording.
Na het zoeken van de literatuur, waarbij grote lijsten met abstracts werden verkregen, is de literatuur geselecteerd. Op basis van de abstracts werd vooral geselecteerd op onderwerp. De artikelen moesten in hoofdzaak gaan over primaire tumor onbekend. Daarnaast werd geselecteerd op origineel onderzoek (bijvoorbeeld systematische reviews, gerandomiseerde klinische trial, cohortonderzoeken) en geen editorials, letters of reviews. Een overzicht van de literatuurselectie per uitgangsvraag is opgenomen in Zoekverantwoording. Daarna werd de literatuur full-tekst opgevraagd en beoordeeld op kwaliteit en inhoud. Dit leidde tot verdere selectie, omdat op basis van de full-tekst ook nog artikelen afvielen. Dit staat beschreven in de afzonderlijke hoofdstukken over de verschillende uitgangsvragen. De gebruikte literatuur is samengevat in de inhoudelijke hoofdstukken van deze richtlijn onder het kopje ‘wetenschappelijke onderbouwing'. De korte samenvattingen die gepubliceerd zijn in de evidence review van de NICE-richtlijn zijn, waar van toepassing, integraal overgenomen in het Nederlands.
De literatuur is daarnaast per uitgangsvraag samengevat in evidence tabellen volgens het format van CoCanCPG (bijlage 2). De evidence tabellen (zie Evidence tabellen) zijn ook volgens het format van CoCanCPG en gegradeerd naar mate van bewijs volgens de indeling in bijlage 3.
De literatuur uit de NICE richtlijn is niet separaat gegradeerd. Elke wetenschappelijke onderbouwing is afgesloten met één of meerdere conclusies. Ook aan deze conclusies is een niveau toegekend. Alle gebruikte literatuur is opgenomen in de referentielijst.
Het literatuuronderzoek werd uitgevoerd door een epidemioloog (M.K. Tuut) met input van de werkgroep. Voor de literatuursearches werd ondersteuning verkregen van het CBO.
Totstandkoming aanbevelingen
In een tweedaagse bijeenkomst op 3 en 4 februari 2011 hebben de leden van de kerngroep het evidence rapport (wetenschappelijke onderbouwing en conclusies) beoordeeld en vastgesteld. Op basis van de evidence zijn vervolgens aanbevelingen geformuleerd. Echter, naast de evidence uit de literatuur zijn er ook andere overwegingen die meespelen bij het formuleren van aanbevelingen. Deze zogeheten overige overwegingen zijn expliciet vermeld en zijn onder andere onderstaande overwegingen:
- Klinische relevantie
- Veiligheid
- Patiënten-perspectief
- Professioneel perspectief
- Beschikbaarheid van voorzieningen
- Zorgorganisatie
De aanbevelingen zijn gebaseerd op de evidence, de overige overwegingen en discussie in de werkgroep. De aanbevelingen zijn afgeleid van de antwoorden op de uitgangsvragen. Deze zijn niet gegradeerd. Vanwege zeer recent beschikbaar gekomen evidence is in de autorisatiefase een wijziging doorgevoerd in module over behandelbare metastasen in het hoofd-halsgebied. Hierover is consensus bereikt door de Nederlandse Werkgroep Hoofd Hals Tumoren, Nederlandse Vereniging van Keel-, Neus- en Oorheelkunde en Heelkunde van het Hoofd-halsgebied, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie en de Nederlandse Vereniging voor Radiotherapie en Oncologie.
Zoekverantwoording
De literatuursearches zijn per uitgangsvraag weergegeven (bijlage 4). De vetgedrukte regels zijn de bestanden waarvan de abstracts zijn beoordeeld in de literatuurselectie.
Alle abstracts die gevonden zijn in de literatuursearch (bijlage 5) zijn beoordeeld op relevantie. Daarbij zijn met name artikelen die niet over onbekende primaire tumoren gingen afgevallen. Ook werd gekeken naar de methodologie. Artikelen waarbij zeker was dat het geen systematisch onderzoek betrof, werden geëxcludeerd (bijvoorbeeld narratieve reviews, letters, case reports). De referenties (ref's) die overbleven na de literatuurselectie werden full-tekst opgevraagd en beoordeeld op kwaliteit en inhoud. In de tekst per module is beschreven welke artikelen op basis van full-tekst alsnog afvielen.
