Low dose acetylsalicylzuur ter preventie van vroeggeboorte
Uitgangsvraag
Wat is de plaats van low dose acetylsalicylzuur bij laag en hoog risico-zwangere vrouwen ter preventie van vroeggeboorte?
Deze uitgangsvraag omvat de volgende onderliggende vragen:
- Wat is de waarde van low dose acetylsalicylzuur bij zwangere vrouwen met een eenlingzwangerschap zonder vroeggeboorte in de voorgeschiedenis ter preventie van vroeggeboorte?
- Wat is de waarde van low dose acetylsalicylzuur bij zwangere vrouwen met een eenlingzwangerschap met vroeggeboorte in de voorgeschiedenis ter preventie van vroeggeboorte?
- Wat is de waarde van low dose acetylsalicylzuur bij zwangere vrouwen met een meerlingzwangerschap zonder vroeggeboorte in de voorgeschiedenis ter preventie van vroeggeboorte?
- Wat is de waarde van low dose acetylsalicylzuur bij zwangere vrouwen met een meerlingzwangerschap met vroeggeboorte in de voorgeschiedenis ter preventie van vroeggeboorte?
Aanbeveling
Overweeg patiënten te informeren over de mogelijkheid van acetylsalicylzuur voor de preventie van alle vroeggeboorten en neem in deze overweging individuele factoren mee.
Overweeg om lokale afspraken te maken met betrekking tot de counseling van patiënten voor acetylsalicylzuur voor preventie van vroeggeboorte.
Uiteraard is voor vrouwen met bekende risicofactoren de module Acetylsalicylzuur van de richtlijn Hypertensieve aandoeningen in de zwangerschap leidend.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is beperkte literatuur beschikbaar voor de beantwoording van de klinische vraag. De meeste onderzoeken in de bestaande literatuur bleken te zijn uitgevoerd bij zwangere vrouwen met een indicatie voor behandeling met low dose acetylsalicylzuur, bijvoorbeeld hypertensie in een vorige of de huidige zwangerschap. Slechts enkele studies includeerden vrouwen zonder indicatie voor low dose acetylsalicylzuur (zoals nierziekte, collageen-vaatziekte, diabetes mellitus, meerling zwangerschap en chronische hypertensie) of vrouwen met alleen een vroeggeboorte in de voorgeschiedenis.
Ten aanzien van het effect van low dose acetylsalicylzuur op het optreden van spontane vroeggeboorte bij zwangere vrouwen met een eenlingzwangerschap zonder vroeggeboorte in de voorgeschiedenis kon er slechts 1 oude RCT (Hauth 1993) worden geïncludeerd. De populatie bestond uit nulliparae uit Birmingham (Verenigd Koninkrijk), die geen indicatie hadden voor low dose acetylsalicylzuur wegens een ziekte of aandoening waarvan bekend is dat ze de incidentie van pre-eclampsie of zwangerschapshypertensie verhogen. Deze vrouwen gebruikten 1 dd 60 mg acetylsalicylzuur per dag vanaf AD20-22 weken. Ondanks dat er een gunstig klinisch relevant verschil werd gevonden van low dose acetylsalicylzuur ten opzichte van placebo ter preventie van spontane vroeggeboorte voor 37 weken zwangerschapsduur (RR 0.73 [95% CI 0.30, 1.78]) is de kwaliteit van het bewijs zeer laag omdat er sprake was van imprecisie bij een heel breed betrouwbaarheidsinterval waarbij de beide grenzen van klinische relevantie ruimschoots worden overschreden. Een grote RCT naar het effect van low dose acetylsalicylzuur bij nullipara vrouwen op zwangerschapscomplicaties (Sibai, 1993) werd niet meegenomen in de literatuursamenvatting, omdat de uitkomst vroeggeboorte niet vermeld was in titel, abstract of methodesectie. In deze RCT werden 2985 nullipara vrouwen gerandomiseerd tussen 60 mg acetylsalicylzuur en een placebo. Een secundaire analyse van deze RCT (Andrikopoulou, 2018) werd ook niet geïncludeerd, aangezien hierbij de randomisatie teniet was gedaan. In deze studie werd vroeggeboorte uitgesplitst in spontane en totale aantal vroeggeboortes. Met name op spontane vroeggeboorte < 34 weken werd een duidelijk effect gevonden van low dose acetylsalicylzuur 13/1262 (1.03 %) versus 30/1281 (2.34 %), adjusted OR 0.46 (0.23-0.89) (Andrikopoulou, 2018). De werkgroep concludeert dat er aanwijzingen zijn dat low dose acetylsalicylzuur het risico op spontane vroeggeboorte mogelijk reduceert, maar dat er verder onderzoek noodzakelijk is om een conclusie te trekken. Dit wordt gedefinieerd als kennislacune.
Er konden vijf RCT’s worden geïncludeerd die het effect van low dose acetylsalicylzuur onderzochten op het optreden van alle vroeggeboorten (dus inclusief de iatrogene vroeggeboorten) bij vrouwen met een eenlingzwangerschap zonder vroeggeboorte in de voorgeschiedenis (Hauth 1993, Golding 1998, Rotchell 1998, Bakhti 2011, Hoffman 2020). Vier daarvan includeerden alleen nulliparae (Hauth 1993, Golding 1998, Bakhti 2011, Hoffman 2020) en de vijfde includeerde 44% primigravidae. Bij één studie werd bij iedereen met low dose acetylsalicylzuur gestart tussen AD20-22 weken (Hauth 1993) en bij twee andere studies werd in ongeveer de helft van de gevallen gestart met low dose acetylsalicylzuur na AD20 weken (42% Golding 1998, 53% Rotchell 1998). De studiepopulatie bestond uit zwangere vrouwen uit het Verenigd Koninkrijk (Hauth 1993), Jamaica (Golding 1998), Barbados (Rotchell 1998), Algerije (Bakhti 2011), India, Democratische Republiek van Congo, Guatemala, Kenya, Pakistan en Zambia (Hoffman 2020).
De studie van Bakhti (2011) is buiten beschouwing gelaten in de meta-analyse omdat aan de kwaliteit van de data werd getwijfeld. Als de cijfers zouden kloppen zou meer dan 30% van de nulliparae in de controlegroep bevallen voor 34 weken en 90% voor 37 weken. Gepoolde resultaten lieten een voordeel zien van low dose acetylsalicylzuur ten opzichte van placebo ter preventie van alle vroeggeboorten vóór AD37 weken RR 0.92 [95% CI 0.86, 0.98]. Dit effect was kleiner dan wat van tevoren als klinisch relevant verschil was gedefinieerd (RR ≤0.9 or ≥1.1). Echter, het is een statistisch significant effect met een NNT (Number Needed to Treat) van 100 (95% betrouwbaarheidsinterval 50 tot 300), wat betekent dat 100 vrouwen low dose acetylsalicylzuur moeten slikken om één vroeggeboorte voor AD37 weken te voorkomen. Als alle 73.000 nullipara vrouwen in Nederland per jaar (Perined 2020) low dose acetylsalicylzuur zouden slikken, zou dat een reductie van 730 (95% betrouwbaarheidsinterval 243 tot 1460) vroeggeboortes per jaar betekenen. Er werd een klinisch relevant voordeel gezien van low dose acetylsalicylzuur ten opzichte van placebo ter preventie van alle vroeggeboorten vóór AD34 weken: RR 0.82 [95% CI 0.68, 0.99] (Hoffman 2020) met een NNT 139. Dit komt overeen met de resultaten uit de eerder genoemde niet geïncludeerde studie van Sibai 1993, waarin 56/1485 (3.8 %) vroeggeboorte voor AD 34 weken werd gerapporteerd in de low dose acetylsalicylzuur groep en 62/1500 (4.1 %) in de placebo groep. Verder werd er een klinisch relevant voordeel gezien van low dose acetylsalicylzuur ten opzichte van placebo ter preventie van alle vroeggeboorten vóór AD28 weken RR 0.72 [95% CI 0.51, 1.02] (Hoffman 2020) met een NNT van 272.
Samenvattend laten deze resultaten met matige bewijslast zien dat low dose acetylsalicylzuur een klein maar gunstig effect heeft in de preventie van alle vroeggeboorten bij veelal nullipara vrouwen met een eenling zwangerschap zonder vroeggeboorte in de voorgeschiedenis.
Het effect van low dose acetylsalicylzuur ter preventie van vroeggeboorte bij zwangere vrouwen met een eenlingzwangerschap mét een vroeggeboorte in de voorgeschiedenis
Slechts 1 recent in Nederland uitgevoerde RCT (APRIL-studie) onderzocht het effect van low dose acetylsalicylzuur op zowel spontane als alle (inclusief iatrogene) vroeggeboorten bij zwangere vrouwen met een eenlingzwangerschap met een vroeggeboorte in de voorgeschiedenis (Landman 2022). Er werd een klinisch relevant voordeel gezien van low dose acetylsalicylzuur ten opzichte van placebo ter preventie van spontane vroeggeboorte vóór AD37 weken RR [95% CI] 0.84 [0.58, 1.23] en ter preventie van alle vroeggeboorte vóór AD37 weken RR [95% CI] 0.83 [0.58, 1.20]. Echter, de bewijslast was zeer laag wegens imprecisie bij een laag aantal patiënten en een breed betrouwbaarheidsinterval. Beide grenzen van klinische relevantie werden overschreden. Er werd geen voordeel gezien van low dose acetylsalicylzuur ten opzichte van placebo in de preventie van vroeggeboorte vóór AD34 en vóór AD28 weken voor zowel spontane als alle vroeggeboorten.
Het effect van low dose acetylsalicylzuur ter preventie van vroeggeboorte bij zwangere vrouwen met een meerlingzwangerschap zonder vroeggeboorte in de voorgeschiedenis
Er konden geen studies worden geïncludeerd die het effect van low dose acetylsalicylzuur onderzochten op het optreden van spontane vroeggeboorte bij vrouwen met een meerlingzwangerschap zonder vroeggeboorte in de voorgeschiedenis.
Er kon slechts 1 oude RCT (Caspi 1994) worden geïncludeerd die het effect van low dose acetylsalicylzuur onderzocht op het optreden van alle vroeggeboorte bij vrouwen met een meerlingzwangerschap zonder vroeggeboorte in de voorgeschiedenis.
Er werd een klinisch relevant voordeel gezien van low dose acetylsalicylzuur ten opzichte van placebo RR 0.75 [95% CI 0.44, 1.30]. Echter, de bewijslast was wederom zeer laag wegens imprecisie bij een laag aantal patiënten en een breed betrouwbaarheidsinterval.
Het effect van low dose acetylsalicylzuur ter preventie van vroeggeboorte bij zwangere vrouwen met een meerlingzwangerschap mét een vroeggeboorte in de voorgeschiedenis
Er konden geen studies worden geïncludeerd die het effect van low dose acetylsalicylzuur onderzochten op het optreden van spontane en alle vroeggeboorte bij vrouwen met een meerlingzwangerschap met een vroeggeboorte in de voorgeschiedenis.
Veilig gebruik van low dose acetylsalicylzuur tijdens de zwangerschap
Acetylsalicylzuurgebruik tijdens de zwangerschap wordt als veilig beschouwd. In de literatuur is ruime ervaring met het gebruik van low dose acetylsalicylzuur bij zwangere vrouwen. Meta-analyses en internationale richtlijnen onderstrepen allen de veiligheid en beperkte risico’s (LeFevre, 2014; NICE, 2010).
Grote cohort en case-control studies laten zien dat low dose acetylsalicylzuur geen verhoogd risico geeft op aangeboren afwijkingen of het sneller sluiten van de foetale ductus arteriosis (Rolnik, 2022). Ook een recente meta-analyse liet zien dat het gebruik van low dose acetylsalicylzuur (≤ 150 mg) ten opzichte van placebo geen verhoogd risico geeft op structurele aangeboren afwijkingen (Garza-Galvan, 2022). Het theoretische risico van neonatale intracraniële bloeding en maternale hemorragia postpartum is nooit aangetoond in RCT’s, ook niet als de vrouwen deze medicatie tot aan de partus continueerden (Rolnik, 2022).
Tot 10% van de vrouwen die low dose acetylsalicylzuur gebruiken in RCT’s rapporteren gastro-intestinale symptomen (Rolnik, 2022). Een recente RCT liet zien dat het dagelijkse gebruik van low dose acetylsalicylzuur (81 mg) tijdens de zwangerschap (AD6-36 weken) ten opzichte van placebo geen verschil liet zien in aantal onverwachte acute medische consultaties en potentiële bijwerkingen zoals misselijkheid, braken, diarree, gastritis, vaginaal bloedverlies, allergische reactie of iets dergelijks (Short, 2021). Wel werd significant vaker huiduitslag gerapporteerd bij vrouwen die dagelijks low dose acetylsalicylzuur gebruikten (4,2%) ten opzichte van vrouwen die een placebo gebruikten (3,5%), RR 1,20 [95% CI 1,01-1,43]. Echter, het ging hier om zwangere vrouwen in lage en middeninkomen landen.
Er zijn zorgen dat acetylsalicylzuur gebruik ten opzichte van placebo tijdens de zwangerschap een verhoogd risico op abruptio placentae geeft wegens een oude RCT uit 1993 (Sibai, 1993). De dosering en het moment van starten tijdens de zwangerschap zouden mogelijk een rol kunnen spelen, maar dit is nog onzeker. Een recente meta-analyse vond dat het risico op abruptio mogelijk verhoogd is (RR 1,21, 95% BI 0,95 tot 1,54), evenals het risico op postpartum bloedverlies >500 ml (RR 1,06, 95% BI 1,00 tot 1,12)(Duley, 2019).
Het gebruik van acetylsalicylzuur < 160 mg is geen contraindicatie voor het verrichten van een neuraxisblokkade of catheterverwijdering. Er hoeft geen tijdsinterval aangehouden te worden (Link naar richtlijn Neuraxisblokkade en antistolling).
Kortom, er is geen reden om aan te nemen dat low dose acetylsalicylzuur niet veilig kan worden gebruikt tijdens de zwangerschap. Op basis van de huidige data zou de werkgroep adviseren om bij voorkeur te starten ≤ AD16 weken om het risico op abruptio niet te verhogen, in een dosering van ≤ 100 mg per dag. Deze dosering komt overeen met de doseringen gebruikt in de RCT’s die zijn geïncludeerd in de literatuursamenvatting bij deze richtlijn.
Om uniformiteit te behouden, zou voor de dosering hetzelfde advies gehanteerd kunnen worden als in de richtlijn Hypertensieve aandoeningen van de NVOG (Link naar richtlijn Hypertensieve aandoeningen in de zwangerschap) voor vrouwen met risicofactoren voor pre-eclampsie. Advies: start profylaxe met acetylsalicylzuur in een dosering van 80-150 mg per dag vanaf AD12 weken en bij voorkeur vóór het voltooien van de 16e week AD. Staak de behandeling minimaal een week voorafgaande aan de partus of een operatieve ingreep (sectio), d.w.z. bij AD36 weken, tenzij een partus eerder verwacht wordt. Bij voorkeur wordt acetylsalicylzuur in de avond ingenomen.
Contra-indicaties van acetylsalicylzuur zijn: maagklachten, maagpijn bij eerder gebruik, ulcus pepticum (actief of in de voorgeschiedenis), maag-darmbloedingen (actief of in de voorgeschiedenis), maag-darmperforatie, gastritis, optreden van astma-aanval, urticaria, angio-oedeem, neuspoliepen of rinitis, ernstige nier- en leverinsufficiëntie, ernstig hartfalen en/of hemorragische diathese (Farmacotherapeutisch Kompas).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Zwangere vrouwen dienen gecounseld te worden door hun obstetrisch zorgverlener over het effect van low dose acetylsalicylzuur op het optreden van vroeggeboorte en het (mogelijke) effect van vroeggeboorte op het leven van het kind en de ouders. Tevens dienen contra-indicaties voor het gebruik van low dose acetylsalicylzuur en de eventuele bijwerkingen hiervan besproken te worden. De ene patiënt zal laagdrempeliger en bij een hogere NNT medicatie willen gebruiken om een vroeggeboorte te voorkomen dan een andere patiënt. Op basis van shared decision making kan worden gekozen voor of afgezien van low dose acetylsalicylzuur gebruik tijdens de zwangerschap.
Kosten (middelenbeslag)
Er is geen literatuur beschikbaar over kosteneffectiviteit van low dose acetylsalicylzuur in de preventie van vroeggeboorte.
Acetylsalicylzuur 80 mg tabletten zijn goedkoop, per half jaar €9,10, en dienen te worden voorgeschreven door een arts. Acetylsalicylzuur 100 mg is te koop als zelfmedicatie bij de drogist en kost €4,99 voor 20 tabletten (ongeveer €46,- per half jaar). Echter, 100 vrouwen moeten dit gebruiken om 1 vroeggeboorte voor 37 weken te voorkomen. Aangezien het een goedkope interventie betreft, en vroeggeboorte gepaard gaat met hoge korte en lange termijn kosten, is het gebruik waarschijnlijk kosteneffectief. Indien het gebruik van low dose acetylsalicylzuur een vroeggeboorte voor 34 weken voorkomt, zou het kosteneffectief zijn om vrouwen met een eenlingzwangerschap zonder vroeggeboorte in de voorgeschiedenis low dose acetylsalicylzuur te laten gebruiken. Een opname van een neonaat op de afdeling neonatologie of NICU is erg kostbaar.
Aanvaardbaarheid, haalbaarheid en implementatie
Er is geen literatuur bekend over de haalbaarheid en aanvaardbaarheid van low dose acetylsalicylzuur gebruik bij ogenschijnlijk laag-risico vrouwen die zwanger zijn van een eenling zonder een vroeggeboorte in de voorgeschiedenis. Mogelijk zal er verdeeldheid in acceptatie bestaan over low dose acetylsalicylzuurgebruik bij deze zwangere vrouwen. Alle nullipara vrouwen zwanger van een eenling dienen gecounseld te worden over de voor- en nadelen van low dose acetylsalicylzuurgebruik. Het is daarbij van belang dat de objectieve data (NNT) met de vrouwen wordt besproken en dat de individuele normen en waarden, met eventuele eerdere bijwerkingen of contra-indicaties voor het gebruik van low dose acetylsalicylzuur, worden meegenomen in de counseling. De counseling kan door de eerste lijns verloskundige worden verricht. Op deze manier hoeft de zwangere niet verwezen te worden naar de tweede lijn, indien er zich geen complicatie, zoals een vroeggeboorte, voordoet.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er is enig bewijs dat low dose acetylsalicylzuur ten opzichte van placebo een reductie geeft van alle vroeggeboorten bij (veelal nullipara) vrouwen met een eenling zwangerschap zonder vroeggeboorte in de voorgeschiedenis. De NNT voor preventie van vroeggeboorte < AD37 weken is 100, < 34 weken 139 en < 28 weken 272 vrouwen. Deze getallen zijn echter met de huidige literatuur niet heel nauwkeurig vast te stellen (brede 95% betrouwbaarheidsintervallen). Omdat de prevalentie van vroeggeboorte hoog is en vroeggeboorte gepaard kan gaan met negatieve korte en lange termijneffecten (neonatale mortaliteit en morbiditeit), kunnen de voordelen van het gebruik van low dose acetylsalicylzuur opwegen tegen de eventuele nadelen (bijv. gastro-intestinale bijwerkingen).
Nulliparae zwanger van een eenling, zonder risicofactoren voor het ontwikkelen van pre-eclampsie, dienen daarom ook gecounseld te worden ten aanzien van low dose acetylsalicylzuurgebruik in de zwangerschap. Indien na shared decision making ervoor wordt gekozen om te starten met low dose acetylsalicylzuur, wordt geadviseerd te starten tussen AD12-AD16 weken met 1 dd 80-100 mg acetylsalicylzuur en deze in de avond in te nemen. Staak de behandeling minimaal een week voorafgaande aan de partus of een operatieve ingreep (sectio), d.w.z. bij AD36 weken, tenzij een partus eerder verwacht wordt.
Bij een aantal groepen is er onvoldoende bewijs is om low-dose acetylsalicylzuur voor deze indicatie te adviseren. Bespreek daarom geen low-dose acetylsalicylzuur met als enige doel preventie van vroeggeboorte in de huidige zwangerschap bij:
- vrouwen zwanger van een eenling met een vroeggeboorte in de voorgeschiedenis (als enige indicatie)
- vrouwen zwanger van een meerling met of zonder vroeggeboorte in de voorgeschiedenis (als enige indicatie)
Onderbouwing
Achtergrond
Vroeggeboorte (<AD 37 weken) heeft wereldwijd een prevalentie van 10,6% en is de belangrijkste doodsoorzaak voor kinderen onder de 5 jaar (Chawanpaiboon, 2019). Bovendien hebben premature neonaten die overleven een hogere kans op langdurige morbiditeit, waaronder neurologische en ontwikkelingsstoornissen in vergelijking met a terme neonaten (Frey, 2016). Het is daarom van belang om vroeggeboorte te voorkomen.
Verschillende mechanismen kunnen leiden tot vroeggeboorte, waaronder placenta-insufficiëntie en inflammatie/infectie. Indien sprake is van placenta-insufficiëntie, is de kans op iatrogene vroeggeboorte verhoogd. Echter, het wordt steeds meer erkend dat utero-placentaire ischemie ook kan resulteren in een spontane vroeggeboorte wegens verslechtering van de placentatie en toegenomen inflammatie. Low dose acetylsalicylzuur kan de vascularisatie van de placenta verbeteren door zijn werking als trombocytaggregatieremmer en als cyclo-oxygenaseremmer, waardoor stolling en inflammatie worden verminderd (Man, 2021). Mogelijk kan het preventief toedienen van low dose acetylsalicylzuur (<160 mg per dag) helpen de incidentie van vroeggeboorte te verlagen. Low dose acetylsalicylzuur kan veilig worden gegeven tijdens de zwangerschap (Henderson, 2014; ACOG, 2018).
Conclusies / Summary of Findings
1. Spontaneous PTB
Women with a singleton pregnancy without history of PTB
|
Very low GRADE |
The evidence is very uncertain about the effect of low dose acetylsalicylic acid compared to placebo on the rate of spontaneous preterm births before 37 weeks of gestation in women with a singleton pregnancy without history of preterm birth.
Source: Hauth, 1993 |
|
- GRADE |
No studies were found from which conclusions can be drawn about the effect of low dose acetylsalicylic acid compared to placebo in preventing spontaneous preterm births before 34 weeks or before 28 weeks of gestation in women with a singleton pregnancy without history of preterm birth. |
Women with a singleton pregnancy with a history of PTB
|
Very low GRADE |
The evidence is very uncertain about the effect of low dose acetylsalicylic acid compared to placebo on the rate of spontaneous preterm births before 37 weeks of gestation in women with a singleton pregnancy with a history of preterm birth .
Source: Landman, 2022 |
|
Very low GRADE |
The evidence is very uncertain about the effect of low dose acetylsalicylic acid compared to placebo on the rate of spontaneous preterm births before 34 weeks of gestation in women with a singleton pregnancy with a history of preterm birth.
Source: Landman, 2022 |
|
Very low GRADE |
In women with a singleton pregnancy with a history of preterm birth, low dose acetylsalicylic acid compared to placebo may result in an increase in the rate of spontaneous preterm births before 28 weeks of gestation, but the evidence is very uncertain.
Source: Landman, 2022 |
Women with a multiple pregnancy without history of PTB
|
- GRADE |
No studies were found from which conclusions can be drawn about the effect of low dose acetylsalicylic acid compared to placebo in preventing spontaneous preterm births before 37 weeks, 34 weeks or 28 weeks of gestation in women with a multiple pregnancy without history of preterm birth.
|
Women with a multiple pregnancy with a history of PTB
|
- GRADE |
No studies were found from which conclusions can be drawn about the effect of low dose acetylsalicylic acid compared to placebo in preventing spontaneous preterm births before 37 weeks, 34 weeks or 28 weeks of gestation in women with a multiple pregnancy with a history of preterm birth.
|
2. All PTB, including iatrogenic PTB
Women with a singleton pregnancy without history of PTB
|
Moderate GRADE |
In women with a singleton pregnancy without history of preterm birth, low dose acetylsalicylic acid compared to placebo likely results in little or no difference in the rate of all preterm births before 37 weeks of gestation.
Sources: Bakhti, 2011; Hoffman, 2020; Rotchell, 1998; Golding, 1998; Hauth, 1993 |
|
Moderate GRADE |
In women with a singleton pregnancy without history of preterm birth, low dose acetylsalicylic acid compared to placebo likely results in a slight reduction of the rate of all preterm births before 34 weeks of gestation.
Source: Hoffman, 2020 |
|
Moderate GRADE |
In women with a singleton pregnancy without history of preterm birth, low dose acetylsalicylic acid compared to placebo likely results in a slight reduction of the rate of all preterm births before 28 weeks of gestation.
Source: Hoffman, 2020 |
Women with a singleton pregnancy with a history of PTB
|
Very low GRADE |
In women with a singleton pregnancy with a history of preterm birth, low dose acetylsalicylic acid compared to placebo may result in a slight reduction in the rate of all preterm births before 37 weeks of gestation, but the evidence is very uncertain.
Source: Landman, 2022 |
|
Very low GRADE |
In women with a singleton pregnancy with a history of preterm birth, low dose acetylsalicylic acid compared to placebo may result in little to no difference in the rate of all preterm births before 34 weeks of gestation, but the evidence is very uncertain.
Source: Landman, 2022 |
|
Very low GRADE |
In women with a singleton pregnancy with a history of preterm birth, low dose acetylsalicylic acid compared to placebo may result in an increase in the rate of all preterm births before 28 weeks of gestation, but the evidence is very uncertain.
Source: Landman, 2022 |
Women with a multiple pregnancy without a history of PTB
|
Very low GRADE |
Low dose acetylsalicylic acid compared to placebo may reduce the rate of spontaneous preterm births before 37 weeks of gestation in women with a multiple pregnancy without a history of preterm birth, but the evidence is very uncertain.
Source: Caspi, 1994 |
|
- GRADE |
No studies were found from which conclusions can be drawn about the effect of low dose acetylsalicylic acid compared to placebo in preventing all preterm births before 34 weeks or before 28 weeks of gestation in women with a multiple pregnancy without history of preterm birth.
|
Women with a multiple pregnancy with a history of PTB
|
- GRADE |
No studies were found from which conclusions can be drawn about the effect of low dose acetylsalicylic acid compared to placebo in preventing all preterm births before 37 weeks, 34 weeks or 28 weeks of gestation in women with a multiple pregnancy with a history of preterm birth. |
Samenvatting literatuur
Description of studies
Seven RCTs were included. Four of these studies included nulliparous women (Bakhti, 2011, n=164; Golding, 1998, n=6775; Hauth, 1993, n=604; Hoffman, 2020, n=11558), one study included only twin pregnancies (Caspi, 1994, n=48), one study included women with a history of spontaneous preterm birth in a previous pregnancy (Landman 2022, n=406), and in the paper of Rotchell (1998)(n=3647) the inclusion criteria were not reported in detail. All except Bakhti (2011) were double blind placebo controlled RCTs. The daily dosages of acetylsalicylic acid were 60 mg (Golding, 1998; Hauth, 1993), 75 mg (Rotchell, 1998), 80 mg (APRIL), 81 mg (Hoffman, 2020) or 100 mg (Bakhti, 2011; Caspi, 1994) per day. Four studies were performed in developing countries (Bakhti, 2011; Golding, 1998; Hoffman, 2020; Rotchell, 1998), the other studies were performed in Israel (Caspi, 1994), the USA (Hauth, 1993) and The Netherlands (Landman, 2022). The (poorly reported) study by Bakhti (2011) was performed in Algeria, where the length of gestation appears to be less than in most other countries, according to the authors’ statement “Despite this selection, the placebo group delivered around 35 weeks, but this was not unusual among the Algerian population.”
Results
The results are shown in Table 1.
Table 1. Included studies and results shown as relative risks or adjusted odds ratios with 95% Confidence Intervals (RR or aOR [95% CI])
|
spontaneous preterm births (sPTB) |
all preterm births (PTB) |
||||||
|
inclusions |
<37 weeks |
<34 weeks |
<28 weeks |
<37 weeks |
<34 weeks |
<28 weeks |
|
|
singleton pregnancy |
without history of PTB |
Hauth, 1993* RR [95% CI] 0.73 [0.30 to 1.78]
|
- |
-
|
Bakhti 2011 Hoffman 2020 Rotchell, 1998** Golding, 1998 Hauth, 1993*
pooled RR [95% CI] 0.90 [0.84 to 0.96] |
Hoffman 2020 RR [95% CI] 0.82 [0.68 to 0.99]
Bakhti 2011 RR [95% CI] 0.11 [0.01 to 0.35]
|
Hoffman 2020 RR [95% CI] 0.72 [0.51 to 1.02] |
|
with history of PTB |
Landman, 2022 RR [95% CI] 0.84 [0.58 to 1.23] |
Landman, 2022 RR [95% CI] 1.12 [0.59 to 2.13] |
Landman, 2022 RR [95% CI] 1.39 [0.45 to 4.31] |
Landman, 2022 RR [95% CI] 0.83 [0.58 to 1.20]]
|
Landman, 2022 RR [95% CI] 1.05 [0.56 to 1.98] |
Landman, 2022 RR [95% CI] 1.39 [0.45 to 4.31] |
|
|
multiple pregnancy |
without history of PTB |
- |
- |
- |
Caspi, 1994 RR [95% CI]
0.75 [0.44 to 1.30]
|
- |
-
|
|
with history of PTB |
- |
- |
- |
- |
- |
- |
|
*Hauth, 1993: preterm birth not defined in terms of length of gestation
**Rotchell, 1998: inclusion criteria not reported in detail, may have included women with history of PTB
1. Spontaneous preterm birth (sPTB)
Singleton pregnancies in women without a history of preterm birth
In the RCT by Hauth (1993) 8/302 (2.6%) sPTB before 37 weeks of gestation occurred in the acetylsalicylic acid group and 11/302 (3.6%) in the placebo group, RR [95% CI] 0.73 [0.30 to 1.78].
No results were available for spontaneous preterm birth before 34 weeks of gestation.
No results are available for spontaneous preterm birth before 28 weeks of gestation.
Singleton pregnancies in women with a history of preterm birth
Only the APRIL study reports on women with a singleton pregnancy and a history of PTB. The results for sPTB were as follows:
before 37 weeks of gestation 39/194 (20.1%) in the acetylsalicylic acid group and 46/193 (23.8%) in the placebo group; RR [95% CI] 0.84 [0.58, 1.23],
before 34 weeks of gestation 18/194 (9.3%) in the acetylsalicylic acid group and 16/193 (8.3%) in the placebo group; RR [95% CI] 1.12 [0.59, 2.13], and
before 28 weeks of gestation 7/194 (3.6%) in the acetylsalicylic acid group and 5/193 (2.6%) in the placebo group; RR [95% CI] 1.39 [0.45, 4.31].
Multiple pregnancies with or without a history of preterm birth
None of the included studies reported the outcome sPTB in women with multiple pregnancies with or without a history of PTB.
2. All preterm births (PTB)
Singleton pregnancy in women without a history of preterm birth
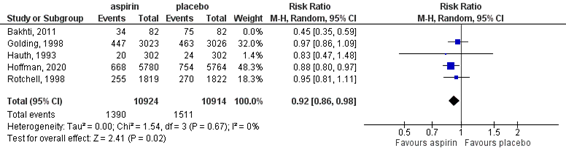
Five RCTs reported the RR [95% CI] on all PTB, including iatrogenic PTB, for all PTB before 37 weeks of gestation (Bakhti, 2011; Hoffman, 2020; Rotchell, 1998; Golding, 1998; Hauth, 1993). Since both the population and the results of the trial by Bakhti (2011) differed considerably from the other RCTs, the data of this trial were excluded, and the results of the other four RCTs were pooled. The pooled RR [95% CI] for preterm birth before 37 weeks of gestation of these five studies was 0.92 [0.86, 0.98] (Figure 1), i.e. the effect was smaller than the minimal clinically relevant effect. The Number Needed to Treat (NNT) [95% CI] was 100 [50, 300].
Figure 1. Outcome preterm birth <37 weeks of gestation comparison low dose acetylsalycic acid versus placebo in women without a history of preterm birth in a previous pregnancy
Z: p-value of the pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
In the RCT by Bakhti (2011) all PTB (including iatrogenic) before 34 weeks of gestation was reported in 3/82 (4%) in the acetylsalicylic acid group and 27/82 (33%) in the control group, RR [95% CI] 0.11 [0.01, 0.35]. It was not clear whether the control was placebo or no intervention. Hoffman (2020) reported all PTB (including iatrogenic) before 34 weeks of gestation in 189/5780 (3.3%) in the acetylsalicylic acid group and 230/5764 (4.0%) in the placebo group, RR [95% CI] 0.82 [0.68, 0.99]. The data of these two studies were not pooled because of considerable clinical heterogeneity. The NNT [95% CI] calculated for the RCT by Hoffman (2020) was 139 [72; 6623].
The RCT by Hoffman (2020) reported for all PTB (including iatrogenic) before 28 weeks of gestation 54/5780 (0.9%) in the acetylsalicylic acid group and 75/5764 (1.3%) in the placebo group; RR [95% CI] 0.72 [0.51, 1.02], NNT 272.
Singleton pregnancy in women with a history of preterm birth
Only the APRIL study reported all PTB, including iatrogenic preterm birth, in this population, with the following results:
before 37 weeks of gestation 41/194 (21.2%) in the acetylsalicylic acid group and 49/193 (25.4%) in the placebo group, RR [95% CI] 0.83 [0.58, 1.20],
before 34 weeks of gestation 18/194 (9.3%) in the acetylsalicylic acid group and 17/193 (8.8%) in the placebo group, RR [95% CI] 1.05 [0.56, 1.98], and
before 28 weeks of gestation 7/194 (3.6%) in the acetylsalicylic acid group and 5/193 (2.6%) in the placebo group; RR [95% CI] 1.39 [0.45, 4.31].
Multiple pregnancies in women without a history of preterm birth
Only Caspi (1994) reported on all PTB (including iatrogenic) in women with multiple pregnancies without a history of PTB. The rates were 11/24 (46%) in the acetylsalicylic acid group and 14/23 (61%) in the placebo group, RR [95% CI] 0.75 [0.44, 1.30] for all PTB before 37 weeks of gestation.
No results are available for preterm birth before 34 or 28 weeks of gestation.
Multiple pregnancies in women with a history of preterm birth
None of the included studies reported the outcome all PTB in women with multiple pregnancies with a history of PTB.
Level of evidence of the literatur
1. Spontaneous PTB
a. Spontaneous preterm births <37 weeks in women with a singleton pregnancy without a history of preterm birth
The level of evidence regarding the outcome measure spontaneous preterm birth <37 weeks in women with a singleton pregnancy without a history of preterm birth started high and was downgraded by three levels to very low because of the small number of events (imprecision), both the lower and the upper limit of clinical relevance were crossed by the 95% CI.
b. Spontaneous preterm births <34 weeks in women with a singleton pregnancy without a history of preterm birth: not reported
c. Spontaneous preterm births <28 weeks in women with a singleton pregnancy without a history of preterm birth: not reported
d. Spontaneous preterm births <37 weeks in women with a singleton pregnancy with a history of preterm birth
The level of evidence regarding the outcome measure spontaneous preterm birth <37 weeks in women with a singleton pregnancy with a history of preterm birth started high and was downgraded by three levels to very low because of the small number of patients (imprecision), both the lower and the upper limit of clinical relevance were crossed by the 95% CI.
e. Spontaneous preterm births <34 weeks in women with a singleton pregnancy with a history of preterm birth
The level of evidence regarding the outcome measure spontaneous preterm birth <34 weeks in women with a singleton pregnancy with a history of preterm birth started high and was downgraded by three levels to very low because of the small number of patients (imprecision), both the lower and the upper limit of clinical relevance were crossed by the 95% CI.
f. Spontaneous preterm births <28 weeks in women with a singleton pregnancy with a history of preterm birth
The level of evidence regarding the outcome measure spontaneous preterm birth <28 weeks in women with a singleton pregnancy with a history of preterm birth started high and was downgraded by three levels to very low because of the small number of events (imprecision), both the lower and the upper limit of clinical relevance were crossed by the 95% CI.
g. Spontaneous preterm births in women with a multiple pregnancy with or without a history of preterm birth: not reported
2. All PTB, including iatrogenic PTB
a. All preterm births <37 weeks in women with a singleton pregnancy without a history of preterm birth
The level of evidence regarding the outcome measure preterm birth <37 weeks in women with a singleton pregnancy without a history of preterm birth started high and was downgraded by one level to moderate, because of imprecision (the lower limit of clinical relevance was crossed by the 95% CI).
b. All preterm births <34 weeks in women with a singleton pregnancy without a history of preterm birth
The level of evidence regarding the outcome measure preterm birth <34 weeks in women with a singleton pregnancy without a history of preterm birth started high and was downgraded by one level to moderate, because of number of included patients (imprecision), since the lower limit of clinical relevance was crossed by the 95% CI.
c. All preterm births <28 weeks in women with a singleton pregnancy without a history of preterm birth
The level of evidence regarding the outcome measure preterm birth <28 weeks in women with a singleton pregnancy without a history of preterm birth started high and was downgraded by one level to moderate because of number of included patients (imprecision), since the lower limit of clinical relevance was crossed by the 95% CI.
d. All preterm births <37 weeks in women with a singleton pregnancy with a history of preterm birth
The level of evidence regarding the outcome measure all preterm births <37 weeks in women with a singleton pregnancy with a history of preterm birth started high and was downgraded by three levels to very low because of the small number of patients (imprecision), since both the lower and the upper limit of clinical relevance were crossed by the 95% CI.
e. All preterm births <34 weeks in women with a singleton pregnancy with a history of preterm birth
The level of evidence regarding the outcome measure all preterm births <34 weeks in women with a singleton pregnancy with a history of preterm birth started high and was downgraded by three levels to very low because of the small number of patients (imprecision), since both the lower and the upper limit of clinical relevance were crossed by the 95% CI.
f. All preterm births <28 weeks in women with a singleton pregnancy with a history of preterm birth
The level of evidence regarding the outcome measure all preterm births <28 weeks in women with a singleton pregnancy with a history of preterm birth started high and was downgraded by three levels to very low because of the small number of patients (imprecision), since both the lower and the upper limit of clinical relevance were crossed by the 95% CI.
g. All preterm births <37 weeks in women with a multiple pregnancy without history of PTB
The level of evidence regarding the outcome measure all preterm births <37 weeks in women with a multiple pregnancy without a history of preterm birth started high and was downgraded by three levels to very low because of the small number of patients (imprecision), since both the lower and the upper limit of clinical relevance were crossed by the 95% CI.
h. All preterm births <37 weeks in women with a multiple pregnancy with a history of PTB: not reported
i. All preterm births <34 weeks in women with a multiple pregnancy with or without a history of PTB: not reported
j. All preterm births <28 weeks in women with a multiple pregnancy with or without a history of PTB: not reported
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of low dose acetylsalicylic acid in pregnant women compared to placebo or no prophylaxis on spontaneous preterm birth and all preterm birth (including iatrogenic preterm birth)?
P: pregnant women without an indication for acetylsalicylic acid use, subgroups:
1. singleton pregnancy without a history of preterm delivery
2. singleton pregnancy with a history of preterm delivery
3. multiple pregnancy without a history of preterm delivery
4. multiple pregnancy with a history of preterm delivery
I: low dose acetylsalicylic acid
C: placebo or no low dose acetylsalicylic acid
O: spontaneous and all preterm delivery (<28 weeks, <34 weeks, <37 weeks of gestational age)
Relevant outcome measures
The guideline development group considered spontaneous and all preterm delivery (<28 weeks, <34 weeks, <37 weeks of gestational age) as critical outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined a relative risk (RR) ≤0.9 or ≥1.1 as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched using relevant search terms until 8 September, 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 505 hits. Studies were selected based on the following criteria:
- systematic reviews (SRs) or randomised clinical trials (RCT)
- including pregnant women with a singleton or multiple pregnancy with or without a history of a previous preterm delivery and no other indications for the use of acetylsalicylic acid prophylaxis, e.g. hypertensive disorders,
- comparing treatment with acetylsalicylic acid compared to placebo or no prophylactic use of acetylsalicylic acid, and
- reporting spontaneous preterm delivery as an outcome.
Seven studies were initially selected based on title and abstract screening. After reading the full text, four studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included. One of these was an SR in which 22 RCTs were included reporting preterm delivery (Kozer, 2003). Since the inclusion criteria for patients in this SR were not clear, the original RCTs were screened, and subsequently, the SR was excluded. This selection process yielded four RCTs. Thus, six studies were included. The guideline development group identified an additional publication after the search (APRIL study, Landman, 2022), which was added.
Results
Seven studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- ACOG Committee Opinion No. 743: Low-Dose Aspirin Use During Pregnancy, Obstetrics & Gynecology: July 2018 - Volume 132 - Issue 1 - p e44-e52.
- Andrikopoulou M, Purisch SE, Handal-Orefice R, Gyamfi-Bannerman C. Low-dose aspirin is associated with reduced spontaneous preterm birth in nulliparous women. Am J Obstet Gynecol. 2018 Oct;219(4):399.e1-399.e6.
- Bakhti, A., & Vaiman, D. (2011). Prevention of gravidic endothelial hypertension by aspirin treatment administered from the 8th week of gestation. Hypertension Research, 34(10), 1116-1120.
- Caspi, E., Raziel, A., Sherman, D., Arieli, S., Bukovski, I., & Weinraub, Z. (1994). Prevention of pregnancy-induced hypertension in twins by early administration of low?dose aspirin: a preliminary report. American Journal of Reproductive Immunology, 31(1), 19-24.
- Chawanpaiboon S, Vogel JP, Moller AB, Lumbiganon P, Petzold M, Hogan D, et al. Global, regional, and national estimates of levels of preterm birth in 2014: a systematic review and modelling analysis. The Lancet Global health. 2019;7(1): e37-e46.
- Duley L, Meher S, Hunter KE, Seidler AL, Askie LM. Antiplatelet agents for preventing pre-eclampsia and its complications. Cochrane Database Syst Rev. 2019 Oct 30;2019(10):CD004659.
- Frey HA, Klebanoff MA. The epidemiology, etiology, and costs of preterm birth. Semin Fetal Neonatal Med. 2016 Apr;21(2):68-73. doi: 10.1016/j.siny.2015.12.011. Epub 2016 Jan 11. PMID: 26794420.
- Garza-Galvan ME, Ferrigno AS, Campos-Zamora M, Bain PA, Easter SR, Kim J, Figueras F, Farber MK, Lumbreras-Marquez MI. Low-dose aspirin use in the first trimester of pregnancy and odds of congenital anomalies: A meta-analysis of randomized controlled trials. Int J Gynaecol Obstet. 2022 Jul 10. doi: 10.1002/ijgo.14334. Epub ahead of print. PMID: 35810407.
- Golding, J., & Jamaica Low Dose Aspirin Study Group. (1998). A randomised trial of low dose aspirin for primiparae in pregnancy. BJOG: An International Journal of Obstetrics & Gynaecology, 105(3), 293-299.
- Hauth, J. C., Goldenberg, R. L., Parker Jr, C. R., Philips III, J. B., Copper, R. L., DuBard, M. B., & Cutter, G. R. (1993). Low-dose aspirin therapy to prevent preeclampsia. American journal of obstetrics and gynecology, 168(4), 1083-1093.
- Henderson J et al. Low dose ASA for prevention of morbidity and mortality from preeclampsia: a systematic review for the U.S. Preventive Services Task Force. Ann Intern Med 2014;160:695-703.
- Hoffman, M. K., Goudar, S. S., Kodkany, B. S., Metgud, M., Somannavar, M., Okitawutshu, J., ... & Wallace, D. (2020). Low-dose aspirin for the prevention of preterm delivery in nulliparous women with a singleton pregnancy (ASPIRIN): a randomised, double-blind, placebo-controlled trial. The Lancet, 395(10220), 285-293.
- Landman, A. J., de Boer, M. A., Visser, L., Nijman, T. A., Hemels, M. A., Naaktgeboren, C. N., ... & Oudijk, M. A. (2022). Evaluation of low-dose aspirin in the prevention of recurrent spontaneous preterm labour (the APRIL study): A multicentre, randomised, double-blinded, placebo-controlled trial. PLoS medicine, 19(2), e1003892.
- LeFevre ML; U.S. Preventive Services Task Force. Low-dose aspirin use for the prevention of morbidity and mortality from preeclampsia: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2014 Dec 2;161(11):819-26.
- National Institute for Health and Care Excellence (2010). Hypertension in pregnancy: the management of hypertensive disorders during pregnancy. Updated 2011. Beschikbaar via: https://www.nice.org.uk/guidance/cg107/evidence/full-guideline-pdf-134794333.
- Man R, Hodgetts Morton V, Devani P, Morris RK. Aspirin for preventing adverse outcomes in low risk nulliparous women with singleton pregnancies: A systematic review and meta-analysis. Eur J Obstet Gynecol Reprod Biol. 2021 Jul;262:105-112.
- Roberge S, Bujold E, Nicolaides KH. Meta-analysis on the effect of aspirin use for prevention of preeclampsia on placental abruption and antepartum hemorrhage. AJOG 2018; 218 (5), 483-489.
- Rolnik DL, Nicolaides KH, Poon LC. Prevention of preeclampsia with aspirin. Review. Am J Obstet Gynecol. 2022 Feb;226(2S):S1108-S1119. doi: 10.1016/j.ajog.2020.08.045. Epub 2020 Aug 21. PMID: 32835720.
- Rotchell, Y. E., Cruickshank, J. K., Phillips Gay, M., Griffiths, J., Stewart, A., Farrell, B., ... & Collins, R. (1998). Barbados Low Dose Aspirin Study in Pregnancy (BLASP): a randomised trial for the prevention of pre?eclampsia and its complications. BJOG: An International Journal of Obstetrics & Gynaecology, 105(3), 286-292.
- Short VL, Hoffman M, Metgud M, Kavi A, Goudar SS, Okitawutshu J, Tshefu A, Bose CL, Mwenechanya M, Chomba E, Carlo WA, Figueroa L, Garces A, Krebs NF, Jessani S, Saleem S, Goldenberg RL, Das PK, Patel A, Hibberd PL, Achieng E, Nyongesa P, Esamai F, Bucher S, Nowak KJ, Goco N, Nolen TL, McClure EM, Koso-Thomas M, Miodovnik M, Derman RJ. Safety of daily low-dose aspirin use during pregnancy in low-income and middle-income countries. AJOG Glob Rep. 2021 Feb;1(1):100003. doi: 10.1016/j.xagr.2021.100003. Epub 2021 Jan 27. PMID: 34085052; PMCID: PMC8171270.
- Sibai B.M. , S.N. Caritis, E. Thom, et al. Prevention of preeclampsia with low-dose aspirin in healthy, nulliparous pregnant women. The National Institute of Child Health and Human Development Network of Maternal-Fetal Medicine Units. N Engl J Med, 329 (1993), pp. 1213-1218
- Visser, L., de Boer, M. A., de Groot, C. J., Nijman, T. A., Hemels, M. A., Bloemenkamp, K. W., ... & Oudijk, M. A. (2017). Low dose aspirin in the prevention of recurrent spontaneous preterm labour-the APRIL study: a multicenter randomized placebo controlled trial. BMC pregnancy and childbirth, 17(1), 1-7.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Type of study: RCT
Setting and country: university hospital, Blida, Algeria
Funding: not reported Conflicts of interest: none reported |
Inclusion criteria: primigest women consulting before the 10th week of amenorrhea without previous vasculo-renal pathology
Exclusion criteria: counter-indication to the use of aspirin, chronic arterial hypertension before pregnancy, chronic nephropathy, a known auto-immune disorder, twin pregnancies, diabetic women
N total at baseline: 164 Intervention: 82 Control: 82
Groups comparable at baseline? Yes
|
100 mg aspirin per day
|
no treatment (or placebo? Not clearly described)
|
Length of follow-up: until delivery
Loss-to-follow-up: 0
Incomplete outcome data: not reported
|
Preterm delivery <37 weeks I: 34/82 (41%); C: 75/82 (91%)
RR [95% CI] 0.45 [0.35 to 0.59]
Preterm delivery < 34 weeks I: 3/82 (4%); C: 27/82 (33%)
RR [95% CI] 0.11 [0.01 to 0.35] |
Poorly reported study; NB: no births >38 weeks of gestation “Despite this selection, the placebo group delivered around 35 weeks, but this was not unusual among the Algerian population.”
RR calculated using MedCalc based on raw numbers presented in paper |
|
|
Caspi, 1994 |
Type of study: RCT
Setting and country: Academic Medical Center, Israel
Funding and conflicts of interest: not reported |
Inclusion criteria: uncomplicated twin pregnancies, start of second trimester Exclusion criteria: chronic renal, cardiovascular, pulmonary or hepatic disorders, past or present coagulopathy or peptic ulcer, gestational diabetes mellitus and known hypersensitivity to aspirin
N total at baseline: 48 Intervention: 24 Control: 24 (one patient withdrawn after 16 weeks of therapy at 32 weeks gestation because of slowly progressive thrombocytopenia)
Important prognostic factors2: Pregnancy-Induced Hypertension in previous pregnancy I: 1/24 C: 3/23
Nulliparous I: 10/24 C: 7/23
Groups comparable at baseline? Yes
|
100mg aspirin/day
|
placebo
|
Length of follow-up: until delivery
Loss-to-follow-up:
Intervention: 0
Control: 1 ( 4%) withdrawn after 16 weeks of therapy at 32 weeks gestation because of slowly progressive thrombocytopenia
Incomplete outcome data: Intervention: 0
Control: 1 (4%) withdrawn after 16 weeks of therapy at 32 weeks gestation because of slowly progressive thrombocytopenia
|
Preterm delivery (<37 weeks) I: 11/24 (46%); C: 14/23 (61%)
RR [95% CI] 0.75 [0.44 to 1.30] in favour of Aspirin |
Poorly reported study
RR calculated using MedCalc based on raw numbers presented in paper |
|
Golding, 1998 |
Type of study: RCT
Setting and country: antenatal clinics Kingston and St Andrew in Jamaica
Funding: Safe Motherhood Programme of the World Health Organization and the Overseas Development Administration of the United Kingdom
Conflicts of interest: not reported
|
Inclusion criteria: primiparae
Exclusion criteria: >32 weeks gestation
N total at baseline: 6775 Intervention: 3142 Control: 3133
Groups comparable at baseline? Yes
|
60 mg asprin/day
|
placebo
|
Length of follow-up: 6 weeks postpartum
Loss-to-follow-up: n=179, not specified in which groups
Incomplete outcome data: not clear
|
preterm delivery <33 weeks: I: 129/3023 (4.3%); C: 125/3026 (4.1%) RR [95% CI]: 1.03 [0.81 to 1.31]
preterm delivery <37 weeks: I: 447/3023 (14.8%); C: 463/3026 (15.3%) RR [95% CI]: 0.97 [0.86 to 1.09] |
Poorly reported study
Baseline characteristics reported for only 6049 participants (I: 3023, C: 3026); of only 229 participants was described why they were excluded (n=50, twin pregnancies) or information on outcomes was missing (n=179, lost to follow-up)
Percentages reported seem to indicate missing values that were not reported
RR calculated using MedCalc based on raw numbers presented in paper
Population may not be comparable to Dutch population |
|
Hauth, 1993 |
Type of study: RCT
Setting and country: Academic hospital Birmingham Alabama, USA
Funding: NICHD grant Conflicts of interest: not reported |
Inclusion criteria: nulliparous pregnant women < 28 years, <23 weeks of gestation
Exclusion criteria: renal disease, collagen vascular disease, diabetes mellitus, multiple pregnancy, chronic hypertension
N total at baseline: 604 Intervention: 302 Control: 302
Groups comparable at baseline? Yes
|
60 mg aspirin/day
|
placebo
|
Length of follow-up: until delivery
Loss-to-follow-up: none
Incomplete outcome data: not reported
|
Spontaneous preterm delivery (length of gestation not defined) I: 8/302 (2.6%); C: 11/302 (3.6%) RR [95% CI]: 0.73 [0.30 to 1.78]
All preterm delivery (length of gestation not defined) I: 20/302 (6.6%); C: 24/302 (7.9%) RR [95% CI]: 0.83 [0.47 to 1.48] |
RR calculated using MedCalc based on raw numbers presented in paper |
|
Hoffman, 2020 |
Type of study: multinational RCT
Setting and country: community sites in India, Pakistan, Zambia, Democratic Republic of the Congo, Guatemala, Kenya
Funding: NICHD (USA public funding) Conflicts of interest: none reported |
Inclusion criteria: nulliparous pregnant women 18-40 years (in Congo, Kenya and Zambia ≥14 years) Exclusion criteria: allergy or contraindication to aspirin; previous prescription of aspirin for more than 7 days during the pregnancy; multiple gestations; more than two first-trimester losses; any other medical condition that might be considered a contraindication to inclusion in the study (eg, diabetes and hypertension) N total at baseline (mITT, excluding ineligible randomised women): 11558 Intervention: 5787 Control: 5771
Groups comparable at baseline? Yes
|
81 mg aspirin per day (initiated between 6 and 14 weeks of gestation)
|
matched placebo
|
Length of follow-up: 6 weeks after delivery
Loss-to-follow-up: not reported
Incomplete outcome data: not reported
|
Preterm birth (between 20 and 37 weeks of gestation) I:668/5780 (11.6%) C: 754/5764 (13.1%) RR [95% CI] 0.89 [0.81 – 0.98]
Early preterm delivery (before 34 weeks) I: 189/5780 (3.3%) C: 230/5764 (4.0%) RR [95% CI] 0.75 [0.61 – 0.93]
Extremely preterm birth (before 28 weeks) I: 54/5780 (0.9%) C: 75/5764 (1.3%) RR [95% CI] 0.72 [0.51 – 1.02]
|
Population may not be comparable to Dutch population |
|
Rotchell, 1998 |
Type of study: RCT
Setting and country: antenatal clinics Barbados
Funding: Sterling Winthrop, New York, NPEU (National Prenatal Epidemiology Unit) and CTSU (Clinical Trial Service Unit) Conflicts of interest: not reported |
Inclusion criteria: pregnant women between 12 and 32 weeks of gestation Exclusion criteria: increased risk of bleeding, known allergy to aspirin, high likelihood of immediate delivery or previous placental abruption
N total at baseline: 3647 Intervention: 1822 Control: 1825
Groups comparable at baseline? Yes
|
75 mg controlled-release aspirin per day
|
matched placebo
|
Length of follow-up: discharge after delivery or 6 weeks after delivery (if mother or infant still in hospital)
Loss-to-follow-up:
Intervention: 3 (0.16%) Control: 3 (0.16%%) Reasons not reported
Incomplete outcome data: not reported
|
Preterm delivery (<37 weeks) I: 255/1819 (14%) C: 270/1822 (14.8%) RR [95% CI] 0.95 [0.81 – 1.11] |
RR calculated using MedCalc based on raw numbers presented in paper
Population may not be comparable to Dutch population
Results did not differ in subgroups (entered earlier (≤20 weeks) or later in gestation; nulliparous or multiparous) |
|
Landman, 2022 |
Type of study: multicenter RCT
Setting and country: Dutch Consortium for Healthcare Evaluation and Research in Obstetrics and Gynecology
Funding: ZonMW Conflicts of interest: none reported |
Inclusion criteria: Women with a singleton pregnancy and a history of spontaneous preterm birth in a singleton pregnancy (22–37 weeks of gestation) Exclusion criteria: women with previous indicated preterm births for maternal reasons such as preeclampsia or HELLP-syndrome or for fetal reasons such as IUGR, other indications for aspirin use, thrombocytopenia/ thrombocytopathy, major fetal malformations in current pregnancy or in previous spontaneous preterm birth
N total at baseline: 406 Intervention: 204 Control: 202
Groups comparable at baseline? Yes
|
80 mg aspirin per day (initiated between 8 and 16 weeks)
|
placebo
|
Length of follow-up: until date of discharge from hospital or 3 months of corrected age
Loss-to-follow-up:
Intervention: none Control: none
Incomplete outcome data: Intervention: 10 (4.9%) excluded from analysis
Control: 9 (4.5%) excluded from analysis
|
Preterm birth (<37 weeks of gestation) I: 41/194 (21.2%) C: 49/193 (25.4%) RR [95% CI] 0.83 [0.58 – 1.20]
Spontaneous preterm birth (<37 weeks of gestation) I: 39/194 (20.1%) C: 46/193 (23.8%) RR [95% CI] 0.84 [0.58 – 1.23]
Preterm birth ≤ 34 weeks I: 18/194 (9.3%) C: 17/193 (8.8%) RR [95% CI] 1.05 [0.56 – 1.98]
Spontaneous preterm birth ≤ 34 weeks I: 18/194 (9.3%) C: 16/193 (8.3%) RR [95% CI] 1.12 [0.59 – 2.13]
Preterm birth ≤ 28 weeks I: 7/194 (3.6%) C: 5/193 (2.6%) RR [95% CI] 1.39 [0.45 – 4.31]
Spontaneous preterm birth ≤ 28 weeks I: 7/194 (3.6%) C: 5/193 (2.6%) RR [95% CI] 1.39 [0.45 – 4.31]
|
|
Risk of bias table RCTs
|
Study reference
(first author, publication year) |
Describe method of randomisation |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Bakhti, 2011 |
‘Two cohorts of 82 patients and 82 controls were analyzed in this study after randomization for treatment (using anonymous sealed envelopes).’ |
likely |
unlikely |
unlikely |
unclear |
unlikely |
unlikely |
likely |
|
Caspi, 1994 |
‘according to a randomization list’ |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Golding, 1998 |
enrolled women received a number and showed this to the pharmacy; numbers were connected to study medication packages |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unclear |
unclear |
|
Hauth, 1993 |
blocked randomization scheme with randomly chosen block sizes |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Hoffman, 2020 |
stratified by site, with the randomisation sequence for each site provided by the data coordinating centre (RTI) using a computer algorithm based on a randomly permuted block design with varied block sizes |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Rotchell, 1998 |
not reported |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Landman, 2022 |
performed centrally with the use of a random 2 : 4 block design |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Andrikopoulou, 2018 |
wrong study design (secondary analysis of RCT, thus observational, not randomised) |
|
Ayala, 2013 |
wrong P |
|
Duley, 2001 |
wrong P (women at risk for pre-eclampsia) |
|
Kozer, 2003 |
SR, inclusion criteria for P not clear |
|
Matei, 2019 |
SR of SRs |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 10-02-2025
Beoordeeld op geldigheid : 20-11-2024
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor zwangere vrouwen zonder klinische verschijnselen van een vroeggeboorte, die al dan niet in een eerdere zwangerschap een spontane vroeggeboorte hebben doorgemaakt.
Werkgroep
- Prof. dr. M.A. Oudijk, gynaecoloog, NVOG (voorzitter)
- Dr. N. Horree, gynaecoloog, NVOG
- Dr. J.B. Derks, gynaecoloog, NVOG
- Dr. T.A.J. Nijman, gynaecoloog, NVOG
- Dr. F. Vlemmix, gynaecoloog, NVOG
- Dr. D.A.A. van der Woude, gynaecoloog, NVOG
- L.T. Brammerloo-Read, MSc, verloskundige, KNOV
- Dr. M.A.C. Hemels, kinderarts-neonatoloog, NVK
- F.A.B.A. Schuerman, MSc, kinderarts-neonatoloog, NVK
- J.D.M. Wagemaker, patiëntenvereniging, Care4Neo
Met ondersteuning van:
- Dr. L. Viester, adviseur, Kennisinstituut van Medisch Specialisten (tot augustus 2022)
- T. Geltink, MSc, adviseur, Kennisinstituut van Medisch Specialisten (vanaf augustus 2022)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. M.A. Oudijk |
Gynaecoloog |
Voorzitter Pijler FMG van de NVOG, onbetaald, alleen vacatiegelden. Voorzitter wetenschapscommissie pijler FMG, onbetaald. Member of the board of the foundation 'Stoptevroegbevallen'; a non-profit foundation with the purpose to raise funds for research projects on preterm labour/birth, onbetaald. Member of the scientific committee of the 'Fonds Gezond Geboren', a non-profit foundation with the purpose to raise funds for reserarch projects on preterm birth and placental insufficiency, onbetaald. Member of the advisory board of the N3, the Dutch Neonatology research network, onbetaald. President of the European Spontaneous Preterm Birth Congress to be held in Haarlem, The Netherlands, www. espbc.eu, onbetaald |
2015 ZonMW836041012 The effect of tocolysis with nifedipine or atosiban on infant development: the APOSTEL III follow-up study. € 43,772. 2015 ZonMW 836041006 Low dose aspirin in the prevention of recurrent spontaneous preterm labour: the APRIL study € 351.898. 2016 Zon|MW 80-84800-98-41027 Atosiban versus placebo in the treatment of late threatened preterm labour: the APOSTEL VIII study € 1.393.639. Hoofdaanvrager/projectleider van deze vroeggeboorte studies. Subsidie wordt alleen aangewend ten behoeve van het onderzoek, promoventi etc. Geen persoonlijke salariëring vanuit deze ZonMw studie |
geen restricties |
|
Dr. N. Horree |
Gynaecoloog |
geen |
Participatie binnen ziekenhuis aan consortium studies vanuit de NVOG. Hieronder vallen ook onderzoek naar vroeggeboorte (o.a. Apnel studies) en preventie vroeggeboorte (April). QP PC - studies |
geen restricties |
|
Dr. J.B. Derks |
Gynaecoloog |
Lid bestuur werkgroep perinatologie en maternale ziektes (onbetaald); Lid otterlo groep (Cie. Ontwikkeling richtlijnen obstetrie) (onbetaald) |
Deelname consortiumstudies waaronder de April studie |
geen restricties |
|
T.A.J. Nijman |
Gynaecoloog |
Lid Commissie Gynaecongres, VAGO-vertegenwoordiger, onbetaald; Lid Koepel Wetenschap. VAGO-vertegenwoordiger, onbetaald |
Project groep April studie, ZonMW gesponsorde Consortium studie naar aspirine vs placebo bij preventie herhaalde vroeggeboorte. |
geen restricties |
|
Dr. F. Vlemmix |
Gynaecoloog |
Lid werkgroep patiëntcommunicatie NVOG |
geen |
geen restricties |
|
Dr. D.A.A. van der Woude |
Gynaecoloog & postdoc |
geen |
geen |
geen restricties |
|
L.T. Brammerloo-Read |
Verloskundige |
geen |
De praktijk + kliniek waarin werkzaam heeft deelname in cervix-meting van patiënten om vroeggeboorte op te kunnen sporen, hierbij geen financieel belang. |
geen restricties |
|
Dr. M.A.C. Hemels |
Kinderarts-neonatoloog |
Faculty cursus antibiotica bij kinderen, betaald |
Deelname APRIL studie, meelezen protocol betreffende de neonatale uitkomst maten |
geen restricties |
|
F.A.B.A. Schuerman |
Kinderarts-neonatoloog |
Bestuurslid stichting kindersedatie Nederland (betaald) |
geen |
geen restricties |
|
J.D.M. Wagemaker |
Patiëntvertegenwoordiger care |
geen |
geen |
geen restricties |
Inbreng patiëntenperspectief
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patiëntenfederatie Nederland, Stichting Kind en Ziekenhuis en Vereniging Ouders Couveusekinderen voor de schriftelijke knelpunteninventarisatie en een afgevaardigde patiëntenvereniging in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland, Stichting Kind en Ziekenhuis en Vereniging Ouders Couveusekinderen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor zwangere vrouwen zonder klinische verschijnselen van een vroeggeboorte, die al dan niet in een eerdere zwangerschap een spontane vroeggeboorte hebben doorgemaakt. Tevens zijn er knelpunten aangedragen door Patiëntenfederatie Nederland, Verpleegkundigen & Verzorgenden Nederland, Nederlandse Vereniging voor Kindergeneeskunde, Nederlandse Vereniging voor Medische Microbiologie, LAREB, Nederlandse Vereniging voor Klinische Fysica, Kind en Ziekenhuis via een schriftelijke knelpunteninventarisatie .
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
Database |
Zoektermen |
|||||||||||||||||||||||||||||||||
|
Embase
|
|
|||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Obstetric Labor, Premature/ or ((labo*r or deliver* or parturition* or birth*) adj3 (premature or preterm or 'pre term' or early or prior)).ti,ab,kf. (67176) 2 exp Aspirin/ or 'acetylsalicylic acid'.ti,ab,kf. or aspirin*.ti,ab,kf. or asa.ti,ab,kf. or 'acetylsalicyclic acid'.ti,ab,kf. or 'acetyl salicylic acid'.ti,ab,kf. or 'acetylic salicylic acid'.ti,ab,kf. (93858) 3 1 and 2 (434) 4 limit 3 to (english language and yr="2000 -Current") (306) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (463846) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2022725) 7 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3513561) 8 4 and 5 (58) 9 (4 and 6) not 8 (84) 10 (4 and 7) not (8 or 9) (72) 11 8 or 9 or 10 (214) |