Acetylsalicylzuur pre-eclampsie zwangerschap
Uitgangsvraag
Wat is de rol van acetylsalicylzuur, gestart ≤16 weken amenorroeduur, ter preventie van pre-eclampsie bij zwangere vrouwen? De uitgangsvraag omvat de volgende deelvragen:
- Is er een rol voor acetylsalicylzuur ter preventie van pre-eclampsie bij zwangere vrouwen met risicofactoren voor pre-eclampsie?
- Is er een rol voor acetylsalicylzuur ter preventie van pre-eclampsie bij zwangere vrouwen met risicofactoren voor pre-eclampsie, maar zonder pre-eclampsie in de voorgeschiedenis?
- Is er een rol voor acetylsalicylzuur ter preventie van pre-eclampsie bij zwangere multipara vrouwen zonder risicofactoren voor pre-eclampsie?
Aanbeveling
Schrijf géén acetylsalicylzuur voor aan zwangere vrouwen zonder risicofactoren voor pre-eclampsie.
Adviseer het gebruik van acetylsalicylzuur aan zwangere vrouwen met een hoog risico op het ontwikkelen van pre-eclampsie.
Bespreek de mogelijkheid om acetylsalicylzuur te gebruiken bij zwangere vrouwen met twee of meer matige risicofactoren voor pre-eclampsie.
Start profylaxe met acetylsalicylzuur in een dosering van 80-150 mg per dag vanaf 12 weken amenorroe en bij voorkeur vóór het voltooien van de 16e week. Staak de behandeling minimaal een week voorafgaand aan de partus of een operatieve ingreep (sectio), d.w.z. bij 36 weken amenorroeduur, tenzij een partus eerder verwacht wordt. Bij voorkeur wordt acetylsalicylzuur in de avond ingenomen.
Overwegingen
Er is in de literatuur onvoldoende bewijs over de effectiviteit van gebruik van acetylsalicylzuur in de algemene populatie zwangere vrouwen zonder risicofactoren voor pre-eclampsie. De werkgroep ziet dan ook geen reden om deze groep zwangere vrouwen profylactisch acetylsalicylzuur voor te schrijven.
Tabel 1. Risicofactoren voor pre-eclampsie
|
Risico |
Risicofactor |
|
HOOG |
Pre-eclampsie in een eerdere zwangerschap Auto-immuun aandoeningen zoals SLE of APS Type 1 of 2 diabetes mellitus Pre-existente hypertensie |
|
MATIG |
Nullipariteit Maternale leeftijd ≥ 40 jaar interval tussen zwangerschappen > 10-jaar Pre-eclampsie in de familie-anamneses (moeder of zuster) Obesitas (BMI > 35 kg/m2) Meerlingzwangerschap Zwangerschap na eiceldonatie |
Bron: gebaseerd op de NICE-guideline 'Hypertension in pregnancy: diagnosis and management' (NICE, 2010), de USPSTF richtlijn (LeFevre, 2014) en Bartsch, 2016.
Volgens de meta-analyse van subvraag 1 is er bewijs van (‘matig’ niveau) voor een reductie van de kans op pre-eclampsie met een absolute risico reductie van 7,4% na behandeling met acetylsalicylzuur bij zwangere vrouwen met een verhoogd risicoprofiel. Een verhoogd risicoprofiel werd in de literatuur gekenmerkt door een breed scala en diversiteit aan risicofactoren, o.a. zoals beschreven in Tabel 1. Hierbij wordt in de literatuur vaak onderscheid gemaakt tussen een hoog of matig risico (LeFevre, 2014; NICE, 2010). Het includeren van primigravidae als risico factor kwalificeert bijna de helft van de verloskundige populatie als verhoogd risico en is alleen op grond van die overweging nauwelijks onderscheidend.
In geval van eerder doorgemaakte pre-eclampsie lijkt acetylsalicylzuur profylaxe het meest effectief. Echter, bij welke overige pre-existente risicofactoren zwangere vrouwen het meest gebaat zijn bij behandeling met acetylsalicylzuur is niet goed uit te maken. De risicofactoren zijn divers en omdat de meeste studies combinaties van risicofactoren hanteren is het effect van preventieve behandeling op basis van geïsoleerde risicofactoren niet goed te bepalen. Poon (2017) toont in een sub analyse van de ASPRE studie dat pre-existente hypertensie wel gepaard gaat met een verhoogd risico op pre-eclampsie, maar dat acetylsalicylzuur in die patiënten geen aanleiding gaf tot afname van het risico op pre-eclampsie. Echter, dit betrof een subgroep analyse met een gering aantal patiënten. Het selecteren van een hoog risico populatie, op basis van het algoritme (van gecombineerde risicofactoren) zoals gehanteerd in de studie van Rolnik (2017), heeft mogelijk een hogere sensitiviteit voor het identificeren van zwangere vrouwen met een verhoogd risico op pre-eclampsie in vergelijking met het selecteren enkel op basis van de medische en obstetrische voorgeschiedenis, waardoor laag risico zwangerschappen niet onnodig blootgesteld worden aan medicatie. Bij gebruik van acetylsalicylzuur door zwangere vrouwen met een verhoogd risico op pre-eclampsie wordt een matige risicoreductie gezien van pre-eclampsie. Echter, sub-analyses van datasets naar de individuele risicofactoren resulteren in kleine aantallen en de power is mogelijk te laag om de rol van individuele factoren goed te schatten. Desondanks lijkt vooralsnog een pragmatische benadering zoals gehanteerd in NICE en USPSTF richtlijnen aan te bevelen (LeFevre, 2014; NICE, 2010). Daarbij kunnen anamnestische factoren uit obstetrische en medische voorgeschiedenis gebruikt worden voor de risicoselectie (zie Tabel 1). Tabel 1 is gebaseerd op de NICE richtlijn (NICE, 2010), de USPSTF-richtlijn (LeFevre, 2014) en de risicoschattingen uit een recente meta-analyse van Bartsch (Bartsch, 2016). Hierin werd een verhoogd risico op pre-eclampsie gerapporteerd bij factoren zoals beschreven in Tabel 1, waarbij het relatieve risico varieerde tussen de 1,5 en 8,4 (Bartsch, 2016).
Hoewel de risicobeoordeling niet systematisch werd onderzocht in deze uitgangsvraag, ontbreekt het in de literatuur aan uniforme definiëring en kwantificering volgens gevalideerde multivariate modellen om het absolute en relatieve belang van individuele risicofactoren en combinaties van risicofactoren nauwkeuriger te schatten. Vooralsnog wordt in Tabel 1 volstaan met een pragmatische indeling in hoog-matig risico.
Er lijkt voldoende bewijs dat een lage dosis acetylsalicylzuur (tot 150 mg per dag) als preventieve medicatie voor pre-eclampsie niet gepaard gaat met een verhoogd risico op abruptio placentae, postpartum bloeding of foetale intracraniële bloeding. Meta-analyses en internationale richtlijnen onderstrepen allen de veiligheid en beperkte risico’s (LeFevre, 2014; NICE, 2010). De bijwerkingen zijn bij lage doseringen zeldzaam en omvatten naast overgevoeligheidsverschijnselen of allergieën een verlenging van de bloedingstijd (1-10%) en soms maagklachten (0,1-1%) (Farmacotherapeutisch Kompas). Daarentegen levert het voorkomen van pre-eclampsie mogelijk gezondheidswinst op door reductie van het aantal opnames, inleidingen en iatrogene premature partus. Echter, zoals bij het voorschrijven van elke medicatie moet een afweging worden gemaakt tussen de te verwachten positieve effecten tegenover de nadelen van behandeling. Ook indien zich tijdens behandeling neveneffecten voordoen moet die afweging opnieuw worden gemaakt. Contra-indicaties van acetylsalicylzuur zijn: maagklachten, maagpijn bij eerder gebruik, ulcus pepticum (actief of in de voorgeschiedenis), maag-darmbloedingen (actief of in de voorgeschiedenis), maag-darmperforatie, gastritis, optreden van astma-aanval, urticaria, angio-oedeem, neuspoliepen of rinitis, ernstige nier- en leverinsufficiëntie, ernstig hartfalen en/of hemorragische diathese (Farmacotherapeutisch Kompas).
De analyse van Roberge (2017) toont een dosis effect relatie waarbij doseringen van meer dan 100 mg/dag acetylsalicylzuur een groter preventief effect lijken te hebben. Een dosering van 80-100 mg/dag is de minimaal benodigde dosering die werkzaam lijkt. In de ASPRE trial wordt bij een dagelijkse dosering van 150 mg/dag geen verhoogd bloedingsrisico gevonden (Rolnik, 2017). Echter, de risico’s van hogere doseringen zijn nog niet uitgebreid onderzocht. In de huidige praktijk wordt in Nederland momenteel veelal gebruik gemaakt van 80-100 mg/dag. Deze doseringen zijn op recept verkrijgbaar in Nederlandse apotheken. Echter, de meest optimale dosering is niet in de literatuur middels direct vergelijkende studies onderzocht. Dit is een kennislacune. Bovenstaande in overweging genomen adviseert de werkgroep een dosering van tenminste 80 mg/dag en ten hoogste 150 mg/dag. Bij voorkeur wordt acetylsalicylzuur in de avond ingenomen (Ayala, 2013; Bonten, 2014).
Ook de amenorroeduur waarop de toediening wordt gestart zou een effect kunnen hebben op de effectiviteit van de interventie. Een lage dosis acetylsalicylzuur is in het eerste trimester niet teratogeen bevonden (Nørgård, 2005) en er zijn geen nadelige effecten gezien bij de behandeling met een lage dosering op moeder, foetus of neonaat (Lareb; Rotchell, 1998). De preventieve behandeling met acetylsalicylzuur dient bij voorkeur ≤16 weken te worden gestart, waarbij de meeste bewijskracht beschikbaar is voor het starten van de behandeling vanaf 12 weken (Roberge, 2017). De risico’s van een lage dosis acetylsalicylzuur gestart vanaf 12 weken amenorroe lijken gering. Het is onduidelijk of er straffeloos eerder gestart kan worden dan 12 weken. Dit is slechts beperk in een kleine IVF series onderzocht. De aantallen zijn te klein om te mogen constateren dat er geen risico is.
Over het algemeen wordt zo veel mogelijk geen medicatie voorgeschreven in de periode van de organogenese. Ook is een abnormale verhouding tussen TXA2 en prostacycline bij 12 weken aangetoond (Atallah, 2017). Het effect van starten na 16 weken is niet in deze uitgangsvraag onderzocht. Acetylsalicylzuur heeft een halfwaardetijd van 30 minuten en het zorgt voor Cyclo-Oxygenase (COX) inhibitie in de trombocyt die de gehele levensduur van de trombocyt (7-10 dagen) aanhoudt (Atallah, 2017). Acetylsalicylzuur passeert de placenta en inhibeert het COX ook in de foetale trombocyt. Het advies is daarom minimaal een week voorafgaand aan de partus of een operatieve ingreep (sectio) de acetylsalicylzuur te staken, d.w.z. bij 36 weken amenorroeduur, tenzij een partus eerder verwacht wordt.
De kosten van acetylsalicylzuur zijn gering (5 eurocent per tablet). Een geringe reductie ter voorkoming van pre-eclampsie kan aanleiding geven tot aanzienlijke gezondheidswinst en dus kostenreductie. Gezien de lage kosten en het lage risicoprofiel van acetylsalicylzuur blijkt dat ook bij een geringe risicoreductie op pre-eclampsie de behandeling met acetylsalicylzuur kosteneffectief is. Een verlaagd risico op pre-eclampsie van 6 – 10% bij een zwangere zou al kosteneffectief zijn voor de behandeling met lage dosis acetylsalicylzuur (Bartsch, 2015).
Bovenstaande in overweging genomen, beveelt de werkgroep aan om bij patiënten met pre-eclampsie in een eerdere zwangerschap acetylsalicylzuur profylaxe voor te schrijven. Hoewel het effect van acetylsalicylzuur per individuele risicofactor of combinaties van (verschillende) risicofactoren onvoldoende is onderzocht, is er bewijs van ‘matig niveau’ dat er sprake is van gunstige effecten in populaties met een breed scala en diversiteit aan risicofactoren, o.a. zoals beschreven in Tabel 1. Op basis van deze bevindingen en mede vanwege internationale consensus op dit gebied, beveelt de werkgroep aan om ook bij vrouwen met een verhoogd risico het gebruik van acetylsalicylzuur te bespreken. Eveneens naar analogie van de NICE-guideline zou acetylsalicylzuur overwogen kunnen worden in geval van twee of meer matige risicofactoren voor pre-eclampsie (zie Tabel 1). Hierbij verdient het aanbeveling met de vrouw te bespreken op welke punten er onzekerheden bestaan ten aanzien van de indicatiestelling voor het gebruik van acetylsalicylzuur bij vrouwen met één of meerdere risicofactoren.
Onderbouwing
Achtergrond
Pre-eclampsie is één van de meest voorkomende zwangerschapscomplicaties. In Nederland krijgt ongeveer 2-5% van de zwangere vrouwen pre-eclampsie (Abalos, 2013). Pre-eclampsie wordt gekenmerkt door een hoge bloeddruk en proteïnurie welke kan ontstaan in de tweede helft van de zwangerschap. Vrouwen die al eerder een zwangerschap met pre-eclampsie hebben doorgemaakt hebben een verhoogd risico op het herhaald optreden van de aandoening (LeFevre, 2014; NICE, 2010; Bartsch, 2016). Preventieve behandeling met acetylsalicylzuur gestart ≤16 weken amenorroeduur kan mogelijk het risico op herhaalde pre-eclampsie verlagen. Het is echter onduidelijk of acetylsalicylzuur bij andere bekende risicofactoren (dan eerder doorgemaakte pre-eclampsie) effectief is in de preventie van pre-eclampsie. Het is eveneens onduidelijk wat de rol is van acetylsalicylzuur ter preventie van pre-eclampsie bij vrouwen zonder risicofactoren. Risicofactoren geassocieerd pre-eclampsie staan in Tabel 1. Deze tabel is gebaseerd op de NICE richtlijn (NICE, 2010), de USPSTF-richtlijn (LeFevre, 2014) en de meer recente meta-analyse van Bartsch (Bartsch, 2016). Onderstaande risicofactoren zijn geassocieerd met een verhoogde incidentie (5-17%) van pre-eclampsie waarbij de gerapporteerde relatieve risico’s variëren tussen de 1,5-8,4 (Bartsch, 2016; LeFevre, 2014). Omdat uniforme definiëring van risicofactoren en kwantificering van het geschatte risico middels gevalideerde multivariate modellen veelal ontbreekt wordt in de tabel volstaan met een pragmatische indeling in hoog en matig risico.
Tabel 1. Risicofactoren voor pre-eclampsie
|
Risico |
Risicofactor |
|
HOOG |
Pre-eclampsie in een eerdere zwangerschap Auto-immuun aandoeningen zoals SLE of APS Type 1 of 2 diabetes mellitus Pre-existente hypertensie |
|
MATIG |
Nullipariteit Maternale leeftijd ≥ 40 jaar interval tussen zwangerschappen > 10-jaar Pre-eclampsie in de familie-anamneses (moeder of zuster) Obesitas (BMI > 35 kg/m2) Meerlingzwangerschap Zwangerschap na eiceldonatie |
Bron: gebaseerd op de NICE-guideline 'Hypertension in pregnancy: diagnosis and management' (NICE, 2010), de USPSTF richtlijn (LeFevre, 2014) en Bartsch, 2016.
Conclusies / Summary of Findings
|
matig GRADE |
Acetylsalicylzuur profylaxe gestart ≤16 weken amenorroeduur verlaagt het risico op pre-eclampsie bij zwangere vrouwen met een verhoogd risico op het ontwikkelen van pre-eclampsie.
Deze conclusie is gebaseerd op 14 RCT’s waarin zwangere vrouwen met een breed en gevarieerd scala aan risicofactoren en/of combinaties van risicofactoren zijn geïncludeerd.
Bronnen: Roberge (2017), Rolnik (2017), Xu (2015) |
|
laag GRADE |
Het is onduidelijk of acetylsalicylzuur profylaxe gestart ≤16 weken amenorroeduur het risico op pre-eclampsie vermindert bij zwangere vrouwen met een hoog risico op het ontwikkelen van pre-eclampsie, maar zonder pre-eclampsie in de voorgeschiedenis.
Deze conclusie is gebaseerd op één RCT (ASPRE trial) waarin een subgroep analyse is uitgevoerd (gering aantal patiënten en breed betrouwbaarheidsinterval). Er is onvoldoende literatuur beschikbaar om uitspraken te doen over deze specifieke subgroep en individuele risicofactoren. Bronnen: Rolnik (2017), Poon (2017) |
|
geen GRADE |
Vanwege het ontbreken van data is de rol van acetylsalicylzuur bij multipara vrouwen zonder risicofactoren op het ontwikkelen van pre-eclampsie onduidelijk.
Bronnen: geen studies |
Samenvatting literatuur
PICO 1: zwangere vrouwen met risicofactoren voor PE
Beschrijving studies
Een recente meta-analyse van Roberge (2017) includeerde 21 RCT’s naar het effect van acetylsalicylzuur vergeleken met placebo/geen behandeling, wanneer gestart ≤16 weken amenorroeduur. De startperiode in de RCT’s varieerde van 11 - 16 weken. In één studie werd de startperiode gedefinieerd als <16 weken (Michael, 1992). In 12 van deze RCT’s werden vrouwen geïncludeerd met een verhoogd risico op pre-eclampsie op basis van een voorgeschiedenis met chronische hypertensie, cardiovasculaire en endocriene aandoeningen, zwangerschapshypertensie, foetale groeirestrictie en/of pre-eclampsie. Voor het beantwoorden van deze uitgangsvraag werden studies geëxcludeerd die enkel nullipariteit, Polycysteus Ovarium Syndroom (PCOS) of een geschiedenis van meerdere miskramen als risicofactor includeerden. De dosering van acetylsalicylzuur varieerde tussen de 60 en 150 mg/dag.
De relevante studies uit Roberge (2017) werden aangevuld met één studie uit de meta-analyse van Xu, 2015 (Vainio, 2002). De RCT van Vainio (2002) includeerde 90 zwangere vrouwen met een verhoogd risico op pre-eclampsie vanwege o.a. een positieve familieanamnese van pre-eclampsie (moeder/zus), chronische hypertensie, zwangerschapsdiabetes, leeftijd <20 of >40 jaar, belaste voorgeschiedenis pre-eclampsie of intra-uteriene groeivertraging. De interventie werd gestart tussen de 12 en 14 weken van de zwangerschap en betrof een dosering van 0,5 mg/kg. Het gemiddelde gewicht van de populatie was 72 kg, waardoor de gemiddelde dosering 36 mg/dag betrof.
Tot slot werd de meta-analyse geüpdatet met een recente RCT van Rolnik (2017). Deze studie betreft de ASPRE-trial naar het effect van acetylsalicylzuur, gestart tussen 11 en 14 weken tot 36 weken zwangerschapsduur op het voorkomen van pre-eclampsie bij eenlingzwangerschappen met een hoog risico op pre-eclampsie. Vrouwen werden gerandomiseerd naar acetylsalicylzuur (150 mg/dag) of placebo. Screening naar pre-eclampsie was gebaseerd op een algoritme van gecombineerde risicofactoren, waaronder maternale factoren, arteriële druk, Uterine Artery Pulsatility Index (UtA-PI), serum PIGF en maternale zwangerschaps-geassocieerde plasma proteïne A factor.
Resultaten
In totaal werden 3708 vrouwen (14 RCT’s) geïncludeerd, waarvan 1838 vrouwen in de interventie groep en 1870 vrouwen in de controle groep. Doseringen varieerden van ≤ 60 – 150 mg/dag. De gepoolde data (Figuur 1) laten zien dat een behandeling met acetylsalicylzuur de kans op pre-eclampsie significant verlaagt bij zwangere vrouwen met een verhoogd risico op pre-eclampsie (RR 0.49, 95% BI 0.36 tot 0.67) in vergelijking met de controle groep. Er was sprake van een relatief hoge mate van heterogeniteit I2 52%. Dit resulteert in een absolute risico reductie (risicoverschil) van 7,4% ten gunste van de interventiegroep. Om één geval van pre-eclampsie te voorkomen dienen 13 zwangeren met een verhoogd risicoprofiel ≤16 weken zwangerschap te starten met een lage dosering acetylsalicylzuur (NNT, Number Needed to Treat: 13,5).
Om de effectiviteit van verschillende doseringen van acetylsalicylzuur voor de preventie van pre-eclampsie te beoordelen, werd een subgroep analyse per dosering uitgevoerd. Bij vrouwen die een lage dosering acetylsalicylzuur kregen, ≤60 mg/dag (3 studies, n=771), werd geen significant effect waargenomen van acetylsalicylzuur op de incidentie van pre-eclampsie in vergelijking met vrouwen in de controle groep (RR 0.50, 95% BI 0.12 tot 2.06). Vrouwen behandeld met een hogere dosering acetylsalicylzuur, 100 mg/dag (6 studies, n=821), hadden een significant lagere kans op pre-eclampsie in vergelijking met vrouwen in de controle groep (RR 0.52, 95% BI 0.33 tot 0.80). Ook bij vrouwen met de hoogste dosering acetylsalicylzuur, 150 mg/dag (2 studies, n=1713), werd een marginaal significant effect waargenomen (RR 0.30, 95% BI 0.09 tot 0.98).
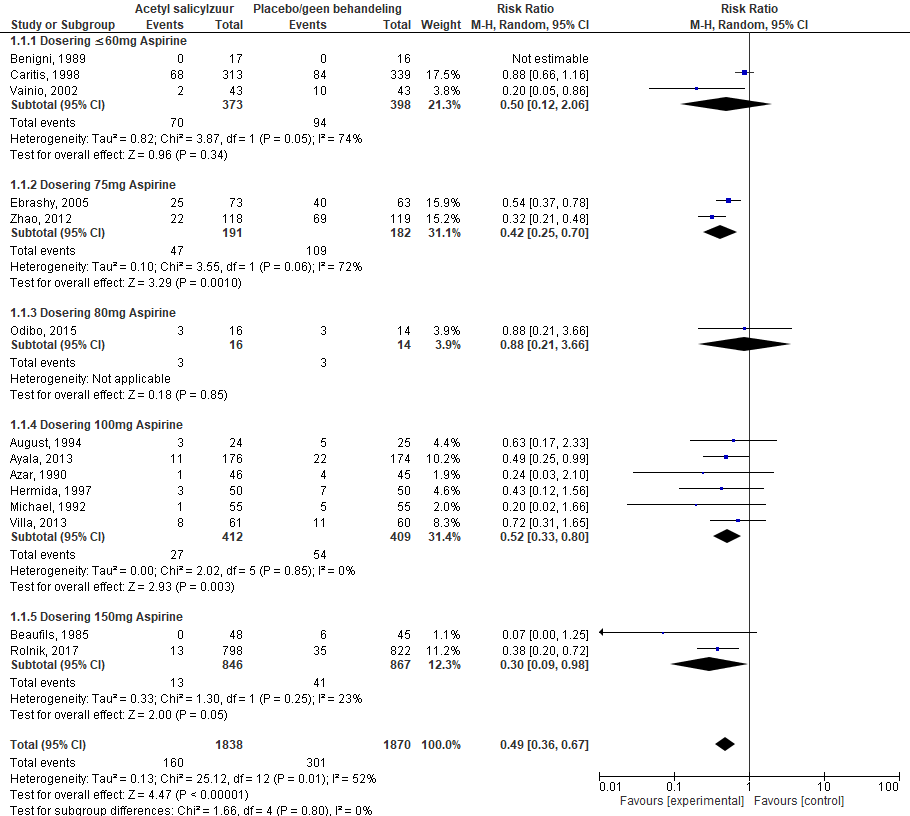
Figuur 1. Forest plot van de studies met als uitkomstmaat pre-eclampsie en acetylsalicylzuur gestart voor ≤ 16 weken zwangerschapsduur bij vrouwen met een verhoogd risico op pre-eclampsie. Bron: Roberge, 2017, aangevuld met RCTs van Vainio, 2002; Rolnik, 2017. Vainio, 2002 hanteert een dosering van 0,5 mg/kg waardoor de gemiddelde dosering 36 mg/dag is (o.b.v. gemiddelde gewicht populatie 72 kg).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pre-eclampsie bij zwangere vrouwen met risicofactoren voor pre-eclampsie is met 1 niveau verlaagd gezien analyse van de funnel-plot (Figuur 2) indicatie geeft tot mogelijke publicatiebias. De bewijskracht wordt gegradeerd als ‘matig’.
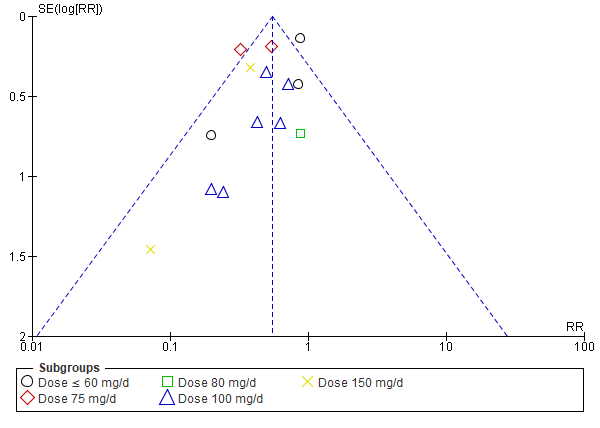
Figuur 2. Funnel-plot analyse van mogelijke publicatiebias voor de uitkomstmaat pre-eclampsie.
PICO 2: zwangere vrouwen met risicofactoren voor PE, zonder PE in de voorgeschiedenis
Beschrijving studies
De RCT van Rolnik (2017) en de opvolgende publicatie van Poon (2017) onderzochten het effect van acetylsalicylzuur (150 mg/dag) in een subgroep van 359 patiënten met een verhoogd risico op pre-eclampsie (risicoprofiel opgesteld in het eerste trimester a.d.h.v. algoritme waaronder maternale factoren, arteriële druk, Uterine Artery Pulsatility Index (UtA-PI), serum PIGF en/of maternale zwangerschaps-geassocieerde plasma proteïne A factor) zonder een belaste voorgeschiedenis van pre-eclampsie.
Resultaten
De ASPRE trial (Rolnik, 2017; Poon, 2017) rapporteerde geen significant effect van acetylsalicylzuur (150 mg/dag) op de incidentie van pre-eclampsie bij zwangere vrouwen met een verhoogd risicoprofiel (o.b.v. het hierboven beschreven algoritme) zonder pre-eclampsie in de voorgeschiedenis (RR 0.68, 95% BI: 0.20 tot 2.28).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat pre-eclampsie bij zwangere vrouwen met risicofactoren voor pre-eclampsie, zonder pre-eclampsie in de voorgeschiedenis is met twee niveau’s verlaagd gezien het geringe aantal patiënten en het brede betrouwbaarheidsinterval (imprecisie). De bewijskracht wordt gegradeerd als ‘laag’.
PICO 3: zwangere multipara zonder risicofactoren voor PE
Niet van toepassing. Er werden geen studies geïncludeerd na de literatuursearch.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Wat is het effect van acetylsalicylzuur gestart ≤ 16 weken amenorroeduur op de incidentie van pre-eclampsie in vergelijking met een placebo of geen behandeling bij:
1) zwangere vrouwen met risicofactoren voor pre-eclampsie?
2) zwangere vrouwen met risicofactoren voor pre-eclampsie, maar zonder pre-eclampsie in de voorgeschiedenis?
3) zwangere vrouwen zonder risicofactoren voor pre-eclampsie?
P1 Zwangere vrouwen met risicofactoren* voor pre-eclampsie
I Acetylsalicylzuur, gestart ≤16 weken amenorroeduur
C Geen acetylsalicylzuur / placebo
O Pre-eclampsie
P2 Zwangere vrouwen met risicofactoren* voor pre-eclampsie, maar zonder pre-eclampsie in voorgeschiedenis
I Acetylsalicylzuur, gestart ≤16 weken amenorroeduur
C Geen acetylsalicylzuur / placebo
O Pre-eclampsie
P3 Zwangere multipara** zonder risicofactoren voor pre-eclampsie
I Acetylsalicylzuur, gestart ≤16 weken amenorroeduur
C Geen acetylsalicylzuur / placebo
O Pre-eclampsie
* Risicofactoren voor pre-eclampsie staan beschreven in Tabel 1. Voor het beantwoorden van deze uitgangsvraag zijn studies met nullipariteit als enige individuele risicofactor buiten beschouwing gelaten. De werkgroep is van mening dat deze factor enkel in een algoritme (combinatie van risicofactoren) meegewogen kan worden.
** Nullipariteit wordt beschouwd als een mogelijke risicofactor voor pre-eclampsie. Om deze reden is voor PICO 3 de populatie gedefinieerd als zwangere multipara zonder risicofactoren voor pre-eclampsie.
Relevante uitkomstmaten
De werkgroep achtte pre-eclampsie een voor de besluitvorming kritieke uitkomstmaat. De werkgroep definieerde de uitkomstmaten als volgt: pre-eclampsie is gedefinieerd als de combinatie van zwangerschapshypertensie (systolische bloeddruk ≥ 140 mmHg en/of diastolische bloeddruk ≥ 90 mmHg (Korotkoff V) ontstaan na 20 weken zwangerschapsduur, tweemaal gemeten, bij een vrouw die voordien een normale bloeddruk had) met proteïnurie (≥ 300 mg/24 uur) (NVOG richtlijn ‘Hypertensieve aandoeningen in de zwangerschap’, 2012). Indien pre-eclampsie niet nader werd gedefinieerd in de individuele studies, hanteerde de werkgroep de in de studie gebruikte definitie. De werkgroep definieerde een minimaal klinisch (patiënt) relevant verschil volgens de grenzen van de GRADE Working Group, namelijk een verschil in relatief risico van 25% (Schünemann, 2013).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) is op 03-08-2016 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerde gecontroleerde trials. De zoekverantwoording is weergegeven onder het tabblad ‘Verantwoording’.
De literatuurzoekactie leverde 407 treffers op. Vanwege de recente publicatie van relevante studies is met dezelfde search-string op 01-11-2017 een update van de zoekactie uitgevoerd. Deze aanvullende literatuurzoekactie leverde 48 treffers op.
Studies werden geselecteerd op grond van de volgende selectiecriteria:
- Gepubliceerd tussen 1-1-2007 en 1-11-2017;
- Systematische reviews of RCT’s
- Een patiëntenpopulatie bestaande uit 1) zwangere vrouwen met risicofactoren voor pre-eclampsie 2) zwangere vrouwen met risicofactoren voor pre-eclampsie zonder pre-eclampsie in de voorgeschiedenis 3) zwangere multipara zonder risicofactoren voor pre-eclampsie;
- Interventie acetylsalicylzuur gestart ≤16 weken amenorroeduur;
- De uitkomstmaat pre-eclampsie.
Op basis van titel en abstract werden in eerste instantie 32 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 28 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 4 studies definitief geselecteerd.
Deze 4 onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Abalos E, Cuesta C, Grosso AL, Chou D, Say L. Global and regional estimates of preeclampsia and eclampsia: a systematic review. Eur J Obstet Gynecol Reprod Biol. 2013 Sep;170(1):1-7. doi: 10.1016/j.ejogrb.2013.05.005. Epub 2013 Jun 7. Review. PubMed PMID: 23746796.
- Atallah A, Lecarpentier E, Goffinet F, Doret-Dion M, Gaucherand P, Tsatsaris V. Aspirin for Prevention of Preeclampsia. Drugs. 2017 Nov;77(17):1819-1831. doi: 10.1007/s40265-017-0823-0. PubMed PMID: 29039130; PubMed Central PMCID: PMC5681618.
- Ayala DE, Ucieda R, Hermida RC. Chronotherapy with low-dose aspirin for prevention of complications in pregnancy. Chronobiol Int. 2013 Mar;30(1-2):260-79. doi: 10.3109/07420528.2012.717455. Epub 2012 Sep 24. PubMed PMID: 23004922.
- Bartsch E, Medcalf KE, Park AL, Ray JG. High Risk of Pre-eclampsia Identification Group. Clinical risk factors for pre-eclampsia determined in early pregnancy: systematic review and meta-analysis of large cohort studies. BMJ. 2016 Apr 19;353:i1753. doi: 10.1136/bmj.i1753.
- Bartsch E, Park AL, Kingdom JC, Ray JG. Risk threshold for starting low dose aspirin in pregnancy to prevent preeclampsia: an opportunity at a low cost. PLoS One. 2015 Mar 19;10(3):e0116296. doi: 10.1371/journal.pone.0116296. eCollection 2015. PubMed PMID: 25789633; PubMed Central PMCID: PMC4366221.
- Bijwerkingencentrum Lareb (z.j.). [geraadpleegd 2018 Feb 13]. Beschikbaar via: https://www.lareb.nl/nl/databank.
- Bonten TN, Saris A, van Oostrom MJ, Snoep JD, Rosendaal FR, Zwaginga J, Eikenboom J, van der Meer PF, van der Bom JG. Effect of aspirin intake at bedtime versus on awakening on circadian rhythm of platelet reactivity. A randomized cross-over trial. Thromb Haemost. 2014 Dec;112(6):1209-18. doi: 10.1160/TH14-05-0453. Epub 2014 Sep 11. PubMed PMID: 25208590.
- LeFevre ML; U.S. Preventive Services Task Force. Low-dose aspirin use for the prevention of morbidity and mortality from preeclampsia: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med. 2014 Dec 2;161(11):819-26. doi: 10.7326/M14-1884. PubMed PMID: 25200125.
- National Institute for Health and Care Excellence (2010). Hypertension in pregnancy: the management of hypertensive disorders during pregnancy. Updated 2011. [geraadpleegd 2018 Feb 12]. Beschikbaar via: https://www.nice.org.uk/guidance/cg107/evidence/full-guideline-pdf-134794333.
- Nederlandse Vereniging voor Obstetrie en Gynaecologie (2012). Richtlijn Hypertensieve aandoeningen in de zwangerschap. Utrecht: NVOG.
- Nørgård B, Puhó E, Czeizel AE, Skriver MV, Sørensen HT. Aspirin use during early pregnancy and the risk of congenital abnormalities: a population-based case-control study. Am J Obstet Gynecol. 2005 Mar;192(3):922-3. PubMed PMID: 15746692.
- Poon LC, Wright D, Rolnik DL, Syngelaki A, Delgado JL, Tsokaki T, Leipold G, Akolekar R, Shearing S, De Stefani L, Jani JC, Plasencia W, Evangelinakis N, Gonzalez-Vanegas O, Persico N, Nicolaides KH. Aspirin for Evidence-Based Preeclampsia Prevention trial: effect of aspirin in prevention of preterm preeclampsia in subgroups of women according to their characteristics and medical and obstetrical history. Am J Obstet Gynecol. 2017 Nov;217(5):585.e1-585.e5. doi: 10.1016/j.ajog.2017.07.038. Epub 2017 Aug 4. Erratum in: Am J Obstet Gynecol. 2018 Feb 1;:. PubMed PMID: 28784417.
- Roberge S, Nicolaides K, Demers S, Hyett J, Chaillet N, Bujold E. The role of aspirin dose on the prevention of preeclampsia and fetal growth restriction: systematic review and meta-analysis. Am J Obstet Gynecol. 2017 Feb;216(2):110-120.e6. doi: 10.1016/j.ajog.2016.09.076. Epub 2016 Sep 15. Review. PubMed PMID: 27640943.
- Rolnik DL, Wright D, Poon LC, O'Gorman N, Syngelaki A, de Paco Matallana C, Akolekar R, Cicero S, Janga D, Singh M, Molina FS, Persico N, Jani JC, Plasencia W, Papaioannou G, Tenenbaum-Gavish K, Meiri H, Gizurarson S, Maclagan K, Nicolaides KH. Aspirin versus Placebo in Pregnancies at High Risk for Preterm Preeclampsia. N Engl J Med. 2017 Aug 17;377(7):613-622. doi: 10.1056/NEJMoa1704559. Epub 2017 Jun 28. PubMed PMID: 28657417.
- Rotchell YE, Cruickshank JK, Gay MP, Griffiths J, Stewart A, Farrell B, Ayers S, Hennis A, Grant A, Duley L, Collins R. Barbados Low Dose Aspirin Study in Pregnancy (BLASP): a randomised trial for the prevention of pre-eclampsia and its complications. Br J Obstet Gynaecol. 1998 Mar;105(3):286-92. PubMed PMID: 9532988.
- Schünemann H, Brozek J, Guyatt G, Oxman A, editors. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013 [geraadpleegd 2018 Feb 12]. Beschikbaar via: guidelinedevelopment.org/handbook.
- Vainio M, Kujansuu E, Iso-Mustajärvi M, Mäenpää J. Low dose acetylsalicylic acid in prevention of pregnancy-induced hypertension and intrauterine growth retardation in women with bilateral uterine artery notches. BJOG. 2002 Feb;109(2):161-7. PubMed PMID: 11888098.
- Xu TT, Zhou F, Deng CY, Huang GQ, Li JK, Wang XD. Low-Dose Aspirin for Preventing Preeclampsia and Its Complications: A Meta-Analysis. J Clin Hypertens (Greenwich). 2015 Jul;17(7):567-73. doi: 10.1111/jch.12541. Epub 2015 Apr 2. Review. PubMed PMID: 25833349.
- Zorginstituut Nederland. Farmacotherapeutisch Kompas (z.j.). [geraadpleegd 2018 Feb 12]. Beschikbaar via: https://farmacotherapeutischkompas.nl.
Evidence tabellen
Research question: Wat is de rol van acetyl salicylzuur, gestart ≤16 amenorroeduur, ter preventie van pre-eclampsie bij zwangere vrouwen?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Rolnik, 2017 |
Type of study: RCT (ASPRE trial)
Setting: multicentre study in 13 hospitals
Country: UK, Spain, Italy, Belgium, Greece, Israel
Source of funding: European Union Seventh Framework Program and the Fetal Medicine Foundation. |
Inclusion criteria: age >18 yrs, singleton pregnancy, live fetus at scanning 11-13 weeks, women who had a routine prenatal visit at 11-13 weeks of gestation and screened at high risk of PE (see comments for details)
Exclusion criteria: unconscious or severely ill, status, learning difficulties or serious mental illness, major fetal abnormality identified at the time that scanning was performed, regular treatment with aspirin within 28 days before treatment, bleeding disorders, peptic ulceration, hypersensitivity to aspirin, long-term use of nonsteroidal anti-inflammatory medication and participation in another drug trial.
N total at baseline: Total: n=1776 I:n= 798 C: n= 822
Important prognostic factors2: For example age (IQR): I:31.5 (27.3-35.8) C:31.4 (26.9-35.8)
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
150mg/day Aspirin (from 11-14wks of gestation) |
Describe control (treatment/procedure/test):
Placebo (from 11-14wks of gestation) |
Length of follow-up: until 36 weeks of gestation
Loss-to-follow-up: 152 (8,6%) withdrew consent after randomization, 4 were lost to follow-up.
Intervention: N 78 withdrew consent, 2 lost to follow-up (9,1%) Reasons (describe)
Control: N 74 withdrew consent, 2 lost to follow-up (8,5%) Reasons (describe)
Incomplete outcome data: See lost to follow-up.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Incidence of preeclampsia (PE): I: 13 out of 798 (1,6%) C: 35 out of 822 (4,3%) Adjusted OR in the aspirin group [95% CI]: 0.38 [95% CI 0.20 – 0.74], p-value 0.004. |
Authors conclusion: treatment with low dose aspirin in women at high risk of preterm preeclampsia resulted in a lower incidence of the diagnosis than placebo.
Definition of high-risk PE was defined based on an algorithm that combines maternal actors, mean arterial pressure, uterine-artery pulsatility index, maternal serum pregnancy-associated plasma protein A and placental growth factor. |
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Research question: Wat is de rol van acetyl salicylzuur, gestart ≤16 ammenoroeduur, ter preventie van pre-eclampsie bij zwangeren?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Roberge, 2017
Study characteristics and results are extracted from the SR (unless stated otherwise by*) |
SR and meta-analysis of RCTs
Literature search up to 2015
A: Benigni, 1989 B: Caritis, 1998 C: Zhao, 2012 D: Ebrashy, 2005 E: Odibo, 2015 F: Ayala, 2013 G: August, 1994 H: Azar, 1990 I: Michael, 1992 J: Villa, 2013 K: Hermida, 1997
Setting and Country: not reported
Study design: RCT
Source of funding: non-commercial
|
Inclusion criteria SR: trials involving pregnant women randomized either to aspirin or to placebo/no treatment.
Exclusion criteria SR: other treatments, other designs, using the same population, or in which relevant data could not be extracted were excluded.
12 studies included
Important patient characteristics at baseline: N total= 5113 I: N= 2564 C: N= 2549
Number of participants, N: A: 33 B: 652 C: 237 D: 136 E: 30 F: 350 G: 54 H: 91 I: 110 J: 121 K: 107
Gestational age at entry (wks) A: 12 B: 13-16 C: 13-16 D: 14-16 E: 11-13 F: 12-16 G: 13-15 H: 16 I: <16 J: 13-14 K: 12-16
Groups comparable at baseline? Unclear |
Describe intervention:
Aspirin A: 60 mg/d B: 60 mg/d C: 75 mg/d D: 75 mg/d E: 80 mg/d F: 100 mg/d G: 100 mg/d H: 100 mg/d* I: 100 mg/d J: 100 mg/d K: 100 mg/d
*With dipyridamole 150-300 mg daily. |
Describe control:
A: placebo B: placebo C: placebo D: placebo E: placebo F: placebo G: placebo H: no treatment I: placebo J: placebo K: placebo
|
End-point of follow-up*: Not reported in SR
For how many participants were no complete outcome data available? * Not reported in SR
|
Outcome measure-1 Defined as incidence of preeclampsia (PE)
Effect measure: RR [95% CI]: A: not estimable B: 0.88 [95% CI 0.66 – 1.16] C: 1.05 [95% CI 0.69 – 1.60] D: 0.32 [95% CI 0.21 – 0.48] E: 0.88 [95% CI 0.21 – 3.66] F: 0.49 [95% CI 0.25 – 0.99] G: 0.63 [95% CI 0.17 – 2.33] H: 0.24 [95% CI 0.03 – 2.10] I: 0.20 [95% CI 0.02 – 1.66] J: 0.72 [95% CI 0.31 – 1.65] K: 0.43 [95% CI 0.12 – 1.56]
|
Author’s conclusion: this meta-analysis demonstrates a beneficial effect of prophylactic aspirin for the prevention of PE, severe PE, and FGR, which is conditional on the onset of treatment being at <16 weeks’ gestation and has a dose-response effect.
|
|
Xu, 2015
Study characteristics and results are extracted from the SR (unless stated otherwise by*)
|
SR and meta-analysis of 29 RCTs of which 7 RCTs initiated treatment 16 wks before gestation.
Literature search up to April 2014
A: Ebrashy, 2005 B: Vainio, 2002 C: Chiaffarino, 2004 D: Ayala, 2013 E: Zhao, 2012 F: Villa, 2013
Study design: All studies are RCTs
Setting and Country: not reported
Source of funding: commercial / non-commercial: supported by the key-technology R&D lab
|
Inclusion criteria SR: RCTs, published or unpublished, comparing LDA with placebo or no treatment in early pregnancy risk for PE (see comments for details)
Exclusion criteria SR: quasi-random studies or cluster-randomized trials
6 studies included relevant for PICO 3
Important patient characteristics at baseline: Number of participants (N) A: 139 B: 90 C: 40 D: 208 E: 350 F: 242 G: 152
Gestational age at entry (wks) A: 14 B:12-14 C: <14 D: 15 E: 12-16 F: 13-16 G: 12-13 (+6)
Groups comparable at baseline? unclear |
Describe intervention:
Aspirin A: 75mg B: 0,5mg/kg/d C: 100mg D: 100mg E: 75mg F: 100mg
|
Describe control:
A: no treatment B: placebo C: no treatment D: placebo E: placebo F: placebo
|
End-point of follow-up: Up until delivery
For how many participants were no complete outcome data available? Completion percentage (%) A: 100 B: 95.6 C: 87.5 E: 100 F: 98 G: 80
|
Outcome measure-1 Defined as incidence of preeclampsia (PE)
Effect measure of individual studies not reported.
Pooled effect (fixed effects model) including all studies: OR 0.37 [95% CI 0.27 to 0.50] favoring the aspirin group. Heterogeneity (I2): 44%
*Chiaffarino 2004 did not separately describe the pre-eclampsia incidence, but combined this with hypertension incidence. Therefore, this data was not pooled in the meta-analysis.
|
Facultative: Only the studies included that initiated treatment 16 weeks before gestation.
Author’s conclusion: prophylactic LDA, especially when initiated before 16 gestational weeks, is effective at preventing PE.
Risk of PE was defined as one of the following: - clinical high-risk factors e.g. antiphospholipid syndrome, chronic renal disease, hypertension, diabetes mellitus, history of PE in previous pregnancies, family history of PE, multiple pregnancies, SBP ≥130 mmHg or DBP ≥ 80 mmHg in the first trimester. - abnormal findings on uterine artery Doppler ultrasound indicating the presence of unilateral or bilateral diastolic notch, a high resistance index, or high pulsatility index. - a positive rollover test, defined as an increase of >15 mmHg in DBP when woman rolls form left side onto back. - a positive angiotensive sensitivity test, defined as an effective presser dose >10 ng/kg/min when DBP increases >20 mmHg
|
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Rolnik, 2017 |
Eligible women were randomly assigned in a 1:1 ratio, with the use of a Web-based system, with stratification for treatment center. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097;
doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Roberge, 2017 |
Yes |
Yes |
No |
Yes |
NA |
Yes |
Yes |
Yes |
Yes |
|
Xu, 2015 |
Yes |
Yes |
No |
Yes |
NA |
Yes |
Yes |
unclear |
Yes |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-04-2019
Beoordeeld op geldigheid : 14-12-2018
Bij het opstellen van de module heeft de werkgroep een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijnmodule komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
|
Module[1] |
Regiehouder[2] |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn[3] |
Frequentie van beoordeling op actualiteit[4] |
Wie houdt er toezicht op actualiteit[5] |
Relevante factoren voor wijzigingen in aanbeveling[6] |
|
Rol van acetyl salicylzuur ter preventie pre-eclampsie bij zwangere vrouwen |
NVOG |
2018 |
2023 |
Minstens eens in 5 jaar |
Regie voerende vereniging |
Ontwikkelingen op gebied van screenen op risicofactoren d.m.v. biomarkers en uterinea afwijkingen. |
De gebruikers van de richtlijnmodule delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Consultatie
De Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) en Nederlandse Vereniging voor Kindergeneeskunde (NVK) hebben concepttekst ter beoordeling ontvangen.
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep:
- F.M van Dunné, gynaecoloog, Haaglanden MC, den Haag, Nederlandse Vereniging voor Obstetrie & Gynaecologie
- Dr. R.H. Stigter, gynaecoloog, Deventer Ziekenhuis, Nederlandse Vereniging voor Obstetrie & Gynaecologie
- Dr. M.T.M. Franssen, gynaecoloog, UMC Groningen, Nederlandse Vereniging voor Obstetrie & Gynaecologie
- Dr. M. Sueters, gynaecoloog, LUMC, Leiden, Nederlandse Vereniging voor Obstetrie & Gynaecologie
Meelezers:
- Leden van de Otterlo werkgroep (2016-2018)
Met ondersteuning van:
- A. Rozeboom, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten (tot november 2017)
- Dr. A. Vaes, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Dr. E.M.E. den Breejen, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de NVOG.
Inbreng patiëntenperspectief
Met de Patiëntenfederatie Nederland heeft gedurende het ontwikkelproces contact plaatsgevonden over het patiëntenperspectief. De conceptrichtlijn is voor commentaar voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze module is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based module tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
De Otterlo werkgroep inventariseerde de knelpunten, stelde een long list met knelpunten op en prioriteerde de knelpunten.
Uitgangsvraag en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse is door de werkgroepleden en de adviseur een uitgangsvraag opgesteld. Vervolgens inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Aan de hand van specifieke zoektermen werd gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De geselecteerde databases waarin is gezocht en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie is opvraagbaar bij de Richtlijnendatabase, zie het tabblad ‘Zoekverantwoording’ voor verdere details.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB)-tabellen. Het gebruikte RoB-instrument (AMSTAR – voor systematische reviews) is een gevalideerd instrument dat wordt aanbevolen door de Cochrane Collaboration.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Indien van toepassing: bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt)relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij één van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en deze worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt, de kosten, de beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Bij de ontwikkeling van de module is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Randvoorwaarden die van invloed zijn op de implementatie van de aanbeveling zijn opgenomen in de implementatietabel.
Kennislacunes
Tijdens de ontwikkeling van deze module is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvraag. Er is nagegaan of (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Mocht dit bij deze module het geval zijn, dan is er een aanbeveling voor het doen van onderzoek opgenomen in de bijlage Kennislacunes. Deze bijlage is te vinden onder de aanverwante producten.
Commentaar- en autorisatiefase
De conceptmodule werd aan de betrokken (wetenschappelijke) verenigingen, instanties en (patiënt)organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve module werd aan de NVOG en Patiëntenfederatie Nederland voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd. De commentaartabel is op te vragen bij het Kennisinstituut via secretariaat@kennisinstituut.nl
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van de Federatie Medisch Specialisten.
Zoekverantwoording
|
Uitgangsvraag: Is er een rol voor acetyl salicylzuur ter preventie van preeclampsie bij zwangeren P1) bij zwangeren met risicofactoren voor PE P2) zwangeren met risicofactoren voor PE, zonder PE in voorgeschiedenis? P3) zwangere multipara zonder risicofactoren voor PE? |
|
|
Database(s): Medline, Embase |
Datum: 03-08-2016 |
|
Periode: > 2007 |
Talen: Geen beperking |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 2007 – augustus 2016
Updated 1 nov 2017
|
1 exp Aspirin/ or aspirin*.ab,ti. or acetylsalicylic.ab,ti. or antiplatelet*.ab,ti. (75531) 2 exp Pre-Eclampsia/ or preeclampsia.ab,ti. or 'pre eclampsia.ab,ti. (35316) 3 1 and 2 (845) 4 limit 3 to yr="2007 -Current" (341) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (293113) 6 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1601477) 7 4 and 5 (63) 8 4 and 6 (111) 9 7 or 8 (130)
= 130 (121 uniek) |
407 + 48 (update 1 nov 2017) |
|
Embase (Elsevier) |
'acetylsalicylic acid'/exp OR aspirin*:ab,ti OR acetylsalicyclic:ab,ti OR 'antithrombocytic agent'/exp OR antiplatelet*:ab,ti AND ('preeclampsia'/exp OR preeclampsia:ab,ti OR 'pre eclampsia':ab,ti) AND [2007-2016]/py
Gebruikte filters Systematische reviews: ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)
RCT’s: ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it),
= 387 (383 uniek) |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur, jaartal |
Redenen van exclusie |
|
Askie 2007 |
Voldoet niet aan de PICO |
|
Adkins, 2017 |
Secundaire analyse van Caritis, 1998 (welke al geïncludeerd). Tevens PE geen uitkomstmaat in deze publicatie |
|
Ayala 2012 |
Wordt beschreven in de geïncludeerde SR van Roberge, 2017 |
|
Bergeron 2015 |
Voldoet niet aan PICO |
|
Bujold 2009 |
Relevante studies worden beschreven in de SR van Roberge, 2017 of Xu, 2015 |
|
Bujold 2014 |
Relevante studies worden beschreven in de SR van Roberge, 2017 |
|
Duley 2007 |
Relevante studies worden beschreven in recentere SR van Roberge, 2017 |
|
Duley 2008 |
Voldoet niet aan de PICO |
|
Groeneveld 2013 |
Voldoet niet aan de PICO (IVF patiënten) |
|
Haapsemo 2010 |
Voldoet niet aan de PICO (IVF en ICSI patiënten) |
|
Euser 2016 |
Voldoet niet aan de PICO |
|
Jamal 2012 |
Voldoet niet aan PICO (patiënten met PCOS) |
|
Lambers 2009 |
Voldoet niet aan de PICO (IVF patiënten) |
|
Lefevre 2014 |
Richtlijn |
|
Liu, 2016 |
Studie methodologisch zwak, randomisatiemethode en startmoment interventie onduidelijk |
|
Meher, 2017 |
IPD meta-analye, echter includeert enkel (oude) studies met lage doseringen (gepubliceerd tussen 1985 en 2005). Aangezien de meeste van deze studies ook in de meta-analyse van Roberge 2017 opgenomen zijn is besloten deze studie te excluderen. |
|
Moore 2015 |
Secundaire analyse van Cantu 2015 (wordt onder 1e auteur Caritis, 1998 beschreven in de SR van Roberge 2017). |
|
Odibo, 2015 |
Data is opgenomen in de meta-analyse van Roberge, 2017 |
|
Papatheodorou, 2015 |
Editorial publicatie |
|
Roberge 2012 |
Relevante studies zijn al opgenomen in de meta-analyse van Roberge, 2017 |
|
Scazzocchio, 2017 |
Voldoet niet aan PICO |
|
Trivedi, 2011 |
Relevante studies zijn al opgenomen in de meta-analyse van Roberge, 2017 |
|
Talari 2014 |
Studie methodologisch zwak, geen correcte randomisatiemethode |
|
Villa 2012 |
Wordt beschreven in de geïncludeerde SR van Roberge, 2017 |
|
Bujold, 2010 |
Alle studies worden beschreven in recentere meta-analyses van Roberge, 2017 of Xu, 2015 |
|
Odibo, 2015 |
Wordt beschreven in de systematische review van Roberge, 2017 |
|
Cantu, 2015 |
Wordt beschreven in de systematische review van Roberge, 2017 (Caritis, 1998) |
|
Henderson, 2014 |
Relevante studies zijn al opgenomen in de meta-analyse van Roberge, 2017 of Xu, 2015 |
