Diagnostiek naar metastasen
Uitgangsvraag
- Wat zijn de indicaties voor beeldvormend onderzoek naar locoregionale metastasen?
- Wat zijn de indicaties voor beeldvormend onderzoek naar afstandsmetastasen?
- Welk beeldvormend onderzoek kan het beste worden verricht naar locoregionale en/of afstandsmetastasen?
Aanbeveling
- Palpeer bij laag-risico en intermediair-risico cPCC de regionale lymfeklieren en verricht alleen een echografie bij suspecte bevindingen
- Verricht in de diagnostische fase bij hoog-risico cPCC en bij laag- en intermediair risico cPCC met regionale lymfadenopathie en/of klinisch palpabele lymfeklieren een echografie die gecombineerd kan worden met een cytologische punctie van radiologisch suspecte lymfklieren, bij voorkeur in één sessie.
- Echografie wordt verricht door een radioloog die bekwaam is met deze procedure in het betreffende gebied.
- Vermeldt in de radiologieverslaglegging duidelijk welke lymfeklieren zijn onderzocht.
- Verricht een FDG PET-CT bij patiënten met lymfogeen gemetastaseerd cPCC als screeningsonderzoek naar afstandsmetastasen.
Overwegingen
Kwaliteit van het bewijs
De bewijskracht van de geïncludeerde studie van Tokez et al. (2022) was redelijk. Echter, de geïncludeerde literatuur richt zich enkel op echografie naar locoregionale metastasen bij hoogrisico cPCC in de hoofd-halsregio, waarbij het echo onderzoek en de echogeleide punctie verricht is in een tertiair verwijzingscentrum voor hoofd-hals tumoren. Dat betekent ook dat de literatuurconclusies ons slechts beperkt ondersteunen in het schrijven van aanbevelingen en de expert opinion en/of overige artikelen hierbij een belangrijke ondersteunende of mogelijk doorslaggevende rol hebben.
Balans van gewenste en ongewenste effecten
Het nadeel van een hoge sensitiviteit van echografie voor detectie van lymfkliermetastasen bij patiënten met een cPCC is dat dit gepaard kan gaan met een lage positief voorspellende waarde (Tokez 2022). De radioloog die het onderzoek verricht wil bij patiënten die komen voor een stadiëringsonderzoek geen lymfklierbetrokkenheid missen (sensitieve leesstrategie) hetgeen kan resulteren in een laagdrempelig gebruik van echogeleide FNAC met relatief veel negatieve resultaten (overbodige cytologische puncties). Door echografie alleen in te zetten bij patiënten met een hogere à priori kans op het hebben van lymfkliermetastasen (hoog-risico cPCC), kan het aantal overbodige cytologische punctie beperkt worden.
Daarentegen kan een lagere sensitiviteit leiden tot fout-negatieve uitslagen waardoor een lymfkliermetastase mogelijk pas in een later stadium ontdekt wordt. Het is daarom van belang om de lymfklierstadiering middels echografie en FNAC te laten verrichten door radiologen in een centrum met ervaring in het diagnosticeren en behandelen van hoog-risico cPCC.
Professioneel perspectief
Detectie van lymfkliermetastasen bij cPCC heeft impact op de prognose en behandeling, door uitbreiding van de behandeling met lymfeklierdissectie en eventueel toevoegen van (postoperatieve) radiotherapie. De beschikbare literatuur over stadiëringsonderzoek voor cPCC is echter beperkt, wat de mogelijkheid voor een evidence based advies beperkt. De initiële evaluatie van de drainerende lymfklierstations wordt door middel van palpatie verricht. Daarbij is het van belang kennis te hebben van drainagepatronen van het lymfesysteem en rekening te houden met contralaterale lymfkliermetastasen bij tumoren die in de midline gelegen zijn. De betrouwbaarheid van palpatie (sensitiviteit van rond de 50%) is laag (Tokez 2022, Mishra 2016), aangezien kleine lymfkliermetastasen niet altijd te palperen zijn en sommige lymfklierstations in het lichaam (bijvoorbeeld de lymfeklieren in de glandula parotis) niet altijd even makkelijk voelbaar zijn. Het toevoegen van echografie in de lymfklierstadiering van cPCC in combinatie met een FNAC van suspecte lymfklieren verhoogt de sensitiviteit van het stadieringsonderzoek. Echter, bij veelvoorkomend laag-risico primair cPCC die geen palpabele lymfklieren hebben, wordt er geen routinematige screening van de lymfklieren aanbevolen. Het gebruik van beeldvorming voor stadiering wordt aanbevolen voor patiënten met een hoog-risico cPCC, en bij laag- en intermediair-risico cPCC met regionale lymfadenopathie en/of klinisch palpabele lymfeklieren. Echografie dient te worden gecombineerd met FNAC (Stratigos 2023, Fox 2019).
Beeldvormingsmethoden zoals echografie, computertomografie (CT) of positronemissietomografie-CT (PET-CT) zijn gevoeliger dan klinisch onderzoek bij het detecteren van lymfeklierbetrokkenheid. In een meta-analyse die zich richtte op patiënten met plaveiselcelcarcinoom van het hoofd-hals gebied (niet specifiek cPCC), werden verschillende beeldvormingsmodaliteiten geëvalueerd, waaronder echografie, echogeleide FNAC, CT en MRI voor het detecteren van lymfekliermetastasen. Echogeleide FNAC toonde de hoogste diagnostische odds ratio (DOR), en echografie presteerde beter dan MRI, met een gemiddelde sensitiviteit van 87% en specificiteit van 98%. Er waren echter slechts twee studies waarin een klinisch N0-hals werden geëvalueerd. (Bondt 2007)
In een review naar het detecteren van lymfeklierbetrokkenheid bij cPCC door Fox et al. (2018) werd gesteld dat, ondanks de beperkte bewijskracht, echografie een hogere DOR, sensitiviteit en specificiteit dan MRI en CT lijkt te hebben. Daarbij is een gelijktijdige cytologische punctie van toegevoegde waarde wanneer een pathologische lymfeklier is vastgesteld.
Eggermont et al. (2023) voerden een retrospectieve multicenter cohort studie uit naar de invloed op morbiditeit van vroegtijdig routinematig screenend onderzoek naar lymfekliermetastasen door middel van echografie in cPCC van het hoofd-hals gebied vergeleken met klinische diagnostisering. De studie liet zien dat er op baseline een laag aantal lymfekliermetastasen werden gevonden en dat deze met name uit het zelfonderzoek van de patiënt kwam tijdens de follow-up periode. De onderzoekers stelden dat er een prospectief onderzoek naar de juiste timing van routinematig echografisch onderzoek van toegevoegde waarde zou zijn.
Gezien het feit dat lymfekliermetastasen van cPCC meestal oppervlakkiger gelegen zijn en daarom gemakkelijker te detecteren kunnen zijn op echografie in vergelijking met mucosaal-PCC, kunnen ervaren radiologen die echografisch onderzoek verrichten een veelbelovende, kosteneffectieve en minimaal invasieve stadiëringsmodaliteit bieden voor het evalueren van lymfeklieren. Daarbij is het van belang dat de radioloog kennis heeft van drainagepatronen van het lymfesysteem (bijvoorbeeld lymfklieren in de glandula parotis bij tumoren op de scalp) en rekening te houden met contralaterale lymfkliermetastasen bij tumoren die in de midline gelegen zijn.
Afstandsmetastasen
Bij patiënten met een lymfogeen gemetastaseerd cPCC moet beeldvorming naar afstandsmetastasen verricht worden. Deze diagnostiek vindt plaats met een PET/CT scan. Bij het verrichten van screeningsonderzoek voor uitzaaiingen op afstand is het belangrijk te realiseren dat er toevalsbevindingen kunnen zijn op de PET-CT scan, die vervolgens een cascade van extra diagnostische onderzoeken kan initiëren. Het is belangrijk dit vooraf met de patiënt te bespreken. Patiënten met een gemetastaseerd cPCC dienen te worden besproken in een multidisciplinair overleg, inclusief een radioloog/nucleair geneeskundige, om correcte interpretatie van de beeldvorming te garanderen.
Verslaglegging
De werkgroep geeft aan dat er soms verwarring bestaat over welke lymfeklieren zijn onderzocht bij echografische onderzoek. Het is van belang dat dit duidelijk in de verslaglegging staat. Gestructureerde verslaglegging kan hierbij behulpzaam zijn.
Waarden en voorkeuren van patiënten
Het is van belang om samen met de patiënt de inzet van aanvullende beeldvorming naar afstandsmetastasen te bespreken en samen een goed afgewogen beslissing te maken. Afhankelijk van de behandelprioriteiten van de patiënt, de aanwezige comorbiditeiten, de (relatieve) contra-indicaties, de voor- en nadelen van de verschillende typen beeldvorming en de uitgebreidheid van het daaropvolgende beleid kan deze beslissing gemaakt worden.
Aanvaardbaarheid en haalbaarheid
Een echografie is vaak gemakkelijk en tegen relatief lage kosten beschikbaar in tegenstelling tot andere diagnostische modaliteiten als CT, MRI en PET-CT.
Onderbouwing
Achtergrond
Als het klinisch onderzoek indicaties geeft voor lymfekliermetastasen, wordt routinematig aanvullend beeldvormend onderzoek naar regionale metastasen uitgevoerd. Het belang van routinematige lymfeklierscreening middels beeldvorming bij patiënten met cutaan plaveiselcelcarcinoom (cPCC) en het type beeldvormend onderzoek met de beste diagnostische accuratesse, is echter niet duidelijk. Hoewel het gebruikelijk is om een echografie aan te vragen bij verdachte klinische onderzoeksresultaten, bestaat er onduidelijkheid of beeldvormend onderzoek ook een toegevoegde waarde heeft als er geen palpabele lymfeklieren aanwezig zijn (klinisch N0). In deze module wordt de diagnostische accuratesse van beeldvormend onderzoek naar locoregionale metastasen en afstandsmetastasen onderzocht bij patiënten met cPCC.
Conclusies / Summary of Findings
|
Redelijk
|
Uitkomstmaat: Sensitiviteit
Er is redelijke zekerheid dat echografie de meeste tot alle mensen met de diagnose locoregionale metastasen identificeert (sensitiviteit), maar tegelijk resulteert in een aanzienlijk aandeel onterecht positieven (lage positief voorspellende waarde).
Tokez et al. (2022) |
|
Redelijk
|
Uitkomstmaat: Specificiteit
Er is redelijke zekerheid dat echografie de meeste tot alle mensen zonder locoregionale metastasen identificeert (specificiteit), en resulteert in een klein deel onterecht negatieve diagnoses (hoge negatief voorspellende waarde).
Tokez et al. (2022) |
Voor de richtlijn Plaveiselcelcarcinoom 2024 is de Britse richtlijn als uitgangspunt gebruikt (Keohane, 2020). De GRADE evidence tabellen van de studies die geïncludeerd werden door Keohane et al. (2020) zijn te vinden in het supplement van de originele publicatie:
Keohane, S. G., Botting, J., Budny, P. G., Dolan, O. M., Fife, K., Harwood, C. A., Mallipeddi, R., Marsden, J. R., Motley, R. J., Newlands, C., Proby, C., Rembielak, A., Slater, D. N., Smithson, J. A., Buckley, P., Fairbrother, P., Hashme, M., Mohd Mustapa, M. F., Exton, L. S., & British Association of Dermatologists’ Clinical Standards Unit (2021). British Association of Dermatologists guidelines for the management of people with cutaneous squamous cell carcinoma 2020. The British journal of dermatology, 184(3), 401–414. https://doi.org/10.1111/bjd.19621
Supplement beschikbaar via: https://academic.oup.com/bjd/article/184/3/401/6702204?login=true#387350142
Tokez, 2022. Vraagstelling: Moet beeldvormende techniek (echo/CT/PET) gebruikt worden voor de diagnose van regionale en afstandsmetastase bij patiënten met PCC?
Explanations
a. There were some concerns with respect to the reference standard.
b. There were only 20 patients with the indication.
Samenvatting literatuur
Na toepassing van de selectiecriteria op titel en samenvatting werd voor de referenties het volledige artikel opgezocht. Na beoordeling van de volledige artikel werd uiteindelijk één studie definitief geïncludeerd.
Beschrijving van de studies
Tokez et al. (2022) voerden een retrospectieve cohortstudie uit, waarbij 233 opeenvolgende patiënten met 246 hoog-risico PCC’s werden geïncludeerd (T2-tumor en hoger of een T1-tumor met lokalisatie aan het oor of de lip, geclassificeerd volgens het stadiëringssysteem van de AJCC Cancer Staging Manual (7e editie; AJCC-7)).
Patiënten kwamen in aanmerking voor de studie wanneer een dermatoloog echografisch onderzoek van het hoofd-halsgebied aanvroeg of wanneer een patiënt werd besproken door het multidisciplinaire hoofd-hals team. Wanneer voor deze patiënten een routinematig echografisch onderzoek voor PCC van het hoofd en de hals werd uitgevoerd, werden de resultaten opgenomen in de dataset.
Patiënten werden uitgesloten als ze een niet-cutaan PCC, cPCC buiten het hoofd-halsgebied of cPCC met metastase hadden die elders histopathologisch was gediagnosticeerd.
Bij alle patiënten met een vermoedelijk cPCC in het hoofd-hals gebied vond klinische evaluatie van hun regionale lymfeklieren plaats conform de toen geldende Nederlandse richtlijn (2018): observatie en palpatie van de speekselklieren en alle lymfeklierniveaus van de cervicale regio. Vervolgens werd echografie uitgevoerd door een radioloog. Echografisch onderzoek omvatte alle lymfeklierniveaus van de hals (niveaus I-VI; de niveaus die overeenkomen met die voor het cervicale gebied) aan beide zijden, evenals een evaluatie van lymfeklieren in de glandula parotis. Vervolgens vond een echogeleide FNAC plaats bij alle patiënten bij wie lymfadenopathie werd gedetecteerd tijdens klinisch onderzoek en bij alle patiënten bij wie 1 of meer verdachte lymfeklieren werden gedetecteerd op echografie. De criteria die werden gebruikt voor verdachte lymfeklieren op echografie waren een korte-as diameter groter dan 5 tot 6 mm (afhankelijk van het lymfklierniveau in de hals), ronde in plaats van ovale vorm, afwezigheid van een vethilus of aanwijzingen voor extranodale extensie.
Een lymfkliermetastase werd gedefinieerd als een cytologisch bevestigde metastase, gedetecteerd door FNAC op baseline of binnen 6 maanden follow-up.
De 6 maanden follow-up diende als validatieperiode voor het gebruik van FNAC als referentiestandaard om een mogelijk fout-negatief resultaat op te sporen. Als de FNAC onvoldoende materiaal opleverde voor een degelijke cytologische beoordeling, werd de procedure herhaald totdat er een definitieve conclusie kon worden getrokken.
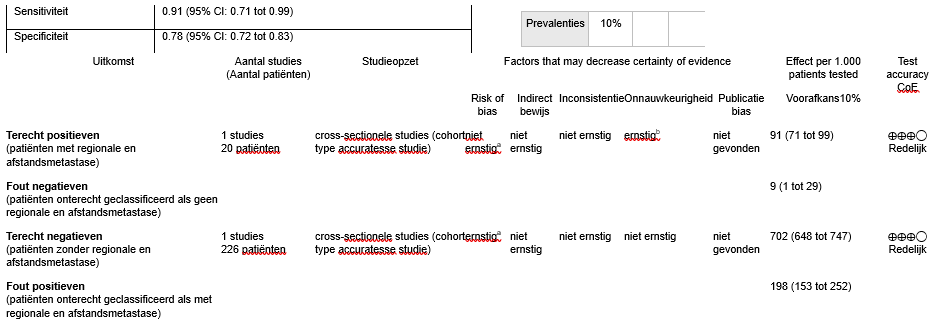
Accuratesse
In de studie van Tokez et al. (2022) werd bij 20/246 plaveiselcelcarcinomen (8,1%) verdachte lymfklieren waargenomen bij klinisch onderzoek, die aanleiding gaven om een echo onderzoek te verrichten. Daarvan bleken er bij 11/20 lymfekliermetastasen te zijn na een echogeleide FNAC. De 9 fout-positieve resultaten bij klinisch onderzoek kwamen overeen met sialoadenitis, een cysteuze laesie in de schildklier en granulerende of abces-achtige ontstekingen.
De sensitiviteit van klinisch onderzoek was 50% (95% BI 28% tot 72%) en de specificiteit 96% (95% BI 93% tot 98%). De positief voorspellende waarde (PVW) en negatief voorspellende waarde (NVW) waren respectievelijk 55% (95% BI 36% tot 72%) en 95% (95% BI 93% tot 97%).
Verdachte lymfeklieren werden op echografie gevonden in 70/246 gevallen (28,5%); bij 20 van deze patiënten werd lymfekliermetastase bevestigd door een FNAC-biopsie. In 9/75 FNAC-procedures produceerde de initiële FNAC onvoldoende materiaal voor goed cytologisch onderzoek; na herhaling van de FNAC-procedure werd bij 1 extra patiënt metastase vastgesteld. De sensitiviteit van baseline echografie voor de totale groep was 91% (95% BI 71% tot 99%), en de specificiteit was 78% (95% BI 72% tot 83%). De PVW van baseline echografie was 29% (95% BI 23% tot 35%), en de NVW was 99% (95% BI 96% tot 100%).
Bijwerkingen / nadelige consequenties van de test
Tokez et al. (2022) vonden geen bijwerkingen als gevolg van de index- of referentietest (Tokez, 2021).
Risk of bias
Hieronder zijn bondig de resultaten beschreven.
De studie van Tokez et al. (2022) had een valide studieopzet wat resulteert in een laag tot gemiddeld risico op bias. De enige beperkingen zijn onvermijdelijk maar kunnen wel tot vertekening leiden: de klinische observatie en de echografie hebben geen expliciete afkapwaarde. Daarnaast was er een afhankelijkheid tussen de uitslag van de indextest, echografie, en het toepassen van de referentiestandaard (FNAC).
Zoeken en selecteren
Tot en met 24 februari 2022 is in de databases Medline en Embase gezocht naar literatuur. De zoekactie beperkte zich tot Engelstalige en Nederlandse literatuur zonder beperking op publicatiedatum.
Voor de onderzoeksvraag is de volgende afbakening gebruikt:
P: Patiënten met cPCC en een indicatie voor onderzoek naar regionale en afstandsmetastasen.
I: Echo/CT/PET
C: Pathologische bevestiging
O: Accuratesse (sensitiviteit en specificiteit)
In- en exclusiecriteria
De literatuur is systematisch geselecteerd op basis van vooraf gestelde criteria. Deze criteria luiden als volgt:
- Patiënten met een risico op/bewezen cPCC
- Er wordt een beeldvormend onderzoekstechniek onderzocht
- De uitkomsten van de index-test zijn vergeleken met de uitkomsten van een referentiestandaard
- Accuratesse uitkomsten zijn gerapporteerd of herleidbaar.
Referenties
- de Bondt, R. B., Nelemans, P. J., Hofman, P. A., Casselman, J. W., Kremer, B., van Engelshoven, J. M., & Beets-Tan, R. G. (2007). Detection of lymph node metastases in head and neck cancer: a meta-analysis comparing US, USgFNAC, CT and MR imaging. European journal of radiology, 64(2), 266-272. https://doi.org/10.1016/j.ejrad.2007.02.037
- Eggermont, C., Nené, L. E. H., Koekelkoren, F. H. J., van der Toorn, Y. R., Snetselaar, L. D., Kroah-Hartman, M., Genders, R. E., Kelleners-Smeets, N. W. J., Hollestein, L. M., van Kester, M. S., & Wakkee, M. (2023). The impact of routine ultrasonography on nodal metastasis in head and neck cutaneous squamous cell carcinoma: A retrospective multicentre cohort study. Journal of the European Academy of Dermatology and Venereology : JEADV, 37(9), e1136-e1140. https://doi.org/10.1111/jdv.19150
- Fox, M., Brown, M., Golda, N., Goldberg, D., Miller, C., Pugliano-Mauro, M., Schmults, C., Shin, T., Stasko, T., Xu, Y. G., Nehal, K., High Risk Squamous Cell Carcinoma Workgroup, & Dermatologic Surgery Section of the Association of Professors of Dermatology (2019). Nodal staging of high-risk cutaneous squamous cell carcinoma. Journal of the American Academy of Dermatology, 81(2), 548-557. https://doi.org/10.1016/j.jaad.2018.09.006
- Mishra, N., Rath, K. C., Upadhyay, U. N., Raut, S., Baig, S. A., & Birmiwal, K. G. (2016). Preoperative evaluation of cervical lymph nodes for metastasis in patients with oral squamous cell carcinoma: A comparative study of efficacy of palpation, ultrasonography and computed tomography. National journal of maxillofacial surgery, 7(2), 186-190. https://doi.org/10.4103/0975-5950.201368
- Stratigos, A. J., Garbe, C., Dessinioti, C., Lebbe, C., van Akkooi, A., Bataille, V., Bastholt, L., Dreno, B., Dummer, R., Fargnoli, M. C., Forsea, A. M., Harwood, C. A., Hauschild, A., Hoeller, C., Kandolf-Sekulovic, L., Kaufmann, R., Kelleners-Smeets, N. W., Lallas, A., Leiter, U., Malvehy, J., ...EADO, EDF, ESTRO, UEMS, EADV and EORTC (2023). European consensus-based interdisciplinary guideline for invasive cutaneous squamous cell carcinoma. Part 1: Diagnostics and prevention-Update 2023. European journal of cancer (Oxford, England : 1990), 193, 113251. Advance online publication. https://doi.org/10.1016/j.ejca.2023.113251
- Tokez, S., Koekelkoren, F. H. J., Baatenburg de Jong, R. J., Grünhagen, D. J., Mooyaart, A. L., Nijsten, T., van der Lugt, A., & Wakkee, M. (2022). Assessment of the Diagnostic Accuracy of Baseline Clinical Examination and Ultrasonographic Imaging for the Detection of Lymph Node Metastasis in Patients With High-risk Cutaneous Squamous Cell Carcinoma of the Head and Neck. JAMA dermatology, 158(2), 151-159. https://doi.org/10.1001/jamadermatol.2021.4990
- Update 2022 hoofd-halstumoren richtlijn, beschikbaar via: https://radiologen.nl/sites/default/files/Kwaliteit/update_richtlijn_hoofd-halstumoren_10_modules_-_tranche_2.pdf
Evidence tabellen
Risico op bias tabellen
Voor de richtlijn Plaveiselcelcarcinoom 2024 is de Britse richtlijn als uitgangspunt gebruikt (Keohane, 2020). De risk of bias analyse van de studies die geïncludeerd werden door Keohane et al. (2020) zijn te vinden in het supplement van de originele publicatie:
Keohane, S. G., Botting, J., Budny, P. G., Dolan, O. M., Fife, K., Harwood, C. A., Mallipeddi, R., Marsden, J. R., Motley, R. J., Newlands, C., Proby, C., Rembielak, A., Slater, D. N., Smithson, J. A., Buckley, P., Fairbrother, P., Hashme, M., Mohd Mustapa, M. F., Exton, L. S., & British Association of Dermatologists’ Clinical Standards Unit (2021). British Association of Dermatologists guidelines for the management of people with cutaneous squamous cell carcinoma 2020. The British journal of dermatology, 184(3), 401–414. https://doi.org/10.1111/bjd.19621
Supplement beschikbaar via: https://academic.oup.com/bjd/article/184/3/401/6702204?login=true#387350142
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 19-07-2024
Beoordeeld op geldigheid : 31-05-2024
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep grotendeels in stand gehouden. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update).
De Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) is regiehouder van deze richtlijn actinische keratose en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Aanleiding
In 2010 is de richtlijn ‘Plaveiselcelcarcinoom’ tot stand gekomen op initiatief van de Nederlandse Vereniging voor Dermatologie en Venereologie. In 2021 is het initiatief genomen om de richtlijn te herzien. Voor de herziening is dankbaar gebruikgemaakt van de Britse richtlijn: “British Association of Dermatologists guidelines for the management of people with cutaneous squamous cell carcinoma 2020” (Keohane, 2020).
Bij het interpreteren en toepassen van de richtlijn plaveiselcelcarcinoom zijn vooraf drie kanttekeningen te plaatsen. Ten eerste is er een gebrek aan gerandomiseerde klinische trials (RCT) voor de behandeling van het primaire plaveiselcelcarcinoom van de huid (cPCC). Ten tweede bestaat er een grote variatie in het maligne gedrag van de tumoren die binnen de histologische categorie van primair plaveiselcelcarcinoom van de huid vallen. Ten derde leven er onder de verschillende specialisten verschillende opvattingen over de behandeling van deze tumoren. Deze opvattingen worden beïnvloed door de variatie in belangstelling en verwijspatronen. Naast dermatologen in een tertiair verwijscentrum, krijgen ook plastisch chirurgen, kaakchirurgen en kno-artsen relatief meer tumoren verwezen met een hoog risico en agressieve groei, terwijl dermatologen werkzaam in perifere praktijken vooral relatief kleinere en minder agressieve tumoren op het spreekuur krijgen. Het is wenselijk om hoog-risico cPCC multidisciplinair te benaderen. De definitie van een hoog risico plaveiselcelcarcinoom is een belangrijk aandachtspunt van de huidige herziening.
Afbakening onderwerp en definitie
Het primaire plaveiselcelcarcinoom van de huid is een kwaadaardige tumor die ontstaat uit hoornvormende cellen van de epidermis. Het is plaatselijk invasief en heeft de potentie om te metastaseren naar andere organen van het lichaam. Deze richtlijn is beperkt tot de zorg rondom het plaveiselcelcarcinoom van de huid (inclusief peri-oculaire tumoren), dus het cutane plaveiselcelcarcinoom, en de huidcarcinomen van de lip (inclusief het lippenrood/ ‘vermillion border’).
Niet in deze richtlijn werden opgenomen:
- het plaveiselcelcarcinoom van de penis, vulva en anus;
- intra-epitheliale neoplasieën van de vulva (VIN);
- in-situplaveiselcelcarcinoom (de ziekte van Bowen);
- het plaveiselcelcarcinoom van slijmvliezen;
- actinische keratose
De richtlijn sluit aan op de volgende richtlijnen:
- Behandeling voorhuidpathologie, module premaligne voorhuidafwijking
- Premaligniteiten van de vulva
Initiatief
Tabel Overzicht betrokken partijen herziening richtlijn Plaveiselcelcarcinoom 2024
|
Overzicht betrokken partijen Plaveiselcelcarcinoom 2024 |
Zitting neming in werkgroep |
Knelpunten analyse |
Commentaarfase |
Autorisatie |
Opmerkingen |
|
Wetenschappelijke verenigingen |
|||||
|
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
X |
X |
X |
X |
|
|
Nederlands Oogheelkundig Gezelschap (NOG) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Heelkunde (NVVH) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Keel-Neus-Oorheelkunde (NVKNO) |
X |
|
X |
X |
|
|
Nederlandse Vereniging voor Nucleaire Geneeskunde (NVNG) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Pathologie (NVVP) |
X |
|
X |
X |
|
|
Nederlandse Vereniging voor Plastische Chirurgie (NVPC) |
X |
|
X |
X |
|
|
Nederlandse Vereniging voor Radiologie (NVvR) |
X |
|
X |
X |
|
|
Nederlandse Internisten Vereniging (NIV) |
X |
|
X |
X |
|
|
Nederlandse Vereniging voor Radiotherapie en Oncologie (NVRO) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) |
|
|
X |
X |
|
|
Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie (NVMKA) |
X |
X |
X |
X | |
|
Overige organisaties |
|
|
|
|
|
|
Verpleegkundigen & Verzorgenden Nederland (V&VN) |
X |
X |
X |
X |
|
|
Integraal Kankercentrum Nederland (IKNL) |
X |
|
X |
|
|
|
Nederlandse Associatie Physician Assistants (NAPA) |
X |
X |
X |
X |
|
|
Nederlandse Vereniging voor Psychosociale Oncologie (NVPO) |
|
|
X |
|
|
|
Nederlandse Vereniging van Huidtherapeuten (NVH) |
|
|
X |
X |
|
|
Nederlands Huisartsen Genootschap (NHG) |
|
|
X |
X |
|
|
Patiëntenverenigingen |
|||||
|
Huidkanker Stichting (HUKAS) |
X |
X |
X |
X |
|
|
HuidNederland (HuidNL) |
|
|
X |
X |
|
|
Nederlandse Federatie voor Kankerpatiëntenorganisaties (NFK) |
|
|
|
X |
|
|
Stakeholders |
|||||
|
Zorgverzekeraars Nederland (ZN) |
|
|
X |
|
|
|
Nederlandse Vereniging Ziekenhuizen (NVZ) |
|
|
X |
|
|
|
Nederlandse Federatie van Universitair Medische Centra (NFU) |
|
|
X |
|
|
|
Inspectie Gezondheidszorg en Jeugd (IGJ) |
|
|
X |
|
|
|
Zorginstituut Nederland (ZiN) |
|
|
X |
|
|
|
Vereniging innovatieve geneesmiddelen (VIG) |
|
|
X |
|
|
*alle partijen werden uitgenodigd voor de knelpuntenanalyse (invitational conference) en de commentaarfase.
Deelname aan de werkgroep en autorisatie wordt enkel aan de wetenschappelijke verenigingen, patiëntenverenigingen en overige organisaties voorgelegd.
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming gericht op het vaststellen van goed medisch handelen. De richtlijn geeft aanbevelingen over begeleiding en behandeling van patiënten met cutaan plaveisecelcarcinoom.
Doelgroep
De richtlijn is bestemd voor leden van de medische en paramedische beroepsgroep. Daartoe behoren onder andere: NVDV, NOG, NVVH, NVKNO, NWHHT, NVNG, NVVP, NVPC, NVvR, NIV, NFN, NVRO, NVOG, NVMKA, V&VN, IKNL, NAPA, NVH, NVPO. Voor huisartsen geldt primair de NHG-Standaard Verdachte huidafwijkingen, die aansluit op deze MDR. Voor patiënten werd informatie op thuisarts.nl ontwikkeld.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld. Bij het samenstellen van de werkgroep werd rekening gehouden met de geografische spreiding van de werkgroepleden en met een evenredige vertegenwoordiging van academische en niet-academische achtergrond. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel lid ontving gunsten met het doel de richtlijnen te beïnvloeden. Naast de afgevaardigden van de verschillende beroepsgroepen is er ook een patiëntenvertegenwoordiger betrokken geweest bij de ontwikkeling van de richtlijn.
|
Werkgroepleden – 2024 |
Vereniging |
|
Klara Mosterd (dermatoloog, voorzitter) |
NVDV |
|
Marlies Wakkee (dermatoloog, voorzitter) |
NVDV |
|
Marcus Muche (dermatoloog) |
NVDV |
|
Elsemieke Plasmeijer (dermatoloog) |
NVDV |
|
Mignon van den Elzen (aios dermatologie) |
NVDV |
|
Ronald de Keizer (oogarts) |
NOG |
|
Nicole Naus (oogarts) |
NOG |
|
Sanne Engelen (oncologisch chirurg) |
NVVH |
|
Saskia Konings (KNO-arts) |
NVKNO |
|
Lotje Zuur (hoofd-halschirurg) |
NVKNO |
|
Stefan Pool (nucleair geneeskundige) |
NVNG |
|
Antien Mooyaart (patholoog) |
NVVP |
|
Eveline Corten (plastisch chirurg) |
NVPC |
|
Pim de Graaf (radioloog) |
NVvR |
|
Hilde Jalving (internist-oncoloog) |
NIV |
|
Frank Hoebers (radiotherapeut) |
NVRO |
|
Roel Steenbakkers (radiotherapeut) |
NVRO |
|
Pim Schreuder (MKA-chirurg) |
NVMKA |
|
Cathelijn den Hartog (verpleegkundig specialist) |
V&VN |
|
Marieke Louwman (epidemioloog) |
IKNL |
|
Fabiënne de Jong (physician assistant dermatologie) |
NAPA |
|
Selin Tokez (co-assistent) |
NVDV |
|
Harun Jacobs van den Hof (patiëntvertegenwoordiger) |
HUKAS |
|
Ondersteuning werkgroep |
Vereniging |
|
Annefloor van Enst (epidemioloog) |
NVDV |
|
Carin Smit (arts-onderzoeker) |
NVDV |
|
Tenzin Methok Nlgisang (arts-onderzoeker) |
NVDV |
|
Diederik van Loon (arts-onderzoeker) |
NVDV |
|
Marit Stolting (arts-onderzoeker) |
NVDV |
|
Ying Chao Weng (arts-onderzoeker) |
NVDV |
|
Zekeriya Ciftci (arts-onderzoeker) |
NVDV |
|
Werkgroepleden – 2018 |
Vereniging |
|
Dr. G.A.M. Krekels (voorzitter) |
NVDV |
|
Dr. C.L.H. van Berlo |
NVvH/NVCO |
|
Dr. E. Corten |
NVPC |
|
Dr. G.F.H. Diercks |
NVVP |
|
Dr. P.A. van der Eerden |
KNO |
|
Dr. J.J.E. van Everdingen |
NVDV |
|
Mr. dr. E.R.M. de Haas |
NVDV |
|
Dr. M.F.C. de Jong |
NIV |
|
S. van der Kleij, MANP |
V&VN |
|
Dr. ir. W.J. Louwman |
IKNL |
|
Drs. A. Navran |
NVRO |
|
H. Sengers, MPA |
V&VN |
|
Prof. dr. L.E. Smeele |
NVMKA |
|
C. Westerlaken |
HPN |
|
Ondersteuning werkgroep |
Vereniging |
|
Drs. Y.Y. Chung |
Arts-onderzoeker NVDV (ondersteuning t/m december 2017) |
|
Drs. A.A.J. van der Sande |
Arts-onderzoeker NVDV (ondersteuning t/m december 2017) |
|
L. Teligui, MSc |
Arts-onderzoeker NVDV (ondersteuning vanaf januari 2018) |
|
Dr. J.B. Terra |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Overige contributors |
|
|
Joseph A. Califano, III, M.D. |
AJCC werkgroep-lid, Head and Neck Surgeon, Director Head and Neck Cancer Center, Vice Chief of Division of Otolaryngology, Department of Surgery, Moores Cancer Center, UC San Diego Health - La Jolla |
|
Raja R. Seethala, M.D.
|
AJCC werkgroep-lid, Head and Neck/Endocrine Pathologist, Director of the Head and Neck/Endocrine Pathology Center of Excellence, and Director of the Head and Neck/Endocrine Pathology Fellowship, UPMC Presbyterian, Pittsburgh |
|
Werkgroepleden – 2010 |
Vereniging |
|
Dr. G.A.M. Krekels (voorzitter) |
NVDV |
|
Dr. C.L.H. van Berlo |
NVvH/NVCO |
|
Dr. M. van Beurden |
NVOG |
|
Dr. M. Buncamper |
NVPC |
|
Dr. J.J.E. van Everdingen |
NVDV |
|
Dr. R. Haas |
NVRO |
|
Drs. B.G.F. Heggelman |
NVvR |
|
Prof. dr. S. Horenblas |
NVU |
|
Drs. I.M.A Joung/drs. A. Stoffer-Brink |
VIKC |
|
Dr. N.W.J. Kelleners-Smeets |
NVDV |
|
Dr. R. Kloos |
NOG |
|
Dr. J.A. Kummer |
NVVP |
|
Drs. F.W.J. Leeman |
NVDV |
|
Dr. P. Lohuis |
KNO |
|
Prof. dr. T.E.C. Nijsten |
NVDV |
|
Dr. L.E. Smeele |
NVMKA |
|
Dr. A. Visser |
NVPO |
|
L. Wientjens-Roex |
V&VN |
|
Ondersteuning werkgroep |
Vereniging |
|
Drs. R.J. Borgonjen |
NVDV |
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad.
De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van de NVDV.
Inbreng patiëntenperspectief
Er is aandacht besteed aan het patiëntenperspectief door de zitting neming van een patiënt in de werkgroep en de opname van een module over patiëntenvoorlichting. De Huidkanker Stichting is betrokken geweest bij de ontwikkeling van de richtlijn en zal in een later stadium ook ondersteunen in de ontwikkeling van nieuwe patiëntinformatie. De conceptrichtlijn is tevens voor commentaar voorgelegd aan leden van de Huidkanker Stichting en Huid Nederland.
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (gebaseerd op het stroomschema ontwikkeld door FMS).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst Raming |
Toelichting |
|
Diagnostiek naar metastasen |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven |
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn(module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. De richtlijn wordt via het internet verspreid onder alle relevante beroepsgroepen en ziekenhuizen en er zal in verschillende specifieke vaktijdschriften aandacht worden besteed aan de richtlijn. Tevens zal een samenvatting worden gemaakt. De voorlichtingsfolder van de NVDV zal worden afgestemd op de richtlijn. Het volledige implementatieplan is opgenomen in het bijlagedocument.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Onderstaand is de methode stapsgewijs beschreven.
Knelpuntenanalyse
In de voorbereidingsfase heeft een bijeenkomst plaatsgevonden waarvoor alle belanghebbenden zijn uitgenodigd. In deze bijeenkomst zijn knelpunten aangedragen door de werkgroepleden van de betrokken verenigingen.Tevens werden uitgenodigd Zorgverzekeraars Nederland (ZN), Nederlandse Vereniging Ziekenhuizen (NVZ), Zorginstituut Nederland (ZiNL), Vereniging Innovatieve Geneesmiddelen (VIG) en de Nederlandse Federatie van Universitair Medische Centra (NFU).
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse heeft de werkgroep uitgangsvragen opgesteld. Daarbij inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen en consultatie van experts. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. Literatuur is geselecteerd op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn per module beschreven. Zoekacties zijn per module opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
Voor alle hoofdstukken geldt dat de zoekstrategieën zijn uitgevoerd in de EMBASE database en Medline databas. Experts op het gebied van Plaveiselcelcarcinoom werden geraadpleegd voor eventuele ontbrekende artikelen en / of casereports.
De zoekactie is met behulp van de PICO-systematiek opgebouwd. De zoekvragen hebben de P als gemeenschappelijke onderdeel. De overige onderdelen van de PICO werden geformuleerd op basis van de uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen zijn overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs (2021)
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog
|
|
|
Redelijk
|
|
|
Laag
|
|
|
Zeer laag
|
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
C) Voor vragen over de waarde van meet- of classificatie-instrumenten (klinimetrie)
Deze instrumenten werden beoordeeld op validiteit, intra- (test-hertest) en inter-beoordelaarsbetrouwbaarheid, responsiviteit (alleen bij meetinstrumenten) en bruikbaarheid in de praktijk. (naar keuze: optie-1 ‘Bij ontbreken van een gouden standaard, werd een beoordeling van de bewijskracht van literatuurconclusies achterwege gelaten.’ Of optie-2 ‘De kracht van het wetenschappelijk bewijs werd bepaald met de generieke GRADE-methode’).
Beoordelen van het niveau van het wetenschappelijke bewijs (oude modules)
Bij de EBRO-methode (Evidence Based Richtlijn Ontwikkeling) wordt een andere classificatie voor de beoordeling van de kwaliteit van studies aangehouden (van Everdingen 2004). Hierbij ligt de belangrijkheid van de uitkomstmaten niet van tevoren vast en is er geen vastgelegde procedure voor upgraden en downgraden van bewijs, zoals die bij GRADE geldt.
|
Kwaliteit |
Interventie |
Diagnostisch accuratesse-onderzoek |
Schade/bijwerkingen*, etiologie, prognose |
|
A1 |
Systematische review van ten minste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controleonderzoek, cohortonderzoek) |
|
|
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Bij het werken volgens de EBRO-methode zijn op basis van de beschikbare literatuur een of meerdere conclusies geformuleerd. Afhankelijk van het aantal onderzoeken en de mate van bewijs is een niveau van bewijskracht toegekend aan de conclusie (van Everdingen 2004).
|
Niveau |
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
1 onderzoek van niveau A2 of ten minste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
1 onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in één of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overkoepelende bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overkoepelende conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk. Door gebruik te maken van de Guideline Development Tool werd het Evidence to decision framework conform GRADE methodiek toegepast. Alle werkgroepleden hebben systematisch antwoord gegeven op vragen over de grootte van het effect en grootte van negatieve consequenties, waarden en voorkeuren van de patiënt, kosten en kosteneffectiviteit, beschikbaarheid van voorzieningen, aanvaardbaarheid, en overwegingen voor subgroepen in de patiëntenpopulatie. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg
Indicatorontwikkeling
Er werden geen indicatoren ontwikkeld voor deze richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling beschreven (zie per module bijlagen Kennislacunes).
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Een richtlijn beschrijft wat goede zorg is, ongeacht de financieringsbron (Zorgverzekeringswet (Zvw), Wet langdurige zorg (Wlz), Wet maatschappelijke ondersteuning (Wmo), aanvullende verzekering of eigen betaling door de cliënt/patiënt). Opname van een richtlijn in een register betekent dus niet noodzakelijkerwijs dat de in de richtlijn beschreven zorg verzekerde zorg is. Informatie over kosten zoals beschreven in de richtlijn is gebaseerd op beschikbare gegevens ten tijde van schrijven.
Commentaar- en autorisatiefase
De conceptrichtlijn is aan de betrokken (wetenschappelijke) verenigingen, (patiënt) organisaties en stakeholders voorgelegd ter commentaar (zie ook tabel Overzicht betrokken partijen herziening richtlijn Plaveiselcelcarcinoom 2024). De commentaren zijn verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren is de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn is aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter autorisatie.
Literatuur
- Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
- Higgins JPT, Green S (editors). Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0 [updated March 2011]. The Cochrane Collaboration, 2011. Available from www.handbook.cochrane.org.
- Keohane SG, Botting J, Budny PG, Dolan OM, Fife K, Harwood CA, et a. British Association of Dermatologists’ Clinical Standards Unit. British Association of Dermatologists guidelines for the management of people with cutaneous squamous cell carcinoma 2020. Br J Dermatol. 2021 Mar;184(3):401-414. doi: 10.1111/bjd.19621. Epub 2021 Jan 18. Erratum in: Br J Dermatol. 2021 Sep;185(3):686. Erratum in: Br J Dermatol. 2022 Mar;186(3):596-597.
- Lydiatt WM, Patel SG, O'Sullivan B, Brandwein MS, Ridge JA, Migliacci JC et al. Head and Neck cancers-major changes in the American Joint Committee on cancer eighth edition cancer staging manual. CA Cancer J Clin 2017;67:122-37.
- Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit.. Online beschikbaar op http://richtlijnendatabase.nl/ Laatst geraadpleegd op [DATUM geraadpleegd voor concepttekst]
- Van Everdingen JJE, Burgers JS, Assendelft WJJ, et al. Evidence-based richtlijnontwikkeling. Bohn Stafleu Van Loghum 2004.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html