Non-farmacologische interventies (delier)
Uitgangsvraag
Wat is de waarde van non-farmacologische interventies ter preventie en behandeling van delier bij intensive-care-(IC)-patiënten?
Aanbeveling
Pas gebundelde non-farmacologische interventies toe om delier te voorkomen en IC-opnameduur te verkorten. Houd bij de toepassing rekening met de voorkeuren van de patiënt.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar het effect van non-farmacologische interventies die aanvullend op de standaardzorg werden uitgevoerd bij patiënten opgenomen op de IC. In deze module werd het effect hiervan op delier onderzocht. Voor effecten van non-farmacologische interventies op de slaapkwaliteit verwijzen we naar module Non-farmacologische interventies (slaap-waakritme). In deze module is uitgegaan van een situatie waarbij reeds aandacht was voor angst en pijn, conform de richtlijn Sedatie en analgesie op de IC.
Deze module omvat 8 publicaties die totaal 19 individuele studies beschreven. De studies onderzochten effecten van oordoppen, een combinatie van oordoppen en oogmaskers, muziek, slaap-waakritme interventies, familieparticipatie en verpleegkundige interventies. De patiëntpopulaties waren heterogeen en niet altijd goed beschreven. Het was niet altijd duidelijk beschreven of patiënten gesedeerd waren en of zij beademd werden. Dit zijn factoren die wel invloed hebben op de kans op een delier.
De incidentie van delier, de duur van een delier en de duur van de IC-opname werden gedefinieerd als cruciale uitkomstmaten en de adverse events, kwaliteit van leven en mortaliteit als belangrijke uitkomstmaten. De geïncludeerde studies hadden methodologische beperkingen (risk of bias). Aanvullend waren de studies binnen een categorie soms inconsistent (inconsistency) en waren de studies relatief klein met vaak brede betrouwbaarheidsintervallen (imprecision). De bewijskracht was daarom zeer laag voor enkele categorieën van interventies voor de cruciale uitkomstmaten voor een delier en de duur van de IC-opname. Daarmee is de algehele bewijskracht zeer laag.
De bewijskracht voor de cruciale uitkomstmaat incidentie van delier was laag, gekeken naar de interventies ter bevordering van het slaap-waakritme en gebundelde interventies. De literatuur suggereert dat de incidentie van delier mogelijk lager is in patiënten die een interventie ter bevordering van het slaap-waakritme dan wel gebundelde interventies ondergingen.
Verpleegkundige interventies en gebundelde interventies vertonen overlappende onderdelen. Onder andere bevorderen van slaap, mobiliseren en interventies ter oriëntatie komen in beide interventies terug.
De bewijskracht voor de cruciale uitkomstmaat duur van een delier was laag gekeken naar de interventies ter bevordering van het slaap-waakritme en gebundelde interventies. De literatuur suggereert dat de duur van een delier mogelijk vergelijkbaar is in patiënten die een interventie ter bevordering van slaap-waakritme dan wel gebundelde interventies ondergingen.
Onder andere bevorderen van slaap, mobiliseren en interventies ter oriëntatie komen in beide typen interventies terug. Voor beide typen interventies kan worden gesteld dat niet duidelijk is of deze interventies de delierduur verkorten door te voorkomen dat delier ontstaat, of door te helpen nadat het delier al is ontstaan. De populaties bevatten niet enkel patiënten die al delier hadden.
Voor de cruciale uitkomstmaat duur van IC-opname was de bewijskracht laag voor gebundelde interventies. De literatuur suggereert dat de duur van IC-opname mogelijk korter is in patiënten die een gebundelde interventies ondergingen. De bewijskracht van literatuur die mortaliteit beschreef in patiënten die een gebundelde interventies ondergingen, was zeer laag. Daarmee is de literatuur onzeker over het effect van deze interventies op mortaliteit. De geïncludeerde reviews en individuele RCTs beschreven geen resultaten voor de belangrijke uitkomstmaten kwaliteit van leven en adverse events.
Er werden geen nadelige gevolgen van non-farmacologische interventies beschreven. Echter, uit de literatuur is bekend dat deprivatie van licht en geluid, bijvoorbeeld door oordoppen en oogmaskers, wel nadelige gevolgen kan hebben (Simons, 2012; Daniel, 2015).
De recent gepubliceerde netwerk meta-analyse van Chen (2022) werd niet meegenomen in onze literatuurstudie, omdat dit design niet voldoet aan de selectiecriteria. Mochten we dit wel hebben gedaan dan zouden er 4 studies toegevoegd worden:
- Contreras, 2012; liet een positief effect zien van een gebundelde verpleegkundige interventies op de delierincidentie.
- Eghbali-Babadi, 2017; liet een positief effect van zien familieparticipatie op de delierincidentie.
- Rosa, 2019: liet geen effect zien van familieparticipatie op de delierincidentie.
- Munro, 2017: liet een positief effect zien van een re-oriëntatie interventie op delierduur.
Deze bevindingen bevestigen de conclusies die zijn getrokken in de samenvatting van de literatuur.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Er is veel kwalitatief onderzoek beschikbaar waarin de ervaringen van patiënten met delier worden beschreven (o.a. Belanger, 2011; Gaete Ortega, 2020). Hieruit blijkt steeds dat het delier een zeer ongewenst syndroom is, dat langdurig impact heeft op de levens van zowel de patiënten als hun naasten. Het voorkomen en behandelen van delier is dan ook vanuit patiëntperspectief uiterst belangrijk. De non-farmacologische interventies beschreven in deze literatuurstudie lijken niet belastend voor patiënten, zolang rekening wordt gehouden met de individuele wensen en voorkeuren van patiënten. Zo wil de ene patiënt wel graag oordoppen gebruiken, terwijl een ander dit absoluut niet wil. Dit vraagt dus gepersonaliseerde aandacht voor toepassing van non-farmacologische interventies.
Kosten (middelenbeslag)
De kosten voor de besproken interventies zijn laag. Wel kost toepassen van non-farmacologische interventies tijd voor zorgverleners, zeker wanneer individuele wensen en voorkeuren geïnventariseerd moeten worden en effecten van de interventies moeten worden geobserveerd.
Aanvaardbaarheid, haalbaarheid en implementatie
Uit diverse studies blijkt dat het toepassen van gebundelde interventies op de intensive care veilig en haalbaar is. De invulling van deze gebundelde interventies verschilt echter nogal tussen verschillende studies. De implementatie van de diverse onderdelen zal meer (bijvoorbeeld het verminderen van licht en geluid, of het structureel toepassen van vroegmobilisatie) of minder (bijvoorbeeld het ophangen van klokken of het aanreiken van brillen en gehoorapparaten) moeite kosten. Dit soort interventies zijn goed inpasbaar in een deliermanagementprotocol dat kan worden gebruikt voor de gehele IC-populatie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op basis van de beschikbare literatuur kunnen we concluderen dat gebundelde interventies de voorkeur krijgen boven enkelvoudige interventies, zoals aanbieden van oordoppen in het voorkomen van delier. Hoewel de bewijskracht laag is, lijken gebundelde interventies een delier te kunnen voorkomen en de IC-opnameduur te kunnen verkorten.
Dergelijke bundels kunnen bestaan uit interventies voor optimale pijnstilling, bevorderen van het slaap-waakritme (inclusief geluid en lichtreductie ’s nachts), oriëntatiehulpmiddelen, vroege mobilisatie, betrokkenheid van naasten en cognitieve stimulatie zoals muziek. De literatuur biedt echter geen houvast voor de meest optimale samenstelling van dergelijke bundels. Bij de toepassing van non-farmacologische interventies dient rekening gehouden te worden met de voorkeuren van patiënten.
Onderbouwing
Achtergrond
IC-patiënten met een delier hebben een wisselend bewustzijnsniveau, aandachtsproblemen en andere cognitieve beperkingen. Vanwege de nadelige gevolgen van een delier op zowel korte- als langetermijn is preventie cruciaal. De literatuur beschrijft verschillende non-farmacologische interventies die kunnen worden toegepast om het optreden van een delier te voorkomen, alsook om de ernst en de duur van het delier te verminderen.
Non-farmacologische interventies omvatten maatregelen zoals het beperken van blootstelling aan licht en geluid met oogmaskers en oordopjes, hulpmiddelen voor oriëntatie, verpleegkundige zorgaanpassingen voor een beter dag- en nachtritme, muziektherapie, lichttherapie en familieparticipatie. Deze interventies zijn zowel individueel als gebundeld beschreven.
Deze module onderzoekt hoe effectief non-farmacologische interventies zijn om delier te voorkomen en behandelen. Ook is onderzocht of zij effect hebben op de IC-opnameduur, (de kans op) complicaties, ervaren kwaliteit van leven en de mortaliteit. Daarbij gaat deze module ervan uit dat bij patiënten angst en pijn reeds adequaat zijn behandeld, zoals beschreven in de richtlijn Sedatie en analgesie op de IC. De effecten van non-farmacologische interventies op slaapkwaliteit zijn beschreven in Module Non-farmacologische interventies (slaap-waakritme). Vroegmobilisatie wordt behandeld in de module (Vroeg)mobilisatie.
Conclusies / Summary of Findings
1. Delirium incidence (critical)
|
Low GRADE |
The evidence suggests that circadian interventions and multicomponent interventions might reduce the delirium incidence in ICU patients.
Sources: Colombo, 2012; Faustino, 2022; Giraud, 2016; Guo, 2016; Guo and Fan, 2016; Kasapoglu, 2022; Lee and Kim, 2014; Moon, 2015; Ono, 2011; Potharajaroen, 2018; Rood,2021; Simons, 2016; Wang, 2022 |
|
Very low GRADE |
The evidence is very uncertain about the effect of the single-component interventions; earplugs, earplugs and eye masks, music, family participation and multicomponent interventions on the delirium incidence in ICU patients.
Sources: Akpinar, 2022; Ma, 2015; van Rompaey, 2012; Zhang, 2017; Zhao, 2018 |
2. Delirium duration (critical)
|
Low GRADE |
The evidence suggests that circadian interventions and multicomponent interventions result in little to no difference in delirium duration in ICU patients.
Sources: Faustino, 2022; Giraud, 2016; Rood,2021; Simons, 2016; Wang, 2022 |
3. Duration of ICU stay (critical)
|
Low GRADE |
The evidence suggests that multicomponent interventions might reduce the duration of ICU stay in ICU patients.
Sources: Lee and Kim, 2014; Moon, 2015; Wang, 2022 |
|
Very low GRADE |
The evidence is very uncertain about the effect of circadian interventions on duration of ICU stay in ICU patients.
Sources: Simons, 2016 |
4. Quality of life (important)
|
No GRADE |
No publications were included reporting the outcome quality of life. |
5. Mortality (important)
|
Very low GRADE |
The evidence is very uncertain about the effect of multicomponent interventions on mortality in ICU patients.
Sources: Faustino, 2022; Guo, 2016; Guo and Fan, 2016; Lee and Kim, 2014; Moon, 2015; Rood,2021; Wang, 2022 |
6. Adverse events (important)
|
No GRADE |
No publications were included reporting adverse events. |
Samenvatting literatuur
Description of studies
Systematic reviews
Deng (2020) described a systematic review and network meta-analysis of randomized controlled trials or cohort studies published up to June 2019, assessing the efficacy of single or multicomponent non-pharmacological interventions for prevention of ICU delirium. In total, 26 studies were included in the review involving 7035 patients. To answer our clinical question, 7 RCTs were eligible. Interventions included circadian interventions (Ono, 2011; Potharajaroen, 2018; Simons, 2016; Giraud, 2016; Colombo, 2012), earplugs (van Rompaey, 2012) and multicomponent interventions (Moon, 2015). Patients were evaluated with respect to incidence of delirium, duration of delirium, hospital mortality and ICU length of stay.
Liang (2021) described a systematic review and meta-analysis of randomized controlled trials, controlled clinical trials (CCTs) and (un)controlled before-and-after studies published up to September 2020, assessing the efficacy of multicomponent or single-component interventions aimed to prevent delirium and improving outcomes among ICU patients. In total, 34 studies were included in the review involving 7159 patients. To answer our clinical question, 8 RCTs/CCTs were eligible. Interventions included circadian interventions (Simons, 2016), multicomponent (Moon, 2015; Guo, 2016; Guo and Fan, 2016; Lee and Kim, 2014), family participation (Ma, 2015) and music (Zhang, 2017; Zhao, 2018). Patients were evaluated with respect to incidence of delirium, duration of delirium, ICU length of stay and ICU mortality.
Furthermore, 5 relevant randomized controlled trials were eligible for the summary of the literature. Studies were categorized into studies about delirium prevention only and studies about delirium prevention and treatment (after delirium onset).
1. Delirium prevention
Systematic reviews
13 RCTs that were included in the systematic reviews described the effects of non-pharmacological interventions on delirium prevention (Ono, 2011; Potharajaroen, 2018; Simons, 2016; Giraud, 2016; Colombo, 2012; van Rompaey, 2012; Moon, 2015; Guo, 2016; Guo and Fan, 2016; Lee and Kim, 2014; Ma, 2015; Zhang, 2017; Zhao, 2018).
Randomized controlled trials
Akpinar (2022) described a single center RCT conducted in Turkey. Patients (mean age 64y) were admitted to the coronary intensive care unit, were not sedated and not mechanically ventilated at time of inclusion. Mechanical ventilation was sometimes initiated during the observation period, but the numbers of ventilated patients was not reported. The intervention group received earplugs and eye masks in addition to standard of care. The control group received standard care alone. The length of follow-up was 3 days. The relevant outcome measure was delirium incidence.
Kasapoglu (2022) described a single center RCT conducted at the general and pulmonary ICU of a hospital in Turkey. Patients were mainly between 66 and 85 years old. The majority of the patients was not mechanically ventilated (97-85% of treatment groups) and all patients had a RASS score of 0. The intervention group received a multicomponent intervention, consisting of reading a newspaper, wearing an eye patch at night and playing audio recordings of either a family member (intervention 1) or a non-family member (intervention 2). The control group received standard care alone. The length of follow-up was 3 days. The relevant outcome measure was delirium incidence.
2. Delirium prevention and treatment
Systematic reviews
Two RCTs that were included in the systematic reviews described the effects of non-pharmacological interventions on delirium prevention as well as treatment effects after delirium onset (Simons, 2016; Giraud, 2016).
Randomized controlled trials
Faustino (2022) described an RCT conducted at 3 ICUs of a large teaching hospital in Brazil. Patients (mean age 67 years) had a score of -3 or higher on the Richmond Agitation Sedation Scale (RASS) for over 24 h after initial screening evaluation and 16 percent was mechanically ventilated. The intervention group received a bundle of 5 non-pharmacological interventions. The bundle included periodic reorientation, cognitive stimulation, correction of visual and hearing deficits, environmental management (calendar and clock) and sleep promotion. The control group received standard of care alone. The intervention was applied until discharge and outcomes were reported until 90 days. The relevant outcome measures were delirium incidence, delirium duration, ICU length of stay and mortality (ICU, 30-day, 90 day).
Rood (2021) describes a multicenter stepped-wedge cluster-RCT conducted at 10 ICUs in the Netherlands. The majority of these patients (mean age of 71 years; 60% male) were mechanically ventilated (88%). The intervention group received a multicomponent intervention, consisting of optimizing visual and hearing impairment, orientation support, sleep deprivation, cognitive impairment and immobility. The control group received standard of care alone. The length of follow-up was 28 days. The relevant outcome measures were the delirium incidence, delirium duration, length of ICU stay and mortality.
Wang (2022) describes a single center RCT conducted at 2 ICUs in a tertiary hospital in China. Patients (mean age of 54 years; 55% male) had an average duration of mechanical ventilation of 159 hours. In addition to standard care, the intervention group received a multicomponent intervention, consisting of: pain monitoring and management; light sedation and daily awakening; early exercise; sleep promotion and delirium monitoring. The control group received standard of care alone. The length of follow-up was 3 days. The relevant outcome measures were the delirium incidence, delirium duration, length of ICU stay and mortality.
Table 1: Study descriptives of delirium prevention studies, sorted by category of the intervention.
|
Author, year |
N intervention |
N control |
Relevant outcome measures |
|
Earplugs |
|||
|
van Rompaey, 2012* |
69 |
67 |
Delirium incidence |
|
Earplugs & eye masks |
|||
|
Akpinar, 2022 |
42 |
42 |
Delirium incidence |
|
Music |
|||
|
Zhang, 2017* |
116 |
115 |
Delirium incidence |
|
Zhao, 2018* |
40 |
40 |
Delirium incidence, ICU length of stay |
|
Circadian interventions |
|||
|
Ono, 2011* |
10 |
12 |
Delirium incidence |
|
Potharajaroen, 2018* |
31 |
31 |
Delirium incidence |
|
Simons, 2016* |
361 |
373 |
Delirium incidence, delirium duration hospital mortality, ICU length of stay |
|
Colombo, 2012* |
144 |
170 |
Delirium incidence |
|
Multicomponent interventions |
|||
|
Faustino, 2022 |
72 |
72 |
Delirium incidence, delirium duration ICU length of stay, mortality (ICU, 30-day, 90-day) |
|
Guo, 2016* |
81 |
79 |
Delirium incidence |
|
Guo and Fan, 2016* |
59 |
63 |
Delirium incidence |
|
Kasapoglu, 2022 |
G1: 30 |
33 |
Delirium incidence |
|
Lee and Kim, 2014* |
68 |
62 |
Delirium incidence, ICU length of stay |
|
Moon, 2015* |
60 |
63 |
Delirium incidence |
|
Rood, 2021 |
924 |
825 |
Delirium incidence, delirium duration ICU length of stay, 28-day mortality, 90-day mortality |
|
Wang, 2022 |
81 |
86 |
Delirium incidence, delirium duration ICU length of stay, 28-day ICU mortality |
|
Family participation |
|||
|
Ma, 2015* |
84 |
80 |
Delirium incidence |
|
Reorientation |
|||
|
Giraud, 2016* |
115 |
108 |
Delirium incidence, delirium duration |
* included from Deng (2020) or Liang (2021).
Results
1. Delirium incidence (crucial)
All 19 studies (concerning delirium prevention and treatment) reported the incidence of delirium. Twelve studies used the Confusion Assessment Method for the ICU (CAM-ICU) to assess delirium (Colombo, 2012; Faustino, 2022; Giraud, 2016; Guo, 2016; Kasapoglu, 2022; Moon, 2015; Potharajaroen, 2018; Rood,2021; Simons, 2016; Wang, 2022; Zhang, 2017; Zhao, 2018), two studies used the Intensive Care Delirium Screening Checklist (ICDSC; Ma, 2015; Akpinar, 2022); two studies used the Neelon and Champagne confusion scale (NEECHAM; van Rompaey, 2012; Ono, 2011); one study used the delirium detection score (DDS; Guo and Fan, 2016); and one study reported that delirium was assess by the neurological physicians (Lee and Kim, 2014).
One study (Akpinar, 2022) reported continuous values and was not included in the pooled analysis. The other 18 studies reported a dichotomous outcome and the results of these studies were included in the forest plot. Results per category were pooled.
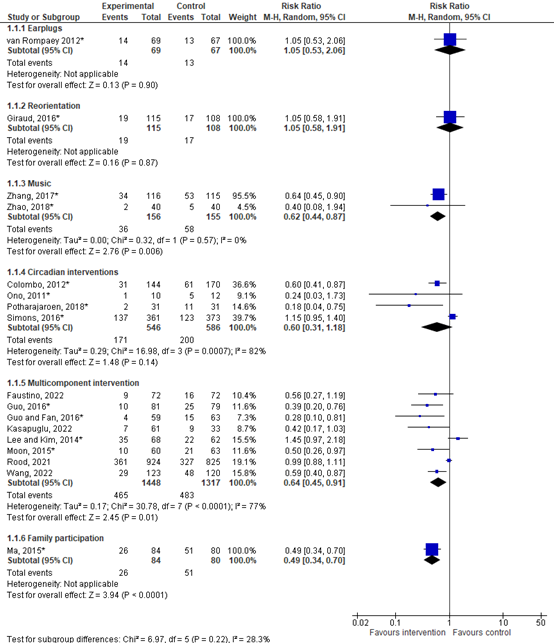
Figure 1. Forest plot showing the comparison between non-pharmacological interventions and control condition. Pooled risk ratio, random effects model.
Earplugs
The RR was 1.05 (95% CI 0.53 to 2.06), indicating no difference between groups.
Reorientation
The RR was 1.05 (95% CI 0.58 to 1.91), indicating no difference between groups.
Music
The RR was 0.62 (95% CI 0.44 to 0.87), indicating a clinically relevant difference in favor of the intervention group.
Circadian intervention
The RR was 0.60 (95% CI 0.31 to 1.18), indicating a clinically relevant difference in favor of the intervention group.
Multicomponent intervention
The RR was 0.64 (95% CI 0.45 to 0.91), indicating a clinically relevant difference in favor of the intervention group.
Family participation
The RR was 0.49 (95% CI 0.34 to 0.70), indicating a clinically relevant difference in favor of the intervention group.
Earplugs and eye masks
Akpinar (2022) reported that the delirium assessment during the third night, the mean ICDSC score in the intervention group was 0.19 (SD 0.39), compared with 0.57 (SD 0.66) in the control group (MD -0.38, 95% CI -0.61 to -0.15). This difference is not considered clinically relevant.
2. Delirium duration
Five studies concerning delirium prevention reported the delirium duration. Four reported the median (IQR) duration (Faustino, 2022; Giraud, 2016; Rood, 2021; Simons, 2016) and one study reported the mean (SD; Wang, 2022). Results were not pooled and are described per study.
Circadian interventions
Simons (2016) reported that the median delirium duration was 2 (IQR 2–5) days in the intervention group, compared with 2 (1–5) days in the control group[1]. This difference is not considered clinically relevant.
[1] Raw data from the author revealed an error in the published data (showing a median delirium duration of 2 hours in both groups). Here the correct data was presented (including a median duration of 2 days in both groups).
Reorientation
Giraud (2016) reported that the median delirium duration was 1 (IQR 1–3 [range 1–25]) days in the intervention group, compared with 2 (IQR 1–8 [range 1–13]) days in the control group. The difference is considered clinically relevant, in favor of the intervention group.
Multicomponent interventions
Faustino (2022) reported that the median delirium duration was 2 (IQR 1–3) days in the intervention group, compared with 2 (IQR 1–7.5) days in the control group. This difference is not considered clinically relevant.
Rood (2021) reported that the median delirium duration was 2 (IQR 1–4) days in the intervention group, compared with 2 (IQR 1–4) days in the control group. This indicates no difference between groups.
Wang (2022) reported that the mean delirium duration was 2.83 (SD 1.20) days in the intervention group, compared with 4.02 (SD 1.99) days in the control group. The MD was -1.19 (95% CI -1.60 to -0.78). This difference is considered clinically relevant, in favor of the intervention group.
3. Duration of ICU stay (important)
Six studies concerning delirium prevention and treatment reported the duration of ICU stay. Four of these, reported the mean length of stay (SD) and were pooled in a meta-analysis (Lee and Kim, 2014; Moon, 2015; Simons, 2016; Wang, 2022) and two reported the median (IQR) length of stay (Faustino, 2022; Rood, 2022).
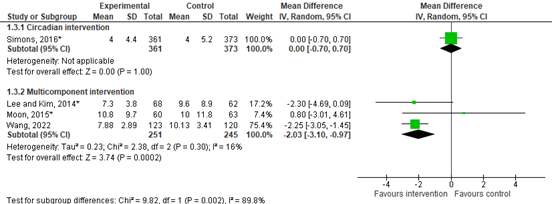
Figure 2. Forest plot showing the comparison between non-pharmacological interventions and control condition. Mean difference, random effects model.
Circadian intervention
The MD was 0.00 (95% CI -0.70 to 0.70), indicating no difference between groups.
Multicomponent intervention
The MD was -2.03 (95% CI -3.10 to -0.97). This indicates a clinically relevant difference in favor of the intervention group.
Faustino (2022) reported a median length of ICU stay of 4 (IQR 3 – 7.5) days for the intervention group and 5 (3 – 7) days for the control group (median difference 1 day). This indicates a clinically relevant difference in favor of the intervention group.
Rood (2021) reported a median length of ICU stay of 6 (IQR 3 – 12) for the intervention group and 6 (IQR 3 – 11) for the control group (median difference 0), indicating no difference between groups.
4. Quality of life (important)
Results regarding quality of life were not reported by the included publications.
5. Mortality (important)
Seven studies concerning delirium prevention and treatment reported mortality rate and were pooled in a meta-analysis. Moon (2015) reported the 7-day in-hospital mortality, Rood (2021) reported the overall 28-day mortality, Wang (2022) reported the 28-day ICU mortality and Faustino (2022) reported the 30-day ICU mortality. The follow-up length for mortality for the studies of Guo (2016), Guo and Fan (2016) and Lee and Kim (2014) was not specified.
The mortality rate was 396 in 1387 (28,6%) patients in the intervention group, compared with 399 in 1284 (31,1%) patients in the control group. The RR was 0.78 (95% CI 0.56 to 1.08), indicating a clinically relevant difference in favor of the intervention group.
6. Adverse events (important)
Results regarding adverse events were not reported by the included publications.
Level of evidence of the literature
1. Delirium incidence (crucial)
Earplugs
The level of evidence regarding the outcome measure delirium incidence was downgraded by 3 levels because of study limitations (risk of bias, -1); number of included patients and only 1 study included and the confidence interval containing both benefit and harm (imprecision, -2). The level of evidence is very low.
Earplugs and eye masks, family participation
The level of evidence regarding the outcome measure delirium incidence was downgraded by 3 levels because of study limitations (risk of bias, -1); number of included patients and only 1 study included (imprecision, -2). The level of evidence is very low.
Music
The level of evidence regarding the outcome measure delirium incidence was downgraded by 3 levels because of study limitations (risk of bias, -1); inconsistency between studies, indicated by the difference in incidence of the outcome measure (inconsistency, -1); number of included patients (imprecision, -1). The level of evidence is very low.
Circadian intervention, multicomponent intervention
The level of evidence regarding the outcome measure delirium incidence was downgraded by 2 levels because of study limitations (risk of bias, -1); the confidence interval crossing the threshold for clinical relevance (imprecision, -1). The level of evidence is low.
2. Delirium duration (crucial)
Circadian intervention, multicomponent intervention
The level of evidence regarding the outcome measure delirium duration was downgraded by 2 levels because of study limitations (risk of bias, -1); and imprecision of results (imprecision, -1). The level of evidence is low.
3. Duration of ICU stay (crucial)
Circadian intervention
The level of evidence regarding the outcome measure duration of ICU stay was downgraded by 3 levels because of study limitations (risk of bias, -1); number of included patients and only 1 study included (imprecision, -2). The level of evidence is very low.
Multicomponent intervention
The level of evidence regarding the outcome measure duration of ICU stay was downgraded by 2 levels because of study limitations (risk of bias, -1); inconsistency between studies, amongst others indicated by the confidence interval of one study including both benefit and harm (imprecision, -1). The level of evidence is low.
4. Quality of life (important)
No publications were included reporting the quality of life.
5. Mortality (important)
Multicomponent intervention
The level of evidence regarding the outcome measure mortality was downgraded by 3 levels because of study limitations (risk of bias, -1); inconsistency between studies (inconsistency, -1) and the confidence interval crossing the threshold of clinical relevance (imprecision, -1). The level of evidence is very low.
6. Adverse events (important)
No publications were included reporting the adverse events.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the effect of non-pharmacological interventions on delirium treatment and prevention; duration of intensive care unit (ICU) stay; quality of life; mortality; and morbidity in adult ICU patients?
| P: | adult ICU patients |
| I: |
non-pharmacological interventions (including: eye masks, cycled light, earplugs or other noise canceling intervention, music therapy, family participation, nurse led interventions; reorientation; as an individual intervention or bundled) |
| C: | no intervention, usual care |
| O: | delirium, duration of ICU stay, quality of life, mortality, adverse events. |
Relevant outcome measures
The guideline development group considered delirium as a critical outcome measure for decision making; and duration of ICU stay, quality of life, mortality and adverse events important outcome measures for decision-making.
The working group defined the outcome measures as follows:
- Delirium incidence: the number of participants who were diagnosed with new onset delirium during ICU/hospital stay.
- Delirium duration: the number of hours or days that delirium persisted
- Duration of ICU stay: the number of days spent at the ICU.
- Quality of life: quality of life as assessed with self-reported questionnaires.
- Mortality: the number of patients who died during ICU/hospital stay.
- Adverse events: incidence of hypotension, bradycardia, respiratory depression, need for controlled mechanical ventilation.
The working group defined the following as minimal clinically (patient) important difference per outcome measure:
- Delirium incidence: a difference of 5% in delirium incidence (RR ≤ 0.95 RR ≥ 1.05) or a difference of 0.8 points at the ICDSC from a score of ≥3.
- Delirium duration: a difference of one day between groups.
- Duration of ICU stay: a difference of one day between groups.
- Quality of life: a difference of 10% of the total score
- Mortality: a difference of 3% (SDD-trial; Smet, 2009; RR ≤ 0.97, RR ≥ 1.03).
- Adverse events: a relative difference of 25% between groups (RR ≤ 0.80, RR ≥ 1.25).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2000 until June 26, 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 380 hits. Studies were selected based on the following criteria:
- Describing adult patients at the intensive care unit;
- Describing non-pharmacological interventions ((bundles of) earplugs, eye mask, light and sound reduction; nursing interventions);
- Study design: randomized controlled trials (RCTs) or systematic reviews (SRs) of RCTs with a detailed description of included studies, a risk-of-bias judgement; a detailed description of the literature search strategy and included a meta-analysis;
- Articles published in English or Dutch;
- Describing at least one of the following outcome measures: delirium, duration of hospital/ICU stay, quality of life, mortality and adverse events;
- At least 10 patients in each study arm.
Forty-five studies were initially selected based on title and abstract screening. After reading the full texts, 38 publications were excluded (see the table with reasons for exclusion under the tab Methods). Nine publications were included: 2 systematic reviews describing 13 relevant RCTs and 5 individual RCTs.
Results
A total of 18 studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bélanger L, Ducharme F. Patients' and nurses' experiences of delirium: a review of qualitative studies. Nurs Crit Care. 2011 Nov-Dec;16(6):303-15. doi: 10.1111/j.1478-5153.2011.00454.x. Epub 2011 Jul 19. PMID: 21999421.
- Daniel C, Mason OJ. Predicting psychotic-like experiences during sensory deprivation. Biomed Res Int. 2015;2015:439379. doi: 10.1155/2015/439379. Epub 2015 Feb 24. PMID: 25811027; PMCID: PMC4354964.
- Gaete Ortega D, Papathanassoglou E, Norris CM. The lived experience of delirium in intensive care unit patients: A meta-ethnography. Aust Crit Care. 2020 Mar;33(2):193-202. doi: 10.1016/j.aucc.2019.01.003. Epub 2019 Mar 11. PMID: 30871853.
- Akpinar RB, Aksoy M, Kant E. Effect of earplug/eye mask on sleep and delirium in intensive care patients. Nurs Crit Care. 2022 Jul;27(4):537-545. doi: 10.1111/nicc.12741. Epub 2022 Jan 12. PMID: 35021263.
- Deng LX, Cao L, Zhang LN, Peng XB, Zhang L. Non-pharmacological interventions to reduce the incidence and duration of delirium in critically ill patients: A systematic review and network meta-analysis. J Crit Care. 2020 Dec;60:241-248. doi: 10.1016/j.jcrc.2020.08.019. Epub 2020 Aug 31. PMID: 32919363.
- Faustino TN, Suzart NA, Rabelo RNDS, Santos JL, Batista GS, Freitas YS, Saback DA, Sales NMMD, Brandao Barreto B, Gusmao-Flores D. Effectiveness of combined non-pharmacological interventions in the prevention of delirium in critically ill patients: A randomized clinical trial. J Crit Care. 2022 Apr;68:114-120. doi: 10.1016/j.jcrc.2021.12.015. Epub 2022 Jan 6. PMID: 34999377.
- Kasapo?lu ES, Enç N. Role of multicomponent non-pharmacological nursing interventions on delirium prevention: A randomized controlled study. Geriatr Nurs. 2022 Mar-Apr;44:207-214. doi: 10.1016/j.gerinurse.2022.02.015. Epub 2022 Feb 26. PMID: 35227973.
- Liang S, Chau JPC, Lo SHS, Zhao J, Choi KC. Effects of nonpharmacological delirium-prevention interventions on critically ill patients' clinical, psychological, and family outcomes: A systematic review and meta-analysis. Aust Crit Care. 2021 Jul;34(4):378-387. doi: 10.1016/j.aucc.2020.10.004. Epub 2020 Nov 26. PMID: 33250403.
- Rood PJT, Zegers M, Ramnarain D, Koopmans M, Klarenbeek T, Ewalds E, van der Steen MS, Oldenbeuving AW, Kuiper MA, Teerenstra S, Adang E, van Loon LM, Wassenaar A, Vermeulen H, Pickkers P, van den Boogaard M; UNDERPIN-ICU Study Investigators. The Impact of Nursing Delirium Preventive Interventions in the ICU: A Multicenter Cluster-randomized Controlled Clinical Trial. Am J Respir Crit Care Med. 2021 Sep 15;204(6):682-691. doi: 10.1164/rccm.202101-0082OC. PMID: 34170798.
- Simons KS, van den Boogaard M, de Jager CP. Reducing sensory input in critically ill patients: are eyemasks a blind spot? Crit Care. 2012 Jul 16;16(4):439. doi: 10.1186/cc11402. PMID: 22805589; PMCID: PMC3580688.
- Wang XP, Lv D, Chen YF, Chen N, Li XD, Xu CF, Li Y, Tian L. Impact of Pain, Agitation, and Delirium Bundle on Delirium and Cognitive Function. J Nurs Res. 2022 Aug 1;30(4):e222. doi: 10.1097/jnr.0000000000000497. PMID: 35608396.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Deng, 2020
[individual study characteristics deduced from [1st author, year of publication ]]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to end of June 2019
A: Colombo, 2012 B: Giraud, 2016 C: Ono, 2011 D: Potharjaroen, 2018 E: van Rompaey, 2012
Study design: RCT
Setting and Country: Department of critical care and teaching and research section of clinical Nursing; Central South University; China
Source of funding and conflicts of interest: Funding not reported; “Declaration of Competing Interest: None.” |
Inclusion criteria SR: (i) RCTs or cohort studies that included adult patients (>18 years) who were admitted to an ICU of any type; (ii) trials that employed single or multicomponent non-pharmacological interventions for prevention of ICU delirium; (iii) studies published in peer-reviewed journals in English with full-length text accessible; (iv) studies resulted in the assessment of one or more of the following outcomes: incidence of delirium, delirium duration, LOS in the ICU, and hospital mortality.
Exclusion criteria SR: (i) trial was a case report or protocol study; (ii) trials focused on non-ICU patients (iii) trials that used pharmacological treatments for delirium.
26 studies included in the SR; 5 included in the current literature summary
Important patient characteristics at baseline:
N, mean age A: % male NR I: n=144, age NR C: n=170, age NR B: 24% male I: n=115, age NR C: n=108, age NR C: % male NR I: n=10, age NR C: n=12, age NR D: 44% male I: n=31, age NR C: n=31, age NR E: 66% male I: n=69, age NR C: n=67, age NR |
A: multicomponent intervention B: physical environment intervention C: physical environment intervention D: physical environment intervention E: physical environment intervention
|
A: usual care B: usual care C: usual care D: usual care E: usual care |
End-point of follow-up: Not specified
For how many participants were no complete outcome data available? (intervention/control) Not specified
A: Colombo, 2012 B: Giraud, 2016 C: Ono, 2011 D: Potharjaroen, 2018 E: van Rompaey, 2012 |
Delirium (critical) A: I: 22% of 144 = 31/144 (21.5%) C: 36% of 170 = 61/170 (35.8%) B: I: 17% of 115 = 19/115 (16.5%) C: 16% of 108 = 17/108 (15.7%) C: I: 10% of 10 = 1/10 (10%) C: 42% of 12 = 5/12 (42%) D: I: 6% of 31 = 2/31 (6%) C: 36% of 31 = 11/31 (36%) E: I: 20% of 69 = 14/69 (20.3%) C: 19% of 67 = 13/67 (19.4%)
Delirium duration B: median (IQR [range]) I: 1 (IQR 1–3 [range 1–25]) days C: 2 (IQR 1–8 [range 1–13]) days
Duration of ICU stay (important) Not reported for these studies
Quality of life (important) NR in the SR
Mortality Hospital mortality Not reported for these studies
Adverse events NR in the SR
|
Facultative: |
|
Liang, 2021 |
SR and meta-analysis of RCTs, controlled clinical trials, controlled or uncontrolled before-and-after studies
Literature search up to Sept 2020
A: Guo, 2016 B: Guo and Fan, 2016 C: Lee and Kim, 2014 D: Ma, 2015 E: Moon, 2015 F: Simons, 2016 G: Zhang, 2017 H: Zhao, 2018
Study design: RCT
Setting and Country: School of Nursing; Hong Kong
Source of funding and conflicts of interest: Declaration of no conflicts of interest and no funding received |
Inclusion criteria SR: ICU patients of 18y or older
Exclusion criteria SR: History of neurologic condition (see publication for examples) or who had undergone neurosurgery
34 studies included in the SR; of which 8 RCTs included in the current summary
Important patient characteristics at baseline: N, mean age A: I: n=81, 73y C: n=79, 74y B: I: n=59, 54y C: n=63, 52y C: I: n=68, 51y C: n=62, 52y D: I: n=84, 53y C: n=80, 47y E: I: n=60, 70y C: n=63, 69y F: I: n=361, 66y C: n=373, 64y G: I: n=116, 566 C: n=116, 59y H: I: n=40, not reported C: n=10, not reported
Sex: Not specified
Groups comparable at baseline in age |
Describe intervention:
A: multicomponent B: multicomponent C: multicomponent D: Family participation E: multicomponent F: Physical environment G: Music H: Music |
Usual care, including but not limited to, a spontaneous breathing trial, indwelling catheter, feeding and bowel care. |
End-point of follow-up: Not specified
For how many participants were no complete outcome data available? Not specified
|
Delirium (critical) A: CAM-ICU I: 10/81 (12.3%) C: 25/79 (31.6%) B: DDS I: 4/59 (6.8%) C: 15/63 (23.8%) C: Neurological physicians I: 35/68 (51.5%) C: 22/62 (35.5%) D: ICDSC I: 26/84 (%) C: 51/80 (%) E: CAM-ICU I: 10/60 (16.7%) C: 21/63 (33.3%) F: CAM-ICU I: 137/361 (38.0%) C: 123/373 (33.0%) G: CAM-ICU I: 34/116 (29.3%) C: 53/115 (21.6%) H: CAM-ICU I: 2/40 (5%) C: 5/40 (12.5)
Delirium duration I: 2 (IQR 2–5) hours C: 2 (1–5) hours Duration of ICU stay (important) A: not reported B: not reported C: I: 7.3 SD 3.8, n=68 C: 9.6 SD 8.9 n=62 D: not reported E: I: 10.8 SD 9.7 n=60 C: 10 SD 11.8 n=63 F: I: 4 SD 4.4 n=361 C: 4 SD 5.2 n=373 G: not reported H: not reported
Quality of life (important) not reported
Mortality A: I: 10/81 C: 25/79 B: I: 4/59 C: 15/63 C: I: 35/68 C: 22/62 D: not reported E: I: 10/60 C: 21/63 F: not reported G: not reported H: not reported
Adverse events not reported |
Facultative: |
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Akpinar, 2022 |
Type of study: RCT
Setting and country: coronary intensive care unit (CICU) of a university hospital, Turkey
Funding and conflicts of interest: “This study did not receive any specific grant from funding agencies in the public, commercial, or not-for-profit sectors. CONFLICT OF INTEREST The author declare no potential conflicts of interest with respect to the authorship and/or publication of this article.” |
Inclusion criteria:
Exclusion criteria:
N total at baseline: 84 Intervention: 42 Control:42
Important prognostic factors2: For example age ± SD: I: 64.04 ± 8.64 C:63.73 ± 6.92
Sex, n %: I: 24; 57.1% M C: 22; 52.4% M
Groups comparable at baseline? yes |
earplugs and an eye mask
The patients in the experimental group were asked to use earplugs and an eye mask overnight (from approximately 22:30 to 6:30 the next morning) on the second (Time 1) and third nights (Time 2). They were told that the earplugs and eye mask should be removed only for a short time if an intervention or communication was necessary.
|
Standard of care
The patients in the control group received only routine care. |
Length of follow-up: 3 days
Loss-to-follow-up & Incomplete outcome data: Intervention: 0 Control: 0 |
Delirium (critical) ICDSC Baseline I: 0.47 ± 0.50 (43.50) C: 0.42 ± 0.50 (41.50) 840.000 0.663 Time 1 (second night) I: 0.33 ± 065 (39.52) C: 0.50 ± 0.70 (45.48) Time 2 (third night) I: 0.19 ± 039 (36.12) C: 0.57 ± 0.66 (48.88)
Duration of ICU stay (important) Not reported
Quality of life (important) Not reported
Mortality Not reported
Adverse events Not reported
|
Note: Unclear what was meant with: “To ensure that all the patients were equally affected by the environmental conditions that were likely to affect sleep quality in the ICU, such as noise, light, and heat, the same number of patients was included in the experimental and control groups each night.” |
|
Faustino, 2022 |
Type of study: RCT; randomized, controlled, parallel, and open clinical trial
Setting and country: 3 ICUs of a large teaching hospital in Salvador, Brazil from February to September 2019; Brazil
Funding and conflicts of interest: “This study was funded by the Institutional Scientific Initiation Program (PICIN) of the University of the State of Bahia (Edital n° 026/ 2018), which provided grants for nursing students who participated in data collection. There was no involvement of the funding source in the study design, collection, analysis, and interpretation of results, or in writing this paper and the decision to submit it for publication.” “The authors declare that they have no competing interests.” |
Inclusion criteria:
in ICU Patients (E-PRE-DELIRIC) score [15] ≥ 10%. (risk of developing delirium into four categories: very low (0–10%), low (10–20%), moderate (20–35%), and high risk (> 35%))
Exclusion criteria:
N total at baseline: Intervention: 72 Control: 72
Important prognostic factors2: age median (IQR) I: 68.5 (62.0–78.0) C: 64.5 (57.0–75.5)
Sex, F: I: 36 (50.0%) F C: 41 (56.9%) F
“Patients' baseline characteristics were similar across groups, except for the percentage of clinical admission that was higher in the control group (97.2% versus 83.3%) and the percentage of arterial hyper-tension (59.7% versus 76.4%) that was higher in the intervention group. |
bundle of 5 non-pharmacological interventions
The application started within 24 h of ICU admission, after randomization, and applied daily until ICU discharge.
Periodic reorientation: Twice a day, the research team helped patients orient themselves to the ICU environment, the multidisciplinary team, and the evolution of their clinical condition. In addition, patients were asked about their lives, work, family, leisure activities, and recent issues to stimulate thinking, awareness of their identities, and short- and long-term memories. Photos, personal items, and a radio were requested from the family and kept in the ICU to help with reorientation.)
The research team performed seven different cognitive training activities throughout the ICU stay + A folder that was comprised of magazines, word search activities, crossword and Sudoku puzzles, calculus, and painting, was distributed.
The research team asked families for glasses and/or hearing aids for those patients who previously used them.,
management: This intervention consisted of installing a calendar and a clock in a place that was easy for patients to see.
In order to promote sleep, the research team distributed eye masks and earplugs. They also requested the ICU staff to avoid the period from 10:00 pm to 6:00 am for scheduling elective procedures and administration of oral, subcutaneous, and intramuscular medications; however, the assistance team was responsible for patient compliance. |
Standard of care
|
Length of follow-up: Intervention until discharge; outcomes reported until 90 days (mortality)
Loss-to-follow-up & incomplete outcome data: Intervention: 8/80 (10%) Reasons (discharge in less than 24 hours of inclusion 4x, death within 24 hours of inclusion 2x; respiratory precaution initiated, 2x))
Control: 8/80 (10%) Reasons (discharge in less than 24 hours of inclusion 5x; respiratory precaution initiated, 3x))
|
Incidence of delirium incidence density of delirium, which is the ratio of patients in delirium to the number of person-days of exposure;
The density of incidence I: 1.34 × 10−2 C: 2.29 × 10−2 person-days), aHR, 0.40; 95% CI, 0.17–0.95; p = 0.04; adjusted for Simplified Acute Physiology Score III, surgical admission and alcoholism.
Cumulative incidence C: 22.2% (n = 16) I: 12.5% (n = 9) aRR, 0.44; 95% CI, 0.21–0.91; p = 0.03), adjusting for the same confounders
Delirium, cases I: 9 C: 16 More specifically: hypoactive delirium I: 7 C: 7 Mixed I: 1 C: 9 Hyperactive I: 1 C: 0
Delirium duration I: median 2 (IQR 1–3) days C: median 2 (IQR 1–7.5) days Duration of ICU stay, median (IQR), days I: 4 (3–7.5) C: 5 (3–7)
Quality of life Not reported
Mortality ICU mortality, n (%) I: 6 (8.3) C: 9 (12.5)
Adverse events Not reported |
Delirium was defined as a positive episode detected by the Confusion Assessment Method for the Intensive Care Unit Flowsheet |
|
Kasapoglu, 2022 |
Type of study: RCT
Setting and country: Single centra; ICUs (general ICU and pulmonary ICU) of a state hospital in Turkey
Funding and conflicts of interest: “This research did not receive any specific grant from funding agencies in the public, commercial of not-for-profit sectors. Th authors report no actual or potential conflict of interest.” |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 39+34 Control: 34 Analyzed: I: 30+31 C: 33
Important prognostic factors: Age, % 56-65y I-1: 20.5 | I-2: 0 C: 11.8 66-75y I-1: 38.5 | I-2: 26.5 C: 11.8 76-85y I-1: 28.2 | I-2: 47.2 C: 44.1
Sex, M%: I-1: 59% |I-2: 64.7% C: 41.2%
Mechanically ventilated: I-1: 5.1% | I-2: 14.7% C: 2.9%
Groups comparable at baseline? Age, gender, % ventilated and number of days in ICU differs |
Multicomponent intervention
I1:
I2:
|
Standard of care
|
Length of follow-up: 3 days
Loss-to-follow-up & incomplete outcome data: Intervention-1: N (%) 9/39 (23%) Reasons (2 x died, 7x transferred)
Intervention-2: N (%) 3/34 (9%) Reasons (1 x died, 2x transferred)
Control: N (%) 1/34 (3%) Reasons (1 x died) |
Incidence of delirium CAM-ICU After 3 days of intervention Negative I-1+2: 25+29 (88.4%) C: 24 (72.7%) Positive I-1+2: 5+2 (11.6%) C: 9 (27.3%)
Duration of ICU stay, Not reported
Quality of life, Not reported
Mortality Not reported
Adverse events Not reported |
|
|
Rood, 2021
NCT03002701 |
Type of study: RCT; Cluster-randomized
Setting and country: Multi center (ICUs of 10 centers: 1 university hospital, 4 Teaching hospitals, and 5 nonteaching hospitals); the Netherlands
Funding and conflicts of interest: funding and interest specified in publication |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 924 Control: 825
Important prognostic factors2: For example Age, y, mean (SD) I: 71 (10) C: 71 (11)
Sex, M/F, n (%) I: 539/385 (58/42) C: 508/317 (62/38)
Mechanically ventilated I: 770 (90%) C: 685 (86%)
RASS at admission, median (IQR) I: 23 (25 to 0) C: 23 (24 to 0)
Groups comparable at baseline? Yes |
Multicomponent nursing intervention program
Optimizing: Visual and hearing impairment
Orientation loss,
Sleep deprivation,
light at night.
Cognitive impairment, When RASS –2 to +1:
Immobility
Nurses were allowed to—based on their professional expertise—individually tailor the program to patient needs while covering all UNDERPIN-ICU domains as much as possible, starting within 24 hours after ICU admission until ICU discharge. |
Standard of care
|
Length of follow-up: 90 days
Loss-to-follow-up & Incomplete outcome data: ITT protocol Intervention: 0 Control: 0 Per protocol Intervention: 166+52 Reasons: comatose during admission; including during training period Control: 134+29 Reasons: comatose during admission; including during training period |
Incidence of delirium (defined as the new onset of delirium [positive CAM-ICU or treatment with haloperidol] after ICU admission), Delirium incidence I: 361 (39) C: 327 (40) OR 1.10, 95% CI 0.79 to 1.53 p=0.59
Delirium duration I: median 2 (IQR 1–4) days C: 2 (IQR 1–4) days Duration of ICU stay, Median (IQR) ICU length of stay I: 6 (3–12) C: 6 (3–11) 1.09, 95% CI 0.94 to 1.26 P=0.27
Quality of life Not reported
Mortality 28-d mortality I: 297 (32) C: 273 (33) 1.16† 0.85 to 1.59 P=0.34 90-d mortality I: 350 (38) C: 312 (38) 1.24† 0.92 to 1.67 P=0.17
Adverse events Not reported |
|
|
Wang, 2022 |
Type of study: RCT
Setting and country: 2 adult ICUs at Tianjin Third Central Hospital, tertiary hospital, China
Funding and conflicts of interest: “This research was funded by Tianjin Key Medical Discipline (Specialty) Construction Project.” “The authors declare no conflicts of interest.” |
Inclusion criteria:
expected for at least 72 hours
Exclusion criteria:
N total at baseline: Intervention: 135 Control:135 Included in analysis: C: 120
Important prognostic factors2: age ± SD: I:54.88y ± 12.29 C:52.78y ±10.83
Sex: I: 70/123; 57% M C: 62/120; 52% M
Groups comparable at baseline. |
Multicomponent intervention
1. Pain monitoring and management 2. Light sedation and daily awakening 3. Early exercise 4. Sleep promotion 5. Delirium monitoring
The PAD care bundle of interventions was implemented starting from the patient's ICU admission until their discharge from the ICU, transfer to another medical center or ward, or death. This interdisciplinary, multi component, evidence-based protocol consisted of five major components. For details, see publication
|
Usual care |
Length of follow-up: Up to discharge from the ICU and then surveys at 3 and 6 months after ICU discharge
Loss-to-follow-up & incomplete outcome data: First analysis: I: 120/135 (88.9%) in analysis; C: 123/135 (91.1%) in analysis 8-11 percent not included in analysis
6 month FU: I: 40% not analysed (giving up treatment, mechanical ventilation < 72h, lost contact, death) C: 36.3% not analysed (giving up treatment, mechanical ventilation < 72h, lost contact, death) |
Incidence of delirium Delirium* (n and %) I: 29/123, 23.58 C: 48/120, 40.00 OR = 0.46, 95% CI [0.23, 0.92]; adjusting for gender, age, APACHE II score, history of hypertension, and comorbidity of sepsis p = .028
Delirium duration, mean SD I: 2.83 (SD 1.20) days C: 4.02 (SD 1.99) days MD was -1.19 (95% CI -1.60 to -0.78)
Duration of ICU stay, ICU LOS (days) I: 7.88 ± 2.89 C: 10.13 ± 3.41
Quality of life Not reported
Mortality 28-day ICU mortality (n and %) I: 27/123, 21.95% C: 30/120; 25.00%
Adverse events Not reported |
*Nurses assessed the patients for delirium once every 8 hours using the Confusion Assessment Method for the ICU (CAMICU; Selim et al., 2018). Additional assessments were conducted when the participant's level of consciousness changed. |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Deng 2020 |
Yes |
No (no systematic search) |
Unclear |
Yes |
Not applicable |
yes |
yes |
Yes |
Yes |
|
Liang 2021 |
Yes |
Yes |
Unclear |
Yes |
Not applicable |
yes |
yes |
Yes |
Yes |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding:
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH |
|
Akpinar, 2021 |
Definitely yes
Reason: “were included in the study and then assigned to the experimental and control groups via the block randomization method. A research team member not involved in either subject recruitment or the intervention processes prepared the random assignment schedule, which was generated by the computer software Research Randomizer.” |
Definitely yes
Reason: “Group assignments were placed in sealed envelopes and revealed sequentially at the time of randomization.” |
Probably no
Reason: patient blinding not possible, other details not reported |
Definitely yes
Reason: all allocated patients included in analysis |
Probably yes
Reason: announced outcomes reported; trial not registered |
No information
Reason: funding and conflicts described; unclear whether intention-to-treat protocol was used and whether data was incomplete |
Some concerns
Reason: no registration, blinding not reported; protocol for missing data and analysis unclear |
|
Faustino, 2022 |
Definitely yes
Reason: “Randomization was performed in random blocks of 4, 6, and 8 participants with the RStudio randomization system (Boston, MA, USA).” |
Definitely yes
Reason: “Allocation concealment was ensured by opaque envelopes, sequentially numbered, and sealed. This process was carried out by a professional, who was external to the research team. The envelopes were opened only after they had been irreversibly assigned to the participants” |
Definitely no
Reason: ‘Due to characteristics of the intervention bundle, it was not possible to blind participants, research staff, and ICU care providers’ |
Probably yes
Reason: no, both groups lost 10% of patients due to comparable reasons |
Probably yes
Reason: trials registered (Brazilian Registry of Clinical Trials (ReBEC), identifier RBR-6xq95s) and announced outcomes are reported |
Probably yes
Reason: ‘Enrolled patients were included in the intention-to-treat analysis. ‘ |
Some concerns
Reason: blinding issues inherent to type of intervention |
|
Kasapoglu, 2022 |
Definitely yes
Reason: “A blinded statistician generated the allocation table.” |
Probably no
Reason: concealment of allocation not described |
Definitely no
Reason: “nurses did not know which group patients were in”. “the same authors administered all the interventions in this study and collected data” Blinding of data analysts not reported |
Definitely no
Reason: 3, 9 and 23% of lost to follow-up |
Probably yes
Reason: announced outcomes reported; trial not registered |
Probably no
Reason: 3, 9 and 23% of lost to follow-up; no intention-to-treat protocol was used |
Some concerns
Reason: some baseline differences; blinding issues; lost to FU not balances between groups; protocol for missing data and analysis unclear |
|
Rood, 2021 |
Definitely no
“Using the stepped-wedge method, all centers started as controls, and every second month, the program was implemented in a randomly assigned center.” |
Probably no
“Using the stepped-wedge method, all centers started as controls, and every second month, the program was implemented in a randomly assigned center.” |
Probably no
“Because of the nature of the interventions, blinding was not possible. Using the stepped-wedge method, all centers started as controls, and every second month, the program was implemented in a randomly assigned center.” |
Definitely yes
All patients in ITT analysis; clear description of data and per protocol analysis |
Definitely yes
Reason: announced outcomes reported; trial not registered |
Definitely yes
Reason: funding and conflicts described; protocol registered; funding and conflicts reported; data and missing data reported |
Low concerns |
|
Wang, 2022 |
Probably yes
“A computer was used to generate the random numbers used for group assignments.” |
No information
|
No information |
Definitely no
Reason: 11.1 and 8.9% of patients were not included in the primary analysis |
Probably yes
Reason: announced outcomes reported; trial not registered |
Probably no
Reason: 3, 9 and 23% of lost to follow-up; no intention-to-treat protocol was used; protocol not registered |
Some concerns
Reason: possibly blinding issues; relatively high proportion lost to follow up; protocol for missing data and analysis unclear; trial not registered |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Al-Qadheeb NS, Balk EM, Fraser GL, Skrobik Y, Riker RR, Kress JP, Whitehead S, Devlin JW. Randomized ICU trials do not demonstrate an association between interventions that reduce delirium duration and short-term mortality: a systematic review and meta-analysis. Crit Care Med. 2014 Jun;42(6):1442-54. doi: 10.1097/CCM.0000000000000224. PMID: 24557420; PMCID: PMC4799649. |
Included studies do not meet PICO |
|
Arttawejkul P, Reutrakul S, Muntham D, Chirakalwasan N. Effect of Nighttime Earplugs and Eye Masks on Sleep Quality in Intensive Care Unit Patients. Indian J Crit Care Med. 2020 Jan;24(1):6-10. doi: 10.5005/jp-journals-10071-23321. PMID: 32148342; PMCID: PMC7050172. |
N < 10 per arm |
|
Bannon L, McGaughey J, Verghis R, Clarke M, McAuley DF, Blackwood B. The effectiveness of non-pharmacological interventions in reducing the incidence and duration of delirium in critically ill patients: a systematic review and meta-analysis. Intensive Care Med. 2019 Jan;45(1):1-12. doi: 10.1007/s00134-018-5452-x. Epub 2018 Nov 30. PMID: 30506354. |
Relevant studies included in other review |
|
Barr J, Fraser GL, Puntillo K, Ely EW, Gélinas C, Dasta JF, Davidson JE, Devlin JW, Kress JP, Joffe AM, Coursin DB, Herr DL, Tung A, Robinson BR, Fontaine DK, Ramsay MA, Riker RR, Sessler CN, Pun B, Skrobik Y, Jaeschke R; American College of Critical Care Medicine. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med. 2013 Jan;41(1):263-306. doi: 10.1097/CCM.0b013e3182783b72. PMID: 23269131. |
Design |
|
Burry LD, Hutton B, Guenette M, Williamson D, Mehta S, Egerod I, Kanji S, Adhikari NK, Moher D, Martin CM, Rose L. Comparison of pharmacological and non-pharmacological interventions to prevent delirium in critically ill patients: a protocol for a systematic review incorporating network meta-analyses. Syst Rev. 2016 Sep 8;5(1):153. doi: 10.1186/s13643-016-0327-0. PMID: 27609018; PMCID: PMC5016934. |
Design |
|
Burry LD, Cheng W, Williamson DR, Adhikari NK, Egerod I, Kanji S, Martin CM, Hutton B, Rose L. Pharmacological and non-pharmacological interventions to prevent delirium in critically ill patients: a systematic review and network meta-analysis. Intensive Care Med. 2021 Sep;47(9):943-960. doi: 10.1007/s00134-021-06490-3. Epub 2021 Aug 11. PMID: 34379152; PMCID: PMC8356549. |
Design |
|
Chen TJ, Traynor V, Wang AY, Shih CY, Tu MC, Chuang CH, Chiu HY, Chang HR. Comparative effectiveness of non-pharmacological interventions for preventing delirium in critically ill adults: A systematic review and network meta-analysis. Int J Nurs Stud. 2022 Jul;131:104239. doi: 10.1016/j.ijnurstu.2022.104239. Epub 2022 Mar 28. PMID: 35468538. |
Design |
|
Chen YF, Chang MY, Chow LH, Ma WF. Effectiveness of Music-Based Intervention in Improving Uncomfortable Symptoms in ICU Patients: An Umbrella Review. Int J Environ Res Public Health. 2021 Nov 1;18(21):11500. doi: 10.3390/ijerph182111500. PMID: 34770015; PMCID: PMC8582781. |
Design |
|
Contreras CCT, Páez-Esteban AN, Rincon-Romero MK, Carvajal RR, Herrera MM, Castillo AHDD. Nursing intervention to prevent delirium in critically ill adults. Rev Esc Enferm USP. 2021 Apr 16;55:e03685. doi: 10.1590/S1980-220X2019035003685. PMID: 33886913. |
Wrong design |
|
Dehghani S, Asadizaker M, Adineh M, Maraghi E, Akbarian S, Ramezani B. Multidimensional Nursing Interventions effect on Delirium and Hospital Admission Duration. International Journal of Pharmaceutical and Phytopharmacological Research. April 2020: 10 (2): 67-73. |
Does not meet PICO (I) |
|
Fahimi K, Abbasi A, Zahedi M, Amanpour F, Ebrahimi H. The effects of multimedia education on postoperative delirium in patients undergoing coronary artery bypass graft: A randomized clinical trial. Nurs Crit Care. 2020 Nov;25(6):346-352. doi: 10.1111/nicc.12473. Epub 2019 Sep 18. PMID: 31532055. |
Does not meet PICO (P, I) |
|
Finotto S, Artioli G, Davoli L, Barbara B. Interventi infermieristici nella prevenzione del delirium in Unità Coronarica: uno studio randomizzato [Nursing interventions for the prevention of the delirium in intensive care unit (ICU): a randomized study]. Prof Inferm. 2006 Oct-Dec;59(4):228-32. Italian. PMID: 17320017. |
Does not meet PICO |
|
Flannery AH, Oyler DR, Weinhouse GL. The Impact of Interventions to Improve Sleep on Delirium in the ICU: A Systematic Review and Research Framework. Crit Care Med. 2016 Dec;44(12):2231-2240. doi: 10.1097/CCM.0000000000001952. PMID: 27509391. |
Relevant studies included in other review |
|
Garcia Guerra G, Almeida L, Zorzela L, King-Jones S, Joffe AR, Hartling L, Jou H, Vohra S; Canadian Critical Care Trials Group. Efficacy of music on sedation, analgesia and delirium in critically ill patients. A systematic review of randomized controlled trials. J Crit Care. 2019 Oct;53:75-80. doi: 10.1016/j.jcrc.2019.06.006. Epub 2019 Jun 4. PMID: 31202161. |
No meta-analysis |
|
Golubovic J, Neerland BE, Aune D, Baker FA. Music Interventions and Delirium in Adults: A Systematic Literature Review and Meta-Analysis. Brain Sci. 2022 Apr 28;12(5):568. doi: 10.3390/brainsci12050568. PMID: 35624955; PMCID: PMC9138821. |
No meta-analysis |
|
Huang S, Xu J, Du Y, Wang Y, Wei H, Wei G, Hu M. The effect of evidence-based cluster nursing intervention on the incidences of delirium and the prognoses of ICU patients. Am J Transl Res. 2021 Jul 15;13(7):8309-8315. PMID: 34377321; PMCID: PMC8340266. |
Does not meet PICO (I) |
|
Jaber S, Bahloul H, Guétin S, Chanques G, Sebbane M, Eledjam JJ. Effets de la musicothérapie en réanimation hors sédation chez des patients en cours de sevrage ventilatoire versus des patients non ventilés [Effects of music therapy in intensive care unit without sedation in weaning patients versus non-ventilated patients]. Ann Fr Anesth Reanim. 2007 Jan;26(1):30-8. French. doi: 10.1016/j.annfar.2006.09.002. Epub 2006 Nov 3. PMID: 17085009. |
Language |
|
Kang J, Lee M, Ko H, Kim S, Yun S, Jeong Y, Cho Y. Effect of nonpharmacological interventions for the prevention of delirium in the intensive care unit: A systematic review and meta-analysis. J Crit Care. 2018 Dec;48:372-384. doi: 10.1016/j.jcrc.2018.09.032. Epub 2018 Sep 29. PMID: 30300863. |
Does not meet PICO (P) |
|
Khan SH, Xu C, Purpura R, Durrani S, Lindroth H, Wang S, Gao S, Heiderscheit A, Chlan L, Boustani M, Khan BA. Decreasing Delirium Through Music: A Randomized Pilot Trial. Am J Crit Care. 2020 Mar 1;29(2):e31-e38. doi: 10.4037/ajcc2020175. PMID: 32114612; PMCID: PMC7666845. |
Does not meet PICO (C) |
|
Liao J, Kui C, Zhou Y, Huang L, Zuo D, Huang Y, Pan R. Effect of Programmed Comprehensive Nursing for Postoperative Delirium in Intensive Care Unit Patients. Evid Based Complement Alternat Med. 2022 May 11;2022:1227659. doi: 10.1155/2022/1227659. PMID: 35600946; PMCID: PMC9117019. |
Does not meet PICO (P) |
|
Litton E, Carnegie V, Elliott R, Webb SA. The Efficacy of Earplugs as a Sleep Hygiene Strategy for Reducing Delirium in the ICU: A Systematic Review and Meta-Analysis. Crit Care Med. 2016 May;44(5):992-9. doi: 10.1097/CCM.0000000000001557. PMID: 26741578. |
Design / search |
|
Lulu, Lv. Effect of earplugs and eye masks on sleep quality and delirium in intensive care patients. Critical Care & Shock - Volume 22, Issue 1, pp. 66-66 - published 2019-01-01 |
Conference abstract |
|
Luther R, McLeod A. The effect of chronotherapy on delirium in critical care - a systematic review. Nurs Crit Care. 2018 Nov;23(6):283-290. doi: 10.1111/nicc.12300. Epub 2017 May 15. PMID: 28508438. |
Design |
|
Mailhot T, Cossette S, Côté J, Bourbonnais A, Côté MC, Lamarche Y, Denault A. A post cardiac surgery intervention to manage delirium involving families: a randomized pilot study. Nurs Crit Care. 2017 Jul;22(4):221-228. doi: 10.1111/nicc.12288. Epub 2017 Mar 31. PMID: 28371230. |
Does not meet PICO (C) |
|
Matsuura Y, Ohno Y, Toyoshima M, Ueno T. Effects of non-pharmacologic prevention on delirium in critically ill patients: A network meta-analysis. Nurs Crit Care. 2022 May 27. doi: 10.1111/nicc.12780. Epub ahead of print. PMID: 35624556. |
Relevant studies included in other review |
|
Moon KJ, Lee SM. The effects of a tailored intensive care unit delirium prevention protocol: A randomized controlled trial. Int J Nurs Stud. 2015 Sep;52(9):1423-32. doi: 10.1016/j.ijnurstu.2015.04.021. Epub 2015 May 19. PMID: 26032729. |
Included in review |
|
Oh ES, Fong TG, Hshieh TT, Inouye SK. Delirium in Older Persons: Advances in Diagnosis and Treatment. JAMA. 2017 Sep 26;318(12):1161-1174. doi: 10.1001/jama.2017.12067. PMID: 28973626; PMCID: PMC5717753. |
Does not meet PICO (P) |
|
Pieri M, De Simone A, Rose S, De Domenico P, Lembo R, Denaro G, Landoni G, Monaco F. Trials Focusing on Prevention and Treatment of Delirium After Cardiac Surgery: A systematic Review of Randomized Evidence. J Cardiothorac Vasc Anesth. 2020 Jun;34(6):1641-1654. doi: 10.1053/j.jvca.2019.09.028. Epub 2019 Sep 24. PMID: 31668634. |
Does not meet PICO (P) |
|
Potharajaroen S, Tangwongchai S, Tayjasanant T, Thawitsri T, Anderson G, Maes M. Bright light and oxygen therapies decrease delirium risk in critically ill surgical patients by targeting sleep and acid-base disturbances. Psychiatry Res. 2018 Mar;261:21-27. doi: 10.1016/j.psychres.2017.12.046. Epub 2017 Dec 18. PMID: 29276990. |
Included in review |
|
Rains J, Chee N. The role of occupational and physiotherapy in multi-modal approach to tackling delirium in the intensive care. J Intensive Care Soc. 2017 Nov;18(4):318-322. doi: 10.1177/1751143717720589. Epub 2017 Jul 18. PMID: 29123562; PMCID: PMC5661800. |
Design |
|
Reznik ME, Slooter AJC. Delirium Management in the ICU. Curr Treat Options Neurol. 2019 Nov 14;21(11):59. doi: 10.1007/s11940-019-0599-5. PMID: 31724092. |
Design / search |
|
Siddiqi N, Harrison JK, Clegg A, Teale EA, Young J, Taylor J, Simpkins SA. Interventions for preventing delirium in hospitalised non-ICU patients. Cochrane Database Syst Rev. 2016 Mar 11;3:CD005563. doi: 10.1002/14651858.CD005563.pub3. PMID: 26967259. |
Does not meet PICO (P) |
|
Simons KS, Laheij RJ, van den Boogaard M, Moviat MA, Paling AJ, Polderman FN, Rozendaal FW, Salet GA, van der Hoeven JG, Pickkers P, de Jager CP. Dynamic light application therapy to reduce the incidence and duration of delirium in intensive-care patients: a randomised controlled trial. Lancet Respir Med. 2016 Mar;4(3):194-202. doi: 10.1016/S2213-2600(16)00025-4. Epub 2016 Feb 16. PMID: 26895652. |
Included in review |
|
Van Rompaey B, Elseviers MM, Van Drom W, Fromont V, Jorens PG. The effect of earplugs during the night on the onset of delirium and sleep perception: a randomized controlled trial in intensive care patients. Crit Care. 2012 May 4;16(3):R73. doi: 10.1186/cc11330. PMID: 22559080; PMCID: PMC3580615. |
Included in review |
|
Wassenaar A, Rood P, Schoonhoven L, Teerenstra S, Zegers M, Pickkers P, van den Boogaard M. The impact of nUrsiNg DEliRium Preventive INnterventions in the Intensive Care Unit (UNDERPIN-ICU): A study protocol for a multi-centre, stepped wedge randomized controlled trial. Int J Nurs Stud. 2017 Mar;68:1-8. doi: 10.1016/j.ijnurstu.2016.11.018. Epub 2016 Dec 8. PMID: 28013104. |
Protocol |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 26-06-2024
Laatst geautoriseerd : 26-06-2024
Geplande herbeoordeling : 01-01-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten die op de intensive care worden behandeld.
Werkgroep
- dr. T.H. (Thomas) Ottens, intensivist, NVIC
- drs. N.C. (Niels) Gritters van den Oever, intensivist, NVIC
- dr. K.S. (Koen) Simons, internist-Intensivist, NVIC
- D. (Daphne) Bolman, patiëntvertegenwoordiger, FCIC en IC Connect
- Dr. R. (Roel) van Oorsouw, fysiotherapeut/onderzoeker, KNGF/NVZF
- D.L.J. (David) Moolenaar, internist-intensivist, NIV
- dr. M.C.W. (Meta) van der Woude, anesthesioloog-intensivist, NVA
- dr. R.J. (Robert Jan) Osse, psychiater, NVVP
- Prof.dr. M. (Mark) van den Boogaard, senior verpleegkundig onderzoeker, V&VN IC
- dr. B.E. (Liesbeth) Bosma, ziekenhuisapotheker, NVZA
- drs. N.M.S. (Nienke) Golüke, klinisch geriater, NVKG
Met ondersteuning van:
- dr. M.M.J. (Machteld) van Rooijen, adviseur, Kennisinstituut van Medisch Specialisten
- dr. L.M.P. (Linda) Wesselman, adviseur, Kennisinstituut van Medisch Specialisten
- drs. F. (Florien) Ham, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
dr. T.H. (Thomas) Ottens |
Intensivist, Staflid Intensive Care HagaZiekenhuis |
- Lid Geneesmiddelcommissie HagaZiekenhuis - Plaatsvervangend opleider intensive care HagaZiekenhuis - Freelance arts bij evenementen, MAI medische diensten (nieuw 0-uren verband, nog nooit ingezet) - Voormalig lid tijdelijk COVID-19 expert panel, Gilead Sciences Nederland |
Mijn partner is betrokken bij onderzoeksprojecten "Muziek als Medicijn" van het Erasmus MC. Dit project omvat meerdere studies naar muziekinterventies tegen angst, stress, pijn en delirium rondom operaties en ernstige ziekten.
Ik ontvang een bijdrage voor een wetenschappelijk onderzoeksproject "EARLY DELTA trial" van Prolira B.V. Zij leveren onder andere een delirium-monitor "DeltaScan". |
Exclusie betrokkenheid bij een uitgangsvraag over de deltascan. |
|
drs. N.C. (Niels) Gritters van den Oever |
intensivist 1,0 fte Treant Zorggroep medisch manager IC, vakgroephoofd IC, lid stafbestuur (vacatievergoeding) |
- Chief Medical Officer Landelijk Coördinatiecentrum Patiënten Spreiding (vacatievergoeding) - lid commissie Acute Tekorten Geneesmiddelen (ATG en ATG+) deel van Landelijk Coördinatiecentrum Geneesmiddelen (vergadervergoeding) |
Geen. |
Geen actie. |
|
dr. K.S. (Koen) Simons |
internist-intensivist (betaald) Jeroen Bosch Ziekenhuis |
- Lid van diverse commissies in het ziekenhuis (o.a. donatiecommissie als voorzitter, reanimatiecommissie), (onbetaald) - co-promotor promovendus (onbetaald) - FCCS instructeur (betaald) - Lid PSA richtlijn, subrichtlijn Sedatie en Analgesie op de IC (betaald) |
In het verleden tot 2018 contact gehad met Philips research in het kader van onderzoek naar effecten van licht en geluid op de IC; toen gebruik gemaakt van apparatuur en expertise van onderzoekers Philips Geen betaald adviseurschap Geen directe financiële belangen in een bedrijf of aandelen Geen eigenaar van lopend patent of product.
Als lokale P.I./ subinvestigator betrokken bij meerdere sponsor-driven en investigator driven onderzoeken, waaronder 1) REMAP-CAP studie (studie naar effect verschillende soorten behandeling bij community acquired pneumonie. Financiering door overheid); MONITOR-IC studie (studie: studie naar lange termijnuitkomsten van IC patienten; financiering door overheid/ ziekenhuis (radboudumc)); 3) REVIVAL studie (studie naar effect van medicament op nierschade bij IC patienten; financiering door bedrijf) 4) OSCAR studie (studie naar effect van anti-GM-CSF ( Otilimab) op verloop COVID 19 ; financiering door Glaxo Smith Kline). |
Geen actie. |
|
D. (Daphne) Bolman |
Vrijwillig bestuurslid |
Geen. |
Boegbeeldfunctie bij een patiënten- of beroepsorganisatie |
Geen actie. |
|
Dr. R. (Roel) van Oorsouw |
Fysiotherapeut/ onderzoeker Radboudumc |
- Lid KNGF ethiekcommissie - Lid ethiekcommissie Radboudumc |
Geen. |
Geen actie. |
|
D.L.J. (David) Moolenaar |
Internist-intensivist |
Geen. |
Geen. |
Geen actie. |
|
dr. M.C.W. (Meta) van der Woude |
Anesthesioloog-intensivist, medisch specialist patiëntveiligheid - Zuyderland MC 0,4 FTE, betaald" |
- Medisch adviseur Triage voor letselschade incidenteel, betaald - Werkt mee aan een voorlichtingsfilm over delirium en de deltascan, onbetaald",
|
Deelname als Investigator bij extern gefinancierd onderzoek: 1) MONITOR-IC (Studie onder andere onder supervisie via het Radboud. Doel is om patiënten na ontslag langdurig te vervolgen na ontslag IC, zie https://monitor-ic.nl. (financiering ZonMW). Enkel betrokkenheid bij een deel van de studie die de COVID patiënten uit de eerste golf betrof, daarna niet meer); 2) CoDaP studie (Corona Data driven interventions & data Platform binnen de euregio data verzamelen van Covid patiënten en analyseren, gefinancierd door INTERREG en Europese Unie); 3) studie naar de CoLab score, testen van bundel laboratorium parameters waarmee je kunt bepalen of iemand met COVID veilig uit de isolatie gehaald kan worden in het ziekenhuis. Ik ben hierbij patiëntvertegenwoordiger. (financiering ZonMW); 4) NeNesCo studie (mede onderzoeker bij studie naar neurologische outcome na eerste COVID golf. Financiering ZonMw).
Ben gevraagd voor voorlichtingsfilm over delier door firma Prolira. Dit is zonder vergoeding. |
Exclusie betrokkenheid bij een uitgangsvraag over de deltascan. |
|
dr. R.J. (Robert Jan) Osse |
Psychiater, staflid, Erasmus MC, afdeling psychiatrie |
- Raad van toezicht ISTDP-house (psychotherapeutische behandeling en dagbehandeling). - Voorzitter, In sociorum salutem, (medisch genootschap sinds 1840). - Voorzitter werkgroep vrijheidsbeperkende interventies (VBI), Erasmus MC. - Voorzitter Stichting Jos Schaap-Feering (fonds voor onderzoek naar bipolaire stoornissen) - Participatie aan Euridice-trial (onderzoek naar haloperidol op delirium in IC) en aan de MUSIC-Trail (onderzoek naar effecten van Muziek op delirium) - Participatie aan onderzoek door verpleegkundig specialisten (o.a. naar VBI)" |
- Echtgenote is eigenaar van Calandschoen, tevens consultant-adviseur in eigen praktijk en is werkzaam bij Filosofische school Nederland, (allen zonder directe relatie of belangen met zaken uit de medische of farmaceutische wereld). - Eerder participatie aan richtlijn delirium bij volwassenen. - Eerste auteur bij hoofdstukken over delirium in handboek Spoedeisende psychiatrie en handboek Psychiatrie in het ziekenhuis.
|
Geen actie. |
|
dr. M. (Mark) van den Boogaard |
Senior onderzoeker intensive care Radboudumc |
Onbezoldigde functies: - Bestuurslid European Delirium Association - Adviseur Network for lnvestigation of Delirium: Unifying Scientists (NIDUS) - Organisator IC-café regio Nijmegen & Omstreken - Lid werkgroep Longterm Outcome and ICU Delirium van de European Society of lntensive Care Medicine - Lid richtlijn Nazorg en revalidatie IC-patiënten |
Gemeld maar niet van belang in het kader van deze richtlijn: ZonMw subsidies: - programma GGG [2013]: Prevention of ICU delirium and delirium-related outcome with haloperidol; a multicentre randomized controlled trial - programma DO [2015]: The impact of nUrsing DEliRium Preventive lnterventions in the lntensive Care Unit (UNDERPIN-ICU)
ZIN subsidie: - programma Gebruiken van uitkomsteninformatie bij Samen beslissen [2018]: Samen beslissen op de IC: het gebruik van (patiëntgerapporteerde) uitkomst informatie bij gezamenIijke besluitvorming over IC-opname en behandelkeuzes op de IC |
Geen actie. |
|
dr. B.E. (Liesbeth) Bosma |
Ziekenhuisapotheker Haga ziekenhuis |
Voorzitter HiX gebruikersgroep antistolling, onbezoldigd. |
Mijn partner werkt bij Astra Zeneca, maar heeft niets van doen met PADIS of IC. |
Geen actie. |
|
drs. N.M.S. (Nienke) Golüke |
Klinisch geriater ziekenhuis Gelderse Vallei |
Geen. |
Geen. |
Geen actie. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van IC-Connect voor de werkgroep. IC-Connect heeft een achterbanraadpleging gedaan om het patiëntenperspectief in kaart te brengen. Het verslag hiervan [zie aanverwante producten] is besproken in de werkgroep. De verkregen input is meegenomen bij de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen bij elke module. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging IC-Connect en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
Module |
Uitkomst raming |
Toelichting |
|
Module Non-farmacolgische interventies delirium |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. |
Implementatie
Inleiding
Dit plan is opgesteld ter bevordering van de implementatie van de richtlijn LTH en PCS in de chronische fase. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het toepassen en naleven van de aanbevelingen. Daarbij heeft de richtlijncommissie een advies uitgebracht over het tijdspad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die voor verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
• per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
• de verwachtte impact van implementatie van de aanbeveling op de zorgkosten;
• randvoorwaarden om de aanbeveling te kunnen implementeren;
• mogelijk barrières om de aanbeveling te kunnen implementeren;
• mogelijke acties om de implementatie van de aanbeveling te bevorderen;
• verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbevelingen is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord. Er kan een onderscheid worden gemaakt tussen “sterk geformuleerde aanbevelingen” en “zwak geformuleerde aanbevelingen”. In het eerste geval doet de richtlijncommissie een duidelijke uitspraak over iets dat zeker wel of zeker niet gedaan moet worden. In het tweede geval wordt de aanbeveling minder zeker gesteld (bijvoorbeeld “Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe meer uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”. Bij elke module is onderstaande tabel opgenomen.
|
Aanbeveling |
Tijdspad voor implementatie: 1 tot 3 jaar of > 3 jaar |
Verwacht effect op kosten |
Randvoorwaarden voor implementatie (binnen aangegeven tijdspad) |
Mogelijke barrières voor implementatie1 |
Te ondernemen acties voor implementatie2 |
Verantwoordelijken voor acties3 |
Overige opmerkingen |
|
|
|
|
|
|
|
|
|
1 Barrières kunnen zich bevinden op het niveau van de professional, op het niveau van de organisatie (het ziekenhuis) of op het niveau van het systeem (buiten het ziekenhuis). Denk bijvoorbeeld aan onenigheid in het land met betrekking tot de aanbeveling, onvoldoende motivatie of kennis bij de specialist, onvoldoende faciliteiten of personeel, nodige concentratie van zorg, kosten, slechte samenwerking tussen disciplines, nodige taakherschikking, et cetera.
2 Denk aan acties die noodzakelijk zijn voor implementatie, maar ook acties die mogelijk zijn om de implementatie te bevorderen. Denk bijvoorbeeld aan controleren aanbeveling tijdens kwaliteitsvisitatie, publicatie van de richtlijn, ontwikkelen van implementatietools, informeren van ziekenhuisbestuurders, regelen van goede vergoeding voor een bepaald type behandeling, maken van samenwerkingsafspraken.
3 Wie de verantwoordelijkheden draagt voor implementatie van de aanbevelingen, zal tevens afhankelijk zijn van het niveau waarop zich barrières bevinden. Barrières op het niveau van de professional zullen vaak opgelost moeten worden door de beroepsvereniging. Barrières op het niveau van de organisatie zullen vaak onder verantwoordelijkheid van de ziekenhuisbestuurders vallen. Bij het oplossen van barrières op het niveau van het systeem zijn ook andere partijen, zoals de NZA en zorgverzekeraars, van belang. Echter, aangezien de richtlijn vaak enkel wordt geautoriseerd door de (participerende) wetenschappelijke verenigingen is het aan de wetenschappelijke verenigingen om deze problemen bij de andere partijen aan te kaarten.
Implementatietermijnen
Voor “sterk geformuleerde aanbevelingen” geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Voor de meeste “sterk geformuleerde aanbevelingen” betekent dat dat zij komend jaar direct geïmplementeerd moeten worden en dat per 2023 dus iedereen aan deze aanbevelingen dient te voldoen.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die op de intensive care worden behandeld. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijn (NVIC, 2010]) op noodzaak tot revisie. Tevens zijn de volgende partijen uitgenodigd om knelpunten aan te dragen via een schriftelijke knelpunteninventarisatie: Inspectie Gezondheidszorg en Jeugd, Nederlandse Federatie van Universitair Medisch Centra, Nederlands Huisartsen Genootschap, Nederlandse Vereniging van Ziekenhuizen, Patiëntenfederatie Nederland, Samenwerkende Topklinische opleidingsZiekenhuizen, Nederlandse Associate Physician Assistants, Zorginstituut Nederland, Zelfstandige Klinieken Nederland, Zorgverzekeraars Nederland, Vereniging Innovatieve Geneesmiddelen, Nederlandse Vereniging voor Intensive Care, Nederlandse Vereniging voor Anesthesiologie, Nederlandse Vereniging van Ziekenhuisapothekers, Nederlandse Vereniging voor Klinische Geriatrie, Nederlandse Internisten Vereniging, Nederlandse Vereniging voor Neurologie, Nederlandse Vereniging voor Psychiatrie, Verpleegkundigen en Verzorgenden Nederland-afdeling intensive care, Koninklijk Nederlands Genootschap voor Fysiotherapie, Stichting Family and Patient Centered Intensive Care. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kennislacunes
Tijdens de ontwikkeling van de richtlijn ‘PADIS’ is systematisch gezocht naar onderzoeksbevindingen die nuttig konden zijn voor het beantwoorden van de uitgangsvragen. Een deel (of een onderdeel) van de hiervoor opgestelde zoekvragen is met het resultaat van deze zoekacties te beantwoorden, een groot deel echter niet. Door gebruik te maken van de evidence-based methodiek (EBRO) is duidelijk geworden dat er nog kennislacunes bestaan. De werkgroep is van mening dat (vervolg)onderzoek wenselijk is om in de toekomst een duidelijker antwoord te kunnen geven op vragen uit de praktijk. Om deze reden heeft de werkgroep per module aangegeven op welke vlakken nader onderzoek gewenst is.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.