Niet-geoxygeneerde machineperfusie versus statisch koud bewaren
Uitgangsvraag
Wat is de waarde van hypotherme, niet-geoxygeneerde machineperfusie van postmortale donornieren?
Aanbeveling
Pas hypotherme niet-geoxygeneerde machineperfusie toe als standaard preservatiemethode gedurende de gehele orgaanpreservatieperiode voor alle nieren afkomstig van postmortale orgaandonoren.
- Maak geen onderscheid naar typen donoren: Vooralsnog lijkt deze preservatiemethode geïndiceerd voor nieren afkomstig van donatie na hartdood én donatie na hersendood.
- Maak geen onderscheid naar donorleeftijd.
Voor de plaats van oxygenatie bij hypotherme machineperfusie, zie module Geoxygeneerde machineperfusie versus niet-geoxygeneerde machineperfusie. Voor de aanbeveling met betrekking tot gecombineerde preservatiemethode, zie module Module Machineperfusie na een periode van statisch koud bewaren.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het was tot op heden onvoldoende duidelijk wat de wetenschappelijk onderbouwing is ten aanzien van vertraagde transplantaatfunctie (delayed graft function, DGF), transplantaatoverleving en nierfunctie na niertransplantatie na hypotherme, niet-geoxygeneerde machine perfusie en na statisch koud bewaren in ontvangers van postmortale donornieren. Er is daarom literatuuronderzoek verricht. Er zijn vijf gerandomiseerde studies gevonden die voldoen aan de PICO. De resultaten uit deze studies laten een significant en klinisch relevant verschil zien op de cruciale uitkomstmaat DGF en ook op de belangrijke uitkomstmaten transplantaatoverleving en nierfunctie na 6 en 12 maanden. De totale bewijskracht is als ‘redelijk’ te classificeren, doordat het betrouwbaarheidsinterval rondom de puntschatter voor de cruciale uitkomstmaat DGF de onderste grens van klinische relevantie overschrijdt. De bewijskracht voor de uitkomstmaat transplantaatoverleving is echter hoog en deze uitkomstmaat is uiteindelijk de belangrijkste indicator voor het succes van een niertransplantatie. Op basis van deze resultaten bestaat er een voorkeur voor het gebruik van hypotherme machinale perfusie als orgaanpreservatiemethode in het gehele tijdsinterval tussen orgaanuitname en -transplantatie.
Hoewel er in sommige studies aanwijzingen zijn dat nieren van oudere donoren meer baat zouden kunnen hebben, is er op dit moment nog onvoldoende bewijs dat er bij het wel of niet toepassen van hypotherme machineperfusie gedifferentieerd zou moeten worden naar bepaalde leeftijdscategorieën. Er is ook geen bewijs voor de soms heersende overtuiging dat nieren van hartdode donoren meer baat zouden hebben bij hypotherme machineperfusie dan nieren van hersendode donoren. Het bewijs voor de superioriteit van hypotherme machineperfusie over statisch koud bewaren is er met name voor een situatie waarin alle postmortale nieren, en dus niet slechts een selectie, koud worden gepompt.
Belangrijke randvoorwaarden die in ogenschouw genomen dienen te worden zijn:
- Bij deze PICO is uitdrukkelijk alleen maar gekeken naar het effect van hypotherme, niet-geoxygeneerde machineperfusie. Inmiddels is er ook een geoxygeneerde variant van deze preservatiemethode beschikbaar, waarvan wordt beschreven dat deze nog beter zou kunnen zijn. De volgende PICO van deze richtlijn behandelt die wetenschappelijke vraag.
- In met name de Amerikaanse literatuur is er veel data beschikbaar over het effect van hypotherme machineperfusie van postmortale donornieren die slechts enkele uren, direct voorafgaand aan transplantatie (‘eind-ischemisch’), op de pomp hebben gestaan en dus het grootste deel van de preservatieperiode statisch koud zijn bewaard. Hoewel in die studies meestal ook een significante vermindering van de incidentie van DGF wordt beschreven, hebben we deze data bewust buiten beschouwing gelaten, omdat het de typische Nederlandse praktijk is om nieren koud te pompen gedurende de gehele preservatieperiode. Daarom zijn in deze PICO alleen studies opgenomen waarin nieren van orgaanuitname tot transplantatie koud werden gepompt.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor patiënten is het belangrijk dat zij een donornier krijgen die zo lang mogelijk overleeft met een goede functie. Voor hen is het daarom van belang dat een preservatie techniek gebruikt wordt, waarvan is aangetoond dat deze voor de beste postoperatieve transplantaatfunctie en -overleving zorgt.
De werkgroep is van mening dat patiënten niet betrokken moeten worden bij de keuze voor een nierpreservatiemethode, omdat het op het moment dat die keuze gemaakt dient te worden (nog vóór orgaanuitname) vaak nog niet helemaal zeker is naar wie het orgaan gaat.
Belangrijkste doel van hypotherme machineperfusie is te zorgen voor een betere postoperatieve transplantaatfunctie en -overleving, hetgeen de algehele gezondheid, levensverwachting en kwaliteit van leven van de patiënt ten goede komt. Voor patiënten zijn er geen duidelijke nadelen van hypotherme machineperfusie te verwachten.
Vooralsnog valt het niet te verwachten dat bij de keuze voor het wel of niet inzetten van hypotherme machineperfusie gedifferentieerd zou moeten worden naar bepaalde categorieën ontvangers (nierpatiënten). De werkgroep is van mening dat hypotherme machineperfusie aanbevolen kan worden als de beste orgaanpreservatiemethode voor alle volwassen ontvangers van postmortale donornieren.
Kosten (middelenbeslag)
Gezien het positieve effect van hypotherme machineperfusie op alle drie de in de PICO gedefinieerde uitkomstmaten, acht de werkgroep eventuele extra kosten die geassocieerd zijn met deze interventie gerechtvaardigd. De kosten van een vertraagd op gang komend, of vroegtijdig falend niertransplantaat zijn doorgaans zeer hoog (terugkeer naar dialyse, meer morbiditeit, noodzaak om opnieuw een niertransplantatie te ondergaan), zowel in termen van financiën, als in termen van (verlies van) kwaliteit van leven. Iedere interventie die de kans hierop significant verkleint is dus in principe zeer gewenst. Hoewel dit niet binnen het bestek van deze PICO viel, is er ook een aantal kosteneffectiviteitsstudies gevonden, waarin zelfs wordt gesuggereerd dat het toepassen van hypotherme machineperfusie bij alle postmortale donornieren zou kunnen leiden tot een netto reductie van gezondheidszorgkosten, alsmede een toename in quality-adjusted life years (QALY’s) (Groen, 2012).
Aanvaardbaarheid, haalbaarheid en implementatie
Aangezien de aanbevelingen niet afwijken van de huidige praktijk, is implementatie niet van toepassing. Het overwegen van het toepassen van hypotherme niet-geoxygeneerde machineperfusie is aanvaardbaar en haalbaar.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De huidige wetenschappelijke literatuur laat een duidelijk voordeel zien van hypotherme niet-geoxygeneerde machineperfusie ten opzichte van statisch koud bewaren. Met name de uitkomstmaten ‘delayed graft function’ en transplantaatoverleving worden overtuigend verbeterd door het toepassen van machineperfusie, waarbij de verbetering ook klinisch relevant wordt geacht. Hoewel machineperfusie geassocieerd is met hogere kosten dan statisch koud bewaren, zal een lagere incidentie van DGF en een betere transplantaatoverleving leiden tot lagere kosten na niertransplantatie. Hoe deze balans precies uitvalt is afhankelijk van de marktprijzen op een bepaald moment. Gezien de duidelijke klinische superioriteit en het feit dat dergelijke betere uitkomsten eventuele extra kosten rechtvaardigen is de werkgroep van mening dat hypotherme niet-geoxygeneerde machineperfusie gedurende de gehele orgaanpreservatieperiode kan worden aanbevolen voor alle typen postmortale donornieren.
Onderbouwing
Achtergrond
Between organ retrieval and transplantation, deceased-donor kidneys must be stored for several hours (organ preservation), as time is needed for transport from donor to recipient hospital, preparing the recipient and possibly carrying out immunological cross-matches before transplantation can take place. Cooling the kidney to a temperature below 10 degrees Celsius during organ preservation delays the onset of additional damage during this period. Worldwide, deceased-donor kidneys are usually stored static cold. However, there is increasing interest in dynamic cold preservation (hypothermic machine perfusion), as this storage method may improve transplantation results. Because there now appears to be considerable evidence for this approach, hypothermic machine perfusion has been the standard preservation method for all deceased-donor kidneys in the Netherlands for several years now. The Netherlands are a forerunner in this, because most countries have not (yet) fully introduced this dynamic preservation method. Despite the current national implementation, there is still a need for a guideline with a thorough and structured scientific basis for whether to use hypothermic machine perfusion.
Conclusies / Summary of Findings
Delayed graft function (DGF) - critical
|
Moderate GRADE |
Kidney transplantation following hypothermic, non-oxygenated machine perfusion likely results in a reduction in delayed graft function when compared with kidney transplantation after static cold storage in recipients of deceased-donor kidneys.
Sources: Moers, 2009; Tedesco-Silva, 2017; Zhong, 2017; Kwiatkowski, 2009; Summers, 2020 |
Graft survival censored for death with a functioning graft - important
|
High GRADE |
Kidney transplantation following hypothermic, non-oxygenated machine perfusion results in better graft survival when compared with kidney transplantation after static cold storage in recipients of deceased- donor kidneys.
Sources: Moers, 2009; Zhong, 2017; Kwiatkowski, 2009; Summers, 2020 |
Renal function (6 and 12 months post-transplant in terms of eGFR) - important
|
Moderate GRADE |
Kidney transplantation following hypothermic, non-oxygenated machine perfusion likely results in a better renal function at 12 months when compared with kidney transplantation after static cold storage in recipients of deceased- donor kidneys.
Sources: Tedesco-Silva, 2017; Summers, 2020 |
Samenvatting literatuur
Description of studies
Tedesco-Silva (2017) performed a multicenter, prospective, randomized controlled trial to compare the use of static cold storage (SCS) versus continuous hypothermic machine perfusion (MP) in a cohort of kidney transplant recipients at high risk for delayed graft function (DGF). The primary endpoint was the incidence of DGF. Secondary endpoints included the duration of DGF, hospital stay, primary nonfunction, estimated glomerular filtration rate, acute rejection, and allograft and patient survivals. Donors younger than 18 years, with unstable hemodynamic condition, and when combined transplants were anticipated, were excluded. Enrollment occurred in two periods, from July 26, 2014, to August 22, 2014, and from January 26, 2015, to March 28, 2015, depending on the availability of machine, perfusion kit, and preservation solution. During both periods, the organ procurement organizations (OPO) screened 262 donors. Of 104 randomized donors, 39 were multiorgan donors and 65 kidney-only donors. In total, 160 kidneys (80 preserved in cold storage and 80 in continuous machine perfusion) from 80 donors were randomized, transplanted, and followed up for 12 months in 14 different transplant centers in the state.
Moers (2009) performed an international randomized controlled trial to compare MP with SCS preservation in deceased-donor kidney transplantation with DGF as primary outcome. Organ donors had to be 16 years of age or older. Only kidney pairs from deceased donors were included in the study, either from donation after brain death (DBD) or donation after cardiocirculatory death (DCD). Kidney pairs were included only if both organs were transplanted into two different recipients. If one kidney was transplanted into the same recipient together with another organ, this kidney pair was excluded. The only exclusion criterion for recipients was the death of the patient in the first week after transplantation since a follow-up of at least one week was required to determine the primary end point. A total of 336 consecutive deceased donors were randomized to MP and the other to SCS. All 672 recipients were followed for one year.
Zhong (2017) performed a randomized controlled trial to compare the effect of MP and SCS in protecting kidneys harvested from DCDs. The early outcomes measured by the study were DGF and functional DGF (f-DGF). Subsequent outcome was the resistance index of the main renal artery, subsegmental artery, and interlobular artery which were calculated by color Doppler ultra- sound (LOGIQ E9, GE, Fairfield, CT, USA) within 48 h after transplantation. Graft survival rates at one and three years are used for long-term prognosis. The study period was from July 2010 to July 2015. A total of 168 DCDs were identified in this study; 27 donors were excluded and 282 kidneys from 141 donors were included in the study.
Summer (2020) performed a multicenter randomized controlled trial to compare outcomes of kidneys stored with MP versus SCS. Fifty-one pairs of DCD kidneys were randomly allocated to receive SCS or cold pulsatile MP. The primary endpoint, delayed graft function, was analyzed by “intention-to-treat” evaluation. Secondary endpoints included day 7 estimated glomerular filtration rate (eGFR), slow graft function (defined as a fall of <10% for 3 consecutive days in first 7 days), whether the recipient was dialysis-free at 30 days posttransplant, incidence of acute rejection (biopsy proven), 3- and 12- month death censored graft survival, 3- and 12- month eGFR (using the MDRD equation) and serum creatinine (if patient had died, or graft failed, these were excluded from the analysis), 1-year patient survival and hospital stay.
The study recruited kidney transplant recipients between May 2011 and April 2016 in 5 UK transplant centers (Cambridge, Leeds, Manchester, Edinburgh and Glasgow). All DCD donors attended by participating organ recovery teams, were considered for inclusion in the trial. Recipients were considered for inclusion if they were adults (≥18 y old) and if they were 1 of a pair of recipients of a single kidney transplant from the same donor. Recipients were excluded if they did not give informed consent, if they had a positive cytotoxic or flow cytometric crossmatch, if the kidneys were transplanted in a nonparticipating transplant center, if patients were a recipient of a non-kidney solid-organ transplant, and if the kidney underwent some form of normothermic perfusion preservation either in-situ or ex-situ.
Kwiatkowski (2009) performed a prospective randomized study to assess prospectively the long term function and survival of paired kidney allografts retrieved from the same donor, comparing the influence of SCS and MP. There were 37 deceased donors, and 74 kidneys were procured. Reported outcomes were DGF, graft survival, return to dialysis, percentage of patients with creatine <2 mg/dl at 5 years and patient survival.
Results
Delayed graft function (DGF)
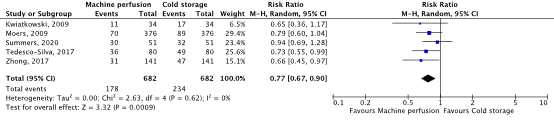
The outcome measure DGF was reported in five randomized controlled trials (Moers, 2009; Tedesco-Silva, 2017; Zhong, 2017; Kwiatkowski, 2009; Summers, 2020). A total of 682 patients were included in both the MP and SCS group. A pooled risk ratio (RR) of 0.77 (95% confidence interval (CI) 0.67 to 0.90) was calculated, favoring the MP group (figure 1). The difference is considered clinically relevant.
Figure 1. Delayed graft function
Random effects model. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Graft survival censored for death with functioning graft
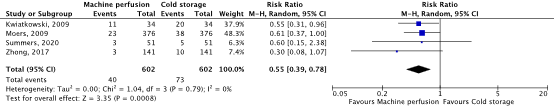
The outcome measure graft survival was reported in five randomized controlled trials (Moers, 2009; Tedesco-Silva, 2017; Zhong, 2017; Kwiatkowski, 2009; Summers, 2020). The results from Tedesco-Silva (2017) could not be included in the meta-analysis because the exact data was not described. A total of 602 patients were included in both the MP and SCS group. A pooled RR of 0.55 (95% C) 0.39 to 0.78) was calculated, favoring the MP group (figure 2). The difference is considered clinically relevant.
Figure 2. Graft survival
Random effects model. Z: p-value of pooled effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Renal function (6- and 12-months post-transplant in terms of eGFR)
The outcome measure renal function in terms of eGFR was reported in two randomized controlled trials (Tedesco-Silva, 2017; Summers, 2020). The result could not be pooled due difference in data notation.
Tedesco-Silva (2017) reported a mean 12 month post-transplant renal function of 54.4 (standard deviation (SD): 28.6) and 48.3 (SD: 19.8) mL/min per 1.73m2 in the MP and SCS group, respectively. This resulted in a mean difference of 6.10 mL/min per 1.73m2 (95% CI: -1.52 to 13.72), favoring MP. The difference is considered clinically relevant.
Summers (2020) reported a median 12-month post-transplant renal function of 46.8 (interquartile rate (IQR): 37 to 63) and 44.1 (IQR: 34 to 55) mL/min per 1.73m2 in the MP and CS group, respectively.
Level of evidence of the literature
The level of evidence for all outcomes were based on randomized studies and therefore started high.
Delayed graft function (DGF)
The quality of evidence regarding the outcome measure DGF was downgraded by one level because of exceeding the lower limit of clinical relevance (-1, imprecision), resulting in a level of evidence of moderate.
Graft survival censored for death with functioning graft
The quality of evidence regarding the outcome measure graft survival was not downgraded, resulting in a level of evidence of high.
Renal function (6- and 12-months post-transplant in terms of eGFR)
The quality of evidence regarding the outcome measure renal function was downgraded by one level because of exceeding the upper limit of clinical relevance (-1, imprecision), resulting in a level of evidence of moderate.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)beneficial effects of non-oxygenated kidney preservation in recipients of deceased-donor kidneys compared to static cold storage?
| P: | Recipients of post-mortem donor kidneys, subdivided into 1) all types of deceased-donor kidneys together, 2) DBD kidneys, 3) DCD kidneys, 4) DBD ECD kidneys, 5) DCD ECD kidneys, 6) ESP kidneys (=DBD and DCD 65+) |
| I: | Kidney transplantation following hypothermic, non-oxygenated machine perfusion throughout the entire pathway between organ retrieval and transplantation |
| C: | Kidney transplantation after static cold storage during the entire process between organ retrieval and transplantation |
| O: | Delayed graft function (DGF), graft survival censored for death with functioning graft, renal function 6 and 12 months post-transplant in terms of estimated glomerular filtration rate (eGFR) |
Relevant outcome measures
The guideline development group considered delayed graft function (DGF) as a critical outcome measure for decision making; and graft survival censored for death with functioning graft, renal function 6 and 12 months post-transplant in terms of eGFR as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions in the studies.
The working group used the GRADE standard limits of 25% for dichotomous outcomes and 10% for continuous variables as minimal clinically (patient) important differences. For the outcome measure eGFR a minimal clinically relevant difference of 4-5 mL/min was used.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 21-6-2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 408 hits. Studies were selected based on the following criteria: systematic reviews, RCTs and observational studies about machine preservation of deceased-donor kidneys. Nineteen studies were initially selected based on title and abstract screening. After reading the full text, 14 studies were excluded (see the table with reasons for exclusion under the tab Methods), and five studies were included.
Results
Five studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Groen H, Moers C, Smits JM, Treckmann J, Monbaliu D, Rahmel A, Paul A, Pirenne J, Ploeg RJ, Buskens E. Cost-effectiveness of hypothermic machine preservation versus static cold storage in renal transplantation. Am J Transplant. 2012 Jul;12(7):1824-30.
- Kwiatkowski A, Wszoła M, Kosieradzki M, Danielewicz R, Ostrowski K, Domagala P, Lisik W, Fesołowicz S, Michalak G, Trzebicki J, Durlik M, Paczek L, Rowiński W, Chmura A. The early and long term function and survival of kidney allografts stored before transplantation by hypothermic pulsatile perfusion. A prospective randomized study. Ann Transplant. 2009 Jan-Mar;14(1):14-7. PMID: 19289991.
- Moers C, Pirenne J, Paul A, Ploeg RJ; Machine Preservation Trial Study Group. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 2012 Feb 23;366(8):770-1. doi: 10.1056/NEJMc1111038. PMID: 22356343.
- Summers DM, Ahmad N, Randle LV, O'Sullivan AM, Johnson RJ, Collett D, Attia M, Clancy M, Tavakoli A, Akyol M, Jamieson NV, Bradley JA, J E Watson C. Cold Pulsatile Machine Perfusion Versus Static Cold Storage for Kidneys Donated After Circulatory Death: A Multicenter Randomized Controlled Trial. Transplantation. 2020 May;104(5):1019- 1025. doi: 10.1097/TP.0000000000002907. PMID: 31403552.
- Tedesco-Silva H Junior, Mello Offerni JC, Ayres Carneiro V, Ivani de Paula M, Neto ED, Brambate Carvalhinho Lemos F, Requião Moura LR, Pacheco E Silva Filho A, de Morais Cunha MF, Francisco da Silva E, Miorin LA, Demetrio DP, Luconi PS, da Silva Luconi WT, Bobbio SA, Kuschnaroff LM, Noronha IL, Braga SL, Barsante RC, Mendes Moreira JC, Fernandes-Charpiot IMM, Abbud-Filho M, Modelli de Andrade LG, Dalsoglio Garcia P, Tanajura Santamaria Saber L, Fernandes Laurindo A, Chocair PR, Cuvello Neto AL, Zanocco JA, Duboc de Almeida Soares Filho AJ, Ferreira Aguiar W, Medina Pestana J. Randomized Trial of Machine Perfusion Versus Cold Storage in Recipients of Deceased Donor Kidney Transplants With High Incidence of Delayed Graft Function. Transplant Direct. 2017 Apr 18;3(5):e155. doi: 10.1097/TXD.0000000000000672. PMID: 28573190; PMCID: PMC5441986.
- Tingle SJ, Figueiredo RS, Moir JA, Goodfellow M, Talbot D, Wilson CH. Machine perfusion preservation versus static cold storage for deceased donor kidney transplantation. Cochrane Database Syst Rev. 2019 Mar 15;3(3):CD011671. doi: 10.1002/14651858.CD011671.pub2. PMID: 30875082; PMCID: PMC6419919.
- Zhong Z, Lan J, Ye S, Liu Z, Fan L, Zhang Y, Fu Z, Qiao B, Shiu-Chung Ko D, Wang Y, Ye Q. Outcome Improvement for Hypothermic Machine Perfusion Versus Cold Storage for Kidneys From Cardiac Death Donors. Artif Organs. 2017 Jul;41(7):647-653. doi: 10.1111/aor.12828. PMID: 2803374.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Moers, 2009 |
Type of study: parallel RCT
Setting and country: Netherlands, Belgium and Germany
Funding and conflicts of interest:
Organ Recovery Systems government of Flanders consulting fees from Bristol-Myers Squibb and grant support from Nuts Ohra Trust; Dutch Kidney Foundation Eurotrans-Bio pro-donor project;
No other potential conflict of interest relevant to this article was reported
|
Inclusion criteria: organ donors had to be 16 years of age or older. Only kidney pairs from deceased donors were included in the study, either from donation after brain death or donation after CCD. The category for donors without a heartbeat had to be Maastricht category III (awaiting CCD after withdrawal of treatment) or IV (CCD in a brain-dead donor).
Exclusion criteria: Kidney pairs were excluded if both organs were not transplanted into two different recipients. If one kidney was transplanted into the same recipient together with another organ, this kidney pair was excluded
N total at baseline: Intervention: 376 Control: 376
Important prognostic factors2: Mean age, range (years) I: 52, 2 to 79 C: 53, 11 to 79
Sex: Not reported
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Machine perfusion: LifePort transporter machines (pulsatile perfusion) using KPS-1 solution
|
Describe control (treatment/procedure/test):
Static cold storage: UW or HTK solutions |
Length of follow-up: 36 months
Loss-to-follow-up: 1 patient, unclear which group
Incomplete outcome data: 1 patient, unclear which group
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Delayed graft function I: 70/376 C: 89/376
2. Graft survival 1 year I: 94% C: 90%
3. Renal function (6 and 12 months post-transplant Not reported |
Author’s conclusion:
In conclusion, the present trial showed that hypothermic machine perfusion reduced the in- cidence of delayed graft function in the kidneys obtained from the most common types of de- ceased donors. In addition, machine perfusion re- duced the duration of delayed graft function, when it occurred. Machine-perfused renal allografts had a lower risk of graft failure in the first year af- ter transplantation and, as a result, these kid- neys showed an improved 1-year graft survival as compared with kidneys preserved by static cold storage.
|
|
Tedesco-Silva, 2017 |
Type of study: parallel RCT
Setting and country: Brazil
Funding and conflicts of interest: The authors declare no funding or conflicts of interest.
|
Inclusion criteria: We screened all adult brain dead deceased donors referred to a single OPO during the enrollment period. To be included in the study it was required the availability of the equipment and trained surgeons and sufficient time to recover the organs, considering the distance to travel at the time of referral. Exclusion criteria: We excluded donors younger than 18 years, with unstable hemodynamic condition, and when combined transplants were anticipated.
N total at baseline: Intervention: 80 Control: 80
Important prognostic factors2: Mean age ± SD (years): I: 47.4 ± 15.6 C: 48.9 ± 12.3
Sex (M/F): I: 45/35 C: 49/31
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Machine perfusion: LifePort transporter machines (Organ Recovery Systems) using KPS-1
|
Describe control (treatment/procedure/test):
Static cold storage: SPS-1 (Organ Recovery Systems) or Celsior preservation solution (Genzyme) based on surgeon preference.
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: None
Control: 2(2.5%) Reasons not described
Incomplete outcome data: None
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Delayed graft function I: 36/80 C: 49/80
2. Graft survival One year patient and death-censored graft survivals were not different between the 2 groups and were not influenced by the incidence of DGF or acute rejection. No exact data was reported.
3. Renal function (6 and 12 months) mean ± SD, mL/min per 1.73 m2
6 months not reported
12 months: I: 54.4 ± 28.6 C: 48.3 ± 19.8 |
Author’s conclusion:
In this cohort of recipients of deceased donor kidneys with high mean cold ischemia time and high incidence of DGF, the use of continuous machine perfusion was associated with a reduced risk of DGF compared with the traditional cold storage preservation method.
|
|
Zhong, 2017
|
Type of study: parallel RCT
Setting and country: China
Funding and conflicts of interest: Funding not reported. The authors have declared that there is no conflict of interests in the article.
|
Inclusion criteria: DCD donors which where Maastricht category III; organ donors had to be at least 16 years of age
Exclusion criteria: Not reported
N total at baseline: Intervention: 141 Control: 141
Important prognostic factors2: Mean age ± SD (years): I: 41.4 ± 11.6 C: 40.6 ± 9.3
Sex (M/F): I: 79/62 C: 73/68
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Machine perfusion: LifePort kidney transporter machines (ORS) with a constant pressure of 30 mmHg and temperature of 0°C to 4°C was used for HMP using KPS-1
|
Describe control (treatment/procedure/test):
Static cold storage: UW solution |
Length of follow-up: 3 years
Loss-to-follow-up: Intervention: 6 (4.3) Reasons: Death (n=6)
Control: 8(5.7) Reasons: Death (n=8)
Incomplete outcome data: None
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Delayed graft function I: 31/141 C: 47/141
2. Graft survival 1 year I: 98% C 93% P=0.026
3 years I: 93% C: 82% P=0.036
3. Renal function (6 and 12 months) Not reported |
Author’s conclusion: From this study, our observations suggest that machine perfusion can reduce the rate of delayed graft function and the resistance of renal arteries, improve early graft function, and increase the graft survival rate, but the mechanisms remain unclear. We hypothesized that it may improve the viability of kidney by ameliorating vasospasm. Enlarged renal artery insured an increase of blood flow and a higher glomerular filtration rate, therefore, it reduced the DGF rate and increased the survival rate. However, more studies are needed to confirm our assumption.
|
|
Kwiatkowski, 2009 |
Type of study: RCT
Setting and country: Poland
Funding and conflicts of interest: Not reported |
Inclusion criteria: Not reported
Exclusion criteria: Not reported
N total at baseline: Intervention: 37 Control: 37
Important prognostic factors2: age ± SD: I: 37±12 C: 40±15
Sex: Not reported
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Machine perfusion (MP)
|
Describe control (treatment/procedure/test):
cold storage (CS)
|
Length of follow-up: 10 years
Loss-to-follow-up: Intervention: 3 (8.1%) Reasons not reported
Control: 3 (8.1%) Reasons not reported
Incomplete outcome data: Not reported
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Delayed graft function I: 11/34 C: 17/34
2. Graft survival I: 68.2% C: 43%
3. Renal function (6 and 12 months) Not reported |
Author’s conclusion:
Kidney storage by MP improves graft survival and reduces the number of patients who return to dialysis treatment at long-term post-transplant.
|
|
Summers, 2020 |
Type of study: RCT
Setting and country: UK
Funding and conflicts of interest:
PhD grant (UKT07-02) from NHS Blood and Transplant. Additional support was provided by NIHR BRC Cambridge and the study was on the NIHR Portfolio.
Conflict of interest not reported
|
Inclusion criteria: Recipients were considered for inclusion if they were adults (≥18 y old) and they were 1 of a pair of recipients of a single kidney transplant from the same donor.
Exclusion criteria: Recipients were excluded if they did not give informed consent, if they had a positive cytotoxic or flow cytometric crossmatch, if the kidneys were transplanted in a nonparticipating transplant center, if patients were a recipient of a non-kidney solid-organ transplant, and if the kidney underwent some form of normothermic perfu- sion preservation either in-situ or ex-situ.
N total at baseline: Intervention: 51 Control: 51
Important prognostic factors2: age ± SD: I: 56.6 ± 12.2 C: 54.5 ± 12.1
Sex: I: 64.7% M C: 60.8% M
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
cold pulsatile machine perfusion (MP)
|
Describe control (treatment/procedure/test):
static cold storage
|
Length of follow-up: 12 months
Loss-to-follow-up: None
Incomplete outcome data: none
|
Outcome measures and effect size (include 95%CI and p-value if available):
1. Delayed graft function I: 30/51 C: 32/51
2. Graft survival I: 96% C: 92%
3. Renal function, median eGFR (3, 6 and 12 months)
3 months I: 44.8mL/min C: 33.6mL/min
6 months Not reported
12 months I: 46.8 mL/min C: 44.1mL/min
|
Author’s conclusion: This study is underpowered, which limits definitive conclusions about the use of MP, as an alternative to static CS. It did not demonstrate that the use of MP reduces the incidence of delayed graft function in donation after circula- tory death kidney transplantation.
|
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Moers, 2009 |
Definitely yes;
Reason: Randomisation lists for each study region |
Definitely yes;
Reason: Allocation happened prior to procurement, whilst the donor was still in the ICU |
Definitely yes;
Reason: They performed blinding at the time of organ offer, so a centre could not turn down a kidney on the basis of storage method. No blinding, but outcome measurements are unlikely to be affected by the lack of blinding. |
Definitely yes;
Reason: Only 1 patient out of 672 was lost to follow-up. The rest were followed up to at least one year
|
Definitely yes;
Reason: All outcomes reported were present in the original study protocol except for PNF
|
No information |
LOW |
|
Tedesco-Silva, 2017 |
Definitely yes;
Reason: Randomisation using a web based program |
Definitely yes;
Reason: Once a random sequence was generated us- ing a web based program allocations were placed in opaque envelopes
|
Definitely yes;
Reason: No blinding but this is unlikely to affect the outcome, especially as there was no difference in CIT between the groups No blinding, but outcome measurements are unlikely to be affected by the lack of blinding
|
Definitely yes;
Reason: Clear reasons given for excluded pairs of kidneys. Primary outcome data reported for all 160 included participants. Only 2/ 160 were lost to follow up and were there- fore not included in the graft/patient sur- vival analysis
|
Definitely yes;
Reason: Outcomes suitable, with adequate reporting
|
Definitely yes;
Reason: Kidneys were assessed to ensure that both kidneys were suitable for HMP/SCS before randomisation. This removes the potential bias associated with excluding kidneys only if a kidney with unusual vascular anatomy is randomised to HMP |
LOW |
|
Zhong, 2017
|
Definitely yes;
Reason: No specific information on random sequence generation, but all consecutive donors were assessed for inclusion, and valid reasons were given for any excluded donors |
Definitely yes;
Reason: No specific information on allocation concealment but all consecutive donors were assessed for inclusion, and valid reasons were given for any excluded donors |
Definitely yes;
Reason: Transplanting teams were blinded to the perfusion parameter readings. Transplant teams were not blinded to the storage method used but this is unlikely to affect the outcome, especially as there was no difference in CIT between the groups
No blinding, but outcome measurements are unlikely to be affected by the lack of blinding |
Definitely yes;
Reason: Full follow-up was reported for all participants
|
Definitely yes;
Reason: Outcomes suitable, with adequate reporting
|
Definitely yes;
Reason: No kidneys were swapped between groups. An independent scientific steering commit- tee composed of clinicians and scientists was solely responsible for the design, con- duct, data analysis, and manuscript preparation
|
LOW |
|
Summer, 2020 |
Definitely yes;
Reason: The randomization sequence was based on random number integers from 1 to 4 taken from random number tables and this assigned kidneys to 1 of the 4 possible combinations of trial group. |
Definitely yes;
Reason: Sealed envelopes were used
|
Definitely yes;
Reason: No blinding, but outcome measurements are unlikely to be affected by the lack of blinding
|
Definitely yes;
Reason: No lost to follow-up |
Definitely yes;
Reason: Outcomes suitable, with adequate reporting
|
No information |
LOW |
|
Kwiatkowski, 2009 |
No information |
No information |
No information |
Probably yes;
Reason: same amount of lost to follow. |
Definitely yes;
Reason: Outcomes suitable, with adequate reporting |
No information |
Some concerns |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Wang W, Xie D, Hu X, Yin H, Liu H, Zhang X. Effect of Hypothermic Machine Perfusion on the Preservation of Kidneys Donated After Cardiac Death: A Single-Center, Randomized, Controlled Trial. Artif Organs. 2017 Aug;41(8):753-758. doi: 10.1111/aor.12836. Epub 2017 Feb 8. PMID: 28176336. |
Does not meet PICO criteria: wrong I (not specified whether hypothermic machine perfusion was oxygenated or non-oxygenated) |
|
Martínez Arcos L, Fabuel Alcañiz JJ, Gómez Dos Santos V, Burgos Revilla FJ. Functional Results of Renal Preservation in Hypothermic Pulsatile Machine Perfusion Versus Cold Preservation: Systematic Review and Meta-Analysis of Clinical Trials. Transplant Proc. 2018 Jan-Feb;50(1):24-32. doi: 10.1016/j.transproceed.2017.12.005. PMID: 29407316. |
Does not meet PICO criteria: wrong I (hypothermic pulsatile machine perfusion) |
|
Lam VW, Laurence JM, Richardson AJ, Pleass HC, Allen RD. Hypothermic machine perfusion in deceased donor kidney transplantation: a systematic review. J Surg Res. 2013 Mar;180(1):176-82. doi: 10.1016/j.jss.2012.10.055. Epub 2012 Nov 15. PMID: 23211958. |
Does not meet PICO criteria: wrong I (not specified whether hypothermic machine perfusion was oxygenated or non-oxygenated), older RCT |
|
Tingle SJ, Figueiredo RS, Moir JA, Goodfellow M, Thompson ER, Ibrahim IK, Bates L, Talbot D, Wilson CH. Hypothermic machine perfusion is superior to static cold storage in deceased donor kidney transplantation: A meta-analysis. Clin Transplant. 2020 Apr;34(4):e13814. doi: 10.1111/ctr.13814. Epub 2020 Mar 5. PMID: 32031711. |
Includes studies that do not comply with the PICO (oxygen not specified) |
|
Peng P, Ding Z, He Y, Zhang J, Wang X, Yang Z. Hypothermic Machine Perfusion Versus Static Cold Storage in Deceased Donor Kidney Transplantation: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Artif Organs. 2019 May;43(5):478-489. doi: 10.1111/aor.13364. Epub 2018 Nov 9. PMID: 30282122. |
Does not meet PICO criteria: wrong I (not specified whether hypothermic machine perfusion was oxygenated or non-oxygenated) |
|
Bathini V, McGregor T, McAlister VC, Luke PP, Sener A. Renal perfusion pump vs cold storage for donation after cardiac death kidneys: a systematic review. J Urol. 2013 Jun;189(6):2214-20. doi: 10.1016/j.juro.2012.11.173. Epub 2012 Dec 3. PMID: 23219548. |
Includes studies that do not comply with the PICO |
|
Watson CJ, Wells AC, Roberts RJ, Akoh JA, Friend PJ, Akyol M, Calder FR, Allen JE, Jones MN, Collett D, Bradley JA. Cold machine perfusion versus static cold storage of kidneys donated after cardiac death: a UK multicenter randomized controlled trial. Am J Transplant. 2010 Sep;10(9):1991-9. doi: 10.1111/j.1600-6143.2010.03165.x. PMID: 20883534. |
Does not meet PICO criteria: wrong I (for the kindney randomized to MP cold perfusion was used initially) |
|
Matsuno N, Sakurai E, Tamaki I, Uchiyama M, Kozaki K, Kozaki M. The effect of machine perfusion preservation versus cold storage on the function of kidneys from non-heart-beating donors. Transplantation. 1994 Jan;57(2):293-4. PMID: 8310523. |
Does not meet PICO criteria: wrong I (for the kindney randomized to MP cold perfusion was used initially) |
|
Brat A, de Vries KM, van Heurn EWE, Huurman VAL, de Jongh W, Leuvenink HGD, van Zuilen AD, Haase-Kromwijk BJJM, de Jonge J, Berger SP, Hofker SH. Hypothermic Machine Perfusion as a National Standard Preservation Method for Deceased Donor Kidneys. Transplantation. 2022 May 1;106(5):1043-1050. doi: 10.1097/TP.0000000000003845. Epub 2021 Jun 23. PMID: 34172648; PMCID: PMC9038234. |
Does not meet PICO criteria, observational study |
|
Merion RM, Oh HK, Port FK, Toledo-Pereyra LH, Turcotte JG. A prospective controlled trial of cold-storage versus machine-perfusion preservation in cadaveric renal transplantation. Transplantation. 1990 Aug;50(2):230-3. doi: 10.1097/00007890-199008000-00011. PMID: 2382290. |
Does not meet PICO criteria: wrong I (pulsatile machine perfusion preservation) |
|
Treckmann J, Moers C, Smits JM, Gallinat A, Maathuis MH, van Kasterop-Kutz M, Jochmans I, Homan van der Heide JJ, Squifflet JP, van Heurn E, Kirste GR, Rahmel A, Leuvenink HG, Pirenne J, Ploeg RJ, Paul A. Machine perfusion versus cold storage for preservation of kidneys from expanded criteria donors after brain death. Transpl Int. 2011 Jun;24(6):548-54. doi: 10.1111/j.1432-2277.2011.01232.x. Epub 2011 Feb 17. PMID: 21332580. |
Does not meet PICO criteria: wrong I (not specified whether hypothermic machine perfusion was oxygenated or non-oxygenated) |
|
Gallinat A, Moers C, Treckmann J, Smits JM, Leuvenink HG, Lefering R, van Heurn E, Kirste GR, Squifflet JP, Rahmel A, Pirenne J, Ploeg RJ, Paul A. Machine perfusion versus cold storage for the preservation of kidneys from donors ≥ 65 years allocated in the Eurotransplant Senior Programme. Nephrol Dial Transplant. 2012 Dec;27(12):4458-63. doi: 10.1093/ndt/gfs321. Epub 2012 Jul 26. PMID: 22844103. |
Does not meet PICO criteria: wrong P (donors aged ≥65y) |
|
Jochmans I, Moers C, Smits JM, Leuvenink HG, Treckmann J, Paul A, Rahmel A, Squifflet JP, van Heurn E, Monbaliu D, Ploeg RJ, Pirenne J. Machine perfusion versus cold storage for the preservation of kidneys donated after cardiac death: a multicenter, randomized, controlled trial. Ann Surg. 2010 Nov;252(5):756-64. doi: 10.1097/SLA.0b013e3181ffc256. PMID: 21037431. |
Same data used as in publication Moers (2009). |
|
Tingle SJ, Figueiredo RS, Moir JA, Goodfellow M, Talbot D, Wilson CH. Machine perfusion preservation versus static cold storage for deceased donor kidney transplantation. Cochrane Database Syst Rev. 2019 Mar 15;3(3):CD011671. doi: 10.1002/14651858.CD011671.pub2. PMID: 30875082; PMCID: PMC6419919. |
Includes studies that do not comply with the PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 08-05-2025
Beoordeeld op geldigheid : 01-05-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2023 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg met betrekking tot nierpreservatie bij postmortale nierdonatie.
Werkgroep
- Dr. C. (Cyril) Moers (voorzitter), NVvH, transplantatiechirurg, UMC Groningen
- Dr. D.K. (Dorottya) de Vries, NVvH, transplantatiechirurg, Leids Universitair Medisch Centrum
- Dr. A.D. (Arjan) van Zuilen, NTS, internist-nefroloog, UMC Utrecht
- Dr. J.D. (Jeroen) Langereis, HLA-WN, medisch-immunoloog, Radboud UMC
Met ondersteuning van
- Drs. B.L. (Babette) Gal-de Geest, adviseur Kennisinstituut van de Federatie Medisch Specialisten (tot mei 2024)
- Dr. A.C. (Anniek) van Westing, adviseur Kennisinstituut van de Federatie Medisch Specialisten (vanaf mei 2024)
- Drs. E.R.L. (Evie) Verweg, junior adviseur Kennisinstituut van de Federatie Medisch Specialisten (vanaf mei 2024)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Moers |
Transplantatiechirurg, UMCG |
Geen |
Extern gefinancierd onderzoek: ERC Starting GrantResearch grant Nukem Isotopes GmBH. Studie naar metabole activiteit na toevoeging van specifiek zuurstofisotoop tijdens normotherme machineperfusie in varkensnieren. PI van de studie. Onderwerp komt niet voor in de richtlijn.
Overige belangen: Eenmalige vergoeding als spreker bij Transplantatie Symposium van Astellas Pharma. |
Geen actie |
|
de Vries |
Transplantatiechirurg, LUMC |
Geen |
Extern gefinancierd onderzoek: PROPER studie naar normotherme perfusie (NMP) gefinancierd door Nierstichting, lokale onderzoeker. NMP komt niet voor in de richtlijn. |
Geen actie |
|
van Zuilen |
Internist-nefroloog, UMC Utrecht |
Geen |
Geen |
Geen actie |
|
Langereis |
Laboratorium Medische Immunologie, Radboud UMC |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van Nierpatiënten Vereniging Nederland voor de schriftelijke knelpuntenanalyse. De conceptrichtlijn is tevens ter commentaar voorgelegd aan Nierpatiënten Vereniging Nederland en de aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Preservatiemethode - Niet-geoxygeneerde machineperfusie versus statisch koud bewaren |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg met betrekking tot nierpreservatie bij postmortale nierdonatie.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Cluster/richtlijn: NVvH Nierpreservatie bij postmortale nierdonatie |
|
|
Uitgangsvraag/modules: UV2 Wat is de waarde van niet-geoxygeneerde dynamische nierpreservatie van postmortale donornieren? |
|
|
Database(s): Embase.com, Ovid/Medline |
Datum: 21 juni 2023 |
|
Periode: vanaf 1990 |
Talen: geen restrictie |
|
Literatuurspecialist: Alies van der Wal |
Rayyan review: https://rayyan.ai/reviews/704747 |
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht op de elementen:
De sleutelartikelen worden gevonden met deze search, m.u.v. PMID 22356343. Vanwege het publication type: letter. |
|
|
Te gebruiken voor richtlijnen tekst: Nederlands In de databases Embase.com en Ovid/Medline is op 21 juni 2023 systematisch gezocht naar systematische reviews, RCTs en observationele studies over dynamische nierpreservatie bij postmortale donornieren. De literatuurzoekactie leverde 408 unieke treffers op.
Engels On the 21st of June 2023, a systematic search was performed in the databases Embase.com and Ovid/Medline for systematic reviews, RCTs and observational studies about machine preservation of deceased-donor kidneys. The search resulted in 408 unique hits. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SR |
23 |
17 |
23 |
|
RCT |
69 |
67 |
78 |
|
Observationele studies |
157 |
114 |
165 |
|
Overig |
116 |
139 |
142 |
|
Totaal |
365 |
337 |
408* |
*in Rayyan
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#17 |
#9 NOT (#14 OR #15 OR #16) = overig |
116 |
|
#16 |
#9 AND (#12 OR #13) NOT (#14 OR #15) = observationeel |
157 |
|
#15 |
#9 AND #11 NOT #14 = RCT |
69 |
|
#14 |
#9 AND #10 = SR |
23 |
|
#13 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
14184281 |
|
#12 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
7697179 |
|
#11 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3813427 |
|
#10 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
937206 |
|
#9 |
#8 AND [1990-2023]/py |
365 |
|
#8 |
#7 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
404 |
|
#7 |
#5 AND #6 |
1021 |
|
#6 |
'machine perfusion'/exp OR 'kidney perfusion system'/exp OR 'organ perfusion system'/de OR ('perfusion'/exp AND 'machine'/exp) OR hmp:ti,ab,kw OR evkp:ti,ab,kw OR ((machine NEAR/2 (perfusion* OR preservation OR transport*)):ti,ab,kw) OR (('ex vivo' NEAR/3 perfusion):ti,ab,kw) |
9066 |
|
#5 |
#1 OR #4 |
38227 |
|
#4 |
#2 AND #3 |
21835 |
|
#3 |
'kidney donor'/exp OR 'kidney transplantation'/exp OR (((kidney* OR renal) NEAR/3 (donor* OR donat* OR transplant* OR allotransplant* OR homotransplant* OR graft*)):ti,ab,kw) |
214253 |
|
#2 |
'deceased donor'/exp OR bdd*:ti,ab,kw OR dbd*:ti,ab,kw OR dcd*:ti,ab,kw OR (((decease* OR dead OR death OR cadaver* OR 'non heart beat*' OR 'non heartbeat*' OR braindead OR postmort*) NEAR/4 (donor* OR donat*)):ti,ab,kw) |
60036 |
|
#1 |
'cadaver kidney'/exp OR (((decease* OR dead OR death OR cadaver* OR 'non heart beat*' OR 'non heartbeat*' OR braindead OR postmort* OR bdd* OR dbd* OR dcd*) NEAR/4 (kidney* OR renal)):ti,ab,kw) |
28020 |
Ovid/Medline
|
# |
Searches |
Results |
|
17 |
9 not (14 or 15 or 16) = overig |
139 |
|
16 |
(9 and (12 or 13)) not (14 or 15) = observationeel |
114 |
|
15 |
(9 and 11) not 14 = RCT |
67 |
|
14 |
9 and 10 = SR |
17 |
|
13 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5449144 |
|
12 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4465539 |
|
11 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2601166 |
|
10 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
675255 |
|
9 |
limit 8 to yr="1990 -Current" |
337 |
|
8 |
7 not (comment/ or editorial/ or letter/) not ((exp animals/ or exp models, animal/) not humans/) |
368 |
|
7 |
5 and 6 |
448 |
|
6 |
(hmp or evkp or (machine adj2 (perfusion* or preservation or transport*)) or ('ex vivo' adj3 perfusion)).ti,ab,kf. |
5156 |
|
5 |
1 or 4 |
19812 |
|
4 |
2 and 3 |
9384 |
|
3 |
exp Kidney Transplantation/ or ((kidney* or renal) adj3 (donor* or donat* or transplant* or allotransplant* or homotransplant* or graft*)).ti,ab,kf. |
132530 |
|
2 |
(bdd* or dbd* or dcd* or ((decease* or dead or death or cadaver* or 'non heart beat*' or 'non heartbeat*' or braindead or postmort*) adj4 (donor* or donat*))).ti,ab,kf. |
30994 |
|
1 |
((decease* or dead or death or cadaver* or 'non heart beat*' or 'non heartbeat*' or braindead or postmort* or bdd* or dbd* or dcd*) adj4 (kidney* or renal)).ti,ab,kf. |
15887 |