Minimaal invasieve chirurgie
Uitgangsvraag
Wat is de plaats van minimaal invasieve chirurgie ten opzichte van open chirurgie bij patiënten met een maagcarcinoom?
Aanbeveling
Overweeg om bij patiënten met een resectabel maagcarcinoom (alle subgroepen) minimaal invasieve chirurgie toe te passen, mits uitgevoerd in centra met expertise.
Overwegingen
Balans tussen gewenste en ongewenste effecten
De belangrijkste cruciale uitkomstmaat is overleving. De overleving op 1, 3 en 5 jaar werd onderzocht in meerdere studies, met hazard ratios rond de 1 en brede betrouwbaarheidsintervallen. Geen van deze uitkomsten liet een klinisch relevant verschil zien tussen minimaal invasieve en open chirurgie. Ook het risico op postoperatieve complicaties verschilde niet significant tussen beide behandelgroepen. De kwaliteit van leven leek in de STOMACH-studie klinisch beter in de open chirurgie groep, maar dit werd niet bevestigd in de LOGICA-studie. Pijnscores waren vergelijkbaar en niet klinisch verschillend.
Bij de belangrijke uitkomstmaten werd een klinisch relevant voordeel gezien voor de opnameduur: patiënten die laparoscopische chirurgie ondergingen verbleven gemiddeld 1,25 dagen korter in het ziekenhuis. Voor R0-resectie en lymfeklierretrieval werden kleine verschillen gerapporteerd, zonder klinische relevantie.
De bewijskracht voor alle uitkomstmaten werd als zeer laag beoordeeld vanwege risico op bias (door open-label design, onduidelijke allocatie en afwijkingen van het protocol) en heterogeniteit tussen studies. Hierdoor is er grote onzekerheid over de werkelijke effecten.
Aanvullend bewijs uit registratiedata of internationale richtlijnen werd niet geïdentificeerd. De interventie is echter technisch haalbaar en wordt reeds toegepast in de meeste Nederlandse centra en wereldwijd in hoog volume centra, wat wijst op een zekere mate van aanvaardbaarheid in de praktijk.
Er zijn geen aanwijzingen dat specifieke subgroepen, zoals ouderen of patiënten met comorbiditeit, een andere balans tussen voor- en nadelen ervaren, al is de literatuur hierover beperkt. Wel kunnen individuele voorkeuren (bijv. m.b.t. sneller herstel of minder littekens) meewegen in gezamenlijke besluitvorming.
Overleving (cruciaal)
Algehele overleving werd gerapporteerd in 3 studies (Jiang, 2022; STOMACH; Xing, 2024), maar met verschillende meet uitkomsten.
1.1 Eénjarige overleving
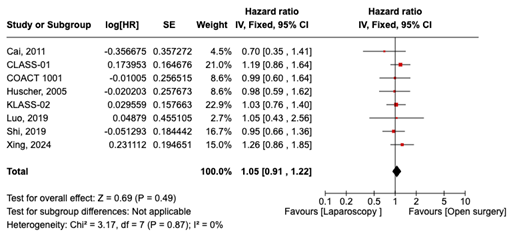
Eénjarige overleving werd gerapporteerd in 8 studies. De algehele hazards ratio (HR) was 1.05 (95% CI, 0.91 tot 1.22) bij vergelijking van patiënten die laparoscopie ondergingen met diegenen die open chirurgie ondergingen. Dit verschil werd als niet klinisch relevant beschouwd.
1.2 Driejarige overleving
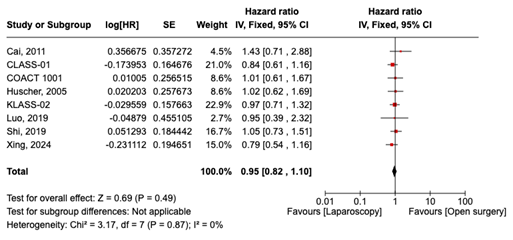
Driejarige overleving werd gerapporteerd in 8 studies. De algehele HR was 0.95 (95% CI, 0.82 tot 1.10) bij vergelijking van patiënten die laparoscopie ondergingen met diegenen die open chirurgie ondergingen. Dit verschil werd als niet klinisch relevant beschouwd.
1.3 Vijfjarige overleving
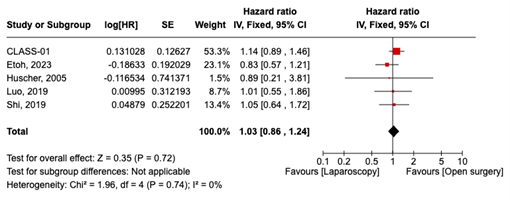
Vijfjarige overleving werd gerapporteerd in 5 studies. De algehele HR was 1.03 (95% CI, 0.86 tot 1.24) bij vergelijking van patiënten die laparoscopie ondergingen met diegenen die open chirurgie ondergingen. Dit verschil werd als niet klinisch relevant beschouwd.
Overleving als percentage werd gerapporteerd in één studie (STOMACH-trial). De éénjarige overlevingspercentage was 85.5% in de laparoscopie-groep vergeleken met 90.4% in de open chirurgie-groep. Aangezien er geen HR was gepresenteerd, kon de klinisch relevante verschil niet worden beoordeeld.
Complicaties (cruciaal)
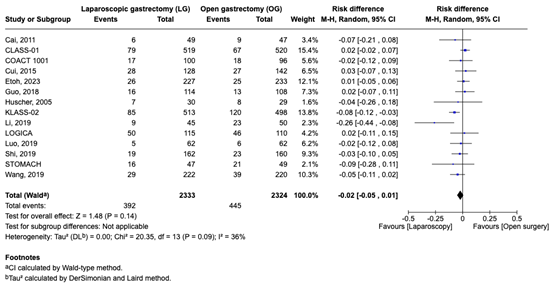
Complicaties werden gerapporteerd in 14 studies. Het risico verschil was -0.02 (95% CI, -0.05 tot 0.01) bij vergelijking van patiënten die laparoscopie ondergingen met diegenen die open chirurgie ondergingen. Dit verschil werd als niet klinisch relevant beschouwd.
Kwaliteit van leven (cruciaal)
Kwaliteit van leven (QoL) werd gerapporteerd in twee studies, de LOGICA-studie en de STOMACH-studie. In de STOMACH-studie werd een verschil van 17 punten in de overall health vastgesteld tussen patiënten die een laparoscopie ondergingen en diegenen die open chirurgie ondergingen. Het mediane verschil in overall health score van de EORTC-QLQ-C30, één jaar postoperatief, was 25 punten met een voorkeur voor open chirurgie. Deze verschillen werden beschouwd als klinisch significant ten gunste van open chirurgie. In de LOGICA-studie werden alleen gemiddelde verschillen gerapporteerd, en dit verschil werd als niet klinisch relevant beschouwd.
Pijn (cruciaal)
Pijn werd gerapporteerd in de STOMACH-studie met behulp van de EORTC QLQ-C30 pijnsymptoomscore. In de LOGICA-studie werd pijn beoordeeld met zowel de EORTC QLQ-C30 als de QLQ-STO22 pijnsymptoomschalen. De STOMACH-studie verstrekte geen individuele gegevens, maar gaf aan dat er geen verschillen in pijnscores waren tussen de laparoscopie-groep en de open chirurgie-groep. In de LOGICA-studie werden alleen gemiddelde verschillen gerapporteerd. Dit verschil werd als niet klinisch relevant beschouwd.
Opnameduur (belangrijk)
De opnameduur werd gerapporteerd in 11 studies. Het gemiddelde verschil was -1.25 (95% CI, -2.09 tot -0.41). Dit verschil werd als klinisch relevant beschouwd, ten gunste van laparoscopie.
R0-resectie (belangrijk)
R0-resectie werd gerapporteerd in 5 studies (KLASS-02; Li, 2019; COACT- 1001; LOGICA Jiang, 2022; STOMACH). Het risicoverschil was 0.01 (95% CI, -0.02 tot 0.03). Dit verschil werd als niet klinisch relevant beschouwd.
Lymfeklierretrieval (belangrijk)
Lymfeklierretrieval werd gerapporteerd in 13 studies. Het gemiddelde verschil was -1.05 (95% CI, -1.80 tot -0.31). Dit verschil werd als niet klinisch relevant beschouwd, ten gunste van laparoscopie.
Kwaliteit van bewijs
De overall kwaliteit van bewijs is zeer laag. Dit betekent dat we zeer onzeker zijn over het gevonden geschatte effect van de cruciale uitkomstmaten.
Er is afgewaardeerd vanwege zeer ernstige:
- Risk of Bias: Allocatie niet verborgen. Bias door open-label design.
- Inconsistentie: inconsistentie van de resultaten.
Waarden en voorkeuren van patiënten (en eventueel hun naasten/verzorgers)
De voorkeuren van patiënten kunnen sterk variëren afhankelijk van leeftijd, fitheid en persoonlijke afwegingen ten aanzien van risico’s en herstel. Samen beslissen op basis van duidelijke informatie over de (on)zekerheid van uitkomsten is daarom essentieel.
Patiënten met maagcarcinoom hechten doorgaans waarde aan een snel herstel, een kortere opnameduur en behoud van kwaliteit van leven. Hoewel cosmetiek zelden als primaire uitkomst wordt onderzocht, geven sommige patiënten de voorkeur aan minimaal invasieve chirurgie vanwege minder zichtbare littekens en een beter lichaamsbeeld. Ook geeft dit minder kans op grote littekenbreuken Tegelijkertijd blijven oncologische veiligheid en resectiekwaliteit cruciaal, zeker bij afwezigheid van een duidelijk overlevingsvoordeel. Gezien de onzekerheid in de bewijsvoering is gezamenlijke besluitvorming essentieel, afgestemd op individuele waarden en voorkeuren.
Kostenaspecten
De interventie (minimaal invasieve chirurgie) levert volgens de kostenanalyse uit de LOGICA-trial iets hogere totale kosten op dan open chirurgie, met een gemiddeld verschil van circa €750 per patiënt na één jaar. Deze meerkosten worden voornamelijk veroorzaakt door langere operatieduur en het gebruik van duurdere apparatuur. Daartegenover staan potentiële besparingen door kortere opnameduur (ondanks dat dat in de LOGICA trial niet werd aangetoond) en sneller herstel, wat kan leiden tot minder zorggebruik na ontslag en lagere maatschappelijke kosten. Gezien de vergelijkbare QALY-uitkomsten tussen beide benaderingen is de kosteneffectiviteit in balans, al is er geen sprake van een duidelijk kostenvoordeel of klinisch relevante gezondheidswinst.
Gelijkheid ((health) equity/equitable)
De interventie leidt naar verwachting tot gelijkblijvende (of slechts geringe afname) gezondheidsgelijkheid, aangezien minimaal invasieve chirurgie voor maagresectie inmiddels in de meerderheid van de Nederlandse centra wordt toegepast en daarmee breed toegankelijk is voor patiënten. Dit zal de komende tijd, met de verwachte veranderingen rondom IZA centralisatie en spreiding nog verder toenemen.
Aanvaardbaarheid:
Ethische aanvaardbaarheid
De interventie lijkt aanvaardbaar voor de betrokkenen. Er zijn geen ethische bezwaren, aangezien minimaal invasieve chirurgie een geaccepteerde behandelvorm is binnen de oncologische standaardzorg en bijdraagt aan patiëntgerichte uitkomsten zoals sneller herstel en behoud van kwaliteit van leven.
Duurzaamheid
Bij de interventie spelen de volgende duurzaamheidsaspecten een rol: minimaal invasieve chirurgie vereist doorgaans meer disposables en geavanceerde apparatuur, wat leidt tot hogere milieu-impact door afvalproductie en energieverbruik (R-ladder: Recycle/Recover). Bij de controlebehandeling (open chirurgie) is de milieu-impact mogelijk lager door minder gebruik van single-use instrumentarium, maar dit voordeel kan deels worden tenietgedaan door langere opnameduur en herstel, met bijbehorende zorgbelasting (R-ladder: Reduce). Chirurgen kunnen een belangrijke rol spelen bij de keuze voor meer duurzaam instrumentarium en andere ‘groene opties’ (zie de Green Deal Duurzame zorg, de leidraad Duurzaamheid in Richtlijnen en de handreiking Doelmatigheid en Duurzaamheid in Kwaliteitsstandaarden)
Haalbaarheid
De interventie lijkt haalbaar. Minimaal invasieve chirurgie bij maagresectie is in Nederland inmiddels breed geïmplementeerd en wordt in de meeste centra routinematig toegepast. Er is voldoende expertise aanwezig in gecertificeerde centra, en er bestaan geen juridische of financiële belemmeringen voor uitvoering binnen de huidige DBC-structuur. Verdere opschaling of concentratie vereist wel blijvende investering in training en apparatuur.
Rationale van de aanveling
Ondanks de zeer lage bewijskracht liet de beschikbare literatuur geen klinisch relevante verschillen zien in overleving of oncologische uitkomsten tussen minimaal invasieve en open maagresectie. Aangezien minimaal invasieve chirurgie gepaard gaat met voordelen, zoals kortere opnameduur, en tevens een vergelijkbare kwaliteit van de resectie oplevert, geeft de werkgroep een voorkeur aan minimaal invasieve benadering in centra met expertise.
Eindoordeel:
Zwakke aanbeveling voor (Overweeg).
Onderbouwing
Achtergrond
Currently, the guideline provides no clear recommendation regarding preferred surgical approach —minimally invasive versus open resection—for patients with gastric cancer. This may lead to variability in clinical practice and uncertainty in treatment selection. Given the potential advantages of minimally invasive surgery, such as reduced postoperative morbidity and faster recovery, it is important to determine whether these benefits are achieved without compromising oncological outcomes. Clarifying this could lead to more standardized care and improved short- and long-term health outcomes for patients.
Conclusies / Summary of Findings
Click here to see this table in a document
|
|
Outcome
|
Study results and measurements |
Absolute effect estimates |
Certainty of the Evidence (Quality of evidence) |
Conclusions |
|
|
Control |
Intervention |
|||||
|
Jiang, 2022
|
1-year survival (critical)
|
HR: 1.05 (95% CI, 0.91– 1.22)
|
Open surgery |
Laparoscopy |
Very low1 |
The evidence is very uncertain about the effect of Laparoscopy on survival when compared with Open surgery in patients with gastric carcinoma (Jiang, 2022) |
|
|
|
|||||
|
Jiang, 2022
Xing, 2024 |
3-years survival (critical)
|
HR: 0.95 (95% CI, 0.85– 1.10)
|
|
|
Very low1 |
The evidence is very uncertain about the effect of Laparoscopy on 3-years survival when compared with Open surgery in patients with gastric carcinoma (Jiang, 2022) |
|
Jiang, 2022
|
5-years survival (critical)
|
HR: 1.03 (95% CI, 0.86 to 1.24) |
|
|
Very low1 |
The evidence is very uncertain about the effect of Laparoscopy on 5-years survival when compared with Open surgery in patients with gastric carcinoma (Jiang, 2022) |
|
Jiang, 2022
Etoh, 2023
STOMACH trial |
Complications (critical) |
Risk difference: -0.02 (95% CI, -0.05 to 0.01) |
|
|
Very low1 |
The evidence is very uncertain about the effect of Laparoscopy on complications when compared with Open surgery in patients with gastric carcinoma (Jiang, 2022, Etoh, 2023, STOMACH trial ) |
|
STOMACH
LOGICA in Jiang, 2022
|
Quality of life (critical)
|
STOMACH: EQ-5D score difference: 17 points
Median difference EORTC-QLQ-C30: 25 points
LOGICA: Mean difference: 6 weeks: 2.5 (95% CI, -3.3 to 8.4) 3 months: 0.5 (95% CI, -4.3 to 7.5) 6 months: 3.6 (95% CI, -2.4 to 9.6) 9 months: 1.5 (95% CI, -4.7 to 7.7) 1 year: 2.5 (95% CI, -3.9 to 8.9) |
|
|
Very low1 |
The evidence is very uncertain about the effect of Laparoscopy on QoL when compared with Open surgery in patients with gastric carcinoma (LOGICA, STOMACH) |
|
LOGICA in Jiang, 2022
|
Pain (important) |
EORTC- QLQ-C30: Mean difference: 6 weeks: 0.9 (95% CI, -6.3 to 8.2) 3 months: 0.5 (95% CI, -6.8 to 7.8) 6 months: 0.5 (95% CI, -6.8 to 7.8) 9 months: (95% CI, -9.6 to 5.9) 1 year: (95% CI, -9.9 to 6.0)
QLQ-STO22 Mean difference: 6 weeks: 1.1 (95% CI, -4.7 to 7.0) 3 months: 3.4 (95% CI, -2.5 to 9.2) 6 months: 1.8 (95% CI, -4.1 to 7.8) 9 months: 0.4 (95% CI, -6.1 to 7.3) 1 year: -0.4 (95% CI, -6.7 to 6.0) |
|
|
Very low1 |
The evidence is very uncertain about the effect of Laparoscopy on pain when compared with Open surgery in patients with gastric carcinoma (LOGICA) |
|
Jiang, 2022
|
Length of hospital stay (important)
|
Mean difference of -1.25 days. |
|
|
Very low1 |
The evidence is very uncertain about the effect of Laparoscopy on length of hospital stay when compared with Open surgery in patients with gastric carcinoma (Jiang, 2022) |
|
Klass-02 in Jiang, 2022
COACT- 1001
Li, 2019
LOGICA in Jiang, 2022
STOMACH trial
|
R0 resection (important)
|
Risk difference: -0.01 (95% CI, -0.02 to 0.03). |
|
|
Very low1 |
The evidence is very uncertain about the effect of Laparoscopy on R0 resection when compared with Open surgery in patients with gastric carcinoma (LOGICA, STOMACH, Klass-02) |
|
Jiang, 2022
STOMACH trial |
Lymph node retrieval (important) |
Mean difference of -1.05 (95% CI, -1.80 to -0.31) |
|
|
Very low1 |
The evidence is very uncertain about the effect of Laparoscopy on Lymph node retrieval when compared with Open surgery in patients with gastric carcinoma (Jiang, 2022, STOMACH) |
|
1 Risk of bias: serious (-2 level). Allocation concealment questionable. Bias due to deviations from intended interventions Inconsistency: serious (-1 level). Due to inconsistency of the results. |
||||||
Samenvatting literatuur
Description of studies
A total of 4 studies were included in the analysis of the literature. Important study characteristics and results are summarized in table 2. The assessment of the risk of bias is summarized in the risk of bias tables (under the tab ‘Evidence tabellen’).
Systematic review of Jiang, 2022
- A systematic literature search was performed from inception until December 2021. Studies were considered eligible if they included adult patients (aged 18 years and older) diagnosed with advanced gastric cancer (AGC) and compared laparoscopic surgery for gastrectomy with open surgery for gastrectomy. The reported outcomes included short-term metrics such as postoperative complications, the number of retrieved lymph nodes, surgical time, blood loss, length of hospital stay, and short-term mortality (defined as in-hospital mortality and mortality within 30 days after the operation). Long-term outcomes assessed comprised survival rates at 1, 3, and 5 years, with a specific focus on overall survival (OS) and disease-free survival (DFS) rates. The study design was restricted to randomized controlled trials (RCTs).
Invidual study STOMACH trial
- A non-inferiority, multicenter, international randomized trial took place from January 2015 to June 2018 across 13 hospitals in six European countries: the Netherlands, Sweden, Spain, Italy, Germany, and the United Kingdom. Eligible patients had resectable adenocarcinoma of the stomach and underwent neoadjuvant chemotherapy, with total gastrectomy indicated based on tumor location. Participants had to be over 18 years old and classified as American Society of Anesthesiologists (ASA) 3 or lower. Those with early gastric cancer suitable for local treatment, distal gastric cancer eligible for distal gastrectomy, gastro-esophageal junction tumors, prior stomach surgery, or a history of other malignancies were excluded from the study.
Individual study of Etoh, 2023
- This study conducted an open-label, multi-institutional, prospective, randomized phase 2/3, focusing on patients with gastric adenocarcinoma in 37 participants hospitals in Japan between November 26, 2009, and July 29, 2016. Participants were eligible if they between 20 and 80 years, a BMI less than 30.
Individual study of Xing, 2024
- This study conducted a multicenter, non-inferiority, open label randomized clinical trial focusing on patients with gastric adenocarcinoma from five tertiary hospitals in China. Participants were eligible if they were 18 years and older and with no prior chemotherapy, immunotherapy or radiotherapy.
Table 2. Characteristics of included studies
*For further details, see risk of bias table in the appendix
Results
Survival (critical)
Overall survival was reported in 3 studies (Jiang,2022; STOMACH; Xing, 2024) but in different measurement outcomes.
1.1 1-year survival
1-year survival was reported in 8 studies. The overall HR was 1.05 (95% CI, 0.91 to 1.22) when comparing patients who underwent Laparoscopy (n=1651) to those who underwent Open surgery (n=1626). The difference was considered not clinically relevant (figure 1).
Figure 1. 1-year survival in patients who underwent Laparoscopy compared Open surgery
1 year-survival was reported as a rate in one study (STOMACH trial). The 1-year survival rate was 85.5% in the Laparoscopy group (n=47) compared to 90.4% in the Open surgery group (n=49). HR was not reported so the clinically relevant difference could not be assessed, and these data were not added to the pooled data.
1.2 3-years survival
3-years survival was reported in 8 studies. The overall HR was 0.95 (95% CI, 0.82 to 1.10) when comparing patients who underwent Laparoscopy (n=1651) to those who underwent Open surgery (n=1626). The difference was considered not clinically relevant (figure 2).
Figure 2. 3-years survival in patients who underwent Laparoscopy compared Open surgery
1.3 5-years survival
5-years survival was reported in 5 studies. The overall HR was 1.03 (95% CI, 0.86 to 1.24) when comparing patients who underwent Laparoscopy (=1021) to those who underwent Open surgery (n=1025). The difference was considered not clinically relevant (figure 3).
Figure 3. 5-years survival in patients who underwent Laparoscopy compared Open surgery
Complications (critical)
Complications were reported in 14 studies. The risk difference was -0.02 (95% CI, -0.05 to 0.01) when comparing patients who underwent Laparoscopy (n=2333) to those who underwent Open surgery (n=2324). This difference was considered not clinically relevant (figure 4).
Figure 4. Complications in patients who underwent Laparoscopy compared Open surgery
Quality of life (critical)
Quality of life (QoL) was reported in two studies, the LOGICA trial and the STOMACH trial, utilizing the EORTC-QLQ-C30 questionnaire. Additionally, the STOMACH trial used the EQ-5D. Both assessment tools use a Likert scale ranging from 0 to 100, where higher scores indicate a better quality of life.
In the STOMACH trial, one year after surgery, the overall health score using the EQ-5D was 68 (range: 50 to 83.8) for the Laparoscopy group (n=47) and 85 (range: 60 to 90) for the open surgery group (n=49), resulting in a difference of 17 points. The median overall health score from the EORTC-QLQ-C30 one-year post-surgery was 58.3 (range: 35.4 to 66.7) for the Laparoscopy group and 83.3 (range: 66.7 to 83.3) for the open surgery group, resulting in a difference of 25 points. These differences were considered clinically relevant in favor of open surgery.
In the LOGICA trial, only mean differences were reported (see Table 3), and these differences were considered not clinically relevant.
Table 3. QLQ-C30 global health-related quality of life score in patients who underwent Laparoscopy compared Open surgery. Source: LOGICA-trial
|
Follow up time |
Mean difference |
Confidence interval (95%) |
N (Laparoscopy | Open surgery) |
|
6 weeks |
2.5 |
-3.3 to 8.4 |
84 | 84 |
|
3 months |
1.6 |
-4.3 to 7.5 |
85 | 81 |
|
6 months |
3.6 |
9.6 to 22.4 |
79 | 80 |
|
9 months |
1.5 |
-4.7 to 7.7 |
70 | 76 |
|
1 year |
2.5 |
3.9 to 8.9 |
70 | 68 |
Length of hospital stay (important)
Length of hospital stay in days was reported in 11 studies. The mean difference was between Laparoscopy (n=1997) and Open surgery (n=1980) was -1.25 (95% CI, -2.09 to -0.41) days. This difference was considered clinically relevant in favor of Laparoscopy (figure 5).
Figure 5. Length of hospital stay in patients who underwent Laparoscopy compared Open surgery
R0 resection (important)
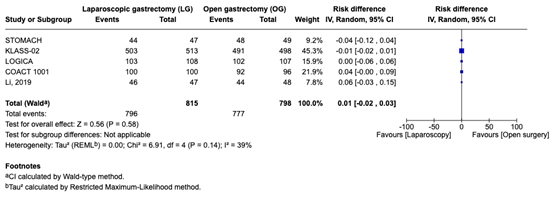
R0 resection was reported in 5 studies. A total of 796 out of 815 resections were performed in the Laparoscopy group compared to 777 resections out of 798 in the Open surgery group. The risk difference was -0.01 (95% CI, -0.02 to 0.03). This difference was considered not clinically relevant (figure 6).
Figure 6. R0 resection in patients who underwent Laparoscopy compared Open surgery
Lymph node retrieval (important)
Lymph node retrieval was reported as the number of resected lymph nodes in 13 studies. The mean difference between Laparoscopy (n=2099) and Open surgery (n=2088) was -1.05 (95% CI, -1.80 to -0.31). This difference was considered not clinically relevant (figure 7).
Figure 7. Lymph node retrieval in patients who underwent Laparoscopy compared Open surgery
Pain (important)
Pain was assessed in the Stomach trial using the EORTC QLQ-C30 pain symptom scale. In the LOGICA trial, pain was evaluated using both the EORTC QLQ-C30 and the QLQ-STO22 pain symptom scales. Scores on these scales range from 0 to 100, with higher scores indicating more severe symptoms. The Stomach trial did not provide individual data but indicated that there were no differences in pain scores between the Laparoscopy group (n = 40) and the open surgery group (n = 37). In the LOGICA trial, only mean differences were reported (table 4, 5). This difference was considered not clinically relevant.
Table 4. EORTC QLQ-C30 pain score in patients who underwent Laparoscopy compared Open surgery. Source: STOMACH- trial
|
Follow up time |
Mean difference |
Confidence interval (95%) |
N (Laparoscopy | Open surgery) |
|
6 weeks |
0.9 |
-6.3 to 8.2 |
84 | 84 |
|
3 months |
0.5 |
-6.8 to 7.8 |
85 | 81 |
|
6 months |
-2.8 |
-10.3 to 4.6 |
79 | 80 |
|
9 months |
-1.9 |
-9.6 to 5.9 |
70 | 76 |
|
1 year |
-2.0 |
-9.9 to 6.0 |
70 | 68 |
Table 5. QLQ-STO22 pain score in patients who underwent Laparoscopy compared Open surgery. Source: LOGICA-trial
|
Follow up time |
Mean difference |
Confidence interval (95%) |
N (Intervention | control) |
|
6 weeks |
1.1 |
-4.7 to 7.0 |
84 | 84 |
|
3 months |
3.4 |
-2.5 to 9.2 |
85 | 81 |
|
6 months |
1.8 |
-4.1 to 7.8 |
79 | 80 |
|
9 months |
0.4 |
-5.8 to 6.6 |
70 | 76 |
|
1 year |
-0.4 |
-6.7 to 6.0 |
70 | 68 |
Time to recovery (important)
No studies reported on time to recovery.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question(s):
What is the role of minimally invasive surgery compared to open surgery in patients with gastric carcinoma?
Table 1. PICO
| Patients | Patients with gastric carcinoma (after neoadjuvant treatment) |
| Intervention | Minimally invasive surgery (laparoscopy) |
| Control | Open surgery |
| Outcomes | Survival, complications (pulmonary, gastric), Quality of Life, pain, time to recovery, length of hospital stay, R0 resection, lymph node retrieval |
| Other selection criteria | Study design: systematic reviews and randomized controlled trials |
Relevant outcome measures
The guideline development group considered survival, complications and quality of life and as critical outcome measures for decision making and pain, time to recovery, length of hospital stay, R0 resection and lymph node retrieval as important outcome measures for decision making.
A priori, the guideline panel did not define the outcome measures listed above but used the definitions used in the studies.
The guideline panel defined minimal clinically (patient) important differences for the following outcomes:
- Survival: >5% or >3% and HR<0.70 and >1.43.
- Complications: Absolute difference ≥1% for lethal complications, or ≥5% for severe complications.
- Quality of life: A difference of 10 points on the quality of life instrument EORTC QLQ-C30 or a difference of a similar magnitude on other quality of life instruments.
- Pain: Change of 10 on 100mm (1 on 10) Visual Analogue Scale (VAS) (Myles, 2017) .
- Time to recovery: > 1 week.
- Length of hospital stay: > 1 day.
- R0 resection: Absolute difference >5% or absolute difference >3% with a Hazard Ratio (HR) <0.7.
- Lymph node retrieval: Number of resected lymph nodes >10% difference.
Search and select (Methods)
A systematic literature search was performed by a medical information specialist using the following bibliographic databases: Embase.com and Ovid/Medline. Both databases were searched from 2011 to 2025 for systematic reviews and RCTs. Systematic searches were completed using a combination of controlled vocabulary/subject headings (e.g., Emtree-terms, MeSH) wherever they were available and natural language keywords. The overall search strategy was derived from 2 primary search concepts: (1) Stomach carcinoma; (2) minimal invasive surgery. Duplicates were removed using EndNote software. After deduplication a total of 1225 records were imported for title/abstract screening. Initially, 13 studies were selected based on title and abstract screening. After reading the full text, 9 studies were excluded (see the exclusion table under the tab ‘Evidence tabellen’), and 4 studies were included.
Referenties
- 1 - Etoh T, Ohyama T, Sakuramoto S, Tsuji T, Lee SW, Yoshida K, Koeda K, Hiki N, Kunisaki C, Tokunaga M, Otsubo D, Takagane A, Misawa K, Kinoshita T, Cho H, Doki Y, Nunobe S, Shiraishi N, Kitano S; Japanese Laparoscopic Surgery Study Group (JLSSG). Five-Year Survival Outcomes of Laparoscopy-Assisted vs Open Distal Gastrectomy for Advanced Gastric Cancer: The JLSSG0901 Randomized Clinical Trial. JAMA Surg. 2023 May 1;158(5):445-454.
- 2 - Jiang J, Ye G, Wang J, Xu X, Zhang K, Wang S. The Comparison of Short- and Long-Term Outcomes for Laparoscopic Versus Open Gastrectomy for Patients With Advanced Gastric Cancer: A Meta-Analysis of Randomized Controlled Trials. Front Oncol. 2022 Apr 5;12:844803.
- 3 - van der Wielen N, Straatman J, Daams F, Rosati R, Parise P, Weitz J, Reissfelder C, Diez Del Val I, Loureiro C, Parada-González P, Pintos-Martínez E, Mateo Vallejo F, Medina Achirica C, Sánchez-Pernaute A, Ruano Campos A, Bonavina L, Asti ELG, Alonso Poza A, Gilsanz C, Nilsson M, Lindblad M, Gisbertz SS, van Berge Henegouwen MI, Fumagalli Romario U, De Pascale S, Akhtar K, Jaap Bonjer H, Cuesta MA, van der Peet DL. Open versus minimally invasive total gastrectomy after neoadjuvant chemotherapy: results of a European randomized trial. Gastric Cancer. 2021 Jan;24(1):258-271. doi: 10.1007/s10120-020-01109-w. Epub 2020 Jul 31. Erratum in: Gastric Cancer. 2021 Jan;24(1):272.
- 4 - van der Wielen N, Daams F, Rosati R, Parise P, Weitz J, Reissfelder C, Diez Del Val I, Loureiro C, Parada-González P, Pintos-Martínez E, Vallejo FM, Achirica CM, Sánchez-Pernaute A, Campos AR, Bonavina L, Asti ELG, Poza AA, Gilsanz C, Nilsson M, Lindblad M, Gisbertz SS, van Berge Henegouwen MI, Romario UF, De Pascale S, Akhtar K, Bonjer HJ, Cuesta MA, van der Peet DL, Straatman J. Health related quality of life following open versus minimally invasive total gastrectomy for cancer: Results from a randomized clinical trial. Eur J Surg Oncol. 2022 Mar;48(3):553-560.
- 5 - van der Wielen N, Brenkman H, Seesing M, Daams F, Ruurda J, van der Veen A, van der Peet DL, Straatman J, van Hillegersberg R; STOMACH and LOGICA study group. Minimally invasive versus open gastrectomy for gastric cancer. A pooled analysis of two European randomized controlled trials. J Surg Oncol. 2024 Apr;129(5):911-921.
- 6 - Xing J, Cai J, Wang X, Zhang N, An D, Li F, Cui M, Niu L, Gao C, Fan Q, Ren S, Zhang Z, Su X; SWEET trial group. Long-term outcomes of laparoscopic versus open distal gastrectomy for patients with advanced gastric cancer in North China: a multicenter randomized controlled trial. Surg Endosc. 2024 Sep;38(9):4976-4985.
Evidence tabellen
Risk of Bias table
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
LOGICA (Van der Veen, 20)
|
Definitely yes
Reason: Randomized in a 1:1 ratio.
|
Definitely no
Reason: NR |
Definitely no
Reason: Open-label |
Definitely yes
Reason: No loss to follow-up |
Definitely yes
Reason: All relevant outcomes were reported |
Probably yes
Reason: The first author holds a consulting or advisory position with Medtronic. |
Some concerns
|
|
STOMACH trial (van der Wielen, 2020) |
Definitely yes
Reason: Randomized in a 1:1 ratio.
|
Definitely yes
Reason: Computer-generated randomization too. |
Definitely no
Reason: Both patient and the surgeon were not blinded for the allocated procedure. |
Probably yes
Reason: NR |
Definitely yes
Reason: All relevant outcomes were reported |
Probably yes
Reason: Funded by Fonds NutsOhra (FNO). No conflicts of interest. |
Some concerns |
|
Etoh, 2022 |
Definitely yes
Reason: Randomization using minimization method. |
Definitely no
Reason: The procedure was not concealed from the investigators or patients.
|
Definitely no
Reason: Open-label
|
Probably no
Reason: 4 participants were lost to follow up in the intervention group compared to 1 in the control group. |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely yes
Reason: No conflicts of interest |
Some concerns |
|
Xing, 2024 |
Definitely yes
Reason: Randomly assigned to either intervention or control upon signing informed consent. |
Definitely no
Reason: The procedure was not concealed from investigators or patients. |
Definitely no
Reason: Open-label
|
Definitely no
Reason: After randomization 6 participants were lost to follow up in the intervention group compared to 2 in the control group. In the intervention group 4 participants were excluded compared to 8 in the control group. |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely no
Reason: No conflicts of interest |
Some concerns |
|
Cai, 2011 |
Probably yes
Reason: Randomization process. |
Definitely no
Reason: NR |
Definitely no
Reason: Open-label
|
Probably yes
Reason: NR |
Definitely yes
Reason: All relevant outcomes were reported. |
Definitely no
Reason: NR |
HIGH |
|
CLASS-01
Huang, 2019
|
Definitely yes
Reason: Randomization by use of the Pocock-Simon minimization method. |
Definitely yes
Reason: Participating sites submitted the above information to the data center at the Department of Biological Statistics, Southern Medical University, Guangzhou, China, where central randomization was performed. Information on treatment allocation was subsequently sent to each participating site. |
Definitely no
Reason: Open-label
|
Definitely no
Reason: Lost to follow up was infrequent between groups. |
Definitely yes
Reason: All relevant outcomes were reported |
Probably yes
Reason: sponsored by Nanfang Hospital, Southern Medical University. |
LOW |
|
COACT 1001
|
Definitely yes
Reason: Randomized in a 1:1 ratio.
|
Definitely yes
Reason: Randomized in a 1:1 ratio.
|
Definitely no
Reason: Open-label
|
Definitely no
Reason: Lost to follow up was infrequent between groups. |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely yes
Reason: No conflicts of interest |
Some concerns |
|
Cui, 2015
|
Probably yes
Reason: Randomization process. |
Definitely yes
Reason: Randomization was perfomed by closed envelopes. |
Definitely no
Reason: Open-label
|
Definitely no
Reason: Lost to follow up in the intervention group was 19 compared to 6 in the control group. |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely yes
Reason: No conflicts of interest |
Some concerns |
|
Guo, 2018 |
Probably yes
Reason: Randomization process. |
Definitely no
Reason: NR |
Definitely no
Reason: Open-label |
Probably no
Reason: NR |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely yes
Reason: No conflicts of interest |
High |
|
Huscher, 2005
|
Probably yes
Reason: Randomization process. |
Probably no
Reason: Single person was aware of randomization. |
Definitely no
Reason: Open-label
|
Definitely yes
Reason: No loss to follow-up |
Definitely yes
Reason: All relevant outcomes were reported |
Probably yes
Reason: No conflicts of interest |
High |
|
KLASS-02
Hyung, 2020 |
Definitely yes
Reason: Randomized in a 1:1 ratio.
|
Definitely yes
Reason: Using a confidential block size. |
Definitely no
Reason: Open-label
|
Probably no
Reason: No infrequencies. |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely yes
Reason: No conflicts of interest |
LOW |
|
Li, 2019 |
Definitely yes
Reason: Randomized by envelope method.
|
Definitely yes
Reason: Randomized by envelope method.
|
Definitely no
Reason: Open-label
|
Probably no
Reason: No infrequencies. |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely no
Reason: The funder had no role in the design and conduct of the study and no conflicts of intrest |
LOW |
|
Luo, 2017
Luo, 2021
|
Definitely yes
Reason: Randomized in a 1:1 ratio.
|
Definitely yes
Reason: Allocation sequence was concealed.
|
Definitely no
Reason: Open-label
|
Probably no
Reason: NR |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely no
Reason: Funded by the department of Science and Technology |
High |
|
Shi, 2018
Shi, 2019 |
Definitely yes
Reason: Randomized in a 1:1 ratio.
|
Definitely yes
Randomization sequence was created using a computer-generated randomization list. |
Definitely no
Reason: Open-label
|
Definitely no
Reason: NR |
Definitely yes
Reason: All relevant outcomes were reported |
Probably yes
Reason: No conflicts of interest |
Some concerns |
|
Wang, 2019 |
Definitely yes
Reason: Randomized in a 1:1 ratio.
|
Definitely yes
Reason: Computer-generated randomization list. |
Definitely no
Reason: Open-label
|
Probably no
Reason: 1 participant was lost to follow up in the intervention group compared to 3 participants in the control group. |
Definitely yes
Reason: All relevant outcomes were reported |
Definitely no
Reason: No conflicts of interest |
LOW |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Yan Y, Ou C, Cao S, Hua Y, Sha Y. Laparoscopic vs. open distal gastrectomy for locally advanced gastric cancer: A systematic review and meta-analysis of randomized controlled trials. Front Surg. 2023 Feb 17;10:1127854. doi: 10.3389/fsurg.2023.1127854. PMID: 36874456; PMCID: PMC9982133. |
Studies already included in Jiang article |
|
Bittar V, Boneli MF, Reis PCA, Felix N, Braga MAP, Rocha KM, Fogaroli LO, Costa GB, Comini AC, Amaral G, Marini DC, Camandaroba MPG. Laparoscopic Versus Open Gastrectomy for Advanced Gastric Cancer: A Meta-Analysis of Randomized Controlled Trials. J Gastrointest Cancer. 2024 Jun;55(2):652-661. doi: 10.1007/s12029-024-01048-0. Epub 2024 Apr 2. PMID: 38564116. |
Studies already included in Jiang article |
|
Garbarino GM, Laracca GG, Lucarini A, Piccolino G, Mercantini P, Costa A, Tonini G, Canali G, Muttillo EM, Costa G. Laparoscopic versus Open Surgery for Gastric Cancer in Western Countries: A Systematic Review and Meta-Analysis of Short- and Long-Term Outcomes. J Clin Med. 2022 Jun 22;11(13):3590. doi: 10.3390/jcm11133590. PMID: 35806877; PMCID: PMC9267365. |
Studies already included in Jiang article |
|
Pang HY, Chen XF, Chen LH, Yan MH, Chen ZX, Sun H. Comparisons of perioperative and long-term outcomes of laparoscopic versus open gastrectomy for advanced gastric cancer after neoadjuvant therapy: an updated pooled analysis of eighteen studies. Eur J Med Res. 2023 Jul 5;28(1):224. doi: 10.1186/s40001-023-01197-1. PMID: 37408041; PMCID: PMC10320971. |
Studies already included in Jiang article |
|
Shen H, Shan C, Liu S, Qiu M. Laparoscopy-assisted versus open total gastrectomy for gastric cancer: a meta-analysis. J Laparoendosc Adv Surg Tech A. 2013 Oct;23(10):832-40. doi: 10.1089/lap.2013.0152. Epub 2013 Aug 27. PMID: 23980591. |
Wrong study designs included |
|
Quan Y, Huang A, Ye M, Xu M, Zhuang B, Zhang P, Yu B, Min Z. Comparison of laparoscopic versus open gastrectomy for advanced gastric cancer: an updated meta-analysis. Gastric Cancer. 2016 Jul;19(3):939-50. doi: 10.1007/s10120-015-0516-x. Epub 2015 Jul 28. PMID: 26216579. |
All studys except for Cai et al. However already included in Jiang |
|
Pang H, Yan M, Zhao Z, Chen L, Chen X, Chen Z, Sun H, Zhang Y. Laparoscopic versus open gastrectomy for nonmetastatic T4a gastric cancer: a meta-analysis of reconstructed individual participant data from propensity score-matched studies. World J Surg Oncol. 2024 May 29;22(1):143. doi: 10.1186/s12957-024-03422-5. PMID: 38812025; PMCID: PMC11134691. |
Wrong study designs included |
|
van der Wielen N, Brenkman H, Seesing M, Daams F, Ruurda J, van der Veen A, van der Peet DL, Straatman J, van Hillegersberg R; STOMACH and LOGICA study group. Minimally invasive versus open gastrectomy for gastric cancer. A pooled analysis of two European randomized controlled trials. J Surg Oncol. 2024 Apr;129(5):911-921. doi: 10.1002/jso.27578. Epub 2024 Jan 4. PMID: 38173355. |
Stomach trial and Logica |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-12-2025
Beoordeeld op geldigheid : 01-12-2025
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire cluster ingesteld. Het cluster Maag-Oesofaguscarcinoom bestaat uit meerdere richtlijnen, zie hier voor de actuele clusterindeling. De stuurgroep bewaakt het proces van modulair onderhoud binnen het cluster. De expertisegroepsleden geven hun expertise in, indien nodig. De volgende personen uit het cluster zijn betrokken geweest bij de herziening van deze module:
Clusterstuurgroep
- Dhr. Prof. Dr. P.D. (Peter) Siersema (voorzitter), maag-darm-leverarts, Erasmus MC, Rotterdam; NVMDL
- Mevr. Dr. R.E. (Roos) Pouw, maag-darm-leverarts, UMC Utrecht; NVMDL
- Mevr. Prof. Dr. H.W.M. (Hanneke) van Laarhoven, internist, Amsterdam UMC, NIV
- Dhr. Dr. E. (Erik) Vegt, nucleair geneeskundige, Erasmus MC, Rotterdam, NVNG
- Dhr. Prof. Dr. M.I. (Mark) van Berge Henegouwen, chirurg, Amsterdam UMC, NVvH
- Dhr. Prof. Dr. R. (Richard) van Hillegersberg, chirurg, UMC Utrecht, NVvH
- Mevr. Dr. A. (Annemarieke) Bartels-Rutten, radioloog, AVL Amsterdam, NVvR
Clusterexpertisegroep
- Dhr. Dr. M.J. (Marc) van Det, chirurg, ZGT Almelo, NvVH
- Mevr. Dr. S.S. (Suzanne) Gisbertz, chirurg, Amsterdam UMC, NvVH
- Dhr. R. (Remco) Huiszoon MBA, ervaringsdeskundige Stichting voor Patiënten met kanker aan het Spijsverteringskanaal; SPKS
Met ondersteuning van
- Mevr. Dr. J. (Jana) Tuijtelaars, adviseur, Kennisinstituut van de Federatie voor Medisch Specialisten
- Mevr. S.N. (Sarah) van Duijn MSc, adviseur, Kennisinstituut van de Federatie voor Medisch Specialisten
- Mevr. Dr. M.H.D. (Majke) van Bommel, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dhr. T.A. (Thibaut) Dederen MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten via secretariaat@kennisinstituut.nl.
Clusterstuurgroepleden
|
Naam |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Datum |
Restrictie |
|
Peter Siersema (Voorzitter cluster) |
Maag-Darm-Leverarts en Hoogleraar Gastro-intestinale Endoscopie met focus op Innovatie en Duurzaamheid, Erasmus MC Universitair Medisch Centrum
|
Editor-in-Chief, Endoscopy - betaald
|
Geen |
Geen |
* Pentax, FujiFilm, Norgine & Magentiq Eye - Endoscopisch onderzoek - Projectleider * Astra Zeneca - Onderzoek behandeling Eosinofiele oesofagitis - Geen projectleider
|
Geen |
Geen |
24-07-2025 |
Geen restricties |
|
Hanneke van Laarhoven
|
Internist-oncoloog. Hoofd afdeling medische oncologie, Amsterdam UMC
|
Lid Raad van Toezicht IKLNL - betaald
|
Research funding e/o medicatie materialen voorziening: AMGEN, AstraZeneca, AURISTONE, BMS, Incyte, Merck, ORCA, and Servier - betaald/verstrekt aan Amsterdam UMC Consultant/adviesrol: Amphera, Astellas, Beigene, Daiichy, Myeloid - betaald aan Amsterdam UMC Spreker rol: Astellas, AstraZeneca, BMS, Benecke, Daiichi-Sankyo, JAAP, Medtalks, Novartis, Servier, and Travel Congress Management - betaald aan Amsterdam UMC
|
Geen |
Zie persoonlijke financiele belangen. Daarnaast onderzoek gefinancier door KWF Kankerbestrijding en Health Holland op het gebied van slokdarm/maagkanker (Projectleider)
|
Geen |
Geen |
28-07-2025 |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; b) Werkgroeplid werkt tenminste samen met een ander werkgroeplid met vergelijkbare expertise in alle fasen (studieselectie, data-extractie, evidence synthese, evidence-to-decision, aanbevelingen formuleren) van het ontwikkelproces; c) In alle fasen van het ontwikkelproces is een onafhankelijk methodoloog betrokken; d) Overwegingen en aanbevelingen worden besproken en vastgesteld tijdens een werkgroepvergadering onder leiding van een onafhankelijk voorzitter (zonder gemelde belangen)
|
|
Annemarieke Bartels-Rutten
|
Radioloog, Antoni van Leeuwenhoek
|
Geen |
In dienst bij ziekenhuis dat zich volledig richt op oncologische zorg.
|
Geen |
Geen |
Geen |
Geen |
23-07-2025 |
Geen restricties |
|
Mark van Berge Henegouwen
|
chirurg slokdarm en maagchirurgie Amsterdam UMC hoogleraar slokdarm en maagchirurgie Universiteit van Amsterdam
|
Consultant: Intuitive Surgery, Johnson and Johnson, Medtronic, Stryker Alle fees voor deze functies betaald aan Amsterdam UMC.
|
Geen |
Geen |
Olympus financiering studie (researcher initiated grant) Stryker financiering studie (researcher initiated grant) uitkomsten richtlijn geen invloed op deze bedrijven of studies
|
Geen |
consultancy voor meerdere bedrijven (uitbetaling aan Amsterdam UMC), niet gerelateerd aan richtlijn. bedrijven: Alesi Surgical, Mylan, Jonson and Johnson. bij Medtronic niet meer actief. Toevoeging: bestuur DUCA, DICA en voorzitter werkgroep Upper GI (allen onbetaald). Bij consultancy uitbetaald aan A'dam UMC mag nog bij: BBraun en Viatris
|
26-08-2025 |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; b) Werkgroeplid werkt tenminste samen met een ander werkgroeplid met vergelijkbare expertise in alle fasen (studieselectie, data-extractie, evidence synthese, evidence-to-decision, aanbevelingen formuleren) van het ontwikkelproces; c) In alle fasen van het ontwikkelproces is een onafhankelijk methodoloog betrokken; d) Overwegingen en aanbevelingen worden besproken en vastgesteld tijdens een werkgroepvergadering onder leiding van een onafhankelijk voorzitter (zonder gemelde belangen)
|
|
Richard van Hillegersberg
|
Chirurg, UMC Utrecht
|
Proctor Intuitive Surgical Consultant Medtronic Consultant Olympus, betaald aan UMC Utrecht
|
Proctor Intuitive Surgical Consultant Medtronic
|
Geen
|
1. Intuitive - Telementoring trial (Projectleider JA) 2. Intuitive- UGIRA benigne registry (Projectleider JA)
|
Bestuur DUCA, DICA
|
Geen |
4-08-2025 |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; b) Werkgroeplid werkt tenminste samen met een ander werkgroeplid met vergelijkbare expertise in alle fasen (studieselectie, data-extractie, evidence synthese, evidence-to-decision, aanbevelingen formuleren) van het ontwikkelproces; c) In alle fasen van het ontwikkelproces is een onafhankelijk methodoloog betrokken; d) Overwegingen en aanbevelingen worden besproken en vastgesteld tijdens een werkgroepvergadering onder leiding van een onafhankelijk voorzitter (zonder gemelde belangen)
|
|
Erik Vegt
|
Nucleair geneeskundige, Afdeling Nucleaire Geneeskunde, Erasmus MC, Rotterdam. Werkzaam op de Afdeling Radiologie Erasmus MC
|
Voorzitter Concilium Radiologicum NVvR / NVNG, onbetaald.
|
Geen |
Geen |
ZonMW-subsidie voor de PLASTIC-studie, programma doelmatigheid van zorg, naar de kosten-effectiviteit van FDG-PET/CT en laparoscopie bij maagcarcinoom. KWF: PLASTIC-3, maagkanker FAPI-PET
|
Geen |
Geen |
23-07-2025 |
Geen restricties |
|
Roos Pouw |
Maag-Darm-Leverarts UMC Utrecht
|
Secretaris Dutch Upper Cancer Group (DUCG), onbetaald - Secretary General van de United European Gastroenterology (UEG), onbetaald - Consultancy voor Medtronic BV, betaling voor verrichte werkzaamheden gaat naar het ziekenhuis - Consultancy voor MicroTech Europe, betaling voor verrichte werkzaamheden gaat naar het ziekenhuis - Consultancy voor Cook BV, betaling voor verrichte werkzaamheden gaat naar het ziekenhuis - Consultancy voor Fujifilm BV, betaling voor verrichte werkzaamheden gaat naar het ziekenhuis - Consultancy voor Boston Scientific, betaling voor verrichte werkzaamheden gaat naar het ziekenhuis.
|
Geen |
Geen |
Projectleider MLDS: Personaliseren van follow-up na endoscopische eradicatie therapie van Barrett slokdarm met neoplasie. Projectleider KWF PREFER studie: onderzoek naar endoscopische follow-up na endoscopische resectie van T1b slokdarmcarcinoom. Projectleider MOELLER Medical: Studie naar endoscopische vacuumtherapie voor profylaxe en therapie van naadlekkage na slokdarm resectie. Projectleider NVGE: Studie die T-cell infiltratie bij vroegcarcinomen onderzoekt en relatie met metastasering
|
Geen |
Geen |
29-08-2025 |
a) Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module; b) Werkgroeplid werkt tenminste samen met een ander werkgroeplid met vergelijkbare expertise in alle fasen (studieselectie, data-extractie, evidence synthese, evidence-to-decision, aanbevelingen formuleren) van het ontwikkelproces; c) In alle fasen van het ontwikkelproces is een onafhankelijk methodoloog betrokken; d) Overwegingen en aanbevelingen worden besproken en vastgesteld tijdens een werkgroepvergadering onder leiding van een onafhankelijk voorzitter (zonder gemelde belangen)
|
Betrokken clusterexpertisegroepleden
|
Naam |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Datum |
Restrictie |
|
Suzanne Gisbertz
|
Upper GI chirurg Amsterdam UMC
|
Bestuur ESDE, NVGIC, Vice President ISDE, program chair EAES, de Groene OK: allen onbetaald
Commissies: * Voorzitter wetenschappelijke commissie DUCA |
Consultant voor (voor geen enkele persoonlijk geld ontvangen): * J&J * Medicaroid *Olympus Invited Speaker *Stryker
|
Geen |
Geen |
Geen |
Geen |
26-08-2025 |
Geen restricties |
|
Marc van Det
|
Gastro-intestinaal chirurg Ziekenhuis groep Twente (ZGT) full-time aanstelling
|
Proctor/Instructor voor Intuitive Surgical betreffende Robot-Assisted operaties in de upper-GI zoals: - Slokdarm resecties - Maagresecties - Hernia diafragmatica. Trainingen worden enkele keren per jaar gegeven en hiervoor ontvangt de trainee geen acreditatiepunten. - deelnemer MEC-U.
|
Proctor/Instructor voor Intuitive Surgical betreffende Robot-Assisted operaties in de upper-GI zoals: - Slokdarm resecties - Maagresecties - Hernia diafragmatica.
|
Geen |
Geen |
Geen |
Geen |
23-07-2025 |
Geen restricties |
|
Remco Huiszoon |
ING Nederland NV, teammanager
|
Bestuurslid SPKS - Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal
|
Geen |
Geen |
Geen |
Geen |
Geen |
14-01-2025 |
Geen restricties |
Werkwijze
Voor meer details over de gebruikte richtlijnmethodologie verwijzen wij u naar de Werkwijze. Relevante informatie voor de ontwikkeling/herziening van deze richtlijnmodule is hieronder weergegeven.
Zoekverantwoording
Algemene informatie
|
Cluster/richtlijn: Oesophagus- maagcarcinoom |
|
|
Uitgangsvraag/modules: 4: Wat is de plaats van minimaal invasieve chirurgie ten opzichte van open chirurgie bij patiënten met een maagcarcinoom? |
|
|
Database(s): Embase.com, Ovid/Medline |
Datum: 19-11-2024 |
|
Periode: vanaf 2011 |
Talen: geen restrictie |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
Rayyan review: https://new.rayyan.ai/reviews/1232993/review_data |
|
BMI-zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht met de concepten: Maagcarcinoom EN minimale invasieve chirurgie |
|
|
Te gebruiken voor richtlijntekst: A systematic literature search was performed by a medical information specialist using the following bibliographic databases: Embase.com and Ovid/Medline. Both databases were searched from 2011to 2025 for systematic reviews and RCTs. Systematic searches were completed using a combination of controlled vocabulary/subject headings (e.g., Emtree-terms, MeSH) wherever they were available and natural language keywords. The overall search strategy was derived from 2 primary search concepts: (1) Stomach carcinoma and (2) minimal invasive surgery. Duplicates were removed using EndNote software. After deduplication a total of 1225 records were imported for title/abstract screening. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SR |
549 |
419 |
605 |
|
RCT |
569 |
162 |
620 |
|
Observationele studies |
|
|
|
|
Totaal |
|
|
1225 |
*in Rayyan
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#1 |
'stomach tumor'/exp OR 'linitis plastica':ti,ab,kw OR (((carcinoma* OR neoplas* OR adenoma* OR adenocarcinoma* OR tumor* OR tumour* OR cancer* OR oncolog* OR malignan* OR carcinogen* OR oncogen* OR anticarcinogen* OR squamous*) NEAR/5 (stomach OR gastric* OR cardia OR gastroesophag* OR gastrooesophag* OR oesogast* OR esogast*)):ti,ab,kw) |
253302 |
|
#2 |
'minimally invasive procedure'/exp OR 'laparoscopy'/exp OR 'laparoscope'/exp OR laparoscop*:ti,ab,kw OR ((mini* NEAR/2 invasive*):ti,ab,kw) OR ((minimal* NEAR/3 (surg* OR procedure* OR access OR gastrectom*)):ti,ab,kw) |
473114 |
|
#3 |
#1 AND #2 |
13342 |
|
#4 |
#3 NOT (('adolescent'/exp OR 'child'/exp) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp)) |
13271 |
|
#5 |
#4 NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
13148 |
|
#6 |
#5 NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it OR 'case report'/exp) |
7583 |
|
#7 |
#5 NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it OR 'case report'/exp) AND [2011-2025]/py |
6015 |
|
#8 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
823255 |
|
#9 |
#7 AND #8 |
549 |
|
#10 |
'randomized controlled trial'/exp OR random*:ti,ab,kw OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab,kw) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab,kw) |
2264246 |
|
#11 |
#7 AND #10 |
714 |
|
#12 |
#7 AND #10 NOT #9 |
569 |
Ovid/Medline
|
# |
Searches |
Results |
|
1 |
Stomach Neoplasms/ or linitis-plastica.ti,ab,kf. or ((carcinoma* or neoplas* or adenoma* or adenocarcinoma* or tumor* or tumour* or cancer* or oncolog* or malignan* or carcinogen* or oncogen* or anticarcinogen* or squamous*) adj5 (stomach or gastric* or cardia or gastroesophag* or gastrooesophag* or oesogast* or esogast*)).ti,ab,kf. |
167420 |
|
2 |
"Minimally Invasive Surgical Procedures"/ or exp Laparoscopy/ or Laparoscopes/ or (laparoscop* or (mini* adj2 invasive*) or (minimal* adj3 (surg* or procedure* or access or gastrectom*))).ti,ab,kf. |
288635 |
|
3 |
1 and 2 |
8068 |
|
4 |
3 not ((Adolescent/ or Child/ or Infant/) not Adult/) |
8035 |
|
5 |
4 not ((exp animals/ or exp models, animal/) not humans/) |
7975 |
|
6 |
5 not (comment/ or editorial/ or letter/ or Case Reports/) |
6325 |
|
7 |
limit 6 to yr="2011 -Current" |
5049 |
|
8 |
(systematic-review.pt. or (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.)) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
750184 |
|
9 |
7 and 8 |
419 |
|
10 |
exp randomized controlled trial/ or random*.ti,ab,kf. or ((pragmatic or practical) adj clinical trial*).ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1711836 |
|
11 |
7 and 10 |
658 |
|
12 |
9 or 11 |
881 |
|
13 |
(7 and 10) not 9 |
462 |