Behandelstrategie voor anti-VEGF medicatie
Uitgangsvraag
Wat is de beste behandelstrategie voor anti-VEGF injecties bij patiënten met neovasculaire LMD?
Aanbeveling
Hanteer na de inductiefase van vier maandelijkse anti-VEGF injecties een treat-and-extend beleid.
Overweeg de volgende keuzes in de extensiefase van het treat-and-extend beleid:
- Verleng bij inactiviteit de periode tussen twee injecties met twee weken.
- Controleer na iedere verlenging met minimaal een OCT scan.
- Verleng de periode tussen twee injecties zo mogelijk tot 12 weken, eventueel te verlengen tot maximaal 16 weken.
- Overweeg een restant subretinaal vocht te accepteren, maar streef naar zo min mogelijk intraretinaal vocht
- Ga bij re-activatie van de MNV terug naar de inductiefase of naar het laatste stabiele interval, afhankelijk van de ernst van het recidief en de voorgeschiedenis van de patiënt.
- Hanteer indien opnieuw inactiviteit van de MNV is bereikt een treat-and-extend beleid waarbij gekozen kan worden tussen oprekken met 1 of 2 weken.
- Houd na een re-activatie langer vast aan het laatst bewezen veilige interval.
Betrek altijd patiënt-specifieke kenmerken in de extensiefase.
Beslis samen met de patiënt hoe lang u doorgaat met anti-VEGF injecties in de onderhoudsfase.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De bovengenoemde systematic review laat zien dat een treat-and-extend beleid niet leidt tot een slechtere uitkomst dan maandelijkse injecties in termen van visus. Deze conclusie wordt bevestigd door andere, meer recentere review artikelen (Fallico, 2020; Spaide, 2021; Rosenberg, 2022; Matonti, 2022). In essentie is een treat-and-extend beleid een persoonlijke behandeling welke aangepast wordt op de individuele noodzaak en kenmerken. Dit maakt deze strategie ook theoretisch een aantrekkelijkere optie dan standaard iedere maand injecteren. Overbehandeling wordt verminderd met als gevolg minder belasting voor de patiënt, de maatschappij en het milieu.
Wat echter niet uit bovengenoemde studies kan worden afgeleid is de wijze waarop de treat-and-extend strategie precies moet worden uitgevoerd en worden voortgezet. Tot welk interval moet worden opgerekt en op welke manier? Wanneer moet worden gecontroleerd en wat dient bij controle minimaal gemeten te worden? En kan er ook worden gestopt met onderhoudsinjecties? In deze module bespreken we de eerste twee vragen. In module Criteria om te stoppen met anti-VEGF behandeling wordt besproken of en hoe kan worden gestopt met (onderhouds) behandeling.
Uitgaande van een volledige respons tijdens de inductiefase van anti-VEGF behandeling zijn de volgende scenario’s mogelijk:
Na standaard inductiefase van 4-maandelijkse injecties:
- Snel oprekken met controle na ieder interval tijdens fase oprekken
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totaal |
|
Weken |
0 |
4 |
4 |
4 |
6 |
8 |
10 |
12 |
12 |
12 |
12 |
12 |
12 |
108 |
|
Injectie |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
13 |
|
Controle |
|
|
|
x |
x |
x |
x |
x |
|
x |
|
x |
|
7 |
Maximale interval na 48 weken met 8 injecties en 5 controles
Bij continueren in 12 week interval: 13 injecties en 7 controles in 108 weken
- Langzaam oprekken met controle na 2 intervallen
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totaal |
|
Weken |
0 |
4 |
4 |
4 |
6 |
6 |
8 |
8 |
10 |
10 |
12 |
12 |
12 |
12 |
108 |
|
Injectie |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
14 |
|
Controle |
|
|
|
x |
x |
|
x |
|
x |
|
x |
|
x |
|
6 |
Maximale interval na 84 weken met 12 injecties en 5 controles
Bij continueren in 12 week interval: 14 injecties en 6 controles in 108 weken
- Langzaam oprekken met controle na 3 intervallen
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totaal |
|
Weken |
0 |
4 |
4 |
4 |
6 |
6 |
6 |
8 |
8 |
8 |
10 |
10 |
10 |
12 |
12 |
108 |
|
Injectie |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
x |
15 |
|
Controle |
|
|
|
x |
x |
|
|
x |
|
|
x |
|
|
x |
|
5 |
Maximale interval na 120 weken met 16 injecties en 5 controles
Bij continueren in 12 week interval: 15 injecties en 5 controles in 108 weken
Bij verlengen van het interval zonder directe controle bestaat het risico dat er een re-activatie optreedt welke niet wordt onderkend. Hoe langer deze situatie bestaat, hoe groter de kans is op blijvend visusverlies. Om deze reden is scenario A aan te bevelen. Dit betekent wel een grotere belasting van de oogzorg; er zullen meer OCT scans moeten worden gemaakt die ook beoordeeld dienen te worden. De exacte aantallen staan in de tabel genoemd.
De vraag tot welk interval tussen injecties kan worden opgerekt hangt samen met het risico op re-activatie van de MNV. Re-activatie kan zich uiten in een visusdaling en/of terugkeer van intra- of subretinaal vocht op OCT. Beiden kunnen reversibel zijn maar kunnen ook leiden tot een blijvende vermindering van visus. Het risico op re-activatie na de laatste injectie is niet onderzocht in een experimentele setting. We zijn dus aangewezen op observationele en real-world studies.
In de meeste studies blijkt het risico op re-activatie met visusdaling toe te nemen na een interval van 12 weken. Het lijkt erop dat patiënten die snel reageren op anti-VEGF minder vaak een recidief activatie vertonen in de onderhoudsfase (Jaggi, 2022). Bij re-activatie van de MNV lijkt het verstandig om eerst weer intensief te behandelen, alvorens terug te keren naar het interval waarop de MNV rustig bleef.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Op basis van de literatuur en de mening van experts wordt in deze module de aanbeveling gedaan om een treat-and-extend regime te volgen bij de behandeling met anti-VEGF medicatie bij nLMD. Dit behandelregime wordt afgestemd op de specifieke kenmerken en behoefte van de patiënt. Deze persoonlijke benadering zal ook aansluiten bij de voorkeur van patiënt. Een discussie met de patiënt over dit aspect van de behandeling lijkt daarom niet nodig.
Dit wordt anders in de chronische fase van de onderhouds anti-VEGF behandeling. In module Criteria om te stoppen met anti-VEGF behandeling wordt dit onderwerp besproken, waarbij ook nadrukkelijk een gesprek en een gezamenlijk beslissing wordt aanbevolen.
Kosten (middelenbeslag)
De kosten van anti-VEGF behandeling worden met name bepaald door het aantal injecties. Dit aantal is bij treat-and-extend beleid lager dan bij vaste maandelijkse injecties. De kosten van injecties in de onderhoudsfase moeten wel worden afgewogen tegen de kosten van een re-activatie met blijvend visusverlies. Een formele financiële afweging is niet beschikbaar. Kosten zijn daarom niet specifiek meegewogen in de aanbevelingen van deze module.
Aanvaardbaarheid, haalbaarheid en implementatie
In de overwegingen bij een treat-and-extend beleid moet een balans worden gevonden tussen onderbehandeling en overbehandeling. Onderbehandeling kan leiden tot onherstelbaar visusverlies en overbehandeling leidt tot hoger infectierisico en onnodige belasting van patiënt, maatschappij en milieu. Het doel moet dus zijn om de patiënt met zo min mogelijk injecties een zo veilig mogelijke onderhoudsbehandeling te geven. Daarbij speelt mee dat de oogzorg zwaarder wordt belast bij meer injecties en meer controles.
Indien er een re-activatie optreedt gedurende het treat-and-extend beleid is het advies om in eerste instantie terug te gaan naar het interval waarop de MNV niet actief was. Echter, bij forse re-activatie kan ook worden besloten om opnieuw de inductiefase te doorlopen met drie maandelijkse injecties. Indien dit niet tot een volledige respons leidt wordt verwezen naar module Criteria voor het veranderen van anti-VEGF medicatie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Onderstaande aanbevelingen zijn gebaseerd op de literatuur en de mening van de richtlijncommissie. De aanbeveling om een treat-and-extend beleid te hanteren is onderbouwd door een systematic review met een lage bewijskracht. De andere aanbevelingen zijn gebaseerd op relevante literatuur en de expertise van de commissieleden. Hierbij is het belang van de patiënt leidend geweest.
Het aanbevolen beleid staat los van het type anti-VEGF middel wat wordt gebruikt. Het kan zijn dat de respons verschilt per middel, maar dit zal in de praktijk blijken en verandert niet de aanbevelingen.
Zie het stroomschema Behandeling nLMD voor het overzicht.
Zie module Criteria voor het veranderen van anti-VEGF middel
Zie module Criteria voor het stoppen met anti-VEGF medicatie
Onderbouwing
Achtergrond
Het doel van anti-VEGF behandeling bij nLMD is om de maculaire neovascularisatie (MNV) tot permanente inactiviteit te brengen (Mettu, 2021). Na introductie van de anti-VEGF behandeling voor nLMD zijn diverse behandelstrategieën ontwikkeld, zoals een vast, maandelijks, interval (‘fixed’), een injectie bij recidief vocht (‘zo nodig’ of ‘pro re nata’), en een onderhoudsinjectie ook als er geen vocht aanwezig is (‘treat-and-extend’). Op dit moment bestaat er in Nederland variatie in deze behandelstrategieën en heeft zowel de oogarts als de patiënt behoefte aan zekerheid over wat de beste behandelstrategie is.
Het streven moet zijn om de patiënt optimaal te behandelen, zonder over- of onderbehandeling. De consequentie van onderbehandeling is dat patiënten het risico lopen op onherstelbare visusdaling door onvoldoende bescherming van een (prolyactische) toediening van anti-VEGF medicatie. De consequentie van overbehandeling is dat patiënten onnodig belastende injecties ondergaan met het daarbij horende risico op o.a. een endophthalmitis. Tevens gaat dit gepaard met hogere kosten voor de maatschappij en belasting van de gezondheidszorg en het milieu.
Om tot een optimale lange termijn behandeling te komen is een literatuuronderzoek verricht naar de diverse injectie strategieën. Hierbij is in eerste instantie alleen gekeken naar visus als uitkomstmaat.
Conclusies / Summary of Findings
Visual acuity
|
Low GRADE |
A treat-and-extend regimen may result in little to no difference in visual acuity when compared with monthly doses in patients with age-related macular degeneration.
Sources: Li (2020) |
Visual improvement
|
Low GRADE |
A treat-and-extend regimen may result in little to no difference in visual improvement when compared with monthly doses in patients with age-related macular degeneration.
Sources: Li (2020) |
Samenvatting literatuur
Description of studies
Li (2020) performed a systematic review to investigate the effects of monthly versus non-monthly intravitreous injection of an anti-VEGF agent in people with newly diagnosed nAMD. A systematic search was conducted in the following databases for randomized controlled trials (RCTs): Cochrane Central Register of Controlled Trials (CENTRAL), MEDLINE Ovid( from January 1946 to 18 October 2019), Embase Ovid (from January 1980 to 18 October 2019), LILACS (Latin American and Caribbean Health Sciences Literature Database; from 1982 to 18 October 2019), ISRCTN registry (www.isrctn.com/editAdvancedSearch: searched 18 October 2019), US National Institutes of Health Ongoing Trials Register ClinicalTrials.gov (searched 18 October 2019) and the World Health Organization International Clinical Trials Registry Platform (searched 18 October 2019).
Randomized controlled trials (RCTs) that compared different treatment regimens for anti-VEGF agents with standard doses (ranibizumab 0.5 mg, bevacizumab 1.25 mg, aflibercept 2.0 mg, or a combination of these) in people with newly diagnosed nAMD were included. Fifteen RCTs were included. The total number of participants was 7732, ranging from 37 to 2457 in each trial. Three trials (1226 participants) compared treat-and-extend with a monthly injection (CANTREAT, 2019; TREND, 2017; TREX-AMD, 2015). In this module, only the comparison that meets the PICO criteria will be described.
Results
Visual acuity
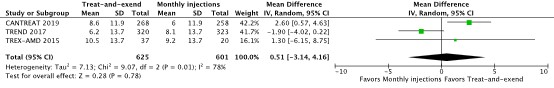
The outcome measure visual acuity was described in three trials (CANTREAT, 2019; TREND, 2017; TREX-AMD, 2015). The treat-and-extend regimen delivered a median of 9.4 injections in one year with no evidence of a clinically relevant difference in visual acuity change compared to monthly injections (0.51 letters, 95% CI –3.14 to 4.16; 1226 participants; I2 = 78%;). The estimates from these studies were heterogeneous, and in CANTREAT (2019) a reduced- intensity treat-and-extend regimen gained more visual acuity than the monthly regimen.
Figure 1 Forest plot of comparison Treat-and-extend versus monthly injections, outcome visual acuity
Visual improvement
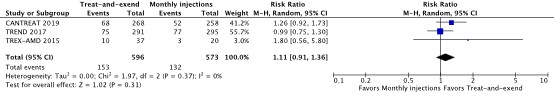
The outcome visual improvement was defined as a gain of ³15 letters visual acuity at 1 year and reported in three studies (CANTREAT, 2019; TREND, 2017; TREX-AMD, 2015). A pooled RR of 1.11 (95% CI 0.91 to 1.36, n=1169) was reported. The difference is not considered clinically relevant.
Figure 2 Forest plot of comparison Treat-and-extend versus monthly injections, outcome visual improvement
Level of evidence of the literature
Visual acuity
The level of evidence regarding the outcome measure visual acuity comes from a randomized controlled trials and therefore starts at high. The level of evidence was downgraded by two levels due to lack of blinding (risk of bias) and conflicting results (inconsistency). Resulting in a level of evidence of low.
Visual improvement
The level of evidence regarding the outcome measure visual improvement comes from a randomized controlled trials and therefore starts at high. The level of evidence was downgraded by two levels due to lack of blinding (risk of bias) and exceeding the upper limit of clinical relevance (imprecision). Resulting in a level of evidence of low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effect of a treat-and-extend regimen on visual improvement and visual acuity, compared to standard care in patients with age-related macular degeneration?
P: patients with age-related macular degeneration
I: treat-and-extend regimen
C: standard care or fixed dosing
O: visual improvement, visual acuity
Relevant outcome measures
The guideline development group considered visual acuity as a critical outcome measure for decision making; and visual improvement as an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group used the GRADE standard limit of 25% as a minimal clinically (patient) important difference for dichotomous outcomes and 10% for continuous variables.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until the 12th of July 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 84 hits. Studies were selected based on the following criteria: systematic reviews about the best treatment strategy for anti-VEGF injections for patients with AMD. 17 studies were initially selected based on title and abstract screening. After reading the full text, 16 studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One study was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Fallico M, Lotery AJ, Longo A, Avitabile T, Bonfiglio V, Russo A, Castellino N, Parisi G, Pulvirenti A, Eandi C, Cennamo G, Furino C, Cicinelli MV, Alovisi C, Reibaldi M. Treat and extend versus fixed regimen in neovascular age related macular degeneration: A systematic review and meta-analysis. Eur J Ophthalmol. 2021 Sep;31(5):2496-2504. doi: 10.1177/1120672120964699. Epub 2020 Oct 29. PMID: 33118382.
- Jaggi D, Nagamany T, Ebneter A, Munk M, Wolf S, Zinkernagel M. Aflibercept for age-related macular degeneration: 4-year outcomes of a 'treat-and-extend' regimen with exit-strategy. Br J Ophthalmol. 2022 Feb;106(2):246-250. doi: 10.1136/bjophthalmol-2020-316514. Epub 2020 Oct 30. PMID: 33127830; PMCID: PMC8788035.
- Li E, Donati S, Lindsley KB, Krzystolik MG, Virgili G. Treatment regimens for administration of anti-vascular endothelial growth factor agents for neovascular age-related macular degeneration. Cochrane Database Syst Rev. 2020 May 5;5(5):CD012208. doi: 10.1002/14651858.CD012208.pub2. PMID: 32374423; PMCID: PMC7202375.
- Matonti F, Korobelnik JF, Dot C, Gualino V, Soler V, Mrejen S, Delyfer MN, Baillif S, Streho M, Gascon P, Creuzot-Garcher C, Kodjikian L. Comparative Effectiveness of Intravitreal Anti-Vascular Endothelial Growth Factor Therapies for Managing Neovascular Age-Related Macular Degeneration: A Meta-Analysis. J Clin Med. 2022 Mar 25;11(7):1834. doi: 10.3390/jcm11071834. PMID: 35407439; PMCID: PMC8999505.
- Mettu PS, Allingham MJ, Cousins SW. Incomplete response to anti-VEGF therapy in neovascular AMD: exploring disease mechanisms and therapeutic opportunities. Prog Retin Eye Res 2021; May https://doi.org/10.1016/j.preteyeres.2020.100906
- Rosenberg D, Deonarain DM, Gould J, Sothivannan A, Phillips MR, Sarohia GS, Sivaprasad S, Wykoff CC, Cheung CMG, Sarraf D, Bakri SJ, Chaudhary V. Efficacy, safety, and treatment burden of treat-and-extend versus alternative anti-VEGF regimens for nAMD: a systematic review and meta-analysis. Eye (Lond). 2022 Apr 8. doi: 10.1038/s41433-022-02020-7. Epub ahead of print. PMID: 35396574.
- Spaide RF. ANTIVASCULAR ENDOTHELIAL GROWTH FACTOR DOSING AND EXPECTED ACUITY OUTCOME AT 1 YEAR. Retina. 2021 Jun 1;41(6):1153-1163. doi: 10.1097/IAE.0000000000003116. PMID: 33464022.
Evidence tabellen
Evidence tables
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Li, 2020
[individual study characteristics deduced from Li, 2020]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to October 2019
A: CANTREAT, 2019 B: TREND, 2017 C: TREX-AMD, 2015
Study design: RCT
Setting and Country: A: Canada, multicenter B: Belgium, Croatia, Denmark, Egypt, Germany, Hungary, India, Israel, Italy, Korea, Portugal, Russia, Slovakia, Slovenia, Spain, Switzerland, Turkey, UK, multicenter C: USA, multicenter
Source of funding and conflicts of interest: Non-commercial
|
Inclusion criteria SR: RCTs, participants had a diagnosis of nAMD as defined by study investigators,.
Exclusion criteria SR: Not reported
Three studies included
Important patient characteristics at baseline:
N, mean age A: 526 patients, 78.8 yrs B: 585, 75.2 yrs C: 60, 77 yrs
Sex: A: 39.7% male B: 44.6% male C: 37% male
Groups comparable at baseline? Yes |
Describe intervention:
A: intravitreous ranibizumab 0.5 mg injected monthly until achievement of disease stability, then the interval between each subsequent injection was extended by 2 weeks (intervals of 6 weeks, 8 weeks, 10 weeks, and a maximum of 12 weeks) until clinical or diagnostic evidence of disease instability was observed based on OCT findings, ETDRS BCVA, or bot B: treat-and-extend group received 2 initial monthly ranibizumab injections at baseline (day 1) and month 1. After 1 month, visits in the treat-and-extend group were scheduled based on dis- ease activity as assessed by VA and OCT criteria. Participants were treated at monthly intervals until disease activity was resolved, as assessed by SD-OCT according to the investigator's judgment (i.e. no intraretinal or subretinal fluid). If disease activity was not present, the next visit was scheduled in 6 weeks (i.e. the treatment interval, defined as the period between 2 ranibizumab injections, was extend- ed by 2 weeks); however, if disease activity was present, the interval to the next visit was not extend- ed and thus was scheduled in 4 weeks (1 month). The treatment interval could be extended by 2 weeks at each visit as long as there was no disease activity, with a maximum of a 12-week treatment interval. During the course of the study, if disease activity was present, the treatment interval was shortened by 2 weeks, but never to fewer than 4 weeks. The participant was treated at this interval until no disease activity was present, after which an extension of 2 weeks was reactivated. The possibility to extend the interval between treatments was limited to 2 attempts. If disease activity recurred, the visit schedule was shortened by 2 weeks and fixed on this interval up to the end of the study. However, if disease ac- tivity was present along with visual impairment, the treatment interval was allowed to shorten by 4 weeks instead of 2 weeks based on the investigator's judgment. C: intravitreous ranibizumab 0.5 mg in 0.05 mL, monthly for first 3 months, then treat- and-extend protocol (quote: "interval between treatments was tailored based on exudative disease activity: eyes were treated at each visit, no more frequently than every 4 weeks and no less frequently than every 12 weeks") |
Describe control:
A: intravitreous ranibizumab 0.5 mg monthly B: monthly regimen group, treatment visits were scheduled at monthly intervals up to the end of the study. C: intravitreous ranibizumab 0.5 mg in 0.05 mL, monthly for 1 year
|
End-point of follow-up:
A: 1 year B: 1 year C: 1 year
For how many participants were no complete outcome data available? (intervention/control) A: 18 (6.3%)/36 (12.3%) B: 5 (1.7%)/4 (1.4%) C: 3 (8.1%)/ 0 (0%)
|
1. Visual acuity Defined as mean change in best-corrected visual acuity at 1 year
Effect measure: mean difference [95% CI]: A: 2.60 [0.57 to 4.63] B: -1.90 [-4.02 to 0.22] C: 1.30 [-6.15 to 8.75]
Pooled effect (random effects model): 0.51 [95% CI -3.14 to 4.16] favoring treat-and-extend Heterogeneity (I2): 78%
2. Visual improvement Defines as a gain of ³15 letters
Effect measure: RR [95% CI]: A: 1.26 [0.92 to 1.73] B: 0.99 [0.75 to 1.30] C: 1.80 [0.56 to 5.80]
Pooled effect (random effects model): 1.11 [95% CI 0.91 to 1.36] favoring treat-and-extend Heterogeneity (I2): 0%
|
Author’s conclusion: We found that, at one year, monthly regimens are probably more effective than PRN regimens using seven or eight injections in the first year, but the difference is small and clinically insignificant. Endophthalmitis is probably more common with monthly injections and differences in costs between regimens are higher if aflibercept or ranibizumab are used compared to bevacizumab. This evidence only applies to settings in which regimens are implemented as described in the trials, whereas undertreatment is likely to be common in real-world settings. There are no data from RCTs on long-term effects of different treatment regimens.
|
Risk of bias tables
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Li, 2020 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
No |
Yes |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Chin-Yee, 2016 |
Does not meet PICO criteria |
|
Daien, 2021 |
Narrative review |
|
Danyliv, 2021 |
Does not meet PICO criteria |
|
Garweg, 2019 |
Only observational studies included |
|
Garweg, 2021 |
Only observational studies included |
|
Gemenetzi, 2017 |
Only observational studies included |
|
Lanzetta, 2013 |
Included same studies as Li (2020) |
|
Okada, 2018 |
Included same studies as Li (2020) |
|
Rufai, 2017 |
Included same study as Li (2020) |
|
Ye, 2020 |
Does not meet PICO criteria |
|
Zhang, 2021 |
Does not meet PICO criteria |
|
Zhao, 2021 |
Included same studies as Li (2020) |
|
Jiang, 2014 |
Does not meet PICO criteria |
|
Matonti, 2022 |
Does not meet PICO criteria |
|
Schmucker, 2015 |
Does not meet PICO criteria |
|
Zhao, 2021 |
Does not meet PICO criteria |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 07-08-2023
Beoordeeld op geldigheid : 17-07-2023
Algemene gegevens
De herziening van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Werkgroep
- Dr. R. van Leeuwen, oogarts, Universitair Medisch Centrum Utrecht, Utrecht (NOG, voorzitter)
- Prof. dr. C.C.W. Klaver, oogarts en hoogleraar, Erasmus Medisch Centrum, Rotterdam (NOG)
- Dr. P.H.B. Kok, oogarts, Bergman Clinics, Amsterdam (NOG)
- Dr. J.J.C. van Lith-Verhoeven, oogarts, Elisabeth-TweeSteden Ziekenhuis, Tilburg (NOG)
- Dr. F.D. Verbraak, oogarts, Amsterdam Universitair Medisch Centrum, Amsterdam (NOG)
- Dr. A.C. Lambooij, oogarts, Reinier de Graaf Gasthuis, Delft (NOG)
- Drs. E.A. Huiskamp, oogarts, Universitair Medisch Centrum Groningen, Groningen (NOG)
- Drs. O.A.M. Tigchelaar-Besling, oogarts, Amphia Ziekenhuis, Breda (NOG)
- Drs. L.J. Noordzij, oogarts, Oog Op Zuid, Rotterdam (NOG)
Klankbordgroep
- M.E. Diepman-Leerdam, optometrist, Bergman Clinics, Doetichem (OVN)
- H.J. Jansen-Molenaar, adviseur oogzorg (Oogvereniging) (tot 01-09-2022)
- P. Kortenhoeven, waarnemend coördinator oogzorg (Oogvereniging) (vanaf 01-09-2022)
- H.M.M.J. Schoots, voorzitter MaculaVereniging (MaculaVereniging)
Met ondersteuning van
- Dr. A. van der Hout, adviseur Kennisinstituut van de Federatie Medisch Specialisten
- Drs. B.L. Gal-de Geest, adviseur Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen acties |
|
van Leeuwen * |
Oogarts, netvliesspecialist, in het UMC Utrecht. |
Bestuur Vitreoretinale werkgroep, onbetaald Voorzitter Projectgroep Duurzame Oogheelkunde Vertegenwoordiger namens NOG in Landelijke Netwerk Groene OK, onbetaald |
* Ik doe op dit moment niet mee aan door industrie gesponsorde studies. Wel begeleid ik op dit moment wetenschappelijk onderzoek naar LMD welke betaald wordt door een particulier fonds (Stichting AmphoraEst). Deze stichting heeft geen belang bij het advies of de richtlijn, anders dan optimale zorg voor LMD patiënten. Ik heb geen intellectuele of reputatie belangen bij deze richtlijn commissie, anders dan erkenning als professional. * Ik zet mij actief en publiekelijk in voor verduurzaming van de gezondheidszorg, zowel binnen mijn eigen ziekenhuis als landelijk. Hierbij zijn er raakvlakken met de onderhavige richtlijn. * In het verleden heb ik een financiële vergoeding voor presentaties op gesponsord symposium of nascholing ontvangen. Sinds 2018 niet meer. |
Geen restricties |
|
Noordzij |
Werkzaam als oogarts o.a. in het zelfstandig behandelcentrum Oog op Zuid Oogkliniek. Lid van de Coöperatie Oogheelkunde op Zuid U.A. en voorzitter van het bestuur van de Coöperatie Oogheelkunde op Zuid U.A. Bestuurder bij de Stichting Oogheelkunde op Zuid. Medisch directeur bij het zelfstandig behandel Oog op Zuid Oogkliniek. |
De afgelopen maanden in samenwerking met Novartis een enquete opgesteld voor uirvragen hoe er in Nederland intravitreaal geïnjecteerd wordt. Names het Maasstad Ziekenhuis lid van de werkgroep "Santeon dure geneesmiddelen maculadegeneratie". Lid FMS/ NOG werkgroep Cluster Oog (onbetaald). |
Het Maasstad Ziekenhuis nam deel aan de Raven studie van Novartis to 2020. Ik was daarvan voor de locatie Maasstad ziekenhuis de principal investigator. |
Geen restricties |
|
Verbraak |
Oogarts, Amsterdam Universitair Medisch Centrum |
Voorzitter stuurgroep FRB!NL, niet betaald.Ik ben onbezoldigd voorzitter FRB!NL, een project dat gesteund wordt door Bayer, waar nu alleen nog financiering gaat naar advocaten kantoor (via Oogfonds) voor uitwerking agreement tussen deelnemende NL centra en universiteit van Sydney (SSR project). |
Betaald adviseur: Bayer, Novartis, IDxDR, UCB. vergoeding voor deelname (voorzitter) aan werkgroep die de toekomst van oogheelkunde in kaart wil brengen, project van Novartis, dit beslaat gehele oogheelkunde. Ontwikkeling Qualiteit van Visueel Functioneren questionair, AUMC, grant van Bayer. Ik werk mee aan project om een computer assisted test toe te passen als maat voor kwaliteit van leven/visus bij patiënten, die anti-VEGF injecties krijgen, dit wordt gesteund door Bayer, PI is Ruth van Nispen, onderzoekster wordt (deels) betaald. |
Uitgesloten van besluitvorming bij modules over anti-VEGF. Novartis project over toekomst oogheelkunde: geen belangenverstrengeling. |
|
Van Lith-Verhoeven |
Oogarts ETZ (medisch manager oogheelkunde ETZ) |
Lasik centrum Boxtel: ooglidcorrecties |
Adviescommissie Novartis, Bayer en allergan Organisatie congres Novartis en Bayer Honarium voor eigen presentatie Bayer. 1 advies bijeenkomst oogvitaal bv 1 advies bijeenkost horus pharma (betaald) 1 advies bijeenkomst Roche 1 advies bijeenkomst Roche en co-auteur aan expert opinion T & E.
Extern gefinancierd onderzoek: Novartis, Roche, Chengdu Kanghong biological science, Bayer. Het zijn studies van verschillende sponsoren met verschillende medicijnen, zowel op gebied AMD, DME en RVO. We hebben maar enkele deelnemers per studie. Het geld wat we ontvangen gedurende de studieduur gebruiken we om de studie coordinator (trial nurse) en de medewerkers (TOA's, optometristen) te betalen voor de tijd die ze in het onderzoek stoppen. Dat verekenen we dus met het ziekenhuis.
1 advies bijeenkomst oogvitaal bv 1 advies bijeenkost horus pharma (betaald) 1 advies bijeenkomst Roche 1 advies bijeenkomst Roche en co-auteur aan expert opinion T & E. |
Uitgesloten van besluitvorming bij modules over anti-VEGF.
|
|
Huiskamp |
Oogarts, netvliesspecialist in het Universitair Medisch Centrum Groningen |
Geen |
*Annexin Pharmaceuticals, Onderzoek naar moleculair imaging bij patiënten met retinale veneuze occlusie of diabetische retinopathie. SIGHT studie. Kosten voor de afdeling oogheelkunde worden gefinancierd door Annexin Pharmaceuticals. Deelname als onderzoeker aan deze studie (geen projectleider). * Bayer, Multicenter onderzoek naar medicijn voor diabetische retinopathie. NEON-NPDR studie. Kosten voor de afdeling oogheelkunde worden gefinancierd door Bayer. Deelname als onderzoeker aan deze studie (geen projectleider). * Heidelberg Engineering, Onderzoek naar moleculair imaging bij patiënten met neovasculaire LMD. LEAF studie. Financiering door het UMCG zelf. Apparatuur is voor deze studie ter beschikking gesteld door Heidelberg Engineering. Deelname als onderzoeker aan deze studie (geen projectleider). |
Geen restricties |
|
Kok |
Oogarts, medisch retina speciliast Bergamn Clinics Ogen Amsterdam UMC |
Geen |
Geen |
Geen restricties |
|
Lambooij |
Oogarts, Reinier de Graaf ziekenhuis Delft |
Gastdocent TOA opleiding Dutch Health Tec Academy Utrecht, betaald |
Geen |
Geen restricties |
|
Tigchelaar |
Oogarts |
Consultent oogarts bij visio R&A, betaald Consultent oogarts bij visio school, betaald Werkgroep FRB, onbetaald Eenmalige meet the expert bijeenkomst, uren vergoeding Voor novartis voorafgaand introductie van broculizumab. Broculizumab wordt gebruikt bij amd, in het voorstadium van de introductie was een meet the expert bijeenkomst om van een oogarts in het veld te horen wat overwegingen zijn voor beslissingen in de praktijk. Introductie in nederland in 2020. Honorering was alleen uren vergoeding. |
Geen |
Uitgesloten van besluitvorming bij modules over anti-VEGF, mocht wel meelezen als er geen andere experts waren. |
|
Klaver |
Erasmus MC, 0.6FTE, Hoogleraar Radboudumc, 0.4FTE, Oogarts University of Basel (locatie IOB, Basel), 0.15FTE, Hoogleraar |
Lid bestuur van Euretina, Europese vereniging voor retina specialisten, onbetaald Lid bestuur Landelijke Stichting voor Blinden en Slechtzienden (LSBS), onbetaald Lid bestuur Rotterdamse Oogheelkundig Onderzoek Stichting (ROOS), onbetaald Lid bestuur Collaborative Ophthalmic Research Rotterdam (CORR), onbetaald,
Betaald op projectbasis: Consultant voor TheaPharma Consultant voor Bayer |
* Ik maak geen deel uit van onderzoek geïnitieerd door het bedrijfsleven. Wel financiert Bayer een deel van de ontwikkeling van AI algoritmen die wij gebruiken voor het beoordelen van oogheelkundige beelden in ons EyeNED reading center. Bayer heeft geen invloed op deze algoritmen. Algoritmen hebben deels betrekking op LMD. Echter, Bayer is geen producent/leverancier van AI software. * Ik heb geen persoonlijk gewin bij, ander dan persoonlijke erkenning van mijn expertise als clinicus en als wetenschappelijk onderzoeker in dit vakgebied. De LSBS is een slechtziendenstichting die weinig patiënten met maculadegenratie als lid heeft. Mijn grootste inbreng voor de commissie is mijn expertise op het gebied van genetica, voeding en leefstijl. * Ik organiseer 1x per jaar nascholingsdagen voor de werkgroep Medische Retina. Deze nascholingen worden door Bayer gefinancierd. Bayer heeft geen invloed op de inhoud van deze nascholing. Ik geef 1x per jaar lezingen die georganiseerd worden door de firma Thea Pharma voor Europese oogartsen. Deze lezingen gaan over dieet adviezen voor maculadegeneratie. *Het IOB instituut in Basel is opgericht als een samenwerking tussen de Universiteit van Basel, het universiteitsziekenhuis van Basel, en Novartis. Novartis heeft geen zeggenschap over de wetenschappelijke koers en de onderzoeken die IOB uitvoert. Werknemers van IOB hebben geen financiele relatie met Novartis en leggen geen verantwoording af aan deze partij. |
Uitgesloten van besluitvorming bij modules over anti-VEGF.
|
|
Diepman-Leerdam |
Optometrist werkzaam bij Berman Clinics Doetinchem |
Niet van toepassing |
Geen |
Geen restricties |
|
Jansen Molenaar |
Adviseur oogzorg |
Niet van toepassing |
Geen |
Geen restricties |
|
Schoots-Wilke |
Voorzitter MD |
Vrienden van Walstede - onbetaald |
Voorzitter patiëntenvereniging |
Geen restricties |
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Symptomen van LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Fasering diagnostiek van LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module OCT |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module FAG |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module ICG-angiografie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module OCT-angiografie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Indicaties en contra-indicaties voor anti-VEGF behandeling bij neovasculaire LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Keuze van anti-VEGF middel |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Chirurgie bij submaculaire bloeding |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij polypoidale choroidale vasculopathie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij retinale angiomateuze proliferatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij chronische centrale sereuze chorioretinopathie met subretinale neovascularisatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Photodynamic therapy bij non-responders op anti-VEGF therapie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Thermische laserbehandeling |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Cataractextractie bij patiënt met neovasculaire LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Behandelstrategie voor anti-VEGF medicatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Instructies aan patiënt voor herkennen reactivatie van maculaire neovascularisatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Criteria om te stoppen met anti-VEGF behandeling |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Criteria voor het veranderen van anti-VEGF middel |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Voedingsadvies ter preventie van LMD progressie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Leefstijladviezen ter preventie van LMD progressie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Bloedverdunners bij LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Advies aan familieleden van een patiënt met LMD |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Intravitreale injecties |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Verwijzing naar oogarts |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Verwijzing voor hulpmiddelen en revalidatie |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Informed Consent |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Informed consent voor de behandeling met off-label bevacizumab (Avastin®) |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Informatievoorziening aan patiënten en naasten |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Module Rol van de patiëntenvereniging |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Patiëntenfederatie Nederland, MaculaVereniging en Oogvereniging voor de schriftelijke knelpuntenanalyse en het afgevaardigde patiëntenverenigingen in de klankbordgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de MaculaVerening en Oogvereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patiënten met leeftijdsgebonden maculadegeneratie (LMD). De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijnmodule (NOG, 2014]) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de IGJ, Zorginstituut, OVN en Oogvereniging via enquête.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zou de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J [corrected to Schünemann, Holger J]. PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Literature search strategy
Embase
|
No. |
Query |
Results |
|
#21 |
#19 AND #20 |
75 |
|
#20 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
839193 |
|
#19 |
#16 AND #17 AND #18 AND ([english]/lim OR [dutch]/lim) AND [2010-2022]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
681 |
|
#18 |
'drug dose regimen'/exp OR 'dosage schedule comparison'/exp OR regimen*:ti,ab,kw OR ((treat NEAR/3 extend):ti,ab,kw) |
472827 |
|
#17 |
'vasculotropin antibody'/exp/mj OR 'vasculotropin inhibitor'/exp/mj OR ((('vascular endothelial growth factor*' OR vegf OR vasculotropin) NEAR/3 (antagonis* OR inhibit*)):ti,ab,kw) OR 'anti-vegf':ti,ab,kw OR 'anti-vascular endothelial growth factor*':ti,ab,kw OR 'bevacizumab'/exp/mj OR 'bevacizumab':ti,ab,kw OR 'abevmy':ti,ab,kw OR 'ainex':ti,ab,kw OR 'altuzan':ti,ab,kw OR 'ankeda':ti,ab,kw OR 'avastin':ti,ab,kw OR 'aybintio':ti,ab,kw OR 'bevax':ti,ab,kw OR 'byvasda':ti,ab,kw OR 'bryxta':ti,ab,kw OR 'cizumab':ti,ab,kw OR 'equidacent':ti,ab,kw OR 'krabeva':ti,ab,kw OR 'kyomarc':ti,ab,kw OR 'onbevzi':ti,ab,kw OR 'pusintin':ti,ab,kw OR 'versavo':ti,ab,kw OR 'zirabev':ti,ab,kw OR 'rhumab-vegf':ti,ab,kw OR 'aflibercept'/exp/mj OR 'ranibizumab'/exp/mj OR 'ranibizumab'/exp OR 'ranibizumab':ti,ab,kw OR 'lucentis':ti,ab,kw OR 'lucentris':ti,ab,kw OR 'aflibercept'/exp OR aflibercept:ti,ab,kw OR 'vegf trap':ti,ab,kw OR 'ave 0005':ti,ab,kw OR 'ave0005':ti,ab,kw OR 'bay 86 5321':ti,ab,kw OR 'bay 865321':ti,ab,kw OR 'bay865321':ti,ab,kw OR 'eylea':ti,ab,kw OR 'vascular endothelial growth factor trap':ti,ab,kw OR 'vasculotropin trap':ti,ab,kw OR 'zaltrap':ti,ab,kw OR 'brolucizumab'/exp OR 'brolucizumab':ti,ab,kw OR 'beovu':ti,ab,kw OR 'dlx 1008':ti,ab,kw OR 'dlx1008':ti,ab,kw OR 'esba 1008':ti,ab,kw OR 'esba1008':ti,ab,kw OR 'rth 258':ti,ab,kw OR 'rth258':ti,ab,kw |
72841 |
|
#16 |
'age related macular degeneration'/exp/mj OR ('wet macular degeneration'/de AND age:ti,ab,kw) OR (('macula* degeneration' NEAR/3 ('age-related' OR exsudative)):ti,ab,kw) OR amd:ti,ab,kw OR wamd:ti,ab,kw OR warmd:ti,ab,kw OR armd:ti,ab,kw OR namd:ti,ab,kw |
37324 |
|
# |
Searches |
Results |
|
8 |
6 and 7 |
68 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
604161 |
|
6 |
5 not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
755 |
|
5 |
limit 4 to ((english language or dutch) and yr="2010 -Current") |
782 |
|
4 |
1 and 2 and 3 |
857 |
|
3 |
(regimen* or (treat adj3 extend)).ti,ab,kf. |
279528 |
|
2 |
Angiogenesis Inhibitors/ag, tu, ad, ae or exp Vascular Endothelial Growth Factors/ai or (('vascular endothelial growth factor*' or VEGF or vasculotropin) adj3 (antagonis* or inhibit*)).ti,ab,kf. or 'anti-VEGF'.ti,ab,kf. or 'anti-vascular endothelial growth factor*'.ti,ab,kf. or Bevacizumab/ or 'bevacizumab'.ti,ab,kf. or aflibercept.ti,ab,kf. or Ranibizumab/ or 'ranibizumab'.ti,ab,kf. or aflibercept.ti,ab,kf. or 'brolucizumab'.ti,ab,kf. or exp Biosimilar Pharmaceuticals/ or biosimilar*.ti,ab,kf. |
53684 |
|
1 |
(exp Macular Degeneration/ and ('age related' or wet or neovascular*).ti,ab,kf.) or Wet Macular Degeneration/ or ('macula* degeneration' adj3 ('age-related' or exsudative or neovascular*)).ti,ab,kf. or AMD.ti,ab,kf. or WAMD.ti,ab,kf. or WARMD.ti,ab,kf. or armd.ti,ab,kf. or namd.ti,ab,kf. or Choroidal Neovascularization/ or (neovasculari*ation adj3 (choroid* or subretinal)).ti,ab,kf. or CNV.ti,ab,kf. |
38204 |
