Controle van de tiplocatie
Uitgangsvraag
Wat is de optimale techniek ter controle/bevestiging van de tip van de perifeer ingerichte centraal veneuze katheter (PICC), poortkatheter (PAC), getunnelde centraal veneuze katheters (CVC) bij volwassen patiënten welke niet zijn opgenomen op de intensive care?
Aanbeveling
Gebruik doorlichting of ECG-geleiding om de tip van een centraal veneuze lijn of perifeer ingebrachte centrale katheters te positioneren of controleren.
Overweeg ECG-geleiding met het oog op het verminderen van stralingsbelasting.
Bij een niet-getunnelde centraal veneuze katheter voor perioperatief gebruik kan vanwege logistieke redenen controle van de tiplocatie worden uitgesteld.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de optimale techniek ter controle van de tip van de centrale lijn. ECG-geleiding werd vergeleken met plaatsing op basis van anatomische landmarks met postprocedurele X-thorax en met doorlichting. Daarnaast werd doorlichting vergeleken met postprocedurele X-thorax. Re-interventie en complicaties werden beschouwd als cruciale uitkomstmaten. Kosteneffectiviteit werd gedefinieerd als belangrijke uitkomstmaat.
Eén gerandomiseerde studie vergeleek doorlichting met postprocedurele X-thorax. Het aantal re-interventies leek lager bij doorlichting dan bij X-thorax (GRADE laag). Door de zeer lage bewijskracht kon de uitkomstmaat complicaties geen richting geven aan de besluitvorming. Kosteneffectiviteit werd niet beschreven. Op basis van de literatuur is er een lichte voorkeur voor doorlichting ten opzichte van een X-thorax achteraf.
Vijf studies vergeleken postprocedurele X-thorax met ECG-geleiding bij het plaatsen van PICC-lijnen. ECG-geleiding geeft waarschijnlijk een vermindering van het aantal re-interventies (GRADE redelijk) en lijkt minder complicaties te geven dan inbrengen en de tip van de lijn achteraf met een X-thorax controleren (GRADE laag).
Kosteneffectiviteit werd niet beschreven. Op basis van de literatuur is er een voorkeur voor het gebruik ECG-geleiding ten opzichte van een X-thorax achteraf bij het plaatsen van tip van de centrale lijn.
Twee gerandomiseerde studies vergeleken doorlichting met ECG-geleiding. Op basis van één studie (Gullo, 2021) leek het aantal re-interventies lager bij doorlichting dan bij ECG (GRADE laag). Door de zeer lage bewijskracht kon de uitkomstmaat complicaties, beschreven door Mack (2022) geen richting geven aan de besluitvorming. Kosteneffectiviteit werd niet beschreven. Op basis van de literatuur is er een lichte voorkeur voor doorlichting ten opzichte van ECG-geleiding bij deze vergelijking.
Uit de studies lijkt te kunnen worden geconcludeerd dat het gebruik van fluoroscopie waarschijnlijk de minste interventies nodig heeft voor het bereiken van een goede tippositie, gevolgd door ECG-geleiding en blinde insertie met een X-thorax achteraf. Voor wat betreft het optreden van complicaties kan op basis van de literatuur geen gedegen uitspraak gedaan worden. Of doorlichting ook de techniek van voorkeur is, zal onder andere afhangen van de indicatie van de lijn, patiënt kenmerken, logistieke mogelijkheden, beschikbare ervaring met inbrengmethodes, patiënt voorkeuren en kosten. We gaan hier verder in op de eerste 2 punten, de overige punten zullen verderop aan bod komen. Voor wat betreft de indicatie van de lijn is met name bij het geven van (langdurig) irriterende middelen een ideale tippositie na te streven (zie module Optimale locatie van de tip). Dit kan met alle methodes bereikt worden, alleen lijken er bij het gebruik van periprocedurele doorlichting minder reïnterventies nodig te zijn om de ideale tippositie te bereiken. Hiervoor is het echter noodzakelijk dat de lijnplaatsing plaatsvindt op een angio-.hybride kamer of met een C-boog welke is uitgerust met een angiografie softwarepakket. Dit leidt mogelijk tot meer logistieke uitdagingen en kosten. Daarnaast dient men als zorgprofessional te voldoen aan de ALARA-principes waarbij de hoeveelheid toegepaste röntgenstraling zo minimaal mogelijk moet worden gehouden. Het gebruik van fluoroscopie zou dan ook gereserveerd kunnen worden voor risicopatiënten (zie hieronder) waarbij een ideale tippositie na te streven is vanwege het toedienen van irriterende vloeistoffen via de centraal veneuze lijn. Indien op basis van indicatie een acceptabele tippositie voldoende is, lijkt het gebruik van ECG geleide controle en in de tweede plaats een X-thorax achteraf een goed alternatief.
Wat betreft patiënt factoren is het belangrijk na te gaan of er risicofactoren voor een gecompliceerde lijnplaatsing te verwachten zijn. Op basis van ervaring moet hierbij met name gedacht worden aan de mogelijke aanwezigheid van centrale of meer perifeer gelegen veneuze stenosen. De kans op stenosen in het traject van de veneuze katheter (PICC, PAC, getunnelde CVL) is op basis van ervaring groter bij een patiënt met een voorgeschiedenis met een cardiaal device met endovasculaire leads via de veneuze circulatie. Ook een voorgeschiedenis met eerder in gebrachte centraal veneuze of dialyse katheters geeft een grotere kans op significante centrale stenosen.
Wanneer veneuze stenosen in het lijntraject te verwachten zijn, lijkt het meer voor de hand te liggen de plaatsing uit te voeren onder fluoroscopie en met de beschikbaarheid van endovasculaire hulpmiddelen.
Een ander patiëntgebonden factor om in overweging te nemen is de aan of afwezigheid van een sinusritme. Bovenstaande conclusies hebben alleen betrekking op patiënten met een sinusritme. In alle geïncludeerde studies met de ECG-techniek werden patiënten met atriumfibrilleren geëxcludeerd. Bij de ECG geleide techniek worden immers veranderingen in de P golf gebruikt voor het bepalen van de optimale tip positie. Bij het naderen van de sinusknoop op de cava-atriale overgang door de vena cava superior zal de amplitude van de P golf steeds groter worden totdat hij zijn maximum bereikt ter plaatse van de cava-atriale overgang waarna de amplitude weer kleiner wordt. De ideale positie van de katheter tip is ter plaatse van de maximale P golf amplitude. Bij patiënten met atriumfibrilleren ontbreekt een P golf. In plaats daarvan hebben zij F golven. Studies hebben laten zien dat deze F golven op dezelfde wijze veranderen in amplitude als de P golf bij het inbrengen van een katheter. Echter vanwege de irregulariteit van de F golven met het ontbreken van een isopotentiale lijn, is het lastig om een maximale amplitude verandering ten opzichte van de isopotentiaal te zien. De ECG geleide techniek lijkt daarom niet geschikt voor patiënten met persisterend atriumfibrilleren. Bij patiënten met paroxysmaal atriumfibrilleren kan het wel toegepast worden, mits zij is sinusritme verkeren op moment van katheterplaatsing (Zhao, 2022; Gao, 2018). Wel kan er gekozen worden om de lijn met ECG-techniek te gebruiken om de lijn richting de VCS te begeleiden de F golven worden immers groter bij het naderen van het rechter atrium, en postprocedureel een X-thorax te maken om de tip positie te controleren.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Voor de patiënt is een vlotte, veilige, ongecompliceerde procedure zonder noodzaak tot re-interventie van groot belang. Fluoroscopie geeft mogelijk de kleinste kans op een re-interventie. Dit heeft echter als nadeel dat de logistieke beschikbaarheid van röntgenapparatuur en geschoold personeel de wachttijd kan verlengen. Het plaatsen middels ECG-geleiding vereist minder scholing en kan door artsen, physician assistants en verpleegkundigen aan bed worden uitgevoerd. Daarnaast hoeven patiënten bij de ECG-geleide techniek niet te worden blootgesteld aan röntgenstraling.
Kosten (middelenbeslag)
Een vlotte ongecompliceerde lijnplaatsing met zo min mogelijk materiaal en personeel levert de minste kosten op. Welke methode dat is, komt niet naar voren uit de literatuuranalyse. Een re-interventie zal de kosten doen stijgen, waardoor de blinde insertie kostentechnisch minder aantrekkelijk is vanwege het hogere aantal re-interventies. De verschillen in re-interventies tussen de ECG en fluoroscopie methode zijn klein. Het is aannemelijk dat de ECG-methode goedkoper is dan gebruik van fluorosopie, zeker als de techniek aan bed kan worden uitgevoerd, aangezien minder en goedkoper materiaal en personeel nodig is. Zoals beschreven onder ‘waarden en voorkeuren van patiënten’ zijn voor niet-getunnelde centraal veneuze katheters en getunnelde centraal veneuze katheters behandelkamers en/of operatiekamers nodig.
Aanvaardbaarheid, haalbaarheid en implementatie
Om een zo klein mogelijke kans op re-interventies te hebben, lijkt een vorm van peri-procedurele controle de voorkeur te hebben, met name bij de patienten met risico factoren voor een gecompliceerde lijnplaatsing of waarbij over de lijn irriterende vloeistoffen gegeven gaan worden. Hierbij lijkt er geen duidelijk verschil tussen het gebruik van ECG of fluoroscopie waarbij volgens de ALARA principes ECG wel de voorkeur heeft bij de patiënt zonder risicofactoren voor gecompliceerde lijnplaatsing. Bij patiënten zonder risicofactoren waarbij geen irriterende vloeistoffen toegediend gaan worden is een C-thorax achteraf ook te overwegen. De logistiek per ziekenhuis en de ervaring van het personeel zal voor een groot deel uitmaken welke vorm het meest toegankelijk, goedkoop, patiëntvriendelijk is.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het streven is om het plaatsen van een centraal veneuze lijn of perifeer ingebrachte centrale katheter ongecompliceerd en vlot te laten verlopen. Welke techniek het beste gebruikt kan worden om een goede tip positie te bereiken, zal onder andere afhangen van de indicatie van de lijn, patiënt kenmerken, logistieke mogelijkheden, ervaring van de inbrenger, patiëntvoorkeuren en kosten.
Als alleen gekeken wordt naar de kans op het in één keer bereiken van een goede tippositie dan heeft een vorm van directe controle de voorkeur ten opzichte van controle met X-thorax achteraf. Hierbij is er geen duidelijk voordeel van één van beide technieken, ECG of fluoroscopie. In een aantal situaties kan het gebruik van fluoroscopie (en de beschikbaarheid van aanvullende endovasculaire hulpmiddelen) de voorkeur hebben boven de ECG geleide techniek:
- Indien een ideale tippositie moet worden bereikt vanwege het toedienen van irriterende stoffen.
- Indien op basis van de voorgeschiedenis van patiënt mogelijk een moeilijke procedure wordt verwacht door eventuele aanwezigheid van stenosen of obstructies in het af te leggen veneuze traject (zie module Beeldvorming voorafgaand aan plaatsing van een centraal veneuze lijn).
- Patiënt heeft geen sinusritme.
In overige situaties lijkt op basis van de ALARA-principes, kosten en duurzaamheid de ECG geleide techniek de voorkeur te hebben. Bij patiënten zonder risico factoren voor een gecompliceerde lijnplaatsing en waarbij geen irriterende stoffen gegeven gaan worden kan dopbasis van logistieke of personele overwegingen gekozen worden voor een X-thorax achteraf.
Onderbouwing
Achtergrond
Een adequate positie van de tip van de centraal veneuze katheter lijkt van belang in het voorkomen van complicaties als trombose, katheter disfunctie en het optreden van ritmestoornissen. Radiologisch onderzoek (thoraxfoto) is een veel gebruikte techniek ter controle van de positie van de katheter tip. Deze techniek vereist echter de aanwezigheid van hoogstaande röntgeninfrastructuur en technologie. Een alternatief is om de tip positie te controleren met behulp van ECG. Dit vereist minder uitgebreide infrastructuur, echter het is onduidelijk of de techniek net zo accuraat is. Daarnaast is de vraag op welk moment röntgen het beste ingezet kan worden, na afloop van de procedure in de vorm van een controle X-thorax danwel direct tijdens de procedure in de vorm van doorlichting/fluoroscopie.
Voor patiënten op de intensive care wordt verwezen naar de Richtlijn Centraal veneuze lijn van de NVIC. De aanleg van een vaattoegang voor hemodialyse valt buiten de afbakening van deze richtlijn en wordt beschreven in de richtlijn ‘Vaattoegang voor hemodialyse’.
Conclusies / Summary of Findings
1. Fluoroscopy versus postprocedural chest X-ray
Critical outcomes
|
Low GRADE |
Fluoroscopic guidance may reduce reintervention rate when compared with postprocedural chest X-ray in placement of peripherally inserted central catheters in adult patients.
Source: Glauser, 2016 |
|
No GRADE |
No relevant evidence was found regarding the effect of fluoroscopic guidance compared with postprocedural chest X-ray on complications in central venous catheters in adult patients. |
Important outcomes
|
No GRADE |
No evidence was found regarding the effect of fluoroscopic guidance compared with postprocedural chest X-ray on cost-effectiveness in central venous catheters in adult patients. |
2. ECG guidance versus postprocedural X-ray
Critical outcomes
|
Moderate GRADE |
Electrocardiographic guidance likely reduces reintervention rate when compared with postprocedural chest X-ray in placement of peripherally inserted central catheters in adult patients.
Sources: Alexandrou, 2022; Yin, 2020; Yu, 2020 |
|
Low GRADE |
Electrocardiographic guidance may reduce incidence of complications when compared with postprocedural chest X-ray in placement of central venous catheters in adult patients.
Sources: Alexandrou, 2022; Jayaraman, 2019; Yin, 2020; Yu, 2020 |
Important outcomes
|
No GRADE |
Insufficient evidence was found regarding cost-effectiveness of electrocardiographic guidance compared with postprocedural chest X-ray for placement of central venous catheters in adult patients.
Source: Alexandrou, 2022 |
3. ECG versus fluoroscopy
Critical outcomes
|
Low GRADE |
Fluoroscopic guidance may reduce reintervention rate when compared with electrocardiographic guidance in placement of peripherally inserted central catheters in adult patients.
Source: Gullo, 2021 |
|
Very low GRADE |
The evidence is very uncertain about the effect of electrocardiogram guidance on complications when compared with fluoroscopic guidance in peripherally inserted central catheters in adult patients.
Sources: Mack, 2020 |
Important outcomes
|
No GRADE |
No evidence was found regarding the effect of electrocardiographic guidance compared with fluoroscopic guidance on cost-effectiveness in central venous catheters in adult patients. |
Samenvatting literatuur
Description of studies
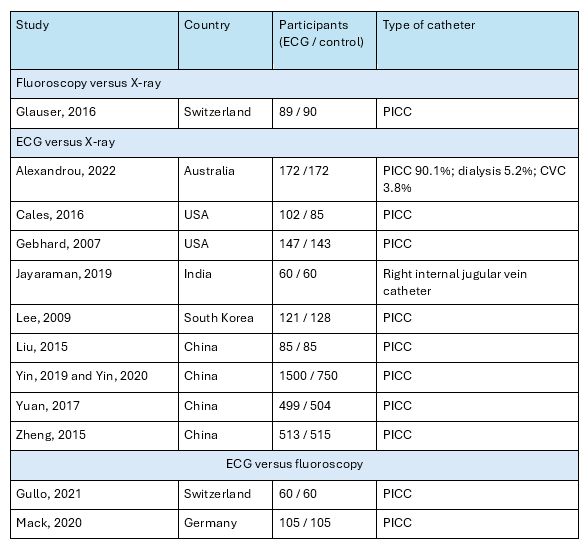
For the comparison of fluoroscopic guidance with postprocedural X-ray, one RCT was included in the analysis of the literature.
Glauser (2016) performed a prospective randomized controlled study to compare the blind bedside insertion with the fluoroscopically guided technique for PICC placement, with specific regard to catheter tip position. One hundred eighty patients were randomized. All procedures were performed by an interventional radiology team experienced in PICC placement (10 years’ experience, with >800 procedures per year). All procedures were done by the same interventional team and included postprocedural chest X-ray to assess tip position. Depending on the international guidelines for optimal CTP, positioning was classified in three types: optimal (located less than 1 cm above or under the CAJ), suboptimal not needing repositioning (tip located >1 cm under the CAJ or >1 cm above the CAJ but remaining in the SVC), and nonoptimal requiring additional repositioning (tip located >3 cm under the CAJ or not inside the SVC). For the bedside technique, distance was measured between planned insertion sites to the right clavicular head, then down to the third intercostal space, with the shoulder abducted to 90°, as previously described and as recommended by the manufacturer. Risk of bias was considered low for this study.
For the comparison between ECG and landmark approach with post-procedural chest X-ray, one systematic review with nine RCTs and 4 additional RCTs were included.
Yu (2020) performed a systematic review and meta-analysis to examine the accuracy and safety of using the electrocardiogram (ECG) positioning technique to localize the peripherally inserted central catheter (PICC) tip position in adult patients. They searched the literature for randomized controlled trials in the MEDLINE, EMBASE, PubMed, Cochrane Central Register of Controlled Trials (CENTRAL) and PsycINFO databases. This systematic review identified nine studies with 3,194 patients in total, that compared ECG positioning with landmark-based positioning with subsequent chest X-ray. The overall quality of all studies was fair to good, but the therapists and participants were not blinded in the design of all studies. Three studies in the meta-analysis were excluded from the current analysis: Baldinelli (2015) and Elli (2016) were not randomized and Barnwall (2016) concerned pediatric patients.
Alexandrou (2022) compared intracavitary electrocardiography guided central venous catheter placement with landmark based placement in a pragmatic, open label randomized controlled trial in adult patients. All patients received a post-procedural chest X-ray. ECG-guiding was performed with a portable, wireless IC-ECG navigation system (Nautilus Delta Tip Confirmation System – BARD access systems). When maximum P-wave amplitude was achieved, the tip was considered in position. Single and double lumen PICC, double and triple lumen central venous catheters and dialysis lines were included. Correct positioning as interpreted on Chest X-ray was defined as in the lower third of the SVC (within 3 cm above the tracheal carina), the cavoatrial junction (CAJ), up to 3 cm below tracheal carina or upper right atrium (RA, 3-5 cm below tracheal carina). The study was not blinded, but risk of bias for the relevant outcomes was considered low.
Jayaraman (2019) performed a randomized double blinded study in 180 patients aged between 18 to 65 years requiring central venous catheterization. The optimal depth of insertion of right internal jugular vein catheter using three different techniques, Peres’ formula method, Landmark technique and intra-atrial ECG guided technique was performed, and the three techniques were compared with respect to optimal positioning using carina as a landmark in post procedural chest radiograph. Correct position of the catheter tip was considered up to 1 cm above or below the carina in post procedure X-ray. In the ECG group, the ECG adapter (Certodyn® ‑ Universal adapter, B. Braun Melsungen, Germany) was connected in‑line between the ECG monitor and the right‑arm electrode. While lead II was observed on the ECG monitor, the catheter was slowly advanced until the RA‑ECG indicated a CVC position in the SVC/RA junction (peaked, tall P‑wave) or in the RA (biphasic P‑wave). Thereafter, the CVC was withdrawn at 0.5 cm intervals until the P‑wave returned to a normal configuration. There were some concerns for risk of bias due to a lack of information about randomization and allocation concealment.
In a multicenter, open label, randomized controlled study, Yin (2019) and Yin (2020) compared intracavitary ECG guidance with traditional anatomical landmarks method followed by a post-procedural chest X-ray in PICC placement and reported optimal tip positioning and complications, respectively. In the control group (N=750), the ultrasound technology provided by the ECG and Doppler Ultrasound Guidance devices (EDUG, Branden Medical Scientific, Inc.) device was used to identify a suitable vein for catheter insertion and perform ultrasound-guided venipuncture. The traditional anatomical landmarks method was used to estimate the catheter length. In the study group (N=1500), ultrasound guidance and traditional anatomical landmarks methods were performed the same as in the control group. Tip-conductive PICC was advanced gently until 5 cm was remaining, after which IC-ECG was performed according to the standard technique. As the catheter was slowly advanced into the SVC, the P-wave gradually increased, reaching a maximal peak at the CAJ. As the catheter entered the RA, a diphasic P-wave appeared and the catheter was retracted slowly to return to the position of maximal peak P-wave, with no negative components. The study was not blinded, but risk of bias for the relevant outcomes was considered low.
For the comparison between ECG and fluoroscopic guidance, two RCTs were included.
In a prospective randomized controlled study, Gullo (2021) compared electromagnetic guidance (EM) combined with intracavitary ECG versus fluoroscopic guidance in PICC insertion in 120 adult patients. Fluoroscopic guidance was performed using a multipurpose x-ray system (Artis Zee, Siemens Healthcare). Combined ECG-EM guidance was performed using an ultrasound system (Site-Rite 8) with an integrated system for guidance and PICC tip confirmation (Sherlock-3CG Diamond-Tip Confirmation System, BD and Company). The ECG was used to drive the catheter into the target position, until the intracavitary P wave increased and reached its maximum height in the absence of negative deflection. A final tip position on final chest radiograph of less than or equal to 1 cm from the CAJ was defined as optimal placement. Inadequate placement requiring repositioning was defined as more than three centimeters under the cavo-artrial junction or not in the superior vena cava. Risk of bias was considered low for this study.
Mack (2020) performed a prospective, randomized, open-label, single-center, investigator initiated, noninferiority trial that sought to determine whether PICC insertion using magnetic tip confirmation system (TCS) including real-time ECG guidance is noninferior to fluoroscopy regarding the incidence of correct PICC tip position confirmed by chest X-ray. The study included 210 patients with an indication for PICC insertion. In the investigational group, the Sherlock 3CG TCS (including single-use PowerPICC SOLO catheter with Sherlock 3CG tip positioning system stylet, Becton, Dickinson and Company, Franklin Lakes, NJ, USA) was used for magnetic tracking of the PICC tip and real-time ECG confirmation of the tip position during insertion. The maximum ECG P-wave anatomically corresponds with the cavoatrial junction. The PICC was inserted with the guidewire inside to support proper placement. After PICC insertion, the guidewire was removed. Signal intensity was documented in all patients in the TCS group. Correct PICC tip position was defined as within the mid to lower superior vena cava, at the level of the cavoatrial junction, or within the upper portion of the right atrium, corresponding to 1.5 vertebral body units (approximal 3 cm) from the tracheal carina on chest X-ray obtained immediately after insertion. The study was not blinded, but risk of bias for the relevant outcomes was considered low.
Study characteristics are outlined in table 1.
Table 1. Study characteristics
Results
1. Fluoroscopy versus postprocedural chest X-ray
Reintervention (critical outcome)
Glauser (2016) classified tip placement as follows. Type 1: optimal tip position located less than 1 cm above or below the CAJ. Type 2: suboptimal tip location not requiring repositioning, with tip located >1 cm under the CAJ or >1 cm above the CAJ but remaining in the SVC. Type 3: nonoptimal tip location requiring repositioning, with tip located >3 cm under the CAJ or not inside the SVC. In the fluoroscopy group, 1/89 (1%) PICCs required repositioning (type 3), versus 27/90 (30%) in the X-ray group, resulting in a RR of 0.04 (95% CI 0.01 to 0.27) in favor of fluoroscopy, which was considered clinically relevant.
Complications
Glauser (2016) reported complications in 8/89 (9%) patients in the fluoroscopy group, versus 6/90 (6.7%) in the X-ray group. The RR of 1.35, with a broad 95% CI from 0.49 to 3.73 These were all hematomas, which were not considered relevant for decision-making.
Important outcome measures
The included publication did not report the important outcome measure cost-effectiveness.
Level of evidence of the literature
For the outcome “reintervention”, the level of evidence was downgraded by two levels to LOW because the criteria for optimal positioning and reintervention were different from the criteria defined by the working group (indirectness, -1), and because of the limited population size (imprecision, -1).
For the outcome “complications”, the level of evidence could not be graded due to a lack of relevant data.
For the outcome “cost-effectiveness”, the evidence could not be graded due to a lack of data.
2. ECG guidance versus postprocedural X-ray
Thirteen publications compared ECG guided catheter placement with insertion with a landmark-based approach with postprocedural X-ray.
Reintervention (critical outcome)
Five trials reported reintervention.
Yin (2020) reported the need for extra insertion procedures in 0/1500 patients (0%) in the ECG group versus 4/750 patients (0.5%) in the X-ray group.
Alexandrou (2022) reported that 170/172 catheters (99%) in the ECG group did not require further manipulation after bedside chest X-ray assessment. In the X-ray group, 139/172 catheters (81%) required no further intervention.
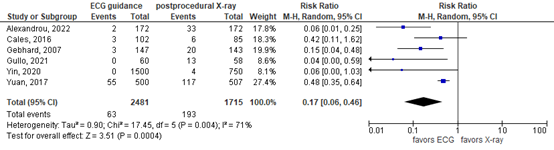
The review by Yu (2020) did not report reintervention rate. Data were extracted from the original publications. Yuan (2017) reported that ultrasound examinations indicated that in 29 (5.8%) patients who underwent placement using the anatomical landmark technique, the PICC tip failed to reach the SVC area on the first attempt. Of them, eight patients experienced aberrant placement of 3 times or more. Conversely, In the ECG guided group, tip misplacement was totally avoided due to real-time monitoring of changes in P-waves. Cales (2016) stated that the ideal position was considered in the SVC at the junction of the right atrium. A tip located 6.1 cm or more above the junction, would be required to be reinserted. This was the case in 3/102 (2.9%) in the ECG group versus 6/85 (7.1%) in the X-ray group. Gebhard (2007) reported that 3/147 (2.0%) patients in ECG group required repositioning of their CVC after surgery, whereas this maneuver was necessary 20/143 (14.0%) patients in the X-ray group (P ≤ 0.001). The publication by Zheng (2015) was not found. Taken together, the pooled risk ratio (RR) was 0.17 in favor of ECG guidance, with a 95% confidence interval (CI) from 0.06 to 0.46 (figure 1). The difference was considered clinically relevant.
Figure 1. Reintervention after ECG guidance versus postprocedural X-ray
Random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect
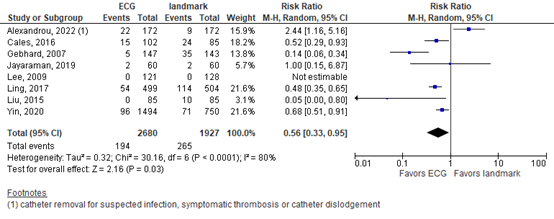
Complications (critical outcome)
In eight relevant publications (figure 2), 194 complications occurred after ECG guidance in 2680 patients (7.2%), versus 265 complications in 1927 patients (13.8%) after the landmark approach with chest X-ray (RR 0.56 in favor of ECG, 95% CI 0.33 to 0.95). The difference was considered clinically relevant. Included complications may have varied between the studies. The systematic review (Yu, 2022) did not specify which complications were included. Therefore, it is not clear whether the reported complications are the predefined relevant complications infection, venous thrombosis, arrhythmia and catheter dysfunction.
Figure 2. Complications after ECG guidance versus postprocedural X-ray
Random effects model; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval; Z: p-value of pooled effect
In addition, Alexandrou (2022) reported central line associated bloodstream infection per 1000 catheter days and found no infections in the ECG group versus one infection in the landmark group.
Cost-effectiveness
One study reported costs. Alexandrou (2022) reported costs for intracavitary electrocardiography guided CVAD placement with CXR confirmation versus landmark based CVAD placement with CXR confirmation in a single center, tertiary referral hospital in Australia. The estimated total cost was 36,546 Australian dollars for ECG guided placement versus 47,206 postprocedural X-ray (N=172 in both groups). The cost per patient was 212 versus 265, respectively. ECG guidance gives a reduction of 62 Australian dollars per patient. The evidence could not be graded, because there was no information about the data distribution. It should be noted that with ECG-guided placement, routine CXR confirmation would not be necessary.
Level of evidence of the literature
The level of evidence for all outcomes was based on randomized controlled trials and therefore started high.
For the outcome “reintervention”, the level of evidence was downgraded by one level to MODERATE because of heterogeneity in ECG guidance approaches, definitions of optimal location, and indications for reintervention (risk of bias, -1).
For the outcome “complications”, the level of evidence was downgraded by two levels to LOW because of heterogeneity in ECG guidance approaches (risk of bias, -1), and because the confidence interval crossed one boundary of clinical relevance (imprecision, -1).
The evidence for cost-effectiveness could not be graded due to insufficient information about the data distribution.
3. ECG versus fluoroscopy
Two studies compared ECG guided with fluoroscopy guided catheter insertion.
Reintervention (critical outcome)
Gullo (2021) classified PICC placement as “optimal”, “suboptimal” or “inadequate requiring repositioning” with postprocedural X-ray. In the FX group, no PICC placements were classified as “inadequate placement requiring repositioning”, versus 13/58 (22.4%) in the ECG group (RR 0.04; 95% CI 0.00 to 0.59). Mack (2020) did not report reintervention rate.
Complications
Mack (2020) reported complications up to two weeks (table 2). Local wound infection occurred in 2.0% in the ECG group, versus 1.9% in the fluoroscopy group. There were no thrombosis events in either group. The differences were not clinically relevant.
Table 2. Complications reported by Mack (2020)
|
|
ECG |
fluoroscopy |
|
Bleeding event (minor access site bleedings) |
8/99 (8.1%) |
13/103 (12.6%) |
|
Pain (mild to moderate) |
8/99 (8.1%) |
12/103 (11.7%) |
|
Local wound infection |
2/99 (2.0%) |
2/103 (1.9%) |
|
Thrombosis |
0/99 (0%) |
0/103 (0%) |
|
Nerve damage |
0/99 (0%) |
0/103 (0%) |
|
Catheter malfunction |
0/99 (0%) |
0/103 (0%) |
Gullo (2021) did not report complications
Important outcome measures
The included publications did not report the important outcome measure cost-effectiveness.
Level of evidence of the literature
For the outcome “reintervention”, the level of evidence was downgraded by two levels to LOW because of a different definition of optimal location and indication for reintervention (risk of bias, -1), and because of the limited population size (imprecision, -1).
For the outcome “complications”, the level of evidence was downgraded by three levels to VERY LOW because the event rate was too low to make an estimation of the difference between the groups (imprecision, -3).
For the outcome “cost-effectiveness”, the evidence could not be graded due to a lack of data.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions: What are the benefits and harms of fluoroscopic guidance compared to post-procedural chest X-ray in patients receiving a central venous access?
| P: |
Adult patients receiving a central venous access |
| I: |
Fluoroscopic guidance |
| C: | Postprocedural chest X-ray |
| O: |
Reintervention, complications, cost-effectiveness |
What are the benefits and harms of ECG-guided positioning of the tip compared to fluoroscopic guidance or post-procedural chest X-ray in patients receiving a central venous access?
| P: |
Adult patients receiving a central venous access |
| I: | ECG positioning |
| C: |
(1) postprocedural chest X-ray; (2) fluoroscopic guidance |
| O: |
Reintervention, complications, cost-effectiveness |
Relevant outcome measures
The guideline development group considered reintervention and complications as outcome measures critical for decision making; and cost-effectiveness as an important outcome measure for decision making.
For reintervention, the definition used in literature was reported. Optimal tip location and criteria for repositioning are defined in module Optimal tip location. For complications, infection, venous thrombosis, arrhythmia and catheter dysfunction were considered relevant. The working group did not define the other outcome measures a priori, but followed the definitions used in the studies.
The working group considered 25% a minimal clinically (patient) important differences for relative risk (RR), 10% of the maximum score for continuous outcomes and 0.5 for standardized mean differences.
Search and select (Methods)
For ECG guidance compared to fluoroscopy or X-ray, the databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 25-7-2023. The systematic literature search resulted in 351 hits. Studies were selected based on the following criteria: randomized controlled trials or systematic reviews thereof, comparing ECG-guided central venous access positioning with either landmark-based insertion or fluoroscopy-guided insertion. Based on title and abstract screening, nineteen studies were initially selected. After reading the full text, twelve studies were excluded (see the table with reasons for exclusion under the tab Methods), and seven studies were included.
For fluoroscopic guidance versus postprocedural X-ray, the databases Medline (via OVID) and Embase (via Embase.com) were additionally searched with relevant search terms until 11-3-2024. The systematic literature search resulted in 391 hits. Studies were selected based on the following criteria: randomized controlled trials or systematic reviews thereof, comparing fluoroscopy-guided central venous access positioning with postprocedural X-ray. Based on title and abstract screening, three studies were initially selected. After reading the full text, two studies were excluded (see the table with reasons for exclusion under the tab Methods), and one publication was included.
Results
For ECG guidance compared to fluoroscopy or X-ray, seven publications were included in the analysis of the literature. For fluoroscopic guidance versus postprocedural X-ray, one publication was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Alexandrou E, Mifflin N, McManus C, Sou V, Frost SA, Sanghavi R, Doss D, Pillay S, Lawson K, Aneman A, Konstantinou E, Rickard CM. A randomised trial of intracavitary electrocardiography versus surface landmark measurement for central venous access device placement. J Vasc Access. 2022 Apr 8:11297298221085228. doi: 10.1177/11297298221085228. Epub ahead of print. PMID: 35394395.
- Gao Y, Liu Y, Zhang H, Fang F, Song L. The safety and accuracy of ECG-guided PICC tip position verification applied in patients with atrial fibrillation. Ther Clin Risk Manag. 2018 Jun 6;14:1075-1081. doi: 10.2147/TCRM.S156468. PMID: 29922068; PMCID: PMC5995413.
- Glauser F, Breault S, Rigamonti F, Sotiriadis C, Jouannic AM, Qanadli SD. Tip malposition of peripherally inserted central catheters: a prospective randomized controlled trial to compare bedside insertion to fluoroscopically guided placement. Eur Radiol. 2017 Jul;27(7):2843-2849. doi: 10.1007/s00330-016-4666-y. Epub 2016 Dec 12. PMID: 27957644.
- Gullo G, Colin A, Frossard P, Jouannic AM, Knebel JF, Qanadli SD. Appropriateness of Replacing Fluoroscopic Guidance With ECG-Electromagnetic Guidance for PICC Insertion: A Randomized Controlled Trial. AJR Am J Roentgenol. 2021 Apr;216(4):981-988. doi: 10.2214/AJR.20.23345. Epub 2021 Feb 17. PMID: 33594912.
- Jayaraman J, Shah V. Bedside prediction of the central venous catheter insertion depth - Comparison of different techniques. J Anaesthesiol Clin Pharmacol. 2019 Apr-Jun;35(2):197-201. doi: 10.4103/joacp.JOACP_125_16. PMID: 31303709; PMCID: PMC6598586.
- Mack V, Nißler D, Kasikci D, Malouhi A, Aschenbach R, Teichgräber U. Magnetic Tracking and Electrocardiography-Guided Tip Confirmation System Versus Fluoroscopy for Placement of Peripherally Inserted Central Catheters: A Randomized, Noninferiority Comparison. Cardiovasc Intervent Radiol. 2020 Dec;43(12):1891-1897. doi: 10.1007/s00270-020-02551-0. Epub 2020 Jun 17. PMID: 32556606; PMCID: PMC7649160.
- Yin YX, Gao W, Li XY, Lu W, Deng QH, Zhao CY, Liu XR, Cao MK, Wang LN, Zhang HJ. Randomized multicenter study on long-term complications of peripherally inserted central catheters positioned by electrocardiographic technique. Phlebology. 2020 Sep;35(8):614-622. doi: 10.1177/0268355520921357. Epub 2020 May 6. PMID: 32375605.
- Yin YX, Gao W, Li XY, Lu W, Deng QH, Zhao CY, Liu XR, Zhou C, Hou WB, Lu ST, Liu G, Wang LN, Li MQ, Zhang HJ. Insertion of peripherally inserted central catheters with intracavitary electrocardiogram guidance: A randomized multicenter study in China. J Vasc Access. 2019 Sep;20(5):524-529. doi: 10.1177/1129729818819732. Epub 2018 Dec 31. PMID: 30596472; PMCID: PMC6699060.
- Yu C, Shulan L, Juan W, Ling L, Chun-Mei L. The accuracy and safety of using the electrocardiogram positioning technique in localizing the peripherally inserted central catheter tip position: A systematic review and meta-analysis. Nurs Open. 2022 May;9(3):1556-1563. doi: 10.1002/nop2.932. Epub 2021 Jun 16. PMID: 34132498; PMCID: PMC8994971.
- Zhao C, Zhu Y, Yin X, Zhang C, He Y, Gao J. ECG method for positioning the tip of peripherally inserted central catheters in patients with atrial fibrillation. Ann Noninvasive Electrocardiol. 2022 May;27(3):e12931. doi: 10.1111/anec.12931. Epub 2022 Feb 17. PMID: 35174568; PMCID: PMC9107092.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Yu, 2020
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to July 2019
A: Baldinelli, 2015 B: Barnwall, 2016 C: Cales, 2016 D: Elli, 2016 E: Gebhard, 2007 F: Lee, 2009 G: Yuan, 2017 H: Liu, 2015 I: Zheng, 2015
Study design: RCT
Setting and Country: Single center, China
Source of funding and conflicts of interest: This study was supported by a research grant from the Army Medical University. The authors declare no conflicts of interest. |
Inclusion criteria SR: RCTs that investigated the use of ECGs to localize the peripherally inserted central catheter tip position. Eligible studies compared patients in whom the ECG localization technique was used with subsequent chest X-ray to confirm the tip position. Studies were considered eligible for inclusion regardless of publication status, language or size.
Exclusion criteria SR: (a) were not RCTs, (b) did not compare ECG guidance technology and landmark positioning, (c) were in a language for which a translation to English was not available or (d) were unpublished studies with only the abstracts presented at national and international meetings.
9 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N (ECG/landmark) A: 42/48 B: 30/30 C: 102/85 D: 75/44 E: 147/143 F: 121/128 G: 499/504 H: 85/85 I: 513/515 |
Electrocardiogram (ECG) localization technique followed by chest X-ray
A: ECG B: ECG C: ECG D: ECG E: ECG F: ECG G: ECG H: ECG I: ECG |
Landmark-based insertion followed by chest X-ray
A: landmark B: landmark C: landmark D: landmark E: landmark F: landmark G: landmark H: landmark I: landmark |
End-point of follow-up: Not specified
For how many participants were no complete outcome data available? Not specified |
Correct placement RR [95% CI] of accurate placement A: 1.24 [1.03, 1.49] B: 1.74 [1.28, 2.38] C: 1.13 [0.84, 1.52] D: 1.26 [1.06, 1.51] E: 1.27 [1.15, 1.40] F: 1.00 [0.95, 1.05] G: 1.18 [1.06, 1.51] H: 1.13 [1.04, 1.23] I: 0.99 [0.97, 1.01]
Pooled effect (random effects model): 1.17 [1.04, 1.32] favoring ECG. Heterogeneity (I2): 94%
ECG N=1614 Landmark N=1580
Quality of life Not reported
Patient satisfaction Not reported
Complications (not specified in review) RR [95% CI] of complications A: 0.16 [0.01, 3.06] B: 0.04 [0.00, 0.60] C: 0.52 [0.29, 0.93] D: not reported E: 0.14 [0.06, 0.34] F: No events G: 0.48 [0.35, 0.65] H: 0.05 [0.00, 0.80] I: not reported
Pooled effect (random effects model): 0.28 [0.14, 0.55] favoring ECG. Heterogeneity (I2): 64%
ECG N=1026 Landmark N=1023
Catheter-related interventions Not reported
Costs Not reported
Resource availability Not reported
|
Risk of bias (high, some concerns or low): PEDro scale study quality (0-10) A: 8 B: 8 C: 7 D: 6 E: 7 F: 7 G: 8 H: 7 I: 6 The overall quality of all studies was fair to good, but the therapists and participants were not blinded in the design of all articles.
Author’s conclusions: The existing research shows that the application of atrial ECG in PICC tip positioning can improve the accuracy of catheter tip positioning, reduce the incidence of related complications and provide a scientific basis for further promotion of the atrial ECG positioning method. |
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size |
|
|
Gullo, 2021 |
Type of study: RCT
Setting and country: Single center, Switzerland
Funding and conflicts of interest: Funding not stated in publication. On clinicaltrials.gov Qanadli is stated as the study sponsor. S. D. Qanadli is a consultant for C.R. Bard, Inc. The remaining authors declare that they have no disclosures relevant to the subject matter of this article. |
Inclusion criteria: All consecutive patients who were more than 18 years old and had been referred to the radiology department for PICC insertion were considered for study enrollment
Exclusion criteria: Candidates were excluded if they weighed more than 150 kg (table load limit) or had cardiac arrhythmia affecting the P wave
N total at baseline: Intervention: 60 Control: 60
Important prognostic factors2: Age, mean ± SD: I: 59.8 ± 15.8 C: 60.6 ± 18.3
Sex: I: 51.7% M C: 37.9% M
BMI, mean ± SD: I: 26.0 ± 6.5 C: 25.4 ± 5.7
Left arm access I: 73.3% C: 63.8%
Basilic vein access I: 66.7% C: 81.0%
Groups were comparable at baseline |
Electromagnetic guidance combined with intracavitary ECG tracing (ECG-EM)
Combined ECG-EM guidance was performed using an ultrasound system (Site-Rite 8) with an integrated system for guidance and PICC tip confirmation (Sherlock-3CG Diamond-Tip Confirmation System, BD and Company). Inall patients, we used a 4-French single-lumen or 5-French dual-lumen catheter (PowerPICC2 Solo, C.R. Bard).
The Y-shaped magnetic sensor and external ECG electrodes were placed on the patient to ensure distinct P-wave presence. The procedure was similar to the FX-guided procedure except for PICC length estimation and navigation to CAJ. the PICC was cut, prepared so that the magnetic tip stylet inserted therein was close to its tip, and advanced into central circulation through a “peel-away” sheath using EM guidance of the integrated system, until reaching the superior vena cava (SVC). The stylet generates a field detected by the Y sensor so that the PICC can be followed in real time on a display. Finally, the ECG was used to drive the catheter into the target position— that is, until the intracavitary P wave increased and reached its maximum height in the absence of negative deflection. |
Fluoroscopic guidance (FX)
FX guidance was performed using a multipurpose x-ray system (Artis Zee, Siemens Healthcare). The FX-guided PICC placement procedure is based on the technique described by Glauser et al. At the end of the procedure, the final tip position was documented by immediate posteroanterior chest radiography, which was performed with the patient in a supine position during deep inspiration. |
Length of follow-up: End of the PICC placement procedure
Loss-to-follow-up: N/A
Incomplete outcome data: N/A |
Correct placement T1 corresponds to a final tip position of less than or equal to 1 cm from the CAJ and is defined as optimal placement; T2, more than 1 cm to less than or equal to 3 cm above or below the CAJ (suboptimal placement); and T3, more than 3 cm under the CAJ or not in the SVC (inadequate placement requiring repositioning). T3, inadequate placement requiring repositioning I: 13/60 (21.7%) C: 0/58 (0%)
T2, suboptimal positioning I: 21/60 (36.8%) C: 16/58 (28.1%)
T1, optimal positioning I: 23/60 (40.4%) C: 41/58 (71.9%)
Complications Not reported
Quality of life Not reported
Patient satisfaction Not reported
Catheter-related interventions Not reported
Costs Not reported
Resource availability Not reported |
Authors’ conclusions our results showed optimal tip position in 71.9% of FX-guided procedures versus 40.4% of ECG-EM–guided procedures. With our stringent criteria for classifying tip position, 22.8% of the ECG-EM–guided procedures needed further correction, whereas 0% of the FX-guided procedures required reintervention in the FX group. Furthermore, all PICCs requiring additional actions were inserted from the left side. Thus, ECG-EM guidance could not replace FX guidance in unselected patients. However, ECG-EM guidance could be considered as an acceptable technique to replace FX guidance among patients in whom the PICC is inserted from the right side. |
|
Mack, 2020 |
Type of study: RCT
Setting and country: Single center, Germany
Funding and conflicts of interest: The study was funded with an educational grant from C. R. Bard GmbH, Karlsruhe, Germany (later joined Becton, Dickinson and Company, Franklin Lakes, NJ, USA). The company did neither have any influence on design and conduct of the study nor on collection and reporting of data. All authors declare that they have no conflict of interest with respect to this article. |
Inclusion criteria: Patients were eligible for inclusion if they were at least 18 years of age and had a medical indication for PICC insertion.
Exclusion criteria: Exclusion criteria were systemic infection, infection including puncture site, and known allergy to materials used. Additionally, cardiac arrhythmia including atrial fibrillation, severe tachycardia, or paced rhythm was exclusion criterion because it could interfere with interpretation of the P-wave morphology when using the TCS system.
N total at baseline: Intervention: 105 Control: 105
Important prognostic factors2: Age, mean ± SD: I: 60.6 ± 13.8 C: 64.1 ± 13.0
Sex: I: 67.6% M C: 60.0% M
BMI, mean ± SD: I: 26.0 ± 6.5 C: 25.4 ± 5.7
Groups were comparable at baseline. |
Magnetic Tracking and Electrocardiography-Guided Tip Confirmation System (at bedside)
Sherlock 3CG® TCS (including single-use PowerPICC SOLO catheter with Sherlock 3CG tip positioning system stylet, Becton, Dickinson and Company, Franklin Lakes, NJ, USA) was used for magnetic tracking of the PICC tip and real-time ECG confirmation of the tip position during insertion. |
Fluoroscopy (in the radiology department)
Length of the guidewire was measured to determine the required PICC length. Subsequently, an introducer sheath was inserted over the wire, the guidewire was removed, and the PICC catheter inserted through the introducer sheath and then advanced under fluoroscopic control to the predetermined length. The same PICC kit type in different sizes was used in all patients.
Finally, in both groups, the PICC was attached on the arm with a seamless stabilization device (StatLockTM, Bard Access Systems, Becton, Dickinson and Company, Franklin Lakes, NJ, USA). Placement of the catheter was confirmed by obtaining chest X-ray. |
Length of follow-up: 2 weeks
Loss-to-follow-up: Access not possible I: 3 C: 1
No 2-week clinical investigation: I: 3 C: 1
Incomplete outcome data: N/A |
Correct placement Correct PICC tip position was defined as within the mid to lower superior vena cava, at the level of the cavoatrial junction, or within the upper portion of the right atrium, corresponding to 1.5 vertebral body units (approximal 3 cm) from the tracheal carina on chest X-ray obtained immediately after insertion. I: 84/102 (82.4%) C: 103/104 (99.0%)
Complications Bleeding event (minor access site bleedings) I: 8/99 (8.1%) C: 13/103 (12.6%)
Pain (mild to moderate) I: 8/99 (8.1%) C: 12/103 (11.7%)
Allergic reaction (due to antimicrobial film dressing) I: 0/99 (0%) C: 3/103 (2.9%)
Local wound infection I: 2/99 (2.0%) C: 2/103 (1.9%)
Thrombosis I: 0/99 (0%) C: 0/103 (0%)
Nerve damage I: 0/99 (0%) C: 0/103 (0%)
Catheter malfunction I: 0/99 (0%) C: 0/103 (0%)
Quality of life Not reported
Patient satisfaction Not reported
Catheter-related interventions Not reported
Costs Not reported
Resource availability Not reported |
Authors’ conclusions TCS for PICC insertion was associated with less tip position accuracy than fluoroscopy. However, it was associated with reasonable success and a similar complication rate. For this reason, we conclude that TCS would be most useful in patients where fluoroscopy cannot be used, bedside placement is necessary, or resources are limited. |
|
Alexandrou, 2022
ACTRN 12620000919910 |
Type of study: RCT
Setting and country: Single center, tertiary referral hospital, Australia
Funding and conflicts of interest: Unrestricted investigator-initiated research grants form Cook Medical Australia, Flo Medical Australia and CR Bard. All funds were paid to Western Sydney University and not to individual researchers. The authors declared no conflict of interest. |
Inclusion criteria: Age at least 18 years; native P wave on 12 lead ECG, ability to provide written informed consent in English.
Exclusion criteria: Pacemaker dependency; <18 years old, no informed consent at time of catheter insertion.
N total at baseline: Intervention: 172 Control: 172
Important prognostic factors2: Age, median (IQR): I: 58 (49-68) C: 60 (51-69)
Sex: I: 56% M C: 60% M
BMI, median (IQR): I: 28 (24-34) C: 28 (24-34)
Catheter type CVC double lumen I: 0% C: 1%
CVC triple lumen I: 4% C: 3%
Dialysis catheter I: 5% C: 5%
PICC single lumen I: 59% C: 73%
PICC double lumen I: 32% C: 18%
Groups were comparable at baseline. |
Intracavitary electrocardiography guided CVAD placement with CXR confirmation
Portable, wireless IC-ECG navigation system (Nautilus Delta Tip Confirmation System – BARD access systems, Salt lake City, USA)
When maximum P-wave amplitude was achieved, the tip was considered in position. |
Landmark based CVAD placement with CXR confirmation.
In both groups, CXR was taken immediately after catheter insertion to compare tip position. |
Length of follow-up: Not specified
Loss-to-follow-up: None
Incomplete outcome data: None |
Catheters not requiring repositioning as interpreted on CXR: lower third of the SVC (within 3 cm above of tracheal carina), the CAJ (up to 3 cm below tracheal carina) or upper RA (3-5 cm below tracheal carina). I: 162/172 (94%) C: 131/172 (76%)
Complications CLABSI per 1000 catheter days I: 0/172 (0%) C: 1/172 (0.2%)
Catheter removal for suspected infection I: 7/172 (4.1%) C: 3/172 (1.7%)
Catheter removal for symptomatic thrombosis I: 2/172 (1.2%) C: 1/172 (0.6%)
Catheter removal for dislodgement I: 13/12 (7.6%) C: 5/172 (2.9%)
Quality of life Not reported
Patient satisfaction Not reported
Catheter-related interventions Not reported
Costs Total, in Australian dollars I: 36,546 C: 47,206
Average per patient I: 212 C: 265
Resource availability Not reported |
Authors’ conclusions Intracavitary ECG is more accurate and efficient than traditional placement of CVADs and can be used across diverse patient cohorts requiring a wide range of devices. |
|
Jayaraman, 2019 |
Type of study: RCT
Setting and country: Single center, India
Funding and conflicts of interest: No financial support and sponsorship. There are no conflicts of interest. |
Inclusion criteria: patients aged between 18 to 65 years requiring central venous catheterization.
Exclusion criteria: Patients with atrial fibrillation. Multifocal ventricular premature complexes, left bundle branch block, patient with cardiac pacemaker and altered coagulation profile.
N total at baseline: Intervention: 60 Control: 60
Important prognostic factors2: Age, mean ± SD: ECG: 40.8±16.22 Landmark: 39.23±14.69 Formula: 44.9±17.2
Sex (male/female): ECG: 43/17 Landmark: 48/12 Formula: 41/19
BMI: ECG: 25.39±4.56 Landmark: 25.18±3.99 Formula: 25.88±3.75
Groups were comparable at baseline. |
Intra-atrial Electrocardiography (ECG) guided technique: the catheter was slowly advanced until the RA‑ECG indicated a CVC position in the SVC/RA junction (peaked, tall P‑wave) or in the RA (biphasic P‑wave).[7] Thereafter, the CVC was withdrawn at 0.5 cm intervals until the P‑wave returned to a normal configuration. At that point, the CVC was secured at the skin with suture and dressed with a transparent dressing and the depth of insertion noted. If an intra atrial ECG could not be obtained, the CVC was fixed to a depth of 15 cms. |
Landmark technique the vertical distance between the right clavicular notch and the carina was measured on the routine preprocedure CXR, using an internal measuring tool available on the hospital’s picture archiving communication system. The vertical distance between the insertion point of the puncture needle and the right clavicular notch was measured using a sterile disposable ruler. The final depth of CVC insertion was determined by adding the two measurements.
Peres’ formula method: In the Formula group, heights of all the patients were measured prior to the procedure and the catheter was inserted and final insertion depth was kept as per the Peres’ formula of “height (in cm)/10”. |
Length of follow-up: Catheter placement procedure
Loss-to-follow-up: None
Incomplete outcome data: None |
Proper positioning CVC tip was properly positioned within 1 cm above and below the carina ECG: 58/60 (96.7%) Landmark: 56/60 (93.3%) Formula: 35/60 (58.3%)
Complications Not reported
Quality of life Not reported
Patient satisfaction Not reported
Catheter-related interventions Not reported
Costs Total, in Australian dollars Not reported
Resource availability Not reported |
Authors’ conclusions We conclude that both landmark guidance and ECG guidance are comparable with regard to accurate central venous catheter tip positioning when CVCs are placed through right internal jugular vein whereas formula based technique is least accurate and results in overinsertion of CVCs. |
|
Yin, 2019 Yin, 2020
ChiCTR 1900022763 |
Type of study: RCT
Setting and country: Multicenter, China
Funding and conflicts of interest: This work was supported by the Innovation and Achievement Transformation Fund of Shandong Province (No. 2013ZHZX2A0401). Hai-Jun Zhang holds intellectual property rights on the technology licensed to Branded Tech Inc., who manufactured the PICCs described in the paper. Zhang guarantees the impartiality during implementation. Other authors have no conflict of interest. |
Inclusion criteria: (a) clinical indication to PICC insertion, (b) age between 18 and 80 years, and (c) normal P-wave appearance on the surface ECG recordings.
Exclusion criteria: pregnancy, previous history of central line insertion, cardiovascular conditions such as valve heart disease, atrial fibrillation, supraventricular tachycardia, pulmonary heart disease, pacemaker implantation, and history of cardiac surgery, which may affect P-waves.
N total at baseline: Intervention: 1500 Control: 750
Important prognostic factors2: Age, mean ± SD: I: 55.1 ± 10.9 C: 58.1 ± 10.5
Sex: I: 57.9% F C: 57.2%
Puncture site Upper left arm I: 47.5% C: 44.8%
Upper right arm I: 39.4% C: 41.3% Basilic vein: I: 87.8% C: 86.1%
Groups were comparable at baseline. |
Intracavitary electrocardiogram (IC-ECG) guidance
Tip-conductive PICC was advanced gently until 5 cm was remaining, after which IC-ECG was performed according to the standard technique. As the catheter was slowly advanced into the SVC, the P-wave gradually increased, reaching a maximal peak at the CAJ. As the catheter entered the RA, a diphasic P-wave appeared and the catheter was retracted slowly to return to the position of maximal peak P-wave, with no negative components. |
Traditional anatomical landmarks method was used to estimate the catheter length. |
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: 6 patients (0.4%) with no P-wave changes were excluded
Control: 0
Incomplete outcome data: None |
Unsatisfactory location by X-ray The position of the tip close to the CAJ (approximately 3 cm below the tracheal carina) was considered optimal I: 11/1500 (0.7%) C: 99/750 (13.2%)
Complications At 1 week Exit site infection I: 3/750 (0.2%) C: 4/1494 (0.5%) RR 2.68 (0.60–11.99)
Phlebitis I: 0% C: 0%
DVT I: 0% C: 0%
Catheter malposition I: 2 (0.1%) C: 1 (0.1%) RR 1.00 (0.09–11.05)
At 6 months Exit site infection I: 40 (2.7%) C: 30 (4.0%) RR 1.52 (0.94–2.46)
Phlebitis I: 16 (1.1%) C: 10 (1.3%) RR 1.25 (0.57–2.78)
DVT I: 18 (1.2%) C: 11 (1.5%) RR 1.23 (0.58–2.61)
Catheter malposition I: 15 (1.0%) C: 12 (1.6%) RR 1.61 (0.75–3.46)
Catheter breakage I: 3 (0.2%) C: 2 (0.3%)
Extravasation I: 36 (2.4%) C: 22 (2.9%)
Total complications I: 96/1494 (6.4%) C: 71/750 (9.5%)
Quality of life Not reported
Patient satisfaction Not reported
Catheter-related interventions Not reported
Costs Total, in Australian dollars Not reported
Resource availability Not reported |
Authors’ conclusions our study demonstrated that the intra-procedural tip location by IC-ECG is safer and more accurate than the traditional method of verifying tip location only post-procedurally, by chest X-ray. It can achieve a rapid and accurate tip location during PICC placement, reduce the need of reposition, the whole time of procedure and X-ray exposures, especially decrease the PICC-related complications. |
|
Glauser, 2016 |
Type of study: RCT
Setting and country: Single center, Switzerland
Funding and conflicts of interest: The scientific guarantor of this publication is Salah Dine Qanadli. The authors of this manuscript declare relationships with the following companies: Salah Dine Qanadli was a consultant for C. R Bard Inc. during the last 3 years. The authors state that this work has not received any funding. No complex statistical methods were necessary for this paper. |
Inclusion criteria: all consecutive patients >18 years referred to the interventional radiology department for PICC insertion.
Exclusion criteria: Patients were excluded if they were unable or refused to consent to participate.
N total at baseline: Intervention: 90 Control: 90
Important prognostic factors: Age, mean ± SD: I: 61.8 ± 1.8 C: 60.7 ± 1.9
Sex: I: 51% M C: 49% M
Groups were comparable at baseline. |
Fluoroscopy guided insertion.
The final CTP was documented with an immediate chest fluoroscopy (posteroanterior projection) with the patient’s arm in adduction and the patient in deep inspiration.
All PICCs were done in the Interventional Radiology Unit using a low-dose X-ray system and US guidance with a 5 to 10-MHz linear-array transducer. All procedures were performed by an interventional radiology team experienced in PICC placement (10 years’ experience, with >800 procedures per year). Operators (SB, FG) were instructed to use a standardized procedure. All operators received specific BST training prior to the study. The PowerPICC2® Solo (4-F single lumen or 5-F dual lumen) device was used for all participants. |
Bedside insertion with postprocedural X-ray.
Once the insertion site was identified, we estimated catheter length using two cutaneous anatomic landmarks: the right clavicular head and the third intercostal space. The distance was measured between planned insertion sites to the right clavicular head, then down to the third intercostal space, with the shoulder abducted to 90°, as previously described.
Once the insertion site was identified, we estimated catheter length using two cutaneous anatomic landmarks: the right clavicular head and the third intercostal space. The distance was measured between planned insertion sites to the right clavicular head, then down to the third intercostal space, with the shoulder abducted to 90°, as previously described. |
Length of follow-up: Insertion and following X-ray.
Loss-to-follow-up: none |
Reintervention - Type 1: optimal tip position located either more than or less than 1 cm from the CAJ – Type 2: suboptimal tip location not requiring repositioning, with tip located >1 cm under the CAJ or >1 cm above the CAJ but remaining in the SVC – Type 3: nonoptimal tip location requiring repositioning, with tip located >3 cm under the CAJ or not inside the SVC Type 3: I: 1/89 (1%) C: 27/90 (30%)
Complications I: 8/89 (9%) C: 6/90 (6.7%)
Cost-effectiveness Not reported |
Authors’ conclusions: This study clearly demonstrates that techniques used for placement are not equal for attaining optimal CTP. Considering the importance of the CTP, the FGT should be considered at least for patients at high risk of complications. Further evaluations are needed to better select patients for the optimal placement technique, and technologica advances will aid in greater CTP accuracy when using the the BST. |
Risk of bias table
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH |
|
Gullo, 2021 |
Probably yes;
Reason: Randomization was performed with 1:1 allocation using sequentially numbered opaque sealed envelopes |
Definitely yes;
Reason: opaque sealed envelopes |
Definitely yes;
Reason: final chest radiographs were anonymized, and tip positions were assessed in terms of navigation and localization success independently by radiologists and radiologic technicians, all of whom are members of the PICC team and were blinded to guiding technique. Blinding of patients was not reported. |
Probably yes;
Reason: Loss to follow-up was infrequent in intervention and control group. Adequate imputation methods (multiple imputation) were used. |
Definitely yes;
Reason: All relevant outcomes were reported |
Probably yes;
Reason: Some concerns about the role of the study sponsor. However, the results do not seem to be in favor of the sponsor. |
LOW |
|
Mack, 2020 |
Definitely yes;
Reason: Eligible patients were allocated 1:1 to either TCS or fluoroscopy by means of computer-generated randomization. |
No information |
Definitely no
Reason: Open-label trial |
Definitely yes
Reason: Loss to follow-up was infrequent in intervention and control group. |
Probably yes
Reason: All relevant outcomes were reported. |
Probably yes;
Reason: No other problems noted. |
LOW The reported outcomes are likely not affected by lack of blinding |
|
Alexandrou, 2022 |
Definitely yes;
Reason: random allocations were computer generated in a 1:1 ratio using R |
Definitely yes;
Reason: random allocations were concealed to investigators and patients until enrolment. |
Definitely no
Reason: Pragmatic, open-label trial |
Definitely yes;
Reason: there was no loss to follow up. |
Probably yes
Reason: All relevant outcomes were reported. |
Probably yes;
Reason: No other problems noted. |
LOW The reported outcomes are likely not affected by lack of blinding |
|
Jayaraman, 2019 |
No information |
No information |
Definitely yes;
Reason: CXRs were read by one attending radiologist, who was aware of the study protocol but blinded to the group assignment. |
Definitely yes;
Reason: there was no loss to follow up. |
Probably yes
Reason: All relevant outcomes were reported. |
Probably yes;
Reason: No other problems noted. |
SOME CONCERNS due to lack of information about randomization and allocation concealment |
|
Yin, 2019 Yin, 2020 |
Definitely yes;
Reason: Patients were randomly assigned to either the study group or to the control group in a 2:1 allocation. A site-stratified block randomization with randomly varying block sizes of 4 and 6 was performed. |
Definitely yes;
Reason: Random assignment was performed by a statistician from Fudan University, and random envelopes were assigned to each site. Sequences were concealed from patients and clinical staff until assignment. |
Definitely no;
Reason: Open label study. |
Definitely yes;
Reason: there was no loss to follow up. |
Probably yes
Reason: All relevant outcomes were reported. |
Probably yes;
Reason: No other problems noted. |
LOW The reported outcomes are likely not affected by lack of blinding |
|
Glauser, 2016 |
Definitely yes;
Patients were randomly assigned in a 1:1 manner to the BST or the FGT using sequentially numbered, opaque, sealed envelopes. |
Definitely yes;
Patients were randomly assigned in a 1:1 manner to the BST or the FGT using sequentially numbered, opaque, sealed envelopes. |
Definitely yes;
Chest X-rays were interpreted by senior interventional radiologists (SC, SDQ) blinded to the technique used for catheter insertion. |
Definitely yes;
Reason: there was no loss to follow up. |
Probably yes;
Reason: All relevant outcomes were reported. |
Probably no;
Reason: The criteria for repositioning used in the study did not exactly match the criteria as proposed by the guideline development group. |
SOME CONCERNS for the outcome repositioning |
Exclusie tabel
|
Reference |
Reason for exclusion |
|
Ling G, Zhiwen W, Guorong W, Shaomei S, Xue W. Guide wire electrode versus liquid electrode for intravascular electrocardiography-guided central venous catheterization in adults: A systematic review and meta-analysis. J Vasc Access. 2020 Sep;21(5):564-572. doi: 10.1177/1129729819868044. Epub 2019 Aug 17. PMID: 31422729. |
wrong comparison |
|
Liu G, Hou W, Zhou C, Yin Y, Lu S, Duan C, Li M, Toft ES, Zhang H. Meta-analysis of intracavitary electrocardiogram guidance for peripherally inserted central catheter placement. J Vasc Access. 2019 Nov;20(6):577-582. doi: 10.1177/1129729819826028. Epub 2019 Mar 6. PMID: 30838913. |
more recent meta-analysis used |
|
Practice Guidelines for Central Venous Access 2020: An Updated Report by the American Society of Anesthesiologists Task Force on Central Venous Access. Anesthesiology. 2020 Jan;132(1):8-43. doi: 10.1097/ALN.0000000000002864. PMID: 31821240. |
wrong study design |
|
Chu KS, Hsu JH, Wang SS, Tang CS, Cheng KI, Wang CK, Wu JR. Accurate central venous port-A catheter placement: intravenous electrocardiography and surface landmark techniques compared by using transesophageal echocardiography. Anesth Analg. 2004 Apr;98(4):910-914. doi: 10.1213/01.ANE.0000105865.94157.4C. PMID: 15041571. |
wrong comparison |
|
Dong H, Zhu Y, Zhang X, Yin X, Liu F. Chest CT tomography vs. intracavitary electrocardiogram guidance in predicting the length of PICC placement. BMC Surg. 2022 May 19;22(1):197. doi: 10.1186/s12893-022-01604-0. PMID: 35590297; PMCID: PMC9118803. |
wrong comparison |
|
Xu YF, Xu XF, Song K, Qiu C, Zhang XL, Mam DL, Huang S. Study on the Safety and Accuracy of Intracavitary Electrocardiography and Ultrasound in the Peripherally Inserted Central Venous Catheter tip positioning of Breast Cancer Patients. INDIAN JOURNAL OF PHARMACEUTICAL SCIENCES. 2021 Jan 1;83:6-11. |
wrong comparison |
|
Li A, Jiao J, Zhang Y, Tian L, Miao J, Hao X, Sun Z, Sun Q. A randomized controlled study of bedside electrocardiograph-guided tip location technique & the traditional chest radiography tip location technique for peripherally inserted central venous catheter in cancer patients. Indian J Med Res. 2018 May;147(5):477-483. doi: 10.4103/ijmr.IJMR_1120_16. PMID: 30082572; PMCID: PMC6094514. |
Control group not sufficiently defined |
|
Yuan L, Li R, Meng A, Feng Y, Wu X, Yang Y, Chen P, Qiu Z, Qi J, Chen C, Wei J, Qin M, Kong W, Chen X, Xu W. Superior success rate of intracavitary electrocardiogram guidance for peripherally inserted central catheter placement in patients with cancer: A randomized open-label controlled multicenter study. PLoS One. 2017 Mar 9;12(3):e0171630. doi: 10.1371/journal.pone.0171630. PMID: 28278167; PMCID: PMC5344315. |
Data extracted from meta-analysis |
|
Cales YK, Rheingans J, Steves J, Moretti M, PICC Team. Electrocardiogram-guided peripherally inserted central catheter tip confirmation using a standard electrocardiogram machine and a wide-mouth electrocardiogram clip compared with traditional chest radiograph. Journal of the Association for Vascular Access. 2016 Mar 1;21(1):44-54. |
Data extracted from meta-analysis |
|
Sharma D, Singh VP, Malhotra MK, Gupta K. Optimum depth of central venous catheter - Comparision by pere's, landmark and endocavitory (atrial) ECG technique: A prospective study. Anesth Essays Res. 2013 May-Aug;7(2):216-20. doi: 10.4103/0259-1162.118966. PMID: 25885836; PMCID: PMC4173511. |
wrong study design |
|
Lee JH, Bahk JH, Ryu HG, Jung CW, Jeon Y. Comparison of the bedside central venous catheter placement techniques: landmark vs electrocardiogram guidance. Br J Anaesth. 2009 May;102(5):662-6. doi: 10.1093/bja/aep046. Epub 2009 Mar 26. PMID: 19329467. |
Data extracted from meta-analysis |
|
Gebhard RE, Szmuk P, Pivalizza EG, Melnikov V, Vogt C, Warters RD. The accuracy of electrocardiogram-controlled central line placement. Anesth Analg. 2007 Jan;104(1):65-70. doi: 10.1213/01.ane.0000250224.02440.fe. PMID: 17179244. |
Data extracted from meta-analysis |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 25-06-2025
Beoordeeld op geldigheid : 25-06-2025
Nog in afwachting autorisatie van de volgende partijen:
- Vereniging voor Hygiëne en Infectiepreventie in de Gezondheidszorg
- Patiëntenfederatie Nederland
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg rondom vaattoegangswegchirurgie.
Werkgroep
- dr. C.G. (Niels) Vos (voorzitter), Nederlandse Vereniging voor Heelkunde
- dr. M.E. (Marianne) Sitsen (vice-voorzitter), Nederlandse Vereniging voor Anesthesiologie
- dr. M.J. (Marijke) Molegraaf, Nederlandse Vereniging voor Heelkunde
- dr. M.G.J. (Maarten) Snoeijs, Nederlandse Vereniging voor Heelkunde
- dr. M. (Mahir) Uslu, Nederlandse Vereniging voor Anesthesiologie
- dr. M. (Michelle) Gompelman, Nederlandse Internisten Vereniging
- dr. E.R. (Eric) van der Vorm, Nederlandse Vereniging voor Medische Microbiologie / Samenwerkingsverband Richtlijnen Infectiepreventie
- drs. Ir. P.A.A. (Pum) Le Haen, Nederlandse Vereniging voor Radiologie
Klankbordgroep
- dr. H. (Hanneke) Buter, Nederlandse Vereniging voor Intensive Care
- Werkgroep SRI-richtlijn Veneuze en arteriële katheters
Met ondersteuning van
- dr. M.S. (Matthijs) Ruiter, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Mitchel) Griekspoor, MSc, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Hoofdfunctie |
Project Tekstveld |
Nevenwerkzaamheden |
Persoonlijke Financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intell. Belangen en reputatie |
Overige belangen |
Ondernomen actie |
|
Niels Vos (vz.) |
Vaatchirurg |
Richtlijn Centraal Veneuze Toegang |
Voorzitter huidige richtlijncommissie. |
Geen. |
Geen. |
1. Studie naar functioneren van Artivion (Jotec) EVAR prothese. Gefinancierd door Artivion. Multicenter, ik ben lokale (martini ziekenhuis) hoofdonderzoeker. Het ziekenhuis krijgt een onkosten vergoeding van een paar 100 euro. Persoonlijk krijg ik er niets voor. Het is een reguliere verkrijgbare stent waar de leverancier wilde kijken hoe deze presteert (technisch/klinisch en QoL).
2.Door ZonMW gefinancierde multicenter trial naar antistolling na pta (CLEARPATH trial, RCT, clopidogrel / placebo vs clopidogrel / ascal na dotter). Hier is een onkostenvergoeding per patiënt voor die naar het ziekenhuis (wetenschappelijk instituut) gaat. Ik ben ook hier lokale hoofdonderzoeker.
|
Geen. |
Geen. |
Geen restricties. Extern gefinancierd onderzoek valt buiten bestek van de richtlijn. |
|
Eric van der Vorm |
Arts-microbioloog |
Richtlijn Centraal Veneuze Toegang |
Geen. |
Geen. |
Geen. |
Geen. |
Geen. |
Geen. |
Geen restricties. |
|
Maarten Snoeijs |
Vaatchirurg |
Centraal Veneuze Toegang & Cluster expertisegroep Arteriële en Veneuze Pathologie. |
Geen. |
Geen. |
Geen. |
1. OASIS Zorgevaluatie (Zorgevaluatie Nederland) 2. FLOW Zorgevaluatie (ZonMw) 3. Personalised hemodynamic modeling of arteriovenous grafts for prediction of vascular access stenosis and thrombosis (Vascular Access Society research grant) 4. ShuntSimulationStudy (Nierstichting).
|
Leider expertisecentrum met topreferente zorgfunctie voor vaattoegangchirurgie in MUMC+ |
Geen. |
Geen restricties. Extern gefinancierd onderzoek valt buiten bestek van de richtlijn. |
|
Mahir Uslu |
Anesthesioloog |
Richtlijn Centraal Veneuze Toegang
|
Geen. |
Geen. |
Geen. |
Geen. |
Geen. |
Geen. |
Geen restricties. |
|
Marianne Elisabeth Sitsen |
Anesthesioloog en medisch manager OK centrum |
Richtlijn Centraal Veneuze Toegang |
Geen. |
Geen. |
Geen. |
Geen. |
Geen. |
Geen. |
Geen restricties. |
|
Marijke Molegraaf |
Vaatchirurg |
Richtlijn Centraal Veneuze Toegang
|
Geen. |
Geen. |
Geen. |
Geen. |
Geen. |
Geen. |
Geen restricties. |
|
Michelle Gompelman |
Internist-infectioloog, Arts-onderzoeker |
Richtlijn Centraal Veneuze Toegang |
Hoofdredactieraad lid Tijdschrift voor Infectieziekten – onbetaald. |
Geen. |
Geen. |
CARRIER-trial (ZonMW), Staphylococcus aureus decolonization in patients on home parenteral nutrition, geen PI. |
Geen. |
Geen. |
Geen restricties. Extern gefinancierd onderzoek valt buiten bestek van de richtlijn.
|
|
Pum le Haen |
Interventieradioloog |
Richtlijn Centraal Veneuze Toegang |
Geen. |
Geen. |
Geen. |
Lokale P.I. voor onderzoek naar de verbeterde/snellere toegang tot de AFS bij antegrade punctie van de AFC met de Speedwire. Multi center internationale studie onder P.I-schap van D. van den Heuvel, interventieradioloog St Antonius Ziekenhuis in Nieuwegein. Voor de inclusie van een patiënt in het bovengenoemde onderzoek wordt een onkostenvergoeding van 100 euro betaald. Deze vergoeding loopt via het ziekenhuis en de specialisten coöperatie en wordt betaald door Speedwire. Gaat om in totaal 20-25 patiënten in de looptijd van het onderzoek. |
Geen. |
Geen. |
Geen restricties. Extern gefinancierd onderzoek valt buiten bestek van de richtlijn. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van de Patiëntenfederatie Nederland voor de invitational conference. Het verslag hiervan is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de deelnemers van de invitational conference en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz (Volgt na de commentaarfase)
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Controle van de tiplocatie |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn, betreft het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met die een centraal veneuze lijn krijgen. Tevens zijn er knelpunten aangedragen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. [Review Manager 5.4] werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: NVvH Centraal veneuze toegang |
|
|
Uitgangsvraag: Wat zijn de (on)gunstige effecten van het controleren/bevestigen van de tip door middel van een elektrocardiogram (ECG) in vergelijking met doorlichting/een fluoroscopie bij patiënten die een centraal veneuze lijn krijgen? |
|
|
Database(s): Ovid/Medline, Embase |
Datum:25-7-2023 |
|
Periode: nvt |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht met de volgende concepten: veneuze toegang EN electrocardiografie Omdat doorlichting/fluoroscopie de standaard is, wordt in overleg met de adviseur de PICO aangepast en wordt gezocht naar electrocardiografie als interventie. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
67 |
10 |
66 |
|
RCTs |
164 |
68 |
194 |
|
Observationele studies |
76 |
72 |
91 |
|
Overig |
|
|
|
|
Totaal |
|
|
351 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#21 |
#12 AND #20 3e sleutelartikel gevonden |
1 |
|
#20 |
#17 AND #18 NOT #7 NOT #8 Diagnostische accuratess |
76 |
|
#19 |
#17 AND #18 |
106 |
|
#18 |
tip*:ti,ab,kw OR 'accurate placement':ti,ab,kw |
164023 |
|
#17 |
#4 AND #16 |
1579 |
|
#16 |
'sensitivity and specificity'/de OR sensitivity:ab,ti OR specificity:ab,ti OR predict*:ab,ti OR 'roc curve':ab,ti OR 'receiver operator':ab,ti OR 'receiver operators':ab,ti OR likelihood:ab,ti OR 'diagnostic error'/exp OR 'diagnostic accuracy'/exp OR 'diagnostic test accuracy study'/exp OR 'inter observer':ab,ti OR 'intra observer':ab,ti OR interobserver:ab,ti OR intraobserver:ab,ti OR validity:ab,ti OR kappa:ab,ti OR reliability:ab,ti OR reproducibility:ab,ti OR ((test NEAR/2 're-test'):ab,ti) OR ((test NEAR/2 'retest'):ab,ti) OR 'reproducibility'/exp OR accuracy:ab,ti OR 'differential diagnosis'/exp OR 'validation study'/de OR 'measurement precision'/exp OR 'diagnostic value'/exp OR 'reliability'/exp OR 'predictive value'/exp OR ppv:ti,ab,kw OR npv:ti,ab,kw OR (((false OR true) NEAR/3 (negative OR positive)):ti,ab) |
6105405 |
|
#15 |
#12 NOT #14 |
1 |
|
#14 |
#12 AND #13 1 sleutelartikel gemist |
2 |
|
#13 |
#7 OR #8 |
231 |
|
#12 |
#9 OR #10 OR #11 sleutelartikelen |
3 |
|
#11 |
'magnetic tracking and electrocardiography-guided tip confirmation system versus fluoroscopy for placement of peripherally inserted central catheters: a randomized, noninferiority comparison' AND mack |
1 |
|
#10 |
'appropriateness of replacing fluoroscopic guidance with ecg-electromagnetic guidance for picc insertion: a randomized controlled trial' |
1 |
|
#9 |
'ecg-based techniques to optimize peripherally inserted central catheters: rationale for tip positioning and practical use' |
1 |
|
#8 |
#4 AND #6 NOT #7 RCT |
164 |
|
#7 |
#4 AND #5 SR |
67 |
|
#6 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
2079411 |
|
#5 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#4 |
#3 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
6457 |
|
#3 |
#1 AND #2 |
10251 |
|
#2 |
'electrocardiography'/exp OR 'electro cardiograph*':ti,ab,kw OR 'electrocardiograph*':ti,ab,kw OR 'electromyocardiograph*':ti,ab,kw OR 'polycardiograph*':ti,ab,kw OR 'electrocardiogram'/exp OR 'ecg':ti,ab,kw OR 'cardiogram':ti,ab,kw OR 'ekg':ti,ab,kw OR 'electrocardiogram':ti,ab,kw |
469426 |
|
#1 |
'central venous catheter'/exp OR 'central venous catheterization'/exp OR ((central* NEAR/3 (venous OR vein OR intravenous) NEAR/3 (catheter* OR 'access' OR line* OR device*)):ti,ab,kw) OR 'vascular access'/exp OR 'vascular access device'/exp OR cvc:ti,ab,kw OR ((central NEAR/3 line*):ti,ab,kw) OR 'vascular access':ti,ab,kw OR ((peripheral* NEAR/3 (insert* OR catheter*)):ti,ab,kw) OR picc*:ti,ab,kw OR 'implantable port system'/exp OR 'port a cath':ti,ab,kw OR 'implant* port*':ti,ab,kw OR 'tunneled central venous catheter'/exp OR 'hickman catheter'/exp OR 'tunnel* central':ti,ab,kw OR 'nontunneled central venous catheter'/exp OR 'subclavian vein catheter'/exp/mj OR (((intravascular OR intravenous OR venous OR vascular OR cardiovascular) NEAR/3 catheter*):ti,ab,kw) OR ((central NEAR/3 cath*):ti,ab,kw) OR vascath:ti,ab,kw OR 'peripherally-inserted central catheter*':ti,ab,kw OR ((tunnel* NEAR/3 central*):ti,ab,kw) OR hickman*:ti,ab,kw OR broviac:ti,ab,kw OR leonard:ti,ab,kw OR groshong:ti,ab,kw OR cook:ti,ab,kw OR permcath:ti,ab,kw OR tesio:ti,ab,kw OR tivad*:ti,ab,kw OR tivap*:ti,ab,kw |
125759 |
Ovid/Medline
|
# |
Searches |
Results |
|
18 |
17 not 13 |
3 |
|
17 |
13 or 16 Diagnostische accuratesse |
72 |
|
16 |
4 and 7 and 15 |
6 |
|
15 |
accurate place*.ti,ab,kf. |
1123 |
|
14 |
8 or 9 or 13 |
147 |
|
13 |
(4 and 12) not 8 not 9 |
69 |
|
12 |
10 and 11 |
92 |
|
11 |
tip*.ti,ab,kf. |
135731 |
|
10 |
4 and 7 |
173 |
|
9 |
(4 and 6) not 8 RCT |
68 |
|
8 |
4 and 5 SR |
10 |
|
7 |
exp "Sensitivity and Specificity"/ or (sensitivity or specificity).ti,ab. or (predict* or ROC-curve or receiver-operator*).ti,ab. or (likelihood or LR*).ti,ab. or exp Diagnostic Errors/ or (inter-observer or intra-observer or interobserver or intraobserver or validity or kappa or reliability).ti,ab. or reproducibility.ti,ab. or (test adj2 (re-test or retest)).ti,ab. or "Reproducibility of Results"/ or accuracy.ti,ab. or Diagnosis, Differential/ or Validation Study/ or ((false or true) adj3 (negative or positive)).ti,ab. |
4855739 |
|
6 |
exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf. |
1632460 |
|
5 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
683284 |
|
4 |
3 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
641 |
|
3 |
1 and 2 |
760 |
|
2 |
exp Electrocardiography/ or electro cardiograph*.ti,ab,kf. or electrocardiograph*.ti,ab,kf. or electromyocardiograph*.ti,ab,kf. or polycardiograph*.ti,ab,kf. or ecg.ti,ab,kf. or cardiogram.ti,ab,kf. or ekg.ti,ab,kf. or electrocardiogram.ti,ab,kf. |
275190 |
|
1 |
exp Catheterization, Central Venous/ or exp Central Venous Catheters/ or (central* adj3 (venous or vein or intravenous) adj3 (catheter* or 'access' or line* or device*)).ti,ab,kf. or exp Catheterization, Peripheral/ or (peripheral* adj3 (insert* or catheter*)).ti,ab,kf. or PICC*.ti,ab,kf. or 'port a cath'.ti,ab,kf. or (tivad* or tivap* or hickman* or (tunnel* adj 3 central)).ti,ab,kf. or exp Catheterization, Peripheral/ or picc*.ti,ab,kf. or vascath.ti,ab,kf. or 'Peripherally-Inserted Central Catheter*'.ti,ab,kf. |
42947 |