Kruis- en coallergieën
Uitgangsvraag
Welke middelen moeten tevens (naast koemelk) worden gemeden in verband met risico op een gelijksoortige allergische reactie of kruisallergie?
Aanbeveling
Raad de consumptie van geitenmelk en schapenmelk af bij kinderen met een IgE-gemedieerde koemelkallergie, in verband met het optreden van een mogelijke kruisallergie.
Sojaproducten hoeven niet te worden vermeden bij IgE-gemedieerde koemelkallergie. Er is geen reden om aan te nemen dat soja allergie vaker voorkomt bij kinderen met een IgE- gemedieerde koemelkallergie.
Raad de consumptie van buffelmelk en jerseymelk af – deze producten zijn (vormen van) koemelk.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
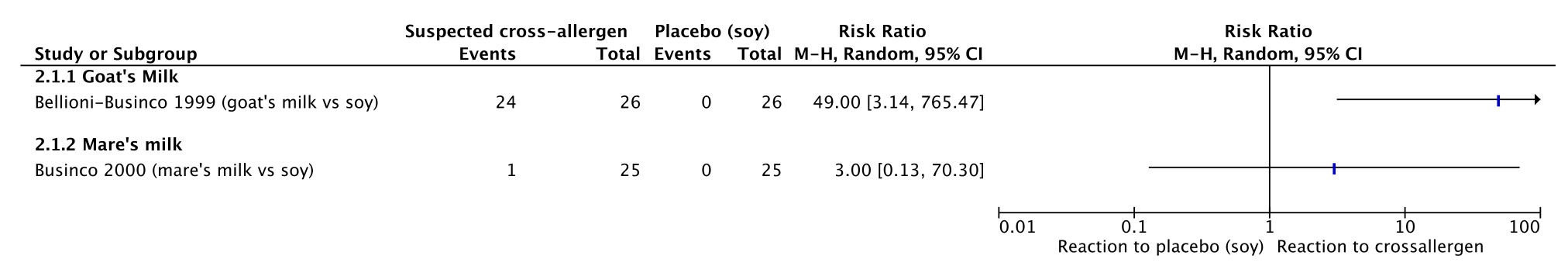
Het literatuuronderzoek naar kruis- en co-allergieën bij kinderen met IgE-gemedieerde koemelkallergie kan geen antwoord geven op de vraag welke eventuele andere allergenen moeten worden vermeden. Twee studies die verschillende allergenen hebben onderzocht waren geïncludeerd, waaruit bleek dat geitenmelk bij 92% van de kinderen zorgde voor een IgE-gemedieerde reactie, ten opzichte van 4% na consumptie van paardenmelk, en geen bij soja. Onderzoek naar sensibilisatie (huidpriktest) gaf vergelijkbare resultaten. De bewijskracht uit de literatuur is echter zeer laag door zeer kleine onderzochte studiepopulaties (hoge mate van imprecisie).
Sojadrink
In de studies beschreven in de literatuuranalyse, wordt soja als placebo gebruikt. Er worden geen reacties waargenomen. In een andere studie, die niet is meegenomen in de literatuuranalyse (Klemola, 2002), werd wel een klein percentage reacties beschreven. Echter, in deze studie was onduidelijkheid of het bij de geïncludeerde patiënten om IgE-gemedieerde koemelkallergie ging.
Sojadrink is het meest gebruikte alternatief voor koemelk in Nederland. In de kliniek worden weinig IgE-gemedieerde reacties met soja gezien.
Dierlijke producten
Naast geitenmelk en paardenmelk (beschreven in de literatuuranalyse) vallen ook andere dierlijke producten onder de mogelijke kruisallergenen:
- Rundvlees: In een review van Martelli (2002) wordt een prevalentie van rundvleesallergie beschreven van 13% tot 20% bij kinderen met koemelkallergie. Er wordt echter geen onderscheid gemaakt tussen patiënten met een IgE- of niet-IgE-gemedieerde allergie, en ook het type reactie op rundvlees wordt niet beschreven.
- Schapenmelk: Järvinen (2009) beschrijft dat schapenmelk en geitenmelk vergelijkbaar zijn: ze hebben beiden een even hoge overeenkomst in aminozuurvolgorde met moedermelk. Hoewel er geen studies zijn gevonden die IgE-gemedieerde reacties onderzoeken na schapenmelk, wordt om deze reden wel geadviseerd ook schapenmelk te mijden. Ook het onderzoek van Spuergin (1997) laat soortgelijke overeenkomsten in aminozuurvolgorde zien. Zij adviseren om geiten- en schapenmelk te mijden. In het onderzoek van Sancakli (2019) hadden zeven van de 10 kinderen (70%) met een positieve huidpriktest voor koemelk een kruisreactie tegen geiten- en schapenmelk
- Kamelenmelk: Over kamelenmelk zijn geen klinische studies beschikbaar, maar wel een aantal labstudies (Talarico, 2021; Monti, 2007; Ehlayel, 2011). Deze labstudies laten weinig kruisreacties zien.
- Ezelinnenmelk: In het onderzoek van Sarti (2019) reageerde maar één van de 70 kinderen met een IgE gemedieerde koemelkallergie op Ezelinnenmelk.
Buffelmelk en melk van Jerseykoeien worden niet aangemerkt als producten die een mogelijke kruisreactie kunnen veroorzaken, omdat beide (vormen van) koemelk zijn.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Vanzelfsprekend is het bij het adviseren van het dieet van belang om voorkeuren van patiënten en ouders mee te laten wegen in de besluitvorming. Het risico op allergische reacties op andere middelen dan koemelk moet daarbij ook onderwerp van gesprek zijn.
Kosten (middelenbeslag)
Bij patiënten met een IgE-gemedieerde koemelkallergie, die geen aanwijzingen hebben voor een soja-allergie in de anamnese, mag zonder aanvullende diagnostiek geadviseerd worden om sojadrink te gebruiken. Ook wordt bij deze patiënten geadviseerd om geiten- en schapenmelk te mijden, zonder aanvullend onderzoek. Aanvullend onderzoek (sensibilisatieonderzoek of provocatietest) zijn onnodig invasief en leiden tot onnodige kosten.
Het vermijden van geiten- en schapenmelk (naast koemelk) leidt ook niet tot extra kosten omdat er voldoende alternatieven zijn voor patiënten met een IgE-gemedieerde koemelkallergie. Sojadrink is goedkoper dan andere alternatieven.
Aanvaardbaarheid, haalbaarheid en implementatie
Het vermijden van specifieke producten en het verrichten van minder aanvullend onderzoek zijn aanvaardbaar en haalbaar. Er worden dan ook geen problemen verwacht bij de implementatie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
Uit de literatuur komt niet met hoge bewijskracht naar voren welke middelen een (IgE-gemedieerde) kruis- of co-reactie bij kinderen met een IgE-gemedieerde koemelkallergie kunnen veroorzaken. Geitenmelk, en door vergelijkbare aminozuurvolgorde ook schapenmelk, kan beter worden vermeden, terwijl over paardenmelk, kamelenmelk, rundvlees en varkensvlees geen uitspraken kunnen worden gedaan. Het lijkt niet nodig om soja-alternatieven te vermijden. De werkgroep doet hier geen uitspraak over goede vervangers voor koemelk (zie hiervoor de module Kunstvoeding zuigelingen of Blootstelling aan kleine hoeveelheden).
Onderbouwing
Achtergrond
In clinical practice, it is often unclear whether children with IgE-mediated cow's milk allergy can safely consume other animal products such as goat's milk, goat's cheese, camel's milk, sheep's milk, horse's milk, beef or pork. It creates uncertainty among health care providers and patients which can lead to unsafe advice or use. Of the plant-based beverages, soy is often considered a possible co-allergy. However, there are no clear guidelines on which products cause cross-allergies and co-allergies in IgE-mediated CMA. In practice, it remains unclear which products can be consumed, and which should be avoided by children with IgE-mediated CMA.
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of goat’s milk, mare’s milk, and soy on IgE-mediated symptoms when compared with placebo in patients with cow’s milk allergy.
Source: Bellioni-Businco, 1999; Businco, 2000 |
|
Very low GRADE |
The evidence is very uncertain about the effect of goat’s milk, mare’s milk, and soyon sensitization, measured by a positive skin prick test when compared with placebo in patients with cow’s milk allergy.
Source: Bellioni-Businco, 1999; Businco, 2000 |
Samenvatting literatuur
Description of studies
Bellioni-Businco (1999) investigated the allergenicity of goat’s milk in children with cow’s milk allergy (CMA) using a cross-wise inhibition design. The study included 26 children with proven IgE-mediated CMA, aged five months to seven years. Through a double-blind, placebo-controlled, food challenge (DBPCFC) children received cow’s milk, goat’s milk or placebo (soy formula) in increasing amounts, and allergic reactions were monitored. The children were observed for at least four hours after the last administration, and challenges were repeated one week later. Children also underwent skin prick tests (SPT), using isotonic saline as a negative control, histamine as a positive control, and fresh cow’s milk and goat’s milk. The wheal size was measured after twenty minutes.
Businco (2000) aimed to investigate the allergenicity of mare’s milk. 25 children (17 boys, 8 girls) aged 19 to 72 months with severe IgE-mediated CMA confirmed through SPT and DBPCFC, were included. Exclusion criteria were not explicitly mentioned. DBPCFC tests were performed in a day-hospital setting, with cow’s milk, mare’s milk or placebo (soy formula) administered in increasing amounts. The children were observed for at least four hours after the last administration. The challenges were repeated one week later. SPT was performed using the prick method on the forearm, and the wheal responses were measured after twenty minutes.
A summary of the characteristics of the included studies is shown in Table 2.
|
Study |
Design |
Population, n |
Inter-vention |
Control |
Follow-up |
Clinical tolerance |
Results SPT |
Results serum IgE |
|
Bellioni-Businco, 1999 |
Cohort study |
Children with positive DBPCFC for cow’s milk (n = 26) |
DBPCFC with fresh goat’s milk |
DBPCFC with placebo (soy formula) |
4 hours |
DBPCFC reaction to goat’s milk: 24/26 (92%) control (soy): 0/26 (0%) |
Reaction to goat’s milk: 26/26 (100%) Control: 0/26 (0%) |
All children had positive values of specific serum IgE to goat’s milk |
|
Businco, 2000 |
Cohort study |
Children with severe IgE-mediated CMA and positive DBPCFC for cow’s milk (n = 25) |
DBPCFC with fresh mare’s milk |
DBPCFC with placebo (soy formula) |
4 hours |
DBPFCOFC reaction to mare’s milk: 1/25 (4%) control (soy): 0/25 (0%) |
Reaction to mare’s milk: 2/25 (8%) control: 0/25 (0%) |
|
Table 2. Characteristics of included studies.
Results
The results per study are shown in Table 2.
1. IgE-mediated symptoms (measured or confirmed by double-blind placebo-controlled food challenge)
In observational studies, reaction to goat’s milk was 92% (24 out of 26 patients), whereas reaction to mare’s milk was 4% (1 out of 25); both in comparison to soy formula (no reactions) (Bellioni-Businco, 1999; Businco, 2000). These results are graphically depicted in Figure 1.
Figure 1. IgE-mediated symptoms in cross-allergens versus placebo.
2. Skin prick test
Wheal diameters were measured after skin prick tests (SPT) with the anticipated allergens. A positive SPT was defined as a wheal of more than 3 mm larger than that produced by the negative control. The results of the different allergens are shown in table 3.
|
Suspected allergen |
Studies, n |
Reaction SPT |
Relative effect (Relative Risk of reaction, RR) |
|
Goat’s milk |
Observational: 1 study, 26 patients |
26/26 (100%) |
Compared to soy: RR 53.0 (95% CI 3.4 to 826.2) |
|
Mare’s milk |
Observational: 1 study, 25 patients |
2/25 (8%) |
Compared to soy: RR 5.0 (95% CI 0.3 to 99.2) |
|
Soy formula (assessed as placebo) |
Observational: 2 studies, 51 patients |
0/51 (0%) |
Used as placebo |
Table 3. Wheal diameter reactions per suspected cross-allergen.
Level of evidence of the literature
The level of evidence regarding the outcome measures IgE-mediated symptoms and skin prick test started at low as these were based on observational studies, and were downgraded by one level because of a small number of included patients with large confidence intervals (imprecision, -1).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the effects on IgE-allergy symptoms of exposure to suspected cross-allergens (goat’s milk, camel’s milk, soy milk, beef, pork, mare’s milk, sheep’s milk, buffalo’s milk, deer milk) in children with an IgE-mediated cow’s milk allergy (CMA)?
| Patients: | Children with IgE-mediated cow’s milk allergy |
| Intervention: | Exposure to suspected cross-allergens: goat’s milk, camel’s milk, soy milk, beef, pork, mare’s milk, sheep’s milk, buffalo’s milk, deer milk |
| Comparison: | Diet without cow’s milk and potential cross allergens (see I) |
| Outcomes: | IgE-mediated cross-allergy/IgE symptoms (preferably using (double-blind) provocation test) |
Relevant outcome measures
The guideline development group considered IgE-mediated cross-allergy and/or IgE-mediated symptoms as a critical outcome measure for decision making.
Symptoms of IgE-mediated allergy are defined in the article of Sampson (2003), as specified in Table 1.
|
Grade |
Skin |
GI tract |
Respiratory Tract |
Cardiovascular |
Neurological |
|
1 |
Localized pruritus, flushing, urticaria, angioedema |
Oral pruritus, oral “tingling”, mild lip swelling |
|
|
|
|
2 |
Generalized pruritus, flushing, urticaria, angioedema |
Any of the above, nausea and/or emesis x’s 1 |
Nasal congestion and/or sneezing |
|
Change in activity level |
|
3 |
Any of the above |
Any of the above plus repetitive vomiting |
Rhinorrhea, marked congestion, sensation of throat pruritus or tightness |
Rachycardia (increase >15 beats/min) |
Change in activity level plus anxiety |
|
4 |
Any of the above |
Any of the above plus diarrhea |
Any of the above, hoarseness, “barky” cough, difficulty swallowing, dyspnea, wheezing, cyanosis |
Any of the above, dysrhythmia and/or mild hypotension |
“Light headedness”, feeling of “pending doom” |
|
5 |
Any of the above |
Any of the above, loss of bowel control |
Any of the above, respiratory arrest |
Severe bradycardia and/or hypotension or cardiac arrest |
Loss of conciousness |
|
All symptoms are not mandatory. The severity score should be based on the organ system most affected, e.g. if grade 3 respiratory symtpoms are present but only grade 1 GI symptoms, then the anaphylaxis severity score would be “grade 3”. Boldface symptoms are absolute indications for the use of epinephrine; use of epinephrine with other symptoms will depend on patient’s history. |
|||||
Table 1. Grading of Food-induced anaphylaxis according to severity of clinical symptoms
The working group defined a 10% difference in allergenicity between products (a Relative Risk – RR – of <0.91 or >1.10) as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until July 4th, 2023. The detailed search strategy is available upon request. The systematic literature search resulted in 475 hits. Studies were selected based on the following criteria:
- Randomized controlled trials, systematic review and/or meta-analysis, or observational cohort studies;
- Included children with IgE-mediated CMA;
- Described exposure to potential cross-allergens and compared to no exposure;
- Described IgE-mediated symptoms or IgE-mediated allergy as outcome.
A total of 29 studies was initially selected based on title and abstract screening. After reading the full text, 27 studies were excluded (see the table with reasons for exclusion under the heading Evidence Tables), and two studies were included.
Results
Two studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bellioni-Businco B, Paganelli R, Lucenti P, Giampietro PG, Perborn H, Businco L. Allergenicity of goat's milk in children with cow's milk allergy. J Allergy Clin Immunol. 1999 Jun;103(6):1191-4. doi: 10.1016/s0091-6749(99)70198-3. PMID: 10359905.
- Businco L, Giampietro PG, Lucenti P, Lucaroni F, Pini C, Di Felice G, Iacovacci P, Curadi C, Orlandi M. Allergenicity of mare's milk in children with cow's milk allergy. J Allergy Clin Immunol. 2000 May;105(5):1031-4. doi: 10.1067/mai.2000.106377. PMID: 10808187.
- Ehlayel M, Bener A, Abu Hazeima K, Al-Mesaifri F. Camel milk is a safer choice than goat milk for feeding children with cow milk allergy. ISRN Allergy. 2011 Jun 29;2011:391641. doi: 10.5402/2011/391641. PMID: 23724227; PMCID: PMC3658853.
- Järvinen KM, Chatchatee P. Mammalian milk allergy: clinical suspicion, cross-reactivities and diagnosis. Curr Opin Allergy Clin Immunol. 2009 Jun;9(3):251-8. doi: 10.1097/ACI.0b013e32832b3f33. PMID: 19412090.
- Martelli A, De Chiara A, Corvo M, Restani P, Fiocchi A. Beef allergy in children with cow's milk allergy; cow's milk allergy in children with beef allergy. Ann Allergy Asthma Immunol. 2002 Dec;89(6 Suppl 1):38-43. doi: 10.1016/s1081-1206(10)62121-7. PMID: 12487203.
- Monti G, Bertino E, Muratore MC, Coscia A, Cresi F, Silvestro L, Fabris C, Fortunato D, Giuffrida MG, Conti A. Efficacy of donkey's milk in treating highly problematic cow's milk allergic children: an in vivo and in vitro study. Pediatr Allergy Immunol. 2007 May;18(3):258-64. doi: 10.1111/j.1399-3038.2007.00521.x. PMID: 17433003.
- Sampson HA. Anaphylaxis and emergency treatment. Pediatrics. 2003 Jun;111(6 Pt 3):1601-8. PMID: 12777599.
- Sancakli Ö, Yenigün A, Tuncel T. Comparison of cross reactions between cow’s milk and other mammals’ milk using skin prick test and atopy patch test in children with atopic dermatitis and cow’s milk allergy. Asthma Allergy Immunology. 2019;17(2):97-102.
- Sarti L, Martini M, Brajon G, Barni S, Salari F, Altomonte I, Ragona G, Mori F, Pucci N, Muscas G, Belli F, Corrias F, Novembre E. Donkey's Milk in the Management of Children with Cow's Milk protein allergy: nutritional and hygienic aspects. Ital J Pediatr. 2019 Aug 17;45(1):102. doi: 10.1186/s13052-019-0700-4. PMID: 31420060; PMCID: PMC6698021.
- Spuergin P, Walter M, Schiltz E, Deichmann K, Forster J, Mueller H. Allergenicity of alpha-caseins from cow, sheep, and goat. Allergy. 1997 Mar;52(3):293-8. doi: 10.1111/j.1398-9995.1997.tb00993.x. PMID: 9140519.
- Talarico V, Mazza G, Rubino M, Monti G, Giancotti L, Bua A, Mohamed AM, Miniero R. Camel milk: a possible alternative for children with cow's milk allergy? Minerva Pediatr (Torino). 2021 Aug;73(4):289-293. doi: 10.23736/S2724-5276.19.05632-9. Epub 2019 Nov 5. PMID: 31692312.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Bellioni-Businco, 1999 |
Type of study: Cohort
Setting and country: Hospital, Italy
Funding and conflicts of interest: Not reported |
Inclusion criteria: Children with positive double-blind, placebo-controlled oral food challenge (DBPCFC); positive skin test responses; and positive RAST responses to cow milk
Exclusion criteria: Negative results on aforementioned challenges
N total at baseline: 26
Important prognostic factors: Median age: 2 years, 9 months
Sex: 17 boys (65%), 9 girls (35%)
Groups comparable at baseline? Yes |
double-blind, placebo-controlled, oral food challenges (DBPCFCs) with fresh Goat’s milk
|
DBPCFC with placebo (soy formula)
|
Length of follow-up: Four hours
Loss-to-follow-up: NA
Incomplete outcome data: NA
|
DBPCFC: 24 children reacted to goat’s milk 0 children reacted to soy
Skin prick: All children reacted to goat’s milk 0 children reacted to soy
|
These data strongly indicate that goat’s milk is not an appropriate cow’s milk substitute for children with IgE-mediated cow’s milk allergy. A warning on the lack of safety of goat’s milk for children with cow’s milk allergy should be on the label of goat’s milk formulas to prevent severe allergic reactions in babies with cow’s milk allergy. |
|
Businco, 2000 |
Type of study: Cohort
Setting and country: Hospital, Italy
Funding and conflicts of interest: Not reported |
Inclusion criteria: Children with IgE-mediated cow’s milk allergy as indicated by personal history and positive skin prick test and DBPCFC to cow’s milk
Exclusion criteria: Negative results on aforementioned challenges
N total at baseline: Intervention: 25 | Control: 25
Important prognostic factors2: Median age: 2 years, 10 months
Sex: 17 boys, 8 girls
Groups comparable at baseline? Yes |
Mare’s milk
|
Placebo (soy formula) |
Length of follow-up: Four hours
Loss-to-follow-up: NA
Incomplete outcome data: NA
|
DBPCFC: 1 child (4%) reacted to mare’s milk 0 children reacted to soy
Skin prick: 2 children (8%) reacted to mare’s milk 0 children reacted to soy
|
These data suggest that mare’s milk can be regarded as a good substitute of cow’s milk in most children with severe IgE-mediated cow’s milk allergy. It would be prudent, however, to confirm its tolerability by a supervised titrated oral challenge test. |
Risk of bias table cohort studies
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population?
|
Exposure
Can we be confident in the assessment of exposure? |
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study? |
Confounding-assessment
Can we be confident in the assessment of confounding factors? |
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables? |
Assessment of outcome
Can we be confident in the assessment of outcome? |
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
|
Co-interventions
Were co-interventions similar between groups?
|
Overall Risk of bias |
|
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Low, Some concerns, High |
|
|
Bellioni-Businco, 1999 |
Definitely yes
Reason: Same patient population
|
Definitely yes
Reason: Double-blind placebo-controlled intervention and skin prick test |
Definitely yes
Reason: No allergic reaction before exposure
|
Definitely yes
Reason: Allergic reaction or not
|
Definitely yes
Reason: only the intervention can explain the reaction
|
Definitely yes
Reason: allergic reaction or not
|
Definitely yes
Reason: No loss-to-follow-up
|
Definitely yes
Reason: Placebo-controlled and skin prick test
|
Low (DBPCOFC)
Low (Skin prick test) |
|
Businco, 2000 |
Definitely yes
Reason: Same patient population
|
Definitely yes
Reason: Double-blind placebo-controlled intervention and skin prick test |
Definitely yes
Reason: No allergic reaction before exposure
|
Definitely yes
Reason: Allergic reaction or not
|
Definitely yes
Reason: only the intervention can explain the reaction
|
Definitely yes
Reason: allergic reaction or not
|
Definitely yes
Reason: No loss-to-follow-up
|
Definitely yes
Reason: Placebo-controlled and skin prick test
|
Low (DBPCOFC)
Low (Skin prick test) |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Hill DJ, Murch SH, Rafferty K, Wallis P, Green CJ. The efficacy of amino acid-based formulas in relieving the symptoms of cow's milk allergy: a systematic review. Clin Exp Allergy. 2007 Jun;37(6):808-22. doi: 10.1111/j.1365-2222.2007.02724.x. PMID: 17517094. |
Wrong population (non-IgE-mediated) |
|
Wilken-Jensen K. Ernaering. Gedemaelk kan virke saerdeles gunstigt på komaelksallergi [Nutrition. Goat's milk can be extremely beneficial in cow's milk allergy]. Sygeplejersken. 1984 Dec 12;84(50):23-4. Danish. PMID: 6571074. |
Article in Danish |
|
Jelert H. Ernaering. Ved komaelksallergi er gedemaelk et dårligt valg og bør frarådes [Nutrition. With cow's milk allergy goat's milk is a poor alternative and ought to be discouraged]. Sygeplejersken. 1984 Dec 12;84(50):20-2, 24. Danish. PMID: 6571073. |
Article in Danish |
|
Fiocchi A, Dahda L, Dupont C, Campoy C, Fierro V, Nieto A. Cow's milk allergy: towards an update of DRACMA guidelines. World Allergy Organ J. 2016 Nov 15;9(1):35. doi: 10.1186/s40413-016-0125-0. PMID: 27895813; PMCID: PMC5109783. |
Wrong publication type (non-systematic literature review; no methods described) |
|
Gutiérrez-Castrellón P, Vázquez-Frías R, Jiménez-Gutiérrez C, González-Rodríguez RI, Quezada-Chalita CT, Greenawalt SR, et al. Recomendaciones sobre la utilización de las fórmulas infantiles con proteína aislada de soya en la alimentación del lactante. Documento de posición basado en la evidencia. Gac Med Mex. 2019;155(92) |
Full-text not available, wrong publication type (position paper) |
|
Muraro MA, Giampietro PG, Galli E. Soy formulas and nonbovine milk. Ann Allergy Asthma Immunol. 2002 Dec;89(6 Suppl 1):97-101. doi: 10.1016/s1081-1206(10)62132-1. PMID: 12487214. |
Wrong publication type (non-systematic literature review; no methods described) |
|
Garhwal R, Sangwan K, Mehra R, Kumar N, Bhardwaj A, Pal Y, Buttar HS, Kumar H. A Systematic Review of the Bioactive Components, Nutritional Qualities and Potential Therapeutic Applications of Donkey Milk. J Equine Vet Sci. 2022 Aug;115:104006. doi: 10.1016/j.jevs.2022.104006. Epub 2022 May 6. PMID: 35526725. |
Wrong publication type (non-systematic literature review; no methods described), about composition of donkey milk |
|
Tesse R, Paglialunga C, Braccio S, Armenio L. Adequacy and tolerance to ass's milk in an Italian cohort of children with cow's milk allergy. Ital J Pediatr. 2009 Jul 9;35:19. doi: 10.1186/1824-7288-35-19. PMID: 19589131; PMCID: PMC2717565. |
No control group |
|
Navarrete-Rodríguez EM, Ríos-Villalobos LA, Alcocer-Arreguín CR, Del-Rio-Navarro BE, Del Rio-Chivardi JM, Saucedo-Ramírez OJ, Sienra-Monge JJL, Frias RV. Cross-over clinical trial for evaluating the safety of camel's milk intake in patients who are allergic to cow's milk protein. Allergol Immunopathol (Madr). 2018 Mar-Apr;46(2):149-154. doi: 10.1016/j.aller.2017.06.005. Epub 2017 Dec 6. PMID: 29223706. |
Unclear population (how many children with IgE-mediated CMA) |
|
Sarti L, Martini M, Brajon G, Barni S, Salari F, Altomonte I, Ragona G, Mori F, Pucci N, Muscas G, Belli F, Corrias F, Novembre E. Donkey's Milk in the Management of Children with Cow's Milk protein allergy: nutritional and hygienic aspects. Ital J Pediatr. 2019 Aug 17;45(1):102. doi: 10.1186/s13052-019-0700-4. PMID: 31420060; PMCID: PMC6698021. |
No control group |
|
Ahn KM, Han YS, Nam SY, Park HY, Shin MY, Lee SI. Prevalence of soy protein hypersensitivity in cow's milk protein-sensitive children in Korea. J Korean Med Sci. 2003 Aug;18(4):473-7. doi: 10.3346/jkms.2003.18.4.473. PMID: 12923320; PMCID: PMC3055070. |
Gaat enkel om sensibilisatie (geen provocatie), geen vergelijkingsgroep |
|
Szaflarska-Szczepanik A, Gasiorowska J. Czestość wystepowania uczulenia na białka soi u dzieci z alergia na białka mleka krowiego [Prevalence of soya allergy in children with cow's milk allergy]. Med Wieku Rozwoj. 2003 Apr-Jun;7(2):241-8. Polish. PMID: 12878795. |
Article in Polish |
|
Iacono G, Carroccio A, Cavataio F, Montalto G, Soresi M, Balsamo V. Use of ass' milk in multiple food allergy. J Pediatr Gastroenterol Nutr. 1992 Feb;14(2):177-81. doi: 10.1097/00005176-199202000-00010. PMID: 1593372. |
Wrong publication type (case reports) |
|
Infante Pina D, Tormo Carnice R, Conde Zandueta M. Empleo de leche de cabra en pacientes con alergia a las proteínas de la leche de vaca [Use of goat's milk in patients with cow's milk allergy]. An Pediatr (Barc). 2003 Aug;59(2):138-42. Spanish. doi: 10.1016/s1695-4033(03)78737-2. PMID: 12882742. |
Article in Spanish |
|
Sancakli Ö, Yenigün A, Tuncel T. Comparison of cross reactions between cow’s milk and other mammals’ milk using skin prick test and atopy patch test in children with atopic dermatitis and cow’s milk allergy. Asthma Allergy Immunology. 2019;17(2):97-102. http://dx.doi.org/10.21911/aai.441 |
No control group |
|
Gunaydin NC, Severcan EU, Akarcan SE, Bal CM, Gulen F, Tanac R, Demir E. Effects of Cow's Milk Components, Goat's Milk and Sheep's Milk Sensitivities on Clinical Findings, and Tolerance Development in Cow's Milk Allergy. Sisli Etfal Hastan Tip Bul. 2021 Sep 24;55(3):391-397. doi: 10.14744/SEMB.2020.90688. PMID: 34712082; PMCID: PMC8526229. |
Wrong outcome (only sensibilization measurement) |
|
Cantani A, Ferrara M, Ragno V, Businco L. Efficacy and safety of a soy-protein-formula for feeding babies with atopic dermatitis and cow's milk hypersensitivity. Riv Eur Sci Med Farmacol. 1990 Dec;12(6):311-8. PMID: 2132284. |
Case series ("we have selected 21 infants") |
|
Vandenplas Y, De Greef E, Devreker T. Treatment of Cow's Milk Protein Allergy. Pediatr Gastroenterol Hepatol Nutr. 2014 Mar;17(1):1-5. doi: 10.5223/pghn.2014.17.1.1. Epub 2014 Mar 31. PMID: 24749081; PMCID: PMC3990777. |
Wrong study design (scoping review) |
|
Terracciano L, Isoardi P, Arrigoni S, Zoja A, Martelli A. Use of hydrolysates in the treatment of cow's milk allergy. Ann Allergy Asthma Immunol. 2002 Dec;89(6 Suppl 1):86-90. doi: 10.1016/s1081-1206(10)62130-8. PMID: 12487212. |
Wrong publication type (onvoldoende kwaliteit SR) |
|
Galli E, Chini L, Paone F, Moschese V, Knafelz D, Panel P, Emanuele E, Palermo D, Di Fazio A, Rossi P. Comparazione clinica di differenti formule di latte sostitutivo in bambini con allergia alle proteine del latte vaccino. Follow-up a 24 mesi [Clinical comparison of different replacement milk formulas in children with allergies to cow's milk proteins. 24-month follow-up study]. Minerva Pediatr. 1996 Mar;48(3):71-7. Italian. PMID: 8766671. |
Article in Italian |
|
Buts JP, Di Sano C, Hansdorffer S. Valutazione clinica della tolleranza di una formula speciale di latte a base di soia su bambini affetti da intolleranza/allergia alle proteine del latte vaccino (CMPI/CMPA) [Clinical evaluation of the tolerance for a soy-based special milk formula in children with cow's milk protein intolerance/allergy (CMPI/CMPA)]. Minerva Pediatr. 1993 May;45(5):209-13. Italian. PMID: 8366851. |
Article in Italian |
|
Cantani A. Nutrition of allergic babies and children. Eur Rev Med Pharmacol Sci. 1999 Sep-Oct;3(5):233-4. PMID: 11075624. |
Wrong publication type (comment) |
|
Fiocchi A, Travaini M, D'Auria E, Banderali G, Bernardo L, Riva E. Tolerance to a rice hydrolysate formula in children allergic to cow's milk and soy. Clin Exp Allergy. 2003 Nov;33(11):1576-80. doi: 10.1046/j.1365-2222.2003.01781.x. PMID: 14616871. |
Wrong intervention (hydrolyzed rice products) |
|
Reche M, Pascual C, Fiandor A, Polanco I, Rivero-Urgell M, Chifre R, Johnston S, Martín-Esteban M. The effect of a partially hydrolysed formula based on rice protein in the treatment of infants with cow's milk protein allergy. Pediatr Allergy Immunol. 2010 Jun;21(4 Pt 1):577-85. doi: 10.1111/j.1399-3038.2010.00991.x. Epub 2010 Mar 10. PMID: 20337976; PMCID: PMC2904490. |
Wrong intervention (hydrolyzed rice products) |
|
Klemola T, Vanto T, Juntunen-Backman K, Kalimo K, Korpela R, Varjonen E. Allergy to soy formula and to extensively hydrolyzed whey formula in infants with cow's milk allergy: a prospective, randomized study with a follow-up to the age of 2 years. J Pediatr. 2002 Feb;140(2):219-24. doi: 10.1067/mpd.2002.121935. PMID: 11865274. |
Wrong population (includeert ook niet-IgE-gemedieerde CMA patiënten) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 14-07-2025
Beoordeeld op geldigheid : 14-07-2025
Algemene gegevens
De herziening van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor kinderen met een IgE-gemedieerde koemelkallergie.
Werkgroep
- Mevr. dr. E.C. (Eva) Koffeman, kinderarts-allergoloog, namens de Nederlandse Vereniging voor Kindergeneeskunde (NVK) (voorzitter)
- Mevr. dr. L.J. (Lonneke) Landzaat, kinderarts-allergoloog, namens de NVK
- Mevr. dr. M.M.J. (Marjoke) Verweij, kinderarts, namens de NVK
- Mevr. drs. K. (Kelly) van de Vorst-van der Velde, kinderarts-allergoloog, namens de NVK
- Mevr. dr. L. (Lonneke) van Onzenoort-Bokken, kinderarts, namens de NVK
- Mevr. drs. M.F. (Maartje) van Velzen, kinderarts, namens de NVK
- Mevr. dr. B. (Berber) Vlieg-Boerstra, diëtist, namens de Nederlandse Vereniging van Diëtisten (NVD/DAVO)
- Mevr. O. (Olga) Benjamin-Aalst, diëtist, namens de NVD/DAVO
- Mevr. E. (Erna) Botjes, voedselallergie en niet-allergische voedselovergevoeligheid belangenbehartiger, namens Stichting Voedselallergie
- Mevr. C. (Chantal) Janssen, verpleegkundig specialist, namens het Netwerk van Allergie Professionals (NAPRO)
Klankbordgroep
- Mevr. drs. D.A. (Dana-Anne) de Gast-Bakker, kinderarts, namens de NVK
- Mevr. drs. E.A. (Ellen) Croonen, kinderlongarts, namens de NVK
- Mevr. drs. E. (Ester) Rijks, jeugdarts, namens AJN Jeugdartsen Nederland
- Mevr. D.G. (Daphne) Philips, verpleegkundig specialist, namens NAPRO
- Mevr. (M.) Mathilde Serné, lactatiekundige, namens de Nederlandse Vereniging van Lactatiekundigen (NVL)
- Mevr. M. (Maria) Oligschläger-Lindelauf, lactatiekundige, namens de NVL
Met ondersteuning van
- Mevr. dr. M.M.J. (Machteld) van Rooijen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Mevr. drs. L.C. (Laura) van Wijngaarden, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Koffeman (voorzitter) |
kinderarts-allergoloog, Rijnstate Arnhem |
Geen. |
Extern gefinancierd onderzoek: 1. Onderzoeksproject SinFoNIA: Specialist Infant Formulas in non-IgE mediated cow's milk allergy. In 2018 financiering toegezegd gekregen (Health Holland met behulp van Nutricia Research) maar geannuleerd door stopzetting project (maart 2020). Het project heeft niet geleid tot publicaties. 2. Lokale hoofdonderzoeker voor BAT koemelk bij koemelkallergie, gefinancierd met de beurs van ZonMW Veelbelovende Zorg.
Presentaties koemelkallergie, voedselallergie en FPIES (in brede zin: het gehele ziektebeeld in het kader van congres of nascholing) wanneer deze onderwijskundig belang dienen. - 2020 Mead Johnson, webinar voor kinderartsen en jeugdartsen - 2021 NVK congres (sessie gesponsord door Nestle) De eventuele honoraria die voortvloeien uit deze presentaties werden tot start van de richtlijn gestort aan het Vriendenfonds Rijnstate t.b.v. opleiding en onderzoek binnen de kinderallergologie. Gedurende voorzitterschap richtlijn is voor deze presentaties geen honorarium meer aangenomen. . |
Geen restricties |
|
Landzaat |
Kinderarts-allergoloog, Elisabeth-Tweesteden ziekenhuis Tilburg |
Geen. |
Geen. |
Geen restricties. |
|
Verweij |
Kinderarts, VieCurie Medisch centrum |
Geen. |
In het VieCurie wordt gewerkt aan uitbreiding van het kinderallergiecentrum. |
Geen restricties. |
|
Van der Vorst- van der Velde |
Kinderarts-allergoloog, Maasstad ziekenhuis Rotterdam |
Geen. |
Geen. |
Geen restricties. |
|
Onzenoort |
Kinderarts, Máxima Medisch centrum Eindhoven |
Financiële vergoeding voor deze werkzaamheden. |
Extern gefinancierd onderzoek: Lokale hoofdonderzoeker voor 3 projecten: 1. D-CAAP studie: onderzoek naar 0- toepassing corticosteroïden naast IVIG en acetylsalicylzuur (gefinancierd door UCL) 2. COPP studie: onderzoek naar covid infecties in kinderen (gefinancierd door LUMC/ ZonMW) 3. SVSpread: observationeel onderzoek naar RSV infecties (gefinancierd door UMCU/ ZonMW)
Presentaties koemelkeiwitallergie (gehele ziektebeeld en behandeling daarvan, geen invloed van sponsor op inhoud) in het kader van scholingen of congressen (Nutricia). |
Geen restricties. |
|
Van Velzen |
Kinderarts, Meander MC Amerstfoort |
Geen. |
Presentaties voedselallergie (gehele ziektebeeld en behandeling daarvan, geen invloed van sponsor op inhoud) in het kader van scholing, waarvoor honorarium beschikbaar werd gesteld. Bewuste samenwerking met alle spelers op de Nederlandse markt om binding met enkel bedrijf te voorkomen (o.a. Nutricia, Mead Johnson, Friso/Hero). |
Geen restricties. |
|
Vlieg-Boerstra |
Diëtist, Rijnstate Arnhem |
Lid Advisory board: Nestle, Nutricia, Vini Mini (producent pindapoeder), tot 1-1-2023: Marfo Food Groups (waarvoor vergoeding) |
Extern gefinancierd onderzoek: 1. Principal investigator van Groei studie: studie over de groei bij kinderen met allergie (sponsoring Nutricia) 2. Principal investigator van studie voeding bij borstvoeding, waarin voedingspatroon van moeder en HMO's in moedermelk worden onderzocht. Studie is volledig onafhankelijk opgezet en de resultaten worden niet beïnvloedt door de sponsor (Nutricia betaalt enkel de HMO bepalingen)
Expertise voedselprovocaties en dieetbehandeling van koemelkallergie via eigen praktijk (maatschap Vlieg Diëtisten)
Presentaties voedselallergie (inclusief koemelkallergie, en indicatie over typen voedingen in het algemeen; vrije invulling van inhoud) in het kader van scholing, waarvoor honorarium beschikbaar werd gesteld (Nestle, Nutricia). |
Geen restricties. Studies (externe onderzoeken) hebben geen invloed op de modules in de richtlijn, De studies gaan over de bestanddelen van moedermelk. |
|
Benjamin- van Aalst |
Diëtist-onderzoeker, OLVG Amsterdam Diëtist, Noordwest ziekenhuisgroep |
Lid dagelijks bestuur Netwerk Kinderdiëtisten. |
Presentaties voedselallergie (gehele ziektebeeld en behandeling daarvan) in het kader van scholing, waarvoor honorarium beschikbaar werd gesteld. Bewuste samenwerking met alle spelers op de Nederlandse markt om binding met enkel bedrijf te voorkomen (Nutricia, Reckitt, Abbott). |
Geen restricties. |
|
Janssen |
Verpleegkundig specialist kinderallergologie, Zuyderland Medisch centrum, Heerlen |
Geen. |
Geen. |
Geen restricties. |
|
Botjes |
Voedselallergie belangenbehartiger, Stichting Voedselallergie |
Geen. |
Geen. |
Geen restricties. |
Overkoepelend: Sommige Nederlandse ziekenhuizen (onder andere een aantal waarin de werkgroepleden werkzaam zijn) hebben een samenwerkingsovereenkomst met Nutricia. Het onderzoek dat door deze werkgroepleden wordt verricht, wordt niet beïnvloed door deze samenwerkingsbijdrage.
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de patiëntenvereniging Stichting Voedselallergie in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop ‘Waarden en voorkeuren van patiënten’). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Stichting Voedselallergie en Patiëntenfederatie Nederland, en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
|
Module |
Uitkomst raming |
Toelichting |
|
Module Kruis- en coallergieën |
geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Binnen het SKMS project “Inventarisatie en optimalisatie modulair onderhoud richtlijn kindergeneeskunde” is breed geïnventariseerd welke kindergeneeskundige modules toe waren aan herziening, en er is een onderhoudsplan opgeleverd. De modules van deze richtlijn, herzien in 2022-2024, kwamen uit dit project naar voren. De modules zijn kritisch beoordeeld en de uitgangsvraag en zoekvraag werden aangepast of aangescherpt.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Referenties
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
Algemene informatie
|
Cluster/richtlijn: NVK IgE-gemedieerde koemelkallergie bij kinderen |
|
|
Uitgangsvraag/modules: Welke middelen moeten tevens (naast koemelk) worden gemeden in verband met risico op een gelijksoortige allergische reactie of kruisallergie? |
|
|
Database(s): Embase.com, Ovid/Medline |
Datum: 4 juli 2023 |
|
Periode: geen restrictie |
Talen: geen restrictie |
|
Toelichting: Voor deze vraag is gezocht op de elementen: koemelkallergie (vermoede) kruisallergenen kinderen De sleutelartikelen worden gevonden met deze search |
|
|
Te gebruiken voor richtlijnen tekst: Nederlands In de databases Embase.com en Ovid/Medline is op 4 juli 2023 systematisch gezocht naar systematische reviews, RCTs en observationele studies over (vermoede) kruisallergenen bij koemelkallergie bij kinderen. De literatuurzoekactie leverde 475 unieke treffers op.
Engels On the 4th of July 2023, a systematic search was performed in the databases Embase.com and Ovid/Medline for systematic reviews, RCTs and observational studies about (suspected) cross-allergens in cow's milk allergy in children. The search resulted in 475 unique hits. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SR |
42 |
37 |
45 |
|
RCT |
138 |
112 |
164 |
|
Observationele studies |
217 |
106 |
266 |
|
Totaal |
397 |
255 |
475* |
*in Rayyan
Zoekstrategie
Embase.com
|
No. |
Query |
Results |
|
#13 |
#10 OR #11 OR #12 |
397 |
|
#12 |
#5 AND (#8 OR #9) NOT (#10 OR #11) = observationeel |
217 |
|
#11 |
#5 AND #7 NOT #10 = RCT |
138 |
|
#10 |
#5 AND #6 = SR |
42 |
|
#9 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
14221972 |
|
#8 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
7720187 |
|
#7 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3823872 |
|
#6 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
941215 |
|
#5 |
#4 NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
713 |
|
#4 |
#1 AND #2 AND #3 |
1123 |
|
#3 |
'adolescent'/exp OR 'baby'/exp OR 'boy'/exp OR 'child'/exp OR 'minors'/exp/mj OR 'pediatric patient'/exp OR 'pediatrics'/exp OR 'schoolchild'/exp OR infan*:ti,ab OR newborn*:ti,ab OR 'new born*':ti,ab OR perinat*:ti,ab OR neonat*:ti,ab OR baby*:ti,ab OR babies:ti,ab OR toddler*:ti,ab OR minors*:ti,ab OR boy:ti,ab OR boys:ti,ab OR boyfriend:ti,ab OR boyhood:ti,ab OR girl*:ti,ab OR kid:ti,ab OR kids:ti,ab OR child*:ti,ab OR children*:ti,ab OR schoolchild*:ti,ab OR adolescen*:ti,ab OR juvenil*:ti,ab OR youth*:ti,ab OR teen*:ti,ab OR pubescen*:ti,ab OR pediatric*:ti,ab OR paediatric*:ti,ab OR peadiatric*:ti,ab OR school:ti,ab OR school*:ti,ab OR prematur*:ti,ab OR preterm*:ti,ab |
5722846 |
|
#2 |
'cross allergy'/exp OR ((cross* NEAR/3 (allerg* OR intoleran* OR sensitization* OR sensitisation* OR hypersensitization OR hypersensitisation OR sensitivity OR hypersensitivity OR anaphyla* OR react*)):ti,ab,kw) OR 'buffalo milk'/exp OR 'camel milk'/exp OR 'donkey milk'/exp OR 'goat milk'/exp OR 'horse milk'/exp OR 'pig milk'/exp OR 'sheep milk'/exp OR 'yak milk'/exp OR 'plant-based milk'/exp OR (((goat* OR camel* OR horse* OR sheep* OR mammalian* OR ass OR 'ass s' OR buffalo* OR deer* OR reindeer* OR ibex* OR donkey* OR mare* OR pig* OR yak* OR soy* OR almond OR plant OR nondairy OR 'non dairy') NEAR/3 (milk OR formula*)):ti,ab,kw) OR 'beef'/exp OR beef:ti,ab,kw OR beefsteak:ti,ab,kw OR 'pork'/exp OR pork:ti,ab,kw |
150112 |
|
#1 |
'milk allergy'/exp OR 'milk intolerance'/exp OR (('cow milk'/exp OR 'whey'/exp OR 'whey protein'/exp OR 'casein'/exp) AND ('allergy'/exp OR 'hypersensitivity'/exp OR 'food allergen'/exp OR 'immunoglobulin e'/exp)) OR ((('cow s milk' OR 'cow* milk' OR casein* OR whey) NEAR/3 (allerg* OR intoleran* OR sensitization OR sensitisation OR hypersensitization OR hypersensitisation OR sensitivity OR hypersensitivity OR anaphyla* OR ige OR 'ig e' OR 'gammaglubulin e' OR 'gamma e' OR 'immunoglobulin gamma e' OR 'immunoglobulin e')):ti,ab,kw) |
10320 |
Ovid/Medline
|
# |
Searches |
Results |
|
13 |
10 or 11 or 12 |
255 |
|
12 |
(5 and (8 or 9)) not (10 or 11) = observationeel |
106 |
|
11 |
(5 and 7) not 10 = RCT |
112 |
|
10 |
5 and 6 = SR |
37 |
|
9 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5459711 |
|
8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4476836 |
|
7 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2606587 |
|
6 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
678494 |
|
5 |
4 not (comment/ or editorial/ or letter/) not ((exp animals/ or exp models, animal/) not humans/) |
503 |
|
4 |
1 and 2 and 3 |
552 |
|
3 |
(child* or schoolchild* or infan* or adolescen* or pediatri* or paediatr* or neonat* or boy or boys or boyhood or girl or girls or girlhood or youth or youths or baby or babies or toddler* or childhood or teen or teens or teenager* or newborn* or postneonat* or postnat* or puberty or preschool* or suckling* or picu or nicu or juvenile?).tw. |
2910190 |
|
2 |
exp Cross Reactions/ or (cross* adj3 (allerg* or intoleran* or sensitization* or sensitisation* or hypersensitization or hypersensitisation or sensitivity or hypersensitivity or anaphyla* or react*)).ti,ab,kf. or exp Soy Milk/ or ((goat* or camel* or horse* or sheep* or mammalian* or ass or 'ass s' or buffalo* or deer* or reindeer* or ibex* or donkey* or mare* or pig* or yak* or soy* or almond or plant or nondairy or 'non dairy') adj3 (milk or formula*)).ti,ab,kf. or exp Red Meat/ or beef.ti,ab,kf. or beefsteak.ti,ab,kf. or pork.ti,ab,kf. |
149077 |
|
1 |
exp Milk Hypersensitivity/ or ((Milk/ or exp Milk Proteins/ or exp Whey/) and (exp Hypersensitivity/ or exp Allergens/ or exp Immunoglobulin E/)) or (('cow s milk' or 'cow* milk' or casein* or whey) adj3 (allerg* or intoleran* or sensitization or sensitisation or hypersensitization or hypersensitisation or sensitivity or hypersensitivity or anaphyla* or ige or 'ig e' or 'gammaglubulin e' or 'gamma e' or 'immunoglobulin gamma e' or ' immunoglobulin e')).ti,ab,kf. |
6578 |