Genetisch onderzoek bij Hemochromatose
Uitgangsvraag
Wat is de indicatie voor genetisch onderzoek? Wanneer, welke genen, door wie, welke mutaties, welke volgorde? Hoe moet genetisch onderzoek worden geïnterpreteerd?
Aanbeveling
|
Geen gradering |
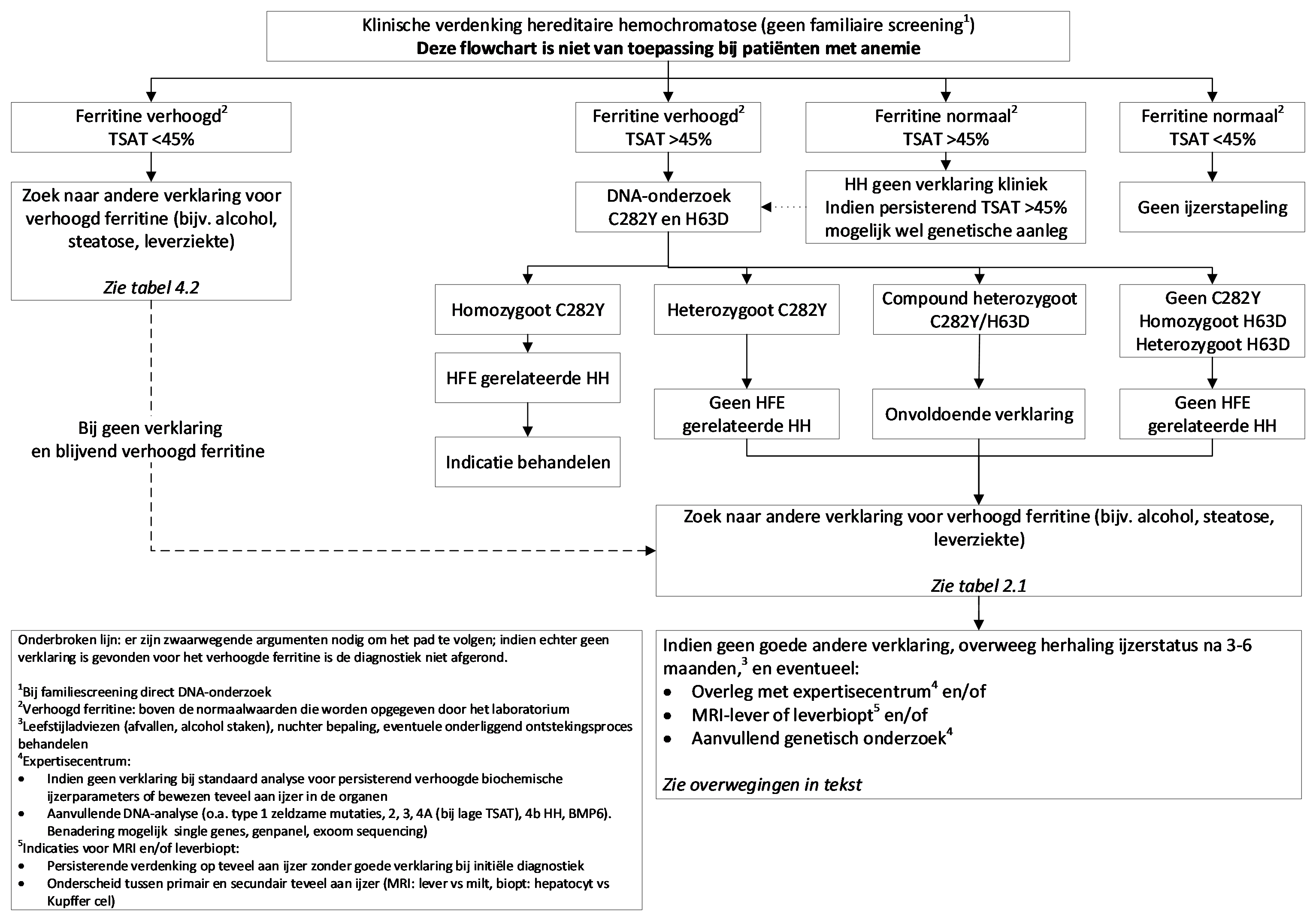
Onderzoek van HFE-mutaties dient te worden verricht bij alle patiënten (van kaukasische afkomst) met verhoging van transferrinesaturatie > 45% en serumferritine boven de normaalwaarde van het laboratorium voor leeftijd en geslacht, waarbij andere oorzaken van verhoogde ijzerparameters zijn uitgesloten. Bij alternatieven (i) geen mutaties, (ii) heterozygoot voor C282Y, (iii) compound heterozygotie (iv) heterozygoot voor H63D en (v) homozygoot voor H63D: zie flowchart. (*: onderzoek van het gen op zeldzame mutaties, anders dan C282Y en H63D)
Zie flowchart: |
Overwegingen
De allelfrequentie van de bekende HFE-mutaties is zeer laag bij niet-kaukasiërs. Derhalve is onderzoek naar C282Y- en H63D-mutaties niet zinvol bij patiënten in deze groep. Andere mutaties in het HFE-gen en mutaties in andere genen die betrokken zijn bij hemochromatose komen niet exclusief bij kaukasiërs voor.
Het wordt geadviseerd om DNA-onderzoek van patiënten met vermoeden van HH type 1 (voor zeldzame mutaties) en type 2-4 te laten uitvoeren in formele expertise centra (in Nederland is dit het Radboudumc expertise centrum zeldzame aandoeningen van de ijzerstofwisseling dat onderdeel is van het Europese reference netwerk (ERN) EuroBloodNet (https://www.eurobloodnet.eu/eurobloodnet/subnetworks/ https://www.radboudumc.nl/expertisecentra/ijzerstofwisselingsziekten). Websites voor aanvragen van genanalyse: http://www.radboud-ironcenter.com/diagnostics/dna-diagnostics/ of https://order.radboudumc.nl/genetics. (zie ook de module ´Diagnostisch vervolgonderzoek Hemochromatose´)
Onderbouwing
Achtergrond
Deze module is afkomstig uit de richtlijn 2007, en beperkt herzien zonder systematisch literatuuronderzoek.
De ziekte ‘idiopathische’ hemochromatose veranderde in ‘hereditaire’ hemochromatose (HH) met de waarneming, rond 1975, dat de aandoening opvallend frequent voorkwam bij broers en zussen van patiënten en bij kinderen uit consanguïne huwelijken. Tevens bleek uit segregatieanalyse van stambomen dat de ziekte autosomaal recessief overerft. Genetisch onderzoek bij patiënten met biochemische of klinische verdenking op HH werd pas mogelijk met de ontdekking, door Michel Simon en medewerkers, dat hemochromatose geassocieerd was met HLA serotype A3. In een Deense studie bij HH patiënten was het relatieve risico (in vergelijking met een normale populatie) op HLA-A3 10,9 en op HLA-B7 4,1. Bij patiënten met een klinisch kennelijk homozygote vorm van HH werden daarna vele verschillende HLA haplotypen waargenomen die overigens identiek waren bij ‘sibs’ (broers en zussen) die eveneens klinische of biochemische expressie van teveel aan ijzer hadden. HLA typering had derhalve geen betekenis voor de diagnostiek van HH bij patiënten maar wel bij familieonderzoek. Daarbij bleek overigens dat er grote verschillen bestonden in de fenotypische expressie van HH, zelfs bij personen met dezelfde HLA haplotypen.(109, 110)
Genetisch onderzoek als een zinvolle aanvulling van de diagnostiek bij ijzerstapeling werd pas mogelijk na isolatie van een met hemochromatose geassocieerd gen (HFE) in 1996.(3) Bij patiënten met de kenmerken van HH bleek een mutatie van het HFE-gen te bestaan die resulteerde in een 845G→A verandering (van cysteïne naar tyrosine bij residu 282 van het HFE-eiwit): de C282Y mutatie. Dit genotype werd bij 52-100% van de patiënten met het fenotype van HH gevonden.(4, 111, 112) Van de niet-C282Y homozygote patiënten was een aantal compound heterozygoot voor C282Y en een tweede HFE mutatie, n.l. met een 187C→G verandering, resulterend in een H63D mutatie.(113) Overigens wordt compound heterozygotie tegenwoordig eerder als risicofactor beschouwd dan als genetische aanleg.(114) De prevalentie van de H63D-mutatie is hoog in populaties van Noord-Europese afkomst (ongeveer 20%), terwijl de C282Y prevalentie in deze populaties ongeveer 10% is. Bij C282Y heterozygoten en H63D homozygoten wordt doorgaans geen teveel aan ijzer gevonden. Naast genoemde HFE-mutaties worden sporadisch nog andere pathologische mutaties gevonden in het HFE-gen.
De afgelopen jaren is gebleken dat mutaties in een aantal andere genen verantwoordelijk zijn voor de non-HFE vormen van HH. Het betreft eiwitten die een rol spelen als ijzertransporter of ijzersensor zoals transferrinereceptor-2 (TfR2), hemojuveline (HJV), hepcidine (HAMP), ferroportine (FPN) en recentelijk BMP6.(24, 115) De genetische afwijkingen die leiden tot HH zijn hierdoor behoorlijk gecompliceerd geworden.
Conclusies / Summary of Findings
|
Geen gradering |
Homozygotie voor de C282Y mutatie van het HFE-gen is bewijzend voor de aanleg voor de ziekte HH, maar geeft geen indicatie of er ook teveel aan ijzer zal optreden en kan de ernst van teveel aan ijzer en weefselschade niet voorspellen. |
Samenvatting literatuur
Voor de plaatsbepaling van genetisch onderzoek zijn vier overwegingen van belang: (i) bij alle vormen van HH bestaat de behandeling uit aderlatingen, (ii) momenteel is alleen diagnostiek van HFE mutaties algemeen beschikbaar, (iii) voor het bij HH obligate familieonderzoek moeten de mutaties van de proband bekend zijn en (iv) indien bij mensen met slechts geringe biochemische tekenen van teveel aan ijzer homozygotie voor de C282Y mutatie gevonden wordt, zal dat richting geven aan de planning van toekomstige controles.
Hoewel strikt genomen klinische en biochemische parameters bepalend zijn voor al dan niet instellen van behandeling met aderlatingen, zal onderzoek naar mutaties van het HFE-gen, op grond van bovenstaande overwegingen, moeten plaatsvinden bij alle patiënten met de combinatie van een verhoogde transferrinesaturatie, boven 45%, en een verhoogd ferritine (zie de module ´IJzerparameters bij Hemochromatose´). Indien onderzoek plaatsvindt op jeugdige leeftijd of bij vrouwen die nog menstrueren, dan kan het ferritine nog laag zijn maar met kans op een aanzienlijke stijging in een volgende levensfase.
Een derde mutatie S65C, met een lage allelfrequentie van 1,6-2,0% heeft een klein maar consistent effect op de ijzerparameters in combinatie met de C282Y.(15, 116, 117) Tot nu toe zijn er echter geen overtuigende bewijzen dat S65C is geassocieerd met HH. Dit tezamen met de lage allelfrequentie maakt dat er onvoldoende argumenten zijn om ook voor S65C te testen om de aanwezigheid van HH te bevestigen.(114)
Alleen de interpretatie van onderzoek naar de veel voorkomende mutaties van het HFE-gen wordt hier besproken.
De mogelijkheden zijn: (i) geen mutaties, (ii) heterozygoot voor C282Y, (iii) homozygoot voor C282Y, (iv) heterozygoot voor H63D, (v) homozygoot voor H63D, (vi) compound heterozygoot voor C282Y/H63D.
Alleen de bevinding (iii) past bij HH type 1. Andere afwegingen bij het inzetten van vervolgdiagnostiek zoals aanvullend DNA onderzoek, leverbiopsie, lever MRI worden besproken in de modules ´IJzer in de lever: leverbiopsie bij Hemochromatose´, ´IJzer in de lever: MRI bij Hemochromatose´ en ´Diagnostisch vervolgonderzoek Hemochromatose´.
Referenties
- 1 - (NIV) NIV, Laboratoriumgeneeskunde NVvKCe, Laboratoriumdiagnostiek VA. Richtlijn Hereditaire Hemochromatose. Diagnostiek en behandeling van hereditaire hemochromatose. 2007.
- 2 - De Beer JJA, Kuijpers T. Toepassen GRADE in Nederland. 2012.
- 3 - Feder JN, Gnirke A, Thomas W, Tsuchihashi Z, Ruddy DA, Basava A, et al. A novel MHC class I-like gene is mutated in patients with hereditary haemochromatosis. Nat Genet. 1996;13(4):399-408.
- 4 - Hanson EH, Imperatore G, Burke W. HFE gene and hereditary hemochromatosis: a HuGE review. Human Genome Epidemiology. Am J Epidemiol. 2001;154(3):193-206.
- 5 - den Dunnen JT, Antonarakis SE. Mutation nomenclature extensions and suggestions to describe complex mutations: a discussion. Hum Mutat. 2000;15(1):7-12.
- 6 - Pietrangelo A. Hereditary hemochromatosis--a new look at an old disease. N Engl J Med. 2004;350(23):2383-97.
- 7 - Swinkels DW, Janssen MC, Bergmans J, Marx JJ. Hereditary hemochromatosis: genetic complexity and new diagnostic approaches. Clin Chem. 2006;52(6):950-68.
- 8 - Beutler E. The HFE Cys282Tyr mutation as a necessary but not sufficient cause of clinical hereditary he-mochromatosis. Blood. 2003;101(9):3347-50.
- 9 - Adams P, Brissot P, Powell LW. EASL International Consensus Conference on Haemochromatosis. J Hepatol. 2000;33(3):485-504.
- 10 - Edwards CQ, Ajioka RS, Kushner JP. Hemochromatosis: a genetic definition. In: Barton JC, Edwards CQ, editors. Hemochromatosis Genetics, pathophysiology, diagnosis: Cambridge university press; 2000. p. 8-11.
- 11 - Powell LW, Dixon JL, Hewett DG. Role of early case detection by screening relatives of patients with HFE-associated hereditary haemochromatosis. Best Pract Res Clin Haematol. 2005;18(2):221-34.
- 12 - Tavill AS, American Association for the Study of Liver D, American College of G, American Gastroenterological A. Diagnosis and management of hemochromatosis. Hepatology. 2001;33(5):1321-8.
- 13 - Brissot P, de Bels F. Current approaches to the management of hemochromatosis. Hematology Am Soc Hematol Educ Program. 2006:36-41.
- 14 - Swinkels DW, Jacobs EM. [From gene to disease; HFE-mutations in primary haemochromatosis]. Ned Tijdschr Geneeskd. 2003;147(14):652-6.
- 15 - Mura C, Raguenes O, Ferec C. HFE mutations analysis in 711 hemochromatosis probands: evidence for S65C implication in mild form of hemochromatosis. Blood. 1999;93(8):2502-5.
- 16 - Hamdi-Roze H, Beaumont-Epinette MP, Ben Ali Z, Le Lan C, Loustaud-Ratti V, Causse X, et al. Rare HFE variants are the most frequent cause of hemochromatosis in non-c282y homozygous patients with he-mochromatosis. Am J Hematol. 2016;91(12):1202-5.
- 17 - Best LG, Harris PE, Spriggs EL. Hemochromatosis mutations C282Y and H63D in 'cis' phase. Clin Genet. 2001;60(1):68-72.
- 18 - Lucotte G, Champenois T, Semonin O. A rare case of a patient heterozygous for the hemochromatosis mutation C282Y and homozygous for H63D. Blood Cells Mol Dis. 2001;27(5):892-3.
- 19 - Bergmans JP, Kemna EH, Janssen MC, Jacobs EM, Stalenhoef AF, Marx JJ, et al. [Hereditary haemochromatosis: novel genes, novel diseases and hepcidin]. Ned Tijdschr Geneeskd. 2007;151(20):1121-7.
- 20 - Bridle KR, Frazer DM, Wilkins SJ, Dixon JL, Purdie DM, Crawford DH, et al. Disrupted hepcidin regulation in HFE-associated haemochromatosis and the liver as a regulator of body iron homoeostasis. Lancet. 2003;361(9358):669-73.
- 21 - Ganz T. Hepcidin--a regulator of intestinal iron absorption and iron recycling by macrophages. Best Pract Res Clin Haematol. 2005;18(2):171-82.
- 22 - Nicolas G, Viatte L, Lou DQ, Bennoun M, Beaumont C, Kahn A, et al. Constitutive hepcidin expression prevents iron overload in a mouse model of hemochromatosis. Nat Genet. 2003;34(1):97-101.
- 23 - Nemeth E, Tuttle MS, Powelson J, Vaughn MB, Donovan A, Ward DM, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science. 2004;306(5704):2090-3.
- 24 - Pietrangelo A. Genetics, Genetic Testing, and Management of Hemochromatosis: 15 Years Since Hep-cidin. Gastroenterology. 2015;149(5):1240-51 e4.
- 25 - Girelli D, Nemeth E, Swinkels DW. Hepcidin in the diagnosis of iron disorders. Blood. 2016;127(23):2809-13.
- 26 - Finch SC, Finch CA. Idiopathic hemochromatosis, an iron storage disease. A. Iron metabolism in hemo-chromatosis. Medicine (Baltimore). 1955;34(4):381-430.
- 27 - Moirand R, Adams PC, Bicheler V, Brissot P, Deugnier Y. Clinical features of genetic hemochromatosis in women compared with men. Ann Intern Med. 1997;127(2):105-10.
- 28 - Andersen RV, Tybjaerg-Hansen A, Appleyard M, Birgens H, Nordestgaard BG. Hemochromatosis muta-tions in the general population: iron overload progression rate. Blood. 2004;103(8):2914-9.
- 29 - Asberg A, Hveem K, Thorstensen K, Ellekjter E, Kannelonning K, Fjosne U, et al. Screening for hemochromatosis: high prevalence and low morbidity in an unselected population of 65,238 persons. Scand J Gastroenterol. 2001;36(10):1108-15.
- 30 - Beutler E, Felitti VJ, Koziol JA, Ho NJ, Gelbart T. Penetrance of 845G--> A (C282Y) HFE hereditary haemochromatosis mutation in the USA. Lancet. 2002;359(9302):211-8.
- 31 - Olynyk JK, Cullen DJ, Aquilia S, Rossi E, Summerville L, Powell LW. A population-based study of the clini-cal expression of the hemochromatosis gene. N Engl J Med. 1999;341(10):718-24.
- 32 - Powell LW, Dixon JL, Ramm GA, Purdie DM, Lincoln DJ, Anderson GJ, et al. Screening for hemochromatosis in asymptomatic subjects with or without a family history. Arch Intern Med. 2006;166(3):294-301.
- 33 - van Dijk BA, Kemna EH, Tjalsma H, Klaver SM, Wiegerinck ET, Goossens JP, et al. Effect of the new HJV-L165X mutation on penetrance of HFE. Blood. 2007;109(12):5525-6.
- 34 - Whitlock EP, Garlitz BA, Harris EL, Beil TL, Smith PR. Screening for hereditary hemochromatosis: a sys-tematic review for the U.S. Preventive Services Task Force. Ann Intern Med. 2006;145(3):209-23.
- 35 - Asberg A, Hveem K, Kruger O, Bjerve KS. Persons with screening-detected haemochromatosis: as healthy as the general population? Scand J Gastroenterol. 2002;37(6):719-24.
- 36 - Schumacher HR, Jr. Hemochromatosis and Arthritis. Arthritis Rheum. 1964;7:41-50.
- 37 - Elmberg M, Hultcrantz R, Simard JF, Carlsson A, Askling J. Increased risk of arthropathies and joint re-placement surgery in patients with genetic hemochromatosis: a study of 3,531 patients and their 11,794 first-degree relatives. Arthritis Care Res (Hoboken). 2013;65(5):678-85.
- 38 - Sahinbegovic E, Dallos T, Aigner E, Axmann R, Engelbrecht M, Schoniger-Hekele M, et al. Hereditary he-mochromatosis as a risk factor for joint replacement surgery. Am J Med. 2010;123(7):659-62.
- 39 - Sahinbegovic E, Dallos T, Aigner E, Axmann R, Manger B, Englbrecht M, et al. Musculoskeletal disease burden of hereditary hemochromatosis. Arthritis Rheum. 2010;62(12):3792-8.
- 40 - Wang Y, Gurrin LC, Wluka AE, Bertalli NA, Osborne NJ, Delatycki MB, et al. HFE C282Y homozygosity is associated with an increased risk of total hip replacement for osteoarthritis. Semin Arthritis Rheum. 2012;41(6):872-8.
- 41 - McDonnell SM, Preston BL, Jewell SA, Barton JC, Edwards CQ, Adams PC, et al. A survey of 2,851 patients with hemochromatosis: symptoms and response to treatment. Am J Med. 1999;106(6):619-24.
- 42 - Waalen J, Felitti V, Gelbart T, Ho NJ, Beutler E. Prevalence of hemochromatosis-related symptoms among individuals with mutations in the HFE gene. Mayo Clin Proc. 2002;77(6):522-30.
- 43 - Cauza E, Hanusch-Enserer U, Etemad M, Koller M, Kostner K, Georg P, et al. HFE genotyping demon-strates a significant incidence of hemochromatosis in undifferentiated arthritis. Clin Exp Rheumatol. 2005;23(1):7-12.
- 44 - Sinigaglia L, Fargion S, Fracanzani AL, Binelli L, Battafarano N, Varenna M, et al. Bone and joint involve-ment in genetic hemochromatosis: role of cirrhosis and iron overload. J Rheumatol. 1997;24(9):1809-13.
- 45 - Dymock IW, Hamilton EB, Laws JW, Williams R. Arthropathy of haemochromatosis. Clinical and radiological analysis of 63 patients with iron overload. Ann Rheum Dis. 1970;29(5):469-76.
- 46 - Hamilton E, Williams R, Barlow KA, Smith PM. The arthropathy of idiopathic haemochromatosis. Q J Med. 1968;37(145):171-82.
- 47 - Hirsch JH, Killien FC, Troupin RH. The arthropathy of hemochromatosis. Radiology. 1976;118(3):591-6.
- 48 - McCarthy GM, Rosenthal AK, Carrera GF. Hemochromatosis-like arthropathy in diabetes mellitus without hemochromatosis. J Rheumatol. 1996;23(8):1453-6.
- 49 - Lasserre C, Pauzat D, Derennes R. Osteoarthritis of the trapezio-metacarpal joint. J Bone Joint Surg Br. 1949;31B(4):534-6, illust.
- 50 - Conte D, Manachino D, Colli A, Guala A, Aimo G, Andreoletti M, et al. Prevalence of genetic hemochro-matosis in a cohort of Italian patients with diabetes mellitus. Ann Intern Med. 1998;128(5):370-3.
- 51 - Dubois-Laforgue D, Caillat-Zucman S, Djilali-Saiah I, Larger E, Mercadier A, Boitard C, et al. Mutations in HFE, the hemochromatosis candidate gene, in patients with NIDDM. Diabetes Care. 1998;21(8):1371-2.
- 52 - Frayling T, Ellard S, Grove J, Walker M, Hattersley AT. C282Y mutation in HFE (haemochromatosis) gene and type 2 diabetes. Lancet. 1998;351(9120):1933-4.
- 53 - Mainous AG, 3rd, Gill JM, Pearson WS. Should we screen for hemochromatosis? An examination of evi-dence of downstream effects on morbidity and mortality. Arch Intern Med. 2002;162(15):1769-74.
- 54 - Turnbull AJ, Mitchison HC, Peaston RT, Lai LC, Bennett MK, Taylor R, et al. The prevalence of hereditary haemochromatosis in a diabetic population. Qjm. 1997;90(4):271-5.
- 55 - Cadet E, Capron D, Perez AS, Crepin SN, Arlot S, Ducroix JP, et al. A targeted approach significantly in-creases the identification rate of patients with undiagnosed haemochromatosis. J Intern Med. 2003;253(2):217-24.
- 56 - Hramiak IM, Finegood DT, Adams PC. Factors affecting glucose tolerance in hereditary hemochromato-sis. Clin Invest Med. 1997;20(2):110-8.
- 57 - Ryan E, Byrnes V, Coughlan B, Flanagan AM, Barrett S, O'Keane JC, et al. Underdiagnosis of hereditary haemochromatosis: lack of presentation or penetration? Gut. 2002;51(1):108-12.
- 58 - Deugnier Y, Jouanolle AM, Chaperon J, Moirand R, Pithois C, Meyer JF, et al. Gender-specific phenotypic expression and screening strategies in C282Y-linked haemochromatosis: a study of 9396 French people. Br J Haematol. 2002;118(4):1170-8.
- 59 - Tweed MJ, Roland JM. Haemochromatosis as an endocrine cause of subfertility. Bmj. 1998;316(7135):915-6.
- 60 - Adams PC, Kertesz AE, Valberg LS. Clinical presentation of hemochromatosis: a changing scene. Am J Med. 1991;90(4):445-9.
- 61 - Charlton RW, Abrahams C, Bothwell TH. Idiopathic hemochromatosis in young subjects. Clinical, patho-logical, and chemical findings in four patients. Arch Pathol. 1967;83(2):132-40.
- 62 - Gezondheidsraad. Vroege opsporing van ijzerstapelingsziekte. Den Haag: Gezondheidsraad; 1999.
- 63 - Haematology. BCfSi. Genetic Haemochromatosis. . 2000.
- 64 - Schmitt B, Golub RM, Green R. Screening primary care patients for hereditary hemochromatosis with transferrin saturation and serum ferritin level: systematic review for the American College of Physicians. Ann Intern Med. 2005;143(7):522-36.
- 65 - Swinkels DW. Diagnostiek en behandeling van primaire hemochromatose. Ned Tijdschr Klin Chem. 2003;28:124-44.
- 66 - Ellervik C, Mandrup-Poulsen T, Nordestgaard BG, Larsen LE, Appleyard M, Frandsen M, et al. Prevalence of hereditary haemochromatosis in late-onset type 1 diabetes mellitus: a retrospective study. Lancet. 2001;358(9291):1405-9.
- 67 - Trousseau A. Glycosurie, diabète sucré. Clinique médicale de l'Hôtel-Dieu de Paris. 1865;2:663-98.
- 68 - Brissot P, Moirand R, Guyader D, Loreal O, Turlin B, Deugnier Y. Hemochromatosis after the gene discovery: revisiting the diagnostic strategy. J Hepatol. 1998;28 Suppl 1:14-8.
- 69 - Hanot VC, Chauffard AME. Cirrhose hypertrophique pigmentaire dans le diabète sucré. . Rev Med (Paris). 1882;2(385).
- 70 - Recklinghausen FDv. Uber Haemochromatose. Bern Klin Wochenschr. 1880;26:925.
- 71 - Sheldon JH. Haemochromatosis. Oxford University Press, London. 1935.
- 72 - Simon M, Bourel M, Fauchet R, Genetet B. Association of HLA-A3 and HLA-B14 antigens with idiopathic haemochromatosis. Gut. 1976;17(5):332-4.
- 73 - Ridefelt P, Larsson A, Rehman JU, Axelsson J. Influences of sleep and the circadian rhythm on iron-status indices. Clin Biochem. 2010;43(16-17):1323-8.
- 74 - Dallman PR. Diagnosis of anemia and iron deficiency: analytic and biological variations of laboratory tests. Am J Clin Nutr. 1984;39(6):937-41.
- 75 - Edwards CQ, Griffen LM, Kaplan J, Kushner JP. Twenty-four hour variation of transferrin saturation in treated and untreated haemochromatosis homozygotes. J Intern Med. 1989;226(5):373-9.
- 76 - Sinniah R, Doggart JR, Neill DW. Diurnal variations of the serum iron in normal subjects and in patients with haemochromatosis. Br J Haematol. 1969;17(4):351-8.
- 77 - Olsson KS, Eriksson K, Ritter B, Heedman PA. Screening for iron overload using transferrin saturation. Acta Med Scand. 1984;215(2):105-12.
- 78 - Cavill I, Jacobs A, Worwood M. Diagnostic methods for iron status. Ann Clin Biochem. 1986;23 ( Pt 2):168-71.
- 79 - Gambino R, Desvarieux E, Orth M, Matan H, Ackattupathil T, Lijoi E, et al. The relation between chemically measured total iron-binding capacity concentrations and immunologically measured transferrin concentrations in human serum. Clin Chem. 1997;43(12):2408-12.
- 80 - Gottschalk R, Wigand R, Dietrich CF, Oremek G, Liebisch F, Hoelzer D, et al. Total iron-binding capacity and serum transferrin determination under the influence of several clinical conditions. Clin Chim Acta. 2000;293(1-2):127-38.
- 81 - Kasvosve I, Delanghe J. Total iron binding capacity and transferrin concentration in the assessment of iron status. Clin Chem Lab Med. 2002;40(10):1014-8.
- 82 - Adams PC, Bhayana V. Unsaturated iron-binding capacity: a screening test for C282Y hemochro-matosis? Clin Chem. 2000;46(11):1870-1.
- 83 - Adams PC, Kertesz AE, McLaren CE, Barr R, Bamford A, Chakrabarti S. Population screening for hemo-chromatosis: a comparison of unbound iron-binding capacity, transferrin saturation, and C282Y genotyping in 5,211 voluntary blood donors. Hepatology. 2000;31(5):1160-4.
- 84 - Jackson HA, Carter K, Darke C, Guttridge MG, Ravine D, Hutton RD, et al. HFE mutations, iron deficiency and overload in 10,500 blood donors. Br J Haematol. 2001;114(2):474-84.
- 85 - Murtagh LJ, Whiley M, Wilson S, Tran H, Bassett ML. Unsaturated iron binding capacity and transferrin saturation are equally reliable in detection of HFE hemochromatosis. Am J Gastroenterol. 2002;97(8):2093-9.
- 86 - McCullen MA, Crawford DH, Dimeski G, Tate J, Hickman PE. Why there is discordance in reported deci-sion thresholds for transferrin saturation when screening for hereditary hemochromatosis. Hepatology. 2000;32(6):1410-1.
- 87 - McLaren CE, McLachlan GJ, Halliday JW, Webb SI, Leggett BA, Jazwinska EC, et al. Distribution of trans-ferrin saturation in an Australian population: relevance to the early diagnosis of hemochromatosis. Gastroenterology. 1998;114(3):543-9.
- 88 - de Swart L, Hendriks JC, van der Vorm LN, Cabantchik ZI, Evans PJ, Hod EA, et al. Second international round robin for the quantification of serum non-transferrin-bound iron and labile plasma iron in patients with iron-overload disorders. Haematologica. 2016;101(1):38-45.
- 89 - Hershko C. Pathogenesis and management of iron toxicity in thalassemia. Ann N Y Acad Sci. 2010;1202:1-9.
- 90 - Maas RP, Voets PJ, de Swart L, Swinkels DW. [Non-transferrin-bound iron: a promising biomarker in iron overload disorders]. Ned Tijdschr Geneeskd. 2013;157(49):A6258.
- 91 - Jenkitkasemwong S, Wang CY, Coffey R, Zhang W, Chan A, Biel T, et al. SLC39A14 Is Required for the Development of Hepatocellular Iron Overload in Murine Models of Hereditary Hemochromatosis. Cell Metab. 2015;22(1):138-50.
- 92 - Finch CA, Bellotti V, Stray S, Lipschitz DA, Cook JD, Pippard MJ, et al. Plasma ferritin determination as a diagnostic tool. West J Med. 1986;145(5):657-63.
- 93 - Kawabata H. The mechanisms of systemic iron homeostasis and etiology, diagnosis, and treatment of hereditary hemochromatosis. Int J Hematol. 2018;107(1):31-43.
- 94 - Ferraro S, Mozzi R, Panteghini M. Revaluating serum ferritin as a marker of body iron stores in the traceability era. Clin Chem Lab Med. 2012;50(11):1911-6.
- 95 - Fargion S, Mattioli M, Fracanzani AL, Sampietro M, Tavazzi D, Fociani P, et al. Hyperferritinemia, iron overload, and multiple metabolic alterations identify patients at risk for nonalcoholic steatohepatitis. Am J Gastroenterol. 2001;96(8):2448-55.
- 96 - Halliday JW, Powell LW. Ferritin metabolism and the liver. Semin Liver Dis. 1984;4(3):207-16.
- 97 - Jehn M, Clark JM, Guallar E. Serum ferritin and risk of the metabolic syndrome in U.S. adults. Diabetes Care. 2004;27(10):2422-8.
- 98 - Mendler MH, Turlin B, Moirand R, Jouanolle AM, Sapey T, Guyader D, et al. Insulin resistance-associated hepatic iron overload. Gastroenterology. 1999;117(5):1155-63.
- 99 - Moirand R, Mortaji AM, Loreal O, Paillard F, Brissot P, Deugnier Y. A new syndrome of liver iron overload with normal transferrin saturation. Lancet. 1997;349(9045):95-7.
- 100 - Piperno A, Trombini P, Gelosa M, Mauri V, Pecci V, Vergani A, et al. Increased serum ferritin is common in men with essential hypertension. J Hypertens. 2002;20(8):1513-8.
- 101 - Rossi E, Bulsara MK, Olynyk JK, Cullen DJ, Summerville L, Powell LW. Effect of hemochromatosis geno-type and lifestyle factors on iron and red cell indices in a community population. Clin Chem. 2001;47(2):202-8.
- 102 - Swinkels DW, Marx JJ. [Diagnosis and treatment of primary hemochromatosis]. Ned Tijdschr Geneeskd. 1999;143(27):1404-8.
- 103 - Aigner E, Weiss G, Datz C. Dysregulation of iron and copper homeostasis in nonalcoholic fatty liver. World J Hepatol. 2015;7(2):177-88.
- 104 - Aguilar-Martinez P, Schved JF, Brissot P. The evaluation of hyperferritinemia: an updated strategy based on advances in detecting genetic abnormalities. Am J Gastroenterol. 2005;100(5):1185-94.
- 105 - Phatak PD, Sham RL, Raubertas RF, Dunnigan K, O'Leary MT, Braggins C, et al. Prevalence of hereditary hemochromatosis in 16031 primary care patients. Ann Intern Med. 1998;129(11):954-61.
- 106 - European Association For The Study Of The L. EASL clinical practice guidelines for HFE hemo-chromatosis. J Hepatol. 2010;53(1):3-22.
- 107 - Witte DL, Crosby WH, Edwards CQ, Fairbanks VF, Mitros FA. Practice guideline development task force of the College of American Pathologists. Hereditary hemochromatosis. Clin Chim Acta. 1996;245(2):139-200.
- 108 - Capellini D, Lo S, Swinkels DW. Hemoglobin, iron and bilirubin. In: Rifai, Horvath, Wittwer, editors. Tietz Textbook of Clinical Chemistry and Molecular Diagnostics. Ed.6: Elsevier; 2018.
- 109 - Dadone MM, Kushner JP, Edwards CQ, Bishop DT, Skolnick MH. Hereditary hemochromatosis. Analysis of laboratory expression of the disease by genotype in 18 pedigrees. Am J Clin Pathol. 1982;78(2):196-207.
- 110 - Valberg LS, Lloyd DA, Ghent CN, Flanagan PR, Sinclair NR, Stiller CR, et al. Clinical and biochemical ex-pression of the genetic abnormality in idiopathic hemochromatosis. Gastroenterology. 1980;79(5 Pt 1):884-92.
- 111 - Beutler E. Genetic irony beyond haemochromatosis: clinical effects of HLA-H mutations. Lancet. 1997;349(9048):296-7.
- 112 - Edwards CQ, Griffen LM, Ajioka RS, Kushner JP. Screening for hemochromatosis: phenotype versus genotype. Semin Hematol. 1998;35(1):72-6.
- 113 - Aguilar Martinez P, Biron C, Blanc F, Masmejean C, Jeanjean P, Michel H, et al. Compound heter-ozygotes for hemochromatosis gene mutations: may they help to understand the pathophysiology of the disease? Blood Cells Mol Dis. 1997;23(2):269-76.
- 114 - Porto G, Brissot P, Swinkels DW, Zoller H, Kamarainen O, Patton S, et al. EMQN best practice guidelines for the molecular genetic diagnosis of hereditary hemochromatosis (HH). Eur J Hum Genet. 2016;24(4):479-95.
- 115 - Piubelli C, Castagna A, Marchi G, Rizzi M, Busti F, Badar S, et al. Identification of new BMP6 pro-peptide mutations in patients with iron overload. Am J Hematol. 2017;92(6):562-8.
- 116 - Arya N, Chakrabrati S, Hegele RA, Adams PC. HFE S65C variant is not associated with increased transfer-rin saturation in voluntary blood donors. Blood Cells Mol Dis. 1999;25(5-6):354-7.
- 117 - Beutler E, Felitti VJ, Ho NJ, Gelbart T. Commentary on HFE S65C variant is not associated with increased transferrin saturation in voluntary blood donors by Naveen Arya, Subrata Chakrabrati, Robert A. Hege-le, Paul C. Adams. Blood Cells Mol Dis. 1999;25(5-6):358-60.
- 118 - Acton RT, Barton JC. HFE genotype frequencies in consecutive reference laboratory specimens: comparisons among referral sources and association with initial diagnosis. Genet Test. 2001;5(4):299-306.
- 119 - Adams PC. The natural history of untreated HFE-related hemochromatosis. Acta Haematol. 2009;122(2-3):134-9.
- 120 - Aguilar-Martinez P, Bismuth M, Picot MC, Thelcide C, Pageaux GP, Blanc F, et al. Variable phenotypic presentation of iron overload in H63D homozygotes: are genetic modifiers the cause? Gut. 2001;48(6):836-42.
- 121 - Allen KJ, Gurrin LC, Constantine CC, Osborne NJ, Delatycki MB, Nicoll AJ, et al. Iron-overload-related disease in HFE hereditary hemochromatosis. N Engl J Med. 2008;358(3):221-30.
- 122 - Badar S, Busti F, Ferrarini A, Xumerle L, Bozzini P, Capelli P, et al. Identification of novel mutations in he-mochromatosis genes by targeted next generation sequencing in Italian patients with unexplained iron overload. Am J Hematol. 2016;91(4):420-5.
- 123 - Barton JC, Wiener HW, Acton RT, Go RC. HLA haplotype A 03-B 07 in hemochromatosis probands with HFE C282Y homozygosity: frequency disparity in men and women and lack of association with severity of iron overload. Blood Cells Mol Dis. 2005;34(1):38-47.
- 124 - Branco CC, Gomes CT, De Fez L, Bulhoes S, Brilhante MJ, Pereirinha T, et al. Carriers of the Complex Al-lele HFE c.[187C>G;340+4T>C] Have Increased Risk of Iron Overload in Sao Miguel Island Population (Azores, Portugal). PLoS ONE. 2015;10(10):e0140228.
- 125 - Dever JB, Mallory MA, Mallory JE, Wallace D, Kowdley KV. Phenotypic characteristics and diagnoses of patients referred to an iron overload clinic. Dig Dis Sci. 2010;55(3):803-7.
- 126 - Gurrin LC, Bertalli NA, Dalton GW, Osborne NJ, Constantine CC, McLaren CE, et al. HFE C282Y/H63D compound heterozygotes are at low risk of hemochromatosis-related morbidity. Hepatology. 2009;50(1):94-101.
- 127 - Hellerbrand C, Bosserhoff AK, Seegers S, Lingner G, Wrede C, Lock G, et al. Mutation analysis of the HFE gene in German hemochromatosis patients and controls using automated SSCP-based capillary electrophoresis and a new PCR-ELISA technique. Scand J Gastroenterol. 2001;36(11):1211-6.
- 128 - Holmstrom P, Marmur J, Eggertsen G, Gafvels M, Stal P. Mild iron overload in patients carrying the HFE S65C gene mutation: a retrospective study in patients with suspected iron overload and healthy con-trols. Gut. 2002;51(5):723-30.
- 129 - Jackson HA, Carter K, Darke C, Guttridge MG, Ravine D, Hutton RD, et al. HFE mutations, iron deficiency and overload in 10,500 blood donors. Br J Haematol. 2001;114(2):474-84.
- 130 - Lim EM, Rossi E, De Boer WB, Reed WD, Jeffrey GP. Hepatic iron loading in patients with compound heterozygous HFE mutations. Liver Int. 2004;24(6):631-6.
- 131 - Mainous AG, 3rd, Wright RU, Hulihan MM, Twal WO, McLaren CE, Diaz VA, et al. Telomere length and elevated iron: the influence of phenotype and HFE genotype. Am J Hematol. 2013;88(6):492-6.
- 132 - Milman N, Koefoed P, Pedersen P, Nielsen FC, Eiberg H. Frequency of the HFE C282Y and H63D muta-tions in Danish patients with clinical haemochromatosis initially diagnosed by phenotypic methods. Eur J Haematol. 2003;71(6):403-7.
- 133 - Mura C, Le Gac G, Raguenes O, Mercier AY, Le Guen A, Ferec C. Relation between HFE mutations and mild iron-overload expression. Mol Genet Metab. 2000;69(4):295-301.
- 134 - Neghina AM, Anghel A. Hemochromatosis genotypes and risk of iron overload--a meta-analysis. Ann Epidemiol. 2011;21(1):1-14.
- 135 - Nieves-Santiago P, Cancel D, Canales D, Toro DH. Presence of hemochromatosis-associated mutations in Hispanic patients with iron overload. P R Health Sci J. 2011;30(3):135-8.
- 136 - Olynyk JK, Gan E, Tan T. Predicting iron overload in hyperferritinemia. Clin Gastroenterol Hepatol. 2009;7(3):359-62.
- 137 - Samarasena J, Winsor W, Lush R, Duggan P, Xie Y, Borgaonkar M. Individuals homozygous for the H63D mutation have significantly elevated iron indexes. Dig Dis Sci. 2006;51(4):803-7.
- 138 - Velati C, Marlianici E, Rigamonti D, Barillari G, Chiavilli F, Fugiani P, et al. Mutations of the hemochroma-tosis gene in Italian candidate blood donors with increased transferrin saturation. Hematol J. 2003;4(6):436-40.
- 139 - Walsh A, Dixon JL, Ramm GA, Hewett DG, Lincoln DJ, Anderson GJ, et al. The clinical relevance of com-pound heterozygosity for the C282Y and H63D substitutions in hemochromatosis. Clin Gastroenterol Hepatol. 2006;4(11):1403-10.
- 140 - Watkins S, Thorburn D, Joshi N, Neilson M, Joyce T, Spooner R, et al. The biochemical and clinical pene-trance of individuals diagnosed with genetic haemochromatosis by predictive genetic testing. Eur J Gastroenterol Hepatol. 2008;20(5):379-83.
- 141 - Chapman BA, Horton DM, Burt MJ, Romeril KR, Walmsley TA, Grant SJ, et al. Investigation of subjects with abnormal iron studies: role of the hepatic iron index. N Z Med J. 1994;107(991):504-7.
- 142 - George PM, Conaghan C, Angus HB, Walmsley TA, Chapman BA. Comparison of histological and bio-chemical hepatic iron indexes in the diagnosis of genetic haemochromatosis. J Clin Pathol. 1996;49(2):159-63.
- 143 - Moodie SJ, Ang L, Stenner JM, Finlayson C, Khotari A, Levin GE, et al. Testing for haemochromatosis in a liver clinic population: relationship between ethnic origin, HFE gene mutations, liver histology and serum iron markers. Eur J Gastroenterol Hepatol. 2002;14(3):223-9.
- 144 - Bulaj ZJ, Phillips JD, Ajioka RS, Franklin MR, Griffen LM, Guinee DJ, et al. Hemochromatosis genes and other factors contributing to the pathogenesis of porphyria cutanea tarda. Blood. 2000;95(5):1565-71.
- 145 - Brissot P, Bourel M, Herry D, Verger JP, Messner M, Beaumont C, et al. Assessment of liver iron content in 271 patients: a reevaluation of direct and indirect methods. Gastroenterology. 1981;80(3):557-65.
- 146 - Deugnier YM, Loreal O, Turlin B, Guyader D, Jouanolle H, Moirand R, et al. Liver pathology in genetic he-mochromatosis: a review of 135 homozygous cases and their bioclinical correlations. Gastroenterology. 1992;102(6):2050-9.
- 147 - Ortega L, Ladero JM, Carreras MP, Alvarez T, Taxonera C, Olivan MP, et al. A computer-assisted mor-phometric quantitative analysis of iron overload in liver biopsies. A comparison with histological and biochemical methods. Pathol Res Pract. 2005;201(10):673-7.
- 148 - Beaton M, Guyader D, Deugnier Y, Moirand R, Chakrabarti S, Adams P. Noninvasive prediction of cirrhosis in C282Y-linked hemochromatosis. Hepatology. 2002;36(3):673-8.
- 149 - George DK, Ramm GA, Walker NI, Powell LW, Crawford DH. Elevated serum type IV collagen: a sensitive indicator of the presence of cirrhosis in haemochromatosis. J Hepatol. 1999;31(1):47-52.
- 150 - Guyader D, Jacquelinet C, Moirand R, Turlin B, Mendler MH, Chaperon J, et al. Noninvasive prediction of fibrosis in C282Y homozygous hemochromatosis. Gastroenterology. 1998;115(4):929-36.
- 151 - Morrison ED, Brandhagen DJ, Phatak PD, Barton JC, Krawitt EL, El-Serag HB, et al. Serum ferritin level predicts advanced hepatic fibrosis among U.S. patients with phenotypic hemochromatosis. Ann Intern Med. 2003;138(8):627-33.
- 152 - Qaseem A, Aronson M, Fitterman N, Snow V, Weiss KB, Owens DK, et al. Screening for hereditary hemochromatosis: a clinical practice guideline from the American College of Physicians.[Erratum appears in Ann Intern Med. 2006 Mar 7;144(5):380], [Summary for patients in Ann Intern Med. 2005 Oct 4;143(7):I46; PMID: 16204158]. Ann Intern Med. 2005;143(7):517-21.
- 153 - Bacon BR, Adams PC, Kowdley KV, Powell LW, Tavill AS, American Association for the Study of Liver D. Diagnosis and management of hemochromatosis: 2011 practice guideline by the American Association for the Study of Liver Diseases. Hepatology. 2011;54(1):328-43.
- 154 - Powell LW, Seckington RC, Deugnier Y. Haemochromatosis. Lancet. 2016;388(10045):706-16.
- 155 - Alustiza Echeverria JM, Castiella A, Emparanza JI. Quantification of iron concentration in the liver by MRI. Insights Imaging. 2012;3(2):173-80.
- 156 - Juchems MS, Cario H, Schmid M, Wunderlich AP. Liver iron content determined by MRI: spin-echo vs. gradient-echo. Rofo. 2012;184(5):427-31.
- 157 - Castiella A, Alustiza JM, Emparanza JI, Zapata EM, Costero B, Diez MI. Liver iron concentration quantification by MRI: are recommended protocols accurate enough for clinical practice? Eur Radiol. 2011;21(1):137-41.
- 158 - Alustiza JM, Artetxe J, Castiella A, Agirre C, Emparanza JI, Otazua P, et al. MR quantification of hepatic iron concentration. Radiology. 2004;230(2):479-84.
- 159 - Gandon Y, Guyader D, Heautot JF, Reda MI, Yaouanq J, Buhe T, et al. Hemochromatosis: diagnosis and quantification of liver iron with gradient-echo MR imaging. Radiology. 1994;193(2):533-8.
- 160 - Gandon Y, Olivie D, Guyader D, Aube C, Oberti F, Sebille V, et al. Non-invasive assessment of hepatic iron stores by MRI. Lancet. 2004;363(9406):357-62.
- 161 - Brugere JF, Gobron S, Baud E, Cailloux F. Design and validation of a colorimetric test for the genetic diagnosis of hemochromatosis using alpha-phosphorothioate nucleotides. Biochem Genet. 2013;51(7-8):635-43.
- 162 - Bryant J, Cooper K, Picot J, Clegg A, Roderick P, Rosenberg W, et al. A systematic review of the clinical validity and clinical utility of DNA testing for hereditary haemochromatosis type 1 in at-risk populations. J Med Genet. 2008;45(8):513-8.
- 163 - Bryant J, Cooper K, Picot J, Clegg A, Roderick P, Rosenberg W, et al. Diagnostic strategies using DNA testing for hereditary haemochromatosis in at-risk populations: a systematic review and economic evaluation. Health Technol Assess. 2009;13(23):iii, ix-xi, 1-126.
- 164 - Cherfane CE, Hollenbeck RD, Go J, Brown KE. Hereditary hemochromatosis: missed diagnosis or misdiagnosis? Am J Med. 2013;126(11):1010-5.
- 165 - Cooper K, Bryant J, Picot J, Clegg A, Roderick PR, Rosenberg WM, et al. A decision analysis model for di-agnostic strategies using DNA testing for hereditary haemochromatosis in at risk populations. Qjm. 2008;101(8):631-41.
- 166 - Gallego CJ, Burt A, Sundaresan AS, Ye Z, Shaw C, Crosslin DR, et al. Penetrance of Hemochromatosis in HFE Genotypes Resulting in p.Cys282Tyr and p.[Cys282Tyr];[His63Asp] in the eMERGE Network. Am J Hum Genet. 2015;97(4):512-20.
- 167 - Gianesin B, Zefiro D, Musso M, Rosa A, Bruzzone C, Balocco M, et al. Measurement of liver iron overload: noninvasive calibration of MRI-R2 by magnetic iron detector susceptometer. Magn Reson Med. 2012;67(6):1782-6.
- 168 - Kingston J, Bowen D, Sweeney M, Lawless S, Jackson H, Worwood M. Heteroduplex analysis for the three common HFE variants: methodology, reliability and analysis of over 5000 requests for testing. J Clin Pathol. 2007;60(11):1244-8.
- 169 - Kreeftenberg HG, Jr., Mooyaart EL, Huizenga JR, Sluiter WJ. Quantification of liver iron concentration with magnetic resonance imaging by combining T1-, T2-weighted spin echo sequences and a gradient echo sequence. Neth J Med. 2000;56(4):133-7.
- 170 - McGrath JS, Deugnier Y, Moirand R, Jouanolle AM, Chakrabarti S, Adams PC. A nomogram to predict C282Y hemochromatosis. J Lab Clin Med. 2002;140(1):6-8.
- 171 - Przygodzki RM, Goodman ZD, Rabin L, Centeno JA, Liu Y, Hubbs AE, et al. Hemochromatosis (HFE) gene sequence analysis of formalin-fixed, paraffin-embedded liver biopsy specimens. Mol Diagn. 2001;6(4):227-32.
- 172 - Sarigianni M, Liakos A, Vlachaki E, Paschos P, Athanasiadou E, Montori VM, et al. Accuracy of magnetic resonance imaging in diagnosis of liver iron overload: a systematic review and meta-analysis. Clin Gas-troenterol Hepatol. 2015;13(1):55-63.e5.
- 173 - St Pierre TG, Clark PR, Chua-anusorn W, Fleming AJ, Jeffrey GP, Olynyk JK, et al. Noninvasive measure-ment and imaging of liver iron concentrations using proton magnetic resonance. Blood. 2005;105(2):855-61.
- 174 - Tziomalos K, Perifanis V. Liver iron content determination by magnetic resonance imaging. World J Gas-troenterol. 2010;16(13):1587-97.
- 175 - Runge JH, Akkerman EM, Troelstra MA, Nederveen AJ, Beuers U, Stoker J. Comparison of clinical MRI liver iron content measurements using signal intensity ratios, R 2 and R 2. Abdom Radiol (NY). 2016;41(11):2123-31.
- 176 - Beaton MD, Adams PC. Treatment of hyperferritinemia. Ann Hepatol. 2012;11(3):294-300.
- 177 - Tiniakos G, Williams R. Cirrhotic process, liver cell carcinoma and extrahepatic malignant tumors in idio-pathic haemochromatosis. Study of 71 patients treated with venesection therapy. Appl Pathol. 1988;6(2):128-38.
- 178 - Milman N, Pedersen P, a Steig T, Byg KE, Graudal N, Fenger K. Clinically overt hereditary hemochromatosis in Denmark 1948-1985: epidemiology, factors of significance for long-term survival, and causes of death in 179 patients. Ann Hematol. 2001;80(12):737-44.
- 179 - Niederau C, Fischer R, Purschel A, Stremmel W, Haussinger D, Strohmeyer G. Long-term survival in pa-tients with hereditary hemochromatosis. Gastroenterology. 1996;110(4):1107-19.
- 180 - Niederau C, Fischer R, Sonnenberg A, Stremmel W, Trampisch HJ, Strohmeyer G. Survival and causes of death in cirrhotic and in noncirrhotic patients with primary hemochromatosis. N Engl J Med. 1985;313(20):1256-62.
- 181 - Morrison ED, Brandhagen DJ, Phatak PD, Barton JC, Krawitt EL, El-Serag HB, et al. Serum ferritin level predicts advanced hepatic fibrosis among U.S. patients with phenotypic hemochromatosis.[Erratum appears in Ann Intern Med. 2003 Aug 5;139(3):235], [Summary for patients in Ann Intern Med. 2003 Apr 15;138(8):I1; PMID: 12693917]. Ann Intern Med. 2003;138(8):627-33.
- 182 - Barton JC, Barton JC, Acton RT, So J, Chan S, Adams PC. Increased risk of death from iron overload among 422 treated probands with HFE hemochromatosis and serum levels of ferritin greater than 1000 mug/L at diagnosis. Clin Gastroenterol Hepatol. 2012;10(4):412-6.
- 183 - Bardou-Jacquet E, Laine F, Guggenbuhl P, Morcet J, Jezequel C, Guyader D, et al. Worse Outcomes of Patients With HFE Hemochromatosis With Persistent Increases in Transferrin Saturation During Mainte-nance Therapy. Clin Gastroenterol Hepatol. 2017.
- 184 - Barton JC. Should we treat individuals homozygous for HFE p.Cys282Tyr with ferritin 300-1000 mug/L? Lancet Haematol. 2017;4(12):e569-e70.
- 185 - Ong SY, Gurrin LC, Dolling L, Dixon J, Nicoll AJ, Wolthuizen M, et al. Reduction of body iron in HFE-related haemochromatosis and moderate iron overload (Mi-Iron): a multicentre, participant-blinded, randomised controlled trial. Lancet Haematol. 2017;4(12):e607-e14.
- 186 - Bolan CD, Conry-Cantilena C, Mason G, Rouault TA, Leitman SF. MCV as a guide to phlebotomy therapy for hemochromatosis. Transfusion. 2001;41(6):819-27.
- 187 - Ong SY, Dolling L, Dixon JL, Nicoll AJ, Gurrin LC, Wolthuizen M, et al. Should HFE p.C282Y homozygotes with moderately elevated serum ferritin be treated? A randomised controlled trial comparing iron reduction with sham treatment (Mi-iron). BMJ Open. 2015;5(8):e008938.
- 188 - Bardou-Jacquet E, Morcet J, Manet G, Laine F, Perrin M, Jouanolle AM, et al. Decreased cardiovascular and extrahepatic cancer-related mortality in treated patients with mild HFE hemochromatosis. J Hepatol. 2015;62(3):682-9.
- 189 - Zoller H, Finkenstedt A. Should C282Y homozygotes with mild iron overload be treated? J Hepatol. 2015;62(3):510-1.
- 190 - Delatycki MB, Gurrin LC, Ong SY, Ramm GA, Anderson GJ, Olynyk JK, et al. Reduced mortality due to phlebotomy in moderately iron-loaded HFE haemochromatosis? The need for clinical trials. J Hepatol. 2015;63(1):282-3.
- 191 - van Dijk BA, Laarakkers CM, Klaver SM, Jacobs EM, van Tits LJ, Janssen MC, et al. Serum hepcidin levels are innately low in HFE-related haemochromatosis but differ between C282Y-homozygotes with elevated and normal ferritin levels. Br J Haematol. 2008;142(6):979-85.
- 192 - Girelli D, Trombini P, Busti F, Campostrini N, Sandri M, Pelucchi S, et al. A time course of hepcidin re-sponse to iron challenge in patients with HFE and TFR2 hemochromatosis. Haematologica. 2011;96(4):500-6.
- 193 - Adams PC. Is there a threshold of hepatic iron concentration that leads to cirrhosis in C282Y hemochro-matosis? Am J Gastroenterol. 2001;96(2):567-9.
- 194 - Casanova-Esteban P, Guiral N, Andres E, Gonzalvo C, Mateo-Gallego R, Giraldo P, et al. Effect of phlebotomy on lipid metabolism in subjects with hereditary hemochromatosis. Metabolism. 2011;60(6):830-4.
- 195 - Liu J, Sun B, Yin H, Liu S. Hepcidin: A Promising Therapeutic Target for Iron Disorders: A Systematic Re-view. Medicine (Baltimore). 2016;95(14):e3150.
- 196 - Verhaegh PL, Moris W, Koek GH, van Deursen CT. The modified iron avidity index: a promising phenotypic predictor in HFE-related haemochromatosis. Liver Int. 2016;36(10):1535-9.
- 197 - Le Lan C, Loreal O, Cohen T, Ropert M, Glickstein H, Laine F, et al. Redox active plasma iron in C282Y/C282Y hemochromatosis. Blood. 2005;105(11):4527-31.
- 198 - Danjou F, Cabantchik ZI, Origa R, Moi P, Marcias M, Barella S, et al. A decisional algorithm to start iron chelation in patients with beta thalassemia. Haematologica. 2014;99(3):e38-40.
- 199 - Hutchinson C, Geissler CA, Powell JJ, Bomford A. Proton pump inhibitors suppress absorption of dietary non-haem iron in hereditary haemochromatosis. Gut. 2007;56(9):1291-5.
- 200 - Poullin P, Lefevre PA. [Effectiveness of therapeutic erythrocytapheresis to achieve iron depletion in hereditary type 1 hemochromatosis: report of 30 cases]. Transfus Clin Biol. 2011;18(5-6):553-8.
- 201 - Rombout-Sestrienkova E, Nieman FH, Essers BA, van Noord PA, Janssen MC, van Deursen CT, et al. Erythrocytapheresis versus phlebotomy in the initial treatment of HFE hemochromatosis patients: results from a randomized trial. Transfusion. 2012;52(3):470-7.
- 202 - Sundic T, Hervig T, Hannisdal S, Assmus J, Ulvik RJ, Olaussen RW, et al. Erythrocytapheresis compared with whole blood phlebotomy for the treatment of hereditary haemochromatosis. Blood Transfus. 2014;12 Suppl 1:s84-9.
- 203 - van Aerts RM, van Deursen CT, Koek GH. Proton Pump Inhibitors Reduce the Frequency of Phlebotomy in Patients With Hereditary Hemochromatosis. Clin Gastroenterol Hepatol. 2016;14(1):147-52.
- 204 - Buzzetti E, Kalafateli M, Thorburn D, Davidson BR, Tsochatzis E, Gurusamy KS. Interventions for heredi-tary haemochromatosis: an attempted network meta-analysis. Cochrane Database Syst Rev. 2017;3:CD011647.
- 205 - Rombout-Sestrienkova E, De Jonge N, Martinakova K, Klopping C, van Galen KP, Vink A, et al. End-stage cardiomyopathy because of hereditary hemochromatosis successfully treated with erythrocytapheresis in combination with left ventricular assist device support. Circ Heart Fail. 2014;7(3):541-3.
- 206 - Moretti D, van Doorn GM, Swinkels DW, Melse-Boonstra A. Relevance of dietary iron intake and bioa-vailability in the management of HFE hemochromatosis: a systematic review. Am J Clin Nutr. 2013;98(2):468-79.
- 207 - Doorn GMv, Gosselink IMG. Voedingsadvies bij HFE-hemochromatose. Wageningen: Wetenschapswinkel, Wageningen UR; 2011.
- 208 - Olsson KS, Vaisanen M, Konar J, Bruce A. The effect of withdrawal of food iron fortification in Sweden as studied with phlebotomy in subjects with genetic hemochromatosis. Eur J Clin Nutr. 1997;51(11):782-6.
- 209 - Cade JE, Moreton JA, O'Hara B, Greenwood DC, Moor J, Burley VJ, et al. Diet and genetic factors associ-ated with iron status in middle-aged women. Am J Clin Nutr. 2005;82(4):813-20.
- 210 - Milward EA, Baines SK, Knuiman MW, Bartholomew HC, Divitini ML, Ravine DG, et al. Noncitrus fruits as novel dietary environmental modifiers of iron stores in people with or without HFE gene mutations. Mayo Clin Proc. 2008;83(5):543-9.
- 211 - Hutchinson C, Conway RE, Bomford A, Hider RC, Powell JJ, Geissler CA. Post-prandial iron absorption in humans: comparison between HFE genotypes and iron deficiency anaemia. Clin Nutr. 2008;27(2):258-63.
- 212 - Adams PC, Agnew S. Alcoholism in hereditary hemochromatosis revisited: prevalence and clinical consequences among homozygous siblings. Hepatology. 1996;23(4):724-7.
- 213 - Adams PC, Speechley M, Kertesz AE. Long-term survival analysis in hereditary hemochromatosis. Gastroenterology. 1991;101(2):368-72.
- 214 - Niederau C, Fischer R, Sonnenberg A, Stremmel W, Trampisch HJ, Strohmeyer G. Survival and causes of death in cirrhotic and in noncirrhotic patients with primary hemochromatosis. N Engl J Med. 1985;313(20):1256-62.
- 215 - Scotet V, Merour MC, Mercier AY, Chanu B, Le Faou T, Raguenes O, et al. Hereditary hemochromatosis: effect of excessive alcohol consumption on disease expression in patients homozygous for the C282Y mutation. Am J Epidemiol. 2003;158(2):129-34.
- 216 - Vanclooster A, van Deursen C, Jaspers R, Cassiman D, Koek G. Proton Pump Inhibitors Decrease Phlebotomy Need in HFE Hemochromatosis: Double-Blind Randomized Placebo-Controlled Trial. Gastroenterology. 2017;153(3):678-80 e2.
- 217 - Xie Y, Bowe B, Li T, Xian H, Yan Y, Al-Aly Z. Risk of death among users of Proton Pump Inhibitors: a longi-tudinal observational cohort study of United States veterans. BMJ Open. 2017;7(6):e015735.
- 218 - Walters GO, Jacobs A, Worwood M, Trevett D, Thomson W. Iron absorption in normal subjects and pa-tients with idiopathic haemochromatosis: relationship with serum ferritin concentration. Gut. 1975;16(3):188-92.
- 219 - Mainous AG, 3rd, Wells B, Carek PJ, Gill JM, Geesey ME. The mortality risk of elevated serum transferrin saturation and consumption of dietary iron. Ann Fam Med. 2004;2(2):139-44.
- 220 - Bezwoda WR, Disler PB, Lynch SR, Charlton RW, Torrance JD, Derman D, et al. Patterns of food iron ab-sorption in iron-deficient white and indian subjects and in venesected haemochromatotic patients. Br J Haematol. 1976;33(3):425-36.
- 221 - Lynch SR, Skikne BS, Cook JD. Food iron absorption in idiopathic hemochromatosis. Blood. 1989;74(6):2187-93.
- 222 - van Aerts RM, van Deursen CT, Koek GH. Proton Pump Inhibitors Reduce the Frequency of Phlebotomy in Patients With Hereditary Hemochromatosis. Clin Gastroenterol Hepatol. 2016;14(1):147-52.
- 223 - De Buck E, Pauwels NS, Dieltjens T, Compernolle V, Vandekerckhove P. Is blood of uncomplicated hemochromatosis patients safe and effective for blood transfusion? A systematic review. J Hepatol. 2012;57(5):1126-34.
- 224 - Winters AC, Tremblay D, Arinsburg S, Mascarenhas J, Schiano TD. Reassessing the Safety Concerns of Utilizing Blood Donations from Patients with Hemochromatosis. Hepatology. 2017.
- 225 - Aleman S, Endalib S, Stal P, Loof L, Lindgren S, Sandberg-Gertzen H, et al. Health check-ups and family screening allow detection of hereditary hemochromatosis with less advanced liver fibrosis and survival comparable with the general population. Scand J Gastroenterol. 2011;46(9):1118-26.
- 226 - Bulaj ZJ, Ajioka RS, Phillips JD, LaSalle BA, Jorde LB, Griffen LM, et al. Disease-related conditions in rela-tives of patients with hemochromatosis. N Engl J Med. 2000;343(21):1529-35.
- 227 - El-Serag HB, Inadomi JM, Kowdley KV. Screening for hereditary hemochromatosis in siblings and children of affected patients. A cost-effectiveness analysis. Ann Intern Med. 2000;132(4):261-9.
- 228 - Gleeson F, Ryan E, Barrett S, Crowe J. Clinical expression of haemochromatosis in Irish C282Y homozy-gotes identified through family screening. Eur J Gastroenterol Hepatol. 2004;16(9):859-63.
- 229 - Jacobs EM, Hendriks JC, Marx JJ, van Deursen CT, Kreeftenberg HG, de Vries RA, et al. Morbidity and mortality in first-degree relatives of C282Y homozygous probands with clinically detected haemochro-matosis compared with the general population: the HEmochromatosis FAmily Study (HEFAS). Neth J Med. 2007;65(11):425-33.
- 230 - Jacobs EM, Hendriks JC, van Deursen CT, Kreeftenberg HG, de Vries RA, Marx JJ, et al. Severity of iron overload of proband determines serum ferritin levels in families with HFE-related hemochromatosis: the HEmochromatosis FAmily Study. J Hepatol. 2009;50(1):174-83.
- 231 - Jin F, Qu LS, Shen XZ. Association between C282Y and H63D mutations of the HFE gene with hepatocellular carcinoma in European populations: a meta-analysis. J Exp Clin Cancer Res. 2010;29:18.
- 232 - McCune CA, Ravine D, Carter K, Jackson HA, Hutton D, Hedderich J, et al. Iron loading and morbidity among relatives of HFE C282Y homozygotes identified either by population genetic testing or presenting as patients. Gut. 2006;55(4):554-62.
- 233 - Nelson RL, Persky V, Davis F, Becker E. Risk of disease in siblings of patients with hereditary hemochro-matosis. Digestion. 2001;64(2):120-4.
- 234 - Rasmussen ML, Folsom AR, Catellier DJ, Tsai MY, Garg U, Eckfeldt JH. A prospective study of coronary heart disease and the hemochromatosis gene (HFE) C282Y mutation: the Atherosclerosis Risk in Com-munities (ARIC) study. Atherosclerosis. 2001;154(3):739-46.
- 235 - Powell LW, Dixon JL, Ramm GA, Purdie DM, Lincoln DJ, Anderson GJ, et al. Screening for hemochromatosis in asymptomatic subjects with or without a family history. Arch Intern Med. 2006;166(3):294-301.
- 236 - Adams LA, Angulo P, Abraham SC, Torgerson H, Brandhagen D. The effect of the metabolic syndrome, hepatic steatosis and steatohepatitis on liver fibrosis in hereditary hemochromatosis. Liver Int. 2006;26(3):298-304.
- 237 - Asberg A, Hveem K, Kruger O, Bjerve KS. Persons with screening-detected haemochromatosis: as healthy as the general population? Scand J Gastroenterol. 2002;37(6):719-24.
- 238 - Camacho A, Funck-Brentano T, Simao M, Cancela L, Ottaviani S, Cohen-Solal M, et al. Effect of C282Y genotype on self-reported musculoskeletal complications in hereditary hemochromatosis. PLoS ONE. 2015;10(3):e0122817.
- 239 - Cruz E, Melo G, Lacerda R, Almeida S, Porto G. The CD8+ T-lymphocyte profile as a modifier of iron overload in HFE hemochromatosis: an update of clinical and immunological data from 70 C282Y homozygous subjects. Blood Cells Mol Dis. 2006;37(1):33-9.
- 240 - Donnelly SC, Joshi NG, Thorburn D, Cooke A, Reid G, Neilson M, et al. Prevalence of genetic haemochromatosis and iron overload in patients attending rheumatology and joint replacement clinics. Scott Med J. 2010;55(1):14-6.
- 241 - Ellervik C, Tybjaerg-Hansen A, Appleyard M, Sillesen H, Boysen G, Nordestgaard BG. Hereditary hemo-chromatosis genotypes and risk of ischemic stroke. Neurology. 2007;68(13):1025-31.
- 242 - Fargion S, Fracanzani AL, Piperno A, Braga M, D'Alba R, Ronchi G, et al. Prognostic factors for hepatocel-lular carcinoma in genetic hemochromatosis. Hepatology. 1994;20(6):1426-31.
- 243 - Fletcher LM, Dixon JL, Purdie DM, Powell LW, Crawford DH. Excess alcohol greatly increases the preva-lence of cirrhosis in hereditary hemochromatosis. Gastroenterology. 2002;122(2):281-9.
- 244 - Manet G, Bardou-Jacquet E, Perrin M, Morcet J, Sinteff JP, Laine F, et al. The iron reabsorption index: a new phenotypic and pathophysiological descriptor in HFE hemochromatosis. Eur J Gastroenterol Hepa-tol. 2013;25(11):1321-9.
- 245 - Moczulski DK, Grzeszczak W, Gawlik B. Role of hemochromatosis C282Y and H63D mutations in HFE gene in development of type 2 diabetes and diabetic nephropathy. Diabetes Care. 2001;24(7):1187-91.
- 246 - Paris I, Hermans M, Buysschaert M. [Endocrine complications of genetic hemochromatosis]. Acta Clin Belg. 1999;54(6):334-45.
- 247 - Rong Y, Bao W, Rong S, Fang M, Wang D, Yao P, et al. Hemochromatosis gene (HFE) polymorphisms and risk of type 2 diabetes mellitus: a meta-analysis. Am J Epidemiol. 2012;176(6):461-72.
- 248 - Ross JM, Kowalchuk RM, Shaulinsky J, Ross L, Ryan D, Phatak PD. Association of heterozygous hemo-chromatosis C282Y gene mutation with hand osteoarthritis. J Rheumatol. 2003;30(1):121-5.
- 249 - Shizukuda Y, Bolan CD, Tripodi DJ, Yau YY, Nguyen TT, Botello G, et al. Significance of left atrial contrac-tile function in asymptomatic subjects with hereditary hemochromatosis. Am J Cardiol. 2006;98(7):954-9.
- 250 - Shizukuda Y, Bolan CD, Tripodi DJ, Yau YY, Smith KP, Sachdev V, et al. Left ventricular systolic function during stress echocardiography exercise in subjects with asymptomatic hereditary hemochromatosis. Am J Cardiol. 2006;98(5):694-8.
- 251 - Shizukuda Y, Tripodi DJ, Zalos G, Bolan CD, Yau YY, Leitman SF, et al. Incidence of cardiac arrhythmias in asymptomatic hereditary hemochromatosis subjects with C282Y homozygosity. Am J Cardiol. 2012;109(6):856-60.
- 252 - Stickel F, Buch S, Zoller H, Hultcrantz R, Gallati S, Osterreicher C, et al. Evaluation of genome-wide loci of iron metabolism in hereditary hemochromatosis identifies PCSK7 as a host risk factor of liver cirrhosis. Hum Mol Genet. 2014;23(14):3883-90.
- 253 - Valenti L, Maggioni P, Piperno A, Rametta R, Pelucchi S, Mariani R, et al. Patatin-like phospholipase do-main containing-3 gene I148M polymorphism, steatosis, and liver damage in hereditary hemochromatosis. World J Gastroenterol. 2012;18(22):2813-20.
- 254 - Wood MJ, Powell LW, Dixon JL, Subramaniam VN, Ramm GA. Transforming growth factor-beta and toll-like receptor-4 polymorphisms are not associated with fibrosis in haemochromatosis. World J Gastroenterol. 2013;19(48):9366-76.
- 255 - Beaton MD, Adams PC. Prognostic factors and survival in patients with hereditary hemochromatosis and cirrhosis. Can J Gastroenterol. 2006;20(4):257-60.
- 256 - Gulati V, Harikrishnan P, Palaniswamy C, Aronow WS, Jain D, Frishman WH. Cardiac involvement in he-mochromatosis. Cardiol Rev. 2014;22(2):56-68.
- 257 - Crawford DH, Fletcher LM, Hubscher SG, Stuart KA, Gane E, Angus PW, et al. Patient and graft survival after liver transplantation for hereditary hemochromatosis: Implications for pathogenesis. Hepatology. 2004;39(6):1655-62.
- 258 - Robinson MR, Al-Kindi SG, Oliveira GH. Heart and heart-liver transplantation in patients with hemo-chromatosis. Int J Cardiol. 2017;244:226-8.
- 259 - Allen KJ, Bertalli NA, Osborne NJ, Constantine CC, Delatycki MB, Nisselle AE, et al. HFE Cys282Tyr homo-zygotes with serum ferritin concentrations below 1000 microg/L are at low risk of hemochromatosis. Hepatology. 2010;52(3):925-33.
- 260 - Ellervik C, Birgens H, Tybjaerg-Hansen A, Nordestgaard BG. Hemochromatosis genotypes and risk of 31 disease endpoints: meta-analyses including 66,000 cases and 226,000 controls. Hepatology. 2007;46(4):1071-80.
- 261 - Beutler E, Felitti V, Gelbart T, Ho N. The effect of HFE genotypes on measurements of iron overload in patients attending a health appraisal clinic.[Erratum appears in Ann Intern Med 2001 Apr 17;134(8):715]. Ann Intern Med. 2000;133(5):329-37.
- 262 - Carroll GJ, Breidahl WH, Bulsara MK, Olynyk JK. Hereditary hemochromatosis is characterized by a clini-cally definable arthropathy that correlates with iron load. Arthritis Rheum. 2011;63(1):286-94.
- 263 - Carroll GJ, Breidahl WH, Olynyk JK. Characteristics of the arthropathy described in hereditary hemo-chromatosis. Arthritis Care Res (Hoboken). 2012;64(1):9-14.
- 264 - Dever JB, Mallory MA, Mallory JE, Wallace D, Kowdley KV. Phenotypic characteristics and diagnoses of patients referred to an iron overload clinic. Dig Dis Sci. 2010;55(3):803-7.
- 265 - Crooks CJ, West J, Solaymani-Dodaran M, Card TR. The epidemiology of haemochromatosis: a popula-tion-based study. Aliment Pharmacol Ther. 2009;29(2):183-92.
- 266 - Richardson A, Prideaux A, Kiely P. Haemochromatosis: unexplained metacarpophalangeal or ankle ar-thropathy should prompt diagnostic tests: findings from two UK observational cohort studies. Scand J Rheumatol. 2017;46(1):69-74.
- 267 - Legros L, Bardou-Jacquet E, Latournerie M, Guillygomarc'h A, Turlin B, Le Lan C, et al. Non-invasive as-sessment of liver fibrosis in C282Y homozygous HFE hemochromatosis. Liver Int. 2015;35(6):1731-8.
- 268 - Paparo F, Cevasco L, Zefiro D, Biscaldi E, Bacigalupo L, Balocco M, et al. Diagnostic value of real-time elastography in the assessment of hepatic fibrosis in patients with liver iron overload. Eur J Radiol. 2013;82(12):e755-61.
- 269 - Adhoute X, Foucher J, Laharie D, Terrebonne E, Vergniol J, Castera L, et al. Diagnosis of liver fibrosis using FibroScan and other noninvasive methods in patients with hemochromatosis: a prospective study. Gastroenterol Clin Biol. 2008;32(2):180-7.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 11-12-2018
Beoordeeld op geldigheid : 28-10-2018
De commissie richtlijnen van de Nederlandse Internisten Vereniging beziet jaarlijks of herziening van (delen van) deze richtlijn noodzakelijk is. Indien dat het geval is, dan spant de Nederlandse Internisten Vereniging zich ervoor in om de voorwaarden hiervoor te realiseren.
Algemene gegevens
Met ondersteuning van
PROVA
Financiering
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten.
Doel en doelgroep
Doel
Het doel van deze richtlijn is de kwaliteit van zorg en patiëntveiligheid van patiënten met (verdenking op of verhoogde kans op) hereditaire hemochromatose te waarborgen en waar mogelijk te verbeteren. In deze richtlijn worden aanbevelingen geformuleerd die professionals in de zorg hiertoe de handvaten geven.
Doelgroep
De doelgroep van deze richtlijn zijn professionals die zich bezighouden met medisch specialistische zorg voor patiënten met (verdenking op of verhoogde kans op) hereditaire hemochromatose. Hieronder worden in ieder geval verstaan: internisten, maag-darm-leverartsen, hematologen, radiologen, klinisch chemici en klinisch genetici. Maar, ook anderen kunnen deze richtlijn gebruiken.
Samenstelling werkgroep
Voor de ontwikkeling van deze richtlijn is een werkgroep geformeerd onder voorzitterschap van dr. Alexander Rennings, internist, vasculair geneeskundige, klinisch farmacoloog. In de werkgroep hadden gemandateerde vertegenwoordigers van de belangrijkste beroepsverenigingen die te maken hebben met de specialistische zorg rondom patiënten met (verdenking op of verhoogde kans op) hereditaire hemochromatose zitting. Om het patiëntenperspectief te waarborgen, hadden twee vertegenwoordigers van de Hemochromatose Vereniging Nederland eveneens zitting in de werkgroep. De werkgroep is procedureel en methodologisch ondersteund door PROVA en logistiek door het bureau van de Nederlandse Internisten Vereniging. De ontwikkeling van deze richtlijn is gefinancierd vanuit een projectbudget door de Stichting Kwaliteitsgelden Medisch Specialisten.
- Dhr. dr. Alexander Rennings, internist, vasculair geneeskundige, klinisch farmacoloog, Radboudumc, Maartenskliniek, Nijmegen, voorzitter
- Mw. drs. Mariska Tuut, epidemioloog, PROVA, Varsseveld, secretaris
- Dhr. dr. Cees van Deursen, internist, Zuyderland Medisch Centrum, Heerlen, Maastricht UMC+, Maastricht
- Mw. dr. Esther Jacobs, internist-hematoloog, Elkerliek Ziekenhuis, Helmond
- Mw. prof. dr. Dorine Swinkels, arts klinische chemie, Radboudumc, Nijmegen
- Mw. drs. Khalida Soufidi, MDL-arts, Zuyderland Medisch Centrum, Heerlen
- Dhr. dr. Menno van der Waart, biochemicus, hemochromatose patiënt, bestuurslid van de Hemochromatose Vereniging Nederland, Oss
- Dhr. drs. Henk Jacobs, arts, hemochromatose patiënt, voorzitter van de Hemochromatose Vereniging Nederland, Hapert
- Dhr. dr. Jacques Giltay, klinisch geneticus, UMC Utrecht
- Dhr. drs. Sebastiaan van Koeverden, radioloog, Radboudumc, Nijmegen
Belangenverklaringen
Alle leden van de werkgroep hebben een belangenverklaring ingevuld. Hieruit bleken geen beperkingen voor deelname aan de werkgroep.
|
Naam |
Hoofdfunctie |
Nevenfunctie |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis-valorisatie |
Overige belangen |
|
Alexander Rennings |
Internist Radboudumc en St. Maartenskliniek |
Lid werkgroep geneesmiddelen van de Orde |
- |
- |
Voor mijn aanstelling binnen het Radboudumc waarbij ik de voortrekkersrol heb voor de patiëntenzorg hemochromatose is het belangrijk dat ik mij daarin landelijk profileer Medisch adviseur HVN, vergoeding: onkosten |
- |
- |
Werk in het Radboudumc nauw samen met Dorine Swinkels binnen het expertisecentrum ijzerstofwisselingsziekten |
|
Mariska Tuut |
Eigenaar PROVA |
- |
- |
- |
- |
- |
- |
- |
|
Cees van Deursen |
Internist Zuyderland MC |
- |
- |
- |
Medisch adviseur HVN, sinds 2000, vergoeding: onkosten |
- |
- |
- |
|
Esther Jacobs |
Internist-hematoloog |
Lid commissie richtlijnen NvVH |
- |
- |
Medisch adviseur HVN, vergoeding: onkosten |
- |
- |
- |
|
Dorine Swinkels |
Hoogleraar experimentele klinische chemie |
- |
- |
- |
Lid Medische Adviesraad HVN, sinds 1999, vergoeding: pro deo Primus inter pares van het Radboudumc expertisecentrum zeldzame aandoeningen van de ijzerstofwisseling |
- |
Ik ben een werknemer van het Radboudumc dat analyses van het ijzerhormoon hepcidine en ijzergenen aanbiedt voor wetenschappelijk onderzoek, patiëntenzorg en farmaceutische industrie |
- |
|
Khalida Soufidi |
Maag Darm en Leverarts |
- |
- |
- |
- |
- |
- |
- |
|
Jacques Giltay |
Klinisch geneticus |
- |
- |
- |
- |
- |
- |
- |
|
Menno van der Waart |
Bestuurslid HVN |
Lid Bondsraad Consumentenbond |
- |
- |
Lid bestuur HVN, speerpunt P&R, sinds 2015, vergoeding: onkosten |
- |
- |
- |
|
Henk Jacobs |
Voorzitter HVN |
- |
- |
- |
Lit bestuur HVN, vergoeding: onkosten |
- |
- |
- |
|
Sebastiaan van Koeverden |
Radioloog Radboudumc |
|
- |
- |
- |
- |
- |
- |
Methode ontwikkeling
Evidence based
Implementatie
Gedurende het hele proces van richtlijnontwikkeling is rekening gehouden met implementatie van de richtlijn in de praktijk, bijvoorbeeld bij de samenstelling van de werkgroep, de brede knelpunteninventarisatie en de uitgebreide commentaarronde.
Na autorisatie van de richtlijn wordt deze ten minste op de website van de Nederlandse Internisten Vereniging gepubliceerd. Ook andere deelnemende partijen zijn vrij de richtlijn op hun website te publiceren. De richtlijn wordt ter publicatie aangeboden aan www.richtlijnendatabase.nl. Daarnaast wordt getracht samenvattingen van de richtlijn in Nederlandse tijdschriften te publiceren, aandacht aan de richtlijn te besteden op congressen, en nascholingsmateriaal en voorlichtingsmateriaal te ontwikkelen, om zo de implementatie van de richtlijn te bevorderen.
In aansluiting op de informatie in deze richtlijn is een keuzekaart ontwikkeld, een keuzehulp die patiënten kan helpen bij de keuze tussen verschillende vormen van behandeling.
Werkwijze
Knelpunteninventarisatie
In een invitational conference, gehouden op 17 februari 2016 zijn knelpunten in de zorg voor patiënten met (verdenking op of verhoogde kans op) hereditaire hemochromatose geïnventariseerd. Voor deze invitational conference waren de volgende partijen uitgenodigd:
- Werkgroepleden
- Nederlandse Vereniging voor Radiologie
- Nederlandse Vereniging voor Reumatologie
- Nederlands Huisartsen Genootschap
- Nederlandse Vereniging voor Pathologie
- Sanquin
- Zorgverzekeraars Nederland
- Nederlandse Vereniging van Ziekenhuizen
- Nederlandse Federatie van Universitair Medische Centra
- Nefarma
- ZorgInstituut Nederland
- Patiëntenfederatie Nederland
- Inspectie voor de Gezondheidszorg
- Nederlandse ZorgAutoriteit
- Verpleegkundigen & Verzorgenden Nederland
- Nederlandse Vereniging van ZiekenhuisApothekers
- Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie
De richtlijnwerkgroep heeft in de eerste werkgroepvergadering eveneens knelpunten geïdentificeerd. Deze zijn in de invitational conference ter commentaar voorgelegd aan de deelnemers.
In de tweede vergadering van de richtlijnwerkgroep zijn de in de richtlijn te behandelen knelpunten en uitgangsvragen vastgesteld.
Uitwerking knelpunten en uitgangsvragen in conceptrichtlijn
Om de uitgangsvragen te beantwoorden is op systematische wijze per uitgangsvraag de evidence beoordeeld (zie hiervoor de inhoudelijke modules). Hierbij is gebruik gemaakt van de GRADE methodiek. Voor achtergrondinformatie hierover wordt verwezen naar de Nederlandse handleiding voor het gebruik van GRADE.(2) De evidence is samengevat door de epidemioloog in de werkgroep, met inhoudelijke input en feedback van de inhoudelijk experts in de werkgroep. Per uitgangsvraag was hiervoor een aantal ‘ambassadeurs’ aangewezen. De praktische overwegingen en conceptaanbevelingen zijn voorbereid door deze ‘ambassadeurs’ per uitgangsvraag. De aanbevelingen, en de gehele conceptrichtlijn, zijn plenair door de werkgroep vastgesteld.
Integratie oude richtlijn
Relevante delen uit de richtlijn hereditaire hemochromatose uit 2007 zijn enigszins geactualiseerd in deze nieuwe richtlijn geïntegreerd.(1) Voor deze delen van de tekst is geen systematisch literatuuronderzoek gedaan. Deze teksten kennen een wat andere opbouw in vergelijking met de paragrafen over de nieuwe knelpunten. Per module is aangegeven of dit nieuwe of geactualiseerde tekst betreft.
Procedure voor commentaar en autorisatie
De conceptrichtlijn is ter commentaar aangeboden aan alle partijen die bij de knelpunteninventarisatie om input gevraagd zijn. Het binnengekomen commentaar is door de werkgroep beoordeeld en verwerkt in de richtlijn. Daarbij is beargumenteerd welke commentaren wel en welke niet zijn overgenomen.
Daarna is de richtlijn ter autorisatie voorgelegd aan de partijen die in de werkgroep vertegenwoordigd zijn. De richtlijn is geautoriseerd door de Nederlandse Internisten Vereniging, de Hemochromatose Vereniging Nederland, de Nederlandse Vereniging van Maag-Darm-Leverartsen, de Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, de Nederlandse Vereniging voor Radiologie en de Vereniging Klinische Genetica Nederland.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence' gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Na autorisatie van de richtlijn door een beroepsvereniging, wordt de richtlijn gezien als deel van de ‘professionele standaard'. Aangezien de aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt', kunnen zorgverleners op basis van hun professionele autonomie waar nodig afwijken van de richtlijn. Afwijken van richtlijnen kan in bepaalde situaties zelfs noodzakelijk zijn. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
Zoekverantwoording
De literatuursearch voor alle uitgangsvragen is uitgevoerd op 8 november 2016, in Medline.
Searchstrategie
1 Hemochromatosis/ (7619)
2 (h?emochromatos?s or (iron adj3 storage adj3 disorder?)).tw. (7832)
3 (h?emochromatos?s or (iron adj3 storage adj3 disorder?)).kf. (1234)
4 or/1-3 (9802)
5 (dutch or english or german or french).la. (24050408)
6 4 and 5 (8809)
7 DIAGNOSTIC STUDIES.ti. (363)
8 exp "Sensitivity and Specificity"/ (493164)
9 sensitivity.tw. (646587)
10 specificity.tw. (383918)
11 ((pre-test or pretest) adj probability).tw. (1709)
12 post-test probability.tw. (453)
13 predictive value$.tw. (85473)
14 likelihood ratio$.tw. (11824)
15 (false adj (negative$1 or positive$1)).ti,ab. (64995)
16 or/8-15 (1263237)
17 6 and 16 (407)
18 Phlebotomy/ (2685)
19 (phlebotom* or (blood adj3 letting)).tw. (7242)
20 (phlebotom* or (blood adj3 letting)).kf. (399)
21 or/18-20 (9044)
22 17 and 21 (42)
23 exp Magnetic Resonance Imaging/ (365884)
24 magnetic resonance imaging.tw. (171335)
25 mri.tw. (182025)
26 magnetic resonance imaging.kf. (13831)
27 mri.kf. (13950)
28 or/23-27 (468224)
29 17 and 28 (49)
30 c282Y.ti. (382)
31 limit 30 to medline (356)
32 HFE protein.rn. (1802)
33 HFE protein.tw. (106)
34 Hemochromatosis/ge (3318)
35 ((C282Y adj3 mutat*) or (H63D adj3 mutat*)).tw. (1074)
36 ((C282Y adj3 mutat*) or (H63D adj3 mutat*)).kf. (2)
37 HFE protein.kf. (2)
38 or/32-37 (4129)
39 c282Y.tw. (1492)
40 38 or 39 (4209)
41 17 and 40 (201)
42 22 or 29 or 41 (258)=vr1 diagnose
43 from 42 keep 1-251 (251)
44 lifetime risk.ti. (255)
45 6 and 44 (0)
46 lifetime risk.tw. (2933)
47 6 and 46 (4)
48 (familial adj3 risk).tw. (3464)
49 Genetic Testing/ (31149)
50 Genetic Counseling/ (12823)
51 (genetic adj3 test*).tw. (21989)
52 (genetic adj3 test*).kf. (867)
53 Genetic Predisposition to Disease/ (112385)
54 (genetic adj3 predisposi*).tw. (12280)
55 (genetic adj3 predisposi*).kf. (200)
56 or/48-55 (168365)
57 6 and 56 (795)
58 Morbidity/ (26762)
59 morbidit*.tw. (310642)
60 morbidit*.kf. (4536)
61 symptomat*.ti. (25867)
62 clinical express*.tw. (4351)
63 (iron adj3 storage?).tw. (2506)
64 (iron adj3 storage?).kf. (18)
65 or/58-64 (355925)
66 57 and 65 (74)
67 66 (74)
68 limit 67 to humans (66)
69 53 or 54 or 55 (120880)
70 exp risk/ (989087)
71 risk.tw,kf. (1601466)
72 70 or 71 (2010894)
73 6 and 69 and 72 (142)
74 "mccune $".fc_auts. and "2006".fc_pubyr. and "554".fc_pg. (1)
75 (clinical adj3 penetran*).tw. (297)
76 (disease adj3 expres*).tw. (10845)
77 (disease adj3 expres*).kf. (3)
78 (clinical adj3 express*).tw. (12276)
79 (clinical adj3 express*).kf. (5)
80 Phenotype/ (200882)
81 phenotyp*.tw,kf. (458879)
82 or/75-81 (556221)
83 6 and 82 (810)
84 6 and 69 and 82 (71)
85 57 and 82 (203)
86 exp Family Health/ or exp Family Characteristics/ (78396)
87 72 or 86 (2071440)
88 85 and 87 (79)
89 di.fs. (2255566)
90 83 and 89 (223)
91 exp nuclear family/ or siblings/ (109091)
92 83 and 91 (3)
93 (family or relative* or sibling?).tw. (1789001)
94 (family or relative* or sibling?).kf. (44803)
95 91 or 93 or 94 (1889278)
96 6 and 95 (953)
97 82 and 96 (202)
98 ge.fs. (2916721)
99 iron.kf,tw. (155301)
100 97 and 99 (172)
101 65 and 96 (84)
102 101 (84)
103 limit 102 to humans (78)= vr2 familie onderzoek
104 from 103 keep 1-76 (76)
105 (compound adj3 heterozyg*).tw. (8079)
106 (compound adj3 heterozyg*).kf. (68)
107 105 or 106 (8088)
108 6 and 107 (285)
109 Iron Overload/ (3634)
110 Hemosiderosis/ (2502)
111 ((iron adj3 overload) or hemosideros?s).tw. (9671)
112 ((iron adj3 overload) or hemosideros?s).kf. (842)
113 or/109-112 (11828)
114 63 or 64 or 113 (13950)
115 6 and 113 and 107 (161)=vr3 compound heterozygotie
116 from 115 keep 1-157 (157)
117 "ong$".fc_auts. and "hfe".fc_titl. and "2015".fc_pubyr. (3)
118 exp Ferritins/ (18154)
119 ferritin?.tw,kf. (24020)
120 Blood Component Removal/ (4080)
121 (blood adj3 component adj3 removal?).tw. (5)
122 (apheres?s or pheres?s).tw. (6225)
123 (apheres?s or pheres?s).kf. (327)
124 118 or 119 (28469)
125 120 or 121 or 122 or 123 (8018)
126 21 or 125 (16994)
127 6 and 124 and 126 (338)
128 normali?ation?.tw,kf. (42872)
129 127 and 128 (18)
130 (target* or limit* or value? or concentrati* or level*).tw,kf. (6929742)
131 128 or 130 (6948928)
132 127 and 131 (237)
133 from 132 keep 10 (1)
134 132 (237)
135 limit 134 to humans (218)
136 (target* or limit* or value? or concentrati* or level*).ti,kf. (831089)
137 135 and 136 (18)
138 exp Ferritins/bl (8832)
139 136 or 138 (838468)
140 135 and 139 (119)= vr 4 en 5 ferritine waarden
141 from 140 keep 1-116 (116)
142 erythrocytopheresis.mp. (7)
143 Eryt?rocytap?ere*.tw,kf. (181)
144 (proton adj3 pump adj5 inhibit*).tw,kf. (11468)
145 Chelation Therapy/ (1288)
146 (chelation adj3 therap*).tw,kf. (2496)
147 21 or 143 or 144 or 145 or 146 (23723)
148 6 and 147 (887)
149 (proton adj3 pump adj5 inhibit*).ti,kf. (3802)
150 "sensitief filter voor RCT's van Cochrane".ti. (0)
151 randomized controlled trial.pt. (434822)
152 controlled clinical trial.pt. (91892)
153 (randomized or randomised).ab. (451617)
154 placebo.ab. (180951)
155 drug therapy.fs. (1923428)
156 randomly.ab. (266794)
157 trial.ab. (391050)
158 groups.ab. (1657086)
159 or/151-158 (3951645)
160 159 not (exp animals/ not humans/) (3410777)
161 "filter rct cochrane sensitief".ti. (0)
162 "filter systematic reviews".ti. (0)
163 meta analysis.pt. (75231)
164 (meta-anal$ or metaanal$).af. (133188)
165 (quantitativ$ adj10 (review$ or overview$)).tw. (6401)
166 (systematic$ adj10 (review$ or overview$)).tw. (106891)
167 (methodologic$ adj10 (review$ or overview$)).tw. (8568)
168 medline.tw. and review.pt. (61178)
169 (pooled adj3 analy*).tw. (12912)
170 or/163-169 (236246)
171 "filter systematic reviews".ti. (0)
172 "cochrane$".fc_jour. (16296)
173 170 or 172 (237879)
174 148 and (160 or 173) (170)= vr6 therapiekeuze
175 from 174 keep 1-161 (161)
176 prognosis/ or probability/ or proportional hazards models/ or uncertainty/ or likelihood functions/ or logistic models/ or proportional hazards models/ (635608)
177 ((risk adj prediction) or (predictor adj variabl??) or (increas* adj risk)).tw. (194830)
178 ((predict* and (outcome* or risk* or model*)) or ((history or variable* or criteria or scor* or characteristic* or finding* or factor*) and (predict* or model* or decision* or identi* or prognos*)) or (decision* and (model* or clinical* or (logistic adj3 models)))).tw. (2700637)
179 or/176-178 (3165615)
180 6 and 179 (1272)
181 exp Liver Cirrhosis/ (79366)
182 Carcinoma, Hepatocellular/ (69545)
183 Heart Failure/ (99052)
184 exp Diabetes Mellitus/ (362409)
185 rheumatic diseases/ or arthritis, rheumatoid/ or gout/ or osteoarthritis/ (143699)
186 Erectile Dysfunction/ (16282)
187 Libido/ (4387)
188 Sexual Dysfunction, Physiological/ (8183)
189 ((liver adj3 cirrhosis) or (hepatocellular adj3 carcin*) or (heart adj3 failure) or diabetes).tw,kf. (643780)
190 ((joint adj3 pain) or libido or impotence or amenorr*).tw,kf. (30665)
191 (hypothyroidis* or dysrhythmia*).tw,kf. (31985)
192 Hypothyroidism/ (25617)
193 exp Arrhythmias, Cardiac/ (184157)
194 Amenorrhea/ (9628)
195 or/181-194 (1245454)
196 180 and 195 (393)
197 (hypothyroidis* or dysrhythmia*).ti,kf. (14490)
198 ((joint adj3 pain) or libido or impotence or amenorr*).ti,kf. (9405)
199 ((liver adj3 cirrhosis) or (hepatocellular adj3 carcin*) or (heart adj3 failure) or diabetes).ti,kf. (328575)
200 181 or 182 or 183 or 184 or 185 or 186 or 187 or 188 or 192 or 193 or 194 or 197 or 198 or 199 (1031181)
201 180 and 200 (270)
202 case reports/ (1835398)
203 201 not 202 (247)
204 *Hemochromatosis/ (6057)
205 (h?emochromatos?s or (iron adj3 storage adj3 disorder?)).ti. (4998)
206 204 or 205 or 3 (6516)
207 203 and 206 (122)
208 Hemochromatosis/co (1596)
209 206 or 208 (6779)
210 203 and 209 (130)
211 1 or 205 or 3 (8010)
212 211 and 179 and 4 and 200 (189)
213 200 or 208 (1032082)
214 211 and 179 and 5 and 213 (250)= vraag 7 kans orgaanschade
215 from 214 keep 1-246 (246)
216 follow up.ti. (84115)
217 200 and 211 and 216 (1)
218 patient care planning/ or case management/ (45263)
219 200 and 211 and 218 (1)
220 200 and 211 (1626)
221 Follow-Up Studies/ (565907)
222 220 and 221 (36)
223 Survival Rate/ (145002)
224 200 and 211 and (221 or 223) (42)
225 200 and 211 and 173 (8)
226 224 or 225 (50) = vraag 8 follow up
Searchopbrengst
|
Naam file |
Aantal referenties |
|
Vr1 diagnose |
258 |
|
Vr2 familieonderzoek |
78 |
|
Vr3 compoundheterozygotie |
161 |
|
Vr4 en 5 ferritinewaarden |
119 |
|
Vr6 therapiekeuze |
170 |
|
Vr7 kans orgaanschade |
250 |
|
Vr8 followup systrev |
50 |
Literatuurselectie
Bij de literatuursearch is niet ingeperkt op een specifieke tijdperiode. Omdat de werkgroep verwacht dat evidence gepubliceerd vanaf 2000 van een hogere kwaliteit en beter toepasbaar is, is er bij de selectie onderscheid gemaakt in publicaties verschenen voor 2000 en publicaties verschenen vanaf 2000. Alle abstracts verschenen vanaf 2000 zijn bestudeerd, waarbij is gecontroleerd of dit abstract aansluit bij een uitgangsvraag en of het systematisch onderzoek betreft. Bij uitgangsvragen waar de selectie vanaf 2000 onvoldoende resultaat gaf, werd ook gekeken naar evidence die voor 2000 werd gepubliceerd. Dit leidde tot de selectie in onderstaande tabel. De artikelen die geselecteerd zijn voor beantwoording van de uitgangsvraag zijn in volledige tekst bestudeerd. Dit heeft geleid tot een nadere selectie, die bij de betreffende uitgangsvragen is beschreven.
|
Naam file |
Aantal referenties |
Gepubliceerd voor 2000 |
Gepubliceerd vanaf 2000 |
Geselecteerd voor beantwoording uitgangsvraag op basis van kwaliteit en inhoud |
|
Vr1 diagnose |
258 |
57 |
201 |
16 |
|
Vr2 familieonderzoek |
78 |
33 |
45 |
14 |
|
Vr3 compoundheterozygotie |
161 |
17 |
144 |
23 |
|
Vr4 en 5 ferritinewaarden |
119 |
35 |
84 |
4: 3 |
|
5: 7 |
||||
|
Vr6 therapiekeuze |
170 |
44 |
126 |
5 |
|
Vr7 kans orgaanschade |
250 |
86 |
164 |
21 |
|
Vr8 followup systrev |
50 |
22 |
28 |
2 |
