Canulatietechnieken
Uitgangsvraag
Hoe dient de perifere canulatie uitgevoerd te worden bij patiënten met een cardiogene shock die veno-arteriële ECMO behandeling moeten ondergaan?
Aanbeveling
Maak de keuze voor het toepassen van perifere percutane of chirurgische canulatie bij de veno-arteriële extracorporele membraanoxygenatie patiënt op basis van de ervaring van het team dat de canulatie uitvoert. Waarborg hierbij een goede distale beenperfusie.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de effectiviteit van chirurgische perifere canulatie vergeleken met percutane perifere canulatie bij patiënten met een cardiogene shock die VA-ECMO behandeling ondergaan. Er zijn drie cohortstudies geïncludeerd die deze vergelijking hebben onderzocht.
Op basis van de cruciale uitkomstmaat mortaliteit, uitgesplitst in overleving op dag 30 en mortaliteit in het ziekenhuis, kan geen conclusie getrokken worden voor de vergelijking tussen chirurgische perifere canulatie en percutane perifere canulatie bij patiënten met een cardiogene shock die VA-ECMO behandeling ondergaan. De bewijskracht voor deze uitkomstmaat was zeer laag. De belangrijke uitkomstmaten kunnen ook geen verdere richting geven. Enkele uitkomsten werden niet gerapporteerd in de geïncludeerde studies (perfusie van het been, trombose, vasculair trauma) of hadden een zeer lage bewijskracht (bloedingen, infecties, ischemie van het been).
De zeer lage bewijskracht werd veelal veroorzaakt door een hoog risico op bias omdat er in de gerapporteerde resultaten geen correctie is toegepast voor confounding factors en door de brede betrouwbaarheidsintervallen rondom de puntschatters. Hier bestaat een kennislacune. De keuze voor chirurgische perifere canulatie versus percutane perifere canulatie bij patiënten met een cardiogene shock die VA-ECMO behandeling ondergaan zal dan ook afhangen van andere factoren.
In de praktijk wordt de methode van canulatie bepaald op basis van de ervaring van het ECMO team.
Er zijn geen subgroepen van ECMO patiënten waarbij duidelijk de perifeer chirurgische techniek boven de perifeer percutane techniek, of vice versa, te verkiezen is. Echter, de keuze wordt gemaakt door het aanwezige ECMO team, afhankelijk van de opname indicatie en de ziekenhuislocatie waar de VA-ECMO-therapie wordt gestart.
Distale been perfusie
In de Nederlandse praktijk wordt door vele ECMO centra los van de canulatie methode middels verschillende methoden distale been perfusie gewaarborgd.
Zoals bovenstaand beschreven bleek de beschikbare vergelijkende literatuur tussen perifere chirurgische, danwel perifeer percutane canulatie zeer beperkt. Er kon geen uitspraak met voldoende bewijskracht worden gedaan over de uitkomstmaat been ischemie. Het gebruik van een distale methoden om ischemie van het been te voorkomen viel buiten de scope van deze module en werd derhalve niet systematisch onderzocht. Er is wel een grote meta-analyse (Marbach, 2022), die plaatsen van een beencanule ondersteunt. Op grond van deze meta-analyse en expertopinie van de werkgroep bevelen we overweging van distale beenperfusie aan.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het canuleren van een patiënt die ECMO-behoeftig is, is altijd een spoedsituatie bij een meestal bewusteloze of anderszins ernstig zieke patiënt. In de huidige praktijk zal de keuze voor dan wel chirurgisch, dan wel percutaan, gemaakt worden o.b.v. ervaring met een bepaalde techniek in verschillende situaties. De patiënt kan op deze gronden hier niet zelf over beslissen. Een goede afweging gericht op zo min mogelijk schade voor de patiënt zal echter ook hier gemaakt worden. De patiënt en familie worden over alle handelingen en ingrepen achteraf geïnformeerd, waarbij uitleg over de diverse keuzes kan worden gegeven.
Een behandeling met ECMO is zeer intensief en invasief, en daarom is het van groot belang continu aandacht te hebben voor optimalisatie van het comfort van de patiënt (zie ook de richtlijn Nazorg en Revalidatie van IC-Patiënten, ‘module preventie van PICS’).
Kosten (middelenbeslag)
Tussen het chirurgisch en perifeer canuleren van VA-ECMO patiënten zijn geen aantoonbare verschillen in kosten in Nederland.
Aanvaardbaarheid, haalbaarheid en implementatie
Over de haalbaarheid van percutaan en chirurgisch canuleren bij VA-ECMO patiënten bestaat geen twijfel, aangezien beide methodes gangbaar zijn in de huidige praktijk.
Alle patiënten in Nederland hebben toegang tot deze vorm van zorg. Een multidisciplinair team bepaalt of het behandelen met ECMO bij een individuele patiënt zinvol en haalbaar is.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Canuleren van VA-ECMO patiënten kan zowel perifeer chirurgisch als perifeer percutaan worden uitgevoerd. De literatuur werd onderzocht of er op basis van de vastgestelde uitkomstmaten een aanbeveling gedaan kan worden om voor de ene danwel de andere methode van canuleren te kiezen. De werkgroep komt tot de conclusie dat bij gebrek uit adequaat bewijs voor perifeer chirurgische, danwel perifeer percutane canulatie, de te verkiezen techniek wordt bepaald door de ervaring van het team dat de canulatie uitvoert. De praktijk leert dat de klinische setting en primair aanwezige medische specialisten hierin belangrijke bepalende factoren zijn.
Onderbouwing
Achtergrond
In patients with cardiogenic shock that are treated with veno-arterial extracorporeal membrane oxygenation (ECMO) and who are peripheral cannulated, the ECMO cannula can be inserted either surgical or percutaneous. Both forms of cannulation have their advantages and associated complications. In this module the net benefit between these methods is compared.
Conclusies / Summary of Findings
Mortality (critical)
30-day survival
|
Very low GRADE |
The evidence is very uncertain about the effect of surgical cannulation on 30-day survival when compared with percutaneous cannulation in patients with cardiogenic shock undergoing VA-ECMO treatment.
Source: Danial (2018), Saiydoun (2022), |
In-hospital mortality
|
Very low GRADE |
The evidence is very uncertain about the effect of surgical cannulation on in-hospital mortality when compared with percutaneous cannulation in patients with cardiogenic shock undergoing VA-ECMO treatment.
Source: Wang (2022) |
Complications (critical)
|
Very low GRADE |
The evidence is very uncertain about the effect of surgical cannulation on infection and ischemia of the leg when compared with percutaneous cannulation in patients with cardiogenic shock undergoing VA-ECMO treatment.
Source: Danial (2018), Saiydoun (2022), Wang (2022) |
|
Very low GRADE |
The evidence is very uncertain about the effect of surgical cannulation on bleeding when compared with percutaneous cannulation in patients with cardiogenic shock undergoing VA-ECMO treatment.
Source: Saiydoun (2022), Wang (2022) |
|
No GRADE |
No evidence was found regarding the effect of surgical cannulation on perfusion of the leg, thrombosis and vascular trauma when compared with percutaneous cannulation in patients with cardiogenic shock undergoing VA-ECMO treatment. |
Samenvatting literatuur
Description of studies
Danial (2018) performed a retrospective cohort study to compare complication rates and survival in patients undergoing VA-ECMO with the surgical or total percutaneous approach for cardiogenic shock. A description of both cannulation techniques can be found in the evidence tables. Included patients were aged >16 years old and had received peripheral femoro-femoral VA-ECMO (surgical or percutaneous). A total of 814 patients were included in the surgical group (n=485) and percutaneous group (n=329). Propensity score matching was used to equal the probability to receive surgical or percutaneous ECMO and thus balance patient’s baseline characteristics. After matching, each group consisted of 266 patients. The mean age in the propensity matched groups was 54.2 years (SD 14.4) in the surgical group, versus 55.2 years (SD 14.9) in the percutaneous group. There were 80 females (30%) in the surgical group, versus 70 (26%) in the percutaneous group. Overall, baseline characteristics were balanced after propensity score matching.
Saiydoun (2022) conducted a prospective cohort study to compare outcomes of patients who received VA-ECMO for refractory cardiac arrest or refractory cardiogenic shock using the percutaneous angio-guided or surgical approach. A description of both cannulation techniques can be found in the evidence tables. Patients who received VA-ECMO following cardiac surgery were excluded. A total of 120 patients were included, of which 59 underwent surgical cannulation and 61 underwent angio-guided percutaneous cannulation. The median (IQR) age of the population was 57 (47 to 66) years old and 72% of the patients were male. Not all baseline characteristics were balanced between the two groups.
Wang (2022) conducted a retrospective cohort study to compare in-hospital outcomes
in cardiogenic shock patients who received femoro-femoral VA-ECMO with percutaneous versus surgical cannulation. Adult patient >18 years who received femoro-femoral VA-ECMO with percutaneous (percutaneous group) or surgical (surgical group) cannulation primarily
for refractory cardiogenic shock were included. Patients were excluded if they received VA-ECMO during cardiopulmonary resuscitation, multiple ECMO-runs, hybrid ECMO modalities (veno-veno-arterial or veno-arterial-venous, or missing data regarding key variables: cannulation site and hospital outcome. A total of 12,592 patients met the inclusion criteria. Percutaneous cannulation was used in 9,249 patients (73%), whereas surgical cannulation was used in 3,343 cases (27%). The median (IQR) age was 57 (45 to 65) years, the median (IQR) weight was 80 (68-97) kg, and the majority of patients were white (53%) and were male (68%).
Results
Mortality (crucial)
30-day survival
Danial (2018) reported 30-day survival in the propensity matched groups: 150 out of 266 (56.3%) patients in the surgical group survived, versus 170 out of 266 (63.8%) patients in the percutaneous group. The RR for the propensity matched groups was not reported. Hence, it is not possible to interpret these results. Danial (2018) also reported the 30-day survival in the entire cohort without correction for confounding: 267 out of 485 (55%) patients in the surgical group survived, versus 190 out of 327 (58%) in the percutaneous group. The unadjusted RR was 0.95 (95% CI 0.84 to 1.07).
Saiydoun (2022) also reported 30-day survival: 10 out of 59 (17%) patients in the surgical group survived, versus 16 out of 61 (26%) patients in the percutaneous group. No adjusted RR was reported. The unadjusted RR was 0.65 (95%CI 0.32 to 1.31).
In-hospital mortality
Wang (2022) reported in-hospital mortality: 1925 out of 3343 (58%) patients in the surgical group died, versus 4881 out of 9249 (53%) patients in the percutaneous group. No adjusted RR was reported. The unadjusted RR is 1.09 (95% CI 1.05 to 1.13).
Complications (important)
Major bleeding
Danial (2018) did not report bleeding.
Saiydoun (2022) reported major bleeding. Major bleeding was defined as peri-procedural bleeding at the sites of cannulation or the sites of puncture with a drop in hemoglobin level of at least 3.0 g/dL and/or requiring transfusion (3 units of packed red blood cells). Major bleeding was reported in 18 out of 59 (31%) patients in the surgical group, versus in 4 out of 61 (7%) patients in the percutaneous group. No adjusted RR was reported. The unadjusted RR is 4.65 (95%CI 1.67 to 12.94).
Wang (2022) reported cannulation site bleeding in 582 out of 3343 (22%) patients in the surgical group, versus in 1177 out of 9249 (19%) patients in the percutaneous group. No adjusted RR was reported. The unadjusted RR is 1.37 (95% CI 1.25 to 1.50).
Infection
Danial (2018) reported ECMO-associated infections in the propensity matched groups. In total, 74 out of 266 (27.8%) patients had an ECMO-associated infection in the surgical group, versus 44 out of 266 (16.5%) patients in the percutaneous group. The RR for the propensity matched groups was not reported. Hence, it is not possible to interpret these results.
Danial (2018) also reported the local infection in the entire cohort without correction for confounding. Saiydoun (2022) reported groin infection (unadjusted data), and Wang (2022) reported systemic infection (unadjusted data). Results for the unadjusted data were pooled in Figure 1. The pooled unadjusted RR was 2.07 (95%CI 1.84 to 2.32).
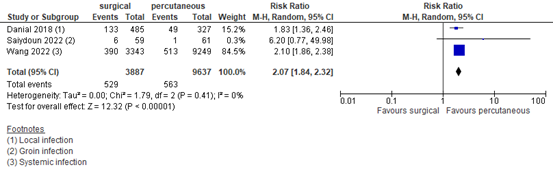
Figure 1. Infection; surgical versus percutaneous cannulation.
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Perfusion flow of the leg
No study reported perfusion flow of the leg.
Thrombosis
No study reported thrombosis.
Vascular trauma
No study reported vascular trauma.
Ischemia of the leg
Danial (2018) reported limb ischemia in the propensity matched groups. In total, 33 out of 266 (12.4%) patients had limb ischemia in the surgical group, versus 23 out of 266 (8.6%) patients in the percutaneous group. The RR for the propensity matched groups was not reported. Hence, it is not possible to interpret these results.
Danial (2018) also reported limb ischemia in the entire cohort without correction for confounding Saiydoun (2022) reported limb ischemia (unadjusted data), and Wang (2022) reported severe limb ischemia in (unadjusted data). Results for the unadjusted data were pooled in Figure 2. The pooled unadjusted RR was 1.06 (95%CI 0.62 to 1.84).
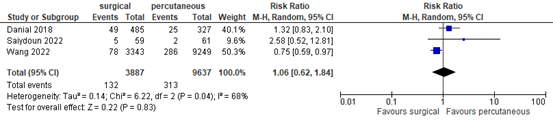
Figure 2. Ischemia of the leg; surgical versus percutaneous cannulation.
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Level of evidence of the literature
The level of evidence for all outcome measures started at LOW because of the observational study designs of the included studies.
Mortality
30-day survival
The level of evidence regarding the outcome measure ‘30-day survival’ was downgraded to very low because of study limitations due to no confounding correction (risk of bias, -1) and the confidence interval around the point estimate crossing both thresholds for clinical relevance (imprecision, -2).
In-hospital mortality
The level of evidence regarding the outcome measure ‘in-hospital mortality’ was downgraded to very low because of study limitations due to no confounding correction (risk of bias, -1).
Complications
Bleeding
The level of evidence regarding the outcome measure ‘bleeding’ was downgraded to very low because of study limitations due to no confounding correction (risk of bias, -1).
Infection
The level of evidence regarding the outcome measure ‘infection’ was downgraded to very low because of study limitations due to no confounding correction (risk of bias, -1).
Perfusion flow of the leg
The level of evidence regarding the outcome measure ‘perfusion flow of the leg’ could not be determined, as no included study reported this outcome measure.
Thrombosis
The level of evidence regarding the outcome measure ‘thrombosis’ could not be determined, as no included study reported this outcome measure.
Vascular trauma
The level of evidence regarding the outcome measure ‘vascular trauma’ could not be determined, as no included study reported this outcome measure.
Ischemia of the leg
The level of evidence regarding the outcome measure ‘ischemia of the leg’ was downgraded to very low because of study limitations due to no confounding correction (risk of bias, -1), inconsistency in the reported unadjusted RR’s (inconsistency, -1), and the confidence interval around the point estimate crossing both thresholds for clinical relevance (imprecision, -2).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the (in)effectivity of peripheral surgical cannulation compared to peripheral percutaneous cannulation in patients with cardiogenic shock undergoing veno-arterial ECMO treatment?
P: Patients with cardiogenic shock undergoing VA-ECMO treatment
I: Peripheral surgical cannulation
C: Peripheral percutaneous cannulation
O: Mortality, complications
Relevant outcome measures
The guideline development group considered mortality as a critical outcome measure for decision making; and complications as important outcome measure for decision making.
The working group defined the outcome measures as follows: complications were defined as major bleeding (two units of blood or a specific intervention), infections, perfusion flow of the leg, thrombosis, vascular trauma, and ischemia of the leg. A priori, the working group did not define the outcome measure mortality, but used the definitions used in the studies.
The working group defined the following minimal clinically (patient) important differences:
- Mortality: 0.95 ≥ RR ≥ 1.05
- Complications:
- Major bleeding: 0.91 ≥ RR ≥ 1.10
- Infections: 0.91 ≥ RR ≥ 1.10
- Perfusion flow of the leg: 0.91 > RR ≥ 1.10
- Thrombosis: 0.91 ≥ RR ≥ 1.10
- Vascular trauma, necessitating surgical or percutaneous intervention: 0.91 ≥ RR ≥ 1.10
- Ischemia of the leg: 0.91 ≥ RR ≥ 1.10
Search and select (Methods)
The databases Medline (via OVID) and Embase (via embase.com) were searched with relevant search terms from 2013 until September 18th, 2023. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 346 hits. Studies were selected based on the following criteria:
- Systematic reviews, randomized controlled trials and observational studies
- Comparing surgical with percutaneous cannulation in patients undergoing VA-ECMO
Four studies were initially selected based on title and abstract screening. After reading the full text, one study was excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
Three studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Danial, P. and Hajage, D. and Nguyen, L. S. and Mastroianni, C. and Demondion, P. and Schmidt, M. and Bouglé, A. and Amour, J. and Leprince, P. and Combes, A. and Lebreton, G. Percutaneous versus surgical femoro-femoral veno-arterial ECMO: a propensity score matched study. Intensive Care Medicine. 2018; 44 (12) :2153-2161
- Marbach JA, Faugno AJ, Pacifici S, Chweich H, Marbach JK, Rabinowitz JB, Thayer KL, Di Santo P, Kapur NK. Strategies to reduce limb ischemia in peripheral venoarterial extracorporeal membrane oxygenation: A systematic review and Meta-analysis. Int J Cardiol. 2022 Aug 15;361:77-84. doi: 10.1016/j.ijcard.2022.04.084. Epub 2022 May 9. PMID: 35523371.
- Saiydoun, G. and Gall, E. and Boukantar, M. and Fiore, A. and Mongardon, N. and Masi, P. and Bagate, F. and Radu, C. and Bergoend, E. and Mangiameli, A. and de Roux, Q. and Mekontso Dessap, A. and Langeron, O. and Folliguet, T. and Teiger, E. and Gallet, R. Percutaneous angio-guided versus surgical veno-arterial ECLS implantation in patients with cardiogenic shock or cardiac arrest. Resuscitation. 2022; 170 :92-99
- Wang, L. and Yang, F. and Zhang, S. and Li, C. and Du, Z. and Rycus, P. and Tonna, J. E. and Alexander, P. and Lorusso, R. and Fan, E. and Ogino, M. and Brodie, D. and Combes, A. and Chen, Y. S. and Qiu, H. and Peng, Z. and Fraser, J. F. and Shao, J. and Jia, M. and Wang, H. and Hou, X. Percutaneous versus surgical cannulation for femoro-femoral VA-ECMO in patients with cardiogenic shock: Results from the Extracorporeal Life Support Organization Registry. Journal of Heart and Lung Transplantation. 2022; 41 (4) :470-481
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Danial et al |
Type of study: Retrospective cohort study
Setting and country: The study was conducted at La Pitié Salpêtrière University Hospital in Paris, France
Funding and conflicts of interest: Pr. Combes reports receiving grant support and lecture fees from Maquet and Baxter and consulting fees from Hemoven. The other authors declare that they have no conflict of interest.
|
Inclusion criteria: The inclusion criteria were consecutive patients aged over 16 who received peripheral femoro femoral VA ECMO between January 2015 and December 2017 at La Pitié Salpêtrière University Hospital, Paris, France
Exclusion criteria: Patients surgically cannulated after November 2016 (n = 85, 40 under cardiopulmonary resuscitation, 15 during the transition period and 30 for failure of percutaneous approach) were excluded from the study
N total at baseline: Intervention (surgical): 485 Control (percutaneous): 329
After propensity score matching, both groups held 266 patients.
Important prognostic factors: Before matching age (yrs) ± SD: I: 53.6 ± 14.3 C: 55.8 ± 14.5
Sex, female, n (%) I: 145 (30) C: 88 (27)
BMI, km/m2, mean ± SD: I: 26.4 ± 5.6 C: 26.8 ± 5.3
After matching age (yrs) ± SD: I: 54.2 ± 14.4 C: 55.2 ± 14.9
Sex, female, n (%) I: 80 (30) C: 70 (26)
BMI, km/m2, mean ± SD: I: 26.4 ± 5.5 C: 26.5 ± 5.0
Groups comparable at baseline? Groups comparable after propensity score matching.
|
Describe intervention (treatment/procedure/test):
“Femoral vessels were cannulated using an arterial cannula (Maquet®, 23 cm, 15–19 F) inserted into the common femoral artery and a venous cannula ( Maquet®, 55 cm, 23–29 F) into the common femoral vein. An additional anterograde perfusion cannula (Terumo® 5 F or Selidcath ® 5 F) was systematically inserted into the superficial femoral artery to prevent leg ischemia. Prophylactic antibiotic therapy was not used for peripheral cannulation (unless the patient received ECMO immediately before or after sternotomy for cardiac surgery or the patient was already on antibiotics at the time of cannulation).
For the surgical approach, femoral vessels were exposed with a limited transversal incision in the groin. Then, the Seldinger’s technique was used to insert arterial, venous and leg perfusion cannulas and the skin was surgically sutured. At the time of decannulation, a bolus of 5000 IU of heparin was injected, the operative field was reopened, vessels controlled, cannulas removed and cannulation sutures tied. Reconstructive procedures were performed if needed (bleeding, arterial tear) and were considered a vascular decannulation complication.
In the days following surgical or percutaneous decannulation, Doppler ultrasound was performed in case of clinical suspicion of false aneurysm or arteriovenous fistula.”
|
Describe control (treatment/procedure/test):
“Femoral vessels were cannulated using an arterial cannula (Maquet®, 23 cm, 15–19 F) inserted into the common femoral artery and a venous cannula (Maquet®, 55 cm, 23–29 F) into the common femoral vein. An additional anterograde perfusion cannula (Terumo® 5 F or Selidcath ® 5 F) was systematically inserted into the superficial femoral artery to prevent leg ischemia. Prophylactic antibiotic therapy was not used for peripheral cannulation (unless the patient received ECMO immediately before or after sternotomy for cardiac surgery or the patient was already on antibiotics at the time of cannulation).
When the percutaneous approach was used, femoral vessels were localized by Doppler ultrasound. Then, femoral and leg perfusion cannulas were percutaneously inserted under echo guidance with the Seldinger’s technique, while the ipsilateral or the contralateral femoral vein was also percutaneously cannulated.
In the days following surgical or percutaneous decannulation, Doppler ultrasound was performed in case of clinical suspicion of false aneurysm or arteriovenous fistula.”
|
Length of follow-up: 30 days
No long-term follow-up was available.
Incomplete outcome data: N.R.
|
Outcome measures and effect size (include 95%CI and p-value if available):
ECMO-associated infections Propensity matched groups I: 74 out of 266 (27.8%) C: 44 out of 266 (16.5%)
IPTW weighted populations I: 16.2% C: 28.5%
Local infection Total population I: 133 (27.4%) C: 49 (14.9%)
Limb ischemia Propensity matched groups I: 33 out of 266 (12.4%) C: 23 out of 266 (8.6%)
IPTW weighted populations I: 11.2% C: 9.6%
Total population I: 49 (10.1%) C: 25 (8.5%)
30-day survival Propensity matched groups I: 150 out of 266 (56.3%) C: 170 out of 266 (63.8%)
IPTW weighted populations I: 55.4% C: 62.9%
Total population I: 267 (55%) C: 190 (58%)
|
|
|
Saiydoun et al |
Type of study: monocentric prospective observational registry study Setting and country: Paris, France Funding and conflicts of interest: The authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in this paper. |
Inclusion criteria: The inclusion criteria were adult patients admitted at Henri Mondor University Hospital and supported with peripheral V a ECLS for refractory cardiac arrest or refractory cardiogenic shock from January 2018 to March 2021
Exclusion criteria: The exclusion criteria were patients supported by VA-ECLS following cardiac surgery
N total at baseline: I (surgical): 59 C (percutaneous): 61
Important prognostic factors: age ± SD: I: 53 (41–64) C: 60 (51–67)
Sex male: I: 39 (66%) C: 47 (77%)
BMI, kg/m2 I: 27 (23–31) C: 25 (23–28)
Groups comparable at baseline? “Patients in the percutaneous group were older (60 [51–67], vs. 53 [41–64], P = 0.007) with lower LVEF (15 [11–20] vs 26 [15–45], P < 0.0001) and a higher rate of diabetes mellitus (34% vs. 15%, P = 0.015). They also presented more frequently with STEMI, while patients in the surgical groups had more frequently a previous history of chronic heart failure. There was a higher prevalence of long-term anticoagulation in the surgical group. No significant difference in the rate of cardiac arrest and refractory cardiac arrest was observed, and the SOFA scores at admission and before cannulation were similar.” |
Describe intervention (treatment/procedure/test):
“All surgical V-A ECLS implantation were performed in the operative room or at bedside in case of extreme emergency by trained cardiac surgeons.
For the surgical approach, femoral vessels were exposed with a limited transversal incision in the groin. Purse string sutures were made before cannulation in the femoral artery and vein. Access to the common femoral artery, to the femoral vein and to the superficial femoral artery (anterograde access for distal perfusion line insertion) were obtained using the Seldinger’s technique. Then, after preparation with adequate dilatators, femoral vessels were cannulated. The venous cannula was advanced under echocardiographic guidance to confirm its progression and positioning. After cannulation, the skin was surgically sutured. Decannulation procedures were performed in the operative room by cardiac surgeons. At the time of decannulation, the operative field was reopened. Then, the arterial cannula was removed and the purse string sutures were tied and, after clamping the femoral artery, the arteriotomy was sutured. The distal reperfusion cannula was then retrieved from the distal superficial femoral artery and the purse string suture was tied.”
|
Describe control (treatment/procedure/test):
“For the percutaneous approach, V-A ECLS was implanted in the cardiac catheterization laboratory under fluoroscopic guidance by senior interventional cardiologists trained to echo-guided vascular puncture, preclosing and large bore vascular access as previously described. The common femoral artery and femoral vein were punctured under ultrasound guidance using the Seldinger’s technique. The position of the wires was verified using angiography. Preclosing using two Perclose ProGlides (Abbott , Chicago, Illinois, USA) was performed as
often as possible before cannulation in both the femoral artery and the femoral vein, as previously described. nThen, after preparation with adequate dilatators, femoral vessels were cannulated over a stiff wire (Amplatz Super Stiff, Boston Scientific, Marlborough, Massachusetts, USA) under fluoroscopic guidance. V-A ECLS decannulation was performed percutaneously in the catheterization room except for exceptional cases (no preclosing performed or removal by the cardiac surgeon at the time of LVAD implantation or heart transplant). All percutaneous decannulation were performed using the “the crossover balloon occlusion technique” as previously described. Briefly, the contralateral femoral artery was punctured to obtain a crossover access. A balloon was advanced in the external iliac artery and inflated, to allow a nontraumatic occlusion of the vessel. The arterial cannula was removed and the knots were tied. The balloon was then deflated and an angiography of the femoral artery was performed to ensure the proper closing of the artery and the absence of complications.”
|
Length of follow-up: 30 days
Loss-to-follow-up: N.R.
Incomplete outcome data: N.R. |
Outcome measures and effect size (include 95%CI and p-value if available):
30-day survival I: 10 out of 59 (17%) C: 16 out of 61 (26%)
Major bleeding I: 18 out of 59 (31%) C: 4 out of 61 (7%)
Lower limb ischemia I: 5 out of 59 (8%) C: 2 out of 61 (3%)
Groin infection I: 6 out of 59 (10%) C: 1 out of 61 (2%)
|
|
|
Wang et al |
Type of study: retrospective cohort study
Setting and country: ELSO registry was used, which consists of data from more than 400 member centers worldwide.
Funding and conflicts of interest: This work was supported by the National Key Research and Development Program of China (2016YFC1301001, to X Hou). There are no conflicts of interest. |
Inclusion criteria: We included adult patients (≥18 years) who received femoro-femoral VA-ECMO with percutaneous (percutaneous group) or surgical (surgical group) cannulation primarily for refractory cardiogenic shock from January 1, 2008, through December 31, 2019.
Exclusion criteria: We excluded patients who received VAECMO during cardiopulmonary resuscitation. Additional exclusion criteria included patients with multiple VA-ECMO runs, hybrid ECMO modalities (VVA or VAV), or missing data with regard to key variables: cannulation site and hospital outcome.
N total at baseline: I (surgical): 3,343 cases (27%) C (percutaneous): 9,249 patients (73%)
Important prognostic factors: Age, median (IQR): I: 57 (44-65) C: 57 (46-65)
Sex female, n (%) I: 1077 (32) C: 2883 (31)
Groups comparable at baseline? There was a significant difference between the percutaneous group and the surgical group in age, weight, race, valvular heart disease, obesity, prior cardiac arrest, pre-ECMO RRT, baseline pH level, bilateral groin cannulation, and distal limb cannula placement.
|
Describe intervention (treatment/procedure/test):
Surgical cannulation
|
Describe control (treatment/procedure/test):
Percutaneous cannulation
|
Length of follow-up: Not reported.
Loss-to-follow-up: Not reported.
Incomplete outcome data: Data for secondary outcomes were missing in 3,951 cases (31%). Missing values for some variables resulted in different denominators for the following variables: severe limb ischemia, cannulation site bleeding, and systemic infection (n = 8641). |
Outcome measures and effect size (include 95%CI and p-value if available):
In-hospital mortality I: 1925 out of 3343 (58%) C: 4881 out of 9249 (53%) After controlling for previously described risk factors, percutaneous cannulation was independently associated with a lower risk of in-hospital mortality (OR 0.76; 95% CI 0.70-0.84.
Severe limb ischemia I: 78 out of 3343 (3%) C: 286 out of 9249 (5%) In multivariable logistic regression analyses, with adjustment for potential confounders, percutaneous cannulation was not independently associated with severe limb ischemia (OR 1.28; 95% CI 0.93-1.62.
Cannulation site bleeding I: 582 out of 3343 (22%) C: 1177 out of 9249 (19%) In multivariable logistic regression analyses, percutaneous cannulation was independently associated with a lower risk of cannulation site bleeding (OR 0.70; 95% CI 0.60-0.80).
Systemic infection I: 390 out of 3343 (15%) C: 513 out of 9249 (8%) After adjustment for potential confounders, percutaneous cannulation was independently associated with a lower risk of systemic infection (OR, 0.63; 95% CI 0.54-0.74). |
|
Risk of bias table
|
Author, year |
Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population?
|
Exposure
Can we be confident in the assessment of exposure?
|
Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
|
Confounding-assessment
Can we be confident in the assessment of confounding factors?
|
Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables? |
Assessment of outcome
Can we be confident in the assessment of outcome?
|
Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
|
Co-interventions
Were co-interventions similar between groups?
|
Overall Risk of bias
|
|
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Definitely yes, probably yes, probably no, definitely no |
Low, Some concerns, High |
|
|
Danial et al. |
Definitely yes
Reason: All consecutive patients aged over 16 who received peripheral femoro-femoral VA-ECMO between January 2015 and December 2017 at our institution (La Pitié-Salpêtrière University Hospital, Paris, France) were Included. |
Definitely yes
Reason: During the study period, the same surgical team (senior or assistant cardiac surgeons) performed all VA-ECMO implantations (both surgical and percutaneous) and all surgeons performed the same proportion of procedures. |
No information
|
Definitely yes
Reason: Baseline variables considered for propensity score estimation were chosen based on empirical knowledge for their expected influence on survival and other outcomes, and included: age, sex, weight, height, BMI, SOFA score, peripheral artery disease, diabetes mellitus, dyslipidemia, ECMO indication, reperfusion cannula, long-term anticoagulation before VA-ECMO, and chronic cardiac failure. Variable entered into the propensity score model were age, weigh, seize, body mass index, sex, SOFA score, peripheral artery disease, diabetes mellitus, dyslipidemia, VA-ECMO indications, chronic heart failure, reperfusion cannula and long-term anticoagulation before VA-ECMO |
Definitely yes
Reason: Clinical endpoints were compared between surgical and percutaneous groups using propensity score (PS) framework. The PS approach aims at creating a new dataset in which the probability to receive surgical or percutaneous ECMO is equal (as in a pure randomized trial) to balance patients’ baseline characteristics. |
Probably yes
Reason: Reported variables were also reported in the results. Method of analyses reported. |
Probably yes
Reason: Follow of 30 days probably appropriate for the measured outcomes. Missing data not reported, but data of matched participants was present. |
Definitely yes
Reason: Comparable after PS matching. |
Low (all outcome measures)
|
|
Saiydoun et al. |
Definitely yes
Reason: Patients were selected from a registry |
Probably yes
Reason: All surgical V-A ECLS implantation were performed in the operative room or at bedside in case of extreme emergency by trained cardiac surgeons. |
No information
Only information reported: “Access related complications occurring at the time of cannulation, during V-A ECLS support and after decannulation were recorded.” |
Definitely yes
Reason: Variables included in the model were based on their clinical relevance (regardless of their p-values), with others variables when their p-values was inferior or equal to 0.15 on univariate analysis. The variables included were age, body mass index, chronic heart failure, Sequential Organ Failure Assessment (SOFA) score at cannulation, LVEF, preclosing, cardiac arrest and refractory cardiac arrest. |
Probably yes
Reason: Log-Rank test was used for univariate survival analysis. A Cox proportional hazard regression model was performed to identify independent multivariable factors predictive of survival. Variables included in the model were based on their clinical relevance. |
No information
|
Probably yes
Reason: Follow of 30 days probably appropriate for the measured outcomes. Missing data not reported. |
Probably yes
Reason: Correction for confounding was done, so co-interventions should be comparable. |
Low (all outcome measures)
|
|
Wang et al. |
Definitely yes
Reason: Two authors (L.W and F.Y) independently reviewed the deidentified dataset from the ELSO Registry database and identified all patients meeting the inclusion criteria |
Definitely yes
Reason: Patients were included from the ELSO registry, which contains information on procedures, techniques, etc. |
Probably yes
Reason: The following information was extracted for all included patients: demographic variables; diagnoses associated with cardiogenic shock; comorbidities associated with atherosclerosis; pre-ECMO support; pre- ECMO cardiac arrest; pre-ECMO hemodynamic variables; pre-ECMO arterial blood gases (ABGs); year of ECMO run; cannulation site; cannulation techniques; cannula type; VA-ECMO duration; and ECMO-associated mortality and morbidities, including limb complications, cannulation site bleeding and infections. |
Definitely yes
Reason: variables found to be associated with in-hospital mortality in previous studies:17,19 age, sex, weight, race, pre- ECMO cardiac arrest, congenial heart disease, acute myocarditis, post-heart or lung transplantation, and pre-ECMO RRT. |
Probably yes
Reason: adjusted analyses to control for confounders in the evaluation of patients’ outcomes were performed. |
Probably yes
Reason: Data was subtracted from the ELSO registru |
No information
|
Probably yes
Reason: No statistical significant difference at baseline, and correction for confounding was done, so co-interventions should be comparable. |
Low (all outcome measures)
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Wilhelm, M. J. and Inderbitzin, D. T. and Malorgio, A. and Aser, R. and Gülmez, G. and Aigner, T. and Vogt, P. R. and Reser, D. Acute limb ischemia after femoro-femoral extracorporeal life support implantation: A comparison of surgical, percutaneous, or combined vascular access in 402 patients. Artificial Organs. 2022; 46 (11) :2284-2292
|
Population does not fit the PICO (too broad - more indications than cardiogenic shock only) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 25-11-2024
Beoordeeld op geldigheid : 07-11-2024
De richtlijn zal modulair onderhouden worden in het cluster “Intensive Care” en frequent worden beoordeeld op de geldigheid van de aanbeveling vanaf 2026. Meer informatie over werken in clusters en modulair onderhoud vindt u hier.
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten die extracorporele membraanoxygenatie (ECMO) ondergaan.
Werkgroep
Dhr. dr. L.C. (Luuk) Otterspoor (voorzitter), cardioloog-intensivist, Catharina Ziekenhuis, Eindhoven; NVIC
Mw. dr. J.M.D. (Judith) van den Brule, cardioloog-intensivist, Radboudumc, Nijmegen; NVIC
Dhr. drs. C.V. (Carlos) Elzo Kraemer, internist-intensivist, Leids Universitair Medisch Centrum, Leiden; NVIC
Mw. dr. A. (Annemieke) Oude Lansink-Hartgring, internist-intensivist, Universitair Medisch Centrum Groningen, Groningen; NVIC
Dhr. drs. J.E. (Jorge) Lopez Matta, longarts-intensivist, Leids Universitair Medisch Centrum, Leiden; NVALT
Dhr. dr. M. (Meindert) Palmen, cardiothoracaal chirurg, Leids Universitair Medisch Centrum, Leiden; NVT
Dhr. dr. K. (Kadir) Çaliskan, cardioloog, Erasmus Medisch Centrum, Rotterdam; NVVC
Dhr. dr. (Krischan) Sjauw (vanaf januari 2023), interventiecardioloog, St. Antonius Ziekenhuis, Nieuwegein; NVVC
Dhr. M.A. (Michel) de Jong, klinisch perfusionist, Universitair Medisch Centrum Utrecht, Utrecht; NeSECC
Dhr. drs. E. (Erik) Scholten, anesthesioloog-intensivist, St. Antonius Ziekenhuis, Nieuwegein; NVA
Mw. K.S.M. (Kimberley) Amatdasim (vanaf februari 2023), intensive care verpleegkundige, Maastricht UMC+, Maastricht; V&VN
Mw. J. (Juul) van de Steeg (tot 30 oktober 2023), verpleegkundig specialist intensive- en medium care, St. Antonius Ziekenhuis, Nieuwegein; V&VN
Mw. J. (José) Joustra, patiëntvertegenwoordiger; FCIC/IC Connect
Klankbordgroep
Dhr. dr. F.J. (Erik) Slim, revalidatiearts, Ziekenhuis Rivierenland, Tiel; VRA
Mw. drs. M.P. (Marijn) Mulder, technisch geneeskundige en docent-onderzoeker, Universiteit Twente, Twente; NVvTG
Dhr. R. (Robert) van der Stoep, fysiotherapeut, Erasmus Medisch Centrum, Rotterdam; KNGF, NVZF
Met ondersteuning van
Mw. drs. I. (Ingeborg) van Dusseldorp, senior medisch informatiespecialist, Kennisinstituut van de Federatie van Medisch Specialisten
Mw. drs. F.M. (Femke) Janssen, junior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Mw. dr. J.C. (José) Maas, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Mw. drs. L.H.M. (Linda) Niesink-Boerboom, medisch informatiespecialist, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Annemieke Oude Lansink - Hartgring |
Intensivist bij Universitair Medisch Centrum Groningen |
Bestuurslid bij Stichting Venticare - vrijwilligersvergoeding |
Geen |
Geen restricties |
|
Carlos Elzo Kraemer |
Internist-Intensivist volwassen IC, LUMC |
Geen |
Toegevoegd 24-1-24 |
Geen restricties |
|
Erik Scholten |
Anesthesioloog-intensivist st Antonius ziekenhuis |
Geen |
Deelgenomen aan de INCEPTION trial (rol: lokale onderzoeker, PI Antonius ziekenhuis; geen overkoepelend projectleider) |
Geen restricties |
|
Jorge E. Lopez Matta |
Longarts-Intensivist. Werkzaam als full time intensivist in het Leids Universitair Medisch Centrum. |
Longarts-intensivist in het LUMC: Betaald. Full time. Behalve regulier IC, ook actief betrokken bij het opstellen van protocollen en onderwijs rondom ECMO en point of care ultrasound. |
Geen |
Geen restricties |
|
Jose Joustra |
Ervaringsdeskundige |
Communicatiemedewerker gemeente Purmerend |
Geen |
Geen restricties |
|
Judith van den Brule |
Cardioloog-intensivist Radboudumc |
- |
Geen |
Geen restricties |
|
Juul van de Steeg, vertrokken 30-10-2023 |
Verpleegkundig Specialist Intensive- en Medium Care |
Literatuur selecteren |
Geen |
Geen restricties |
|
Kadir Çaliskan |
Cardioloog |
Werkgroep MCS |
Geen |
Geen restricties |
|
Kimberley Amatdasim |
Intensive Care Verpleegkundige, Maastricht UMC+ |
Geen |
Geen |
Geen restricties |
|
Krischan Sjauw |
Interventiecardioloog Medisch Centrum Leeuwarden. |
Afgevaardigde NVVC - inhoudelijk voorzitter ZiN/Programma Uitkomstgerichte zorg, project "Samen beslissen in Acuut coronaire syndromen"; vacatie/uren vergoeding |
- 1. Industry initiated international trial Philips/Volcano: DEFINE-GPS trial (ClinicalTrials.gov Identifier: NCT04451044); Multi-center, prospective, randomized controlled study comparing PCI guided by angiography versus iFR Co-Registration using commercially available Philips pressure guidewires and the SyncVision co-registration system, employing an adaptive design study for interim sample size re-estimation; rol Nationale PI en local PI MCL; betaling trial patient fees aan Research afdeling Cardiologie/HAVA.
|
Geen restricties. Onderwerp van industrie gesponsorde onderzoek valt buiten bestek van de richtlijn. |
|
Luuk Otterspoor (voorzitter) |
Intensivist (50%) Cardioloog (50%), Catharina Ziekenhuis |
Geen |
1EURO-ICE Toegev (restricted grant, geen PI) INCEPTION. Deze werd deels gefinancierd door Getinge. ON SCENE trial, initiatiefnemer is Erasmus MC. |
Geen restricties |
|
Meindert Palmen |
Cardiothoracaal chirurg LUMC. Uit hoofde van deze functie leid ik het LVAD programma in het LUMC |
Geen. |
Cytosorbents voor inclusie patiënten cytosorb tijdens hartfalen studie. Zoals hierboven aangegeven komen alle financiële vergoedingen ten bate van het afdelingsfonds van de afdeling cardiothoracale chirurgie van het LUMC
|
Geen restricties. Onderwerp van industrie gesponsorde onderzoek valt buiten bestek van de richtlijn. |
|
Michel de Jong |
Klinisch perfusionist UMCU, betaald ( niet in loondienst maar vanuit de maatschap heartbeat)
|
LVAD specialist, betaald
|
Geen |
Geen restricties |
|
Erik Slim |
Revalidatiearts |
n.v.t. |
Geen |
Geen restricties
|
|
Marijn Mulder |
Docent/onderzoeker - Universiteit Twente (1.0 FTE) |
n.v.t. |
Betrokken bij research consultancy voor Maquet Critical Care, AB, maar krijg daarvoor geen persoonlijke vergoeding, deze wordt uitbetaald aan de universiteit.
De scope van dit onderzoeksproject valt buiten de scope van de richtlijn.
|
Geen restricties
|
|
Robert van der Stoep |
Fysiotherapeut Erasmus Medisch Centrum (36 uur per week, betaald) |
Gastdocent voor het Nederlands Paramedisch Instituut bij verschillende cursussen over fysiotherapie op de IC. (2 à 3 keer per jaar, betaald). |
Visual incentivised and monitored rehabilitation for early mobilisation in the Intensive Care Unit - ICMOVE
|
Geen restricties
|
|
Valentijn Schweitzer
NVMM heeft zich teruggetrokken uit klankbordgroep, omdat voor NVMM geen relevante modules zijn opgenomen in het definitieve raamwerk |
AIOS MMB |
Geen |
Geen |
Geen restricties
|
|
Nelianne Verkaik, Vertrokken 22-11-2023
NVMM heeft zich teruggetrokken uit klankbordgroep, omdat voor NVMM geen relevante modules zijn opgenomen in het definitieve raamwerk |
Arts-microbioloog Erasmus MC |
Deelnemersraad Stichting Werkgroep Antibiotica Beleid onbetaald |
Intellectueel gewin in zin van meer kennis opdoen/expertise opbouwen omtrent antibiotica bij ECLS, zonder mogelijkheden voor vermarkting
|
Geen restricties
|
|
Femke Janssen |
Junior adviseur kennisinstituut van de Federatie van Medisch Specialisten |
Geen |
Geen |
Geen restricties
|
|
José Maas |
Adviseur kennisinstituut van de Federatie van Medisch Specialisten |
Geen |
Geen |
Geen restricties
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van Family and Patient Centered Intensive Care/IC Connect (FCIC/IC Connect), Harteraad en het Longfonds voor deelname aan de invitational conference. Een afgevaardigde van Family and Patient Centered Intensive Care/IC Connect (FCIC/IC Connect) nam deel aan de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan FCIC/IC Connect, Harteraad, het Longfonds en de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module Canulatietechnieken |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten die extracorporele membraanoxygenatie (ECMO) ondergaan. Tevens zijn er knelpunten aangedragen door verschillende partijen/vertegenwoordigers via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zou de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Database(s): Ovid/Medline, Embase |
Datum:18-9-2023 |
|
Periode: 2013- |
Talen: nvt |
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
26 |
12 |
27 |
|
RCTs |
39 |
16 |
51 |
|
Observationele studies |
207 |
153 |
268 |
|
Overig |
|
|
|
|
Totaal |
|
|
346 |
Zoekstrategie
Embase
|
#17 |
#6 AND #16 sleutelartikel gevonden |
1 |
|
#16 |
#13 OR #14 OR #15 |
272 |
|
#15 |
#8 AND (#11 OR #12) NOT #13 NOT #14 OBS |
207 |
|
#14 |
#8 AND #10 NOT #13 Clinical trials |
39 |
|
#13 |
#8 AND #9 SR |
26 |
|
#12 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
14418354 |
|
#11 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
7837241 |
|
#10 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3874256 |
|
#9 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
962092 |
|
#8 |
#5 NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
1995 |
|
#7 |
#5 AND #6 |
1 |
|
#6 |
'percutaneous versus surgical femoro-femoral veno-arterial ecmo: a propensity score matched study' |
1 |
|
#5 |
#4 AND [2013-2023]/py NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
584 |
|
#4 |
#1 AND #2 |
1355 |
|
#2 |
'veno-arterial ecmo'/exp OR (('veno arterial' NEAR/3 (extracorporeal OR ecmo OR ecls)):ti,ab,kw) OR 'va ecmo':ti,ab,kw OR 'va ecls':ti,ab,kw |
8182 |
|
#1 |
'arterial cannula'/exp OR 'cardioplegia cannula'/exp OR 'cardiopulmonary bypass cannula'/exp OR 'cannulation'/mj OR (((arter* OR cardiopleg* OR cardiopulmon*) NEAR/3 cannula*):ti,ab,kw) OR 'extracorporeal membrane oxygenation cannula'/exp OR 'ecmo cannula*':ti,ab,kw OR 'ecls cannula*':ti,ab,kw OR ((extracorporeal NEAR/4 cannula*):ti,ab,kw) OR ((surgical NEAR/4 (ecmo OR ecls)):ti,ab,kw) |
14301 |
Ovid/Medline
|
# |
Searches |
Results |
|
13 |
(6 and (11 or 12)) not 9 not 10 OBS |
153 |
|
12 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5511272 |
|
11 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4532548 |
|
10 |
(6 and 8) not 9 Clinical trials |
16 |
|
9 |
6 and 7 SR |
12 |
|
8 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2633127 |
|
7 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
693657 |
|
6 |
5 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
304 |
|
5 |
limit 4 to yr="2013 -Current" |
331 |
|
4 |
3 not ((Child/ or Infant/ or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) |
383 |
|
3 |
1 and 2 |
465 |
|
2 |
(Extracorporeal Membrane Oxygenation/ and ("veno arter*" or va or venoarter*).ti,ab,kf.) or ('venoarterial' adj3 (extracorporeal or ecmo or ecls)).ti,ab,kf. or 'vaecmo'.ti,ab,kf. or 'vaecls'.ti,ab,kf. |
3531 |
|
1 |
exp cannulation/ or ((arter* or cardiopleg* or cardiopulmon*) adj3 cannula*).ti,ab,kf. or ((extracorporeal adj4 cannula*) or (surgical adj4 (ecmo or ecls))).ti,ab,kf. |
212059 |
