Differentiaaldiagnose gecombineerde dyslipidemie
Uitgangsvraag
Hoe kan bepaald worden welke lipoproteïnepartikels aanwezig zijn voor het stellen van een differentiaaldiagnose bij patiënten met gecombineerde dyslipidemie?
Deelvragen
- Wat moet men meten om vast te stellen welke lipoproteïnepartikels aanwezig zijn voor het stellen van een differentiaaldiagnose bij patiënten met gecombineerde dyslipidemie op basis van chylomicronen en VLDL-remnants?
- Hoe kan bepaald worden welke lipoproteïnepartikels aanwezig zijn voor het stellen van een differentiaaldiagnose bij patiënten met gecombineerde dyslipidemie op basis van VLDL en (small, dense) LDL?
Aanbeveling
Bepaal bij patiënten met gecombineerde dyslipidemie welke lipoproteïnepartikels verhoogd zijn: chylomicronen en VLDL-remnants of VLDL en LDL.
Overweeg daarom bij patiënten met gecombineerde dyslipidemie tevens het apoB te meten en om vervolgens het apoB diagnostisch algoritme toe te passen, om de aanwezigheid in te schatten van chylomicronen en VLDL-remnants of VLDL en LDL.
Overweeg apoB te meten bij patiënten met gecombineerde dyslipidemie voor het vaststellen van de aanwezigheid van het zeer atherogene small, dense LDL. Het LDL-cholesterol kan namelijk normaal zijn waarbij er toch sprake is van atherogeen small, dense LDL, hetgeen gemeten kan worden middels hoog apoB (>1,2 g/l) (hyperapoB-hyperTG fenotype).
Overweeg bij patiënten met gecombineerde dyslipidemie op basis van chylomicronen en VLDL-remnants de volgende primaire oorzaken:
- familiaire dysbètalipoproteïnemie = remnant particle disease;
- hepatische lipasedeficiëntie.
Overweeg bij patiënten met gecombineerde dyslipidemie op basis van LDL en VLDL de volgende primaire oorzaken:
- familiaire gecombineerde dyslipidemie;
- sitosterolemie.
Bepaal bij iedere patiënt met nieuwe gecombineerde dyslipidemie de glucoseconcentratie en registreer bij anamnese en lichamelijk onderzoek de volgende parameters:
- overgewicht (met name hoge middelomtrek);
- diabetes mellitus type 2;
- End Stage Renal Disease;
- hiv;
- hemodialyse;
- metabool syndroom;
- polycysteus-ovariumsyndroom;
- alcoholgebruik.
Vraag tevens naar gebruik van medicatie, daar antipsychotica, glucocorticoïden, estrogenen en HAART- therapie hypertriglyceridemie kunnen veroorzaken, dan wel verergeren indien er sprake is van FDBL, HL-deficiëntie of FGD.
Wat moet men meten om vast te stellen welke lipoproteïnepartikels aanwezig zijn voor het stellen van een differentiaaldiagnose bij patiënten met gecombineerde dyslipidemie op basis van chylomicronen en VLDL-remnants?
Bepaal bij patiënten met gecombineerde dyslipidemie welke lipoproteïnenpartikels verhoogd zijn: chylomicronen en VLDL-remnants of VLDL en LDL.
Overweeg apoB te meten bij patiënten met gecombineerde dyslipidemie om vervolgens het apoB diagnostisch algoritme toe te passen, om te kunnen inschatten of chylomicronen en VLDL-remnants of VLDL en LDL aanwezig zijn .
Overweeg bij patiënten met gecombineerde dyslipidemie op basis van chylomicronen en VLDL-remnants de volgende primaire oorzaken:
- familiaire dysbètalipoproteïnemie = remnant particle disease;
- hepatische lipase deficiëntie.
Bepaal het apoE genotype bij patiënten met een gecombineerde dyslipidemie bij wie sprake is van aanwezigheid van chylomicronen en VLDL-remnants en de diagnose familiaire dysbètalipoproteïnemie wordt overwogen vanwege een apoB/TC-ratio <0,15.
Hoe kan bepaald worden welke lipoproteïnepartikels aanwezig zijn voor het stellen van een differentiaaldiagnose bij patiënten met gecombineerde dyslipidemie op basis van VLDL en (small, dense) LDL?
Bepaal bij patiënten met gecombineerde dyslipidemie welke lipoproteïnepartikels verhoogd zijn: chylomicronen en VLDL-remnants of VLDL en LDL.
Overweeg apoB te meten bij patiënten met gecombineerde dyslipidemie om vervolgens het apoB diagnostisch algoritme toe te passen, om een inschatting te kunnen maken over de aanwezigheid van VLDL en LDL.
Overweeg bij patiënten met gecombineerde dyslipidemie op basis van VLDL en LDL de volgende primaire oorzaken:
- familiaire gecombineerde dyslipidemie;
- sitosterolemie.
Bepaal bij iedere patiënt met nieuwe gecombineerde dyslipidemie op basis van VLDL en LDL de glucoseconcentratie en registreer bij anamnese en lichamelijk onderzoek de volgende parameters:
- overgewicht (met name hoge middelomtrek);
- diabetes mellitus type 2;
- End Stage Renal Disease;
- hiv;
- hemodialyse;
- metabool syndroom;
- polycysteus-ovariumsyndroom;
- alcoholgebruik.
Vraag tevens naar gebruik van medicatie, daar antipsychotica, glucocorticoïden en HAART-therapie hypertriglyceridemie kunnen veroorzaken, dan wel verergeren, indien er sprake is van FCH.
Bepaal bij iedere patiënt met gecombineerde dyslipidemie met verhoogd TC en TG en normaal LDL-C het apoB omdat er vaak sprake is van small, dense LDL, waarvoor een aanwijzing bestaat wanneer de apoB-concentratie hoger dan 1,2 g/l is.
Overwegingen
Bij patiënten met gecombineerde dyslipidemie is het belangrijk onderscheid te maken welke lipoproteïnenpartikels verhoogd zijn: LDL en VLDL of chylomicronen en VLDL remnants (zie figuur 2 in de module ‘(Patho)fysiologie van dyslipidemieën'). Dit onderscheid is belangrijk omdat het afhankelijk is van welke lipoproteïnenpartikels aanwezig zijn welke differentiaaldiagnose moet worden overwogen. Hieronder is in het kort een overzicht van de differentiaaldiagnoses afhankelijk van welke lipoproteïnenpartikels aanwezig zijn.
Tabel 1 Primaire en secundaire oorzaken van gecombineerde dyslipidemie op basis van verschillende lipoproteïnen
|
Gecombineerde dyslipidemie Op basis van: |
Chylomicronen en VLDL-remnants |
VLDL en LDL en vaak small, dense LDL |
|
Primaire oorzaken |
Familiaire dysbètalipoproteïnemie (remnant particle disease) |
Familiaire gecombineerde dyslipidemie |
|
|
Hepatische lipasedeficiëntie |
Sitosterolemie |
|
Secundaire oorzaken |
Abdominale obesitas |
Abdominale obesitas |
|
|
Diabetes mellitus type 2 |
Diabetes mellitus type 2 |
|
|
Metabool syndroom |
Metabool syndroom |
|
|
Glucocorticoïden en steroïden gebruik |
Glucocorticoïden en steroïden gebruik |
|
|
Alcoholgebruik |
Dialysepatiënten (CAPD) |
|
|
Antipsychotica |
Antipsychotica |
|
|
ESRD |
Systemische lupus erythematosus |
|
|
|
Medicatiegebruik voor hiv, in het bijzonder HAART-therapie |
|
|
|
Polycysteus-Ovariumsyndroom |
|
|
|
Patiënten met nefrotisch syndroom |
Wat moet men meten om vast te stellen welke lipoproteïnepartikels aanwezig zijn voor het stellen van een differentiaaldiagnose bij patiënten met gecombineerde dyslipidemie op basis van chylomicronen en VLDL-remnants?
In de normale situatie worden triglyceriden in chylomicronen en VLDL gehydrolyseerd door LPL. De chylomicronen- en VLDL-remnantpartikels (relatief cholesterolrijk) worden vervolgens geklaard via de lever of – in geval van VLDL – verder omgezet in LDL. Bij de klaring door de lever speelt het apoE een belangrijke rol. Het apoE is aanwezig op chylomicronen en VLDL (zie figuur 5 in de module ‘Diagnose dyslipidemie bij hypertriglyceridemie’).
De primaire oorzaken van gecombineerde dyslipidemie op basis van chylomicronen en VLDL-remnants zijn familiaire dysbètalipoproteïnemie en hepatische lipasedeficiëntie (tabel 1).
Familiaire dysbètalipoproteïnemie (FDBL)
Diagnostiek: De diagnose FDBL kan niet gesteld worden aan de hand van het traditionele lipoproteïnenprofiel (TC, TG, HDL-C, LDL-C). Patiënten presenteren zich vaak met verhoogd totaalcholesterol en verhoogde triglyceriden, vaak in een verhouding van 2:1. De gouden standaard voor de diagnose van FDBL is een VLDL-cholesterol/VLDL-triglyceriden ratio van ≥ 0,35 (of VLDL-C/TG >0,30) middels ultracentrifugatie of het vinden van de broad bèta-band bij lipoproteïnenelektroforese. Dit is echter een kostbare en arbeidsintensieve methode, waarvoor inmiddels acceptabele alternatieven bestaan, zoals een apoB/TC-ratio <0,15 (Blom, 2005); of een VLDL/chylomicronen-remnant lipoproteïnenprofiel op basis van het diagnostische algoritme voor apoB dyslipidemieën. Wanneer een van deze lipidenprofielen wordt gevonden is de diagnose van FDBL erg waarschijnlijk en moet er verder genetisch onderzoek naar het apoE gen plaatsvinden.
Bij patiënten met FDBL is er sprake van apoE2/E2. Het apoE kent namelijk 3 allelen, E4, E3 en E2. Het ApoE2 heeft de laagste/minste affiniteit voor de receptor op de lever. Derhalve hebben patiënten met genotype apoE2/E2 een gestoorde klaring van chylomicronen en VLDL-remnants. De partikels blijven in de circulatie, waar LPL zorgt voor verdere hydrolyse van de triglyceriden, waarbij er dus kleinere, vooral cholesterolrijke remnants ontstaan. Deze zijn zeer atherogeen.
Verhoogde triglyceriden op basis van chylomicronen- en VLDL-remnantspartikels zijn juist wel geassocieerd met hart- en vaatziekten, daar deze deeltjes kleiner zijn en cholesterolrijk en derhalve uitermate atherogeen. Deze patiënten hebben dus vaak familiaire dysbètalipoproteïnemie (zie tabel 1 en figuur 2 in de module ‘(Patho)fysiologie van dyslipidemieën’).
Alleen het hebben van apoE2/E2 (1% van de bevolking) is vaak niet voldoende voor het volledig tot expressie komen van het FDBL-fenotype. Ongeveer 1:50 patiënten met E2/E2 hebben chylomicronen en VLDL-remnants. Er moet dus vaak een extra factor aanwezig zijn om het volledige E2/E2 fenotype tot uiting te laten komen, bijvoorbeeld DM2, obesitas, hypothyreoïdie, nierziekten, alcohol, medicatie of estrogenendeficiëntie. Al deze factoren jagen de productie van VLDL-partikels in de lever op, door verhoogde aanvoer van vetzuren naar de lever of verminderen de klaring door LPL-inactiviteit. Door het E2/E2 genotype zal de opname van VLDL en chylomicronen door de lever verminderd zijn, met als resultaat stapeling van remnants in het bloed.
Klinische diagnostiek: In de kliniek kan de patiënt zich presenteren met tubereuze xanthomen en gele handlijnen (xanthochromia striata palmaris). Klinische kenmerken van FDBL zijn handlijn xanthomen en/of eruptieve xanthomen op elleboog of achillespees. Ook peesxanthomen komen voor.
Hepatische lipasedeficiëntie
Pathofysiologie en diagnostiek: Hepatische lipasedeficiëntie is een zeldzame autosomaal recessieve aandoening, die zich kan presenteren als FDBL-fenotype. Hepatische lipase speelt een cruciale rol in de omzetting van VLDL in LDL-partikels. Bij HL-deficiëntie vindt er dus stapeling plaats van chylomicronen en VLDL-remnantpartikels. De diagnose kan bevestigd worden door het meten van HL-activiteit in post heparine plasma.
Hoe kan bepaald worden welke lipoproteïnepartikels aanwezig zijn voor het stellen van een differentiaaldiagnose bij patiënten met gecombineerde dyslipidemie op basis van VLDL en (small, dense) LDL?
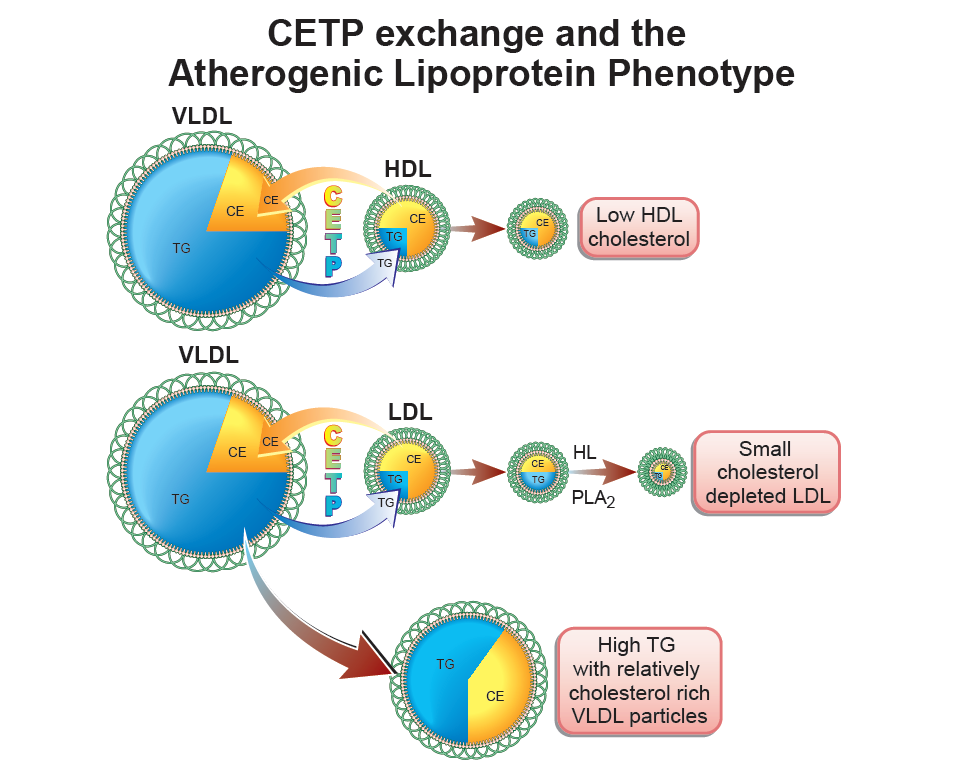
In de klinische praktijk presenteren patiënten zich vaak met een gecombineerde dyslipidemie, dat wil zeggen verhoogd totaalcholesterol en verhoogde triglyceriden. Ook bij deze patiënten is het belangrijk om vast te stellen in welke lipoproteïnenpartikels het cholesterol en triglyceriden worden vervoerd – dus welke lipoproteïnenpartikels zijn in het bloed van de patiënt verhoogd aanwezig. Karakteristiek voor deze patiënten met gecombineerde dyslipidemie op basis van VLDL en LDL, dat er sprake is van small, dense LDL. Dit zijn zeer kleine LDL-partikels met relatief weinig cholesterol per deeltje. Echter, het aantal LDL-partikels is vaak hoog. Derhalve hebben deze patiënten weliswaar soms een hoog LDL-C maar meestal een normaal LDL-C. Middels een hoog apoB kan worden gemeten of het aantal LDL-partikels verhoogd zijn. Het zijn juist de small, dense LDL-partikels die uitermate atherogeen zijn. Het small, dense LDL ontstaat doordat er uitwisseling plaatsvindt van cholesterolesters en triglyceriden tussen VLDL en LDL-partikels of tussen VLDL en HDL-deeltjes, gemedieerd door het CETP (figuur 1). Dit verklaart ook waarom vaak het HDL-C laag is en er VLDL-remnants ontstaan.
Traditioneel bestaat het lipiden en lipoproteïnenprofiel uit totaalcholesterol, triglyceriden, LDL-C en HDL-C. Op basis hiervan kan de diagnose gecombineerde dyslipidemie gesteld worden. Echter men mist bij patiënten met gecombineerde dyslipidemie de aanwezigheid van small, dense LDL. Bepaal derhalve bij patiënten met verhoogd totaalcholesterol en verhoogde triglyceriden ook altijd het apoB opdat u middels het apoB diagnostisch algoritme een indicatie krijgt welke lipoproteïnen in het bloed verhoogd aanwezig zijn.
De primaire oorzaak van gecombineerde dyslipidemie op basis van VLDL en (small, dense) LDL is familiaire gecombineerde dyslipidemie (tabel 1).
Familiaire gecombineerde dyslipidemie (FGD)
Diagnose: De meest voorkomende primaire dyslipidemie die zich presenteert met verhoogd TC en TG, is familiaire, gecombineerde hyperlipidemie. Men stelt de diagnose op basis van apoB >1,2 g/l en TG >1,5 mmol/l. Er is in de literatuur veel discussie over ‘het bestaan van FGD’, mede daar het genetisch defect niet eenduidig is. Dit is gevolg van het feit dat FGD geen monogenetische aandoening is maar een multigenetische en multifactoriële aandoening, dat wil zeggen er zijn meerdere genen en exogene factoren betrokken bij het tot expressie komen van het FGD-fenotype. Daarnaast is er sprake van predisponerende factoren die het FGD-fenotype tot expressie laten komen, zoals overgewicht, alcohol gebruik, insuline resistentie et cetera Feit is dat 20% van de patiënten die hart- en vaatziekten ontwikkelen voor het 60ste levensjaar een FGD-fenotype, dat wil zeggen een gecombineerde dyslipidemie hebben. Meest belangrijk is dat familiegegevens met betrekking tot premature hart- en vaatziekten en dyslipidemie worden nagevraagd opdat een primaire gecombineerde dyslipidemie vroegtijdig wordt opgespoord bij nog asymptomatische familieleden. Dit zal, afhankelijk van de competentie van betrokkenen en de lokale situatie, kunnen plaatsvinden door de behandelaar, eventueel in samenwerking met de genetisch consulent.
Klinische diagnostiek: Er zijn geen specifieke kenmerken bij lichamelijk onderzoek. Belangrijk is de familieanamnese ten aanzien van hart- en vaatziekten en dyslipidemie.
Secundaire oorzaken van gecombineerde dyslipidemie op basis van VLDL en (small, dense) LDL
Alle patiënten met een secundaire oorzaak van gecombineerde dyslipoproteinemie hebben verhoogde TG (hoger dan 1,5 mmol/l), laag HDL en hoog apoB, waarbij het LDL-C soms verbazend normaal lijkt te zijn. Het hoge apoB wijst echter op de aanwezigheid van veel kleine dense LDL-partikels die juist zeer atherogeen zijn (zie figuur 1 en figuur 2 in de module ‘Diagnose bij hypercholesterolemie met LDL’). Het is van groot belang om bij patiënten met hypertriglyceridemie dus vast te stellen of er sprake van een hoog apoB (hyperTG-hyperapoB). Juist deze patiënten hebben zeer atherogeen kleine dense LDL-partikels, hetgeen het hoge apoB verklaart, met een normaal LDL-C. Het apoB reflecteert het aantal atherogene LDL en VLDL-partikels.
Pathofysiologie: Bij patiënten met overgewicht, DM2 en metabool syndroom is er sprake van verhoogde flux van vrije vetzuren vanuit het vetweefsel naar de lever. De vrije vetzuren zijn in overmaat toxisch voor de lever en worden derhalve ingebouwd in triglyceriden. De triglyceriden worden verpakt in VLDL-partikels. En dus leidt dit tot verhoogde productie van VLDL-partikels door de lever. Daarnaast is er vaak een gestoorde afbraak van VLDL-partikels door verminderde LPL-activiteit, geassocieerd met insuline resistentie. Het zijn de atherogene, cholesterolrijke apoB-lipoproteïnenpartikels die uiteindelijk de vaatwand binnendringen en atheroma veroorzaken. Derhalve is het aantal apoB-lipoproteïnepartikels in het bloed, gemeten door middel van apoB, een betere predictor voor HVZ dan LDL-C. Met LDL-C meet men namelijk alleen de cholesterolconcentratie in de LDL-partikels. Het is niet alleen de cholesterolconcentratie in het LDL-partikel, maar juist het aantal partikels dat het risico op hart- en vaatziekten bepaalt. Daarnaast meet men met apoB niet alleen LDL, maar ook de atherogene VLDL-partikels (zie figuur 2 in de module ‘Diagnose bij hypercholesterolemie met LDL’). Het non-HDL-cholesterol reflecteert de hoeveelheid cholesterol in LDL en VLDL-partikels. Juist bij patiënten met gecombineerde dyslipidemieën, diabetes mellitus, metabool syndroom en chronische nierschade, bij wie sprake is van verhoogde TG en kleine, dense LDL-partikels, wordt de bepaling van non-HDL-C aanbevolen in de Europese richtlijnen, met als alternatief de apoB concentratie, als target voor behandeling.
Alvorens een behandeling wordt ingesteld, dient men na te gaan welke lipoproteïnepartikels en welke vorm van dyslipidemie het betreft (zie de module ‘(Patho)fysiologie van dyslipidemieën’). Dit heeft consequenties voor de therapievorm en eventueel voor het te adviseren familieonderzoek. Bij patiënten met een familiaire vorm van dyslipidemie met of zonder aangetoonde cardiovasculaire aandoening bestaat een indicatie voor medicamenteuze therapie. Verder is het belangrijk onderscheid te maken tussen de primaire en secundaire preventiesetting.
In geval van een secundaire dyslipidemie moet de onderliggende oorzaak worden aangepakt.
Figuur 1 Fysiologie relatie hypertriglyceridemie – kleine, dense LDL partkels – laag HDL
Sitosterolemie
Bij patiënten met xanthomen waarbij de cholesterolconcentratie niet sterk verhoogd is, moet men de diagnose sitosterolemie overwegen. Bij patiënten met sitosterolemie is er sprake van sterk verhoogde concentraties van plantensterolen, onder andere sitosterol en campesterol die kunnen leiden tot xanthomen en ook tot hart- en vaatziekten. Vaak hebben patiënten ook een hartgeruis, hetgeen veroorzaakt wordt door verdikte aortaklepslippen, waarschijnlijk als gevolg van ophoping van sterolen.
Het moleculaire defect bestaat uit een mutatie in een transporter in de darm, die behoort tot de ABC-transporterfamilie (ABC-G5 en ABC-G8). Deze transporters zorgen ervoor dat bijna 100% van plantensterolen en 50% van dierlijk cholesterol na opname in de intestinale cellen weer het darmlumen wordt ingepompt en uitgescheiden met de feces. Het biochemisch verschil van 1 methyl- of ethylgroep tussen de plantesterolen en cholesterol maakt daarbij het onderscheid. Mutaties in een van de beide transporters leiden tot een excessieve opname van plantensterolen en cholesterol in de darm en stapeling van deze sterolen in diverse weefsels in het lichaam, zich uitend als xanthomen. Ook prematuur vaatlijden komt dus voor. Het is een zeldzame aandoening, met <100 families in de literatuur beschreven. De aandoening wordt behandeld met een speciaal plantaardig sterol-arm dieet (geen plantaardige margarine, noten, avocado en chocolade) en cholesterolabsorptieremmers (ezetimibe) om de plasma sterolconcentratie te verlagen.
Onderbouwing
Referenties
- Blom DJ, O'Neill FH, Marais AD. Screening for dysbetalipoproteinemia by plasma cholesterol and apolipoprotein B concentrations. Clin Chem. 2005;51(5):904-7.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 03-04-2018
Deze richtlijn is geautoriseerd is door de in de werkgroep participerende partijen; daarnaast ligt deze richtlijn nog ter autorisatie voor bij de VKGN.
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep wel in stand gehouden. Het bestuur van de Nederlandse Internisten Vereniging bepaalt uiterlijk na de autorisatie van de multidisciplinaire richtlijn CardioVasculair RisicoManagement (CVRM) of de modules van deze richtlijn nog actueel zijn. Aangezien de richtlijn naar de huidige CVRM-richtlijn uit 2011 refereert, zal bij een herziene CVRM-richtlijn gecontroleerd moeten worden of de verwijzingen nog kloppen. De geldigheid van deze richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Internisten Vereniging is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze richtlijn is het bevorderen van een optimale diagnostiek en behandeling van patiënten met een (erfelijke) dyslipidemie. Door het optimaliseren van de diagnostiek en behandeling bij een (erfelijke) dyslipidemie wordt het risico op het krijgen van hart- en vaatziekten en de andere genoemde aandoeningen verkleind.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen van internisten, cardiologen en kinderartsen. Daarnaast is deze richtlijn bedoeld om zorgverleners die anderzijds betrokken zijn bij patiënten met (erfelijke) dyslipidemie te informeren, waaronder (kader)huisartsen, neurologen, vaatchirurgen, laboratoriumspecialisten klinische chemie, klinisch genetici/genetisch consulenten (klinische genetica), verpleegkundig specialisten hart- en vaatziekten en praktijkondersteuners.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2015 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met (erfelijke) dyslipidemie te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Professor dr. J. (Jacqueline) de Graaf, internist-vasculaire geneeskunde, werkzaam in het Radboudumc te Nijmegen, voorzitter, NIV
- Dr. J.E. (Jeanine) Roeters van Lennep, internist-vasculaire geneeskunde, werkzaam in het Erasmus MC te Rotterdam, voorzitter, NIV
- Professor dr. F.L.J. (Frank) Visseren, internist-vasculaire geneeskunde, werkzaam in het UMCU te Utrecht, NIV
- Dr. B.P.M. (Ben) Imholz, internist-vasculaire geneeskunde, werkzaam in het Elisabeth-TweeSteden Ziekenhuis te Tilburg, NIV
- Dr. J.J.J. (Jeroen) de Sonnaville, internist-endocrinoloog, werkzaam in het Tergooi Ziekenhuis te Hilversum, NIV
- Dr. P.E. (Petr) Jira, kinderarts, werkzaam in het Jeroen Bosch Ziekenhuis te ’s-Hertogenbosch, NVK
- Dr. A. (Anho) Liem, cardioloog, werkzaam in het Sint Franciscus Gasthuis te Rotterdam, NVVC
- Dr. T. (Talip) Tumkaya, huisarts, werkzaam in de Huisartsenpraktijk Parkhof te Maassluis, NHG
- H. (Hans) van Laarhoven, manager team collectieve belangenbehartiging, werkzaam bij de Hart&Vaatgroep te Den Haag, De Hart&Vaatgroep
Meelezers:
- J.M.H. (Annette) Galema-Boers, verpleegkundig specialist, werkzaam bij Erasmus MC te Rotterdam, NVHVV
- Dr. R.P. (Raoul) Kloppenborg, neuroloog, werkzaam bij het UMCU te Utrecht, NVN
- Dr. J.C. (Joep) Defesche, staflid Laboratorium voor Genoom diagnostiek, werkzaam bij het AMC te Amsterdam
- Dr. J. (Peter) van Tintelen, klinisch geneticus, werkzaam bij het AMC te Amsterdam, VKGN
- Dr. S. (Sjana) Kos, klinisch chemicus, werkzaam bij het Maasstadziekenhuis te Rotterdam, NVKC
- Dr. B.H.P. (Bernard) Elsman, chirurg, werkzaam bij het Deventer Ziekenhuis te Deventer, NVVH
- Dr. M.E. (Janneke) Wittekoek, cardioloog en medisch directeur Stichting LEEFH, werkzaam bij Heartlife Klinieken & Stichting LEEFH, StLEEFH
Met ondersteuning van:
- Dr. B.H. (Bernardine) Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
- A. (Anouk) Rozeboom, MSc, junior adviseur, Kennisinstituut van Medisch Specialisten
- Ing. L.H.M. (Linda) Niesink-Boerboom, MSc, literatuurspecialist, Kennisinstituut van Medisch Specialisten
- S. (Samara) de Jong-Jaber, MSc, beleidsadviseur, Nederlandse Internisten Vereniging
- G.M. (Maike) van Leeuwen, beleid- en projectondersteuner, Nederlandse Internisten Vereniging
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventueel belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
De Graaf |
|
Geen |
Ontwikkelaar van de ApoB-app (diagnostisch tool op basis van apoB) |
Geen opsteller aanbevelingen over het gebruik van de ApoB-app |
|
Roeters van Lennep |
Internist-vasculair geneeskundige |
|
|
Geen actie; Lomitapide wordt niet in de richtlijn besproken en lezingen zijn overschrijdend over de hele richtlijn. |
|
Visseren |
|
|
Deelname aan verschillende fase II en III multicenter klinische trials met PCSK9 monoklonale antilichamen of PCSK9 siRNA (Amgen, Sanofi, Pfizer), antisense apoB (GenZyme), antisense Lp(a) (ISIS) antisense apoCIII (ISIS).
|
Geen actie (PCSK9 monoklonale antilichamen: alleen betrokken bij patiënteninclusie; PCSK9 siRNA: nog niet beschikbaar en naar verwachting ook niet binnen twee jaar)
|
|
Imholz |
Internist-vasculair geneeskundige |
|
|
Geen actie; gemelde belangen zijn overschrijdend aan de gehele richtlijn |
|
De Sonnaville |
Internist-endocrinoloog |
Geen |
Geen |
Geen actie |
|
Jira |
Kinderarts |
Geen |
Geen |
Geen actie |
|
Liem |
|
|
|
Geen actie; gemelde belangen zijn overschrijdend aan de gehele richtlijn |
|
Tumkaya |
|
Geen |
Geen |
Geen actie |
|
Van Laarhoven |
|
Lid Raad van Toezicht LAREB (bestuurskostenvergoeding conform NVTZ)
|
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigde patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan De Hart&Vaatgroep.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door De Hart&Vaatgroep, NHG en VIG (voorheen Nefarma) via invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitters en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; ROBINS-I – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Randvoorwaarden bij dyslipidemie'.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review.
Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html. 2012.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten, 2015.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html. 2013.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

