Welk anti-aanvalsmedicatie bij epilepsie na een beroerte
Uitgangsvraag
Is er een voorkeur aan te geven voor één of meerdere anti-aanvalsmedicatie bij de behandeling van epileptische aanvallen na een beroerte?
Aanbeveling
Voor patiënten met epileptische aanvallen na een beroerte gelden dezelfde adviezen rondom anti-aanvalsmedicatie als voor patiënten met epileptische aanvallen met een focaal begin:
Geef bij voorkeur lamotrigine als monotherapie bij patiënten met laat symptomatische epileptische aanvallen na een beroerte.
Overweeg lacosamide en levetiracetam (alfabetische volgorde) als alternatieven als hiervoor aanleiding is op grond van bijwerkingenprofiel, aanvalsfrequentie, co-morbiditeit, interacties met co-medicatie, leeftijd, geslacht, leefpatroon of het gebruiksgemak.
Overweeg carbamazepine, oxcarbazepine, topiramaat, valproaat of zonisamide (alfabetische volgorde) als er op basis van patiëntspecifieke factoren aanleiding toe is of als lacosamide, lamotrigine of levetiracetam geen geschikte keuze zijn.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Lamotrigine lijkt een hogere retention rate na 5 jaar te hebben in vergelijking met carbamazepine, valproïnezuur en fenytoïne voor patiënten met epileptische aanvallen na een beroerte. Ook lijkt levetiracetam een hogere retention rate te hebben in vergelijking met carbamazepine. Voor oxcarbazepine zijn de data beperkt. Of dit verschil in retention rate ook klinisch relevant is, is lastig te zeggen. De bewijskracht is (zeer) laag omdat er beperkingen aan de opzet van een retrospectieve cohort studie zitten, het studietype waarop deze conclusies zijn gebaseerd. Deze studies hebben daarnaast als beperking dat er geen nieuwere anti-aanvalsmedicatie zijn onderzocht (zoals lacosamide), omdat de studieduur van de meest recente studie maar tot 2015 liep. Ook voor de uitkomsten aanvalsreductie en bijwerkingen is de bewijskracht zeer laag door studiebeperkingen en zeer kleine onderzochte patiëntenaantallen.
De werkgroep beoordeelt de retention rate als uitkomstmaat als relevant, echter plaatst als kanttekening dat bij deze uitkomst geen onderscheid kan worden gemaakt tussen verminderde effectiviteit of verdraagzaamheid als oorzaak voor het staken van een anti-aanvalsmedicijn.
Interacties
Patiënten die een herseninfarct of een hersenbloeding hebben doorgemaakt en daarna epilepsie hebben ontwikkeld worden vaak behandeld met zowel anti-aanvalsmedicatie als medicatie ter secundaire preventie (bloedverdunners, cholesterolverlagers, antihypertensiva). Het bestaan van een interactie tussen een of meerdere middelen is relevant om mee te nemen bij de keuze voor een bepaald anti-aanvalsmedicijn.
Relevante interacties met bloedverdunners (uit Farmacotherapeutisch Kompas):
- Door valproaat kan de werking van acetylsalicylzuur en anticoagulantia worden versterkt.
- Gelijktijdig gebruik van apixaban met sterke CYP3A4- én Pgp-inductoren (zoals carbamazepine, fenobarbital of fenytoïne) kan leiden tot lagere plasmaconcentraties van apixaban.
- Er is melding gedaan dat levetiracetam de plasmaspiegel van rivaroxaban kan verlagen.
- Gelijktijdig gebruik van rivaroxaban met sterke CYP3A4-inductoren (bijv. carbamazepine, fenytoïne of fenobarbital) kan leiden tot lagere plasmaconcentraties van rivaroxaban.
- Mogelijk stijgen de serumspiegels van fenytoïne door gelijktijdig gebruik met acenocoumarol.
- De werking van vitamine K-antagonisten kan worden versterkt door valproaat.
- De werking van vitamine K-antagonisten kan worden verzwakt door o.a. inductoren van CYP2C9 of CYP2C19 (carbamazepine, barbituraten)
Relevante interacties met cholesterol verlagende middelen
- Bij combinatie met sterke CYP3A4–inductoren, zoals carbamazepine, moet rekening worden gehouden met een verlaagde atorvastatinespiegel.
Relevante interacties met bloeddrukverlagende middelen
- Bij patiënten die worden behandeld met carbamazepine of oxcarbazepine en met natriumwaarden-verlagende middelen (bijv. diuretica) is er een verhoogd risico op een hyponatriëmie
Relevante interacties bij patiënten met tevens cardiaal lijden
- Bij het gebruik van lacosamide is voorzichtigheid geboden bij patiënten met geleidingsproblemen, een ernstige hartaandoening (zoals een voorgeschiedenis van myocardinfarct, hartfalen, structurele hartaandoening of natriumkanalopathieën) en bij ouderen (vanwege het PQ-verlengend effect). Overweeg het maken van een ECG vóór verhoging van de dosering > 400 mg/dag en nadat naar een steady-state is getitreerd.
- Bij lamotrigine is voorzichtigheid geboden bij hartziekten zoals hartfalen, ischemische hartziekte, hartblok, ventriculaire aritmieën, het Brugada-syndroom, of andere kanalopathieën. Lamotrigine gedraagt zich als een zwak klasse 1B-antiaritmicum; aritmogene ST-T-afwijkingen en Brughada ECG zijn bij gebruik van lamotrigine gemeld. Overweeg overleg met een cardioloog vóór de start van lamotrigine bij patienten met hartziekten.
Voor overwegingen gerelateerd aan mogelijke bijwerkingen van de verschillende anti-aanvalsmedicatie wordt verwezen naar de module 'Aanvallen met een focaal begin bij epilepsie'.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Net als bij andere patiëntengroepen met focale epilepsie, is het belangrijk om individuele factoren mee te wegen bij de keuze voor een anti-aanvalsmedicijn. Zorgverleners moeten het gesprek aangaan met de patiënt (en naasten) en vragen naar diens voorkeuren, persoonlijke situatie en zorgen. Als er sprake is van ADL-afhankelijkheid waarbij bijvoorbeeld autorijden geen optie meer is, kunnen sommige focale aanvallen wellicht weinig impact hebben en makkelijker geaccepteerd worden. Als iemand nog zelfstandig kan functioneren, alleen woont en/of zijn rijgeschiktheid wil terugkrijgen, is hij/zij wellicht bereid om meer bijwerkingen te accepteren. De verwachtingen ten aanzien van effectiviteit en mogelijke bijwerkingen kunnen in het licht van wat voor de patiënt belangrijk is, worden meegewogen in de keuze.
De keuzekaarten ‘afwachten of medicijnen bij epilepsie’, ‘medicijnen bij epilepsie’ en ‘behandeling als medicijnen niet werken’ bieden handvatten voor het gesprek over de keuze voor behandelen en met welk middel, zodat patiënt en zorgverlener samen kunnen beslissen.
Kosten (middelenbeslag)
De kosten(effectiviteit) van de onderzochte middelen voor patiënten met epileptische aanvallen na beroerte is gelijk aan die van de middelen gebruikt voor patiënten met aanvallen met een focaal begin. Verdere overwegingen over kosten kunnen dan ook worden gevonden onder de module Welk anti-aanvalsmedicijn bij aanvallen met een focaal begin.
Als enige aantekening daarbij kan worden gemaakt dat lacosamide inmiddels niet meer gepatenteerd is, en als generiek middel beschikbaar. Bovendien geldt voor de generieke variant dat voor tabletten van 150mg niet meer bijbetaald hoeft te worden en dat er ook tabletten van 200mg beschikbaar zijn.
Aanvaardbaarheid, haalbaarheid en implementatie
Er zijn geen grote belemmeringen op het gebied van aanvaardbaarheid, haalbaarheid en implementatie bij de huidige aanbeveling. Lamotrigine moet geleidelijk opgebouwd worden, waardoor het voorschrijven van het recept en de uitleg ervan meer tijd in beslag nemen. In veel elektronische voorschrijfsystemen is het mogelijk om hiervoor een standaardprotocol aan te maken. Bij een reguliere opbouw duurt het vier weken tot een basisdosis van 100mg wordt bereikt. In bepaalde situaties is dat minder wenselijk (bijvoorbeeld na een reeks aanvallen of een status epilepticus). In die gevallen kan het een optie zijn om de eerste weken clobazam toe te voegen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op basis van de gevonden literatuur is er geen reden om voor de patiëntengroep met epileptische aanvallen na een beroerte af te wijken van de middelen aanbevolen voor aanvallen met een focaal begin. De trage opbouw van lamotrigine zou geen belemmering moeten zijn, omdat er niet altijd haast is om de therapeutische dosis te bereiken. Wanneer dat wel gewenst is, kan de opbouwperiode overbrugd worden door tijdelijk clobazam toe te voegen.
Studies naar de effectiviteit en veiligheid van lacosamide ontbreken in deze doelgroep. Er is op basis van de huidige praktijkervaring geen reden om aan te nemen dat lacosamide vermeden moet worden.
Bij het gebruik van, carbamazepine, fenytoine, oxcarbazepine en valproaat is het belangrijk om extra alert te zijn op de interacties die deze middelen met bloedverdunners, de cholesterolverlager atorvastatine en sommige bloeddrukverlagers (mn diuretica) kunnen hebben.
Onderbouwing
Achtergrond
Na een beroerte – ofwel een herseninfarct of hersenbloeding – kunnen epileptische aanvallen voorkomen. Wanneer deze binnen een week na de beroerte voorkomen, worden de aanvallen geclassificeerd als ‘acuut symptomatisch’. Wanneer de eerste epileptische aanval meer dan een week na de beroerte optreedt wordt deze geclassificeerd als ‘laat symptomatisch’. Gezien de hoge kans op herhaling van een aanval kan een eenmalige laat symptomatische aanval reeds worden beschouwd als epilepsie. Welk anti-aanvalsmedicijn het meest geschikt is voor de behandeling van deze laat symptomatische aanvallen hangt af van verschillende factoren zoals effectiviteit, bijwerkingen, en interacties met co-medicatie. Deze laatste factor is belangrijk omdat met name enzym-inducerende anti-aanvalsmedicatie interacties kunnen hebben met de antistollingsmedicatie die vaak door voorgeschreven aan patiënten die een herseninfarct hebben doorgemaakt.
Conclusies / Summary of Findings
1. Retention rate (crucial)
| Very low GRADE |
The evidence is uncertain about the superior effect of lamotrigine over carbamazepine, valproic acid, and phenytoin, and about the superior effect of levetiracetam over carbamazepine, with regard to retention and discontinuation rate in patients with post-stroke epilepsy. The evidence is uncertain regarding the effect of oxcarbazepine.
Source: Consoli (2012), Larsson (2019) |
2. Seizure reduction (important)
| Very low GRADE |
The evidence is uncertain about differences in seizure freedom after one year between levetiracetam, carbamazepine, and lamotrigine, in patients with post-stroke epileptic seizures.
Source: Consoli (2012), Gilad (2007) |
3. Adverse events (important)
| Very low GRADE |
The evidence is uncertain about a difference in adverse events between levetiracetam, carbamazepine, and lamotrigine, in patients with post-stroke epileptic seizures.
Source: Consoli (2012), Gilad (2007) |
Samenvatting literatuur
Description of studies
Elaborate information of all studies can be found in the evidence table.
The RCT by Consoli (2012) evaluated the proportion of seizure-free patients with late post-stroke seizures. If these patients were >18 years of age, they were randomized to carbamazepine (n = 66) or levetiracetam (n = 62) treatment (open-label). After 54 weeks, a per protocol analysis was performed with the patients that had not discontinued (carbamazepine n = 54, and levetiracetam n = 52). The seizure frequency during treatment period, the retention of treatment, and tolerability were researched.
Gilad (2007) analyzed the tolerability and efficacy of lamotrigine versus sustained-release carbamazepine in an RCT. Patients with a first episode of post-stroke seizures (either early or late-onset), with evidence of stroke on CT or MRI, were randomized to either lamotrigine (n = 32) or carbamazepine (n = 32) treatment. The follow-up was one year. The outcomes assessed were seizure freedom and adverse events.
Larsson (2019) performed a retrospective cohort study to investigate the retention rates of the first antiseizure medication (ASM). Patients registered in the Swedish Stroke Register (Riksstroke) between 2005 and 2010, who had a first-ever dispensation of an ASM after epilepsy diagnosis, at least 7 days after the date of the index stroke, were included. Patients with a prior seizure-related diagnosis, death during the first 2 months after stroke, or with registration anomalies (age >110 or <18, death before stroke, or incomplete date of death) were excluded. A total of 4991 patients were included, treated with carbamazepine (n = 2373), valproic acid (n = 943), levetiracetam (n = 555), lamotrigine (n = 519), phenytoin (n = 176), or oxcarbazepine (n = 89). The other 336 patients used ASMs that were used by less than 20 patients (topiramate, phenobarbital, clonazepam), used ASMs that are frequently prescribed for other indications (pregabalin, gabapentin), or used two or more ASMs. Patients were relatively similar at baseline, yet atrial fibrillation occurred relatively more often in the levetiracetam group and less often in the carbamazepine group; and statin use was relatively more frequent in the levetiracetam group and less frequent in the phenytoin group. Patients were followed-up for 5 years or until study end (31 December 2014). The primary outcome researched was the retention rate through Kaplan-Meier analysis, and the risk of discontinuation compared to carbamazepine was assessed using adjusted and unadjusted Cox proportional hazard models.
Results
1. Retention rate (crucial)
Consoli (2012) included 128 patients, of whom 22 discontinued within one year. This results in a retention rate of 83.8% (52 out of 62 randomized) for levetiracetam, and 81.8% (54 out of 66 randomized) for carbamazepine. The Relative Risk (RR) is 0.89 (95% CI 0.41 to 1.91, not clinically relevant).
Larsson (2019) researched retention rate through Kaplan-Meier analysis, from treatment start to event (discontinuation) over a period of 5 years, censoring at patient death or end of follow-up (31 December 2014). No imputation methods were used. The retention rate for every researched ASM can be found in Figure 1.
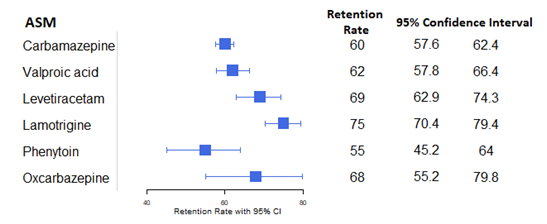
Figure 1. Retention rates for several ASMs and their respective 95% Confidence intervals.
Larsson (2019) also researched discontinuation rates (the inverse of retention rate) through an unadjusted and an adjusted Cox proportional hazards model. Adjustment took place for background characteristics (mentioned in table 1 of original article), with only 4114 patients whom had a full dataset available. No imputation methods took place. Carbamazepine was set as reference ASM. The hazard ratios for discontinuation can be found in Table 1.
| ASM | Adjusted HR (95% CI) |
| Carbamazepine | Ref |
| Valproic acid | 0.88 (0.75-1.03) |
| Levetiracetam | 0.75 (0.60-0.94) |
| Lamotrigine | 0.53 (0.43-0.67) |
| Phenytoin | 1.14 (0.84-1.54) |
| Oxcarbazepine | 0.90 (0.57-1.40) |
Table 1. Hazard ratios for discontinuation of several ASM including their respective 95% confidence intervals, with carbamazepine set as reference drug.
2. Seizure reduction (important)
Seizure freedom after 1 year of treatment was reported by Consoli (2012) and Gilad (2007), which differs from the previously defined outcome measures for seizure reduction (see heading Search and select). However, Consoli (2012) included only those patients that had not discontinued due to poor compliance, severe adverse events, or unknown causes. Gilad (2007) does not describe clearly whether patients that withdrew from the study (due to adverse events) were counted as not being seizure free.
Table 2 shows each study with researched ASM and proportion of seizure free patients at the end of study. The studies reported no statistically significant differences between carbamazepine and levetiracetam or lamotrigine, respectively.
|
ASM |
Consoli (2012) N = 106 |
Gilad (2007) N = 64 |
| Levetiracetam | 49 of 52 (94.2%) | |
| Carbamazepine | 46 of 54 (85.2%) | 14 of 32 (43.8%) |
| Lamotrigine | 23 of 32 (71.9%) |
Table 2. Proportion of seizure free patients after one year, for different studies researching different antiseizure medication (ASM).
3. Adverse events (important)
Adverse events were reported by Consoli (2012) and Gilad (2007). The total number of adverse events, proportion of patients experiencing adverse events, and the number of patients withdrawing due to side effects per respective researched drug are presented in Table 3.
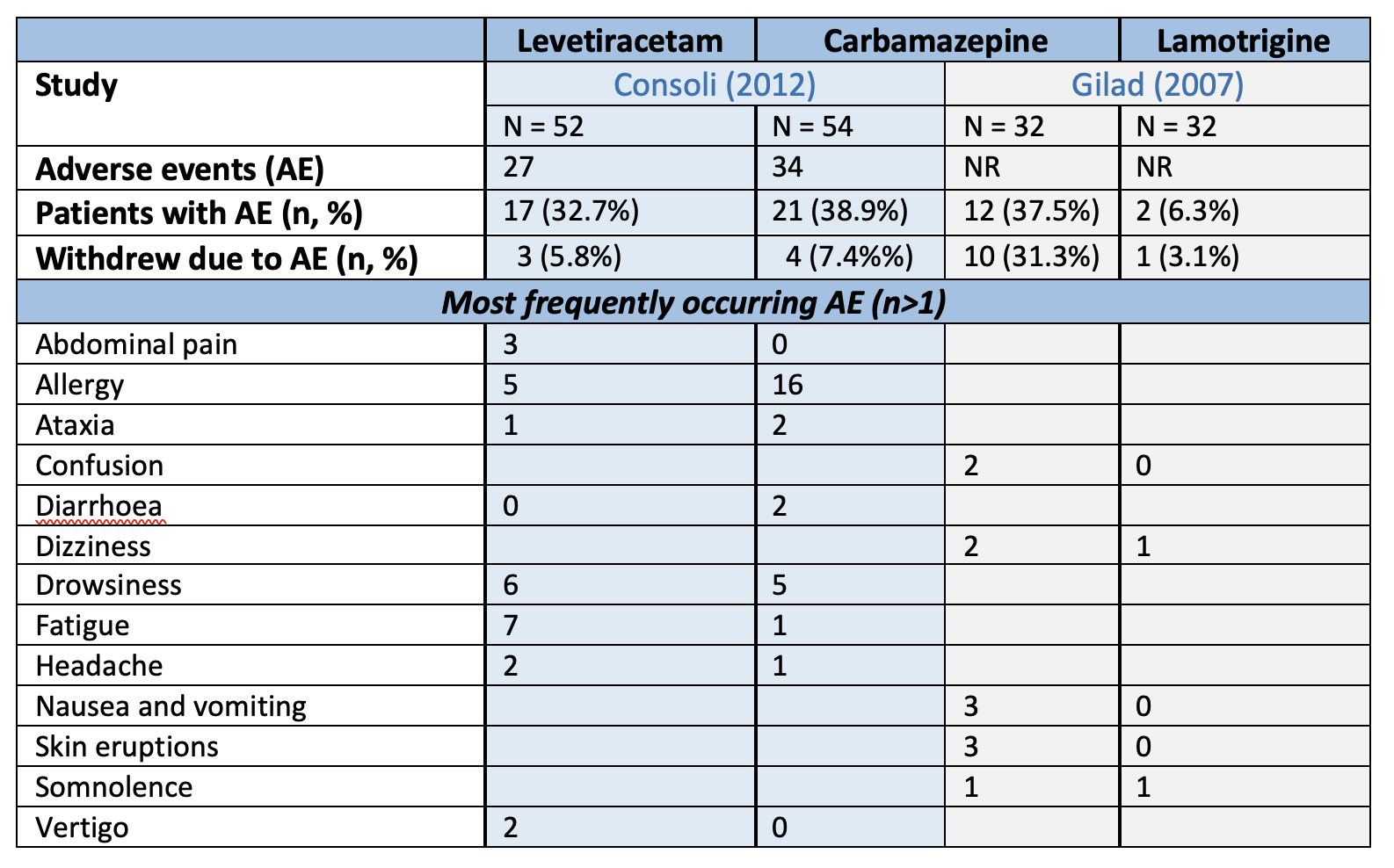
Table 3. Number of adverse events and frequently occurring adverse events per ASM, as reported by Consoli (2012) and Gilad (2007).
Statistically significant differences in adverse events (Consoli, 2012) or withdrawal due to adverse events (Gilad, 2007) were found, discountenancing carbamazepine compared to levetiracetam and lamotrigine, respectively.
Level of evidence of the literature
1. Retention rate (crucial)
The level of evidence regarding the outcome measure retention rate started at low because it was based on an observational study in addition to an RCT. It was downgraded by 2 levels because of risk of residual confounding and misclassification of events (-1, risk of bias); and the relative discontinuation rates crossing the borders of clinical relevance and/or clinical significance (-1, imprecision; with the exception of lamotrigine).
2. Seizure reduction (important)
The level of evidence regarding the outcome measure seizure reduction was downgraded by 3 levels because of the risk of bias in the patient populations (-2, risk of bias):
- Consoli (2012) included only those patients that had not discontinued due to poor compliance, severe adverse events, or unknown causes; resulting in an overestimation of effect.
- Gilad (2007) does not describe clearly whether patients that withdrew from the study (due to adverse events) were counted as not being seizure free, with unsymmetrical withdrawal between study arms; resulting in a stronger underestimation of effect in one arm compared to the other
Additionally, downgrading took place for the small study populations with estimates crossing the borders of clinical relevance (-1, imprecision).
3. Adverse events (important)
The level of evidence regarding the outcome measure adverse events was downgraded by 4 levels because of similar study limitations as mentioned under 2. Seizure reduction (-2, risk of bias); different methods and definitions used for (collecting) adverse events (-1, inconsistency); and small study populations (-1, imprecision).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What are the beneficial and harmful effects of antiseizure medication in the treatment of post-stroke seizures?
P: patients with a history of stroke (ischemic or hemorrhagic) and an indication for antiseizure medication (ASM)
I: antiseizure medication
C: other antiseizure medication
O: Retention rate, seizure reduction, adverse events
Timing: treatment should have continued for at least 3 months to adequately assess outcomes.
Relevant outcome measures
The guideline development group considered retention rate as a critical outcome measure for decision making; and seizure reduction and adverse events as important outcome measures for decision making.
The working group defined the outcome measure seizure reduction as the proportion of patients experiencing a 50% or more reduction in seizure frequency.
A priori, the working group did not define the outcome measures retention rate and adverse events, but used the definitions used in the studies.
The working group defined a 10% difference for continuous outcome measures, 25% for dichotomous outcome measures informing on relative risk (0.8 ≤ RR ≥ 1.25), and 0.5 for Cohen’s d in standardized mean difference (-0.5 ≤ SMD ≥ 0.5) as minimal clinically (patient) important differences.
Search and select (Methods)
The previous guideline module on this topic has been revised, in which the evidence and literature previously assessed has been reassessed for the formulated PICO, and supplemented with newer literature. The process for the search and selection of the new literature is described below.
The databases Embase (via OVID) and Pubmed/Medline were searched with relevant search terms from the last revision of the module (17 January 2020) until 6 May 2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 372 hits. Studies were selected based on the following criteria:
- Systematic review (with detailed search strategy, risk of bias assessment and results of individual studies available), randomized controlled trial, cohort study, or case-control study;
- Described ASM as monotherapy for patients with post-stroke epilepsy;
- Described other ASMs as comparison;
- Described a treatment duration of at least 3 months;
- Described at least retention rate, 28 days free of seizure rate or 50% reduction rate as outcome(s);
- Full-text English language publication
From the previous version of the module, two of the five included studies fulfilled the selection criteria above and were included. From the additional search, six studies were initially selected based on title and abstract screening. After reading the full text, five studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included.
Results
One study was included in the analysis of the literature, in addition to two of the five studies already present in the previous version of the module. Important study characteristics and results of these three studies are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Consoli D, Bosco D, Postorino P, Galati F, Plastino M, Perticoni GF, Ottonello GA, Passarella B, Ricci S, Neri G, Toni D; EPIC Study. Levetiracetam versus carbamazepine in patients with late poststroke seizures: a multicenter prospective randomized open-label study (EpIC Project). Cerebrovasc Dis. 2012;34(4):282-9. doi: 10.1159/000342669. Epub 2012 Nov 1. PMID: 23128439.
- Farmacotherapeutisch Kompas. Diverse paginas. Beschikbaar via: https://www.farmacotherapeutischkompas.nl/
- Gilad R, Sadeh M, Rapoport A, Dabby R, Boaz M, Lampl Y. Monotherapy of lamotrigine versus carbamazepine in patients with poststroke seizure. Clin Neuropharmacol. 2007 Jul-Aug;30(4):189-95. doi: 10.1097/WNF.0b013e3180333069. PMID: 17762314.
- Larsson D, Åsberg S, Kumlien E, Zelano J. Retention rate of first antiepileptic drug in poststroke epilepsy: A nationwide study. Seizure. 2019 Jan;64:29-33. doi: 10.1016/j.seizure.2018.11.013. Epub 2018 Nov 23. PMID: 30529757.
Evidence tabellen
| Study reference | Study characteristics | Patient characteristics | Intervention (I) | Comparison / control (C) | Follow-up | Outcome measures and effect size | Comments |
| Larsson, 2019 | Type of study: Retrospective cohort
Setting and country: (crosslinking of) National registries (Riksstroke, National Patient Register, Drug Register), Sweden
Funding and conflicts of interest: Funding by Jeanssons foundation, Gothenburg Society for medicine, Felix Neuberghs foundation, Magnus Bergvall foundation, and Swedish Society for Medicine. Some authors received institutional research funding and research support. | Inclusion criteria: Patients registered in the Swedish Stroke Register (Riksstroke) between 2005 and 2010, at least 7 days after the date of the index stroke, with a first-ever dispensation of an ASM after epilepsy diagnosis.
Exclusion criteria: (1) Prior seizure-related diagnosis (ICD-10: G40, G41, R56.8), (2) death during first 2 months after stroke, (3) registration anomalies (age >110 or <18, death before stroke, incomplete date of death)
N total at baseline: 4991
Important prognostic factors: ASM Age (±SD) Sex (%M) Stroke type (% infarct) CBZ 73 (13) 57 81 VPA 76 (11) 54 86 LEV 74 (12) 55 85 LTG 73 (14) 49 86 PHT 76 (11) 56 81 OXC 74 (11) 62 85
Comorbidities ASM Living* (%unass) AF (%) DM (%) Statins (%) CBZ 87 31 20 55 VPA 83 35 19 53 LEV 87 43 21 70 LTG 87 35 20 59 PHT 79 34 18 42 OXC 90 36 23 51 * Percentage living unassisted at stroke onset
Groups comparable at baseline? CBZ relatively less and LEV relatively more atrial fibrillation. PHT relatively less and LEV relatively more statin use | Anti-epileptic drugs:
(n = 2373)
(n = 943)
(n = 555)
(n = 519)
(n = 176)
(n = 89)
| See intervention.
| Length of follow-up: 5-years, until 31/12/2014.
Loss-to-follow-up: Not reported. Treatment end was defined as more than one year without renewal of ASM.
Incomplete outcome data: 5 (0.1%) Reasons: date of death prior to first ASM dispensation
336 patients were not used in analysis for retention rate (6.7%) Reasons: ASM used by less than 20 patients (topiramate, phenobarbital, clonazepam), ASM used frequently for other indication (pregabalin, gabapentin), two or more ASMs in combination
| Outcome measures and effect size (incl. 95%CI)
Retention rate Analysed through Kaplan-Meier analyses with time from treatment start to event, censoring at death or end of follow-up (31/12/2014). No imputation methods used.
ASM Rate 95% CI CBZ 60 57.6 – 62.4 VPA 62 57.8 – 66.4 LEV 69 62.9 – 74.3 LTG 75 70.4 – 79.4 PHT 55 45.2 – 64.0 OXC 68 55.2 – 79.8
Risk of discontinuation Cox proportional hazards, unadjusted (n = 4986) and adjusted for background characteristics (not specified which). Adjusted analysis only for 4114 patients with full dataset available (no imputation methods used). CBZ set as reference. ASM Unadjusted HR (95% CI) Adjusted HR (95% CI) CBZ Ref Ref VPA 0.82 (0.71-0.95) 0.88 (0.75-1.03) LEV 0.77 (0.64-0.94) 0.75 (0.60-0.94) LTG 0.56 (0.45-0.69) 0.53 (0.43-0.67) PHT 1.18 (0.90-1.54) 1.14 (0.84-1.54) OXC 0.74 (0.48-1.13) 0.90 (0.57-1.40)
| Loss to follow-up in registers is considered treatment end = possible misclassification of events.
Discontinuation could be correlated with confounders, yet adjusted analysis not clearly specified which confounders (if only table 1) = risk of bias through residual confounding. |
| Consoli, 2012 | Type of study: Open-label RCT
Setting and country: Multicentre, Italy
Funding and conflicts of interest: No funding received, no conflicts of interest. | Inclusion criteria: (1) Patients 18 years or older; (2) late epileptic post-stroke seizures (either haemorrhagic or ischemic)
Exclusion criteria: (1) patients who had seizures under special circumstances (acute electrolyte imbalance or metabolic conditions), (2) patients diagnosed with epilepsy before stroke; (3) pregnancy; (4) history of status epilepticus; (5) neoplastic disease; (6) severe stroke (Rankin scale >3); (7) MMSE <24; (8) allergy or contraindications to used ASM; (9) life expectancy <1 year; (10) myoclonic seizures; (11) dysphagia; (12) poor compliance; (13) brain injury; (14) impairment of consciousness; (15) no previous ASM treatments <4 weeks prior to trial entry or drugs that could interfere with study drugs
N total at baseline: 128 I: 62 C: 66
Important prognostic factors: Mean age ± SD: I: 74.1 (± 11.3) C: 69.7 (± 13.2)
Sex (male, %) I: 55.8% C: 53.7%
Type of stroke (ischemic, %): I: 38 (73%) C: 41 (76%)
Groups comparable at baseline? Yes | Levetiracetam 250mg twice daily, with increments of 250 mg every week up to 1000 mg/day.
For patients with continued seizures, dosage was increased gradually to a maximum of 3000mg/day. | Carbamazepine 100mg daily for 1-3 days, subsequently increased to 100mg twice daily, then increased to 300mg twice daily
For patients with continued seizures, dosage was increased gradually to a maximum of 1600mg/day. | Length of follow-up: 1 year
Loss-to-follow-up: 22 (17.2%) I: 10 (16.1%) Reasons: poor compliance (n = 4), severe adverse events (n = 3), unknown (n = 3)
C: 12 (18.2%) Reasons: poor compliance (n = 4), severe adverse events (n = 4), unknown (n = 4)
Incomplete outcome data: See above
| Outcome measures and effect size (incl. 95%CI)
Retention rate 0.89 (95% CI 0.41 to 1.91).
Seizure freedom Analysed through Kaplan-Meier analysis. RR: 1.11 (95% CI 0.97 to 1.26)
Adverse events Patients with adverse events RR: 0.84 (95% CI 0.50 to 1.41)
LEV CBZ Syncope 1 0 Allergy 5 16 Visual disturbance 0 1 Ataxia 1 2 Drowsiness 6 5 Abdominal pain 3 0 Diarrhoea 0 2 Leukopenia 0 1 Liver parameters ↑ 0 1 Fatigue 7 1 Vertigo 2 0 Headache 2 1
| |
| Gilad, 2007 | Type of study: Open-label RCT
Setting and country: Single centre, Israel
Funding and conflicts of interest: Not reported. | Inclusion criteria: Patients with a first early or late-onset post-stroke seizure, with evidence of ischemic stroke with middle cerebral artery distribution on CT or MRI.
Exclusion criteria: (1) patients with conditions that can cause seizures (subarachnoid or intracerebral haemorrhage, acute electrolyte imbalance, neurodegenerative diseases or metabolic conditions), (2) Acute severe psychiatric states; (3) patients with status epilepticus or >2 seizures during first 24 hours after stroke
N total at baseline: 64 I: 32 C: 32
Important prognostic factors: Mean age ± SD: I: 67.2 (± 2.4) C: 67.7 (± 2.6)
Sex: I: 65 % M | C: 78 % M
Time from stroke onset: I: 8.5 (±2.3) months C: 12.5 (±3.3) months
Antihypertensive/antidiabetic drugs (%) I: 8% / 44% C: 33% / 11%
Groups comparable at baseline? Mainly yes, but LTG group shows a shorter mean period from previous stroke, less use of antihypertensive drugs and more use of antidiabetic drugs | Lamotrigine Uptitration every week by 25mg to 100mg daily
For patients with continued seizures, dosage was increased gradually by 50mg per week. | Carbamazepine (sustained-release) Uptitration every day by 100mg to 300mg daily.
For patients with continued seizures, dosage was increased gradually by 100mg per day. | Length of follow-up: 1 year
Loss-to-follow-up: Not reported.
Incomplete outcome data: I: 1 (3.1%) C: 11 (34.4%) Reasons: All adverse events, but for one in the control group: death due to non-drug related pulmonary edema
| Outcome measures and effect size (incl. 95%CI)
Seizure freedom RR: 1.64 (95% CI 1.05 to 2.57)
Adverse events Patients with adverse events
LTG CBZ Somnolence 1 1 Dizziness 1 2 Nausea and vomiting 0 3 Skin eruptions 0 3 Confusion 0 2 Overdose symptoms 0 1
| Unclear in seizure freedom analysis of patients who had withdrawn due to side effects were counted as not “seizure free”. |
Abbreviations: ASM: antiseizure medication, AF: atrial fibrillation, CBZ: carbamazepine, CI: confidence interval, DM: diabetes mellitus, ICD: International Classification of Disease, LEV: levetiracetam, LTG: lamotrigine, OXC: oxcarbazepine, PHT: phenytoin, SD: standard deviation, VPA: valproic acid,
Risk of bias table for intervention studies
Study reference
(first author, publication year) | Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no | Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no | Blinding:
Definitely yes Probably yes Probably no Definitely no | Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no | Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no | Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no | Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
| Consoli, 2012 | Definitely yes
Reason: Central randomization with computer generated randomization scheme in blocks | Probably no
Reason: Randomization numbers were sequentially assigned across centers, concealment not reported. | Definitely no
Reason: Open-label study. Patients and providers not blinded. Data assessment was done by an observer blinded to treatment arm. (Blinding by analysts not reported). | Probably no
Reason: >10% patients in both arms discontinued after randomisation and were not included in the analysis. No imputation methods were used. | Probably no;
Reason: No research protocol available. Retention rate and quality of life not clearly reported. | Probably no
Reason: Per protocol analysis, underpowered. Patients were censored at last observation time = loss to follow up. | HIGH
|
| Gilad, 2007 | Probably no
Reason: randomization procedure not reported | Probably no
Reason: Allocation concealment procedures not reported | Definitely no
Reason: Open-label trial (patients, outcome assessors and health care providers not blinded). Blinding of data collectors and analysts not reported.
| Probably no
Reason: Unclear how many patients were found eligible and randomized. Large proportion of withdrawal not balanced over groups, unclear imputation methods. | Probably yes
Reason: no research protocol available. | Definitely no
Reason: Unclear whether patients that withdrew are counted as not being seizure free. | HIGH
|
Risk of bias table for cohort studies
| Author, year | Selection of participants
Was selection of exposed and non-exposed cohorts drawn from the same population? | Exposure
Can we be confident in the assessment of exposure?
| Outcome of interest
Can we be confident that the outcome of interest was not present at start of study?
| Confounding-assessment
Can we be confident in the assessment of confounding factors?
| Confounding-analysis
Did the study match exposed and unexposed for all variables that are associated with the outcome of interest or did the statistical analysis adjust for these confounding variables? | Assessment of outcome
Can we be confident in the assessment of outcome?
| Follow up
Was the follow up of cohorts adequate? In particular, was outcome data complete or imputed?
| Co-interventions
Were co-interventions similar between groups?
| Overall Risk of bias
|
Definitely yes Probably yes Probably no Definitely no | Definitely yes Probably yes Probably no Definitely no | Definitely yes Probably yes Probably no Definitely no | Definitely yes Probably yes Probably no Definitely no | Definitely yes Probably yes Probably no Definitely no | Definitely yes Probably yes Probably no Definitely no | Definitely yes Probably yes Probably no Definitely no | Definitely yes Probably yes Probably no Definitely no | Low Some concerns High | |
| Larsson, 2019 | Definitely yes
Reason: participants were selected from a national registry | Probably yes
Reason: medication prescription extracted from national registry | Definitely yes
Reason: selection criteria were used excluding participants with prior dispensation of ASMs (therefore discontinuation could not be present at start) | Probably yes
Reason: information on confounders was extracted from national patient registry | Probably no
Reason: The researched variables were included in the adjusted analysis, yet plausible residual confounding exists | Probably yes
Reason: Renewal information is extracted from registry, yet loss to follow-up of patients is misclassified as discontinued (event). | Probably no
Reason: 5 year follow-up is adequate. However, no imputation for missing data was applied. | No information
Reason: co-interventions or medication could have taken place, yet not extracted from registry. | Some concerns
|
Table of excluded studies
| Reference from literature search | Reason for exclusion |
| Rosenow F, Brandt C, Bozorg A, Dimova S, Steiniger-Brach B, Zhang Y, et al. Lacosamide in patients with epilepsy of cerebrovascular etiology. Acta Neurol Scand. 2020 Jun;141(6):473-482. doi: 10.1111/ane.13230. Epub 2020 Mar 13. PMID: 32068241. | Wrong intervention (add-on) |
| Hsu CY, Cheng CY, Lee JD, Lee M, Ovbiagele B. Effects of long-term anti-seizure medication monotherapy on all-cause death in patients with post-stroke epilepsy: a nationwide population-based study in Taiwan. BMC Neurol. 2021 Jun 21;21(1):226. doi: 10.1186/s12883-021-02241-5. PMID: 34154568; PMCID: PMC8215791. | Wrong outcome |
| Zhang YJ, Lu XM, Li PW, Guo CA, Wan DJ. Oxcarbazepine versus Carbamazepine for the Treatment of Post-Stroke Epilepsy: A Systematic Review and Meta-Analysis. Turk Neurosurg. 2022;32(2):176-184. doi: 10.5137/1019-5149.JTN.34664-21.3. PMID: 34936076. | Definition of outcome unclear (wrong outcome) |
| Larsson D, Baftiu A, Johannessen Landmark C, von Euler M, Kumlien E, Åsberg S, Zelano J. Association Between Antiseizure Drug Monotherapy and Mortality for Patients With Poststroke Epilepsy. JAMA Neurol. 2022 Feb 1;79(2):169-175. doi: 10.1001/jamaneurol.2021.4584. PMID: 34902006; PMCID: PMC8669603. | Wrong outcome |
| Tanaka T, Fukuma K, Abe S, Matsubara S, Motoyama R, Mizobuchi M, et al.; PROPOSE Study Investigators. Antiseizure medications for post-stroke epilepsy: A real-world prospective cohort study. Brain Behav. 2021 Sep;11(9):e2330. doi: 10.1002/brb3.2330. Epub 2021 Aug 22. PMID: 34423590; PMCID: PMC8442594. | Unclear intervention (monotherapy or add-on mix-group) |
| Reference from previous module | Reason for exclusion |
| Alvarez-Sabín J, Montaner J, Padró L, Molina CA, Rovira R, Codina A, Quintana M. Gabapentin in late-onset poststroke seizures. Neurology. 2002 Dec 24;59(12):1991-3. doi: 10.1212/01.wnl.0000038388.57824.b6. PMID: 12499501. | Wrong comparison (none) |
| Belcastro V, Costa C, Galletti F, Autuori A, Pierguidi L, Pisani F, Calabresi P, Parnetti L. Levetiracetam in newly diagnosed late-onset post-stroke seizures: a prospective observational study. Epilepsy Res. 2008 Dec;82(2-3):223-6. doi: 10.1016/j.eplepsyres.2008.08.008. Epub 2008 Sep 30. PMID: 18829259. | Wrong comparison (none) |
| Kutlu G, Gomceli YB, Unal Y, Inan LE. Levetiracetam monotherapy for late poststroke seizures in the elderly. Epilepsy Behav. 2008 Oct;13(3):542-4. doi: 10.1016/j.yebeh.2008.04.025. Epub 2008 Jun 6. PMID: 18539085. | Wrong comparison (none) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-10-2023
Beoordeeld op geldigheid : 30-05-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules is in 2020 een multidisciplinair cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met epilepsie.
Clusterstuurgroep
- Prof. dr. H.J.M. Majoie (voorzitter), neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze en Maastricht
- Drs. M.H.G. Dremmen, radioloog, Erasmus MC Rotterdam
- Dr. P. Klarenbeek, neuroloog, Zuyderland Medisch Centrum, Heerlen
- Dr. J. Nicolai, kinderneuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Maastricht
- Dr. C.M. Delsman-van Gelder, kinderneuroloog, RadboudUMC, Nijmegen
- Dr. P. van Vliet, neuroloog/intensivist, Haaglanden Medisch Centrum, Den Haag
- Drs. R. van Vugt, anesthesioloog, Sint Maartens Kliniek, Nijmegen
Clusterexpertisegroep betrokken bij deze module
- Drs. J. H. van Tuijl, neuroloog, Elisabeth-TweeSteden ziekenhuis, Tilburg
- Dr. M. Vlooswijk, neuroloog, Maastricht UMC+, Maastricht
Met ondersteuning van
- Dr. M.M.J. van Rooijen, adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
- Dr. J. Buddeke senior adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Stuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Majoie* |
Functie: Neurologie Werkgever: Academisch Centrum voor Epileptologie Kempenhaeghe, Maastricht UMC+ |
Relevante commissies
NB geen betaalde functies |
Lopende onderzoek- en zorginnovatieprojecten (anders dan contract research) worden gefinancierd uit ZonMW, Nationaal epilepsiefonds, stichting vrienden van Kempenhaeghe, en SKMS.
Incidenteel financiële ondersteuning aan stichting Kempenhaeghe voor organisatie refereeravonden en workshops/symposia (telkens volgens geldende wet en regelgeving). |
Geen actie |
|
Delsman |
Kinderneuroloog/kinderarts Werkgever: Maxima Medisch Centrum Veldhoven |
Geen |
Geen |
Geen actie |
|
Dremmen |
Functie: Kinderradioloog met subspecialisatie kinderneuroradiologie Werkgever: ErasmusMC te Rotterdam |
Een van de voorzitters van de richtlijn Radiologische diagnostiek acute trauma-opvang bij kinderen Expertisegroep richtlijn Traumatologie Uitgenodigd spreker op meerdere nationale en internationale cursussen en congressen |
Geen |
Geen actie |
|
Klarenbeek |
Functie: Neuroloog Werkgever: Zuyderland te Heerlen/Sittard (vrijgevestigd) |
Geen |
Geen |
Geen actie |
|
Nicolai |
Functie: Kinderneuroloog Werkgever: Maastricht UMC+. Tevens gedetacheerd/ werkzaam in Kempenhaeghe, Heeze; St Jansgasthuis, Weert; Elkerliek, Helmond en Viecuri, Venlo. |
Coördinator Sepion beginnerscursus; vergoeding wordt door Sepion naar AMBI goed doel gestort. Tevens betrokken bij Sepion gevorderden cursus en AVG cursus; vergoeding wordt door Sepion naar AMBI goed doel gestort. |
Boegbeeldfunctie bij een patiënten- of beroepsorganisatie |
Geen actie |
|
Van Vliet |
Functie: Intensivist Werkgever: Haaglanden Medisch Centrum te Den Haag |
|
Geen |
Geen actie |
|
Van Vugt |
Functie: Anesthesioloog Werkgever: Sint Maartenskliniek te Nijmegen |
Lid commissie kwaliteitsdocumenten NVA (onbetaald) |
Geen |
Geen actie |
Expertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Altinbas |
Functie: Neuroloog-kinderneuroloog Werkgever: SEIN locatie Meer en Bosch werkzaam op de polikliniek en kliniek (0.6 fte), LUMC polikliniek kinderneurologie (0.2 fte). |
|
Per 2023 zal het landelijk CBD consortium een onderzoek starten naar de behandeling van kinderen met therapieresistente epilepsie met CBD (gesubsidieerd door ZonMW). |
Geen actie |
|
Balvers |
Functie: Neuroloog (Behandeling van patiënten met epilepsie; klinisch, poliklinisch en in woonzorg) Werkgever: Stichting Epilepsie Instellingen Nederland (SEIN) (0.6fte)
Functie: Neuroloog (Behandeling van patiënten met hoofdpijn; poliklinisch) Werkgever: The Migraine Clinic, Amsterdam (0.2 fte) |
|
|
Geen restrictie voor Epilepsie. |
|
De Bruijn |
Functie: neuroloog in opleiding Werkgever: ETZ Tilburg |
Geen |
Geen |
Geen actie |
|
Draak |
Functie: Kinderneuroloog, neuroloog. Werkgever: Zuyderland Medisch Centrum |
Geen |
Geen |
Geen actie |
|
Eshuis |
Functie: AIOS Spoedeisende geneeskunde Werkgever: Catharina Ziekenhuis te Eindhoven |
|
Geen |
Geen actie |
|
Hofman |
Functie: Radioloog Werkgever: Maastricht UMC+ (1.0fte) |
|
Geen |
Geen actie |
|
Koekkoek |
Functie: Neuroloog Werkgever: Leids Universitair Medisch Centrum (0.8fte), Haaglanden Medisch Centrum (0.2fte) |
|
Geen |
Geen actie |
|
Lazeron |
Functie: Neuroloog Werkgever: Academisch centrum Epileptologie Kempenhaeghe Maastricht UMC+ (voltijds).
Functie: Wetenschappelijk onderzoeker Werkgever: Technische universiteit te Eindhoven (nul uren aanstelling) |
|
Lid van het TeleEpilepsie consortium. Met dit consortium hebben een aanvalsdetector ontwikkeld, de Nightwatch(R) die door LivAssured geproduceerd wordt. Geen direct financieel belang in dit bedrijf, maar van eventuele toekomstige winsten van LivAssured vloeit een klein percentage terug naar het consortium voor epilepsie-onderzoek |
Restricties ten aanzien van besluitvorming met betrekking tot apparaten die aanvallen detecteren (e.g. Nightwatch) |
|
Masselink |
Functie: Ziekenhuisapotheker Werkgever: Medisch Spectrum Twente |
|
Geen |
Geen actie |
|
M’Rabet |
Functie: MT-lid Kennis en Innovatie Werkgever: EpilepsieNL, Houten |
Geen |
|
Geen actie |
|
Reijneveld |
Functie: Neuroloog, Werkgever: Stichting Epilepsie Instellingen Nederland (SEIN) te Heemstede (0.8 fte)
Functie: Universitair Hoofddocent, afdeling Neurologie Werkgever: Amsterdam UMC (0.2 fte) |
|
Geen |
Geen actie |
|
Ronner |
Functie: Neuroloog Werkgever: Amsterdam UMC (0.8 fte) |
|
Geen |
Geen actie |
|
Schijns |
Functie: Neurochirurg met specialisatie Epilepsiechirurgie en Neuro-oncologische Chirurgie |
|
|
Geen actie |
|
Snoeijen |
Functie: Arts Verstandelijk Gehandicapten Werkgever: Kempenhaeghe, fulltime |
Geen |
Geen |
Geen actie |
|
Thijs |
Functie: neuroloog Werkgever: Stichting Epilepsie Instellingen Nederland (1.0 fte) Leids Universitair Medisch Centrum (detachering vanuit SEIN voor 0.2 fte) |
|
|
Restrictie ten aanzien van besluitvorming met betrekking tot apparaten die aanvallen detecteren (e.g. Nightwatch®). |
|
Tousseyn |
Functie: neuroloog Werkgever: Academisch Centrum voor Epileptologie (ACE) Kempenhaeghe/Maastricht UMC+, locatie Heeze |
|
|
Geen actie |
|
Uiterwijk |
Functie: Epileptoloog Werkgever: Academisch Centrum voor Epileptologie Kempenhaeghe |
Geen |
Geen |
Geen actie |
|
Van 't Hof |
Functie: neuroloog Werkgever: SEIN (Stichting Epilepsie Instellingen Nederland) |
|
Geen |
Geen actie |
|
Van Tuijl |
Functie: Neuroloog Werkgever: ETZ Tilburg |
|
|
Geen actie |
|
Tolboom |
Functie: Nucleair geneeskundige Werkgever: UMC Utrecht |
Geen |
Geen |
Geen actie |
|
Verbeek |
Functie: Klinisch geneticus Werkgever: UMC Utrecht |
Geen |
Geen |
Geen actie |
|
Vlooswijk |
Functie: Neuroloog Werkgever: Maastricht UMC+ |
|
|
Geen actie |
|
Wegner |
Functie: Neuroloog Werkgever: Stichting Epilepsie instellingen Nederland (SEIN) |
|
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de afvaardiging van EpilepsieNL in het cluster. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens voor commentaar voorgelegd aan Epilepsie NL en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er [waarschijnlijk geen/ mogelijk] substantiële financiële gevolgen zijn, zie onderstaande tabel.
| Module | Uitkomst raming | Toelichting |
| Module ‘Beroerte: welk anti-epilepticum bij beroerte’ | Geen financiële gevolgen |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Cyclus werkwijze
Bij de start van de cyclus is de geldigheid van alle modules geïnventariseerd, waarna er een prioriteringsronde heeft plaatsgevonden. De geprioriteerde modules zijn herzien en geüpdatet door het cluster.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
| GRADE | Definitie |
| Hoog |
|
| Redelijk |
|
| Laag |
|
| Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Netwerk meta-analyse
Voor de beoordeling van de bewijskracht uit een netwerk meta-analyse (NMA) wordt gebruik gemaakt van de CINeMA-tool (Nikolakopoulou, 2020; Papakonstantinou, 2020). Met deze tool wordt op basis van een analyse in R de effectschattingen berekend. Voor het beoordelen van de bewijskracht, op basis van de berekende effectschattingen, worden zes domeinen geëvalueerd, namelijk Risk-of-Bias, publicatiebias, indirectheid, imprecisie, heterogeniteit and incoherentie. Voor het opstellen van de conclusies zijn principes van de GRADE working group gebruikt op basis van grenzen van klinische besluitvorming (Brignardello-Petersen, 2020).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
| Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers | ||
| Sterke aanbeveling | Zwakke (conditionele) aanbeveling | |
| Voor patiënten | De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. | Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
| Voor behandelaars | De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. | Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
| Voor beleidsmakers | De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. | Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brignardello-Petersen R, Florez ID, Izcovich A, Santesso N, Hazlewood G, Alhazanni W, Yepes-Nuñez JJ, Tomlinson G, Schünemann HJ, Guyatt GH; GRADE working group. GRADE approach to drawing conclusions from a network meta-analysis using a minimally contextualised framework. BMJ. 2020 Nov 11;371:m3900. doi: 10.1136/bmj.m3900. PMID: 33177059.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Nikolakopoulou A, Higgins JPT, Papakonstantinou T, Chaimani A, Del Giovane C, Egger M, Salanti G. CINeMA: An approach for assessing confidence in the results of a network meta-analysis. PLoS Med. 2020 Apr 3;17(4):e1003082. doi: 10.1371/journal.pmed.1003082. PMID: 32243458; PMCID: PMC7122720.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Papakonstantinou T, Nikolakopoulou A, Higgins JPT, Egger M & Salanti G. CINeMA: Software for semiautomated assessment of the confidence in the results of network meta-analysis. Campbell Systematic Reviews 2020;16:e1080.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
