Aanvallen met een focaal begin bij epilepsie
Uitgangsvraag
Welke medicamenteuze behandeling heeft de voorkeur bij patiënten met epileptische aanvallen met een focaal begin?
De uitgangsvraag omvat de volgende deelvragen:
- Met welk anti-aanvalsmedicijn in monotherapie wordt bij voorkeur gestart bij patiënten met nieuw gediagnosticeerde epileptische aanvallen met een focaal begin?
- Wat zijn eerste keus middelen als adjuvante behandeling bij patiënten met epileptische aanvallen met een focaal begin waarbij monotherapie onvoldoende effectief is?
Aanbeveling
Aanbeveling 1: Monotherapie bij nieuw gediagnosticeerde epileptische aanvallen met een focaal begin
Geef bij voorkeur lamotrigine als eerstekeus monotherapie bij patiënten met nieuw gediagnosticeerde epileptische aanvallen met focaal begin.
Lacosamide en levetiracetam (alfabetische volgorde) zijn geschikte alternatieven als hiervoor aanleiding is op grond van bijwerkingenprofiel, aanvalsfrequentie, co-morbiditeit, co-medicatie, leeftijd, geslacht, leefpatroon of het gebruiksgemak.
Overweeg alleen carbamazepine, oxcarbazepine, topiramaat, valproaat of zonisamide (alfabetische volgorde) als er op basis van patiëntspecifieke factoren aanleiding toe is of als lacosamide, lamotrigine of levetiracetam geen geschikte keus zijn.
Aanbeveling 2: Adjuvante behandeling bij falen van monotherapie bij epileptische aanvallen met een focaal begin.
Verwijs bij medicatieresistente epileptische aanvallen met een focaal begin laagdrempelig naar de expertisecentra voor evaluatie van epilepsiechirurgie (of andere niet-medicamenteuze behandeling).
Kies als adjuvante behandeling (na falen van twee monotherapieën) bij patiënten met epileptische aanvallen met een focaal begin bij voorkeur een van de volgende middelen (alfabetische volgorde): brivaracetam, carbamazepine, cenobamaat, lacosamide, lamotrigine, levetiracetam, oxcarbazepine, perampanel, topiramaat. Ook clobazam, valproaat en zonisamide kunnen overwogen worden hoewel het bewijs voor deze middelen als adjuvans zeer beperkt is.
Voor cenobamaat geldt dat dit toegepast kan worden als adjuvante behandeling als ten minste 2 anti-aanvalsmedicijnen faalden.
Geef bij voorkeur middelen met een verschillend werkingsmechanisme.
Aanbeveling 3: Voorzorgen in specifieke situaties
Geef geen valproaat of topiramaat aan meisjes en vrouwelijke patiënten in de vruchtbare levensfase.
Overweeg deze middelen alleen als andere middelen niet geschikt of niet effectief zijn en zorg dan voor adequate zwangerschapspreventie/ anticonceptie.
Een uitzondering kan worden gemaakt voor meisjes bij wie de verwachting is dat de epilepsie in remissie zal gaan en valproaat of topiramaat gestaakt kan worden voor de puberteit.
Raadpleeg de module ‘Zwangerschap en hormonen’ voor het starten van anti-aanvalsmedicatie bij vrouwelijke patiënten in de vruchtbare levensfase.
Aanbeveling 4: cardiale geleidingsstoornissen
Overweeg een ECG te maken bij:
- Patiënten ouder dan 60 jaar: vóór het starten met een natriumkanaalblokker (carbamazepine, fenytoïne, lacosamide, lamotrigine en oxcarbazepine) ter evaluatie van cardiale geleidingsstoornissen.
- Patiënten jonger dan 60 jaar: indien er sprake is van bekende cardiovasculaire risicofactoren of een bekende cardiale aandoening.
Geef geen natriumkanaalblokker indien er sprake is van geleidingsstoornissen op het ECG.
Consulteer een cardioloog bij twijfel over het ECG en de wens om toch een natriumkanaalblokker te starten omdat er geen geschikt alternatief voorhanden is. Zorg in dit geval voor adequate follow-up door het ECG te herhalen na de opbouwfase.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor deelvraag 1 werden twee ‘individuele patiënten data’ meta-analyses (IPDMA) en vijf RCTs geïncludeerd. Eén IPDMA onderzocht de effectiviteit en veiligheid van carbamazepine ten opzichte van fenytoïne (Nevitt, 2019a), de andere IPDMA vergeleek carbamazepine met topiramaat (Nevitt, 2019b). Voor de vergelijking carbamazepine vs. fenytoïne werd een klein verschil in incidentie van aanvallen gerapporteerd in het voordeel van fenytoïne (Nevitt, 2019a). Voor de andere uitkomstmaten werd geen verschil tussen beide behandelingen aangetoond. Voor de vergelijking carbamazepine vs. topiramaat werd voor alle uitkomsten een klein verschil gevonden in het voordeel van carbamazepine (Nevitt, 2019b). Voor alle uitkomsten werd de bewijskracht met één niveau afgewaardeerd vanwege het overschrijden voor de grenzen van klinische relevantie.
Voor deelvraag 2 werd één netwerk meta-analyse geïncludeerd, waarbij anti-aanvalsmedicatie met elkaar vergeleken en gerangschikt werden. Met een hoge tot redelijke bewijskracht resulteren de middelen brivaracetam, lamotrigine, levetiracetam, perampanel in een betere aanvalsvrijheid in vergelijking met placebo. Middelen die niet beschikbaar zijn op de Nederlandse markt of enkel een indicatie kennen bij specifieke epilepsiesyndromen worden verder buiten beschouwing gelaten (onder andere carisbamate, remacemide hydrochloride, rufinamide).
Zoals in de inleiding van deze module toegelicht worden middelen welke in Nederland niet beschikbaar zijn (zoals esclicarbazepine) buiten beschouwing gelaten. Daarnaast worden die middelen buiten beschouwing gelaten die in de reguliere behandeling enkel een plaats hebben in specifieke omstandigheden of bij specifieke epilepsiesyndromen (zoals felbamaat en rufinamide bij Lennox-Gastaut syndroom). Voor de behandeling van specifieke epilepsiesyndromen op de kinderleeftijd wordt verwezen naar de betreffende modules binnen de richtlijn epilepsie.
Monotherapie bij nieuw gediagnosticeerde epileptische aanvallen met een focaal begin
In de literatuursamenvatting worden zes studies beschreven waarin acht middelen als monotherapie onderzocht worden. Zoals in de methode beschreven is deze module in 2012 gebaseerd op de toenmalige NICE richtlijn (NICE, 2012). Studies van vóór deze datum zijn daarom niet opgenomen in de literatuursamenvatting.
De gevonden verschillen in effectiviteit tussen de middelen zijn gering op basis van de cruciale uitkomstmaten (seizure incidence en time to seizure recurrence). De keuze voor een bepaald middel moet dus gebaseerd worden op andere factoren dan enkel de effectiviteit. Denk daarbij aan het aanvalstype, de aanvalsfrequentie, het bijwerkingenprofiel, co-morbiditeit, interacties, leeftijd, geslacht en het gebruiksgemak. Het valt buiten het bestek van deze richtlijn om deze factoren tot in detail te bespreken. Enkele belangrijke waarschuwingen en voorzorgen die mede bepalend zijn geweest voor de aanbeveling van de module worden hier wel genoemd. Voor een uitgebreider overzicht van rationeel anti-aanvalsmedicatiebeleid wordt verwezen naar bestaande reviews (Moshé, 2015; Abou-Khalil, 2019).
Lamotrigine wordt in internationale richtlijnen, zoals de NICE richtlijn (NICE, 2012) en de practice guideline (Kanner, 2018) van de American Acadamy of Neurologists (AAN) aanbevolen als eerste keus middel voor monotherapie bij nieuw ontstane epileptische aanvallen met een focaal begin. De werkgroep neemt dit advies over, mede omdat lamotrigine een gunstig bijwerkingenprofiel heeft met een goede retentietijd en weinig relevante interacties met andere middelen (Marson, 2007; Marson, 2021). Belangrijk bij lamotrigine is dat het langzaam opgebouwd moet worden om de kans op huidreacties te verkleinen. Daarnaast is er recent een waarschuwing afgegeven door de Federal Drug Administration (FDA) over het gebruik van lamotrigine bij cardiale geleidingsstoornissen (French, 2021).
Levetiracetam en lacosamide hebben net als lamotrigine weinig relevante interacties met andere geneesmiddelen. Ten opzichte van lamotrigine kunnen deze middelen sneller in de therapeutische dosering gegeven worden en is er een intraveneus preparaat beschikbaar. Dit verbetert het gebruiksgemak, zeker in acute situaties.
In de SANAD II studie (Marson, 2021) werd levetiracetam als monotherapie bij nieuw ontstane epileptische aanvallen met een focaal begin vergeleken met lamotrigine. Hierbij werd geen verschil gevonden in de primaire uitkomstmaat (tijd tot het bereiken van 12 maanden aanvalsvrijheid). De studie was echter opgezet als een non-inferiority trial waarbij levetiracetam niet voldeed aan de criteria voor non-inferioriteit. Hierdoor kan op basis van deze studie niet worden uitgesloten dat er een klinisch relevant verschil in effectiviteit bestaat tussen levetiracetam en lamotrigine. De retentietijd (time to treatment failure) van lamotrigine was statistisch significant beter dan van levetiracetam (hazard ratio: 0.60; 95%CI 0.46-0.77). Van lacosamide zijn dergelijke data (nog) niet beschikbaar. De werkgroep beschouwt deze middelen ook als eerste keusmiddelen als er op basis van patiëntspecifieke factoren reden is om geen lamotrigine te geven.
Enzym-inducerende anti-aanvalsmedicatie zoals carbamazepine, fenytoïne en in mindere mate topiramaat en oxcarbazepine hebben belangrijke interacties met andere geneesmiddelen (www.farmacotherapeutischkompas.nl). Valproaat is een enzym-remmend middel en geeft ook interacties met andere geneesmiddelen. Bij alle patiënten met andere medicatie of co-morbiditeit moet hiermee expliciet rekening worden gehouden. Onder andere vanwege deze interacties worden deze middelen enkel als eerste keus beschouwd als hier op basis van patiëntspecifieke factoren aanleiding toe is.
Het farmacokinetisch profiel van fenytoïne beperkt dit middel in het gebruik. Er is sprake van een smalle therapeutische breedte, non-lineaire farmacokinetiek en variabele absorptie van het orale preparaat (Abou-Khalil, 2019). Een constante therapeutische spiegel zonder onder- of overdosering is hierdoor erg moeilijk. Om deze reden is dit middel geen alternatief voor de eerstekeusmiddelen naar de mening van de werkgroep.
Voorzorgen in specifieke situaties
Onderstaand worden enkele voorbeelden van situaties met betrekking tot geslacht, co-morbiditeit en bijwerkingenprofiel beschreven die vanwege de mogelijke impact of de prevalentie aandacht verdienen. Dit betreft geen uitputtende lijst aan voorbeelden, er zijn meer situaties denkbaar waarin patiënt- en geneesmiddelkarakteristieken de keuze voor een anti-aanvalsmedicijn beïnvloeden (bijvoorbeeld bijwerkingen op cognitie, obesitas, chronische pijn, lever- of nierfunctiestoornissen).
Bij vrouwen in de vruchtbare levensfase moeten interacties met anticonceptie en mogelijke teratogene effecten van anti-aanvalsmedicatie worden meegewogen in de keuze voor een bepaald middel. Over valproaat deed de ILAE in dit licht in 2015 een aantal aanbevelingen (Tomson, 2015). Dit middel mag niet worden gegeven aan vrouwelijke patiënten in de vruchtbare levensfase in verband met het duidelijk verhoogde risico op aangeboren afwijkingen en cognitieve beperkingen bij kinderen. Als er geen alternatieven zijn, dan mag dit middel alleen overwogen worden als er sprake is van adequate anticonceptieve maatregelen (Tomson, 2015). Voor topiramaat werd in 2023 door de European Medicines Agency (EMA) eenzelfde aanbeveling gepubliceerd (EMA 2023). Naast topiramaat en valproaat zijn er uiteraard nog andere middelen waarbij voorzorgsmaatregelen gelden (zie de module ‘Zwangerschap en hormonen’).
Co-morbide stemmingsstoornissen of andere psychiatrische problematiek moeten ook worden meegewogen in de keus voor een anti-aanvalsmedicijn. Veel middelen kunnen in potentie neuro-psychiatrische bijwerkingen geven, maar bij levetiracetam, topiramaat, zonisamide en perampanel komt dit vaker voor (www.farmacotherapeutischkompas.nl). Bij deze middelen is voorzichtigheid geboden.
Osteoporose is een bijwerking met potentieel grote gevolgen op de lange termijn. Traditioneel worden vooral enzym-inducerende middelen en valproaat hiermee in verband gebracht. De richtlijn osteoporose en fractuurpreventie maakt het onderscheid niet tussen verschillende groepen anti-aanvalsmedicatie. Ook de werkgroep onderschrijft het advies om bij alle patiënten met anti-aanvalsmedicatie te zorgen voor adequate osteoporose en fractuurpreventie (zie module ‘Bewaking bij anti-aanvalsmedicatie’ en de richtlijn osteoporose en fractuurpreventie voor praktische behandeladviezen).
Bij met name bij klassieke natriumkanaalblokkers (carbamazepine, fenytoïne, lamotrigine, oxcarbazepine en topiramaat) is er een risico op het ontstaan van ernstige (soms levensbedreigende) huidreacties zoals het Stevens-Johnsonsyndroom of DRESS (Drug Rash with Eosinophilia and Systemic Symptoms). In een Aziatische populatie is dit risico duidelijk groter dan in een Kaukasische populatie (Tassaneeyakul, 2010; Chen, 2017). Dit geldt bijvoorbeeld met name voor een Han-Chinese of Thaise afkomst. Zie voor een actueel overzicht het Farmacotherapeutisch Kompas. Wanneer tenminste één van de vier voorouders of één van de ouders van Aziatische afkomst is, dient voorafgaand aan een eventuele behandeling met carbamazepine of oxcarbazepine een HLA-typering (HLA-B*1502) gedaan te worden. Dit vanwege het verhoogde risico op een ernstige huidreactie bij dragerschap hiervan (Tassaneeyakul, 2010; Chen, 2017). Ook bij de andere genoemde middelen is de associatie van HLA-B*1502-positieve polymorfismen en ernstige huidreacties aanwezig (www.farmacotherapeutischkompas.nl). Praktischer is het om in populaties met een vergroot risico niet primair te kiezen voor middelen die deze bijwerking kunnen geven.
Bij vrijwel alle natriumkanaalblokkers worden ook cardiale geleidingsstoornissen als mogelijke bijwerking beschreven (www.farmacotherapeutischkompas.nl; pagina’s van de specifieke middelen). Op basis van in vitro onderzoek met mogelijke aritmogene effecten van lamotrigine in therapeutische doseringen heeft de FDA een veiligheidswaarschuwing afgegeven voor dit middel (FDA, 2021). In respons hierop adviseert de ILAE om voor het starten met lamotrigine bij oudere patiënten (≥60 jaar) te screenen op cardiale geleidingsstoornissen middels een ECG (French, 2021). Bij patiënten jonger dan 60 jaar dient alleen gescreend worden bij een voorgeschiedenis van hartziekten of bij aanwezigheid van cardiale risicofactoren. Relevante afwijkingen op het ECG zijn de cardiale geleidingsstoornissen (2e of 3e graads AV blok, het Brugada syndroom, aritmogene ventriculaire cardiomyopathie, linker bundeltakblok en rechter bundeltakblok met linker anterior of posterior fasciculair blok). Bij dergelijke geleidingsstoornissen is het advies om geen lamotrigine te geven of patiënt voor het starten van lamotrigine te laten beoordelen door een cardioloog met de vraag of lamotrigine bij de gevonden afwijking veilig gegeven kan worden. Na de opbouwfase dient bij patiënten uit de risicogroepen het ECG herhaald te worden ter controle van de geleidingstijden. Op dit moment is er nog onvoldoende klinisch bewijs om de veiligheidswaarschuwing van de FDA (op basis van in vitro data) te onderbouwen danwel te ontkrachten (Bunschoten, 2022). Het is de mening van de werkgroep dat er in de praktijk rekening mee moet worden gehouden tot dit bewijs beschikbaar komt. Het ILAE-advies is in de ogen van de werkgroep ook valide voor de andere natriumkanaalblokkers. Met name bij combinatietherapie met meerdere natriumkanaalblokkers wordt voorzichtigheid geadviseerd. Overigens heeft de European Medicines Authority (EMA) een dergelijk advies over lamotrigine of andere natriumkanaalblokkers niet uitgebracht.
Adjuvante behandeling bij falen van monotherapie bij epileptische aanvallen met een focaal begin
Bij medicatieresistente epilepsie is de kans op aanvalsvrijheid bij aanvullende medicamenteuze behandeling zeer klein en daarom is er een indicatie om te verwijzen naar de landelijke expertisecentra voor evaluatie voor epilepsiechirurgie (Chen, 2018). Er is sprake van medicatieresistente epilepsie als een patiënt aanvallen houdt ondanks behandeling met twee anti-aanvalsmedicamenten in adequate dosering (Schiller, 2008). Er wordt altijd gestart met monotherapie en als deze behandeling faalt dan wordt een tweede middel toegevoegd waarna geprobeerd wordt het eerste middel uit te sluipen (zie module ‘Mono- of combinatietherapie’). Indien ook dit middel faalt dan moet men denken aan verwijzing. In de praktijk zal er bij medicatieresistente epilepsie in de tweede lijn dus eerder gedacht moeten worden aan verwijzing voor evaluatie voor epilepsiechirurgie (of andere niet-medicamenteuze therapie zoals nervus vagusstimulator, ketogeen dieet of DBS) dan aan adjuvante behandeling.
Als er in het geval van medicatieresistente epilepsie wordt gekozen voor gelijktijdige behandeling met twee anti-aanvalsmedicamenten, dan verdient het de voorkeur om te kiezen voor twee middelen met een verschillend werkingsmechanisme. Bij gelijktijdig gebruik van twee middelen met eenzelfde werkingsmechanisme kan de effectiviteit lager zijn, zoals bijvoorbeeld bij de combinatie levetiracetam en brivaracetam (Lattanzi, 2021). Ook kunnen de bijwerkingen meer uitgesproken zijn, bijvoorbeeld bij combinatie van twee natriumkanaalblokkers (Sake, 2010). Resultaten van een netwerk meta-analyse, zoals opgenomen in de literatuursamenvatting kunnen om deze redenen niet zomaar geëxtrapoleerd worden naar de klinische praktijk. De behandelend arts dient bij het starten van een tweede middel, naast eerder genoemde factoren, expliciet rekening te houden met de actuele medicatie en medicatiehistorie van de patiënt. Vanwege dit breed scala aan overwegingen, is het niet eenvoudig om een aanbeveling te doen welk middel bij voorkeur te kiezen als adjuvans als met een tweede middel gestart wordt. De werkgroep beveelt aan om hierbij te kiezen voor een middel waarvoor op basis van de beoordeling van de netwerk meta-analyse voldoende bewijs beschikbaar is, te weten: brivaracetam, carbamazepine, cenobamaat, lacosamide, lamotrigine, levetiracetam, oxcarbazepine, perampanel of topiramaat (in alfabetische volgorde).
Het bewijs voor valproaat als add-on is minder duidelijk, echter het is de mening van de werkgroep dat dit middel zijn waarde in de klinische praktijk ruimschoots bewezen heeft. Daarnaast is er ook bewijs voor werkzaamheid van valproaat als monotherapie bij epilepsie met focaal begin. Om deze reden is de werkgroep van mening dat ook valproaat te overwegen is als adjuvante behandeling bij falen monotherapie. Een ander middel dat op basis van geïncludeerde studies overwogen kan worden voor monotherapie behandeling, maar waarvoor onvoldoende bewijs werd gevonden in de netwerk meta-analyse van de NICE is zonisamide. Gezien dit bewijs bij monotherapie behandeling is het volgens de werkgroep ook te overwegen om dit middel te gebruiken bij falen monotherapie.
Er werden in de netwerk meta-analyse geen studies geïncludeerd die de effectiviteit van clobazam onderzochten. Om de plaats van clobazam bij de (langdurige) adjuvante behandeling van epilepsie met een focaal begin te bepalen heeft de werkgroep ook gebruik gemaakt van een Cochrane review (Bresnahan, 2019) en de practice parameter van de American Academy of Neurology (Kanner, 2018). De conclusie in beide artikelen is dat clobazam als adjuvans mogelijk effectief is in het verlagen van de aanvalsfrequentie bij medicatieresistente epilepsie met een focaal begin, maar dat deze conclusie gebaseerd is op bewijs van een erg lage kwaliteit (weinig studies, met kleine aantallen patiënten en een onduidelijk risico op bias als gevolg van incompleet beschreven methoden). Gebaseerd op de ervaring van de leden van de werkgroep kan ook clobazam een effectieve optie zijn als adjuvans bij patienten met een medicatieresistente epilepsie, zeker als tijdelijke behandeling bij een ontregeling of aanvalscluster. Om te laten zien dat het beschikbare bewijs voor adjuvante behandeling voor clobazam, valproaat en zonisamide minder is dan voor de overige middelen worden deze in de aanbevelingen apart genoemd.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het doel voor patiënten is veelal het bereiken van aanvalsvrijheid zonder bijwerkingen of andere negatieve effecten van de medicatie. Het is belangrijk om de patient (en evt. naasten) optimaal te betrekken bij de besluitvorming rondom de start van behandeling. Maak samen een zorgvuldige afweging over de te starten behandeling. Informeer de patiënt over de te verwachten bijwerkingen en het te verwachten effect van de therapie. Het aantal mensen dat de behandeling vol houdt (retentietijd, in Engels: retention rate) of omgekeerd het aantal mensen dat de behandeling staakt (in Engels: discontinuation rate), wordt in de literatuur vaak gebruikt als samengestelde maat die de balans tussen beide beschrijft aangezien de effectiviteit enerzijds en de bijwerkingen van een middel anderzijds worden meegewogen. Een netwerk meta-analyse van Nevitt (2017) vergeleek tien anti-aanvalsmedicatie als monotherapie met als primair eindpunt retentietijd (12.391 patiënten). De retentietijden van levetiracetam en lamotrigine waren het langst. De andere onderzochte middelen waren: carbamazepine, fenobarbital, fenytoïne, gabapentine, oxcarbazepine, topiramaat, valproaat en zonisamide.
Als de therapietrouw bij patiënten een punt van aandacht is, dan kan overwogen worden te kiezen voor een middel dat eenmaal daags gedoseerd kan worden. Lamotrigine, perampanel en zonisamide komen hiervoor in aanmerking.
Kosten (middelenbeslag)
Er zijn verschillende kosten-effectiviteitsstudies uitgevoerd waarbij monotherapie bij focale aanvallen is onderzocht (Hawkins, 2005; Marson, 2007; Maltoni & Messori, 2003; Remak, 2003; Remak, 2004). Verschillende anti-aanvalsmedicatie (in alfabetische volgorde) bleken kosteneffectief: carbamazepine, lamotrigine, oxcarbazepine, topiramaat en valproaat. In de SANAD II studie (Marson, 2021) werd geconcludeerd dat zowel levetiracetam als zonisamide geen kosteneffectieve alternatieven zijn in vergelijking met lamotrigine.
Tevens zijn er kosten-effectiviteitsstudies bekend over add-on therapie bij focale aanvallen. Uit verschillende evaluaties bleek add-on therapie kosteneffectief, zoals lacosamide (Bolin, 2010; Simoens, 2012; Knoester, 2005), lamotrigine (Spackman, 2007) en pregabaline (Vera-Llonch, 2008).
De actuele medicijnkosten in Nederland zijn beschikbaar via https://www.medicijnkosten.nl/. Middelen die nog niet als generiek preparaat beschikbaar zijn, hebben hogere kosten. Voor brivaracetam, lacosamide en perampanel zijn nog geen generieke preparaten beschikbaar, de directe kosten van deze middel zijn dus hoger. Kosten-effectiviteit behelst uiteraard meer dan enkel de directe kosten van een medicijn. Een kosteneffectiviteitsanalyse die deze middelen als monotherapie vergelijkt met andere middelen ontbreekt voor zover bekend.
Rationale van de aanbeveling: weging van de argumenten voor en tegen de interventie
Aanbeveling 1: Monotherapie bij nieuw gediagnosticeerde epileptische aanvallen met een focaal begin
Lamotrigine wordt als eerste keus middel beschouwd gezien de weinig relevante interacties, het gunstige bijwerkingenprofiel en de goede retentietijd in meerdere studies. Levetiracetam en lacosamide hebben wel voordelen in gebruiksgemak in vergelijking met lamotrigine. Op basis van de studieresultaten van de SANAD II studie (Marson, 2021) heeft lamotrigine echter de voorkeur bij gelijke geschiktheid boven levetiracetam. Lacosamide heeft op dit moment nog duidelijk hogere directe kosten dan lamotrigine hetgeen bij gelijke geschiktheid betekent dat lamotrigine de voorkeur heeft.
Aanbeveling-2: Adjuvante behandeling bij falen van monotherapie bij epileptische aanvallen met een focaal begin.
Bij medicatieresistente epileptische aanvallen dient de clinicus als eerst altijd doorverwijzing naar een gespecialiseerd epilepsiecentrum voor evaluatie van epilepsiechirurgie te overwegen. Ten aanzien van de adjuvante behandeling bij falen van monotherapie zijn verschillende opties beschikbaar waarbij er geen duidelijk superieur middel aan te wijzen is. De arts moet samen met de patient naast effectiviteit de keuze baseren op factoren zoals het bijwerkingenprofiel, comorbiditeit, comedicatie, patiënt karakteristieken en het gebruiksgemak.
Aanbeveling-3: Voorzorgen in specifieke situaties
Valproaat is gecontra-indiceerd bij vrouwelijke patiënten in de vruchtbare levensfase. De ILAE heeft hierover een duidelijk standpunt ingenomen dat door de werkgroep wordt overgenomen (zie hiervoor ook de module ‘Zwangerschap en hormonen’).
Aanbeveling-4: cardiale geleidingsstoornissen
De werkgroep neemt de adviezen en voorzorgen van de FDA/ILAE ten aanzien van cardiale geleidingsstoornissen bij het voorschrijven van lamotrigine over. Ondanks het feit dat de waarschuwing van de FDA enkel gebaseerd is op in vitro onderzoek betreft het een ernstige complicatie waar op eenvoudige en niet invasieve manier voorzorgen voor genomen kunnen worden. Omdat bijwerkingen ten aanzien van de cardiale geleiding bij alle natriumkanaalblokkers voor kunnen komen adviseert de werkgroep om deze adviezen bij al deze middelen in acht te nemen.
Onderbouwing
Achtergrond
Om een adequate keuze te maken voor de medicamenteuze behandeling bij epilepsie, is het eerst van belang om het aanvalstype vast te stellen. Hierbij wordt onderscheid gemaakt tussen epilepsie met een focaal of gegeneraliseerde begin. Als het aanvalstype onduidelijk is dan wordt gesproken van een epilepsie met onbekend begin (zie module ‘Classificatie’).
Als epilepsie met focaal begin wordt vastgesteld, dan zijn er verschillende middelen beschikbaar voor de behandeling. De keuze van het anti-aanvalsmedicijn wordt naast effectiviteit gebaseerd op bijvoorbeeld het bijwerkingenprofiel, comorbiditeit, comedicatie, patiënt karakteristieken of praktische overwegingen zoals het gebruiksgemak (NICE, 2012; Perucca, 2011). Tot zover bekend is er niet één bepaald middel dat qua effectiviteit superieur is aan de anderen. Het is tot zover onduidelijk welk middel de voorkeur heeft.
Om in deze module antwoord te geven op deze vraag, is deze module is opgesplitst in twee deelvragen. De twee deelvragen beantwoorden de beslismomenten zoals we die ook in de praktijk zien. Namelijk: “met welk middel start je bij patiënten met epileptische aanvallen met een focaal begin?” en “welk middel kan je het best toevoegen aan de behandeling als monotherapie faalt?”. Voor de beantwoording van deze laatste vraag wordt in de literatuur noodgedwongen uitgeweken naar studies waarin adjuvante behandeling bij patiënten met therapieresistente epilepsie wordt onderzocht. Dit zijn veelal patiënten die reeds meerdere middelen gebruikt hebben of polyfarmacie met meer dan twee anti-aanvalsmedicatie hebben.
Conclusies / Summary of Findings
Subquestion 1: Which anti-seizure monotherapy is the most effective and safe in patients with newly diagnosed focal onset seizures?
1. Carbamazepine vs phenytoin
| Moderate GRADE |
Seizure recurrence may occur slightly earlier on carbamazepine than on phenytoin. There is little to no difference in time to six- and 12-month remission between the two anti-seizure treatments in patients with focal onset seizures. Sources: Nevitt, 2019a |
2. Topiramate vs carbamazepine
| Moderate GRADE |
Treatment failure due to adverse events and seizure occurrence probably occurred slightly earlier on topiramate than carbamazepine and topiramate probably has a slightly less favorable effect on time to six- and 12-month remission compared to topiramate in patients with focal onset seizures. Sources: Nevitt, 2019b |
3. Zonisamide vs carbamazepine
| Low GRADE |
The evidence suggests that zonisamide has a similar effect on seizure freedom, retention rates and serious adverse effects compared to carbamazepine in patients with focal onset seizures and/or patients with seizures of unknown onset. Sources: Baulac, 2012; 2014 |
4. Lacosamide vs carbamazepine
| Low GRADE |
The evidence suggests that lacosamide has a similar effect on seizure freedom and serious adverse effects compared to carbamazepine in a group of patients with predominantly focal onset seizures. Sources: Baulac, 2017; Ben-Menachem, 2019 |
5. Levetiracetam vs carbamazepine or valproate
| Low GRADE |
The evidence suggests that levetiracetam has a similar effect on seizure freedom and (serious) adverse compared to carbamazepine or valproate in patients with predominantly focal onset seizures. Sources: Trinka, 2012; Suresh, 2015 |
6. Lamotrigine vs levetiracetam
| Low GRADE |
12-month remission from seizures may occur slightly more on lamotrigine than on levetiracetam in patients with focal epilepsy. Adverse events may occur more often in patients treated with levetiracetam compared to lamotrigine. There is little to no difference in 24-month remission from seizures and time to first seizure between the two anti-seizure treatments.
Sources: Marson (2021) |
7. Lamotrigine vs zonisamide
| Low GRADE |
Adverse events may occur more often in patients treated with zonisamide compared to lamotrigine in patients with focal epilepsy. There is little to no difference in 12-month and 24-month remission from seizures and time to first seizure between the two anti-seizure treatments.
Sources: Marson (2021) |
Subquestion 2: Which anti-seizure add-on therapy is the most effective and safe in patients with treatment resistant focal onset seizures?
8. Adjunctive brivaracetam, lamotrigine, levetiracetam, and perampanel vs placebo
|
High GRADE |
Adjunctive brivaracetam, lamotrigine, levetiracetam, and perampanel lead to more patients with focal onset drug-resistant seizures being seizure free compared to placebo.
Sources: Hu, 2020 |
9. Adjunctive lacosamide, oxcarbazepine and topiramate vs placebo
|
Moderate GRADE |
Lacosamide, oxcarbazepine and topiramate probably lead to more patients with focal onset drug-resistant seizures being seizure free compared to placebo.
Sources: Hu, 2020 |
10. Adjunctive pregabalin vs placebo
|
Low GRADE |
Pregabalin may result in more patients with focal onset drug-resistant seizures being seizure free compared to placebo.
Sources: Hu, 2020 |
11. Adjunctive gabapentin or zonisamide vs placebo
|
Low GRADE |
Gabapentin and zonisamide may not result in more patients with focal onset drug-resistant seizures being seizure free compared to placebo.
Sources: Hu, 2020 |
Samenvatting literatuur
1. Description of studies
Subquestion 1 - Which anti-seizure monotherapy is the most effective and safe in patients with newly diagnosed focal onset seizures?
Carbamazepine vs phenytoin
Nevitt (2019a) conducted an Individual Participant Data Meta-Analysis (IPDMA) to investigate the efficacy and safety of carbamazepine compared to phenytoin (any doses). The databases were searched with relevant search terms until August 2018. The study included randomized controlled trials (RTCs) comparing therapy with either carbamazepine or phenytoin in children or adults with focal onset seizures or generalized onset (tonic-clonic) seizures. To answer our research question, we used the results in patients with focal onset seizures (78% of total study population). Individual participant data were available for 595 participants out of 1102 eligible individuals, from four out of 11 trials (i.e. 54% of the potential data). The study reported about retention time, time to first seizure and time to six and 12-month remission.
Carbamazepine vs topiramate
In another IPDMA, Nevitt (2019b) investigated the effectiveness and safety of carbamazepine compared to topiramate (any doses). The literature search was conducted in May 2018. The study included RTCs comparing therapy with either carbamazepine or topiramate in children or adults with focal onset seizures or generalized onset (tonic-clonic) seizures. To answer our research question, we used the results in patients with focal onset seizures (81% of total study population). Individual participant data were available for 1.151 of 1.239 eligible individuals from two of three eligible studies (93% of the potential data). The study reported about time to first seizure, time to six-month remission and time to 12-month remission.
Carbamazepine vs zonisamide
Baulac (2012; 2014) compared carbamazepine to zonisamide in an RCT in a non-inferiority design. A total of 282 patients were randomized to zonisamide 100 mg/day and 301 patients were randomized to carbamazepine 200 mg/day (given in two doses) and up-titration (to 300 mg/day vs 600 mg/day). Patients entered a 26–78 weeks flexible-dosing period (200–500 mg/day vs 400–1200 mg/day, according to response and tolerance). Once patients were seizure-free for 26 weeks they entered a 26-week maintenance phase. The study reported about seizure freedom and retention rates at 6, 12 and 24-months and adverse event at 24 months.
Lacosamide vs controlled-release carbamazepine
Baulac (2017) conducted an RCT comparing lacosamide versus controlled-release carbamazepine. A total of 444 patients were randomized to 100 mg/day (uptitration to 200mg/day) lacosamide and 442 patients to 200 mg/day (uptitration to 400mg/day) carbamazepine-CR. To answer our research question, we used the results in patients with focal onset seizures (91% of total study population) as specified subgroup analyses were performed for patients who had a clear diagnosis of focal epilepsy at the end of the treatment period.
Ben‐Menachem (2019) performed a double blind extension trial for 24 months. Patients were eligible for the extension trial if they had remained seizure‐free and completed the 6‐month maintenance period of the initial trial, or had experienced one or more seizures during the 6‐month maintenance period while on the first or second target dose. A total of 548 patients were treated in the extension trial (n=279 lacosamide, n=269 carbamazepine). The study reported serious treatment‐emergent adverse events (TEAEs) and seizure freedom at 6, 12, and 24‐months.
Levetiracetam vs controlled-release carbamazepine and extended-release sodium valproate
Trinka (2012) compared levetiracetam with controlled-release carbamazepine and extended-release sodium valproate in an unblinded RCT in patients with newly diagnosed epilepsy. At screening, the clinician decided whether extended-release sodium valproate or controlled-release carbamazepine would be the standard first-line treatment. Central randomization, stratified by best recommended treatment, was done. Within the valproate stratum, patients were randomized to treatment with levetiracetam or valproate. Within the carbamazepine stratum, patients were randomized to treatment with levetiracetam or carbamazepine. Starting doses (levetiracetam 500 mg/day, valproate 500 mg/day, carbamazepine 200 mg/day, administered twice daily as equal doses) were up-titrated over two weeks to the initial target doses (levetiracetam 1000 mg/day, valproate 1000 mg/day, carbamazepine 600 mg/day). If a seizure occurred, doses could be increased according to the clinician’s judgement to a maximum of 3000, 2000 and 1600 mg/day for levetiracetam, valproate and carbamazepine, respectively. To answer our research question, we used the results in patients with focal onset seizures (65% of total study population; 30% in valproate stratum and 89% in carbamazepine stratum). The study reported time to treatment withdrawal, time to first seizure, seizure freedom, and adverse events.
Suresh (2015) investigated the effectiveness and safety of levetiracetam compared to carbamazepine in an open-label RCT including patients with newly diagnosed focal seizures with or without secondary generalization. Thirty patients were randomized to levetiracetam (500 to 3000mg/day) and 30 patients were randomized to carbamazepine (300 to 600mg/day). At baseline, the patient group randomized to levetiracetam experienced more seizures compared to the group randomized to carbamazepine (“pretreatment mean seizure frequency”, levetiracetam: 4.2 ± 0.65; carbamazepine 2.83 ± 0.19, p-value: 0.047, no details were provided for which duration these numbers applied). The total follow-up was 26 weeks. The study reported seizure freedom and adverse events.
Levetiracetam, zonisamide, or lamotrigine
In the SANAD II study, the effectiveness, safety and cost-effectiveness of levetiracetam, zonisamide and lamotrigine were compared in a phase four, open label RCT (Marson, 2021). Participants were eligible for recruitment if they were aged five years or older, had a history of at least two unprovoked seizures requiring anti-seizure medication, had focal epilepsy, and were treatment naïve. Exclusion criteria included patients with provoked or acute symptomatic seizures only, patients currently taking anti-seizure medication, and
known progressive neurological disease. Participants were randomly allocated (1:1:1) to receive either lamotrigine (n=330), levetiracetam (n=332), or zonisamide (n=328). For participants aged 12 years or older, the initial advised maintenance doses were lamotrigine (50 mg in the morning and 100 mg in the evening), levetiracetam (500 mg twice per day), and zonisamide (100 mg twice per day). For children aged 5-12 years, the initial daily maintenance doses advised were lamotrigine (1.5 mg/kg twice per day), levetiracetam (20 mg/kg twice per day), and zonisamide (2.5 mg/kg twice per day). Subsequent dose and treatment changes at follow-up visits were done following routine clinical practice according to treatment response and adverse effects. The study reported about time to 12-month and 24-month remission from seizures (calculated as days from randomization to the first date at which a period of 12/24 months had elapsed without the patient having any seizures), time to first seizure and adverse events.
1. Results
An overview of the results is shown in Table 1. Pooled results of levetiracetam versus carbamazepine for the outcome seizure freedom at six months, based on Suresh (2015) and Trinka (2012) is presented in Figure 1. The pooled risk ratio is 0.95 (95%CI 0.84 to 1.07), indicating no clear differences between the drugs regarding seizure freedom at six months.
Figure 2 shows the pooled results of of levetiracetam versus carbamazepine for the outcome ≥1 adverse events based on Suresh (2015) and Trinka (2012). The pooled risk ratio is 1.01 (95%CI 0.94 to 1.09), indicating no clear differences between the drugs regarding adverse events.
Table 1 Summary of findings of subquestion 1
| Nevitt (2019a) Carbamazepine (CBZ) Phenyotin (PHT) |
Seizure recurrence (432 participants, four trials)
Time to six-month remission (430 participants, three trials)
Time to 12-month remission (430 participants, three trials) HR: 1.06 (95%CI 0.80 to 1.42); indicating no clear differences between the drugs. |
|
Nevitt (2019b) Topiramate (TPM) Carbamazepine (CBZ) |
Time to treatment failure (due to adverse events)
Seizure recurrence
Time to six-month remission Time to 12-month remission |
| Baulac (2012; 2014) Zonisamide (ZNS) Carbamazepine (CBZ) |
Seizure freedom, at 6 mo (Baulac, 2012) CBZ: n=224 out of 300 (74.7%) The absolute difference was -6.1% (95%CI -13.6 to 1.4) in the intention-to-treat population.
Seizure freedom, at 12 mo (Baulac, 2012) CBZ: n=187 (62.3%)
Seizure freedom, at 24 mo (Baulac, 2014) ZNS: 32.3% (95%CI 26.5 to 38.0%)
Retention rates (Baulac, 2012; Baulac, 2014)
Serious treatment emergent adverse events, at 24 mo (Baulac, 2014) There were no reports of Stevens-Johnson syndrome or toxic epidermal necrolysis in either group. |
| Baulac (2017); Ben‐Menachem (2019) lacosamide (LCM) carbamazepine (CBZ) |
Seizure freedom after 6-month assessment period (Baulac, 2017) Remaining seizure-free for 12 consecutive months during follow-up1 (Ben‐Menachem, 2019)
Seizure freedom, at 12 mo1 (Ben‐Menachem, 2019) Seizure freedom, at 24 mo1 (Ben‐Menachem, 2019)
Drug-related treatment emergent adverse events, at 24 mo1 (Ben‐Menachem, 2019)
Serious treatment emergent adverse events, at 24 mo1 (Ben‐Menachem, 2019) |
| Suresh (2015) Levetiracetam (LEV) Carbamazepine (CBZ) |
Seizure freedom, at 6mo p-value=not significant See figure 1 for pooled results.
Adverse events ≥1, at 6 mo |
| Trinka (2012) Levetiracetam (LEV) Carbamazepine (CBZ) Valproate (VPA) |
Time to treatment withdrawal LEV vs CBZ: -4.2 (95%CI -10.7 to 2.2) See figure 1 for pooled results.
Seizure freedom, 12mo; absolute difference
Adverse events ≥1, at 12mo
|
|
SANAD-II Marson (2021) Zonisamide (ZNS) |
12-month remission from seizures (calculated as days from randomization to the first date at which a period of 12 months had elapsed without the patient having any seizures) LTG vs LEV: unadjusted HR 1.18 (97.5%CI 0.96 to 1.47); indicating a slight advantage for lamotrigine, which is not statistically significant nor clinically relevant.2 adjusted for gender, number of seizures and centre as random effect HR 1.13 (97.5%CI 0.91 to 1.41) indicating a slight advantage for lamotrigine, which is not statistically significant nor clinically relevant.2 LTG vs ZNS: HR 1.03 (97.5%CI 0.83 to 1.28); indicating no clear differences between the drugs. [adjusted for gender, number of seizures and centre as random effect] 2
24-month remission from seizures (unadjusted) LTG vs LEV: HR 1.04 (95%CI 0.81 to 1.33) indicating no clear differences between the drugs.
Time to first seizure
LTG vs LEV: RR 0.75 (95%CI 0.62 to 0.92); indicating an advantage for LTG, which is statistically significant and clinically relevant. LTG vs ZNS: RR 0.60 (95%CI 0.44 to 0.82); indicating an advantage for LTG, which is statistically significant and clinically relevant. Seven events were classified as a serious adverse reaction (SAE) in two participants who initiated LTG, one participant who initiated LEV, four participants who initiated ZNS.
2 SANAD II was designed to assess non-inferiority of both LEV and ZNS to LTG for the primary outcome of time to 12-month remission. The non-inferiority limit was a hazard ratio (HR) of 1.329, which equates to an absolute difference of 10%. The study concluded that there was a possibility of an important clinical difference between LEV and LTG. |
Based of intention-to-treat analyses, unless otherwise specified CI: confidence interval; 1= based on a population with ±10% having generalized tonic–clonic seizures.
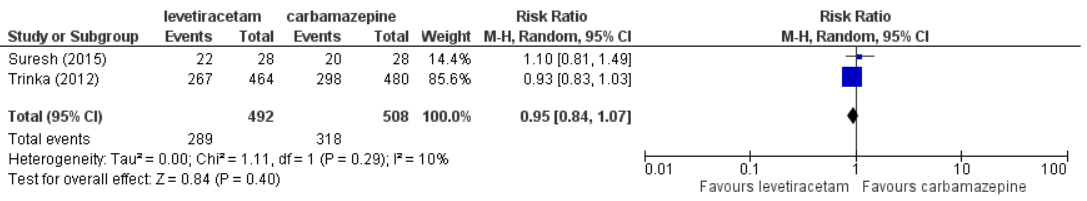
Figure 1. Pooled results of levetiracetam versus carbamazepine for outcome seizure freedom, at 6 months
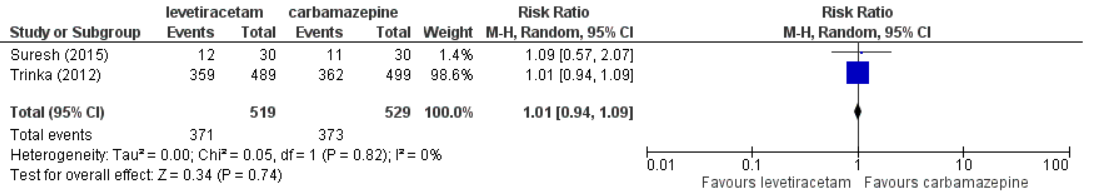
Figure 2. Pooled results of levetiracetam versus carbamazepine for outcome ≥1 adverse events
2. Description of studies
Subquestion 2. Which anti-seizure add-on therapy is the most effective and safe in patients with treatment resistant focal onset seizures?
For the NICE guideline, a network meta-analyses (NMA) of ASMs in focal drug-resistant epilepsy was conducted. Various databases (including MEDLINE, CENTRAL and EMBASE) were searched from their inception until February 3rd, 2021. RCTs or systematic reviews/meta-analyses of RCTs that compared any ASM as adjunctive therapy for focal-onset drug-resistant epilepsy against placebo or other ASMs were included in the network. Trial arms with differing drug dose were pooled together in the analysis as dose comparisons were outside of the scope of this review. Risk of bias of the individual studies were assessed according Cochrane RoB tool v.2 for RCTs. NMAs were performed for the outcomes seizure-free-rate and 50% seizure reduction. In addition, outcomes were described for adverse events, i.e. percentage of patients with reported side effects and treatment cessation due to adverse event.
2. Results
Seizure incidence
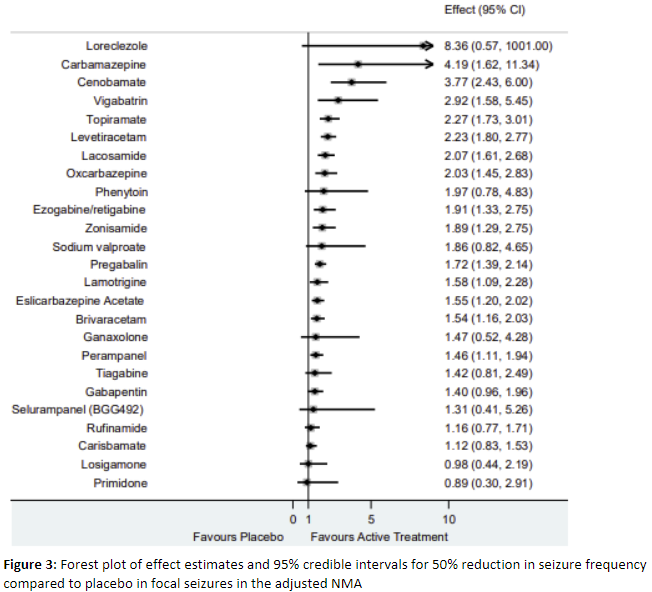
The results of the NMA for seizure freedom and 50% seizure reduction are shown in Table 2. Seizure incidence was assessed as >50% reduction in seizure frequency during treatment or maintenance period. For seizure freedom, 40 out of 61 studies provided data with in total 9.136 patients. The odds ratios for 50% seizure reduction were larger than 1 for all ASMs except for losigamone and primidone, suggesting better effectiveness than placebo. However, note that some intervals were very wide suggesting (high) uncertainty around the estimate.
Table 2. Estimated odds ratios for the unadjusted and adjusted network meta-analyses for seizure freedom and 50% seizure reduction
|
ASM |
Seizure freedom |
50% Seizure reduction
|
||
|
Unadjusted NMA OR (95% CrI) |
Adjusted NMA OR (95% CrI) |
Unadjusted NMA OR (95% CrI) |
Adjusted NMA OR (95% CrI) |
|
|
Brivaracetam |
9.85(2.63-50.63) |
6.75(1.89-31.17) |
2.26(1.55-3.33) |
1.54(1.16-2.03) |
|
Carbamazepine |
NR |
NR |
9.76(2.91-32.94) |
4.19(1.62-11.34) |
|
Carisbamate |
2.73(0.31-26.7) |
2.07(0.28-16.08) |
1.44(0.89-2.33) |
1.12(0.83-1.53) |
|
Cenobamate |
4.06(0.92-20.96) |
12.62(1.01-453.1) |
2.30(1.23-4.29) |
3.77(2.43-6.00) |
|
Eslicarbazepine Acetate |
4.05(1.31-13.7) |
3.12(1.03-10.04) |
1.96(1.35-2.87) |
1.55(1.2-2.02) |
|
Ezogabine/retigabine |
9.53(1.45-111.5) |
6.15(1.02-61.76) |
3.13(1.93-5.18) |
1.91(1.33-2.75) |
|
Gabapentin |
4.5(0.22-202.6) |
2.92(0.18-114.9) |
2.28(1.46-3.58) |
1.4(0.96-1.96) |
|
Ganaxolone |
NR |
NR |
2.71(0.83-9.74) |
1.47(0.52-4.28) |
|
Lacosamide |
4.76(1.54-19.37) |
3.85(1.34-13.81) |
2.42(1.64-3.55) |
2.07(1.61-2.68) |
|
Lamotrigine |
1.73(0.61-5.00) |
1.88(0.88-4.04) |
1.74(1.04-2.92) |
1.58(1.09-2.28) |
|
Levetiracetam |
10.19(5.01-22.59) |
8.84(4.65-17.14) |
3.10(2.37-4.09) |
2.23(1.80-2.77) |
|
Loreclezole |
NR |
NR |
30.08(1.71-13360) |
8.36(0.57-1001) |
|
Losigamone |
NR |
NR |
1.72(0.62-4.85) |
0.98(0.44-2.19) |
|
Oxcarbazepine |
7.07(1.72-33.54) |
5.29(1.36-21.82) |
2.91(1.81-4.74) |
2.03(1.45-2.83) |
|
Perampanel |
5.49(1.46-25.25) |
4.45(1.57-13.78) |
2.03(1.38-2.99) |
1.46(1.11-1.94) |
|
Phenytoin |
NR |
NR |
4.47(1.42-14.11) |
1.97(0.78-4.83) |
|
Pregabalin |
2.46(0.82-7.65) |
2.02(0.70-5.62) |
2.41(1.8-3.26) |
1.72(1.39-2.14) |
|
Primidone |
4.34(0.12-324.4) |
3.14(0.11-185.6) |
1.26(0.29-5.59) |
0.89(0.30-2.91) |
|
Rufinamide |
2.21(0.21-26.15) |
1.68(0.19-16.07) |
2.04(1.24-3.42) |
1.16(0.77-1.71) |
|
Selurampanel (BGG492) |
2.08(0.11-93.76) |
1.85(0.12-79.15) |
2.17(0.56-10.31) |
1.31(0.41-5.26) |
|
Sodium valproate |
7.98(0.47-373) |
5.76(0.37-236.2) |
2.64(0.92-7.86) |
1.86(0.82-4.65) |
|
Tiagabine |
2.05(0.04-69.26) |
1.75(0.03-48.42) |
3.26(1.76-6.17) |
1.42(0.81-2.49) |
|
Topiramate |
5.63(2.07-17.72) |
4.88(1.95-13.36) |
3.54(2.54-5.03) |
2.27(1.73-3.01) |
|
Vigabatrin |
6.42(0.84-78.36) |
5.03(0.71-54.1) |
4.38(2.14-9.22) |
2.92(1.58-5.45) |
|
Zonisamide |
2.41(0.52-12.27) |
1.8(0.42-8.12) |
2.43(1.47-4.02) |
1.89(1.29-2.75) |
Adjusted for placebo drift (placebo response rate change overtime likely caused both through an improvement in the management of epilepsy and through tougher selection criteria for inclusion in clinical trials). NR: not reported; CrL: credible intervals, in this model credible intervals can be interpreted as confidence intervals.
Adapted from NICE (2022). ASMs not available in The Netherlands and ASMs only prescribed in epilepsy expertise centers for specific epilepsy syndromes are colored grey. Further discussion can be found in the considerations paragraph.
Time to seizure recurrence (critical) and retention rate (important)
The performed NMA for the update of the NICE guidelines did not report time to seizure recurrence and retention rate
Adverse events (important)
The percentage of patients with reported side effects and treatment cessation due to adverse events were reported inconsistently across studies and it was difficult to draw conclusions. An overview of mean percentages recorded adverse events and treatment cessation due to adverse events for all ASMs is shown in Table 3.
Table 3. Adverse event rate and consequential withdrawal for antiseizure medications used as add-on medication for patients with focal seizures
|
ASM |
n |
Total patients with AE (%) |
Patients withdrew from medication due to AE (%) |
|
Brivaracetam |
1404 |
67.0% |
14.0% |
|
Carbamazepine |
101 |
NR |
NR |
|
Carisbamate |
2212 |
59.3% |
11.1% |
|
Cenobamate |
76 |
NR |
NR |
|
Eslicarbamazepine Acetate |
633 |
43.6% |
13.4% |
|
Gabapentin |
68 |
NR |
NR |
|
Ganaxolone |
871 |
80.0% |
11.8% |
|
Lacosamide |
863 |
63.4% |
23.6% |
|
Lamotrigine |
1686 |
52.7% |
6.0% |
|
Levetiracetam |
1114 |
25.0% |
4.4% |
|
Loreclezole |
99 |
59.6% |
11.1% |
|
Losigamone |
952 |
82.4% |
16.9% |
|
Oxcarbazepine |
209 |
54.7% |
11.5% |
|
Perampanel |
442 |
76.9% |
12.0% |
|
Phenytoin |
1708 |
76.4% |
9.3% |
|
Placebo |
8873 |
48.4% |
5.3% |
|
Pregabalin |
739 |
54.0% |
6.5% |
|
Primidone |
2017 |
73.0% |
6.8% |
|
Retigabine |
1094 |
37.7% |
15.0% |
|
Rufinamide |
68 |
67.6 |
11.8% |
|
Selurampanel |
142 |
NR |
0.7% |
|
Sodium valproate |
98 |
83.7% |
7.1% |
|
Tiagabine |
1478 |
648 |
9.6% |
|
Topiramate |
687 |
10.6% |
9.8% |
|
Vigabatrin |
32 |
NR |
NR |
|
Zonisamide |
480 |
44.8% |
12.9% |
Abbreviatons: AE: adverse event. NR: not reported. Adapted from NICE (2022). ASMs not available in The Netherlands and ASMs only prescribed in epilepsy expertise centers for specific epilepsy syndromes are colored grey. Further discussion can be found in the considerations paragraph.
Level of evidence of the literature
(SRs of) RCTs and start at a high level of evidence.
Subquestion 1: Which anti-seizure monotherapy is the most effective and safe in patients with newly diagnosed focal onset seizures?
1. Carbamazepine vs phenytoin
The level of evidence regarding the outcome measures retention time, seizure recurrence, time to six and twelve-months remission was downgraded by one level due to imprecision (-1, crossing boundaries clinical relevance).
2. Topiramate vs carbamazepine
The level of evidence regarding the outcome measures seizure recurrence, time to six and twelve-months remission was downgraded by one level due to imprecision (-1, crossing boundaries clinical relevance).
3. Zonisamide vs carbamazepine
The level of evidence regarding the outcome measures seizure freedom, retention rate and serious adverse events was downgraded by two levels because of study limitations (-1, risk of bias); number of included patients (-1, imprecision).
4. Lacosamide vs carbamazepine
The level of evidence regarding the outcome measures seizure freedom and serious adverse events was downgraded by two levels because of study limitations (-1, risk of bias); number of included patients (-1, imprecision).
5. Levetiracetam vs carbamazepine or valproate
The level of evidence regarding the outcome measures seizure freedom and (serious) adverse events was downgraded by two levels because of study limitations (-1, risk of bias); number of included patients (-1, imprecision).
6. Lamotrigine vs levetiracetam
The level of evidence regarding the outcome measures 12- and 24-month remission from seizures time to first seizure and adverse events were downgraded by two levels because of study limitations (-1, risk of bias) and due to imprecision (-1, crossing boundaries clinical relevance).
7. Lamotrigine vs zonisamide
The level of evidence regarding the outcome measures 12- and 24-month remission from seizures time to first seizure and adverse events were downgraded by two levels because of study limitations (-1, risk of bias) and due to imprecision (-1, crossing boundaries clinical relevance).
Subquestion 2: Which anti-seizure add-on therapy is the most effective and safe in patients with treatment resistant focal epilepsy?
8. Seizure incidence
The level of evidence regarding the outcome measures seizure freedom and (serious) adverse events was downgraded due to risk of bias (mainly due to missing outcome data and some concerns about bias arising from the randomisation process, deviation from the protocol). For cenobamate, ezogabine/retigabine, eslicarbazepine acetate, lamotrigine, brivaracetam, perampanel the level of evidence was downgraded by one extra level due to imprecision to low. For loreclezole, sodium valproate, vigabatrin, primidone, gabapentin, carisbamate, pregabalin, selurampanel, zonisamide, tiagabine, rufinamide, phenytoin, ganaxolone, losigamone was downgraded by two extra levels due to imprecision to very low. Publication bias was not assessed but might be present, yet was not a reason for downgrading.
9. Adverse events
The level of evidence regarding the outcome measure adverse events for was downgraded by three levels due to risk of bias, heterogeneity in assessing and reporting adverse events through different studies; and impression (large variation in estimates).
Time to seizure recurrence
The level of evidence regarding the outcomes time to seizure recurrence could not be assessed with GRADE, as this outcome measure was not studied in the performed NMA.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
PICO 1: Which anti-seizure monotherapy is the most effective and safe in patients with newly diagnosed focal onset seizures?
P: Patients with newly diagnosed focal onset seizures and an indication for anti-seizure treatment
I: Anti-seizure drug (AED) monotherapy
C: Other AEDs
O: Seizure incidence (seizure freedom, 50% seizure reduction), time to seizure recurrence, retention/discontinuation rate, adverse events
PICO 2: Which anti-seizure add-on therapy is the most effective and safe in patients with treatment resistant focal onset seizures?
P: Patients with treatment resistant focal onset epilepsy and with an indication for anti-seizure treatment
I: Add-on anti-seizure drugs (AEDs)
C: Other AEDs, other dose, placebo, no treatment
O: Seizure incidence (seizure freedom, 50% seizure reduction), time to seizure recurrence, retention/discontinuation rate, adverse events
Not all anti-seizure drugs are included in the literature summary for the following reasons:
- Eslicarbazepin, tiagabine, and sulthiame are not available in The Netherlands.
- Cenobamate is expected to become available in The Netherlands on short term. However, at the time of our literature search it was not yet and is therefore excluded from the summary of the literature.
- Vigabatrin, stiripentol, rufinamide and felbamate are only indicated in patients with specific epilepsy syndromes (such as Severe Myoclonic Epilepsy in Infancy SMEI/ Dravet or Lennox-Gastaut, see: www.farmacotherapeutischkompas.nl), we excluded these drugs from the summary of literature. These drugs are only prescribed in epilepsy expertise centres in The Netherlands.
Relevant outcome measures
The working group considered seizure incidence and time to seizure recurrence as a critical outcome measure for decision making; retention/discontinuation rate and adverse effects as an important outcome measure for decision making.
The working group did not define the outcome measures listed above but used the definitions used in the studies. For instance, for seizure freedom this could mean number of patients being seizure free at a certain time point during follow-up or for a certain duration during follow-up.
The working group defined HR/RR ≤0.8 or ≥1.25 (dichotomous variables) and 0.5 SD (continuous variables) as minimal clinically (patient) important difference, and HR/RR between 0.8 and 0.9 or 1.10 and 1.25 as small effects.
Search and select (Methods)
From 2012 onwards a yearly search of the literature was conducted to check for relevant new literature (last search 24-11-2022). The search was limited to systematic reviews and randomized controlled trials. The systematic literature search resulted in 1.204 hits. Studies were selected based on the following criteria:
-
systematic review (searched in at least two databases, and detailed search strategy, risk of bias assessment and results of individual studies available) or randomized controlled trial;
-
full-text English language publication;
-
studies including ≥ 20 (ten in each study arm) patients; and
-
studies according to PICO.
Studies that included solely children were excluded. In general, studies in Asian populations were excluded due to different genetic variations influencing epilepsy and treatment decisions in these populations. One literature search was conducted for the effectiveness and safety of ASMs for focal onset, generalized onset, and unclassified onset seizures.
The module was fully revised in 2021. In 2022, the Dutch National Health Care Institute (Zorginstituut) published a statement about cenobamate. They concluded that cenobamate is indicated as add-on therapy in patients with treatment resistant focal onset epilepsy with a medical history of at least two ASMs. The working group decided to revise subquestion 2 (add-on therapy) and concluded that subquestion 1 (monotherapy) was still up to date.
For subquestion 1, nine studies were included in the summary of the literature (see the table with reasons for exclusion under the tab Methods). For subquestion 2, the update of the NICE guideline from 2022 was used.
Results
Eight studies were included in the analysis of the literature; seven studies for PICO 1 and one study for PICO 2. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Abou-Khalil, B. W. (2019). Update on antiepileptic drugs 2019. CONTINUUM: Lifelong Learning in Neurology, 25(2), 508-536.
- Baulac, M., Brodie, M. J., Patten, A., Segieth, J., & Giorgi, L. (2012). Efficacy and tolerability of zonisamide versus controlled-release carbamazepine for newly diagnosed partial epilepsy: a phase 3, randomised, double-blind, non-inferiority trial. The Lancet Neurology, 11(7), 579-588.
- Baulac, M., Patten, A., & Giorgi, L. (2014). Long‐term safety and efficacy of zonisamide versus carbamazepine monotherapy for treatment of partial seizures in adults with newly diagnosed epilepsy: results of a phase III, randomized, double‐blind study. Epilepsia, 55(10), 1534-1543.
- Baulac, M., Rosenow, F., Toledo, M., Terada, K., Li, T., De Backer, M.,... & Brock, M. (2017). Efficacy, safety, and tolerability of lacosamide monotherapy versus controlled-release carbamazepine in patients with newly diagnosed epilepsy: a phase 3, randomised, double-blind, non-inferiority trial. The Lancet Neurology, 16(1), 43-54.
- Ben‐Menachem, E., Grebe, H. P., Terada, K., Jensen, L., Li, T., De Backer, M.,... & Biton, V. (2019). Long‐term safety and efficacy of lacosamide and controlled‐release carbamazepine monotherapy in patients with newly diagnosed epilepsy. Epilepsia, 60(12), 2437-2447.
- Bolin, K., Berggren, F., & Forsgren, L. (2010). Lacosamide as treatment of epileptic seizures–cost utility results for Sweden. Acta Neurologica Scandinavica, 121(6), 406-412.
- Chen, C. B., Hsiao, Y. H., Wu, T., Hsih, M. S., Tassaneeyakul, W., Jorns, T. P.,... & Taiwan Severe Cutaneous Adverse Reaction Consortium. (2017). Risk and association of HLA with oxcarbazepine-induced cutaneous adverse reactions in Asians. Neurology, 88(1), 78-86.
- Ensrud, K. E., Walczak, T. S., Blackwell, T. L., Ensrud, E. R., Barrett-Connor, E., & Orwoll, E. S. (2008). Antiepileptic drug use and rates of hip bone loss in older men: a prospective study. Neurology, 71(10), 723-730.
- FDA, 2021. Studies show increased risk of heart rhythm problems with seizure and mental health medicine lamotrigine (Lamictal) in patients with heart disease. 31 March 2021 FDA Drug Safety Communication. Link: https://www.fda.gov/drugs/drug-safety-and-availability/studies-show-increased-risk-heart-rhythm-problems-seizure-and-mental-health-medicine-lamotrigine?utm_medium=email&utm_source=govdelivery
- French, J. A., Perucca, E., Sander, J. W., Bergfeldt, L., Baulac, M., Auerbach, D. S.,... & Welty, T. E. (2021). FDA safety warning on the cardiac effects of lamotrigine: An advisory from the Ad Hoc ILAE/AES Task Force. Epilepsy Currents, 1535759721996344.
- Hawkins, N., Epstein, D., Drummond, M., Wilby, J., Kainth, A., Chadwick, D., & Sculpher, M. (2005). Assessing the cost-effectiveness of new pharmaceuticals in epilepsy in adults: the results of a probabilistic decision model. Medical decision making, 25(5), 493-510.
- Hu, T. Y., Wang, H. Q., Zhang, W. P., Tian, R. F., Lei, G. S., Deng, Y. C., & Xing, J. L. (2020). Network meta-analysis of antiepileptic drugs in focal drug-resistant epilepsy. Epilepsy Research, 167, 106433.
- Kanner, A. M., Ashman, E., Gloss, D., Harden, C., Bourgeois, B., Bautista, J. F.,... & French, J. (2018). Practice guideline update summary: efficacy and tolerability of the new antiepileptic drugs I: treatment of new-onset epilepsy. Epilepsy currents, 18(4), 260-268.
- Knoester, P. D., Boendermaker, A. J., Egberts, A. C. G., Hekster, Y. A., Keyser, A., Severens, J. L.,... & Deckers, C. L. P. (2005). Cost-effectiveness of add-on lamotrigine therapy in clinical practice. Epilepsy research, 67(3), 143-151.
- Kwan, P., Arzimanoglou, A., Berg, A. T., Brodie, M. J., Allen Hauser, W., Mathern, G.,... & French, J. (2010). Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies.
- Lattanzi, S., De Maria, G., Rosati, E., Didato, G., Chiesa, V., Ranzato, F.,... & Beretta, S. (2021). Brivaracetam as add‐on treatment in focal epilepsy: A real‐world time‐based analysis. Epilepsia, 62(1), e1-e6.
- Maltoni, S., & Messori, A. (2003). Lifetime cost-utility analysis of patients with refractory epilepsy treated with adjunctive topiramate therapy. Clinical drug investigation, 23(4), 225-232.
- Marson, A. G., Al-Kharusi, A. M., Alwaidh, M., Appleton, R., Baker, G. A., Chadwick, D. W.,... & SANAD Study Group. (2007). The SANAD study of effectiveness of carbamazepine, gabapentin, lamotrigine, oxcarbazepine, or topiramate for treatment of partial epilepsy: an unblinded randomised controlled trial. The Lancet, 369(9566), 1000-1015.
- Marson, A. G., Appleton, R., Baker, G. A., Chadwick, D. W., Doughty, J., Eaton, B.,... & Williamson, P. R. (2007). A randomised controlled trial examining the longer-term outcomes of standard versus new antiepileptic drugs. The SANAD trial. HEALTH TECHNOLOGY ASSESSMENT-SOUTHAMPTON-, 11(37).
- Marson, A., Burnside, G., Appleton, R., Smith, D., Leach, J. P., Sills, G.,... & Jauhari, P. (2021). The SANAD II study of the effectiveness and cost-effectiveness of levetiracetam, zonisamide, or lamotrigine for newly diagnosed focal epilepsy: an open-label, non-inferiority, multicentre, phase 4, randomised controlled trial. The Lancet, 397(10282), 1363-1374.
- Moshé, S. L., Perucca, E., Ryvlin, P., & Tomson, T. (2015). Epilepsy: new advances. The Lancet, 385(9971), 884-898.
- Nevitt, S. J., Sudell, M., Smith, C. T., & Marson, A. G. (2019). Topiramate versus carbamazepine monotherapy for epilepsy: an individual participant data review. Cochrane Database of Systematic Reviews, (6).
- Nevitt, S. J., Marson, A. G., & Smith, C. T. (2019). Carbamazepine versus phenytoin monotherapy for epilepsy: an individual participant data review. Cochrane Database of Systematic Reviews, (7).
- Nevitt, S. J., Sudell, M., Weston, J., Smith, C. T., & Marson, A. G. (2017). Antiepileptic drug monotherapy for epilepsy: a network meta‐analysis of individual participant data. Cochrane Database of Systematic Reviews, (6).
- NICE, 2012. Epilepsies: diagnosis and management Clinical guideline [CG137] Published: 11 January 2012 Last updated: 12 May 2021. Link: https://www.nice.org.uk/guidance/CG137
- Nikolakopoulou A, Higgins JPT, Papakonstantinou T, Chaimani A, Del Giovane C, Egger M, Salanti G. CINeMA: An approach for assessing confidence in the results of a network meta-analysis. PLoS Med. 2020 Apr 3;17(4):e1003082. doi: 10.1371/journal.pmed.1003082. PMID: 32243458; PMCID: PMC7122720.
- Papakonstantinou T, Nikolakopoulou A, Higgins JPT, Egger M & Salanti G. CINeMA: Software for semiautomated assessment of the confidence in the results of network meta-analysis. Campbell Systematic Reviews 2020;16:e1080.
- Remak, E., Hutton, J., Price, M., Peeters, K., & Adriaenssen, I. (2003). A Markov model of treatment of newly diagnosed epilepsy in the UK. The European Journal of Health Economics, formerly: HEPAC, 4(4), 271-278.
- Remák, E., Hutton, J., Selai, C. E., Trimble, M. R., & Price, M. J. (2004). A cost-utility analysis of adjunctive treatment with newer antiepileptic drugs in the UK. Journal of Medical Economics, 7(1-4), 29-40.
- Sake, J. K., Hebert, D., Isojärvi, J., Doty, P., De Backer, M., Davies, K.,... & Zackheim, J. (2010). A pooled analysis of lacosamide clinical trial data grouped by mechanism of action of concomitant antiepileptic drugs. CNS drugs, 24(12), 1055-1068.
- Schiller, Y., & Najjar, Y. (2008). Quantifying the response to antiepileptic drugs: effect of past treatment history. Neurology, 70(1), 54-65.
- Simoens, S., De Naeyer, L., & Dedeken, P. (2012). Cost effectiveness of lacosamide in the adjunctive treatment of patients with refractory focal epilepsy in Belgium. CNS drugs, 26(4), 337-350.
- Suresh, S. H., Chakraborty, A., Virupakshaiah, A., & Kumar, N. (2015). Efficacy and safety of levetiracetam and carbamazepine as monotherapy in partial seizures. Epilepsy research and treatment, 2015.
- Spackman, D. E., Yeates, A., Rentz, A. M., & Hutton, J. (2007). The cost effectiveness of zonisamide as adjunctive therapy in adult partial seizure epilepsy. Journal of Medical Economics, 10(4), 455-473.
- Tassaneeyakul, W., Tiamkao, S., Jantararoungtong, T., Chen, P., Lin, S. Y., Chen, W. H.,... & Yodnopaglaw, P. (2010). Association between HLA‐B* 1502 and carbamazepine‐induced severe cutaneous adverse drug reactions in a Thai population. Epilepsia, 51(5), 926-930.
- Tomson, T., Marson, A., Boon, P., Canevini, M. P., Covanis, A., Gaily, E.,... & Trinka, E. (2015). Valproate in the treatment of epilepsy in women and girls Pre-Publication Summary of Recommendations from a joint Task Force of ILAE-Commission on European Affairs* and European Academy of Neurology (EAN).
- Trinka, E., Marson, A. G., Van Paesschen, W., Kälviäinen, R., Marovac, J., Duncan, B.,... & KOMET Study Group. (2013). KOMET: an unblinded, randomised, two parallel-group, stratified trial comparing the effectiveness of levetiracetam with controlled-release carbamazepine and extended-release sodium valproate as monotherapy in patients with newly diagnosed epilepsy. Journal of Neurology, Neurosurgery & Psychiatry, 84(10), 1138-1147.
- Vera‐Llonch, M., Brandenburg, N. A., & Oster, G. (2008). Cost‐effectiveness of add‐on therapy with pregabalin in patients with refractory partial epilepsy. Epilepsia, 49(3), 431-437.
Evidence tabellen
Hu (2020) – Network meta-analyses: outcome ‘Seizure-free rate’
|
Study |
id |
t1 |
r1 |
n1 |
t2 |
r2 |
n2 |
rob |
Indirectness |
|
Anhut (1994) |
1 |
gabapentin |
/ |
52 |
placebo |
/ |
109 |
1 |
1 |
|
Arrayo (2004) |
2 |
placebo |
1 |
96 |
pregabalin |
11 |
92 |
1 |
1 |
|
Baulac (2010) |
3 |
pregabalin |
17 |
152 |
placebo |
16 |
141 |
1 |
1 |
|
Ben - Menachem (2000) |
4 |
levetiracetam |
15 |
181 |
placebo |
1 |
105 |
1 |
1 |
|
Ben - Menachem (2007) |
5 |
placebo |
3 |
97 |
levetiracetam |
12 |
106 |
1 |
1 |
|
Ben - Menachem (2010) |
6 |
placebo |
1 |
100 |
EZG/RTG |
4 |
97 |
1 |
2 |
|
Beran (1998) |
7 |
lamotragine |
/ |
20 |
placebo |
/ |
21 |
2 |
1 |
|
Beydoun (2005) |
8 |
placebo |
/ |
98 |
pregabalin |
/ |
111 |
1 |
1 |
|
Biton (2011) |
9 |
RUF |
/ |
176 |
placebo |
/ |
181 |
1 |
|
|
Biton (2014) |
10 |
brivaracetam |
4 |
101 |
placebo |
0 |
98 |
1 |
1 |
|
Brodie (2004) |
11 |
zonisamide |
/ |
73 |
placebo |
/ |
71 |
1 |
1 |
|
Brodie (2005) |
12 |
placebo |
2 |
120 |
zonisamide |
6 |
118 |
2 |
1 |
|
Brodie (2009) |
13 |
RUF |
6 |
156 |
placebo |
3 |
157 |
1 |
2 |
|
Brodie (2010) |
14 |
placebo |
2 |
50 |
EZG/RTG |
7 |
48 |
1 |
2 |
|
Cereghino (2000) |
15 |
placebo |
0 |
95 |
levetiracetam |
8 |
101 |
1 |
1 |
|
Chadwick (2002) |
16 |
RMC |
0 |
64 |
placebo |
0 |
64 |
1 |
2 |
|
Chung (2010) |
17 |
placebo |
0 |
104 |
lacosamide |
5 |
97 |
1 |
1 |
|
Cramer (2000) |
18 |
placebo |
/ |
81 |
levetiracetam |
/ |
85 |
1 |
1 |
|
Elger (2007) |
19 |
ESL |
12 |
50 |
placebo |
3 |
47 |
1 |
2 |
|
Elger (2009) |
20 |
ESL |
8 |
102 |
placeno |
2 |
102 |
1 |
2 |
|
Elger (2010) |
21 |
placebo |
/ |
133 |
RUF |
/ |
133 |
1 |
2 |
|
Faught (1996) |
22 |
topiramate |
/ |
28 |
placebo |
/ |
28 |
1 |
1 |
|
Faught (2008) |
23 |
carisbamate |
/ |
106 |
placebo |
/ |
109 |
1 |
2 |
|
French (2003) |
24 |
pregabalin |
/ |
89 |
placebo |
/ |
100 |
1 |
1 |
|
French (2011) |
25 |
Ezogabin |
3 |
154 |
placebo |
0 |
152 |
1 |
2 |
|
French (2012) |
26 |
perampanel |
2 |
134 |
placebo |
0 |
121 |
1 |
1 |
|
French (2013) |
27 |
perampanel |
6 |
121 |
placebo |
2 |
136 |
1 |
1 |
|
French (2014) |
28 |
oxcarbaz |
14 |
123 |
placebo |
4 |
121 |
1 |
1 |
|
Gil-Nagel (2009) |
29 |
eslicarba |
3 |
80 |
placebo |
1 |
87 |
1 |
2 |
|
Halasz (2009) |
30 |
lacosamide |
3 |
159 |
placebo |
0 |
163 |
1 |
1 |
|
Halford (2011) |
31 |
carisbamate |
9 |
182 |
placebo |
4 |
185 |
1 |
2 |
|
Kalviainen (1998) |
32 |
topiramate |
2 |
77 |
placebo |
0 |
77 |
1 |
1 |
|
Klein (2015) |
33 |
placebo |
2 |
263 |
brivarecetam |
13 |
251 |
1 |
1 |
|
Korean Topiramate group (1999) |
34 |
topiramate |
7 |
91 |
placebo |
1 |
86 |
1 |
1 |
|
Krauss (2012a) |
35 |
placebo |
2 |
185 |
perampanel |
8 |
169 |
1 |
1 |
|
Krauss (2012b1) |
36 |
placebo |
/ |
51 |
perampanel |
/ |
51 |
1 |
1 |
|
Krauss (2012b2) |
37 |
perampanel |
/ |
38 |
placebo |
/ |
10 |
1 |
1 |
|
Lee (2009) |
38 |
pregabalin |
5 |
119 |
placebo |
2 |
59 |
1 |
1 |
|
Lim (2016) |
39 |
Retigabine/ ezogabine |
4 |
24 |
placebo |
0 |
25 |
1 |
1 |
|
Lindberger (2000) |
40 |
gabapentin |
13 |
50 |
vigabatrin |
18 |
52 |
1 |
2 |
|
Lu (2011) |
41 |
zonisamide |
3 |
53 |
placebo |
1 |
50 |
1 |
1 |
|
Naritoku (2007) |
42 |
lamotragine |
22 |
116 |
placebo |
6 |
120 |
1 |
1 |
|
Peltola (2009) |
43 |
levetiracetam |
8 |
79 |
placebo |
1 |
79 |
1 |
1 |
|
Porter (2007) |
44 |
retigabine |
/ |
106 |
placebo |
/ |
96 |
1 |
2 |
|
Ryvlin (2014) |
45 |
brivaracetam |
4 |
100 |
placebo |
0 |
100 |
1 |
1 |
|
Sackellares (2004) |
46 |
zonisamide |
/ |
78 |
placebo |
/ |
74 |
1 |
1 |
|
Schmidt (1993) |
47 |
zonisamide |
/ |
71 |
placebo |
/ |
68 |
1 |
1 |
|
Sethi (2002) |
48 |
gabapentin |
/ |
27 |
lamotragine |
/ |
25 |
2 |
1 |
|
Shorvon (2000) |
49 |
placebo |
1 |
112 |
levetiracetam |
2 |
106 |
1 |
1 |
|
Sivenius (1991) |
50 |
placebo |
/ |
18 |
gabapentin |
/ |
9 |
1 |
1 |
|
Sperling (2010a1) |
51 |
carisbamate |
/ |
192 |
placebo |
/ |
186 |
1 |
2 |
|
Sperling (2010a2) |
52 |
carisbamate |
/ |
185 |
placebo |
/ |
189 |
1 |
2 |
|
Sperling (2015) |
53 |
eslicarbazepine |
4 |
210 |
placebo |
2 |
224 |
1 |
2 |
|
Tsai (2006) |
54 |
levetiracetam |
4 |
47 |
placebo |
0 |
47 |
1 |
1 |
|
UK gabapentin study (1990) |
55 |
gabapentin |
/ |
61 |
placebo |
/ |
66 |
1 |
1 |
|
UK gabapentin study (1993) |
56 |
gabapentin |
/ |
54 |
placebo |
/ |
98 |
1 |
1 |
|
Wu (2009) |
57 |
levetiracetam |
11 |
103 |
placebo |
2 |
103 |
1 |
1 |
|
Xiao (2009) |
58 |
levetiracetam |
3 |
28 |
placebo |
2 |
28 |
1 |
1 |
|
Yamauchi (2006) |
59 |
gabapentin |
0 |
41 |
placebo |
2 |
82 |
1 |
1 |
|
Yen (2000) |
60 |
topiramate |
/ |
23 |
placebo |
/ |
23 |
1 |
1 |
|
Zaccara (2014) |
61 |
pregabalin |
40 |
254 |
levetiracetam |
58 |
255 |
1 |
1 |
Risk of bias assessment RCTs
|
Study reference
|
Was the allocation sequence adequately generated? a
|
Was the allocation adequately concealed?b
|
Blinding: Was knowledge of the allocated interventions adequately prevented?c |
Was loss to follow-up (missing outcome data) infrequent?d
|
Are reports of the study free of selective outcome reporting?e
|
Was the study apparently free of other problems that could put it at a risk of bias?f
|
Overall risk of bias
|
|
Baulac (2012; 2014) |
Definitely yes
Reason: Central randomization with computer generated random numbers |
Definitely yes
Reason: Central randomization with computer generated random numbers |
Probably yes
Reason: Patients, investigator, and sponsor personnel giving drugs, analysing outcomes, and interpreting data were masked to treatment allocation. Blinding of health care personnel not reported) |
Probably no
Reason: loss-to-follow-up was frequent in both groups. Reasons differed. |
Probably yes |
The study was sponsored by a pharmaceutical company. Not for all outcome ITT analyses available |
Some concerns (all outcomes) |
|
Baulac (2017); Ben Menachem (2019 |
Unknown
Reason: according to a predetermined randomisation schedule generated by UCB Pharma, Brussels, Belgium, with an SAS/AF software application (version 2.0) |
Unclear |
Probably yes
Reason: All investigators, patients, and trial personnel were unaware of treatment assignment. The trial medications and packaging were identical in size and colour. |
Probably yes
Reason: quite high, but reasons were quite similar |
Probably yes |
The study was sponsored by a pharmaceutical company
|
Some concerns |
|
Suresh (2015) |
Not described |
Not described |
Definitely no
Reason: Unblinded trial |
Probably yes |
Probably yes |
Definitely no
Baseline seizure frequency differed between the groups.
|
HIGH (seizure freedom) Some concerns |
|
Marson (2021) |
Definitely yes
centrally controlled, 24-h web-based facility to implement a minimisation program with random element utilising factors, which were not made known to reduce the risk of predicting allocation. |
Definitely yes
centrally controlled, 24-h web-based facility to implement a minimisation program with random element utilising factors, which were not made known to reduce the risk of predicting allocation. |
Definitely no
Participants and investigators were not masked and were all aware of treatment allocation. |
Probably yes |
Probably yes |
Probably yes |
Some concerns |
|
Trinka (2012) |
Definitely yes
Reason: central randomization |
Definitely yes
Reasons: Treatment allocation was concealed by use of an Interactive Voice Response System via telephone to manage the randomisation process. |
Definitely no
Reason: Unblinded trial |
Probably yes
Reason: discontinuation similar across groups, ITT |
Definitely yes
Reason: All relevant outcomes were reported; |
The study was funded and sponsored by UCB Pharma who was responsible for the design and conduct of the study, and collection, management, analysis and interpretation of the data. Medical writing and editorial assistance was provided by Jennifer Stewart, MSc, (QXV Communications, Macclesfield, UK), and was funded by UCB Pharma. |
HIGH |
- Randomization: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomization process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomization (performed at a site remote from trial location). Inadequate procedures are all procedures based on inadequate randomization procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments, but this should not affect the risk of bias judgement. Blinding of those assessing and collecting outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment or data collection (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is usually not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary. Finally, data analysts should be blinded to patient assignment to prevents that knowledge of patient assignment influences data analysis.
- If the percentage of patients lost to follow-up or the percentage of missing outcome data is large, or differs between treatment groups, or the reasons for loss to follow-up or missing outcome data differ between treatment groups, bias is likely unless the proportion of missing outcomes compared with observed event risk is not enough to have an important impact on the intervention effect estimate or appropriate imputation methods have been used.
- Results of all predefined outcome measures should be reported; if the protocol is available (in publication or trial registry), then outcomes in the protocol and published report can be compared; if not, outcomes listed in the methods section of an article can be compared with those whose results are reported.
- Problems may include: a potential source of bias related to the specific study design used (e.g. lead-time bias or survivor bias); trial stopped early due to some data-dependent process (including formal stopping rules); relevant baseline imbalance between intervention groups; claims of fraudulent behaviour; deviations from intention-to-treat (ITT) analysis; (the role of the) funding body. Note: The principles of an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
- Overall judgement of risk of bias per study and per outcome measure, including predicted direction of bias (e.g. favours experimental, or favours comparator). Note: the decision to downgrade the certainty of the evidence for a particular outcome measure is taken based on the body of evidence, i.e. considering potential bias and its impact on the certainty of the evidence in all included studies reporting on the outcome.
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Bresnahan (2019) - clobazam |
No subgroup analyses for focal epilepsy specifically |
|
Panebianco (2021) |
AED included in Hu (2020) |
|
Cutillo (2021) |
Very specific inclusion criteria |
|
Babar (2021) |
AED included in Hu (2020) |
|
Trinka (2020) |
Better SRs for these AEDs available |
|
Song (2020) |
AED included in Hu (2020) |
|
Panebianco (2020) |
AED included in Hu (2020) |
|
Mbizvo (2020) |
AED included in Hu (2020) |
|
Brigo (2020) |
AED included in Hu (2020) |
|
Bresnahan (2020) |
AED included in Hu (2020) |
|
Brandt (2020) |
AED included in Hu (2020) |
|
Steinhoff (2020) |
AED included in Hu (2020) |
|
Lattanzi (2019) |
Many relevant AEDs not taken into account |
|
Bresnahan (2019) |
AED included in Hu (2020) |
|
Bresnahan (2019) |
Not stratified to focal epilepsy |
|
Bresnahan (2019) |
AED included in Hu (2020) |
|
Brigo (2019) |
One of two studies in patients with absence epilepsy |
|
Panebianco (2019) |
AED included in Hu (2020) |
|
Yamamoto (2020) |
wrong study design |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 18-09-2024
Het cluster Epilepsie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. Jaarlijks wordt de geldigheid van elke module herbeoordeeld.
De onderstaande modules zijn herzien in cyclus ’23-’24:
- Richtlijn Epilepsie: ‘Classificatie’
- Richtlijn Epilepsie: ‘Genetisch onderzoek’
- Richtlijn Epilepsie: ‘Welk anti-aanvalsmedicatie: Aanvallen met een focaal begin’
- Richtlijn Dravetsyndroom: ‘Anti-aanvalsmedicatie’
- Richtlijn Dravetsyndroom: ‘Klinische criteria’
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Doel
De epilepsiepatiënt in Nederland op eenduidige en wetenschappelijk onderbouwde wijze diagnosticeren en behandelen. Ter ondersteuning van de richtlijngebruiker wordt - daar waar relevant - verwezen naar de module Informatie voor patiënten. De inhoud van de patiënteninformatie valt buiten verantwoordelijkheid van de werkgroep.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met epilepsie.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules is in 2020 een multidisciplinair cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met epilepsie.
Clusterstuurgroep
- Prof. dr. H.J.M. Majoie (voorzitter), neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze en Maastricht
- Dr. C.M. Delsman-van Gelder, kinderneuroloog, Maxima Medisch Centrum, Eindhoven
- Drs. M.H.G. Dremmen, radioloog, Erasmus MC Rotterdam
- Dr. P. Klarenbeek, neuroloog, Zuyderland Medisch Centrum, Heerlen
- Dr. L. M’Rabet, patiëntvertegenwoordiger, EpilepsieNL, Houten
- Dr. P. van Vliet, neuroloog/intensivist, Haaglanden Medisch Centrum, Den Haag
- Drs. R. van Vugt, anesthesioloog, Sint Maartens Kliniek, Nijmegen
Clusterleden betrokken bij module ‘Welk anti-aanvalsmedicatie: Aanvallen met een focaal begin’
- Dr. P. Klarenbeek, neuroloog, Zuyderland Medisch Centrum, Heerlen
- Drs. T. Balvers, neuroloog, SEIN, Heemstede
- Drs. J. Masselink, neuroloog, Medisch Spectrum Twente, Enschede
- Dr. F.N.G van 't Hof, neuroloog, SEIN, Heemstede en Amsterdam
Met ondersteuning van
- Dr. M.M.J. van Rooijen, adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
- Dr. J. Buddeke, senior adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Stuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Majoie* |
Functie: Neurologie Werkgever: Academisch Centrum voor Epileptologie Kempenhaeghe, Maastricht UMC+ |
Relevante commissies
NB geen betaalde functies |
Lopende onderzoek- en zorginnovatieprojecten (anders dan contract research) worden gefinancierd uit ZonMW, Nationaal epilepsiefonds, stichting vrienden van Kempenhaeghe, en SKMS.
Incidenteel financiële ondersteuning aan stichting Kempenhaeghe voor organisatie refereeravonden en workshops/symposia (telkens volgens geldende wet en regelgeving). |
Geen actie |
|
Delsman |
Kinderneuroloog/kinderarts Werkgever: Maxima Medisch Centrum Veldhoven |
Geen |
Geen |
Geen actie |
|
Dremmen |
Functie: Kinderradioloog met subspecialisatie kinderneuroradiologie Werkgever: ErasmusMC te Rotterdam |
Een van de voorzitters van de richtlijn Radiologische diagnostiek acute trauma-opvang bij kinderen Expertisegroep richtlijn Traumatologie Uitgenodigd spreker op meerdere nationale en internationale cursussen en congressen |
Geen |
Geen actie |
|
Klarenbeek |
Functie: Neuroloog Werkgever: Zuyderland te Heerlen/Sittard (vrijgevestigd) |
Geen |
Geen |
Geen actie |
|
Nicolai |
Functie: Kinderneuroloog Werkgever: Maastricht UMC+. Tevens gedetacheerd/ werkzaam in Kempenhaeghe, Heeze; St Jansgasthuis, Weert; Elkerliek, Helmond en Viecuri, Venlo. |
Coördinator Sepion beginnerscursus; vergoeding wordt door Sepion naar AMBI goed doel gestort. Tevens betrokken bij Sepion gevorderden cursus en AVG cursus; vergoeding wordt door Sepion naar AMBI goed doel gestort. |
Boegbeeldfunctie bij een patiënten- of beroepsorganisatie |
Geen actie |
|
Van Vliet |
Functie: Intensivist Werkgever: Haaglanden Medisch Centrum te Den Haag |
|
Geen |
Geen actie |
|
Van Vugt |
Functie: Anesthesioloog Werkgever: Sint Maartenskliniek te Nijmegen |
Lid commissie kwaliteitsdocumenten NVA (onbetaald) |
Geen |
Geen actie |
Expertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Altinbas |
Functie: Neuroloog-kinderneuroloog Werkgever: SEIN locatie Meer en Bosch werkzaam op de polikliniek en kliniek |
|
Per 2023 zal het landelijk CBD consortium een onderzoek starten naar de behandeling van kinderen met therapieresistente epilepsie met CBD (gesubsidieerd door ZonMW). |
Geen actie |
|
Balvers |
Functie: Neuroloog (Behandeling van patiënten met epilepsie; klinisch, poliklinisch en in woonzorg) Werkgever: Stichting Epilepsie Instellingen Nederland (SEIN) (0.6fte)
Functie: Neuroloog (Behandeling van patiënten met hoofdpijn; poliklinisch) Werkgever: The Migraine Clinic, Amsterdam (0.2 fte) |
|
|
Geen restrictie voor Epilepsie. |
|
Comans |
Hoogleraar nucleaire geneeskunde Amsterdam UMC (0.4 FTE) en nuclair geneeskundige HMC Den Haag (0.6 FTE) |
Lid cluster Longoncologie (onbetaald) |
Geen |
Geen actie. |
|
De Bruijn |
Functie: neuroloog in opleiding Werkgever: ETZ Tilburg |
Geen |
Geen |
Geen actie |
|
Draak |
Functie: Kinderneuroloog, neuroloog. Werkgever: Zuyderland Medisch Centrum |
Geen |
Geen |
Geen actie |
|
Eshuis |
Functie: AIOS Spoedeisende geneeskunde Werkgever: Catharina Ziekenhuis te Eindhoven |
|
Geen |
Geen actie |
|
Hofman |
Functie: Radioloog Werkgever: Maastricht UMC+ (1.0fte) |
|
Geen |
Geen actie |
|
Koekkoek |
Functie: Neuroloog Werkgever: Leids Universitair Medisch Centrum (0.8fte), Haaglanden Medisch Centrum (0.2fte) |
|
Geen |
Geen actie |
|
Lazeron |
Functie: Neuroloog Werkgever: Academisch centrum Epileptologie Kempenhaeghe Maastricht UMC+ (voltijds).
Functie: Wetenschappelijk onderzoeker Werkgever: Technische universiteit te Eindhoven (nul uren aanstelling) |
|
Lid van het TeleEpilepsie consortium. Met dit consortium hebben een aanvalsdetector ontwikkeld, de Nightwatch(R) die door LivAssured geproduceerd wordt. Geen direct financieel belang in dit bedrijf, maar van eventuele toekomstige winsten van LivAssured vloeit een klein percentage terug naar het consortium voor epilepsie-onderzoek |
Restricties ten aanzien van besluitvorming met betrekking tot apparaten die aanvallen detecteren (e.g. Nightwatch) |
|
Mantione |
Klinisch neuropsycholoog UMC Utrecht |
|
Geen |
Geen actie |
|
Masselink |
Functie: Ziekenhuisapotheker Werkgever: Medisch Spectrum Twente |
|
Geen |
Geen actie |
|
M’Rabet |
Functie: MT-lid Kennis en Innovatie Werkgever: EpilepsieNL, Houten |
Geen |
|
Geen actie |
|
Reijneveld |
Functie: Neuroloog, Werkgever: Stichting Epilepsie Instellingen Nederland (SEIN) te Heemstede (0.8 fte)
Functie: Universitair Hoofddocent, afdeling Neurologie Werkgever: Amsterdam UMC (0.2 fte) |
|
Geen |
Geen actie |
|
Ronner |
Functie: Neuroloog Werkgever: Amsterdam UMC (0.8 fte) |
|
Geen |
Geen actie |
|
Schijns |
Functie: Neurochirurg met specialisatie Epilepsiechirurgie en Neuro-oncologische Chirurgie |
|
|
Geen actie |
|
Snoeijen-Schouwenaars |
Functie: Arts Verstandelijk Gehandicapten Werkgever: Kempenhaeghe, fulltime |
Geen |
Geen |
Geen actie |
|
Thijs |
Functie: neuroloog Werkgever: Stichting Epilepsie Instellingen Nederland (1.0 fte) Leids Universitair Medisch Centrum (detachering vanuit SEIN voor 0.2 fte) |
|
|
Restrictie ten aanzien van besluitvorming met betrekking tot apparaten die aanvallen detecteren (e.g. Nightwatch®). |
|
Tousseyn |
Functie: neuroloog Werkgever: Academisch Centrum voor Epileptologie (ACE) Kempenhaeghe/Maastricht UMC+, locatie Heeze |
|
|
Geen actie |
|
Uiterwijk |
Functie: Epileptoloog Werkgever: Academisch Centrum voor Epileptologie Kempenhaeghe |
Geen |
Geen |
Geen actie |
|
Van 't Hof |
Functie: neuroloog Werkgever: SEIN (Stichting Epilepsie Instellingen Nederland) |
|
Geen |
Geen actie |
|
Van Schie |
AIOS neurologie LUMC (tot 05-2023) |
Geen |
Geen |
Geen actie |
|
Van Tuijl |
Functie: Neuroloog Werkgever: ETZ Tilburg |
|
|
Geen actie |
|
Tolboom |
Functie: Nucleair geneeskundige Werkgever: UMC Utrecht |
Geen |
Geen |
Geen actie |
|
Verbeek |
Functie: Klinisch geneticus Werkgever: UMC Utrecht
|
Geen |
Geen |
Geen actie |
|
Verhoeven |
Functie: Kinderarts-kinderneuroloog |
Geen |
|
Geen actie |
|
Vlooswijk |
Functie: Neuroloog Werkgever: Maastricht UMC+ |
|
|
Geen actie |
|
Wegner |
Functie: Neuroloog Werkgever: Stichting Epilepsie instellingen Nederland (SEIN) |
|
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de afvaardiging van EpilepsieNL in het cluster. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens voor commentaar voorgelegd aan Epilepsie NL en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming per module blijkt dat er geen substantiële financiële gevolgen zijn.
Module |
Uitkomst raming |
Toelichting |
|
Welk anti-aanvalsmedicatie: aanvallen met een focaal begin |
Geen financiële gevolgen |
|
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Cyclus werkwijze
Bij de start van de cyclus is de geldigheid van alle modules geïnventariseerd, waarna er een prioriteringsronde heeft plaatsgevonden. De geprioriteerde modules zijn herzien en geüpdatet door het cluster.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder ‘Onderbouwing’. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Netwerk meta-analyse
Voor de beoordeling van de bewijskracht uit een netwerk meta-analyse (NMA) wordt gebruik gemaakt van de CINeMA-tool (Nikolakopoulou, 2020; Papakonstantinou, 2020). Met deze tool wordt op basis van een analyse in R de effectschattingen berekend. Voor het beoordelen van de bewijskracht, op basis van de berekende effectschattingen, worden zes domeinen geëvalueerd, namelijk Risk-of-Bias, publicatiebias, indirectheid, imprecisie, heterogeniteit en incoherentie. Voor het opstellen van de conclusies zijn principes van de GRADE working group gebruikt op basis van grenzen van klinische besluitvorming (Brignardello-Petersen, 2020).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Organisatie van zorg’.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brignardello-Petersen R, Florez ID, Izcovich A, Santesso N, Hazlewood G, Alhazanni W, Yepes-Nuñez JJ, Tomlinson G, Schünemann HJ, Guyatt GH; GRADE working group. GRADE approach to drawing conclusions from a network meta-analysis using a minimally contextualised framework. BMJ. 2020 Nov 11;371:m3900. doi: 10.1136/bmj.m3900. PMID: 33177059.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Nikolakopoulou A, Higgins JPT, Papakonstantinou T, Chaimani A, Del Giovane C, Egger M, Salanti G. CINeMA: An approach for assessing confidence in the results of a network meta-analysis. PLoS Med. 2020 Apr 3;17(4):e1003082. doi: 10.1371/journal.pmed.1003082. PMID: 32243458; PMCID: PMC7122720.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Papakonstantinou T, Nikolakopoulou A, Higgins JPT, Egger M & Salanti G. CINeMA: Software for semiautomated assessment of the confidence in the results of network meta-analysis. Campbell Systematic Reviews 2020;16:e1080.
Zoekverantwoording
Embase (Ovid)
Database: Embase <1974 to 2021 Week 24>
Search Strategy:
--------------------------------------------------------------------------------
1 ((exp Acetazolamide/ or (acetazolamide or diamox).ab,ti,kw. or exp corticotropin/ or (acth or adrenocorticotrophin or corticotropin).ab,ti,kw. or anakinra/ or anakinra.ti,ab. or exp brivaracetam/ or (brivaracetam or briviact).ab,ti,kw. or exp Carbamazepine/ or (carbamazepine or tegretol).ab,ti,kw. or carisbamate.ab,ti,kw. or cenobamate/ or cenobamate.ab,ti,kw. or exp clobazam/ or (clobazam or frisium).ab,ti,kw. or exp clonazepam/ or (clonazepam or ritrovil).ab,ti,kw. or cvl-865.ab,ti,kw. or exp Diazepam/ or (diazepam or stesolid or valium).ab,ti,kw. or exp eslicarbazepine acetate/ or (eslicarbazepine or zebinix).ab,ti,kw. or exp ethosuximide/ or (ethosuximide or ethymal or zarontin).ab,ti,kw. or exp ezogabine/ or (ezogabine or retigabine or trobalt).ab,ti,kw. or exp felbamate/ or (felba* or taloxa or FBM).ab,ti,kw. or exp fenfluramine/ or (fenfluramine or fintepla).ab,ti,kw. or flupirtine/ or flupirtine.ab,ti,kw. or exp fosphenytoin/ or (fosphenytoin or prodilantin).ab,ti,kw. or exp gabapentin/ or (gabapentin or neurontin).ab,ti,kw. or exp Ganaxolone/ or ganaxolone.ab,ti,kw. or exp lacosamide/ or (lacosamide or vimpat).ab,ti,kw. or exp etiracetam/ or (etiracetam or levetiracetam or keppra).ab,ti,kw. or exp lamotrigine/ or (lamotrigine or lamictal).ab,ti,kw. or exp lorazepam/ or (lorazepam or temesta).ab,ti,kw. or exp losigamone/ or (losigame or losigamone).ab,ti,kw. or exp methsuximide/ or (methsuximide or petinutin).ab,ti,kw. or exp midazolam/ or (midazolam or dormicum).ab,ti,kw. or exp nitrazepam/ or (nitrazepam or mogadon).ab,ti,kw. or exp oxcarbazepine/ or (oxcarbazepine or trileptal).ab,ti,kw. or exp paraldehyde/ or paraldehyde.ab,ti,kw. or exp perampanel/ or (perampanel or fycompa).ab,ti,kw. or exp pregabalin/ or (pregabalin or lyrica).ab,ti,kw. or exp phenytoin/ or (phenytoin or diphantoine).ab,ti,kw. or exp phenobarbital/ or phenobarbital.ab,ti,kw. or exp piracetam/ or piracetam.ab,ti,kw. or exp primidone/ or (primidone or liskantin).ab,ti,kw. or exp rufinamide/ or (rufinamide or inovelon).ab,ti,kw. or "sec-butyl-propylacetamide".ab,ti,kw. or exp sulthiame/ or (sulthiame or ospolot).ab,ti,kw. or exp stiripentol/ or (stiripentol or diacomit).ab,ti,kw. or exp tiagabine/ or (tiagabine or gabitril).ab,ti,kw. or exp topiramate/ or (topiramate or topamax).ab,ti,kw. or exp vigabatrin/ or (vigabatrin or sabril).ab,ti,kw. or exp valproic acid/ or ("valproic acid" or valproate or depakine or depakene or orfiril).ab,ti,kw. or exp zonisamide/ or (zonisamide or zonegran).ab,ti,kw. or exp anticonvulsants/ or exp barbituric acid derivative/ or exp anticonvulsive agent/ or (anticonvulsant* or antiepileptic* or anti-epileptic).ab,ti,kw.) and (exp Epilepsy/ or Landau Kleffner Syndrome/ or Infantile Spasm/ or ((continuous spikes and waves during sleep) or csws or landau-kleffner syndrome or lennox-gastaut syndrome or infant* spasm* or seizure* or convulsion*).ab,ti,kw.)) not (pre eclampsia or preeclampsia or eclampsia).ab,ti,kw. (117869)
2 limit 1 to yr="2020 -Current" (8100)
3 limit 2 to english language (7857)
4 (exp meta analysis/ or exp "meta analysis (topic)"/ or (metaanaly* or meta analy* or metanaly*).ti,ab. or systematic review/ or "cochrane database of systematic reviews".jn. or prisma.ti,ab. or prospero.ti,ab. or ((systemati* or scoping or umbrella or structured literature) adj3 (review* or overview*)).ti,ab. or (systematic* adj1 review*).ti,ab. or ((systemati* or literature or database* or data base*) adj10 search*).ti,ab. or ((structured or comprehensive* or systematic*) adj3 search).ti,ab. or ((literature adj3 review).ti. and (search* or database* or data base*).ab.) or ((data extraction or "data source*") and study selection).ti,ab. or (search strategy and selection criteria).ti,ab. or (data source and data synthesis).ti,ab. or medline.ab. or pubmed.ab. or embase.ab. or cochrane.ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data base*)).ab. or metasynthes*.ti,ab. or meta synthes*.ti,ab.) not ((exp animal/ or exp 'animal experiment'/ or exp 'animal model'/ or exp 'nonhuman'/) not exp 'human'/) not (conference abstract or conference review or editorial or letter or note).pt. (567235)
5 3 and 4 (423)
6 (exp randomized controlled trial/ or random*.ti,ab. or ((pragmatic or practical) adj clinical trial*).ti,ab. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab.) not ((exp animal/ or exp 'animal experiment'/ or exp 'animal model'/ or exp 'nonhuman'/) not exp 'human'/) not (conference abstract or conference review or editorial or letter or note).pt. (1196337)
7 (3 and 6) not 5 (261)
Pubmed/Medline
#7
Search: #3 AND #6 NOT #5 Sort by: Most Recent 231
06:02:53
#6
Search: ("Randomized Controlled Trial" [Publication Type] OR random*[tiab] OR pragmatic clinical trial*[tiab] OR practical clinical trial*[tiab] OR non-inferiority trial*[tiab] OR noninferiority trial*[tiab] OR superiority trial*[tiab] OR equivalence clinical trial*[tiab]) NOT (("Animals"[Mesh]) OR "Models, Animal"[Mesh] NOT humans[mh]) NOT (letter[pt] OR comment[pt] OR editorial[pt]) Sort by: Most Recent 1,213,528
06:01:55
#5
Search: #3 AND #4 Sort by: Most Recent 278
06:01:37
#4
Search: ("Meta-Analysis" [Publication Type] OR "Meta-Analysis as Topic"[Mesh] OR metaanaly*[tiab] OR meta-analy*[tiab] or metanaly*[tiab] OR "Systematic Review" [Publication Type] OR systematic[sb] OR "Cochrane Database Syst Rev"[Journal] or prisma[tiab] OR preferred reporting items[tiab] OR prospero[tiab] OR ((systemati*[ti] OR scoping[ti] OR umbrella[ti] OR structured literature[ti]) AND (review*[ti] OR overview*[ti])) OR systematic review*[tiab] OR scoping review*[tiab] OR umbrella review*[tiab] OR structured literature review*[tiab] OR systematic qualitative review*[tiab] OR systematic quantitative review*[tiab] OR systematic search and review[tiab] OR systematized review[tiab] OR systematised review[tiab] OR systemic review[tiab] OR systematic literature review*[tiab] OR systematic integrative literature review*[tiab] OR systematically review*[tiab] OR scoping literature review*[tiab] OR systematic critical review[tiab] OR systematic integrative review*[tiab] OR systematic evidence review[tiab] OR Systematic integrative literature review*[tiab] OR Systematic mixed studies review*[tiab] OR Systematized literature review*[tiab] OR Systematic overview*[tiab] OR Systematic narrative review*[tiab] OR ((systemati*[tiab] OR literature[tiab] OR database*[tiab] OR data-base*[tiab] OR structured[tiab] OR comprehensive*[tiab] OR systemic*[tiab]) AND search*[tiab]) OR (Literature[ti] AND review[ti] AND (database*[tiab] OR data-base*[tiab] OR search*[tiab])) OR ((data extraction[tiab] OR data source*[tiab]) AND study selection[tiab]) OR (search strategy[tiab] AND selection criteria[tiab]) OR (data source*[tiab] AND data synthesis[tiab]) OR medline[tiab] OR pubmed[tiab] OR embase[tiab] OR Cochrane[tiab] OR ((critical[ti] OR rapid[ti]) AND (review*[ti] OR overview*[ti] OR synthes*[ti])) OR (((critical*[tiab] OR rapid*[tiab]) AND (review*[tiab] OR overview*[tiab] OR synthes*[tiab]) AND (search*[tiab] OR database*[tiab] OR data-base*[tiab]))) OR metasynthes*[tiab] OR meta-synthes*[tiab]) Sort by: Most Recent 561,232
06:01:13
#3
Search: #2 AND english[Language] Sort by: Most Recent 3,780
06:00:58
#2
Search: #1 AND (2020[pdat]:2021[pdat]) Sort by: Most Recent 3,875
06:00:46
#1
Search: (("Acetazolamide"[Mesh] OR acetazolamide[TW] OR diamox[TW]) OR ("Adrenocorticotropic Hormone"[Mesh] OR acth[TW] OR adrenocorticotrophin[TW] OR corticotropin[TW]) OR ("brivaracetam" [Supplementary Concept] OR brivaracetam[TW] OR Briviact[TW]) OR ("Carbamazepine"[Mesh] OR carbamazepine[TW] OR Tegretol[TW]) OR ("Cenobamate" [Supplementary Concept] OR cenobamate[TW]) OR ("Clobazam"[Mesh] OR clobazam[TW] OR frisium[TW]) OR ("Clonazepam"[Mesh] OR clonazepam[TW] OR ritrovil[TW]) OR "CVL-865"[TW] OR ("Diazepam"[Mesh] OR diazepam[TW] OR stesolid[TW] OR valium[TW]) OR ("eslicarbazepine acetate"[Supplementary Concept] OR eslicarbazepine[TW] OR zebinix[TW]) OR ("ethosuximide"[Mesh] OR ethosuximide[TW] OR ethymal[TW] OR zarontin[TW]) OR ("ezogabine"[Supplementary Concept] OR ezogabine[TW] OR retigabine[TW] OR trobalt[TW]) OR ("Felbamate"[Mesh] OR felba*[TW] OR taloxa[TW] OR FBM[TW]) OR ("Fenfluramine"[Mesh] OR fenfluramine[TW] OR fintepla[TW]) OR ("flupirtine"[Supplementary Concept] OR flupirtine[TW]) OR ("fosphenytoin"[Supplementary Concept] OR fosphenytoin[TW] OR prodilantin[TW]) OR ("gabapentin"[Supplementary Concept] OR gabapentin[TW] OR neurontin[TW]) OR ("ganaxolone"[Supplementary Concept] OR ganaxolone[TW] OR "CCD 1042"[TW]) OR ("Interleukin 1 Receptor Antagonist Protein"[Mesh] OR "Interleukin 1 Receptor Antagonist Protein"[TW] OR anakinra[TW]) OR ("lacosamide"[Supplementary Concept] OR lacosamide[TW] OR vimpat[TW]) OR ("Levetiracetam"[Mesh] OR etiracetam [TW] OR levetiracetam[TW] OR keppra[TW]) OR ("lamotrigine"[Supplementary Concept] OR lamotrigine[TW] OR lamictal[TW]) OR ("lorazepam"[Mesh] OR lorazepam[TW] OR temesta[TW]) OR ("losigame" [Supplementary Concept] OR logisame[TW] OR logisamone[TW]) OR ("methsuximide"[Supplementary Concept] OR methsuximide[TW] OR petinutin[TW]) OR ("midazolam"[Mesh] OR midazolam[TW] OR dormicum[TW]) OR ("nitrazepam"[Mesh] OR nitrazepam[TW] OR mogadon[TW]) OR ("oxcarbazepine"[Supplementary Concept] OR oxcarbazepine[TW] OR trileptal[TW]) OR ("paraldehyde"[Mesh] OR paraldehyde[TW]) OR ("perampanel"[Supplementary Concept] OR perampanel[TW] OR fycompa[TW]) OR ("pregabalin"[Supplementary Concept] OR pregabalin[TW] OR lyrica[TW]) OR ("phenytoin"[Mesh] OR phenytoin[TW] OR diphantoine[TW]) OR ("phenobarbital"[Mesh] OR phenobarbital[TW]) OR ("piracetam"[Mesh] OR piracetam[TW]) OR ("primidone"[Mesh] OR primidone[TW] OR liskantin[TW]) OR ("rufinamide"[Supplementary Concept] OR rufinamide[TW] OR inovelon[TW]) OR ("S-2-O-carbamoyl-1-o-chlorophenyl-ethanol" [Supplementary Concept] OR "carisbamate"[TW]) OR ("sec-butyl-propylacetamide" [Supplementary Concept] OR sec-butyl-propylacetamide [TW]) OR ("sulthiame"[Supplementary Concept] OR sulthiame[TW] OR ospolot[TW]) OR ("stiripentol"[Supplementary Concept] OR stiripentol[TW] OR diacomit[TW]) OR ("Tiagabine"[Mesh] OR tiagabine[TW] OR gabitril[TW]) OR ("Topiramate"[Mesh] OR topiramate[TW] OR topamax[TW]) OR ("vigabatrin"[Mesh] OR vigabatrin[TW] OR sabril[TW]) OR ("valproic acid"[Mesh] OR valproic acid[TW] OR valproate[TW] OR depakine[TW] OR depakene[TW] OR orfiril[TW]) OR ("Zonisamide"[Mesh] OR zonisamide[TW] OR zonegran[TW]) OR "anticonvulsants"[Pharmacological Action] OR "Anticonvulsants"[Mesh] OR anticonvulsant*[TW] OR antiepileptic*[TW] OR anti-epileptic*[TW]) AND ("Epilepsy"[MeSH] OR epilep*[TW] OR (continuous[TW] AND spike[TW] AND wave[TW] AND slow[TW] AND sleep[TW]) OR landau-kleffner syndrome[TW] OR lennox-gastaut syndrome[TW] OR infantile spasm*[TW] OR seizure*[TW] OR convulsion[TW] OR convulsions[TW]) NOT ("pre eclampsia"[Mesh] OR "pre eclampsia"[TW] OR "preeclampsia"[TW] OR "Eclampsia"[Mesh] OR "eclampsia*"[TW]) Sort by: Most Recent 63,413
06:00