Aanvallen met een gegeneraliseerd begin
Uitgangsvraag
Welke medicamenteuze behandeling heeft de voorkeur bij patiënten met epileptische aanvallen met een gegeneraliseerd begin?
De uitgangsvraag omvat de volgende deelvragen:
- Met welk anti-aanvalsmedicijn als monotherapie wordt bij voorkeur gestart bij patiënten met nieuw gediagnosticeerde epileptische aanvallen met een gegeneraliseerd begin?
- Wat zijn eerste keus middelen als adjuvante behandeling bij patiënten met epileptische aanvallen met een gegeneraliseerd begin, bij wie monotherapie onvoldoende effectief is?
Aanbeveling
Aanbeveling 1: Monotherapie bij epileptische aanvallen met een gegeneraliseerd begin
Geef bij epileptische aanvallen met een gegeneraliseerd begin lamotrigine, levetiracetam, topiramaat of valproaat (alfabetische volgorde) als monotherapie.
Wees voorzichtig met lamotrigine bij epileptische aanvallen met een gegeneraliseerd begin met myoclonieën omdat dit middel kan zorgen voor een toename van myoclonieën.
Geef meisjes en vrouwelijke patiënten in de vruchtbare levensfase GEEN valproaat of topiramaat.
Overweeg valproaat of topiramaat alleen als andere middelen niet geschikt of niet effectief zijn en zorg dan voor adequate zwangerschapspreventie/ anticonceptie.
Een uitzondering kan worden gemaakt voor meisjes bij wie de verwachting is dat de epilepsie in remissie zal gaan en valproaat of topiramaat gestaakt kan worden voor de puberteit.
Raadpleeg de module ‘zwangerschap en hormonen’ voor het starten van anti-aanvalsmedicatie bij vrouwelijke patiënten in de vruchtbare levensfase.
Aanbeveling 2: Adjuvante behandeling bij falen van monotherapie bij aanvallen met een gegeneraliseerd begin
Kies als adjuvante behandeling bij patiënten met epileptische aanvallen met een gegeneraliseerd begin bij voorkeur een van de volgende middelen (alfabetische volgorde): brivaracetam, clobazam, lacosamide, lamotrigine, levetiracetam, perampanel, topiramaat of valproaat.
Geef bij voorkeur geen carbamazepine, gabapentine, oxcarbazepine, fenytoine of pregabaline als adjuvante behandeling bij patiënten met epileptische aanvallen met een gegeneraliseerd begin omdat deze middelen myoclone of absence aanvallen kunnen verergeren.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Monotherapie bij epileptische aanvallen met een gegeneraliseerd begin
Voor de cruciale uitkomstmaten welke de effectiviteit van de verschillende anti-aanvalsmedicatie beoordelen (tijd tot bereiken 6 en 12 maanden aanvalsvrijheid, tijd tot eerste aanval na randomisatie) is er geen enkel middel dat significant dan wel klinisch relevant beter werkt dan valproaat. Op basis hiervan is er dus geen grond om een ander middel te verkiezen boven de huidige standaard: valproaat.
Valproaat is wel significant beter dan lamotrigine op de uitkomstmaat tijd tot eerste aanval na randomisatie. Mogelijk is dit een gevolg van de langzame opbouwfase van lamotrigine. Dit mogelijke verband wordt benadrukt door het feit dat er geen verschil is tussen beide middelen op de uitkomstmaten tijd tot bereiken van 6 maanden en 12 maanden aanvalsvrijheid (voor de data over 6 maanden aanvalsvrijheid zie de netwerkmeta-analyse van Nevitt (2022)). Voor fenobarbital, oxcarbazepine en gabapentine werd er een significant verschil gevonden op deze uitkomstmaat ten nadele van deze middelen ten opzichte van valproaat. De bewijskracht voor deze conclusie was laag.
Naast effectiviteit is ook het bijwerkingenprofiel van een medicijn een belangrijk aspect om rekening mee te houden bij de keuze voor een bepaald middel. De potentiële bijwerkingen van anti-aanvalsmedicatie zijn uitgebreid en divers. Het voert te ver om in deze module een gedetailleerd overzicht te geven van alle mogelijke bijwerkingen. In de Cochrane review van Nevitt (2022) werden bijwerkingen onderverdeeld in 27 subcategorieën waarbij er voor vrijwel ieder middel in alle categorieën bijwerkingen werden gerapporteerd.
In de literatuur wordt de tijd tot behandelfalen (time to treatment failure) of de inverse, de tijd dat iemand het middel blijft gebruiken (retention time) gebruikt als maat om zowel effectiviteit als verdraagbaarheid van een behandeling weer te geven. Ook voor de tijd tot falen en/of staken van de behandeling (belangrijke uitkomstmaat) was er geen enkel middel superieur aan valproaat. Valproaat is waarschijnlijk wel beter dan carbamazepine en topiramaat (gemiddelde bewijskracht) en mogelijk beter dan fenobarbital en lacosamide (bewijskracht laag). Levetiracetam en lamotrigine presteerden vergelijkbaar met valproaat met een nauw betrouwbaarheidsinterval. Ook voor oxcarbazepine en gabapentine werd geen significant verschil gevonden met valproaat, echter voor deze twee middelen was het betrouwbaarheidsinterval wel duidelijk wijder en de level of evidence werd als zeer laag beoordeeld. Om deze reden beveelt de werkgroep aan om lamotrigine en levetiracetam ook te beschouwen als eerstekeusmiddelen. Zeker in de situaties waar valproaat een ongeschikte keus is.
De uiteindelijke keuze voor een anti-aanvalsmedicijn wordt niet alleen gemaakt op basis van effectiviteit en bijwerkingen. Ook andere factoren zoals comorbiditeit, comedicatie, patiënt karakteristieken (zoals leeftijd) of praktische overwegingen zoals het gebruiksgemak moeten worden meegewogen. Via een proces van shared decision making moet er samen met de patiënt (of zijn/haar ouders/verzorgers) een afweging worden gemaakt tussen de voor- en nadelen van behandeling en de verschillende middelen. Een tweetal specifieke voorzorgen bij patiënten met epileptische aanvallen met een gegeneraliseerd begin worden hier nog benoemd.
Een belangrijke voorzorg geldt voor valproaat bij meisjes en vrouwen in de vruchtbare levensfase (Tomson, 2015). Dit middel mag niet worden gegeven aan deze patiëntencategorie in verband met het duidelijk verhoogde risico op aangeboren afwijkingen en cognitieve beperkingen bij het ongeboren kind. Als er geen alternatieven zijn, dan mag dit middel alleen overwogen worden als er sprake is van adequate anticonceptieve maatregelen (Tomson, 2015). Om deze reden stelt de werkgroep dat valproaat geen eerste keusmiddel is bij meisjes en vrouwen in de vruchtbare levensfase. Een uitzondering kan worden gemaakt voor meisjes waarbij het de verwachting is dat er een remissie zal zijn van de epilepsie voor de puberteit.
Een andere belangrijk punt om in overweging te nemen bij de keuze voor een anti-aanvalsmedicijn bij patiënten met epileptische aanvallen met een gegeneraliseerd begin is het feit dat bepaalde middelen myoclone of absence aanvallen kunnen verergeren. Dit geldt voor carbamazepine, gabapentine, , oxcarbazepine, fenytoïne en pregabaline. Bij lamotrigine kunnen myoclone aanvallen toenemen (Abou-Khalil 2019; NICE guideline 2022).
Uiteraard gelden ook bij epileptische aanvallen met een gegeneraliseerd begin de voorzorgen en overwegingen in specifieke situaties zoals deze beschreven zijn in de module: 'Aanvallen met een focaal begin'.
Adjuvante behandeling bij falen van monotherapie bij epileptische aanvallen met een gegeneraliseerd begin
Alle in de netwerkmeta-analyse onderzochte anti-aanvalsmedicatie als adjuvante behandeling waren ten opzichte van placebo effectief op de gerapporteerde uitkomstmaat >50% aanvalsreductie. Om deze reden doet de werkgroep geen aanbeveling welke van deze middelen de voorkeur heeft bij de adjuvante behandeling bij falen van monotherapie. Clobazam heeft zijn waarde in de klinische praktijk bewezen bij de behandeling van aanvallen met een gegeneraliseerd begin en kan dus ook overwogen worden als adjuvans. Het is bij polyfarmacie in elk geval aan te bevelen te kiezen voor twee middelen met een verschillend werkingsmechanisme (zie voor onderbouwing module 'Aanvallen met een focaal begin').
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het is belangrijk de afwegingen omtrent het starten van een medicamenteuze behandeling goed te bespreken met de patient (en/of verzorgers). Hiervoor zijn verschillende keuzekaarten ontwikkeld welke als gesprekshulp kunnen dienen (zie www.thuisarts.nl). In dit gesprek moeten het te verwachten behandeleffect, de bijwerkingen en patiënt-specifieke factoren (comorbiditeit, comedicatie, leeftijd, etc.) die de keus voor een bepaald middel bepalen specifiek aandacht krijgen. Het doel voor patiënten is veelal het bereiken van aanvalsvrijheid zonder negatieve effecten van de medicatie. Zoals beargumenteerd in de overwegingen is de tijd tot behandelfalen een maat welke beide aspecten meeweegt. Het is dus raadzaam om, indien mogelijk, voor een middel te kiezen dat goed presteert op deze uitkomstmaat.
Kosten (middelenbeslag)
De grootste verschillen in directe kosten voor anti-aanvalsmedicatie ontstaan als medicijnen nog niet als generiek beschikbaar zijn. Alle in deze module besproken middelen (incl. lacosamide als meest recente) zijn als generiek beschikbaar. Uiteraard behelst een gedetailleerde kosteneffectiviteitsanalyse meer dan alleen de directe kosten van een medicijn. Een dergelijke analyse ontbreekt voor de meeste van de genoemde middelen.
Aanvaardbaarheid, haalbaarheid en implementatie
Sommige middelen kampen met leveringsproblemen, waardoor start met (adjuvante) behandeling soms noodgedwongen moet worden uitgesteld of voor een ander middel moet worden gekozen. Met het gebruik van onderzochte middelen is reeds ervaring in de klinische praktijk, waardoor geen verdere (grote) barrières met betrekking tot aanvaardbaarheid of haalbaarheid worden geïdentificeerd.
Onderbouwing
Achtergrond
Om een adequate keuze te maken voor de medicamenteuze behandeling bij epilepsie, is het eerst van belang om het aanvalstype vast te stellen. Hierbij wordt onderscheid gemaakt tussen epilepsie met een focaal of gegeneraliseerd begin. Als het aanvalstype onduidelijk is dan wordt gesproken van een epilepsie met onbekend begin. Epileptische aanvallen met een gegeneraliseerd begin zijn aanvallen waarbij vanaf het begin bilateraal verdeelde netwerken betrokken zijn (zie module ‘Classificatie’).
Als er sprake is van epileptische aanvallen met een gegeneraliseerd begin dan zijn er verschillende middelen beschikbaar. Valproaat is van oudsher het middel van eerste keus. Het doel van deze module is om antwoord te geven op 2 vragen:
- Met welk anti-aanvalsmedicijn kan het beste worden gestart bij een nieuwe diagnose van epileptische aanvallen met een gegeneraliseerd begin
- Welk middel zou moeten worden toegevoegd wanneer monotherapie onvoldoende is?
Voor absence epilepsie, zie de module ‘Absence epilepsie’.
Conclusies / Summary of Findings
PICO 1: Which antiseizure monotherapy is the most effective and safe in patients with newly diagnosed generalized onset seizures?
1a. Seizure incidence (critical)
|
Moderate GRADE |
Carbamazepine, lamotrigine, levetiracetam or topiramate result in little to no difference in time to 12-month remission when compared with valproic acid in patients with generalized onset seizures.
Sources: Nevitt, 2022 |
|
Low GRADE |
Phenobarbitone, oxcarbazepine or gabapentin may increase the risk of incidence of seizure in patients with generalized onset seizures compared with valproic acid.
Sources: Nevitt, 2022 |
|
Low GRADE |
Phenytoin may result in little to no difference in time to 12-month remission in patients with generalized onset seizures compared with valproic acid.
Sources: Nevitt, 2022 |
|
Very low GRADE |
The evidence is very uncertain about the effect of lacosamide on seizure incidence in patients with generalized onset seizures compared with valproic acid.
Sources: Nevitt, 2022 |
1b. Time to seizure recurrence (critical)
|
Moderate GRADE |
Lamotrigine likely results in a slight decrease in the time to seizure recurrence (unfavourable) compared with valproic acid in patients with generalized onset seizures
Sources: Nevitt, 2022 |
|
Moderate GRADE |
Carbamazepine, phenytoin, levetiracetam or topiramate likely result in little to no difference in time to seizure recurrence when compared with valproic acid in patients with generalized onset seizures.
Sources: Nevitt, 2022 |
|
Low GRADE |
Phenobarbitone, oxcarbazepine or gabapentin may decrease the time to seizure recurrence (unfavourable) in patients with generalized onset seizures compared with valproic acid.
Sources: Nevitt, 2022 |
|
Very low GRADE |
The evidence is very uncertain about the effect of lacosamide on time to seizure recurrence in patients with generalized onset seizures compared with valproic acid.
Sources: Nevitt, 2022 |
1c. Retention rate (important)
|
Moderate GRADE |
Carbamazepine or topiramate likely result in an increase in treatment failure (unfavourable) when compared with valproic acid in patients with generalized onset seizures.
Sources: Nevitt, 2022 |
|
Moderate GRADE |
Lamotrigine or levetiracetam likely result in little to no difference in time to treatment failure in patients with generalized onset seizures, compared with valproic acid.
Sources: Nevitt, 2022 |
|
Low GRADE |
Phenobarbitone or lacosamide may increase the risk of treatment failure (unfavourable) in patients with generalized onset seizures, compared with valproic acid.
Sources: Nevitt, 2022 |
|
Low GRADE |
Phenytoin may result in little to no difference in time to treatment failure in patients with generalized onset seizures compared with valproic acid.
Sources: Nevitt, 2022 |
|
Very low GRADE |
The evidence is very uncertain about the effect of oxcarbazepine or gabapentin on time to treatment failure in patients with generalized onset seizures compared with valproic acid.
Sources: Nevitt, 2022 |
1d. Adverse events (important)
|
Low GRADE |
The evidence suggests frequent adverse events after the use of antiseizure medications as monotherapy, most commonly drowsiness or fatigue, headache or migraine, gastrointestinal disturbances, dizziness, and rash or skin disorders.
Source: Nevitt (2022) |
PICO 2: Which antiseizure add-on therapy is the most effective and safe in patients with treatment resistant generalized onset seizures?
2a. Seizure incidence (critical)
|
Very Low GRADE |
The evidence is uncertain about the superiority of brivaracetam, lacosamide, lamotrigine, levetiracetam, perampanel, and topiramate over placebo as add-on drugs in achieving >50% reduction in seizure frequency during the treatment or maintenance period of patients with generalized seizures, compared to placebo.
Source: NICE (2022) |
2b. Time to seizure recurrence (critical)
|
No GRADE |
No conclusions can be drawn on the effect of add-on antiseizure medications with regard to time to seizure recurrence. |
2c. Retention rate (important)
|
No GRADE |
No conclusions can be drawn on the effect of add-on antiseizure medications with regard to retention rate. |
2d. Adverse events (important)
|
Very low GRADE |
With high uncertainty can be said that adverse events occur frequently after the use of add-on antiseizure medications in patients with generalized seizures, yet the discontinuation rate due to these adverse events – with the exception of perampanel – seems low.
Source: NICE (2022) |
Samenvatting literatuur
Description of studies
PICO 1
The Cochrane review by Nevitt (2022) was used in the NICE guidelines for the recommendations with regard to monotherapy in patients with epilepsy. After the search on April 12th, 2021, this systematic review included 89 trials (n = 22,040 participants), of which 30 trials recruited individuals with focal seizures only, 5 recruited individuals with generalized tonic-clonic seizures with or without other generalized seizure types or unclassified seizure types only, and the remaining 54 trials recruited both. A total of 5268 patients were classified as experiencing generalized onset seizures. For 4270 of these, individual participant data was available for analysis out of 34 trials, and sensitivity analyses were performed for potential misclassification. A table of characteristics of the included trials and their risk of bias assessment is presented in the “Characteristics of studies section” in the article by Nevitt (2022).
For generalized onset seizures, the drugs carbamazepine, sodium valproate, phenobarbitone, phenytoin, lamotrigine, oxcarbazepine, topiramate, gabapentin, levetiracetam, and lacosamide were assessed. The level of evidence was assessed with the Confidence in Network Meta-Analysis (CINeMA) approach (Nikolakopoulou, 2020), based on the GRADE framework.
The primary outcome of interest was time to treatment failure (retention time), either due to lack of efficacy (i.e. recurrent seizures), poor tolerability (i.e. adverse events) or a combination of both (any treatment-related reason). Secondary outcomes were time to achieve 6- and 12-month seizure-free period (remission) after randomisation, time to first seizure post-randomization, and the occurrence of adverse events.
Results
1a. Seizure incidence (critical)
Nevitt (2022) reports time to achieve 6- and 12-month seizure remission through hazard ratios instead of a relative risk or patient proportion of seizure freedom at 6 or 12 months. The results per drug for time to 12-month seizure remission, compared to sodium valproate as reference, are shown in figure 1a. The conclusion for all comparisons was that no difference between drugs with regard to time to 6- and 12-month remission was found. This conclusion did not change when only considering direct evidence.
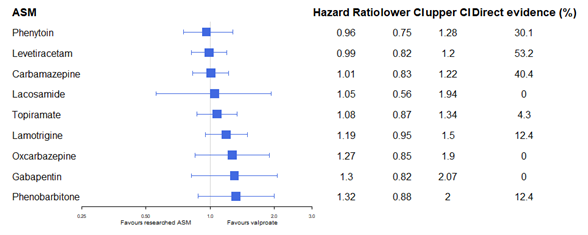
Figure 1a. Time to 12-month remission for individuals with generalized seizures (reference sodium valproate). Adapted from Nevitt (2022).
1b. Time to seizure recurrence (critical)
Time to first seizure post-randomisation was also reported through HRs by Nevitt (2022). In Figure 1b, the comparison of different antiseizure medications to sodium valproate is depicted. Lamotrigine is the only ASM showing a significantly worse effect than valproate, yet the confidence interval crosses the border of clinical importance as defined under the heading ‘search and select’.
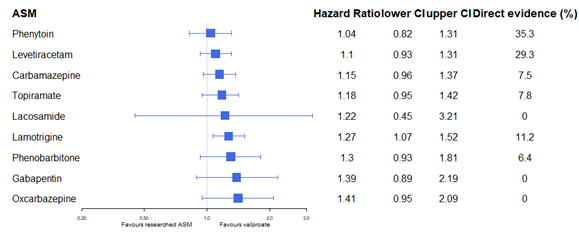
Figure 1b. Time to first seizure for individuals with generalized epilepsy (reference sodium valproate). Adapted from Nevitt (2022).
1c. Retention rate (important)
Treatment failure can be due to either lack of efficacy (continued seizures or the initiation of add-on treatment) or tolerability issues (side effects or non-compliance). Time to treatment failure is therefore a combined measure of efficacy and tolerability. Sodium valproate was taken as reference; results are depicted in figure 1c. From the NMA, sodium valproate performs significantly better than topiramate, carbamazepine, phenobarbitone, and lacosamide, yet this difference was not found from the direct evidence. No statistically significant differences (not in NMA, nor in direct evidence) were found between sodium valproate and lamotrigine, levetiracetam, gabapentin, phenytoin, and oxcarbazepine.
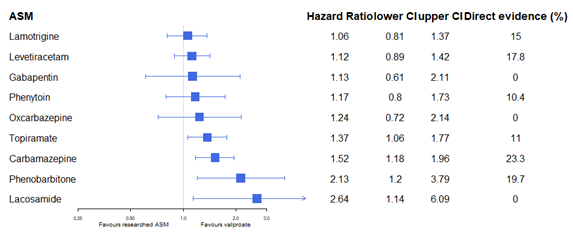
Figure 1c. Time to treatment failure for individuals with generalized seizures (reference sodium valproate, SVP). Adapted from Nevitt (2022).
1d. Adverse events (important)
Adverse events were reported narratively. A subdivision of adverse events per drug used for focal onset seizures or generalized onset seizures was not made. Adverse event data were available for 20,275 participants (92% of total included patients in the review). Adverse events were reported in 62% of these participants. The most common adverse events across all drugs were drowsiness or fatigue, headache or migraine, gastrointestinal disturbances, dizziness, and rash or skin disorders.
The two most commonly occurring adverse events per studied ASM are summarised in table 3. Comparison of adverse events between different medications should be made with caution, as more detailed information on side effects is available for newer ASMs compared to older ASMs.
|
ASM |
n |
Two most frequently occurring adverse events |
|
|
Levetiracetam |
2503 |
Drowsiness or fatigue (21.9%) |
Headache or migraine (24.8%) |
|
Lamotrigine |
3368 |
Drowsiness or fatigue (17.0%) |
Headache or migraine (17.0%) |
|
Carbamazepine |
5748 |
Drowsiness or fatigue (25.2%) |
Headache or migraine (16.6%) |
|
Phenytoin |
1057 |
Drowsiness or fatigue (unclear%) |
Headache or migraine (unclear%) |
|
Sodium valproate |
2250 |
Drowsiness or fatigue (20.0%) |
Weight gain (17.3%) |
|
Gabapentin |
948 |
Drowsiness or fatigue (34.4%) |
Weight gain (27.2%) |
|
Topiramate |
1209 |
Drowsiness or fatigue (51.2%) |
Paraesthesia or tingling (58.6%) |
|
Oxcarbazepine |
1021 |
Drowsiness or fatigue (23.1%) |
Dizziness or faintness (13.7%) |
|
Lacosamide |
445 |
Abnormal laboratory results (26.7%) |
Dizziness or faintness (19.8%) |
|
Phenobarbitone |
640 |
Mood or behavioural change (7.0%) |
Cognitive disorder (6.4%) |
Table 3. The two most frequently occurring adverse events for the researched antiseizure medications (used for both focal or generalized onset seizures).
Abbreviations: ASM: antiseizure medication
An elaborate overview of the number and type of reported events per medication for all different medications can be found in Table 21 of the original article by Nevitt (2022).
Level of evidence:
As the evidence is based on RCTs, the level of evidence for all outcome measures started at high.
1a. seizure incidence; 1b. time to seizure recurrence; 1c. retention rate
For these outcome measures no downgrading of the level of evidence took place for risk of bias, publication bias, inconsistency, or indirectness. However, downgrading in varying degrees for imprecision took place for different ASM.
Rationale:
For all three outcome measures above applies: some RCTs were at high risk of bias for at least one domain, yet sensitivity analyses showed similar numerical results and no changes to conclusions. Therefore, the authors judged that risk of bias within the trials had not influenced the overall results. In addition, publication bias was considered through the applicability of the individual participant data used. The authors noted a high risk of misclassification of epilepsy type in several studies, yet investigation of misclassification within the review did not show any important changes to treatment effect sizes and no changes to conclusions. No indication of important inconsistency between direct evidence and NMA results was found, except for:
- Seizure incidence (1a): large heterogeneity was present in the direct comparison of levetiracetam to sodium valproate (likely due to difference in trial designs), yet numerical results with NMA were similar.
- Time to seizure recurrence (1b): The direct evidence showed an advantage to sodium valproate compared to topiramate, yet the NMA showed no significant difference.
For none of these three issues has the level of evidence been downgraded.
For imprecision, downgrading took place by -1, -2, or -3 levels. Table 4 provides overview of the degree of downgrading per outcome measure and per ASM.
|
|
Reason for downgrading |
1a. Seizure incidence |
1b. Time to seizure recurrence |
1c. Retention rate |
|
-1 Moderate |
Not reaching optimal information size |
Carbamazepine Levetiracetam |
|
|
|
CI crossing one boundary of clinical important difference |
Lamotrigine Topiramate |
Carbamazepine Levetiracetam Lamotrigine Topiramate Phenytoin |
Carbamazepine Levetiracetam Lamotrigine Topiramate |
|
|
-2 Low |
CI crossing one boundary of clinical important difference with different inferences |
Phenobarbitone Oxcarbazepine Gabapentin |
Phenobarbitone Oxcarbazepine Gabapentin |
Phenobarbitone Phenytoin Lacosamide |
|
CI crossing both boundaries of clinical important difference |
Phenytoin |
|
|
|
|
-3 Very low |
Broad CI crossing both boundaries of clinical important difference with very different inferences |
Lacosamide |
Lacosamide |
Oxcarbazepine Gabapentin |
1d. Adverse events
The level of evidence regarding the outcome measure adverse events was downgraded by 2 levels because of possibly biased results due to study limitations in some of the included studies (-1, risk of bias); and heterogeneity in assessing and reporting adverse events through different studies (-1, inconsistency). The evidence was not downgraded for indirectness, despite the inclusion of adverse events after medication use for focal seizures, as the expected side effects are similar for both indications (focal and generalized seizures).
Description of studies
PICO 2
For the update of the NICE guidelines, an NMA was performed to answer the question: What add-on antiseizure medications are effective in the treatment of generalized tonic-clonic onset seizures? After the search on February 3rd, 2021, eight studies were included, with a cumulative of 1,218 participants with generalized onset tonic-clonic seizures for which one or more antiseizure medications had failed (with or without other generalized seizure types such as absence or myoclonus). Of these participants, 599 were in the placebo group (49.2%). In the active treatment groups, patients were treated with one of the following drugs: brivaracetam, lacosamide, lamotrigine, levetiracetam, perampanel or topiramate. All evidence was for active drugs compared to placebo, and no direct evidence was identified between two active treatments.
The outcome measures researched were >50% reduction in seizure frequency and seizure freedom during treatment or maintenance period. In addition, adverse events and health-related quality of life were assessed. Risk of bias was assessed with the Cochrane RoB tool v.2 for RCTs (Higgins, 2019). Of the eight included articles, four were assessed as having low risk of bias, two with some concerns (due to the randomization process or risk of bias in measurement of outcomes), and two with high risk of bias (concerns on multiple risk of bias domains).
Results
2a. Seizure incidence (critical)
Seizure incidence was assessed as >50% reduction in seizure frequency during treatment or maintenance period. The odds ratios (ORs) of ASMs compared to placebo (through a fixed effects NMA) are shown in figure 2a.
However, please note that odds ratio’s are not the desired outcome measure for the outcome 50% seizure reduction, as it can overestimate the risk; risk ratios would have been the adequate reporting measures.
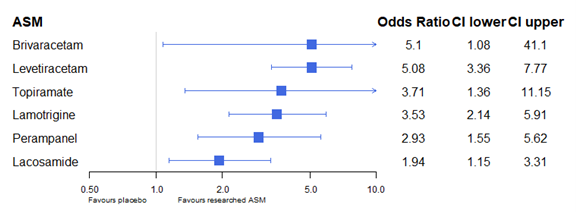
Figure 2a. The relative effect of antiseizure medicaton on seizure incidence (>50% reduction in seizure frequency) compared to placebo for patients with generalized seizures. Adapted from NICE (2022).
Seizure incidence was also assessed through seizure freedom rates during treatment or maintenance period, expressed in Odds Ratios (ORs), in Table 4.
|
Antiseizure medication |
Seizure free Odds Ratio (95% CI) |
|
Brivaracetam |
2.62 (0.11 to 13.27) |
|
Levetiracetam |
12.24 (5.1 to 37.1) |
|
Topiramate |
7.14 (0.31 to 34.55) |
|
Lamotrigine |
1.79 (0.92 to 3.54) |
|
Perampanel |
3.44 (1.56 to 8.11) |
|
Lacosamide |
2.03 (1.15 to 3.63) |
Table 4. Seizure freedom for patients with generalized seizures, after the use of antiseizure medicaton compared to placebo.
Abbreviations: CI: confidence interval.
2b. Time to seizure recurrence (critical) and 2c. Retention rate (important)
The performed NMA for the update of the NICE guidelines did not include time to seizure recurrence or retention rate as outcome measures.
2d. Adverse events
Side effects, treatment cessation due to adverse events, and mortality were recorded. However, the reporting was inconsistent across studies and the types of adverse events were not reported. The number of patients experiencing adverse events for ASM and placebo, and the number consequentially withdrawing, are presented in table 5. Despite having relatively high adverse event rates, the discontinuation rate due to adverse events was generally low. A relatively large discontinuation rate due to adverse events was seen in patients treated with perampanel.
|
Antiseizure medication |
n |
Total patients with AE (%) |
Patients withdrew from medication due to AE (%) |
|
Brivaracetam |
36 |
24 (66.0%) |
5 (13.9%) |
|
Levetiracetam |
206 |
130 (63.0%) |
15 (7.3%) |
|
Lamotrigine |
134 |
54 (40.1%) |
20 (14.9%) |
|
Perampanel |
81 |
67 (82.7%) |
48 (59.3%) |
|
Lacosamide |
121 |
96 (79.3%) |
5 (4.1%) |
|
Topiramate |
41 |
NR |
5 (12.2%) |
|
Placebo |
599 |
261 (43.5%) |
41 (6.8%) |
Table 5. Adverse event rate and consequential withdrawal for antiseizure medications used as add-on medication for patients with generalized seizures.
Abbreviatons: AE: adverse event.
Level of evidence of the literature
As the evidence was based on RCTs, the level of evidence started as high.
For the outcome measure seizure incidence (2a), the level of evidence was downgraded by 3 levels because of study limitations in half of the included studies (-1, risk of bias: in the randomization process in three studies, for deviation from intended interventions in two studies, for missing outcome data in two studies, and in measurement of the outcome in three studies); and because of the use of odds ratios overestimating the risk with the confidence intervals crossing the borders of clinical relevance and/or clinical significance (-2, imprecision). Publication bias was not assessed but might be present, yet was not a reason for downgrading.
The level of evidence regarding the outcomes time to seizure recurrence (2b) and retention rate (2c) could not be assessed with GRADE, as this outcome measure was not studied in the performed NMA.
The level of evidence regarding the outcome measure adverse events (2d) for add-on therapy was downgraded by 3 levels because of study limitations in half of the included studies (-1, risk of bias); heterogeneity in assessing and reporting adverse events through different studies (-1, inconsistency); and large variation in estimates (-1, imprecision).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following questions:
Subquestion 1: Which antiseizure medication as monotherapy is most effective and safe in patients with newly diagnosed generalized onset seizures?
P: Patients with newly diagnosed generalized onset seizures (with or without myoclonic seizures) and an indication for antiseizure treatment
I: antiseizure medication (ASM) monotherapy
C: other ASMs
O: Seizure incidence (seizure freedom, 50% seizure reduction), time to seizure recurrence, retention or discontinuation rate, adverse events
Subquestion 2: Which antiseizure medication as add-on therapy is the most effective and safe in patients with treatment resistant generalized onset seizures?
P: Patients with treatment resistant generalized onset seizures (with or without myoclonic seizures) and with an indication for antiseizure treatment
I: Add-on ASMs
C: Other ASMs, other doses, placebo, or no treatment
O: Seizure incidence (seizure freedom, 50% seizure reduction), time to seizure recurrence, retention or discontinuation rate, adverse events
Relevant outcome measures
The guideline development group considered seizure incidence and time to seizure recurrence as critical outcome measures for decision making; and retention/discontinuation rate and adverse events as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies. For instance, for seizure freedom this could mean number of patients being seizure free at a certain time point during follow-up, or for a certain duration during follow-up.
The working group defined a HR or RR ≤0.8 or ≥1.25 (dichotomous outcomes) and 10% (continuous outcomes) as minimal clinically (patient) important difference.
Search and select (Methods)
In 2012, the first version of this module was based on the NICE guideline (NICE, 2012). Studies from before this date were not included in the literature summary. After this date, a yearly search of the literature was conducted to include relevant studies.
For the current revision, the update of the NICE guideline from 2022 was used. In addition, we searched the databases Medline/Pubmed and Embase with relevant search terms from the January 1st, 2019 (last search) until March 23rd, 2022. The detailed search strategy is available upon request. The search was limited to systematic reviews (with or without meta-analysis) and randomized controlled trials. The systematic literature search resulted in 1563 hits. Studies were selected based on the following criteria:
- Systematic review (with detailed search strategy, risk of bias assessment and results of individual studies available) or randomized controlled trial;
- Described ASM as monotherapy or add-on therapy as intervention
- Described other ASMs, doses, placebo, or no treatment as comparison
- Described at least one of the outcome measures as described in the PICO
- Full-text English language publication
- Studies including ≥10 participants in each study arm
One single literature search was conducted for the effectiveness and safety of ASMs for focal onset, generalized onset, and unclassified onset seizures. For this module, 10 studies were initially selected based on title and abstract screening (one for monotherapy, and nine for add-on therapy). After reading the full text, one study was found for PICO 1 (monotherapy), and two studies were deemed suitable for inclusion for PICO 2 (add-on therapy). However, the study for PICO 1 was included in a recent Cochrane review from 2022, and the studies for PICO 2 were included in the Network Meta-analysis (NMA) performed in the 2022 update of the NICE guideline. Therefore, all studies were excluded (see the table with reasons for exclusion under the heading Evidence Tables); the Cochrane review and the 2022 update of the NICE guideline was used for the literature analysis.
Results
A recent large Cochrane review (for PICO 1) and the 2022 update of the NICE guidelines (for PICO 2) were used for the literature analysis.
Referenties
- Abou-Khalil BW. Update on Antiepileptic Drugs 2019. Continuum (Minneap Minn). 2019 Apr;25(2):508-536. doi: 10.1212/CON.0000000000000715. PMID: 30921021.
- Higgins, J. P., Thomas, J., Chandler, J., Cumpston, M., Li, T., Page, M. J., & Welch, V. A. Cochrane handbook for systematic reviews of interventions. 2019. John Wiley & Sons.
- Nevitt SJ, Sudell M, Cividini S, Marson AG, Tudur Smith C. Antiepileptic drug monotherapy for epilepsy: a network meta-analysis of individual participant data. Cochrane Database Syst Rev. 2022 Apr 1;4(4):CD011412. doi: 10.1002/14651858.CD011412.pub4. PMID: 35363878; PMCID: PMC8974892.
- National Institute for Health and Care Excellence. Epilepsies in children, young people and adults (NICE guideline NG217). 2022. https://www.nice.org.uk/guidance/ng217/evidence/f-addon-therapy-for-generalised-tonicclonic-and-focal-onset-seizures-pdf-398366282815
- Nikolakopoulou A, Higgins JPT, Papakonstantinou T, Chaimani A, Del Giovane C, Egger M, Salanti G. CINeMA: An approach for assessing confidence in the results of a network meta-analysis. PLoS Med. 2020 Apr 3;17(4):e1003082. doi: 10.1371/journal.pmed.1003082. PMID: 32243458; PMCID: PMC7122720.
- Tomson T, Marson A, Boon P, Canevini MP, Covanis A, Gaily E, Kälviäinen R, Trinka E. Valproate in the treatment of epilepsy in girls and women of childbearing potential. Epilepsia. 2015 Jul;56(7):1006-19. doi: 10.1111/epi.13021. Epub 2015 May 16. PMID: 25851171.
- Abou-Khalil BW. Update on Antiepileptic Drugs 2019. Continuum (Minneap Minn). 2019 Apr;25(2):508-536. doi: 10.1212/CON.0000000000000715. PMID: 30921021.
- Higgins, J. P., Thomas, J., Chandler, J., Cumpston, M., Li, T., Page, M. J., & Welch, V. A. Cochrane handbook for systematic reviews of interventions. 2019. John Wiley & Sons.
- Nevitt SJ, Sudell M, Cividini S, Marson AG, Tudur Smith C. Antiepileptic drug monotherapy for epilepsy: a network meta-analysis of individual participant data. Cochrane Database Syst Rev. 2022 Apr 1;4(4):CD011412. doi: 10.1002/14651858.CD011412.pub4. PMID: 35363878; PMCID: PMC8974892.
- National Institute for Health and Care Excellence. Epilepsies in children, young people and adults (NICE guideline NG217). 2022. https://www.nice.org.uk/guidance/ng217/evidence/f-addon-therapy-for-generalised-tonicclonic-and-focal-onset-seizures-pdf-398366282815
- Nikolakopoulou A, Higgins JPT, Papakonstantinou T, Chaimani A, Del Giovane C, Egger M, Salanti G. CINeMA: An approach for assessing confidence in the results of a network meta-analysis. PLoS Med. 2020 Apr 3;17(4):e1003082. doi: 10.1371/journal.pmed.1003082. PMID: 32243458; PMCID: PMC7122720.
- Tomson T, Marson A, Boon P, Canevini MP, Covanis A, Gaily E, Kälviäinen R, Trinka E. Valproate in the treatment of epilepsy in girls and women of childbearing potential. Epilepsia. 2015 Jul;56(7):1006-19. doi: 10.1111/epi.13021. Epub 2015 May 16. PMID: 25851171.
Evidence tabellen
Evidence table for systematic review of RCTs
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Nevitt, 2022 |
SR and (network) meta-analysis of RCTs
Literature search up to April 2022
Study design: RCT [parallel design]
Setting and Country: Academic centre, United Kingdom
Source of funding and conflicts of interest: Non-commercial funding; last author is editor of Cochrane Epilepsy Group, yet was not involved in the editorial process of this review. He also received individual funding from non-commercial sources.
|
Inclusion criteria SR: (1) double-blind, single-blind or unblinded RCTs, (2) children or adults with focal onset seizures (with or without secondary generalisation) or generalized onset tonic-clonic seizures., (4) comparing 2 ASMs
Exclusion criteria SR: (1) cross-over designs, (2) trials with add-on medication, (3) trials that considered ASMs as treatment for conditions other than epilepsy.
89 studies included
Important patient characteristics at baseline: see table 2 and 3 in original review
Mean age Ranging from 6 to 78 years
Sex: 57% M/ 43% F
Epilepsy type Focal: 70% Generalized: 29%
Median epilepsy duration Ranging from 0.2 to 7 years
Median number of seizures in last 6 months Ranging from 1 to 24
Groups comparable at baseline? Yes |
Monotherapy treatment with one of the following ASM:
|
Monotherapy with any other ASM mentioned in (I). |
End-point of follow-up: Not specifically mentioned, yet outcome measure is time to 12-month seizure-free period (so follow-up preferably >12 months)
For how many participants were no complete outcome data available? A total of 5268 patients were classified as experiencing generalized onset seizures. For 4270 of these , individual participant data was available. Aggregate data from articles without individual participant data was extracted and incorporated in the network meta-analyses through sensitivity analyses.
|
Time to treatment failure Defined as failure for any treatment-related reason, either tolerability (side effects, non-compliance) or efficacy (continued seizures, initiation of add-on treatment)
Effect measure: HR [95%CI] – all compared to sodium valproate
Time to 12-month seizure-free Effect measure: HR [95%CI] – all compared to sodium valproate
Time to first seizure post-randomization Effect measure: HR [95%CI] – all compared to sodium valproate
Adverse events Narratively reported. See table 20 and 21 in review. |
Brief description of author’s conclusion the use of sodium valproate as the first-line treatment is recommended for individuals with generalized tonic-clonic seizures and lamotrigine and levetiracetam would be suitable alternative firstline treatments.
GRADE-assessment GRADE-assessment through the CINeMa tool was done by the authors and presented in the article.
Sensitivity analyses Several sensitivity analyses were performed, not showing any numerical differences in effect estimates for all comparisons made.
Heterogeneity: In some comparisons large amount of heterogeneity was presents, likely due to difference in trial design, yet sensitivity analyses showed no numerical difference.
|
Abbreviations: ASM: antiseizure medication, CBZ: carbamazepine, CI: confidence interval, GBP: gabapentin, HR: hazard ratio, LCM: lacosamide, LEV: levetiracetam, LTG: lamotrigine, OXC: oxcarbazepine, PHB: phenobarbitone, PHT: phenytoin, RCT: randomised controlled trial, SR: systematic review, TPM: topiramate
Risk of Bias Table
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for confounders in obs. studies?
Yes/no/unclear/n.a. |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Nevitt, 2022 |
Yes, clear objectives stated with clear PICO |
Yes, various databases on 12 april 2021, with search strategy available in appendix |
Yes, under “Characteristics of studies” and Figure 3 |
Yes, under “Characteristics of studies” |
Not applicable |
Yes, under “Characteristics of studies” |
Yes, network meta-analysis with sensitivity analyses |
Yes, though no formal funnel plot for information bias has been performed, as the review is based on individual participant data. “Availability bias” is considered in discussion. |
Yes, both for the authors of the review as funding information of the included studies. |
|
NICE, 2022 |
Yes, clear objectives stated with PICO |
Yes, various databases searched on 3 February 2021, with search strategy available in appendix B |
Yeas, in appendix C and K (excluded) |
Yes, in appendix D. |
Not applicable |
Yes, in additional information B: 4 studies low RoB (Vossler 2020, Wu 2018, French 2015, Biton 1999), 2 studies some concerns (Kwan 2014; Berkovic 2007), 2 studies high RoB (Biton 2005 & 2010). |
Yes, network meta-analysis with sensitivity analyses |
No, impact of publication bias on results was not investigated (mentioned in discussion) |
Yes, recorded according to NICE’s conflicts of interest policy |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Bresnahan R, Panebianco M, Marson AG. Lamotrigine add-on therapy for drug-resistant generalised tonic-clonic seizures. Cochrane Database Syst Rev. 2020 Jul 1;7(7):CD007783. doi: 10.1002/14651858.CD007783.pub3. PMID: 32609387; PMCID: PMC7387132. |
2 of 3 included articles by Bresnahan included in NICE guideline 2022, 1 excluded because of crossover design. |
|
Marson A, Burnside G, Appleton R, Smith D, Leach JP, Sills G, Tudur-Smith C, Plumpton C, Hughes DA, Williamson P, Baker GA, Balabanova S, Taylor C, Brown R, Hindley D, Howell S, Maguire M, Mohanraj R, Smith PE; SANAD II collaborators. The SANAD II study of the effectiveness and cost-effectiveness of valproate versus levetiracetam for newly diagnosed generalised and unclassifiable epilepsy: an open-label, non-inferiority, multicentre, phase 4, randomised controlled trial. Lancet. 2021 Apr 10;397(10282):1375-1386. doi: 10.1016/S0140-6736(21)00246-4.. Erratum in: Lancet. 2021 May 15;397(10287):1808. PMID: 33838758; PMCID: PMC8047813. |
Included in systematic review by Nevitt (2022) |
|
Driscoll J, Almas M, Gregorian G, Kyrychenko A, Makedonska I, Liu J, Patrick J, Scavone JM, Antinew J; 1105 Study Group. Pregabalin as adjunctive therapy in adult and pediatric patients with generalized tonic-clonic seizures: A randomized, placebo-controlled trial. Epilepsia Open. 2021 Jun;6(2):381-393. doi: 10.1002/epi4.12492. Epub 2021 May 16. PMID: 34033265; PMCID: PMC8166786. |
Wrong population |
|
Vossler DG, Knake S, O'Brien TJ, Watanabe M, Brock M, Steiniger-Brach B, Williams P, Roebling R; SP0982 co-investigators. Efficacy and safety of adjunctive lacosamide in the treatment of primary generalised tonic-clonic seizures: a double-blind, randomised, placebo-controlled trial. J Neurol Neurosurg Psychiatry. 2020 Oct;91(10):1067-1075. doi: 10.1136/jnnp-2020-323524. Epub 2020 Aug 18. PMID: 32817358; PMCID: PMC7509528. |
Included in NICE guideline 2022 |
|
Mehndiratta MM, Gulhane M, Jabeen SA, Patten A, Dash A, Malhotra M. Efficacy and safety of adjunctive perampanel in patients with focal seizures or generalized tonic-clonic seizures: Post hoc analysis of Phase II and Phase III double-blind and open-label extension studies in India. Epilepsia Open. 2021 Feb 8;6(1):90-101. doi: 10.1002/epi4.12448. PMID: 33681652; PMCID: PMC7918331. |
Wrong population, wrong study design |
|
Brandt C, Wechsler RT, O'Brien TJ, Patten A, Malhotra M, Ngo LY, Steinhoff BJ. Adjunctive perampanel and myoclonic and absence seizures: Post hoc analysis of data from study 332 in patients with idiopathic generalized epilepsy. Seizure. 2020 Aug;80:115-123. doi: 10.1016/j.seizure.2020.06.011. Epub 2020 Jun 8. PMID: 32563171. |
Wrong study design |
|
He J, Wu X, Zhou D. The efficacy of lamotrigine after failure of the first administration of valproate in treating epilepsy: a systematic review and meta-analysis. Ann Palliat Med. 2022 Jan;11(1):113-122. doi: 10.21037/apm-21-3555. PMID: 35144403. |
Wrong study design |
|
Ji ZY, Huang YQ, He WZ. Sodium Valproate Combined With Topiramate vs. Sodium Valproate Alone for Refractory Epilepsy: A Systematic Review and Meta-Analysis. Front Neurol. 2022 Jan 5;12:794856. doi: 10.3389/fneur.2021.794856. PMID: 35069424; PMCID: PMC8766331. |
Wrong population |
|
Yang C, Peng Y, Zhang L, Zhao L. Safety and Tolerability of Lacosamide in Patients With Epilepsy: A Systematic Review and Meta-Analysis. Front Pharmacol. 2021 Sep 20;12:694381. doi: 10.3389/fphar.2021.694381. PMID: 34616294; PMCID: PMC8488108. |
Wrong population |
|
Resnick T, Patten A, Ngo LY, Malhotra M. Sustained seizure freedom with adjunctive perampanel in patients with convulsive seizures: Post hoc analysis of open-label extension studies 307 and 332. Epilepsy Behav. 2022 Mar;128:108528. doi: 10.1016/j.yebeh.2021.108528. Epub 2022 Jan 22. PMID: 35078116. |
Wrong study design |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 04-10-2023
Beoordeeld op geldigheid : 30-05-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules is in 2020 een multidisciplinair cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met epilepsie.
Clusterstuurgroep
- Prof. dr. H.J.M. Majoie (voorzitter), neuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/ Maastricht UMC+, Heeze en Maastricht
- Drs. M.H.G. Dremmen, radioloog, Erasmus MC Rotterdam
- Dr. P. Klarenbeek, neuroloog, Zuyderland Medisch Centrum, Heerlen
- Dr. J. Nicolai, kinderneuroloog, Academisch Centrum voor Epileptologie Kempenhaeghe/Maastricht UMC+, Maastricht
- Dr. C.M. Delsman-van Gelder, kinderneuroloog, RadboudUMC, Nijmegen
- Dr. P. van Vliet, neuroloog/intensivist, Haaglanden Medisch Centrum, Den Haag
- Drs. R. van Vugt, anesthesioloog, Sint Maartens Kliniek, Nijmegen
Clusterexpertisegroep betrokken bij deze module
- Drs. T. Balvers, neuroloog, SEIN, Heemstede
- Drs. J. Masselink, neuroloog, Medisch Spectrum Twente, Enschede
- Dr. F.N.G van 't Hof, neuroloog, SEIN, Heemstede en Amsterdam
- Dr. P. Klarenbeek, neuroloog, Zuyderland Medisch Centrum, Heerlen
Met ondersteuning van
- Dr. M.M.J. van Rooijen, adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
- Dr. J. Buddeke senior adviseur Kennisinstituut van de Federatie Medisch Specialisten Utrecht
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
Stuurgroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Majoie* |
Functie: Neurologie Werkgever: Academisch Centrum voor Epileptologie Kempenhaeghe, Maastricht UMC+ |
Relevante commissies
NB geen betaalde functies |
Lopende onderzoek- en zorginnovatieprojecten (anders dan contract research) worden gefinancierd uit ZonMW, Nationaal epilepsiefonds, stichting vrienden van Kempenhaeghe, en SKMS.
Incidenteel financiële ondersteuning aan stichting Kempenhaeghe voor organisatie refereeravonden en workshops/symposia (telkens volgens geldende wet en regelgeving). |
Geen actie |
|
Delsman |
Kinderneuroloog/kinderarts Werkgever: Maxima Medisch Centrum Veldhoven |
Geen |
Geen |
Geen actie |
|
Dremmen |
Functie: Kinderradioloog met subspecialisatie kinderneuroradiologie Werkgever: ErasmusMC te Rotterdam |
Een van de voorzitters van de richtlijn Radiologische diagnostiek acute trauma-opvang bij kinderen Expertisegroep richtlijn Traumatologie Uitgenodigd spreker op meerdere nationale en internationale cursussen en congressen |
Geen |
Geen actie |
|
Klarenbeek |
Functie: Neuroloog Werkgever: Zuyderland te Heerlen/Sittard (vrijgevestigd) |
Geen |
Geen |
Geen actie |
|
Nicolai |
Functie: Kinderneuroloog Werkgever: Maastricht UMC+. Tevens gedetacheerd/ werkzaam in Kempenhaeghe, Heeze; St Jansgasthuis, Weert; Elkerliek, Helmond en Viecuri, Venlo. |
Coördinator Sepion beginnerscursus; vergoeding wordt door Sepion naar AMBI goed doel gestort. Tevens betrokken bij Sepion gevorderden cursus en AVG cursus; vergoeding wordt door Sepion naar AMBI goed doel gestort. |
Boegbeeldfunctie bij een patiënten- of beroepsorganisatie |
Geen actie |
|
Van Vliet |
Functie: Intensivist Werkgever: Haaglanden Medisch Centrum te Den Haag |
|
Geen |
Geen actie |
|
Van Vugt |
Functie: Anesthesioloog Werkgever: Sint Maartenskliniek te Nijmegen |
Lid commissie kwaliteitsdocumenten NVA (onbetaald) |
Geen |
Geen actie |
Expertisegroep
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Altinbas |
Functie: Neuroloog-kinderneuroloog Werkgever: SEIN locatie Meer en Bosch werkzaam op de polikliniek en kliniek (0.6 fte), LUMC polikliniek kinderneurologie (0.2 fte). |
|
Per 2023 zal het landelijk CBD consortium een onderzoek starten naar de behandeling van kinderen met therapieresistente epilepsie met CBD (gesubsidieerd door ZonMW). |
Geen actie |
|
Balvers |
Functie: Neuroloog (Behandeling van patiënten met epilepsie; klinisch, poliklinisch en in woonzorg) Werkgever: Stichting Epilepsie Instellingen Nederland (SEIN) (0.6fte)
Functie: Neuroloog (Behandeling van patiënten met hoofdpijn; poliklinisch) Werkgever: The Migraine Clinic, Amsterdam (0.2 fte) |
|
|
Geen restrictie voor Epilepsie. |
|
De Bruijn |
Functie: neuroloog in opleiding Werkgever: ETZ Tilburg |
Geen |
Geen |
Geen actie |
|
Draak |
Functie: Kinderneuroloog, neuroloog. Werkgever: Zuyderland Medisch Centrum |
Geen |
Geen |
Geen actie |
|
Eshuis |
Functie: AIOS Spoedeisende geneeskunde Werkgever: Catharina Ziekenhuis te Eindhoven |
|
Geen |
Geen actie |
|
Hofman |
Functie: Radioloog Werkgever: Maastricht UMC+ (1.0fte) |
|
Geen |
Geen actie |
|
Koekkoek |
Functie: Neuroloog Werkgever: Leids Universitair Medisch Centrum (0.8fte), Haaglanden Medisch Centrum (0.2fte) |
|
Geen |
Geen actie |
|
Lazeron |
Functie: Neuroloog Werkgever: Academisch centrum Epileptologie Kempenhaeghe Maastricht UMC+ (voltijds).
Functie: Wetenschappelijk onderzoeker Werkgever: Technische universiteit te Eindhoven (nul uren aanstelling) |
|
Lid van het TeleEpilepsie consortium. Met dit consortium hebben een aanvalsdetector ontwikkeld, de Nightwatch(R) die door LivAssured geproduceerd wordt. Geen direct financieel belang in dit bedrijf, maar van eventuele toekomstige winsten van LivAssured vloeit een klein percentage terug naar het consortium voor epilepsie-onderzoek |
Restricties ten aanzien van besluitvorming met betrekking tot apparaten die aanvallen detecteren (e.g. Nightwatch) |
|
Masselink |
Functie: Ziekenhuisapotheker Werkgever: Medisch Spectrum Twente |
|
Geen |
Geen actie |
|
M’Rabet |
Functie: MT-lid Kennis en Innovatie Werkgever: EpilepsieNL, Houten |
Geen |
|
Geen actie |
|
Reijneveld |
Functie: Neuroloog, Werkgever: Stichting Epilepsie Instellingen Nederland (SEIN) te Heemstede (0.8 fte)
Functie: Universitair Hoofddocent, afdeling Neurologie Werkgever: Amsterdam UMC (0.2 fte) |
|
Geen |
Geen actie |
|
Ronner |
Functie: Neuroloog Werkgever: Amsterdam UMC (0.8 fte) |
|
Geen |
Geen actie |
|
Schijns |
Functie: Neurochirurg met specialisatie Epilepsiechirurgie en Neuro-oncologische Chirurgie |
|
|
Geen actie |
|
Snoeijen |
Functie: Arts Verstandelijk Gehandicapten Werkgever: Kempenhaeghe, fulltime |
Geen |
Geen |
Geen actie |
|
Thijs |
Functie: neuroloog Werkgever: Stichting Epilepsie Instellingen Nederland (1.0 fte) Leids Universitair Medisch Centrum (detachering vanuit SEIN voor 0.2 fte) |
|
|
Restrictie ten aanzien van besluitvorming met betrekking tot apparaten die aanvallen detecteren (e.g. Nightwatch®). |
|
Tousseyn |
Functie: neuroloog Werkgever: Academisch Centrum voor Epileptologie (ACE) Kempenhaeghe/Maastricht UMC+, locatie Heeze |
|
|
Geen actie |
|
Uiterwijk |
Functie: Epileptoloog Werkgever: Academisch Centrum voor Epileptologie Kempenhaeghe |
Geen |
Geen |
Geen actie |
|
Van 't Hof |
Functie: neuroloog Werkgever: SEIN (Stichting Epilepsie Instellingen Nederland) |
|
Geen |
Geen actie |
|
Van Tuijl |
Functie: Neuroloog Werkgever: ETZ Tilburg |
|
|
Geen actie |
|
Tolboom |
Functie: Nucleair geneeskundige Werkgever: UMC Utrecht |
Geen |
Geen |
Geen actie |
|
Verbeek |
Functie: Klinisch geneticus Werkgever: UMC Utrecht |
Geen |
Geen |
Geen actie |
|
Vlooswijk |
Functie: Neuroloog Werkgever: Maastricht UMC+ |
|
|
Geen actie |
|
Wegner |
Functie: Neuroloog Werkgever: Stichting Epilepsie instellingen Nederland (SEIN) |
|
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de afvaardiging van EpilepsieNL in het cluster. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens voor commentaar voorgelegd aan Epilepsie NL en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er [waarschijnlijk geen/ mogelijk] substantiële financiële gevolgen zijn, zie onderstaande tabel.
| Module | Uitkomst raming | Toelichting |
| Module ‘Welk anti-epilepticum: aanvallen met een gegeneraliseerd begin’ | geen financiële gevolgen |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Cyclus werkwijze
Bij de start van de cyclus is de geldigheid van alle modules geïnventariseerd, waarna er een prioriteringsronde heeft plaatsgevonden. De geprioriteerde modules zijn herzien en geüpdatet door het cluster.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Netwerk meta-analyse
Voor de beoordeling van de bewijskracht uit een netwerk meta-analyse (NMA) wordt gebruik gemaakt van de CINeMA-tool (Nikolakopoulou, 2020; Papakonstantinou, 2020). Met deze tool wordt op basis van een analyse in R de effectschattingen berekend. Voor het beoordelen van de bewijskracht, op basis van de berekende effectschattingen, worden zes domeinen geëvalueerd, namelijk Risk-of-Bias, publicatiebias, indirectheid, imprecisie, heterogeniteit and incoherentie. Voor het opstellen van de conclusies zijn principes van de GRADE working group gebruikt op basis van grenzen van klinische besluitvorming (Brignardello-Petersen, 2020).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brignardello-Petersen R, Florez ID, Izcovich A, Santesso N, Hazlewood G, Alhazanni W, Yepes-Nuñez JJ, Tomlinson G, Schünemann HJ, Guyatt GH; GRADE working group. GRADE approach to drawing conclusions from a network meta-analysis using a minimally contextualised framework. BMJ. 2020 Nov 11;371:m3900. doi: 10.1136/bmj.m3900. PMID: 33177059.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Nikolakopoulou A, Higgins JPT, Papakonstantinou T, Chaimani A, Del Giovane C, Egger M, Salanti G. CINeMA: An approach for assessing confidence in the results of a network meta-analysis. PLoS Med. 2020 Apr 3;17(4):e1003082. doi: 10.1371/journal.pmed.1003082. PMID: 32243458; PMCID: PMC7122720.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Papakonstantinou T, Nikolakopoulou A, Higgins JPT, Egger M & Salanti G. CINeMA: Software for semiautomated assessment of the confidence in the results of network meta-analysis. Campbell Systematic Reviews 2020;16:e1080.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
