Zorg op afstand
Uitgangsvraag
In hoeverre kan zorg op afstand bij diabetes (type 1 en 2) worden ingezet in de tweede lijn?
Aanbeveling
- Overweeg zorg op afstand middels telemonitoring, e-consult, telefonisch consult en videobellen in te zetten als aanvulling op de reguliere, niet-digitale diabeteszorg. Houd de diabeteszorg altijd toegankelijk via niet-digitale toegang.
- Bied mogelijkheden voor telemonitoring gericht op glykemische controle breed aan.
- Lever diabeteszorg op afstand op maat en passend bij de patiënt. Maak gezamenlijk met de patiënt een individuele afweging, waarbijzowel patiëntfactoren en -wensen als specifieke medische factoren (bijv. diabetische voet) een rol spelen
Situaties en onderdelen uit de follow-up van mensen met diabetes (type 1 en 2) die wel of niet op afstand kunnen:
|
Kan digitaal of op afstand |
Fysiek consult |
|
|
Zie in de tweedelijnszorg elke patiënt met diabetes minstens eenmaal per jaar fysiek.
Houd voor de frequentie van controles de aanbevelingen volgens het programma uitkomstgerichte zorg aan (Programma Uitkomstgerichte Zorg, 2023).
Voor kinderen en adolescenten met diabetes type 1 gelden dezelfde bovenstaande aanbevelingen (Zie bijlage ‘De inzet van zorg op afstand bij kinderen en adolescenten met diabetes type 1’)
In het bijgevoegde samenvattingsschema kunt u het overzicht van het zorgproces vinden.
Overwegingen
In dit evidence-to-decision framework worden alle aspecten van kwaliteit (effectiviteit, veiligheid, efficiëntie, kosten, toegankelijkheid, en patiënt- en zorgverlenertevredenheid) toegelicht. Op basis hiervan heeft de werkgroep beoogd aanbevelingen op te stellen over zorg op afstand: of, en zo ja in welke situaties, deze in de keten van diabeteszorg kan worden toegepast. Dit is weergegeven in het bijgevoegde samenvattingsschema van diabeteszorg.
De onderzochte interventie betroffen vooral (combinaties van) de volgende vier vormen van digitale diabeteszorg:
- Telemonitoring (bijv. monitoring van glucose, bloeddruk en of gewicht, beweging op afstand)
- Specifieke interventies of counseling via een digitaal medium/platform al dan niet met specifieke apps en al dan niet met real-time contact mogelijkheden
- Contact op afstand in de vorm van een e-consult
- Contact op afstand in de vorm van een telefonisch consult
- Contact op afstand in de vorm van een videoconsult
Voor- en nadelen van de interventie
Effectiviteit en veiligheid
Definitief stellen dat fysieke zorg vervangen kan worden door zorg op afstand kunnen we niet, omdat er in de literatuur geen onderzoek is gedaan naar de lange termijnseffectiviteit van zorg op afstand. Het vervangen en langetermijnsaspect zijn hierin essentieel: tijdelijk op afstand werken, onderwijs krijgen/geven of zorg ontvangen vormden geen problemen, maar de lange termijnseffecten waren niet altijd positief.
Effectiviteit en veiligheid zijn wel in de literatuuranalyse onderzocht in studies die de reguliere zorg probeerden te verbeteren met (intensievere of meer gestructureerde) behandeling met behulp van zorg op afstand. Er lijkt uit deze studies geen klinisch relevant beter, noch slechter effect van zorg op afstand te zijn ten opzichte van fysieke reguliere zorg. De bewijskracht hiervoor is laag voor patiënten met diabetes type 1, omdat de beoordeelde studies voornamelijk gebaseerd zijn op patiënten met diabetes type 2 (voor hen is de bewijskracht moderate).
Hoewel sommige studies een sterk positief effect op de HbA1c waarden suggereren van zorg op afstand ten opzichte van fysieke zorg bij diabetespatiënten, is dit lastig toe te schrijven aan specifieke factoren of componenten. Men kan de hypothese stellen dat het positieve effect zou kunnen samenhangen met het intensiever bezig te zijn met de eigen zorg en de frequentere en laagdrempelige contactmomenten met de zorgverlener.
- De systematische review van Michaud (2021) beschrijft dat het zelfmanagement bij patiënten met diabetes type 2 verbeterd kan worden omdat ook leefstijl- en gedragsverandering efficiënter kan worden aangepakt met zorg op afstand, in aanvulling op reguliere interactie met zorgprofessionals en het aanpassen van de diabetesmedicatie; real-time feedback (via synchroon contact: telefonisch of videobellen) bleek een sterker positief effect op HbA1c waarden dan feedback die op een later willekeurig moment werd gegeven (asynchroon via e-mail, SMS, webportaal, automatisch gegenereerd bericht).
- Kebede’s (2018) systematische review doet subanalyses voor verschillende typen zorg op afstand voor patiënten met diabetes type 2: voor het gebruik van SMS, communicatie met de zorgverlener via telefoon of video, en internet-gebaseerde interventies (via persoonlijke digitale assistent, computer, tablet of smartphone). Alleen de internet-gebaseerde interventies effectueerden een significante HbA1c daling. Studies met een langere interventieperiode toonden een groter effect op HbA1c; dit kan te maken hebben met gedragsveranderingscomponenten waarop de interventie zich richt, waarbij gedragsverandering tijd nodig heeft. Ook lieten patiënten met een HbA1c waarde >7.5% een grotere daling zien ten opzichte van patiënten met waarde >7.0%. Daarnaast waren er ook psychologische technieken ter ondersteuning van gedragsverandering (promoten van zelfmonitoring en oplossen van problemen), welke gepaard gingen met een sterkere verlaging van het HbA1c.
- Twee RCT’s met een laag risico op bias identificeerden aanvullende factoren voor het succes van zorg op afstand. Molavynejad (2020) hypothetiseert dat patiënten met diabetes type 2 die video tele-educatie ontvingen meer kennis van de therapiedoelen hebben, en een hogere motivatie hebben om te leren over diabetes zelfmanagement en om deel te nemen in shared decision making en andere educatieprogramma’s. Hu (2021) beschrijft ook het beter begrijpen van (de oorzaak van) hypoglykemieën (kennis van therapiedoelen) en het zelfstandig kunnen handelen (zelfmanagement) als positieve componenten van zorg op afstand. Daarnaast worden het frequenter controleren van de bloedglucosewaarden en tijdig advies geven ter voorkoming van hypoglykemie bij telemonitoring aangewezen als componenten die het verschil kunnen maken met de controlegroep.
Vanwege de zeer lage bewijskracht van de literatuur voor Diabetische voetzorg, kan niet met zekerheid iets worden gezegd over hetamputatiepercentage, genezingspercentage en mortaliteit wanneer deze op afstand geleverd wordt, in vergelijking met fysieke zorg. De zeer lage bewijskracht betekent dat de conclusie gemakkelijk kan veranderen bij de publicatie van nieuwe literatuur. De mortaliteit ligt mogelijk hoger, en dit is relevant voor de praktijk en ook zeer plausibel: vaak is dit gerelateerd aan infectie en/of sepsis, waarbij de patiënten gezien moeten worden om de wonden te verzorgen en de mate van infectie en genezingstendens te beoordelen. Deze beoordeling gaat veel lastiger via zorg op afstand.
Met betrekking tot de veiligheid lijkt zorg op afstand te leiden tot minder hypoglykemische events, waarbij de incidence rate ratio tussen de 0.39 en 0.72 gemiddeld ligt (zeer lage bewijskracht). De verklaring die in de RCT voor dit verschil wordt gegeven, is dat frequente monitoring met vroege aanpassingen van de insuline dosering en patiënteducatie ter voorkoming van hypoglykemieën kon plaatsvinden. Het frequentere en laagdrempeligere contact op de cruciale momenten (waarbij proactief kan worden gehandeld) kan dus een succesfactor zijn ten opzichte van een vaste afspraak elke 3 maanden (waarbij achteraf informatie beschikbaar komt).
Efficiëntie
Over efficiëntie is in de literatuur weinig tot geen informatie naar voren gekomen. Efficiëntie hangt echter samen met de invulling van “remote health care delivery”/ zorg op afstand: is dit een app met bijvoorbeeld real time informatie, waardoor er frequenter en tijdiger zorg wordt geleverd? De factoren die maken dat (het proces van) zorg op afstand een succes is moeten worden geïdentificeerd. Pas dan kan er worden beoordeeld welke tijdsinvestering voor deze factoren nodig zijn, en in hoeverre de bestaande zorg hierop kan inspelen.
Kosten (middelenbeslag)
Uit de literatuuranalyse voor de beoordeling van de effectiviteit en veiligheid van zorg op afstand kwamen ook twee RCT’s naar voren die kosten rapporteerden.
Li (2021) gebruikte een diabetes datamanagement systeem en een app om een HbA1c waarde van <7.0% te bereiken. Hierbij werden de totale kosten, incrementele kosten, en incrementele kosten-effectiviteitsratio (ICER) berekend. Registratie, materialen, behandeling, laboratoriumkosten, en kosten voor ziekenhuisopname werden meegenomen. Yang (2022) analyseerde de totale kosten van zorg op afstand-interventies voor één maand, inclusief geneesmiddel- en teststripgebruik, en advieskosten voor diëtisten en fysiotherapeuten. De monetaire eenheid in beide studies was Chinese Yen (¥). De resultaten staan weergegeven in tabel 5. Zorg op afstand lijkt tot een kleine afname van kosten te leiden, maar hoe deze kosten zich verhouden tot effectiviteit (bijvoorbeeld kwaliteit van leven) is niet onderzocht. Daarbij is het niet zeker of deze kostenalyse ook geldt voor Westerse landen, gezien de verschillen in inrichting in het zorgsysteem ten opziche van China.
Tabel 5. Kosten uitkomsten voor zorg op afstand vergeleken met fysieke zorg.
|
|
Yang (2022) (kosten per maand per patiënt) |
Li (2021) (kosten per jaar per patiënt) |
||
|
Telemedicine (n = 50) |
Control (n = 50) |
mHealth (n = 130) |
Usual care (n = 85) |
|
|
Totale kosten (gem., SD) |
193.48 (21.71) |
331.67 (56.37) |
1169.76 (NR) |
1775.44 (NR) |
|
Incrementele kosten (95% CI) |
-138.19 (-154.93 tot -121.45) |
-605.86 (NR) |
||
|
ICER |
|
-22.02 |
||
Gem.: gemiddelde, NR: niet gerapporteerd.
Ook andere niet-Europese auteurs rapporteren (voorzichtig) positief over de kosten verbonden aan zorg op afstand. Eberle (2021) rapporteert een reductie in directe kosten van 24% en in indirecte kosten van 22% voor de groep die maandelijks feedback ontving op data gedownload uit insulinepompen en glucosemeters, in vergelijking met de controlegroep. Per fysiek consult dat kan worden overgeslagen, kan US$142 worden bespaard (Eberle, 2021). Daarnaast rapporteert Hall (2020) een afname van US$60-70 in reiskosten voor patiënten, en minder tijd die patiënten vrij moesten nemen van werk. Hierbij zijn echter ook niet direct de bevindingen te extrapoleren naar de Nederlandse situatie, gezien het verschil in gezondheidszorgsysteem.
Uiteraard zijn er wel kosten verbonden aan het opzetten en inrichten van zorg op afstand. Hoe deze inrichting er precies uit moet zien – zoals ook genoemd onder het kopje Efficiëntie – hangt samen met welke factoren van zorg op afstand effectief zijn. Patiënten moeten beschikken over een mobiele telefoon, computer of tablet (die compatibel is met de geboden software), en een stabiele internetverbinding. Ook in het ziekenhuis moeten de juiste middelen voor communicatie en monitoring aanwezig zijn. Momenteel bestaat er nog onduidelijkheid wie verantwoordelijk is voor deze investering: is dit de afdeling zelf, het ziekenhuis, of is dit een landelijke aangelegenheid? Recent is de handreiking telemonitoring gepubliceerd (FMS, 2022), waarin staat op welke manier en onder welke voorwaarden medisch specialisten zorg op afstand mogen registreren en declareren. Ook moeten de langetermijnscomplicaties die kunnen optreden bij zorg op afstand en de kosten van (het oplossen van) die complicaties in kaart worden gebracht om een betere kosten-batenanalyse van zorg op afstand te kunnen maken.
Verder geeft zorg op afstand milieubelasting. De batterijen en datacentra die hiervoor nodig zijn kosten veel energie en (uitputbare) grondstoffen. Echter, zorg op afstand kan ook zorgen voor een reductie van reisbewegingen (en daarmee CO2-uitstoot).
Waarden en voorkeuren van patiënten en zorgverleners
Uit de literatuur
In de artikelen gebruikt voor de literatuuranalyse voor de effectiviteit en veiligheid van zorg op afstand werden ook zorgverlener- en patiënttevredenheid en verschillende onderdelen van motivatie en gedragsverandering onderzocht.
Drie studies onderzochten tevredenheid op verschillende manieren.
- Maria Gomez (2022) rapporteerde patiënttevredenheid via de insulin treatment satisfaction questionnaire (ITSQ), met een score van 0 (laagste tevredenheid) tot 100 (hoogste tevredenheid). Tevredenheid na 3 maanden behandeling was hoger in de mHealth groep (gemiddeld 73.8, SD 11.1) dan in de standaard zorg groep (gemiddeld 42.8, SD 16.7).
- Turnin (2022) gebruikte een ad-hoc vragenlijst, voor de tevredenheid met het onderzochte telemonitoring apparaat dat sensoren voor biomedische data (glucosemeter, impedantiemeter en actometer) en onderwijssoftware voor voeding en beweging bevatte, en telemonitoring data rapporten genereerde. Vanuit de patiëntenpopulatie antwoordde 97.4% van de respondenten geheel of behoorlijk tevreden te zijn met het gebruik van het telemonitoring apparaat. Slechts de helft van de deelnemende zorgverleners (55%) vulde de tevredenheidsvragenlijst in; van wie 80% aangaf het gebruik van het telemonitoring apparaat gemakkelijk te vinden met betrekking tot het verkrijgen van de telemonitoringsuitslagen. Ook gaf 82.3% aan het gebruik van het apparaat graag te willen continueren.
- Molavynejad (2020) inventariseerde tevredenheid met het gegeven educatieprogramma (via DVD’s of fysiek) middels een score van 0 tot 10. De gemiddelde score voor het video tele-educatieprogramma was 7.13 (SD 1.80) en voor het fysiek gegeven educatieprogramma 5.91 (SD 1.70).
Factoren rondom zelfredzaamheid werden gerapporteerd door Leong (2022) en Timurtas (2022). In de eerste studie werd gevonden dat kennis, attitude en zelfzorgactiviteiten toenamen in beide groepen (standaard zorg of met een communicatieplatform). Zelfredzaamheid nam (uit de resultaten van de tweede studie) in beide groepen evenveel toe (mobile app of smartwatch en controlegroep, 36%).
Focusgroepen
Uit een achterbanraadpleging onder DVN panelleden (n = 46) en een gehouden focusgroep onder mensen met diabetes (n = 9) die zorg ontvangen in de tweede lijn kwam naar voren dat patiënten over het algemeen positief zijn over zorg op afstand en het als tijdbesparend ervaren. Vormen van zorg op afstand die zij (DM1 bij n = 7) onder andere ontvingen waren e-consults (n = 9), videoconsults (n = 2), en telemonitoring (n = 9). Digitale zorgvormen (dus zonder contactmoment tussen patiënt en zorgverlener) waren het ontvangen van informatie (n = 3), digitaal afspraken maken (n = 7), (herhaal)medicatie opvragen (n = 4) en gegevens of (lab)uitslagen bekijken (n = 8). Zeven deelnemers gaven aan in de toekomst vaker digitale zorg te willen gebruiken, twee stonden daar neutraal over. Wel werd aangegeven dat niet alles digitaal kan, maar ook dat fysiek niet per se beter is: om een consult fysiek in plaats van digitaal te houden, moet dat wel wat toevoegen aan de zorg. Voor persoonlijke aandacht en psychologische problematiek is het bijvoorbeeld wenselijker om een fysiek consult te hebben; een digitaal consult is afstandelijker. Digitaal kunnen follow-up waarden worden besproken; echter een voorwaarde voor een effectief digitaal consult is eenheid van taal en duidelijke verwachtingen en taken. Patiënten zien daarom graag een individuele afstemming wat voor hem/haar passende zorg is en waar hij/zij de balans tussen fysiek en digitaal ziet. Daarbij is de wens van de patiënt leidend, maar moeten duidelijke afspraken worden gemaakt en verwachtingen tussen zorgverlener en patiënt worden afgestemd: wanneer kan welke vorm van zorg kan worden ingezet (in welke situaties is videobellen/data-uitwisseling/e-consult geschikt?).
Binnen het SKMS-kwaliteitsproject Uniformiteit van dataplatforms voor geïntegreerde diabeteszorg zijn middels interviews met zorgverleners en mensen met diabetes mellitus de behoefte en voorwaarden geïnventariseerd van een platform dat zorg op afstand mogelijk maakt. De belangrijkste conclusie is dat zowel zorgprofessionals als mensen met diabetes een diabetesdataplatform belangrijk vinden waarop data betreffende de glykemische regulatie gedeeld kunnen worden. Zowel glucosedata als insulinedata dienen in één platform weergegeven te kunnen worden. Verschillende soorten en typen devices moeten met één platform kunnen werken. De behoefte voor communicatie en telemonitoring via het platform wordt minder groot en minder belangrijk gevonden. Het huidige beschikbare aanbod van diabetesdataplatforms voldoet niet of slechts ten dele aan de wensen van zowel de zorgprofessional als de patiënt (Programma uitkomstgerichte zorg, 2023).
Uit een focusgroep onder zorgverleners in de diabeteszorg in de tweede lijn (n = 5; internisten, diëtisten en diabetesverpleegkundigen/verpleegkundig specialisten) kwam naar voren dat zorgverleners digitaal contact als effectief contact ervaren en met telemonitoring een vollediger beeld krijgen (geen momentopname van labuitslagen). Zij zien ook het voordeel in voor de patiënt wat betreft het niet hebben van reistijd en reis- of parkeerkosten. Echter, zij gaven wel aan dat het minder ruimte biedt voor contactgroei en dat het informatieverlies kan geven omdat er geen fysiek onderzoek uitgevoerd kan worden. Zorgverleners geven aan (net als patiënten) dat duidelijke afspraken over wanneer welke vorm van zorg op afstand kan worden ingezet van cruciaal belang is voor het behouden van goede kwaliteit van zorg. Zij achtten het niet geschikt voor alle patiënten en geven aan dat bij onderstaande situaties een fysiek consult moet plaatsvinden:
- Diabetische voetzorg: zoals hierboven al eerder genoemd kan er een hogere mortaliteit bij voetzorg op afstand zijn. Zowel jaarlijks voetonderzoek als beoordeling van een ulcus kan onvoldoende met behulp van zorg op afstand, en dient fysiek plaats te vinden (zie Richtlijn Diabetische voet en Richtlijn Pijnlijke diabetische neuropathie). In acute situaties kan de eerste lijn hierin ook een belangrijke rol vervullen.
- Het niet halen van de glykemische streefdoelen ondanks telemonitoring: bij mensen met diabetes met slechte glucoseregulatie en/of grote schommelingen, ondanks het gebruik van een glucosemeter/sensor met telemonitoring, moet met lichamelijk onderzoek naar de aanwezigheid van spuitinfiltraten en andere oorzakelijke factoren worden gekeken. Ook moet overwogen worden of mentale of omgevingsfactoren bijdragen aan het onvermogen om tot een goede regulatie te komen.
- Fysieke parameters: elk jaar moet het gewicht en de bloeddruk van elke patiënt worden gemeten. Gezien er nog geen goede standaard eisen zijn (en de kosteneffectiviteit laag lijkt) wordt het noodzakelijk geacht om dit jaarlijks tijdens een fysiek consult met een geijkte machine te meten.
- Zorgmijders: aan hen kan in eerste instantie zorg op afstand worden aangeboden. Indien dit geen oplossing blijkt voor hen, dienen zij actief te worden opgevolgd en benaderd voor fysieke consulten.
- Uit het zicht verloren patiënten: voor de zorgverlener is het soms lastig om een inschatting te maken hoe het met de patiënt gaat (na een langere periode) op afstand.
- Mensen met diabetes met onvoldoende (cognitieve, linguïstische of digitale) vaardigheden. Een valkuil kan echter zijn dat zorgverleners onvoldoende in staat zijn om te beoordelen of een patiënt digitaal vaardig is. Naast scholing van de patiënt in digitale vaardigheden, kan ook scholing van de zorgverlener voor de herkenning hiervan wenselijk zijn.
Uiteraard geldt voor elke patiënt het zorgaanbod passend moet zijn bij zijn/haar wensen en zorgvraag; telemonitoring is geen “one size fits all”.
Aanvaardbaarheid, haalbaarheid en implementatie
Toegankelijkheid
In theorie verhoogt zorg op afstand de toegankelijkheid van de zorg: patiënten hebben minder reistijd en maken minder kosten. Ook de timing van een consult kan beter worden gepland: patiënten kunnen makkelijker zelf een moment bepalen en hoeven er geen halve of hele dag voor vrij te nemen van werk (Hall, 2020). Daarbij moet wel aan een aantal randvoorwaarden worden voldaan.
Basis randvoorwaarden om zorg op afstand te kunnen ontvangen zijn voor patiënten het hebben van een goede internetverbinding, een mobiele telefoon of computer/tablet, en een rustige ruimte. Om zorg op afstand te kunnen leveren hebben zorgverleners hetzelfde nodig, plus een eenvoudig systeem om data in te zien en een goede communicatie tussen de verschillende gebruikte systemen, wat soms wordt gehinderd door de privacywetgeving en tot veel registratielast leidt. Een verdere uitdaging is de communicatie tussen de verschillende ziekenhuis- en (industriële) monitoringssystemen.
Randvoorwaarden voor vervolgens het effectief gebruik van zorg op afstand volgens patiënten (volgend uit de focusgroep) zijn de aanwezigheid van voldoende technische kennis van/digitale affiniteit met de gebruikte apparatuur en software voor telemonitoring en teleconsulten bij de zorgverleners, en adequate gegevensuitwisseling tussen verschillende zorgverleners. Hiervoor moet iemand in het ziekenhuis zich verantwoordelijk voelen, wat vaak niet zo wordt ervaren door patiënten. In het zorgsysteem moeten ook organisatorische aanpassingen plaatsvinden, omdat dit niet is ingesteld op real-time contact, maar op periodieke controles. Zorgverleners geven ongeveer hetzelfde aan: er moet bekendheid zijn met de mogelijkheden van zorg op afstand, en de benodigde ICT-ondersteuning om deze mogelijkheden te bieden. Aanvullend wordt ook als eis gesteld dat – indien een device voor glucosemonitoring wordt gebruikt – dit device data automatisch uitleest en zorgt voor een continue verstrekking van data. Als dit niet het geval is, blijft het risico van niet-representatieve meetmomenten bestaan.
Om tot betere implementatie van zorg op afstand te komen is volgens zowel patiënten als zorgverleners educatie over het gebruik van digitale zorg bij beide partijen nodig. Patiënten zien hierbij een rol voor Diabetesvereniging Nederland. Zorgverleners geven aan dat voor implementatie dataverzameling gestandaardiseerd moet worden en indicaties moeten worden gesteld wanneer een patiënt meer dan 1x per jaar fysiek moet worden teruggezien.
Rationale van de aanbevelingen
De literatuur geeft geen definitief antwoord op de vraag of fysieke zorg kan worden vervangen door zorg op afstand met betrekking tot de langetermijnseffecten. IUit studies die zorg probeerden te verbeteren door intensievere en meer gestructureerde behandeling met behulp van zorg op afstand bleek wel dat zorg op afstand, in vergelijking met fysieke controle, minstens zo effectief kan zijn in het verbeteren van de glykemische regulatie uitgedrukt als HbA1c en het reduceren van het aantal hypoglykemieën. De vraag welke vormen van zorg op afstand werkzaam zijn en op welk moment is hierbij lastiger te beantwoorden omdat de diverse studies verschillende interventies gebruikten. Niettemin lijken de geïdentificeerde factoren van succes:
- nadruk op telemonitoring (delen van glucosewaarden via apps, flash glucose monitoring (FGM), continue glucose monitoring (CGM)),
- zelfmanagement en feedback op data betreffende de glykemische regulatie, waarbij vooral real-time feedback effectief lijkt
Voor diabetische voetzorg bij volwassenen met diabetes mellitus kan schadelijkheid niet worden uitgesloten (hogere diabetische voetgerelateerde mortaliteit). De zorg beschreven in de richlijn diabetische voet geeft feitelijk ook aan dat fysiek contact een wezenlijk onderdeel is van diabetische voetzorg.
Vormen van zorg op afstand
De telemonitoring data kunnen worden besproken via een e-consult, een telefonisch consult, een videoconsult, of een communicatieplatform (bijv. persoonlijke gezondheidsomgevingen (PGO’s)), echter hierin is geen duidelijk keuze te maken op basis van de literatuur.
Op basis van focusgroepen kan worden geconcludeerd dat zowel patiënten als zorgverleners over het algemeen positief zijn over zorg op afstand.
- Telemonitoring wordt door beide groepen vooral gezien als als een effectieve manier van opvolging van de glucosewaarden en het insuline-gebruik, maar minder voor uitwisseling van andere biomedische data (bloeddruk, gewicht) of communicatiedoeleinden. Ook pleiten de zorgverleners voor het verbeteren van de integratie van FGM/CGM data met elektronisch patiëntenossier (EPD).
- T.a.v. de feedback en communicatie met de patiënt is het telefonisch consult nog het meest gebruikt voor zorg op afstand.
- Het e-consult is inzetbaar bij eenvoudige, niet-urgente vragen die geen lichamelijk onderzoek vereisen, maar er dienen goede afspraken te worden gemaakt over omgangsregels tussen arts en patiënt (o.a. responstijd en type vragen). Het e-consult lijkt, in tegenstelling tot de andere toepassingen, ook inzetbaar om taalbarrières te overbruggen.
- Het videoconsult kan nuttig zijn voor consulten waarbij een visuele beoordeling wel van belang kan zijn.
Zorgverleners (net als patiënten) achtten zorg op afstand niet geschikt voor alle patiënten en geven aan dat bij medische noodzaak, zorgmijders, patiënten met een taalbarrière of met beperkte digitale vaardigheden een fysiek consult moet plaatsvinden. Zorgverleners en patiënten geven aan dat duidelijke afspraken over wanneer welke vorm van zorg op afstand kan worden ingezet van cruciaal belang is voor het behouden van goede kwaliteit van zorg.
Onderbouwing
Achtergrond
Het gebruik van digitale zorg en digitale communicatiemiddelen tussen zorgverlener en zorgvrager wordt steeds belangrijker en maakt zorg op afstand mogelijk. Tijdens de coronapandemie heeft zorg op afstand een snelle ontwikkeling doorgemaakt, door het (gedwongen) gebruik van (digitale) hulpmiddelen op afstand om zorg te kunnen leveren, specifiek ook voor mensen met diabetes. Dit is ook terug te zien in de declaratiegegevens voor diabeteszorg in de periode 2020 (NZA, 2022). Hierdoor is veel geleerd en zijn verschillende verbeterpunten aan het licht gekomen, wat heeft geleid tot het initiatief voor het uniformeren van dataplatforms voor geïntegreerde diabeteszorg. Echter, er bleven ook veel onduidelijkheden bestaan rondom (het verlenen van) zorg op afstand. Tot op heden is er beperkt onderzoek gedaan naar de kwaliteit (veiligheid, bruikbaarheid, effectiviteit en doelmatigheid) van verschillende zorg op afstandtoepassingen. Om zorg op afstand toekomstbestendig te kunnen benutten en de continuïteit en efficiëntie van de diabeteszorg te waarborgen, is beter zicht op de bruikbaarheid, effectiviteit en succesvolle implementatie nodig.
Deze module beoogt een overzicht te geven van over de bruikbaarheid en effectiviteit van zorgtoepassingen op afstand in de tweedelijns diabeteszorg (zowel type 1 als 2). Dit kan praktische handvatten bieden voor zorgverleners die in hun praktijk zorg op afstand leveren. Voor succesvolle en duurzame implementatie van diabeteszorg op afstand moet tenminste worden voldaan aan de volgende randvoorwaarden:
- Diabeteszorg op afstand moet kwalitatief vergelijkbaar zijn met reguliere face-to-facezorg in de spreekkamer (effectiviteit);
- Diabeteszorg op afstand moet voor patiënten en zorgverleners van toegevoegde waarde zijn (ervaringen).
Werkwijze
De bevindingen in deze module zijn gebaseerd op:
- Studie van de internationale wetenschappelijke literatuur
- Inventarisatie lopende projecten in Nederland (Stichting Kwaliteitsgelden Medisch Specialisten-kwaliteitsproject Uniformiteit van dataplatforms voor geïntegreerde diabeteszorg (Nederlande Internisten Vereniging))
- Focusgroepen met zorgverleners en patiënten
De resultaten zijn gebundeld in consensusbijeenkomsten waarin ook aanbevelingen voor praktijk en toekomstig onderzoek werden geformuleerd over zorg op afstand.
Definities en begrippen
Onder zorg op afstand vallen alle zorgactiviteiten tussen patiënt en zorgverlener die op afstand worden gegeven, dit gaat zowel om digitale zorg als digitale of telefonische contacten. Deze ‘afstand’ duidt dus op het ontvangen van de zorgactiviteit terwijl zorgverlener en patiënt zich niet in eenzelfde fysieke ruimte bevinden. Deze zorgactiviteiten kunnen synchroon zijn (patiënt en zorgverlener hebben gelijktijdig contact, bijv. in een videoconsult), ofwel asynchroon (zorgvraag en respons zijn niet gelijktijdig, bijv. online een vraag indienen die later door de zorgverlener wordt behandeld).
De verdere gebruikte definities (van der Burg, 2023):
|
Digitale zorg Digitale zorg is de toepassing van zowel digitale informatie als communicatie om de gezondheid en gezondheidszorg te ondersteunen en/of te verbeteren in de context van zorg. Hierop is wet- en regelgeving van zorg van toepassing zoals de Wet inzake de geneeskundige behandelingsovereenkomst (WGBO) en de Wet kwaliteit, klachten en geschillen zorg (Wkkgz).
Telemonitoring Telemonitoring is het gedurende langere periode volgen van de gezondheidssituatie van de patiënt door het delen van zelfmetingen ter interpretatie door een zorgverlener voor een vooraf samen afgestemd doel en beleid.
E-consult Het e-consult is een digitaal schriftelijk contact met de zorgverleners op initiatief van de patiënt over een zorginhoudelijke vraag, via een beveiligde verbinding. Het e-consult vervangt een regulier face-to-face consult, telefonisch consult of videoconsult met de zorgverlener.
Videoconsult Het videoconsult is een consult waarbij de zorgverlener op afstand zorgt verleent aan de patiënt via een directe (‘live’) videoverbinding. |
Conclusies / Summary of Findings
Literature offers no definite conclusions on the basic question whether remote healthcare delivery results in the same long-term quality of care outcomes as face-to-face care delivery (and therefore no evidence exists whether it would be a viable option to replace face-to-face care). Studies that ameliorate care through remotely delivered (intensified) guidance show circumstantial evidence that remote delivery might be as effective as physical care delivery; the level of evidence is slightly higher for patients with type 2 diabetes compared with type 1.
- Effectiveness (critical)
1a. HbA1c
|
Low GRADE |
The evidence suggests that remote healthcare delivery is non-inferior concerning effectiveness (HbA1c control) in adults with diabetes mellitus, compared to physical healthcare delivery.
Source: Michaud (2021), Kebede (2018), Verma (2021), Leong (2022), Di Molfetta (2022), Yang (2022), Maria Gómez (2022), Timurtas (2022), Li (2021), Turnin (2021), Hu (2021), Molavynejad (2020) |
1b. Foot care
|
Very low GRADE |
The evidence is very uncertain about the effectiveness of telemedicine compared to physical care delivery for diabetic foot care in adults with diabetes mellitus
Source: Yammine (2022) |
1c. Time in range
|
- GRADE |
Time in range was not reported and could not be graded. |
- Safety (important)
|
Very Low GRADE |
The evidence is very uncertain about a reduction of hypoglycemic events when using remote healthcare delivery in adults with diabetes mellitus, compared to physical care delivery.
Source: Hu (2022), Maria Gomez (2022) |
Samenvatting literatuur
Description of studies
Four systematic reviews were included; their study characteristics can be found in Table 1.
Three focused on glycemic control (Michaud, 2021; Verma, 2021; Kebede, 2018), one on diabetic foot care (Yammine, 2022).
The included forms of remote healthcare or telehealth were broad; Yammine (2022) included all types of remote consultations and Kebede (2018) included all technology based interventions: interventions delivered through the use of a Personal Digital Assistant (PDA), tablet, computer, internet, telemedicine, videoconferencing, or telehealth. In contrast, Verma (2021) focused more specifically on mobile health through mobile applications, text messaging (SMS) or phone calls, and Michaud (2021) specifically on telemonitoring through the transmission of self-monitored data.
Comparators were conventional, standard or usual care (with or without additional disease self-management education) (Michaud, 2021; Verma, 2021; Kebede, 2018) or any type of face-to-face consultation (Yammine, 2022).
Table 1. Study characteristics of the included systematic reviews.
|
Author, year |
Included articles and patients |
Population |
Intervention |
Control |
Outcomes |
Follow-up |
Health care phase |
Health care provider |
|
Michaud, 2021 |
17 RCTs (2453 patients) |
Patients ≥ 18 years with DM2
Sex: 57.7% male Age: mean 46.7 to 66.2 |
Telemonitoring: transmission of self-monitored data |
Usual care |
HbA1c reduction (%) |
3 to 12 months |
Treatment and follow-up |
Not specified |
|
Kebede, 2018 |
21 RCTs (3785 patients) |
Patients with DM2 with HbA1c level of >7.0%
Sex|Age: NR |
Several technology-based interventions |
Usual care |
HbA1c reduction (%) |
3 to 12 months Mean 7.29 ± 3.05 months |
Treatment and follow-up |
Not specified |
|
Verma, 2021 |
18 RCTs (2931 patients) |
Patients with DM2 without severe diabetic complications
Sex|Age: NR |
mHealth interventions through Mobile health applications, text messages or phone calls |
Usual care |
HbA1c difference (%) |
3 to 24 months |
Treatment and follow-up |
Not specified |
|
Yammine, 2022 |
3 RCTs, 1 non-randomized study (816 patients) |
Patients with diabetic foot ulcer
Sex: 63.7% male Age: I 62.2 ± 4.4 C: 61.8 ± 6.3 |
Any type of remote consultation |
Any type of face-to-face consultation (such as home care or in hospital) |
Healing rate (%) Time to heal (days) Amputation rate (%) Mortality rate (%)
|
3 to 12 months Mean: I 5.9 months C: 6.1 months |
Treatment |
Multidisciplinary foot care team (incl. physicians) |
Abbreviations: DM2: diabetes mellitus type 2, mHealth: mobile health, NR: not reported, RCT: randomized controlled trial
Nine RCTs were included, of which the baseline characteristics are presented in table 2.
Table 2. Study characteristics of included RCTs.
|
Author, year |
Patients included |
Population |
Intervention |
Control |
Outcomes |
FU (mo) |
Healthcare phase |
Health care provider |
|
Leong, 2022 |
Intervention: 91 Control: 90
Age ± SD: I: 59.0 ± 11.4 C: 58.1 ± 11.9
Sex (%M): I: 73.6% |C: 63.3% |
Patients with DM2 ≥ 20 years with ≥ 1 HbA1c measurement ≥6.0% in past 6 months, using antidiabetic drugs. |
Communication platform with educational videos and a messaging feature in addition to usual care |
Usual care including several types of consultations |
HbA1c (%) |
3 |
Treatment and follow-up |
Physicians, nurses, pharmacists and diabetes educators |
|
Di Molfetta, 2022 |
Intervention: 62 Control: 61
Age ± SD: I: 47.15 ± 14.54 C: 45.21 ± 14.76
Sex (% M) I: 53.2% | C: 55.7% |
Patients aged 18-70 with insulin-treated diabetes (type 1 or 2) for at least 1 year and inadequate glycaemic control |
Telemedicine assisted self-monitoring of BG, with feedback about their blood glucose levels and therapy suggestions from the study staff via phone/SMS. |
Standard self-monitoring blood glucose, reported on paper daily, without remote assistance. |
HbA1c reduction (%) Hypoglycemia (episodes) |
6 |
Treatment and follow-up |
“Study staff” |
|
Yang, 2022 |
Intervention: 50 Control: 50
Age ± SD: I: 65.09 ± 6.06 C: 67.34 ± 5.33
Sex (% M) I: 38.3% | C: 42.0% |
Normotensive patients with newly diagnosed DM2 within the past 3 months with a HbA1c of 6.5-7.5% and aged 40-60 years |
Telemonitoring with reminders for recording data, and automatic warning feedback messages, plus a monthly 40-minute consultation by phone for lifestyle education |
Standard outpatient consultations including dietary advise or exercise recommendation each visit. |
HbA1c (%) Quality of life (SF-36) Costs (¥) |
12 |
Monitoring |
Nutrition platform and outpatient doctor |
|
Maria Gomez, 2022 |
Intervention: 42 Control: 45
Age ± SD: I: 58.6 ± 10.6 C: 60.5 ± 12.8
Sex (% M): I: 55.0% | C: 54.2% |
Adults with DM2 using insulin and having a HbA1c ≥ 6.5% |
Telemedicine platform (on web, mobile or desktop app) for weekly recording (by the patient) and adjusting insulin doses (by the research group). Patients received pop-up notifications about changes. |
Standard care of the institution plus education for the management of diabetes medications and diet. |
HbA1c (%) Episodes of hypoglycemia Patient satisfaction (ITSQ) |
3 |
Treatment and monitoring |
Endocrin-ologists |
|
Timurtas, 2022 |
Intervention: 60 Control: 30
Age ± SD: MA: 51.6 ± 7.8 SW: 51.4 ± 8.1 Control: 51.8 ± 8.0
Sex: Not reported
|
Patients between 30 and 65 years old with DM2 diagnosed by an endocrinologist. |
Exercise training for 3 times/week, supported by a digital platform (app) in which patients had a personal account.
|
Physically supervised exercise training for 3 times/week prescribed by physiotherapist |
HbA1c (%) Self-efficacy |
12 weeks |
Treatment |
Physio-therapists |
|
Li, 2021 |
Intervention: 130 Control: 85
Age ± SD: I: 47.5 ± 9.88 Cl: 46.7 ± 10.11
Sex (% M): I: 67.7%| C: 63.5% |
Patients ≥18 years with DM2, registered in the clinical database of patients with DM living in territories served by Community Health Care |
App for medical services from the hospital: appointment registration, EMR access, medication reminders, BG monitoring and threshold alarms, diet and exercise monitoring and suggestions, health education, telephone follow-up, real-time communication with care team, and peer support. |
Standard medical care every three months. |
HbA1c <7.0% (rate) Costs (¥) Incremental costs (¥) ICER (¥) |
12 |
Treatment, control and monitoring |
Doctors, nurses, health educators and dietitians |
|
Turnin, 2021 |
Intervention: 141 Control: 141
Age ± SD: I: 59.8 ± 9.2 C: 59.3 ± 10.0
Sex (% M): I: 64.1% | C: 62.2%1 |
Patients ≥18 years with a documented medical history of DM2 (with or without insulin treatment) with a recent HbA1c value of >6.5% and ≤10% |
Home telemonitoring device, that combined biomedical data sensors with educational software (on nutrition and exercise). Data was sent weekly to the platform; patients had access to platform. Physicians had insight in data, received alerts for events and could communicate with the patient. |
Face-to-face consultations in accordance with standard practices. |
HbA1c (%) Patient satisfaction(ad hoc questionnaire) Health professional satisfaction (ad hoc questionnaire) |
12 |
Monitoring |
Physicians |
|
Hu, 2021 |
Intervention: 74 Control: 74
Age ± SD: I: 50.04 ± 5.76 C: 52.21 ± 8.38
Sex (% M): I: 71% | C: 61% |
Patients aged 18-70 with diagnosis of DM2 > 3 months |
Telemedicine platform in which BG values from wireless meter and information (diet, exercise, oral medication) was uploaded and transmitted. If necessary, hospital contacted patient through chat, phone or online connections. Plus monthly diabetes education. |
Once per month: Conventional outpatient treatment; data upload from wireless BG meter by endocrinologist and nurses. Plus monthly diabetes education |
HbA1c (%) Hypoglycemia (episodes ≤3.9 mmol/L) |
6 |
Control |
Endocri-nologists and (diabetes) nurses |
|
Molavynejad, 2020 |
VTE: 126 P: 126 IPE: 125
Age ± SD: VTE: 45.88 ± 9.09 P: 48.31 ± 7.61 IPE: 47.37 ± 7.07
Sex (%M): VTE: 54.2% P: 40.7% IPE: 50.4% |
Patient ≥ 18 years with DM2 for ≥ 1 year, having no other chronic conditions and receiving no official education on self-care |
Video tele-education (VTE): Educational movie (divided into several episodes) in the form of DVDs or cell phone formats for home use. Text messages with reminders to watch the video education and contact if patients had questions.
|
In-person education (IPE): Oral face-to-face education via 4 group sessions of 45 minutes over the course of 2 week), with the opportunity to ask questions, and monthly in-person education at the clinic. |
HbA1c (%) Patient satisfaction (score 0-10) |
3 |
Treatment and follow-up |
Diabetes nurses |
Abbreviations: DM2: diabetes mellitus type 2, EMR: Electronic Medical Record, FU: follow-up, ICER: incremental cost-effectiveness ratio, IPE: in-person education, , M: male, mo: months, SD: standard deviation, P: pamphlets, SMS: short message service, VTE: video tele-education
Results
Below, the results from the 13 included studies are analyzed per outcome measure as specified in the PICO.
- Effectiveness (critical)
1a. HbA1c
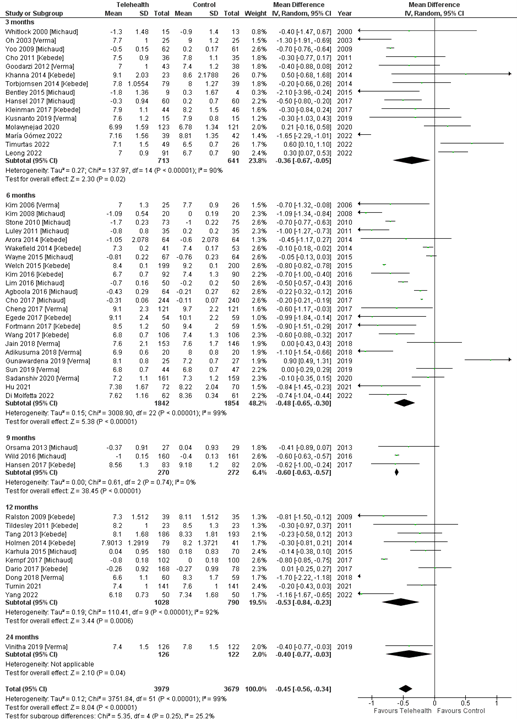
All authors, with the exception of Yammine (2022), reported on the difference in HbA1c (expressed in %) after the telehealth intervention. The results from all studies from the systematic reviews and included RCTS are presented in figure 2.
Figure 2. Forest plot of HbA1c outcomes after telehealth compared to usual care, with results from all separate included studies in the systematic reviews by Michaud (2021), Kebede (2018), and Verma (2021), together with the included RCTs.
A pooled mean difference of -0.45% (95% CI -0.56 to -0.34) in HbA1c value favouring telehealth is found. Despite this finding being statistically significant, it does not reach our threshold for clinical relevance (0.5%).
Only Li (2021) reported the outcome as the proportion of patients having HbA1c <7.0% after 12 months, who found a Relative Risk (RR) of 1.67 (95% CI 1.29 to 2.16) favouring telehealth.
1b. Foot care
One systematic review (Yammine, 2022) researched the effect of remote consultations compared to face-to-face consultations in diabetic foot care. Different outcomes were assessed, depicted in table 3. Time to heal for diabetic foot ulcers was also researched, with a mean number of days of 73 (SD 24.1) for telemedicine, and 83.5 days (SD 28.4) for face-to-face consultations.
Table 3. Relative risks of outcomes for telemedicine compared to face-to-face consultations in diabetic foot care.
|
Outcome |
Relative Risk (RR) |
95% confidence interval |
Favours |
|
Mortality rate |
2.25 |
0.28 to 18.13 |
Face-to-face |
|
Healing rate |
0.99 |
0.91 to 1.09 |
Face-to-face |
|
Amputation rate |
0.59 |
0.29 to 1.18 |
Telemedicine |
Differences in outcomes for diabetic foot healing and amputation rate were not statistically significant. Mortality rate showed a clinically relevant difference (RR > 1.25). However, the confidence intervals are broad, comprising different inferences.
1c. Time in Range
The outcome time in range was not reported in the included studies.
- Safety (important)
Three authors reported in their methods that they recorded frequency of hypoglycemic episodes (Di Molfetta, 2022; Maria Gomez, 2022; Hu, 2022). However, one did not define hypoglycemia and did not present these results (Di Molfetta, 2022). Hypoglycemia in the other two studies was defined as blood glucose level <3.8 mmol/L (Maria Gomez, 2022) or ≤3.9 mmol/L (Hu, 2022).
Hu (2022) reported the incidence of hypoglycemic events based on blood-glucose data: in the telemedicine group automatic uploads from the wireless intelligent blood-glucose meter were used, and the control group had their blood-sugar data exported to a physician who counted the hypoglycemic events. After 6 months, 18 patients (25.0%) in the telemedicine group had had a hypoglycemic event in the past month, compared to 29 patients (41.4%) in the control group (RR 0.60, 95% CI 0.37 to 0.98).
Maria Gomez (2022) reported hypoglycemic events as the percentage of patients experiencing one or more of those over the follow-up period of 3 months, and calculated the incidence rate as events per person month. A subdivision in hypoglycemic events of level 1 (3.0 to 3.8 mmol/L), 2 (<3.0 mmol/L), and 3 (severe, requiring assistance) was made, of which the numbers are presented in table 4. In the Mobile health group, 2.5% of patients required hospitalization for diabetes decompensation, compared to 15.2% in the standard care group (RR 0.16, 95% CI 0.02 to 1.28).
Table 4. Risk Ratio (RR) and Incidence Rate Ratio (IRR, events per person-month) of patients experiencing different levels of hypoglycemia over a period of 3 months.
|
Patients experiencing hypoglycemic event |
Mobile Health (%) |
Standard Care (%) |
RR (95% CI) |
Mobile Health (IR) |
Standard Care (IR) |
IRR (95% CI) |
|
Level 1 (3.0 to 3.8 mmol/L) |
75.0 |
72.3 |
1.03 (0.80 to 1.33) |
1.74 |
2.40 |
0.72 (0.66 to 0.87) |
|
Level 2 (<3.0 mmol/L) |
52.2 |
52.3 |
1.01 (0.67 to 1.51) |
0.45 |
0.84 |
0.53 (0.37 to 0.74) |
|
Level 3 (severe) |
15.0 |
25.6 |
0.59 (0.24 to 1.44) |
0.06 |
0.18 |
0.39 (0.15 to 0.91) |
Level of evidence of the literature
- Effectiveness (critical)
1a. HbA1c
The level of evidence regarding the outcome measure effectiveness for HbA1c started at high as it was based on systematic reviews and RCTs. It was downgraded by 2 levels because of study limitations (-1, risk of bias; see risk of bias tables under the heading “Evidence tables”), and because of indirectness (-1, studies mostly conducted in patients with diabetes mellitus type 2).
No downgrading took place for conflicting results (inconsistency), as difference in results can be explained by either the type of care assessed (physiotherapy intervention and physiotherapy control in Timurtas, 2022), or the study design (open-label in Leong, 2022 and Gunawardena, 2019). No downgrading took place for imprecision or publication bias. For this last factor, the slight disbalance in the funnel plot can be explained by the studies with shorter follow-up.
1b. Foot care
The level of evidence regarding the outcome measure effectiveness for diabetic foot care started at high as it was based on a systematic review. However, it was downgraded by 3 levels because of study limitations (-1, risk of bias); and the confidence intervals from the estimates crossing the border of clinical relevance, therefore leading to different inferences (-2, imprecision). No downgrading took place for inconsistency, indirectness, or publication bias.
1c. Time in range
The outcome Time in range was not reported and could not be graded.
- Safety (important)
The level of evidence regarding the outcome measure safety (hypoglycemic events) started at high as it was based on systematic reviews and RCTs. It was downgraded by 3 levels because of study limitations in the form of possible risk of bias in randomization, no blinding and limited generalizability (-1, risk of bias); indirectness (-1, studies mostly conducted in patients with diabetes mellitus type 2); and the inclusion of two studies with a low number of included patients and the confidence intervals crossing the border of clinical relevance (-1, imprecision). No downgrading took place for inconsistency or publication bias.
Zoeken en selecteren
A prerequisite for remote healthcare delivery is that its quality is equal to that of physical care delivery. Therefore, a systematic review of the literature was performed to answer the following question: What is the quality of remote healthcare delivery/telehealth compared to physical care delivery for patients with diabetes?
P: Adult patients (≥18 years) with diabetes (type 1 and/or 2), living at home
I: Remote healthcare delivery (either digital or by telephone), as a replacement for face-to-face care delivery
C: Face-to-face care delivery
O: Quality of care, comprising: effectivity and safety
Relevant outcome measures
The guideline development group considered effectiveness as a critical outcome measure for decision making; and safety as an important outcome measure for decision making.
However, other aspects of quality (efficiency, costs, accessibility, and patient and provider satisfaction) also influence decision making significantly, and will be thoroughly addressed in the considerations of the evidence-to-decision framework.
The working group defined the outcome measures as follows:
- Effectivity through HbA1c values, Time in Range measurements, or mortality (as outcome in diabetic foot care).
- HbA1c as a reduction, difference or change in HbA1c values, or as the proportion of patients having HbA1c value after intervention of <7.0% or <53 mmol/mol; and
- Safety through the frequency of hypoglycemic episodes
The working group defined a difference of 0.5% or 5 mmol/mol as a minimal clinically (patient) important difference for HbA1c values.
For time in range, hypoglycemic episodes, and mortality (in case of diabetic foot care) the working group used the GRADE default limits as limits for clinical decision making (RR <0.80; RR>1.25). Since the objective was to determine whether remote care delivery was at least as effective as face-to-face care delivery (i.e. similar or better), the results were compared only against the threshold of harmful effect (figure 1).
Figure 1. Visual representation of the values of clinical decision making for any harmful effect.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched for systematic reviews (from 2012 and later) and randomized controlled trials (from 2017 and later) with a broader search strategy for all somatic disorders (instead of only diabetes patients) until June 20th, 2022. This timeframe was chosen as telehealth has been upcoming (mostly) since the last 10 years. The detailed search strategy is available upon request. The systematic literature search resulted in 20.429 hits.
Title and abstract screening took place with the tool ASReview. First, two advisors independently screened a set of articles for inclusion until 10 articles were included, to create a calibration set. After the screening of 181 articles, 11 abstracts were included. The digital tool ASReviewer was used for further selection, resulting in 689 relevant abstracts. The studies concerning diabetic populations were filtered from these abstracts, resulting in 89 systematic reviews and 53 randomized clinical trials (RCTs).
These studies were selected based on the following criteria:
- Study type: excluded were observational studies, guidelines, pilot studies, or pre-post design studies
- Population: adult patients living at home with diabetes
- Intervention: remote healthcare delivery as a replacement for face-to-face care delivery, excluding psychologic interventions, public health interventions or preventive care interventions (primary prevention)
- Control: face-to-face care delivery, excluding waiting list control groups or other forms of remote or digital health care as control
- Outcome: conform PICO
- Setting: in the hospital or specialist care setting
- English language
After reading the full text, 85 systematic reviews were excluded and four included. The RCTs published after the last search date from the included systematic reviews were judged based on full text (to prevent inclusion of duplicates); 44 were excluded and nine RCTs were included. See the table with reasons for exclusion under the heading Evidence tables.
Results
Thirteen studies were included in the analysis of the literature: four systematic reviews and nine RCTs. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Di Molfetta S, Patruno P, Cormio S, Cignarelli A, Paleari R, Mosca A, Lamacchia O, De Cosmo S, Massa M, Natalicchio A, Perrini S, Laviola L, Giorgino F. A telemedicine-based approach with real-time transmission of blood glucose data improves metabolic control in insulin-treated diabetes: the DIAMONDS randomized clinical trial. J Endocrinol Invest. 2022 Sep;45(9):1663-1671. doi: 10.1007/s40618-022-01802-w. Epub 2022 Apr 27. PMID: 35476320; PMCID: PMC9044385.
- Eberle C, Stichling S. Telemetric Interventions Offer New Opportunities for Managing Type 1 Diabetes Mellitus: Systematic Meta-review. JMIR Diabetes. 2021 Mar 16;6(1):e20270. doi: 10.2196/20270. PMID: 33724201; PMCID: PMC8080418.
- Federatie Medisch Specialisten, NVZ, NFU, en ZN. Handreiking Telemonitoring. Dec 2022. Beschikbaar via: https://demedischspecialist.nl/sites/default/files/2022-12/handreiking_telemonitoring.pdf
- Hall R, Harvey MR, Patel V. Diabetes care in the time of COVID-19: video consultation as a means of diabetes management. Pract Diabetes. 2022 Apr;39(2):33-37c. doi: 10.1002/pdi.2387.
- Hu, Y., Wen, X., Ni, L. et al. Effects of telemedicine intervention on the management of diabetic complications in type 2 diabetes. Int J Diabetes Dev Ctries 41, 322328 (2021). https://doi.org/10.1007/s13410-020-00893-6
- Joo JY. Effectiveness of Web-Based Interventions for Managing Diabetes in Korea. Comput Inform Nurs. 2016 Dec;34(12):587-600. doi: 10.1097/CIN.0000000000000274. PMID: 27392258.
- Kebede MM, Zeeb H, Peters M, Heise TL, Pischke CR. Effectiveness of Digital Interventions for Improving Glycemic Control in Persons with Poorly Controlled Type 2 Diabetes: A Systematic Review, Meta-analysis, and Meta-regression Analysis. Diabetes Technol Ther. 2018 Nov;20(11):767-782. doi: 10.1089/dia.2018.0216. Epub 2018 Sep 26. PMID: 30257102.
- Leong CM, Lee TI, Chien YM, Kuo LN, Kuo YF, Chen HY. Social Media-Delivered Patient Education to Enhance Self-management and Attitudes of Patients with Type 2 Diabetes During the COVID-19 Pandemic: Randomized Controlled Trial. J Med Internet Res. 2022 Mar 23;24(3):e31449. doi: 10.2196/31449. PMID: 35319478; PMCID: PMC8987969.
- Li J, Sun L, Hou Y, Chen L. Cost-Effectiveness Analysis of a Mobile-Based Intervention for Patients with Type 2 Diabetes Mellitus. Int J Endocrinol. 2021 Jul 1;2021:8827629. doi: 10.1155/2021/8827629. PMID: 34306072; PMCID: PMC8266460.
- María Gómez A, Cristina Henao D, León Vargas F, Mauricio Muñoz O, David Lucero O, García Jaramillo M, Aldea A, Martin C, Miguel Rodríguez Hortúa L, Patricia Rubio Reyes C, Alejandra Páez Hortúa M, Rondón M. Efficacy of the mHealth application in patients with type 2 diabetes transitioning from inpatient to outpatient care: A randomized controlled clinical trial. Diabetes Res Clin Pract. 2022 Jul;189:109948. doi: 10.1016/j.diabres.2022.109948. Epub 2022 Jun 11. PMID: 35700926.
- Michaud TL, Ern J, Scoggins D, Su D. Assessing the Impact of Telemonitoring-Facilitated Lifestyle Modifications on Diabetes Outcomes: A Systematic Review and Meta-Analysis. Telemed J E Health. 2021 Feb;27(2):124-136. doi: 10.1089/tmj.2019.0319. Epub 2020 May 11. PMID: 32397845.
- Molavynejad S, Miladinia M, Jahangiri M. A randomized trial of comparing video telecare education vs. in-person education on dietary regimen compliance in patients with type 2 diabetes mellitus: a support for clinical telehealth Providers. BMC Endocr Disord. 2022 May 2;22(1):116. doi: 10.1186/s12902-022-01032-4. PMID: 35501846; PMCID: PMC9063130.
- Nederlandse Zorgautoriteit (NZA). Open data dbc-informatiesysteem (DIS) [website]. 2022 Nov. Beschikbaar via: https://www.opendisdata.nl/
- Programma Uitkomstgerichte Zorg. Eindrapport aandoeningswerkgroep diabetes mellitus. 2023. Beschikbaar via: https://platformuitkomstgerichtezorg.nl/aan+de+slag/documenten/handlerdownloadfiles.ashx?idnv=2461914
- Timurtas E, Inceer M, Mayo N, Karabacak N, Sertbas Y, Polat MG. Technology-based and supervised exercise interventions for individuals with type 2 diabetes: Randomized controlled trial. Prim Care Diabetes. 2022 Feb;16(1):49-56. doi: 10.1016/j.pcd.2021.12.005. Epub 2021 Dec 17. PMID: 34924318.
- Turnin, MC., Gourdy, P., Martini, J. et al. Impact of a Remote Monitoring Programme Including Lifestyle Education Software in Type 2 Diabetes: Results of the Educ@dom Randomised Multicentre Study. Diabetes Ther 12, 20592075 (2021). https://doi.org/10.1007/s13300-021-01095-x
- van der Burg L, Bruinsma J, Crutzen R, Cals J. Onderzoek naar de effectiviteit van digitale zorgtoepassingen in de huisartsenzorg: e-consult, videoconsult, telemonitoring en digitale zelftriage. Maastricht: Universiteit Maastricht, 2023. Beschikbaar via: https://www.rijksoverheid.nl/documenten/rapporten/2023/03/15/onderzoek-naar-de-effectiviteit-van-digitale-zorgtoepassingen-in-de-huisartsenzorg
- Verma D, Bahurupi Y, Kant R, Singh M, Aggarwal P, Saxena V. Effect of mHealth Interventions on Glycemic Control and HbA1c Improvement among Type II Diabetes Patients in Asian Population: A Systematic Review and Meta-Analysis. Indian J Endocrinol Metab. 2021 Nov-Dec;25(6):484-492. doi: 10.4103/ijem.ijem_387_21. Epub 2022 Feb 17. PMID: 35355920; PMCID: PMC8959192.
- Yammine K, Estephan M. Telemedicine and diabetic foot ulcer outcomes. A meta-analysis of controlled trials. Foot (Edinb). 2022 Mar;50:101872. doi: 10.1016/j.foot.2021.101872. Epub 2021 Oct 25. PMID: 35219129.
- Yang L, Xu J, Kang C, Bai Q, Wang X, Du S, Zhu W, Wang J. Effects of Mobile Phone-Based Telemedicine Management in Patients With Type 2 Diabetes Mellitus: A Randomized Clinical Trial. Am J Med Sci. 2022 Mar;363(3):224-231. doi: 10.1016/j.amjms.2021.09.001. Epub 2021 Sep 14. PMID: 34534510.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies
NB: study characteristics and results are extracted from the SR (unless stated otherwise)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Kebede, 2018
|
SR and meta-analysis of RCTs Literature search up to June 2017
A: Agboola, 2016 B: Arora, 2014 C: Capozza, 2015 D: Fortmann, 2017 E: Cho, 2011 F: Cho, 2017 G: Egede, 2017 H: Holmen, 2014 I: Kim, 2016 J: Kleinmann, 2017 K: Ralston, 2009 L: Tang, 2013 M: Tildesley, 2011 N: Trobjohnsen, 2014 O: Wang, 2017 P: Welch, 2015 Q: Wild, 2016 R: Dario, 2017 S: Hansen, 2017 T: Khanna, 2014 U: Liou, 2014 V: Wakefield, 2014
Study design: RCT parallel or cross-over
Setting and Country: Academic hospital, Germany
Source of funding and conflicts of interest: No competing interests; information on funding not disclosed |
Inclusion criteria SR: (1) study design (cluster) RCT; (2) patients with poorly controlled type 2 diabetes (HbA1c >7.0%); (3) interventions were technology-based; (4) HbA1c was reported as outcome; (5) control group received usual care; (6) English ublication
Exclusion criteria SR: (1) Studies targeting either persons with type 1 or both type 1 and 2 diabetes; (2) studies including control groups receiving interventions
22 studies included, 21 studies included in meta-analysis (not C)
Important patient characteristics at baseline: Not reported per study. 3787 subjects; with 52.6% randomized to intervention groups and 47.4% to control groups.
Groups comparable at baseline? Cannot be judged. |
A: text message to move B: text message (twice daily) for education, medication reminders and healthier living C: Text message for education, medication adherence, glucose control, weight and exercise D: text messages E: Internet diabetes management F: health-care provider mediated remote coaching via glucometer and internet G: telehealth and clinical decision support system H: diabetes diary app with or without health counselling I: Internet based glucose monitoring system J: smartphone app for patients and app + web-based portal for providers K: web-based care management L: Online disease management system M: Internet-based glucose monitoring system N: diabetes diary app with or without health counselling O: monitoring via computer/web/mobile phone connected to glucometer via cable P: internet-based integrated diabetes management system Q: monitoring through computer/ web-based/mobile phone connected to glucometer via modem R: videoconferencing S: Videoconferencing T: automated telephone support with dialogic telephone card U: web-based and videoconferencing V: tele-monitoring |
Usual care, standard care, or existing care
|
End-point of follow-up: A: 6 months B: 6 months C: 6 months D: 6 months E: 3 months F: 6 months G: 6 months H: 12 months I: 6 months J: 3 months K: 12 months L: 12 months M: 12 months N: 4 months O: 6 months P: 6 months Q: 9 months R: 12 months S: 8 months T: 3 months U: 6 months V: 6 months
For how many participants were no complete outcome data available? Not reported
|
Outcome measure Defined as glycosylated hemoglobin (HbA1c, %). mean difference [95% CI]:
A: -0.07 (-2.04 to 1.90) B: -0.25 (-0.56 to 0.06) C: not included in meta-analysis D: -0.84 (-1.13 to -0.55) E: -0.30 (-0.50 to -0.10) F: -0.17 (-0.25 to -0.10) G: -0.90 (-1.54 to -0.26) H: -0.30 (-0.81 to 0.21) I: -0.71 (-0.92 to -0.50) J: -0.41 (-0.78 to -0.07) K: -0.81 (-1.50 to -0.12) L: -0.24 (-0.41 to -0.07) M: -0.42 (-1.24 to 0.39) N: -0.20 (-0.66 to 0.26) O: -0.63 (-0.82 to -0.44) P: -0.79 (-1.00 to -0.58) Q: -0.51 (-1.12 to 0.09) R: 0.0 (-0.18 to 0.19) S: -0.65 (-0.90 to -0.39) T: 0.45 (0.02 to 0.88) U: -0.61 (-0.92 to -0.29) V: -0.16 (-2.70 to 2.38)
Pooled effect (random effects model): -0.39 [95% CI -0.51 to -0.26] favoring digital interventions Heterogeneity (I2): 80.8%
|
Author’s conclusion: Participation in digital interventions, particularly web-based interventions, favourably influences HbA1c levels among patients with poorly controlled type 2 diabetes.
|
|
Michaud, 2021 |
SR and meta-analysis of RCTs Literature search up to October 2018
A: Whitlock, 2000 B: Kim, 2008 C: Yoo, 2009 D: Stone, 2010 E: Castelnuovo, 2011 F: Luley, 2011 G: Orsama, 2013 H: Karhula, 2015 I: Wayne, 2015 J: Agboola, 2016 K: Bentley, 2016 L: Lim, 2016 M: Wild, 2016 N: Cho, 2017 O: Kempf, 2017 P: Hansen, 2017 Q: Hansel, 2017
Study design: RCT [parallel / cross-over]
Setting and Country: Academic hospital, United States of America
Source of funding and conflicts of interest: Non-commercial grant, authors report no competing financial interest (information about other conflicts of interest not disclosed)
|
Inclusion criteria SR: (1) patients ≥18 years with type 2 diabetes, (2) transmission of physiological or physical data to a health care professional as intervention, (3) usual care with or without additional conventional disease self-management education as comparator, (4) diabetes-related outcomes (weight, HbA1c, lipids, complications)
Exclusion criteria SR: Not reported
17 studies included
Important patient characteristics at baseline: N – mean age – %male A: 28 – 63 y – 83% B: 40 – 46.7 ±8.4 y – 48% C: 123 – 58.0 ±8.7 y – 59% D: 148 – NR – 99% E: 34 – 53.3 ±8.4 y – 69% F: 70 – 57.5 ±8.0 y – 50% G: 56 – 61.8 ±8.2 y – 54% H: 287 – 66.2 ±8.6 y – 56% I: 131 – 53.2 ±11.3 y – 28% J: 126 – 51.4 ±11.6 y – 49% K: 18 – 52.9 ±8.6 y – 44% L: 100 – 65.1 ±4.9 y – 75% M: 321 – 60.9 ±9.8 y – 67% N: 484 – 53.3 ±8.9 y – 53% O: 202 – 59.0 ±8.7 y – 37% P: 165 – 58.1 ±9.3 y – 53% Q: 120 – 56.5 ±9.4 y – 33%
Groups comparable at baseline? Large differences in % males, but ages are similar |
A: Telemonitoring device, voice and videoconsults B: Monitoring + feedback through website and cell phone C: Text messaging, physiological and physical activity monitoring D: Physiological telemonitoring, telephone calls E: Weight-loss website on phone, teleconference F: remote monitoring, weekly reports mailed G: diabetes self-management promotion program with remote reporting and automated feedback H: mobile phone health coaching and remote health monitoring I: health coaching and smartphone interaction J: text messages in addition to usual care K: diet and exercise advice and smart wearable with or without email motivational support L: electronic reporting and monitoring of health values and text message response M: remote monitoring + feedback N: internet-based monitoring device (automatic recording and relayed information from care providers) O: automatic reporting sale, step counter and glucometer + personalized online portal P: videoconferencing, remote monitoring of physiological data Q: web-based nutritional support tool; feedback provided based on the input step count
|
Usual care with or without additional conventional disease self-management education. |
End-point of follow-up: A: 3 months B: 6 months C: 3 months D: 6 months E: 12 months F: 6 months G: 10 months H: 12 months I:6 months J: 6 months K: 4 months L: 6 months M: 9 monhts N: 6 months O: 12 months P: 8 months Q: 4 months
For how many participants were no complete outcome data available? A: 0% B: 15% C: 10% D: 9% E: 62% F: 3% G: 18% H: 10% I: 26% J: 0% K: 26% L: 15% M: 11% N: 8% O: 17% P: 16% Q: 11%
|
Outcome measure-1 Defined as glycosylated hemoglobin (HbA1c, %). mean difference [95% CI]:
A: -0.40 (-1.47 to 0.67) B: -1.09 (-1.34 to -0.84) C: -0.70 (-0.76 to -0.64) D: -0.70 (-0.77 to -0.63) E: not included in meta-analysis F: -1.0 (-1.27 to -0.73) G: -0.41 (-0.89 to 0.07) H: -0.14 (-0.38 to 0.10) I: -0.05 (-0.13 to 0.03) J: -0.22 (-0.32 to -0.12) K: -2.10 (-3.96 to -0.24) L: -0.50 (-0.57 to -0.43) M: -0.60 (-0.63 to -0.57) N: -0.20 (-0.21 to -0.19) O: -0.80 (-0.85 to -0.75) P: not included in meta-analysis Q: -0.50 (-0.80 to -0.20)
Pooled effect (fixed/random effects not reported): -0.30 [95% CI -0.31 to -0.29] favoring telemonitoring Heterogeneity (I2): 99.1%
|
Authors’ conclusion: inform telemonitoring design for future diabetes management to enhance access to care, ease of use, and to improve patient engagement
|
|
Verma, 2021 |
SR and meta-analysis of RCTs and clinical trials Literature search up to August 2020
A: Cheng, 2017 B: Vinitha, 2019 C: Kusnanto, 2019 D: Adikusuma, 2018 E: Dong, 2018 F: Goodarzi, 2012 G: Gunawardena, 2019 H: Kumar, 2018 I: Kim, 2006 J: Jarab, 2012 K: Jain, 2018 L: Kleinman, 2017 M: Lee, 2018 N: Sun, 2019 O: Oh, 2003 P: Patnaik, 2014 Q: Sadanshiv, 2020 R: Islam, 2015
Study design: RCT [parallel / cross-over]
Setting and Country: Public Health department, India
Source of funding and conflicts of interest: None.
|
Inclusion criteria SR: RCT or clinical trial; (2) reporting on outcomes after mHealth interventions (mHealth app, text message or phone calls); (3) targeting patients with diabetes type 2; (4) study conducted in Asian population and published in English language
Exclusion criteria SR: (1) diabetes patients wit severe complications (e.g. diabetic foot, heart disease); (2) mixed population of type 1 and 2 diabetes; (3) pregnant patients with type 2 diabetes
18 studies included (13 for quantitative analysis of main outcome; not H, J, M, P, R)
Important patient characteristics at baseline: Not reported per study.
Groups comparable at baseline? Cannot be judged. |
A: Phone calls B: text message C: mobile application D: text message E: mobile application F: text message G: mobile application H: text message I: text message J: phone calls K: phone calls L: mobile application M: mobile application N: mobile application O: phone calls P: text message +phone calls Q: text message R: text message
|
Usual or conventional care
|
End-point of follow-up: A: 5 months B: 24 months C: 3 months D: 6 months E: 12 months F: 3 months G: 6 months H: 12 months I: 6 months J: 6 months K: 6 months L: 6 months M: 12 months N: 6 months O: 3 months P: 3 months Q: 6 months R: 6 months
For how many participants were no complete outcome data available? A: 41 (16.9%) B: 30 (12.1%) C: - D: - E: 1 (0.8%) F: 18 (18%) G: 15 (22.4%) H: 103 (10.8%) I: 9 (15%) J: 15 (8.8%) K: 9 (3%) L: 11 (12.1%) M: 43 (29.1%) N: - O: 12 24%) P: 45 (45%) Q: 18 (5.6%) R: 6 (2.5%)
|
Outcome measure-1 Defined as glycosylated haemoglobin (HbA1c, %). mean difference [95% CI]:
A: -0.60 (-1.17 to -0.03) B: -0.40 (-0.77 to -0.03) C: -0.30 (-1.03 to 0.43) D: -1.10 (-1.54 to -0.66) E: -1.70 (-2.22 to -1.18) F: -0.40 (-0.88 to 0.08) G: 0.90 (0.49 to 1.31) H: not included in meta-analysis I:-0.70 (-1.32 to -0.08) J: not included in meta-analysis K: 0.0 (-0.43 to 0.43) L: -0.30 (-0.84 to 0.24) M: not included in meta-analysis N: 0.0 (-0.29 to 0.29) O: -1.30 (-1.91 to -0.69) P: not included in meta-analysis Q: -0.10 (-0.35 to 0.15) R: not included in meta-analysis
Pooled effect (random effects model): -0.44 [95% CI -0.79 to-0.10] favoring mHealth. Heterogeneity (I2): 87%
|
Authors’ conclusion: mHealth interventions can be seen as a suitable medium to improve the glycemic index among diabetic patients. The available literature about assessing the use of mHealth is limited and inconsistent to draw any robust conclusions. |
|
Yaminne, 2022 |
SR and meta-analysis of studies with comparative design Literature search up to March 2020
A: Wilbright, 2004 (n = 140) B: Rasmussen, 2015 (n = 374) C: Smith-Strøm, 2018 (n = 182)
Study design: RCTs (parallel design) and clinical trials
Setting and Country: Academic hospital, Lebanon
Source of funding and conflicts of interest: None.
NB: study D will not be analyzed as it does not compare remote healthcare delivery with regular healthcare activities; rather it compares home-based care to hospital-based care. |
Inclusion criteria SR: (1) intervention including any type of remote consultation, (2) comparison including any type of face-to-face consultation (e.g. home care or hospital/medical center care)
Exclusion criteria SR: (1) wounds not being diabetic foot ulcers
4 studies included
Important patient characteristics at baseline: 816 patients total I: 387 (47.4%) C: 429 (52.6%)
Mean age A: I: 55.1 | C: 56.5 B: I: 66.8 | C: 66.7 C:I: 67.2 | C: 65.5
Sex (% male): A: I: 45% | C: 55% B: I: 78.2% | C: 71.3% C: I: 74.5% | C: 73.9%
Groups comparable at baseline? Yes, though participants from study A are younger and have less males |
A: Telemedicine consultation B: Telemedical monitoring (2 consultations at patient’s home) and 1 at outpatient clinic C: telemedicine follow-up care
|
A: face-to-face care at diabetes foot program B: 3 outpatient clinic visits C: standard outpatient care
|
End-point of follow-up: A: 3 months B: 3 months C: 12 months
For how many participants were no complete outcome data available? Not reported |
Healing rate Effect measure: RR [95% CI]: A: 0.93 [0.71 to 1.21] B: 0.97 [0.86 to 1.10] C: 1.05 [0.90 to 1.22]
Pooled effect (random effects model): 0.99 [95% CI 0.91 to 1.09] Favoring telemedicine. Heterogeneity (I2): 0%
Time to heal A: I: 34 ±29.3 | C: 45.5 ± 43.4 B: I: 74 | C: 91 C: I: 102 | C: 114
Overall mean: I: 73 ± 24.1 days C: 83.5 ± 28.4 days
Amputation rate Effect measure: RR [95% CI]: B: 0.76 [0.44 to 1.30] C: 0.36 [0.13 to 0.97]
Pooled effect (random effects model): 0.59 [95% CI 0.29 to 1.18] Favoring telemedicine. Heterogeneity (I2): 41%
Mortality rate Effect measure: RR [95% CI]: B: 7.50 [0.95 to 59.39] C: 0.94 [0.28 to 3.12]
Pooled effect (random effects model): 2.25 [95% CI 0.28 to 18.13] Favoring face-to-face care delivery. Heterogeneity (I2): 68%
|
Authors’ conclusion: treating DFU via TM could be at least as effective as to face-to-face attendance.
Not researched (selective reporting?): ulcer recurrence rate, ulcer transfer rate, infection rate
|
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/n.a. |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Kebede, 2018 |
Yes, objective stated with selection criteria for the parts of the PICO |
No, search strategy not presented, search date to June 2017 |
No, only PRISMA flowchart presented |
Partly, table 1 provides study characteristics, but not of the population in the studies |
Not applicable |
Yes, figure 2 risk of bias table (Cochrane tool) |
Unclear, as population characteristics are poorly presented |
Yes, supplementary figure 1 and tests. |
No, declaration of no competing interests for review, but not reported for individual RCTs |
|
Michaud, 2021 |
Yes, clear objectives stated with clear PICO |
Yes, search period (to October 2018) and strategy reported |
Partly, only PRISMA flowchart and overview of included studies |
Yes, Table 1 characteristics of included studies |
Not applicable |
Yes, using the Jadad scale (presented in table 1) |
Unclear, I2 results in 99.1%, possible clinical heterogeneity |
Yes, funnel plot and Egger’s model |
No, declaration of no competing financial interests for review, but not reported for individual RCTs |
|
Verma, 2021 |
Yes, objective stated with selection criteria for the parts of the PICO |
Yes, search period (to August 2020) and strategy reported |
Yes, in annexure 1. |
Partly, table 2 provides study characteristics, but not of the population in the studies |
Not applicable |
Yes, figure 1 risk of bias table (Cochrane tool) |
Unclear, I2 results in 87%, possible clinical heterogeneity |
Partly, visual inspection of funnel plot only |
No, declaration of no conflicts of interests for review, but not reported for individual RCTs |
|
Yammine, 2022 |
Partly, research question clear but broad subparts of PICO. |
No, search strategy insufficient, search date to March 2020 |
No, only PRISMA flowchart presented |
Yes, Table 1 characteristics of included studies |
Not applicable |
Yes, Joanna Briggs Institute critical appraisal tool |
No, last study different intervention group; and I2 72.2% for first outcome. |
No, no funnel plots and no tests. |
No, declaration of no conflicts of interests for review, but not reported for individual RCTs |
Evidence tabel for Randomized Controlled Trials
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Direction of effect |
Comments |
|
Leong, 2022 |
Type of study: Open-label RCT
Setting and country: Taiwan
Funding: Reported
Conflicts of interest: Reported |
Inclusion criteria: (1) Patients ≥20 years, (2) at least one HbA1c measurement ≥6% in the past 6 months, (3) possessed smartphone with LINE app
Exclusion criteria: (1) Gestational diabetes, (2) cognitive impairment, (3) controlled diabetes through dietary control without medication
N total at baseline: Intervention (I): 91 Control (C): 90
Important prognostic factors: Age ± SD: I: 59.0 ± 11.4 C: 58.1 ± 11.9
Sex (% male): I: 73.6% | C: 63.3%
Groups comparable at baseline? Yes |
TMU-LOVE program in addition to usual care. The program consisted of educational videos, frequently asked questions, one-on-one chat room, graphic messages, and the ability to direct patients to certain websites. Physicians could send educational videos and communicate with patients by text message, voice, or video call. The program was designed to last for a study duration of 3 months (i.e., 12 weeks), with two or three videos sent every week and a care message sent every 2 weeks to the patients in the intervention group. |
Usual care, including patient consultations with physicians, access to nurses in the outpatient services, as well as medication consultations with pharmacists upon receiving prescriptions. Physicians also referred patients for consultations with certified diabetes educators (CDEs) when necessary. |
Length of follow-up: 3 months
Loss-to-follow-up: I: 9 | C: 8 Did not return to clinics (n=3 for I, n = 4 for C); Unwilling to complete post-test (n=6 for I, n = 4 for C)
Incomplete outcome data: No incomplete outcome data, 91 patients in the IG and 90 patients in the CG were analysed.
|
Effectiveness HbA1c (mean % ± SD) Intervention: 7.0 ± 0.9 Control: 6.7 ± 0.7
Knowledge (measured using the Simplified Diabetes Knowledge Scale (SDKS)) (mean % correctness ± SD) Intervention: 76.7 ± 11.7 Control: 73.2 ± 12.6
Patient focus Patient attitude towards diabetes (mean score ± SD) (measured using the Chinese version of the Diabetes Care Profile-Attitudes Toward Diabetes Scales (DCP-ATDS)) Intervention: 3.8 ± 0.5 Control: 3.7 ± 0.5
Self-care activities (mean score ± SD) (measured using the Chinese version of the Summary of Diabetes Self-Care Activities (SDSCA)) Intervention: 3.97 ± 1.18 Control: 3.86 ± 1.46
|
HbA1c: no difference.
Knowledge: no difference.
Patient attitude: significant increase in IG compared with baseline (no comparison made between IG and CG)
Self-care activities: significant increase in IG compared with baseline (no comparison made between IG and CG) |
Study also reports utility rates of the educational videos and performed a subgroup analysis to measure the effects of health literacy. These data were not reported here. |
|
Di Molfetta, 2022 |
Type of study: Prospective RCT
Setting and country: Three tertiary referral centres for diabetes in Italy
Funding: Reported
Conflicts of interest: Reported |
Inclusion criteria: (1) Age 18-70 years; (2) Insulin-treated diabetes, (3) diagnosis of diabetes for at least 1 year, (4) inadequate glycaemic control, (5) ability and willingness to carry out standard self-monitoring blood glucose
Exclusion criteria: (1) complications of diabetes, (2) comorbidities, (3) diagnosis of active neoplasia within the last 5 years, (4) pregnancy or intervention to become pregnant
N total at baseline: Intervention (I): 62 Control (C): 61
Important prognostic factors: Age ± SD: I: 47.15 ± 14.54 C: 45.21 ± 14.76
Sex (% male): I: 53.2 % | C: 55.7 %
Groups comparable at baseline? Yes |
Patients received prompt feedback about their blood glucose levels and therapy suggestions from the study staff via phone/SMS, when appropriate. |
Standard self-monitoring blood glucose, reported on paper daily, without remote assistance. |
Length of follow-up: 6 months
Loss-to-follow-up: I: 7 | C: 19 Withdrew from the trial (Article: Most common reasons for declining participation in the trial were poor compliance with self-testing of blood glucose and/or unwillingness to be engaged in an intensive monitoring program involving use of smartphone and device.)
Incomplete outcome data: 138 patients were randomised. 15 were excluded because on CSII, resulting in 123 patients included in the final analysis. |
Effectiveness HbA1c (% change) Intervention: -0.38% Control: +0.08%
Mean blood glucose Blood glucose Fasting blood glucose Postprandial blood glucose Postprandial blood glucose excursion No difference over time in IG (14 days following first visit, 14 days preceding 3 months, and 14 days preceding 6 months).
Body weight change No difference between baseline and six months in either IG or CG patients.
Waist circumference No difference between baseline and six months in either IG or CG patients.
Hypoglycemia Not reported. |
HbA1c: significant reduction in IG between baseline and six months.
No difference in other parameters. |
No comments. |
|
Yang, 2022 |
Type of study: RCT
Setting and country: Community health centre, China
Funding: Reported
Conflicts of interest: Reported |
Inclusion criteria: (1) Newly diagnosed type 2 diabetes mellitus within the past 3 months; (2) HbA1c of 6.5-7.5%; (3) age 40-60 years, (4) systolic blood pressure of 90-120 mmHg and diastolic blood pressure of 60-90 mmHg
Exclusion criteria: (1) type 1 diabetes, (2) comorbidities, (3) inability to understand or comply with instructions, (4) lactating, pregnant, or planning to be pregnant, (5) serious disease resulting in loss to follow-up, (6) smoking, (7) alcoholism, (8) attending another clinical trial
N total at baseline: Intervention (I): 50 Control (C): 50
Important prognostic factors2: Age ± SD: I: 65.09 ± 6.06 C: 67.34 ± 5.33
Sex (% male): I: 38.30% | C: 42.00%
Groups comparable at baseline? Yes |
Telemedicine management, using a mobile phone to manage patients’ health condition remotely. Patients would get reminders for recording and uploading all daily meals and snacks, weight, fasting glucose, blood pressure and medication every day via WeChat, and the nutrition platform would check the data automatically and give an immediate warning message or feedback if the patient ate too much high glycemic index (GI) value food or saturated fat. A 40-minute phone visit was conducted every month to educate patients about diet or exercise, such as eating low GI value food, moderate aerobic physical activity, or resistance exercise to increase mass of muscle and received a dietary guideline. |
Regularly routine intervention; patients came to see the outpatient doctor per standard of care during the study period and received simple dietary advise or exercise recommendation each visit. |
Length of follow-up: 12 months
Loss-to-follow-up: I: 3 | C: 0 Did not upload data or return to outpatient department
Incomplete outcome data: No incomplete outcome data
|
HbA1c (mean % ± SD) Intervention: 6.18 ± 0.73 Control: 7.34 ± 1.68
Fasting blood glucose (mean mmol/L ± SD) Intervention: 6.10 ± 0.83 Control: 7.07 ± 1.43
Biochemical parameters Total cholesterol (mean mmol/L ± SD) I: 4.61 ± 0.95 | C: 5.02 ± 1.03
Physical and body composition parameters Weight (mean kg ± SD) I: 58.25 ± 8.23 | C: 59.43 ± 9.91
BMI (mean kg/m2 ± SD) I: 23.66 ± 2.86 | C 24.69 ± 3.51
Waist circumference (mean cm ± SD) I: 86.22 ± 4.80 |C: 90.92 ± 5.11
Diastolic BP (mean mmHg ± SD) I: 75.85 ± 7.30 | C: 75.22 ± 7.59
Systolic BP (mean mmHg ± SD) I: 123.21 ± 12.61 | C: 128.88 ± 10.28
Adverse events There were no adverse events reported during the study.
Quality of life (SF-36) Intervention: 71.38 ± 14.68 Control: 69.96 ± 13.92
Costs Total costs 1 month (mean ¥ ± SD) Intervention: 193.48 ± 21.71 Control: 331.67 ± 56.37 |
Physical and body composition parameters: significant improvement in IG, except lean body mass change and muscle mass change. (body fat percentage, body fat mass, lean body mass, body water and muscle mass not reported in this table)
Biochemical parameters: all significant improvement in IG. (Triglicerides, LDL, and HDL not reported in this table)
Quality of life: no significant difference.
Costs: Significant lower in IG. |
Patients had to be between 40 and 60 years but the mean age is above 60. Protocol states inclusion of patients 30 to 75 years à risk of bias.
Study also performed correlation analysis, these data is not presented here. |
|
Li, 2021 |
Type of study: Cost-effectiveness analysis, random
Setting and country: Tertiary care hospital specific to diabetes in China
Funding: Reported
Conflicts of interest: Reported |
Inclusion criteria: (1) Patients ≥18 years, (2) type 2 diabetes, (3) registered in the clinical database for enrolment and follow-up of patients with DM living in the territories served by Community Health Care
Exclusion criteria: (1) No interest, (2) no smartphone
N total at baseline: Intervention (I): 130 Control (C): 85
Important prognostic factors: Age ± SD: I: 47.5 ± 9.88 C: 46.7 ± 10.11
Sex (% male): I: 67.7% | C: 63.5% M
Groups comparable at baseline? Yes |
Mobile-based intervention, extending medical services from hospitals to families. The functions of the app include authentication, appointment registration, electronic medical record access, medication reminders, results checks, blood glucose monitoring and threshold alarms, diet and exercise monitoring and suggestions, health education, telephone follow-up, real-time communication with the management team, and peer support and communication. |
Standard medical care every three months. |
Length of follow-up: 12 months
Loss-to-follow-up: No loss to follow-up
Incomplete outcome data: NR |
Effectiveness HbA1c (% control rates) Intervention: 74.6% Control: 47.1%
Costs Costs at 12-month follow-up (mean ¥ ± SD) Intervention: 7754.03 ± 7118.53 Control: 12428.06 ± 11122.32
Incremental costs -605.68 ¥ per patient/year
ICER -22.02 ¥ per patient/year
No differences between controlled and uncontrolled HbA1c.
|
HbA1c: significant improvement in IG
Costs: significant less costs in IG |
|
|
María Gómez, 2022 |
Type of study: Open non-blinded RCT
Setting and country: Tertiary referral hospital, Colombia
Funding: Not reported
Conflicts of interest: Reported |
Inclusion criteria: (1) adults with type 2 diabetes mellitus, (2) using insulin, (3) HbA1c ≥ 6.5%, (4) access to technology used
Exclusion criteria: (1) patients admitted for acute diabetes decompensation or acute coronary syndrome, (2) under glucocorticoid treatment within the last 3 months, (3) using real-time or intermittent continuous glucose monitoring, (4) visual impairment, (5) pregnant, (6) psychiatric illness or cognitive impairment limiting the likelihood of device use
N total at baseline: Intervention (I): 42 Control (C) : 45
Important prognostic factors: Age ± SD: I: 58.6 ± 10.6 C: 60.5 ± 12.8
Sex (% male): I: 55.0% | C: 54.2% M
Groups comparable at baseline? Yes, except for the proportion of patients with obesity (IG 46% vs CG 29%). |
Patients were assessed by nutrition service and a telemedicine platform (ClouDi) was used to record and adjusted insulin doses. The platform consists of a web version, a version for mobile devices, and a desktop application. This allowed glucose measurements to be uploaded, and these were reviewed weekly by the members of the research group who were responsible for adjusting the therapy. Patients received pop-up notifications about changes. |
Standard care of the institution and assessment by nutrition service. They also received education in the management of diabetes medications and diet by nutrition and nursing before discharge from the hospital. |
Length of follow-up: 3 months
Loss-to-follow-up: I: 3 | C 3 Died before treatment (n = 1 for I); died during follow-up (n = 2 for I, n = 3 for C)
Incomplete outcome data: I: 14 | C: 20
|
Effectiveness HbA1c (%), means and mean difference in change Intervention: 7.16 Control: 8.81 MD: -2.03% (95%CI -3.39 to -0.68)
Hypoglycaemia (≥1 episodes) (%) Level 1 (<3.0 mmol/L [<70 mg/dL]) Intervention: 52.5 Control: 52.3 RR 1.01 [0.67; 1.51]
Level 2 (<3.8 mmol/L [<54 mg/dL]) Intervention: 75.0 Control: 72.3 RR 1.03 [0.80; 1.33]
Level 3 or severe hypoglycaemia Intervention: 15.0 Control: 25.6 RR 0.59 [0.24; 1.44]
Weight reduction (MD kg [95%CI]) I: 3.63 [1.28 to 5.97] C: 1.64 [-0.28 to 3.56]
BMI change (MD kg/m2 [95%CI] Intervention: 1.20 [0.41 to 1.98] Control: 0.53 [-0.26 to 1.32]
Patient focus Satisfaction (measured using the ITSQ questionnaire) I: 73.8 ± 11.1| C: 42.8 ± 16.7
|
HbA1c: significant reduction in IG
Hypoglycaemia: no difference
Weight: significant decrease in IG
BMI: significant decrease in IG
Patient satisfaction: significant higher in IG |
|
|
Turnin, 2021 |
Type of study: Open-label RCT
Setting and country: 16 investigation sites in France
Funding: Reported
Conflicts of interest: Reported
|
Inclusion criteria: (1) 18 years or above, (2) documented medical history of type 2 diabetes, with or without insulin treatment, (3) recent HbA1c value >6.5% and ≤10%, (4) active internet connection at home
Exclusion criteria: (1) severe or active comorbidities, (2) reduced mobility, (3) serious eating disorders, (4) who had undergone bariatric surgery
N total at baseline: Intervention (I): 141 Control (C): 141
Important prognostic factors: Age ± SD: I: 59.8 ± 9.2 C: 59.3 ± 10.0
Sex (% male): I: 64.1% | C: 62.2% M
Groups comparable at baseline? Yes |
Home telemonitoring device, that combined biomedical data sensors with educational software. Participants received three tele-educational software programs: (1) Nutri-Kiosk (set of self-learning quizzes for formative assessment based on nutritional knowledge); (2) Acti-Kiosk (support in starting physical activity (assessment, information and videos)); (3) Nutri-Educ (personalized nutritional educational software application that meets international clinical recommendations). Patients in the IG sent the data to a platform weekly and had free access to this information and their monitoring summary. Physicians could see the data, received alerts about certain events, and could communicate with the patient. No face-to-face consultations were scheduled in advance. |
Face-to-face consultations in accordance with standard practices. |
Length of follow-up: 12 months
Loss-to-follow-up: I: 13 | C: 6
Incomplete outcome data: No incomplete outcome data |
Effectiveness HbA1c (mean % ± SD) Intervention: 7.4 ± 1.0 Control: 7.6 ± 1.0%
BMI change (mean kg/m2 ± SD) Intervention: -0.30 ± 1.9 Control: 0.06 ± 1.3
Waist circumference Adjusted intergroup difference -1.67 cm [-3.27; -0.06] in favour of the IG
Patient focus Satisfaction (measured using an ad hoc questionnaire) 97.4% was completely satisfied or rather satisfied with device use and telemonitoring data synthesis. Device-generated assistance was deemed positive by 88.2% of subjects for the daily management of diabetes.
Health professional focus Satisfaction (measured using an ad hoc questionnaire) 85% of the investigators reported having completely integrated the web application functions and over 80% found it easy to very easy to use, in terms of both patient records and telemonitoring synthesis reports. 82.3% were keen to continue using the device. |
HbA1c: no difference
BMI: no difference
Waist circumference: significant reduction in IG
Satisfaction: patients in IG were satisfied (no comparison made with CG)
Satisfaction: HCPs in IG were satisfied (no comparison made with CG) |
Study performed baseline HbA1c level stratification before patients were randomly assigned.
Study is funded by SANOFI laboratory for provision of blood glucose monitors, and some of the authors received congress invitations and consultancy fees from the company. |
|
Hu, 2021 |
Type of study: RCT
Setting and country: Single hospital in China
Funding: Reported
Conflicts of interest: Not reported
|
Inclusion criteria: (1) diagnosis of T2DM more than 3 months prior, (2) age 18-70 years, (3) ability to use a smartphone and blood-glucose meter, (4) voluntary participation
Exclusion criteria: (1) severe heart, liver, or renal insufficiency, (2) history of cancer, coronary heart disease, or cerebral infarction, (3) hyper- or hypothyroidism, (4) severe infection, (5) current treatment with drugs that affect blood-glucose levels, (6) mental illness, communication disorder, or blindness, (6) major trauma, major surgery, or any severe illness
N total at baseline: Intervention (I): 74 Control (C): 74
Important prognostic factors: Age ± SD: I: 50.04 ± 5.76 C: 52.21 ± 8.38
Sex (% male): I: 71% | C: 61% M
Groups comparable at baseline? Yes |
Monthly diabetes education from a diabetes specialist nurse pertaining to self-monitoring of blood-glucose levels, dietary habits, importance of medication timing, and physical activity.
Telemedicine, including a wireless intelligent blood-glucose meter for monitoring blood-glucose levels, transmit data, and upload information on diet, exercise frequency, and oral medications. It was possible to communicate between the hospital and patient. Blood-glucose, exercise frequency, and dietary were uploaded to the telemedicine platform each week. This was transmitted to a telemedicine system. This allowed the researchers to view the patients’ blood-glucose levels, insulin dosage, physical activity frequency, and meal data. The researchers contacted the patients, if necessary, via WeChat (Tencent), telephone, or other online connections. |
Monthly diabetes education from a diabetes specialist nurse pertaining to self-monitoring of blood-glucose levels, dietary habits, importance of medication timing, and physical activity.
Patients used an intelligent blood-glucose meter that did no upload blood-glucose data via the network. These patients received conventional outpatient treatment once a month from department endocrinologists and nurses. Blood-glucose levels were uploaded once a month by the doctors and nurses. |
Length of follow-up: 6 months
Loss-to-follow-up: Intervention: 2
Control: 4
Incomplete outcome data: No incomplete outcome data |
Effectiveness HbA1c (mean % ± SD) Intervention: 7.38 ± 1.67 Control: 8.22 ± 2.04
Hypoglycaemia (n patients (%)) Intervention: 18 (25%) Control: 29 (41.4%)
UACR (mean mg/mmol ± SD) Intervention: 4.36 ± 1.45 Control: 4.56 ± 1.11
Carotid plaque (n patients (%)) Intervention: 27 (37.5%) Control: 27 (38.6%)
|
HbA1c: significant reduction in IG
Hypoglycaemia: significant reduction in IG
Urinary albumin to creatinine ratio: no difference
Carotid plaque: no difference |
Data after 3 months also described in the article, not reported here.
Conflicts of interest not reported. |
|
Timurtas, 2022 |
Type of study: Stratified, randomized, assessor-blind, controlled, pragmatic trial, with three arms.
Setting and country: Single centre trial in Turkey
Funding: Reported
Conflicts of interest: Reported |
Inclusion criteria: (1) between 30 and 65 years, (2) type 2 diabetes diagnosed by an endocrinologist, (3) possess a smartphone
Exclusion criteria: (1) participation in an exercise program before, (2) unable to use a smartphone or wearable smartwatch independently, (3) health condition other than T2D associated with disordered glucose metabolism, (4) diagnosed cognitive, mental health, neurological, or orthopaedic condition
N total at baseline: Intervention (I): 60 Control (C): 30
Important prognostic factors: Age ± SD: I-SP: 51.6 ± 7.8 I-SW: 51.4 ± 8.1 C: 51.8 ± 8.0
Sex (% male): Not reported
Groups comparable at baseline? Not reported by the authors, but probably yes. |
As control group, plus: An online platform to support the delivery, tracking, and adaption of exercise programs.
IG SP: three one-on-one training sessions; after that push exercise reminders (for which participants decided the frequency). Message feature of the app for communication between participants and physiotherapists as needed. Step count in smartphone. Extra notifications when participants did not check in exercises. Possibility for viewing progress daily, weekly, and monthly.
IG SW: three one-on-one training sessions. After that participants accessed their DIABETEX account through smartwatch and could view their personal exercise program. This permitted real-time remote tracking. Automatic push notifications when the sensors did not detect sufficient heart rate elevation or acceleration. |
Prescribed exercise training composed of aerobic, strengthening, balance, and stretching exercises to 3x/week, starting with a 30-minute session building up to a one-hour session for a duration of 12 weeks. The programs were designed by physiotherapists as per the needs of each individual. Each exercise session included a warm-up, aerobic exercises with treadmill or cycling, resistance exercises with elastic band and dumbbell, balance and flexibility exercises, and a cool down. The intensity of aerobic exercise was determined by the target heart rate, measured with an oximeter, according to the Karvonen method. |
Length of follow-up: 12 weeks
Loss-to-follow-up: Intervention SP: 3
Intervention SW: 4
Control: 2
Incomplete outcome data: Dropped out after randomization but before the intervention started for reasons unrelated to the study group assigned.
à 2 in each group |
Efficiency HbA1c (mean % ± SD) Intervention (n=49): 7.1 ± 1.5 Control (n=26): 6.5 ± 0.7
Patient focus Self-efficacy Intervention:
Control:
|
HbA1c: Significance level not provided
Self-efficacy: significance level not provided
|
Stratification by age (3 categories) and sex yielded 6 strata and randomization in blocks of 6 was used to assign people to groups.
Gender of participants is not reported. |
|
Avdal, 2020 |
Type of study: RCT
Setting and country: Single centre university hospital in Turkey
Funding: Not reported
Conflicts of interest: Reported
|
Inclusion criteria: (1) diagnosed with type 2 diabetes at least 6 months prior (having had diabetes education, (2) taking oral antidiabetic drugs (OADs) and insulin, (3) 18 years of age or older. (4) BMI > 29.0, (5) LDL > 130 mg/dl, (6) HDL > 35 mg/dl, (7) Systolic blood pressure > 130 mmHg, (8) Diastolic blood pressure > 110 mg/dl, (9) fasting blood glucose > 140 mg/dl, (10) postprandial blood glucose > 160 mg/dl, (11) agreeing to receive continuing diabetes education, (12) participating voluntarily, (13) able to use computers and the internet.
Exclusion criteria: (1) severe retinopathy, (2) severe neuropathy
N total at baseline: Intervention (I): 40 Control (C): 40
Important prognostic factors: Age ± SD: Not reported Sex (% male): Not reported
Groups comparable at baseline? Yes according to study authors |
2-h course on how to use the internet program. After, every participant was tracked weekly to assess usage of program. A second course was given by the researchers to those who could not use the program.
Diabetes diagnosis forms were sent online to all the participants in the experimental group. Participants saved their data and sent it to the researcher. Using this information, the researcher sent each participant a unique slideshow or media component that included information on how to meet their self-care needs. An FAQ section was available. Participants saved their daily or weekly blood glucose levels on the online data entry screen and were monitored and frequently advised which LDL, HDL, and systolic and diastolic blood pressure levels were recommended by the doctors. |
2-h course on how to use the internet program. After, every participant was tracked weekly to assess usage of program. A second course was given by the researchers to those who could not use the program.
Training and monitoring of control group continued at the outpatient clinic, receiving education by diabetes nurses and training materials were prepared. Monitoring of patients in the control group was conducted by the researcher by using patients’ medical records from the Endocrinology Outpatient Clinic every 3 months. |
Length of follow-up: 12 months
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported |
Effectiveness BMI (mean kg/m2 ± SD) Intervention: 24.8 ± 0.231 Control: 28.6 ± 1.621
LDL (mean mg/dl ± SD) Intervention: 95 ± 10 Control: 130 ± 12
HDL (mean mg/dl ± SD) Intervention: 50 ± 10 Control: 39 ± 13
Systolic blood pressure (mean mmHg ± SD) Intervention: 80 ± 9 Control: 120 ± 10
Diastolic blood pressure (mean mmHg ± SD) Intervention: 80 ± 5 Control: 95 ± 5
Fasting blood glucose (mean mg/dl ± SD) Intervention: 120 ± 10 Control: 138 ± 12
Postprandial blood glucose (mean mg/dl ± SD) Intervention: 148 ± 10 Control: 168 ± 11
|
BMI: significant reduction in IG.
LDL: significant reduction in IG.
HDL: significant reduction in IG.
SBP: significant reduction in IG.
DBP: significant reduction in IG.
FBG: significant reduction in IG.
PPBG: significant reduction in IG. |
Data from the experimental group were collected online while data belonging to the control group were collected by the researcher from patients’ medical records in the Endocrinology Outpatient Clinic.
No table 1 with patient characteristics.
Loss to follow-up and incomplete outcome data not reported -> not applicable or just not reported?
Funding not reported. |
|
Molavy-nejad, 2020 |
Type of study: 3-arm RCT
Setting and country: University hospital in Iran
Funding: Reported
Conflicts of interest: Reported |
Inclusion criteria: (1) T2DM at least for one year, (2) age > 18 years, (3) no other chronic conditions, (4) receiving no official education on self-care or attending other educational program before or during the study, (5) not being pregnant or under breastfeeding
Exclusion criteria: (1) absent in two educational sessions, (2) worsening health condition, (3) no longer interested in participation in the study, (4) hospitalized during the study, (5) changed therapeutic regimen
N total at baseline: Video (VTE): 126 In-person (IPE): 125 Pamphlets (P): 126
Important prognostic factors: Age ± SD: VTE: 45.88 ± 9.09 IPE: 47.37 ± 7.07
Sex (% male): VTE: 54.2% | IPE: 50.4%
Groups comparable at baseline? Yes |
Video tele-education (VTE): An educational movie (2 hours) was displayed in the clinic for all subgroups with opportunity to ask questions. The educational movie divided into several episodes was provided to the participants in the form of DVDs or Cell phone formats for home use (distance learning) during study process. During the study, research assistants reminded participants via regular text messages to watch the video education again and contact if they had any questions.
Pamphlets (P): Participants received an education by staff nurses via pamphlets including education about lifestyle management of T2DM. à not assessed for this literature analysis
|
In-person education (IPE): An educational movie (2 hours) was displayed in the clinic for all subgroups with opportunity to ask questions. The patients received 4 in-person educational sessions (45 minutes + discussion opportunity) by clinical nurses during a two-week period, then they received monthly in-person education at the clinic. Also an abstract of the educational content was provided in writing to the patients.
|
Length of follow-up: 3 months
Loss-to-follow-up: VTE: 3 | IPE: 4
Incomplete outcome data: No incomplete outcome data |
Effectiveness Triglyceride (mean mg/dl ± SD) Video tele-education: 168.02 ± 67.19 In-person education: 174.60 ± 58.83
HDL (mean mg/dl ± SD) Video tele-education: 43.42 ± 6.91 In-person education: 44.01 ± 6.67
LDL (mean mg/dl ± SD) Video tele-education: 104.86 ± 28.26 In-person education: 111.28 ± 38.71
V-LDL (mean mg/dl ± SD) Video tele-education: 30.99 ± 13.24 In-person education: 31.69 ± 12.90
Total cholesterol (mean mg/dl ± SD) Video tele-education: 180.24 ± 34.69 In-person education: 190.70 ± 47.99
Fasting blood sugar (mean mg/dl ± SD) Video tele-education: 162.67 ± 61.06 In-person education: 159.02 ± 59.13
HbA1c (mean % ± SD) Video tele-education: 6.99 ± 1.59 In-person education: 6.78 ± 1.34
Weight (mean kg ± SD) Video tele-education: 91.23 ± 14.77 In-person education: 87.74 ± 14.76
Patient focus Satisfaction with educational programs (scale from 0 to 10) Video tele-education: 7.13 ± 1.80 In-person education: 5.91 ± 1.7 |
Triglyceride, HDL, LDL: no significant difference
V-LDL, total cholesterol: significant reduction in IG
Fasting blood sugar: no significant difference
HbA1c: significant reduction in IGs
Weight: no significant difference
Satisfaction: significant higher satisfaction with VTE compared with IPE. |
Study describes in text that there are no difference in baseline characteristics, but occupation status and marital status differ significantly between groups (table 1) |
NM: not measured; IG: intervention group; CG: control group; SD: standard deviation; NR: not reported
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
|
Study reference
|
Was the allocation sequence adequately generated? |
Was the allocation adequately concealed? |
Blinding: Was knowledge of the allocated interventions adequately prevented?
|
Was loss to follow-up (missing outcome data) infrequent?
|
Are reports of the study free of selective outcome reporting?
|
Was the study apparently free of other problems that could put it at a risk of bias?
|
Overall risk of bias If applicable/necessary, per outcome measure
|
|
|
Definitely yes Probably yes Probably no Definitely no |
Definitely yes Probably yes Probably no Definitely no |
Definitely yes Probably yes Probably no Definitely no |
Definitely yes Probably yes Probably no Definitely no |
Definitely yes Probably yes Probably no Definitely no |
Definitely yes Probably yes Probably no Definitely no |
LOW Some concerns HIGH
|
|
Leong, 2022 |
Probably yes;
Reason: random sequence generated by a digital program before start of study |
Unclear;
Reason: Pharmacists allocated participants according to the random sequence. |
Definitely no,
Reason: open-label RCT (blinding of data analysts not reported) |
Probably yes;
Reason: Loss to follow-up was infrequent in intervention and control group. Adequate imputation methods (multiple imputation) were used. |
Definitely yes;
Reason: All relevant outcomes were reported (conform pre-registered protocol) |
Probably no;
Reason: use of self-reported outcome measures leading to possible recall bias |
Some concerns:
|
|
Di Molfetta, 2022 |
Probably yes;
Reason: randomization was carried out using a web-based application, stratified by age, sex, type of diabetes, HbA1c level |
No information;
Reason: using web-based application; no further information supplied. |
Definitely no,
Reason: patients and physicians not blinded (blinding of outcome assessors, data collectors and analysts not reported) |
Definitely no
Reason: Loss to follow-up was more frequent in control group (nearly 30%). No imputation methods were used |
Probably no
Reason: set of secondary (subgroup) outcomes from protocol not reported |
Probably no;
Reason: Unclear sample size calculation (clinical difference in HbA1c) |
High:
|
|
Yang, 2022 |
Probably yes;
Reason: randomized using a computer-generated randomization number |
No information;
Reason: no further information supplied. |
Probably no,
Reason: no information on blinding provided |
Definitely yes
Reason: Loss to follow-up was infrequent. No imputation methods were used |
Probably yes
Reason: protocol very brief, in article all outcomes reported |
Definitely no;
Reason: Patients had to be between 40 and 60 years but the mean age is above 60. Protocol states 30 to 75 years |
Some concerns:
|
|
Li, 2021 |
Insufficient information;
Reason: drawing lots |
Insufficient information;
Reason: drawing lots (unclear how and if sufficiently concealed) |
Definitely no;
Reason: patients and physicians not blinded (blinding of outcome assessors, data collectors and analysts not reported) |
Insufficient information
Reason: No information on loss to follow-up reported. |
Probably yes
Reason: no protocol registered. All relevant outcomes from methods are reported. |
Definitely yes;
Reason: Not all possible costs taken into account. |
High:
|
|
Maria Gomez, 2022 |
Insufficient information;
Reason: reported: “the selected patients were randomized” |
Insufficient information;
Reason: reported: “the selected patients were randomized” |
Definitely no
Reason: Open-label trial (patients, outcome assessors and health care providers not blinded). Blinding of data collectors not reported. Data analysts were blinded. |
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. No imputation methods were used |
Probably yes
Reason: no protocol registered. Outcomes stated in objective are reported. |
Probably yes;
Reason: Patients with more than 80% compliance were selected for the study (limited generalizability) |
Some concerns
|
|
Turnin, 2021 |
Definitely yes;
Reason: Random block sizes stratified by HbA1c level |
Insufficient information;
Reason: allocation concealment not described. |
Definitely no
Reason: Open-label trial (patients, health care providers, outcome assessors and data collectors not blinded). Blinding of data analysts not reported. |
Probably yes
Reason: Loss to follow-up was infrequent (<10% )in both groups. Mixed model for repeated measurements used. |
Probably yes
Reason: Not all outcomes from protocol reported; relevant outcomes for objective are. |
Definitely no;
Reason: Study is funded by SANOFI, some authors received consultancy fees |
Some concerns:
|
|
Hu, 2021 |
Probably yes;
Reason: random number table for odd and even numbers, put in envelopes randomly drawn. |
Definitely yes;
Reason: Doctors who were not part of the study prepared opaque, sealed envelopes which patients drew. |
Definitely no
Reason: Patients, health care providers, outcome assessors and data collectors not blinded. Blinding of data analysts not reported. |
Probably yes
Reason: Loss to follow-up was infrequent (<10%) in both groups. No imputation methods were used. |
Probably yes
Reason: no protocol registered. All relevant outcomes from methods are reported |
No information
Reason: Conflicts of interest not reported. |
Low
|
|
Timurtas, 2022 |
Probably yes;
Reason: Randomization in blocks of 6 with 6 strata. |
Insufficient information;
Reason: allocation concealment not described. |
Probably no
Reason: Patients and health care providers not blinded. Data collectors and outcome assessors blinded (not for self-reported outcomes). Blinding of data analysts not reported. |
Probably no
Reason: Loss to follow-up was frequent (>10%) in all groups. Inadequate imputation method (last observation carried forward) used. |
Probably no
Reason: Biochemical measurements from protocol not reported in study. |
Probably no
Reason: Underpowered due to randomization in 6 strata. No gender reported. |
High
|
|
Avdal, 2020 |
Unclear;
Reason: Experimental and control groups were determined with the basic random array |
Definitely no;
Reason: composition of groups was determined before the trial |
Definitely no
Reason: Patients, health care providers, outcome assessors and data collectors not blinded. Blinding of data analysts not reported. |
No information
Reason: Loss to follow-up was not reported |
Probably yes
Reason: no protocol registered. All relevant outcomes from methods are reported |
Probably no
Reason: no baseline characteristics provided. Funding information and ethical approval not reported. |
High
|
|
Molavynejad, 2020 |
Definitely yes;
Reason: Statistician generated random allocation sequence with permuted block randomization. |
Probably yes;
Reason: Research assistant enrolled and assigned participants |
Probably yes;
Reason: Patients blinded to existence of other study arms. Healthcare providers not blinded. Data collectors, outcome assessors and data analysts blinded to group assignment. |
Probably yes
Reason: Loss to follow-up was infrequent (<10%) in both groups. No imputation methods were used. |
Probably yes
Reason: no protocol registered. All relevant outcomes from methods are reported |
Probably yes
Reason: Marital status and occupation differed at baseline. |
High
|
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Systematic reviews |
|
|
Salehi 2020. DOI: 10.1007/s40200-019-00482-3 |
Wrong population (eerste lijn) |
|
Hangaard 2021. DOI: 10.1177/19322968211064633 |
Wrong intervention |
|
Fernando 2022. DOI: 10.3389/fendo.2022.848695 |
Wrong population (eerste lijn) |
|
Correira 2021. DOI: 10.2471/BLT.19.250068 |
Wrong control |
|
De Groot 2021. DOI: 10.4239/WJD.V12.I2.170 |
Wrong population (eerste lijn) |
|
Yang 2019. DOI: 10.1111/phn.12603 |
Wrong control (& duplicate) |
|
Faruque 2017. DOI: 10.1503/cmaj.150885 |
Wrong population (eerste lijn) |
|
Marcolino 2013. DOI: 10.1371/journal.pone.0079246 |
Wrong control |
|
Zhai 2014. DOI: 10.1097/MD.0000000000000312 |
Wrong population (eerste lijn) |
|
Liu 2020. DOI: 10.2196/15779 |
Wrong population |
|
Lee 2017. DOI: 10.3389/fphar.2017.00330 |
Wrong outcome |
|
Timpel 2020. DOI: 10.2196/16791 |
Wrong population (eerste lijn) |
|
Udsen 2022. DOI: 10.1177/19322968221076874 |
Wrong intervention |
|
Lee 2018. DOI: 10.1186/s12913-018-3274-8 |
Wrong control |
|
Zhang 2022. DOI: 10.3390/ijerph19074173 |
Wrong population (eerste lijn) |
|
Hu 2019. DOI: 10.1177/1357633X18776823 |
Wrong population (eerste lijn) |
|
Bassi 2021. DOI: 10.3390/ijerph18178982 |
Wrong population (eerste lijn) |
|
Wu 2018. DOI: 10.1097/MD.0000000000012962 |
Wrong population (eerste lijn) |
|
Pal 2014. DOI: 10.2337/dc13-1386 |
Wrong control |
|
Tchero 2019. DOI: 10.1089/tmj.2018.0128 |
Wrong population (eerste lijn) |
|
Robson 2021. DOI: 10.3390/ijerph182212171 |
Wrong population (eerste lijn) |
|
Tristão 2022. DOI: 10.2174/1573399818666220519164605 |
Wrong population (eerste lijn) |
|
Eberle 2021. DOI: 10.2196/23244 |
Wrong population (eerste lijn) |
|
Suksomboon 2014. DOI: 10.1371/journal.pone.0089207 |
Wrong control |
|
Su 2016. DOI: 10.1016/j.diabres.2016.04.019 |
Wrong population (eerste lijn) |
|
Moreira 2022. DOI: 10.1177/1357633X221102257 |
Wrong intervention |
|
Cui 2016. DOI: 10.1371/journal.pone.0166718 |
Wrong control |
|
Alharbi 2016. DOI: 10.2196/jmir.5778 |
Wrong control |
|
He 2022. DOI: 10.1111/jan.14993 |
Wrong control |
|
Kim 2022. DOI: 10.3390/healthcare10030522 |
Wrong population (eerste lijn) |
|
Huang 2015. DOI: 10.1530/EJE-14-0441 |
Wrong control (& duplicate) |
|
Yang 2022. DOI: 10.1016/j.pcd.2022.05.004 |
Wrong intervention |
|
Santos 2022. DOI: 10.1186/s13098-022-00846-5 |
Wrong population |
|
El-Gayar 2021. DOI: 10.1016/j.jbi.2021.103839 |
Wrong control |
|
Kim 2019. DOI: 10.1177/1357633X18782599 |
Wrong control |
|
Nkhoma 2021. DOI: 10.1136/bmjhci-2020-100291 |
Wrong population (eerste lijn) |
|
Arambepola 2016. DOI: 10.2196/jmir.5425 |
Wrong intervention |
|
Wang 2020. DOI: 10.2196/15400 |
Wrong population |
|
Chin-Jung 2021. DOI: 10.1002/nur.22094 |
Wrong control |
|
Wu 2019. DOI: 10.2196/12297 |
Wrong intervention |
|
So 2018. DOI: 10.1177/1357633X17700552 |
Wrong control |
|
Agastiya 2022. DOI: 10.1016/j.dsx.2022.102485 |
Wrong intervention, wrong outcome |
|
Lee 2017. DOI: 10.1038/s41598-017-12987-z |
Wrong intervention, wrong comparator |
|
Cassimatis 2012. DOI: 10.1258/jtt.2012.GTH105 |
Wrong intervention |
|
Wei 2019. DOI: 10.1177/1357633X17745456 |
Wrong population (eerste lijn) |
|
Kitsiou 2017. DOI: 10.1371/journal.pone.0173160 |
Wrong control |
|
Tchero 2017. DOI: 10.1177/1534734617739195 |
Same articles as Yammine (included in analysis), less recent |
|
Farmer 2016. DOI: 10.1111/dme.12987 |
Wrong control, wrong outcome |
|
Kongstad 2019. DOI: 10.1177/1357633X17733772 |
Wrong control, wrong outcome |
|
Wu 2018. DOI: 10.1111/obr.12669 |
Wrong control |
|
Feigerlova 2020. DOI: 10.1002/dmrr.3313 |
Wrong intervention |
|
Tao 2013. DOI: 10.1093/jamia/ocx014 |
Wrong control |
|
Mokaya 2022. DOI: 10.1186/s12966-021-01238-0 |
Wrong intervention |
|
Saffari 2014. DOI: 10.1016/j.pcd.2014.03.004 |
Wrong study designs included |
|
Sun 2019. DOI: 10.1016/j.jcjd.2018.03.010 |
Wrong study designs included |
|
Kaveh 2021. DOI: 10.1177/1357633X211052222 |
Wrong population (eerste lijn) |
|
Tao 2017. DOI: 10.1093/jamia/ocx014 |
Wrong intervention, wrong control |
|
Or 2014. DOI: 10.1016/j.ijmedinf.2014.01.009 |
Wrong intervention |
|
Buss 2020. DOI: 10.2196/21159 |
Wrong control |
|
Shrivastava 2021. DOI: 10.1177/19322968211060060 |
Wrong control |
|
Bingham 2021. DOI: 10.1177/1060028020950726 |
Wrong population |
|
Bonoto 2017. DOI: 10.2196/mhealth.6309 |
Wrong population |
|
Cao 2022. DOI: 10.1093/ajhp/zxac070 |
Wrong study designs included |
|
Enyioha 2022. DOI: 10.2196/25890 |
Wrong intervention |
|
Cotter 2014. DOI: 10.1016/j.jdiacomp.2013.07.003 |
Wrong control |
|
Joo 2016. DOI: 0.1097/CIN.0000000000000274 |
Wrong study designs included |
|
Hyun 2021. DOI: 10.1177/19322968211010153 |
Wrong population (eerste lijn) |
|
Baron 2012. DOI: 10.1177/193229681200600524 |
Wrong control |
|
Wang 2017. DOI: 10.3945/an.116.014100 |
Wrong control |
|
Lee 2018. DOI: 10.1089/dia.2018.0098 |
Wrong control |
|
Yoshida 2018. DOI: 10.1007/s11892-018-1105-2 |
Wrong control |
|
Chen 2019. DOI: 10.1111/wvn.12409 |
Wrong intervention |
|
Eberle 2021. DOI: 10.2196/20270 |
Wrong study designs included |
|
El-Gayar 2013. DOI: 10.1016/j.ijmedinf.2013.05.006 |
Wrong control |
|
McDonnell 2018. DOI: 10.1007/s11892-018-1015-3 |
Wrong study design |
|
Lepard 2015. DOI: 10.1007/s11892-015-0608-3 |
Wrong study design |
|
Toma 2014. DOI: 10.1016/j.diabres.2014.06.008 |
Wrong control |
|
Kamusheva 2021. DOI: 10.3389/fendo.2021.636959 |
Wrong population |
|
Dario 2017. DOI: 10.1089/tmj.2015.0224 |
Wrong study design |
|
Hall 2022. DOI: 10.1002/pdi.2387 |
Wrong study designs included |
|
Maiga 2021. DOI: 10.54931/2053-4787.29-S1-4 |
Wrong intervention, wrong control |
|
Chakranon 2020. DOI: 10.1111/dme.14156 |
Wrong control |
|
Nordheim 2014. DOI: 10.1186/s12913-014-0565-6 |
Same articles as Yammine (included in analysis), less recent |
|
Randomized controlled trials |
|
|
Wild 2016. DOI: 10.1371/journal.pmed.1002098 |
Publication date before last search of included SR (August 2020) |
|
Ramallo-Fariña 2020. DOI: 10.2196/18922 |
Wrong population (eerste lijn) |
|
Jia 2021. DOI: 10.1371/journal.pmed.1003754 |
Wrong population (eerste lijn) |
|
Lee 2020. DOI: 10.1007/s11606-019-05316-9 |
Publication date before August 2020 |
|
Lu 2021. DOI: 10.1089/tmj.2020.0123 |
Wrong control |
|
Steventon 2014. DOI: 10.1186/1472-6963-14-334 |
Publication date before August 2020 |
|
Jeong 2018. DOI: 10.1089/tmj.2017.0203 |
Publication date before August 2020 |
|
Parsons 2019. DOI: 10.1111/dme.13899 |
Publication date before August 2020 |
|
Maslakpak 2017. DOI: 10.1155/2017/8404328 |
Publication date before August 2020 |
|
Rasmussen 2016. DOI: 10.1177/1357633X15608984 |
Publication date before August 2020 |
|
Cho 2017. DOI: 10.1177/1357633X16657500 |
Publication date before August 2020 |
|
Zhang 2019. DOI: 10.2196/15401 |
Publication date before August 2020) |
|
Ruiz de Adana 2020. DOI: 10.2337/dc19-0739 |
Publication date before August 2020 |
|
Sarayani 2018. DOI: 10.1007/s11096-018-0593-0 |
Publication date before August 2020 |
|
Wang 2019. DOI: 10.1002/hpm.2872 |
Publication date before August 2020 |
|
Guo 2021. DOI: 10.1177/1357633X211020261 |
Wrong population (eerste lijn) |
|
Young 2020. DOI: 10.2196/16665 |
Publication date before August 2020) |
|
Greenwood 2015. DOI: 10.2196/jmir.4112 |
Publication date before August 2020 |
|
Kassavou 2020. DOI: 10.2196/16629 |
Publication date before August 2020) |
|
Iversen 2020. DOI: 10.1186/s12902-020-00637-x |
Wrong intervention |
|
Young 2014. DOI: 10.1089/tmj.2013.0326 |
Publication date before August 2020 |
|
Owolabi 2019. DOI: 10.1371/journal.pone.0224791 |
Publication date before August 2020 |
|
Egede 2021. DOI: 10.1177/1357633X211028491 |
Wrong population (eerste lijn) |
|
Kotsani 2018. DOI: 10.1016/j.ijnurstu.2018.01.003 |
Publication date before August 2020 |
|
Bertuzzi 2018. DOI: 10.1007/s00592-017-1084-9 |
Publication date before August 2020 |
|
Vinitha 2019. DOI: 10.1016/j.diabres.2019.107919 |
Publication date before August 2020 |
|
Owolabi 2020. DOI: 10.1097/MD.0000000000018953 |
Publication date before August 2020 |
|
Patnaik 2022. DOI: 10.4103/ijpvm.IJPVM_92_20 |
Wrong control |
|
Amante 2021. DOI: 10.2196/25574 |
Wong control |
|
Yaron 2019. DOI: 10.1007/s00592-019-01300-1 |
Publication date before August 2020 |
|
Fortmann 2017. DOI: 10.2337/dc17-0230 |
Publication date before August 2020) |
|
Jiang 2022. DOI: 10.1111/jan.15178 |
Wrong control |
|
Smith-Strøm 2018. DOI: 10.2337/dc17-1025 |
Publication date before August 2020) |
|
Gong 2020. DOI: 10.2196/20322 |
Wrong population (eerste lijn) |
|
Sun 2019. DOI: 10.2196/10664 |
Publication date before August 2020 |
|
Wang 2020. DOI: 10.1186/s12911-020-01129-7 |
Publication date before August 2020 |
|
Yu 2019. DOI: 10.1111/jdi.13031 |
Publication date before August 2020 |
|
Kim 2015. DOI: 10.1038/srep18214 |
Publication date before August 2020 |
|
Sood 2018. DOI: 10.1177/1357633X17704346 |
Publication date before August 2020 |
|
Frias 2017. DOI: 10.2196/jmir.7833 |
Publication date before August 2020 |
|
Egede 2017. DOI: 10.1089/dia.2017.0006 |
Publication date before August 2020 |
|
Franc 2019. DOI: 10.1111/dom.13806 |
Publication date before August 2020 |
|
Avdal 2020. DOI: 10.1016/j.jiph.2020.03.008 |
Wrong outcome measures assessed |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 10-11-2023
Beoordeeld op geldigheid : 12-10-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit ZonMW. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2023 de multidisciplinaire werkgroep van de eerdere richtlijnontwikkeling bijeengekomen, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor mensen met diabetes mellitus.
Samenstelling van de werkgroep
Werkgroep:
- Dr. P.S. van Dam, internist-endocrinoloog, OLVG Amsterdam. Nederlandse Internisten Vereniging (voorzitter).
- Dr. E. Serné, internist-vasculaire geneeskunde, Amsterdam UMC. Nederlandse Internisten Vereniging (co-voorzitter).
- Dr. T.C.J. Sas, kinderarts-endocrinoloog, Erasmus MC Rotterdam. Nederlande Vereniging voor Kindergeneeskunde.
- Dr. B.E. de Galan, internist, Maastricht UMC+ en Radboud UMC Nijmegen. Nederlandse Internisten Vereniging.
- Dr. A.C. van Bon, internist-endocrinoloog, Rijnstate Arnhem. Nederlandse Internisten Vereniging.
- Dr. H.W. de Valk, internist-endocrinoloog, UMC Utrecht. Nederlandse Internisten Vereniging.
- Mw. P.L.M. Bouhuijzen-Kooger, (kinder)diabetesverpleegkundige, St. Antonius ziekenhuis. Verpleegkundigen & Verzorgenden Nederland.
- Drs. T. Obers, beleidsmedewerker Belangenbehartiging, Diabetesvereniging Nederland.
Methodologische ondersteuning:
- Dr. J. de Groot, Senior Adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
- Dr. M.M.J. van Rooijen, Adviseur, Kennisinstituut van de Federatie Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van Dam |
internist-endocrinoloog, OLVG Amsterdam |
Geen |
Geen |
Geen restricties |
|
Serné |
internist-vasculaire geneeskunde, Amsterdam UMC |
|
Doelmatigheidsproject ZonMw betreffende behandeling patiënten met 'hypoglycemia unawareness' met 'stepped care' bestaande uit cursus HypoBewust en vervolgens eventueel continue glucose monitoring (CGM) versus directe start CGM |
Geen restricties. |
|
Sas |
kinderarts-endocrinoloog, Erasmus MC Rotterdam (0,6 fte) en Diabeter (0,4 fte) |
|
Medtronic (eigenaar Diabeter) helpt Diabeter met uitvraag naar Carelink data naar zorg evaluatie van behandeling met pomp en sensor. |
Restricties m.b.t. uitgangsvragen over glucose zelfmanagement |
|
De Galan |
internist, Maastricht UMC+ en Radboud UMC Nijmegen |
|
Onderzoek in het verleden ondersteund door Novo Nordisk (investigator initiated trial naar aanpassing van degludec bij sport, unrestricted grant, 2019-2022) Huidige ondersteuning onderzoek:
|
Geen restricties |
|
Van Bon |
internist-endocrinoloog, Rijnstate Arnhem |
Cursusleiding van DESG diabetes update (sinds 2021) en geven van nascholing technische insulinepompcursus |
Nauwe betrokkenheid bij de ontwikkeling van de kunstalvleesklier van het bedrijf lnreda Diabetic. |
Geen restricties |
|
De Valk |
internist-endocrinoloog, UMC Utrecht |
Mede-oprichter en bestuurlid Bidon stichting (diabetes onderzoek, non profit) en lid Rondetafel Diabeteszorg NDF-ZIN (NIV/BIDON) (onbetaald) |
Geen |
Geen restricties |
|
Bouhijzen |
(kinder)diabetes-verpleegkundige, St. Antonius ziekenhuis |
|
Geen |
Geen restricties |
|
Obers |
beleidsmedewerker Belangenbehartiging, Diabetesvereniging Nederland (24 u/week) Freelance Adviseur voor Goede Doelen, Groei voor Goed (16 u/week) |
Geen. |
Boegbeeldfunctie bij patiëntenorganisatie. |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een raadpleging van de achterban via de Nederlandse Diabetes Federatie; het uitnodigen van Nederlandse Diabetes Federatie, Diabetesvereniging Nederland en de Patiëntenfederatie Nederland voor de invitational conference; het houden van een focusgroep met patiënten; en een afgevaardigde van Diabetesvereniging Nederland in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvraag, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop ‘Waarden en voorkeuren van patiënten en zorgverleners – focusgroep). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Diabetesvereniging Nederland, Nederlandse Diabetes Federatie Nederland en de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de module is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodulesop verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Zorg op afstand bij Diabetes |
geen financiële gevolgen |
Er worden geen substantiële investeringen voorzien op maatschappelijk niveau. Indien extra investeringen nodig zijn, komen er naar verwachting vanuit het IZA transformatiegelden beschikbaar waarop ziekenhuizen/ zorgorganisaties aanspraak kunnen doen; het kader “kosten” wordt verder uitgewerkt in een generieke module over zorg op afstand. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekverantwoording
Algemene informatie
|
Richtlijn: Zorg op afstand |
|
|
Uitgangsvraag: |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 20-6-2022 |
|
Periode: 2012- SR 2017-RCT |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze oriënterende zoekopdracht is op een uiterst specifieke manier gezocht naar de volgende elementen:
e-health AND adults NOT Mental disease
Omdat het aantal gevonden papers groot is, is een pragmatische keuze gemaakt in het zoekblok e-health. In de zoekstrategie van Embase is in set 1 #1 in rood aangegeven op welke woorden niet is gezocht. Het definitieve zoekblok voor e-health is te vinden in set #4
Daarnaast is met specifieke SR en RCT filters de zoekstrategie verder beperkt. Omdat er alleen naar somatische ziekten gekeken wordt is het trefwoord mental disease uitgesloten van de zoekopdracht. Dat kan ook betekenen dat artikelen die zowel over somatische als mentale ziekten gaan, worden gemist. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs vanaf 2020 |
6635 |
6385 |
|
|
RCTs vanaf 2017 |
5225 |
10574 |
|
|
Observationele studies |
|
|
|
|
Overig |
|
|
|
|
Totaal |
11.860 |
16.959 |
20.429 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#16 |
#14 NOT #11 |
5225 |
|
#15 |
#11 OR #14 |
10593 |
|
#14 |
#13 NOT #10 AND [1-1-2017]/sd |
6428 |
|
#13 |
#8 AND #12 |
10511 |
|
#12 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*): ti,ab) OR rct:ti,ab,kw |
1922717 |
|
#11 |
#9 NOT #10 |
5446 |
|
#10 |
'mental disease'/exp |
2606647 |
|
#9 |
#4 AND #8 |
6635 |
|
#8 |
#7 AND [1-1-2012]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
68819 |
|
#7 |
#6 NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
130076 |
|
#6 |
'telehealth'/exp/mj OR 'telemedicine'/exp/mj OR 'telemonitoring'/exp/mj OR 'medical informatics'/exp/mj OR 'web-based intervention'/exp/mj OR 'wearable sensor'/exp/mj OR 'personal digital assistant'/exp/mj OR 'e-health':ti,ab,kw OR 'ehealth':ti,ab,kw OR telehealth:ti,ab,kw OR 'tele medicine':ti,ab,kw OR 'telemedicine':ti,ab,kw OR (((tele OR distance OR remote OR patient) NEAR/3 monitoring):ti,ab,kw) OR 'mobile app*':ti,ab,kw OR ((('clinical informat*' OR 'medical informat*' OR mobile OR health) NEAR/2 technolog*):ti,ab,kw) OR econsult*:ti,ab,kw OR 'e-consult*':ti,ab,kw OR ediagnos*:ti,ab,kw OR 'e-diagnos*':ti,ab,kw OR 'mobile-health*':ti,ab,kw OR mhealth*:ti,ab,kw OR 'm-health*':ti,ab,kw OR telehealth*:ti,ab,kw OR 'tele-health':ti,ab,kw OR telerehabilitat*:ti,ab,kw OR 'remote-consult*':ti,ab,kw OR teleconsult*:ti,ab,kw OR 'tele-consult*':ti,ab,kw OR 'video-consult*':ti,ab,kw OR videoconsult*:ti,ab,kw OR telenursing:ti,ab,kw OR (((tele OR remote OR distan*) NEAR/2 (rehabilitat* OR nurs* OR diagnos* OR medic* OR monitor* OR care OR counsel* OR consult*)):ti,ab,kw) OR telediagnos*:ti,ab,kw OR telemedic*:ti,ab,kw OR telemonitor*:ti,ab,kw OR ehealth*:ti,ab,kw OR 'e-health*':ti,ab,kw OR telecare:ti,ab,kw OR 'digital-health*':ti,ab,kw OR 'digital-intervention*':ti,ab,kw OR 'health-app*':ti,ab,kw OR telecounsel*:ti,ab,kw OR 'e-coach*':ti,ab,kw OR ecoach*:ti,ab,kw |
149450 |
|
#5 |
#3 AND #4 |
16271 |
|
#4 |
'meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de |
665433 |
|
#3 |
#2 AND [1-1-2012]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
245520 |
|
#2 |
#1 NOT (('adolescent'/exp OR 'child'/exp OR adolescent*:ti,ab,kw OR child*:ti,ab,kw OR schoolchild*:ti,ab,kw OR infant*:ti,ab,kw OR girl*:ti,ab,kw OR boy*:ti,ab,kw OR teen:ti,ab,kw OR teens:ti,ab,kw OR teenager*:ti,ab,kw OR youth*:ti,ab,kw OR pediatr*:ti,ab,kw OR paediatr*:ti,ab,kw OR puber*:ti,ab,kw) NOT ('adult'/exp OR 'aged'/exp OR 'middle aged'/exp OR adult*:ti,ab,kw OR man:ti,ab,kw OR men:ti,ab,kw OR woman:ti,ab,kw OR women:ti,ab,kw)) |
479246 |
|
#1 |
'telehealth'/exp/mj OR 'telemedicine'/exp/mj OR 'telemonitoring'/exp/mj OR 'tablet computer'/exp/mj OR 'medical informatics'/exp/mj OR 'multimedia'/exp/mj OR 'internet'/exp/mj OR 'web-based intervention'/exp/mj OR 'whatsapp'/exp/mj OR 'wearable sensor'/exp/mj OR 'personal digital assistant'/exp/mj OR 'deep learning'/exp/mj OR 'e-health':ti,ab,kw OR 'ehealth':ti,ab,kw OR telehealth:ti,ab,kw OR 'tele medicine':ti,ab,kw OR 'telemedicine':ti,ab,kw OR (((tele OR distance OR remote OR patient) NEAR/3 monitoring):ti,ab,kw) OR 'internet':ti,ab,kw OR 'world wide web':ti,ab,kw OR 'user computer interface*':ti,ab,kw OR 'user-computer interface*':ti,ab,kw OR 'multimedia':ti,ab,kw OR smartphone*:ti,ab,kw OR (((cell* OR mobile) NEAR/2 (phone* OR telephone*)):ti,ab,kw) OR 'cellphone':ti,ab,kw OR 'cellphones':ti,ab,kw OR 'mobile app*':ti,ab,kw OR ((('clinical informat*' OR 'medical informat*' OR mobile OR health) NEAR/2 technolog*):ti,ab,kw) OR 'ipad':ti,ab,kw OR 'laptop/tablet computer':ti,ab,kw OR 'tablet computer*':ti,ab,kw OR (((internet OR online OR web*) NEAR/2 intervention*):ti,ab,kw) OR 'deep learning*':ti,ab,kw OR 'hierarchical learning*':ti,ab,kw OR 'whatsapp'/exp OR whatsapp*:ti,ab,kw OR 'hand held computer*':ti,ab,kw OR 'handheld computer*':ti,ab,kw OR 'palm pc':ti,ab,kw OR 'palmtop':ti,ab,kw OR 'personal data assistant':ti,ab,kw OR 'personal digital assistant':ti,ab,kw OR 'pocket computer*':ti,ab,kw OR 'pocket-sized computer*':ti,ab,kw OR econsult*:ti,ab,kw OR 'e-consult*':ti,ab,kw OR ediagnos*:ti,ab,kw OR 'e-diagnos*':ti,ab,kw OR 'mobile-health*':ti,ab,kw OR mhealth*:ti,ab,kw OR 'm-health*':ti,ab,kw OR telehealth*:ti,ab,kw OR 'tele-health':ti,ab,kw OR 'remote-consult*':ti,ab,kw OR teleconsult*:ti,ab,kw OR 'tele-consult*':ti,ab,kw OR 'video-consult*':ti,ab,kw OR videoconsult*:ti,ab,kw OR telenursing:ti,ab,kw OR (((tele OR remote OR distan*) NEAR/2 (nurs* OR diagnos* OR medic* OR monitor* OR care OR counsel* OR consult*)):ti,ab,kw) OR telediagnos*:ti,ab,kw OR telemedic*:ti,ab,kw OR telemonitor*:ti,ab,kw OR ehealth*:ti,ab,kw OR 'e-health*':ti,ab,kw OR telecare:ti,ab,kw OR 'digital-health*':ti,ab,kw OR 'digital-intervention*':ti,ab,kw OR app:ti,ab,kw OR apps:ti,ab,kw OR 'telephone app*':ti,ab,kw OR 'mobile-app*':ti,ab,kw OR 'health-app*':ti,ab,kw OR internet*:ti,ab,kw OR 'world-wide-web*':ti,ab,kw OR website*:ti,ab,kw OR webportal*:ti,ab,kw OR 'web-portal*':ti,ab,kw OR 'patient-portal*':ti,ab,kw OR ipad:ti,ab,kw OR ipads:ti,ab,kw OR 'i-pad*':ti,ab,kw OR ussd:ti,ab,kw OR pda:ti,ab,kw OR laptop*:ti,ab,kw OR palmtop*:ti,ab,kw OR 'palm-top*':ti,ab,kw OR telecounsel*:ti,ab,kw OR 'interactive voice response*':ti,ab,kw OR multimedia:ti,ab,kw OR iphone*:ti,ab,kw OR 'i-phone*':ti,ab,kw OR android:ti,ab,kw OR game:ti,ab,kw OR games:ti,ab,kw OR gaming:ti,ab,kw OR gamification:ti,ab,kw OR 'e-coach*':ti,ab,kw OR ecoach*:ti,ab,kw OR wearable*:ti,ab,kw OR 'social-media':ti,ab,kw OR 'online-social-network*':ti,ab,kw OR facebook:ti,ab,kw OR exergam*:ti,ab,kw OR 'serious-gam*':ti,ab,kw |
522933 |
Ovid/Medline
|
# |
Searches |
Results |
|
14 |
13 not 8 |
10574 |
|
13 |
12 not 7 |
12118 |
|
12 |
11 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
13332 |
|
11 |
9 and 10 |
13484 |
|
10 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1384513 |
|
9 |
limit 2 to yr="2017 -Current" |
103311 |
|
8 |
6 not 7 |
6385 |
|
7 |
exp Mental Disorders/ |
1378233 |
|
6 |
4 and 5 |
6933 |
|
5 |
meta-analysis/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. |
365731 |
|
4 |
3 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
162889 |
|
3 |
limit 2 to yr="2012 -Current" |
175489 |
|
2 |
1 not ((Adolescent/ or Child/ or Infant/ or adolescen*.ti,ab,kf. or child*.ti,ab,kf. or schoolchild*.ti,ab,kf. or infant*.ti,ab,kf. or girl*.ti,ab,kf. or boy*.ti,ab,kf. or teen.ti,ab,kf. or teens.ti,ab,kf. or teenager*.ti,ab,kf. or youth*.ti,ab,kf. or pediatr*.ti,ab,kf. or paediatr*.ti,ab,kf. or puber*.ti,ab,kf.) not (Adult/ or adult*.ti,ab,kf. or man.ti,ab,kf. or men.ti,ab,kf. or woman.ti,ab,kf. or women.ti,ab,kf.)) |
326408 |
|
1 |
exp *Telemedicine/ or exp *Medical Informatics/ or *Internet-Based Intervention/ or exp *Wearable Electronic Devices/ or e-health.ti,ab,kf. or ehealth.ti,ab,kf. or telehealth.ti,ab,kf. or tele medicine.ti,ab,kf. or telemedicine.ti,ab,kf. or ((tele or distance or remote or patient) adj3 monitoring).ti,ab,kf. or mobile app*.ti,ab,kf. or ((clinical informat* or medical informat* or mobile or health) adj2 technolog*).ti,ab,kf. or econsult*.ti,ab,kf. or e-consult*.ti,ab,kf. or ediagnos*.ti,ab,kf. or e-diagnos*.ti,ab,kf. or mobile-health*.ti,ab,kf. or mhealth*.ti,ab,kf. or m-health*.ti,ab,kf. or telehealth*.ti,ab,kf. or tele-health.ti,ab,kf. or telerehabilitat*.ti,ab,kf. or remote-consult*.ti,ab,kf. or teleconsult*.ti,ab,kf. or tele-consult*.ti,ab,kf. or video-consult*.ti,ab,kf. or videoconsult*.ti,ab,kf. or telenursing.ti,ab,kf. or ((tele or remote or distan*) adj2 (rehabilitat* or nurs* or diagnos* or medic* or monitor* or care or counsel* or consult*)).ti,ab,kf. or telediagnos*.ti,ab,kf. or telemedic*.ti,ab,kf. or telemonitor*.ti,ab,kf. or ehealth*.ti,ab,kf. or e-health*.ti,ab,kf. or telecare.ti,ab,kf. or digital-health*.ti,ab,kf. or digital-intervention*.ti,ab,kf. or health-app*.ti,ab,kf. or telecounsel*.ti,ab,kf. or e-coach*.ti,ab,kf. or ecoach*.ti,ab,kf. |
343920 |