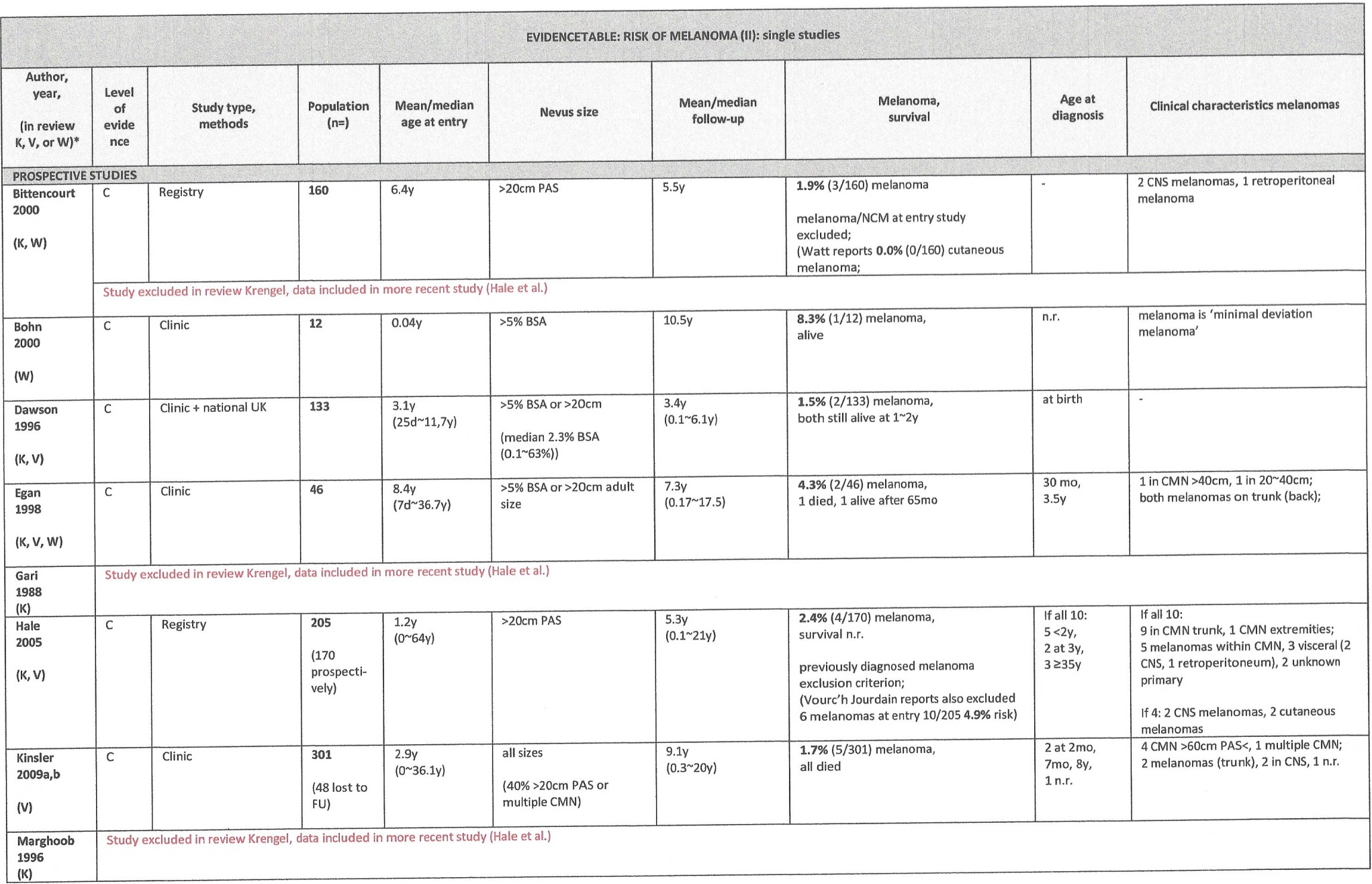
Invasieve behandelingen bij CMN
Uitgangsvraag
Is excisie (chirurgie) veilig en effectief voor de behandeling van congenitale naevi?
Welke van de excisie/reconstructie technieken kan het beste worden toegepast?
Zijn superficiële therapieën veilig en effectief voor de behandeling van congenitale naevi?
Aanbeveling
‘Full thickness’ behandeling
Sluitingstechnieken
Op basis van de huidige literatuur (onvoldoende gegevens) kan geen wetenschappelijke uitspraak worden gedaan over het cosmetisch resultaat en het risico op complicaties van de verschillende technieken van excisie en reconstructie. In het algemeen is te verwachten dat een primaire sluiting of een rotatie lap (na bijv. ‘tissue expansion’) een beter cosmetisch resultaat zal geven dan bij het plaatsen van een huidtransplantatie.
De werkgroep acht het van belang dat de mogelijk complexe ingrepen worden verricht door chirurgen met ervaring in de kinder plastische chirurgie.
Keuze sluitingstechniek bij excisie
Geen enkele van de huidige chirurgische technieken is geschikt voor álle CMN. Welke techniek van sluiting wordt toegepast is in grote mate afhankelijk van:
- grootte van de CMN
- lokalisatie van de CMN
- ervaring van de chirurg
(Seriële) excisie met primaire sluiting heeft in principe de voorkeur bij het verwijderen van CMN, mits de grootte en lokalisatie dit toelaten. Bij grotere CMN en specifieke lokalisaties geeft een combinatie van reconstructietechnieken een beter resultaat, voor een leidraad zie tabel 2.
‘Partial thickness’ behandeling
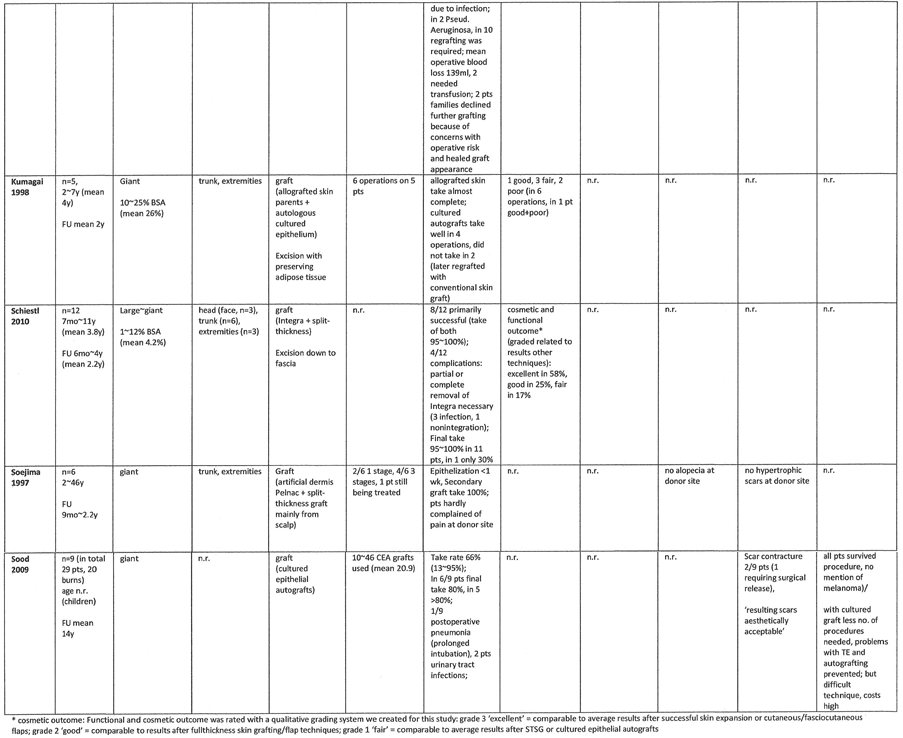
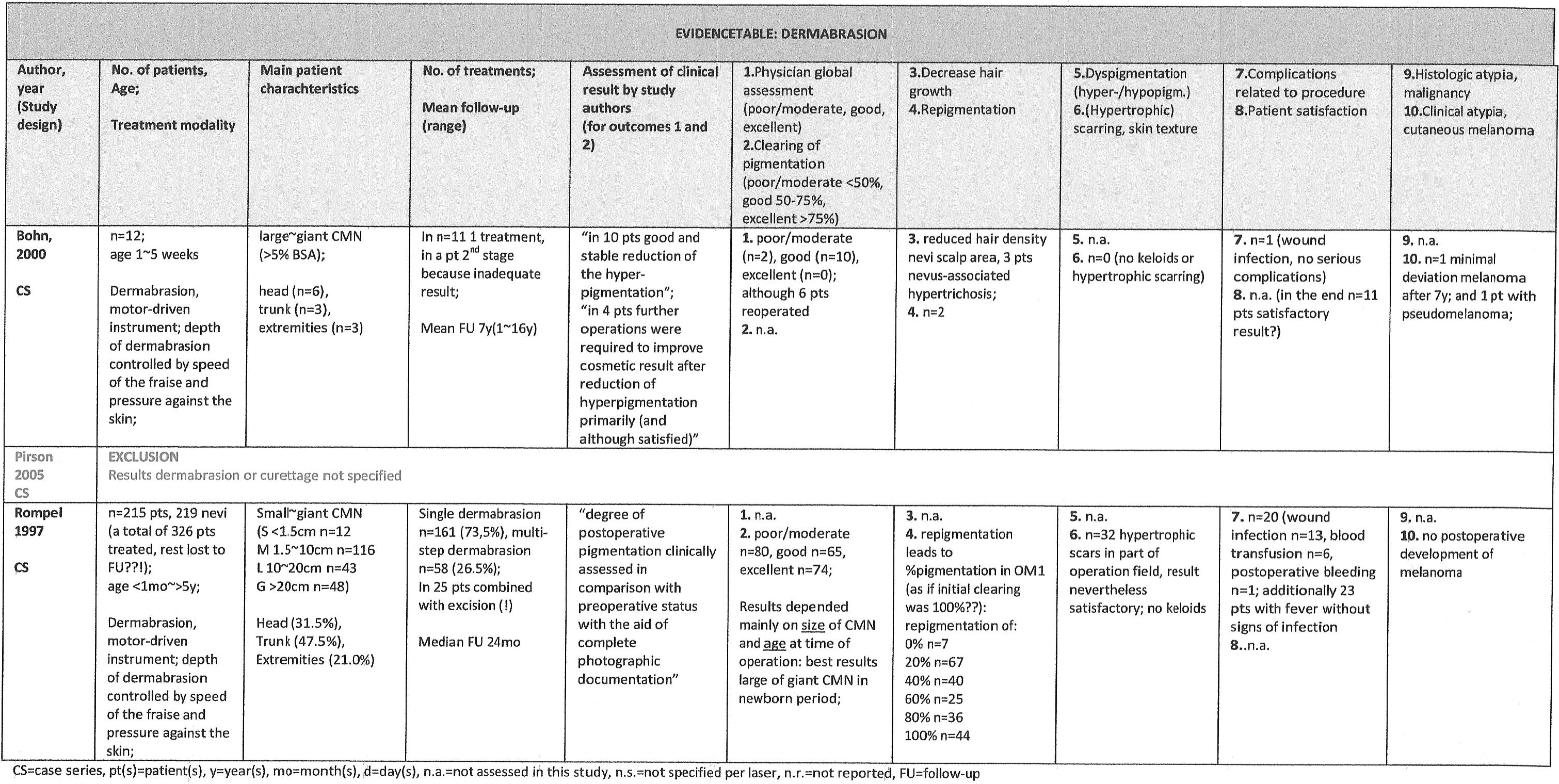
Dermabrasie en curettage
De werkgroep is van mening dat in alleen ervaren handen, de toepassing van dermabrasie en curettage kan worden overwogen in grotere CMN, zich niet bevindend op het behaarde hoofd. Het cosmetisch resultaat van deze technieken wordt beïnvloed door de repigmentatie die bij vrijwel iedereen optreedt. Van belang is zich te realiseren dat met deze technieken een groot wondoppervlak wordt gecreëerd, en dat het postoperatieve beloop intens is (o.a. pijn, risico op infectie).
De werkgroep adviseert als voorkeursleeftijd voor de toepassing van curettage de leeftijd van 1~3 maanden na de geboorte. Curettage op latere leeftijd is wellicht mogelijk maar is op basis van praktijkervaring beduidend lastiger en geeft daarmee cosmetisch minder goed resultaat.
De werkgroep heeft geen voorkeur als leeftijd voor de toepassing van dermabrasie, tenzij dermabrasie als vervanging van curettage wordt gezien (dan ook de leeftijd van 1~3 maanden).
Na toepassing van deze technieken is nauwe follow-up postoperatief essentieel voor het bereiken en behouden van optimale wondcondities, en op de langere termijn vanwege een blijvend risico op melanoom.
Lasertherapie en ‘Intense pulsed light’ (IPL) therapie
De werkgroep acht een vermeend verhoogd maligniteitsrisico mogelijk geïnduceerd door laserbehandeling van CMN niet bewezen. Frequente herhaling van laserbehandelingen van CMN acht de werkgroep echter niet wenselijk.
Hoewel de resultaten van lasertherapie bij CMN wisselend en lastig te voorspellen zijn, is de werkgroep van mening dat in de handen van een ervaren expert lasertherapie effectief en veilig kan worden toegepast bij CMN op cosmetisch kwetsbare lokalisaties of bij CMN die te groot zijn om met excisie te verwijderen.
Ter behandeling van (donkere) hypertrichosis kan lasertherapie of ‘Intense Pulsed Light’ therapie een oplossing bieden.
Na toepassing van deze technieken is nauwe follow-up postoperatief essentieel voor het bereiken en behouden van optimale wondcondities, en op de langere termijn vanwege een blijvend risico op melanoom.
Bij voorkeur wordt behandeling met superficiële technieken toegepast binnen landelijk onderzoek, gecoördineerd vanuit een expertisecentrum.
Overwegingen
‘Full thickness’ behandeling
Sluitingstechnieken
Dat er weinig studies over chirurgie bij CMN zijn geïdentificeerd hangt samen met de zeldzaamheid van de aandoening en daarbij het selectiecriterium dat resultaten voor CMN apart en per techniek apart dienen te zijn beschreven. Er zijn daarnaast veel ‘expert opinion’ publicaties verschenen, deze konden niet worden geïncludeerd. Ondanks de beperkte literatuur is de werkgroep van mening dat wanneer de verwijdering van een CMN geindiceerd is, excisie de gouden standaard is en blijft [zie de module ‘Leidraad chirurgische behandeling van CMN’]
Na excisie kan na volledige verwijdering repigmentatie optreden rondom het litteken, zelfs als de snijranden vrij waren van pigmentatie. Ook huidtransplantaten kunnen repigmenteren. Dit heeft consequenties voor het cosmetisch resultaat. Er is nog geen duidelijke histologische verklaring voor deze (‘fysiologische’) repigmentatie. (Re)pigmentatie wordt ook gezien na ingrepen waarbij de excisie van naevuscellen geen rol speelt, bijv. na reconstructies bij brandwond patiënten of na huidtransplantatie na het verwijderen van een basaalcelcarcinoom.
Daarnaast bestaat er een restrisico op een pathologisch ‘recidief’. Voorheen werd gedacht dat na excisie het risico op cutaan melanoom in feite nul was. Vanwege de repigmentatie blijft echter een (klein) maligniteitsrisico bestaan. Daarnaast kunnen in uitgebreidere CMN mogelijk niet alle naevuscellen in de diepte worden verwijderd, deze kunnen zeer diep infiltreren [zie de module ‘Achtergrond van CMN’]. Men spreekt bij excisie daarom van ‘hoogst haalbare’ verwijdering van naevuscellen. Verder kan het zo zijn dat een grotere CMN niet in zijn volledige omvang met exicisie kan worden verwijderd (te groot). In kleinere CMN wordt meestal wel volledige excisie bereikt (zowel diepte als omvang).
Of primaire sluiting kan en in hoeveel etappes is met name afhankelijk van de grootte en ook lokalisatie van de CMN. Veel tractie aan de wond geeft risico op wonddehiscentie en een verwijding van het litteken, de meest voorkomende complicaties bij primaire sluiting. Hiermee dient rekening te worden gehouden bij de keuze van het aantal etappes. Op basis van de studies kan niet worden gezegd tot welke grootte primaire sluiting nog volstaat.
De belangrijkste complicaties die bij ‘tissue expansion’ kunnen optreden zijn:
- failure van de expanders (met vroegtijdige verwijdering tot gevolg bijv door lekken), exposure/extrusie (necrose van de overliggende huid),
- bloeding, infectie, pijn
- wonddehiscentie
Complicaties treden frequent op en ingrepen moeten daarom liefst door een chirurg met ervaring met tissue expansie worden gedaan. Bij de toepassing van ‘tissue expansion’ is overexpansie erg belangrijk, bij onvoldoende expansie komt er namelijk snel contractie met wonddehiscentie en littekens tot gevolg. Het beste hierbij is vaker re-expansie toe te passen. De beste leeftijd voor ‘tissue expansion’ is onder de leeftijd van 4 jaar vanwege de grootste rekbaarheid van de huid op jonge leeftijd. Er bestaat soms angst voor de toepassing van expanders op het hoofd op jonge leeftijd vanwege de kans op indeuking van de (weke) schedel. In studies is beschreven dat inderdaad erosie wordt gezien, maar deze zich later restloos herstelt (bewezen met CT-onderzoek) [El-Saadi 2007, Collorio 1997].
Voor een succesvolle huidtransplantatie is een adequate ingroei van de huidtransplantatie (zogenaamde ‘graft take’) nodig van tenminste 95%. Van ‘split-skin’ grafts is bekend dat ze slecht genezen, een slechte take hebben, zeker over een groot gebied. In het algemeen is daarom het gebruik van volle dikte transplantaten (‘full-thickness’ graft) te preferen boven ‘split-skin’ grafts, deze geven een beter cosmetisch resultaat. Bij huidtransplantaten geldt extra dat tevens op de donorplaats waar huid afgenomen wordt littekenvorming/complicaties kunnen optreden. Ook rondom het huidtransplantaat ontstaat littekenvorming, en de kleur van het huidtransplantaat kan afwijkend zijn van de omliggende huid. In reuze CMN is vanwege vele satellietnaevi en/of de het grote oppervlak dat nodig is soms weinig donorhuid beschikbaar. In die gevallen kan gekweekte huid (cultured epithelial graft) wellicht een oplossing bieden, Voor ervaringen met huidtransplantatie kan worden gekeken naar de ervaringen in de brandwondenchirurgie.
‘Partial thickness’ behandeling
Dermabrasie en curettage
Hoewel geen betrouwbare resultaten t.a.v. cosmetisch resultaat uit de literatuur kunnen worden verkregen, is de beleving onder de experts uit de werkgroep dat zowel currettage als dermabrasie een redelijk tot goed cosmetisch resultaat geeft bij een deel van de patiënten. Repigmentatie wordt veel gezien, en het cosmetisch resultaat lijkt met het vorderen van de leeftijd af te nemen.
Curettage is een minder traumatische techniek dan dermabrasie (minder bloedverlies), waarbij een groter oppervlak kan worden behandeld en minder sessies nodig zijn. Echter, ook de impact van curettage moet niet worden onderschat. Voor beide technieken geldt in de behandeling van reuze CMN dat een relatief groot en soms diep wondoppervlak wordt gecreëerd. Re-epithelialisatie duurt 1~2 weken, het postoperatieve beloop is vaak pijnlijk en er dreigt infectierisico. Adequate wondverzorging postoperatief is essentieel. Neonaten verblijven postoperatief enkele dagen op de Medium of Intensive Care. Ouders ervaren dit als een heftige periode.
Voor alle oppervlakkige therapieën geldt: te oppervlakkige behandeling resulteert in minder pigmentreductie en een hoger risico op repigmentatie, te diepe behandeling in een hoger risico op (hypertrofische) littekenvorming. Bij m.n. dermabrasie (slijptol) is er matige controle over de diepte van behandeling. Met curettage blijft men oppervlakkiger. Voor m.n. curettage geldt dat behandeling van zeer donkere, verdikte en/of CMN met veel hypertrichose moeizaam is [Zaal 2008]. Bovendien gaat behandeling van de randen van CMN met curettage lastiger (waarschijnlijk door ontbreken klievingsvlak), Behandeling met deze superficiële technieken van kleinere CMN lijkt een slechter cosmetisch resultaat te geven dan grotere. Dit heeft mogelijk te maken met een andere histologische verdeling van naevuscellen in kleinere CMN. Mogelijk is hierbij ook leeftijd van behandeling een confounder (kleinere CMN in deze studies vaker op latere leeftijd behandeld).
Geen enkele techniek heeft in principe effect op de haarfollikels (dieper gelegen), dus ook niet op de hypertrichose in een CMN. Deze blijft dus bestaan. Pigment rondom de haarfollikels kan voor repigmentatie zorgen, vaker bij patiënten met hypertrichose. Behandeling met dermabrasie/curettage van lokalisaties met gewénste lichaamsbeharing (wenkbrauw, behaarde hoofd) lijkt minder geschikt vanwege een reëel risico op cicatriciële alopecie.
Of het toepassen van deze technieken alleen op zeer jonge leeftijd mogelijk is, tot welke leeftijd en of het uitmaakt voor het cosmetisch resultaat is in de literatuur in feite niet bekend. Zeer beperkte data in de literatuur suggereren tevens dat CMN behandeld met dermabrasie of curettage na de eerste levensweken een slechter cosmetisch resultaat geven [Rompel 1997, Moss 1987].
De werkgroep zet kanttekeningen bij het op zeer jonge leeftijd (<2 weken) behandelen van neonaten, vanwege de korte bedenktijd voor de ouders en de forse impact van de behandeling (groot wondoppervlak). Voor de toepassing van dermabrasie lijkt de aanwezigheid van het klievingsvlak minder essentieel, voor de toepassing van curettage is dit op basis van ervaring wel zeker van belang.
De werkgroep is daarom van mening dat de beste leeftijd voor curettage 1~3 maanden is. Met dermabrasie kan ook worden gewacht, de beste leeftijd voor behandeling met dermabrasie is niet bekend.
Residuale naevuscellen kunnen mogelijk ontaarden in een melanoom. Dit is ook beschreven in de literatuur [Bohn 2000, Dragieva 2006, Cutt 2003, Hori 1989], evenals het optreden van ‘pseudomelanoom’ [Bohn 2000, Zitelli 1984]. Dit fenomeen wordt vaker beschreven na superficiële verwijderingstechnieken waarbij naevuscellen in het wondbed achterblijven, en wordt gezien als een benigne laesie [Lee 2006]. In principe is een CMN na deze behandelingen goed te vervolgen op het ontstaan van melanoom, omdat de bovenlaag lichter is.
Lasertherapie en ‘Intense pulsed light’ (IPL) therapie
Lasertherapie
Onder Nederlandse dermatologen is/was er terughoudendheid met lasertherapie bij CMN [Zaal 2008]. Belangrijke reden is de angst voor een mogelijk mutageen effect: door herhaaldelijke (thermische) schade die wordt toegebracht met laser en daardoor mogelijk herhaaldelijke reactivatie van de dieper gelegen naevuscellen (chronische irritatie van de huid). In in-vitro studies wordt een mogelijk mutageen effect beschreven [Zhu 1999, van Leeuwen 1996, Hall 1995], de resultaten zijn echter wisselend en niet bevestigd in in-vivo studies. Melanoom is beschreven na lasertherapie bij andere pigmentlaesies [Larsen 2013, Gottschaller 2006, Woodrow 2003], het is echter ook mogelijk dat in deze casus voor behandeling maligniteit is gemist. Tevens wordt regelmatig ‘pseudomelanoom’ na lasertherapie beschreven. Dit wordt echter gezien als een benigne vorm van recurrence, histologisch lijkt pseudomelanoom op het superficieel spreidend melanoom [Lee 2006, Dummer 1998, Trau 1986]. De werkgroep acht op basis van de bestudeerde literatuur het risico op het ontwikkelen van melanoom door lasertherapie gering.
Een andere reden voor terughoudendheid met laserbehandeling waren de wisselende resultaten van lasertherapie bij CMN, o.a. veel repigmentatie en soms ook littekenvorming. Er zijn veel verschillende lasermodaliteiten en –combinaties toegepast bij CMN (20 in 24 studies). Op basis van de huidige literatuur kan geen uitspraak worden gedaan welke modaliteit de voorkeur heeft bij CMN, hiervoor zijn prospectieve studies (liefst gerandomiseerd) nodig.
Over behandeling van hypertrichose bij CMN met lasers is te weinig bekend in de literatuur om hier een uitspraak over te kunnen doen. In theorie zijn pigment-specifieke lasers met lange pulsduur en IPL geschikt om de haren te verwijderen, Of er hierbij ook een effect op de CMN (vermindering van melanocyten) is hangt af van de instellingen van deze lasers. Een direct mutageen effect is afwezig maar er is ook hierbij sprake van herhaaldelijke thermische schade. Met name over IPL behandeling is geen zekere uitspraak mogelijk omdat er in de literatuur niet is gekeken naar de effecten van IPL op de CMN. Voor (permanente) ontharing zijn meerdere behandelingen nodig, die afhankelijk van de grootte van het te behandelen oppervlak langer dan een uur kunnen duren. De werkgroep is van mening dat bij patiënten waarbij alléén ontharing gewenst is en hier een duidelijke indicatie voor bestaat (bijvoorbeeld bij recidiverende folliculitiden of zwaarwegende cosmetische redenen waarbij de hypertrichose het meest storend is), pigment-specifieke lasers met lange pulsduur of IPL een optie kan zijn. Hierbij is het van belang dat deze behandelingen in een ervaren centrum gebeuren, en follow-up door een dermatoloog gewaarborgd is gezien de onzekere effecten op de CMN.
In feite gelden dezelfde overwegingen voor ablatieve lasertherapie als voor de andere non-specifieke technieken (dermabrasie en curettage) qua diepte van behandeling en wondoppervlak. Ostertag et al. melden wel in hun discussie dat grotere CMN behandeld met Er:YAG een kortere genezingsduur hebben dan na curettage en dermabrasie. Van behandeling met CO2 laser is dit niet bekend, maar ook niet te verwachten vanwege de grotere thermische schade van CO2 lasers. Lasertherapie met pigment-specifieke lasers is absoluut minder traumatisch omdat niet-gepigmenteerd weefsel gespaard blijft, deze werken specifieker op melanine-houdende structuren, maar gaan ook minder diep.
Laserbehandeling van CMN is op alle leeftijden onderzocht. Theoretisch is lasertherapie op alle leeftijden effectief. Het is niet uit de literatuur op te maken of leeftijd van behandeling uitmaakt voor het cosmetisch resultaat. Mogelijk kan in grotere CMN ook met lasertherapie in de eerste levensweken een beter resultaat bereikt worden, maar dit moet nog bewezen worden.
Onderbouwing
Achtergrond
‘Full thickness’ behandeling
‘Full-thickness’ chirurgische behandeling van CMN houdt in adequate (seriële) excisie, met juist gebruik van reconstructieve methoden. Indien primaire sluiting niet mogelijk is, bv. vanwege de grootte van het verwachte huiddefect, kunnen ingrepen soms vooraf gegaan worden door ‘tissue expansion’ met opschuiven van een locoregionale flap, en/of gevolgd worden door een huidtransplantaat (‘skin graft’).
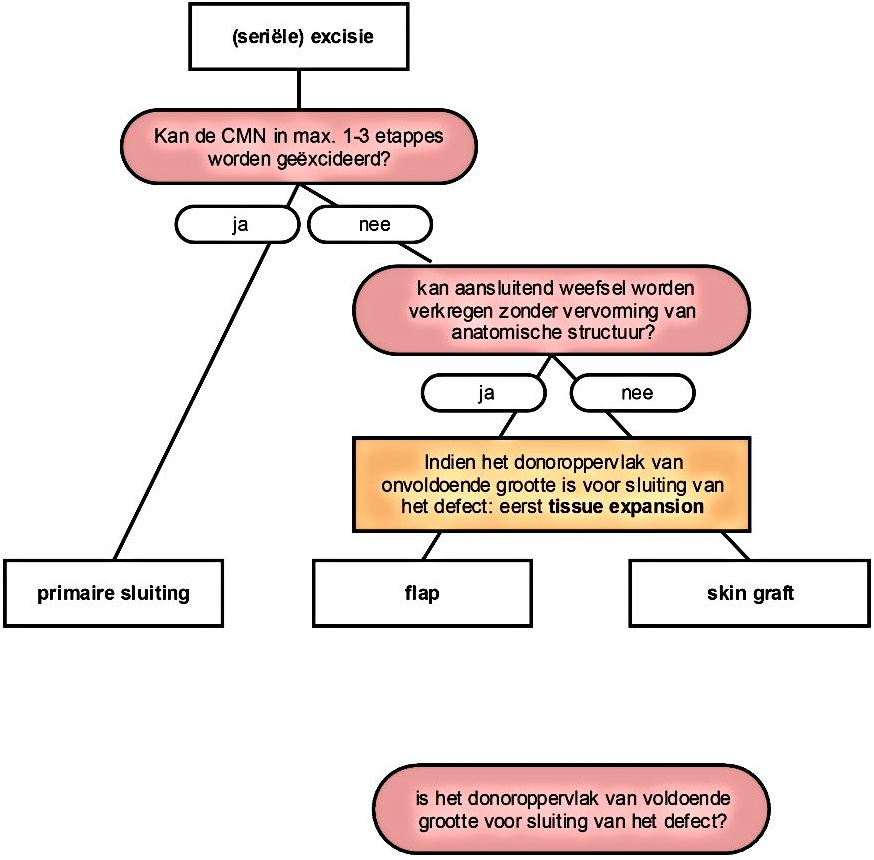 Fig. 1: Algoritme keuze sluiting na (seriële) excisie [afgeleid van: Gosain 1999];
Fig. 1: Algoritme keuze sluiting na (seriële) excisie [afgeleid van: Gosain 1999];
‘Partial thickness’ behandeling
In CMN bevinden de meeste naevuscellen zich in de superficiële dermis. Met ‘partial thickness’, oftewel superficiële technieken worden (naevuscellen in) de oppervlakkigere huidlagen verwijderd. Deze technieken geven daarmee een forse reductie van de load aan naevuscellen (ongeveer 70%), echter er blijven naevuscellen achter in de reticulaire dermis of het subcutane vlak. Vanuit profylactisch oogpunt (voorkomen van cutaan melanoom) zijn deze technieken daarom in feite onbevredigend. Vanuit esthestisch oogpunt zijn ze echter mogelijk wel geschikt. Bovendien is volledige excisie van grotere naevi niet altijd mogelijk, geeft dit op sommige lokalisaties esthetische of functionele problemen, en is ook hierbij niet bewezen dat dit zeker het optreden van melanoom voorkomt.
In deze paragraaf worden de resultaten van de gangbare oppervlakkige technieken toegepast bij CMN uiteengezet. Chemical peeling, cryotherapie en shaving blijven in deze richtlijn buiten beschouwing vanwege gebrek aan literatuur.
Dermabrasie en curettage
Dermabrasie en curettage werden toegepast bij CMN n.a.v. de bevinding van Johnson in 1977: bij toeval bleek na een bevalling met forceps een deel van een CMN op de behaarde hoofdhuid van een pasgeborene verwijderd, die spontaan genas zonder littekenvorming of repigmentatie [Johnson 1977]. Op basis hiervan werden de resterende delen van de CMN met dermabrasie behandeld, die ook niet repigmenteerden. In 1987 presenteerde Moss als eerste curettage van CMN [Moss 1987].

Fig. 2: Instrumenten voor het verrichten van dermabrasie of curettage; A. slijptol (mechanische frees) voor dermabrasie; B. scherpe curette voor curettage [bron: www.intechopen.com; sites.psu.edu]
Dermabrasie wordt verricht met behulp van een mechanisch apparaat (slijptol), curettage met behulp van een curette (bij CMN meestal scherpe curette) [zie fig. 2]. Met dermabrasie worden meerdere dunne lagen van de huid weg ‘geslepen’, totdat de dermis zonder zichtbare pigmentatie is. Dit is een vrij aggressieve procedure. Curettage werd geïntroduceerd als relatief simpele verwijderingstechniek (goedkoop instrument), en nauwkeuriger en minder traumatisch dan dermabrasie (minder bloedverlies).
Bij curettage wordt gebruik gemaakt van een verschil in dichtheid van naevuscellen tussen de superficiële (hoge dichtheid) en diepe dermis (lage dichtheid), waardoor deze oppervlakkige laag relatief makkelijk kan worden losgemaakt. Dit klievingsvlak zou alleen op zeer jonge leeftijd bestaan, de hypothese is dat deze met het toenemen van de leeftijd verdwijnt doordat huidstructuren compacter opeen komen en naevuscellen migreren naar de diepe dermis, dit is echter niet bewezen.
Fig. 3: Verdeling naevuscellen in de huid [bron: Kishi 2010]
Lasertherapie en ‘Intense pulsed light’ (IPL) therapie
Laser therapie wordt toegepast bij diverse pigmentstoornissen, en wordt ook toegepast bij CMN. Laser therapie bij CMN kan worden gecategoriseerd als aspecifiek (ablatieve/verdampende lasers) of specifiek (pigment-selectieve lasers), soms worden ook combinaties toegepast. De infrarood straling van de ablatieve lasers (CO2 laser, Erbium:YAG laser) wordt goed opgenomen door water, waar een groot deel van de huid uit bestaat. Deze lasers kunnen niet-selectief een gehele laag van de huid en de laesie verwijderen, en zijn daarmee vergelijkbaar met andere non-specifieke mechanische verwijderingsmethoden zoals dermabrasie en curettage. Een belangrijk verschil tussen de ablatieve laser en mechanische verwijderingsmethoden is de mogelijkheid om de ablatiediepte exact in te stellen. Tevens ontstaat bij ablatieve laser thermische schade in het wondbed, Deze thermische schade geeft verminderd bloedverlies,maar kan anderzijds ook de kans op littekenvorming verhogen. Pigment-selectieve lasers (o.a. robijn laser, alexandriet laser, Neodynium:YAG lasers) zorgen voor selectieve schade aan celstructuren die melanine bevatten, met minimale schade aan het omliggende weefsel. Er bestaan twee soorten pigment-selectieve lasers; lasers met een zeer korte pulsduur (‘Q-switched’ lasers, picoseconden lasers) die middels een fotoakoestische interactie de pigmentcellen verwijderen, en lasers met een lange pulsduur (‘normal mode’ lasers) die middels een fotothermische interactie de pigmentcellen verwijderen. Pigment-selectieve lasers met een korte pulsduur (nanoseconden tot picoseconden) hebben primair pigmenthoudende celorganellen zoals melanosomen als doel terwijl pigment-selectieve lasers met langere pulsduur gericht zijn tegen grotere gepigmenteerde structuren zoals haren. Deze lasers kunnen ook worden gebruikt als ontharingslaser.
‘Intense Pulsed Light’ (IPL) therapie is een behandeling met een spectrum aan electromagnetische straling puur gericht op ontharing, de energie richt zich alleen op het haarzakje.
Conclusies / Summary of Findings
‘Full thickness’ behandeling
Sluitingstechnieken
|
Niveau 4 |
Er is slechts weinig, weinig betrouwbare, en zeer heterogene literatuur (patiëntkenmerken) die de resultaten van excisie van CMN beschrijven. Op basis van de literatuur kan geen betrouwbare uitspraak worden gedaan over cosmetisch resultaat en veiligheid van de technieken. Wel is de tevredenheid van excisie bij CMN over het algemeen goed (90~95%), met name bij kleinere CMN. In grotere CMN neemt de tevredenheid af. Ook dit is echter gebaseerd op weinig objectieve uitkomsten.
D mening werkgroep |
|
Niveau 3 |
Het risico op specifiek ‘tissue expander’-gerelateerde complicaties lijkt ongeveer rond de 10-12% te liggen (percentage van de gebruikte expanders), met name door infectie en exposure (huidnecrose).
C Fahmy 2010, Zaal 2009, Adler 2009, Bauer 2001 |
‘Partial thickness’ behandeling
Dermabrasie en curettage
|
Niveau 3 |
Met dermabrasie en curettage kunnen de epidermis en het oppervlakkige deel van de dermis worden verwijderd. De diepe dermis inclusief de haarfollikels blijft intact.
C Bohn 2000, Rompel 1997 C Gatibelza 2013, Rasmussen 2013, Zaal 2008, De Raeve 2002, Michel 2000, De Mey 1992, Moss 1987 |
|
Niveau 3 |
Dermabrasie en curettage zijn met name beschreven in de behandeling van grotere CMN (grote~reuze CMN) te groot om met excisie te verwijderen. Tevens is de behandeling met m.n. dermabrasie van kleinere CMN (kleine~middelgrote) op cosmetisch kwetsbare lokalisaties onderzocht.
C Bohn 2000, Rompel 1997 C Gatibelza 2013, Rasmussen 2013, Zaal 2008, De Raeve 2002, Michel 2000, De Mey 1992, Moss 1987 |
|
Niveau 3
|
Curettage van CMN wordt in de literatuur alleen toegepast in de eerste levensweken (1~8 weken), dermabrasie ook op latere leeftijd.
C Bohn 2000, Rompel 1997 C Gatibelza 2013, Rasmussen 2013, Zaal 2008, De Raeve 2002, Michel 2000, De Mey 1992, Moss 1987 |
|
Niveau 3
|
Ten aanzien van zowel curettage als dermabrasie wordt in de beperkte literatuur gemeld dat dit met het toenemen van de leeftijd (na de eerste levensweken) moeizamer gaat.
C Gatibelza 2013, de Raeve 2002, Moss 1987 C Rompel 1997 |
|
Niveau 4 |
Er is slechts weinig, en weinig betrouwbare literatuur beschikbaar over de toepassing van dermabrasie en curettage bij CMN. De algehele kwaliteit van de studies werd volgens de GRADE-methode beoordeeld als ‘very low’, met name door kleine patiëntaantallen en een hoog risico op (selectie)bias in de studies. Tevens zijn de resultaten in vrijwel geen enkele studie op objectieve wijze of middels gevalideerde meetinstrumenten vastgesteld, bij heterogene en onduidelijke follow-up duur.
D mening werkgroep |
|
Niveau 4 |
Op basis van de huidige literatuur kan geen betrouwbare uitspraak worden gedaan over cosmetisch resultaat en veiligheid (complicaties en risico op melanoom) van dermabrasie en curettage bij CMN. In het algemeen wordt vermindering van pigment verkregen met gedeeltelijke repigmentatie als laat resultaat. Dat beïnvloedt de cosmetische uitkomst.
D mening werkgroep |
Lasertherapie en ‘Intense pulsed light’ (IPL) therapie
Lasertherapie
|
Niveau 3 |
Lasertherapie is in CMN van alle groottes toegepast, met name bij kleinere CMN op cosmetische kwetsbare lokalisaties en in CMN te groot om met excisie te verwijderen.
C Lee 2015, Al-Hadithy 2012, Funayama 2012, August 2011, Minakawa 2011, Kishi 2009, Helsing 2006, Mandal 2006, Ostertag 2006, Chong 2005, Horner 2005, Kim 2005, Kono 2005, Downs 2004, Sohn 2004, Reynolds 2003, Michel 2001, Park 2001, Imayama 1999, Waldorf 1996 |
|
Niveau 3 |
Er zijn relatief veel Aziatische studies gepubliceerd over lasertherapie bij CMN (10/24, 42%). De resultaten uit de Aziatische studies kunnen mogelijk niet direct geëxtrapoleerd worden naar de Kaukasische bevolking. Reden is het verschil in huidtype, met daaraan gerelateerd een hoger risico op dyspigmentatie na laserbehandeling en een lager algeheel risico op melanoom in Aziaten.
C Lee 2015, Funayama 2012, Minakawa 2011, Kishi 2009, Chong 2005, Kim 2005, Kono 2005, Sohn 2004, Kono 2002, Park 2001 D Chan 2002 |
|
Niveau 4 |
Er is slechts weinig, en weinig betrouwbare literatuur beschikbaar over de toepassing van lasertherapie bij CMN. De algehele kwaliteit van de studies werd volgens de GRADE-methode beoordeeld als ‘very low’, met name door kleine patiëntaantallen en een hoog risico op (selectie)bias in de studies. Tevens zijn de resultaten in vrijwel geen enkele studie op objectieve wijze of middels gevalideerde meetinstrumenten vastgesteld, bij heterogene en onduidelijke follow-up duur.
D mening werkgroep |
|
Niveau 4 |
Op basis van de weinig betrouwbare en zeer heterogene literatuur over lasertherapie bij CMN kan geen betrouwbare uitspraak worden gedaan over (cosmetisch) resultaat en veiligheid (complicaties en melanoomrisico) van laser therapie bij CMN.
D mening werkgroep |
|
Niveau 4 |
Er is geen literatuur beschikbaar over de resultaten van ‘Intense Pulsed Light’-behandeling bij CMN.
D mening werkgroep |
Samenvatting literatuur
‘Full thickness’ behandeling
Sluitingstechnieken
Primaire sluiting
Wetenschappelijke onderbouwing
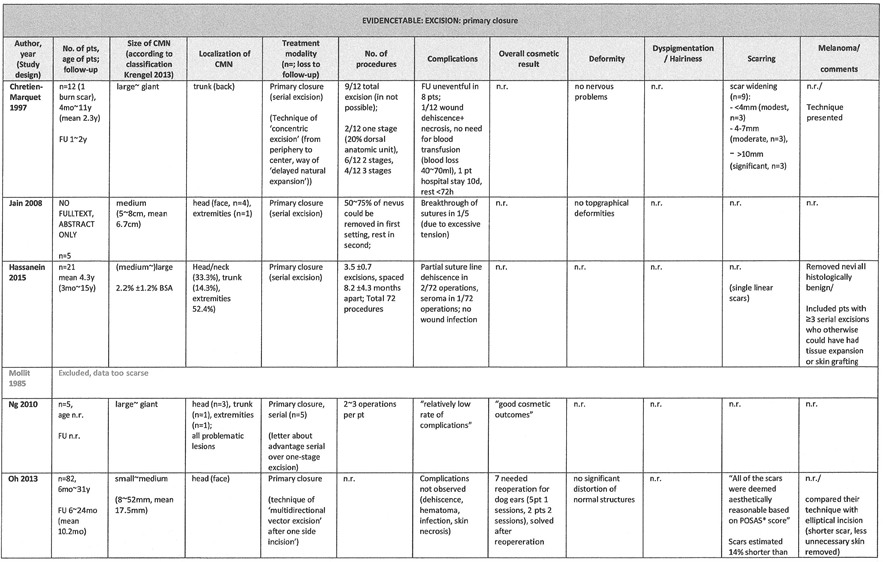
In zes studies zijn de resultaten van excisie van CMN met primaire sluiting in éénmaal, danwel meerdere etappes (seriële excisie) separaat beschreven [Hassanein 2015 (n=21), Oh 2013 (n=82), Ng 2010 (n=5), Rothfuss 2009 (n=51), Jain 2008 (n=5), Kruk-Jeromin 1999, Chretien-Marquet 1997 (n=12).
Kruk-Jeromin et al. en Oh et al. beschrijven primaire sluiting in één etappe in veelal kleine naevi, Kruk-Jeromin het merendeel op de romp (n=66), Oh et al. aan het hoofd (n=82). Kruk-Jeromin et al. beschrijven dat CMN <5cm succesvol geëxcideerd konden worden in één ingreep. Het cosmetisch resultaat in Kruk-Jeromin was overwegend goed (63 goed, 2 bevredigend, 1 ontevreden). Oh et al. beschrijven een speciale techniek (eenzijdige incisie). Bij 7 patiënten was een enkele reoperatie nodig vanwege ‘dog ears’, maar alle patiënten hadden normale contouren als resultaat en alle littekens werden als esthetisch acceptabel beoordeeld (POSAS littekenschaal). Jain et al. beschrijven excisie van middelgrote CMN in m.n. in het gelaat, het merendeel kon in één sessie worden verwijderd de rest in een tweede, er trad geen vervorming op.
Seriële excisie met primaire sluiting is in de overige studies beschreven in grote~reuze CMN [Ng 2010, Rothfuss 2009, Chretien-Marquet 1997]. Enkele beschrijven speciale technieken: Chretien-Marquet ‘concentrische excisie’ op de rug, en Rothfuss sluiting volgens Breuninger voor minder tractie op de wond. In de studies waren gemiddeld twee (1~3) operaties nodig. Het cosmetisch resultaat in de studies wordt als overwegend goed beschreven, hoewel weinig objectief. In de studie van Rothfuss is het resultaat beoordeeld door ouders: 39/51 goed tot zeer goed resultaat, 5 bevredigend, 3 adequaat en 2 onvoldoende. Chretien-Marquet et al. beschrijven littekenverwijding van <3mm bij 3 van 12 patiënten, 4~7mm bij 3 en >10mm ook bij 3.
Qua complicaties werd met name wonddehiscentie beschreven (1/5 Jain, 1/12 Chretien-Marquet met necrose, 3/51 Rothfuss). Oh et al. en Ng et al. zeggen dat er geen of nauwelijks complicaties waren. In de studie van Hassanein worden patiënten beschreven met grote CMN die ≥3 seriële ingrepen met primaire slutiting gehad hebben en die ook in aanmerking zouden komen voor ‘tissue expansion’ of huidtransplantatie. Partiële dehiscentie vondt plaats bij 2/21 kinderen en seroom bij 1/21, er werden geen infecties gezien [Hassanein 2015].
In geen enkele studie is cutaan melanoom als uitkomstmaat meegenomen.
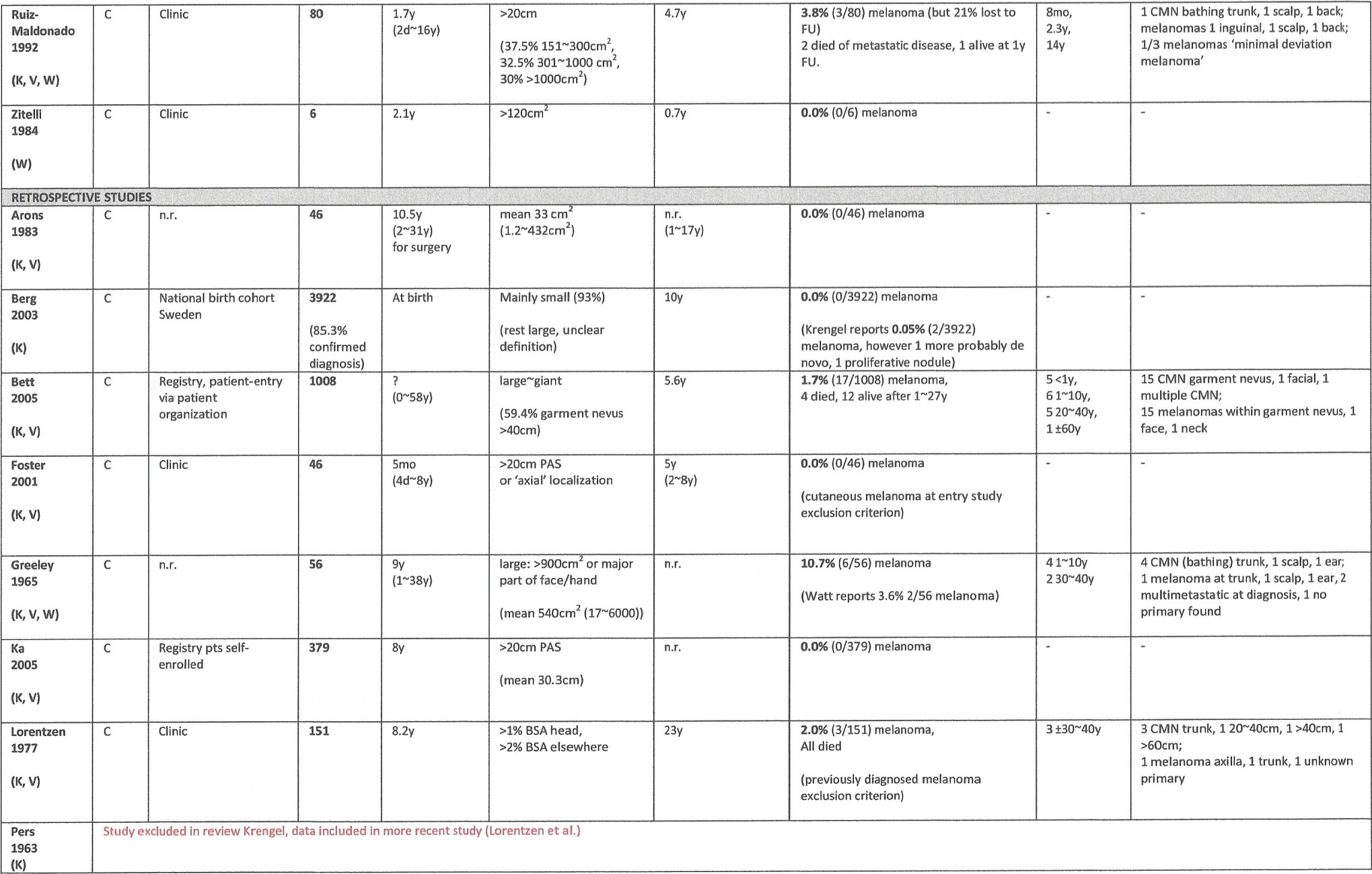
‘Tissue expansion’ + flap
Wetenschappelijke onderbouwing
In zeven studies zijn resultaten/complicaties van verwijdering van CMN met excisie en flap na ‘tissue expansion’ (TE) separaat beschreven [Nguyen 2014 (n=33), Vaienti 2011 (n=8), Fahmy 2010 (n=12), Zaal 2009 (n=17), Merigou 2009 (n=12), Warner 2008 (n=10), Alfaro 2002 (n=11), Bauer 2001 (n=21)].
Deze techniek is veelal beschreven voor reconstructie van CMN op het hoofd [Bauer 2001, Vaienti 2011, Zaal 2009], in middelgrote tot grote~reuze CMN. De meeste kinderen waren van jonge leeftijd. Per patiënt waren gemiddeld iets meer dan 2 expanders nodig. In de reconstructie zijn niet altijd de normale contouren behouden (5/21 Bauer, 2/8 Vaienti, 5/17 Zaal), met name trad op wenkbrauw elevatie of –ptosis op of haarafwijkingen (alopecie, asymmetrische haarlijn). Beoordeling van het litteken is alleen door Zaal et al. beschreven, aan de hand van de POSAS littekenschaal. De littekenbreedte was over het geheel beoordeeld als gematigd, met een breedte van ongeveer4~5mm. Bij 3/17 patiënten was er milde repigmentatie.
Fahmy et al. beschrijven ‘tissue expansion’ van grote en reuze CMN op de buik (n=12). Per patiënt waren 4~14 operaties nodig, met plaatsing van 2~5 expanders. Bij 2/12 ontstonden er hypertrofische littekens. Gemiddeld genomen was er bij 58% goede tevredenheid, bij 34% gematigd en bij 8% weinig.
Alfaro et al. beschrijven TE bij 11 middelgrote~grote CMN aan de extremiteiten bij oudere kinderen en jongvolwassenen. De ‘tissue expansion’ vond plaats in dezelfde operatie als de excisie, in tegenstelling tot de overige studies waar éérst en tussentijds expansie plaatsvond. Er trad partiële wonddehiscentie op bij 4/11, bij 2/11 een hypertrofisch litteken en bij 2/11 donkere pigmentatie in het litteken. 8/11 patiënten waren tevreden met het resultaat.
Merigou et al. beschrijven ‘tissue expansion’ bij 12 patiënten, grootte en lokalisatie onbekend. Bij 4/12 was er repigmentatie van het litteken, met name indien op jonge leeftijd behandeld.
Expander-gerelateerde complicaties werden beschreven door Bauer (9,5% patiënten), Zaal (21,1% expanders) en Fahmy (18,9% expanders). Dit waren infectie (Zaal n=2, Fahmy n=3), exposure oftewel huidnecrose (Zaal n=4, Fahmy n=1, Bauer infectie+exposure n=2) en lekken van de expander (Zaal n=2) of expander failure (Fahmy n=3). Fahmy et al. beschrijven verder nog 41% van de patiënten mildere complicaties: bij 2 patiënten partiële wonddehiscentie, bij 1 een hematoom, 2 een seroom. Ook Warner et al. beschrijven complicaties van ‘tisse expansion’ bij grote~reuze CMN (locatie onbekend) bij 28% van expanders: 4 infecties (waarvan 1 necrotiserende fasciitis), 1 malpositie, 1 flap necrose en 1 exposure. Merigou et al. vonden wonddehiscentie bij 3/12 en lipoatrofie bij 2/12, expander-gerelateerde complicaties werden niet gemeld.
Naast bovenstaande studies zijn er veel studies over ‘tissue expansion’ bij kinderen verschenen waarvan congenitale naevi een groep van patiënten is waarbij deze techniek wordt toegepast [o.a. Duclert-Bompaire 2016 (n=45, 27% CMN), Maillet-Declerk 2012 (n=15, 80% CMN), Dotan 2009 (n=41, 46% CMN), Adler 2009 (n=215, meerderheid CMN), Hurvitz 2005 (n=89, 44% CMN)]. Andere indicaties voor ‘tissue expansion’ zijn bijvoorbeeld brandwonden of hemangiomen. Het algehele complicatierisico varieert in de genoemde studies van 13% van de patiënten [Dotan 2009] tot wel 26% of 31% van de expanders [Duclert-Bompaire 2016, Hurvitz 2005]. Het risico op infectie of exposure (‘major complications’) is in de studies 7 of 9% van de patiënten, 11 of 16% van de expanders of 11% van de operaties.
Huidtransplantatie (‘skin grafting’)
Wetenschappelijke onderbouwing
In 10 studies zijn de resultaten van ‘skin grafting’ bij CMN beschreven [Schiestl 2010 (n=12), Adler 2009 (n=14), Sood 2009 (n=9), Warner 2008 (n=28), Coeugniet 2007 (n=8), Kruk-Jeromin 1998 (n=17), Kumagai 1998 (n=5), Soejima 1997 (n=6), Bauer 1993 (n=10), Gallico 1989 (n=8)]. Er is een grote variatie aan soorten huidtransplantaat die zijn toegepast: ‘allografts’, ‘autografts’, ‘artificial skin’, en zowel ‘full-thickness’ als ‘split-skin’ transplantaten of combinaties. Grafts zijn vooral beschreven in reuze CMN, voornamelijk op de romp en/of extremiteiten [Gallico, Kumagai, Schiestl, Soejima, Sood, Warner], of op middelgrote~grote CMN op specifieke lokalisaties (hoofd, oor, liesstreek) [Adler, Bauer, Coeugniet, Kruk-Jeromin]. In de studies in reuze CMN is vaak kunsthuid of gekweekte huid toegepast.
In reuze CMN is in het algemeen de uiteindelijke ‘graft take’ goed (>95%), maar is de primaire ‘take’ vaak matig (gemiddeld 60~70%) met soms de noodzaak tot regrafting. Het resultaat werd in 2 studies algeheel beoordeeld: gemiddeld~goed in een studie en matig~slecht in een andere [Schiestl 2010, Kumagai 1998]. In de kleinere CMN is de graft take goed te noemen, en is het resultaat in 2 studies beoordeeld als gemiddeld~goed [Coeugniet 2007] tot overwegend goed [Kruk-Jeromin 1999]
Qua structuur van de huid was in een aantal studies resectie van het litteken nodig (1/14 Adler, 2/10 Bauer), sprake van littekencontractie (2/9 Sood) of een hypertrofische rand (in Gallico), in Coegniet werd de textuur van de huid als goed~zeer goed beoordeeld. In de overige studies werd hier niets over gemeld. Pigmentatie van de graft werd in Gallico et al. benoemd in 1/8 patiënten, in de overige studies is dit niet benoemd. Er zijn geen vormafwijkingen beschreven, alleen in 2/14 patiënten in de studie van Adler met CMN op het oor.
Complicaties naast lage graft take zijn weinig beschreven, behalve door Gallico et al. en Schiestl et al (beide studies in reuze CMN). Gallico et al. beschrijven in 2/17 grafts open wonden, in 2 graft destructie door infectie, en in 2 patiënten bloedtransfusie. Hierdoor (en tegenvallend resultaat) wilden 2 families niet verder met de procedure. Gallico et al. is een oude studie uit 1989. Schiestl et al. beschrijven in 3/12 patiënten infectie waarvoor verwijdering van de graft nodig was. Sood beschrijft postoperatief 1/9 patiënten met een pneumonie en 2/9 met urineweginfecties.
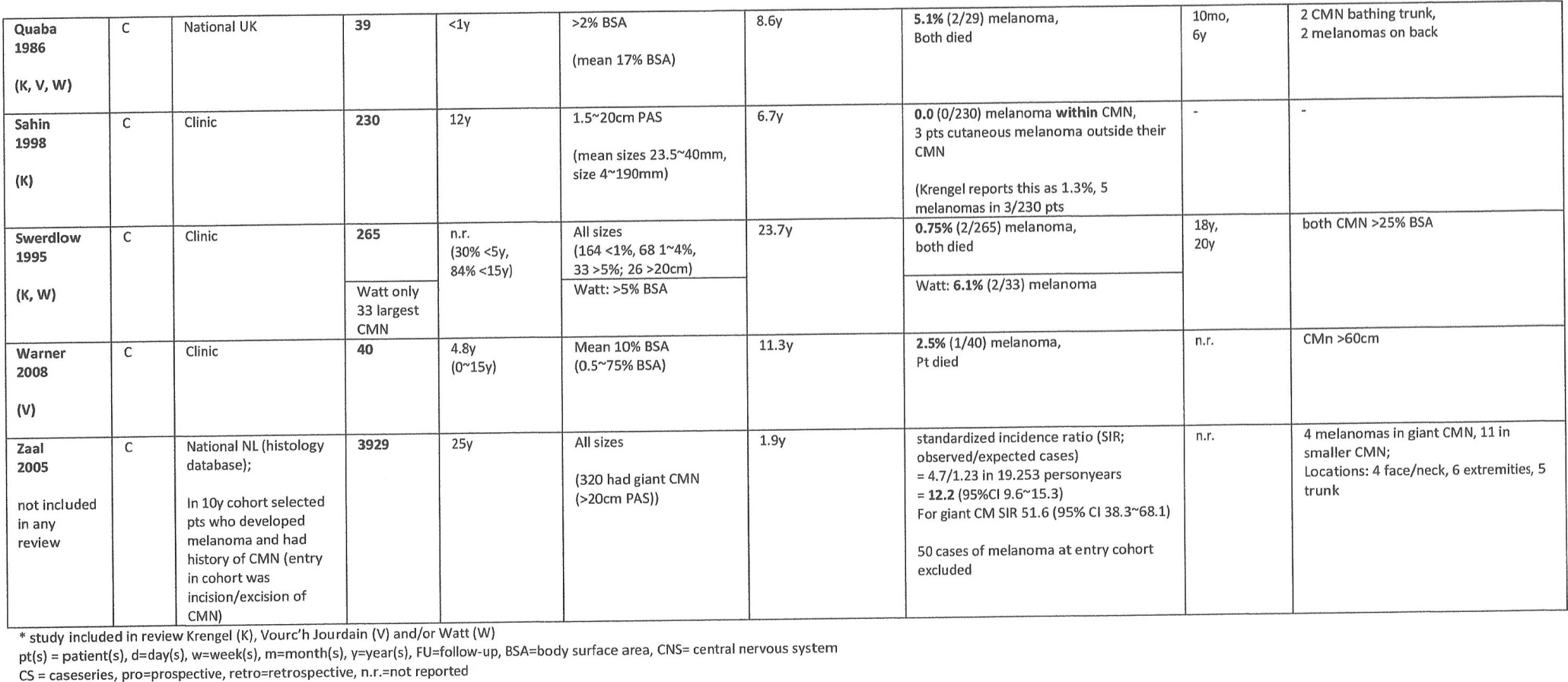
Meerdere technieken
Wetenschappelijke onderbouwing
Tevens zijn er twaalf studies geïdentificeerd waarin er meerdere sluitingstechnieken bij CMN zijn beschreven. Indien resultaten per techniek en bij ≥5 patiënten werden genoemd zijn ze meegenomen in de onderbouwing bij de diverse sluitingstechnieken (zie eerder, [Chowchuen 2011, Merigou 2009, Warner 2008, Kruk-Jeromin 1999]).
Er zijn echter ook studies waarin resultaten niet per techniek apart zijn beschreven [Rasmussen 2015, Rehal 2011, Kinsler 2009, Bellier-Waast 2008, Leshem 2005, Gur 2000, Ruiz-Maldonado 1992, Pitanguy 1981], bijvoorbeeld als meerdere reconstructietechnieken zijn toegepast in dezelfde patiënt (zie ook evidencetabel). Er vanuit gaande dat de chirurg bij elke patiënt kiest voor de best mogelijke techniek(en) kan op basis van deze studies wel iets worden gezegd over het overkoepelend cosmetisch resultaat van excisie (±reconstructie).
In zeven van de 12 studies wordt een oordeel gegeven over het cosmetisch resultaat (Rasmussen, Chowchuen, Kinsler, Merigou, Kruk-jeromin, Ruiz-Maldonado, Pitanguy). In Kruk-Jeromin (n=295), Merigou (n=65) en Kinsler (n=301) zijn laesies van alle groottes en op alle lokalisaties behandeld, maar veelal kleinere. Kruk-Jeromin et al. beschrijven een goed resultaat bij 94,9% en onbevredigend bij slechts 1,4%. Merigou beschrijft, beoordeeld door zowel clinici als de familie, een uitstekend resultaat bij 49,2%, goed bij 41,9% en slecht bij 8,9%. In de studie van Kinsler et al. vond 89~90% de chirurgische behandeling de moeite waard. In de genoemde studies was de beoordeling afhankelijk van de grootte: slechter resultaat werd gevonden in grotere CMN. In de studie van Kinsler vond 11~14% van de patiënten met CMN >20cm PAS dat het cosmetisch resultaat slechter was dan de oorspronkelijke naevus. Ruiz-Maldonado (n=22) en Rasmussen (n=9) deden onderzoek in met name (grote~) reuze CMN. Rasmussen vond een relatief goed resultaat (bevredigend in 77,7%, onbevredigend in 11,1%), Ruiz-Maldonado een overwegend slecht resultaat (goed in 27,2%, matig in 36,3% en slecht in eveneens 36,3%). In een andere oude studie, Pitanguy (n=19, middelgrote~reuze CMN behandeld) is het resultaat uitstekend/goed in 5, acceptabel/bevredigend in 4 maar van 10 niet bekend. Behandeling van CMN op het hoofd of nek wordt over het algemeen als goed beoordeeld: in de studie van Kinsler was >95% in deze groep is tevreden (tov 90% in de gehele groep). Dit wordt ook gezien in de studie van Chowchuen (n=19) met alleen CMN op het hoofd (gelaat), alle patiënten waren tevreden met het resultaat.
In slechts 2 van de 7 studies is de wijze waarop ze tevredenheid hebben gemeten geobjectiveerd (Kruk-Jeromin, Merigou).
Operatiegerelateerde complicaties (zoals infectie, wonddehiscentie) werd gezien bij 6~55% (in 5 studies niet gerapporteerd) en complicaties qua cosmetisch resultaat (zoals vervorming, littenvorming, dyspigmentatie) bij 6~72% (in 3 studies niet gerapporteerd). De meeste complicaties traden op bij excisie van de grotere CMN. Er zijn onvoldoende gegevens om verdere uitspraken te doen over complicaties van behandeling, dit is sterk gerelateerd aan de gehanteerde techniek. Bij 4~5 patiënten werd een cutaan melanoom gevonden, alle in patiënten met reuze CMN (2~3/301 in studie Kinsler, 2/80 in studie Ruiz-Maldonado), behandelde status was van 3 bekend: 2 niet behandeld 1 wel.
Keuze sluitingstechniek bij excisie
Wetenschappelijke onderbouwing
Bij excisie van CMN en keuze van reconstructietechniek is het o.a. van belang dat er weinig tractie aan de wond is, en het ontstane defect wordt opgevuld met weefsel van vergelijkbare aard.
Indien excisie met primaire sluiting in een redelijk aantal etappes kan worden bereikt heeft dit in het algemeen de voorkeur, omdat hierbij additionele complicaties door het gebruik van ‘tissue expanders’ en huidtransplantatie worden voorkomen. Echter, een combinatie van technieken geeft vaak een betere cosmetische uitkomst, dit geldt zeker voor het gezicht en grote aaneengesloten anatomische regio’s. Hierdoor kunnen grotere oppervlakten, met minder spanning, worden gesloten. Ook dient rekening te worden gehouden met het aantal ingrepen dat nodig is, elke operatie kent risico’s (infectie, bloeding, gevolgen anesthesie etc.).
Indien seriële excisie met primaire sluiting niet volstaat kan men de volgende leidraad hanteren bij het maken van een keuze [tabel 2]:
Tabel 2: voorkeurstechniek per lokalisatie indien (seriële) excisie met primaire sluiting niet volstaat [gebaseerd op: Bauer 1988, Gosain 2001]
|
lokalisatie |
|
Voorkeur techniek |
|
hoofd |
schedel |
‘tissue expansion’ |
|
|
gezicht |
‘tissue expansion’ van voorhoofd, nek en wang; huidtransplantaat (volle dikte, geëxpandeerd) periorbitaal, neus |
|
romp |
voorzijde |
‘tissue expansion’, huidtransplantaat |
|
|
achterzijde |
huidtransplantatie (‘tissue expansion’ is hier minder effectief) |
|
extremiteiten |
proximaal |
huidtransplantaat, evt ‘tissue expansion’ |
|
|
distaal |
huidtransplantaat (bij ‘tissue expansion’ risico op complicaties hoog) |
Daarnaast zijn er in de literatuur nog meerdere en specifiekere publicaties verschenen over de beste techniek van reconstructie per lichaamsdeel. Zo zijn er bijvoorbeeld meerdere artikelen verschenen van dr. Bruce Bauer (kinder plastisch chirurg U.S.) met daarin zijn expert opinion op basis van jarenlange ervaring (o.a. uitgesplitst periorbitale regio, oren, thorax, benen, armen) [Margulis 2009, Adler 2009, Kryger 2008, Bauer 2005, Margulis 2004, Bauer 2004, Bauer 2001, Bauer 1993].
Bij de planning van ingrepen (m.n. in grotere CMN) is het van belang te realiseren dat het gaat om uitgebreide behandelingen, in meerdere etappes, waarbij de gehele periode zeer intensief is voor zowel patiënt als omgeving. Bijvoorbeeld bij ‘tissue expansion’ lopen tussen excisies in patiënten met expanders rond (dit is oncomfortabel en ziet er ‘gek’ uit), en deze dienen een aantal keer gevuld te worden.
In principe geeft op de langere termijn ‘tissue expansion’ een beter resultaat dan sluiten met een huidtransplantaat.
‘Partial thickness’ behandeling
Dermabrasie en curettage
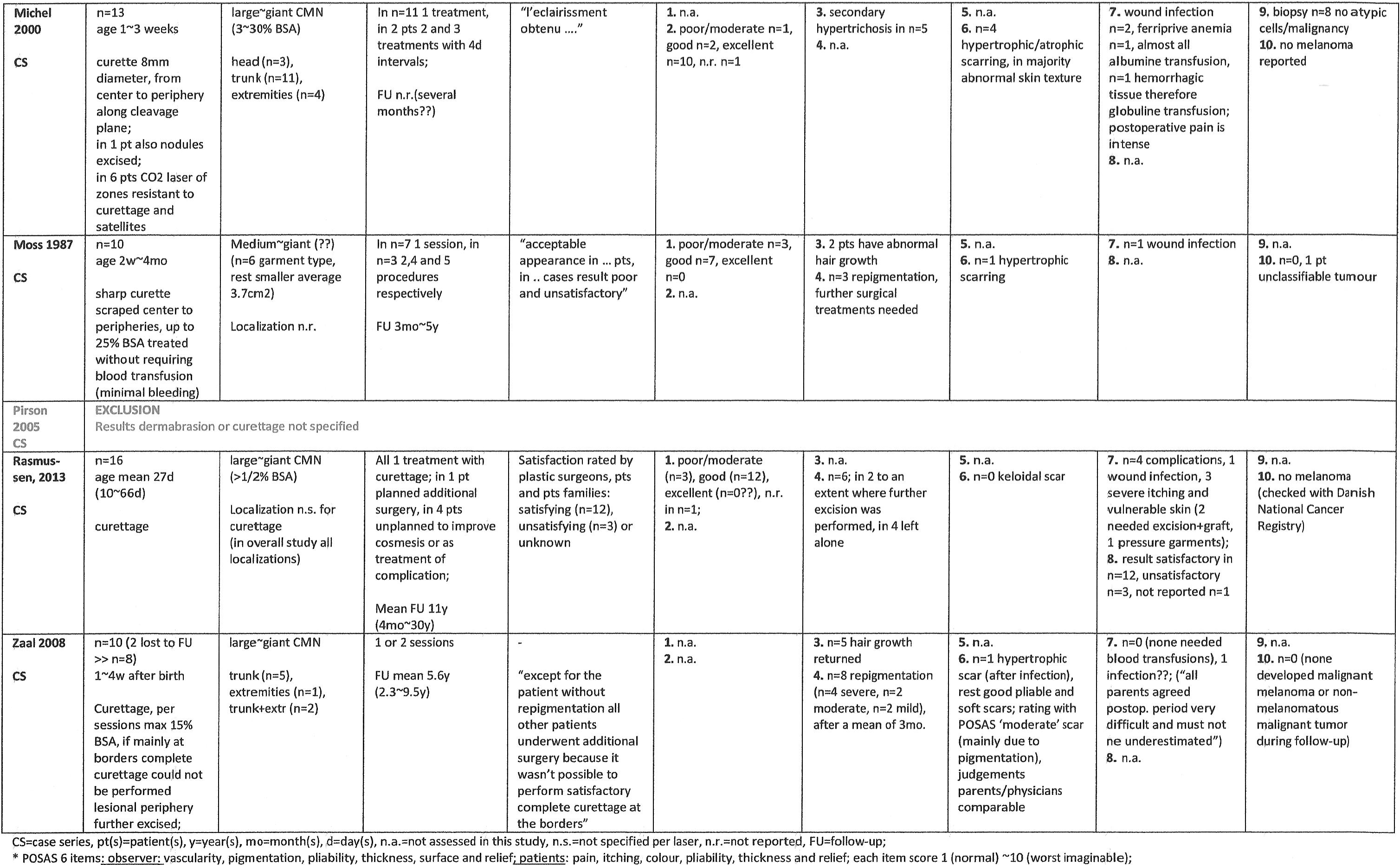
Dermabrasie
Wetenschappelijke onderbouwing
Er werden twee studies geïdentificeerd die specifiek dermabrasie bij tenminste 5 patiënten met CMN hebben beschreven [Bohn 2000, Rompel 1997], beide retrospectieve caseseries. Rompel et al. beschrijven behandeling van 219 CMN van alle groottes, waarvan de kleinere op cosmetisch kwetsbare lokalisaties. Bohn et al. beschrijven 12 patiënten met grote~reuze CMN behandeld 1~14 weken na de geboorte. In beide studies werd een motorgedreven dermabrasie frees gebruikt, waarmee de diepte van abrasie werd gecontroleerd door de snelheid en druk tussen frees en huid. De behandeling werd in één of meerdere sessies verricht.
Bohn. et al. beschrijven na een uiteenlopende follow-up duur van 1~16 jaar na behandeling een stabiele vermindering in pigmentatie bij 83% van de patiënten (n=10). De overige 2 patiënten toonden repigmentatie, en deze en nog 4 andere patiënten ondergingen verdere operatie van hun CMN. Deze laatste 4 ondanks primaire verbetering van de hyperpigmentatie, waarvan 3 in het gelaat. In de studie van Rompel et al. is de uiteindelijke vermindering van pigmentatie na een mediane duur van 24 maanden uitstekend (>80%) in 33,8%, goed (40~60%) in 29,7% en matig tot slecht (<40% vermindering) in 36,5%, Slechts in 7 patiënten trad er geen repigmentatie op, in de overige patiënten varieerde deze van 20% (n=67) tot 100% (n=44). Het resultaat t.a.v. (re)pigmentatie lijkt gerelateerd aan grootte van de naevus en leeftijd van behandelen: de beste resultaten werden gezien in grotere CMN behandeld in de eerste levensweken (grootte en leeftijd van behandelen zijn mogelijk confounders van elkaar). Het resultaat in kleinere naevi is slecht te noemen door forse repigmentatie. In de studie van Bohn et al. werd postoperatieve hypertrichose beschreven in 3 patiënten, in Rompel et al. werd dit niet benoemd. Een aanzienlijk aantal patiënten in de studie van Rompel et al. ontwikkelde hypertrofische littekens (n=32, 14,6%), waarvan 72% in behandelde laesies op de rug. In de serie van Bohn et al. werden geen hypertrofische littekens gezien.
Beide studies beschrijven complicaties na dermabrasie. Rompel et al. benoemen bloedtransfusie in 6/215 patiënten, en een postoperatieve bloeding in één patiënt. In de serie van Bohn et al. werden geen ernstige complicaties gezien. Wondinfecties kwamen voor in 5,9% en 8,3% respectievelijk. Ten aanzien van het optreden van melanoom werd geen maligne ontaarding gezien in de studie van Rompel, na een relatief korte gemiddelde follow-up duur van mediaan 24 maanden. In de serie van Bohn et al. werd bij één patiënt een ‘minimal deviation melanoma’ geconstateerd, en bij één een ‘pseudomelanoom’ na een gemiddelde follow-up duur van 7 jaar.
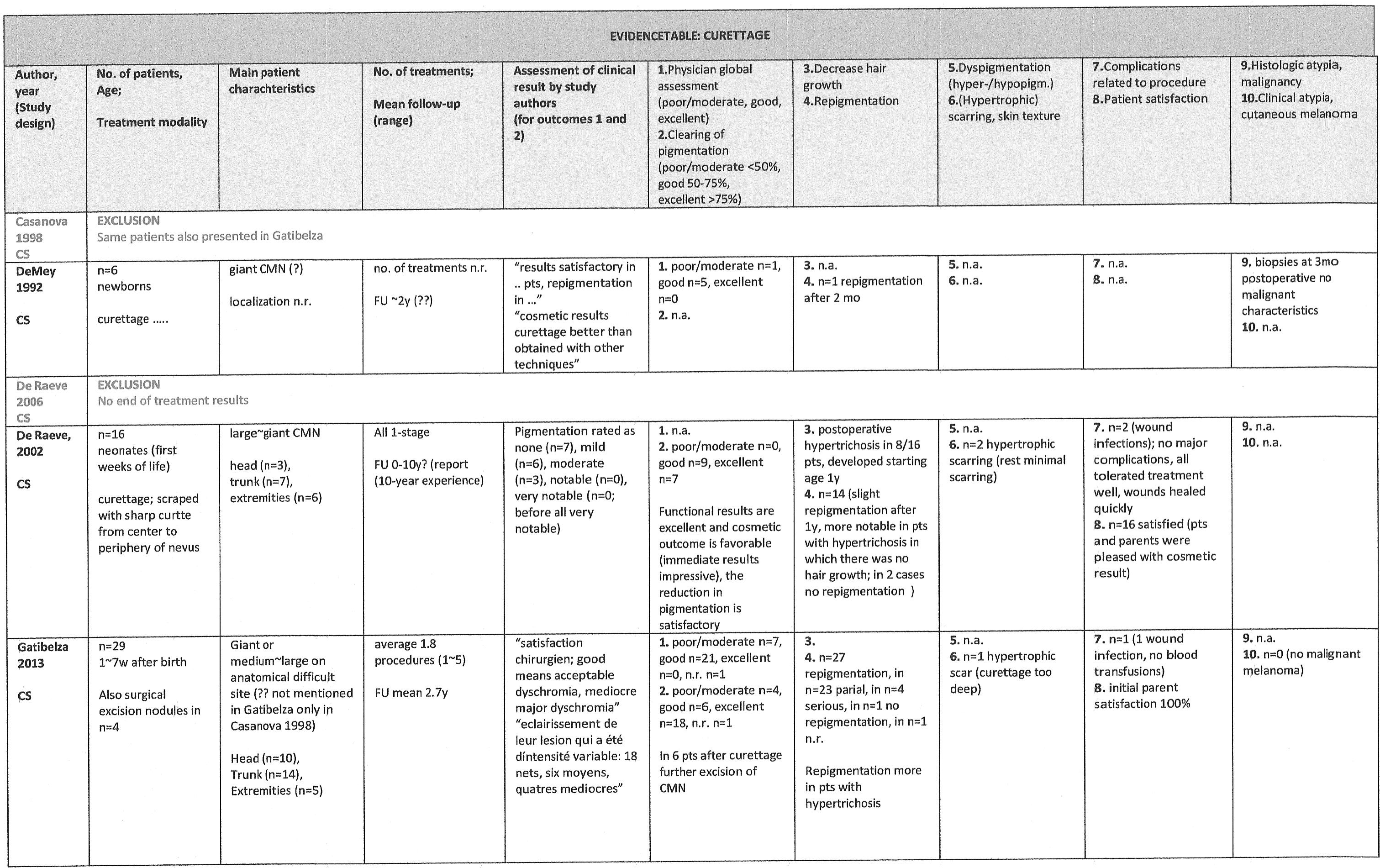
Curettage
Wetenschappelijke onderbouwing
Er werden 7 studies geïdentificeerd betreffende de behandeling van CMN met curettage bij tenminste 5 patiënten beschreven [Rasmussen 2015, Gatibelza 2013, Zaal 2008, De Raeve 2002, Michel 2000, De Mey 1992, Moss 1987]. Alle zijn retrospectieve niet-gecontroleerde case series met patiëntpopulaties variërend van 6 tot 29 patiënten, in totaal zijn 100 patiënten beschreven. In alle zijn (grote~)reuze CMN bij pasgeborenen onderzocht binnen enkele (1~8) weken na de geboorte, in Gatibelza ook enkele kleinere CMN op lastige lokalisaties (o.a. gelaat).
Vermindering van pigmentatie is in slechts 3 studies expliciet beschreven [Gatibelza 2013, de Raeve 2002, Michel 2000]. In vier studies werd een algemene indruk van het resultaat beschreven (‘physician global assessment’, niet-objectief) [Rasmussen 2015, Gatibelza 2013, De Mey 1992, Moss 1987]: oordeel ‘goed’ in 73,8% van de patiënten (uitstekend in 0%) en ‘slecht/matig’ in 23,0% Samengevat werd een hoge initiële ‘clearing’ gevonden: uitstekend (>75% vermindering) in 60,3%, goed (50~75%) in 29,3%, en slecht/matig in <10%. Resultaten t.a.v. repigmentatie lopen sterk uiteen, maar lijkt veel voor te komen (gemiddeld bij 67,8%). Zaal et al. rapporteren na 5,5 jaar bij alle 8 patiënten repigmentatie, waarvan in 50% ernstig. Gatibelza et al. zagen ook bij vrijwel alle patiënten repigmentatie: partiële bij 79,5% en ernstige bij 13,8%. De Raeve et al. tonen vergelijkbare resultaten: bij 87,5% van de patiënten een vorm van repigmentatie. In de andere studies is het aantal patiënten met repigmentatie lager: 30,0% (3/10) in de studie van Moss et al., 37,5% (6/16) in Rasmussen en 16,7% (1/6) in de studie van De Mey. In geen van de studies is repigmentatie objectief gemeten en de follow-up duur is zeer heterogeen. Hypertrichose werd in 4 studies beschreven bij gemiddeld 40,8% van de patiënten [Zaal 2008, DeRaeve 2002, Michel 2000, Moss 1987]. Littekenvorming (hypertrofisch) werd bij gemiddeld 9,6% van de patiënten beschreven [Rasmussen 2015, Gatibelza 2013, Zaal 2008, De Raeve 2002, Michel 2000, Moss 1987], variërend van 3.4% in Gatibelza et al. tot 30,8% in de studie van Michel. In Zaal et al. is littekenvorming als enige studie met een kwantitatief meetinstrument gemeten, de POSAS littekenschaal voor zowel arts als patiënt [Zaal 2008]. Over het algemeen werden de littekens beoordeeld als ‘moderate’, met name door pigmentatie. Michel et al. beschrijven tevens het optreden van een andere huidtextuur bij alle patiënten na de ingreep, onbekend in welke mate.
Auteurs beschrijven dat curettage gemakkelijk ging in de allerjongste patiënten (± 2 weken) en moeilijker werd naarmate ze ouder werden (tot 8 weken onderzocht, tot 6 maanden voor vervolgbehandeling) [Gatibelza 2013, de Raeve 2002, Moss 1987]. Patiënten later behandeld zouden meer repigmentatie vertonen.
De incidentie van wondinfecties kwam enigszins overeen tussen de studies en varieerde van 3~14% [Rasmussen 2015, Gatibelza 2013, De Raeve, 2002, Michel 2000, Moss, 1987]. Daarnaast is er geen rapportage geweest van ernstig bloedverlies of bloedtransfusies tijdens of na de ingreep [Gatibelza 2013, Zaal 2008]. Wel wordt in de studie van Michel beschreven dat bij vrijwel alle patiënten albumine-transfusie nodig was, en de postoperatieve pijn hevig was. Verder beschreven Rasmussen et al. in 3/16 patiënten ernstige jeuk en kwetsbaarheid van de huid waar reoperatie voor nodig is.
In vijf studies werd gelet op maligne veranderingen, in geen enkele werden deze gerapporteerd na een gemiddelde follow-up duur van 3~11 jaar [Rasmussen 2015, Gatibelza 2013, Zaal 2008, Michel 2000, Moss 1987].
Lasertherapie en ‘Intense pulsed light’ (IPL) therapie
Lasertherapie
Wetenschappelijke onderbouwing
Er werden 24 studies in de literatuur gevonden over lasertherapie bij tenminste 5 patiënten met CMN [Lee 2015, Al-Hadithy 2012, Funayama 2012, August 2011, Minakawa 2011, Kishi 2009, Helsing 2006, Mandal 2006, Ostertag 2006, Chong 2005, Horner 2005, Kim 2005, Kono 2005, Downs 2004, Sohn 2004, Reynolds 2003, Kono 2002, Michel 2001, Park 2001, Duke 1999, Imayama 1999, Grevelink 1997, Waldorf 1996, Scheepers 1993]. Hiervan zijn er 4 ‘pilot’ studies [Kono, 2002, Duke, 1999; Grevelink, 1997; Scheepers 1993], de overige 20 zijn caseseries die resultaten na einde behandeling beschrijven.
In totaal zijn in deze 24 studies 406 patiënten beschreven, behandeld met 20 verschillende lasermodaliteiten of -combinaties. Lasertherapie is met name toegepast op CMN op cosmetisch lastige lokalisaties (o.a. gelaat) en CMN te groot voor verwijdering met excisie. Vanwege de grote varieteit aan lasermodaliteiten heeft de werkgroep deze naar werkingsmechanisme ingedeeld in 6 lasercategorieën: 1. Pigment-specifiek, Q-Switched (QS); 2. Pigment-specifiek, Normal Mode (NM); 3. Pigment-specifiek (QS+NM); 4. Ablatief; 5. Ablatief + Pigment-specifiek QS; 6. Ablatief + Pigment-specifiek NM. In ‘Toelichting lasermodaliteiten’ (bij de aanverwante prodcuten) is exact te zien welke lasermodaliteiten en –combinaties in de studies zijn beschreven. De resultaten per categorie kunnen overzichtelijk worden teruggevonden in de GRADE-tabel.
Qua cosmetisch resultaat wordt op de korte termijn in alle 6 lasercategorieën overwegend goede (50~75% verbetering) tot uitstekende (75~100%) vermindering van pigmentatie gezien. Echter, met name in pigment-specifieke lasers is de incidentie van repigmentatie hoog, bij ongeveer 50% van de patiënten. Dit maakt het cosmetisch resultaat op de lange termijn matig, en er zijn vele behandelingen nodig. Met de ablatieve lasers (al dan niet in combinatie met pigment-specifieke laser) ligt de incidentie van repigmentatie lager (13,2~21,7%). Dyspigmentatie (hyper- of hypopigmentatie) is niet veel in studies genoemd, hoewel wel vaak beschreven in de combinatie van NM en QS pigment-specifieke lasers in 2 studies (17/40 patiënten), in 20% van patiënten hypo- en in 25% hyperpigmentatie. Beide studies werden verricht in een Aziatische populatie. Permanente of hypertrofische littekenvorming kwam in de meeste lasercategorieën niet veel voor (pigment-specifieke lasers 0~2,2%), behalve na behandeling met ablatieve laser (ablatieve laser alleen 25,0%). Van alle lasercategorieën zijn de ablatieve lasers als monotherapie het meest toegepast in grote en reuze CMN, de andere lasers ook vaker in kleinere CMN. Dit zou mogelijk het hoge percentage littekenvorming in deze groep kunnen verklaren. In enkele studies werd ook voorbijgaande littekenvorming gerapporteerd, die dan vaak verdween na behandeling met steroid injecties of siliconen dressings. Patiënttevredenheid werd slechts in 3 studies bekeken, met o.a. volledig tegenstellende resultaten tussen 2 studies in de groep combinatietherapie van NM met QS pigment-specifieke lasers. Effect op hypertrichose is nauwelijks onderzocht.
De pilot-studies geven weinig aanvullende informatie. In studies waarin meerdere lasermodaliteiten zijn beschreven lijkt een combinatie van behandelingen effectiever dan monotherapie [Kim 2005, Kono 2002, Park 2001].
Vanwege verschillende of onduidelijk gehanteerde classificaties voor grootte in de studies of niet separaat weergegeven resultaten is het lastig een resultaat per grootte CMN weer te geven. Voor 85% van de patiënten kan wel ongeveer een tweedeling worden gemaakt: 303 patiënten met kleine~middelgrote CMN en 39 patiënten met grote~reuze CMN werden geïncludeerd. De meeste grotere CMN werden behandeld met een ablatieve laser, de kleinere met een Q-switched pigment-specifieke laser. In de grotere CMN waren de incidenties van cosmetische complicaties hoger (repigmentatie 40 vs 22%, dyspigmentatie 40 vs 16%, littekenvorming 47 vs 4%).
Of er complicaties waren van de laserbehandeling werd vaak niet beschreven, en als het werd benoemd was dit veelal summier. Alleen in de groep van ablatieve lasers, met name toegepast in
grote~reuze CMN, werd één serieuze complicatie gerapporteerd (septische shock) en 4 patiënten met wondinfecties (‘minor’). Ten aanzien van maligne transformatie, werd in geen van de studies histologische atypie of een klinisch cutaan melanoom na laserbehandeling van CMN beschreven.
‘Intense Pulsed Light (IPL) therapie
Wetenschappelijke onderbouwing
Bij de werkgroep zijn na een literatuursearch geen studies bekend die de effectiviteit en veiligheid van IPL therapie bij CMN hebben onderzocht.
Keuze oppervlakkige techniek
Expert opinion
Indien superficiële behandeling de voorkeur heeft in de behandeling van grotere CMN, kan er op basis van de literatuur geen uitspraak worden gedaan welke therapie het beste kan worden toegepast. Alle genoemde opties zijn mogelijk. Ze geven allen zeker vermindering van pigment, maar geen volledig verdwijnen van het pigment. Bij vrijwel alle patiënten treedt (op korte of langere termijn) partiële repigmentatie op. Littekenvorming kan bij alle technieken optreden indien men te diep behandelt. Diepte van behandeling is met dermabrasie lastiger te controleren dan met curettage en ablatieve lasers. Verder is het postoperatieve beloop met de oppervlakkige technieken heftig. Men maakt altijd een wond die secundair moet genezen waarbij veel wondvocht geproduceerd wordt en veel pijn kan ontstaan. Ook is er een risco op infectie mede afhankelijk van de grootte van het wondoppervlak en de diepte van behandeling.
Op basis van de huidige literatuur kan geen uitspraak worden gedaan over oppervlakkige behandeling van kleinere CMN. Dermabrasie en curettage zijn hierbij te weinig onderzocht. Lasertherapie is wel in enkele studies in kleinere CMN onderzocht en lijkt een acceptabel cosmetisch resultaat te geven; de literatuur is echter van lage kwaliteit.
Qua leeftijd van behandeling is onduidelijk of dit het beste op zeer jonge leeftijd kan gebeuren gezien het ‘hypothetische klievingsvlak’ in de eerste levensweken. Voor curettage is dit op basis van ervaring wel het geval.
Zoeken en selecteren
‘Full thickness’ behandeling
Er werd een systematische search verricht met synoniemen voor congenitale naevus en chirurgische technieken (voor zoektermen en selectiecriteria zie de zoekstrategie). Studies werden alleen meegenomen indien resultaten per techniek apart werden beschreven, voor CMN apart, en bij tenminste 5 patiënten.
De resultaten van de studies zijn terug te vinden in evidencetabel en worden per techniek in deze module kort samengevat.
‘Partial thickness’ behandeling
Studies over dermabrasie en curettage werden geëxtraheerd uit de overkoepelende systematische search naar chirurgische technieken bij CMN. Voor laser therapie werd een separate search verricht [zie de zoekstrategie]. Studies werden alleen meegenomen indien resultaten per techniek apart werden beschreven, voor CMN apart, en bij tenminste 5 patiënten.
Het beschikbare bewijs voor de oppervlakkige therapieën voor CMN is beoordeeld volgens de GRADE-methode (zie inleiding richtlijn voor uitleg GRADE). De resultaten zijn per vooraf vastgestelde uitkomstmaten ‘gepooled’, en beoordeeld op methodologische kwaliteit van het bewijs. De tien onderzochte uitkomstmaten zijn: ‘physician global assessment’, vermindering van pigmentatie, vermindering van haargroei, repigmentatie, dyspigmentatie, littekenvorming (hypertrofisch), complicaties, patiënt-tevredenheid, histologische atypie, en klinisch cutaan melanoom. Per soort therapie zijn de resultaten per uitkomstmaat samengebracht in GRADE ‘summary of findings’ tabellen, de resultaten per studie zijn terug te vinden in de evidencetabellen [zie de evidence tabellen]. In deze paragraaf worden de resultaten kort samengevat.
Referenties
- Adler N, Dorafshar AH, Bauer BS, Hoadley S, Tournell M. Tissue expander infections in pediatric patients: management and outcomes. Plast Reconstr Surg. 2009 Aug;124(2):484-9.
- Adler N, Margulis A, Bauer BS. Congenital pigmented nevi of the auricle: clinical experience and approach to treatment. Plast Reconstr Surg. 2009;124(6):1932-9.
- Adler N, Margulis A, Bauer BS. Congenital pigmented nevi of the auricle: clinical experience and approach to treatment. Plast Reconstr Surg. 2009 Dec;124(6):1932-9.
- Alfaro A, Garcia SS, Arenas D. Intraoperative expansion of skin around large congenital naevi with foley catheter balloons: 11 new cases. Scand J Plast Reconstr Surg Hand Surg. 2002;36(5):273-8.
- Al-Hadithy N, Al-Nakib K, Quaba A. Outcomes of 52 patients with congenital melanocytic naevi treated with UltraPulse Carbon Dioxide and Frequency Doubled Q-Switched Nd-Yag laser. J Plast Reconstr Aesthet Surg. 2012;65(8):1019-28.
- August PJ, Ferguson JE, Madan V. A study of the efficacy of carbon dioxide and pigment-specific lasers in the treatment of medium-sized congenital melanocytic naevi. Br J Dermatol. 2011;164(5):1037-42.
- Bauer BS, Corcoran J. Treatment of large and giant nevi. Clin Plast Surg. 2005 Jan;32(1):11-8, vii.
- Bauer BS, Few JW, Chavez CD, Galiano RD. The role of tissue expansion in the management of large congenital pigmented nevi of the forehead in the pediatric patient. Plast Reconstr Surg. 2001;107(3):668-75.
- Bauer BS, Margulis A. The expanded transposition flap: shifting paradigms based on experience gained from two decades of pediatric tissue expansion. Plast Reconstr Surg. 2004 Jul;114(1):98-106.
- Bauer BS, Vicari FA, Richard ME, Schwed R. Expanded full-thickness skin grafts in children: case selection, planning, and management. Plast Reconstr Surg. 1993;92(1):59-69.
- Bauer BS, Vicari FA. An approach to excision of congenital giant pigmented nevi in infancy and early childhood. Plast Reconstr Surg. 1988 Dec;82(6):1012-21.
- Bohn J, Svensson H, Aberg M. Dermabrasion of large congenital melanocytic naevi in neonates. Scand J Plast Reconstr Surg Hand Surg. 2000;34(4):321-6.
- Chong SJ, Jeong E, Park HJ, Lee JY, Cho BK. Treatment of congenital nevomelanocytic nevi with the CO2 and Q-switched alexandrite lasers. Dermatol Surg. 2005;31(5):518-21.
- Chretien-Marquet B, Bennaceur S, Fernandez R. Surgical treatment of large cutaneous lesions of the back in children by concentric cutaneous mobilization. Plast Reconstr Surg. 1997;100(4):926-36.
- Coeugniet E, Martinot-Duquennoy V, Gottrand L, Degardin N, Pellerin P. [Early preventive pressure therapy in extensive skin grafts on children's face, a comeback of classic methods? A retrospective study on 8 cases]. Ann Chir Plast Esthet. 2007;52(6):561-8.
- De Mey A, Dupuis C, Lejeune F, Lejour M. Neonatal treatment of giant naevi. Dermatology. 1992;185(4):300-1.
- De Raeve LE, Roseeuw DI. Curettage of giant congenital melanocytic nevi in neonates: a decade later. Arch Dermatol. 2002;138(7):943-7.
- Dotan L, Icekson M, Yanko-Arzi R, Ofek A, Neuman R, Margulis A. Pediatric tissue expansion: our experience with 103 expanded flap reconstructive procedures in 41 children. Isr Med Assoc J. 2009 Aug;11(8):474-9.
- Downs AM, Rickard A, Palmer J. Laser treatment of benign pigmented lesions in children: effective long-term benefits of the Q-switched frequency-doubled Nd:YAG and long-pulsed alexandrite lasers. Pediatr Dermatol. 2004;21(1):88-90.
- Duke D, Byers HR, Sober AJ, Anderson RR, Grevelink JM. Treatment of benign and atypical nevi with the normal-mode ruby laser and the Q-switched ruby laser: clinical improvement but failure to completely eliminate nevomelanocytes. Arch Dermatol. 1999;135(3):290-6.
- Duclert-Bompaire M, Sallot A, Lardy H, Le Touze A. [Tissue expansion in children: Indications and management of complications. A 10-year experience] [article in French]. Ann Chir Plast Esthet. 2016 Mar 18. pii: S0294-1260(16)30023-1.
- Dummer R, Kempf W, Burg G. Pseudo-melanoma after laser therapy. Dermatology. 1998;197(1):71-3.
- Fahmy MA, Mazy A. The feasibility of tissue expanders in reconstruction of giant congenital melanocytic nevi in children. Surg Innov. 2010;17(3):189-94.
- Funayama E, Sasaki S, Furukawa H, Hayashi T, Yamao T, Takahashi K, et al. Effectiveness of combined pulsed dye and Q-switched ruby laser treatment for large to giant congenital melanocytic naevi. Br J Dermatol. 2012;167(5):1085-91.
- Gallico GG, 3rd, O'Connor NE, Compton CC, Remensnyder JP, Kehinde O, Green H. Cultured epithelial autografts for giant congenital nevi. Plast Reconstr Surg. 1989;84(1):1-9.
- Gatibelza ME, Denis D, Bardot J, Casanova D, Degardin N. [Current place of curettage in the management of giant congenital nevi: report of 29 patients]. Ann Chir Plast Esthet. 2013;58(3):228-34.
- Gosain AK, Santoro TD, Larson DL, Gingrass RP. Giant congenital nevi: a 20-year experience and an algorithm for their management. Plast Reconstr Surg. 2001 Sep 1;108(3):622-36.
- Gottschaller C, Hohenleutner U, Landthaler M. Metastasis of a malignant melanoma 2 years after carbon dioxide laser treatment of a pigmented lesion: case report and review of the literature. Acta Derm Venereol. 2006;86(1):44-7.
- Grevelink JM, van Leeuwen RL, Anderson RR, Byers HR. Clinical and histological responses of congenital melanocytic nevi after single treatment with Q-switched lasers. Arch Dermatol. 1997;133(3):349-53.
- Hall M, Bates S, Peters G. Evidence for different modes of action of cyclin-dependent kinase inhibitors: p15 and p16 bind to kinases, p21 and p27 bind to cyclins. Oncogene. 1995;11(8):1581-8.
- Hassanein AH, Rogers GF, Greene AK. Management of challenging congenital melanocytic nevi: outcomes study of serial excision. J Pediatr Surg. 2015 Apr;50(4):613-6.
- Helsing P, Mork G, Sveen B. Ruby laser treatment of congenital melanocytic naevi--a pessimistic view. Acta Derm Venereol. 2006;86(3):235-7.
- Horner BM, El-Muttardi NS, Mayou BJ. Treatment of congenital melanocytic naevi with CO2 laser. Ann Plast Surg. 2005;55(3):276-80.
- Hurvitz KA, Rosen H, Meara JG. Pediatric cervicofacial tissue expansion. Int J Pediatr Otorhinolaryngol. 2005 Nov;69(11):1509-13.
- Imayama S, Ueda S. Long- and short-term histological observations of congenital nevi treated with the normal-mode ruby laser. Arch Dermatol. 1999;135(10):1211-8.
- Jain VK, Singhi MK, Goyal R. Serial excision of congenital melanocytic nevi. J Cutan Aesthet Surg. 2008;1(1):17-8.
- Kim S, Kang WH. Treatment of congenital nevi with the Q-switched Alexandrite laser. Eur J Dermatol. 2005;15(2):92-6.
- Kishi K, Okabe K, Ninomiya R, Konno E, Hattori N, Katsube K, et al. Early serial Q-switched ruby laser therapy for medium-sized to giant congenital melanocytic naevi. Br J Dermatol. 2009;161(2):345-52.
- Kono T, Ercocen AR, Chan HH, Kikuchi Y, Nozaki M. Effectiveness of the normal-mode ruby laser and the combined (normal-mode plus q-switched) ruby laser in the treatment of congenital melanocytic nevi: a comparative study. Ann Plast Surg. 2002;49(5):476-85.
- Kono T, Ercocen AR, Nozaki M. Treatment of congenital melanocytic nevi using the combined (normal-mode plus Q-switched) ruby laser in Asians: clinical response in relation to histological type. Ann Plast Surg. 2005;54(5):494-501.
- Kruk-Jeromin J, Lewandowicz E, Rykala J. Surgical treatment of pigmented melanocytic nevi depending upon their size and location. Acta Chir Plast. 1999;41(1):20-4.
- Kryger ZB, Bauer BS. Surgical management of large and giant congenital pigmented nevi of the lower extremity. Plast Reconstr Surg. 2008 May;121(5):1674-84.
- Kumagai N, Oshima H, Tanabe M, Ishida H. Treatment of giant congenital nevi with cryopreserved allogeneic skin and fresh autologous cultured epithelium. Ann Plast Surg. 1997;39(5):483-8.
- Larsen TH, Nielsen M, Lindskov R, Hegelund BL, Haedersdal M. Metastases from malignant melanoma after laser treatment of undiagnosed pigmented skin lesions. Lasers Med Sci. 2013;28(5):1403-4.
- Lee HW, Ahn SJ, Lee MW, Choi JH, Moon KC, Koh JK. Pseudomelanoma following laser therapy. J Eur Acad Dermatol Venereol. 2006;20(3):342-4.
- Lee SE, Choi JY, Hong KT, Lee KR. Treatment of acquired and small congenital melanocytic nevi with combined Er: YAG laser and long-pulsed alexandrite laser in Asian skin. Dermatol Surg. 2015;41(4):473-80.
- Maillet-Declerck M, Calibre C, Herbaux B, Duquennoy-Martinot V. Long-term results in scalp tissue expansion in children. Eur J Pediatr Surg. 2012 Aug;22(4):269-73.
- Mandal A, Al-Nakib K, Quaba AA. Treatment of small congenital nevocellular naevi using a combination of ultrapulse carbon dioxide laser and Q-switched frequency-doubled Nd-YAG laser. Aesthetic Plast Surg. 2006;30(5):606-10.
- Mandal A, Al-Nakib K, Quaba AA. Treatment of small congenital nevocellular naevi using a combination of ultrapulse carbon dioxide laser and Q-switched frequency-doubled Nd-YAG laser. Aesthetic Plast Surg. 2006;30(5):606-10.
- Margulis A, Adler N, Bauer BS. Congenital melanocytic nevi of the eyelids and periorbital region. Plast Reconstr Surg. 2009 Oct;124(4):1273-83.
- Margulis A, Bauer BS, Fine NA. Large and giant congenital pigmented nevi of the upper extremity: an algorithm to surgical management. Ann Plast Surg. 2004 Feb;52(2):158-67.
- Michel JL, Caillet-Chomel L. [Treatment of giant congenital nevus with high-energy pulsed CO2 laser]. Arch Pediatr. 2001;8(11):1185-94.
- Michel JL, Laborde-Milaa Roux V, Chavrier Y, Roux V, Metafiot H, Chalencon F, et al. [Neonatal curettage of giant congenital nevi]. Ann Dermatol Venereol. 2000;127(1):23-8.
- Minakawa S, Takeda H, Korekawa A, Kaneko T, Urushidate S, Sawamura D. Q-switched ruby laser therapy and long-term follow-up evaluation of small to medium-sized congenital melanocytic naevi. Clin Exp Dermatol. 2012;37(4):438-40.
- Moss AL. Congenital "giant" naevus: a preliminary report of a new surgical approach. Br J Plast Surg. 1987;40(4):410-9.
- Ng S, Madan V, Morris A. Serial excision: a useful technique to achieve good cosmetic outcomes when excising large benign naevi. British Journal of Dermatology 163 (Suppl 1), pp101117. 2010 163(suppl. 1):113-4.
- Nguyen NVN, Francois-Fiquet C, Diner P, Sergent B, Zazurca F, Franchi G, et al. [Tissular expansion in giant congenital nevi treatment]. Annales de chirurgie plastique et esthetique. 2014;59(4).
- Oh SI, Lee YH. Multidirectional vector excision leads to better outcomes than traditional elliptical excision of facial congenital melanocytic nevus. Arch Plast Surg. 2013;40(5):570-4.
- Ostertag JU, Quaedvlieg PJ, Kerckhoffs FE, Vermeulen AH, Bertleff MJ, Venema AW, et al. Congenital naevi treated with erbium:YAG laser (Derma K) resurfacing in neonates: clinical results and review of the literature. Br J Dermatol. 2006;154(5):889-95.
- Park SH, Koo SH, Choi EO. Combined laser therapy for difficult dermal pigmentation: resurfacing and selective photothermolysis. Ann Plast Surg. 2001;47(1):31-6.
- Rasmussen BS, Henriksen TF, Kolle SF, Schmidt G. Giant congenital melanocytic nevus: report from 30 years of experience in a single department. Ann Plast Surg. 2015;74(2):223-9.
- Reynolds N, Kenealy J, Mercer N. Carbon dioxide laser dermabrasion for giant congenital melanocytic nevi. Plast Reconstr Surg. 2003;111(7):2209-14.
- Rompel R, Moser M, Petres J. Dermabrasion of congenital nevocellular nevi: experience in 215 patients. Dermatology. 1997;194(3):261-7.
- Rothfuss M, Schilling M, Breuninger H. Early excision of congenital melanocytic nevi under tumescent anesthesia and skin expansion by intracutaneous double butterfly sutures. J Dtsch Dermatol Ges. 2009;7(5):427-33.
- Scheepers JH, Quaba AA. Clinical experience with the PLDL-1 (Pigmented Lesion Dye Laser) in the treatment of pigmented birthmarks: a preliminary report. Br J Plast Surg. 1993;46(3):247-51.
- Schiestl C, Stiefel D, Meuli M. Giant naevus, giant excision, eleg(i)ant closure? Reconstructive surgery with Integra Artificial Skin to treat giant congenital melanocytic naevi in children. J Plast Reconstr Aesthet Surg. 2010;63(4):610-5.
- Soejima K, Nozaki M, Sasaki K, Takeuchi M, Negishi N. Treatment of giant pigmented nevus using artificial dermis and a secondary skin graft from the scalp. Ann Plast Surg. 1997;39(5):489-94.
- Sohn S, Kim S, Kang WH. Recurrent pigmented macules after q-switched alexandrite laser treatment of congenital melanocytic nevus. Dermatol Surg. 2004;30(6):898-907; discussion
- Sood R, Balledux J, Koumanis DJ, Mir HS, Chaudhari S, Roggy D, et al. Coverage of large pediatric wounds with cultured epithelial autografts in congenital nevi and burns: results and technique. J Burn Care Res. 2009;30(4):576-86.
- Trau H, Orenstein A, Schewach-Miller M, Tsur H. Pseudomelanoma following laser therapy for congenital nevus. J Dermatol Surg Oncol. 1986;12(9):984-6.
- Vaienti L, Masetto L, Davanzo D, Marchesi A, Ravasio G. Giant congenital nevi of the scalp and forehead treated by skin expansion. Pediatr Med Chir. 2011;33(2):98-101.
- van Leeuwen RL, Dekker SK, Byers HR, Vermeer BJ, Grevelink JM. Modulation of alpha 4 beta 1 and alpha 5 beta 1 integrin expression: heterogeneous effects of Q-switched ruby, Nd:YAG, and alexandrite lasers on melanoma cells in vitro. Lasers Surg Med. 1996;18(1):63-71.
- Waldorf HA, Kauvar AN, Geronemus RG. Treatment of small and medium congenital nevi with the Q-switched ruby laser. Arch Dermatol. 1996;132(3):301-4.
- Warner PM, Yakuboff KP, Kagan RJ, Boyce S, Warden GD. An 18-year experience in the management of congenital nevomelanocytic nevi. Ann Plast Surg. 2008;60(3):283-7.
- Woodrow SL, Burrows NP. Malignant melanoma occurring at the periphery of a giant congenital naevus previously treated with laser therapy. Br J Dermatol. 2003;149(4):886-8.
- Zaal LH, Mooi WJ, Sillevis Smitt HJ. Results of early curettage of giant congenital melanocytic nevi; a report of eight cases and review of the literature. Eur J Plast Surg. 2008;30:25762.
- Zaal LH, van der Horst CM. Results of the early use of tissue expansion for giant congenital melanocytic naevi on the scalp and face. J Plast Reconstr Aesthet Surg. 2009;62(2):216-20.
- Zhu NW, Perks CM, Burd AR, Holly JM. Changes in the levels of integrin and focal adhesion kinase (FAK) in human melanoma cells following 532 nm laser treatment. Int J Cancer. 1999;82(3):353-8.
Evidence tabellen
Excisie
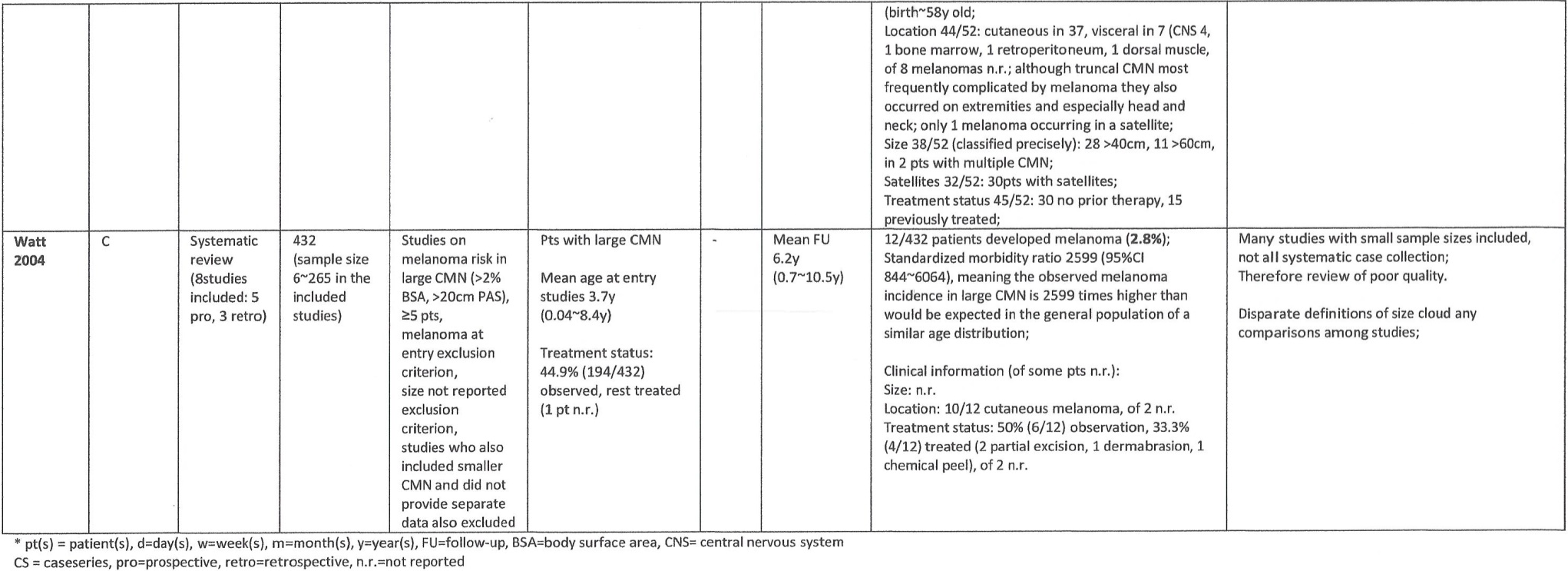
Dermabrasie en curettage
|
Dermabrasion for Congenital Nevi (2 studies, 342 patients)1,2 |
|
|||
|
Outcomes |
Impact |
№ of participants |
Quality of the evidence |
|
|
Physician global assessment |
Poor/moderate 16.7% (2/12), good 83.3% (10/12), excellent 0.0% (0/0); In 2 no stable/good pigmentation, these 2 and an dditional 4 further treatment; |
12 |
⨁◯◯◯ |
|
|
Clearing of pigmentation |
Poor/moderate 36.5% (80/219), good 29.7% (65/219), excellent 33.8% (74/219), n=111 patients lost to follow-up; |
330 |
⨁◯◯◯ |
|
|
Decrease hair growth |
- not assessed in any study; |
- |
- |
|
|
Repigmentation |
62.6% (214/342) at least some repigmentation, n=111 lost to follow-up; Bohn repigmentation 2/12 which required additional surgery, rest good and stable. Rompel only 7 no repigmentation, rest 20~100%. Much loss to follow-up in Rompel; |
342 |
⨁◯◯◯ |
|
|
Dyspigmentation (hypo-, hyperpigmentation) |
- not assessed in any study |
- |
- |
|
|
Scarring (hypertrophic) |
9.4% (32/342) hypertrophic scarring, n=111 lost to follow-up; In Rompel scarring 32/219 nevi, in Bohn no scarring (0/12); |
342 |
⨁◯◯◯ |
|
|
Complications related to the procedure |
6.1% (21/342) complications, n=111 lost to follow-up; In Rompel 13 wound infection, 6 blood transfusion, 1 postoperative bleeding. In Bohn 1 patient wound infection |
342 |
⨁◯◯◯ |
|
|
Patient satisfaction |
- not assessed in any study; |
- |
- |
|
|
Histologic atypia |
- not assessed in any study |
- |
- |
|
|
Clinical cutaneous malignancy follow up: range ~16 years |
0.3% (1/342), n=111 lost to follow-up; In Bohn 1 'minimal deviation melanoma', 1 'pseudomelanoma'. In Rompel none. |
342 |
⨁◯◯◯ |
|
1. Bohn 2000 (n=12), 2. Rompel 1997 (n=342, 111 lost to follow-up); a. case serie(s) of low quality (risk of bias) b.small sample size (imprecision)
|
Curettage for Congenital Nevi (7 studies, 100 patients)3-9 |
|
|||
|
Outcomes |
Impact |
№ of participants |
Quality of the evidence |
|
|
Physician global assessment |
Poor/moderate 23.0% (14/61), 73.8% (45/61) good, 0.0% (0/61) excellent 0.0% (0/61), not reported in 2 patients; |
61 |
⨁◯◯◯ |
|
|
Clearing of pigmentation |
Poor/moderate 8.6% (5/58), good 29.3% (17/58), excellent 60.3% (35/58), not reported in 2 patients; |
58 |
⨁◯◯◯ |
|
|
Decrease hair growth dichotomous: yes/no |
40.8% (20/49) hypertrichosis, 2 patients lost to follow-up; |
49 |
⨁◯◯◯ |
|
|
Repigmentation |
67.8% (59/87) some degree of repigmentation, 2 patients lost to follow-up; Severe repimentation in 13 |
87 |
⨁◯◯◯ |
|
|
Dyspigmentation (hyper-, hypopigmentation) dichotomous: yes/no |
- not assessed in any study |
|
||
|
Scarring (hypertrophic) |
9.6% (9/94) hypertrophic scarring, 2 patients lost to follow-up; De Raeve et al. report minimal scarring in the remaining 14/16 patients, Zaal 'moderate' scarring overall according to POSAS scar scale (mainly due to pigmentation), and Michel et al. in the majority of patients abnormal skin texture; |
94 |
⨁◯◯◯ |
|
|
Complications related to the procedure |
10.6% (10/94) complications, 2 patients lost to follow-up; Wound infection in 7, in Rasmussen 3 severe itching and vulnerable skin (which required further therapy). |
94 |
⨁◯◯◯ |
|
|
Patient satisfaction |
93.4% (57/61) patients/parents satistfied with result, not reported in 1 patient; In Gatibelza (n=29) only initial satisfaction |
61 |
⨁◯◯◯ |
|
|
Histologic atypia |
0.0% (0/19) atypic cells in nevus biopsies, in 5 patients not biopsied; |
19 |
⨁◯◯◯ |
|
|
Clinical cutaneous malignancy |
0.0% (0/78) malignant melanoma, 2 patients lost to follow-up; |
78 |
⨁◯◯◯ |
|
3. De Mey 1992 (n=6), 4. De Raeve 2002 (n=16), 5. Gatibelza 2013 (n=29), 6. Michel 2000 (n=13), 7. Moss 1987 (n=10), 8. Rasmussen 2013 (n=16), 9. Zaal 2008 (n=10, 2 lost to follow-up);
a. case serie(s) of low quality (risk of bias), b. small sample size (imprecision), c. no objective outcome measurement (risk of bias)
Lasertherapie
|
Q-switched laser for Congenital Nevi (8 studies, 125 patients)1-8 |
|
|||
|
Outcomes |
Impact |
№ of participants |
Quality of the evidence |
|
|
Physician global assessment |
Poor/moderate 66.7% (18/27), good 7.4% (2/27), excellent 18.5% (5/27), in 2 patients not reported; Kishi with short follow-up good and excellent results (7/9), Minakawa with very long follow-up only poor results (18/18); |
27 |
⨁◯◯◯ |
|
|
Clearing of pigmentation |
Poor/moderate 7.3% (3/41), good 43.9% (n=18/41), excellent 43.9% (18/41), 2 patients lost to follow-up; |
41 |
⨁◯◯◯ |
|
|
Decrease hair growth |
- not assessed in any study |
- |
- |
|
|
Repigmentation |
50.6% (41/81) at least some repigmentation, 8 patients lost to follow-up; Minakawa severe repigmentation in 6/18 (33.3%) patients, Sohn and Waldorf partial repigmentation in 13/13 (100%) and 11/18 (61.1%) respectively but in Waldorf 6 patients lost to follow-up. Kishi (n=9) on short term severe repigmentation in 1 (11.1%) slight in 2 (22.2%) and after 1 year very slight in all patients (100.0%). August repigmentation in 2/23 (8.7%) but degree not mentioned. |
81 |
⨁◯◯◯ |
|
|
Dyspigmentation (hypo-, hyperpigmentation) |
1.4% (1/71) dyspigmentation, 8 patients lost to follow-up; This patient had partial hypopigmentation (Minakawa), Waldorf reports only transient hypopigmentation in darker skinned patients, Al-Hadithy, August and Kishi report absence of dyspigmentation. |
71 |
⨁◯◯◯ |
|
|
Scarring (hypertrophic) |
0.0% (0/71) scarring (hypertrophic), 8 patients lost to follow-up; All 5 studies report no hypertrophic scarring, Kishi (n=9) minimal change in skin texture in 6 patients (grade 1 on a 1-3 scale), Minakawa (n=18) and Waldorf (n=18) skin texture unchanged |
71 |
⨁◯◯◯ |
|
|
Complications related to the procedure dichotomous: yes/no |
0.0% (0/18) complications reported ("all patients tolerated procedure well") |
18 |
⨁◯◯◯ |
|
|
Patient satisfaction |
- not assessed in any study |
- |
- |
|
|
Histologic atypia |
0.0% (0/3) atypia reported in nevus biopsies, all non-suspicious, 24 patients not biopsied (no indication in Kishi or patients not willing in Waldorf) |
27 |
⨁◯◯◯ |
|
|
Clinical cutaneous malignancy dichotomous: yes/no |
0.0% (0/3) with cutaneous melanoma (checked with national database), no pseudomelanoma observed |
3 |
⨁◯◯◯ |
|
1. Al-Hadithy 2012 (n=3); 2.August 2011 (n=23, 2 lost to follow-up); 3.Kim 2005 (n=37); 4.Kishi 2009 (n=9); 5.Minakawa 2011 (n=18); 6.Park 2001 (n=4); 7.Sohn 2004 (n=13); 8.Waldorf 1996 (n=18, 6 lost to follow-up after final evaluation at last treatment); a. No objective outcome measurement (risk of bias); b. In Minakawa one case is further described this patient received also 5 treatments of NMRL, therefore unclear if all patients are treated with QRL alone (risk of bias); c. Results varied largely between studies due to large spread in follow-up time (inconsistency); d. Small sample size (imprecision); e. Large selection bias (risk of bias)
|
Normal mode (pigment-specific) laser for Congenital Nevi (3 studies, 10 patients)9-11 |
|
|||
|
Outcomes |
Impact |
№ of participants |
Quality of the evidence |
|
|
Physician global assessment |
- not assessed in any study |
- |
- |
|
|
Clearing of pigmentation |
Poor/moderate 0.0% (0/5), good 40.0% (2/5), excellent 40.0% (2/5), 1 patient lost to follow-up |
5 |
⨁◯◯◯ |
|
|
Decrease hair growth |
- not assessed in any study |
- |
- |
|
|
Repigmentation |
0.0% (0/5) repigmentation, 1 patient lost to follow-up |
5 |
⨁◯◯◯ |
|
|
Dyspigmentation (hypo-, hyperpigmentation) |
0.0% (0/5) dyspigmentation, 1 patient lost to follow-up |
5 |
⨁◯◯◯ |
|
|
Scarring (hypertrophic) |
0.0% (0/5) hypertrophic scarring, 1 patient lost to follow-up; |
5 |
⨁◯◯◯ |
|
|
Complications related to the procedure |
- not assessed in any study |
- |
- |
|
|
Patient satisfaction |
- not assessed in any study |
- |
- |
|
|
Histologic atypia |
0.0% (0/5) atypia reported in nevus biopsies, all non-suspicious |
5 |
⨁◯◯◯ |
|
|
Clinical cutaneous malignancy |
- not assessed in any study |
- |
- |
|
9. August 2011 (n=1); 10. Downs 2004 (n=4, 1 lost to follow-up); 11. Imayama 1999 (n=5); a. Small sample size (imprecision)
|
Combination of QS and NM pigment-specific laser for Congenital Nevi (5 studies, 65 patients)12-16 |
|
|||
|
Outcomes |
Impact |
№ of participants |
Quality of the evidence |
|
|
Physician global assessment |
- not assessed in any study |
- |
- |
|
|
Clearing of pigmentation |
Poor/moderate 10.9% (5/46), good 30.4% (14/46), excellent 56.5% (26/46), 1 patient lost to follow-up; |
46 |
⨁◯◯◯ |
|
|
Decrease hair growth |
83.3% (5/6) sustained hair loss of 50-100%, 1 patient lost to follow-up; |
6 |
⨁◯◯◯ |
|
|
Repigmentation |
53.8% (14/26) repigmentation, 1 patient lost to follow-up; Helsing (n=14) in all patients after several months, Downs (n=6) and Funayama (n=6) no repigmentation |
26 |
⨁◯◯◯ |
|
|
Dyspigmentation (hypo-, hyperpigmentation) |
42.5% (17/40) dyspigmentation; 20.0% (8/40) hypopigmentation, 22.5% (9/40) hyperpigmentation; Funayama 2 had slight hypopigmentation (33.3%), Kono 6/34 patients with hypo- and 9/34 with hyperpigmentation (44.1% dyspigmentation) |
40 |
⨁◯◯◯ |
|
|
Scarring (hypertrophic), skin texture |
2.2% (1/46) hypertrophic scarring, 1 patient lost to follow-up; Downs (n=6) 1 patient with hypertrophic scarring at edge of lesion (16.7%), Funayama and Kono no hypertrophic scarring but abnormal skin texture of varying degrees / texture changes in 6/6 and 5/34 patients. |
46 |
⨁◯◯◯ |
|
|
Complications related to the procedure |
0.0% (0/34) complications reported |
34 |
⨁◯◯◯ |
|
|
Patient satisfaction |
30.0% (6/20) satisfied, 70.0% (14/20) not satisfied; Funayama (n=6) all were satisfied with the outcome, Helsing (n=14) result was not satisfactory in any patient as judged by the patient or parent |
20 |
⨁◯◯◯ |
|
|
Histologic atypia |
0.0% (0/40) atypia reported in nevus biopsies (all non-suspicious), 5 patients not biopsied; In Funayama 1 patient with 20 treatments subsequently biopsied, In Imayama all 5 patients biopsied after mean of 3.9 years, in Kono all 34 biopsied short term (3 months) and 9 nevi after 6~38 months |
45 |
⨁◯◯◯ |
|
|
Clinical cutaneous malignancy |
0.0% (0/6) malignant transformation observed; |
6 |
⨁◯◯◯ |
|
12. Downs 2004 (n=6, 1 lost to follow-up); 13. Funayama 2012 (n=6); 14. Helsing 2006 (n=14); 15. Imayama 1999 (n=5); 16. Kono 2005 (n=34);); a. In Funayama 1 patient partially treated with ablative laser (one time)
b. Small sample size (imprecision); c. Results varied largely between studies due to spread in follow-up time (inconsistency); d. In Helsing 2 patients treated with only NM pigment-specific laser (deviation from protocol);
e. No objective outcome measurement (risk of bias);
|
Ablative laser for Congenital Nevi (6 studies, 55 patients)17-22 |
|
|||
|
Outcomes |
Impact |
№ of participants |
Quality of the evidence |
|
|
Physician global assessment |
Poor/moderate 21.4% (3/14), good 42.9% (6/14), excellent 35.7% (5/14); |
14 |
⨁◯◯◯ |
|
|
Clearing of pigmentation |
Poor/moderate 6.7% (1/15), good 20.0% (3/15), excellent 60.0% (9/15), 2 patients lost to follow-up; |
15 |
⨁◯◯◯ |
|
|
Decrease hair growth |
20.0% (1/5) "result on pilosity"; Unclear how much decrease and if all nevi were hairy before but they probably were. |
5 |
⨁◯◯◯ |
|
|
Repigmentation |
21.7% (10/46) at least some repigmentation, 4 patients lost to follow-up; Ostertag (n=10) 2 patients serious repigmentation and 6 little, August (n=10) and Michel (n=5) both 1 patient with repigmentation (degree not reported), Horner (n=12) and Reynolds (n=9) both 0 patients |
46 |
⨁◯◯◯ |
|
|
Dyspigmentation (hypo-, hyperpigmentation) |
0.0% (0/9) dyspigmentation |
9 |
⨁◯◯◯ |
|
|
Scarring (hypertrophic), skin texture |
25.0% (9/36) persistent hypertrophic scarring, additionally in 2 patients hypertrophic scarring resolved with treatment; Horner 6/12 (50.0%) patients with hypertrophic scarring of varying degrees, Michel (n=5) hypertrophic scarring in 1 (20.0%) and none in the remaining 4, Ostertag 2/10 (20.0%) some hypertrophic scarring and skin atrophy, Al-Hadithy (n=9) transient hypertrophic scarring in 2 (resolved within 6 months with silicone dressings or steroid injection) |
36 |
⨁◯◯◯ |
|
|
Complications related to the procedure |
3.7% (1/27) major complications, 14.8% (4/27) minor complications; Michel (n=5) a very serious complication in 1 patient (septic shock, DIC, ARDS probably caused by non-sterile Vaseline cream, and skin necrosis) none in the other 4; Horner and Ostertag wound infection in 2/12 and 2/10 |
27 |
⨁◯◯◯ |
|
|
Patient satisfaction |
- not assessed in any study |
- |
- |
|
|
Histologic atypia follow up: range 6 months~15 years |
0.0% (0/4) atypia reported in nevus biopsies for other indications, all non-suspicious, 6 patients not biopsied |
10 |
⨁◯◯◯ |
|
|
Clinical cutaneous malignancy |
0.0% (0/30) melanoma, also no pseudomelanoma observed |
30 |
⨁◯◯◯ |
|
17. Al-Hadithy 2012 (n=9), first outcome (PGA) only specified for 4 patients with largest CMN; 18. August 2011 (n=10, 2 lost to follow-up); 19. Horner 2005 (n=12); 20. Michel 2001 (n=5); 21. Ostertag 2006 (n=10); 22. Reynolds 2002 (n=9, 2 lost to follow-up); a. No objective outcome measurement (risk of bias); b. Small sample size (imprecision); c. In Horner 2005 hypertrophic scarring was treated with silicone and/or pressure dressings, in later cases they were used prophylactically (risk of bias); d. Results varied largely between studies due to laser type, continuous wave CO2 laser in study Horner gives more scarring (inconsistency);
|
Combination of ablative and QS pigment-specific laser for Congenital Nevi (6 studies, 109 patients)22-27 |
|
|||
|
Outcomes |
Impact |
№ of participants |
Quality of the evidence |
|
|
Physician global assessment |
Poor/moderate 7.1% (1/14), good 7.1% (1/14), excellent 85.7% (12/14) |
14 |
⨁◯◯◯ |
|
|
Clearing of pigmentation |
Poor/moderate 0.0% (0/43), good 20.9% (9/43), excellent 69.8% (30/43), 4 patients lost to follow-up Additionally: in study Kim (n=16) average improvement of 81%; |
43 |
⨁◯◯◯ |
|
|
Decrease hair growth |
- not assessed in any study |
- |
- |
|
|
Repigmentation |
13.2% (7/53), 4 patients lost to follow-up; August repigmentation in 2/17 patients (degree not reported), Mandal in 2/10 patients of which 1 underwent further treatment, Park 3/15 especially in hairy CMN (degree not reported), Chong no repigmentation |
53 |
⨁◯◯◯ |
|
|
Dyspigmentation (hypo-, hyperpigmentation) |
0.0% (0/66) permanent dyspigmentation, additionally in several patients transient dyspigmentation; Al-Hadithy (n=40) hyperpigmentation in 1 which settled after application of hydroquinone cream, Chong (n=11) postinflammatory hyperpigmentation in 1 not persisting beyond 2 weeks after treatment with topical steroids, Park (n=15) hypo-/hyperpigmentation which disappeared within 6 months; |
66 |
⨁◯◯◯ |
|
|
Scarring (hypertrophic) |
0.0% (0/76) persistent hypertrophic scarring, additionally in at least 6 patients hypertrophic scarring which settled with treatment; Al-Hadithy 3/40 hypertrophic scarring resolved within 6 months with silicone dressings or steroid injection, Chong 3/11 hypertrophic scarring but none persisted beyond 2 weeks after treatment with topical steroids, Mandal (n=10) only minor textural changes acceptable to patients, Park (n=15) no permanent scarring |
76 |
⨁◯◯◯ |
|
|
Complications related to the procedure |
- not assessed in any study |
- |
- |
|
|
Patient satisfaction |
100.0% (11/11) patients were satisfied with the clearing of pigmentation at 6 weeks (good n=3, excellent n=8) |
11 |
⨁◯◯◯ |
|
|
Histologic atypia follow up: end of treatment |
0.0% (0/1) atypia reported in nevus biopsy, non-suspicious lesion, 10 patients gave no consent for biopsy |
11 |
⨁◯◯◯ |
|
|
Clinical cutaneous malignancy |
0.0% (0/55) melanoma, Al-Hadithy (n=40) also reports no pseudomelanoma was observed |
55 |
⨁◯◯◯ |
|
22. Al-Hadithy 2012 (n=40), first outcome only specified for 4 patients with largest CMN; 23. August 2011 (n=14, 3 lost to follow-up); 24. Chong 2005 (n=11); 25. Kim (n=16); 26. Mandal (n=10); 27. Park 2001 (n=15);
a. No objective outcome measurement (risk of bias); b. Small sample size (inconsistency); c. In Park 2001 patients were also treated with bleaching cream (risk of bias)
|
Combination of ablative and NM pigment-specific laser for Congenital Nevi (2 studies, 11 patients)28,29 |
|
|||
|
Outcomes |
Impact |
№ of participants |
Quality of the evidence |
|
|
Physician global assessment |
- not assessed in any study |
7 |
⨁◯◯◯ |
|
|
Clearing of pigmentation |
Poor/moderate 0.0% (0/11), good 0.0% (0/11), excellent 100.0% (9/11), 2 patients lost to follow-up |
11 |
⨁◯◯◯ |
|
|
Decrease hair growth |
- not assessed in any study |
- |
- |
|
|
Repigmentation |
18.2% (2/11) repigmentation, 2 patients lost to follow-up; Degree of repigmentation not reported |
11 |
⨁◯◯◯ |
|
|
Dyspigmentation (hypo-, hyperpigmentation) |
0.0% (0/7) dyspigmentation; |
7 |
⨁◯◯◯ |
|
|
Scarring (hypertrophic), skin texture follow up: 6 months |
14.3% (1/7) hypertrophic scarring; Lee reports 1 patient with hypertrophic scarring and 1 with mild atrophic scarring, Lee also reports a mean improvement in skin texture of 3.2±0.7 on a 4-grade scale |
7 |
⨁◯◯◯ |
|
|
Complications related to the procedure |
0.0% (0/7) complications reported ("all patients tolerated treatment well”) |
7 |
⨁◯◯◯ |
|
|
Patient satisfaction |
- not assessed in any study |
- |
- |
|
|
Histologic atypia |
- not assessed in any study |
- |
- |
|
|
Clinical cutaneous malignancy |
- not assessed in any study |
- |
- |
|
28. August 2011 (n=4, 2 lost to follow-up); 29. Lee 2014 (n=7); a. Small sample size (imprecision)
|
GRADE Working Group grades of evidence |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 21-02-2018
Beoordeeld op geldigheid : 17-11-2017
Een richtlijn heeft alleen zeggingskracht als op continue basis onderhoud plaatsvindt, op grond van systematische monitoring van zowel de medisch wetenschappelijke literatuur als praktijkgegevens en door gebruikers van de richtlijn aangeleverde commentaren. Voor deze richtlijn is afgesproken één keer per jaar de literatuur te evalueren om nieuwe ontwikkelingen te volgen. Bij essentiële ontwikkelingen kan besloten worden om een gehele richtlijnwerkgroep bij elkaar te roepen en tussentijdse elektronische amendementen te maken en deze onder de verschillende beroepsgroepen te verspreiden. Om de richtlijn ‘levend’ te houden is modulaire herziening mogelijk, waarbij slechts een deel of delen van de richtlijn kunnen worden gereviseerd.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Deze richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering in de begeleiding van patiënten met congenitale melanocytaire naevi (CMN) en hun directe omgeving. De richtlijn berust op de resultaten van wetenschappelijk onderzoek en aansluitende meningsvorming, door experts, gericht op het vaststellen van goed medisch handelen. De financiering van deze richtlijn is tot stand gekomen met gelden die de NVDV uit zijn SKMS-programma heeft vrijgemaakt.
Doelgroep
De richtlijn is bestemd voor leden van de medische en paramedische beroepsgroepen, waartoe tenminste behoren: dermatologen, plastisch chirurgen, pathologen, kinderartsen, neurologen, huisartsen, verpleegkundigen en huidtherapeuten. Tevens is in een samenwerking tussen patiëntenvereniging NNN en de VSOP een huisartsbrochure ontwikkeld.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn werd een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordiging van de bij CMN betrokken disciplines. Bij het samenstellen van de werkgroep is getracht rekening te houden met de geografische spreiding van de werkgroepleden en met een evenredige vertegenwoordiging van academische en niet-academische werkgroepleden. De werkgroepleden hebben onafhankelijk gehandeld en geen enkel werkgroeplid ontving gunsten met het doel de richtlijn te beïnvloeden.
|
Werkgroepleden |
Vereniging |
|
Prof.dr. Suzanne Pasmans (voorzitter) |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Drs. Céline Eggen (secretaris) |
Promovendus kinderdermatologie Erasmus MC (NVDV)
|
|
Prof.dr. Wilma Bergman |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Dr. Nicole Kukutsch |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Dr. Albert Wolkerstorfer |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Dr. Simone Stadhouders-Keet |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Dr. Marianne Crijns |
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Drs. Annelies Lommerts
|
Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) |
|
Prof.dr. Chantal van der Horst |
Nederlandse Vereniging voor Plastische Chirurgie (NVPC) |
|
Dr. Corstiaan Breugem |
Nederlandse Vereniging voor Plastische Chirurgie (NVPC) |
|
Prof.dr. Wolter Mooi |
Nederlandse Vereniging voor Pathologie (NVVP) |
|
Dr. Hanneke Rijk-van Gent |
Nederlandse Vereniging voor Kindergeneeskunde (NVK) |
|
Prof.dr. Michèl Willemsen |
Nederlandse Vereniging voor Neurologie (NVN) en Nederlandse Vereniging voor Kinderneurologie (NVKN) |
|
Mw. Anja Ebus |
Verpleegkundigen en Verzorgenden Nederland Verpleegkundig Specialist (V&VN VS) en V&VN Dermatologie. |
|
Mw. Marjolein van Kessel |
Nevus Netwerk Nederland (NNN)
|
Verder hebben aan deze richlijn meegewerkt drs. Joep Wijnand en drs. Michéle Hennekam.
Inbreng patiëntenperspectief
Reeds sinds de start van het richtlijntraject is de patiëntenvereniging Nevus Netwerk Nederland (NNN) zeer betrokken geweest bij de totstandkoming van deze richtlijn, door afvaarding van een bestuurslid in de werkgroep. Zij zijn in deze hoedanigheid tijdens het gehele richtlijntraject betrokken geweest, door actieve participatie tijdens werkgroepvergaderingen, en het aandragen van knelpunten die vanuit patiëntenperspectief van groot belang zijn, evenals het deelgenoot maken van lopende initiatieven in het veld. Nevus Netwerk Nederland heeft ook zijn fiat verleend aan de inhoud van de richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de ontwikkeling van de conceptrichtlijn is zoveel mogelijk rekening gehouden met de implementatie van de richtlijn en de daadwerkelijke uitvoerbaarheid van de aanbevelingen. De richtlijn wordt gepubliceerd op de website van de NVDV, de website van de richtlijnen database en wordt tevens verspreid onder alle bij CMN betrokken beroepsgroepen. Ook wordt een samenvatting van de richtlijn gepubliceerd en er zal in verschillende specifieke vaktijdschriften aandacht aan worden besteed. Daarnaast wordt de richtlijn onder de aandacht gebracht via de betrokken patiëntenvereniging. De richtlijn is ondergebracht in huidhuis.nl (vanuit de NVDV) en gekoppeld aan het persoonlijk gezondheidsdossier van Patient1 in huidhuis.nl voor mensen met een huidafwijking en de betrokken professionals.
Werkwijze
De richtlijn congenitale melanocytaire naevi is een geheel nieuwe richtlijn. In de richtlijn melanoom (goedgekeurd op 13.08.2012) wordt reeds verwezen naar de in wording zijnde richtlijn CMN. De richtlijnwerkgroep is opgestart in het najaar van 2011, maar heeft tussendoor enkele malen stil gelegen onder andere vanwege een andere prioritering op de richtlijnagenda van de NVDV.
In de eerste vergadering(en) werden de knelpunten en wensen ten aanzien van het onderwerp CMN geïnventariseerd binnen de werkgroep. De werkgroep formuleerde aan de hand hiervan in de richtlijn vermelde uitgangsvragen. Ook werd aan de start van het traject een enquête uitgezet onder dermatologen en plastisch chirurgen in Nederland om het huidige beleid omtrent CMN te inventariseren. De doelen van deze enquête waren het vastleggen van de uitgangssituatie om tot een richtlijn te komen die aansluit op de werkvloer, en het identificeren van aanvullende knelpunten.
De uitgangsvragen werden op het bureau van de Nederlandse Vereniging voor Dermatologie en Venereologie (NVDV) uitgewerkt tot PICO-zoekvragen. Via systematische zoekopdrachten en reference checking is bruikbare literatuur verzameld. De secretaris van de richtlijn en studenten hebben samen met de werkgroepleden de literatuur beoordeeld op inhoud en kwaliteit. Vervolgens zijn er teksten geschreven waarin de beoordeelde literatuur werd verwerkt. Deze teksten, op basis van de evidencetabellen met de verwerkte literatuur, zijn tijdens een tweedaagse vergadering besproken en van nuances en aanbevelingen voorzien. Na verdere discussie binnen de gehele richtlijnwerkgroep is de tekst verder afgestemd.
De uiteindelijke tekst werd in september 2016 aan alle betrokken wetenschappelijke verenigingen aangeboden. Men is in staat gesteld om via websites van de betrokken verenigingen commentaar op de richtlijn te geven. De commentaren zijn in de definitieve versie van de richtlijn verwerkt.
Wetenschappelijke bewijsvoering
De aanbevelingen uit deze richtlijn zijn, voor zover mogelijk, gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek.
Relevante artikelen zijn gezocht via een systematische, oriënterende zoekopdracht in Pubmed, overkoepelend voor het onderwerp congenitale melanocytaire naevi (van 1987 tot november 2014, talen Nederlands, Engels, Frans, Duits). Voor specifieke uitgangsvragen werd nog een aanvullende systematische search verricht met meer specifieke zoektermen voor de desbetreffende vraag, en in aanvullende databases (zoals Embase, CENTRAL, Cochrane library etc). Tevens is voor enkele uitgangsvragen en passages de search meer recent herhaald (2014~2016). Zie ook de zoekstrategie.
De zoekacties zijn met behulp van de PICO-systematiek opgebouwd. Dit houdt in dat voor elke uitgangsvraag een zoekvraag is geformuleerd waarbij zoveel mogelijk de volgende structuur is gehanteerd: Patiënt-Interventie-Controle-Outcome. De zoekvragen hebben de P als gemeenschappelijk onderdeel, de overige onderdelen van de PICO zijn geformuleerd op basis van de uitgangsvraag. Het merendeel van de zoekcriteria is afhankelijk van de uitgangsvraag.
Algemeen werden de volgende zoek- en selectiecriteria opgesteld:
|
Taal |
Engels, Nederlands, Duits, Frans |
|
Populatie |
Congenitale melanocytaire naevi (in alle synoniemen), alle groottes, alle leeftijden (exclusie van verworven melanocytaire naevi, of als niet gespecifieerd was of de naevi congenitaal waren) |
|
level of evidence |
Literatuurselectie volgens piramide van bewijs (EBRO-methode). Vanwege het veelal ontbreken van studies van goede kwaliteit (gerandomiseerd of prospectief) is er niet beperkt op de fundamentele opzet van de studie |
|
grootte van de studies |
Hier is in het algemeen geen limiet aangesteld, omdat voor de meeste uitgangsvragen slechts caseseries met enkele patiënten beschikbaar zijn. Wel zijn bij meerdere uitgangsvragen casereports en caseseries met <5 patiënten geëxcludeerd, omdat deze een nog grotere selectiebias geven en daarmee een mogelijk te vertekend beeld van de werkelijkheid. |
Van de geselecteerde referenties op basis van titel en/of abstract werd de full-text aangevraagd. Op basis van full-text artikelen is vervolgens verder geselecteerd en zijn artikelen zonder informatie over de betreffende uitgangsvraag geëxcludeerd. De overgebleven artikelen zijn full-text beoordeeld op kwaliteit en inhoud.
Tijdens de search werden geen (buitenlandse) richtlijnen over dit onderwerp geïdentificeerd, maar wel enkele relevante en betrouwbare ‘learning articles’, waarin op gedegen wijze relevante literatuur over het onderwerp CMN in zijn totaliteit is samengebracht. Deze artikelen vormen deels de basis voor de enkele richtlijnteksten [Alikhan 2012, Ibrahimi 2012, Viana 2013], aangevuld met andere relevante literatuur.
Fig. 1: Piramide van wetenschappelijk bewijs
Methode van literatuurbeoordeling
De richtlijn is ontwikkeld volgens de EBRO-methode (Evidence-based Richtlijn Ontwikkeling). Per deelonderwerp is van de relevante artikelen een ‘evidencetabel’ opgesteld, waarin de literatuur is samengevat en beoordeeld op kwaliteit. De beschrijving en beoordeling van de artikelen staan in de verschillende module onder het kopje ‘wetenschappelijke onderbouwing’, en de literatuur is vervolgens samengevat in ‘conclusies’. De kwaliteit van de artikelen en het niveau van het relevante bewijs is volgens de EBRO-methode gegradeerd, aan de hand van de indeling in tabel 1.
Daarnaast is voor de beoordeling van uitgangsvraag 12 gekozen voor de GRADE methodiek (Grading of Recommendations Assessment, Development and Evaluation), waarbij per uitkomstmaat het beschikbare bewijs is ‘gepooled’ en beoordeeld op de kwaliteit van het bewijs, zie tabel 2. De toepassing van GRADE voor deze richtlijn was lastig omdat er alleen observationele studies zijn, geen vergelijkende studies, en de studies erg heterogeen zijn qua patiënt- en naevuskenmerken. Deze methodiek is daarom alleen toegepast bij behandelmodaliteiten waarbij ‘pooling’ van resultaten volgens de werkgroep mogelijk was.
Tabel 1: EBRO methode; A. niveau van conclusies volgens EBRO; B. Indeling van methodologische kwaliteit van individuele studies
A.
|
niveau |
Conclusie gebaseerd op |
|
1 |
Onderzoek van niveau A1 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
1 onderzoek van niveau A2 of tenminste 2 onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
1 onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
B.
|
Kwaliteit |
Interventie |
Diagnostisch accuratesse onderzoek |
Schade / bijwerkingen*, etiologie, prognose |
|
A1 |
Systematische review van tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohortonderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten. |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controle onderzoek, cohortonderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohortonderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohortonderzoek of patiënt-controle onderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Tabel 2: GRADE methode; A. niveau van bewijs volgens GRADE; C. wijze van beoordelen niveau van bewijs per uitkomstmaat
A.
|
GRADE Working Group grades of quality of evidence |
|
|
High |
We are very confident that the true effect lies close to that of the estimate of the effect |
|
Moderate |
We are moderately confident in the effect estimate: The true effect is likely to be close to the estimate of the effect, but there is a possibility that it is substantially different |
|
Low |
Our confidence in the effect estimate is limited: The true effect may be substantially different from the estimate of the effect |
|
Very low |
We have very little confidence in the effect estimate: The true effect is likely to be substantially different from the estimate of effect |
B.
|
Startpunt van beoordelen kwaliteit van bewijs |
|
|
RCT’s |
Beginnen als ‘high quality’ |
|
Observationele studies |
Beginnen als ‘low quality’ |
|
Per uitkomstmaat over de studies heen evt quality of evidence één of twee niveaus downgraden (1-5) of upgraden (6-8) |
|
|
1. |
risk of bias |
|
2. |
inconsistency |
|
3. |
indirectness |
|
4. |
imprecision |
|
5. |
publication bias |
|
6. |
large effect |
|
7. |
plausible confounding |
|
8. |
dose response gradient |
Totstandkoming van de aanbevelingen
Voor het komen tot een aanbeveling zijn er naast het wetenschappelijke bewijs vaak andere aspecten van belang, bijvoorbeeld: patiëntvoorkeuren, beschikbaarheid van speciale technieken of expertise, organisatorische aspecten, maatschappelijke consequenties of kosten. Deze aspecten worden besproken na de conclusie(s) onder ‘overige overwegingen’. Hierin wordt de conclusie op basis van de literatuur geplaatst in de context van de dagelijkse praktijk en vindt een afweging plaats van de voor- en nadelen van de verschillende beleidsopties. De uiteindelijk geformuleerde aanbeveling is het resultaat van het beschikbare bewijs in combinatie met deze overwegingen vanuit expert opinion. Het volgen van deze procedure en het opstellen van de richtlijn in dit format heeft als doel de transparantie van de richtlijn te verhogen.
Fig. 2: Schematisch weergave methodiek van evidence-based richtlijnontwikkeling
Innovatie
Het veld van de congenitale melanocytaire naevi is in beweging. Enerzijds wordt langzamerhand de moleculaire signatuur van CMN ontrafeld, hetgeen belangrijke nieuwe aanknopingspunten geeft voor nieuwe (genetische) diagnostiek en (niet-chirurgische) therapieën. Daarnaast is er in de loop der jaren een verschuiving opgetreden van invasief en agressief behandelen om zoveel mogelijk naevusweefsel te verwijderen in het kader van een vermeend hoog melanoomrisico, naar minder agressief en meer oppervlakkig of partieel ingrijpen met meer oog voor het cosmetisch resultaat. Verder is er in het verleden veelal slechts retrospectief onderzoek verricht met een hoog risico op bias. Er zijn inmiddels enkele prospectieve studies verschenen over melanoomrisico, maar nog niet over therapie in CMN.
Advies voor onderzoek
Over de gehele linie ontbreekt het aan goed uitgevoerde studies op het gebied van CMN. Veelal zijn er alleen caseseries en casereports verschenen, met een hoog risico op bias. Dit is ergens inherent aan het onderwerp, waarbij met name grotere CMN zeldzaam zijn, en CMN daarnaast nog in grote mate interindividueel verschillen. Met name op het gebied van therapieën ontbreekt het aan betrouwbaar onderzoek. Bijna alle auteurs meten verschillende of niet-gevalideerde uitkomstmaten, en ‘patient-important outcomes’, zoals kwaliteit van leven, patiënttevredenheid maar ook veiligheid, worden vrijwel niet onderzocht. In de studies over melanoomrisico ontbreekt het aan studies in volwassen patiënten en kleinere CMN, en studies met langere follow-up duur (>10 jaar). Dit geldt ook voor studies naar het risico op NCM, hierbij zijn tevens veel verschillende definities voor NCM gehanteerd.
Onderzoek naar CMN zou moeten bestaan uit prospectief onderzoek, met nauwkeurige en gestandaardiseerde registratie van patiëntkenmerken, en gevalideerde en gestandaardiseerde registratie van uitkomsten, over een lange tijd. Hierbij moet er ten aanzien van behandeling ook meer aandacht komen voor voor de patiënt belangrijke uitkomsten en veiligheid. Op het gebied van melanoomrisico is dit internationaal reeds opgepakt, door het in diverse landen opzetten van (nationale) prospectieve registries. De werkgroep is van plan op korte termijn een dergelijke registry op te zetten in Nederland (via huidhuis.nl vanuit de NVDV), waarbij ook de uitkomsten van therapieën zullen worden meegenomen. Later zal deze gekoppeld worden aan internationale registries.
Daarnaast is meer en beter onderzoek nodig naar diagnostische modaliteiten bij CMN, zoals dermatoscopie en MRI, en diagnostische technieken om melanoom in CMN te ontdekken en te kunnen onderscheiden van benigne naevusweefsel of proliferaties.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar wetenschappelijk onderbouwde en breed gedragen inzichten en aanbevelingen waaraan zorgverleners zouden moeten voldoen om kwalitatief goede zorg te verlenen. Aangezien richtlijnen uitgaan van ‘gemiddelde patiënten’, kunnen zorgverleners in individuele gevallen zo nodig afwijken van de aanbevelingen in de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, soms zelfs noodzakelijk. Wanneer bewust van de richtlijn wordt afgeweken, moet dit echter beargumenteerd, gedocumenteerd en waar nodig in overleg met de patiënt worden gedaan.
Zoekverantwoording
Search richtlijn overkoepelend
Zoekstrategie voluit:
(nevi OR naevi OR nevus OR naevus OR mole OR moles OR birthmark* OR “Nevus”[MESH] OR “Nevus, pigmented”[MESH])
AND
((congenita* OR inborn OR hereditary OR newborn OR “congenital”[Subheading]) OR
(giant OR garment OR Tierfell OR gigantic OR ‘bathing trunk’))
NOT
connective tissue OR anaemicus OR elasticus OR inelasticus OR depigmentosus OR mucinosis OR lipomatosus OR sebaceus OR blue OR comedonicus OR spindle OR sponge OR woolly OR spilus OR spider OR flammeus OR Jadassohn OR Ota OR Becker OR Sutton OR Unna OR neurofibromatosis OR pancreas* OR placenta
Filters: taal: NL, EN, DU; jaar: vanaf 1987
Gezocht op 22.11.2014: 1934 hits (PubMed)
Tussentijds (2014~2016) op specifieke uitgangsvragen geupdate.
Search fotografie
Zoekstrategie voluit:
("congenital naevus".ti,ab OR "congenital naevi".ti,ab OR "congenital nevus".ti,ab OR "congenital nevi".ti,ab OR "congenital melanocytic naevus".ti,ab OR "congenital melanocytic naevi".ti,ab OR "congenital melanocytic nevus".ti,ab OR "congenital melanocytic nevi".ti,ab OR (("naevus".ti,ab OR "naevi".ti,ab OR "nevus".ti,ab OR "nevi".ti,ab OR "melanocytic naevus".ti,ab OR "melanocytic naevi".ti,ab OR "melanocytic nevus".ti,ab OR "melanocytic nevi".ti,ab) AND congenital*.ti,ab)) AND (Photography/ OR medical photography/ OR Photograph*.ti,ab) AND (english.la OR dutch.la)
Gezocht op 07.05.2014: 44 hits (34 Pubmed, 37 Embase waarvan 10 uniek)
Search dermatoscopie
Zoekstrategie voluit:
("congenital naevus".ti,ab OR "congenital naevi".ti,ab OR "congenital nevus".ti,ab OR "congenital nevi".ti,ab OR "congenital melanocytic naevus".ti,ab OR "congenital melanocytic naevi".ti,ab OR "congenital melanocytic nevus".ti,ab OR "congenital melanocytic nevi".ti,ab OR (("naevus".ti,ab OR "naevi".ti,ab OR "nevus".ti,ab OR "nevi".ti,ab OR "melanocytic naevus".ti,ab OR "melanocytic naevi".ti,ab OR "melanocytic nevus".ti,ab OR "melanocytic nevi".ti,ab) AND congenital*.ti,ab)) AND (Dermoscopy/ OR Dermascopy/ OR dermatosc*.ti,ab) AND (english.la OR dutch.la OR german.la)
Filters: taal: NL, EN, DU (zie searchtermen) en jaar vanaf 1990
Gezocht in mei/juni 2014: 243 hits (Pubmed, Embase) >> na ontdubbeling 171; met reference checking 2 extra artikelen
Search chirurgie
Chirurgische ingrepen (excision, tissue expansion, skin grafting)
((nevus/de AND ('congenital disorder'/de OR congenital:lnk OR (congent* OR unacquir* OR 'not acquired' OR 'non acquired'):ab,ti)) OR 'congenital nevus'/de OR 'pigmented nevus'/de OR 'melanocytic nevus'/de OR (((congenit* OR unacquir* OR 'not acquired' OR 'non acquired' OR pigment* OR melanocyt* OR nevocell* OR naevocell* OR 'nevo cellular' OR 'naevo cellular' OR giant OR gigantic OR medium OR large* OR multiple OR small* OR pilos* OR hair* OR divided) NEAR/3 (nevus OR naevus OR nevi OR naevi OR mole OR moles OR birthmark* OR nævi OR nævus)) OR nevocyt* OR nevomelanocyt* OR naevocyt* OR naevomelanocyt* OR ((nevocell* OR naevocell* OR 'nevo cellular' OR 'naevo cellular') NEAR/3 (lesion* OR laesion*)) OR tierfell* OR (bathing NEXT/1 trunk*) OR (((pigment* NEAR/3 (lesion* OR laesion*))) AND (nevus OR naevus OR nevi OR naevi OR mole OR moles OR birthmark*) AND (melanom* OR pseudomelanom*))):ab,ti) AND (surgery/de OR 'surgical technique'/de OR excision/de OR 'local excision'/de OR surgery:lnk OR 'minor surgery'/de OR 'major surgery'/de OR 'pediatric surgery'/exp OR 'plastic surgery'/exp OR dermatome/de OR 'skin surgery'/exp OR autograft/de OR allograft/de OR transplantation/de OR (surg* OR dermatosurg* OR excis* OR resect* OR remov* OR dermatome* OR shaving OR shave OR shaved OR ((skin OR tissue) NEAR/3 (flap* OR expan* OR stretch* OR transplant* OR replace*)) OR graft* OR autograft* OR allograft* OR reconstruct* OR resurfac*):ab,ti)
Gezocht in juli 2014: 4609 hits na ontdubbelen
|
Embase.com |
3134 |
|
Medline (OvidSP) |
393 |
|
Web-of-science |
304 |
|
Scopus |
618 |
|
PubMed publisher |
35 |
|
Cochrane |
0 |
|
Google scholar |
125 |
|
Total |
4609 |
Curettage, dermabrasie
Uit bovenstaande search kwamen ook artikelen over curettage en dermabrasie naar boven. Met reference checking en een korte search op synoniemen voor ‘congenital n(a)evi, dermbrasion, curettage) is gekeken of de gevonden artikelen voor dit onderwerp compleet waren.
Search lasertherapie
(((nevus[tiab] OR nevi[tiab] OR naevus[tiab] OR naevi[tiab] OR CMNs[tiab] OR SCMN[tiab] OR MCMN[tiab] OR LCMN[tiab] OR LCMNs[tiab] OR GCMN[tiab] OR GCMNs[tiab] OR CNNs[tiab] OR SCNN[tiab] OR MCNN[tiab] OR MCNNs[tiab] OR GCNN[tiab] OR Tierfell*[tiab] OR bathing-trunk*[tiab] OR garment-like[tiab] OR ((CNN[tiab] OR CMN[tiab] OR mole[tiab] OR moles[tiab] OR birthmark*[tiab]) AND (giant[tiab] OR gigantic[tiab] OR medium[tiab] OR large[tiab] OR multiple[tiab] OR pilos*[tiab] OR hairy[tiab] OR melanocytic[tiab] OR naevocytic[tiab] OR nevocytic[tiab] OR naevocell*[tiab] OR nevocell*[tiab] OR naevomelanocytic[tiab] OR nevomelanocytic[tiab] OR congenital*[tiab] OR unacquired[tiab] OR non-acquired[tiab]))) AND (laser[tiab] OR lasers[tiab] OR yttrium[tiab] OR erbium[tiab] OR neodymium[tiab] OR aluminum oxide[tiab] OR QSRL*[tiab] OR QSNYL*[tiab] OR QSND[tiab] OR FDQS*[tiab] OR NMRL*[tiab] OR NM-QS*[tiab] OR ND-QS*[tiab] OR Q-switch*[tiab] OR Qswitch*[tiab] OR YAG*[tiab] OR NDYAG*[tiab] OR ND-YAG*[tiab] OR ERYAG*[tiab] OR ER-YAG*[tiab] OR Neodymi*[tiab] OR Erbium*[tiab] OR Yttrium*[tiab] OR Alexandrit*[tiab] OR UCO2*[tiab] OR UltraPulse[tiab])) NOT ota[ti])
Gezocht in November 2015: 683 hits
|
Medline (OvidSP) |
330 |
|
Embase.com |
554 |
|
Central |
33 |
|
PubMed publisher |
7 |
|
Total (na ondubb.) |
683 |
